Защитную функцию в организме выполняют белки которые: Защитную функцию в организме выполняют белки, которые. Биология 2438
Белки с защитными функциями — Справочник химика 21
Белки с защитными функциями [c.424]
Белки-это макромолекулярные соединения, имеющиеся во всех живых клетках. Они служат важнейшим строительным материалом в тканях животных, являются главной составной частью кожи, хрящей, ногтей и мышц. К белкам относятся и ферменты-катализаторы биохимических реакций, протекающих во всех живых организмах. Белки осуществляют перенос жизненно важных веществ в организме. Например, гемоглобин, который переносит О2 от легких к клеткам, представляет собой белок. Антитела, выполняющие в организме защитную функцию (защищают от вредных веществ), тоже состоят из белков. [c.444]
Значение коллоидной защиты для биологии и фармации чрезвычайно велико. Принцип коллоидной защиты используют при получении колларгола, золей серебра, золота и т, д. Частицы колларгола так хорошо защищены, что не коагулируют даже при высушивании, Белки крови защищают капельки жира, холестерин и другие гидрофобные вещества от коагуляции. Ослабление защитных функций белков крови приводит к отложению холестерина на стенках сосудов, образованию камней в почках, печени и т. п. [c.439]
Глобулины — глобулярные белки, обладающие низкой растворимостью в солевых растворах и совершенно не растворяющиеся в воде. Полностью высаливаются раствором сульфата аммония в пределах насыщения 50%. Широко распространены в природе, в организме высших организмов выполняют защитную функцию. Так, глобулинами являются специфичные антитела, защитный белок крови (фибриноген) также глобулин. По химической природе глобулины близки к альбуминам, однако они несколько богаче аминокислотой глицином. [c.19]
Функции белков в организме чрезвычайно многообразны. Некоторые из них (например, коллаген) составляют основу костно-мышечных тканей. Другие белки включены в иммунную систему и вьшолняют защитные функции против инфекций и возбудителей болезней. Наиболее важные белки — ферменты (энзимы), которые катализируют химические реакции, протекающие в организме, и гормоны, регулирующие все биохимические процессы в организме. [c.502]
Наиболее важные белки — ферменты (энзимы), которые катализируют химические реакции, протекающие в организме, и гормоны, регулирующие все биохимические процессы в организме. [c.502]
Защитная функция. Основную функцию защиты в организме выполняет иммунная система, которая обеспечивает синтез специфических защитных белков-антител в ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации биологического действия антигенов. Защитная функция белков проявляется и в способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В результате свертывания фибриногена образуется сгусток крови, предохраняющий от потери крови при ранениях. [c.21]
По форме молекул все белки делят на две большие группы волокнистые (или фибриллярные) и глобулярные. Первые представляют собой нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых не имеют глобулярной формы, а вытянуты вдоль одной оси. Большинство фибриллярных белков выполняет структурные или защитные функции. [c.425]
Биологическое действие. Витамин С (аскорбиновая кислота) участвует в окислительно-восстановительных реакциях и передаче водорода при аэробном энергообразовании. Он влияет на синтез белка коллагена, способствующего сохранению целостности опорных тканей (хрящей и костей) и нормальной проницаемости стенок сосудов. Активность многих ферментов зависит от присутствия аскорбиновой кислоты. Прежде всего это относится к ферментам, участвующим в обмене аминокислот и нуклеиновых кислот, биосинтезе белков в мышцах, что определяет анаболическое действие витамина С. Этот витамин стимулирует процессы кроветворения, улучшая всасывание железа из кишечника, а также улучшает защитную функцию печени, что повышает устойчивость организма к различным токсическим веществам и способствует более быстрому восстановлению организма после больших физических нагрузок. Витамин С влияет на синтез гормонов надпочечников, в том числе кортикостероидов, что улучшает приспособительные реакции организма, повышает устойчивость организма к инфекционным и простудным заболеваниям. Благодаря таким биологическим функциям он широко применяется в медицине и спорте. [c.119]
Витамин С влияет на синтез гормонов надпочечников, в том числе кортикостероидов, что улучшает приспособительные реакции организма, повышает устойчивость организма к инфекционным и простудным заболеваниям. Благодаря таким биологическим функциям он широко применяется в медицине и спорте. [c.119]
Иммуноглобулины, ингибитор трипсина ai (дополнение 7-В), десяток или больше факторов свертывания крови (рис. 6-16) и белки системы комплемента (дополнение 5-Ж) несут защитные функции этот вопрос будет рассмотрен несколько позже. Гормоны, многие из которых являются белками (табл. 16-1), присутствуют в крови в процессе их переноса к органам-мишеням. Функции целого ряда сывороточных белков пока не известны. К ним, в частности, относятся многие гликопротеиды. Концентрация некоторых из них, например гаптоглобина (а также аа-макроглобулина), имеет тенденцию повышаться при самых разнообразных патологических состояниях организма. [c.104]
По функциям ферменты, структурные белки, транспортные белки, защитные белки, сократительные белки мышц, гормоны (гормон роста, пролактин, паратгормон), токсины (ботулиновый, столбнячный, холерный), рецепторы (зрительный, ацетилхолиновый), запасные белки в семенах растений и др. [c.23]
Чем сложнее организм, тем более разнообразны функции, выполняемые белкО М. Белки составляют основу опорных тканей животных (костей, хрящей, сухожилий), выполняют покровные и защитные функции (волос, шерсть, рога, копыта), откладываются в виде питательных запасных веществ в семенах и в яйце. Некоторые белки являются переносчиками кислорода (гемоглобин крови), другие выполняют сократительные функции мышц (миозин). Все известные в настоящее время энзимы являются белками. Многие гормоны, антибиотики, многие яды змей и бактериальные токсины также относятся к белкам. [c.697]
А. Фибриллярные белки. Как показывает название, фибриллярные белки состоят из фибрилл. Конфигурация их может быть складчатой или иметь форму и-спирали. Эти белки могут растягиваться и сокращаться. Они выполняют важные структурные, опорные или защитные функции. В водной среде они нерастворимы. [c.330]
Эти белки могут растягиваться и сокращаться. Они выполняют важные структурные, опорные или защитные функции. В водной среде они нерастворимы. [c.330]
В крови находятся клеточные элементы и белки, выполняющие соответственно дыхательную и защитную функции, для чего необходимо, чтобы они быстро циркулировали в организме. [c.451]
Совсем недавно было завершено исследование строения еще одного белка — лизоцима. Лизоцим содержится в тканях многих животных и растений. Он обладает защитной функцией, помогает организму бороться с инфекцией — может растворять, уничтожать некоторые бактерии. [c.101]
Окисление ядовитого индола и выведение последнего с мочой в виде индикана, или калиевой соли сернокислого эфира индоксила является одним из проявлений защитной функции организма по обезвреживанию токсичных продуктов обмена веществ (стр. 229). Повышенное содержание индикана — индиканурия — наблюдается уже при простом запоре. При усилении процессов гниения в кишечнике, например при непроходимости кишечника, перитоните или при повышенном распаде белка, например при гангрене легких, содернконцентрированной соляной кислоты, чтобы омылить эфир и выделить свободный индоксил, при добавлении небольшого количества окислителя, например КМ 0 , индоксил окисляется в индиго, извле- [c.341]
Считается, что свободные радикалы кислорода вьшолняют также защитную функцию, окисляя различные чужеродные вещества, поступающие в организм извне, в том числе мембранные белки и липоиды патогенных микроорганизмов. [c.43]
Глобулины — высокомолекулярные белки с молекулярной массой около 300 тыс. Да. Подобно альбуминам глобулины также выполняют транспортную функцию и способствуют задержке воды в кровяном русле, но в этом они существенно уступают альбуминам. Однако у глобулинов имеются и очень важные функции. Так, некоторые глобулины являются ферментами и ускоряют химические реакции, протекающие непосредственно в кровяном русле. Еще одна функция глобулинов заключается в их участии в свертывании крови и в обеспечении иммунитета (защитная функция). [c.103]
Еще одна функция глобулинов заключается в их участии в свертывании крови и в обеспечении иммунитета (защитная функция). [c.103]
Защитная функция обусловлена содержанием в крови иммунных глобулинов и антител, предохраняющих организм от многих инфекций. В крови находятся белки, с участием которых происходит свертывание крови с образованием ее сгустка (тромба), закупоривающего просвет сосудов при ранениях и останавливающего кровотечение. [c.159]
Изучение белков — одна из важнейших проблем современной химии и биохимии. Объект исследования исключительно лабилен, многообразен и сложен. Белки составляют основу покровных, соединительных, опорных, мышечных тканей, входят в состав клеточных мембран, определяют защитные функции организма белковые гормоны участвуют в регуляции процессов жизнедеятельности белки-ферменты обусловливают направление и скорость процессов распада и синтеза, происходящих на клеточном уровне. Поэтому понятен тот пристальный интерес, которьш вызывают белки у представителей целого ряда смежных наук, занимающихся изучением живой материи. Значительная роль в изучении белка принадлежит химии. [c.17]
Белки выполняют и защитные функции — вырабатывают антитела, защищающие организм от инфекции многие биологические яды (токсины) являются белками или белковоподобными соединениями. [c.62]
Лизоцим содержится в белке куриного яйца, селезенке, сердце, печени, легком, в различных секреторных выделениях (слюне, слизистой носа и др.) и в соках некоторых растений. Особенно много лизоцима в легочной ткани, которая непосредственно соприкасается с бактериями воздуха. Значительное количество лизоцима обнаружено и в селезенке. С другой стороны, лизоцим отсутствует или находится в незначительных количествах в органах и тканях, которые мало доступны микрофлоре (например, мышцы). Это свидетельствует о том, что лизоцим является антибактериальным веществом, выполняющим определенные защитные функции в естественном иммунитете животного организма. [c.219]
[c.219]
Защитная функция. Наличие в крови иммунных глобулинов и антител предохраняет организм от ряда инфекций. Кроме того, в крови содержатся белки и ферментативная система, предохраняющие организм от кровопотерь. При ранениях благодаря свертыванию крови образуется тромб, закрывающий просвет сосудов и останавливающий кровотечение. [c.505]
Защитная функция. Антитела иммуноглобулины) — это высокоспецифичные белки, которые способны узнавать и связывать такие чужеродные организму объекты, как вирусы, бактерии и клетки других организмов. Кроме того, к защитным белкам можно отнести фибриноген и тромбин — они участвуют в свертывании крови, предохраняя тем самым организм от кровопотери. [c.82]
Защитная функция углеводов проявляется в том, что они являются основными компонентами оболочек растительных клеток, участвуют в построении наружного скелета (внешней оболочки) насекомых и ракообразных, в образовании клеточных стенок бактерий и клеточных мембран всех живых организмов (в виде сложных молекулярных комплексов с белками). [c.232]
Прежде чем рассмотреть исследования Астбери, кратко остановимся на предложенной им классификации белков, в основу которой был положен структурный признак [11, 12]. По этому признаку все белки делятся на два больших класса фибриллярных и глобулярных белков. Первые имеют вытянутую, волокнистую структуру вторые -форму глобулы (во времена Астбери они назывались корпускулярными белками). Такое разделение отчасти согласуется со спецификой функционирования белков и растворимостью их в воде. Фибриллярные белки входят в состав кожи, соединительных тканей, хрящей, скелета, волос, рогов и т.д. Как правило, в обычных условиях они химически инертны, не растворяются в воде и выполняют структурную или защитную функцию. Глобулярные белки играют активную роль в метаболизме, участвуя во всех процессах жизнедеятельности организма. Многие глобулярные белки растворимы в воде.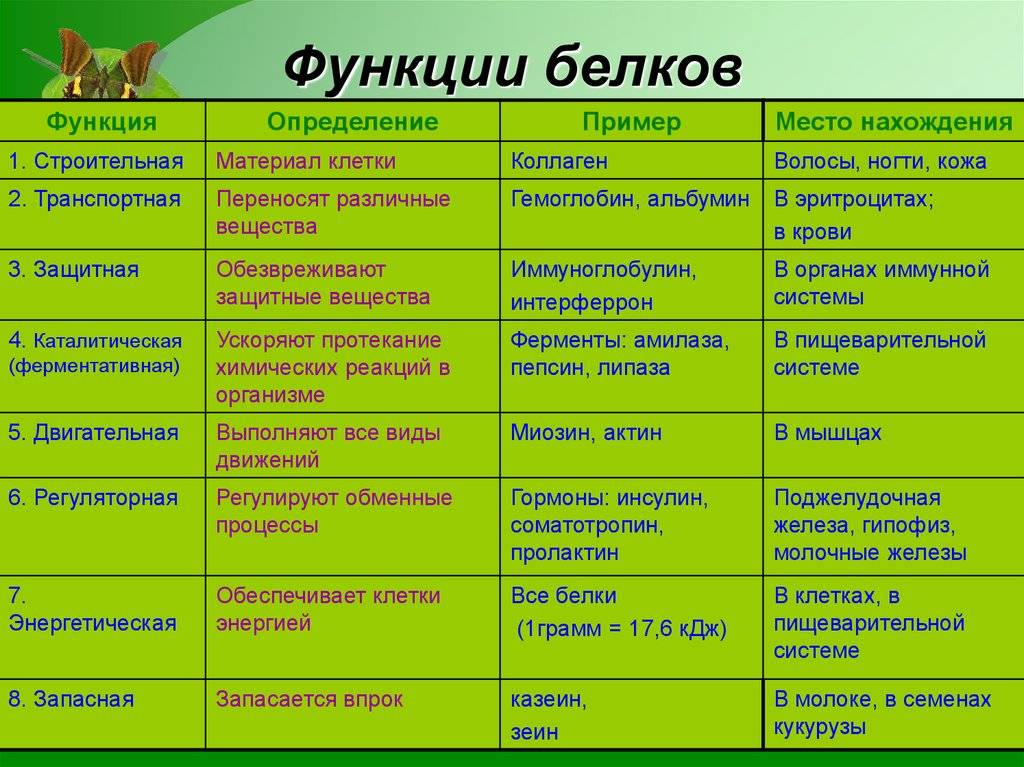 Четкой структурной или функциональной границы между двумя классами белков, однако, провести нельзя. Например, миозин (белок мышц), хотя и имеет волокнистое строение, тем не менее химически не инертен. Функция миозина связана с превращением химической энергии в механическую работу. Несмотря на значительную условность, предложенная Астбери и сохранившаяся до сих пор классификация белков по структурному признаку остается все еще целесообразной. Сама идея разделения белков в зависимости от топологии структуры хорошо согласуется с одной из задач молекулярной биологии, а именно с установлением связи между строением (в том числе пространственным) и функцией биологических молекул. У. Астбери были изучены структуры разнообразных фибриллярных белков [13, 14]. Оказалось, что эти белки по структурному признаку могут быть разделены на две конформационные группы. Первая группа, названная по начальным буквам входящих в нее белков группой к.т.е.Г., включает такие белки, как кератин (белок волос, шерсти, ногтей и т.д.), миозин (белок мышц), эпидермин (белок кожи) и фибриноген (белок плазмы крови). Во вторую группу фибриллярных белков (группа коллагена) входят белки сухожилий, соединительных тканей, хрящей и др. Белки каждой группы имеют близкие картины рентгеновской дифракции, что указывает на их конформационную аналогию. [c.11]
Четкой структурной или функциональной границы между двумя классами белков, однако, провести нельзя. Например, миозин (белок мышц), хотя и имеет волокнистое строение, тем не менее химически не инертен. Функция миозина связана с превращением химической энергии в механическую работу. Несмотря на значительную условность, предложенная Астбери и сохранившаяся до сих пор классификация белков по структурному признаку остается все еще целесообразной. Сама идея разделения белков в зависимости от топологии структуры хорошо согласуется с одной из задач молекулярной биологии, а именно с установлением связи между строением (в том числе пространственным) и функцией биологических молекул. У. Астбери были изучены структуры разнообразных фибриллярных белков [13, 14]. Оказалось, что эти белки по структурному признаку могут быть разделены на две конформационные группы. Первая группа, названная по начальным буквам входящих в нее белков группой к.т.е.Г., включает такие белки, как кератин (белок волос, шерсти, ногтей и т.д.), миозин (белок мышц), эпидермин (белок кожи) и фибриноген (белок плазмы крови). Во вторую группу фибриллярных белков (группа коллагена) входят белки сухожилий, соединительных тканей, хрящей и др. Белки каждой группы имеют близкие картины рентгеновской дифракции, что указывает на их конформационную аналогию. [c.11]
Тактика минимальной защиты эффектно продемонстрирована Хирш-маиом при полном синтезе S-белка рибонуклеазы А. Пептидная цепь из 103 аминокислот содержит все трифункциональные аминокислоты, исключая триптофан, в которых были защищены только -амиио- и тиольные группы. Вследствие частичной защиты синтез фрагментов и последующая их конденсация (сборка) могли быть проведены лишь немногими методами (с применеииём НКА и НТА, N-гидроксисукцииимидиых эфиров и азидным методом). Само собой разумеется, что опасность побочных реакций при минимальной защите велика, поэтому фрагменты после их синтеза должны быть очень тщательно очищены. Деблокирование защитных функций обычно протекает без осложнений. [c.221]
[c.221]
Обмен веществ, структура и функция каждой клетки в решающей степени определяются белками. Химические реакции в клетке, которые in vitro протекали бы исключительно медленно, ускоряются особыми каталитическими белками, ферментами, в сотни тысяч раз. Само собой разумеется, что при этом подвергается влиянию не состояние равновесия реакции, а скорость его наступления. Другие белки выполняют внешние или внутренние защитные функции. [c.340]
Особенно важную защитную функцию выполняют белки н процессе свертывания крови у позвоночных. На последней стадии этого сложного процесса, включающего 12 факторов (из них 11 белковых) и начинающегося при понрежденни сосуда, растворимый белок плазмы фибриноген, синтезируемый в печени, переходит в фибрин, закрывающий рану. [c.427]
Защитная функция соединений кислорода. В живых организмах происходит восстановление кислорода. В частности, в белых кровяных клетках — лейкоцитах — молекулярный кислород Og восстанавливается до надпероксид-ионов О , пероксида водорода HgOg и гидроксильных радикалов ОН. Главная функция этих частиц — защита организма от вторгающихся микробов. Кроме того, лейкоциты используют HgOg для окисления хлорид-ионов в хлорноватистую кислоту Н0С1, которая также служит средством для уничтожения бактерий. Подобные защитные механизмы действуют не только у млекопитающих, но и у растений, насекомых и простейших организмов. К сожалению, реакционноспособные соединения кислорода и хлора не только убивают проникающие микроорганизмы, но могут наносить ущерб и тканям организма-хозяина, повреждая важные биомолекулы, такие, как липиды, белки и ДНК. [c.470]
Обратимся теперь к функциям этих трех типов белков. Известно, что иммуноглобулины и HL-A-белки препятствуют вторжению в организм чужеродного белка. Пероксид-дисмутаза выполняет ту же функцию по отношению к небольшим радикалам О а- Необходимость в такой функции должна была возникнуть с появлением кислорода в атмосфере Земли. Поскольку все три рассмотренных типа белков выполняют защитную функцию, они представляют такой случай дифференциации, при котором функции изменяются значительно, но не полностью. [c.219]
Поскольку все три рассмотренных типа белков выполняют защитную функцию, они представляют такой случай дифференциации, при котором функции изменяются значительно, но не полностью. [c.219]
Нуклеоид — ядерное вещество, распыленное в щ1топлазме клетки. Не имеет ядерной мембраны, ядрыщек. В нем локализуется ДНК, представленная двухцепочечной спиралью. Обычно замкнута в кольцо и прикреплена к цитоплазматической мембране. Содержит около 60 млн пар оснований. Это чистая ДНК, она не содержит белков гистонов. Их защитную функцию выполняют метилированные азотистые основания. В нуклеоиде закодирована основная генетическая информация, т. е. геном клетки. [c.9]
Следует отметить, что некоторые авторы, и в том числе такие видные исследователи дубильных веществ, как Краус и Деккер, хотя и не считали, что фенольные соединения принимают активное участие в метаболизме, признавали их важное значение в жизни растений. По Краусу (Kraus, 1889), одной из важнейших функций фенольных соединений является их способность образовывать нри повреждении растений комплексы с белками (подобно взеШмо-действию дубильных веществ с коллагеном). Такие комплексы создают на поврежденной поверхности пленку, препятствующую проникновению гриба-натогепа. Отсюда возник термин защитная функция дубильных веществ. Краус считал, что проблема физиологической роли дубильных веществ очень сложна и полна противоречий. С одной стороны, широкое распространение фенольных соединений в важнейших органах и тканях растений свидетель- [c.8]
Защитная. Белки иммунной системы гаммаглобулины «узнают» и связывают чужеродные вещества, поступающие в организм, защищая тем самым его от вирусов, бактерий и клеток других организмов. Защитную функцию выполняет также белок интерферон. Белки плазмы крови фибриноген и тромбин участвуют в процессах свертывания крови, предотвращая кровопотери при ранениях. [c.229]
Многие белки образуют волокна, навитые друг на друга или уложенные плоским слоем они вьшолняют опорную или защитную функцию, скрепляя биологические структуры и придавая им прочность. Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий очень высокую прочность на разрыв. Выделанная кожа представляет собой почти чистый коллаген. Связки содержат элаетин-струк- [c.139]
Главным компонентом хрящей и сухожилий является фибриллярный белок коллаген, имеющий очень высокую прочность на разрыв. Выделанная кожа представляет собой почти чистый коллаген. Связки содержат элаетин-струк- [c.139]
Многие белки защищают организм от вторжения других организмов или предохраняют его от повреждений. Иммуноглобулины, или антитела, образующиеся у позвоночных,-это спещ1ализированные белки, вырабатываемые лимфоцитах они обладают способностью распознавать проникшие в организм бактерии, вирусы или чужеродные белки других видов, а затем нейтрализовать их или связываться с ними, вызывая образование осадка. Фибриноген и тромбин-белки, участвуюпдае в процессе свертьшания крови они предохраняют организм от потери крови при повреждении сосудистой системы. Змеиные яды, бактериальные токсины и токсичные белки растений, напримф рицин, по-видимому, также вьшолняют защитные функции. [c.140]
Белки могут быть разбиты на два больших класса в соответствии с формой их молекул и некоторыми физическими свойствами глобулярные и фибриллярные белки (рис. 6-1). В глобулярных белках одна или большее число полипептидных цепей свернуты в плотную компактную структуру сферической, или глобулярной, формы. Обьлно глобулярные белки растворимы в водных системах и легко диффундируют одни из.этих белков выполняют функции, обусловленные их подвижностью, а другие функционируют как динамические системы. К глобулярным белкам относятся почти все ферменты, равно как и транспортные белки крови, антитела и пищевые белки. Фибриллярные белки представляют собой нерастворимые в воде длинные нитевидные молекулы, полипептидные цепи которых не имеют глобулярной формы, а вытянуты вдоль одной оси. Большинство фибриллярных белков выполняет структурные или защитные функции. Типичными фибриллярными белками являются а-кератин волос и шерсти, фиброин шелка и коллаген сухожилий. [c.140]
В связи с этими соображениями возникает два вопроса при каких обстоятельствах они приложимы и известны ли конкретные примеры таких механизмов действия ферментов Очевидно, что если фермент должен эффективно осуществлять эту, по сути дела, защитную функцию, он должен связывать данный метаболит очень прочно это означает, что в растворе должно содержаться мало свободного метаболита. Именно так обстоит дело со многими неустойчивыми метаболитами, напртимер аденилатами аминокислот при синтезе белка, которые существуют в связанной с ферментами форме. С логически крайним случаем такого рода мы имеем дело в реакциях двухсубстратного механизма с замещением фермента, в которых промежуточное соединение [уызывает модификацию какой-либо группировки самого фермента. Это либо окисление — восстановление простетической группы, ковалентно связанной с ферментом, либо замещение одной из группировок фермента группировкой первого субстрата. Такое промежуточное соединение может быть химически весьма неустойчивым, как, например, шиффово основание, образующееся в качестве промежуточного продукта в альдолазной реакции. Тем не менее выбор молекул, с которыми это промежуточное соединение действительно может реагировать, ограничен вследствие различий химического окружения в свободном растворе и на поверхности белка, [c.113]
Именно так обстоит дело со многими неустойчивыми метаболитами, напртимер аденилатами аминокислот при синтезе белка, которые существуют в связанной с ферментами форме. С логически крайним случаем такого рода мы имеем дело в реакциях двухсубстратного механизма с замещением фермента, в которых промежуточное соединение [уызывает модификацию какой-либо группировки самого фермента. Это либо окисление — восстановление простетической группы, ковалентно связанной с ферментом, либо замещение одной из группировок фермента группировкой первого субстрата. Такое промежуточное соединение может быть химически весьма неустойчивым, как, например, шиффово основание, образующееся в качестве промежуточного продукта в альдолазной реакции. Тем не менее выбор молекул, с которыми это промежуточное соединение действительно может реагировать, ограничен вследствие различий химического окружения в свободном растворе и на поверхности белка, [c.113]
Уроновые кислоты, sHioOj — производные простых углеводов, продукты окисления первичной гидроксильной группы альдоз. Окисление D-глюкозы ведет к образованию наиболее распространенной в растительном и животном мире глюкуроновой кислоты. Она входит в состав полисахаридов соединительной ткани ксиланов, камедей, слизей, морских водорослей, глюкопротеидов крови, встречается в свободном состоянии. Свободная глюкуроновая кислота выполняет важную защитную функцию в животном организме. Реагируя с посторонними токсическими веществами (продуктами распада белков), она образует с ними эфиры, которые выделяются из организма с мочой. Таким же образом при участии глюкуроновой кислоты обезвреживаются и выводятся из организма некоторые лекарственные вещества. [c.210]
Такил образом, углеводы играют чрезвычайно важную роль. Они принимают центральное участие в таком космическом процессе, как фотосинтез, и обеспечивают нормальный механизм возбуждения в процессах высшей нервной деятельности. В виде коферментов они участвуют в огромном числе метаболических процессов в области обмена нуклеиновых кислот, белков, жиров и углеводов и множестве защитных функций, включая механические функции гиалуроновой кислоты и Х ондроитинсульфатов и тонкие иммунохимичеокие реакции. [c.6]
[c.6]
Гуминовые кислоты в виде солей аммония обладают физиологической активностью. В настоящее время накоплен обширный материал, подтверждающий положительные биологические свойства гуматов. Физиологическое и стимулирующее действие природных гуминовых кислот на высшие растения проявляются по разному гормональное воздействие улучшение проникновения минеральных элементов через корни растений в виде гуминоминеральных соединений участие в физиологических процессах роста. Как установлено рядом исследователей, гуминовые кислоты могут проникать не только в отдельные органы растений стебель, листья, корень), но также и в отдельные клетки, достигая их составляющих, вплоть до ядра. Гуминовые кислоты в виде растворимых солей усваиваются растениями, принимая активное участие в процессах жизнедеятельности растительных клеток, оказывая активное влияние на биоэнергетику растения, способствуют ускорению синтеза рибонуклеиновых кислот, а следовательно, и белка в целом. Участие гуминовых кислот в процессе жизнедеятельности растения приводят к ускорению и улучшению обмена веществ. Можно отметить также защитную функцию гуминовых препаратов, которые, усваиваясь растениями, повышают их устойчивость к выраженным факторам температурному воздействию, химическому, радиации и т. д. В работе показано стимулирующее влияние гуминовых кислот, веществ как на развитие растений, так и на использование ими азота при внесении в качестве стимуляторов гуминовых препаратов. Таким образом, гуминовые вещества являются необходимой составной частью почв и способствуют нормальному развитию растений. При обеднении почвы гумусовыми веществами возникает необходимость дополнительного их внесения, что дост аточно легко сделать, если их вносить в виде физиологически активных водорастворимых солей гуминовых кислот-гуматов, которые при концентрации тысячных долей процента оказывают стимулирующее действие на растительные организмы. Разнообразный исходный материал, используемый для получения гуматов, методы извлечения отражаются на конечном продукте, поэтому проводить сравнительную характеристику предлагаемого продукта с известными гуматами К и Ыа достаточно трудно. Для оценки физиологической активности препарата была предложена методика лабораторных испытаний в качестве стимулятора роста и развития растений, оп-робированная на кресс-салате. Испытание препарата в условиях защищенного грунта показали эффективность его применения для предпосевной обработки овощных культур. При такой обработке активизируется стартовое начало, что положительно сказывается в течение всего периода вегетации и на конечном урожае. [c.97]
Для оценки физиологической активности препарата была предложена методика лабораторных испытаний в качестве стимулятора роста и развития растений, оп-робированная на кресс-салате. Испытание препарата в условиях защищенного грунта показали эффективность его применения для предпосевной обработки овощных культур. При такой обработке активизируется стартовое начало, что положительно сказывается в течение всего периода вегетации и на конечном урожае. [c.97]
Клетки крови (форменные элементы), 45 % Межклеточное вещество (плазма крови), 55 % Эритроциты (красные кровяные тельца) Лейкоциты (белые кровяные тельца) Тромбоциты (кровяные пластинки неклеточного строения) Вода (90 %) белки (8 %) углеводы, жиры, витамины, гормоны, минеральные соли и другие вещества (2 %) Перенос О2 и СО2 Защитная функция (клеточный иммунитет) Защитная функция (участие в свертьшании крови) Поддержание иммунитета, питание клеток организма, регуляция функций организма [c.209]
Итак, отправной точкой всей фотобиологии является свет, поглощенный молекулами биосубстрата и переведший их в электронно-возбужденное состояние. Электронно-возбужденные состояния возникают либо в результате поглощения кванта света самой молекулой (прямое возбуждение), либо вследствие миграции энергии от соседних молекул (косвенное возбуждение). Миграция энергии увеличивает поперечное сечение биологически активного поглощения (точнее, элементарного акта фотобиологической реакции), как это наблюдается, например, при фотосинтезе, где многие молекулы-светосборщи-ки работают на одну молекулу. реакционного центра. В других случаях миграция энергии выполняет защитную функцию. Например, перенос энергии от нуклеотидов ДНК к тирозину белков в хроматине снижает эффективность повреждающего действия УФ-света на геном,— [c.366]
Мембранные белки участвуют во всех процессах метаболизма и выполняют защитные функции. Кроме того, определенные белки устанавливают специфические контакты с внешним окружением — со средой и соседними клетками. Эти белки Сингер назвал информационными, так как они формируют и передают сигналы об окружении внутрь клетки (Singer, 1992), Такое подразделение является условным, так как все процессы на поверхности клетки (ферментные, контактные, транспортные, электрохимические) взаимосвязаны и информация о них поступает внутрь клетки. [c.118]
Эти белки Сингер назвал информационными, так как они формируют и передают сигналы об окружении внутрь клетки (Singer, 1992), Такое подразделение является условным, так как все процессы на поверхности клетки (ферментные, контактные, транспортные, электрохимические) взаимосвязаны и информация о них поступает внутрь клетки. [c.118]
У диатомовых водорослей кремний выполняет защитную функцию, образуя кремниевый панцирь, он необходим в процессе размиолортокремниевая кислота усиливает синтез аминокислот и белков, регулирует дыхаиие и синтез хлорофилла. [c.289]
что является основными ферментативными функциями рибосомы или углеводов в организме и таблица об этом
Функции белков в природе универсальны. Белки входят в состав всех живых организмов. Мышцы, кости, покровные ткани, внутренние органы, хрящи, шерсть, кровь — все это белковые вещества.
Растения синтезируют белки из углекислого газа и воды за счет фотосинтеза. Животные организмы получают, в основном, готовые аминокислоты с пищей и на их базе строят белки своего организма.
Функции белков в организме
Ни один из известных нам живых организмов не обходится без белков.
Белки служат питательными веществами, они регулируют обмен веществ, исполняя роль ферментов – катализаторов обмена веществ, способствуют переносу кислорода по всему организму и его поглощению, играют важную роль в функционировании нервной системы, являются механической основой мышечного сокращения, участвуют в передаче генетической информации и т.д.
Каталитическая (ферментативная) функция
Каталитическая функция — одна из основных функций белков. Абсолютно все биохимические процессы в организме протекают в присутствии катализаторов – ферментов. Все известные ферменты представляют собой белковые молекулы.
Белки – это очень мощные катализаторы. Они ускоряют реакции в миллионы раз, причем для каждой реакции существует свой фермент.
В настоящее время известно свыше 2000 различных ферментов, которые являются биологическими катализаторами.
Например, фермент пепсин расщепляет белки в процессе пищеварения.
Даже такая простая реакция как гидратация углекислого газа катализируется ферментом карбоангидразой.
Ферменты катализируют реакции расщепления сложных молекул (катаболизм) и их синтеза (анаболизм), а также репликации ДНК и матричного синтеза РНК.
Транспортная функция
Некоторые белки способны присоединять и переносить (транспортировать) различные вещества по крови от одного органа к другому и в пределах клетки.
Белки транспортируют липиды (липопротеиды), углеводы (гликопротеиды), ионы металлов (глобулины), кислород и углекислый газ (гемоглобин), некоторые витамины, гормоны и др. Например, альбумины крови транспортируют липиды и высшие жирные кислоты (ВЖК), лекарственные вещества, билирубин.
Белок эритроцитов крови гемоглобин соединяется в легких с кислородом, превращаясь в оксигемоглобин.
Достигая с током крови органов и тканей, оксигемоглобин расщепляется и отдает кислород, необходимый для обеспечения окислительных процессов в тканях.
Белок миоглобин запасает кислород в мышцах. Специфические белки-переносчики обеспечивают проникновение минеральных веществ и витаминов через мембраны клеток и субклеточных структур.
Защитная функция
Защитную функцию выполняют специфические белки (антитела — иммуноглобулины), которые вырабатываются иммунной системой организма. Они обеспечивают физическую, химическую и иммунную защиту организма путем связывания и обезвреживания веществ, поступающих в организм или появляющихся в результате жизнедеятельности бактерий и вирусов.
Например, белок плазмы крови фибриноген участвует в свертывании крови (образовывает сгусток). Это защищает организм от потери крови при ранениях. Альбумины обезвреживают ядовитые вещества (ВЖК и билирубин) в крови.
Антитела, вырабатываемые лимфоцитами, блокируют чужеродные белки. Интерфероны — универсальные противовирусные белки.
Интерфероны — универсальные противовирусные белки.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
Сократительная (двигательная) функция
Важным признаком жизни является подвижность, в основе которой лежит данная функция белков, таких как актин и миозин – белки мышц. Кроме мышечных сокращений к этой функции относят изменение форм клеток и субклеточных частиц.
B результате взаимодействия белков происходит передвижение в пространстве, сокращение и расслабление сердца, движение других внутренних органов.
Структурная функция
Структурная функция — одна из важнейших функций белков. Белки играют большую роль в формировании всех клеточных структур.
Белки – это строительный материал клеток. Из них построены опорные, мышечные, покровные ткани.
Некоторые из них (коллаген соединительной ткани, кератин волос, ногтей, эластин стенок кровеносных сосудов, фиброин шелка и др.) выполняют почти исключительно структурную функцию. Кератин синтезируется кожей. Волосы и ногти – это производные кожи.
В комплексе с липидами белки участвуют в построении мембран клеток и внутриклеточных образований.
Гормональная (регуляторная) функция
Регуляторная функция присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Интересно знать! В плазме некоторых антарктических рыб содержатся белки со свойствами антифриза, предохраняющие рыб от замерзания, а у ряда насекомых в местах прикрепления крыльев находится белок резилин, обладающий почти идеальной эластичностью. В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
В одном из африканских растений синтезируется белок монеллин с очень сладким вкусом.
Питательная (запасная) функция
Питательная функция осуществляется резервными белками, которые запасаются в качестве источника энергии и вещества.
Например: казеин, яичный альбумин, белки яйца обеспечивают рост и развитие плода, а белки молока служат источником питания для новорожденного.
Рецепторная (сигнальная) функция
Некоторые белки (белки-рецепторы), встроенные в клеточную мембрану, способны изменять свою структуру под воздействием внешней среды. Так происходит прием сигналов извне и передача информации в клетку.
Например, действие света на сетчатку глаза воспринимается фоторецептором родопсином.
Рецепторы, активизируемые низкомолекулярными веществами типа ацетилхолина, передают нервные импульсы в местах соединения нервных клеток.
Энергетическая функция
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке (после их гидролиза). Обычно белки расходуются на энергетические нужды в крайних случаях, когда исчерпаны запасы углеводов и жиров.
При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии. Но в качестве источника энергии белки используются крайне редко. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источник: https://himija-online.ru/organicheskaya-ximiya/belki/funkcii-belkov-v-organizme.html
Функции белков в клетке:
- Строительная – обусловлена наличием белка во всех клеточных структурах. (Форма всех органелл клетки зависит от структуры белков).
- Каталитическая – реакции в клетке без ферментов идут медленно, так как концентрации исходных веществ (субстратов) в клетке малы. Обычно размеры молекул ферментов больше, чем размеры субстратов. Например, молекулярная масса каталазы, разрушающей пероксид водорода Н2О2, равна 250000, а самого пероксида – 34.
 Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций.
Активный центр фермента – лишь небольшой участок его молекулы, на котором и происходит сама реакция. Фермент сравнивают с замком, а субстрат – с ключом, так как они должны точно подходить друг другу. Каждая реакция катализируется своим ферментом, однако существуют ферменты, которые катализируют несколько реакций. - Двигательная – все движения обусловлены работой двигательных (сократительных) белков. В мышечных клетках при сокращении нитей более активна внедрённая между волокнами миозина за счёт энергии АТФ.
- Транспортная – белок гемоглобин транспортирует кислород и углекислый газ в организме. Через мембраны происходит транспорт различных веществ (сахар, ионы и др.).
- Защитная – осуществляется с помощью антител и антигенов. Антитела – белковые структуры β-лимфоцитов избирательно связывающиеся с чужеродными белками и клетками. Антигены – белки на поверхности клетки или в растворе, по которым Т-лимфоциты различают свои клетки и чужеродные. Убитые или ослабленные бактерии и вирусы (вакцины) несут свои антигены. При введении их в организм иммунная система вырабатывает антитела, что препятствует заболеванию.
- Энергетическая – белки являются источниками энергии. 1г белка при окислении даёт 17,6 кДж. Белок при разрушении образует СО2, Н2О, Nh4. Аммиак Nh4 ядовит, поэтому в печени он превращается в мочевину и мочевую кислоту.
- Регуляторная – пептидные гормоны, выделяемые железами внутренней секреции, изменяют обмен веществ в клетках определенных тканей.
Инсулин активирует захват молекулы глюкозы клеткой и синтез из неё гликогена. Без инсулина клетки голодают, так как не поглощают глюкозу, в результате чего развивается сахарный диабет. Т-лимфоциты передают с помощью белков информацию о чужеродных клетках β-лимфоцитам.
ФИЗИЧЕСКИЕ И ХИМИЧЕСКИЕ СВОЙСТВА
Свойства белков так же разнообразны, как и функции. Одни растворяются в воде и образуют коллоидные растворы, другие растворяются в разбавленных растворах солей. Некоторые нерастворимы, например, белки кожи.
Некоторые нерастворимы, например, белки кожи.
ХИМИЧЕСКИЕ СВОЙСТВА
В радикалах АК-остатков белков содержатся различные функциональные группы, способные вступать в химические реакции:
- восстановления;
- этерификации;
- лкилирования;
- нитрования.
Будучи амфотерным соединением белок реагирует и с кислотами, и со щелочами.
Источник: https://megaobuchalka.ru/9/32081.html
Функции белков
Работа и функции белков лежат в основе структуры любого организма и всех протекающих в нем жизненных реакций. Любые нарушения этих белков приводят к изменению самочувствия и нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни «Жизнь есть способ существования белковых тел, …. » до сих пор, по прошествии полутора веков, не потеряли своей правильности и актуальности.
Структурная функция
Вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин (интегральный, фиксирует спектрин на поверхности).
К данной функции можно отнести участие в создании органелл – рибосомы.
Ферментативная функция
Все ферменты являются белками. В то же время есть данные о существовании рибозимов, т.е. рибонуклеиновых кислот, обладающих каталитической активностью.
Гормональная функция
Регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками.
Рецепторная функция
Эта функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортная функция
Только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы.
Транспорт веществ через мембраны осуществляют белки — Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры.
Резервная функция
В качестве примера депонированного белка можно привести производство и накопление в яйце яичного альбумина. У животных и человека таких специализированных депо нет, но при длительном голодании используются белки мышц, лимфоидных органов, эпителиальных тканей и печени.
Сократительная функция
Существует ряд внутриклеточных белков, предназначенных для изменения формы клетки и движения самой клетки или ее органелл (тубулин, актин, миозин).
Защитная функция
Защитную функцию, предупреждая инфекционный процесс и сохраняя устойчивость организма, выполняют иммуноглобулины крови, факторы системы комплемента (пропердин), при повреждении тканей работают белки свертывающей системы крови — например, фибриноген, протромбин, антигемофильный глобулин. Механическую защиту в виде слизистых и кожи осуществляют коллаген и протеогликаны.
К данной функции также можно отнести поддержание постоянства коллоидно-осмотического давления крови, интерстиция и внутриклеточных пространств, а также иные функции белков крови.
Белковая буферная система участвует в поддержании кислотно-щелочного состояния.
Существуют белки, которые являются предметом особого изучения:
Монеллин – выделен из африканского растения, обладает очень сладким вкусом, не токсичен и не способствует ожирению.
Резилин – обладает почти идеальной эластичностью, составляет „шарниры» в местах прикрепления крыльев насекомых.
Белки со свойствами антифриза обнаружены у антарктических рыб, они предохраняют кровь от замерзания
Источник: https://biokhimija.ru/belki/belki.html
Функции белка в клетке: структура белковой молекулы, виды органического вещества
Каждая клетка живого организма функционирует за счет содержания необходимых компонентов. Они выполняют важную роль, стимулируют обменные процессы и способствуют обновлению.
Особенно важны функции белка в клетке. Органические компоненты могут иметь разный состав, строение, некоторые отличия в жизненном цикле. Сегодня специалисты используют различные методы для исследования молекул и выявления их особенностей.
Что такое белки
Белки представляют собой органические соединения, имеющие различный состав и выполняющие важные функции в организме всех живых существ. Существует несколько видов этих молекул, каждый из которых имеет значение в процессе жизнедеятельности.
Состав
Органические вещества являются высокомолекулярными, поэтому могут включать в свой состав различные аминокислоты и другие соединения. Набор важных компонентов в каждой молекуле закладывается генетическим кодом животного или человека.
Основные компоненты каждой молекулы:
- углерод;
- кислород;
- азот;
- водород;
- сера.
Первый компонент обнаруживается в белке в наибольшем количестве, последний — не более 5 % от состава.
История открытия
Первый белок был получен необычным способом. Его выделили из пшеничной муки в виде клейковины. Произошло открытие в 1728 году, сделал его Якопо Беккари, итальянец. В качестве отдельного биологического класса молекулы белка были выделены в XVIII веке после обнародования работ французского ученого и химика Антуана де Фуркруа.
Произошло открытие в 1728 году, сделал его Якопо Беккари, итальянец. В качестве отдельного биологического класса молекулы белка были выделены в XVIII веке после обнародования работ французского ученого и химика Антуана де Фуркруа.
Другие ученые одновременно с французом отметили, что молекулы имеют свойство коагулировать (объединяться) под воздействием некоторых кислот или в процессе нагревания.
На тот момент ученые смогли изучить только альбумин, фибрин и глютен.
Только через 100 лет, в XIX веке, другие исследователи, изучив состав простых белков, отметили, что при нагревании происходит выделение аминокислот. Это помогло сделать вывод, что молекулы включают в себя довольно большое количество важных и разных аминокислот, а состав каждой из них индивидуален.
В 1836 году Мульдер предложил первую структурную формулу белков, основанную на теории радикалов. Он и еще несколько ученых вывели формулу протеинов, что в переводе с греческого означает «первый».
Мульдер также определил почти точную молекулярную массу наиболее простого белка, равную 131 дальтону. Дальтон — единица измерения молекул, называемая еще атомной массой или углеродной единицей.
Позже ученые выявили, что молекулярная масса может быть различной и зависит от состава и структуры органического соединения. В 1880-х годах русский ученый Данилевский изучил пептидные группы и доказал их существование в белковой молекуле. К этому времени большинство аминокислот уже были изучены.
В 1894 году немецкий ученый и физиолог Альбрехт Коссель рассказал о своем предположении. Он считал, что именно аминокислоты являются основными структурными элементами белковой молекулы.
Его теория была подтверждена в начале ХХ века химиком из Германии Эмилем Фишером. Ученый в ходе своего эксперимента доказал, что каждая молекула содержит около 20 аминокислот.
Важность белка в живом организме была признана только в 1926 году благодаря эксперименту американца Джеймса Самнера. После этого начинается активное изучение структур молекулы, выделяются различные виды. В 60—80-ых годах ХХ века исследования продолжаются.
В 60—80-ых годах ХХ века исследования продолжаются.
К 2012 году в базе данных насчитывалось около 87 тысяч структур. Сегодня методы изучения молекулы усовершенствованы, поэтому работа в этом направлении продолжается.
Строение
Белок считается макромолекулой, поскольку имеет большой размер и множество составляющих. В строении белков присутствуют разные аминокислоты или их остатки, они чередуются с полипептидными цепями.
В молекулу могут входить следующие аминокислоты:
- глицин;
- аланин;
- изолейцин;
- серин;
- лейцин;
- валин;
- треонин.
Эти встречаются в составе наиболее часто, сочетаются с пептидными цепями и аминокислотными остатками.
Классификация
Существуют несколько классификаций белков в зависимости от состава, строения, формы, растворимости в воде. Чаще всего молекулы делят на простые и сложные с учетом строения.
К простым относятся следующие:
- Альбумины — жизненно необходимы животным и человеку. Содержатся во многих продуктах, хорошо растворяются в воде, соленых жидкостях под воздействием кислот. Являются основной составляющей мышечных тканей в организме, формируют резерв на случай длительного голодания.
- Глобулины в воде слабо растворяются. Являются составляющими крови, мышечной ткани, оказывают влияние на свертываемость, выполняют защитную функцию.
- Протамины — низкомолекулярные белки, хорошо растворимые в воде. В организме выполняют структурную функцию, являются строительным материалом для мышц и других тканей.
- Гистоны — низкомолекулярные вещества, содержат большое количество лизина и аргинина. Принимают участие в формировании структуры молекул ДНК, предупреждают передачу генетической информации к РНК.
- Проламины — растительные белки с невысокой пищевой ценностью. Создают в организме резерв.
- Глютелины — растительные вещества, принимающие участие в формировании клеточной оболочки.
 Денатурация происходит в солевых растворах, в воде они не растворимы.
Денатурация происходит в солевых растворах, в воде они не растворимы. - Протеноиды — животные белки, богатые аминокислотами, не растворяются в воде, кислотах, щелочах, солевых жидкостях. Входят в состав костной, хрящевой ткани, связок, сухожилий.
Среди сложных белков выделяют фосфопротеины, гликопротеины, нуклеопротеины, липопротеины, хромопротеины, металлопротеины.
Каждый вид имеет свои особенности:
- Фосфопротеины — сложные белки, содержащие остатки фосфорной кислоты, связывающиеся с пептидными цепями. Выполняют в организме защитную, строительную, энергетическую функции.
- Гликопротеины — сложные органические компоненты, содержащие углеводный остаток. Принимают участие в выработке ферментов, выполняют защитную и секреторную функции, стимулируют образование важных для жизнедеятельности гормонов.
- Нуклеопротеины состоят из нуклеиновых кислот (нуклеотиды), наиболее распространенные РНК и ДНК. Содержатся в мембранах клетки, формируют генетический код человека.
- Липопротеины содержат липиды (жиры), присутствуют в лимфе и плазме крови, не растворяются в воде. Выполняют транспортировочную функцию, переносят липиды по всему организму.
- Хромопротеины называют «цветными белками». В составе содержат окрашивающий компонент. Участвуют в транспортировке кислорода. Яркий представитель вида — гемоглобин.
- Металлопротеины содержат ионы металла в составе. Транспортируют металл в организме, создают его резерв.
Любой из видов играет важную роль в метаболических процессах.
Функции
Различные виды белков выполняют в организме важные функции. При отсутствии основных типов нарушаются все жизненно важные процессы.
Каталитическая
Катализ реакций в организме осуществляется благодаря наличию ферментов, являющихся белками по своему составу и строению. Ферменты помогают расщеплять сложные вещества на простые, облегчают их переработку.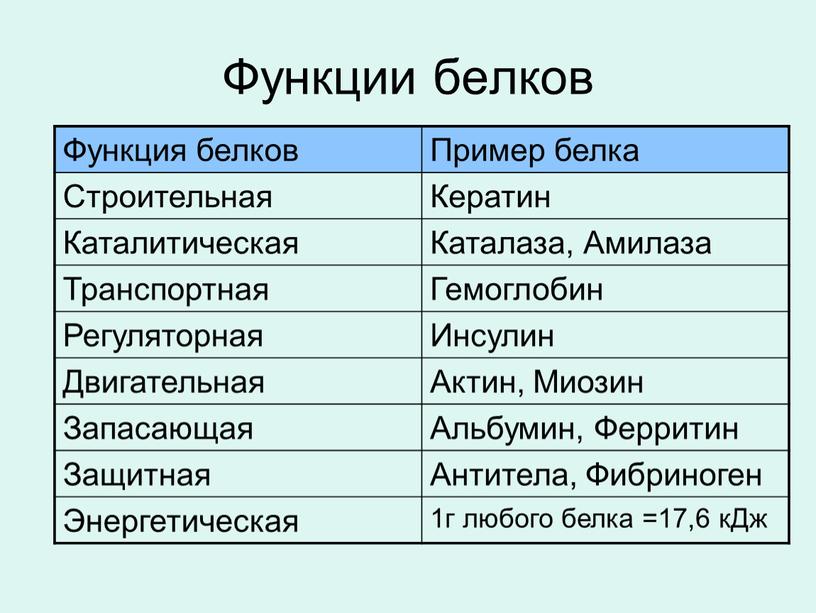
Благодаря этому возможно поступление полезных компонентов ко всем тканям, органам, регенерация клеток, осуществление нормального метаболизма.
Структурная
Осуществляется благодаря коллагену и эластину. Белки являются важным строительным элементом, стимулируют формирование костной ткани, мышц, хрящей, связок и сухожилий.
Выделяют 4 структуры белковой молекулы:
- Первичная структура представляет собой последовательность остатков аминокислот, чередующихся с полипептидной цепью. Встречается во многих тканях, на протяжении жизни организма не меняет строения.
- Вторичная структура — упорядочивание фрагментов полипептидной цепи, подверженное стабилизации за счет наличия водородных связей.
- Третичная структура — строение полипептидной цепи пространственного типа. При детальном рассмотрении можно увидеть, что строение напоминает вторичную структуру, но присутствуют гидрофобные взаимодействия.
- Четвертичная структура представляет собой белковое соединение, состоящее из нескольких пептидных цепей в одном комплексе.
Благодаря различной структуре белковых молекул осуществляется построение всех клеток и тканей в организме.
Защитная
Физическая защита осуществляется благодаря наличию в клетках и тканях коллагена, отвечающего за прочность и предотвращающего повреждения. Химическая защита осуществляется благодаря способности белков связывать токсины, выводить их из организма.
Иммунная защита возможна благодаря способности некоторых белков стимулировать образование лимфоцитов, уничтожать вирусы, патогенные микроорганизмы.
Сигнальная и регуляторная
Регуляция всех процессов в клетках осуществляется с участием белков, представленных ферментами. Часто компоненты связываются с другими веществами, стимулируют процессы регенерации, регулируют метаболизм.
Многие внутриклеточные белки осуществляют сигнальную функцию, помогают передавать информацию между тканями, клетками, органами. Обычно сигнальную функцию выполняют белки-гормоны.
Обычно сигнальную функцию выполняют белки-гормоны.
Транспортная
Транспортная функция осуществляется в основном за счет белка-гемоглобина. Он доставляет кислород ко всем тканям и клеткам, переправляет в легкие углекислый газ для выведения его наружу. Ученые нашли во всех живых организмах молекулы, напоминающие по строению гемоглобин.
Запасная и моторная
Запасная или резервная функция возможна благодаря наличию в клетке белков, содержащих аминокислоты. Они служат источником питания и энергии при недостаточном поступлении подобных компонентов с пищей.
Моторная или двигательная функция играет важную роль. Разные виды белковых молекул принимают участие в сокращении мышечных волокон, передвижении лейкоцитов и других клеток для обеспечения иммунной защиты.
Свойства
Белковые соединения обладают физическими и химическими свойствами, отличающими их от других молекул.
Физические
Физические свойства позволяют выявить белок среди других соединений в живом организме.
Основными будут следующие:
- вес молекулы может достигать 1 млн дальтон;
- при попадании в водный раствор происходит формирование коллоидной системы;
- в зависимости от кислотности среды отличается заряд белкового соединения;
- самый крупный сегодня белок — титин.
Молекулярная масса у каждого соединения отличается, определяется разными способами.
Химические
При определенных условиях белковые соединения проявляют свои химические свойства.
Наиболее частыми реакциями будут следующие:
- Амфотерность — способность белков в зависимости от условий проявлять основные свойства и кислотные.
- Денатурация — изменение биологической активности соединения в результате потери вторичной, третичной или четвертичной структуры. Может быть механической, физической и химической, обратимой и необратимой, полной и неполной.
Химические свойства белков изучаются различными методами для выявления особенностей молекул.
Этапы синтеза белка
Биосинтез белка представляет собой процесс, состоящий из нескольких этапов, в ходе которых происходит созревание соединений. Протекает во всех живых организмах.
Основные этапы синтеза:
- Инициация. Образование аминоацеладинелата одновременно с активацией аминокислоты в присутствии АТФ и специфического фермента.
- Элонгация. Присоединение образовавшейся кислоты к специфичной тРНК с последующим освобождением аденозинмнофосфата.
- Терминация. Связывание соединения аминокислоты и тРНК с рибосомами.
- Трансляция. Включение аминокислоты в белковую молекулу с одновременным высвобождением тРНК.
У разных живых организмов процесс может проходить с разной скоростью, но последовательность этапов неизменна.
Методы изучения
Сегодня исследование белковых соединений продолжается в современных лабораториях.
Популярные методы изучения:
- Метод клеточной и молекулярной биологии используется с целью фиксирования локализации молекул в клетках, наблюдения за синтезом веществ. Для стимулирования реакции используются антитела. Наблюдение проводится посредством микроскопа. На предметное стекло помещается подготовленный белок и антитела, проводится эксперимент, результаты фиксируются.
- Биохимический метод предполагает изучение чистого белка, избавленного от дополнительных компонентов. Для дальнейшего изучения используют центрифугирование, высаливание, электрофокусирование.
- Протеомика — наука, изучающая совокупность белковых соединений в составе одной клетки. Для исследования используются специальные приборы, соединения, белковые микрочипы, позволяющие изучать сразу несколько молекул в клетке.
Благодаря новейшим современным методикам возможно прогрессирование науки в области исследования живых клеток и их составляющих.
Биологическое значение
Биологическое значение органических соединений объясняется множеством полезных функций.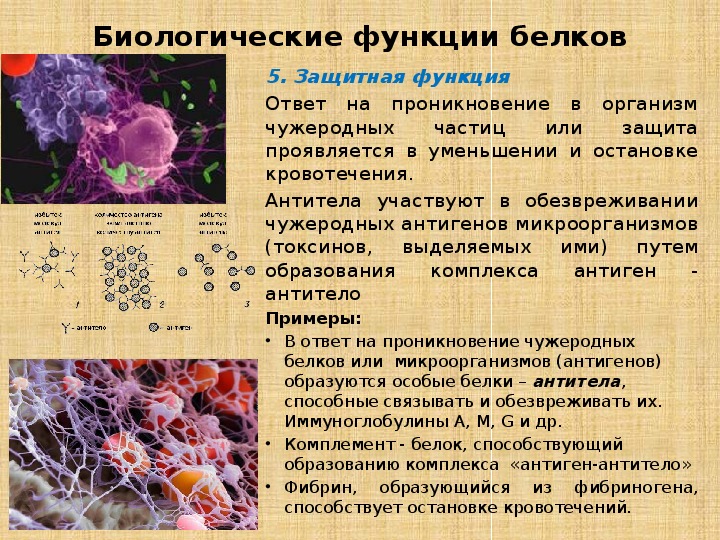 Компоненты принимают участие во всех жизненно важных процессах в организме, являются незаменимым строительным материалом, стимулируют выработку лимфоцитов, отвечающих за стойкость иммунной системы животного или человека.
Компоненты принимают участие во всех жизненно важных процессах в организме, являются незаменимым строительным материалом, стимулируют выработку лимфоцитов, отвечающих за стойкость иммунной системы животного или человека.
При отсутствии сложных белков невозможно образование гормонов, новых клеток и регенерация тканей. Без белковых молекул в организме не осуществляется процесс дыхания, поскольку невозможен перенос кислорода и выведение углекислого газа.
Особенно важное значение имеют белки для человека, поскольку некоторые виды помогают связывать и выводить из организма токсины, вредные соединения. Длительное отсутствие в питании белка приводит к постепенному истощению и смерти организма.
Интересные факты
Некоторые интересные факты о белковых соединениях доказывают важность их в живых организмах.
Наиболее интересными считаются следующие:
- Около 50 % от сухого веса организма приходится на белки.
- Вирусы почти полностью состоят из этого компонента, некоторые на 95 %.
- Более 30 % органических веществ у человека концентрируется в мышцах.
- Клетки головного мозга состоят преимущественно из белковых молекул.
- Волосы на теле и голове человека представлены ороговевшими клетками, состоящими из белковых молекул.
- Недостаток вещества в пище отрицательно отражается на всех процессах.
- В более чем 50 % случаев аллергия на белок у человека проявляется в детском возрасте.
- Человеку одинаково необходим растительный и животный белок.
- Детям белковые соединения необходимы в больших количествах, чем взрослым.
- Яичный белок считается наиболее качественным и легко усваивается.
Белки в организме — незаменимый и необходимый ежедневно компонент, позволяющий обеспечивать здоровье и правильное функционирование клеток.
Источник: https://obrazovanie.guru/nauka/biologiya/funktsii-belka.html
ФУНКЦИИ БЕЛКОВ. «БИОЛОГИЧЕСКАЯ ХИМИЯ», Березов Т.Т., Коровкин Б.
 Ф.
Ф.
Белки
выполняют множество самых разнообразных функций, характерных для живых
организмов, с некоторыми из которых мы познакомимся более подробно при
дальнейшем изучении курса. Ниже рассматриваются главные и в некотором смысле
уникальные биологические функции белков, несвойственные или лишь частично
присущие другим классам биополимеров.
Каталитическая функция. К 1995 г. было идентифицировано более 3400 ферментов.
Большинство известных в настоящее время ферментов, называемых
биологическими катализаторами, является белками. Эта функция белков, хотя и не
оказалась уникальной, определяет скорость химических реакций в биологических
системах.
Транспортная функция. Дыхательная функция крови, в частности перенос кислорода,
осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов
принимают участие альбумины сыворотки крови. Ряд других сывороточных белков
образует комплексы с жирами, медью, железом, тироксином, витамином А и другими
соединениями, обеспечивая их доставку в соответствующие органы-мишени.
Защитная функция. Основную функцию защиты в организме выполняет иммунная
система, которая обеспечивает синтез специфических защитных белков-антител в
ответ на поступление в организм бактерий, токсинов, вирусов или чужеродных
белков. Высокая специфичность взаимодействия антител с антигенами (чужеродными
веществами) по типу белок-белковое взаимодействие способствует узнаванию и нейтрализации
биологического действия антигенов. Защитная функция белков проявляется и в
способности ряда белков плазмы крови, в частности фибриногена, к свертыванию. В
результате свертывания фибриногена образуется сгусток крови, предохраняющий от
потери крови при ранениях.
Сократительная функция. В акте мышечного сокращения и расслабления участвует
множество белковых веществ. Однако главную роль в этих жизненно важных
Однако главную роль в этих жизненно важных
процессах играют актин и миозин – специфические белки мышечной ткани.
Сократительная функция присуща не только мышечным белкам, но и белкам
цитоскелета, что обеспечивает тончайшие процессы жизнедеятельности клеток
(расхождение хромосом в процессе митоза).
Структурная функция. Белки, выполняющие структурную (опорную) функцию, занимают
по количеству первое место среди других белков тела человека. Среди них
важнейшую роль играют фибриллярные белки, в частности коллаген в соединительной
ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др.
Большое значение имеют комплексы белков с углеводами в формировании ряда
секретов: мукоидов, муцина и т.д. В комплексе с липидами (в частности, с
фосфолипидами) белки участвуют в образовании биомембран клеток.
Гормональная функция. Обмен веществ в организме регулируется разнообразными
механизмами. В этой регуляции важное место занимают гормоны, синтезируемые не
только в железах внутренней секреции, но и во многих других клетках организма
(см. далее). Ряд гормонов представлен белками или полипептидами, например
гормоны гипофиза, поджелудочной железы и др. Некоторые гормоны являются
производными аминокислот.
Питательная (резервная) функция. Эту функцию выполняют так называемые резервные белки,
являющиеся источниками питания для плода, например белки яйца (овальбумины).
Основной белок молока (казеин) также выполняет главным образом питательную
функцию. Ряд других белков используется в организме в качестве источника
аминокислот, которые в свою очередь являются предшественниками биологически
активных веществ, регулирующих процессы метаболизма.
Можно назвать
еще некоторые другие жизненно важные функции белков. Это, в частности,
экспрессия генетической информации, генерирование и передача нервных импульсов,
способность поддерживать онкотическое давление в
клетках и крови, буферные свойства, поддерживающие физиологическое значение рН
внутренней среды, и др.
Таким
образом, из этого далеко не полного перечня основных функций белков видно, что
указанным биополимерам принадлежит исключительная и разносторонняя роль в живом
организме. Если попытаться выделить главное, решающее свойство, которое
обеспечивает многогранность биологических функций белков, то следовало бы
назвать способность белков строго избирательно, специфически соединяться с
широким кругом разнообразных веществ. В частности, эта высокая специфичность
белков (сродство) обеспечивает взаимодействие ферментов с субстратами, антител
с антигенами, транспортных белков крови с переносимыми молекулами других
веществ и т.д. Это взаимодействие основано на принципе биоспецифического
узнавания, завершающегося связыванием фермента с соответствующей молекулой
субстрата, что содействует протеканию химической реакции. Высокой
специфичностью действия наделены также белки, которые участвуют в таких
процессах, как дифференцировка и деление клеток, развитие живых организмов,
определяя их биологическую индивидуальность.
Предыдущая страница |
Следующая страница
СОДЕРЖАНИЕ
Какой белок крови выполняет защитную функцию в организме
Главная » Статьи » Какой белок крови выполняет защитную функцию в организме
Ответы@Mail.Ru: какие функции выполняют белки в организме человека?
Транспортные белки — белки, которые выполняют функцию транспорта специфически связывают и переносят те или другие молекулы и ионы через мембраны клеток ( как внутрь клетки, так и во вне) , а также от одного органа организма к другому. Гемоглобин, содержащийся в эритроцитах, при прохождении крови через легкие связывает кислород и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи — процесса в ходе которого производится энергия. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует типы транспортных белков, способных связывать глюкозу, аминокислоты и переносить их внутрь клеток. Пищевые и запасные белки — белки, которые выполняют функцию обеспечения питанием зародышей растений и животных на первых стадиях их развития. Сократительные и двигательные белки — белки, которые обеспечивают клетку или организм двигательной функцией, — способностью сокращаться, изменять форму и передвигаться. Структурные белки — белки образующие волокна, навитые друг на друга или уложенные плоским слоем, выполняют опорную или защитную функцию, скрепляют между собой биологические структуры организмов и придают им прочность. Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохраняют организм от потери крови при повреждении сосудистой системы.
В клеточных мембранах присутствует типы транспортных белков, способных связывать глюкозу, аминокислоты и переносить их внутрь клеток. Пищевые и запасные белки — белки, которые выполняют функцию обеспечения питанием зародышей растений и животных на первых стадиях их развития. Сократительные и двигательные белки — белки, которые обеспечивают клетку или организм двигательной функцией, — способностью сокращаться, изменять форму и передвигаться. Структурные белки — белки образующие волокна, навитые друг на друга или уложенные плоским слоем, выполняют опорную или защитную функцию, скрепляют между собой биологические структуры организмов и придают им прочность. Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохраняют организм от потери крови при повреждении сосудистой системы.
touch.otvet.mail.ru
Защитная функция белков плазмы.
БЕЛКИ ПЛАЗМЫ КРОВИ
(Лекция)
Из 9-10% сухого остатка плазмы крови на долю белков приходится 6,5-8,5%. Кроме того, вне сосудистого русла имеются белки, которые находятся в динамическом равновесии с внутрисосудистыми белками. Общее количество белков плазмы (вне- и внутрисосудистых) составляет примерно 350-400 г. Это количество невелико по сравнению с общим количеством белков в организме, однако их физиологическая роль огромна. Белки плазмы крови представляют собой огромное количество соединений, обладающих отличительными химическими свойствами и биологическими функциями и играют важную роль в белковом обмене организма. Высаливание нейтральными солями щелочных или щелочноземельных металлов, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген.
Физиологическая роль белков плазмы:
-
Поддержание коллоидно-осмотического (онкотического) давления и тем самым сохранение объема циркулирующей крови. Белки являясь коллоидами, связывают воду и удерживают ее, не позволяют выходить из кровеносного русла. В этом процессе особенно велика роль альбуминов.
-
Гемостатическая функция. Белки принимают активное участие в свертывании крови. Ряд белков плазмы, в том числе фибриноген, являются компонентами свертывающей системы крови.
-
Буферная функция. Белки поддерживают постоянное рН крови.
-
Транспортная функция. Белки плазмы крови соединяются с целым рядом нерастворимых веществ (липиды, билирубин, жирные кислоты, стероидные гормоны, жирорастворимые витамины, лекарственные вещества и т.д.) переносят их в ткани и органы.
-
Защитная функция. Белки плазмы крови играют важную роль в иммунных процессах организма. Сывороточные иммуноглобулины входят в состав фракции глобулинов сыворотки крови.
-
Поддержание постоянства концентрации катионов в крови путем образования с ними недиализируемых соединений. Например 40-50% кальция, значительная часть железа, магния, меди и других элементов связаны с белками сыворотки крови.
-
Резервная функция. Сывороточные белки образуют своеобразный «белковый резерв» организма. При голодании они могут распадаться до аминокислот, которые в последующем используются для синтеза белков головного мозга, миокарда и других органов.
Современные физико-химические методы исследования позволили открыть и описать около 200 различных белковых компонентов плазмы крови.
В сыворотки крови здорового человека при использовании различных методов выделения можно обнаружить от пяти (альбумины, α1-, α2-, β- и γ-глобулины) до 25 фракций белков.
Транспортная функция. Понятие транспорта включает в себя действие по перемещению с одного места на другое, предполагая наличие перевозчика, предмета перевозки и направление перемещения. Транспорт играет важную роль во многих физиологических и патологических процессах. Функции, направленные на поддержание гомеостаза по своей сути являются транспортными. Специализированной транспортной системой организма является сердечно сосудистая система, плазма крови, лимфа, интерстициальная жидкость. Переносчиками – белки плазмы, форменные элементы. Примером транспортных белков являются липопротеиды, трансферрин, церулоплазмин (Cu), гаптоглобин (свободный гемоглобин). В основе транспортной функции белков лежит их способность к обратимому связыванию различных биологически активных веществ.
Физиологическая роль транспорта:
-
Перенос липидов и других гидрофобных веществ.
-
Связывание белками веществ способствует удержанию последних в сосудах, а затем и в интерстиции. Связывая вещества с малой молекулярной массой белки препятствуют их проникновению через клеточную мембрану, почечный фильтр, гемато-энцефалический барьер и т.д.
-
При связывании с белками уменьшается токсичность вещества (инактивация лекарственных веществ, токсинов), снижается их биологическая активность (гормоны).
Недостаточность транспортной функции белков проявляется в том, что вещества, в норме переносимые белками плазмы, связываются с белками других тканей. При этом развивается симптомокомплекс, получивший название транспортной болезни. Клинические проявления определяются тем, в отношении какого вещества нарушена транспортная функция (признаки эндокринной патологии, отравление токсическими или лекарственными веществами).
Причины транспортных болезней:
-
Врожденный или приобретенный дефицит переносчиков: атрансферринемия, потеря белков при патологии почек, нарушение синтеза белков при заболеваниях печени, дефицит церулоплазмина при болезни Вильсона.
-
Патологическое увеличение поступления в кровоток веществ, подлежащих переносу, вследствие чего происходит перегрузка транспортной системы (развитие гемохроматоза при повышенном поступлении железа в организм).

-
Блокада утилизации транспортируемых веществ (замедление использования железа при нарушении синтеза гема).
-
Введение в кровоток веществ, способных вступать в конкурентные взаимоотношения с эндогенными веществами за места связывания (салицилаты, сульфаниламиды, некоторые антибиотики, сердечные гликозиды вытеяняют токсичный гембилирубин из связи с альбумином).
Лечение и профилактика транспортных болезней.
-
Щажение существующих переносчиков с целью избежания их перегрузки (диета у больных гепатитом, снижение количества назначаемых медикаментозных средств).
-
Введение натуральных или искусственных переносчиков (переливание крови, плазмы, производных декстрана и других кровезаменителей). В этом случае происходит связывание, перераспределение и снижение биологической активности веществ, а также облегчение их выведения из организма.
Белки, осуществляющие неспецифическую защиту.
Интерфероны – низкомолекулярные гликопротеиды с м.м. 20-30 тыс. Они синтезируются клетками всех позвоночных под действием естественных (вирусы, эндотоксины бактерий, внутриклеточные паразиты) и искусственных индукторов.
Эффекты интерферонов:
-
Интерфероны подавляют размножение большинства вирусов и ряда других микроорганизмов, которые являются их индукторами (антивирусное действие). При действии интерферонов вирусы или не образуются или их число снижается в сотни раз.
-
Интерфероны оказывают антипролиферативное действие – угнетают размножение нормальных и опухолевых клеток.
-
Интерфероны являются белками-иммуномодуляторами, т.е. участвуют в регуляции иммунитета (активируют макрофаги, усиливают активность лимфоцитов-киллеров, увеличивают продукцию антител).
-
На уровне изменения активности ферментов интерфероны могут изменять экспрессию клеточных генов.
Таким образом, интерфероны представляют собой сформировавшуюся в процессе эволюции систему, физиологическая роль которой – основной координатор роста и функции клеток организма, а также ведущее звено защиты организма от вирусов и любых объектов с антигенными свойствами, в т. ч. и опухолевые клетки.
ч. и опухолевые клетки.
В настоящее время выделено несколько типов интерферонов:
-
Лейкоцитарный α-интерферон (имеет около 12 подтипов),
-
Фибробластический β-интерферон,
-
Иммунный γ-интерферон (синтезируемый Т-лимфоцитами).
Механизм действия интерферонов на клетку.
Рецептор для интерферона находится на внешней клеточной мембране. Связывание интерферона с рецептором приводит к следующим изменениям внутриклеточного обмена:
-
Происходит де репрессия группы генов 21 хромосомы, в результате в клетки образуется 12 новых белков.
-
Наибольшее значение имеют синтез ряда новых белков-ферментов. В числе этих белков – олигоаденилатсинтетаза, которая превращает АТФ в 2,5-олигоаденилат (ОА). ОА активирует эндонуклеазы (РНКазы), которые разрушают матричную РНК, что приводит к ингибированию синтеза белка на уровне трансляции. Кроме того, ОА активирует синтез самого интерферона.
-
Активируется цАМФ-независимая протеинкиназа. Она фосфорилирует фактор инициации трансляции на рибосомах, тем самым инактивирует его. В результате ингибируется трансляция и снижается синтез белка.
Таким образом, в результате вмешательства интерферонов в процессы синтезы различных белков, тормозится размножение вирусов и некоторых собственных клеточных белков. Эти эффекты и лежат в основе антивирусного и антипролиферативного действия интерферонов.
Препараты интерфероны используются в клинической практике при лечении различных вирусных заболеваний: грипп, ОРЗ, герпес, ветряная оспа, вирусный гепатит, вирусные энцефаломиелиты. Они применяются и в комплексном лечении онкологических больных (рак молочной железы, матки, почек, меланома, лейкозы).
Фибронектины.
Фибронектины – высокомолекулярные гликопротеиды. В организме обнаружены две формы этих белков: растворимые фибронектины, находящиеся в биологических жидкостях, и нерастворимые фибронектины, локализующиеся в клеточных мембранах фибробластов и некоторых других клеток, в межклеточном матриксе. Белок обладает высоким сродством к коллагену и другим компонентам внеклеточного матрикса и выполняет роль универсального межклеточного клея. Кроме того, у фибронектина есть участки, ответственные за склеивание с желатином, гепарином, фибрином и фибриногеном и другими макромолекулами. Фибронектины склеивают все грамм-положительные и некоторые грамм-отрицательные микроорганизмы. При этом облегчается захват их макрофагами.
Белок обладает высоким сродством к коллагену и другим компонентам внеклеточного матрикса и выполняет роль универсального межклеточного клея. Кроме того, у фибронектина есть участки, ответственные за склеивание с желатином, гепарином, фибрином и фибриногеном и другими макромолекулами. Фибронектины склеивают все грамм-положительные и некоторые грамм-отрицательные микроорганизмы. При этом облегчается захват их макрофагами.
При дефиците фибронектинов снижается устойчивость организма к инфекции. Наследственный дефицит этого белка дети болеют тяжелее, часто в этом случае происходит хронизация процесса. Снижение фибронектинов наблюдается при ожоговой болезни, радиационном поражении, так как в этих случаях образуется большое количество денатурированных белков и других продуктов, сопровождающих повреждение тканей. При этом увеличивается вероятность развития септических осложнений.
studfiles.net
Белки крови выполняют серьезные задачи
Многообразие белков крови приводит к тому, что они обладают многочисленными функциями:
- поддерживают постоянство коллоидно-осмотического давления крови – в первую очередь, альбумины,;
- участвуют в поддержании кислотно-основного состояния – альбумины, гемоглобин,
- удерживают в связанном состоянии и транспортируют ионы кальция, магния, железа, меди и другие ионы, препятствуя их потере с мочой – альбумины и специфические транспортные белки,
- связывают и транспортируют органические вещества (углеводы, липиды, гормоны, лекарства, витамины, токсины) – альбумины и другие белки,
- определяют вязкость крови и сохраняют устойчивость эритроцитов и лейкоцитов в кровотоке, обеспечивают нормальный кровоток в капиллярах (реологические свойства крови) – белки свертывающей системы,
- специализированные белки, участвующие в свертывании крови (фибриноген, протромбин, антигемофильный глобулин и др.),
- обеспечивают иммунную защиту организма – иммуноглобулины, факторы системы комплемента, трансферрин и пропердин,
- обеспечивают неспецифическую защиту организма при повреждении тканей – белки острой фазы.

biokhimija.ru
Функции белка плазмы крови
Благодаря крови осуществляется поступление важных веществ к внутренним органам и тканям. Ее доля в человеческом организме занимает второе место после мышечной ткани. Кровь в свою очередь состоит из жидкой среды – плазмы и находящихся в ней форменных веществ. В состав плазмы входят органические (небелковые и белковые) и минеральные соединения. Белки занимают около 7% объема плазмы крови и выполняют несколько важных функций для организма.
Значение белка
Общий белок – это показатель обменного процесса аминокислот в организме, характеризующий уровень концентрации белковых молекул и фракций в плазме. Значение показателя белкового метаболизма отражает способность организма к восстановлению. В состав плазмы крови входит более 100 видов белков. Синтез в большей степени осуществляется клетками печени (гепатоцитами). Важность белков обусловлена выполнением следующих функций:
- обеспечивают онкотическое давление, за счет которого вода удерживается в русле крови.
- Принимают участие в свертываемости крови.
- Поддерживают кислотно-щелочной баланс крови, так как создают белковый буфер.
- Обеспечивают транспортную функцию. Образуют соединение с некоторыми веществами (холестерин, билирубин и другие), составляющими медикаментозных препаратов и доставляют их к органам и тканям.
- Выполняют иммунную функцию организма.
- Создают резервный запас аминокислот.
- Обеспечивают определенную вязкость и текучесть крови.
- Принимают участие в реакциях организма на воспалительные процессы.
Уровень белка в крови определяют при биохимическом анализе крови, которое имеет важное диагностическое значение при многих патологических нарушениях. Одного лишь определения уровня белка недостаточно для того, чтобы точно поставить диагноз, поэтому при отклонении содержания от нормы производят биохимический анализ фракций белка и прочие дополнительные обследования. Также немаловажным при диагностике является исследование небелковых компонентов крови.
Также немаловажным при диагностике является исследование небелковых компонентов крови.
Фракции белков и их функции
Белки плазмы крови по своему составу делятся на простые и сложные. К простым относятся альбумины, а к сложным липопротеины, гликопротеины (подавляющее число белков плазмы) и металлопротеины (трансферин, церрулоплазмин). Белки плазмы крови представляют собой комплекс белков различных структур и функций. Выделение фракций из белков осуществляют с применением электрического тока — электрофорезом.
Разделить белки данным способом можно на большое количество фракций, но основными из них являются:
- альбумины — основная составляющая белков плазмы, синтезируемый клетками печени. Обновляется альбумин очень стремительно. За одни сутки происходит синтез и распад 10-16 грамм белков данной фракции. Альбумин осуществляет несколько функций для организма. Поддерживает онкотическое давление, создает резервный запас аминокислот, переносит вещества к органам и тканям, в особенности нерастворимые в воде.
- а1-глобулины. Фракция включает в себя нерастворимые белки с высокой гидрофильностью и низкой молекулярной массой. При нарушении функционирования почек быстро выводятся из организма вместе с мочой, не оказывая при этом значительного влияния на онкотическое давление. Выполняют транспортировку липидов, активно участвуют в свертываемости крови, угнетают некоторые ферменты, оказывающие негативное воздействие на организм.
- а2-глобулины, синтезируемые в печени в объеме 75%, являются высокомолекулярными белками. В состав фракции входят регуляторные белки: а2-макроглобулин — участвует в инфекционных и воспалительных реакциях; гаптоглобин — создает специфическое соединение с гемоглобином, препятствует выведению железа; церулоплазмин — обеспечивает постоянное содержание меди в тканях.
- b-глобулины, 50% синтеза осуществляется клетками печени. В фракцию b-глобулинов входят некоторые белки, обеспечивающие свертываемость крови. Большую часть состава фракции занимают: липопротеины низкой плотности; трансферрин — транспортирует железо; составляющие комплемента участвуют в реакции иммунной системы; бета-липопротеиды — переносят холестерин и фосфолипиды.

- g-глобулины, синтез осуществляется В-лимфоцитами. В состав фракции входят белки-антитела (иммуноглобулины) и некоторые элементы системы комплемента. Иммуноглобулины выполняют защитную функцию организма от инфицирования и внешних возбудителей.
Глобулины являются нерастворимыми компонентами плазмы и растворяются в слабоконцентрированных солевых растворах. Нарушение соотношения фракций белков определяется при многих патологических реакциях путем проведения биохимии крови. При анализе показателей в динамике и в совокупности с изменением небелковых соединений можно с высокой точностью определить длительность заболевания и эффективность проводимой терапии.
Причины изменения белковых фракций
Отклонение значений каждой из фракций свидетельствует о наличии нарушений в организме, вызванных реакцией на воспалительные процессы или инфицирование. Например, повышение а1-глобулинов происходит в результате реакции организма на воспалительные процессы в хронической стадии, травмы и операции, опухолевые поражения, нарушении функционирования печени, третий триместр беременности. Рост значения компонентов а2-глобулинов происходит при воспалительных процессах, ожоговых поражениях, нефротическом синдроме, диффузных патологиях соединительной ткани.
Повышенное значение компонентов фракции b-глобулинов происходит при гиперлипопротеинемии, миеломной болезни (вызвана синтезом патологических белков), дефиците железа, беременности, желтухе, нефротическом синдроме. Причинами роста g-глобулинов могут быть: хронические нарушения в работе печени, инфицирование, ревматизм, красная волчанка.
Кроме патологических процессов, повышение значений могут вызвать компоненты некоторых лекарственных препаратов.
Снижение альбуминов происходит при: нарушении питания, патологиях печени (снижается синтез альбуминов), опухолевых поражениях, коллагенозах, ожогах, гипергидрации, обильных кровотечениях, беременности, воспалительных процессах в тяжелой стадии течения. Снижение синтеза глобулинов происходит при иммунодефиците, беременности, панкреатите, дефиците иммуноглобулина IgA, реакции на терапию глюкокортикоидами, саркоидозе.
Снижение синтеза глобулинов происходит при иммунодефиците, беременности, панкреатите, дефиците иммуноглобулина IgA, реакции на терапию глюкокортикоидами, саркоидозе.
Белки плазмы крови выполняют важные для организма человека функции. Благодаря им осуществляется поступление важных веществ к клеткам и органам, обеспечивается свертываемость крови и другие. Колебание их уровня происходит в результате реакции организма на воздействие возбудителей, инфекций, воспалительные нарушения. Исследование общего белка и его фракций проводят при биохимическом анализе крови, имеющем важное значение при диагностике многих заболеваний.
okrovi.ru
какие функции в организме выполняют белки? — Школьные Знания.com
Транспортные белки — белки, которые выполняют функцию транспорта специфически связывают и переносят те или другие молекулы и ионы через мембраны клеток ( как внутрь клетки, так и во вне) , а также от одного органа организма к другому. Гемоглобин, содержащийся в эритроцитах, при прохождении крови через легкие связывает кислород и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи — процесса в ходе которого производится энергия. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует типы транспортных белков, способных связывать глюкозу, аминокислоты и переносить их внутрь клеток. Пищевые и запасные белки — белки, которые выполняют функцию обеспечения питанием зародышей растений и животных на первых стадиях их развития. Сократительные и двигательные белки — белки, которые обеспечивают клетку или организм двигательной функцией, — способностью сокращаться, изменять форму и передвигаться. Структурные белки — белки образующие волокна, навитые друг на друга или уложенные плоским слоем, выполняют опорную или защитную функцию, скрепляют между собой биологические структуры организмов и придают им прочность. Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохрняют организм от потери крови при повреждении сосудистой системы.
Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохрняют организм от потери крови при повреждении сосудистой системы.
5.0
znanija.com
какие функции в организме человека животных растений выполняют белки — Школьные Знания.com
Транспортные белки — белки, которые выполняют функцию транспорта специфически связывают и переносят те или другие молекулы и ионы через мембраны клеток ( как внутрь клетки, так и во вне) , а также от одного органа организма к другому. Гемоглобин, содержащийся в эритроцитах, при прохождении крови через легкие связывает кислород и доставляет его к периферическим тканям, где кислород высвобождается и используется для окисления компонентов пищи — процесса в ходе которого производится энергия. Плазма крови содержит липопротеины, осуществляющие перенос липидов из печени в другие органы. В клеточных мембранах присутствует типы транспортных белков, способных связывать глюкозу, аминокислоты и переносить их внутрь клеток. Пищевые и запасные белки — белки, которые выполняют функцию обеспечения питанием зародышей растений и животных на первых стадиях их развития. Сократительные и двигательные белки — белки, которые обеспечивают клетку или организм двигательной функцией, — способностью сокращаться, изменять форму и передвигаться. Структурные белки — белки образующие волокна, навитые друг на друга или уложенные плоским слоем, выполняют опорную или защитную функцию, скрепляют между собой биологические структуры организмов и придают им прочность.
Защитные белки выполняют функцию защиты организма от вторжения других организмов или предохранения его от повреждений. Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохрняют организм от потери крови при повреждении сосудистой системы.
Эту функцию выполняют иммуноглобулины ( или антитела ), образующиеся у позвоночных, обладающие способностью распознавать чужеродные клетки ,- проникшие в организм бактерии или вирусы или клетки самого организма, переродившиеся в раковые, — а также чужеродные для организма белки, и прочно связываться с ними. Аналогичная защитная функция у фибриногена и тромбина — белков, участвующих в процессе свертывания крови; они предохрняют организм от потери крови при повреждении сосудистой системы.
5.0
znanija.com
Какие функции белка
Белки – это высокомолекулярные органические соединения. Они построены из атомов углерода, кислорода, водорода и азота, но в них могут входить также сера, железо и фосфор.Мономерами белков являются аминокислоты, соединенные между собой пептидными связями. Полипептиды могут иметь большое число аминокислот в своем составе и иметь большую молекулярную массу.
Молекула аминокислоты состоит из радикала, аминогруппы –Nh4 и карбоксильной группы –COOH. Первая группа проявляет основные свойства, вторая – кислотные. Это обусловливает двойственный характер химического поведения аминокислоты – ее амфотерность и, кроме того, высокую реактивность. Разными концами аминокислоты объединяются в цепи белковых молекул.
Радикал (R) – это та часть молекулы, которая различается у разных аминокислот. Она может иметь ту же молекулярную формулу, но другое строение.Белки выполняют ряд важнейших функций как в отдельных клетках, так и во всем организме в целом.Прежде всего, белки выполняют структурную функцию. Из этих молекул строятся мембраны и органоиды клетки. Коллаген – важный компонент соединительной ткани, кератин входит в состав волос и ногтей (а также перьев и рогов у животных), эластичный белок эластин нужен для связок и стенок кровеносных сосудов.
Не менее важна и ферментативная роль белков. К слову, все биологические ферменты имеют белковую природу. Благодаря им возможно протекание биохимических реакций в организме в приемлемых для жизни темпах.
Молекулы ферментов могут состоять только из белков или включать в себя и небелковое соединение – кофермент. В качестве коферментов чаще всего выступают витамины или ионы металлов.
Транспортная функция белков осуществляется благодаря их возможности соединяться с другими веществами. Так, гемоглобин соединяется с кислородом и доставляет его от легких к тканям, миоглобин транспортирует кислород к мышцам. Сывороточный альбумин крови переносит липиды, жирные кислоты и другие биологически активные вещества.
Белки-переносчики действуют в районе клеточных мембран и осуществляют транспорт веществ через них.
Защитную для организма функцию выполняют специфические белки. Вырабатываемые лимфоцитами антитела борются с чужеродными белками, интерфероны защищают от вирусов. Тромбин и фибриноген способствуют образованию тромба и предохраняют организм от потери крови.
Токсины, выделяемые живыми существами в защитных целях, также имеют белковую природу. В организмах-мишенях для подавления действия этих ядов вырабатываются антитоксины.Регуляторная функция осуществляется регуляторными белками – гормонами. Они контролируют протекание физиологических процессов в организме. Так, за уровень глюкозы в крови отвечает инсулин, и при его нехватке возникает сахарный диабет.
Белки иногда выполняют и энергетическую функцию, но не являются основными энергоносителями. Полное расщепление 1 грамма белка дает 17,6 кДж энергии (как и при распаде глюкозы). Однако белковые соединения слишком важны организму для построения новых структур, и в качестве источника энергии используются крайне редко.
Видео по теме
www.kakprosto.ru
Обмен белков в организме — анализы на белки, симптомы, лечение
directions
Белки являются одними из сложнейших веществ организма и служат основой протоплазмы клеток. В их состав помимо углерода, кислорода, водорода и азота входят и аминокислоты. Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Последние дают основу для построения молекул белков. Они играют огромную роль в человеческом организме и отвечают за важнейшие функции: дыхание, выделения, пищеварение, движение, защитную, обеспечивают организм необходимой энергией и восполняют компоненты клетки. Нарушение обмена белка развивается в том случае, если в организм поступает его большее либо меньшее количество. На этой почве могут возникать различные опасные заболевания, поэтому при малейшем подозрении необходимо своевременно сделать все тесты.
Врачи-специалисты
Старшая медицинская сестра
Медицинская сестра
Медицинская сестра эндоскопического кабинета
Врач-терапевт
Медицинская сестра процедурной
Анализ на коронавирус методом ПЦР. Результат в течение 3-х дней
Результат в течение 3-х дней
Наши клиники в Санкт-Петербурге
Медицентр Юго-Запад
Пр.Маршала Жукова 28к2
Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону
+7 (812) 640-55-25
Анализы на белки
Альбумин является основным белком плазмы крови. Его синтез происходит в печени. Главная задача, которую выполняет альбумин, заключается в поддержании давления плазмы относительно объёма крови. Вместе с этим он осуществляет доставку различных веществ и их депонирование. Его сниженный уровень говорит о протекании в организме патологических процессов.
Белковые фракции – комплексный анализ, позволяющий оценить наличие в плазме крови альбумина и глобулинов. Исследование назначается при патологии почек и печени, онкологических и системных заболеваниях, нарушениях питания, а так же хронических и острых воспалительных заболеваниях.
Креатинин представляет собой конечный продукт обмена белков. Принимает участие в энергетическом обмене тканей. Из организма выводится вместе с мочой, поэтому по анализу можно судить о состоянии почек. Высокий уровень указывает на наличие почечной недостаточности, обезвоживании организма, мясной диете.
Мочевая кислота занимается выведение азота из организма. Нарушение её обмена напрямую связано со сбоем в работе почек.
Мочевина вырабатывается в печени. Во время её синтеза обезвреживается аммиак. Анализ мочевины в крови может выявить наличие множество опасных заболеваний, требующих срочного лечения, таких как: злокачественные опухоли, заболевания почек, ожоги, лейкоз, почечная недостаточность, цирроз, гепатит, печёночная недостаточность.
Общий белок – органический полимер, который состоит из аминокислот. Его определение в плазме крови позволяет судить о заболеваниях почек, печени, нарушении питания и онкологических заболеваниях.
Тимоловая проба позволяет дать характеристику работе печени. Повышение результатов исследования возникает в случаях, когда у человека: гепатит А, малярия, токсический гепатит, вирусные инфекции, цирроз печени.
Во время беременности очень часто встречается отличное от нормы значение анализов на белки в организме.
Какие симптомы нарушения обмена белков?
Различают несколько видов нарушения содержания белков в плазме крови: гиперпротеинемия означает увеличение его количества, а гипопротеинемия – уменьшение. Повышенное содержание белка может быть как наследственным, так и приобретённым заболеванием. При нарушении в обмене нуклеиновых кислот возникает подагра.
Симптомы нарушений обмена белка:
- Избыточное потребление белка может проявляться в виде:
- запора либо поноса;
- отвращения к еде;
- повышенного содержания белков в плазме крови;
- дисбактериоза кишечника;
- Низкое потребление белка может проявляться в виде двух различных заболеваний:
- Квашиоркор – это несбалансированный алиментарный недостаток белка в человеческом организме.
 К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами.
К симптомам заболевания можно отнести: отёки, вялость, апатию, низкую массу тела, асцит, задержку развития, иммунодефицит, пониженное содержание белков в крови. Прогноз при возникновении этого заболевания неблагоприятный и очень часто больные умирают. Чаще всего развивается у детей от 1го до 4-х лет. Болезнь возникает из-за дефицита одного либо нескольких питательных веществ. Ещё больше может усугубить положение контакт с инфекцией (например, ВИЧ) или отравление токсинами. - Алиментарная дистрофия – сбалансированная недостаточность. Симптомы возникновения заболевания: отёки, содержание белка в крови на нижней границе, низкая масса тела, иммунодефицит, повышенное содержание кетоновых тел. Для алиментарной дистрофии нехарактерна задержка физического и умственного развития. В отличие от квашиоркора при дистрофии прогноз для заболевших наиболее благоприятный, однако так же встречаются случаи со смертельным исходом. Наблюдается у детей в возрасте до одного года.
- Для несбалансированного питания, при котором происходит дефицит незаменимых аминокислот, характерна: низкая масса тела, нарушение развития и роста, плохой аппетит. В случае недостаточного содержания в организме какой-либо аминокислоты симптомы могут носить специфический характер, влияющий на различные органы и провоцирующий появление заболеваний.
- Избыточное содержание аминокислот так же плохо влияет на организм. Оно проявляется в виде снижения аппетита и массы тела, нарушения вкусовых рецепторов, а так же питания тканей и органов.
Как лечится нарушение обмена белков?
После точной постановки диагноза лечение назначается специалистом для каждого пациента индивидуально. В случае алиментарной дистрофии в первые дни необходимо соблюдать абсолютный покой. Не должно возникать психических и физических нагрузок. Питание при этом должно быть полноценным, богатым витаминами и белками. Вместе с тем расширение рациона происходит постепенно, чтобы организм смог адаптироваться к новому режиму приёма пищи. Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
Вводятся белковые препараты и назначаются анаболические стероидные гормоны. При подагрическом артрите применяются противовоспалительные препараты.
948,1295,832,1352,1306,1328
Тома
01.04.2021
18:01
medi-center.ru
Саранчин Александр, лор и Пискунова Мария, терапевт замечательные внимательные врачи, спасибо за осмотр и лечение!
Смерткин Алексей Сергеевич
11.02.2021
19:40
medi-center.ru
Хочу выразить благодарность врачу Саранчину Александру за качественный осмотр и рекомендации в лечении. Успехов Вам, Александр и профессионально развития.
Алферов Петр Леонидович
28.12.2020
20:17
medi-center.ru
Большое спасибо врачу терапевту Дерешовскому Александру Сергеевичу за профессиональное исполнение своей работы, за терпение и человечность. Благодарю сотрудников колцентра клиники и мед брата, который собирает мазки для анализа на корону. Все перечисленные сотрудники оперативно и профессионально помогали побороть вирус. Здоровья Вам и терпения. Молодцы!
Мансуров А.А.
09.12.2020
18:03
medi-center.ru
Хочу отметить профессиональную работу Кулиева Марата Ахматовича, все рекомендации были доступно и качественно разъяснены. Спасибо большое!
Спасибо большое!
Груздев Алексей Анатольевич
09.08.2020
16:34
medi-center.ru
Прошел эндоскопическое обследование у группы врачей в составе: Мордвинцевой Анны Ахатовны, Суйдюмова Тимура Руслановича, Локотковой Александры Владимировны. Отношение к пациенту внимательное, ответственное. Работу выполняют профессионально, уверенно, без суеты. Спасибо!
Хочу выразить большую благодарность клинике на аллее Поликарпова 6к2, всегда вежливые, доброжелательные девушки на ресепшн. Помогли удобно состыковать время приёма врачей. А также отдельно поблагодарить замечательнейшего доктора Гиндрюк Василия Васильевича за профессионализм, заботу и внимание! Наблюдаться у него одно удовольствие!!!
Клеточная мембрана
Клеточная мембрана также называется плазматической (или цитоплазматической) мембраной и плазмалеммой. Данная структура не только отделяет внутреннее содержимое клетки от внешней среды, но также входит с состав большинства клеточных органелл и ядра, в свою очередь отделяя их от гиалоплазмы (цитозоля) — вязко-жидкой части цитоплазмы. Договоримся называть цитоплазматической мембраной ту, которая отделяет содержимое клетки от внешней среды. Остальными терминами обозначать все мембраны.
Строение клеточной мембраны
В основе строения клеточной (биологической) мембраны лежит двойной слой липидов (жиров). Формирование такого слоя связано с особенностями их молекул. Липиды не растворяются в воде, а по-своему в ней конденсируются. Одна часть отдельно взятой молекулы липида представляет собой полярную головку (она притягивается водой, т. е. гидрофильна), а другая — пару длинных неполярных хвостов (эта часть молекулы отталкивается от воды, т. е. гидрофобна). Такое строение молекул заставляет их «прятать» хвосты от воды и поворачивать к воде свои полярные головки.
е. гидрофобна). Такое строение молекул заставляет их «прятать» хвосты от воды и поворачивать к воде свои полярные головки.
В результате образуется двойной липидный слой, в котором неполярные хвосты находятся внутри (обращены друг к другу), а полярные головки обращены наружу (к внешней среде и цитоплазме). Поверхность такой мембраны гидрофильна, а внутри она гидрофобна.
В клеточных мембранах среди липидов преобладают фосфолипиды (относятся к сложным липидам). Их головки содержат остаток фосфорной кислоты. Кроме фосфолипидов есть гликолипиды (липиды + углеводы) и холестерол (относится к стеролам). Последний придает мембране жесткость, размещаясь в ее толще между хвостами остальных липидов (холестерол полностью гидрофобный).
За счет электростатического взаимодействия, к заряженным головкам липидов присоединяются некоторые молекулы белков, которые становятся поверхностными мембранными белками. Другие белки взаимодействуют с неполярными хвостами, частично погружаются в двойной слой или пронизывают его насквозь.
Таким образом, клеточная мембрана состоит из двойного слоя липидов, поверхностных (периферических), погруженных (полуинтегральных) и пронизывающих (интегральных) белков. Кроме того, некоторые белки и липиды с внешней стороны мембраны связаны с углеводными цепями.
Это жидкостно-мозаичная модель строения мембраны была выдвинута в 70-х годах XX века. До этого предполагалась бутербродная модель строения, согласно которой липидный бислой находится внутри, а с внутренней и наружной стороны мембрана покрыта сплошными слоями поверхностных белков. Однако накопление экспериментальных данных опровергло эту гипотезу.
Толщина мембран у разных клеток составляет около 8 нм. Мембраны (даже разные стороны одной) отличаются между собой по процентному соотношению различных видов липидов, белков, ферментативной активности и др. Какие-то мембраны более жидкие и более проницаемые, другие более плотные.
Разрывы клеточной мембраны легко сливаются из-за физико-химических особенностей липидного бислоя. В плоскости мембраны липиды и белки (если только они не закреплены цитоскелетом) перемещаются.
В плоскости мембраны липиды и белки (если только они не закреплены цитоскелетом) перемещаются.
Функции клеточной мембраны
Большинство погруженных в клеточную мембрану белков выполняют ферментативную функцию (являются ферментами). Часто (особенно в мембранах органоидов клетки) ферменты располагаются в определенной последовательности так, что продукты реакции, катализируемые одним ферментом, переходят ко второму, затем третьему и т. д. Образуется конвейер, который стабилизируют поверхностные белки, т. к. не дают ферментам плавать вдоль липидного бислоя.
Клеточная мембрана выполняет отграничивающую (барьерную) от окружающей среды и в то же время транспортную функции. Можно сказать, это ее самое главное назначение. Цитоплазматическая мембрана, обладая прочностью и избирательной проницаемостью, поддерживает постоянство внутреннего состава клетки (ее гомеостаз и целостность).
При этом транспорт веществ происходит различными способами. Транспорт по градиенту концентрации предполагает передвижение веществ из области с их большей концентрацией в область с меньшей (диффузия). Так, например, диффундируют газы (CO2, O2).
Бывает также транспорт против градиента концентрации, но с затратой энергии.
Транспорт бывает пассивным и облегченным (когда ему помогает какой-нибудь переносчик). Пассивная диффузия через клеточную мембрану возможна для жирорастворимых веществ.
Есть особые белки, делающие мембраны проницаемыми для сахаров и других водорастворимых веществ. Такие переносчики соединяются с транспортируемыми молекулами и протаскивают их через мембрану. Так переносится глюкоза внутрь эритроцитов.
Пронизывающие белки, объединяясь, могут образовывать пору для перемещения некоторых веществ через мембрану. Такие переносчики не перемещаются, а образуют в мембране канал и работают аналогично ферментам, связывая определенное вещество. Перенос осуществляется благодаря изменению конформации белка, благодаря чему в мембране образуются каналы. Пример — натрий-калиевый насос.
Пример — натрий-калиевый насос.
Транспортная функция клеточной мембраны эукариот также реализуется за счет эндоцитоза (и экзоцитоза). Благодаря этим механизмам в клетку (и из нее) попадают крупные молекулы биополимеров, даже целые клетки. Эндо- и экзоцитоз характерны не для всех клеток эукариот (у прокариот его вообще нет). Так эндоцитоз наблюдается у простейших и низших беспозвоночны; у млекопитающих лейкоциты и макрофаги поглощают вредные вещества и бактерии, т. е. эндоцитоз выполняет защитную функцию для организма.
Эндоцитоз делится на фагоцитоз (цитоплазма обволакивает крупные частицы) и пиноцитоз (захват капелек жидкости с растворенными в ней веществами). Механизм этих процессов приблизительно одинаков. Поглощаемые вещества на поверхности клеток окружаются мембраной. Образуется пузырек (фагоцитарный или пиноцитарный), который затем перемещается внутрь клетки.
Экзоцитоз — это выведение цитоплазматической мембраной веществ из клетки (гормонов, полисахаридов, белков, жиров и др.). Данные вещества заключаются в мембранные пузырьки, которые подходят к клеточной мембране. Обе мембраны сливаются и содержимое оказывается за пределами клетки.
Цитоплазматическая мембрана выполняет рецепторную функцию. Для этого на ее внешней стороне располагаются структуры, способные распознавать химический или физический раздражитель. Часть пронизывающих плазмалемму белков с наружней стороны соединены с полисахаридными цепочками (образуя гликопротеиды). Это своеобразные молекулярные рецепторы, улавливающие гормоны. Когда конкретный гормон связывается со своим рецептором, то изменяет его структуру. Это в свою очередь запускает механизм клеточного ответа. При этом могут открываться каналы, и в клетку могут начать поступать определенные вещества или выводиться из нее.
Рецепторная функция клеточных мембран хорошо изучена на основе действия гормона инсулина. При связывании инсулина с его рецептором-гликопротеидом происходит активация каталитической внутриклеточной части этого белка (фермента аденилатциклазы). Фермент синтезирует из АТФ циклическую АМФ. Уже она активирует или подавляет различные ферменты клеточного метаболизма.
Фермент синтезирует из АТФ циклическую АМФ. Уже она активирует или подавляет различные ферменты клеточного метаболизма.
Рецепторная функция цитоплазматической мембраны также включает распознавание соседних однотипных клеток. Такие клетки прикрепляются друг к другу различными межклеточными контактами.
В тканях с помощью межклеточных контактов клетки могут обмениваться между собой информацией с помощью специально синтезируемых низкомолекулярных веществ. Одним из примеров подобного взаимодействия является контактное торможение, когда клетки прекращают рост, получив информацию, что свободное пространство занято.
Межклеточные контакты бывают простыми (мембраны разных клеток прилегают друг к другу), замковыми (впячивания мембраны одной клетки в другую), десмосомы (когда мембраны соединены пучками поперечных волокон, проникающих в цитоплазму). Кроме того, есть вариант межклеточных контактов за счет медиаторов (посредников) — синапсы. В них сигнал передается не только химическим, но и электрическим способом. Синапсами передаются сигналы между нервными клетками, а также от нервных к мышечным.
Источник:
http://biology.su/cytology/cell-membrane
Что такое клеточная мембрана
Клеточная стенка, если таковая у клетки имеется (обычно есть у растительных клеток), покрывает клеточную мембрану.
Клеточная мембрана представляет собой двойной слой (бислой) молекул класса липидов, большинство из которых представляет собой так называемые сложные липиды — фосфолипиды. Молекулы липидов имеют гидрофильную («головка») и гидрофобную («хвост») часть. При образовании мембран гидрофобные участки молекул оказываются обращены внутрь, а гидрофильные — наружу. Мембраны — структуры инвариабельные, весьма сходные у разных организмов. Некоторое исключение составляют, пожалуй, археи, у которых мембраны образованы глицерином и терпеноидными спиртами. Толщина мембраны составляет 7—8 нм.
Биологическая мембрана включает и различные белки: интегральные (пронизывающие мембрану насквозь), полуинтегральные (погруженные одним концом во внешний или внутренний липидный слой), поверхностные (расположенные на внешней или прилегающие к внутренней сторонам мембраны). Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Некоторые белки являются точками контакта клеточной мембраны с цитоскелетом внутри клетки, и клеточной стенкой (если она есть) снаружи. Некоторые из интегральных белков выполняют функцию ионных каналов, различных транспортеров и рецепторов.
Функции
- барьерная — обеспечивает регулируемый, избирательный, пассивный и активный обмен веществ с окружающей средой. Например, мембрана пероксисом защищает цитоплазму от опасных для клетки пероксидов. Избирательная проницаемость означает, что проницаемость мембраны для различных атомов или молекул зависит от их размеров, электрического заряда и химических свойств. Избирательная проницаемость обеспечивает отделение клетки и клеточных компартментов от окружающей среды и снабжение их необходимыми веществами.
- транспортная — через мембрану происходит транспорт веществ в клетку и из клетки. Транспорт через мембраны обеспечивает: доставку питательных веществ, удаление конечных продуктов обмена, секрецию различных веществ, создание ионных градиентов, поддержание в клетке оптимального pH и концентрации ионов, которые нужны для работы клеточных ферментов.
Частицы, по какой-либо причине неспособные пересечь фосфолипидный бислой (например, из-за гидрофильных свойств, так как мембрана внутри гидрофобна и не пропускает гидрофильные вещества, или из-за крупных размеров), но необходимые для клетки, могут проникнуть сквозь мембрану через специальные белки-переносчики (транспортеры) и белки-каналы или путем эндоцитоза.
При пассивном транспорте вещества пересекают липидный бислой без затрат энергии по градиенту концентрации путем диффузии. Вариантом этого механизма является облегчённая диффузия, при которой веществу помогает пройти через мембрану какая-либо специфическая молекула. У этой молекулы может быть канал, пропускающий вещества только одного типа.
Активный транспорт требует затрат энергии, так как происходит против градиента концентрации. На мембране существуют специальные белки-насосы, в том числе АТФаза, которая активно вкачивает в клетку ионы калия (K+) и выкачивают из неё ионы натрия (Na+).
- матричная — обеспечивает определенное взаиморасположение и ориентацию мембранных белков, их оптимальное взаимодействие.
- механическая — обеспечивает автономность клетки, ее внутриклеточных структур, также соединение с другими клетками (в тканях). Большую роль в обеспечение механической функции имеют клеточные стенки, а у животных — межклеточное вещество.
- энергетическая — при фотосинтезе в хлоропластах и клеточном дыхании в митохондриях в их мембранах действуют системы переноса энергии, в которых также участвуют белки;
- рецепторная — некоторые белки, находящиеся в мембране, являются рецепторами (молекулами, при помощи которых клетка воспринимает те или иные сигналы).
Например, гормоны, циркулирующие в крови, действуют только на такие клетки-мишени, у которых есть соответствующие этим гормонам рецепторы. Нейромедиаторы (химические вещества, обеспечивающие проведение нервных импульсов) тоже связываются с особыми рецепторными белками клеток-мишеней. - ферментативная — мембранные белки нередко являются ферментами. Например, плазматические мембраны эпителиальных клеток кишечника содержат пищеварительные ферменты.
- осуществление генерации и проведения биопотенциалов.
С помощью мембраны в клетке поддерживается постоянная концентрация ионов: концентрация иона К+ внутри клетки значительно выше, чем снаружи, а концентрация Na+ значительно ниже, что очень важно, так как это обеспечивает поддержание разности потенциалов на мембране и генерацию нервного импульса. - маркировка клетки — на мембране есть антигены, действующие как маркеры — «ярлыки», позволяющие опознать клетку. Это гликопротеины (то есть белки с присоединенными к ним разветвленными олигосахаридными боковыми цепями), играющие роль «антенн». Из-за бесчисленного множества конфигурации боковых цепей возможно сделать для каждого типа клеток свой особый маркер. С помощью маркеров клетки могут распознавать другие клетки и действовать согласованно с ними, например, при формировании органов и тканей.
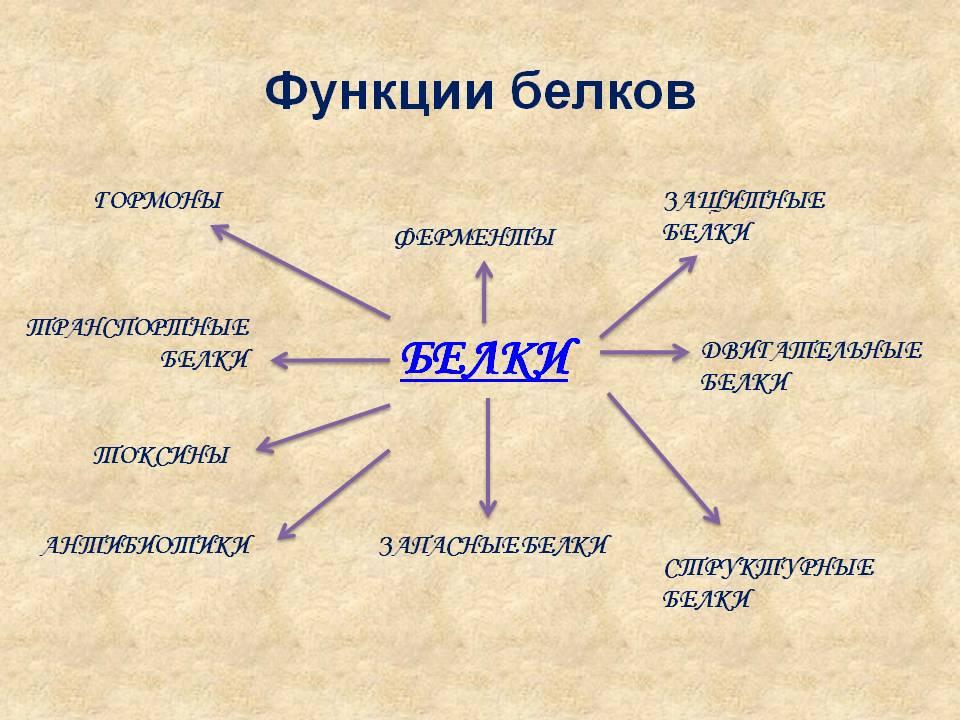 Это же позволяет иммунной системе распознавать чужеродные антигены.
Это же позволяет иммунной системе распознавать чужеродные антигены.
Структура и состав биомембран
Мембраны состоят из липидов трёх классов: фосфолипиды, гликолипиды и холестерол. Фосфолипиды и гликолипиды (липиды с присоединёнными к ним углеводами) состоят из двух длинных гидрофобных углеводородных «хвостов», которые связаны с заряженной гидрофильной «головой». Холестерол придаёт мембране жёсткость, занимая свободное пространство между гидрофобными хвостами липидов и не позволяя им изгибаться. Поэтому мембраны с малым содержанием холестерола более гибкие, а с большим — более жёсткие и хрупкие. Также холестерол служит «стопором», препятствующим перемещению полярных молекул из клетки и в клетку. Важную часть мембраны составляют белки, пронизывающие её и отвечающие за разнообразные свойства мембран. Их состав и ориентация в разных мембранах различаются.
Клеточные мембраны часто асимметричны, то есть слои отличаются по составу липидов, переход отдельной молекулы из одного слоя в другой (так называемый флип-флоп) затруднён.
Мембранные органеллы
Это замкнутые одиночные или связанные друг с другом участки цитоплазмы, отделённые от гиалоплазмы мембранами. К одномембранным органеллам относятся эндоплазматическая сеть, аппарат Гольджи, лизосомы, вакуоли, пероксисомы; к двумембранным — ядро, митохондрии, пластиды. Строение мембран различных органелл отличается по составу липидов и мембранных белков.
Избирательная проницаемость
Клеточные мембраны обладают избирательной проницаемостью: через них медленно диффундируют глюкоза, аминокислоты, жирные кислоты, глицерол и ионы, причем сами мембраны в известной мере активно регулируют этот процесс — одни вещества пропускают, а другие нет. Существует четыре основных механизма для поступления веществ в клетку или вывода их из клетки наружу: диффузия, осмос, активный транспорт и экзо- или эндоцитоз. Два первых процесса носят пассивный характер, то есть не требуют затрат энергии; два последних — активные процессы, связанные с потреблением энергии.
Избирательная проницаемость мембраны при пассивном транспорте обусловлена специальными каналами — интегральными белками. Они пронизывают мембрану насквозь, образовывая своего рода проход. Для элементов K, Na и Cl есть свои каналы. Относительно градиента концентрации молекулы этих элементов движутся в клетку и из неё. При раздражении каналы натриевых ионов раскрываются, и происходит резкое поступление в клетку ионов натрия. При этом происходит дисбаланс мембранного потенциала. После чего мембранный потенциал восстанавливается. Каналы калия всегда открыты, через них в клетку медленно попадают ионы калия.
Источник:
http://dic.academic.ru/dic.nsf/ruwiki/970083
Клеточная мембрана. Функции клеточной мембраны. Строение клеточной мембраны.
Содержание статьи
Клеточная мембрана
Клеточная мембрана или цитолемма или плазмалемма или плазматическая мембрана – эластическая молекулярная структура. Её толщина составляет от 6 до 10 нм. Рассматривая строение клеточной мембраны, можно сказать, что она состоит из белков (около 40%) и липидов (около 60%).
Функции клеточной мембраны
По функциональным особенностям клеточную мембрану можно разделить на 9 выполняемых ей функций.
Функции клеточной мембраны:
1. Транспортная. Производит транспорт веществ из клетки в клетку;
2. Барьерная. Обладает избирательной проницаемостью, обеспечивает необходимый обмен веществ;
3. Рецепторная. Некоторые белки находящиеся в мембране являются рецепторами;
4. Механическая. Обеспечивает автономность клетки и её механических структур;
5. Матричная. Обеспечивает оптимальное взаимодействие и ориентацию матричных белков;
6. Энергетическая. В мембранах действуют системы переноса энергии при клеточном дыхании в митохондриях;
7. Ферментативная. Мембранные белки иногда являются ферментами. Например мембраны клеток кишечника;
8. Маркировочная. На мембране есть антигены (гликопротеины), которые позволяют опознать клетку;
9. Генерирующая. Осуществляет генерацию и проведение биопотенциалов.
Генерирующая. Осуществляет генерацию и проведение биопотенциалов.
Посмотреть как выглядит клеточная мембрана можно на примере строения животной клетки или растительной клетки.
Cтроение клеточной мембраны
На рисунке приведено строение клеточной мембраны.
К компонентам клеточной мембраны можно отнести различные белки клеточной мембраны (глобулярный, переферический, поверхностный), а также липиды клеточной мембраны (гликолипид, фосфолипид). Таже в строении клеточной мембраны присутствуют углеводы, холестерол, гликопротеин и белковая альфа спираль.
Состав клеточной мембраны
К основному составу клеточной мембраны относятся:
1. Белки – отвечающие за разнообразные свойства мембраны;
2. Липиды трёх видов (фосфолипиды, гликолипиды и холестерол) отвечающих за жёсткость мембраны.
Белки клеточной мембраны:
1. Глобулярный белок;
2. Поверхностный белок;
3. Переферический белок.
Основное назначение клеточной мембраны
Основное назначение клеточной мембраны:
1. Регулировать обмен между клеткой и средой;
2. Отделять содержимое любой клетки от внешней среды тем самым обеспечивая её целостность;
3. Внутриклеточные мембраны разделяют клетку на специализированные замкнутые отсеки – органеллы или компартменты, в которых поддерживаются определённые условия среды.
Структура клеточной мембраны
Структура клеточной мембраны представляют собой двумерный раствор глобулярных интегральных белков, растворенных в жидком фосфолипидном матриксе. Данная модель мембранной структуры была предложена двумя учёными Никольсоном и Сингером в 1972 году. Таким образом, основу мембран составляет бимолекулярный липидный слой, с упорядоченным расположением молекул, что вы могли видеть на этом рисунке.
Источник:
http://www.new-era.me/articles/kletochnaya-membrana-funkcii-stroenie.php
Мембрана строение функция
Мембрана строение функция
Основная структурная единица живого организма — клетка, являющаяся дифференцированным участком цитоплазмы, окружённым клеточной мембраной. Ввиду того что клетка выполняет множество важнейших функций, таких, как размножение, питание, движение, оболочка должна быть пластичной и плотной.
Ввиду того что клетка выполняет множество важнейших функций, таких, как размножение, питание, движение, оболочка должна быть пластичной и плотной.
История открытия и исследования клеточной мембраны
В 1925 году Гренделем и Гордером был поставлен успешный эксперимент по выявлению «теней|теней» эритроцитов, или пустых оболочек. Несмотря на несколько допущенных грубых ошибок, учёными было произведено открытие липидного бислоя. Их труды продолжили Даниэлли, Доусон в 1935 году, Робертсон в 1960 году. В результате многолетней работы и накопления аргументов в 1972 году Сингер и Николсон создали жидкостно-мозаичную модель строения мембраны. Дальнейшие опыты и исследования подтвердили труды учёных.
Что же представляет собой клеточная мембрана? Это слово стало использоваться более ста лет назад, в переводе с латинского оно означает «плёнка», «кожица». Так обозначают границу клетки, являющуюся естественным барьером между внутренним содержимым и внешней средой. Строение клеточной мембраны предполагает полупроницаемость, благодаря которой влага и питательные вещества и продукты распада свободно могут проходить сквозь неё. Эту оболочку можно назвать основной структурной составляющей организации клетки.
Рассмотрим основные функции клеточной мембраны
1. Разделяет внутреннее содержимое клетки и компоненты внешней среды|среды.
2. Способствует поддержанию постоянного химического состава клетки.
3. Регулирует правильный обмен веществ.
4. Обеспечивает взаимосвязь между клетками.
5. Распознает|Распознаёт сигналы.
6. Функция защиты.
Наружная клеточная мембрана, называемая также плазменной, представляет собой ультрамикроскопическую плёнку, толщина которой составляет от пяти до семи наномиллиметров. Она состоит преимущественно из белковых соединений, фосфолидов, воды|воды. Плёнка является эластичной, легко впитывает воду, а также стремительно восстанавливает свою целостность после повреждений.
Отличается универсальным строением. Эта мембрана занимает пограничное положение, участвует в процессе избирательной проницаемости, выведении продуктов распада, синтезирует их. Взаимосвязь с «соседями» и надёжная защита внутреннего содержимого от повреждения делает её важной составляющей в таком вопросе, как строение клетки. Клеточная мембрана животных организмов иногда оказывается покрытой тончайшим слоем – гликокаликсом, в состав которого входят белки|белки и полисахариды. Растительные клетки снаружи от мембраны защищены клеточной стенкой, выполняющей функции опоры и поддержания формы. Основной компонент её состава – это клетчатка (целлюлоза) – полисахарид, не растворимый в воде.
Эта мембрана занимает пограничное положение, участвует в процессе избирательной проницаемости, выведении продуктов распада, синтезирует их. Взаимосвязь с «соседями» и надёжная защита внутреннего содержимого от повреждения делает её важной составляющей в таком вопросе, как строение клетки. Клеточная мембрана животных организмов иногда оказывается покрытой тончайшим слоем – гликокаликсом, в состав которого входят белки|белки и полисахариды. Растительные клетки снаружи от мембраны защищены клеточной стенкой, выполняющей функции опоры и поддержания формы. Основной компонент её состава – это клетчатка (целлюлоза) – полисахарид, не растворимый в воде.
Таким образом, наружная клеточная мембрана выполняет функцию восстановления, защиты и взаимодействия с другими клетками.
Строение клеточной мембраны
Толщина этой подвижной|подвижной оболочки варьируется в пределах от шести до десяти наномиллиметров. Клеточная мембрана клетки имеет особый состав, основой которого служит липидный бислой. Гидрофобные хвосты, инертные к воде, размещены с внутренней стороны|стороны, в то время как гидрофильные головки, взаимодействующие с водой, обращены наружу. Каждый липид представляет фосфолипид, который является результатом взаимодействия таких веществ, как глицерин и сфингозин. Липидный каркас тесно окружают белки|белки, которые расположены несплошным слоем. Некоторые из них погружены в липидный слой, остальные проходят сквозь него. В результате этого образуются проницаемые для воды|воды участки. Выполняемые этими белками|белками функции различны. Некоторые из них являются ферментами, остальные — транспортными белками|белками, которые переносят различные вещества из внешней среды|среды на цитоплазму и обратно.
Клеточная мембрана насквозь пронизана и тесно связана интегральными белками|белками, а с переферическими связь менее прочная. Эти белки|белки выполняют важную функцию, которая заключается в поддержании структуры мембраны, получении и преобразовании сигналов из окружающей среды|среды, транспорте веществ, катализации реакций, которые происходят на мембранах.
Состав
Основу клеточной мембраны представляет бимолекулярный слой. Благодаря его непрерывности клетка имеет барьерное и механическое свойства. На разных этапах жизнедеятельности данный бислой может нарушиться. Вследствие этого образуются структурные дефекты сквозных гидрофильных пор. В таком случае могут изменяться абсолютно всё|все функции такой составляющей, как клеточная мембрана. Ядро при этом может пострадать от внешних воздействий.
Свойства
Клеточная мембрана клетки имеет интересные особенности. Благодаря текучести эта оболочка не является жёсткой структурой, а основная часть белков и липидов, которые входят в её состав, свободно перемещается на плоскости мембраны.
В целом клеточная мембрана асимметрична, поэтому состав белковых и липидных слоёв различается. Плазматические мамбраны в животных клетках со своей наружной стороны|стороны имеют гликопротеиновый слой, который выполняет рецепторные и сигнальные функции, а также играет большую|большую роль в процессе объединения клеток в ткань. Клеточная мембрана является полярной, то есть на внешней стороне заряд положителен, а с внутренней стороны|стороны – отрицателен. Помимо всего перечисленного, оболочка клетки обладает избирательной проницательностью. Это означает, что кроме воды|воды в клетку пропускается только определённая группа молекул и ионов растворившихся веществ. Концентрация такого вещества, как натрий, в большинстве клеток значительно ниже, чем во внешней среде. Для ионов калия характерно другое соотношение: их количество в клетке намного выше, чем в окружающей среде. В связи с этим ионам натрия присуще стремление проникнуть в клеточную оболочку, а ионы калия стремятся освободиться наружу. При данных обстоятельствах мембрана активизирует особую систему, выполняющую «насосную» роль, выравнивая концентрацию веществ: ионы натрия откачиваются на поверхность клетки, а ионы калия накачиваются внутрь. Данная особенность входит в важнейшие функции клеточной мембраны.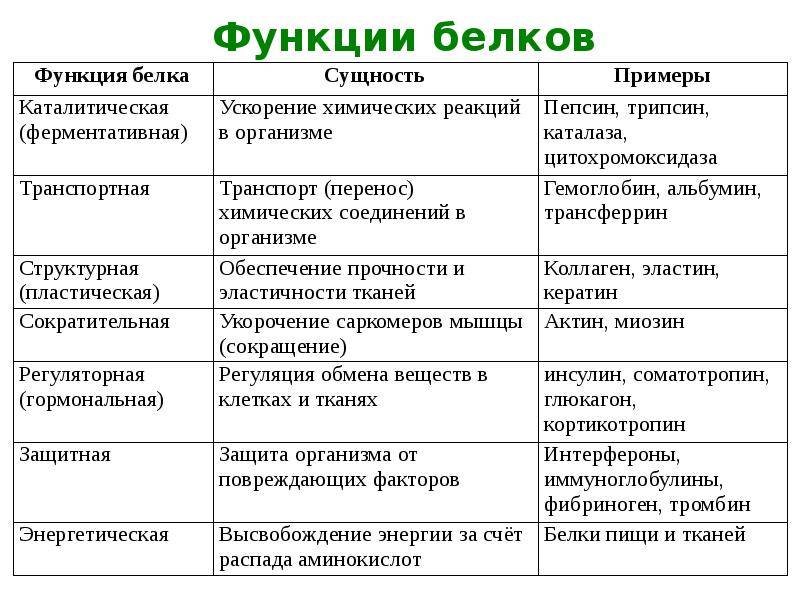
Подобное стремление ионов натрия и калия переместиться внутрь с поверхности играет большую|большую роль в вопросе транспортировки сахара|сахара|сахара и аминокислот в клетку. В процессе активного удаления ионов натрия из клетки мембрана создаёт условия для новых поступлений глюкозы и аминокислот внутрь. Напротив, в процессе переноса ионов калия внутрь клетки пополняется число «транспортировщиков» продуктов распада изнутри клетки во внешнюю среду|среду.
Как происходит питание клетки через клеточную мембрану?
Многие клетки поглощают вещества посредством таких процессов, как фагоцитоз и пиноцитоз. При первом варианте гибкой наружной мембраной создаётся маленькое углубление, в котором оказывается захватываемая частица. Затем диаметр углубления становится больше, пока окружённая частица не попадёт в клеточную цитоплазму. Посредством фагоцитоза подпитываются некоторые простейшие, например амёбы, а также кровяные тельца|тельца — лейкоциты и фагоциты. Аналогичным образом клетки поглощают жидкость, которая содержит необходимые полезные вещества. Такое являние носит название пиноцитоз.
Наружная мембрана тесно соединена с эндоплазматической сетью клетки.
У многих типов основных составляющих ткани на поверхности мембраны расположены выступы, складки, микроворсинки. Растительные клетки снаружи этой оболочки покрыты ещё одной, толстой и отчётливо различимой в микроскоп. Клетчатка, из которой они состоят, помогает формировать опору тканям растительного происхождения, например, древесину. Клетки животных также обладают рядом внешних структур, которые находятся поверх клеточной мембраны. Они носят исключительно защитный характер, пример тому – хитин, содержащийся в покровных клетках насекомых.
Помимо клеточной, существует внутриклеточная мембрана. Её функция заключается в разделении клетки на несколько специализированных замкнутых отсеков – компартментов или органелл, где должна поддерживаться определённая среда.
Таким образом, невозможно переоценить роль такой составляющей основной единицы живого организма, как клеточная мембрана. Строение и функции предполагают значительное расширение общей площади поверхности клетки, улучшение обменных процессов. В состав этой молекулярной структуры входят белки|белки и липиды. Отделяя клетку от внешней среды|среды, мембрана обеспечивает её целостность. С её помощью межклеточные связи поддерживаются на достаточно крепком уровне, образовывая ткани. В связи с этим можно сделать вывод, что одну из важнейших ролей|ролей в клетке играет клеточная мембрана. Строение и функции, выполняемые ею, радикально отличаются в различных клетках, в зависимости от их предназначения. Посредством этих особенностей достигается разнообразие физиологической активности клеточных оболочек и их ролей|ролей в существовании клеток и тканей.
Строение и функции предполагают значительное расширение общей площади поверхности клетки, улучшение обменных процессов. В состав этой молекулярной структуры входят белки|белки и липиды. Отделяя клетку от внешней среды|среды, мембрана обеспечивает её целостность. С её помощью межклеточные связи поддерживаются на достаточно крепком уровне, образовывая ткани. В связи с этим можно сделать вывод, что одну из важнейших ролей|ролей в клетке играет клеточная мембрана. Строение и функции, выполняемые ею, радикально отличаются в различных клетках, в зависимости от их предназначения. Посредством этих особенностей достигается разнообразие физиологической активности клеточных оболочек и их ролей|ролей в существовании клеток и тканей.
Мембрана строение функция
Природа создала множество организмов и клеток, но, несмотря на это, строение и большая|большая часть функций биологических мембран одинаковы, что позволяет рассматривать их структуру и изучать их ключевые свойства без привязанности к конкретному виду клеток.
Что такое мембрана?
Мембраны – это защитный элемент, который является неотъемлемой составляющей клетки любого живого организма.
Структурной и функциональной единицей всех живых организмов на планете является клетка. Жизнедеятельность её неразрывно связана с окружающей средой, с которой она обменивается энергией, информацией, веществом. Так, питательная энергия, необходимая для функционирования клетки, поступает извне и тратится на осуществление ею различных функций.
Структура простейшей единицы строения живого организма: мембрана клетки, ядро, органеллы, разнообразные включения. Она окружена мембраной, внутри которой располагается ядро и всё|все органеллы. Это митохондрии, лизосомы, рибосомы, аппарат Гольджи, эндоплазматический ретикулум. Каждый структурный элемент имеет свою мембрану.
Роль в жизнедеятельности клетки
Биологическая мембрана играет кульминационную роль в строении и функционировании элементарной живой системы. Только клетка, окружённая защитной оболочкой, по праву может называться организмом. Такой процесс, как обмен веществ, также осуществляется благодаря наличию мембраны. Если структурная целостность её нарушена, это приводит к изменению функционального состояния организма в целом.
Только клетка, окружённая защитной оболочкой, по праву может называться организмом. Такой процесс, как обмен веществ, также осуществляется благодаря наличию мембраны. Если структурная целостность её нарушена, это приводит к изменению функционального состояния организма в целом.
Клеточная мембрана и её функции
Она отделяет цитоплазму клетки от внешней среды|среды или от оболочки. Мембрана клетки обеспечивает должное выполнение специфических функций, специфику межклеточных контактов и иммунных проявлений, поддерживает трансмембранную разницу электрического потенциала. В ней имеются рецепторы, способные воспринимать химические сигналы – гормоны, медиаторы и другие биологические активные компоненты. Эти рецепторы наделяют её ещё одной способностью – изменять метаболическую активность клетки.
1. Активный перенос веществ.
2. Пассивный перенос веществ:
2.1. Диффузия простая.
2.2. Перенос через поры|поры.
2.3. Транспорт, осуществляемый за счёт диффузии переносчика вместе с мембранным веществом или посредством передачи по эстафете вещества по молекулярной цепи переносчика.
3. Перенос неэлектролитов благодаря простой и облегчённой диффузии.
4. Активный транспорт ионов.
Строение мембраны клетки
Составляющие мембраны клетки – липиды и белки|белки.
Липиды: фосфолипиды, фосфатидилэтаноламин, сфингомиелин, фосфатидилинозит и фосфатидилсерин, гликолипиды. Доля липидов составляет 40-90 %.
Белки|Белки: периферические, интегральные (гликопротеины), спектрин, актин, цитоскелет.
Основной структурный элемент – двойной слой фосфолипидных молекул.
Кровельная мембрана: определение и типология
Немного статистики. На территории Российской Федерации мембрана в качестве кровельного материала используется не так уж и давно. Удельный вес мембранных кровель из общего числа|числа мягких перекрытий крыш составляет всего 1,5 %. Более широкое распространение в России получили битумные и мастичные кровли. А вот в Западной Европе на долю мембранных кровель приходится 87 %. Разница ощутимая.
Как правило, мембрана в роли основного материала при перекрытии крыши идеально подходит для плоских кровель. Для имеющих большой уклон она подходит в меньшей степени.
Объёмы производства и реализации мембранных кровель на отечественном рынке имеют положительную тенденцию роста|роста. Почему? Причины более чем ясны:
- Срок эксплуатации составляет около 60 лет. Представьте себе, только гарантийный срок использования, который устанавливается производителем, достигает 20 лет.
- Лёгкость в монтаже. Для сравнения: установка битумной кровли занимает в 1,5 раза больше времени, нежели монтаж мембранного перекрытия.
- Простота в обслуживании и проведении ремонтных работ.
Толщина кровельных мембран может составлять 0,8-2 мм, а средний показатель веса|веса одного метра квадратного равен 1,3 кг.
Свойства кровельных мембран:
Мембрана кровельная бывает трёх типов. Главный классификационный признак – вид полимерного материала, составляющего основание полотна|полотна. Итак, кровельные мембраны бывают:
Мембрана профилированная: характеристика, функции и преимущества
Профилированные мембраны – это инновация на строительном рынке. Такая мембрана эксплуатируется в качестве гидроизоляционного материала.
Вещество, используемое при изготовлении, – полиэтилен. Последний бывает двух типов: полиэтилен высокого давления (ПВД) и полиэтилен низкого давления (ПНД).
Техническая характеристика мембраны из ПВД и ПНД
Источник:
http://biologyinfo.ru/page/membrana-stroenie-funkcija/
СПАДИЛО.РУ
теория по биологии цитология
Теория для подготовки к блоку «Цитология»
Клеточная мембрана
Мембрана клетки = цитоплазматическая мембрана = плазматическая мембрана = плазмалемма
Образована двумя слоями фосфолипидов, которые имеют гидрофильные головки и гидрофобные хвосты. Головки расположены в сторону жидких сред: цитоплазма и внеклеточное вещество/ вещество окружающей среды, а хвосты – друг к другу. Так клеточная мембрана является достаточно плотной структурой, но в то же время пластичной и подвижной. Билипидный слой не дает содержимому клетки растекаться, а также препятствует проникновению внутрь клетки веществ, способных нанести ей вред.
Строение клеточной мембраны
Мембрана клеток частично проницаема. Это значит, что любое вещество не может в нее проникнуть, однако и закрытой ее назвать нельзя. Так как существуют константы гомеостаза (гомеостаз – постоянство внутренней среды), определяющие содержание веществ внутри клетки, то клетка выводит ненужные ей вещества и пропускает нужные. Для этого в клетках есть разные приспособления:
Белки-рецепторы для того, чтобы узнавать молекулы веществ, приближающихся к клетке.
Белки, образующие «тоннели» в клеточной мембране для пассивного тока воды и некоторых неорганических ионов.
Клеточная мембрана помимо выборочной проницаемости обладает свойством текучести. Для захвата пищевых частиц мембрана клетки впячивается, края этого участка мембраны как бы обнимают пищу. Потом края замыкаются и пища в пищевом пузырьке, который называется фагосомой, направляется в пищеварительную вакуоль, где специальные белки-ферменты расщепят пищу. Процесс захвата клеткой твердой пищи называется фагоцитозом. Если же клетка поглощает капельку, то процесс называется пиноцитозом, а пузырек, в котором капля транспортируется в вакуоль – везикулой. Когда клетка заканчивает свои пищеварительные процессы, то ей, как и многоклеточному сложному организму, нужно вывести наружу непереваренные остатки. Тогда происходит экзоцитоз (приставка «экзо-» означает наружу), процесс обратный фагоцитозу.
Мембрана клетки не представляет их себя непрерывную цепь липидов, она имеет включения в виде белков разных конфигураций. Они могут быть на поверхности мембраны, проходить сквозь нее, образовывать каналы, находиться в наружном или внутреннем слое липидов.
Во-первых, это отличительная черта эукариотических организмов. Ядро управляет процессами внутри клетки, а также хранит генетическую информацию, которая передается по наследству.
Мембрана ядра состоит из двух оболочек, пронизанных ядерными порами. Внешняя оболочка ядра шероховатая, она связана с эндоплазматической сетью клетки.
Строение ядра. * Ядерный сок = кариоплазма.
Через поры тРНК и иРНК выходят в цитоплазму клетки. Тем временем, пока клетка не делится, в ядре располагаются деспирализованные молекулы ДНК, или же хроматин. Хроматином называются молекулы ДНК, которые связаны с белками. В профазе митоза и в профазе первого деления мейоза хроматин спирализуется, то есть наматывается на специальные гистоновые белки как проволока на карандаш. В таком виде ДНК становится компактной. В интерфазе можно увидеть огромные политенные хромосомы. Они настолько большие, что их прекрасно можно рассмотреть и в обычный световой микроскоп, однако образуются такие хромосомы далеко не во всех клетках. 1 хромосома образована 1 молекулой ДНК. Хромосомы могут быть однохроматидными и двухроматидными. Как раз-таки двухроматидными, состоящими из 2х сестринских хроматид, хромосомы становятся после процесса репликации. В центре такие хромосомы соединены особой перетяжкой – центромерой. Каждая хроматида имеет по два плеча, они могут быть разной длины, а могут быть одинаковой. На концах хроматид располагаются теломеры. Интересный факт: старением организма связано с укорачиванием теломер с течением жизни.
Строение двухроматидной хромосомы
Внутрь клетки проникают неорганические ионы, АТФ, белки и ферменты и т.д. В ядре есть жидкая составляющая, как в клетке, кариоплазма. А в кариоплазме – ядрышки, в которых происходит синтез частей рибосом. В цитоплазме формируются целые рибосомы. В одном ядре могут находиться от 1 до 7 ядрышек, образованных близкими по отношению друг к другу петлями ДНК.
Обычно в клетках располагается одно ядро, но бывают и исключения: эритроциты в ходе созревания утрачивают свое ядро, а клетки мышечной ткани – миоциты, наоборот имеют много ядер.
Источник:
http://spadilo.ru/kletochnaya-membrana-i-yadro/
Одна из важнейших функций, которую выполняют белки в организме, — защитная. Иммунной защите отводится особая роль.
Ядро иммунной системы составляют три типа белков: иммуноглобулины (антитела), интерфероны и белки главного комплекса гистосовместимости. Они являются главными участниками формирования иммунного ответа — способности организма адекватно реагировать на чужеродную информацию и противостоять воздействию патогенов. Ежедневное удовлетворение потребности в белке принципиально важно для иммунной защиты.
Влияет ли белковый дефицит на течение болезни и процесс выздоровления? Что такое аминокислотный скор и какова его роль в удовлетворении потребности в белке? Мы узнали мнения экспертов.
Стабильность — залог успеха
Недостаточное потребление белка и, как следствие, формирование его дефицита в организме нарушает работу всех органов и систем, включая ослабление защитной функции. Основные факторы защиты организма — иммуноглобулины и система комплемента, равно как и фундамент клеток-защитников (лимфоцитов) — все это белковые структуры. Соответственно, без удовлетворения потребности в белке иммунная система адекватно работать не сможет. Все иммунодефициты различной степени выраженности так или иначе сопровождаются нарушениями белкового обмена. Даже легкие формы белковой недостаточности, которые не имеют клинических проявлений и протекают бессимптомно, оказывают негативное влияние на формирование иммунного ответа организма на атаку патогенов, воздействие повреждающих и стрессовых факторов.
Синтез и распад белков в организме — процесс непрерывный. Важность сохранения его стабильности, в том числе для обеспечения иммунной защиты, обусловлена тем, что белок не депонируется в организме, то есть не накапливается для дальнейшего рационального использования. Это особенно актуально для детского возраста, когда все процессы в организме проходят наиболее интенсивно. А вместе с тем на фоне высоких потребностей в макро- и микронутриентах и энергии у детей имеются ограниченные резервы и тенденция к быстрому их истощению. Не допустить дефицит белка важно как для гармоничного роста и развития, так и для формирования крепкого иммунитета.
Еда, которая лечит
Наверное, ни одной семьи, которая бы в отношении своего болеющего родственника сказала: давайте будем кормить его меньше и реже. Один из известнейших ученых в области нутрициологии Бертольд Колецко показал, что даже незначительное повышение температуры тела до субфебрильных цифр повышает потребности в белке на 150–180 % от базовой. При обострении хронической патологии — на 200–250 %, при травме — на 300 %. Вместе с тем есть данные, что почти каждый второй пациент с респираторными заболеваниями страдает от нутритивной недостаточности.
В этом контексте не обеспечивать больному питание, богатое содержанием белка, значит попросту не долечивать его, убеждена Елена Полевиченко. Адекватный состоянию болеющего человека рацион в этом случае расценивается не как удовлетворение его базовых потребностей, а как один из факторов комплексной терапии, повышения иммунных и адаптационных сил организма. Научно доказано, что ежедневное употребление высокобелковой пищи во время болезни и лечения снижает вероятность осложнений, уменьшает побочные эффекты применяемых лекарственных средств и ускоряет процесс выздоровления.
Белок белку рознь
Чтобы обеспечить стабильный биосинтез белка, а значит и адекватную работу иммунной системы, необходимо постоянно пополнять фонд аминокислот в организме. Именно они выступают главным структурным компонентом белков и влияют на их функциональное предназначение. Источником аминокислот служат пищевые продукты.
Белки животного и растительного происхождения усваиваются организмом по-разному. Так, усвояемость молока, молочных продуктов, яиц составляет 96 %. Мяса, рыбы — 93–95 %. А вот белки, содержащиеся в хлебе, организм усваивает лишь на 62–86 %, в картофеле — на 70 %, что определяется сбалансированностью аминокислотного состава. Качество белка определяется таким понятием, как аминокислотный скор, то есть сбалансированным наличием всех незаменимых аминокислот в продукте. Эталоном аминокислотного скора принято считать эталонный белок, разработанный экспертами ФАО/ВОЗ, а также белок грудного молока и куриного яйца. Близкими к нему — животные белки из мяса, птицы, молока. Эти же продукты выступают источником витаминов D, А, витаминов группы В, кальция, фосфора и т. д.
Сочетание в рационе продуктов растительного и животного происхождения для укрепления иммунитета может расцениваться как биологически более полноценное из-за взаимного обогащения одних белков аминокислотами других. При этом суточная потребность в белке должна восполнять как общий расход белка, так и потребность в незаменимых аминокислотах. Разбалансировка аминокислотного состава чревата нарушением азотистого баланса (количество потребляемых белков должно быть адекватно продуктам их распада, которые выделяются из организма), что в свою очередь ведет к ослаблению иммунной защиты.
Более того, положительный азотистый баланс (превышение потребления белковых продуктов над потерями) необходимо обеспечить в периоды интенсивного роста и развития (в детском и подростковом возрасте), повышенных нагрузок на органы и системы (беременность, лактация), во время болезни и восстановления.
Таким образом наряду с привычной пищей, богатой белком (мясо, птица, молоко), более чем оправданно включение в рацион кисломолочных напитков, которые содержат до 30 г белка на 250 мл продукта, обогащены лактобактериями, витаминами D и В6. В основе напитков — сывороточные белки, которые имеют оптимальный аминокислотный состав и усваиваются практически полностью. При отсутствии аппетита, затрудненном глотании они, по сути, могут выступать основным источником белка, необходимого организму для повышения иммунных сил.
Следуя принципам превентивной медицины, ежедневное (а не только в период болезни) включение в рацион высокобелковых продуктов может служить средством обеспечения эффективной работы иммунной системы и повышения резервных и адаптивных возможностей организма перед воздействием патогенов и внешних негативных факторов
Заместитель главного врача по медицинской части
Харитонюк В.Н.
Белок с защитными свойствами против клеточных защитных реакций у насекомых
Реферат
Молекулярный механизм того, как насекомые распознают вторгшиеся микроорганизмы и паразитов и отличают их от структур собственного тела, не очень хорошо известен. Мы исследовали эволюционные адаптации во взаимодействии насекомых-паразитоидов-хозяев, чтобы идентифицировать компоненты, которые мешают распознаванию посторонних объектов и клеточной инкапсуляции. Поскольку некоторые паразитоиды обеспечивают защиту развивающейся осы в отсутствие явного подавления защиты насекомых-хозяев, мы проанализировали поверхность яиц и симбиотических вирусов на предмет защитных свойств.Здесь мы сообщаем о молекулярном клонировании белка массой 32 кДа (Crp32), который является одним из основных защитных компонентов. Он вырабатывается в клетках чашечки яичников самок осы и прикрепляется к поверхности яйца и другим частицам, включая полиднавирусы. Рекомбинантный белок обеспечивает защиту покрытых объектов в анализе клеточной инкапсуляции, предполагая, что слой Crp32 может предотвращать реакции клеточной инкапсуляции путем локальной инактивации системы защиты хозяина.
Хорошо известно, что насекомые быстро реагируют на инородные предметы, которые попадают в гемолимфу, образуя капсулы, включающие гемоциты и компоненты внеклеточной гемолимфы (1).Однако мы все еще не знаем о молекулярном процессе иммунного распознавания беспозвоночных. Поскольку у насекомых отсутствуют специфические рецепторы, которые генерируются соматическими механизмами во время онтогенеза каждого отдельного организма, считается, что распознавание патогенов связано с молекулярными паттернами, а не с конкретными структурами (2). Хотя внутриклеточные регуляторные процессы иммунных функций высоко консервативны, даже между позвоночными и беспозвоночными (3), некоторые молекулы распознавания насекомых, которые потенциально идентифицируют чужеродные объекты, такие как лектины (например, лектины).г., исх. 4) или гемолин (5, 6), не консервативны и могут присутствовать не у всех насекомых. Это может быть признаком того, что отдельные виды насекомых приобретают подмножества распознающих молекул при адаптации к конкретным условиям окружающей среды и соответствующим им микроорганизмам и паразитам.
Процесс распознавания поднимает вопрос о том, как насекомые отличают себя от чужого. В открытой системе кровообращения поверхность базальных мембран, отделяющих ткани от гемолимфы, имеет большое значение для предотвращения инкапсуляции собственных тканей (7).Молекулярное значение этого наблюдения неясно, но защитные свойства также очевидны в анализах инкапсуляции, когда компоненты внеклеточного матрикса позвоночных используются для предотвращения прикрепления и распространения клеток насекомых (8). Во время развития насекомых способность защищать ткани выстилки от собственной защитной системы, по-видимому, добавляется к базальной мембране гемоцитами (9). Это говорит о том, что иммунная система насекомых включает в себя два элемента: процесс распознавания с использованием паттернов внешних признаков потенциальных патогенов и защиту собственных тканей и структур на слизистой оболочке гемолимфы.
Чтобы получить доступ к белкам насекомых, которые мешают процессам внеклеточного распознавания, мы решили изучить генетические адаптации паразитоидных взаимодействий с хозяином, чтобы определить компоненты, обеспечивающие защиту яйца от защиты хозяина. Эти взаимодействия насекомых накладывают экстремальное давление отбора на оба организма и являются идеальными экспериментальными системами для выделения компонентов ос, которые специфически мешают иммунным функциям хозяина. Компоненты, которые защищают яйцо осы, обычно являются частью материнского секрета, который можно выделить из яйцеводов самки.
В Cotesia rubecula развивающиеся эмбрионы и личинки защищены от хозяина, Pieris rapae , защитные реакции с помощью комбинации двух различных механизмов, включающих уклонение от защиты хозяина (10) и подавление клеточной способности к провести реакцию инкапсуляции белком, кодируемым полиднавирусом (CrV) (11, 12). Оба механизма необходимы для завершения роста осы внутри гусеницы. Поскольку инактивация гемоцитов кодируемым вирусом супрессором не наблюдается в течение нескольких часов после паразитирования, поверхностное покрытие отложений яиц материнскими выделениями должно быть эффективным для защиты яйца и, возможно, симбиотических вирусов от немедленной атаки хозяина. гемоциты.
Предполагая, что вирусы и яйца защищены аналогичным механизмом, включающим материнские выделения, мы вывели антитела против очищенных полиднавирусов и протестировали поверхность яйца на перекрестно реагирующие белки из жидкости чашечки. Последующие эксперименты показали, что два белка на поверхности яйца перекрестно реагируют с антивирусными антителами и что защитные свойства на поверхности яйца могут быть замаскированы антивирусными антителами, что приводит к инкапсуляции введенного яйца внутри гусеницы (10 ).Чтобы проанализировать защитные свойства поверхности на молекулярном уровне, мы решили клонировать основной перекрестно реагирующий белковый компонент на поверхности отложений яиц. Здесь мы описываем белок массой 32 кДа, который продуцируется в клетках чашечки осы и прикрепляется к поверхности яйца при его переходе из яичника в яйцевод. Белок обладает свойствами, которые можно использовать для покрытия биотических и абиотических объектов от защитных реакций насекомых.
МАТЕРИАЛЫ И МЕТОДЫ
Анализ белков и нуклеиновых кислот.
Яйца C. rubecula , собранные от паразитированных гусениц P. rapae или из яичников осы, инкубировали в 1% SDS в течение 5 мин. Собирали супернатант, содержащий растворенные белки с поверхности яиц.
Нозерн- и Саузерн-блот-анализы выполняли, как описано (13), с использованием меченной [ 32 P] кДНК, кодирующей Crp32, в качестве зонда в строгих условиях (65 ° C). Тотальную РНК экстрагировали из ос и яичников, как описано (14), и использовали для Нозерн-блот-анализа и конструирования библиотеки кДНК.Вестерн-блоттинг выполняли, как описано (13), с использованием антисыворотки кролика против очищенных CrV (10). Связанные антитела визуализировали с помощью козьих антител, конъюгированных с щелочной фосфатазой кролика.
Микросеквенирование пептидов.
кусочков акриламидного геля, содержащих полосу, соответствующую белку массой 32 кДа, вырезали из препаративного SDS / 10% полиакриламидного геля, содержащего образцы не содержащей вирусов жидкости чашечки (10).Белок элюировали путем гомогенизации срезов геля в 50 мМ трис-HCl и 0,1% SDS, pH 8,0, и инкубировали в течение ночи при 4 ° C. Гелевую матрицу удаляли центрифугированием. Затем белок осаждали из раствора путем медленного добавления ледяного этанола до конечной концентрации 80% и центрифугирования в течение 30 мин при 13000 × g . Осадок растворяли в 50 мкл 50 мМ трис-HCl и 0,1% SDS, восстанавливали добавлением 2-меркаптоэтанола до концентрации 4 мМ и нагревали в течение 45 мин при 60 ° C.Восстановленные остатки цистеина алкилировали добавлением йодацетамида в воде до конечной концентрации 50 мМ и инкубированием в течение 15 мин в темноте. Для получения оптимальных условий для расщепления трипсином к раствору белка добавляли 50 мкл раствора, содержащего 50 мМ Tris⋅HCl (pH 7,2), 20% диметилформамид и 4 мМ CaCl 2 . Добавляли трипсин в воде, чтобы получить соотношение протеазы к белку 1:20, и расщепление проводили при 37 ° C в течение до 44 часов и останавливали кипячением в течение 5 минут.Образец лиофилизировали, ресуспендировали в 3 М гидрохлориде гуанидина и инкубировали в течение 30 мин при комнатной температуре перед центрифугированием при 5000 × g в течение 10 мин. ВЭЖХ выполняли, загружая 50 мкл образца в колонку для ВЭЖХ (Vydac, Hesperia, CA), и выбранные пептидные фракции собирали и секвенировали на секвенаторе белков (Hewlett-Packard G1000A).
Иммуноскрининг и экспрессия бактерий.
Библиотека экспрессии кДНК была сконструирована из самок C.rubecula путем синтеза молекул кДНК из поли (A) + РНК, выделенной из ос, и лигирования в плечи лямбда gt11 (Promega). Первичный титр составлял 1,5 × 10 11 бляшкообразующих единиц. После индукции изопропил-β-d-тиогалактозида (IPTG) 6 × 10 5 бляшек подвергали скринингу с использованием антисыворотки против CrV (разведение 1: 5000) (10). Вторичные антитела (конъюгированные с щелочной фосфатазой антикроличьи Ig, Pierce) использовали в разведении 1: 5000.Бляшки были проверены, как описано (15). ДНК фага выделяли из лизатов фага с использованием набора для получения ДНК лямбда (Qiagen, Chatsworth, CA) в соответствии с инструкциями производителя. Из пяти клонов, которые показали метку на первичном скрининге, три содержали последовательности Crp32 (см. Ниже).
Было продуцировано
лизогенов положительных бляшек (Promega, инструкции производителя), индуцированных 10 мМ IPTG и проанализировано на продукцию белка вестерн-блоттингом с использованием анти-CrV-антисыворотки в качестве зонда.
Элюция антител из блотов нитроцеллюлозы.
Для получения антител, направленных против Crp32 без возможных посттрансляционных модификаций, антитела были элюированы из препаративных вестерн-блотов, содержащих рекомбинантный белок из лизогенов, как описано ранее (16). Вкратце, желаемые полосы вырезали из блота после окрашивания на активность щелочной фосфатазы и переносили в пробирку, содержащую PBS (138 мМ NaCl / 2.7 мМ KCl / 1,47 мМ KH 2 PO 4 / 7,3 мМ Na 2 HPO 4 , pH 7,6). Антитела элюировали из фрагментов быстрой серией из трех промываний по 30 секунд каждый раз в буфере для элюции [50 мМ глицин-HCl, pH 2,3, 50 мМ NaCl / 0,5% (об. / Об.) Твин 20/100 мкг / мл БСА. ). Элюаты немедленно нейтрализовали добавлением Na 2 PO 4 до конечной концентрации 50 мМ.
Клонирование и секвенирование кДНК
.
Лямбда-ДНК, выделенная из выбранных рекомбинантных фагов, была расщеплена рестрикционными ферментами Kpn I и Sac I, ближайшими к сайтам Eco RI, фланкирующим вставку, и лигирована в те же сайты в плазмидном векторе pBluescript (pBluescript SK + , Стратаген).Вставку секвенировали путем реакции терминации в автоматическом секвенаторе (Applied Biosystems Sequencer) с использованием λgt11-специфических прямых и обратных праймеров (Promega) и шести праймеров, которые были сконструированы на основе данных последовательности из вставки ДНК.
Экспрессия белка в бактериях.
Фрагмент кДНК, кодирующий Crp32, амплифицировали с помощью ПЦР с использованием двух праймеров, связывающихся с 5′-концом (5′-GCGCGGTACCCATGGATAAGAAGATAATA-3 ‘) и 3′-концом (5′-GCGCGGTACCTGGCCTTTTTTTTGGCAGTCC-3’ -кодирующим область (последовательности праймеров подчеркнуты).Праймеры содержали выступы, которые можно было использовать для лигирования с сайтами рестрикции Kpn I. Амплифицированный продукт выделяли из низкоплавкого агарозного геля (Promega) и расщепляли Kpn I. Фрагмент клонировали в сайт Kpn I в pQE31 (Qiagen) под промотором lac и трансформировали в Escherichia coli ( M15). Продукция белка, содержащего дополнительные 6 остатков гистидиновой метки, индуцировалась 0,1 мМ IPTG в течение 2 часов при 37 ° C.Слитый белок, который, как было обнаружено, растворим в цитоплазме бактерий, был захвачен с помощью гранул Ni-смолы (Qiagen) после обработки ультразвуком в буфере для обработки ультразвуком (50 мМ фосфат натрия, pH 7,8 / 300 мМ NaCl) и элюирован 110 мМ имидазолом после начальное удаление бактериальных белков 65 мМ имидазолом.
In vitro и In vivo Анализ инкапсуляции .
За день до анализа несколько лунок в планшете для микротитрования засевали клетками Sf21 (культура клеток Spodoptera frugiperda ).Клетки удаляли из лунок и заменяли свежей средой для культивирования насекомых Grace’s (GIBCO / BRL), насыщенной фенилтиурией. Это оставляет слой секретируемых белков с очевидным эффектом на адгезию и дегрануляцию гемоцитов, которые контактируют с пластиковой поверхностью. У двух гусениц P. rapae 4-й возрастной стадии брали кровь непосредственно в каждую лунку, в которую добавляли шарики смолы. Гранулы Ni-NTB (Qiagen) покрывали рекомбинантным Crp32 и бактериальными белками путем инкубации гранул с растворимой фракцией бактерий, содержащих плазмиду (pQE31-Crp32), и бактерий, содержащих вектор pQE31.Чтобы замаскировать покрытые Crp32 шарики антителами, шарики инкубировали с антисывороткой против CrV (1: 500), которая специфически распознает белок Crp32, в течение 2 часов при 4 ° C и трижды промывали перед добавлением к монослоям гемоцитов.
Гранулы, покрытые Crp32 и неродственным белком вируса растений (клостеровирус типа 1, связанный с ролями листьев винограда, GLRaV-1, белок оболочки), экспрессируемые в той же бактериальной системе экспрессии, инъецировали гусеницам P. rapae 4-го возраста и вскрывали в течение 24 часов после инъекции.
РЕЗУЛЬТАТЫ
Calyx Fluid Proteins на поверхности вируса и яйца.
Когда яйца паразитоидов инкубировали с антисывороткой против CrV и вводили наивным гусеницам, они инкапсулировались гемоцитами хозяина (10). Чтобы выяснить, прикреплены ли связанные с вирусом белки к яйцу паразитоидов, белки, элюированные с поверхности яйца, анализировали с помощью вестерн-блоттинга с использованием антисыворотки против CrV в качестве зонда. В дополнение к белку 65 кДа (Crp65), который ранее был идентифицирован в жидкости чашечки и на CrV, белок 32 кДа (Crp32) четко распознавался антисывороткой (рис.1 А ). Поскольку яйца ос и симбиотические полиднавирусы, по-видимому, защищены от защиты хозяина поверхностной оболочкой, мы подозревали, что два белка, обнаруженные на обоих объектах, вероятно, участвуют в защитной функции.
Рисунок 1
( A ) SDS / PAGE анализ белковых экстрактов из C. rubecula (например). Белки, элюированные из яиц после вскрытия яичников, (cf) не содержащей вирусов жидкости чашечки, (v) очищенных полиднавирусов и (ly) лизата рекомбинантных фагов, содержащих кДНК, кодирующую Crp32.Соответствующий вестерн-блот этого геля показан справа, в котором в качестве зонда использовалась антисыворотка против очищенных CrVs. Белок массой 65 и 32 кДа виден, например, во фракциях cf и v. Обратите внимание на сходство размеров рекомбинантного белка и Crp32 из секрета яичников. Маркеры молекулярной массы указаны в кДа. ( B ) Нозерн-блот-анализ РНК, экстрагированной из яичников (ov) и оставшейся туши (car) самок осы C. rubecula . Аналогичные количества РНК загружали для каждого образца (2 мкг).Образцы зондировали двумя клонами кДНК ( A и C ), полученными в результате скрининга библиотеки кДНК C. rubecula . Оба зонда гибридизуются с фрагментом 1,5 РНК в образце яичника. (MW) Маркеры молекулярной массы.
Молекулярное клонирование кДНК, кодирующей Crp32.
Были изучены два независимых подхода к выделению и идентификации ДНК, кодирующей Crp32. Во-первых, мы секвенировали протеолитические пептиды из куска акриламидного геля, который содержал предполагаемую полосу Crp32.Это стало возможным, потому что окрашенная кумасси синим полоса была легко идентифицирована как белок Crp32 при вестерн-блоттинге и, по-видимому, была отделена от других полос белка на геле. Были получены пять пептидных последовательностей, содержащих в общей сложности 54 аминокислоты (см. Фиг. 4).
Во втором подходе мы сконструировали библиотеку бактериальной экспрессии из фрагментов кДНК самок ос C. rubecula и проверили рекомбинантные фаги на слитые белки с использованием антисыворотки против CrV в качестве зонда.Из трех положительных клонов два имели идентичный размер вставки. Вставки ДНК двух независимых клонов использовали в качестве зонда в Нозерн-блоте, содержащем РНК, выделенную из яичников осы. Оба зонда прочно распознали фрагмент РНК размером 1,5 т.п.н. (рис. 1 B ), что указывает на то, что они происходят от одного и того же гена. В этих условиях воздействия не было обнаружено сигнала гибридизации во фракции РНК, выделенной из туш осы, лишенных яичников (рис. 1 B ). Это говорит о том, что выделенный ген сильно экспрессируется в яичниках.
Для сравнения рекомбинантного и нативного белков слитый белок был получен путем индукции лизогена лямбда, содержащего ДНК-вставку. Белки анализировали с помощью вестерн-блоттинга с использованием антисыворотки против CrV в качестве зонда. Белок 32 кДа был обнаружен только в индуцированной фракции (фиг. 2 A ), подобной по размеру белку на поверхности яйца (фиг. 1 A , лизат). Чтобы исключить антитела из антисыворотки против CrV, которые распознают возможные модификации гликозилирования Crp32, мы элюировали антитела из препаративного вестерн-блоттинга, содержащего слитый белок.Эти специфические антитела использовали в качестве зонда при вестерн-блоттинге, включающем белковые экстракты из яичников осы. В этих условиях был распознан только белок 32 кДа (рис. 2 B ), что указывает на то, что белок продуцируется в основном в яичниках.
Рисунок 2
( A ) Вестерн-блот-анализ рекомбинантных белков из IPTG-индуцированных (in) и -неиндуцированных (−in) фагов, выделенных в результате скрининга библиотеки кДНК экспрессии C. rubecula и зондированных антисывороткой против CrV.Белок массой 32 кДа виден только в индуцированном образце. ( B ) Белковые экстракты яичников C. rubecula , зондированные антителами, элюированными из белка Crp32, продуцируемого рекомбинантными фагами (Elu.AB), и вторичных антител в качестве контроля (2AB). Белок массой 32 кДа распознавался специфическим антителом.
Поскольку полиднавирусы продуцируются в яичниковой железе, мы хотели выяснить, является ли ген, кодирующий Crp32, частью циркулярного вирусного генома.ДНК очищенных вирусов и геномная ДНК самцов ос, в которых отсутствуют циркуляризированные молекулы вируса, тестировали с помощью саузерн-блоттинга с использованием фрагмента кДНК, кодирующего белок, в качестве зонда. В вирусной ДНК не было обнаружено значимого сигнала гибридизации (рис. 3) по сравнению с сигналами от аналогичных блотов, протестированных с помощью вирусспецифического зонда (11). Однако зонд прореагировал с геномной ДНК самцов ос (рис. 3). Это указывает на то, что продукция Crp32 в клетках яичников происходит не из циркулярного вирусного генома, а из гена осы, который может быть не связан с полиднавирусами.
Рисунок 3
Саузерн-блот-анализ геномной ДНК, выделенной из CrV (v) и самцов ос C. rubecula , переваренных рестрикционными ферментами Eco RI и Hin dIII. Мембрану зондировали [ 32 P] -меченным фрагментом кДНК, кодирующим Crp32. Отсутствие значимого сигнала в вирусной ДНК указывает на то, что ген не является частью циркулярного генома CrV. Соответствующая микрофотография геля агарозы показана слева.
Выведенная последовательность белка.
Последовательность ДНК большого фрагмента кДНК содержала ORF размером 765 п.н. с предполагаемым белком из 253 аминокислот (фиг. 4). Кодон метионина в начале ORF был идентифицирован как возможный кодон инициации (17). Анализ последовательности второго, немного меньшего фрагмента кДНК показал, что существует другой транскрипт гена с аденином вместо цитозина в положении -1 (рис. 4). Остальные нуклеотидные последовательности двух фрагментов кДНК идентичны.
Рисунок 4
нуклеотидная последовательность ДНК и выведенная аминокислотная последовательность фрагмента кДНК, кодирующего Crp32 из C.rubecula . Гидрофобная область на N-конце, представляющая предполагаемую трансмембранную область, выделена серым, а цитоплазматический хвост — пустым. Аминокислотные последовательности, полученные в результате микросеквенирования белка, подчеркнуты. Было обнаружено, что два клона кДНК, полученные в результате скрининга библиотеки кДНК C. rubecula , различаются по аминокислоте в положении -1 по отношению к кодону инициации. Сайт терминации на конце ORF обозначен точкой. Предполагаемый мотив связывания гиалуронана подчеркнут пунктирной линией.
Выведенная последовательность белка включает пептидные последовательности, полученные в результате микросеквенирования фрагментов триптического пептида из белка (фиг. 4). Поскольку молекулярная идентичность кодирующей белок ДНК и соответствующих пептидов была установлена двумя независимыми подходами, это указывает на то, что клонированная ДНК кодирует Crp32. Расчетная молекулярная масса для выведенной белковой последовательности составляет ≈27,5 кДа по сравнению с расчетным размером 32 кДа, полученным в результате ее миграции в SDS / PAGE.
Установленная последовательность белка содержит трансмембранный домен на N-конце без консенсусного сайта расщепления (18), что указывает на то, что белок не может высвобождаться с поверхности клетки (рис. 4). Белок также содержит несколько доменов, в которых положительно заряженные аминокислоты и липофильные аминокислоты разнесены таким образом, чтобы обеспечить амфипатическую α-спиральную структуру для белка. Используя банк данных в Национальном центре биологической информации (Bethesda, MD), выведенная последовательность белка для Crp32 была сравнена с другими белками, но не показала какого-либо значительного сходства с существующими последовательностями белка.
Crp32-подобных белков.
Чтобы выяснить, ограничен ли Crp32 осами, мы проанализировали белковые экстракты непаразитизированной гусеницы на предмет антигенного сходства с Crp32. Когда специфические антитела против рекомбинантного Crp32 тестировали на Вестерн-блоттинге, было обнаружено, что белок немного большего размера (34 кДа) в гемоцитах P. rapae перекрестно реагирует (фиг. 5 B ). Хотя степень сходства белков еще предстоит подтвердить путем клонирования гомологов Crp32 у других видов, это наблюдение может предполагать, что Crp32 является членом семейства консервативных белков насекомых.
Рисунок 5
Белковые экстракты рекомбинантных бактерий, P. rapae и C. rubecula проанализированы на Вестерн-блоттинге. ( A ) Продукция Crp32 рекомбинантными бактериями. IPTG-индуцированные (in) и -неиндуцированные (не) рекомбинантные бактерии, содержащие плазмиду pQE31-Crp32; слитый белок массой 34 кДа распознавался антисывороткой против CrV в индуцированных бактериях, разница в размере с белком чашечки (cf) обусловлена дополнительными последовательностями пептида гистидиновой метки в бактериальном слитом белке.( B ) Антигенное сходство с белком непаразитизированных гусениц. Белковые экстракты из гемоцитов, выделенных из наивных гусениц P. rapae (Hc) с использованием элюированных антител из препаративного вестерн-блоттинга, содержащего рекомбинантный Crp32 из бактерий (элю). Не наблюдали перекрестной реакции с бесклеточной гемолимфой (H1) с использованием специфического антитела и вторичного антитела (2-е).
Защитные свойства Crp32.
Чтобы исследовать участие Crp32 в обеспечении защиты посторонних предметов, вторгающихся в открытую систему кровообращения насекомых, мы протестировали гранулы смолы, покрытые бактериальным слитым белком, в тесте инкапсуляции in vitro и .КДНК, кодирующую Crp32, вставляли в плазмидный вектор под контролем промотора lac Z для получения слитого белка, содержащего пептид гистидиновой метки, который использовали для связывания белка с Ni-смолой. Было обнаружено, что слитый белок имеет массу 34 кДа (фиг. 5 A ), что немного больше, чем нативный белок из-за остатков гистидина из вектора. Гранулы, покрытые Crp32, содержат гибридный белок массой 34 кДа в дополнение к ряду бактериальных белков со случайными Ni-связывающими свойствами, которые аналогичны контрольным и гранулам, покрытым Crp32 (рис.5 А ).
Когда гранулы, покрытые Crp32 (рис. 6 A ), инкубировали с изолированными гемоцитами P. rapae и исследовали через 24 часа, никаких признаков инкапсуляции не наблюдалось (рис. 6 B ), тогда как контрольные шарики, лишенные Crp32 были инкапсулированы. В наших руках скорость инкапсуляции, наблюдаемая в контрольных шариках, составляет более половины и в некоторой степени зависит от соотношения количества гемоцитов и шариков, добавленных в анализ. В этих условиях на гранулах, покрытых Crp32, не наблюдалось никаких признаков инкапсуляции.Более того, когда покрытые Crp32 шарики инкубировали с антителами, которые специфически распознают белок и добавляли, наблюдалась инкапсуляция гемоцитов (фиг. 6 C ). В экспериментах in vivo , в которых покрытые Crp32 шарики инъецировали гусеницам P. rapae , шарики были защищены, и инкапсуляции не наблюдали (данные не показаны). Однако, когда шарики покрывали неродственным рекомбинантным белком вируса растений (рис.6 A ) и вводили гусеницам, происходила инкапсуляция (рис.6 С ). Это предполагает, что рекомбинантный Crp32 способен защищать абиотические объекты от реакции клеточной инкапсуляции и, вероятно, является одним из функциональных компонентов, участвующих в пассивной защите от иммунных ответов хозяина.
Рисунок 6
( A ) SDS / PAGE анализ поверхностных белков из гранул Ni-смолы, инкубированных с лизатом из бактерий, содержащих ДНК, кодирующую p32, вставленную в плазмиду экспрессии (p32), гранулы, инкубированные с бактериальным лизатом из векторных бактерий (M15) и шарики, инкубированные с бактериальным лизатом, содержащим белок неродственного вируса растений (GLRaV-1).Условия экспрессии были выбраны для получения идентичных количеств слитых белков. В этих условиях бактериальные белки, которые обладают случайными Ni-связывающими свойствами, обнаруживаются на всех поверхностях гранул, с дополнительным белком массой 34 кДа, присутствующим на гранулах, обработанных лизатами бактерий, экспрессирующих p32 (стрелка), и дополнительным белком массой 40 кДа из виноградного вина. покрывающий белок клостеровируса типа 1, ассоциированный с листролом (стрелка). (MW) Маркеры молекулярной массы сверху: 200, 116,3, 97,4, 66,3, 55.4, 36,5, 31, 21,5, 14,4 и 6 кДа. ( B ) In vitro и in vivo Результаты инкапсуляции . Гранулы, покрытые белками бактерий, содержащих плазмиду, экспрессирующую p32 ( Left ), и гранулы, покрытые белками бактерий, содержащих вектор экспрессии ( Right ), инкубировали с гемоцитами P. rapae . В шариках, покрытых p32, не было обнаружено никаких признаков прикрепления гемоцитов, тогда как контрольные шарики были инкапсулированы (стрелки). ( C ) Гранулы, покрытые p32 и замаскированные антисывороткой против CrV, инкубировали с P.rapae гемоцитов ( слева, ). In vivo Анализ инкапсуляции с использованием шариков, покрытых неродственным белком растительного вируса (белок оболочки GLRaV-1, см. A ), инъецировали гусеницам и рассекали через 24 часа ( Right ). Контрольные шарики, покрытые рекомбинантным p32, не инкапсулировались в этих условиях (не показаны).
ОБСУЖДЕНИЕ
Экспериментальные данные, представленные здесь, показывают, что яйца паразитоидов защищены от атаки гемоцитов 32-кДа (Crp32) белком.Рекомбинантный белок, прикрепленный к шарикам из Ni-смолы, предотвращает прикрепление гемоцитов in vivo, и in vitro, к поверхности, таким образом защищая шарики от инкапсулирования. Контрольные шарики, лишенные белка Crp32 или покрытые неродственным белком, инкапсулировали. Точно так же, когда шарики, покрытые Crp32, были замаскированы антителами против белка, произошла инкапсуляция, подтверждая предыдущие наблюдения, что яйца C. rubecula , введенные гусеницам, защищены от реакции инкапсуляции хозяина, тогда как яйца, замаскированные антителами, инкапсулируются (10 ).Молекулярный механизм защиты, опосредованной Crp32, неизвестен. Белок может помешать гемоцитам распознавать покрытые шарики как инородный объект или, альтернативно, препятствовать инкапсуляции путем локальной инактивации атакующих гемоцитов. Поверхностные свойства гранул, используемых в анализе инкапсуляции, предполагают локальную инактивацию гемоцитов на гранулах, покрытых Crp32, поскольку как контрольные, так и покрытые Crp32 гранулы покрыты бактериальными белками, которые обладают случайными Ni-связывающими свойствами (рис.6 A ), предполагая, что Crp32 вкраплен среди бактериальных белков, а не полностью покрывает гранулы.
Выведенная последовательность белка не связана с какой-либо известной последовательностью белка в банках данных по белкам. Помимо амфипатических α-спиральных доменов, последовательность белка содержит общий мотив связывания гиалуронана (19) (рис. 4). Гиалуронан представляет собой гликозаминогликан, содержащий дисахаридные единицы N, -ацетилглюкозамин и глюкуроновую кислоту (20), которые присутствуют во внеклеточном матриксе и на поверхности клеток, влияя на поведение клеток, такое как адгезия, подвижность и рост (20).Функциональное значение этих структурных особенностей белка неясно.
Защитное покрытие отложений яиц было описано и при других взаимодействиях паразитоидов с хозяином. Фиброзный слой был описан на яйцах Cardiochiles nigriceps (Hym: Braconidae), происходящих из яичников ос (21). Этот слой был задействован в пассивном уклонении яиц паразитоидов от инкапсуляции гемоцитами Heliothis virescens . Более недавнее наблюдение (22) указывает на участие белка (p50) на оболочке полиднавируса в защите яиц Cotesia kariyai (Hym: Braconidae) от клеточных иммунных реакций хозяина, Pseudoletia separata .Стеклянные капилляры, предварительно покрытые p50, не были инкапсулированы по сравнению с контролем без покрытия. Предполагалось, что антигенное сходство белка с компонентами гемолимфы является причиной молекулярной маскировки (22). Хотя не существует гомологии последовательностей Crp32 и доступных N-концевых пептидных последовательностей p50, эти два белка могут иметь сходную функцию.
Является ли Crp32 вирусным белком или не имеет отношения к симбиотическим полиднавирусам, не ясно. Хотя экспрессия белка коррелирует с экспрессией гена полиднавируса у осы, отсутствие ДНК, кодирующей белок Crp32, из вирусных частиц предполагает, что ген не является частью генома циркулярного полиднавируса.Однако ген может быть частью провирусной ДНК, не включенной в геном амплифицированного полиднавируса. Требуются дальнейшие исследования, чтобы решить, является ли белок белком оболочки вируса или невирусным белком, секретируемым клетками чашечки в просвет, где он прикрепляется к вирусным частицам и поверхности яиц при прохождении из яичников в яйцевод.
Наблюдение за перекрестно-реактивным белком размером 34 кДа, обнаруженным в гемоцитах непаразитизированных гусениц P. rapae , предполагает, что аналогичные молекулы могут также существовать у видов чешуекрылых, имеющих физиологические функции, которые, вероятно, не зависят от взаимодействий паразитоид-хозяин.В этом контексте тканеспецифическая сверхэкспрессия Crp32 в жидкости чашечки осы может быть адаптацией к эндопаразитарному образу жизни, позволяя покрывать поверхность яйца белком.
Благодарности
Мы благодарим Питера Хой за то, что он поделился методом микросеквенирования белков, и группу биотехнологов в кампусе Уэйта за помощь в разделении пептидов с использованием микрокапиллярной колонки. Мы также благодарим Маркуса Бека за помощь с бактериальной экспрессией Crp32 и Клаудию Фазели за предоставление рекомбинантного белка оболочки GLRaV-1.Этот проект поддержан грантом Австралийского исследовательского совета О. Шмидту.
Сноски
-
↵ * Кому следует обращаться с запросами на перепечатку. электронная почта: oschmidt {at} waite.adelaide.edu.au.
-
Этот документ был отправлен напрямую (Трек II) в Proceedings Office.
-
Сокращение: IPTG, изопропил β-d-тиогалактозид.
-
Размещение данных: Последовательность, указанная в этой статье, была депонирована в базе данных Genbank (инвентарный номер.AF050670).
- Поступило 23 сентября 1997 г.
- Авторские права © 1998, Национальная академия наук
Функции белков в организме — питание человека [УСТАРЕЛО]
Белки являются «рабочими лошадками» тела и участвуют во многих функциях организма. Белки бывают всех размеров и форм, и каждый из них специально структурирован для своей конкретной функции.
Структура и движение
Рисунок 6.9 Структура коллагена
Тройная спираль коллагена от Невита Дилмена / CC BY-SA 3.0
В организме человека было обнаружено более сотни различных структурных белков, но наиболее распространенным является коллаген, который составляет около 6 процентов от общей массы тела. Коллаген составляет 30 процентов костной ткани и включает большое количество сухожилий, связок, хрящей, кожи и мышц. Коллаген — это прочный волокнистый белок, состоящий в основном из глицина и пролина. Внутри его четвертичной структуры три пептидных нити скручиваются друг вокруг друга, как веревка, а затем эти коллагеновые нити перекрываются друг с другом.Эта высокоупорядоченная структура даже прочнее, чем стальные волокна того же размера. Коллаген делает кости крепкими, но гибкими. Волокна коллагена в дерме кожи придают ей структуру, а сопутствующие фибриллы белка эластина делают ее гибкой. Зажмите кожу на руке и отпустите; белки коллагена и эластина в коже позволяют ей вернуться к своей первоначальной форме. Гладкомышечные клетки, которые выделяют белки коллагена и эластина, окружают кровеносные сосуды, придавая им структуру и способность растягиваться назад после того, как через них прокачивается кровь.Еще один сильный волокнистый белок — кератин, из которого состоят кожа, волосы и ногти. Плотно упакованные коллагеновые фибриллы в сухожилиях и связках обеспечивают синхронные механические движения костей и мышц и способность этих тканей возвращаться назад после завершения движения.
Ферменты
Хотя белки в наибольшем количестве содержатся в соединительных тканях, таких как кости, их наиболее необычная функция — это ферменты. Ферменты — это белки, которые проводят определенные химические реакции.Задача фермента — обеспечить место для химической реакции и снизить количество энергии и время, необходимое для того, чтобы эта химическая реакция произошла (это известно как «катализ»). В среднем каждую секунду в клетках происходит более ста химических реакций, и для большинства из них требуются ферменты. Одна только печень содержит более тысячи ферментных систем. Ферменты специфичны и будут использовать только определенные субстраты, которые подходят их активному сайту, подобно тому, как замок может быть открыт только с помощью определенного ключа.Почти каждая химическая реакция требует определенного фермента. К счастью, фермент может снова и снова выполнять свою роль катализатора, хотя в конечном итоге он разрушается и восстанавливается. Все функции организма, включая расщепление питательных веществ в желудке и тонком кишечнике, преобразование питательных веществ в молекулы, которые клетка может использовать, и построение всех макромолекул, включая сам белок, включают ферменты (см. Рисунок 6.10 «Роль ферментов в переваривании углеводов») .
Рисунок 6.Роль 10 ферментов в переваривании углеводов
Гормоны
Белки отвечают за синтез гормонов. Гормоны — это химические сообщения, производимые железами внутренней секреции. Когда эндокринная железа стимулируется, она выделяет гормон. Затем гормон транспортируется с кровью к своей клетке-мишени, где он передает сообщение, чтобы инициировать определенную реакцию или клеточный процесс. Например, после еды уровень глюкозы в крови повышается. В ответ на повышение уровня глюкозы в крови поджелудочная железа выделяет гормон инсулин.Инсулин сообщает клеткам организма, что глюкоза доступна и может забирать ее из крови и хранить или использовать для производства энергии или создания макромолекул. Основная функция гормонов — включать и выключать ферменты, поэтому некоторые белки могут даже регулировать действие других белков. Хотя не все гормоны состоят из белков, многие из них состоят из белков.
Жидкостный и кислотно-щелочной баланс
Правильное потребление белка позволяет основным биологическим процессам организма поддерживать статус-кво в изменяющейся окружающей среде.Баланс жидкости относится к поддержанию распределения воды в организме. Если слишком много воды в крови внезапно попадает в ткань, это приводит к отеку и, возможно, к гибели клеток. Вода всегда течет из области с высокой концентрацией в область с низкой концентрацией. В результате вода перемещается в области с более высокими концентрациями других растворенных веществ, таких как белки и глюкоза. Чтобы вода равномерно распределялась между кровью и клетками, белки постоянно циркулируют в крови в высоких концентрациях.Самый распространенный белок в крови — это белок в форме бабочки, известный как альбумин. Присутствие альбумина в крови делает концентрацию белка в крови похожей на таковую в клетках. Таким образом, обмен жидкости между кровью и клетками не является экстремальным, а скорее сводится к минимуму, чтобы сохранить статус-кво.
Рисунок 6.11 Белковый альбумин
PDB 1o9x EBI Джавахара Сваминатана и сотрудников MSD из Европейского института биоинформатики / Public Domain Белок в форме бабочки, альбумин, выполняет множество функций в организме, включая поддержание жидкостного и кислотно-щелочного баланса и транспортировку молекул.
Белок также необходим для поддержания правильного баланса pH (показатель кислотности или щелочности вещества) в крови. PH крови поддерживается между 7,35 и 7,45, что является слегка щелочным. Даже небольшое изменение pH крови может повлиять на функции организма. Напомним, что кислая среда может вызвать денатурацию белка, что останавливает функционирование белков. В организме есть несколько систем, которые удерживают pH крови в пределах нормы, чтобы этого не происходило. Один из них — циркулирующий альбумин.Альбумин имеет слабую кислотность и, поскольку он отрицательно заряжен, уравновешивает множество положительно заряженных молекул, таких как протоны (H +), кальций, калий и магний, которые также циркулируют в крови. Альбумин действует как буфер против резких изменений концентраций этих молекул, тем самым уравновешивая pH крови и поддерживая статус-кво. Белок гемоглобин также участвует в кислотно-щелочном балансе, связывая и высвобождая протоны.
Транспорт
Альбумин и гемоглобин также играют роль в молекулярном транспорте.Альбумин химически связывается с гормонами, жирными кислотами, некоторыми витаминами, необходимыми минералами и лекарствами и переносит их по кровеносной системе. Каждый эритроцит содержит миллионы молекул гемоглобина, которые связывают кислород в легких и транспортируют его ко всем тканям организма. Плазматическая мембрана клетки обычно не проницаема для больших полярных молекул, поэтому для доставки необходимых питательных веществ и молекул в клетку в клеточной мембране существует множество транспортных белков. Некоторые из этих белков являются каналами, которые позволяют определенным молекулам входить и выходить из клеток.Другие действуют как такси с односторонним движением и требуют энергии для работы.
Защита
Рисунок 6.12 Белки антител
Абаговомаб (моноклональное антитело) по Blake C / CC BY-SA 3.0
Рисунок 6.13 Антигены
Цепи антител от Fred the Oyster / Public Domain
Белок антитела состоит из двух тяжелых цепей и двух легких цепей. Вариабельная область, которая отличается от одного антитела к другому, позволяет антителу распознавать соответствующий ему антиген.
Ранее мы обсуждали, что сильные волокна коллагена в коже обеспечивают ей структуру и поддержку.Плотная сеть коллагеновых волокон кожи также служит преградой для вредных веществ. Функции атаки и разрушения иммунной системы зависят от ферментов и антител, которые также являются белками. Фермент лизоцим выделяется со слюной и атакует стенки бактерий, вызывая их разрыв. Определенные белки, циркулирующие в крови, могут быть направлены на создание молекулярного ножа, который пронзает клеточные мембраны чужеродных захватчиков. Антитела, выделяемые лейкоцитами, исследуют всю систему кровообращения в поисках вредных бактерий и вирусов, которые можно окружить и уничтожить.Антитела также запускают другие факторы иммунной системы для поиска и уничтожения нежелательных злоумышленников.
Заживление ран и регенерация тканей
Белки участвуют во всех аспектах заживления ран, процесса, который проходит в три этапа: воспалительный, пролиферативный и ремоделирующий. Например, если вы шили и укололи палец иглой, ваша плоть покраснела бы и воспалилась. Через несколько секунд кровотечение прекратится. Процесс заживления начинается с белков, таких как брадикинин, которые расширяют кровеносные сосуды в месте повреждения.Дополнительный белок, называемый фибрином, помогает защитить тромбоциты, которые образуют сгусток, чтобы остановить кровотечение. Затем, в фазе пролиферации, клетки перемещаются и восстанавливают поврежденную ткань, устанавливая новые коллагеновые волокна. Волокна коллагена помогают сблизить края раны. В фазе ремоделирования откладывается больше коллагена, образуя рубец. Рубцовая ткань только на 80 процентов функциональна, чем нормальная неповрежденная ткань. Если в диете недостаточно белка, процесс заживления ран заметно замедляется.
В то время как заживление ран происходит только после получения травмы, в организме продолжается другой процесс, называемый регенерацией тканей. Основное различие между заживлением ран и регенерацией тканей заключается в процессе восстановления точной структурной и функциональной копии утраченной ткани. Таким образом, старая умирающая ткань заменяется не рубцовой тканью, а совершенно новой, полностью функциональной тканью. Некоторые клетки (например, клетки кожи, волос, ногтей и кишечника) имеют очень высокую скорость регенерации, в то время как другие (например, клетки сердечной мышцы и нервные клетки) не регенерируют на каких-либо заметных уровнях.Регенерация тканей — это создание новых клеток (деление клеток), для чего требуется множество различных белков, включая ферменты, синтезирующие РНК и белки, транспортные белки, гормоны и коллаген. В волосяном фолликуле клетки делятся, и волосы растут в длину. Рост волос в среднем составляет 1 сантиметр в месяц, а ногтей — около 1 сантиметра каждые сто дней. Клетки, выстилающие кишечник, восстанавливаются каждые три-пять дней. Неадекватные белковые диеты ухудшают регенерацию тканей, вызывая множество проблем со здоровьем, включая нарушение переваривания и усвоения питательных веществ и, что наиболее заметно, роста волос и ногтей.
Производство энергии
Некоторые аминокислоты в белках можно разобрать и использовать для производства энергии (Рисунок 6.14 «Аминокислоты, используемые для получения энергии»). Только около 10 процентов пищевых белков катаболизируются каждый день для производства клеточной энергии. Печень способна расщеплять аминокислоты до углеродного скелета, которые затем могут быть включены в цикл лимонной кислоты. Это похоже на то, как глюкоза используется для производства АТФ. Если диета человека не содержит достаточного количества углеводов и жиров, его организм будет использовать больше аминокислот для производства энергии, что ставит под угрозу синтез новых белков и разрушает мышечные белки.Кроме того, если в рационе человека содержится больше белка, чем необходимо организму, лишние аминокислоты расщепляются и превращаются в жир.
Рисунок 6.14 Аминокислоты, используемые для производства энергии
Изображение Эллисон Калабрезе / CC BY 4.0
Защитная функция — обзор
4 Этиологические убеждения и народные подходы
Все системы исцеления сформированы ценностями, мировоззрением и самовосприятием культур, в которых они развиваются и используются. Следовательно, все лечебные системы являются этномедицинскими.Правила и принципы, которыми руководствуются различные этномедицинские модели, образуют дискретные и разные жанры в целом, что затрудняет межэтнические сравнения. Однако, хотя различие между незападными группами трудно провести, между различными этномедицинскими моделями и традиционными западными методами психотерапии существуют очень заметные различия. Например, западная психотерапия — это традиционно индивидуальная деятельность, которая побуждает клиентов обсуждать самые сокровенные аспекты своей жизни.В латиноамериканской культуре клиенты редко описывают свои жалобы как главный шаг в процессе приема, ожидая, что целитель уже знает жалобы клиента (Koss-Chioino 2000). Из-за опыта угнетения афроамериканцы не решаются раскрывать себя. Это может служить защитной функцией от возможного физического и психологического вреда (Sue and Sue, 1990), но люди, которые не раскрывают себя, могут рассматриваться терапевтами как сопротивляющиеся, защищающиеся или поверхностные. Многие меньшинства, которые не хотят раскрывать себя, считаются психически нездоровыми, а в случае афроамериканцев им ставят диагноз «параноики» (Murray 1998).
Несмотря на различия в методах исцеления каждой группы, у четырех этнических групп, описанных в этой статье, действительно существуют культурные общие черты. В частности, общие черты состоят из (а) широко распространенного убеждения, что причины психических заболеваний существуют вне человека, (б) групповой ориентации на исцеление (то есть семьи и / или сообщества) в отличие от индивидуальной ориентации на лечение, c) упор на мораль как причину и условие выздоровления (Koss-Chioino 2000) и (d) упор на краткосрочные цели в отличие от долгосрочных целей (Sue and Sue 1990).Подобные лечебные практики среди незападных групп отличаются от западных терапевтических практик.
Латиноамериканцы, азиаты, коренные американцы и афроамериканцы — все это разнородные группы, включающие множество специфических традиций, которые сильно отличаются друг от друга. Гадание (то есть вера в сверхъестественное и практики связи с духовным миром) изначально было частью целительских практик каждой из этих групп. В отличие от западных культурных групп, которые отказались от таких практик, гадание до некоторой степени все еще является частью практик исцеления многих, но не всех субкультурных групп в каждой из более широких категорий.Например, у коренных американцев традиционные методы исцеления различаются в зависимости от племен и в основном являются шаманскими (духовное вмешательство для исцеления больных). Одним из основных шаманских целителей является Церковь коренных американцев, которая является паниндийской религией, основанной на ритуале, который способствует прямому контакту с Великим Духом (также Богом) через пейот, курение трубки и сигарет, барабанный бой, песни и молитвы. (Косс-Чиоино, 2000). Афро-американские методы исцеления различаются верованиями, практиками и типами целителей в зависимости от местности (например,g., север против юга, и места с особыми традициями, такие как Морские острова в Южной Каролине). В целом, основная система верований афроамериканцев представляет собой смесь медицинских верований более раннего времени, африканских верований о вуду, европейского фольклора о сверхъестественном мире и фундаменталистского христианства. Этиологические понятия делятся на естественные и неестественные категории, варьирующиеся от нездорового образа жизни и непродуктивного беспокойства до веры в злое влияние или карательные меры Бога.Врачи или травники могут вылечить первые две причины, но последние две причины требуют заступничества религиозного целителя или заключения договора с Богом.
Среди латиноамериканцев гадание может включать использование целителем ракушек или карт Таро в качестве руководства, чтобы заглянуть в мир духов и определить причину проблемы клиента. Целитель описывает проблемы клиента (соматические расстройства, плохие чувства, постоянные межличностные или социальные проблемы), а затем клиент подтверждает (чаще всего) или отрицает.Имеется очень мало эпидемиологических данных об использовании этномедицинских методов лечения латиноамериканцами в США. Существующие данные, однако, указывают на то, что использование гадания варьируется в зависимости от латиноамериканского этнического населения. В США гадание кажется процветающей альтернативой психическому здоровью в Майами, Флорида, среди кубинского населения. Оценки среди американцев мексиканского происхождения варьируются от 7 процентов в Сан-Диего до 54 процентов в Южном Техасе (см. Обсуждение в Koss-Chioino 2000). Важно отметить, что некоторые исследования отделяют веру в традиционные методы исцеления от сообщений о фактическом использовании, поэтому расхождения могут быть не такими серьезными.
Различия особенно заметны среди американцев азиатского происхождения (например, китайцев, японцев, вьетнамцев, корейцев и представителей других племен, таких как хмонги или лао). Среди китайцев в США не сообщалось о шаманском исцелении (например, гадании). Китайско-американские этно-целители подчеркивают сбалансированный и дисциплинированный образ жизни для поддержания физического и психологического здоровья. Кроме того, обычны физические / телесные манипуляции, иглоукалывание, массаж и дыхательные упражнения. Напротив, жители Юго-Восточной Азии в США видят шаманов (напр.g., народные целители, знахари и т. д.), когда они доступны (см. обсуждение в Koss-Chioino 2000). Эта склонность к посещению шаманов мотивирована верой в то, что духи вездесущи в природе и могут вызывать или лечить болезни. Например, среди взрослых жителей Юго-Восточной Азии, особенно мужчин-беженцев из числа хмонгов, проживающих в США, наблюдается «синдром внезапной смерти». Вскрытие не позволяет установить причину смерти: человек с явно хорошим здоровьем заснул и умер, не проснувшись.Часто непосредственно перед смертью жертва демонстрировала затрудненное дыхание, крики и неистовые движения. Перед смертью эти люди сообщали, что их посещали духи, и что духи были несчастны и наказывали их. Очевидно, что эти смерти, по-видимому, не имеют первичной биологической основы, тогда как смерти, похоже, связаны с психологическими факторами, включая веру в неизбежность смерти — либо проклятием (например, внушением вуду), либо какой-либо формой наказания (Сью и Sue 1999).
Терапевты, получившие образование на Западе, слишком часто отвергают эти системы убеждений и навязывают свои собственные объяснения и лечение клиентам, отличным от культурного. Без понимания лежащих в основе культурных убеждений терапевт склонен переоценивать степень патологии. В случае с мужчинами из Юго-Восточной Азии, которые сообщают о приступах духов, западный традиционный терапевт, скорее всего, диагностирует этих людей как параноидальных шизофреников, страдающих бредом и галлюцинациями (Sue and Sue 1999).Такой диагноз, скорее всего, побудит терапевта прописать мощный антипсихотический препарат и, возможно, госпитализировать. Однако исследования показывают, что шаманские техники лечат эти симптомы (Sue and Sue 1999). Эффективность такого лечения может заключаться в вере клиента в силу врача (шамана) и полученное лечение (гадание).
В то время как четыре группы, представленные здесь, различаются по степени однородности в отношении верований в духовные атаки, значительное количество каждой группы действительно придерживается этих убеждений.Западная медицина не поддерживает местные или альтернативные подходы к лечению и часто отвергает такие подходы как ненаучные. Использование неприемлемого с культурной точки зрения подхода может привести к травмам или даже смерти (например, как в случае синдрома внезапной смерти). В попытке обеспечить культурную восприимчивость практикующий психиатр должен либо включить наследие древней мудрости, которое может содержаться в местных моделях исцеления, либо направить культурно отличного клиента к культурно приемлемому целителю.
Белки | Биология для майоров I
Опишите структуру и функции белков
Белки представляют собой полимеры аминокислот. Каждая аминокислота содержит центральный атом углерода, водород, карбоксильную группу, аминогруппу и переменную группу R. Группа R указывает, к какому классу аминокислот она принадлежит: электрически заряженные гидрофильные боковые цепи, полярные, но незаряженные боковые цепи, неполярные гидрофобные боковые цепи и особые случаи.
Белки имеют разные «слои» структуры: первичный, вторичный, третичный, четвертичный.
Белки выполняют в клетках самые разные функции. Основные функции включают действие в качестве ферментов, рецепторов, транспортных молекул, белков, регулирующих экспрессию генов, и так далее. Ферменты — это биологические катализаторы, которые ускоряют химическую реакцию без постоянных изменений. У них есть «активные центры», где связывается субстрат / реагент, и они могут быть либо активированы, либо ингибированы (конкурентные и / или неконкурентные ингибиторы).
Цели обучения
- Продемонстрировать знакомство с мономерными единицами белков: аминокислоты
- Определите различные слои структуры белка
- Определить несколько основных функций белков
Аминокислоты
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул.Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка в живой системе может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры из аминокислот , расположенных в линейной последовательности.
Рис. 1. Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).
Аминокислоты — это мономеры, из которых состоят белки. Каждая аминокислота имеет одинаковую фундаментальную структуру, которая состоит из центрального атома углерода, также известного как альфа ( α ) углерода, связанного с аминогруппой (Nh3), карбоксильной группой (COOH) и атомом водорода. . Каждая аминокислота также имеет другой атом или группу атомов, связанных с центральным атомом, известную как группа R (рис. 1).
Название «аминокислоты» происходит от того факта, что они содержат как аминогруппу, так и карбоксильную кислотную группу в своей основной структуре.Как уже упоминалось, в белках присутствует 20 аминокислот. Десять из них считаются незаменимыми аминокислотами для человека, потому что человеческий организм не может их производить, и они получают с пищей.
Для каждой аминокислоты группа R (или боковая цепь) отличается (рис. 2).
Практический вопрос
Рис. 2. В белках обычно встречаются 20 общих аминокислот, каждая из которых имеет свою R-группу (вариантная группа), которая определяет его химическую природу.
Какие категории аминокислот вы ожидаете найти на поверхности растворимого белка, а какие — внутри? Какое распределение аминокислот вы ожидаете найти в белке, встроенном в липидный бислой?
Показать ответ
Полярные и заряженные аминокислотные остатки (остаток после образования пептидной связи) с большей вероятностью будут обнаружены на поверхности растворимых белков, где они могут взаимодействовать с водой, и неполярные (например.g., боковые цепи аминокислот) с большей вероятностью будут обнаружены внутри, где они изолированы от воды. В мембранных белках неполярные и гидрофобные боковые цепи аминокислот связаны с гидрофобными хвостами фосфолипидов, в то время как полярные и заряженные боковые цепи аминокислот взаимодействуют с полярными головными группами или с водным раствором. Однако бывают исключения. Иногда положительно и отрицательно заряженные боковые цепи аминокислот взаимодействуют друг с другом внутри белка, а полярные или заряженные боковые цепи аминокислот, которые взаимодействуют с лигандом, могут быть обнаружены в кармане связывания лиганда.
Химическая природа боковой цепи определяет природу аминокислоты (то есть, является ли она кислотной, основной, полярной или неполярной). Например, аминокислота глицин имеет атом водорода в качестве группы R. Аминокислоты, такие как валин, метионин и аланин, неполярны или гидрофобны по природе, тогда как аминокислоты, такие как серин, треонин и цистеин, полярны и имеют гидрофильные боковые цепи. Боковые цепи лизина и аргинина заряжены положительно, поэтому эти аминокислоты также известны как основные аминокислоты.Пролин имеет группу R, которая связана с аминогруппой, образуя кольцеобразную структуру. Пролин является исключением из стандартной структуры анимокислоты, поскольку его аминогруппа не отделена от боковой цепи (рис. 2).
Аминокислоты обозначаются одной заглавной буквой или трехбуквенным сокращением. Например, валин обозначается буквой V или трехбуквенным символом val. Так же, как некоторые жирные кислоты необходимы для диеты, некоторые аминокислоты также необходимы. Они известны как незаменимые аминокислоты, а у людей они включают изолейцин, лейцин и цистеин.Незаменимые аминокислоты относятся к тем, которые необходимы для построения белков в организме, но не производятся организмом; Какие аминокислоты являются незаменимыми, варьируется от организма к организму.
Рис. 3. Образование пептидной связи — это реакция синтеза дегидратации. Карбоксильная группа одной аминокислоты связана с аминогруппой входящей аминокислоты. При этом выделяется молекула воды.
Последовательность и количество аминокислот в конечном итоге определяют форму, размер и функцию белка.Каждая аминокислота присоединена к другой аминокислоте ковалентной связью, известной как пептидная связь, которая образуется в результате реакции дегидратации. Карбоксильная группа одной аминокислоты и аминогруппа входящей аминокислоты объединяются, высвобождая молекулу воды. Полученная связь представляет собой пептидную связь (рис. 3).
Продукты, образованные такими связями, называются пептидами. По мере того, как к этой растущей цепи присоединяется больше аминокислот, полученная цепь называется полипептидом. Каждый полипептид имеет свободную аминогруппу на одном конце.Этот конец называется N-концом или амино-концом, а другой конец имеет свободную карбоксильную группу, также известную как C или карбоксильный конец. Хотя термины полипептид и белок иногда используются взаимозаменяемо, полипептид технически представляет собой полимер аминокислот, тогда как термин белок используется для полипептида или полипептидов, которые объединились вместе, часто имеют связанные непептидные простетические группы, имеют различную форму. , и имеют уникальную функцию. После синтеза (трансляции) белков большинство белков модифицируются.Они известны как посттрансляционные модификации. Они могут подвергаться расщеплению, фосфорилированию или могут потребовать добавления других химических групп. Только после этих модификаций белок становится полностью функциональным.
Эволюционное значение цитохрома c
Цитохром c является важным компонентом цепи переноса электронов, частью клеточного дыхания, и обычно он находится в клеточной органелле, митохондрии. Этот белок имеет простетическую группу гема, а центральный ион гема попеременно восстанавливается и окисляется во время переноса электрона.Поскольку роль этого важного белка в производстве клеточной энергии имеет решающее значение, за миллионы лет он очень мало изменился. Секвенирование белков показало, что существует значительная гомология аминокислотных последовательностей цитохрома с среди различных видов; другими словами, эволюционное родство можно оценить путем измерения сходства или различий между последовательностями ДНК или белков различных видов.
Ученые определили, что цитохром с человека содержит 104 аминокислоты.Для каждой молекулы цитохрома с от разных организмов, которая была секвенирована на сегодняшний день, 37 из этих аминокислот появляются в одном и том же положении во всех образцах цитохрома с. Это указывает на то, что, возможно, был общий предок. При сравнении последовательностей белков человека и шимпанзе различий в последовательностях не обнаружено. Когда сравнивали последовательности человека и макаки-резуса, единственное обнаруженное различие заключалось в одной аминокислоте. В другом сравнении секвенирование человека и дрожжей показывает разницу в 44-м положении.
Структура белка
Как обсуждалось ранее, форма белка имеет решающее значение для его функции. Например, фермент может связываться со специфическим субстратом в сайте, известном как активный сайт. Если этот активный сайт изменяется из-за локальных изменений или изменений в общей структуре белка, фермент может быть неспособен связываться с субстратом. Чтобы понять, как белок приобретает свою окончательную форму или конформацию, нам необходимо понять четыре уровня структуры белка: первичный, вторичный, третичный и четвертичный.
Первичная структура
Уникальная последовательность аминокислот в полипептидной цепи — это ее первичная структура. Например, гормон поджелудочной железы инсулин имеет две полипептидные цепи, А и В, и они связаны между собой дисульфидными связями. N-концевой аминокислотой A-цепи является глицин, а C-концевой аминокислотой — аспарагин (рис. 4). Последовательности аминокислот в цепях A и B уникальны для инсулина.
Рис. 4. Инсулин бычьей сыворотки — это белковый гормон, состоящий из двух пептидных цепей: A (длиной 21 аминокислота) и B (длиной 30 аминокислот).В каждой цепи первичная структура обозначена трехбуквенными сокращениями, которые представляют названия аминокислот в порядке их присутствия. Аминокислота цистеин (cys) имеет сульфгидрильную (SH) группу в качестве боковой цепи. Две сульфгидрильные группы могут реагировать в присутствии кислорода с образованием дисульфидной (S-S) связи. Две дисульфидные связи соединяют цепи A и B вместе, а третья помогает цепи A складываться в правильную форму. Обратите внимание, что все дисульфидные связи имеют одинаковую длину, но для ясности показаны разные размеры.
Уникальная последовательность каждого белка в конечном итоге определяется геном, кодирующим этот белок. Изменение нуклеотидной последовательности кодирующей области гена может привести к добавлению другой аминокислоты к растущей полипептидной цепи, вызывая изменение структуры и функции белка. При серповидно-клеточной анемии цепь гемоглобина β (небольшая часть которой показана на рисунке 5) имеет единственную аминокислотную замену, вызывающую изменение структуры и функции белка.
Рис. 5. Бета-цепь гемоглобина имеет длину 147 остатков, однако единственная аминокислотная замена приводит к серповидно-клеточной анемии. В нормальном гемоглобине аминокислота в седьмом положении — глутамат. В серповидно-клеточном гемоглобине этот глутамат заменен валином.
В частности, аминокислота глутаминовая кислота замещена валином в цепи β . Примечательно, что молекула гемоглобина состоит из двух альфа-цепей и двух бета-цепей, каждая из которых состоит примерно из 150 аминокислот.Таким образом, молекула содержит около 600 аминокислот. Структурное различие между нормальной молекулой гемоглобина и молекулой серповидноклеточных клеток — что резко снижает продолжительность жизни — состоит в одной из 600 аминокислот. Что еще более примечательно, так это то, что эти 600 аминокислот кодируются тремя нуклеотидами каждая, а мутация вызвано одним изменением основания (точечной мутацией), 1 из 1800 оснований.
Рис. 6. В этом мазке крови, визуализированном при 535-кратном увеличении с помощью светлопольной микроскопии, серповидные клетки имеют форму полумесяца, а нормальные клетки имеют форму диска.(кредит: модификация работы Эда Усмана; данные шкалы от Мэтта Рассела)
Из-за этого изменения одной аминокислоты в цепи молекулы гемоглобина образуют длинные волокна, которые искажают двояковогнутые или дискообразные красные кровяные тельца и принимают форму полумесяца или «серпа», что закупоривает артерии (рис. 6). Это может привести к множеству серьезных проблем со здоровьем, таких как одышка, головокружение, головные боли и боли в животе у людей, страдающих этим заболеванием.
Вторичная структура
Локальное сворачивание полипептида в некоторых областях приводит к вторичной структуре белка.Наиболее распространены листовые структуры α -спираль и β -складки (рис. 7). Обе структуры представляют собой структуру α -спираль — спираль, форма которой удерживается водородными связями. Водородные связи образуются между атомом кислорода в карбонильной группе одной аминокислоты и другой аминокислотой, которая находится на четыре аминокислоты дальше по цепи.
Рис. 7. α-спираль и β-складчатый лист — это вторичные структуры белков, которые образуются из-за образования водородных связей между карбонильной и аминогруппой в основной цепи пептида.Некоторые аминокислоты имеют склонность к образованию α-спирали, а другие — к образованию β-складчатого листа.
Каждый виток альфа-спирали содержит 3,6 аминокислотных остатка. Группы R (вариантные группы) полипептида выступают из цепи α -спирали. В листе β с складками «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи. Группы R прикреплены к атомам углерода и проходят выше и ниже складок складки.Гофрированные сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе основной цепи пептида. Спиральные структуры α и складчатые листы β обнаружены в большинстве глобулярных и волокнистых белков, и они играют важную структурную роль.
Третичная структура
Уникальная трехмерная структура полипептида — это его третичная структура (рис. 8).Эта структура частично обусловлена химическими взаимодействиями в полипептидной цепи. В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, присутствующих в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Когда происходит сворачивание белка, гидрофобные группы R неполярных аминокислот лежат внутри белка, тогда как гидрофильные группы R лежат снаружи.Первые типы взаимодействий также известны как гидрофобные взаимодействия. Взаимодействие между боковыми цепями цистеина образует дисульфидные связи в присутствии кислорода, единственную ковалентную связь, образующуюся во время сворачивания белка.
Рис. 8. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Все эти взаимодействия, слабые и сильные, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он может больше не функционировать.
Четвертичная структура
В природе некоторые белки образованы из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру. Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как отдельный полипептид и теряет некоторые внутренние последовательности в присутствии посттрансляционной модификации после образования дисульфидных связей, которые удерживают вместе оставшиеся цепи. Шелк (волокнистый белок), однако, имеет складчатую структуру листа β , которая является результатом водородных связей между различными цепями.
Четыре уровня структуры белка (первичный, вторичный, третичный и четвертичный) показаны на Рисунке 9.
Рисунок 9.На этих иллюстрациях можно увидеть четыре уровня белковой структуры. (кредит: модификация работы Национального исследовательского института генома человека)
Денатурация и сворачивание белка
Каждый белок имеет свою уникальную последовательность и форму, которые удерживаются вместе за счет химических взаимодействий. Если белок подвержен изменениям температуры, pH или воздействию химикатов, структура белка может измениться, потеряв свою форму без потери своей первичной последовательности в так называемой денатурации.Денатурация часто обратима, поскольку первичная структура полипептида сохраняется в процессе, если денатурирующий агент удаляется, позволяя белку возобновить свою функцию. Иногда денатурация необратима, что приводит к потере функции. Одним из примеров необратимой денатурации белка является жарение яйца. Белок альбумина в жидком яичном белке денатурируется при помещении на горячую сковороду. Не все белки денатурируются при высоких температурах; например, бактерии, которые выживают в горячих источниках, содержат белки, которые функционируют при температурах, близких к температуре кипения.Желудок также очень кислый, имеет низкий pH и денатурирует белки как часть процесса пищеварения; однако пищеварительные ферменты желудка в этих условиях сохраняют свою активность.
Сворачивание белка имеет решающее значение для его функции. Первоначально считалось, что сами белки несут ответственность за процесс сворачивания. Только недавно было обнаружено, что часто они получают помощь в процессе сворачивания от белков-помощников, известных как шапероны (или шаперонины), которые связываются с целевым белком во время процесса сворачивания.Они действуют, предотвращая агрегацию полипептидов, составляющих полную структуру белка, и отделяются от белка, как только целевой белок сворачивается.
Чтобы получить дополнительную информацию о белках, просмотрите этот анимационный ролик под названием «Биомолекулы: белки».
Функция белков
Основные типы и функции белков перечислены в таблице 1.
| Таблица 1. Типы и функции белков | ||
|---|---|---|
| Тип | Примеры | Функции |
| Пищеварительные ферменты | Амилаза, липаза, пепсин, трипсин | Помощь в переваривании пищи за счет катаболизма питательных веществ до мономерных единиц |
| Транспорт | Гемоглобин, альбумин | Переносит вещества в крови или лимфе по телу |
| Строительный | Актин, тубулин, кератин | Создавать различные структуры, например цитоскелет |
| Гормоны | Инсулин, тироксин | Координировать деятельность различных систем организма |
| Оборона | Иммуноглобулины | Защитить организм от инородных патогенов |
| Сокращение | Актин, миозин | Эффект сокращения мышц |
| Хранилище | Запасные белки бобовых, яичный белок (альбумин) | Обеспечить питание на ранних этапах развития зародыша и проростка |
Два специальных и распространенных типа белков — это ферменты и гормоны. Ферменты , которые вырабатываются живыми клетками, являются катализаторами биохимических реакций (например, пищеварения) и обычно представляют собой сложные или конъюгированные белки. Каждый фермент специфичен для субстрата (реагента, который связывается с ферментом), на который он действует. Фермент может помочь в реакциях разложения, перегруппировки или синтеза. Ферменты, которые расщепляют свои субстраты, называются катаболическими ферментами, ферменты, которые строят более сложные молекулы из своих субстратов, называются анаболическими ферментами, а ферменты, влияющие на скорость реакции, называются каталитическими ферментами.Следует отметить, что все ферменты увеличивают скорость реакции и, следовательно, считаются органическими катализаторами. Примером фермента является амилаза слюны, которая гидролизует свою субстратную амилозу, компонент крахмала.
Гормоны — это химические сигнальные молекулы, обычно небольшие белки или стероиды, секретируемые эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение. Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови.
Белки имеют разную форму и молекулярную массу; некоторые белки имеют глобулярную форму, тогда как другие имеют волокнистую природу. Например, гемоглобин — это глобулярный белок, а коллаген, обнаруженный в нашей коже, — это волокнистый белок. Форма белка имеет решающее значение для его функции, и эта форма поддерживается многими различными типами химических связей. Изменения температуры, pH и воздействие химикатов могут привести к необратимым изменениям формы белка, что приведет к потере функции, известной как денатурация.Все белки состоят из 20 одних и тех же аминокислот по-разному.
Вкратце: Белки
Белки — это класс макромолекул, которые выполняют широкий спектр функций для клетки. Они помогают метаболизму, обеспечивая структурную поддержку и действуя как ферменты, переносчики или гормоны. Строительными блоками белков (мономеров) являются аминокислоты. Каждая аминокислота имеет центральный углерод, связанный с аминогруппой, карбоксильной группой, атомом водорода и R-группой или боковой цепью.Существует 20 обычно встречающихся аминокислот, каждая из которых отличается по группе R. Каждая аминокислота связана со своими соседями пептидной связью. Длинная цепь аминокислот известна как полипептид.
Белки подразделяются на четыре уровня: первичный, вторичный, третичный и (необязательно) четвертичный. Первичная структура — это уникальная последовательность аминокислот. Локальное сворачивание полипептида с образованием таких структур, как спираль α и складчатый лист β , составляет вторичную структуру.Общая трехмерная структура — это третичная структура. Когда два или более полипептида объединяются, чтобы сформировать полную структуру белка, такая конфигурация известна как четвертичная структура белка. Форма и функция белка неразрывно связаны; любое изменение формы, вызванное изменениями температуры или pH, может привести к денатурации белка и потере функции.
Проверьте свое понимание
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.В этой короткой викторине , а не засчитываются в вашу оценку в классе, и вы можете пересдавать ее неограниченное количество раз.
Используйте этот тест, чтобы проверить свое понимание и решить, следует ли (1) изучить предыдущий раздел дальше или (2) перейти к следующему разделу.
Функция ячейки
| SEER Training
Структурные и функциональные характеристики различных типов клеток определяются природой присутствующих белков.Клетки разных типов выполняют разные функции, потому что структура и функция клеток тесно связаны. Очевидно, что очень тонкая клетка не подходит для защитной функции. Костные клетки не имеют подходящей структуры для проведения нервных импульсов. Так же, как существует много типов клеток, существуют различные функции клеток. Обобщенные функции клеток включают перемещение веществ через клеточную мембрану, деление клеток с образованием новых клеток и синтез белка.
Перемещение веществ через клеточную мембрану
Выживание клетки зависит от сохранения разницы между внеклеточным и внутриклеточным материалом.Механизмы движения через клеточную мембрану включают простую диффузию, осмос, фильтрацию, активный транспорт, эндоцитоз и экзоцитоз.
Простая диффузия — это перемещение частиц (растворенных веществ) из области с более высокой концентрацией растворенных веществ в область с более низкой концентрацией растворенных веществ. Осмос — это диффузия молекул растворителя или воды через избирательно проницаемую мембрану. Фильтрация использует давление, чтобы проталкивать вещества через мембрану. Активный транспорт перемещает вещества против градиента концентрации из области более низкой концентрации в область более высокой концентрации.Он требует молекулы-носителя и использует энергию. Эндоцитоз относится к образованию пузырьков для переноса частиц и капель извне внутрь клетки. Секреторные пузырьки перемещаются изнутри наружу клетки путем экзоцитоза.
Отделение клеток
Деление клеток — это процесс образования новых клеток для роста, восстановления и замены в организме. Этот процесс включает деление ядерного материала и деление цитоплазмы. Все клетки тела (соматические клетки), за исключением тех, которые дают начало яйцеклеткам и сперматозоидам (гаметам), размножаются путем митоза.Яйцеклетки и сперматозоиды образуются в результате особого типа деления ядра, называемого мейозом, при котором количество хромосом уменьшается вдвое. Деление цитоплазмы называется цитокинезом.
Соматические клетки размножаются путем митоза, в результате чего образуются две клетки, идентичные одной родительской клетке. Интерфаза — это период между последовательными делениями клеток. Это самая длинная часть клеточного цикла. Последовательные стадии митоза — профаза, метафаза, анафаза и телофаза. Цитокинез, деление цитоплазмы, происходит во время телофазы.
Мейоз — это особый тип деления клеток, который происходит при производстве гамет или яйцеклеток и сперматозоидов. Эти клетки имеют только 23 хромосомы, половину числа хромосом, обнаруженных в соматических клетках, так что, когда произойдет оплодотворение, полученная клетка снова будет иметь 46 хромосом, 23 из яйцеклетки и 23 из сперматозоидов.
Репликация ДНК и синтез белков
Белки, которые синтезируются в цитоплазме, действуют как структурные материалы, ферменты, регулирующие химические реакции, гормоны и другие жизненно важные вещества.ДНК в ядре направляет синтез белка в цитоплазме. Ген — это часть молекулы ДНК, которая контролирует синтез одной конкретной белковой молекулы. Информационная РНК несет генетическую информацию от ДНК в ядре к участкам синтеза белка в цитоплазме.
кератина | Определение, функции и факты
Кератин , волокнистый структурный белок волос, ногтей, рогов, копыт, шерсти, перьев и эпителиальных клеток в самых внешних слоях кожи.Кератин выполняет важные структурные и защитные функции, особенно в эпителии. Также было обнаружено, что некоторые кератины регулируют ключевые клеточные активности, такие как рост клеток и синтез белка.
кератин
Микрофотография, полученная с помощью сканирующего электронного микроскопа, показывающая нити кератина в пёрышке, увеличенная в 186 раз.
Дженис Карр / Центры по контролю и профилактике заболеваний (CDC) (Номер изображения: 8673)
Подробнее по этой теме
Белок
: Кератин
Кератин , структурный белок эпителиальных клеток в самых внешних слоях кожи, был выделен из волос, ногтей…
Кератиновые белки можно подразделить на альфа-кератины и бета-кератины на основе их вторичной структуры (геометрии их полипептидных цепей, на которую влияет водородная связь). Альфа-кератины, которые содержатся в волосах, коже и шерсти млекопитающих, в основном имеют волокнистую и спиральную структуру. Напротив, бета-кератины, которые встречаются у птиц и рептилий, состоят из параллельных слоев полипептидных цепей. Аминокислотный состав кератина также варьируется в зависимости от ткани, в которой он находится, и его функции.Особое значение имеют остатки цистеина, которые становятся ковалентно связанными через дисульфидные связи, образуя цистины. Цистины ответственны за большую стабильность кератина.
Кератин полностью нерастворим в горячей или холодной воде и не подвергается действию протеолитических ферментов (ферментов, расщепляющих молекулы белка). Длина кератиновых волокон зависит от содержания в них воды: полная гидратация (примерно 16 процентов воды) увеличивает их длину на 10–12 процентов.
антитело | Определение, структура, функция и типы
Антитело , также называемое иммуноглобулином , защитный белок, вырабатываемый иммунной системой в ответ на присутствие чужеродного вещества, называемого антигеном.Антитела распознают и захватывают антигены, чтобы удалить их из организма. Организм считает антигенами широкий спектр веществ, включая болезнетворные организмы и токсичные вещества, такие как яд насекомых.
структура антитела
Четырехцепочечная структура молекулы антитела или иммуноглобулина. Базовая единица состоит из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей, которые удерживаются вместе дисульфидными связями, образуя гибкую Y-образную форму.Каждая цепь состоит из вариабельной (V) области и постоянной (C) области.
Британская энциклопедия, Inc.
Британская викторина
Медицинские термины и викторина для первопроходцев
Кто открыл основные группы крови? Что вызывает заболевание крови талассемией? Проверьте, что вы знаете о медицине, пройдя этот тест.
Когда чужеродное вещество попадает в организм, иммунная система может распознать его как чужеродное, потому что молекулы на поверхности антигена отличаются от молекул, обнаруженных в организме. Чтобы устранить захватчика, иммунная система задействует ряд механизмов, в том числе один из наиболее важных — производство антител. Антитела вырабатываются специальными лейкоцитами, называемыми В-лимфоцитами (или В-клетками). Когда антиген связывается с поверхностью В-клетки, он стимулирует В-клетку делиться и созревать в группу идентичных клеток, называемую клоном.Зрелые В-клетки, называемые плазматическими клетками, секретируют миллионы антител в кровоток и лимфатическую систему.
В-клетка человека
Электронная микрофотография в трансмиссии В-клетки или В-лимфоцита человека.
Национальный институт здравоохранения, NIAID
По мере циркуляции антител они атакуют и нейтрализуют антигены, идентичные тому, который вызвал иммунный ответ. Антитела атакуют антигены, связываясь с ними. Например, связывание антитела с токсином может нейтрализовать яд, просто изменив его химический состав; такие антитела называются антитоксинами.Присоединяясь к некоторым вторгающимся микробам, другие антитела могут сделать такие микроорганизмы неподвижными или предотвратить их проникновение в клетки организма. В других случаях антиген, покрытый антителом, подвергается химической цепной реакции с комплементом, который представляет собой ряд белков, обнаруженных в крови. Реакция комплемента может запускать лизис (взрыв) вторгающегося микроба или привлекать убивающие микробы клетки-поглотители, которые поглощают или фагоцитируют захватчика. После начала выработка антител продолжается в течение нескольких дней, пока не будут удалены все молекулы антигена.Антитела остаются в обращении в течение нескольких месяцев, обеспечивая расширенный иммунитет против этого конкретного антигена.
антиген; антитело; лимфоцит
Фагоцитарные клетки уничтожают вирусные и бактериальные антигены, поедая их, в то время как В-клетки вырабатывают антитела, которые связываются с антигенами и инактивируют их.
Encyclopædia Britannica, Inc.
В-клетки и антитела вместе обеспечивают одну из наиболее важных функций иммунитета, которая заключается в распознавании вторгающегося антигена и производстве огромного количества защитных белков, которые очищают организм, чтобы удалить все его следы. антиген.В совокупности В-клетки распознают почти неограниченное количество антигенов; однако по отдельности каждая В-клетка может связываться только с одним типом антигена. В-клетки различают антигены с помощью белков, называемых рецепторами антигенов, которые находятся на их поверхности. Рецептор антигена — это в основном белок антитела, который не секретируется, но прикреплен к мембране B-клетки. Все рецепторы антигена, обнаруженные на конкретной В-клетке, идентичны, но рецепторы, расположенные на других В-клетках, различаются. Хотя их общая структура схожа, различия заключаются в области, которая взаимодействует с антигеном — антигенсвязывающем или связывающем антитела сайте.Эта структурная вариация среди антигенсвязывающих сайтов позволяет различным В-клеткам распознавать разные антигены. Рецептор антигена фактически не распознает весь антиген; вместо этого он связывается только с частью поверхности антигена, областью, называемой антигенной детерминантой или эпитопом. Связывание рецептора с эпитопом происходит только в том случае, если их структуры комплементарны. Если да, то эпитоп и рецептор подходят друг к другу как две части головоломки, что необходимо для активации выработки антител В-клетками.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Каждая молекула антитела по существу идентична рецептору антигена В-клетки, которая ее произвела. Основная структура этих белков состоит из двух пар полипептидных цепей (длины аминокислот, связанных пептидными связями), которые образуют гибкую Y-образную форму. Ствол Y состоит из одного конца каждой из двух идентичных тяжелых цепей, в то время как каждое плечо состоит из оставшейся части тяжелой цепи плюс меньший белок, называемый легкой цепью.


