химический состав, свойства и значение для человеческого организма»
Доклад
по биологии
«Белки: химический состав, свойства
и значение для человеческого организма»
ученика 8 класса
ГБОУ ООШ пос. Аверьяновский
Григорьева Даниила
Руководитель: Величкина А.А.
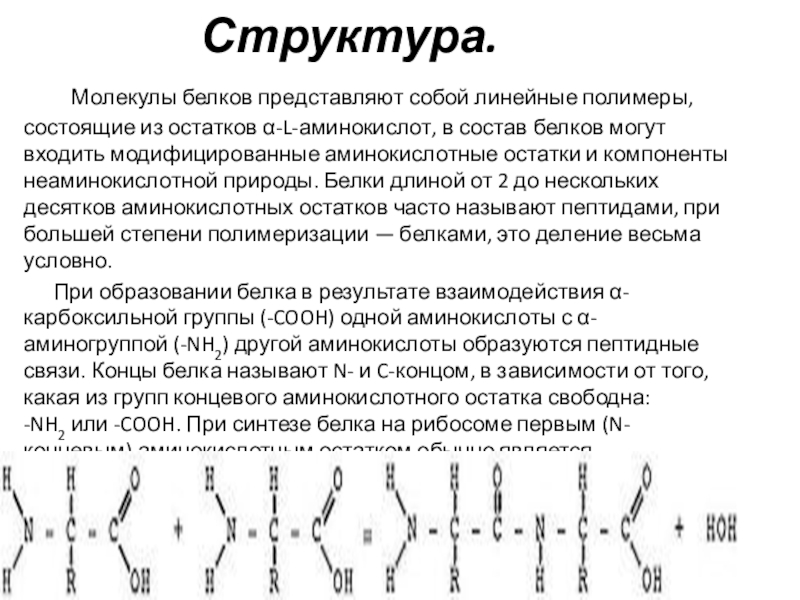
Белки — основная структурная единица клеток. Это полимеры, мономерами которых являются аминокислоты. В состав белков входит 20 типов аминокислот. В каждой из аминокислот содержится аминогруппа (-NH), карбоксильная группа (-СООН) и радикал (R). Строение радикалов отличается у различных аминокислот. Соединение аминокислот в молекуле белка происходит благодаря образованию пептидной связи: аминогруппа одной аминокислоты соединяется с карбоксильной группой другой аминокислоты.
Для каждого белка характерна своя форма.
Белки, состоящее из нескольких аминокислот, называют пептидом. Выделяют первичную, вторичную, третичную и четвертичную структуры белков. Первичная структура белка определяется последовательностью аминокислот в полипептидной цепи. Порядок чередования аминокислот в данной белковой молекуле определяет её особые физико-химические , биологические свойства.
Вторичная структура представляет собой белковую нить, закрученную в виде спирали. Между карбоксильными группами на одном витке спирали и аминогруппами на другом витке возникают водородные связи, которые при их большом числе обеспечивают образование прочной структуры.
Третичная структура — это клубок, или глобула, в который свертывается спираль. Он образуется в результате взаимодействия различных остатков аминокислот
Четвертичная структура характерна для сложных белков. Несколько глобул объединены вместе и удерживаются вместе благодаря ионным, водородным и другим связям. Белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Белок гемоглобин — состоит из четырех глобул, каждая из которых соединена с железосодержащим гемом.
Денатурация белков
Связи, поддерживающие пространственную структуру белка, довольно легко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яичный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за разрушения пространственной структуры белков альбумина в яичном белке и казеина.Такой процесс называется денатурацией. Денатурация белка — разрушение сил (связей), стабилизирующих четвертичную, третичную и вторичную структуры, приводящее к дезориентации конфигурации белковой молекулы и сопровождаемое изменением растворимости, вязкости, химической активности, характера рассеивания рентгеновских лучей, снижением или полной потерей биологической функции. В нашем примере в первом случае денатурацию вызывает нагревание, а во втором — значительное увеличение кислотности (в результате жизнедеятельности обитающих в молоке бактерий). При денатурации белок теряет способность выполнять присущие ему в организме функции. Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков. Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию. Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура. В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели. Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны.
При денатурации белок теряет способность выполнять присущие ему в организме функции. Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов является денатурация белков. Различают физические (температура, давление, механическое воздействие, ультразвуковое и ионизирующее излучения) и химические (тяжелые металлы, кислоты, щелочи, органические растворители, алкалоиды) факторы, вызывающие денатурацию. Обратным процессом является ренатурация, то есть восстановление физико-химических и биологических свойств белка. Иногда для этого достаточно удалить денатурирующий объект. Ренатурация невозможна, если затронута первичная структура. В природе почти ничего не происходит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению какой-то цели. Действительно, только белок с «правильной» пространственной структурой может обладать определёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
А делает он это с помощью всё тех же R-групп аминокислот. Оказывается, боковые цепи не только поддерживают «правильную» форму молекулы белка в пространстве. R-группы могут связывать другие органические и неорганические молекулы, принимать участие в химических реакциях, выступая, например, в роли катализатора.
Функции белков в организме
Белки — это важные компоненты всех живых организмов, они участвуют в жизнедеятельности клетки.
Каталитическая функция
Ферменты — это белки катализирующие разные реакции. Они способствуют расщеплению сложных молекул их образованию. Одна из важнейших функций белков. Обеспечивается белками — ферментами, которые ускоряют биохимические реакции, происходящие в клетках. Например, рибулезобифосфаткарбоксилаза катализирует фиксацию СО2 при фотосинтезе. Пластическая функция Белки — незаменимый строительный материал. Одной из важнейших функций белковых молекул является пластическая. Все клеточные мембраны содержат белок, роль которого здесь разнообразна. Количество белка в мембранах составляет более половины массы.Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов.
Количество белка в мембранах составляет более половины массы.Белки входят в состав клеточных структур, являются структурными компонентами биологических мембран и многих внутриклеточных органоидов.
Энергетическая функция. Белки могут служить источ ником энергии для клетки. При недостатке в организме yглеводов или жиров окисляются молекулы аминокислот. При расщеплении 1 г белков высвобождается 17,6 кДж энергии.
Транспортная функция Имея различные функциональные группы и сложное строение макромолекулы, белки связывают и переносят с током крови многие соединения. Это гемоглобин, переносящий кислород из легких к клеткам. В мышцах эту функцию берет на себя еще один транспортный белок — миоглобин.
Запасающая функция
Эту функцию осуществляют так называемые резервные белки, являющиеся источниками питания для развития плода, например белки яйца (овальбумины). Основной белок молока (казеин) также выполняет главным образом питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ. К запасным белкам относят ферритин — железо, овальбумин — белок яйца, казеин — белок молока, зеин — белок семян кукурузы. В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ. К запасным белкам относят ферритин — железо, овальбумин — белок яйца, казеин — белок молока, зеин — белок семян кукурузы. В организме животных белки, как правило, не запасаются, исключение: альбумин яиц, казеин молока. Но благодаря белкам в организме могут откладываться про запас некоторые вещества, например, при распаде гемоглобина железо не выводится из организма, а сохраняется, образуя комплекс с белком ферритином.
Регуляторная функция
Гормоны белковой природы принимают участие в регуляции процессов обмена веществ. Например, гормон инсулин регулирует уровень глюкозы в крови, способствует синтезу гликогена, увеличивает образование жиров из углеводов.
Двигательная функция
Сократительные белки актин и миозин обеспечивают сокращение мышц у многоклеточных животных. .
.
Энергетическая функция
При распаде 1 г белка до конечных продуктов выделяется 17,6 кДж. Сначала белки распадаются до аминокислот, а затем до конечных продуктов — воды, углекислого газа и аммиака. Однако в качестве источника энергии белки используются только тогда, когда другие источники (углеводы и жиры) израсходованы.
Сигнальная функция
В поверхностную мембрану клетки встроены молекулы белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды, таким образом осуществляя прием сигналов из внешней среды и передачу команд в клетку.
Защитная функция
В ответ на проникновение в организм чужеродных белков или микроорганизмов (антигенов) образуются особые белки — антитела, способные связывать и обезвреживать их. Фибрин, образующийся из фибриногена, способствует остановке кровотечений.
Значение белков в питании
Белок – необходимая составная часть продуктов питания. Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание
Проблема пищевого белка стоит очень остро. По данным Международной организации по продовольствию и сельскому хозяйству при ООН больше половины человечества не получает с пищей необходимого количества белка. Недостаток белка в пище вызывает тяжелое заболевание
Перечень продуктов, которые обеспечивают необходимое
количество белковых веществ.
|
Наименование продукта |
Количество |
Белковые вещества |
|
Ржаной хлеб |
250 |
12,8 |
|
Белый хлеб |
200 |
14,3 |
|
Крупа |
30 |
2,8 |
|
Макароны |
10 |
0,9 |
|
Мука пшеничная |
20 |
1,9 |
|
Мясо |
150 |
22,7 |
|
Рыба |
100 |
9,4 |
|
Молоко |
400 |
14,2 |
|
Творог, сыр |
70 |
11,2 |
|
Сметана |
30 |
0,6 |
|
Сливочное масло |
30 |
0,1 |
|
Яйца |
1/2шт. |
2,6 |
|
Картофель |
400 |
4,2 |
|
Овощи |
300 |
3,5 |
|
Фрукты, ягоды (свежие) |
200 |
0,8 |
|
Итого: |
102,0 |
В процессе пищеварения белки подвергаются гидролизу до аминокислот, которые и всасываются в кровь. Пищевая ценность белка зависит от их аминокислотного состава, содержания в них так называемых незаменимых аминокислот, не синтезирующихся в организмах (для человека незаменимы триптофан, лейцин, изолейцин, валин, треонин, лизин, метионин и фенилаланин).
В питательном отношении растительные белки менее ценны, чем животные; они беднее лизином, метионином и триптофаном, труднее перевариваются. Один из путей решения проблемы – добавление в растительную пищу синтетических аминокислот. Наряду с этим выводят новые сорта растений, содержащие гены, ответственные за синтез недостающих аминокислот.
Перспективно использование для этого методов генетической инженерии. Чрезвычайно важное значение имеет широкое внедрение промышленного микробиологического синтеза, например, выращивание дрожжей на гидролизном этиловом спирте, природном газе или нефти. Получаемые при этом белково-витаминные концентраты (БВК) используют в качестве добавок к корму сельскохозяйственных животных.
Белок – неотъемлемая составляющая нашего организма, нарушение которой может вызвать его разрушение. Необходимость постоянного получения белковой пищи человеком вызвано наличием у белка определенных функций, которые необходимы живому организму для его развития, размножения и осуществления жизнедеятельности.
На долю белка приходится не менее 50 % сухой массы органических соединений животной клетки. Функционирование белка лежит в основе важнейших процессов жизнедеятельности организма. Обмен веществ (пищеварение, дыхание и др.), мышечное сокращение, нервная проводимость и жизнь клетки в целом неразрывно связаны с активностью ферментов – высокоспецифических катализаторов биохимических реакций, являющихся белками. Основу костной и соединительной тканей, шерсти, роговых образований составляют структурные белки. Они же формируют остов клеточных органелл (митохондрий, мембран и др.). Расхождение хромосом при делении клетки, движение жгутиков, работа мышц животных и человека осуществляются по единому механизму при посредстве белков сократительной системы. Важную группу составляют регуляторные белки, контролирующие биосинтез белка, и нуклеиновых кислот.
Белки играют важнейшую роль в жизнедеятельности всех организмов. При пищеварении белковые молекулы перевариваются до аминокислот, которые, будучи хорошо растворимы в водной среде, проникают в кровь и поступают во все ткани и клетки организма. Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
Здесь наибольшая часть аминокислот расходуется на синтез белков различных органов и тканей, часть — на синтез гормонов, ферментов и других биологически важных веществ, а остальные служат как энергетический материал.
Белки — важнейшие компоненты пищи человека и корма животных. Совокупность непрерывно протекающих химический превращений белков занимает ведущее место в обмене веществ организмов. Скорость обновления белков у живых организмов зависит от содержания белков в пище, а также его биологической ценности, которая определяется наличием и соотношением незаменимых аминокислот.
Белки растений беднее белков животного происхождения по содержанию незаменимых аминокислот, особенно лизина, метионина, триптофана. Белки сои и картофеля по аминокислотному составу наиболее близки белкам животных. Отсутствие в корме незаменимых аминокислот приходит к тяжёлым нарушениям азотистого обмена. Поэтому селекция зерновых культур направлена, в частности, и на повышение качества белкового состава зерна.
Сколько аминокислот входит в состав белков, как они называются?
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сколько аминокислот входит в состав белков, как они называются?
Белок является главным строительным материалом для организма. Его структура сложная и многоступенчатая. Какие аминокислоты входят в его состав?
Его структура сложная и многоступенчатая. Какие аминокислоты входят в его состав?
Белок очень важен для организма, так как является строительным материалом. Его основой являются аминокислоты. Эти вещества отвечают за разные функции и нужны для поддержания нормального состояния организма.
Основные свойства аминокислот
Аминокислоты обладают следующими свойствами:
- Быстро и хорошо растворяются в жидкой среде.
- По форме напоминают кристаллы.
- При воздействии высоких температур могут расплавиться.
- Имеют некоторые признаки кислот и оснований одновременно.
- Получаются в процессе белкового гидролиза.
Для чего аминокислоты нужны организму?
Биологическая роль аминокислот заключается в следующем:
- обеспечивают правильную работу иммунной системы;
- синтезируют глюкозу и участвуют в углеводном обмене;
- выступают в роли строительного материала для мышц и сухожилий;
- помогают спортсменам при наборе мышечной массы;
- поддерживают здоровье соединительных тканей;
- помогают поврежденным тканям быстрее восстановиться;
- участвуют в выработке энергии;
- выводят из организма вредные вещества и токсины;
- участвуют в образовании гормонов;
- поддерживают печень в порядке;
- помогают поддерживать нормальную работу головного мозга;
- обеспечивают бодрость духа и хорошее настроение;
- повышают работоспособность человека и его творческий потенциал;
- помогают нервным клеткам защититься от вредного воздействия алкогольных напитков;
- улучшают психическое здоровье человека;
- участвуют в жировом обмене;
- поддерживают работу органов желудочно-кишечного тракта;
- регулируют работу щитовидной железы;
- поддерживают в норме массу тела;
- замедляют естественные процессы старения.

Сколько аминокислот входит в состав белков?
В состав белков входят следующие незаменимые аминокислоты:
- Лейцин, нужный для набора мышечной массы и контроля массы тела.
- Изолейцин, стимулирующий выделение энергии.
- Лизин, отвечающий за укрепление иммунитета и повышение защитных сил организма.
- Фенилаланин, обеспечивающий правильную работу центральной нервной системы.
- Метионин, ответственный за эффективное и быстрое сжигание подкожного жира.
- Треонин, оказывающий положительное влияние на центральную нервную систему.
- Триптофан, формирующий полезные для жизнедеятельности гормоны.
- Валин, ускоряющий процессы обмена веществ.
Также белок образуют несколько заменимых аминокислот. К ним относятся:
- Аланин, необходимый для процессов углеводного обмена и выведения из организма токсических веществ.

- Аспарагиновая кислота, обеспечивающая человеку энергичность и прилив бодрости.
- Аспарагин, обеспечивающий работу центральной нервной системы и головного мозга.
- Гистидин, вырабатывающий кровяные тельца красного цвета.
- Серин, отвечающий за правильную и эффективную работу головного мозга и за протекание когнитивных процессов.
- Цистеин, подающий в организм кератин.
- Аргинин, оздоравливающий кожу, кости, мышечную ткань и сухожилия.
- Глютаминовая кислота, без которой невозможна нормальная работа головного и спинного мозга.
- Глютамин, предотвращающий атрофию мышечных волокон.
- Глицин, ускоряющий процессы свертываемости крови.
- Пролин, стимулирующий выработку коллагена.
- Тирозин, поддерживающий в норме аппетит и артериальное давление.
Внимание! В состав белков входят разные аминокислоты, заменимые и незаменимые.Они обеспечивают правильное формирование протеинов и эффективную работу всего организма.
Отказ от ответсвенности
Обращаем ваше внимание, что вся информация, размещённая на сайте
Prowellness предоставлена исключительно в ознакомительных целях и не является персональной программой, прямой рекомендацией к действию или врачебными советами. Не используйте данные материалы для диагностики, лечения или проведения любых медицинских манипуляций. Перед применением любой методики или употреблением любого продукта проконсультируйтесь с врачом. Данный сайт не является специализированным медицинским порталом и не заменяет профессиональной консультации специалиста. Владелец Сайта не несет никакой ответственности ни перед какой стороной, понесший косвенный или прямой ущерб в результате неправильного использования материалов, размещенных на данном ресурсе.
Сухой яичный белок.
 Состав сухого яичного белка
Состав сухого яичного белка
Свойства сухого яичного белка
Пищевая ценность и состав |
Витамины |
Минеральные вещества
Сколько стоит сухой яичный белок ( средняя цена за 1 кг.)?
Москва и Московская обл.
760 р.
Куриные яйца считаются одним из самых востребованных продуктов питания в кулинарии. Их яиц можно приготовить колоссальное количество разнообразных блюд. Помимо того, яйца считаются незаменимым компонентов многих кулинарных изделий из мяса, рыбы, а также овощей. Особое место куриные яйца занимают в хлебопекарном деле, а также в кондитерском производстве.
Куриное яйцо — это белок, а также желток. Состав яичного белка практически целиком состоит из воды и лишь 10% приходится на белок. При всей важности куриных яиц продукт обладает рядом существенных минусов, которые негативно сказываются прежде всего на промышленном производстве кулинарных изделий. Яйца — это достаточно хрупкий продукт питания, который сложно транспортировать.
Яйца — это достаточно хрупкий продукт питания, который сложно транспортировать.
Чтобы избежать нежелательных затрат производители продуктов питания придумали такие продукты как сухой яичный белок, желток, меланж, а также яичный порошок. Выше перечисленные продукты питания представляют собой концентраты, полученные при сушке куриных яиц. Сухой яичный белок получают в процессе переработки куриных яиц.
На первоначальном этапе яйца подвергаются механической обработке и высвобождаются от скорлупы. Далее происходит отделение яичного белка от яичного желтка. На последнем этапе производства сухого яичного белка белковая масса помещается в вакуумно-распылительную сушку и доводится до кондиции порошка.
Состав сухого яичного белка
Стоит отметить, что состав сухого яичного белка содержит значительное количество полезных для человеческого организма веществ. Сухой яичный белок содержит в своем составе витамины группы В, РР, а также Н. Помимо того, состав сухого яичного белка обогащен магнием, серой, калием, кальцием, натрием, а также железо, молибден, йод и цинк.
Важно отметить, что помимо выше перечисленных компонентов в составе сухого белка содержится незаменимые аминокислоты. Сухой яичный белок используют не только в кулинарных целях, а также как компонент спортивного питания. Всего один килограмм сухого яичного белка может заменить 315 белков от свежих куриных яиц.
Благодаря особенностям биологического строения куриного яйца, сухой яичный белок относится к продуктам с так называемой средней скоростью усвоения. Это означает, что сухой яичный белок можно употреблять в пищу в течении дня или же на ужин.
Наиболее часто сухой белок используют при производстве кондитерских изделий, а кроме того выпечки. лучше всего такой полуфабрикат как сухой яичный белок подойдет для приготовления муссов, а также тортов и пирожных мерингов. Сухой яичный белок помогает придать готовым кулинарным изделиям воздушную консистенцию, а так же увеличивает питательные показатели изделия.
Калорийность сухого яичного белка 350 кКал
Энергетическая ценность сухого яичного белка (Соотношение белков, жиров, углеводов — бжу):
Белки: 82. 4 г. (~330 кКал)
4 г. (~330 кКал)
Жиры: 1.8 г. (~16 кКал)
Углеводы: 1.2 г. (~5 кКал)
Энергетическое соотношение (б|ж|у): 94%|5%|1%
Рецепты с сухим яичным белком
Пропорции продукта. Сколько грамм?
в 1 чайной ложке 4 грамма
в 1 столовой ложке 14 граммов
в 1 упаковке 1000 граммов
Пищевая ценность и состав сухого яичного белка
НЖК — Насыщенные жирные кислоты
0.5 г
Моно- и дисахариды
1.2 г
Витамины
Минеральные вещества
Аналоги и похожие продукты
Просмотров: 19843
Сухой яичный белок: состав и полезные свойства
Сухой яичный белок производители получают путем сушки яиц, во время которой яйцо разделяют на полезные составляющие. Срок годности продукта увеличивается, а полезные свойства остаются прежними. Чаще всего продукт применяют в кондитерском деле, на хлебопекарнях.
Срок годности продукта увеличивается, а полезные свойства остаются прежними. Чаще всего продукт применяют в кондитерском деле, на хлебопекарнях.
Интересно знать! 1 кг сухого белка по питательности и объемному замещению равноценен 316 куриным яйцам.
Состав сухого яичного белка
В составе содержится много протеина (белка), кальция и магния, натрия, йода и цинка.
Также в сухом белке есть витамины группы В, РР, Н, и незаменимые аминокислоты, восполняющие суточную потребность организма человека на 25%.
Совет! Сухой белок относится к группе продуктов, отличающихся средней скоростью усвоения. Поэтому рекомендуется употреблять блюда с этим продуктом в течение всего дня.
Вред и польза сухого яичного белка
В сухом белке повышенная концентрация полезных и питательных веществ, поэтому он наделен рядом таких полезных свойств:
- Высокое содержание протеина, поэтому высушенный белок часто можно встретить в отделе спортивного питания.
 Протеин – это строительный материал для мышц, поэтому его концентрация в пище при занятиях спортом должна быть повышена.
Протеин – это строительный материал для мышц, поэтому его концентрация в пище при занятиях спортом должна быть повышена. - Набор минеральный веществ ускоряет метаболизм, укрепляет кости и зубы, способствует нормальному состоянию женщины и плода во время беременности. А цинк необходим для мужского здоровья.
«Плохих» характеристик у сухого белка практически нет.
Единственная – это высокая калорийность.
Сухой яичный белок в кулинарии
Для кулинарии сухой белок стал настоящей находкой, ведь раньше на производствах портились сотни яиц. Изобретение технологии сушки белка решило эту проблему раз и навсегда, и продукт стал главным ингредиентом практически всех мучных и хлебобулочных изделий.
Важно! Сухой яичный белок получают путем очищения яиц и их разделения на белок и желток.
Белок в жидком виде подвергается термической обработке, после обрабатывается механически энзимами. Следующий процесс заключается в сушке, пастеризации и распылении.
Сухой белок отличается хорошей взбиваемостью, которая часто превышает результаты взбивания свежих белков. Он удерживает сахар, поэтому используется для промышленного изготовления кремов и суфле, пирожных, зефира, различных эмульгаторов.
Важно! Сухой белок не только придает блюдам пышность, но и повышает их пищевую ценность.
Энергетическая ценность продукта (Соотношение белков, жиров, углеводов):
Белки: 82.4г. ( ∼ 329,6 кКал)
Жиры: 1.8г. ( ∼ 16,2 кКал)
Углеводы: 1.2г. ( ∼ 4,8 кКал)
Энергетическое соотношение (б|ж|у):
94%
| 4%
| 1%
Смесь Nestle Alfare для детей с аллергией на коровий белок 400г
Alfaré (Алфаре) — специализированная смесь на основе высокогидролизованного белка молочной сыворотки для лечения аллергии на белок коровьего молока (АБКМ) у детей с симптомами расстройства ЖКТ или поливалентной пищевой аллергии.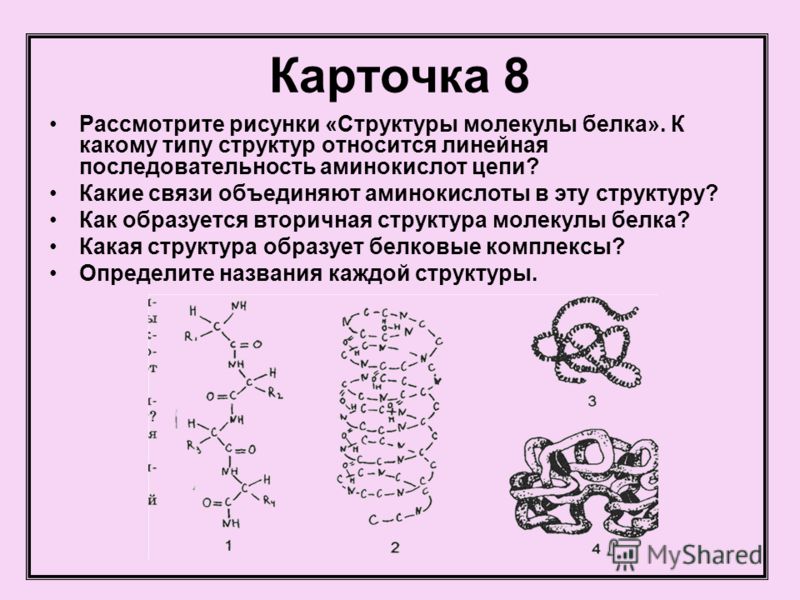 Сухая смесь применяется в рамках диетотерапии при различных формах нарушения переваривания и всасывания пищи, сопровождающихся нарушениями со стороны желудочно-кишечного тракта, включая аллергию к белку коровьего молока, хроническую диарею и мальабсорбцию, и может использоваться с рождения.
Сухая смесь применяется в рамках диетотерапии при различных формах нарушения переваривания и всасывания пищи, сопровождающихся нарушениями со стороны желудочно-кишечного тракта, включая аллергию к белку коровьего молока, хроническую диарею и мальабсорбцию, и может использоваться с рождения.
- Продукт отличается чрезвычайно низким аллергическим потенциалом и содержит все питательные вещества, необходимые для нормального роста и развития детей с пищевой непереносимостью, мальабсорбцией и повреждением слизистой кишечника.
- Продукт не содержит лактозу и сахарозу и легко переваривается даже у грудных детей с тяжелым поражением слизистой.
- Смесь Alfaré также обладает противовоспалительным действием за счет добавки жирных кислот.
- В продукте увеличено содержание многих макро- и микронутриентов по сравнению с обычными детскими смесями, за счет чего смесь способствует коррекции недостаточности питания, восстановлению темпов роста и регенерации тканей.
Состав: Мальтодекстрин, ферментативно гидролизованный белок молочной сыворотки, растительные масла (пальмовый олеин, подсолнечное масло, низкоэруковое рапсовое масло, масло семян черной смородины), среднецепочечные триглицериды, картофельный крахмал, минеральные вещества (кальция глицерофосфат, магния хлорид, натрия хлорид, калия фосфат, калия хлорид, кальция фосфат, железа сульфат, цинка сульфат, меди сульфат, калия йодид, кальция хлорид, марганца сульфат), эмульгатор (Е472с), витамины (С, Е, ниацин, пантотеновая кислота, В2, А, В6, В1, D3, К1, фолиевая кислота, В12, биотин), рыбий жир, таурин, холин битартрат, мио-инозитол, нуклеотиды, (Цитидинмонофосфат, Уридинмонофосфат, Аденозинмонофосфат, Гуанозинмонофосфат), L — картинин.
Сколько аминокислот входит в состав белка
Опубликовано: 20.03.2020Время на чтение: 27 минут5905
Какие аминокислоты входят в состав белка
Аминокислоты, или аминокарбоновые, кислоты (АМК) — очень крупная группа соединений. Известное на сегодня количество таких веществ, существующих природе, достигает пятисот. Но в клетках и тканях человеческого организма их намного меньше: порядка 170. А в составе белка, ответственного за передачу генетической информации, совсем «мало» — двадцать три. Наиболее важными для организма человека являются следующие аминокарбоновые соединения:
- аланин,
- аргинин,
- аспарагин,
- валин,
- гамма-аминомасляная кислота,
- глютаминовая кислота,
- глютамин,
- глютатион,
- глицин,
- гистидин,
- диметилглицин,
- изолейцин,
- карнитин,
- лейцин,
- лизин,
- метионин,
- орнитин,
- пролин,
- серин,
- таурин,
- треонин,
- триптофан,
- тирозин,
- фенилаланин,
- цитруллин,
- цистеин и цистин.

Каждая аминокислота играет собственную роль как в синтезе белка, так и в других процессах, определяющих здоровье человека, его уровень энергии, умственные способности и пр.
Как посчитать количество
Сколько аминокислот в белке, определяется самим белком. В полноценном протеине (он так и называется — полноценный) обнаруживается весь аминокарбоновый состав. В неполноценном отсутствует несколько АМК. Кроме того, белки могут быть простыми (в их состав входят только аминокислоты) и сложными (аминокислотный «комплекс» дополнен другими химическими соединениями). Но во всех случаях именно аминокарбоновые кислоты являются основой для построения молекулы протеина, и без этих веществ невозможна правильная работа организма.
Заменимые и незаменимые аминокислоты
Весь «набор» аминокислот можно распределить в такие группы:
- Заменимые. Эти вещества, входящие в состав белка, могут синтезироваться в организме человека из веществ, которые поступают вместе с пищей.
 При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент.
При высоком расходе той или иной заменимой АМК активируются механизмы, создающие достаточное количество этой аминокислоты из других веществ, доступных на данный момент. - Незаменимые. Эти аминокислоты неспособны синтезироваться организмом и могут поступать в него только в готовом виде, вместе с пищей.
- Условно-незаменимые. В эту группу входят аминокислоты, которые в норме синтезируются в организме человека. Но после перенесенных заболеваний, при высоком уровне стресса, проживании в неблагоприятной экологической обстановке и др. их синтез резко снижается или прекращается вовсе.
Роль аминокислот в организме
Когда речь заходит о белке в организме человека, с ним ассоциируют набор мышечной массы. Соответственно, белок рассматривают в качестве «топлива» для мышц. Но это лишь одна из функций протеина, который в теле человека представлен огромным разнообразием. Белок — это комплекс аминокислот, соединенных между собой пептидами. В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
В зависимости от того, как АМК распределены в молекуле протеина и каким образом они соединены, меняется структура белка, его функции и другие характеристики. Возможно, кого-то это удивит, но под протеинами следует понимать не только «кирпичики» для набора мышечной массы, но и:
- коллаген — естественный «каркас», обеспечивающий упругость кожи, входящий в состав хрящевой ткани и пр.;
- нейромедиаторы — соединения, которые обеспечивают правильную интерпретацию нервных сигналов и их передачу между всеми органами и тканями;
- гормоны — вещества, регулирующие все функции организма: от работы репродуктивной системы до психических реакций.
Этот список можно еще продолжать.
Причины дефицита аминокислот
Даже при современном уровне доступности любой информации продолжает существовать заблуждение о том, что весь набор аминокислот можно получить только из пищи животного происхождения.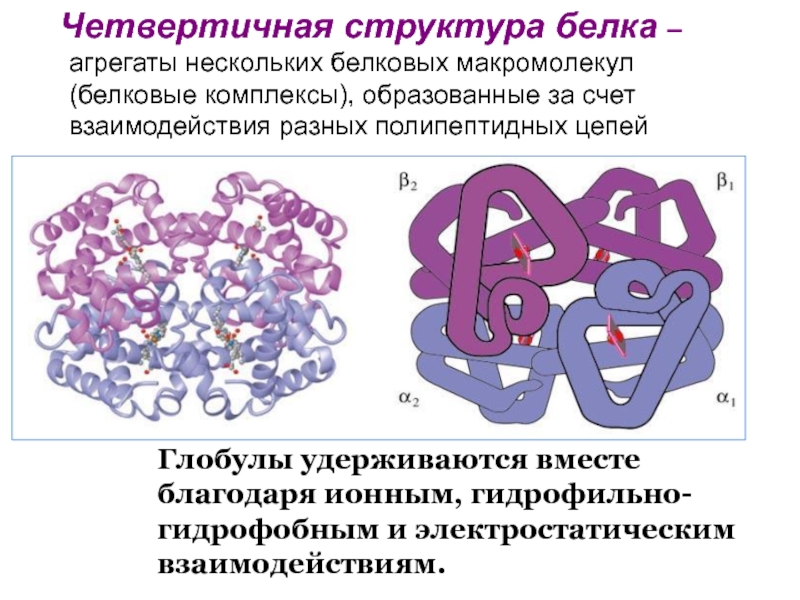 На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
На самом деле, аминокарбоновые кислоты синтезируется и в растениях. Но биодоступность (усвояемость) таких АМК немного ниже, чем их продуктов животного происхождения.
Вегетарианство. Людям, придерживающимся принципов веганства, следует более тщательно контролировать свой рацион, чтобы гарантированно получать из пищи незаменимые аминокислоты.
Высокие нагрузки. Еще одна группа риска — люди, подвергающиеся чрезмерным физическим или психическим нагрузкам. При таких обстоятельствах расход аминокислот существенно выше, так как им приходится восстанавливать клеточные и тканевые ресурсы, израсходованные во время тренировок или стресса.
Некоторые заболевания. Они также могут быть причиной дефицита аминокислот. В частности, нарушения всасывания питательных веществ, при которых определенные вещества, потребляемые вместе с пищей, проходят через организм «транзитом» и неспособны принять участие в синтезе аминокислот или восполнении их дефицита.
Как предупредить дефицит аминокислот
Контроль над сбалансированным и регулярным питанием — основа поддержания аминокислотного состава на нужном уровне. Но это не всегда возможно, и вот почему. Если использовать только продукты питания, невозможно положить в тарелку только аминокислоты. Приходится учитывать еще и калорийность приема пищи, содержание в блюде жиров, углеводов, клетчатки и пр. В итоге число потребленных аминокислот может ограничиваться двумя-тремя, но быть серьезно «обремененным» лишними калориями. Эта проблема особенно актуальна для спортсменов, людей, следящих за фигурой, и тех, кому жирная или калорийная пища нежелательна с точки зрения здоровья.
Niteworks от HERBALIFE Nutrition
В описанных выше ситуациях на помощь могут прийти специальные добавки, например Niteworks от HERBALIFE Nutrition*. В состав продукта входят аминокислоты, поддерживающие правильную работу сердца и сосудов, повышающие эластичность стенок сосудов. Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Одна порция напитка, приготовленного с этой пищевой добавкой, способна поддерживать уровень ряда важных аминокислот на нормальном уровне в течение суток*.
Как проявляется дефицит
При дефиците аминокислот в организме могут возникать следующие неприятные симптомы:
- быстрая умственная и физическая утомляемость;
- мышечная слабость;
- боль в суставах, нарушение их подвижности;
- отеки;
- «необъяснимые» приступы голода;
- снижение остроты зрения;
- ухудшение состояния волос, ногтей, кожи.
На перечисленные симптомы особенно важно обратить внимание, если вы длительное время придерживаетесь ограничительной диеты, испытываете стрессы, подвергаетесь тяжелым физическим нагрузкам, перенесли какое-либо заболевание. Но во всех случаях следует предварительно проконсультироваться с врачом, так как признаки белкового дефицита неспецифичны и схожи с симптомами ряда заболеваний.
* БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
Узнайте, как питаться
сбалансированно
и контролировать
свой весУзнать больше
2020-03-20
Автор: Будь в Форме
Оцените материал!
Добавить отзыв
Отзывы
СветЛана
| 19.12.2020 21:52
Полезная информация
Нут VS Куриная грудка – 4fresh блог
Существует множество споров о неполноценности растительного белка. Одни утверждают, что отсутствие мяса в рационе — вредит здоровью, другие являются вегетарианцами от рождения и прекрасно себя чувствуют без животного белка в рационе.
Мы провели небольшое исследование, итоги которого будет полезно знать и тем, кто занимается спортом, и вегетарианцам, и любому, кто просто старается придерживаться здорового питания и хочет разнообразить свой рацион.
В поисках идеального источника белка
Стоит ли говорить о том, насколько важен белок для организма человека? Он участвует в образовании ферментов, гормонов, входит в состав крови, является структурным материалом наших тканеи и клеток,и именно из белка состоят антитела, которые предотвращают размножение вирусов в нашем организме и формируют иммунитет. Поэтому очень важно, чтобы наше питание было качественным, сбалансированным с достаточным количеством белка и правильными пропорциями аминокислот.
Белки состоят из аминокислот, которые в свою очередь бывают заменимыми и незаменимыми. Полноценным считается тот белок, в котором есть все незаменимые аминокислоты, то есть те, которые наш организм вырабатывать самостоятельно не может.
Идеальный белок представляет собой такое соотношение незаменимых аминокислот, которое позволяет организму без проблем обновлять все внутренние структуры.
Источниками животного белка для человека являются все виды мяса, рыба, морепродукты, яйца, нежирный сыр, творог и другие молочные продукты. Источниками растительного белка — цельнозерновые злаковые продукты, орехи, тофу и бобовые. В бобовых белка в 2 раза больше чем в злаковых, также они обладают высокой усвояемостью (80%) и характеризуются наилучшим аминокислотным составом среди всех растительных продуктов.
Источниками растительного белка — цельнозерновые злаковые продукты, орехи, тофу и бобовые. В бобовых белка в 2 раза больше чем в злаковых, также они обладают высокой усвояемостью (80%) и характеризуются наилучшим аминокислотным составом среди всех растительных продуктов.
Многие считают, что большинство продуктов животного происхождения имеют полноценный аминокислотный профиль, а вот растительная пища очень часто имеет дефицит по той или иной аминокислоте и не может быть основным источником белка. Но так ли это?
Нут VS Курица
Для сравнения, в качестве животного белка мы взяли куриную грудку, в качестве растительного — нут.
Раунд 1: КБЖУ
В первую очередь, сравним основные нутриенты и калорийность на 100 гр сырого продукта:
|
КБЖУ |
Куриная грудка |
Нут |
|
Белки |
19 |
19,3 |
|
Жиры |
2,59 |
6,04 |
|
Углеводы |
3 |
60,65 |
|
из них пищевые волокна (клетчатка) |
1.  3 3
|
17,4 |
|
Калорийность |
180 |
364 |
Для баланса БЖУ на прием пищи к курице можно добавить клетчатки и углеводов, например в виде свежих овощей и гарнира.
Из нута же достаточно сделать салат и заправить его оливковым маслом, чтобы компенсировать низкое количество жиров.
Как мы видим, по количеству белка на 100 гр, нут не уступает курице. Однако, обращаем внимание, что 100 грамм сырого нута — это довольно большая порция в вареном виде, поэтому не стоит пугаться такого количества углеводов, в тоже время как и радоваться практически одинаковому количеству белка 🙂 В любом случае, источников и того, и другого, должно быть несколько.
Раунд 2. Аминокислотный профиль
Теперь сравним аминокислотный состав на 100 г. сырого продукта. В таблице представлены все незаменимые аминокислоты.
|
Аминокислота |
Куриная грудка |
Нут |
|
Аргинин |
0.9 |
1,82 |
|
Валин |
0.69 |
0,81 |
|
Гистидин |
0.45 |
0,53 |
|
Изолейцин |
0.64 |
0,83 |
|
Лейцин |
1.07 |
1,37 |
|
Лизин |
1.03 |
1,29 |
|
Метионин+цистеин |
0.5 |
0,51 |
|
Треонин |
0.  59 59
|
0,72 |
|
Триптофан |
0.2 |
0,19 |
|
Фенилаланин+Тирозин |
0.89 |
1,51 |
Мы видим, все незаменимые аминокислоты присутствуют в обоих продуктах. Какие то в большей степени, какие то в меньшей. Это является подтверждением того, что растительная пища также, как и животная может иметь полный аминокислотный профиль.
Но не стоит забывать, что для того, чтобы наш организм не испытывал дефицита в какой-либо аминокислоте, в течение дня нужно стараться наедать белок из разных источников. При это не важно — мясоед вы или вегетарианец.
Раунд 3. Витамины и минералы
Витаминно-минеральный состав на 100 гр готового продукта:
|
Куриная грудка |
Нут |
|
|
Витамин A |
- |
3 мкг |
|
Витамин D |
0,4 мкг |
- |
|
Витамин E |
0,4 мг |
0,82 мг |
|
Витамин K |
4,5 мкг |
9 мкг |
|
С |
- |
4 мг |
|
B1 |
0,26 мг |
0,48 мг |
|
B2 |
0,08 мг |
0,21 мг |
|
B4 |
39,4 мг |
95,2 мг |
|
B5 |
0,92 мг |
1,59 мг |
|
B9 |
8 мкг |
557 мкг |
|
B12 |
0,34 мкг |
- |
|
PP |
14,37 мг |
6,16 мг |
|
Калий |
218 мг |
875 мг |
|
Кальций |
18 мг |
105 мг |
|
Магний |
24 мг |
115 мг |
|
Натрий |
457 мг |
24 мг |
|
Фосфор |
210 мг |
366 мг |
|
Железо |
1,14 мг |
6,24 мг |
|
Марганец |
0,23 мг |
2,2 мг |
|
Медь |
0,23 мг |
0,85 мг |
|
Селен |
24,6 мкг |
8,2 мкг |
|
Цинк |
0,77 мг |
3,43 мг |
Как мы видим из таблицы, нут во многом опережает курицу по ряду витаминов и минералов.
Однако, чаще всего возникают споры по поводу витамина B12 в растительной диете.
Действительно, почти все источники витамина B12 имеют животное происхождение. Если вы избегаете продуктов животного происхождения, то без соответствующих добавок может появиться дефицит B12. Поэтому если вы веган, стоит принимать его дополнительно. В растительных источниках этот витамин можно найти в водорослях и тофу.
Заключение
Употреблять в пищу мясо или нет — выбор каждого. Все больше различных исследований указывают на то, что необходимо если не исключить, то хотя бы уменьшить количество животного белка в рационе, чтобы снизить потенциальные канцерогенные риски.
Об этом можно спорить много, мы же в нашем сравнении хотели показать, что не нужно зацикливаться на мясе, как на единственном источнике белка. Добавляйте в свой рацион разные виды белка и не бойтесь экспериментировать. А если вы любите мясо, то старайтесь выбирать качественные, фермерские продукты.
Растительный белок — это полноценный белок, но при грамотном сочетании продуктов. Им может полностью заменить мясо и вегетарианец и спортсмен, которому необходимо правильно обслуживать тренировочную активность.
А если вы задумываетесь о вегетарианстве, то не нужно бояться, что вам не будет хватать белка и других полезных веществ. Почему бы не провести эксперимент? Попробуйте, это очень интересный опыт. Вы заметите, что вкусовые рецепторы начинают по-другому воспринимать вкус привычной еды, откроете для себя множество новых продуктов и блюд, о которых даже не подумали бы раньше. Стремитесь формировать мнение, опираясь на собственный опыт и ощущения.
Автор: Светлана Шведова
Если вам понравилась эта статья, не пропустите:
Состав и структура белка
— Biology LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Вторичная структура полипептидной цепи
- График Рамачандрана
- α-Спирали
- α-спираль
- β-ПЛИТИРОВАННЫЕ ЛИСТЫ
- α-ПЛИТИРОВАННЫЕ ЛИСТЫ
- кодирует третичную структуру
- 10 Четвертичная структура цепочка одномерных аминокислот, которые переводятся в трехмерные белки.
 Белки имеют первичную, вторичную и третичную структуру. Первичная структура состоит из аминокислот, которые связаны пептидными связями и образуют линейные цепи полипептидов. Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры — это водорастворимые белки, которые конденсируются в уплотненные структуры.
Белки имеют первичную, вторичную и третичную структуру. Первичная структура состоит из аминокислот, которые связаны пептидными связями и образуют линейные цепи полипептидов. Вторичная структура состоит из полипептидных цепей, которые складываются в трехмерные структуры. Третичные структуры — это водорастворимые белки, которые конденсируются в уплотненные структуры.
Белковые структуры
• Первичная структура (линейный полимер аминокислот)
(удерживается вместе пептидными связями)
• Вторичная структура (стандартные трехмерные модели)
(a-спираль, ß-лист, удерживается вместе с Н-связями между атомами основной цепи)
• Третичная структура (детальная трехмерная конформация)
(связи между атомами боковых цепей)
• Четвертичная структура (комбинированные полимерные цепи)
Вторичная структура полипептидной цепи
Вторичная структура относится к форме сворачивающегося белка, обусловленной исключительно водородными связями между его амидной и карбонильной группами основной цепи.
 Вторичная структура не включает связывание между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой.
Вторичная структура не включает связывание между R-группами аминокислот, гидрофобные взаимодействия или другие взаимодействия, связанные с третичной структурой. Две наиболее часто встречающиеся вторичные структуры полипептидной цепи — это альфа-спирали и бета-складчатые листы. Эти структуры являются первыми основными этапами сворачивания полипептидной цепи, и они устанавливают важные топологические мотивы, которые определяют последующую третичную структуру и конечную функцию белка.
Пептидные связи влияют на вторичную структуру
Напомним, что плоская амидная связь ограничивает плоскости изгиба цепи: вращения вокруг связей CO-N нет, но плоскости вращаются вокруг связей
α-CN (Φ) и α-CC = O связей (Ψ)
График Рамачандрана
Показывает группировку φψ и связывает их со структурами в реальных белках. Часто встречаются повторяющиеся структуры (α-спирали, β-листы)
http://commons.wikimedia.org/wiki/Fi …neral_100K.jpg
α-Спирали
Альфа-спираль представляет собой правосторонний клубок аминокислотных остатков на полипептидной цепи, обычно в диапазоне от 4 до 40 остатков.
 Этот змеевик удерживается вместе водородными связями между кислородом C = O на верхнем витке и водородом N-H на нижнем витке. Такая водородная связь образуется ровно через каждые 4 аминокислотных остатка, а каждый полный виток спирали составляет всего 3,6 аминокислотных остатка. Этот регулярный узор придает альфа-спирали очень определенные характеристики в отношении толщины катушки и длины каждого полного витка вдоль оси спирали.
Этот змеевик удерживается вместе водородными связями между кислородом C = O на верхнем витке и водородом N-H на нижнем витке. Такая водородная связь образуется ровно через каждые 4 аминокислотных остатка, а каждый полный виток спирали составляет всего 3,6 аминокислотных остатка. Этот регулярный узор придает альфа-спирали очень определенные характеристики в отношении толщины катушки и длины каждого полного витка вдоль оси спирали.Структурная целостность альфа-спирали частично зависит от правильной стерической конфигурации. Аминокислоты, R-группы которых слишком велики (триптофан, тирозин) или слишком малы (глицин), дестабилизируют альфа-спирали. Пролин также дестабилизирует альфа-спирали из-за своей неправильной геометрии; его R-группа соединяется обратно с азотом амидной группы, что вызывает стерические затруднения. Кроме того, отсутствие водорода в азоте пролина не позволяет ему участвовать в образовании водородных связей.
Другим фактором, влияющим на стабильность альфа-спирали, является общий дипольный момент всей спирали, обусловленный отдельными диполями групп C = O, участвующих в водородных связях.
 Стабильные альфа-спирали обычно заканчиваются заряженной аминокислотой, чтобы нейтрализовать дипольный момент.
Стабильные альфа-спирали обычно заканчиваются заряженной аминокислотой, чтобы нейтрализовать дипольный момент. α-спираль
- 3,6 аминокислот на виток
- 0,54 нм на виток
- боковые цепи указаны
- Н-связи параллельно оси
- Н-связи n-4
- дипольный момент (отрицательный при C конец)
- no pro, less gly, ser
- ограниченные одинаковые заряды боковой цепи
α-спирали обладают дипольным моментом; некоторые боковые цепи являются предпочтительными.грамм. psi-loop) сегменты полипептидной цепи перекрывают друг друга и образуют ряд водородных связей друг с другом. Это может происходить в параллельном расположении:
Или в антипараллельном расположении:
Параллельное и антипараллельное расположение является прямым следствием направленности полипептидной цепи. В антипараллельной компоновке конец С-конца одного сегмента находится на той же стороне, что и конец-N-конец другого сегмента.
 При параллельном расположении конец С-конца и конец N-конца находятся на одних и тех же сторонах для обоих сегментов.«Складка» возникает из-за чередования плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию от обращенных друг к другу на противоположные направления.
При параллельном расположении конец С-конца и конец N-конца находятся на одних и тех же сторонах для обоих сегментов.«Складка» возникает из-за чередования плоскостей пептидных связей между аминокислотами; выровненные амино- и карбонильная группы каждого противоположного сегмента меняют свою ориентацию от обращенных друг к другу на противоположные направления. Параллельное расположение менее стабильно, потому что геометрия отдельных молекул аминокислоты заставляет водородные связи располагаться под углом, делая их длиннее и, следовательно, слабее. Напротив, в антипараллельном расположении водородные связи выровнены прямо напротив друг друга, что делает связи более прочными и стабильными.
Обычно антипараллельный бета-складчатый лист образуется, когда полипептидная цепь резко меняет направление. Это может происходить в присутствии двух последовательных остатков пролина, которые создают угловой изгиб в полипептидной цепи и загибают ее обратно на себя. Это не обязательно для отдаленных сегментов полипептидной цепи для образования бета-складчатых листов, но для проксимальных сегментов это определенное требование.
 Для коротких расстояний два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, при этом 4 является минимальным числом остатков.
Для коротких расстояний два сегмента бета-складчатого листа разделены 4 + 2n аминокислотными остатками, при этом 4 является минимальным числом остатков.Обратный поворот (ß-изгиб):
- R2 (сторона C = O) часто G, A
- R3 (сторона NH) часто D
- Proline часто R2 или R3
α
— ПЛИССИРОВАННЫЕ ЛИСТЫ
Структура, аналогичная структуре бета-гофрированного листа, представляет собой альфа-гофрированный лист. Эта структура энергетически менее выгодна, чем бета-складчатый лист, и довольно необычна для белков. Альфа-гофрированный лист характеризуется выравниванием карбонильных и аминогрупп; все карбонильные группы ориентированы в одном направлении, тогда как все группы N-H ориентированы в противоположном направлении.Поляризация амино- и карбонильных групп приводит к суммарному дипольному моменту на альфа-складчатом листе. Карбонильная сторона приобретает чистый отрицательный заряд, а амино-сторона приобретает чистый положительный заряд.

Третичная структура
http://commons.wikimedia.org/wiki/Fi…_Structure.png
Третичная структура включает связи между боковыми цепями и между ними:
• Водород (-OH… O -)
• Ионный (обычно отталкивание: -Ch3-Nh5 + ::::::: + h5N-Ch3-)
• Ван-дер-Вааль (притяжение на короткие расстояния)
• Дисульфид (ковалентный: -Ch3-SS- Ch3-)
• Гидрофобные
Третичные связи влияют на положение вторичных структур.
А положение вторичной структуры в белке будет влиять на типы боковых цепей (третичная структура).
α-Спираль на поверхности белка будет иметь гидрофильные боковые цепи с одной стороны оси спирали и гидрофобные боковые цепи с другой. Α-Спираль внутри белка будет иметь в основном гидрофобные боковые цепи. Α-Спираль, подверженная воздействию раствора со всех сторон (необычно), будет иметь гидрофильные боковые цепи со всех сторон от оси спирали (в основном).
Четвертичная структура
Четвертичная структура включает отдельные полипептиды, удерживаемые вместе слабыми связями в различной симметрии
Симметрии:
Гомомультимер :: гетеромультимер
гомомультимер: белок с множеством полипептидных цепей, содержащий два или более идентичных компонента
гетеромультимер : белок с множеством полипептидных цепей, содержащий два или более различных компонента
Изологичный :: гетерологичный
Закрытый :: открытый
Сворачивание белка снижает свободную энергию (ΔG) системы.

Сворачивание белка включает как белок, так и растворитель.
ΔG = GF- GU
= ΔH — TΔS
=
+ ΔH (белок)
+ ΔH (растворитель)
— TΔS (белок)
— TΔS (растворитель)
ΔG для сворачивание
невелико (от -20 до -60 кДж / моль) и в основном из-за гидрофобных взаимодействий
Почему так мало?
Изменения формы являются важной частью функции и контроля белка. Например: изменение формы позволяет ДНК-метилтрансферазе выбирать полуметилированный me CG / GC для биметилирования до me CG / Gme C
Содержание белка и аминокислотный состав коммерчески доступных изолятов растительного белка
Постпрандиальный рост концентраций незаменимых аминокислот (EAA) модулирует увеличение скорости синтеза мышечного белка после приема белка.Содержание EAA и состав AA в источнике пищевого белка вносят вклад в дифференциальную синтетическую реакцию мышечного белка на прием различных белков.
 Более низкое содержание EAA и специфический недостаток лейцина, лизина и / или метионина могут быть причиной более низкой анаболической способности белков растительного происхождения по сравнению с белками животного происхождения. Мы сравнили содержание EAA и состав AA в большом количестве источников растительного белка с белками животного происхождения и белками скелетных мышц человека.Состав АК овса, люпина, пшеницы, конопли, микроводорослей, сои, коричневого риса, гороха, кукурузы, картофеля, молока, сыворотки, казеината, казеина, яиц и белка скелетных мышц человека оценивали с помощью UPLC-MS / MS. Содержание EAA в изолятах растительного белка, таких как овес (21%), люпин (21%) и пшеница (22%), было ниже, чем в белках животного происхождения (сыворотка 43%, молоко 39%, казеин 34% и яйца. 32%) и мышечный белок (38%). Профили АК сильно различались среди белков растительного происхождения с содержанием лейцина от 5,1% для конопли до 13.5% кукурузного белка по сравнению с 9,0% для молока, 7,0% для яичного белка и 7,6% для мышечного белка.
Более низкое содержание EAA и специфический недостаток лейцина, лизина и / или метионина могут быть причиной более низкой анаболической способности белков растительного происхождения по сравнению с белками животного происхождения. Мы сравнили содержание EAA и состав AA в большом количестве источников растительного белка с белками животного происхождения и белками скелетных мышц человека.Состав АК овса, люпина, пшеницы, конопли, микроводорослей, сои, коричневого риса, гороха, кукурузы, картофеля, молока, сыворотки, казеината, казеина, яиц и белка скелетных мышц человека оценивали с помощью UPLC-MS / MS. Содержание EAA в изолятах растительного белка, таких как овес (21%), люпин (21%) и пшеница (22%), было ниже, чем в белках животного происхождения (сыворотка 43%, молоко 39%, казеин 34% и яйца. 32%) и мышечный белок (38%). Профили АК сильно различались среди белков растительного происхождения с содержанием лейцина от 5,1% для конопли до 13.5% кукурузного белка по сравнению с 9,0% для молока, 7,0% для яичного белка и 7,6% для мышечного белка. Метионин и лизин обычно содержали меньше белков растительного происхождения (1,0 ± 0,3 и 3,6 ± 0,6%) по сравнению с белками животного происхождения (2,5 ± 0,1 и 7,0 ± 0,6%) и мышечным белком (2,0 и 7,8% соответственно). В заключение можно сказать, что существуют большие различия в содержании ЕАА и составе АК между различными изолятами растительного белка. Комбинации различных изолятов белков растительного происхождения или смеси белков животного и растительного происхождения могут обеспечить характеристики белков, которые точно отражают типичные характеристики белков животного происхождения.
Метионин и лизин обычно содержали меньше белков растительного происхождения (1,0 ± 0,3 и 3,6 ± 0,6%) по сравнению с белками животного происхождения (2,5 ± 0,1 и 7,0 ± 0,6%) и мышечным белком (2,0 и 7,8% соответственно). В заключение можно сказать, что существуют большие различия в содержании ЕАА и составе АК между различными изолятами растительного белка. Комбинации различных изолятов белков растительного происхождения или смеси белков животного и растительного происхождения могут обеспечить характеристики белков, которые точно отражают типичные характеристики белков животного происхождения.
Ключевые слова:
Незаменимая аминокислота; Лейцин; Синтез мышечного белка; Протеин растительного происхождения; Белковая смесь.
Содержание белка и аминокислотный состав коммерчески доступных изолятов растительного белка
Abstract
Постпрандиальное повышение концентраций незаменимых аминокислот (EAA) модулирует увеличение скорости синтеза мышечного белка после приема белка.
 Содержание EAA и состав AA в источнике пищевого белка вносят вклад в дифференциальную синтетическую реакцию мышечного белка на прием различных белков. Более низкое содержание EAA и специфический недостаток лейцина, лизина и / или метионина могут быть причиной более низкой анаболической способности белков растительного происхождения по сравнению с белками животного происхождения. Мы сравнили содержание EAA и состав AA в большом количестве источников растительного белка с белками животного происхождения и белками скелетных мышц человека.Состав АК овса, люпина, пшеницы, конопли, микроводорослей, сои, коричневого риса, гороха, кукурузы, картофеля, молока, сыворотки, казеината, казеина, яиц и белка скелетных мышц человека оценивали с помощью UPLC-MS / MS. Содержание EAA в изолятах растительного белка, таких как овес (21%), люпин (21%) и пшеница (22%), было ниже, чем в белках животного происхождения (сыворотка 43%, молоко 39%, казеин 34% и яйца. 32%) и мышечный белок (38%). Профили АК сильно различались среди белков растительного происхождения с содержанием лейцина от 5,1% для конопли до 13.
Содержание EAA и состав AA в источнике пищевого белка вносят вклад в дифференциальную синтетическую реакцию мышечного белка на прием различных белков. Более низкое содержание EAA и специфический недостаток лейцина, лизина и / или метионина могут быть причиной более низкой анаболической способности белков растительного происхождения по сравнению с белками животного происхождения. Мы сравнили содержание EAA и состав AA в большом количестве источников растительного белка с белками животного происхождения и белками скелетных мышц человека.Состав АК овса, люпина, пшеницы, конопли, микроводорослей, сои, коричневого риса, гороха, кукурузы, картофеля, молока, сыворотки, казеината, казеина, яиц и белка скелетных мышц человека оценивали с помощью UPLC-MS / MS. Содержание EAA в изолятах растительного белка, таких как овес (21%), люпин (21%) и пшеница (22%), было ниже, чем в белках животного происхождения (сыворотка 43%, молоко 39%, казеин 34% и яйца. 32%) и мышечный белок (38%). Профили АК сильно различались среди белков растительного происхождения с содержанием лейцина от 5,1% для конопли до 13. 5% кукурузного белка по сравнению с 9,0% для молока, 7,0% для яичного белка и 7,6% для мышечного белка. Метионин и лизин обычно содержали меньше белков растительного происхождения (1,0 ± 0,3 и 3,6 ± 0,6%) по сравнению с белками животного происхождения (2,5 ± 0,1 и 7,0 ± 0,6%) и мышечным белком (2,0 и 7,8% соответственно). В заключение можно сказать, что существуют большие различия в содержании ЕАА и составе АК между различными изолятами растительного белка. Комбинации различных изолятов белков растительного происхождения или смеси белков животного и растительного происхождения могут обеспечить характеристики белков, которые точно отражают типичные характеристики белков животного происхождения.
5% кукурузного белка по сравнению с 9,0% для молока, 7,0% для яичного белка и 7,6% для мышечного белка. Метионин и лизин обычно содержали меньше белков растительного происхождения (1,0 ± 0,3 и 3,6 ± 0,6%) по сравнению с белками животного происхождения (2,5 ± 0,1 и 7,0 ± 0,6%) и мышечным белком (2,0 и 7,8% соответственно). В заключение можно сказать, что существуют большие различия в содержании ЕАА и составе АК между различными изолятами растительного белка. Комбинации различных изолятов белков растительного происхождения или смеси белков животного и растительного происхождения могут обеспечить характеристики белков, которые точно отражают типичные характеристики белков животного происхождения.Ключевые слова: Незаменимая аминокислота, лейцин, растительный белок, синтез мышечного белка, белковая смесь
Введение
Потребление диетического белка стимулирует синтез мышечного белка (Rennie et al. 1982). Синтетический ответ мышечного белка на потребление белка может существенно различаться в зависимости от типа или источника пищевого белка.
 Дифференциальный синтетический ответ мышечного протеина в значительной степени зависит от постпрандиальной доступности незаменимых аминокислот (и, в частности, лейцина) для мышц (Atherton et al.2010; Volpi et al. 2003 г.). Доступность незаменимых аминокислот после приема пищи регулируется рядом физиологических процессов, включая переваривание пищевых белков, абсорбцию аминокислот, удержание внутренних аминокислот и перфузию скелетных мышц (Groen et al.2015), а также различные диетические факторы, включая аминокислотный состав, незаменимые содержание аминокислот и наличие антипитательных факторов.
Дифференциальный синтетический ответ мышечного протеина в значительной степени зависит от постпрандиальной доступности незаменимых аминокислот (и, в частности, лейцина) для мышц (Atherton et al.2010; Volpi et al. 2003 г.). Доступность незаменимых аминокислот после приема пищи регулируется рядом физиологических процессов, включая переваривание пищевых белков, абсорбцию аминокислот, удержание внутренних аминокислот и перфузию скелетных мышц (Groen et al.2015), а также различные диетические факторы, включая аминокислотный состав, незаменимые содержание аминокислот и наличие антипитательных факторов. В многочисленных исследованиях оценивалась постпрандиальная реакция синтеза мышечного белка на употребление молочных продуктов (Burd et al.2012; Gorissen et al. 2016; Пеннингс и др. 2011, 2012; Tang et al. 2009; Witard et al. 2014; Ян и др. 2012a) и мяса (Билс и др., 2016; Бурд и др., 2015; Пеннингс и др., 2013; Саймонс и др., 2007, 2009, 2011; Филлипс, 2012; Робинсон и др., 2013). Сильное постпрандиальное увеличение скорости синтеза мышечного белка после приема этих белков животного происхождения связано с быстрым повышением концентрации незаменимых аминокислот в плазме, в частности лейцина.
 Для сравнения: синтетические реакции мышечного белка на потребление растительных белков, таких как соя (Phillips 2012; Tang et al.2009; Wilkinson et al. 2007; Ян и др. 2012b) и пшеницы (Gorissen et al. 2016), как было показано, имеют меньшую величину по сравнению с белками животного происхождения. Меньшие анаболические свойства белков растительного происхождения объясняются более низким содержанием незаменимых аминокислот или нехваткой определенных аминокислот, таких как лейцин, лизин и / или метионин (Консультации экспертов ВОЗ / ФАО / УООН, 2007 г .; van Vliet et al.2015 ; Янг и Пеллетт 1994). Все аминокислоты необходимы для синтеза белка, и недостаток одной или нескольких аминокислот может нарушить постпрандиальную реакцию синтеза мышечного белка.Интересно, что анаболические свойства белков растительного происхождения были изучены только для нескольких источников белка, таких как соя (Fouillet et al. 2002, 2009; Hartman et al. 2007; Phillips 2012; Tang et al. 2009; Wilkinson et al. 2007; Янг и др.
Для сравнения: синтетические реакции мышечного белка на потребление растительных белков, таких как соя (Phillips 2012; Tang et al.2009; Wilkinson et al. 2007; Ян и др. 2012b) и пшеницы (Gorissen et al. 2016), как было показано, имеют меньшую величину по сравнению с белками животного происхождения. Меньшие анаболические свойства белков растительного происхождения объясняются более низким содержанием незаменимых аминокислот или нехваткой определенных аминокислот, таких как лейцин, лизин и / или метионин (Консультации экспертов ВОЗ / ФАО / УООН, 2007 г .; van Vliet et al.2015 ; Янг и Пеллетт 1994). Все аминокислоты необходимы для синтеза белка, и недостаток одной или нескольких аминокислот может нарушить постпрандиальную реакцию синтеза мышечного белка.Интересно, что анаболические свойства белков растительного происхождения были изучены только для нескольких источников белка, таких как соя (Fouillet et al. 2002, 2009; Hartman et al. 2007; Phillips 2012; Tang et al. 2009; Wilkinson et al. 2007; Янг и др. 2012b; Браун и др. 2004; Волек и др. 2013), пшеница (Гориссен и др. 2016; Нортон и др. 2009, 2012) и рис (Джой и др. 2013), несмотря на большое разнообразие источников белка растительного происхождения (van Vliet et al. 2015).
2012b; Браун и др. 2004; Волек и др. 2013), пшеница (Гориссен и др. 2016; Нортон и др. 2009, 2012) и рис (Джой и др. 2013), несмотря на большое разнообразие источников белка растительного происхождения (van Vliet et al. 2015). Использование изолятов растительного белка в пищевых рецептурах в последнее время стало интересным из-за большей устойчивости и более низких производственных затрат.Текущий рынок предлагает широкий выбор растительных белков, но отсутствие исследований, сравнивающих растительные белки, затрудняет выбор наиболее оптимальных растительных белков. Ранее мы сообщали о существенных различиях в характеристиках пищевого белка между различными источниками белка растительного происхождения (van Vliet et al. 2015). Однако в этот отчет включены данные большого количества исследований, в которых использовались независимые анализы и оценивался только один источник белка или сравнивались несколько источников белка растительного происхождения.В текущем исследовании мы применили те же аналитические процедуры к большому выбору коммерчески доступных белковых изолятов, чтобы обеспечить более полный обзор характеристик пищевого белка основных изолятов растительного и животного белка, которые в настоящее время широко доступны на рынке.

В настоящем исследовании мы охарактеризовали различные изоляты белков растительного происхождения (овес, люпин, пшеница, конопля, микроводоросли, соя, коричневый рис, горох, кукуруза и картофель), белковые изоляты животного происхождения (сыворотка, молоко, казеинат , казеин и яйцо) и белок скелетных мышц человека.Используя тандемную масс-спектрометрию с ультраэффективной жидкостной хроматографией (UPLC – MS / MS), мы оценили аминокислотный состав этих типов и источников белка. Это исследование обеспечивает основу для идентификации белков растительного происхождения с высоким анаболическим потенциалом и для определения новых смесей белков растительного происхождения, которые обеспечивают полный спектр незаменимых аминокислот, подобных большинству источников белка животного происхождения.
Методы
Источники белка
Было отобрано тридцать пять образцов белка, которые в настоящее время коммерчески доступны в виде изолированного порошка белка, подходящего для применения в питании человека или кормах для животных.
 Десять различных источников белка растительного происхождения, включая овес ( n = 1), люпин ( n = 1), пшеницу ( n = 7), коноплю ( n = 1), микроводоросли ( n = 1), соя ( n = 7), коричневый рис ( n = 1), горох ( n = 3), кукуруза ( n = 3) и картофель ( n = 2). по сравнению с белками животного происхождения, включая молоко ( n = 1), сыворотку ( n = 3), казеинат ( n = 1), казеин ( n = 2) и яйца ( n = 1), а также белок скелетных мышц человека ( n = 10).Источники растительного белка, выбранные для текущего анализа, составляют примерно 67% от общего потребления растительного белка, из которых овес — 0,3%, пшеница — 32,3%, соя — 2,7%, коричневый рис — 20,6%, горох — 1,0%. , кукуруза составляет 7,3%, а картофель — 3,1% от общего потребления растительного белка (FAOSTAT 2013). Кроме того, в текущий анализ мы включили люпин, коноплю и микроводоросли.
Десять различных источников белка растительного происхождения, включая овес ( n = 1), люпин ( n = 1), пшеницу ( n = 7), коноплю ( n = 1), микроводоросли ( n = 1), соя ( n = 7), коричневый рис ( n = 1), горох ( n = 3), кукуруза ( n = 3) и картофель ( n = 2). по сравнению с белками животного происхождения, включая молоко ( n = 1), сыворотку ( n = 3), казеинат ( n = 1), казеин ( n = 2) и яйца ( n = 1), а также белок скелетных мышц человека ( n = 10).Источники растительного белка, выбранные для текущего анализа, составляют примерно 67% от общего потребления растительного белка, из которых овес — 0,3%, пшеница — 32,3%, соя — 2,7%, коричневый рис — 20,6%, горох — 1,0%. , кукуруза составляет 7,3%, а картофель — 3,1% от общего потребления растительного белка (FAOSTAT 2013). Кроме того, в текущий анализ мы включили люпин, коноплю и микроводоросли. Люпин — это местное европейское бобовое растение с показателем качества белка, аналогичным соевому, и представляет интерес как альтернатива импорту сои (Lucas et al.2015; Мариотти и др. 2002). Микроводоросли привлекли к себе значительное внимание из-за их высокого содержания белка (как в мясе, яйцах, сое и молоке), наличия других полезных питательных веществ и производства, для которого требуется меньше воды и земли, чем для других сельскохозяйственных культур или продуктов животного происхождения (Bleakley and Hayes 2017 ). Все образцы белка были предоставлены натурой различными поставщиками: Agri Nutrition, Doetinchem, Нидерланды; Агридиент, Хофддорп, Нидерланды; Авебе, Вендам, Нидерланды; Каргилл, Миннетонка, Миннесота, США; Шамтор, Базанкур, Франция; Косукра, Варкунг, Бельгия; FrieslandCampina DMV, Вегел, Нидерланды; FrieslandCampina Domo, Бейлен, Нидерланды; Л.И. Франк, Твелло, Нидерланды; MRM Metabolic Response Modifiers, Оушенсайд, Калифорния, США; Рокетт, Лестрем, Франция; Selecta, Гояния, Бразилия; Тейт и Лайл, Кимстад, Швеция; Тереос, Маркольсхайм, Франция; Волак, Оруэлл, Соединенное Королевство; Витэленд, Вольвега, Нидерланды; Вулро, Верт, Нидерланды.
Люпин — это местное европейское бобовое растение с показателем качества белка, аналогичным соевому, и представляет интерес как альтернатива импорту сои (Lucas et al.2015; Мариотти и др. 2002). Микроводоросли привлекли к себе значительное внимание из-за их высокого содержания белка (как в мясе, яйцах, сое и молоке), наличия других полезных питательных веществ и производства, для которого требуется меньше воды и земли, чем для других сельскохозяйственных культур или продуктов животного происхождения (Bleakley and Hayes 2017 ). Все образцы белка были предоставлены натурой различными поставщиками: Agri Nutrition, Doetinchem, Нидерланды; Агридиент, Хофддорп, Нидерланды; Авебе, Вендам, Нидерланды; Каргилл, Миннетонка, Миннесота, США; Шамтор, Базанкур, Франция; Косукра, Варкунг, Бельгия; FrieslandCampina DMV, Вегел, Нидерланды; FrieslandCampina Domo, Бейлен, Нидерланды; Л.И. Франк, Твелло, Нидерланды; MRM Metabolic Response Modifiers, Оушенсайд, Калифорния, США; Рокетт, Лестрем, Франция; Selecta, Гояния, Бразилия; Тейт и Лайл, Кимстад, Швеция; Тереос, Маркольсхайм, Франция; Волак, Оруэлл, Соединенное Королевство; Витэленд, Вольвега, Нидерланды; Вулро, Верт, Нидерланды. Пробы белка транспортировали и хранили в закрытых упаковках в чистом, сухом, хорошо вентилируемом помещении при температуре и влажности окружающей среды до дальнейшего анализа. Мы включили белок скелетных мышц человека в качестве эталонного белка с «идеальным» аминокислотным составом, сосредоточив внимание на синтезе мышечного белка.Образцы скелетных мышц человека были получены с высоты 90–170 м. Wastus lateralis от десяти добровольцев, участвовавших в ранее опубликованном исследовании (Gorissen et al. 2014). Образцы белка были запрошены, получены и проанализированы в период с декабря 2014 года по июнь 2018 года.
Пробы белка транспортировали и хранили в закрытых упаковках в чистом, сухом, хорошо вентилируемом помещении при температуре и влажности окружающей среды до дальнейшего анализа. Мы включили белок скелетных мышц человека в качестве эталонного белка с «идеальным» аминокислотным составом, сосредоточив внимание на синтезе мышечного белка.Образцы скелетных мышц человека были получены с высоты 90–170 м. Wastus lateralis от десяти добровольцев, участвовавших в ранее опубликованном исследовании (Gorissen et al. 2014). Образцы белка были запрошены, получены и проанализированы в период с декабря 2014 года по июнь 2018 года. Анализ содержания белка
Примерно 10 мг белкового порошка (в двух экземплярах) или лиофилизированной ткани скелетных мышц человека было собрано в стальных тиглях. Метод сжигания Дюма использовался для определения азота с помощью vario MAX cube CN (Elementar Analysensysteme, Германия).Содержание белка рассчитывали путем умножения определенного содержания азота на 6,25 в качестве стандартного коэффициента преобразования азота в белок.
 Продолжаются дискуссии о предпочтительном использовании коэффициентов превращения азота в белок, специфичных для источников белка, которые известны для некоторых, но не для всех источников белка, включенных в текущий анализ (Mariotti et al. 2008). В настоящем исследовании мы использовали единый коэффициент пересчета (6,25) для прямого сравнения различных источников белка.
Продолжаются дискуссии о предпочтительном использовании коэффициентов превращения азота в белок, специфичных для источников белка, которые известны для некоторых, но не для всех источников белка, включенных в текущий анализ (Mariotti et al. 2008). В настоящем исследовании мы использовали единый коэффициент пересчета (6,25) для прямого сравнения различных источников белка.Анализ аминокислотного профиля
Приблизительно 6 мг белкового порошка или лиофилизированной ткани скелетных мышц человека гидролизовали в 3 мл 6 М HCl в течение 12 часов при 110 ° C. После гидролиза образцы охлаждали до 4 ° C, чтобы остановить процесс гидролиза. HCl выпаривали в потоке азота и высушенные аминокислоты восстанавливали в 5 мл воды. Стандарты аминокислот были получены от Sigma-Aldrich (A9906) и разбавлены до конечных концентраций 500, 375, 250, 125, 62,5 и 31.25 мкМ. 10 мкл образца гидролизованного белка или стандартного раствора аминокислот смешивали с 1500 мкл 0,5 мМ тридекафторгептановой кислоты (TDFHA; Sigma) в воде и 10 мкл раствора внутреннего стандарта, содержащего стабильные меченые изотопами аминокислоты (Cambridge Isotopes Laboratories) в 0,1 M HCl.
 . Концентрации аминокислот определяли с помощью тандемной масс-спектрометрии ультраэффективной жидкостной хроматографии (UPLC) (Waterval et al. 2009). Жидкостную хроматографию выполняли при 30 ° C с использованием Acquity UPLC BEH C18, 1.Колонка 7 мкм, 2,1 × 100 мм (Waters, Milford, MA, USA) и градиентная система с подвижной фазой, состоящей из буфера A (0,5 мМ TDFHA в воде) и буфера B (0,5 мМ TDFHA в ацетонитриле) при скорости потока 650 мкл / мин (без разделения). Используемая программа градиента была следующей: исходные 99,5% A и 0,5% B; линейный градиент до 70% A и 30% B за 14 мин; удерживайте 3,5 мин, вернитесь к исходным условиям через 1 мин при скорости потока 700 мкл / мин с последующим уравновешиванием в течение 10 мин. За одну минуту до следующего ввода пробы поток был установлен на 650 мкл / мин.Время автономной работы 30 мин. Вводимый объем составлял 5 мкл. Масс-спектрометрию проводили с использованием тандемного масс-спектрометра Micromass Quattro Premier XE (Waters, Milford, MA, USA).
. Концентрации аминокислот определяли с помощью тандемной масс-спектрометрии ультраэффективной жидкостной хроматографии (UPLC) (Waterval et al. 2009). Жидкостную хроматографию выполняли при 30 ° C с использованием Acquity UPLC BEH C18, 1.Колонка 7 мкм, 2,1 × 100 мм (Waters, Milford, MA, USA) и градиентная система с подвижной фазой, состоящей из буфера A (0,5 мМ TDFHA в воде) и буфера B (0,5 мМ TDFHA в ацетонитриле) при скорости потока 650 мкл / мин (без разделения). Используемая программа градиента была следующей: исходные 99,5% A и 0,5% B; линейный градиент до 70% A и 30% B за 14 мин; удерживайте 3,5 мин, вернитесь к исходным условиям через 1 мин при скорости потока 700 мкл / мин с последующим уравновешиванием в течение 10 мин. За одну минуту до следующего ввода пробы поток был установлен на 650 мкл / мин.Время автономной работы 30 мин. Вводимый объем составлял 5 мкл. Масс-спектрометрию проводили с использованием тандемного масс-спектрометра Micromass Quattro Premier XE (Waters, Milford, MA, USA). Масс-спектрометр использовали в режиме мониторинга множественных реакций (MRM) в режиме положительного ESI. Температура десольватации составляла 450 ° C, температура источника составляла 130 ° C. Капиллярное напряжение было установлено на 0,5 кВ, а конусное напряжение было установлено на 25 В. Газообразный азот использовали в качестве газа для десольватации и в качестве газа конуса. Газообразный азот получали с использованием генератора азота NM30L (Peak Scientific, Ренфрушир, Шотландия).Расход газа в конусе составлял 50 л / час, а расход газа для десольватации составлял 800 л / час. Оптимальные условия обнаружения определяли путем постоянной инфузии стандартных растворов (50 мкМ) в растворителе А с использованием сплит-системы. MRM и сканирование дочерних ионов проводили с использованием аргона в качестве газа для столкновений при давлении 3,8 × 10 -3 мбар и потоке 0,2 мл / мин.
Масс-спектрометр использовали в режиме мониторинга множественных реакций (MRM) в режиме положительного ESI. Температура десольватации составляла 450 ° C, температура источника составляла 130 ° C. Капиллярное напряжение было установлено на 0,5 кВ, а конусное напряжение было установлено на 25 В. Газообразный азот использовали в качестве газа для десольватации и в качестве газа конуса. Газообразный азот получали с использованием генератора азота NM30L (Peak Scientific, Ренфрушир, Шотландия).Расход газа в конусе составлял 50 л / час, а расход газа для десольватации составлял 800 л / час. Оптимальные условия обнаружения определяли путем постоянной инфузии стандартных растворов (50 мкМ) в растворителе А с использованием сплит-системы. MRM и сканирование дочерних ионов проводили с использованием аргона в качестве газа для столкновений при давлении 3,8 × 10 -3 мбар и потоке 0,2 мл / мин. Во время кислотного гидролиза заменимые аминокислоты аспарагин и глутамин превращаются в аспарагиновую кислоту и глутаминовую кислоту соответственно, а незаменимая аминокислота триптофан разлагается, что исключает возможность обнаружения этих аминокислот (Fountoulakis and Lahm 1998).
 .Поскольку триптофан не измерялся, сумма незаменимых аминокислот включает треонин, метионин, фенилаланин, гистидин, лизин, валин, изолейцин и лейцин. Кислотный гидролиз проводили в отсутствие кислорода, и процесс гидролиза прекращали после 12 ч инкубации, чтобы минимизировать восстановление цистеина и метионина. Хотя кислотный гидролиз не является оптимальным для всех аминокислот, мы использовали эту процедуру для всех образцов белка, чтобы обеспечить прямое сравнение между различными источниками белка.
.Поскольку триптофан не измерялся, сумма незаменимых аминокислот включает треонин, метионин, фенилаланин, гистидин, лизин, валин, изолейцин и лейцин. Кислотный гидролиз проводили в отсутствие кислорода, и процесс гидролиза прекращали после 12 ч инкубации, чтобы минимизировать восстановление цистеина и метионина. Хотя кислотный гидролиз не является оптимальным для всех аминокислот, мы использовали эту процедуру для всех образцов белка, чтобы обеспечить прямое сравнение между различными источниками белка.Результаты
Содержание белка
Содержание белка варьировалось от 51 до 86% в сырье (рис.). Источники белка растительного происхождения варьировались от 51 до 81%, а содержание белка было ниже в конопле (51%), люпине (61%), овсе (64%) и кукурузе (65%) и выше в коричневом рисе (79%). , горох (80%), картофель (80%) и пшеница (81%). Содержание белка в белках животного происхождения колебалось от 51% в яйцах до 86% в казеинате кальция. Лиофилизированная ткань скелетных мышц человека содержала 84% белка.Содержание белка в различных образцах из одного и того же источника белка различается у разных поставщиков: содержание белка в пшеничном белке составляет от 74 до 88%, соевого белка — от 61 до 91%, горохового белка — от 77 до 81%, кукурузного белка — от 58. до 75%, картофельный белок от 77 до 83%, сывороточный белок от 72 до 84% и казеин от 67 до 78%.
Среднее (± SEM) содержание белка (% исходного материала) в различных источниках пищевого белка и ткани скелетных мышц человека на основе определенного содержания азота, умноженного на 6.25 в качестве стандартного коэффициента преобразования. Белые столбцы представляют источники белка растительного происхождения, серые столбцы представляют источники белка животного происхождения, а черные столбцы представляют белок скелетных мышц человека
Содержание незаменимых аминокислот
Содержание незаменимых аминокислот показано на рис. Содержание незаменимых аминокислот было ниже у белков растительного происхождения (26 ± 2% от общего белка) по сравнению с белками животного происхождения (37 ± 2% от общего белка) и белками скелетных мышц человека (38% от общего белка).Содержание незаменимых аминокислот в растительных белках овса (21%), люпина (21%), пшеницы (22%), конопли (23%) и микроводорослей (23%) ниже аминокислотных показателей ВОЗ / ФАО / УООН. потребность в кислоте (Консультация экспертов ВОЗ / ФАО / УООН, 2007 г.). Таким образом, потребность в незаменимых аминокислотах не будет удовлетворена, если один из этих белков будет единственным потребляемым источником белка. Обратите внимание, что это требование основано на рекомендуемом потреблении взрослого белка 0,66 г / кг массы тела в день. Белки растительного происхождения, которые действительно удовлетворяют потребности в незаменимых аминокислотах, включают сою (27%), коричневый рис (28%), горох (30%), кукурузу (32%) и картофель (37%).Из белков животного происхождения сывороточный белок имел самое высокое содержание незаменимых аминокислот — 43%. Молочный белок (39%) и казеинат кальция (38%) показали более низкое содержание незаменимых аминокислот, а казеин (34%) и яйцо (32%). Все белки животного происхождения были значительно выше аминокислотных требований ВОЗ / ФАО / УООН.
Среднее (± SEM) содержание незаменимых аминокислот (EAA) (% от общего белка) в различных источниках пищевого белка и белка скелетных мышц человека. Белые столбцы представляют источники белка растительного происхождения, серые столбцы представляют источники белка животного происхождения, а черные столбцы представляют белок скелетных мышц человека.Пунктирная линия представляет потребности взрослых в аминокислотах (Консультации экспертов ВОЗ / ФАО / УООН, 2007 г.). Примечание. EAA — это сумма His, Ile, Leu, Lys, Met, Phe, Thr и Val. Trp не измерялся
Профили аминокислот
Профили аминокислот существенно различались среди белков растительного происхождения с содержанием лейцина всего 5,1% в конопле, 5,2% в люпине, 5,8% в микроводорослях и 13,5% в кукурузе. и 8,3% в картофеле по сравнению с 7,6% в белке скелетных мышц человека (рис. а). Несмотря на высокое содержание лейцина в кукурузе и картофеле, среднее содержание лейцина в растительных белках было ниже (7.1 ± 0,8%) по сравнению с белками животного происхождения (8,8 ± 0,7%). Особенно низкое содержание лизина и метионина в растительных белках (3,6 ± 0,6 и 1,0 ± 0,3% соответственно) по сравнению с белками животного происхождения (7,0 ± 0,6 и 2,5 ± 0,1% соответственно) и белками скелетных мышц человека (7,8 ± 0,1%). и 2,0% соответственно), но с большой вариабельностью между растительными источниками белка (рис. a, b). Содержание лизина в пшенице (1,4%), кукурузе (1,5%), овсе (2,1%), коричневом рисе (2,4%), конопле (2,8%) и люпине (3.5%) ниже требований ВОЗ / ФАО / УООН и значительно ниже по сравнению с соей (4,6%), микроводорослями (5,3%), горохом (5,9%) и картофелем (6,0%). Содержание метионина было низким в микроводорослях (0,0%), овсе (0,2%), люпине (0,3%), горохе (0,4%), сои (0,4%) и пшенице (0,9%), но достигнуто ВОЗ / ФАО / УООН. потребности в картофеле (1,6%), кукурузе (1,7%), конопле (2,0%) и коричневом рисе (2,5%). Менее выраженная вариабельность наблюдалась между растительными и животными белками в содержании изолейцина, валина, гистидина, фенилаланина и треонина.За исключением картофельного белка, содержание аминокислот с разветвленной цепью изолейцина и валина было ниже в растительных белках по сравнению с белками животного происхождения и не соответствовало требованиям ВОЗ / ФАО / УООН. Полный обзор аминокислотных профилей, выраженных в г / 100 г сырья, представлен в таблице.
Среднее (± SEM) содержание лейцина ( a ), изолейцина ( b ) и валина ( c ) (% от общего белка) в различных источниках пищевого белка и белка скелетных мышц человека.Белые столбцы представляют источники белка растительного происхождения, серые столбцы представляют источники белка животного происхождения, а черные столбцы представляют мышцы человека. Пунктирная линия представляет потребности в аминокислотах для взрослых (Консультация экспертов ВОЗ / ФАО / УООН, 2007 г.)
Среднее (± SEM) лизин ( a ), метионин ( b ), гистидин ( c ), фенилаланин (). d ) и содержание треонина ( e ) (% от общего белка) в различных источниках пищевого белка и белка скелетных мышц человека.Белые столбцы представляют источники белка растительного происхождения, серые столбцы представляют источники белка животного происхождения, а черные столбцы представляют мышцы человека. Пунктирная линия представляет потребности в аминокислотах для взрослых (Консультация экспертов ВОЗ / ФАО / УООН, 2007 г.)
Таблица 1
Содержание аминокислот в различных источниках пищевого белка и в скелетных мышцах человека



