Белки полноценные и неполноценные — Справочник химика 21
БЕЛКИ ПОЛНОЦЕННЫЕ И НЕПОЛНОЦЕННЫЕ [c.310]
Белки полноценные и неполноценные [c.218]
Какие белки являются полноценными и какие неполноценными [c.220]
Белки, содержащие в своем составе все незаменимые аминокислоты, называются полноценными, а белки, не содержащие хотя бы одной незаменимой аминокислоты,— неполноценными. [c.218]
Классификация белков по аминокислотному составу позволяет подразделить их только на полноценные (содержащие все необходимые для животного организма аминокислоты) и неполноценные, т. е. в которых содержатся не все необходимые аминокислоты. [c.437]
Белки пищи делятся на две категории на белки полноценные и на белки неполноценные. Первые содержат все необходимые для организма аминокислоты (незаменимые аминокислоты). Во вторых же (неполноценных) белках отсутствует или находится в недостаточном количестве та или иная незаменимая аминокислота. Как ни велико было бы содержание неполноценных белков в пище, человек и животные будут находиться в состоянии отрицательного азотистого баланса. Это отнюдь не означает, что в составе пищи имеются только лишь одни полноценные белки, что неполноценные белки непригодны для организма. Для нормального питания необходимо, чтобы различные белки пищи содержали бы все алганокислоты, необходимые для организма, и при этом в нужном соотношении. Более подробно вопросы белкового питания освещаются в главе Биохимия питания (стр. 466). [c.425]
Во вторых же (неполноценных) белках отсутствует или находится в недостаточном количестве та или иная незаменимая аминокислота. Как ни велико было бы содержание неполноценных белков в пище, человек и животные будут находиться в состоянии отрицательного азотистого баланса. Это отнюдь не означает, что в составе пищи имеются только лишь одни полноценные белки, что неполноценные белки непригодны для организма. Для нормального питания необходимо, чтобы различные белки пищи содержали бы все алганокислоты, необходимые для организма, и при этом в нужном соотношении. Более подробно вопросы белкового питания освещаются в главе Биохимия питания (стр. 466). [c.425]
Мышечная ткань обладает высокой питательной ценностью вследствие содержания в ней полноценных белков. Соединительная ткань состоит из неполноценных белков (коллаген, эластин). Однако кол- [c.115]
Потребляемые человеком белковые продукты можно разделить на полноценные белковые продукты, которые содержат все незаменимые аминокислоты, и неполноценные белковые продукты, в которых отсутствует одна или более незаменимых аминокислот. Казеин, например, основной белок молока, с этой точки зрения является полноценным белком, тогда как желатина — белок, получаемый из костей, кожи и сухожилий (при частичном гидролизе нерастворимого белка коллагена и образуется желатина)—неполноценный белок. Желатина не содержит или содержит очень мало треонина и вовсе не содержит триптофана. [c.485]
Казеин, например, основной белок молока, с этой точки зрения является полноценным белком, тогда как желатина — белок, получаемый из костей, кожи и сухожилий (при частичном гидролизе нерастворимого белка коллагена и образуется желатина)—неполноценный белок. Желатина не содержит или содержит очень мало треонина и вовсе не содержит триптофана. [c.485]
Большое развитие получил прием наращивания полипептидных цепей на различные белковые молекулы. Указанный прием — один из путей искусственного создания полноценных белков из неполноценных путем обогащения их недостающими незаменимыми аминокислотами, т. е. создания искусственной пищи. [c.5]
Белки довольно резко различаются по аминокислотному составу, в том числе и по содержанию незаменимых аминокислот. Некоторые белки содержат все незаменимые аминокислоты в количестве, достаточном для организма человека и животных. Такие белки называются биологически полноценными. К ним относятся белки куриного яйца, молока, ряда органов животных. Однако многие белки, чаще всего растительного происхождения, не содержат или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Например, в белках зерновых злаков содержится недостаточное количество лизина и триптофана, в белках семян бобовых культур недостаточно метионина, в белках клубней картофеля мало валина и т. д. Эти белки называют неполноценными. Нетрудно рассчитать, что если в каком-либо белке одна из незаменимых аминокислот содержится в количестве в 2 раза меньшем, чем необходимо для удовлетворения потребностей [c.392]
Однако многие белки, чаще всего растительного происхождения, не содержат или содержат в недостаточном количестве одну или несколько незаменимых аминокислот. Например, в белках зерновых злаков содержится недостаточное количество лизина и триптофана, в белках семян бобовых культур недостаточно метионина, в белках клубней картофеля мало валина и т. д. Эти белки называют неполноценными. Нетрудно рассчитать, что если в каком-либо белке одна из незаменимых аминокислот содержится в количестве в 2 раза меньшем, чем необходимо для удовлетворения потребностей [c.392]
И неполноценные, в которых отсутствует одна или несколько незаменимых аминокислот. С этой точки зрения казеин — основной белок молока— является полноценным белком, тогда как желатина — белок, получаемый из костей и сухожилий (при частичном гидролизе нерастворимого белка коллагена образуется желатина), — неполноценный белок. Желатина не содержит триптофана, валина и очень мало содержит или совсем не содержит треонина. [c.390]
[c.390]
Снижение концентрации неполноценных белков и усиление экспрессии генов полноценных белков. [c.399]
Исключение из пищи всех аминокислот приводит к обеднению всего организма белком, что сопровождается потерей веса, анемией, гипопротеинемией и общей атрофией мышц. При этом организм становится более восприимчивым к инфекциям и хуже переносит травмы и заболевания (ср. [84]). С появлением очищенных рационов из аминокислот стало возможным исследовать изменения, возникающие при выключении одной незаменимой аминокислоты из состава рациона, полноценного в других отношениях. В опытах на животных, лишенных какой-либо одной незаменимой аминокислоты, наиболее отчетливо проявляется потеря аппетита потребление пищи резко снижается уже после первого дня. Потерю аппетита (анорексию) и отрицательный баланс азота как немедленное следствие исключения одной аминокислоты наблюдали также при исследованиях на людях. Механизм анорексии еще не вполне ясен. Сомнительно, чтобы значительная роль здесь принадлежала вкусовым ощущениям более вероятно, что анорексия связана с глубокими общими нарушениями в состоянии организма. Введение неполноценной смеси аминокислот через желудочный зонд в опытах на животных не способствует увеличению веса, сохранению азотистого равновесия или улучшению аппетита. [c.129]
Сомнительно, чтобы значительная роль здесь принадлежала вкусовым ощущениям более вероятно, что анорексия связана с глубокими общими нарушениями в состоянии организма. Введение неполноценной смеси аминокислот через желудочный зонд в опытах на животных не способствует увеличению веса, сохранению азотистого равновесия или улучшению аппетита. [c.129]
Белки пищевых продуктов в зависимости от аминокислотного состава бывают полноценными и неполноценными. Полноценные белки содержат все незаменимые аминокислоты (стр. 200). Биологически полноценными являются белки животного происхождения (белки мяса, рыбы, сыра, молока, яиц). Из белков растительного происхождения наиболее ценные содержатся в сое, подсолнухе, картофеле, гречневой крупе, фасоли, чечевице, рисе. [c.216]
Образование антител точно так же, как и образование других белков, зависит от питания организма. У животных, питающихся полноценной пищей, образуется значительно больше антител, чем у животных, содержащихся на неполноценной диэте[61].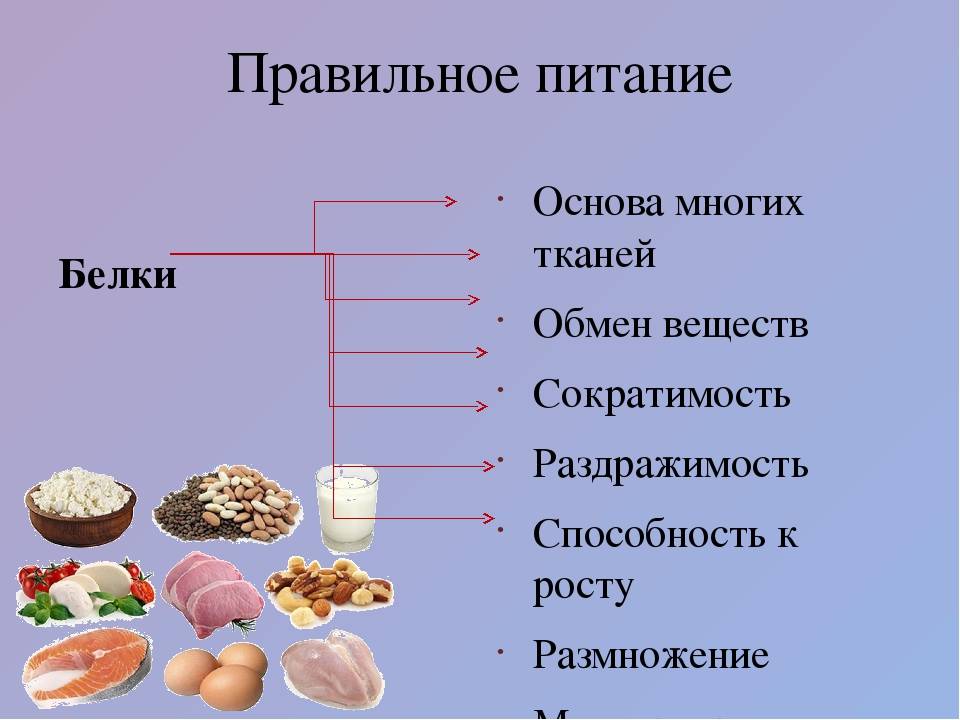 У лягушек титр антисыворотки зависит от температуры тела при 20° он значительно выше, чем при 8°. Снижение температуры вызывает адсорбцию антител клетками печени с соответствующим понижением титра антисыворотки [62]. [c.338]
У лягушек титр антисыворотки зависит от температуры тела при 20° он значительно выше, чем при 8°. Снижение температуры вызывает адсорбцию антител клетками печени с соответствующим понижением титра антисыворотки [62]. [c.338]
Следует, однако, иметь в виду, что грубые (кроме бобовых) и сочные корма являются неполноценными по количеству содержащегося в них перевариваемого белка (40—60% от нормы). Так, например, в расчете на кормовую единицу силос кукурузы с початками содержит 70 г белка, картофель —54 г, корни сахарной свеклы — 47 г и т. д., тогда как на кормовую единицу требуется 100—ПО г перевариваемого протеина (белка). Поэтому для доведения корма до полноценного необходимо обогатить его белком, иначе неизбежен значительный перерасход корма. [c.23]
ТЫ — аминокислоты, которые не синтезируются в организме. Содержание их в пищевых продуктах необходимо для роста, развития и поддержания нормального физиологического состояния человека, животных и некоторых микроорганизмов. Аминокислоты, которые могут синтезироваться в организме, называются заменимыми аминокислотами. Основным источником аминокислот являются белки, которые расщепляются в н елу-дочно-кишечном тракте до аминокислот. Белки, в состав которых входят все Н. а., называются полноценными белки, которые не содержат хотя бы одну из незаменимых аминокислот, являются неполноценными. Н. а. богаты животные белки — молоко, мясо. Н. а. для человека и всех животных являются восемь аминокислот лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валии, изолейцин. Для роста молодых крыс, кроме того, необходим еще аргинин для роста цыплят необходимо до 15 аминокислот. Г1ри отсутствии в организме (пище) отдельных Н. а. могут развиваться некоторые заболевания, например, при отсутствии триптофана развивается катаракта. [c.171]
Аминокислоты, которые могут синтезироваться в организме, называются заменимыми аминокислотами. Основным источником аминокислот являются белки, которые расщепляются в н елу-дочно-кишечном тракте до аминокислот. Белки, в состав которых входят все Н. а., называются полноценными белки, которые не содержат хотя бы одну из незаменимых аминокислот, являются неполноценными. Н. а. богаты животные белки — молоко, мясо. Н. а. для человека и всех животных являются восемь аминокислот лизин, треонин, триптофан, метионин, фенилаланин, лейцин, валии, изолейцин. Для роста молодых крыс, кроме того, необходим еще аргинин для роста цыплят необходимо до 15 аминокислот. Г1ри отсутствии в организме (пище) отдельных Н. а. могут развиваться некоторые заболевания, например, при отсутствии триптофана развивается катаракта. [c.171]
Необходимо остановиться на представлении о полноценности и неполноценности белков в питании. Для изучения свойств белков используются различные методы получения отдельных фракций белков из органов и тканей. Применяя фракционное осаждение, электрофорез и другие методы, из белкового комплекса, находящегося в тканях, выделяют отдельные фракции, например, глиадин (из белков пшеницы), или зеин (из белков кукурузы) и т. п. Эти фракции не содержат некоторых незаменимых аминокислот или содержат их в ничтожных количествах. Опыты с кормлением животных такими белками показали невозможность использовать их для поддержания азотистого равновесия, в связи с чем стали говорить о существовании неполноценных белков . Эти фракции белков действительно неполноценны как источники белкового питания. Однако ни человек, ни животные никогда не употребляют в пищу отдельные фракции белков, подобные зеину, эдестину и др., а едят пищевые продукты (кукурузу, пшеницу и т. п.). В природе не существует животных или растительных тканей, в которых полностью отсутствовали бы незаменимые аминокислоты. На основании аминокислотного состава суммарного белка данного пищевого продукта можно говорить лишь об его большей или меньшей биологической ценности (Б.
Применяя фракционное осаждение, электрофорез и другие методы, из белкового комплекса, находящегося в тканях, выделяют отдельные фракции, например, глиадин (из белков пшеницы), или зеин (из белков кукурузы) и т. п. Эти фракции не содержат некоторых незаменимых аминокислот или содержат их в ничтожных количествах. Опыты с кормлением животных такими белками показали невозможность использовать их для поддержания азотистого равновесия, в связи с чем стали говорить о существовании неполноценных белков . Эти фракции белков действительно неполноценны как источники белкового питания. Однако ни человек, ни животные никогда не употребляют в пищу отдельные фракции белков, подобные зеину, эдестину и др., а едят пищевые продукты (кукурузу, пшеницу и т. п.). В природе не существует животных или растительных тканей, в которых полностью отсутствовали бы незаменимые аминокислоты. На основании аминокислотного состава суммарного белка данного пищевого продукта можно говорить лишь об его большей или меньшей биологической ценности (Б. И. Збарский). [c.310]
И. Збарский). [c.310]
Необходимо остановиться на представлении о полноценности и неполноценности белков в питании. [ Для изучения свойств белков используются различные методы получения отдельных фракций белков из органов и ткане /Применяя фракционное осаждение, электрофорез и другие методы, из белшвого комплекса, находящегося в тканях, выделяют отдельные фракции, например, глиадин (из белков пшеницы), или зеин (из белков кукурузы) и т. п. Эти фракции не содержат некоторых незаменимых аминокислот или содержат их в ничтожных количествах. Опыты [c.327]
Пища, даже содержащая значительное количество белков, может быть неполноценной, если в этих белках нет необходимого набора незаменимых аминокислот. Наиболее полноценны по аминокислотному составу белки животных продуктов (мяса, яиц и т. п.). Недостаток незаменимых аминокислот характерен для растительных белков например, пшеничная мука содержит только третью часть необходимого лизина, в сое мало лейцина, в горохе — триптофана, в дрожжах — метионина и лейцина. Добавка синтетических наиболее дефицитных незаменимых аминокислот (лизина, метионина и триптофана) к растительным продуктам выравнивает их ди-тательность с питательностью животных продуктов. [c.329]
Добавка синтетических наиболее дефицитных незаменимых аминокислот (лизина, метионина и триптофана) к растительным продуктам выравнивает их ди-тательность с питательностью животных продуктов. [c.329]
Чтобы избежать излишеств и в то же время обеспечить нормальную жизнедеятельность организма, надо прежде всего дать человеку с пищей полноценный по ассортименту набор белков. Если белков в питании недо-сшет, взрослый человек ощущает упадок сил, у него снижается работоспособность, его организм хуже сопротивляется инфекции и простуде. Что касается детей, то они при неполноценном белковом питании сильно отстают в развитии дети растут, а белки — основной строительный материал природы. Каждая клетка живого организма содержит белки. Мышцы, кожа, волосы, ногти человека состоят главным образом из белков. Более того, белки — основа жизни, они участвуют в обмене веществ и обеспечивают размножение живых организмов. [c.44]
В середине XIX века было установлено, что для питания человека и животного достаточно следуютих веществ белков, жиров, углеводов, минеральных солей и воды. Далее, в ряде опытов было показано, что из этих групп пищевых веществ безусловно необходимы для питания лишь белки и минеральные вещества, поскольку жиры и углеводы могут образоваться за счет белков. Детализируя проблему искусственного питания и изучая различные синтетические пищевые смеси, ученые занялись энергетической и термодинамической стороной этого вопроса. В результате ряда весьма обстоятельных исследований было установлено, что количество необходимых для организма пищевых веществ должно определяться количеством калорий тепла, которые эти вещества способны выделять при сжигании, и что взрослому человеку при обычных условиях существования необходимо около 2500—3000 калорий в день, получаемых из 70—100 г белка, 40—50 г жира и 400—500 г углеводов. На основании этих данных нередко сравнивали организм с паровой машиной, в которой потенциальная энергия пищевых веществ путем сжигания превращается в кинетическую. Эта прими тивная концепция, разумеется, сильно тормозила развитие исследовательской.
Далее, в ряде опытов было показано, что из этих групп пищевых веществ безусловно необходимы для питания лишь белки и минеральные вещества, поскольку жиры и углеводы могут образоваться за счет белков. Детализируя проблему искусственного питания и изучая различные синтетические пищевые смеси, ученые занялись энергетической и термодинамической стороной этого вопроса. В результате ряда весьма обстоятельных исследований было установлено, что количество необходимых для организма пищевых веществ должно определяться количеством калорий тепла, которые эти вещества способны выделять при сжигании, и что взрослому человеку при обычных условиях существования необходимо около 2500—3000 калорий в день, получаемых из 70—100 г белка, 40—50 г жира и 400—500 г углеводов. На основании этих данных нередко сравнивали организм с паровой машиной, в которой потенциальная энергия пищевых веществ путем сжигания превращается в кинетическую. Эта прими тивная концепция, разумеется, сильно тормозила развитие исследовательской. мысли. Однако вскоре было доказано (2), что наряду с количеством белков решающее значение для правильного питания имеет их аминокислотный состав (качество белков). В этом отношении уже тогда животные и растительные белки были разделены на полноценные (например яичный белок), содержащие все необходимые для организма аминокислоты, и неполноценные (например желатина), не содержащие многих необходимых для питания незаменимых аминокислот (тирозин, триптофан, цистин). [c.6]
мысли. Однако вскоре было доказано (2), что наряду с количеством белков решающее значение для правильного питания имеет их аминокислотный состав (качество белков). В этом отношении уже тогда животные и растительные белки были разделены на полноценные (например яичный белок), содержащие все необходимые для организма аминокислоты, и неполноценные (например желатина), не содержащие многих необходимых для питания незаменимых аминокислот (тирозин, триптофан, цистин). [c.6]
Полноценные и неполноценные белки (Реферат)
ПОЛНОЦЕННЫЕ
И НЕПОЛНОЦЕННЫЕ БЕЛКИ
Существуют
множество различных классификаций
белков: по составу, строению, функциональному
назначению и т.д. Это обусловлено тем,
что хотя элементарный состав белков не
велик и включает в себя лишь атомы C, H,
O, N, S, (иногда P) и белки построены из
остатков лишь 20 аминокислот. Но с другой
стороны в состав их молекул может входить
от несколько десятков до сотен тысяч и
даже миллионов аминокислотных остатков
в различных вариациях, и молекулы белка
могут содержать всевозможные функциональные
группы (практически всю органическую
химию). Но кроме того, с точки зрения
Но кроме того, с точки зрения
пищевой ценности белков, определяемой
их аминокислотным составом и содержанием
так называемых незаменимых аминокислот,
белки подразделяются на полноценные и
неполноценные.
Для
поддержания жизнедеятельности и
функционирования всех живых организмов
должен существовать постоянный обмен
вещества и энергии. Главный элемент,
входящий в состав белков, который нужен
всем живым организмам — углерод. По
источнику получения углерода организмы
делятся на: автотрофные — живущие за
счет неорганического источника С
(двуокиси углерода), к ним относятся
растения; гетеротрофные — использующие
органические источники С, к ним относятся
млекопитающие. Углерод необходим
организмам, т.к. является составляющим
элементом белков, из которых как из
строительного материала строятся клетки
организмов — структурные и функциональные
единицы живых организмов.
Высшие
растения способны синтезировать все
необходимые им аминокислоты и входящие
белки. Для этого им нужен азот в виде
аммиака или нитратов, сера и фосфор в
виде сульфатов и фосфатов, получаемые
из почвенного раствора. Источником
Источником
углерода служит фосфороглицериновая
кислота продукт фотосинтеза. А из
аминокислот в растениях синтезируются
все необходимые для них белки.
Млекопитающие
не могут синтезировать некоторые
аминокислоты и поэтому должны получать
их в виде пищи. Таких незаменимых
аминокислот восемь: валин, лейцин,
изолейцин, треонин, метионин, лизин,
триптофан, фенилаланин. Полноценными
считаются белки включающие в состав
эти восемь незаменимых аминокислот.
Причем продукты, содержащие эти белки
не могут быть заменены продуктами
содержащими жиры и углеводы.
Белки
— необходимая составная часть питания
человека. Отсутствие или недостаток их
в пище вызывают серьезные заболевания.
Основными источниками белков для
человека являются: мясо, яйца, рыба,
фасоль, горох и бобы. В отличие от
углеводов и жиров в организме не
происходит накапливания и запасания
белков. Если с пищей поступило больше
белков, чем необходимо для удовлетворения
текущих потребностей, продукты гидролиза
белков (аминокислоты) подвергаются
биохимическим изменениям и включаются
реакцию метаболизма (обмен веществ).
Часть аминокислот, не использованных
в качестве структурных элементов и
энергетического материала, лишаются
группы — NH2 и включаются в реакцию
углеводородного обмена.
По
этой причине питание должно включать
все необходимые для жизнедеятельности
белки различного состава со структурой
и свойствами, соответствующими выполняемым
ими функциям. Например:
-
устойчивый,
твердый белок кератина необходим для
ногтей и волос, -
белки с
нитевидными молекулами входят в состав
мышц (они способны укорачиваться и
удлиняться), -
белки с
мелкими и круглыми молекулами, легко
растворимые, используются для
транспортировки вещества, -
белки
высокоактивные, с легко изменяющейся
структурой, выполняют функции
катализаторов и передачи сигналов в
клетку из внешней среды.
Из этого видно
насколько многообразны белки и их
функции в организмах. Поэтому так важен
вопрос обеспечения организмов полноценными
белками.
Белки являются
важнейшим компонентом питания организмов
по следующим причинам:
-
С белками
связаны основные проявления жизни —
обмен веществ, сокращение мышц,
раздражимость нервов, способность к
росту, способность к размножению и даже
мышлению. -
Благодаря
белковым веществам, гемоглобину и др.,
происходит перенос кислорода. -
Ферменты
играют роль ускорителей биохимических
реакций. -
Гормоны —
регулируют обменные процессы. -
Нуклеопротеиды
— в значительной степени определяют
направление синтеза белка в организме
и являются носителями наследственных
свойств. -
Белки
представляют основу структурных
элементов клетки и тканей. -
Связывая
значительное количество воды, белки
образуют плотные коллоидные структуры,
определяющие конфигурацию тела.
Несмотря на
то, что белки составляют 1/4 часть
человеческого тела и около 2/3 его плотного
остатка, организм обладает лишь
незначительными белковыми резервами.
Единственным источником образования
белков в организме являются аминокислоты
белков пищи. Вот почему белки совершенно
незаменимы в питании человека. О
полноценности снабжения организма
белком судят по показателям азотистого
баланса.
Белки
являются единственным источником
усвояемого организмом азота. Учитывая
количество поступающего с пищей и
выделяющегося из организма азота, можно
судить о благополучие или нарушении
белкового обмена. В организме взрослых
здоровых людей, как правило, имеет место
азотистое равновесие, когда количество
поступающего с пищей азота уравнивается
с количеством азота, выделяемого из
организма. У детей азотистый баланс
характеризуется накоплением белков в
теле (стимул роста), при этом количество
поступающего с пищей азота значительно
превышает его выделение с продуктами
распада. В этих случаях врачи говорят
о положительном азотистом балансе.
Положительный азотистый баланс в
организме является признаком здоровья.
У людей получающих недостаточное
количество белка с пищей или у
тяжелобольных, в организме которых
белок усваивается плохо, наблюдается
потеря азота, то есть отрицательный
азотистый баланс
Каковы
же потребности человека в белке? Нередко
за эту величину предлагают принимать
минимальную норму белка, необходимую
для поддержания азотистого равновесия
в организме, ниже которой нормальная
жизнедеятельность человека невозможна.
Для взрослого человека эта минимальная
норма составляет всего 40-50 г усвояемого
белка в день. Нет нужды доказывать, что
эта величина намного ниже оптимальных
потребностей организма. При их определении
необходимо исходить из интенсивности
процесса обновления белков в тканях
организма, которая зависит как от
индивидуальных особенностей организма,
пола, возраста, роста, веса и т.п., так и
от характера деятельности человека,
обеспечения иммунных реакций, связанных
с защитой организма от инфекций и т.п.
С увеличением интенсивности физического
труда возрастают и потребности организма
в белке.
Нередко
возникает вопрос: равноценны ли для
человеческого организма белки,
содержащиеся в различных продуктах
питания? Безусловно, неравноценны. В
настоящее время доказано, что пищевая
ценность белков различных видов зависит
от их аминокислотного состава. Наибольшее
значение для определения полноты
усвоения белков из 20 аминокислот имеют
лишь 8, которые являются незаменимыми
в питании для взрослого человека (и на
одну больше для ребенка раннего возраста).
|
Незаменимые |
оптимальные |
содержание аминокислот, |
|||||
|
кислоты |
соотношения |
яйца |
молоко |
говядина |
треска |
мука.пш. |
картофель |
|
триптофан |
1 |
0,2 |
0,05 |
0,2 |
0,16 |
0,13 |
0,02 |
|
лейцин |
4,0 — 7,0 |
1,1 |
0,34 |
1,4 |
1,2 |
0,8 |
0,1 |
|
изолейцин |
4,9 — 4,0 |
0,8 |
0,22 |
0,9 |
0,8 |
0,48 |
0,09 |
|
валин |
3,2 — 4,2 |
0,9 |
0,24 |
0,97 |
0,9 |
0,45 |
0,1 |
|
треонин |
2,0 — 2,7 |
0,6 |
0,16 |
0,8 |
0,7 |
0,3 |
0,08 |
|
лизин |
3,2 — 4,8 |
0,8 |
0,3 |
1,5 |
1,5 |
0,24 |
0,1 |
|
метионин |
2,2 — 3,5 |
0,4 |
0,09 |
0,4 |
0,5 |
0,14 |
0. |
|
фенилаланин |
2,0 — 4,0 |
0,7 |
0,17 |
0,7 |
0,6 |
0,58 |
0,09 |
|
гистидин(дети |
1,5 |
0,3 |
0,09 |
0,6 |
0,21 |
0,1 |
Незаменимые
аминокислоты не синтезируются в организме
и должны обязательно поступать в организм
с пищей. В соответствии с концепцией
сбалансированного питания можно назвать
следующие величины, характеризующие
минимальные потребности в каждой из
незаменимых аминокислот для организма
взрослого человека и их оптимальные
соотношения, обеспечивающие полноту
использования белка. Иными словами,
полное усвоение белка пищи может быть
достигнуто только при указанных
соотношениях незаменимых аминокислот,
т.е. характеризующих их сбалансированность.
Если какой-либо из названных аминокислот
в белках пищи будет меньше, то и другие
аминокислоты не могут быть полностью
использованы организмом. Оценивая с
этой точки зрения огромное разнообразие
белков, содержащихся в продуктах питания,
мы должны будем признать их выраженную
неравноценность. Изучение аминокислотного
состава различных продуктов показало,
что белки животного происхождения
больше соответствуют структуре
человеческого тела. Более того,
аминокислотный состав белков яиц был
принят за идеальный, т.к. их усвоение
организмом человека приближается к
100%. Очень высока степень усвоения и
других продуктов животного происхождения:
молока (75-80%), мяса (70-75%), рыбы (75-80%). В тоже
время, многие растительные продукты,
особенно злаковые, содержат белки
пониженной биологической ценности: в
кукурузе, например, обнаружен значительный
дефицит лизина и триптофана, в пшенице
— лизина и треонина. В большинстве
В большинстве
растительных материалов обнаруживается
недостаток серусодержащих аминокислот.
Таким образом, в питании значительной
части населения земного шара отмечается
определенный дефицит аминокислот:
лизина, трептофана и метионина, которые
в известной мере лимитируют усвоение
пищи.
Знание
особенностей аминокислотных составов
различных продуктов позволяет значительно
более рационально использовать для
удовлетворения аминокислотных
потребностей человеческого организма
комбинации пищевых продуктов по принципу
взаимного дополнения лимитирующих их
биологическую ценность аминокислот. С
этой точки зрения благоприятным является
сочетание растительных и молочных
продуктов. Даже столь простое и широко
используемое сочетание ломтя пшеничного
хлеба со стаканом молока делает их
суммарную аминокислотную формулу
значительно более благоприятной, чем
при раздельном потреблении тех же
продуктов. При этом следует иметь в
виду, что введение в злаковые продукты,
например, обезжиренного молока в тесто,
приводит не только к увеличению общего
содержания белка, но и к значительному
эффекту, получаемому от более полного
усвоения белковых компонентов злаковых
продуктов. Выгодными с точки зрения
Выгодными с точки зрения
соответствия оптимальной аминокислотной
формуле являются также разные мучные
изделия с творогом (ватрушки, вареники,
сочники) и мучные блюда с мясом (пельмени,
блины, пироги). В тоже время пироги с
рисом и другими крупами, повидлом,
капустой, картофелем, с точки зрения
удовлетворения оптимальных потребностей
организма в аминокислотах являются
менее оправданными.
Итак,
мы установили, что человек нуждается в
определенном количестве белка. Он должен
получать с пищей его достаточное
количество, но аминокислоты этих белков
должны быть в определенных сбалансированных
отношениях. Таких пищевых продуктов, в
которых не содержалось бы необходимых
для жизни аминокислот, почти нет, но их
количество в разных продуктах различно:
в животных продуктах этих аминокислот
много, в картофеле и капусте — мало. Но
и среду продуктов растительного
происхождения имеются источники
достаточно ценных белков. Так, крупы
содержат от 6 до 16% белка, наиболее ценные
белки содержатся в гречневой крупе,
овсянке, рисе и бобовых, особенно сое.
Все
разнообразие пищевых продуктов в
большинстве стран принято делить на
группы, отражающие как происхождение,
так и особенности их химического состава.
Первая
группа — молочные продукты. Именно молоко
почти полностью обеспечивает потребности
не только детского, но и взрослого
организма. В 100 г молока содержится 3 г
белка. Пол-литра молока в день — это более
Ѕ суточной потребности человека в
животном белке. Белки молока содержат
все аминокислоты и в наилучшем соотношении,
необходимом организму. В молочных белках
содержатся в значительных количествах
метионин — аминокислота, важная для
обеспечения нормальной деятельности
печени. Для людей, работающих с вредными
веществами, молочные белки имеют
профилактическое значение, т.к. улучшают
деятельность печени и нервной системы.
Очень ценными продуктами питания
являются различные виды сыров и творога.
В твороге содержится 17% белков, большое
количество лецитина и несколько меньшее
количество незаменимой аминокислоты
метионина. Различные сыры содержат
около 20% белка, сухое молоко — около 23%.
Таким образом в молоке и молочных
продуктах весьма удачно сочетаются
полноценные белки.
Вторая
группа — мясо, рыба, яйца. Изучение
аминокислотного состава различных
продуктов показало, что степень усвоения
мясных продуктов очень высока.
Биологическая ценность белков рыбы не
ниже, поскольку их аминокислотные
составы весьма близки. Установлено, что
белки рыбы и многих продуктов моря даже
несколько легче перевариваются и
усваиваются в организме человека, чем
белки мяса. Весьма ценным и питательным
продуктом являются яйца, в них содержатся
лучшие по аминокислотному составу
белки. До настоящего времени сравнительно
большой процент населения земного шара
по ряду мотивов, в том числе и религиозных,
по-разному относится к мясу. В ряде стран
и у отдельных групп населения существуют
многовековые запреты на отдельные виды
мяса. В Индии не едят говядины, а среди
мусульман бытует запрет на свинину.
Славяне, как правило, не едят конину и
с пренебрежением относятся к мясу собак
и лягушек. А в большинстве стран Азии и
Европы широко используется конское
мясо. Мясо собак используется для питания
Мясо собак используется для питания
в Китае, а мясо лягушек считается
деликатесом во Франции. Но биологическая
ценность мяса различных животных зависит
не столько от особенностей строения
белков, сколько от содержания в нем
экстрактивных веществ и других соединений.
В настоящее время нет никаких оснований
утверждать, что биологическая ценность
белков конского мяса (или даже мяса
лягушек) по составу хуже мяса крупного
рогатого скота и свиней. Мясо, несомненно,
очень полезный продукт благодаря
высокому содержанию полноценного
животного белка — в различных сортах
мяса и птицы содержится от 14 до 24% белка.
Взаимозаменяемость
первой и второй группы. Продукты двух
первых групп являются наиболее важными
поставщиками полноценного белка, с
близкими по их аминокислотному составу
и хорошей усвояемости организмом.
Продукты первой и второй группы как
источники белка в значительной степени
могут заменять друг друга. Это означает,
что их следует включать в меню в
эквивалентных по содержанию белка
количествах и в разнообразных сочетаниях
с продуктами растительного происхождения.
Третья
группа — мука, хлебобулочные изделия,
крупы, макаронные изделия. Основное
значение продуктов этой группы, содержащих
большое количество углеводов, — снабжение
организма энергией. Как бы промежуточным
звеном между продуктами третьей и пятой
группы является картофель. Картофель
употребляется населением многих стран
в относительно больших количествах. В
100 г картофеля содержится 2 г белка. В
различных сортах хлеба белка содержится
от 4,7 до 7% белка. И при употреблении
большого количества хлеба и картофеля
содержащиеся в них растительные белки
удовлетворяют общую потребность человека
в белках примерно на 30 — 35%.
Четвертая
группа — жиры. Дневная потребность
взрослого человека в жирах составляет
80 — 100 г, из них немного менее 1/3 должны
составлять растительные масла.
Пятая
и шестая группы — овощи и фрукты. В овощах
и фруктах содержится всего 1,2 — 1,5% белков,
но при достаточном потреблении овощей
и фруктов и эти белки имеют значение в
питании человека. Белки картофеля и
овощей, особенно капусты, содержат
жизненно необходимые аминокислоты в
таких же соотношениях, как белки животного
происхождения.
Перечисленные
шесть групп продуктов дополняют одна
другую, обеспечивая организм необходимыми
материалами для построения и обновления
структур человеческого тела белками,
различающимися многочисленными
функциями, структурой, составом.
Подразделяющимися на полноценные и
неполноценные, отличающимися наличием
или отсутствием восьми незаменимых
аминокислот (валин, лейцин, изолейцин,
треонин, метионин, лизин, триптофан,
фенилаланин). Но признавая неравноценность
продуктов с точки зрения аминокислотного
состава, и то, что белки животного
происхождения более соответствуют
структуре человеческого тела, чем
растительные; отметим, что комбинация
различных продуктов, по принципу
взаимного дополнения лимитирующих
биологическую ценность их аминокислот,
позволяет удовлетворить потребность
человека в белках и обеспечить их высокую
усвояемость.
ЛИТЕРАТУРА:
-
Грин
Н., Стаут У., Тейлор Д. Биология.
Т.1. — М.: Мир, 1990. — 368с.
— 368с.
-
Книга
о вкусной и здоровой пище. Питание
и здоровье /Гл. ред.
акад. А.А. Покровский. — М.: Пищевая
промышленность, 1978.- 384с.
-
Павлов
И.Ю., Вахненко Д.В., Москвичев Д.В.
Биология: Пособие для вузов. —
Ростов-на-Дону: Феникс, 1996.- 576с.
-
Популярная
медицинская энциклопедия /Гл.
ред. А.Н. Бакулев. — М.: Советская
энциклопедия, 1966.- 1040с.
Полноценные и неполноценные белки – в чем разница?
Белки (или протеины) являются важнейшими компонентами пищи (наряду с жирами, углеводами, витаминами, минералами и водой).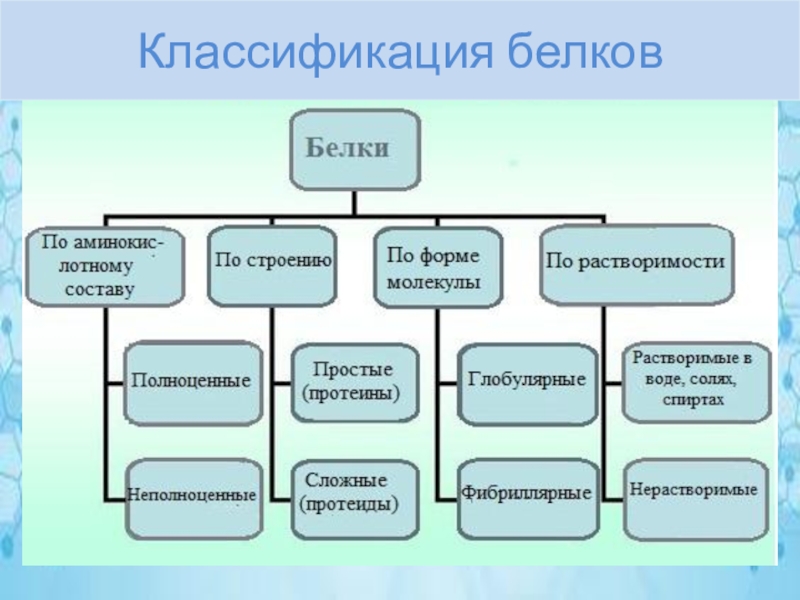
По мнению специалистов, их доля в суточном рационе должна составлять 10 – 15%. Сегодня мы поговорим о строении, а также различных видах белков.
Простые и сложные, животные и растительные, полноценные и неполноценные белки – в чем их отличие.
Белки – это высокомолекулярные вещества, имеющие сложное строение. Мы не способны усваивать их в том виде, в каком они поступают вместе с пищей, так как для нас они являются чужими.
Поэтому, попадая в организм, пищевые белки распадаются на небольшие структурные единицы — аминокислоты. Именно из аминокислот наш организм создает собственные, свойственные только ему белки, которые впоследствии использует на свои нужды.
Как известно из белков состоит наша кожа, волосы, ногти, мышцы и т.д. Кроме того белки (протеины) являются неотъемлемой частью спортивного питания.
Всего насчитывается 20 аминокислот. В их состав входит кислород, водород, углерод, азот, иногда сера и фосфор.
Часть аминокислот образуются в самом организме благодаря кишечным бактериям. Такие аминокислоты называются заменимыми.
Такие аминокислоты называются заменимыми.
Но существуют также 8 незаменимых аминокислот:
- триптофан;
- лизин;
- валин;
- лейцин;
- изолейцин;
- фенилаланин;
- метионин;
- треонин;
- а также гистидин (для детей).
Незаменимые аминокислоты отсутствуют в организме, поэтому обязательно должны поступать вместе с пищевыми продуктами.
Стоит отметить, что в организме человека существует около 5 миллионов различных белков, каждый из которых выполняет свою конкретную функцию.
Своим многообразием протеины обязаны именно аминокислотам. Последние, соединяясь друг с другом, образуют самые разнообразные комбинации.
Рассмотрим более подробно виды белков:
1. Простые и сложные. Первые состоят только из аминокислот (белковой части), в состав же последних входит еще простетическая группа (небелковая часть).
2. Животные (мясо, рыба, птица, молочные продукты) и растительные (орехи, соя, горох, фасоль). При этом на животные белки должно приходится около 60%.
При этом на животные белки должно приходится около 60%.
3. Полноценные и неполноценные белки. Полноценные белки включают все незаменимые аминокислоты, которые самостоятельно в организме не образуются.
Полноценные белки содержатся в продуктах животного происхождения, а также некоторой растительной пище (горох, фасоль, соя).
Стоит отметить, что самым ценным является белок куриного яйца, который содержит полный набор аминокислот в нужных пропорциях.
Кроме того 200 г говядины или 200 г трески или 1,5 л молока способны обеспечить организм человека массой 70 кг всеми незаменимыми аминокислотами.
В неполноценных белках те или иные незаменимые аминокислоты содержатся в незначительных количествах либо же полностью отсутствуют.
Многие растительные белки являются неполноценными, например, некоторые злаки (пшеница, ячмень и другие). Они бедны лизином, триптофаном, треонином и метионином.
Для повышения биологической ценности хлеба в него добавляют лизин.
4. Глобулярные (имеют сферическую форму) и фибриллярные (имеют вытянутую нитевидную форму).
Одни глобулярные белки такие, как альбумины и глобулины, содержатся в яичном белке, молоке, а также сыворотке крови.
Источниками других, например, глютелинов и проламинов, служат растительные белки (пшеница, ячмень, кукуруза и другие).
Фибриллярные белки в основном являются животными белками и выполняют структурную функцию в организме.
К ним относятся коллаген (белок хрящевой, костной и соединительной ткани), эластин (белок соединительной ткани мышц, связок и сосудов), кератины (белки кожи, волос и ногтей).
5. Высококачественные (мясо, рыба, птица, соя, яйца, сыр, молоко) и низкокачественные (картофель, макароны, рис, хлеб, орехи, бобы).
Итак, мы узнали, из чего состоят протеины, чем отличаются полноценные белки от неполноценных, а также познакомились с другими видами белков.
В следующей статье мы поговорим о том, чем полезен белок для организма, каковы его функции.
что такое неполноценные белки — Школьные Знания.com
Помогите з лабораторным заданием дам 30балов 7 класс
кому не сложно посмотрите пожалуйста срочно нужно
СрОчНо!!!!!!1,Выделите цветом правильные утверждения.Выделите цветом тех животных, которым нужна вода для размножения:карасьлягушказмеяящерицачерепаха
…
сусликаистстраусакула2,Впишите номера правильных предложений (только цифры без пробелов в порядке возрастания):1. Черепахи, змеи и крокодилы относятся к классу Пресмыкающиеся.2. У Земноводных и Пресмыкающихся из икринки вылупляется головастик, который сначала дышит жабрами. 3. Молоко для вскармливания детёнышей могут вырабатывать только Млекопитающие.4. Постоянная температура тела характерна для пресмыкающихся, птиц и млекопитающих. 3,Подчеркните те свойства, которые помогают Пресмыкающимся жить в пустынях:кожа, покрытая чешуёйяркая окраскаоткладывание кожистых яицдыхание лёгкимиумение летатьумение рыть норыпостоянная температура тела
Укажіть за рахунок чого відбувається ріст трубчастих кісток в довжину
Подчеркните животных, относящихся к типу Кишечнополостные:
гидра
улитка
медуза
коралл
дождевой червь
осьминог
Зіставте методи генетики людина із їхнім визначенням та отримайте термін, яким позначають вчення про спадкове здоров’я людини т
1 Генеалогічний
2 Близ
…
нюковий
3 Цитогенетичний
4 Популяційний
5 Біохімічний
6 Дерматогліфічний
7 Молекулярно- генетичні
8 Онтогенетичний
А Вивчення прояву ознаки в процесі індивідуального розвитку
В Дослідження ролі спадковості та середовища в прояві ознаки
Г Для дослідження каріотипу людини
Е Вивчення генетичної структури видових груп
Є Вивчення родоводів людини
І Ґрунтується на вивченні рельєфу шкіри на пальців, долонях
К Уможливлюютьвивченняорганізаціїгенетичногоапарату
Н Засновані на вивченні метабол
Срочно пожалуйста помогите. Спостереження за результатами подій, що відбулися?А безпосереднєБ опосереднєВ прямеГ не пряме
Спостереження за результатами подій, що відбулися?А безпосереднєБ опосереднєВ прямеГ не пряме
Увечері відчувають сонливість і рано лягають спать?А совиБ голубиВ жаворонкиГ лінивці
Срочно помогите даю 20 балов.Прикладом добових біоритмів є?А зимова сплячка Б міграції птахівВ нашестя сараниГ нічний сон
Срочно помогіте пожалуйста даю 15 балов!!!!!!! Розвиток кімнатних рослин вивчає?А фізикаБ географіяВ біологіяГ хімія
Химический состав основных тканей мяса (часть 1)
Различные виды основных тканей характеризуются разным химическим составом (табл. 5), который зависит от вида, возраста, пола и упитанности животного, анатомической части туши и других факторов.
Таблица 5. Химический состав основных тканей мяса.
|
Название ткани |
Содержание, % |
|||
|
воды |
белков |
жиров |
золы |
|
|
Мышечная |
72-80 |
18-20 |
2-3 |
0,7-1,5 |
|
Жировая |
5-32 |
0,8-5,0 |
60-94 |
0,1-1,0 |
|
Соединительная |
58-63 |
21-40 |
1,0-3,3 |
0,5-0,7 |
|
Костная |
15-53 |
14-23 |
6-30 |
14-50 |
Мышечная ткань наиболее ценна в пищевом отношении, так как содержит значительное количество полноценных белков, а также липиды (жиры и липоиды), азотистые небелковые экстрактивные и минеральные вещества, витамины (табл. 3).
3).
Таблица 3. Состав витаминов мяса (на 100 г съедобной части продукта)
|
Название витамина |
Говядина I категории |
Баранина 1 категории |
Свинина мясная |
|
А, мг |
Следы |
Следы |
Следы |
|
Е, мг |
0,57 |
0,70 |
— |
|
С, мг |
Следы |
Следы |
Следы |
|
В6, мг |
0,37 |
0,30 |
0,33 |
|
В12, мкг |
2,60 |
— |
— |
|
Биотин, мкг |
3,04 |
— |
— |
|
Ниацин, мг |
4,70 |
3,80 |
2,60 |
|
Пантотеновая кислота, мг |
0,50 |
0,55 |
0,47 |
|
Рибофлавин, мг |
0,15 |
0,14 |
0,14 |
|
Тиамин, мг |
0,06 |
0,08 |
0,52 |
|
Фолацин, мкг |
8,40 |
5,10 |
4,10 |
|
Холин, мг |
70,00 |
90,00 |
75,00 |
Примечание: «-» — отсутствие данных.
Белки мышечной ткани состоят преимущественно (на 75-90%) из биологически полноценных протеинов, содержащих в достаточном и благоприятном соотношении все незаменимые (не синтезируемые организмом взрослого человека) аминокислоты: валин, лизин, триптофан, лейцин, изолейцин, фенилаланин, метионин, треонин.
Полноценные белки представлены в основном белками миофибрилл и саркоплазмы мышечного волокна. Неполноценные (соединительно-тканные) белки входят главным образом в состав оболочки (сарколеммы) мышечного волокна, встречаются также в ядрах и межклеточном пространстве мышечной ткани.
Все внутриклеточные белки, кроме тропомиозина, имеют почти полный набор аминокислот, за исключением оксипролина и оксилизина, и все незаменимые аминокислоты. В соединительно-тканных белках отсутствует триптофан, а остальные незаменимые аминокислоты, за исключением валина, содержатся в сравнительно незначительных количествах. Эти белки характеризуются наличием заменимых аминокислот оксипролина и оксилизина.
Биологическая ценность белков мышечной ткани и мяса может быть оценена по отношению содержания триптофана к содержанию оксипролина.
Основные полноценные белки, %: миозин — 35-40, актин — 15-20, актомиозин — 3-4, миоген — 20, миоальбумин — 1-2, глобулин X — 20, миоглобин — 0,1-1,0.
Основные неполноценные белки, %: коллаген, эластин и ретикулин, составляющие 2-3% общего количества белков мышечной ткани, а также миофибриллярный белок тропомиозин — 2,5%.
Липиды представлены жирами и липоидами. Содержание внутриклеточных жиров в мышечной ткани составляет 2-3%, а жиров, откладываемых между мышечными волокнами, пучками и мускулами, колеблется от 1,5 до 8% в зависимости от упитанности животного и других факторов. В составе внутримышечных жиров свиней предельные жирные кислоты — миристиновая, пальмитиновая и стеариновая — составляют 41%, крупного рогатого скота — 49, овец — 52%. Соответственно в жире свиней больше непредельных жирных кислот, в том числе незаменимых полиненасыщенных — линолевой, арахидоновой.
К липоидам мышечной ткани мяса относятся фосфолипиды — лецитин, кефалин и сфин-гомиелин, которые составляют 0,5-0,8% массы мышечной ткани, а также холестерин — 50-65 мг %.
Углеводы составляют около 1,5%. В основном это гликоген — 0,6-0,9% массы мышечной ткани; в небольших количествах содержатся также глюкоза, декстрины, мальтоза.
Небелковые азотистые экстрактивные вещества в мышечной ткани: креатин, креатин-фосфат, карнозин, АТФ, АДФ, АМФ, свободные аминокислоты и продукты их превращений в количестве 0,9-2,5%.
Из минеральных веществ содержатся макроэлементы: калий — 366 мг %, фосфор — 175, натрий — 65, хлор — 57, магний — 24, кальций — 12, железо — 2,5 мг %, а также микроэлементы: медь — 30-86 мкг %, никель — 7,2-9,3, молибден — 8,5, олово — 3,6-4,0, свинец — 3,9-7,8, алюминий — 440- 500, хром — 1 — 2, марганец — 9-40, кобальт — 3-5, барий — 4-40, ванадий — 5-7, фтор — 20-60, йод — 13-14 мкг %.
Витамины мышечной ткани в основном водорастворимые: В1 — 0,6-1,4 мг%, В2 — 0,2, В3 — 0,4-2,0, В6 — 0,6, Н — 5, РР — 8, холин — 80-110 мг %; витамин С практически отсутствует. Жирорастворимые витамины А и D содержатся в ничтожно малых количествах.
Жирорастворимые витамины А и D содержатся в ничтожно малых количествах.
Определение белка Бенс-Джонса количественно в суточной моче в Санкт-Петербурге
Описание анализа
Белок Бенс-Джонса — онкомаркер, открытый и описанный около 200 лет назад Генри Бенс-Джонсом. Его обнаружение в моче до наших дней используется в качестве диагностического теста множественной миеломы (опухоли из плазматических клеток).
Опухолевые клетки вырабатывают неполноценные белки-иммуноглобулины — легкие цепи (в норме должны синтезироваться легкие и тяжелые цепи). Аномальные белковые комплексы названы белком Бенс-Джонса. Он проходит через почечные канальцы в мочу и может быть обнаружен в ней даже в минимальном количестве.
Это помогает поставить диагноз, а также оценить риск повреждения почек, так как чрезмерная фильтрация белка приводит со временем к необратимой почечной недостаточности. Количественное определение белка Бенс-Джонса позволяет оценить и эффективность лечения миеломной болезни.
Реже белок Бенс-Джонса появляется в моче при первичном амилоидозе и макроглобулинемии Вальденстрема, лейкозе, раке щитовидной, поджелудочной железы, аутоиммунных болезнях.
Показания к назначению:
1. Симптомы миеломной болезни или других похожих заболеваний с образованием неполноценных иммуноглобулинов:
-
боли в костях, внезапные переломы;
-
признаки поражения почек и нервной системы;
-
редкие и скудные мочеиспускания, отеки;
-
лихорадка;
-
частые инфекции;
-
одышка, слабость, утомляемость;
-
высокий белок в крови, моче;
-
ускоренная СОЭ;
-
повышенная вязкость крови.
2. Контроль за эффектом лечения миеломной болезни, амилоидоза, болезни легких цепей, макроглобулинемии Вальденстрема.
С этим исследованием назначают
К какому врачу обратиться?
Терапевт;врач общей практики;онколог;гематолог;нефролог.
Источники
-
Кишкун А. А. Клиническая лабораторная диагностика: Учебное пособие. — М: ГЭОТАР-Медиа, 2015. — 976 с.
-
Костерина А.В. Дифференциальная диагностика моноклональных гаммапатий лабораторными методами // Практическая медицина, 2016, № 2, с. 22-26.
Подготовка к анализу
-
за 14 дней до исследования исключить прием антибактериальных препаратов;
-
перед сдачей анализа произвести тщательный туалет наружных половых органов;
-
женщинам рекомендуется сдавать исследование до менструации или через 2 дня после ее окончания;
-
начинать отсчет периода сбора мочи лучше всего утром с пустым мочевым пузырем;
-
после сна опорожняется мочевой пузырь в унитаз, записывается время и дата, начинается отсчет — 24 часа;
-
в течение суток (в том числе и в ночное время), моча собирается в 2-3 литровую емкость, последняя порция — утро следующего дня (моча после ночи) в то же время, когда накануне был начат сбор;
-
измеряется общий объем мочи (суточный), записывается;
-
из общего объема отливается 100 мл в специальный пластиковый контейнер, который маркируется — ФИО пациента, объем мочи, собранной за сутки и доставляется в лабораторию за 1 час после сбора;
-
питание рекомендуется обычное, питьевой режим — 1,5-2 л жидкости в сутки;
-
необходимо исключить прием мочегонных препаратов, алкогольных напитков;
-
накануне начала сбора мочи необходимо воздержаться от физических нагрузок;
-
емкость, в которую собирается моча, необходимо хранить в прохладном, темном месте, оптимально — в условиях холодильника, при температуре 2-8 градусов, на нижней полке (не допускать замерзания!).

Также необходимо отменить прием препаратов, влияющих на работу почек с разрешения специалиста.
Противопоказания
Абсолютных противопоказаний нет.
Интерпретация результатов
Причины понижения:
Иногда белок Бенс-Джонса не обнаруживается и при миеломной болезни, особенно на начальной стадии.
Причины повышения:
-
множественная миелома;
-
макроглобулинемия Вальденстрема;
-
лимфома с образованием иммуноглобулинов;
-
лимфатический лейкоз;
-
аутоиммунные заболевания;
-
хроническая почечная недостаточность;
-
рак поджелудочной, щитовидной железы.
Обратите внимание, что интерпретацией результатов исследования должен заниматься лечащий врач. Пожалуйста, не занимайтесь самолечением, а лучше обратитесь к специалисту.
Неполноценные белки: действительно ли это проблема?
Что такое «неполноценные» белки?
Белок состоит из строительных блоков, называемых аминокислотами. Хотя в природе существуют сотни аминокислот, для производства всего белка, содержащегося в вашем организме, необходимо только 20. Их можно разделить на три основные категории (1):
- Незаменимые аминокислоты. Незаменимые аминокислоты состоят из девяти аминокислот, которые ваш организм не может производить. Единственным способом получить эти аминокислоты является употребление содержащих их продуктов.
- Заменимые аминокислоты. В эту категорию входят оставшиеся 11 аминокислот, которые ваш организм обычно может производить из 9 незаменимых аминокислот.
- Условно незаменимые аминокислоты. Эти аминокислоты обычно считаются заменимыми, но становятся незаменимыми в подростковом возрасте, во время беременности или при определенных состояниях, таких как травма или болезнь.
Продукты, содержащие хорошее количество всех девяти незаменимых аминокислот, обычно считаются источниками «полноценного» белка, тогда как продукты, которые не содержат, считаются «неполноценными».
Вывод:
Белок состоит из аминокислот, которые можно разделить на незаменимые, заменимые или условно незаменимые. Богатые белком продукты обычно классифицируются как «полноценные» и «неполноценные» в зависимости от количества содержащихся в них незаменимых аминокислот.
Какие продукты содержат «неполноценные» белки?
Вопреки распространенному мнению, большинство продуктов – как животного, так и растительного происхождения – содержат все девять незаменимых аминокислот. Разница заключается в их количестве.
Например, мясо, рыба, яйца и молочные продукты содержат высокие уровни всех девяти незаменимых аминокислот. С другой стороны, растения, как правило, содержат небольшое количество как минимум одной или двух незаменимых аминокислот, в зависимости от категории, к которой они принадлежат.
Например, бобовые и овощи, как правило, содержат мало метионина и цистеина, тогда как зерна, орехи и семена, как правило, содержат мало лизина (2).
На практике это означает, что соблюдение диеты, в которой содержится слишком мало какой-либо группы продуктов, может привести к получению недостаточного количества незаменимых аминокислот.
Вот почему продукты животного происхождения обычно считаются источниками «полноценного» белка, в то время как большинство продуктов растительного происхождения считаются источниками «неполноценного» белка.
Исключение составляют соя, киноа, амарант, гречка и пищевые дрожжи, а также семена конопли и чиа. Эти растительные продукты содержат большое количество всех девяти незаменимых аминокислот и считаются источниками «полноценного» растительного белка.
Вывод:
Большинство продуктов растительного происхождения обычно рассматриваются как источники «неполноценного» белка, за некоторыми исключениями. Напротив, продукты животного происхождения считаются «полноценными» белками.
Можете ли вы получить достаточно полноценного белка на вегетарианской или веганской диете?
Многие люди считают, что из-за низкого содержания в вегетарианской и веганской диете белков животного происхождения им часто не хватает «полноценного» белка.
Однако, за редким исключением, это случается очень редко.
В настоящее время нет никаких свидетельств дефицита белка среди вегетарианцев или веганов, за исключением, возможно, небольшого процента людей, которые едят слишком мало калорий или придерживаются однообразных или ограниченных схем питания, таких как фруктовые диеты или диеты на основе картофеля (3).
Тем не менее белок, содержащийся в растениях, может быть немного сложнее для вашего организма по сравнению с белком из мяса и других продуктов животного происхождения.
Вот почему вегетарианцам и веганам иногда рекомендуется есть немного больше белка, чем мясоедам, то есть около 1 грамма на кг массы тела в день (4).
Тем не менее текущие данные свидетельствуют о том, что эта разница в усвоении, вероятно, слишком мала, чтобы вегетарианцы или веганы получали недостаточное количество незаменимых аминокислот из своего рациона (3).
Короче говоря, пока растительная диета остается достаточно калорийной и предлагает большое разнообразие источников белка, нет причин беспокоиться о том, что на вегетарианской или веганской диете будет слишком мало «полноценного» белка.
Вывод:
Вегетарианцам и веганам не составит труда получить достаточное количество «полноценного» белка из своего рациона, то есть до тех пор, пока диета остается разнообразной и достаточно калорийной.
Подведем итог
Богатые белком продукты, которые содержат большое количество всех девяти незаменимых аминокислот, обычно считаются источниками «полноценного» белка, а те, которые не содержат, считаются источниками «неполноценного» белка.
Это приводит к тому, что большинство растительных продуктов рассматривается как «неполноценные» белки, что увековечивает миф о том, что растительные диеты могут не предлагать нужное количество или тип белка.
Тем не менее до тех пор, пока растительная диета содержит хорошее разнообразие пищевых групп и достаточно калорий, у вегетарианцев или веганов мало причин беспокоиться о «полноценных» или «неполноценных» белках.
Учтите, что это касается здоровых людей среднего веса. Однако потребности в питательных веществах могут варьироваться в зависимости от вашего уровня физической активности, массы тела и состояния здоровья. Если вы худеете или испытываете недостаток энергии, обратитесь к врачу или диетологу.
Материал основан на научных данных. Цифры в скобках (1, 2, 3) являются интерактивными ссылками на рецензируемые научные статьи. Подготовлен специалистами исключительно в ознакомительных целях. Его не следует использовать в качестве руководства для лечения заболеваний, и он не может заменить профессиональную медицинскую консультацию, диагностику или лечение. В случае заболевания или каких-либо симптомов, вам не следует заниматься самолечением и всегда следует обращаться к врачу.
Значение трансляции: дефекты синтеза белка при наследственном заболевании
Джексон, Р. Дж. Альтернативные механизмы инициации трансляции мРНК млекопитающих. Biochem. Soc. Пер. 33 , 1231–1241 (2005).
CAS
Статья
Google ученый
Mangus, D. A., Evans, M. C. & Jacobson, A. Поли (A) -связывающие белки: многофункциональные каркасы для посттранскрипционного контроля экспрессии генов. Genome Biol. 4 , 223 (2003).
Артикул
PubMed
PubMed Central
Google ученый
де Моор, К. Х., Мейер, Х. и Лиссенден, С. Механизмы контроля трансляции с помощью 3 ‘НТО в развитии и дифференцировке. Семин. Cell Dev. Биол. 16 , 49–58 (2005).
CAS
Статья
Google ученый
Каццола, М.И Шкода, Р. С. Трансляционная патофизиология: новый молекулярный механизм болезней человека. Кровь 95 , 3280–3288 (2000).
CAS
Google ученый
Козак М. Новые связи между инициацией трансляции и заболеваниями человека. Мамм. Геном 13 , 401–410 (2002).
CAS
Статья
Google ученый
Пикеринг, Б.М. и Уиллис, А. Е. Влияние структурированных 5′-нетранслируемых областей на трансляцию и заболевание. Семин. Cell Dev. Биол. 16 , 39–47 (2005).
CAS
Статья
Google ученый
Stoneley, M. et al. Синтез белка c-Myc инициируется внутренним входным сегментом рибосомы во время апоптоза. Мол. Клетка. Биол. 20 , 1162–1169 (2000).
CAS
Статья
PubMed
PubMed Central
Google ученый
Стоунли, М., Paulin, F. E. M., Le Quesne, J. P. C., Chappell, S. A. & Willis, A. E. Нетранслируемая область c-myc 5 ‘содержит внутренний входной сегмент рибосомы. Онкоген 16 , 423–428 (1998).
CAS
Статья
Google ученый
Paulin, F. E. M., Chappell, S. A. и Willis, A. E. Одно нуклеотидное изменение во внутреннем сегменте входа в рибосому c-myc приводит к усиленному связыванию группы белковых факторов. Nucl. Acids Res. 26 , 3097–3103 (1998).
CAS
Статья
Google ученый
Evans, J. R. et al. Члены семейства поли (rC) связывающих белков стимулируют активность внутреннего входного сегмента рибосомы c-myc in vitro и in vivo . Онкоген 22 , 8012–8020 (2003).
Артикул
CAS
Google ученый
Хаддер, А.И Вернер Р. Анализ мутации при болезни Шарко – Мари – Тута выявляет важный внутренний элемент сайта входа в рибосому в гене коннексина-32. J. Biol. Chem. 275 , 34586–34591 (2000).
CAS
Статья
Google ученый
Yoon, A. et al. Нарушение контроля IRES-опосредованной трансляции при врожденном Х-сцепленном дискератозе. Наука 312 , 902–906 (2006). Модель на мышах для Х-сцепленного врожденного дискератоза показывает дефект в IRES-опосредованной инициации трансляции.Вместе со ссылкой 14 в этом документе излагается дискуссия о роли перевода при этом заболевании.
CAS
Статья
Google ученый
Лю, Дж. М. и Эллис, С. Р. Рибосомы и поражение костного мозга: случайная ассоциация или молекулярная парадигма? Кровь 107 , 4583–4588 (2006).
CAS
Статья
Google ученый
Вонг, Дж.М. и Коллинз, К. Уровень теломеразной РНК ограничивает поддержание теломер при врожденном Х-сцепленном дискератозе. Genes Dev. 20 , 2848–2858 (2006). Эта статья показывает, что дефекты теломер являются основной причиной врожденного Х-сцепленного дискератоза в клетках пациентов, в то время как наблюдались нормальные уровни псевдоуридиновой модификации рРНК и нормальная кинетика процессинга предшественника рРНК.
CAS
Статья
PubMed
PubMed Central
Google ученый
Докаль, И.Тяжелая апластическая анемия, включая анемию Фанкони и врожденный дискератоз. Curr. Opin. Гематол. 3 , 453–460 (1996).
CAS
Статья
Google ученый
Вуллиами Т. и Докал И. Врожденный дискератоз. Семин. Гематол. 43 , 157–166 (2006).
CAS
Статья
Google ученый
Лю Л.и другие. Мутация 5′-UTR CDKN2A создает аберрантный инициирующий кодон и предрасполагает к меланоме. Nature Genet. 21 , 128–132 (1999).
Артикул
CAS
Google ученый
Choi, B. Y. et al. Супрессор опухолей p16 (INK4a) предотвращает трансформацию клеток за счет ингибирования фосфорилирования c-Jun и активности AP-1. Nature Struct. Мол. Биол. 12 , 699–707 (2005).
CAS
Статья
Google ученый
Hinnebusch, A. G. в Трансляционный контроль экспрессии генов (редакторы Соненберг, Н., Херши, Дж. В. Б. и Мэтьюз, М. Б.) 185–243 (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, 2000).
Google ученый
Гордый, К. Г. eIF2 и контроль физиологии клетки. Семин. Cell Dev.Биол. 16 , 3–12 (2005).
CAS
Статья
Google ученый
Van der Knaap, M. S. et al. Мутации каждой из пяти субъединиц фактора инициации трансляции eIF2B могут вызывать лейкоэнцефалопатию с исчезновением белого вещества. Ann. Neurol. 51 , 264–270 (2002). eIF2B является первым фактором инициации цитозольной трансляции, который был идентифицирован как связанный с заболеванием человека.Несмотря на важную роль в синтезе белка, мутации приводят к тяжелому расстройству белого вещества у детей.
CAS
Статья
Google ученый
Fogli, A. et al. Тяжелый вариант детской атаксии с центральной гипомиелинизацией / лейкоэнцефалопатией исчезающего белого вещества, связанной с мутацией eIF21B5. Неврология 59 , 1966–1968 (2002).
CAS
Статья
Google ученый
Ван дер Кнаап, М.S. et al. Расстройства, связанные с eIF2B: антенатальное начало и поражение нескольких органов. г. J. Hum. Genet. 73 , 1199–1207 (2003).
CAS
Статья
PubMed
PubMed Central
Google ученый
Fogli, A. et al. Влияние генотипа на естественное течение лейкодистрофий, связанных с eIF2B. Неврология 62 , 1509–1517 (2004).
CAS
Статья
Google ученый
Ван дер Кнаап, М.S. et al. Мутация Arg113His в eIF2Bepsilon как причина лейкоэнцефалопатии у взрослых. Неврология 62 , 1598–1600 (2004).
CAS
Статья
Google ученый
Prass, K. et al. Лейкоэнцефалопатия у взрослых с исчезновением белого вещества, проявляющаяся деменцией. Ann. Neurol. 50 , 665–668 (2001).
CAS
Статья
Google ученый
Фогли, А.и другие. Снижение активности фактора обмена гуаниновых нуклеотидов у пациентов с мутацией eIF2B. евро. J. Hum. Genet. 12 , 561–566 (2004).
CAS
Статья
Google ученый
ван Колленбург. B. et al. Регуляция синтеза белка в лимфобластах пациентов с исчезающим белым веществом. Neurobiol. Дис. 21 , 496–504 (2006).
CAS
Статья
Google ученый
Кантор, Л.и другие. Повышенная реакция на стресс в первичных фибробластах, экспрессирующих мутантные гены eIF2B, от пациентов с лейкодистрофией CACH / VWM. Hum. Genet. 118 , 99–106 (2005).
Артикул
Google ученый
Van der Voorn, J. P. et al. Развернутый белковый ответ при болезни исчезающего белого вещества. J. Neuropathol. Exp. Neurol. 64 , 770–775 (2005).
CAS
Статья
Google ученый
ван Колленбург, Б.и другие. Глиа-специфическая активация всех путей развернутого белкового ответа при болезни исчезающего белого вещества. J. Neuropathol. Exp. Neurol. 65 , 707–715 (2006).
CAS
Статья
Google ученый
McCullough, K. D., Martindale, J. L., Klotz, L.O., Aw, T. Y. & Holbrook, N. J. Gadd153 сенсибилизирует клетки к стрессу эндоплазматического ретикулума, подавляя BCL2 и нарушая окислительно-восстановительное состояние клеток. Мол. Клетка. Биол. 21 , 1249–1259 (2001).
CAS
Статья
PubMed
PubMed Central
Google ученый
Scheper, G.C., Proud, C.G. и Van der Knaap, M.S. Неправильная инициация трансляции вызывает исчезновение белого вещества головного мозга. Trends Mol. Med. 12 , 159–166 (2006).
CAS
Статья
Google ученый
Шиффманн, Р.И Элрой-Стейн, О. Детская атаксия с гипомиелинизацией ЦНС / заболеванием исчезающего белого вещества — распространенная лейкодистрофия, вызванная ненормальным контролем синтеза белка. Мол. Genet. Метаб. 88 , 7–15 (2006).
CAS
Статья
Google ученый
Senee, V. et al. Синдром Уолкотта – Раллисона: клиническое, генетическое и функциональное исследование мутаций EIF2AK3 и предположение о генетической гетерогенности. Диабет 53 , 1876–1883 (2004).
CAS
Статья
Google ученый
Scheuner, D. et al. Трансляционный контроль необходим для ответа на развернутый белок и гомеостаза глюкозы in vivo и глюкозы. Мол. Ячейка 7 , 1165–1176 (2001).
CAS
Статья
Google ученый
Zhang, P. et al.Киназа эукариотического фактора инициации 2α PERK необходима для развития скелетной системы, постнатального роста, а также функции и жизнеспособности поджелудочной железы. Мол. Клетка. Биол. 22 , 3864–3874 (2002).
CAS
Статья
PubMed
PubMed Central
Google ученый
Zhang, W. et al. PERK EIF2AK3 контроль дифференцировки и пролиферации β-клеток поджелудочной железы необходим для постнатального гомеостаза глюкозы. Cell Metab. 4 , 491–497 (2006). Эта статья показывает, что PERK особенно необходим в секретирующих инсулин β-клетках во время эмбрионального и раннего неонатального периода, а не во время взрослых стадий, для постнатального гомеостаза глюкозы.
CAS
Статья
Google ученый
Chambers, DM, Peters, J. & Abbott, CM Летальная мутация мыши wasted ( wst ) представляет собой делецию, которая отменяет экспрессию тканеспецифической изоформы фактора удлинения трансляции 1α, кодируемой геном Eef1a2 . Proc. Natl Acad. Sci. США 95 , 4463–4468 (1998).
CAS
Статья
Google ученый
Халифа А. и др. Характеристика экспрессии фактора элонгации-1A (eEF1A-1) и белка eEF1A-2 / S1 у нормальных и потерянных мышей. J. Biol. Chem. 276 , 22915–22922 (2001).
CAS
Статья
Google ученый
Чанг, Р.& Wang, E. Мышиный фактор элонгации трансляции eEF1A-2 взаимодействует с Prdx-I для защиты клеток от апоптотической гибели, вызванной окислительным стрессом. J. Cell Biochem. 100 , 267–278 (2007).
CAS
Статья
Google ученый
Brito, M. et al. Экспансии полиглицина в eRF3 / GSPT1 связаны с предрасположенностью к раку желудка. Канцерогенез 26 , 2046–2049 (2005).
CAS
Статья
Google ученый
Malta-Vacas, J. et al. Дифференциальная экспрессия фактора высвобождения 3 эукариот (eRF3 / GSPT1) в соответствии с гистологическими типами рака желудка. J. Clin. Патол. 58 , 621–625 (2005).
CAS
Статья
PubMed
PubMed Central
Google ученый
Керем Э. Фармакологическая терапия стоп-мутаций: сколько активности CFTR достаточно? Curr.Opin. Pulm. Med. 10 , 547–552 (2004).
CAS
Статья
Google ученый
Welch, E. M. et al. PTC124 нацелен на генетические нарушения, вызванные бессмысленными мутациями. Природа 447 , 87–91 (2007). Разработка PTC124 как возможного средства лечения заболеваний, вызванных нонсенс-мутациями, показывает важные преимущества фундаментальных исследований синтеза белка.
CAS
Статья
Google ученый
Драпчинская, Н.и другие. Ген, кодирующий рибосомный белок S19, мутирован при анемии Даймонда – Блэкфана. Nature Genet. 21 , 169–175 (1999).
CAS
Статья
Google ученый
Газда, Х. Т. и др. Дефектная экспрессия гена рибосомного белка изменяет транскрипцию, трансляцию, апоптоз и онкогенные пути при анемии Даймонда – Блэкфана. стволовых клеток 24 , 2034–2044 (2006).
CAS
Статья
PubMed
PubMed Central
Google ученый
Flygare, J.и другие. Человеческий RPS19 , ген, мутировавший при анемии Даймонда – Блэкфана, кодирует рибосомный белок, необходимый для созревания 40S рибосомных субъединиц. Кровь 109 , 980–986 (2007).
CAS
Статья
PubMed
PubMed Central
Google ученый
Choesmel, V. et al. Нарушение биогенеза рибосом при анемии Даймонда – Блэкфана. Кровь 109 , 1275–1283 (2007).
CAS
Статья
PubMed
PubMed Central
Google ученый
Кога Ю., Охга С., Номура А., Такада Х. и Хара Т. Снижение экспрессии гена кластерных рибосомных белков у пациентов с анемией Даймонда – Блэкфана без мутаций гена RPS19 . J. Pediatr. Гематол. Онкол. 28 , 355–361 (2006).
CAS
Статья
Google ученый
Боммер, У.A., Stahl, J., Henske, A., Lutsch, G. & Bielka, H. Идентификация белков рибосомной субъединицы 40S, участвующих во взаимодействии с фактором инициации eIF-2 в четвертичном инициаторном комплексе с помощью моноспецифических антител. FEBS Lett. 233 , 114–118 (1988).
CAS
Статья
Google ученый
Menne, T. F. et al. Белок синдрома Швахмана-Бодиана-Даймонда опосредует трансляционную активацию рибосом в дрожжах. Nature Genet. 39 , 486–495 (2007).
CAS
Статья
Google ученый
Thiel, C.T. et al. Мутации, приводящие к тяжелой инвалидности у пациентов с очень низким ростом, указывают на то, что эндорибонуклеаза RMRP, обрабатывающая РНК, является важным регулятором роста клеток. г. J. Hum. Genet. 77 , 795–806 (2005).
CAS
Статья
PubMed
PubMed Central
Google ученый
Вуллиами, Т.и другие. РНК-компонент теломеразы мутирован при аутосомно-доминантном врожденном дискератозе. Nature 413 , 432–435 (2001).
CAS
Статья
Google ученый
Walne, A. J. et al. Генетическая гетерогенность врожденного аутосомно-рецессивного дискератоза с одним подтипом из-за мутаций в связанном с теломеразой белке NOP10. Hum. Мол. Genet. 16 , 1619–1629 (2007).
CAS
Статья
PubMed
PubMed Central
Google ученый
Моримото, К., Лин, С. и Сакамото, К. Функции RPS19 и их связь с анемией Даймонда – Блэкфана: обзор. Мол. Genet. Метаб. 90 , 538–562 (2006). Обзор, описывающий функции RPS19, первого рибосомного белка, который, как было обнаружено, связан с болезнями человека.
Google ученый
‘t Hart, L.M. et al. Доказательства того, что ген митохондриальной лейцил тРНК синтетазы (LARS2) представляет собой новый ген восприимчивости к диабету 2 типа. Диабет 54 , 1892–1895 (2005).
CAS
Статья
Google ученый
Жорданова А. и др. Нарушение функции и аксонального распределения мутантной тирозил-тРНК синтетазы при доминантной промежуточной нейропатии Шарко – Мари – Тута. Nature Genet. 38 , 197–202 (2006).
CAS
Статья
Google ученый
Dubourg, O. et al. Мутация гена глицил-тРНК синтетазы G526R при дистальной наследственной моторной нейропатии V типа. Неврология 66 , 1721–1726 (2006).
CAS
Статья
Google ученый
Антонеллис А. и др. Мутации глицил-тРНК синтетазы при болезни Шарко – Мари – Тута типа 2D и дистальной спинномозговой мышечной атрофии типа V. г. J. Hum. Genet. 72 , 1293–1299 (2003). Первое сообщение о связи между мутациями в генах аминоацил-тРНК синтетазы и заболеваниями человека.
CAS
Статья
PubMed
PubMed Central
Google ученый
Себурн, К. Л., Нангл, Л. А., Кокс, Г. А., Шиммель, П. и Берджесс, Р. В. Активная доминантная мутация глицил-тРНК синтетазы вызывает невропатию в 2D мышиной модели Шарко – Мари – Тута. Нейрон 51 , 715–726 (2006).
CAS
Статья
Google ученый
Lee, J. W. et al. Редактирующая дефектная тРНК синтетаза вызывает неправильную укладку белка и нейродегенерацию. Природа 443 , 50–55 (2006).
CAS
Статья
Google ученый
Добсон, К. М. Фолдинг белка и его связь с болезнями человека. Biochem. Soc. Symp. 68 , 1–26 (2001).
CAS
Статья
Google ученый
Гатчел, Дж. Р. и Зогби, Х. Ю. Болезни нестабильной повторной экспансии: механизмы и общие принципы. Nature Rev. Genet. 6 , 743–755 (2005).
CAS
Статья
Google ученый
Парк, С. Г., Эвальт, К. Л.И Ким, С. Функциональное расширение аминоацил-тРНК синтетаз и их взаимодействующих факторов: новые взгляды на домработниц. Trends Biochem. Sci. 30 , 569–574 (2005). Обзор, описывающий дополнительные роли аминоацил-тРНК синтетаз в широком спектре функций, отличных от аминоацилирования, иллюстрирующий дополнительные роли факторов трансляции.
CAS
Статья
Google ученый
Тейлор Р.W. & Turnbull, D. M. Мутации митохондриальной ДНК при заболеваниях человека. Nature Rev. Genet. 6 , 389–402 (2005).
CAS
Статья
Google ученый
Shoubridge, EA & Sasarman, F. in Translational Control in Biology and Medicine (eds Mathews, MB, Sonenberg, N. & Hershey, JWB) 775–801 (Cold Spring Harbor Laboratory Press, Cold Spring Harbor , 2006).
Google ученый
Щапира, А.H. Митохондриальная болезнь. Ланцет 368 , 70–82 (2006).
CAS
Статья
Google ученый
Робинсон Б. Х. Молочная ацидемия и митохондриальные заболевания. Мол. Genet. Метаб. 89 , 3–13 (2006).
CAS
Статья
Google ученый
Финстерер Дж. Проявления митохондриальных нарушений со стороны центральной нервной системы. Acta Neurol. Сканд. 114 , 217–238 (2006).
CAS
Статья
Google ученый
ДиМауро, С. Митохондриальные миопатии. Curr. Opin. Ревматол. 18 , 636–641 (2006).
CAS
Статья
Google ученый
Джейкобс, Х. Т. и Тернбулл, Д. М. Ядерные гены и митохондриальная трансляция: новый класс генетических заболеваний. Trends Genet. 21 , 312–314 (2005).
CAS
Статья
Google ученый
Кирино Ю. и др. Кодон-специфический дефект трансляции, вызванный дефицитом модификации колебания мутантной тРНК митохондриального заболевания человека. Proc. Natl Acad. Sci. США 101 , 15070–15075 (2004). В этом исследовании используется метод молекулярной хирургии для изучения важности модификации таурином положения колебания митохондриальной тРНК Leu (UUR) .
CAS
Статья
Google ученый
Парк, Х., Дэвидсон, Э. и Кинг, М. П. Патогенная мутация A3243G в митохондриальной tRNALeu человека (UUR) снижает эффективность аминоацилирования. Биохимия 42 , 958–964 (2003).
CAS
Статья
Google ученый
Сузуки, Т., Сузуки, Т., Вада, Т., Сайго, К. и Ватанабе, К.Таурин как составная часть митохондриальных тРНК: новое понимание функций таурина и митохондриальных заболеваний человека. EMBO J. 21 , 6581–6589 (2002).
CAS
Статья
PubMed
PubMed Central
Google ученый
Borner, G.V. et al. Снижение аминоацилирования мутантных тРНК в MELAS, но не у пациентов с MERRF. Hum. Мол. Genet. 9 , 467–475 (2000).
CAS
Статья
Google ученый
Шоффнер, Дж.M. et al. Миоклоническая эпилепсия и болезнь рваных красных волокон (MERRF) связаны с мутацией тРНК (Lys) митохондриальной ДНК. Cell 61 , 931–937 (1990).
CAS
Статья
Google ученый
Enriquez, J. A., Chomyn, A. & Attardi, G. Мутация мтДНК при синдроме MERRF вызывает дефектное аминоацилирование тРНК (Lys) и преждевременное прекращение трансляции. Nature Genet. 10 , 47–55 (1995).
CAS
Статья
Google ученый
Равн, К. и др. Мутация мтДНК, 14453G & gt; A, в субъединице 6 НАДН-дегидрогеназы, ассоциированная с тяжелым синдромом MELAS. евро. J. Hum. Genet. 9 , 805–809 (2001).
CAS
Статья
Google ученый
Дэвис Д. Р., Велтри К. А. и Нильсен Л. Модельная система РНК для исследования псевдоуридиновой стабилизации кодон-антикодонного взаимодействия в тРНК Lys , тРНК His и тРНАТир. J. Biomol. Struct. Дин. 15 , 1121–1132 (1998).
CAS
Статья
Google ученый
Быховская Ю., Касас, К., Менгеша, Э., Инбал, А., Фишель-Годсиан, Н. Мутация миссенс в псевдоуридинсинтазе 1 ( PUS1 ) вызывает митохондриальную миопатию и сидеробластную анемию (MLASA ). г. J. Hum. Genet. 74 , 1303–1308 (2004).
CAS
Статья
PubMed
PubMed Central
Google ученый
Ван дер Кнаап, М.S. et al. Новая лейкоэнцефалопатия с поражением ствола и спинного мозга и высоким содержанием лактата. Ann. Neurol. 53 , 252–258 (2003).
Артикул
Google ученый
Scheper, G.C. et al. Дефицит митохондриальной аспартил-тРНК синтетазы вызывает лейкоэнцефалопатию с поражением ствола головного и спинного мозга и повышением уровня лактата. Nature Genet. 39 , 534–539 (2007).
CAS
Статья
Google ученый
Сенека, С.и другие. Мутация митохондриальной тРНК-аспартата, вызывающая изолированную митохондриальную миопатию. г. J. Med. Genet. А 137 , 170–175 (2005).
Артикул
Google ученый
Miller, C. et al. Нарушение митохондриальной трансляции, вызванное мутацией рибосомного белка (MRPS16). Ann. Neurol. 56 , 734–738 (2004).
CAS
Статья
Google ученый
О’Брайен, Т.В., О’Брайен, Б. Дж. И Норман, Р. А. Ядерные гены MRP и митохондриальные заболевания. Gene 354 , 147–151 (2005).
CAS
Статья
Google ученый
Nolden, M. et al. Протеаза m-AAA, дефектная при наследственной спастической параплегии, контролирует сборку рибосом в митохондриях. Cell 123 , 277–289 (2005).
CAS
Статья
Google ученый
Коппен, М., Методиев, М. Д., Касари, Г., Ругарли, Э. И., Лангер, Т. Вариабельный и тканеспецифический субъединичный состав митохондриальных комплексов протеазы m-AAA, связанных с наследственной спастической параплегией. Мол. Клетка. Биол. 27 , 758–767 (2007).
CAS
Статья
Google ученый
Валенте, Л. и др. Детская энцефалопатия и дефектная трансляция митохондриальной ДНК у пациентов с мутациями факторов элонгации митохондрий EFG1 и EFTu. г. J. Hum. Genet. 80 , 44–58 (2007).
CAS
Статья
Google ученый
Смейтинк, Дж. А. и др. Отчетливые клинические фенотипы, связанные с мутацией фактора элонгации митохондриальной трансляции EFT. г. J. Hum. Genet. 79 , 869–877 (2006).
CAS
Статья
PubMed
PubMed Central
Google ученый
Коенен, М.J. et al. Мутантный фактор элонгации митохондрий G1 и дефицит комбинированного окислительного фосфорилирования. N. Engl. J. Med. 351 , 2080–2086 (2004). Это элегантное исследование, в котором использовалась комплементация митохондриального дефекта в фибробластах пациента, привело к открытию первого ядерного кодируемого фактора трансляции, который, как известно, участвует в митохондриальных заболеваниях.
CAS
Статья
Google ученый
Антоницка, Х., Сасарман, Ф., Кеннауэй, Н. Г. и Шубридж, Э. А. Молекулярные основы тканевой специфичности дефицита окислительного фосфорилирования у пациентов с мутациями в митохондриальном факторе трансляции EFG1. Hum. Мол. Genet. 15 , 1835–1846 (2006).
CAS
Статья
Google ученый
ДиМауро, С. и Шон, Э.А. Митохондриальные заболевания дыхательной цепи. N. Engl. J. Med. 348 , 2656–2668 (2003).
CAS
Статья
Google ученый
Шубридж, Э. А. Ядерные генетические дефекты окислительного фосфорилирования. Hum. Мол. Genet. 10 , 2277–2284 (2001).
CAS
Статья
Google ученый
Papapetropoulos, S. et al. Профили мультирегиональной экспрессии генов идентифицируют MRPS6 как возможный ген-кандидат на болезнь Паркинсона. Gene Expr. 13 , 205–215 (2006).
CAS
Статья
Google ученый
Grazina, M. et al. Генетические основы деменции Альцгеймера: роль мутаций мтДНК. Genes Brain Behav. 5 , S92 – S107 (2006).
Артикул
CAS
Google ученый
Лю, К. Ю., Вонг, Х. Н., Шауэрте, Дж. А. и Кауфман, Р.J. Протеинкиназа / эндорибонуклеаза IRE1α, которая сигнализирует о развернутом белковом ответе, имеет люминальный N-концевой лиганд-независимый домен димеризации. J. Biol. Chem. 277 , 18346–18356 (2002).
CAS
Статья
Google ученый
Wek, R.C., Jiang, H.Y. и Anthony, T.G. Как справиться со стрессом: киназы eIF2 и контроль трансляции. Biochem. Soc. Пер. 34 , 7–11 (2006).
CAS
Статья
Google ученый
Harding, H.P. et al. Регулируемая инициация трансляции контролирует вызванную стрессом экспрессию генов в клетках млекопитающих. Мол. Ячейка 6 , 1099–1108 (2000).
CAS
Статья
Google ученый
Jeppesen, T. D. et al. Фенотип мышц и нагрузка мутаций у 51 человека с мутацией митохондриальной ДНК 3243A & gt; G. Arch. Neurol. 63 , 1701–1706 (2006). Это исследование с участием 51 пациента с той же мутацией, но с широким спектром клинической тяжести, устанавливает корреляцию между генотипом мышц и клиническим фенотипом в MELAS.
Артикул
Google ученый
Эренберг, М., Хаурилюк, В., Крист, К. Г. и Накамура, Ю. в книге «Трансляционный контроль в биологии и медицине» (ред. Мэтьюз, М.Б., Соненберг, Н. и Херши, Дж. В. Б.) 173–196 (Лабораторная пресса Колд-Спринг-Харбор, Колд-Спринг-Харбор, 2006 г.).
Google ученый
Leegwater, P.A.J. et al. Субъединицы фактора инициации трансляции eIF2B мутируют при лейкоэнцефалии с исчезновением белого вещества. Nature Genetics 29 , 383–388 (2001).
CAS
Статья
Google ученый
Делепин, М.и другие. eIF2AK3, кодирующий фактор инициации трансляции 2-α киназу 3, мутирован у пациентов с синдромом Wolcott-Rallison. Nature Genet. 25 , 406–409 (2000).
CAS
Статья
Google ученый
Inbal, A. et al. Миопатия, лактоацидоз и сидеробластная анемия: новый синдром. г. J. Med. Genet. 55 , 372–378 (1995).
CAS
Статья
Google ученый
Хейсс, Н.S. et al. Врожденный Х-сцепленный дискератоз вызывается мутациями в высококонсервативном гене с предполагаемыми ядрышковыми функциями. Nature Genet. 19 , 32–38 (1998).
CAS
Статья
Google ученый
Букок, Г. Р. и др. Мутации в SBDS связаны с синдромом Швахмана-Даймонда. Nature Genet. 33 , 97–101 (2003).
CAS
Статья
Google ученый
Риданпаа, М.и другие. Мутации в РНК-компоненте РНКазы MRP вызывают плейотропное заболевание человека — гипоплазию волос и хрящей. Cell 104 , 195–203 (2001).
CAS
Статья
Google ученый
Casari, G. et al. Спастическая параплегия и нарушение OXPHOS, вызванные мутациями параплегина, митохондриальной металлопротеазы, кодируемой ядром. Cell 93 , 973–983 (1998).
CAS
Статья
Google ученый
Хардинг, Х.P. et al. Сахарный диабет и внешнесекреторная дисфункция поджелудочной железы у мышей Perk — / — показывают роль трансляционного контроля в выживаемости секреторных клеток. Мол. Ячейка 7 , 1153–1163 (2001).
CAS
Статья
Google ученый
Guo, F. & Cavener, D. R. Киназа GCN2 eIF2α регулирует гомеостаз жирных кислот в печени во время лишения незаменимой аминокислоты. Cell Metab. 5 , 103–114 (2007).
CAS
Статья
Google ученый
Han, A. P. et al. Регулируемая гемом киназа eIF2α (HRI) необходима для регуляции трансляции и выживания предшественников эритроидов при дефиците железа. EMBO J. 20 , 6909–6918 (2001).
CAS
Статья
PubMed
PubMed Central
Google ученый
Le Bacquer, O.и другие. Повышенная чувствительность к ожирению, вызванному диетой, и к инсулинорезистентности у мышей, лишенных 4E-BP1 и 4E-BP2. J. Clin. Инвестировать. 117 , 387–396 (2007).
CAS
Статья
PubMed
PubMed Central
Google ученый
Scheuner, D. et al. Контроль трансляции мРНК сохраняет функцию эндоплазматического ретикулума в β-клетках и поддерживает гомеостаз глюкозы. Nature Med. 11 , 757–764 (2005).
CAS
Статья
Google ученый
Zhang, S., Shi, M., Hui, C.C. & Rommens, J.M. Утрата мышиного ортолога гена синдрома Швахмана-Даймонда ( Sbds ) приводит к ранней эмбриональной летальности. Мол. Клетка. Биол. 26 , 6656–6663 (2006).
CAS
Статья
PubMed
PubMed Central
Google ученый
Матссон, Х.и другие. Эритропоэз у мышей с нарушением Rps19 : анализ эритропоэтинового ответа и биохимических маркеров анемии Даймонда – Блэкфана. Blood Cells Mol. Дис. 36 , 259–264 (2006).
CAS
Статья
Google ученый
He, J. et al. Направленное разрушение Dkc1 , гена, мутировавшего в Х-сцепленный врожденный дискератоз, вызывает эмбриональную летальность у мышей. Онкоген 21 , 7740–7744 (2002).
CAS
Статья
Google ученый
Uusimaa, J. et al. Молекулярная эпидемиология митохондриальных энцефаломиопатий у детей в финской популяции: анализ последовательности всей мтДНК 17 детей выявил гетероплазматические мутации в генах тРНК Arg , тРНК Glu и тРНК Leu (UUR) . Педиатрия 114 , 443–450 (2004).
Артикул
Google ученый
Неправильная упаковка белка и дегенеративные заболевания
Alper, T. et al. Реплицируется ли агент скрепи без нуклеиновой кислоты? Nature 214 , 764–766 (1967)
Анфинсен, К. Б. Формирование и стабилизация структуры белка. Биохимический журнал 128 , 737–749 (1972)
Бидл, Г. У. и Татум, Э. Л. Генетический контроль биохимических реакций в Neurospora . PNAS 27 , 499–506 (1941)
Чити, Ф. и Добсон, К. М.Неправильная укладка белков, функциональный амилоид и болезнь человека. Ежегодный обзор биохимии 75 , 333–366 (2006)
Дилл К. А. и Чан Х. С. От Левинталя до путей к воронкам. Nature Structural Biology 4 , 10–19 (1997)
Добсон, К. М. Сворачивание и неправильная укладка белков. Nature 426 , 884–890 (2003) doi: 10.1038 / nature02261
Добсон, К. М. Болезни неправильной упаковки белка: потеря формы. Nature 418 , 729–730 (2002) doi: 10.1038 / 418729a
Ellis, J. Белки как молекулярные шапероны. Nature 328 , 378–379 (1987) doi: 10.1038 / 328378a0
Fändrich, M. & Dobson, CM Поведение полиаминокислот показывает обратный эффект боковой цепи в образовании амилоидной структуры The EMBO Journal 21 , 5682-5690 (2002).
Финкель Т. Радикальная медицина: лечение старения для лечения болезней. Nature Reviews Молекулярная клеточная биология 6 , 971–976 (2005)
Гайдусек, Д. К., Гиббс, К. Дж., Младший, и Альперс, М. Передача и передача экспериментального куру шимпанзе. Science 155 , 212–214 (1967)
Gamow, G. & Ycas, M. Статистическая корреляция белков и состава рибонуклеиновой кислоты. PNAS 41 , 1011–1019 (1955)
Гриффит, Дж. С. Самовоспроизведение и скрепи. Nature 215 , 1043–1044 (1967)
Кауфман Р.J., et al. Развернутый белковый ответ при восприятии и различении питательных веществ. Nature Reviews Molecular Cell Biology 3 , 411-421 (2002)
Laskey, R.A. et al. Нуклеосомы собираются кислым белком, который связывает гистоны и передает их ДНК. Nature 275 , 416–420 (1978) doi: 10.1038 / 275416a0
Levinthal, C. Существуют ли пути для сворачивания белков? Journal de Chimie Physique et de Physico-Chimie Biologique 65 , 44–45 (1968)
Lin, M.Ю. и Бил, М. Ф. Дисфункция митохондрий и оксидативный стресс при нейродегенеративных заболеваниях. Nature 443 , 787–795 (2006)
Nirenberg, M. W. & Matthaei, H. Зависимость бесклеточного синтеза белка в E. coli от РНК, полученной из рибосом. Biochemical and Biophysical Research Communications 4 , 404–408 (1961)
Полинг, Л., Кори, Р. Б. и Брэнсон, Х. Р. Структура белков: две спиральные конфигурации полипептидной цепи с водородными связями. PNAS 37 , 205–211 (1951)
Прусинер, С. Б. Новые белковые инфекционные частицы вызывают скрейпи. Science 216 , 136–144 (1982)
Smith, M. A. et al. Влияние длины цепи полиадениловой кислоты на распределение лизиновых пептидов по размерам. Acta Biochimica Polonica 13 , 361–365 (1966)
Лучшее понимание дефектного белка, вызывающего муковисцидоз — ScienceDaily
Группа исследователей изучает белок, который в случае его дефекта или отсутствия вызывает муковисцидоз ( CF) сделал важное открытие о том, как этот белок обычно контролируется и при каких обстоятельствах он может пойти не так.
«Понимание регуляции транспорта соли в нормальных клетках имеет решающее значение для разработки новых методов лечения заболеваний, таких как CF, которые нарушают перемещение соли через границы клеток», — сказал Дженг-Хаур Чен, научный сотрудник Карвер-колледжа Университета Айовы. доктор медицины и ведущий автор статьи, которая будет опубликована 18 декабря в журнале Journal of Biological Chemistry .
Муковисцидоз — это наследственное хроническое заболевание, поражающее многие органы, особенно легкие и пищеварительную систему.Пациенты с МВ несут дефектный ген, который отключает или разрушает его белковый продукт, который обычно регулирует перенос соли через границы клеток. В результате в организме вырабатывается густая слизь, которая блокирует протоки и трубки.
Закупорка дыхательных путей вызывает хронический кашель и легочную инфекцию; закупорка поджелудочной железы препятствует доставке ферментов в кишечник для расщепления пищи; а закупорка в кишечнике препятствует всасыванию пищи.
Около 70 000 человек во всем мире больны этим заболеванием, большинство из которых составляют дети и молодые люди.
Дефектный ген, ответственный за CF и его белковый продукт, называемый регулятором трансмембранной проводимости при муковисцидозе, или CFTR, был открыт только в 1989 году; но благодаря методам раннего выявления и улучшенным методам лечения выживаемость пациентов с МВ значительно улучшилась за последние 40 лет. Чен подчеркнул, что, несмотря на значительные улучшения, существующие методы лечения CF только облегчают симптомы, например, предотвращая легочные инфекции с помощью антибиотиков, разжижая слизь с помощью физиотерапии грудной клетки и помогая пищеварению с помощью ферментных добавок.
По его словам, разработка настоящего лекарства требует двух вещей: во-первых, когда он отсутствует, доставка белка CFTR обратно в его правильное место, на границе клетки, и во-вторых, когда CFTR неисправен, восстановление его функции.
«CFTR сам по себе представляет собой небольшой проход с воротами, называемый ионным каналом, который находится на поверхности клеток, выстилающих протоки и трубки, где он действует как путь для движения хлорид-ионов, одного компонента соли, и регулирует транспорт. бикарбоната, одна часть соды, — объяснил Чен.
По его словам, регулируя транспорт этих молекул, CFTR регулирует кислотно-щелочной баланс или pH клеток; а точный контроль внутриклеточного pH жизненно важен для функционирования всех клеток.
«В случае клеток, выстилающих протоки и трубки, внутриклеточный pH регулирует перенос солей, защищает организм от чужеродных захватчиков, таких как бактерии, и контролирует выживание клеток», — сказал Чен.
Хотя у ученых были доказательства того, что CFTR регулирует pH в клетках, было неизвестно, как он обнаруживал изменения pH и знал, когда регулировать его активность.Итак, Чен решил проверить свою идею о том, что активность CFTR напрямую регулируется внутриклеточным pH.
Он успешно продемонстрировал, что кислотный pH сильно стимулирует транспорт хлоридов с помощью CFTR, тогда как щелочной pH ингибирует его. Чтобы узнать, как pH регулирует транспорт хлоридов через CFTR, Чен изучил функцию отдельных строительных блоков, из которых собирается CFTR.
«Структура CFTR напоминает турникет — у него есть путь для движения хлоридов через границу ячейки и ворота, которые контролируют доступ к этому пути.Вращение ворот осуществляется за счет аденозинтрифосфата, или АТФ, источника энергии для всех клеток », — объяснил Дэвид Шеппард, который руководил работой Чена в качестве докторанта на кафедре физиологии и фармакологии в Бристольском университете». работа демонстрирует, что внутриклеточный pH регулирует стыковку АТФ с затвором и скорость поворота затвора ».
Таким образом, внутриклеточный pH определяет уровень мощности ворот, который, в свою очередь, регулирует транспорт соли и бикарбоната.Между тем, сказал Шеппард, если клетке необходимо сохранять энергию, внутриклеточный pH также может сказать ферментам, когда пора прекратить активность CFTR.
«Оригинальное понимание (Чен) структуры и функции CFTR сыграло решающую роль в продвижении знаний о том, как обычно работает CFTR и как он работает неправильно при заболевании», — сказал Шеппард. «Цель состоит в том, чтобы разработать и разработать лекарственные препараты, которые восстанавливают функцию белков CFTR, отключенных мутациями CF. Нацеливаясь на первопричину заболевания, а не на симптомы, новые лекарственные препараты для лечения CF могут остановить прогрессирование заболевания и предотвратить ухудшение здоровья. людей, живущих с CF.«
Исследование
Чена финансировалось фондом Cystic Fibrosis Trust, британской благотворительной организацией, занимающейся исследованиями МВ и оказанием помощи пациентам. Его статья была названа «Газетой недели» журналом Journal of Biological Chemistry .
Белковый дефект — обзор
Гипомиелинизирующая лейкодистрофия типа 1 (HLD1) или
PLP1 -связанные заболевания
Два различных фенотипа были связаны с аномалиями PLP: болезнь Пелицея-Мерцбахера (PMD) и спастическая параплегия (SPPG2) типа 2 (SPPG2). Saugier-Veber et al., 1994; Mimault et al., 1999; Гарберн, 2007). SPG2 отличается от PMD тем, что достижение моторной вехи на первом году жизни, соответствующей активной младенческой фазе миелинизации, почти нормально для SPG2. Однако клинический континуум, существующий между этими двумя сущностями, привел к описанию «пограничных» пациентов.
PMD (MIM # 312080) характеризуется у пациентов мужского пола ранним нарушением моторного развития (до 6 месяцев жизни) с неврологическими признаками, которые постепенно изменяются под воздействием созревания нервной системы (Cailloux et al., 2000). Нистагм, который присутствует в 93% случаев и иногда ассоциируется со стридором, усиливается в течение первых месяцев и уменьшается после первого года жизни при стойких нарушениях координации глаз и плохой остроте зрения. Хореоатетотические движения конечностей и / или атаксия головы и туловища обычно происходят через 6 месяцев, их интенсивность уменьшается в возрасте от 3 до 5 лет, когда наблюдается прогрессирующая спастичность, часто связанная с дистонией. Эта спастичность, связанная с прогрессирующей аксонопатией, усиливается в подростковом возрасте, что приводит к серьезным ортопедическим деформациям (постоянные деформации стопы, вывих бедра и сколиоз).Двигательная недостаточность всегда больше, чем нарушение психоинтеллектуального развития при хорошем социальном взаимодействии. Снижение скорости роста (сначала в весе, а затем в росте) обычно наблюдается в возрасте от 3 до 5 лет. Приступы наблюдаются редко и хорошо контролируются противоэпилептическими препаратами. Не наблюдается быстрой деградации, и моторные характеристики наиболее заметно улучшаются в течение первых 5 лет жизни. После выхода на плато в подростковом возрасте наблюдается медленное ухудшение.Тяжесть заболевания коррелирует с уровнем двигательной активности, приобретенным до 5 лет, классифицируя заболеваний, связанных с PLP1 , на пять форм, от 0 до 4, лучшая, форма 4, соответствующая SPG2. Форма 0, наблюдаемая в 13% наших серий, также была индивидуализирована как «супружеская» или форма Зайтельбергера. Пациенты почти не достигают двигательных вех, после чего атаксия сменяется тяжелой осевой дистонией. Сильное нарушение роста наблюдается после 1 года жизни, смерть обычно наступает в течение первого десятилетия.Форма 1 (13% в нашей серии) включает пациентов, которые достигают контроля головы в среднем в возрасте 1 года; одна треть умела использовать ассоциированные слова для выражения речи. Пациенты с формой 2 (20% в нашей серии) достигли положения сидя примерно в возрасте 2 лет, а половина из них также достигла дизартрической, но разборчивой речи в возрасте от 2 до 5 лет. Форма 3 — самая частая (44% нашей серии). Пациенты могут ходить с некоторой опорой в среднем в 2,5 года, но 25% теряют эту способность к 10 годам. Подавляющее большинство из них развивает понятный, но дизартрический язык в нормальном возрасте и посещает обычную школу с использованием персонального компьютера, по крайней мере, в первых классах.Нарушения функции лобных долей при плохой работоспособности ухудшают более высокий уровень образования.
Во всех случаях нарушение образования миелина в ЦНС проявляется как резкими, так и обширными аномалиями мультимодальных вызванных потенциалов в ЦНС, присутствующими с рождения, которые остаются стабильными, а также диффузным гипомиелинизированным рисунком сустенториального белого вещества (WM) на МРТ. . Наличие нормального сигнала миелина часто наблюдается в областях с ранним миелином (мозжечок, ствол мозга, внутренняя капсула и мозолистое тело).Существует корреляция между степенью миелинизации, оцененной с помощью МРТ, и уровнем моторного и когнитивного развития. Атрофия более выражена и ухудшается после 10 лет, включая в основном мозолистое тело, полуовалентный центр и червь мозжечка.
SPG2 (MIM # 312920) встречается реже (10% случаев). При этой форме 4 расстройства, связанного с PLP1 , двигательные вехи первого года жизни не нарушены, но у пораженных мальчиков в следующие 5 лет развиваются прогрессирующие нарушения походки.Атаксия, медленное прогрессирование, ведущее к тяжелой спастичности и потере способности передвигаться в течение примерно 10 лет, связаны с низким IQ и дисфункцией лобных долей. Всегда наблюдаются отклонения как в сигнале белого вещества на МРТ головного мозга, так и в соматосенсорных / моторных вызванных потенциалах, свидетельствующие о гипомиелинизации мозга. Прогрессирующая мультифокальная, преимущественно аксональная, периферическая нейропатия часто наблюдается при SPG2 или легких формах расстройств, связанных с PLP1 (Garbern et al., 1999).
О женщинах, пораженных ПМД, сообщалось редко. По сравнению с пациентами мужского пола улучшение явно наблюдается после 5 лет (Inoue et al., 2001). Повреждение олигодендроцитов в перинатальном периоде (недоношенность, аноксия или инфекция), а не искаженный характер инактивации X, по-видимому, изменяет проявление болезни. С другой стороны, матери, гетерозиготы по мутациям PLP, вызывающим тяжелый фенотип у их сыновей, обычно протекают бессимптомно, в то время как носители мутаций, вызывающих легкий фенотип, имеют тенденцию проявлять симптомы при самых легких формах расстройств, связанных с PLP (Hurst et al., 2006). У этих женщин-носительниц проявляется поздняя форма аксонопатии со спастической параплегией в течение четвертого десятилетия, часто связанная с прогрессирующей лобной деменцией в течение шестого десятилетия. В большинстве случаев прогрессирующая атрофия головного мозга без аномалий белого вещества на МРТ связана с аномалиями центральной и периферической проводимости и низким содержанием N -ацетиласпартата.
При PMD большая дупликация, включающая весь ген PLP1 , является наиболее частой причинной мутацией (64%).Уровень сверхэкспрессии PLP, по-видимому, коррелирует со степенью тяжести заболевания, идентично трансгенным мышам, избыточно экспрессирующим PLP (Mimault et al., 1999; Karim et al., 2007; Lee et al., 2008). Напротив, большие делеции геномной области PLP1 и нулевые мутации, по-видимому, хорошо переносятся, что делает возможной миелинизацию и составляет самую легкую форму PMD или SPG2. В PLP1 точечных мутациях корреляция генотип-фенотип менее ясна (Cailloux et al., 2000).Мутации в некодирующих областях гена PLP1 могут быть заподозрены путем обнаружения аномальных продуктов сплайсинга PLP1 в фибробластах, культивируемых из биоптатов кожи пораженных пациентов (Bonnet-Dupeyron et al., 2008). Об усилителях интронных мутаций сайта сплайсинга PLP 5 ‘сообщалось у пациентов с SPG2, демонстрируя критическую роль регуляции альтернативного сплайсинга PLP для процесса миелинизации (Wang et al., 2008).
При PMD патология в значительной степени вызвана непропорциональным количеством белков PLP, удерживаемых в соме клеток олигодендроцитов (Dhaunchak and Nave, 2007).Присутствие неправильно свернутых белков может вызывать гибель олигодендроцитов в наиболее тяжелых формах или ухудшать взаимодействие холестерина и липидов, снижая способность олигодендроцитов синтезировать миелиновые оболочки в самых мягких формах (Krämer-Albers et al., 2006). Отсутствие белка PLP в основном индуцировало уменьшение белков, важных для метаболизма аксоглии, таких как (NAD + ) -зависимый деацетилазный сиртуин 2 (SIRT2) (Werner et al., 2007). Исследования на животных моделях продемонстрировали, что у самок-носителей тяжелых мутаций нормальный апоптоз олигодендроцитов, наблюдаемый после рождения, сопровождается пролиферацией олигодендроцитов, что предполагает дополнительный апоптоз мутировавших олигодендроцитов с последующей пролиферацией олигодендроцитов, экспрессирующих нормальный аллель PLP1 .У мышей, гетерозиготных по легким мутациям, таким как нулевая мутация PLP, мозаицизм существует в экспрессии PLP в олигодендроцитах. В отсутствие PLP / DM20 часть аксонов малого диаметра не могла миелинизироваться, оставаясь заключенными в оболочку, но не имея компактного миелина. Поздний парапарез и деменция, наблюдаемые у матерей пациентов с умеренным PMD / SPG2, являются результатом этого мозаицизма с вторичной дегенерацией аксонов дисмиелинизированных волокон (Hurst et al., 2006).
Поскольку ЦНС чрезвычайно чувствительна к избыточной или недостаточной экспрессии гена PLP1 , регулирование дозировки гена до нормальных уровней экспрессии может быть одной из терапевтических стратегий при расстройствах, связанных с PLP.Нацеливание на олигодендроциты для генной терапии в настоящее время остается сложной задачей. Ремиелинизация и восстановление функции аксонов с помощью трансплантации глиальных клеток были продемонстрированы у разных животных с мутантами PLP с использованием разных типов клеток, что подчеркивает необходимость ранней терапии. Наконец, молекулы, способные защищать или восстанавливать функции аксонов, в значительной степени вызванные окислительным стрессом, идентично другим лейкодистрофиям, проходят доклинические испытания (Lin and Popko, 2009).
Многочисленные пациенты с неустановленной лейкодистрофией проявляют медленно прогрессирующее заболевание с ранним началом, похожим на PMD, а также аномалиями МРТ и вызванных потенциалов, предполагающими процесс гипомиелинизации, но без выявленных PLP1 аномалий.Это состояние называется болезнью Пелицея – Мерцбахера (PMLD). Это могло быть результатом либо присутствия PLP1 аномалий, ускользающих от обычного анализа генов, либо участия других генов, важных для процесса миелинизации. Молекулярный анализ рецессивных форм PMLD позволил идентифицировать второй ген, вовлеченный в HDL, белок щелевых соединений, ген гамма 2 ( GJC2 ).
Два дефектных белка сговариваются, чтобы нарушить «электростанцию» нервных клеток при болезни Альцгеймера
Два белка, которые аномально изменены в мозге пациентов с болезнью Альцгеймера, вступают в сговор, что приводит к пагубному воздействию на важнейшие энергетические центры клеток головного мозга. новые результаты опубликованы в Интернете в Neurobiology of Aging .
Исследование предполагает возможность того, что патологические формы двух белков, бета-амилоида и тау-белка, которые составляют патологические признаки мозга пациентов с болезнью Альцгеймера — бляшки и клубки, — могут работать в тандеме, снижая выживаемость клеток мозга.
Результаты являются частью пакета результатов нескольких лабораторий, которые подвергают клеточные компоненты, известные как митохондрии, более пристальному вниманию при развитии ряда состояний мозга, включая болезни Альцгеймера, Хантингтона и Паркинсона.
Митохондрии похожи на крошечные энергетические растения внутри нейронов и других клеток, которые постоянно находятся в движении, вырабатывая энергию, необходимую клеткам для выживания. Митохондрии также являются главными контролерами, поскольку они выполняют дополнительные функции, такие как поддержание нормального уровня кальция. Клетка с поврежденными митохондриями не может производить достаточно энергии для поддержания жизнедеятельности клетки, не может правильно буферизовать кальций и выделяет окислительные молекулы, которые повреждают клетку. Эти типы событий могут происходить в головном мозге при болезни Альцгеймера, в результате чего нервные клетки не функционируют должным образом.
«Идея о том, что бета-амилоид и тау-амилоид могут работать вместе и причинять вред мозгу, была развивающейся темой среди ученых в течение ряда лет», — сказала Гейл Джонсон, доктор философии, профессор анестезиологии и автор соответствующей книги. бумага. «Точная взаимосвязь между двумя патологиями неясна, но между ними может быть синергия, когда речь идет об их влиянии на митохондрии при болезни Альцгеймера».
Группа Джонсона особенно внимательно изучила патологическую форму белка, известного как тау, который помогает стабилизировать сеть дорожек, похожих на шоссе, называемых микротрубочками, в нейронах.В последние годы такие ученые, как Джонсон, сосредоточили свое внимание на аномально укороченной форме белка, известной как усеченный тау, как на той, которая, вероятно, играет роль в болезни Альцгеймера.
Команда Джонсона изучила работу митохондрий в нейронах крыс во время воздействия бета-амилоида, обычного белка тау, усеченной версии тау и комбинаций бета-амилоида и двух версий тау. Среди экспериментов был один, в котором ученые отслеживали движение митохондрий, делая новое изображение каждые 10 секунд в течение пятиминутного промежутка времени, чтобы отслеживать движения органелл внутри нейронов.
Самые большие изменения в митохондриях произошли, когда бета-амилоид и усеченный тау присутствовали вместе. Эффекты включали:
· Сильно нарушена способность митохондрий сохранять свой электрический потенциал, необходимый для эффективного производства энергии. У них была только треть электрического потенциала митохондрий контрольных клеток.
· Митохондрии обычно очень подвижны и распределены по клетке. Однако в присутствии усеченного тау-белка и бета-амилоида митохондрии аномально сгруппировались в некоторых частях нейронов и не смогли добраться до других частей нейронов, таких как синапсы, как обычно.В целом, только около половины митохондрий были подвижными по сравнению с митохондриями, не подвергавшимися воздействию патологических белков.
· Клетки, подвергшиеся воздействию как усеченного тау-белка, так и бета-амилоида, были менее способны, чем обычно, реагировать на клеточный стресс. Количество вредных молекул, известных как активные формы кислорода или свободные радикалы, в этих клетках увеличилось на 60 процентов.
· Митохондрии, подвергшиеся воздействию бета-амилоида и усеченного тау-белка, были фрагментированы, и их средняя длина была вдвое меньше, чем у нормальных митохондрий.
Клеточные изменения, на которые смотрит Джонсон, вероятно, происходят до того, как у пациента начнут проявляться такие симптомы, как потеря памяти. Большинство ученых считают, что изменения в мозге пациентов с болезнью Альцгеймера начинаются за годы или даже десятилетия до того, как признаки болезни Альцгеймера станут очевидными.
«К тому времени, когда клетки мертвы, уже слишком поздно что-либо делать», — сказал Джонсон, который также является профессором кафедры фармакологии и физиологии и ученым в Центре развития нервной системы и болезней.«Поэтому в области исследования болезни Альцгеймера исследователи ищут ранние маркеры и индикаторы заболевания, чтобы можно было идентифицировать пациентов до того, как произойдет значительная гибель нервных клеток. Кроме того, во многих лабораториях продолжаются исследования для определения методов лечения, которые могут быть нацелены на эти ранние события.
«Возможно, — добавляет Джонсон, — новая информация о митохондриальной дисфункции при болезни Альцгеймера может быть использована для борьбы с болезнью, поскольку она, вероятно, является важной мишенью для терапевтического вмешательства».Учитывая тот факт, что болезнь Альцгеймера — очень сложное заболевание, монотерапевтический подход может быть не таким эффективным, как стратегия комбинаторного лечения, как в случае лечения других заболеваний, включая рак и диабет. Дальнейшие исследования того, почему и как митохондрии нарушены при болезни Альцгеймера, а также других нейродегенеративных состояниях, необходимы для разработки эффективных методов лечения, которые улучшат функцию митохондрий и улучшат здоровье клеток мозга ».
Среди других авторов статьи — научный сотрудник Родриго Кинтанилья, доктор наук.Д., который является первым автором статьи; Филип Долан, доктор философии, сейчас работает в Neotope Biosciences, подразделении Elan Pharmaceuticals; и Янгман Джин, доктор философии, сейчас работает в Гарварде. Работа финансировалась Ассоциацией Альцгеймера. и Национальный институт неврологических расстройств и инсульта.
Как показывают исследования, блокирование разрушения дефектных белков неожиданно задерживает нейродегенерацию у мышей | Центр новостей
Thomas Sudhof
Можно было бы ожидать, что избавление клетки мозга от поврежденных белков было бы универсальным благом, и что нарушение способности клетки делать это могло бы позволить дефектным белкам накапливаться внутри клетки, возможно, до токсичных уровней.Поэтому много научных усилий было потрачено на поиск способов улучшить процесс, с помощью которого клетки избавляются от поврежденных белков.
Но это мышление, возможно, потребует некоторого пересмотра, согласно новому исследованию Медицинской школы Стэнфордского университета. Старший автор Томас Судхоф, доктор медицины, профессор молекулярной и клеточной физиологии, и его коллеги-исследователи неожиданно обнаружили, что подавление процесса, посредством которого поврежденные белки обычно расщепляются внутри клеток, задерживает появление симптомов у лабораторных мышей, которые очень склонны к нейродегенерации. и значительно увеличили их долговечность.
Исследование, опубликованное в Интернете 15 августа в журнале Science Translational Medicine , также показало, что блокирование активности внутренних систем удаления мусора, известных в биологии как протеасомы, в нервных клетках, взятых у мышей, склонных к нейродегенерации, восстанавливается. несколько ключевых биохимических характеристик, необходимых для здорового функционирования клеток.
Хотя Судхоф предупреждает, что необходимы дополнительные исследования, полученные результаты бросают вызов преобладающим представлениям о патологии определенных нейродегенеративных расстройств.
«Текущий консенсус в нейробиологии поддерживает терапевтическую стратегию, направленную на ускорение, а не на препятствие утилизации поврежденных белков, которые накапливаются в головном мозге пациентов с болезнью Альцгеймера, Паркинсона, Хантингтона и другими нейродегенеративными заболеваниями», — сказал Судхоф, который также является Профессор Аврама Гольдштейна в Медицинской школе.
Протеасомы — это клеточные компоненты, разрушающие поврежденные белки. Не только нервные клетки, но и практически все клетки живых существ, от дрожжей до людей, содержат множество этих крошечных трубчатых машин, которые засасывают дефектные белки в свои отверстия и измельчают их на куски.
Исследуя ткань мозга умерших пациентов с болезнью Альцгеймера и Паркинсона, команда Судхофа заметила, что имеет место аспект дегенеративного процесса, идентичный тому, который они предотвратили у лабораторных мышей, предполагая, что их результаты на животной модели могут оказаться актуальными для этих и других людей. болезни тоже.
Особый дефектный белок, уничтожение которого было предотвращено в исследовании Судхофа, названный SNAP-25, играет ключевую роль в высвобождении химических сигналов, которые нервные клетки используют для связи друг с другом.Но, как и все белки, SNAP-25 не может выполнять свою работу, пока ему не придать форму.
«Структура равняется функции» — это девиз биохимии. Белки — молекулярные существа, которые выполняют основную часть работы в каждой живой клетке — изначально производятся в виде длинных линейных последовательностей небольших химических субъединиц, которые постепенно соединяются вместе, как бусинки на веревочке. Но нить — это просто нить, пока она не приобретет определенную структуру, обычно с помощью одной или нескольких молекул-шаперонов, которые придают ей правильную форму.
Подобно ногам почтальона, переутомленные белки со временем могут сойти. Неправильно свернутые и, следовательно, более не функциональные белки, в качестве альтернативы, могут быть быстро восстановлены и возвращены к работе или химически «закодированы» для разрушения протеасомами.
SNAP-25 используется многими типами клеток, но особенно активно работает в нервных клетках или нейронах. Чтобы передавать сигналы друг другу, нейроны выделяют специализированные химические вещества в небольшие промежутки, называемые синапсами, которые отделяют один нейрон от другого в реле.Перед высвобождением эти химические вещества изолируются в мембраносвязанных пакетах или пузырьках внутри нейрона. Каждый раз, когда один нейрон передает сигнал следующему — а это может быть более 100 раз в секунду — сотни крошечных химически упакованных пузырьков приближаются к краю первого нейрона и сливаются с его внешней мембраной. Внутренняя поверхность слитого пузырька становится частью внешней поверхности нейрона (точно так же, как если бы маленький пузырь слился с большим, окружающим его), и его сохраненное содержимое вылилось в синапс.
Чтобы это произошло, везикулы должны активно принуждаться к тесному контакту с мембранами нейронов. Это достигается за счет кластера белков, который служит молекулярным эквивалентом зажима. В ходе повторяющихся импульсов возбуждения нейронов SNAP-25 — ключевой компонент этого зажимного комплекса — может деформироваться, делая весь зажимной узел бесполезным. Чем больше срабатывает нейрон, тем больше молекул SNAP-25 со временем деформируется.
Несколько лет назад группа Судхофа использовала сложную генетическую технику для создания линии лабораторных мышей, лишенных молекулы шаперона, которая помогает в правильной рефолдинге SNAP-25.В молодости эти мыши кажутся вполне нормальными. Но постепенный отказ зажимающего действия, необходимого для слияния везикул и передачи нейронных сигналов, приводит к отмиранию нейронов, что в конечном итоге вызывает поведенческие симптомы и преждевременную смерть. Судхоф широко использовал этих мышей в качестве модельной системы для понимания неправильно свернутых белков и дегенеративных заболеваний.
В новом исследовании введение мышам с дефицитом шаперона одного из двух препаратов, ингибирующих протеасомы (лактацистина и эпоксомицина), один раз в пять дней — вероятно, далеко от оптимального режима, но, по крайней мере, возможного эксперимента на животных, — сказал Судхоф, — откладывалось. типичные внешние симптомы их нейродегенеративного расстройства на целых 30 процентов и продлили их выживание почти на 20 процентов.Затем исследователи инкубировали нейроны экспериментальных мышей в растворах с препаратами, ингибирующими протеасомы, или без них. Биохимические измерения показали, что, хотя общие запасы SNAP-25 в нейронах, инкубированных с лекарствами или без них, были одинаковыми, активность зажимающего комплекса восстанавливалась до нормальных уровней в пропитанных лекарством нейронах. (В нейронах, свободных от лекарств, клэмп-активность оставалась сильно нарушенной.)
Очевидно, что предотвращение распада неправильно свернутых молекул SNAP-25 увеличивает их уровни в нейронах — результат, который интуитивно можно было бы подумать, будет токсичным, сказал Судхоф.Но эксперименты в новом исследовании вместо этого предполагают, что неправильно свернутые белки, либо случайно, просто из-за того, что они отскакивают в окружающей среде, либо при активном содействии «общих» молекул шаперонов, могут вернуться к нормальной форме и вернуться в бой. По мере того, как дефектный SNAP-25 накапливается в клетке, большая часть его восстанавливается, что имеет благоприятные последующие последствия для активности молекулярного зажима, слияния везикул и мембраны и лучшей передачи химических сигналов нейронами. Поскольку нейроны должны эффективно передавать сигналы, чтобы выжить, меньше из них умирают.
Ряд нейродегенеративных заболеваний, таких как болезни Альцгеймера, Паркинсона и Хантингтона, связаны с возникновением поврежденных белков. Среди исследователей широко распространено мнение, что накопление этих поврежденных белков существенно способствует развитию болезни.
Судхоф предупредил, что, хотя возможно, что препараты, ингибирующие протеасомы, могут, как это ни парадоксально, замедлить развитие этих и других дегенеративных состояний человека, это далеко не доказано.Однако гораздо более мощные препараты, ингибирующие протеасомы, чем старые, не запатентованные препараты, которые Судхоф и его товарищи по команде дали своим экспериментальным мышам, уже находятся в клиническом использовании при определенных показаниях к раку, поэтому их можно быстро развернуть в доклинических исследованиях, проверяющих эту возможность.
Постдокторант Ману Шарма, доктор философии, является первым автором исследования, которое финансировалось Национальным институтом старения. Постдокторантура Жаклин Бурр, доктор философии, была дополнительным соавтором.
Информация о кафедре молекулярной и клеточной физиологии медицинского факультета, которая также поддержала эту работу, доступна по адресу http: // mcp.stanford.edu/.
Контроль качества белка в клетке: удаление отходов более эффективно, чем ожидалось
Белки выполняют столько жизненно важных задач, что без них наш организм не функционировал бы. Однако при производстве этих молекул клетки совершают огромное количество ошибок: около одной трети всех вновь синтезированных белков являются дефектными. Неспособность распознать и устранить их может привести к тяжелым заболеваниям. Команда под руководством профессора Томаса Зоммера из Центра молекулярной медицины Макса Делбра ück Ассоциации Гельмгольца (MDC) теперь получила новое понимание сложного процесса контроля качества белка в клетке.Исследователи недавно опубликовали свои результаты в журнале Molecular Cell .
Белки отвечают почти за все в организме: они обеспечивают строительный материал для клеток, переносят кислород через кровь, позволяют мышцам функционировать, контролируют обмен веществ и выполняют многие другие функции. Короче говоря, они поддерживают тело. Это разнообразие белков производится небольшими молекулярными механизмами, называемыми рибосомами, многие из которых находятся на поверхности клеточной органеллы, эндоплазматической сети.В этом процессе клетки часто делают ошибки, складывая белки в ту форму, которая им необходима для функционирования. Такие неправильно свернутые молекулы должны быть удалены вместе с интактными белками, которые выполнили свое предназначение и больше не нужны клетке.
Удаление отходов необходимо для ячейки
«Если эти белки не утилизировать должным образом, они могут накапливаться в клетках и вызывать серьезные повреждения», — говорит Анника Вебер, аспирант исследовательской группы «Внутриклеточный протеолиз» под руководством проф.Томас Соммер в MDC. Она является первым автором недавнего исследования в Molecular Cell . Неспособность устранить дефектные белки может вызвать такие заболевания, как болезнь Альцгеймера, Паркинсона или Хантингтона. Таким образом, для организма жизненно важно, чтобы эти белки удалялись механизмом утилизации клеточных отходов и разбирались в протеасоме, измельчителе клетки.
За последние несколько лет исследователи смогли обнаружить многие детали, с помощью которых происходит этот очень сложный процесс деградации белка.Однако многие вопросы остаются без ответа. Они включают вопрос о том, как белки, которые необходимо удалить, могут быть идентифицированы среди огромного разнообразия клеточных молекул и помечены для удаления отходов.
Ферменты лигазы маркируют белки, которые необходимо разрушить
Ферменты, называемые лигазами, в том числе молекула под названием Doa10, играют ключевую роль в контроле качества белка. Doa10 встроен в мембрану, охватывающую эндоплазматический ретикулум и ядро, и способен идентифицировать аберрантные белки.Он связывается с ними, втягивает дополнительные ферменты и образует машину, состоящую из компонентов, которые передают сигналы для разложения. Следующий шаг имеет решающее значение: небольшая молекула, называемая убиквитином, присоединяется к дефектным белкам. Добавляются дополнительные молекулы убиквитина до образования гомогенной цепи. Это создает метку, которая отмечает белок для разрушения. Только после этого он транспортируется в протеасому и расщепляется.
«Мы хотели узнать больше о том, как образуется эта убиквитиновая цепь», — говорит Анника.Ученые знали, что в этом участвует фермент Ubc7. «Долгое время догма заключалась в том, что один только этот фермент способен выполнять обе задачи: присоединять первый убиквитин к белку и добавлять дополнительные молекулы убиквитина для образования цепи».
В поисках ключей к разгадке в дрожжевых клетках
Однако были также свидетельства участия второго фермента Ubc6. Анника и ее коллеги решили изучить его роль в дрожжевых клетках. Система деградации белков настолько важна для организмов, что основные механизмы сохранились в аналогичной форме у всех живых существ — от дрожжевых клеток до людей — в процессе эволюции.
Исследователи генетически манипулировали дрожжевыми клетками, чтобы они не могли продуцировать Ubc6 или Ubc7, а затем исследовали скорость разложения определенных белков. В другой серии экспериментов они выделили оба фермента из клеток и использовали биохимические методы, чтобы выяснить, вызывает ли это различие в способе прикрепления молекул убиквитина к белкам. Эта часть проекта требовала поддержки со стороны технологической платформы MDC для масс-спектрометрии.
Различные ферменты участвуют в работе
Оказалось, что Ubc6 также играет ключевую роль в маркировке молекул как отходов.Ubc6 связывает первую убиквитиновую метку с дефектным белком. Затем Ubc7 вмешивается, чтобы добавить больше молекул убиквитина. Это было важное открытие: благодаря совместной работе два фермента делают процесс более эффективным. В то время как Ubc7 специализируется на образовании гомогенной убиквитиновой цепи, Ubc6 может инициировать цепь, прикрепляя ее к различным белкам.
Другое наблюдение подтвердило открытие: белки состоят из 20 различных аминокислот; до сих пор предполагалось, что убиквитин может быть присоединен только к определенной аминокислоте, называемой лизином.Исследователи из MDC показали, что Ubc6 также может прикреплять метку к серину и другим аминокислотам. «Это делает сигнальный путь более надежным», — объясняет Анника. «Очень важно, чтобы организм удалил все дефектные белки, даже те, на поверхности которых отсутствует доступный лизин».
Исследователи также смогли показать, что у людей есть фермент, соответствующий дрожжевому Ubc6, названный UBE2J2, который, по-видимому, выполняет ту же функцию. Чтобы выяснить это, они выделили фермент из клеток человека и исследовали его активность в образовании убиквитиновых цепей in vitro .
Следующим шагом группы Томаса Соммера будет более подробное изучение свойств Ubc6. Недавнее исследование впервые показало, что фермент играет решающую роль в эффективной маркировке дефектных белков. Более четкое понимание того, как Ubc6 управляет этим на молекулярном уровне, будет способствовать лучшему пониманию ключевого клеточного процесса деградации белка и болезней, которые возникают из-за дефектов этого процесса.
Анника Вебер, 1 Итамар Коэн, 2 Оливер Попп, 3 Гуннар Дитмар, 3 Юваль Рейсс, 2 Томас Соммер, 1,4 Томмер Равид, н 2 1 ”Последовательное полиубиквитилирование специализированными конъюгированными ферментами увеличивает универсальность убиквитинлигазы для контроля качества.« Молекулярная ячейка 63 . DOI: 10.1016 / j.molcel.2016.07.020
1 Внутриклеточный протеолиз, Центр молекулярной медицины Макса Дельбрюка, Берлин, Германия; 2 Кафедра биологической химии, Еврейский университет Иерусалима, Иерусалим, Израиль; 3 Основная лаборатория масс-спектрометрии, Центр молекулярной медицины Макса Дельбрюка, Берлин, Германия; 4 Институт биологии, Университет Гумбольдта в Берлине, Берлин, Германия
Первые авторы Анника Вебер и Итамар Коэн внесли равный вклад в публикацию.



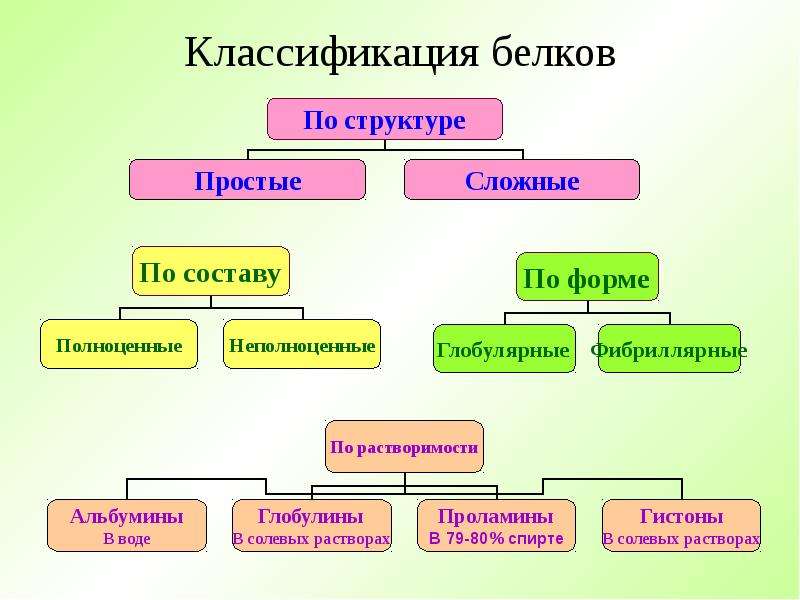 03
03