Нарушена микрофлора кишечника симптомы: симптомы, причины, диагностика, лечение и профилактика
Признаки (симптомы) дисбактериоза кишечника
Дисбактериоз кишечника – состояние, при котором нарушается состав нормальной микрофлоры кишечника, что может приводить к появлению неприятных и даже опасных симптомов. Последствия нарушения баланса могут сказаться не только на функции пищеварительной системы, но и на общем состоянии организма. Симптомы дисбактериоза зависят от стадии заболевания.
На первой стадии под влиянием негативных воздействий происходит снижение численности полезных бактерий. Однако признаки дисбактериоза кишечника человеком не ощущаются, потому что на этой стадии патогенная микрофлора развита незначительно. Таким образом, начальная стадия дисбактериоза проходит бессимптомно и не доставляет беспокойств.
На второй стадии количество полезных бактерий, таких как лакто- и бифидобактерии, снижается еще больше, что дает возможность патогенным бактериям стремительно размножаться. В этот момент появляются первые признаки дисбактериоза кишечника: расстройство желудка, боли в области живота, диарея, повышенное газообразование (метеоризм, вздутие живота). Лечение дисбактериоза кишечника необходимо начинать с появлением первых симптомов.
В отсутствие лечения может начаться третья стадия дисбактериоза кишечника. Симптомы дисбактериоза становятся более выраженными: развившаяся патогенная микрофлора вызывает воспаление стенок кишечника. А пониженный из-за нарушения баланса иммунитет не может эффективно бороться с инфекционными микроорганизмами. Таким образом, отсутствие своевременного лечения и устранения причины заболевания, может привести к тому, что дисбактериоз кишечника приобретет устойчивый хронический характер.
Наиболее тяжелыми последствиями дисбактериоза может стать развитие острой кишечной инфекции, а при попадании патогенов в кровь — может развиться бактериемия и сепсис. Критическое снижение полезных бактерий в кишечнике приводит к нарушениям пищеварения, всасывания полезных веществ, снижению иммунитета.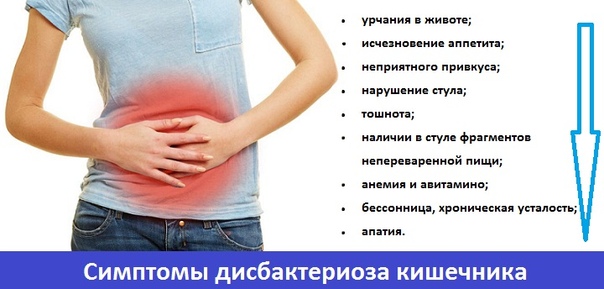 На этой стадии заболевания, развивается общее истощение организма, пациент ощущает усталость, слабость, развивается анемия и авитаминоз.
На этой стадии заболевания, развивается общее истощение организма, пациент ощущает усталость, слабость, развивается анемия и авитаминоз.
Ещё статьи:
ABC-медицина
При эубиозе (то есть в норме) микрофлора кишечника представляет собой оптимальное соотношение различных бактерий – кишечной палочки, лактобацилл, энтерококков и др., всего более 500 видов. Дисбактериозом называют дисбаланс микробов, который длится продолжительное время. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
При должной коррекции, которую может назначить только врач, дисбактериоз кишечника проходит, но при отсутствии лечения обычно переходит в более тяжелую, прогрессирующую форму. Данное бактериологическое состояние принято рассматривать в качестве проявления или осложнения какого-либо заболевания, чаще всего – желудочно-кишечного тракта.
Причины развития дисбактериоза
Гибель полезных бактерий, населяющих микрофлору кишечника, может быть связана с такими факторами, как:
- изменение функций желудка, поджелудочной железы или печени, приводящее к недостатку пищеварительных ферментов и появлению непереваренных остатков пищи, которые способствуют росту болезнетворных микробов;
- пониженный тонус гладкой мускулатуры кишечника или ее спазмы, возникающие в результате психического или физического стресса, хирургического вмешательства, вегетососудистой дистонии – все это приводит к нарушению передвижения пищевых масс;
- различные заболевания желудочно-кишечного тракта, такие как холецистит, гастрит, панкреатит и пр., связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
- неправильное пищевое поведение (диеты, недостаток кисломолочных продуктов и клетчатки, употребление консервантов) препятствует нормальному росту полезных микробов или провоцирует их уничтожение;
- наличие в кишечнике паразитов или болезнетворных микробов, чьи продукты жизнедеятельности убивают полезные микроорганизмы – обычно это связано с дизентерией, сальмонеллезом, вирусными заболеваниями и пр.
 ;
; - прием антибиотиков, пагубно действующих не только на вредных микробов, но и на полезных.
К факторам, повышающим риск развития дисбактериоза кишечника, относят постоянные стрессы и неблагоприятную экологию, от которых страдают жители современных мегаполисов.
Общая симптоматика
Симптомы дисбактериоза кишечника различаются по локализации дисбиотических изменений и степени их выраженности. На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
1 стадия
На данном этапе дисбаланс бактерий выражен слабо: пациента могут беспокоить небольшие расстройства кишечника. Обычно такое состояние связано с кратковременным воздействием на микрофлору, например, со сменой привычной пищи, напитков. После окончания воздействия провоцирующих факторов или привыкания к новым условиям баланс микрофлоры восстанавливается.
2 стадия
Прекращается производство кишечником необходимого количества ферментов, обеспечивающих нормальное пищеварение. В результате возникает процесс брожения, который проявляется болью и вздутием живота, горечью во рту, метеоризмом, запорами или, наоборот, диареей. Это могут быть симптомы как прогрессирующего дисбактериоза, так и развития заболеваний желудочно-кишечного тракта.
3 стадия
На этой стадии при воздействии большого количества патогенной флоры на стенки кишечника развивается воспалительный процесс. Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
4 стадия
Это состояние кишечника, при котором нормальная микрофлора практически полностью вытеснена болезнетворными микроорганизмами, что приводит к нарушению всасывания полезных веществ, развитию авитаминоза и даже анемии. Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Крайняя степень дисбактериоза – проникновение бактерий желудочно-кишечного тракта в кровь (бактериемия), в некоторых случаях – развитие сепсиса.
Диагностика дисбактериоза
Основная цель диагностики – определение вида микробов, заселяющих кишечник, и их количества. Как правило, используются следующие основные методы:
- бактериологическое исследование, на качество результатов которого влияют соблюдение сроков доставки и сохранности материала, а также условий культивирования разных видов бактерий;
- исследование метаболитов микрофлоры, которое основано на определении летучих жирных кислот, выделяемых микроорганизмами. Отличается точностью результатов, простотой и оперативностью выполнения.
При проведении диагностики и постановке диагноза учитывается также, что микрофлора кишечника индивидуальна для каждого человека. Ее состав может зависеть от возраста, потребляемой пищи и сезона. В связи с этим специалист основывается не только на результатах анализов, но и на дополнительных обследованиях, позволяющих выявить причину развития дисбактериоза.
Лечение дисбактериоза
Лечение дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема обычно включает меры, направленные на:
- устранение избыточности патогенных микроорганизмов;
- восстановление нормальной микрофлоры;
- улучшение процесса пищеварения;
- нормализацию моторики кишечника;
- стимулирование реактивности всего организма.
Помните, что назначить грамотное и эффективное лечение может только специалист. Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
Дисбактериоз влагалища: причины, профилактика и лечение
Дисбиоз (дисбактериоз) влагалища — это нарушение нормальной микрофлоры влагалища. Этим заболеванием в той или иной степени страдает большая часть женщин.
При нарушении микрофлоры изменяется равновесие между бактериями-нормальными обитателями влагалища. При этом снижается количество лакто- и бифидобактерий и увеличивается количество какого-то другого возбудителя. Этим другим возбудителем может быть одна из ключевых клеток (тогда развиваются гарднереллез, кандидоз и т.д.), может быть одна из половых инфекций (трихомониаз, хламидиоз), или же может быть любой сапрофитный возбудитель (кишечная палочка, протей, стрептококки, стафилококки и т.д.).
Дисбиоз влагалища и половые инфекции
Половые инфекции всегда связаны с нарушением микрофлоры влагалища. С одной стороны, нормальная микрофлора не допустит развития половой инфекции у женщины, и если обнаруживается половая инфекция, микрофлора не может быть не нарушена. С другой стороны, появление возбудителя какого-либо заболевания, передающегося половым путем (ЗППП) во влагалище смещает pH, вызывает воспалительную реакцию и еще больше способствует прогрессированию нарушения микрофлоры.
Ситуация, при которой во влагалище у женщины обитает только один лишь возбудитель ЗППП, почти никогда не возникает. Половая инфекция, одна или несколько, всегда находятся в ассоциации с условно-патогенной микрофлорой. И это всегда должно учитываться при лечении ЗППП. Иначе может возникнуть ситуация, при которой антибиотиками полностью убивается возбудитель ЗППП, а количество условно-патогенной инфекции лишь возрастает.
Лечение ЗППП
у женщин обязательно должно завершаться восстановлением микрофлоры влагалища. Если речь идет о серьезных инфекциях (хламидия, трихомонада) или нескольких ЗППП, то сначала есть смысл провести антибактериальную терапию против них, а затем заняться восстановлением микрофлоры влагалища следующим курсом. В менее сложных ситуациях есть смысл проводить сначала комплексную диагностику всей урогенитальной микрофлоры, а затем ее восстановление с одновременным устранением половой инфекции.
Если речь идет о серьезных инфекциях (хламидия, трихомонада) или нескольких ЗППП, то сначала есть смысл провести антибактериальную терапию против них, а затем заняться восстановлением микрофлоры влагалища следующим курсом. В менее сложных ситуациях есть смысл проводить сначала комплексную диагностику всей урогенитальной микрофлоры, а затем ее восстановление с одновременным устранением половой инфекции.
Дисбиоз влагалища и заболевания кишечника
Многие заболевания желудочно-кишечного тракта ведут к нарушению нормальной микрофлоры кишечника и развитию дисбактериоза. При дисбактериозе кишечника происходит примерно тоже самое, что и при дисбактериозе влагалища — в кишечнике живет большое количество какой-нибудь бактерии.
Стенка прямой кишки плотно соприкасается со стенкой влагалища, бактерии легко проходят через нее. При выраженном дисбактериозе кишечника нарушение вагинальной микрофлоры всегда обусловлено именно этим, и как правило из влагалища высевается одна из кишечных инфекций — кишечная палочка, энтерококки и др.
Лечение дисбиоза влагалища
в такой ситуации крайне затруднено, вероятность рецидива заболевания очень высока. Восстановление нормальной микрофлоры влагалища в такой ситуации возможно лишь при одновременном лечении заболеваний кишечника.
Дисбиоз влагалища и половой партнер
Чаще всего нарушение микрофлоры влагалища у женщины не вызывает никаких проблем у ее полового партнера, даже при регулярной половой жизни без использования средств контрацепции. В отдельных случаях, когда имеет место выраженный дисбиоз влагалища, у мужчины могут развиваться явления баланопостита и неспецифического уретрита. Но это обычно бывает только в том случае, если у мужчины уже была предрасположенность к этим заболеваниям, в полностью здоровом организме они не разовьются.
Никакое заболевание полового партнера, за исключением венерических заболеваний, не оказывает влияния на микрофлору влагалища у женщины. Лечение дисбиоза влагалища у женщин не предполагает обязательного лечения полового партнера, если только хотя бы у одного из них не выявляется присутствие половой инфекции.
Лечение дисбиоза влагалища у женщин не предполагает обязательного лечения полового партнера, если только хотя бы у одного из них не выявляется присутствие половой инфекции.
Дисбиоз влагалища и беременность
Беременность является одним из факторов, которые могут провоцировать обострение вагинального дисбиоза. На фоне беременности могут появляться или усиливаться выделения, зуд или жжение в половых органах, боль при половом акте и т.д. Это связано с тем, что во время беременности организм женщины подвергается серьезной гормональной перестройке, что не может не сказаться как на состоянии иммунитета, так и на вагинальной микрофлоре.
Спасибо за оставленную заявку.
Наш оператор свяжется с вами с 8:00 до 22:00
Заявки, поступившие после 22:00, будут обработаны на следующий день.
Полноценное лечение дисбиоза влагалища во время беременности возможным не представляется. Даже если это лечение не связано с приемом антибиотиков, что крайне нежелательно во время беременности, оно всегда связано с иммунокоррекцией, а это во время беременности совершенно недопустимо. Поэтому задачей доктора при обострении дисбиоза влагалища у беременной женщины является лишь устранение симптомов и подготовка женщины к родам.
В нашей клинике с этой целью проводится курс процедур, которые если не нормализуют ситуацию, то делают ее более терпимой. Местное лечение, проводимое при этом, совершенно безвредно для плода. Если есть необходимость, это лечение на протяжении беременности можно проводить неоднократно.
Дисбиоз влагалища у девушек
Нарушение микрофлоры влагалища встречается у девушек, не начинавших половую жизнь, примерно с такой же частотой, как и у живущих активной половой жизнью женщин. Это связано несколько с другими факторами — нестабильность гормонального фона, становление цикла, а также с анатомическими особенностями строения девственной плевы.
Дисбиоз влагалища у девушек редко проявляется обильными выделениями, поскольку отверстия девственной плевы как правило не позволяют им выводиться из влагалища в том количестве, в каком они образуются. Поэтому развивается застой выделений во влагалище, и вероятность развития воспалительных заболеваний у девственниц выше. С другой стороны, при начале половой жизни с первыми половыми актами происходит заброс большого количества бактерий из влагалища в мочевой пузырь, и это может привести к возникновению так называемого «цистита медового месяца».
Лечение дисбиоза влагалища у девушек-девственниц несколько затруднительно из-за того, что строение девственной плевы не всегда позволяет проводить обработки влагалища лекарствами должным образом. В отдельных случаях даже приходится прибегать к искусственному нарушению целостности девственной плевы — гименэктомии.
В «СМ-Клиника» врачи-гинекологи после проведения обследования и анализов выявят точные причины дисбактериоза влагалища и назначат эффективное комплексное лечение, которое приведет к восстановлению нормальной микрофлоры влагалища.
Дисбактериоз кишечника: симптомы, коррекция и лечение дисбиоза у взрослых и детей, степени, анализы и профилактика
Дисбактериозом (дисбиоз) называют симптоматическое состояние, характеризующееся нарушением микрофлоры кишечника. В кишечнике в этот момент размножаются патологические бактерии, и нарушается естественный микробный баланс.
Причины дисбактериоза
Существуют различные предпосылки и состояния, которые способны привести к развитию дисбактериоза:
- заболевания органов ЖКТ,
- прием лекарственных препаратов, нарушающих микрофлору кишечника (антибиотики),
- неправильное питание,
- физиологические возрастные изменения,
- прием гормональных препаратов,
- курсы лучевой и химиотерапии,
- стрессы и неправильный режим дня,
- пищевые отравления,
- инфекционные процессы в организме.
Банальные респираторные инфекции или аллергические заболевания могут стать причиной нарушения микрофлоры кишечника, так как в этот период пациенту могут назначаться различные лекарственные препараты, негативно влияющие на микробный баланс.
Как понять, что у вас дисбиоз?
На разных стадиях заболевания симптоматика дисбактериоза различна. Специалисты рекомендуют обращать внимание на следующие проявления:
- отрыжка,
- тошнота,
- урчащие звуки в животе,
- вздутие и метеоризм,
- ноющие или режущие боли в области живота,
- запоры либо диарея и жидкий стул,
- сухость кожных покровов,
- неприятный привкус и запах изо рта,
- утомляемость и нарушение сна.
Наличие одного или нескольких перечисленных симптомов – повод обратиться к врачу.
Диагностика дисбактериоза
Самостоятельно диагностировать состояние дисбактериоза невозможно. Поставить точный диагноз способен только опытный специалист, который обследует пациента при помощи лабораторных методов и специальной аппаратуры. Обратившись за медицинской помощью, пациент проходит обследование, которое включает:
- исследования мочи и кала,
- ПЦР-диагностику микрофлоры,
- визуальный осмотр кожных покровов.
Профилактика дисбактериоза
Развитие заболевания можно предотвратить, если внимательно следить за питанием, избегать стрессовых состояний, соблюдать режим сна и отдыха, не употреблять необоснованных лекарственных препаратов, занимаясь самолечением, контролировать состояние органов желудочно-кишечного тракта.
Что будет, если не лечить дисбактериоз?
Если не лечить дисбиоз, заболевание может перейти в более тяжелую форму, и не исключено появление осложнений. В результате этих процессов в кишечнике будут образовываться токсические вещества, которые с кровотоком будут разнесены по всем органам и тканям. Всасывание и усвоение минералов и витаминов будет нарушено, иммунитет организма ослабнет, и защитные свойства значительно снизятся. Пациент будет легко подвержен различным инфекциям, банальное расстройство кишечника может привести к серьезным заболеваниям, лечение которых нередко требует оперативного вмешательства.
Как вылечить дисбактериоз?
При лечении дисбактериоза важнейшим шагом становится лечение основного заболевания, которое вызвало патологию в кишечнике пациента. Затем проводится терапия по восстановлению микрофлоры кишечника, наиболее правильно подбирать препараты на основе лабораторных исследований посева.
Диета при дисбактериозе
В период лечения и для предупреждения рецидивов необходимо исключить употребление жирного, острого, соленого, жареного, не пить алкоголь. Питание должно быть сбалансированным и щадящим, в рационе должны присутствовать кисломолочные продукты.
Проконсультироваться о диагностике и лечении дисбактериоза и записаться к специалисту вы можете, позвонив в нашу клинику или записавшись через форму на сайте.
УЗНАТЬ ЦЕНЫ
Дисбактериоз — причины, симптомы и лечение — Медкомпас
Дисбактериоз – это нарушение свойств и состава микрофлоры кишечника, которое оказывает негативное влияние на организм в целом. Заболевание встречается часто, болеют как дети, так и взрослые.
Симптомы болезни
Для дисбактериоза характерен большой диапазон тяжести симптоматики. У некоторых людей он протекает без жалоб, у других вызывает тяжелые расстройства здоровья. Дисбактериоз проявляется нарушениями в работе желудочно-кишечного тракта, кожными проявлениями и симптомами отравления организма.
Наиболее частыми симптомами дисбактериоза является:
- Нарушение стула в виде запоров и поносов. Понос кашицеобразный, пенящийся, зловонный
- Дискомфорт и боль в животе
- Метеоризм
- Снижение аппетита
- Тошнота
- Изжога и отрыжка
- Неприятный запах изо рта.
Общие симптомы:
- Головные боли
- Слабость, недомогание
- Повышенная утомляемость
- Нарушение сна
- Похудение.
Кожные симптомы:
- Зуд кожных покровов
- Аллергические высыпания
- Сухость кожи.
Причины болезни
Наиболее частой причиной дисбактериоза является длительный и бесконтрольный прием антибиотиков. Антибактериальные препараты подавляют рост как «плохих микробов», так и «хороших». Кроме антибиотиков, дисбактериоз могут вызвать любые препараты, подавляющие иммунную систему: кортикостероиды, химио- и лучевая терапия.
Провоцирующим фактором в развитии дисбактериоза являются воспалительные заболевания органов пищеварения, а именно: хронические гастриты, панкреатит, холецистит, гепатит, цирроз печени, язвенная болезнь, дискинезия желчевыводящих путей.
Еще одной причиной является несбалансированное, однообразное питание, злоупотребление жирным и сладким, монодиеты, авитаминоз.
У детей до года, наиболее распространенными причинами дисбактериоза являются: раннее введение прикорма, инфекционные инфекции (особенно кишечные), глистные инвазии.
Диагностика
Диагностика дисбактериоза начинается с кабинета врача-гастроэнтеролога. Последний подробно расспрашивает пациента, узнает, какие жалобы беспокоят, когда они впервые появились, с чем пациент связывает развитие заболевания.
Далее следует осмотр кожи и слизистых.
Подтверждается (или опровергается) диагноз лабораторными методами исследования.
.
Для определения возможных нарушений функций ЖКТ назначается копрограмма– общий анализ кала. Исследования показывает: нарушения ферментативной и кислотообразующей функции желудка, патологию ферментативной функции кишечника и поджелудочной железы, нарушения функций печени и желчного пузыря, а также воспалительные явления желудочно-кишечного тракта.
Осложнения
При отсутствии лечения дисбактериоза, возможен переход заболевания в более тяжелую форму. Не исключен риск развития осложнений, а именно:
- Развитие патогенной флоры
- Нарушение всасывания витаминов, минералов и микроэлементов
- Образование токсических веществ в кишечнике, которые, проникая в кровь, отравляют весь организм
- Нарушения местного иммунитета, снижение защитных свойств организма.
Кроме того, при отсутствии лечения, дисбактериоз может провоцировать развитие различных заболеваний – сахарного диабета, панкреатита, дискинезии желчного пузыря, желчекаменной болезни, иммунодефицита, псориаза, экземы и атопического дерматита.
Лечение болезни
Важнейшей частью терапии является лечение основного заболевания, послужившего провоцирующим фактором для развития дисбактериоза. Только в этом случае положительный эффект лечения не заставит ждать.
Следующим этапом в лечении является прием препаратов, восстанавливающих нормальную микрофлору – пробиотиков и пребиотиков. Наиболее правильно подбирать препарат, чувствительный к высеянной флоре.
При наличии патогенной микрофлоры назначаются антибиотики и бактериофаги.
Во время лечения следует избегать приема препаратов, отрицательно действующих на желудочно-кишечный тракт.
Все о дисбактериозе | Медицинский центр «Новая медицина»
ВСЁ О ДИСБАКТЕРИОЗЕ
Дисбактериоз очень распространенное заболевание. По данным Минздрава дисбактериоз выявляют у 90% взрослого населения и свыше 25% детей в возрасте до года. Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Дисбактериоз считается основной социальной болезнью 21-го века. Актуальность проблемы требует постоянного поиска новых средств лечения дисбактериоза и его коррекции.
ДИСБАКТЕРИОЗ У ДЕТЕЙ
Дисбактериоз у детей, как и у взрослых, возникает вследствие нарушения баланса микрофлоры кишечника. Определить его наличие без анализа в лаборатории крайне сложно, поскольку это не является самостоятельным заболеванием, а возникает вследствие воспалительного процесса в организме или же в случае нарушения баланса витаминов. В медицинской терминологии также применяется определение «дисбиоз», которое является синонимом «дисбактериоза».
Чаще всего возникает дисбактериоз у детей грудного возраста. К основному фактору его появления относится искусственное вскармливание малыша и недостаток витаминов, получаемых с дополнительной пищей. Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Источник, как правило, устанавливает врач.
Кишечно-желудочный тракт взрослого человека содержит примерно 1,5 кг бактерий, около 400—500 разных видов, а у детей до двух лет, вскармливаемых грудным молоком, преобладают в основной массе бифидобактерии, которые препятствуют развитию кишечно-желудочных заболеваний. У малышей, которых вскармливают искусственным путем, из-за невозможности кормить грудью, не формируется преобладание какой-то определенной группы бактерий — бифидо бактерий, такое питание не сможет предотвратить дисбактериоз у ребенка и защитить организм от других заболеваний. Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Преобладание бифидобактерий в детском организме важно тем, что они помогают регулировать обмен желчных кислот, а также принимают участие в формировании органических веществ и кислот, необходимых для работы кишечника. Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Как мы уже говорили, симптомов, по которым можно однозначно сделать вывод, что это дисбактериоз — нет, поэтому нужно искать в первую очередь причину — то заболевание, которое может сопровождаться дисбактериозом.
Раньше дисбактериоз определяли с помощью анализа состава кала, но так как осуществить правильный сбор кала в стерильную посуду не возможно, результат такого анализа не до конца объективен. На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
Каким же образом происходит лечение?
Первостепенно необходимо лечить причину его возникновения — основное заболевание, которое устанавливает один из врачей, назначенных педиатром. Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Предотвращается возможный дисбактериоз у ребенка в первую очередь длительным грудным кормлением и своевременным введением дополнительного прикорма к молоку. Лучше всего все этапы вскармливания ребенка согласовывать с наблюдающим педиатром, собственная интуиция важна, но совет профессионала не менее важен, тем более в этом возрасте закладывается основа иммунитета на всю жизнь. Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
В том случае, если врач установил дисбактериоз у ребенка, к основному питанию добавляются кисло-молочные продукты, в зависимости от направления лечения. Наринэ-Форте, Биовестин, Биовестин-лакто содержат бифидо и лактобактерии в пропорциях и состояние, которые способны стимулировать развитие микроорганизмов нормальной флоры.
Но не забывайте — не только питанием лечится дисбактериоз у детей, а также предупреждением первоисточника его возникновения, который определяет врач. Лучше всего сразу применять смеси, которые способствуют образованию бифидобактерий, как прикорм к основному питанию, для того, чтобы поддерживать необходимую микрофлору кишечника и предотвратить дисбактериоз у ребенка, а именно лечение смесями уже осуществлять под руководством врача в сочетании с лечением очага воспаления.
ДИСБАКТЕРИОЗ — ВРАГ ЗДОРОВЬЯ
Каждый день наш организм нуждается в еде. Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Например, переедаем за ужином или перед сном, едим не совсем полезную и здоровую пищу. Полноценное пищеварение возможно только в случае наличия в желудке каждого человека самых разнообразных микробов. Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Если говорить о дисбактериозе, то это состояние, во время которого все микробы нашего организма изменяют свой состав. Это изменение в свою очередь ведет к нарушению работы желудка и кишечника.
Вполне правильным будет вопрос — почему же все это происходит? Изменение состава Вашего кишечника происходит в результате каких-либо изменений в Вашем организме. Что это значит? Ваш организм чем-то заражен или в него попала какая-то инфекция. Все это приводит к появлению дисбактериоза.
Рассмотрим подробнее причины появления дисбактериоза. Этот сбой работы кишечника может произойти в результате неправильного применения различных антибиотиков. Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Во время дисбактериоза кишечник перестает обладать полезными микробами. Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Чтобы выявить наличие этого заболевания, Вам необходимо обратиться к врачу-гастроэнтерологу. Он назначит Вам гастроскопию, то есть проверят Ваш кишечник при помощи специального аппарата. Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
При любом курсе лечения этого заболевания Вы должны будете соблюдать диету. Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Чаще всего для полного выздоровления хватает двух месяцев. Однако есть одно но. Как правило, после лечения ни один врач не даст Вам стопроцентной гарантии, что Вы не заболеете дисбактериозом вновь. Микрофлора кишечника имеет один большой минус. Она очень быстро реагирует на любые изменения Вашего организма. Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Если говорить честно, то все в Ваших руках. Здоровье каждого человека в огромнейшей степени зависит исключительно от него самого. Если Вы будете себя беречь, Вы навсегда останетесь здоровыми и счастливыми.
БАД — ЭТО ТО, ЧТО НАМ НЕ ХВАТАЕТ В ПИЩЕ?
Относятся ли БАДы к разряду медикаментозных препаратов? Вызывают ли пищевые добавки привыкание? Могут ли добавки заменить обычное питание? Как правильно их применять? Что входит в их состав? Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать? На вопросы отвечает директор направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
Кто из нас не мечтает укрепить здоровье и продлить отпущенный природой срок жизни? Для этих целей вроде бы и выпускаются различные биологически активные добавки (БАДы). О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
Так что же такое БАДы и как правильно их принимать? С этим вопросом «Правда.ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
— Относятся ли БАДы к разряду медикаментозных препаратов?
— Биологически активные добавки к пище — не лекарства. Но использовать их в комплексе с лекарственными средствами вполне разумно и оправданно. Они помогают оздоровить организм, сократить длительность болезни, снизить риск развития осложнений и обострений, позволяют увеличить продолжительность жизни. Лекарства хороши, когда человек уже заболел. А БАДы применяются как средства профилактики, предупреждения болезней. Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
— Вызывают ли пищевые добавки привыкание?
— Физиологического привыкания не вызывают. Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
— Могут ли добавки заменить обычное питание? Как правильно их применять?
— БАДы являются именно добавками к пище, а не ее заменителями. С их помощью организм адаптируется к воздействию различных внешних и внутренних факторов. Биодобавки и витаминно-минеральные комплексы рекомендуется принимать регулярно в осенно-зимне-весенний период, когда организм ослаблен непогодой и гиповитоминозами. Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
— А что входит в их состав?
— БАДы включают в себя компоненты животного, растительного и минерального происхождения. В их состав могут входить как природные ингредиенты, так и соединения, полученные биотехнологическими или химическими методами. Могу с уверенностью сказать, что генетически модифицированные продукты при производстве биологически активных добавок не используются. В России утвержден и действует список из 190 разрешенных компонентов. Есть и перечень запрещенных: это, во-первых, сильнодействующие психотропные и ядовитые вещества, а также вещества, не являющиеся аналогами элементов нашего пищевого рациона, неприродные синтетические продукты, гормоны и ряд других…
— Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать?
— Предупреждения о возможных противопоказаниях потребитель может прочитать на этикетке к препарату. В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
РОДИТЕЛЯМ ОБ АНТИБИОТИКАХ
Вторую половину ХХ века можно смело назвать антибактериальной эрой, и это не будет преувеличением: число жизней, спасенных с помощью антибиотиков, давно перешагнуло за миллиард! Об их чудотворной силе ходят легенды, но и хулы в их адрес приходится слышать не меньше. Виной тому поверхностное знание, провоцирующее неоправданные ожидания, а стало быть — и многочисленные обвинения антибиотиков в бедах, за которые они на самом деле ответственности вовсе не несут.
А хуже всего то, что антибиотики применяют гораздо чаще, чем это необходимо, нанося тем самым серьезнейший вред не только больным, но и обществу в целом. Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
О ПОЛЬЗЕ ГРЯЗНОЙ ПОСУДЫ
Слово «антибиотик» образовано из двух элементов греческого происхождения: anti- — «против» и bios — «жизнь». Антибиотиками называют образуемые микроорганизмами, высшими растениями или тканями животных организмов вещества, избирательно подавляющие развитие микроорганизмов (или клеток злокачественных опухолей).
Любопытна история открытия первого антибиотика — пенициллина — шотландским бактериологом Александером Флемингом в 1829 г.: будучи по природе человеком неряшливым, он очень не любил… мыть чашки с бактериологическими культурами. Каждые 2—3 недели на его рабочем столе вырастала целая груда грязных чашек, и он скрепя сердце приступал к очистке «авгиевых конюшен». Одна из таких акций дала неожиданный результат, масштаб последствий которого сам ученый оценить в тот момент не мог. В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В очищенном виде пенициллин был получен лишь в 1940 г., т. е. спустя 11 лет после его открытия, в Великобритании. Сказать, что это произвело революцию в медицине, — значит не сказать ничего. Но у любой медали, увы, две стороны…
ОБОРОТНАЯ СТОРОНА МЕДАЛИ
Открыв столь мощное оружие в борьбе с болезнетворными микроорганизмами, человечество впало в эйфорию: к чему долго и кропотливо подбирать лекарственную терапию, если можно «шарахнуть» по зловредным микробам антибиотиком? Но и микробы «не лыком шиты» — они весьма эффективно защищаются от грозного оружия, вырабатывая устойчивость к нему. Если антибиотик, скажем, блокирует синтез необходимых микробу белков — микроб в ответ на это просто… меняет белок, обеспечивающий его жизнедеятельность. Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
НОВОЕ ПОКОЛЕНИЕ ВЫБИРАЕТ…
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? На помощь, как всегда, приходит классификация. Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы.
Пенициллины и цефалоспорины разрушают оболочку бактериальной клетки.
Аминогликозиды, макролиды, левомицетин, рифампицин и линкомицин убивают бактерии, подавляя синтез разных ферментов — каждый своего.
Фторхинолоны уничтожают микроорганизмы более «изощренно»: подавляемый ими фермент отвечает за размножение микробов.
В непрекращающемся состязании с микробами ученым приходится придумывать все новые и новые методы борьбы — каждый из них дает начало новому поколению соответствующей группы антибиотиков.
Теперь о названиях. Увы, здесь царит изрядная неразбериха. Дело в том, что помимо основных международных (так называемых генерических) названий многие антибиотики имеют и фирменные, запатентованные тем или иным конкретным производителем (в России их более 600). Так, например, один и тот же препарат может называться амоксициллином, Оспамоксом и Флемоксин Солютабом. Как же разобраться? По закону наряду с патентованным фирменным названием на упаковке лекарства обязательно указывается и его генерическое название — мелким шрифтом, нередко по-латыни (в данном случае — amoxycillinum).
При назначении антибиотика часто говорят о препаратепервого выбора и резервных препаратах. Препарат первого выбора — это тот препарат, назначение которого определяется диагнозом — если у больного нет устойчивости или аллергии к этому лекарственному средству. В последнем случае обычно назначаются резервные препараты.
ЧЕГО ЖДАТЬ И ЧЕГО НЕ ЖДАТЬ ОТ АНТИБИОТИКОВ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Именно поэтому бесполезно ожидать эффекта от антибиотика, назначенного при ОРВИ, точнее, эффект в таких случаях бывает негативным: температура держится несмотря на прием антибиотика — вот вам и «питательная среда» для распространения молвы о якобы потерянной эффективности антибиотиков или же о повальной устойчивости микробов.
Назначение антибиотика при вирусной инфекции не предотвращает бактериальных осложнений. Напротив, подавляя рост чувствительных к препарату микробов, например обитающих в дыхательных путях, антибиотик облегчает заселение дыхательных путей устойчивыми к нему патогенными бактериями, легко вызывающими осложнение.
Антибиотики не подавляют воспалительного процесса, обусловливающего подъем температуры, так что «сбить температуру» через полчаса, как парацетамол, антибиотик не может. При приеме антибиотика падение температуры наступает лишь через несколько часов или даже через 1—3 дня. Именно поэтому нельзя давать одновременно антибиотик и жаропонижающее: падение температуры от парацетамола может замаскировать отсутствие эффекта от антибиотика, а при отсутствии эффекта антибиотик, естественно, необходимо как можно скорее сменить.
Однако сохранение температуры нельзя считать признаком, однозначно свидетельствующим о неэффективности принимаемого антибиотика: порой выраженная воспалительная реакция, образование гноя требуют дополнительного к антибактериальному лечения (назначения противовоспалительных средств, вскрытия гнойника).
ВЫБОР ЗА ВРАЧОМ
Для лечения заболеваний, вызываемых чувствительными к антибиотикам микробами, обычно используются препараты первого выбора. Так, ангину, отит, пневмонию лечат амоксициллином или оспеном, микоплазменную инфекцию или хламидиоз эритромицином или другим антибиотиком из группы макролидов.
Возбудители кишечных инфекций зачастую быстро вырабатывают устойчивость к антибиотикам, поэтому при лечении кишечных инфекций антибиотики применяются лишь в тяжелых случаях — обычно цефалоспорины 2—3-го поколений или хинолоны.
Инфекции мочевых путей вызываются представителями кишечной флоры, их лечат амоксициллином или, при устойчивости возбудителей, резервными препаратами.
Как долго принимают антибиотик? При большинстве острых болезней его дают в течение 2—3 дней после падения температуры, однако есть много исключений. Так, отит обычно лечат амоксициллином не более 7—10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
ТАБЛЕТКИ, СИРОПЫ, МАЗИ, КАПЛИ…
Для детей особенно удобны препараты в детских формах. Так, препарат амоксициллина Флемоксин Солютаб выпускается в растворимых таблетках, их легко дать с молоком или чаем. Многие препараты, такие как джосамицин (Вильпрафен), азитромицин (Сумамед), цефуроксим (Зиннат), амоксициллин (Оспамокс) и др., выпускаются в сиропе или в гранулах для его приготовления.
Есть несколько форм антибиотиков для наружного применения — левомицетиновая, гентамициновая, эритромициновая мази, тобрамициновые глазные капли и др.
ОПАСНЫЕ ДРУЗЬЯ
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда.
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т. е. размножение бактерий или грибов, не свойственных тому или иному органу, прежде всего кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при недлительном (1—3 недели) лечении антибиотиками проявления дисбактериоза фиксируются крайне редко, к тому же пенициллин, макролиды, цефалоспорины 1-го поколения не подавляют роста флоры кишечника. Так что противогрибковые (нистатин) и бактериальные (Бифидумбактерин, Лактобактерин) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Термином «дисбактериоз», однако, в последнее время стали злоупотреблять — ставят его в качестве диагноза, списывая на него чуть ли не любые нарушения функционирования желудочно-кишечного тракта. Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
Аминогликозиды могут вызывать поражение почек и глухоту, их без большой надобности их не применяют. Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Принимая во внимание все вышеперечисленные «факторы риска», врач обязательно оценивает вероятность осложнений и применяет препарат только тогда, когда отказ от лечения сопряжен с большой степенью риска.
В заключение остается лишь сказать несколько слов об экономических аспектах назначения антибиотиков. Новые антибиотики стоят очень дорого. Спору нет, бывают ситуации, когда их применение необходимо, однако я часто сталкиваюсь со случаями, когда эти препараты назначаются без надобности, при заболеваниях, которые можно легко вылечить дешевыми лекарствами «старого образца». Я согласен с тем, что не следует скупиться, если речь идет о лечении ребенка. Но траты должны быть разумными! (Можно, например, купить антибиотик в форме сиропа: сиропы довольно дороги, но дети их принимают охотно, да и дозировать сироп или капли очень удобно.) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
ДИСБАКТЕРИОЗ — АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема сохранения здоровья, поиск путей снижения неблагоприятного воздействия на организм внешней среды являются в настоящее время крайне актуальными для нашей страны. По данным Российской академии наук, более 90% населения Российской Федерации в настоящее время имеют отклонения от физиологической нормы по тем или иным показателям, характеризующим здоровье человека.
Техногенные и экологические катастрофы, инфекционные болезни, экспансия некачественных лекарственных средств и продуктов питания, самоотравление алкоголем и наркотиками, психоэмоциональное напряжение и множество других вредоносных факторов истощают защитные силы организма, снижают его адаптационный потенциал.
Одной из важнейших систем поддержания и сохранения гомеостаза организма является его нормальная микрофлора, населяющая желудочно-кишечный тракт, мочеполовую систему, кожные покровы. Она оказывает многоплановое влияние на защитные, адаптационные и обменно-трофические механизмы организма, а ее нарушения под влиянием факторов эндогенной или экзогенной природы могут привести к утрате или искажению этих функций, которые влекут за собой проявления дисбактериоза — изменения качественного и количественного состава микрофлоры организма. Спектр клинических синдромов и патологических состояний, патогенез которых связан с дисбактериозом, в настоящее время очень широк и имеет тенденцию к увеличению.
Это возводит проблему разработки средств, повышающих адаптационный потенциал организма человека, в ранг первостепенных задач не только медицинского, но и экономического и политического характера.
В настоящее время одним из наиболее доступных и эффективных способов экологической реабилитации являются пробиотики — продукты, биологически активные добавки и фармацевтические препараты на основе полезных микроорганизмов, прежде всего, бифидобактерий и лактобацилл, оказывающих многофакторное регулирующее и стимулирующее воздействиие на организм человека, укрепляющих иммунную систему, защищающих от болезнетворных микробов. И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
Представители нормофлоры синтезируют витамины группы В, никотиновую кислоту, биотин, витамин К. Большая роль принадлежит им в защите организма от токсических элементов экзогенного происхождения и эндогенных субстратов и метаболитов. Они принимают активное участие в метаболизации разнообразных веществ растительного, животного и микробного происхождения, рециркуляции желчных кислот, активно влияют на метаболизм билирубина и холестерина. Установлена их антиканцерогенная и антимутагенная активность. Известна способность инактивировать гистамин, играющий важную роль в проявлении аллергии.
Все эти положительные эффекты позволяют рассматривать представителей нормальной микрофлоры как эффективный биокорректор и основу для создания различных форм пробиотиков.
По материалам сайта www.disbakterioza.net
Дисбактериоз: кишечные баталии
Фото носит иллюстративный характер. Из архива «МВ».
Едва ли найдется человек, у которого никогда не было изжоги, отрыжки, тошноты, боли в животе, метеоризма или нарушений стула. Однако за медпомощью люди обращаются только в том случае, если симптомы регулярно дают о себе знать или проявляются остро. Большинство до поры до времени лечатся самостоятельно, пользуясь распространенными «желудочными» средствами на свое усмотрение.
Цель — баланс
Пищеварительный тракт — гетерогенная бактериальная экосистема. Вследствие низкого значения pH желудок здорового человека можно считать стерильной средой.
В кишечнике условия для роста микроорганизмов лучше. В тонком бактерий немного — 104–106/мл (высокое значение pH и быстрый транзит не способствуют увеличению их количества), а в толстом — в 100 000 раз больше.
Кишечник является строго анаэробной системой, богатой питательными веществами, с кислотностью среды от нейтральной до слабощелочной. Его бактериальная экосистема включает от 400 до 500 типов микроорганизмов, которые взаимодействуют. Многие являются компенсалами, помогают расщеплять неперевариваемые соединения, содержащиеся в пище.
У практически здоровых людей около 96% микрофлоры кишечника составляют представители облигатной (т. е. постоянно встречающейся) микрофлоры: бифидо- и лактобактерии, бактероиды, непатогенная кишечная палочка и др.
Вторая группа, куда входят факультативная (непостоянная) и условно-патогенная микрофлора, занимает лишь 2–4% от общего количества микроорганизмов. При определенных условиях (снижение местного, а тем более общего иммунитета) вызывает внутрикишечные и общие нарушения. Факультативная группа представлена микрококками, протеем, стафилококками, клостридиями, цитробактерами и др.
Третью группу составляет транзиторная (случайная) патогенная микрофлора: клостридии, синегнойная палочка, грибы рода Candida. На ее долю приходится 0,001–0,01%.
В процессе постоянного взаимодействия макро- и микроорганизмов формируется уникальная экосистема, находящаяся в состоянии динамического баланса. Существенную роль играют облигатные и факультативные анаэробы: бифидо-, лакто- и энтеробактерии, а также энтерококки. Бифидобактерии создают кислую среду и тем самым препятствуют размножению вредной микрофлоры. Кроме того, обладают выраженным антагонизмом в отношении патогенов, улучшают процессы пищеварения, поддерживают витаминный баланс и иммунный статус, участвуют в синтезе незаменимых аминокислот.
Нарушение бактериоэкологического равновесия в ЖКТ приводит к формированию дисбактериоза (дисбиоза) кишечника.
Нехорошие перемены
Дисбактериоз кишечника — это клинико-лабораторный синдром, возникающий при разных патологических состояниях. Характерны изменения количественного и (или) качественного состава нормофлоры, метаболические и иммунологические нарушения; у некоторых пациентов добавляются симптомы поражения кишечника.
Кишечная микрофлора взрослого человека довольно устойчива к переменам в питании. Между тем стоит помнить, что еда, богатая углеводами, стимулирует бифидофлору и ведет к увеличению бактериальной массы толстого кишечника. Белковые блюда не влияют на спектр и количество кишечных бактерий, а жиры угнетают бифидобактерии и энтерококки, но стимулируют размножение бактероидов. «Пищевой» дисбиоз чаще носит временный характер и исчезает при переходе на здоровый сбалансированный рацион.
При заболеваниях местного и общего характера изменяется микробный пейзаж толстой кишки. Дисбактериоз регистрируется у большинства пациентов с поражением ЖКТ инфекционной и неинфекционной природы, после острых вирусных и бактериальных инфекций внекишечной локализации, при хронической воспалительной и аллергической патологии, у страдающих злокачественными заболеваниями и лейкозами, на фоне применения цитостатиков и особенно антибиотиков. Антибиотикозависимые дисбиозы стабильны и требуют активной терапии.
Сдвиги в микрофлоре кишечника вторичны — отражают воздействие факторов, изменяющих статус кишечника или внутренний баланс самого микробиоценоза. Нарушение микробного равновесия может осложнять многие патологические состояния, быть атерогенным явлением, связанным с антибактериальной, гормональной и другой терапией, несбалансированным питанием и т. д.
Один из частых вариантов (удельный вес порой достигает 31%) дисбактериоза кишечника — кандидозный, при котором имеет место избыточный рост грибов рода Candida. Он нередко ассоциируется с пищевой аллергией и аллергическими заболеваниями вообще, а также с курением.
Лабораторные поиски
Клиническая картина дисбактериоза кишечника вариабельна, а выраженность симптоматики не всегда напрямую зависит от степени дисбиотических нарушений. Ранними и наиболее специфическими симптомами можно считать повышенное газообразование, нарушение переваривания пищи (кишечная диспепсия), изменение характера стула; при развитии дисбактериоза на фоне колита — болевой синдром, патологические примеси в кале (слизь). В более тяжелых случаях добавляются интоксикация, диарея и обезвоживание, снижение массы тела.
В диагностике и трактовке кишечного дисбактериоза большое значение имеет копрологическое исследование, дающее возможность охарактеризовать пищеварительную, ферментовыделительную, всасывательную и двигательную функции кишечника. В последнее время получили распространение методы, основанные на выявлении метаболитов микроорганизмов, — газожидкостная и ионная хроматография. В лабораториях проводят бактериологические исследования фекалий и посев на питательные среды соскобов со слизистых оболочек.
Золотым стандартом диагностики синдрома избыточного роста бактерий считается интестиноскопия с аспирацией содержимого тонкой кишки и посевом аспирата на питательную среду. Но эта методика сложна, требует общей анестезии и хорошей бактериологической базы с возможностью культивирования аэробов и анаэробов, а результат приходится ждать порядка 10 дней.
Синдром избыточного роста бактерий выявляется также по данным дыхательного теста с меченым Н2 — с лактулозой или галактозой. Бактерии разлагают лактулозу, в результате чего освобождается меченый Н2, концентрация которого затем может быть измерена в выдыхаемом воздухе. В норме лактулоза расщепляется лишь микрофлорой в толстом кишечнике. При дисбиозе и тонкая кишка заселяется микроорганизмами, расщепляющими лактулозу. При этом следует исключить ускоренное продвижение субстрата по тонкой кишке.
Посев дуоденального аспирата тоже подтверждает синдром избыточного роста бактерий: при патологии содержание микроорганизмов >106/мл (общее количество бактерий в просвете тощей кишки не превышает 104–106/мл).
Микрофлора различных отделов пищеварительного тракта значительно отличается количественно и качественно.+
Микробиологическое исследование фекалий лишь косвенно может свидетельствовать о микробном неблагополучии, т. к. состав фекальной микрофлоры отражает ситуацию только в толстой кишке, а точнее — в дистальном отделе.
Настрой на победу
Профилактика и особенно лечение дисбактериоза кишечника должны быть комплексными и предполагать:
- устранение избыточного бактериального обсеменения тонкой кишки;
- восстановление нормальной микробной флоры толстой кишки;
- улучшение кишечного пищеварения и всасывания;
- восстановление нормальной моторики кишечника;
- стимулирование реактивности организма.
Важнейшими нормальными обитателями толстого кишечника человека являются бифидобактерии (вид анаэробных палочковидных грамположительных бактерий) — 3–7% от общей фекальной микрофлоры взрослых. Нужны и лактобактерии.
Восстановлению качества и количества бифидобактерий способствует увеличение в рационе пектинов (растворимых пищевых волокон), а для лактобактерий лучшие продукты — кисломолочные. Антибиотическую активность последних повышают путем добавления никотиновой кислоты (на 1 л — 6–8 мг), тиамина (4–6 мг), токоферола (1–3 мг).
Для профилактики и лечения дисбактериоза широко используются пробиотики и пребиотики.
Пробиотики — это живые микроорганизмы (молочнокислые бактерии, чаще бифидо- или лактобактерии), нормальные обитатели кишечника здорового человека, улучшающие микробный баланс. Обладают антагонистическими свойствами по отношению к патогенам (третья группа): конкурируют за рецепторы на эпителиоцитах, питательные вещества; способны выделять ингредиенты (цитокины, масляную кислоту), ингибирующие рост патогенных бактерий. Монокультуру или комплекс живых микроорганизмов дополняют веществом, стимулирующим их колонизирующую способность и размножение.
Пробиотики содержатся в молочных продуктах со специальной закваской, кукурузных хлопьях, крупах, черном хлебе.
При наличии бродильных процессов в кишечнике надо ограничивать углеводы, пищевые волокна (клетчатку), при гнилостных — белки и жиры.
Каждому, у кого высок риск развития дисбиоза, следует избегать цельного молока, бобовых, а также продуктов, богатых эфирными маслами (чеснок, зеленый лук, репа, редька).
Для стабилизации микрофлоры кишечника в рацион включают морковный сок, сою, дрожжевой, тыквенный, картофельный и рисовый экстракты, молочную сыворотку и молозиво (обладают бифидогенным действием).
Используют растительные компоненты и при стафилококковом дисбактериозе. Полезны лесная земляника, рябина, малина, черника, шиповник, черная смородина. При протейном дисбактериозе нужны абрикосы и черная смородина; при наличии гнилостных бактерий — клюква и абрикосы. Если имеет место избыточный рост грибов рода Candida, стоит налегать на бруснику, стручковый перец, морковь.
При торпидно протекающем дисбактериозе рекомендуют дополнять лечение, подключая эффект от приема эвкалипта, календулы, аира, зверобоя. Когда подтвержден грибковый дисбактериоз с бродильной диспепсией, положительное влияние окажет цикорий растворимый.
Кроме пробиотиков, важное значение в профилактике и лечении дисбактериоза кишечника имеют пребиотики (к ним в основном относят растворимые пищевые волокна класса углеводов: фруктоолигосахариды, галактоолигосахариды). В желудке и тонкой кишке они избегают гидролиза пищеварительными ферментами и достигают толстой кишки в неизменном виде. Там подвергаются ферментации бифидо- и лактобактериями, что приводит к увеличению количества флоры и объема каловых масс. При этом важно подчеркнуть, что фруктоолигосахариды представляют собой энергетический субстрат для представителей нормальной микрофлоры кишечника (бифидо- и лактобактерий). В процессе ферментации образуются короткоцепочечные жирные кислоты (преимущественно уксусная, пропионовая, масляная), которые снижают рН в кишечнике, стимулируют перистальтику.
Укреплению защитного барьера толстой кишки при потреблении пребиотиков способствует и стимуляция выработки в ней слизи. Повышенное слизеобразование энтероцитами может быть следствием снижения рН при возросшем синтезе короткоцепочечных жирных кислот микрофлорой кишечника в ответ на введение пребиотиков. Свойствами пребиотиков в наибольшей степени обладают инулин, лактулоза, лактил, олигосахариды, лактоолигосахариды, хилак форте и др.
Инулин присутствует в клетках цикория, артишока, корней одуванчика, клубней топинамбура, фасоли, петрушки. Наиболее хорошо изучен как бифидогенный фактор — избирательно ускоряет рост и метаболизм бифидобактерий. Прием 5 г/день олигофруктозы или ≤8 г/день инулина обеспечивает значительное изменение состава кишечной микрофлоры, увеличивая численность бифидобактерий и снижая количество патогенов.
Пробиотики и пребиотики могут применяться для профилактики и лечения дисбактериоза кишечника, в т. ч. при назначении эрадикационных схем лечения Helicobacter pylori при гастроэзофагеальной рефлюксной, язвенной болезни желудка и двенадцатиперстной кишки, эрозивных гастро- и дуоденопатиях.
Применение антибиотиков нежелательно, т. к. они могут усугублять дисбиоз кишечника. Целесообразно использовать препараты, минимально влияющие на симбиотическую флору и в тоже время подавляющие рост патогенных микроорганизмов. К таким относятся нитрофураны (нифуроксазид, интетрикс) — т. н. кишечные антисептики.
Пациентам с кишечной диспепсией показаны ферментные препараты. Чаще используют панкреатин (мезим форте, трифермент, креон). При стеаторее и гипомоторной дискинезии кишечника к панкреатину добавляют желчные кислоты (панзинорм), при бродильных расстройствах — гемицеллюлозу (фестал, энзистал, дигестал). Для улучшения процессов всасывания можно назначать мембраностабилизирующие препараты (карсил, эссенциале).
При дисбактериозе, особенно в период реабилитации, показаны иммуномодуляторы (натрия нуклеинат, витамины), растительные адаптогены (элеутерококк, женьшень, эхинацея). Когда отмечена тенденция к лейкопении и требуется усилить эпителизацию слизистой оболочки, можно использовать метилурацил и пентоксил (не более двух недель).
Иван Броновец, профессор кафедры кардиологии и внутренних болезней БГМУ, доктор мед. наук
Медицинский вестник, 12 сентября 2016
кишечных бактерий и СРК — о СРК
Бактерии присутствуют в нормальном кишечнике (кишечнике), особенно в нижних отделах кишечника. Они достигают концентрации в несколько миллиардов в толстой кишке / кишечнике.
Эти «нормальные» бактерии выполняют важные жизненные функции, в том числе:
- Защита от заражения болезнетворными бактериями
- Помогая иммунной системе кишечника развиваться
- Производство различных веществ, имеющих важную пищевую ценность
- Вместе нормальные кишечные бактерии часто называют кишечной флорой (или микробиотой).Ряд факторов может нарушить взаимовыгодные отношения между флорой и организмом. Когда это происходит, могут прижиться бактерии, вызывающие заболевание.
Какова роль кишечной микробиоты?
Было сделано много интересных разработок и открытий о связи между нашим кишечником (пищеварительной системой) и нашим мозгом и о том, как это влияет на наше здоровье, а также о роли микробов в этой связи.
Важно знать, что функциональные расстройства желудочно-кишечного тракта, такие как СРК, не являются психологическими заболеваниями; но мы также должны понимать, что мозг играет важную роль.Мозг постоянно общается с микроорганизмами внутри каждого из нас.
Эти микробы поддерживают с нами отношения сотрудничества, не только участвуя в пищеварении, но и взаимодействуя с нашими собственными клетками, кишечником и мозгом. Кишечные микробы могут помочь поддерживать баланс между мозгом и кишечником.
Узнайте больше о микробиоте кишечника
Играют ли бактерии роль в СРК?
В настоящее время имеются доказательства, подтверждающие идею о том, что нарушения в бактериях, населяющих кишечник, могут иметь значение, по крайней мере, у некоторых людей с синдромом раздраженного кишечника (СРК).
Эти данные наблюдений или исследований можно резюмировать следующим образом:
- Использование антибиотиков, которые, как известно, нарушают флору, может предрасполагать людей к СРК
- У некоторых людей СРК может развиться внезапно после эпизода желудочной или кишечной инфекции (гастроэнтерита), вызванной бактериями (состояние, называемое постинфекционным СРК или ИП-СРК).
- У некоторых пациентов с СРК в стенке кишечника может присутствовать очень низкий уровень воспаления, которое могло быть результатом ненормального взаимодействия с бактериями в кишечнике
- Избыточный бактериальный рост в тонком кишечнике (СИБР) может быть связан с СРК
- Изменение бактерий в кишечнике с помощью антибиотиков или пробиотиков может улучшить симптомы СРК
- При PI-IBS у некоторых людей, которые ранее были хорошо развиты, после эпизода гастроэнтерита развиваются симптомы типа IBS, в то время как у большинства других полностью выздоравливают.PI-IBS представляет собой четкую связь между воздействием бактериальной инфекции (например, из-за зараженной пищи или воды) и IBS у тех, кто кажется особенно подверженным риску.
Подробнее о PI-IBS
В ряде исследований сообщается о роли воспаления внутренней оболочки (слизистой оболочки) кишечника при СРК. Это легкое воспаление, которое гораздо реже, чем при истинных воспалительных заболеваниях кишечника, язвенном колите и болезни Крона. Интересно, что это было обнаружено среди пациентов, у которых не было никаких оснований предполагать, что их СРК начался с инфекции.Что внезапно вызывает это воспаление, не ясно. Возможно, им движут тонкие изменения в бактериальной популяции в кишечнике.
Некоторые люди с СРК могут быть генетически предрасположены к усиленной воспалительной реакции на нормальные бактерии. Хотя эта теория СРК находится в зачаточном состоянии, уже есть некоторые свидетельства распространения воспалительного процесса за пределы стенки кишечника. Это может объяснить некоторые из симптомов, таких как усталость и фибромиалгия, которые могут возникать у людей, страдающих СРК.
В течение некоторого времени различные исследования предполагали наличие изменений в типе кишечной флоры у людей с СРК. Эти изменения во флоре могут привести к увеличению количества определенных видов бактерий, которые сами производят больше газа и других продуктов своего метаболизма. Это может способствовать появлению таких симптомов, как газы, вздутие живота и диарея.
Есть ли роль антибиотиков в лечении СРК?
Обычно бактерии практически отсутствуют в кислой среде желудка и немногочисленны в верхних отделах кишечника.Они значительно увеличиваются в нижних отделах тонкой кишки, а затем резко переходят в толстую кишку.
Недавно было высказано предположение, что в тонком кишечнике некоторых пациентов с СРК увеличивается количество бактерий, а также типы бактерий, обычно встречающиеся только в толстой кишке. Это состояние называется избыточным бактериальным ростом тонкой кишки (СИБР). Курс антибиотиков может улучшить симптомы, но эксперты расходятся во мнениях о том, играет ли СИБР роль в СРК.
Остается вопрос, почему по крайней мере некоторые люди с СРК реагируют на курс антибиотиков.Об этом совсем недавно сообщалось в исследованиях пациентов с СРК, получавших антибиотик рифаксимин.
Другим объяснением этих реакций может быть подавление определенных видов бактерий в толстой кишке, особенно тех бактерий, которые склонны выделять газ и другие вещества в процессе ферментации. У группы пациентов с вздутием живота и метеоризмом, у которых не было признаков СИБР, было описано улучшение симптомов, связанных с газами, с помощью терапии антибиотиками.Антибиотики явно помогают некоторым пациентам с СРК, хотя то, как это происходит, может быть более сложным, чем первоначально предполагалось.
К длительному курсу антибиотикотерапии следует подходить с осторожностью, независимо от профиля безопасности данного антибиотика. Это важный вопрос, поскольку СРК часто бывает хроническим и рецидивирующим заболеванием. У некоторых людей наблюдается относительно продолжительное улучшение после однократного курса антибиотиков, у других — нет. Необходимы результаты дальнейших долгосрочных исследований относительно использования антибиотиков.
Есть ли роль пробиотиков в лечении СРК?
- Учитывая их профиль безопасности, эффективные пробиотики на первый взгляд кажутся более привлекательными в качестве средства воздействия на кишечную флору при СРК. Эффективны ли пробиотики при СРК? Было проведено несколько исследований различных пробиотиков при СРК. Лишь недавно они стали качественными, необходимыми для того, чтобы делать твердые выводы. Были некоторые ранние доказательства, хотя и противоречивые, об улучшении симптомов, связанных с «газами».
- Совсем недавно были получены некоторые доказательства пользы некоторых комбинаций пробиотиков. Лучшее доказательство относится к конкретному организму, Bifidobacterium infantis 35624. Исследования показали, что этот штамм превосходит плацебо в облегчении основных симптомов СРК (боль / дискомфорт в животе, затрудненная дефекация и вздутие живота / вздутие живота).
Узнайте больше о роли антибиотиков и пробиотиков в лечении СРК
Сводка
Многие недавние открытия добавляют к растущему количеству доказательств того, что СРК может быть, по крайней мере частично, результатом дисфункционального взаимодействия между нашей кишечной флорой и нами самими.Это приводит к слабому воспалению стенки кишечника, которое может распространиться на другие части тела.
Некоторые исследователи предполагают, что избыточный бактериальный рост в тонком кишечнике является частым фактором, вызывающим симптомы СРК. Другие данные указывают на более тонкие изменения флоры толстой кишки. Обе гипотезы остаются неподтвержденными.
Тем не менее, краткосрочная терапия антибиотиками или пробиотиками, похоже, действительно уменьшает симптомы у некоторых людей с СРК. Независимо от того, возникают ли эти эффекты из-за изменений количества или типа бактерий в толстой и / или тонкой кишке, очевидно, что манипуляции с кишечными бактериями заслуживают дальнейшего внимания.
8 признаков нездорового кишечника
Исследования за последние два десятилетия показали, что здоровье кишечника имеет решающее значение для общего состояния здоровья, а нездоровый кишечник может способствовать широкому спектру проблем со здоровьем, включая диабет, ожирение, ревматоидный артрит, аутоиммунные состояния, депрессию, синдром хронической усталости и т. Д. проблемы психического здоровья.
«Здоровье кишечника имеет решающее значение для здоровья в целом».
Это все хорошо.Но как узнать, применимо ли это к вам?
Если у вас нет синдрома раздраженного кишечника, вздутие живота или газы , есть ли еще признаки, о которых вам следует знать?
Давайте прыгнем!
8 признаков нездорового кишечника
1. Проблемы с пищеварением, такие как вздутие живота, газы или диарея
Это отличительные симптомы дисфункции кишечника. По большому счету это связано со здоровьем; как количество, так и разнообразие бактерий, живущих в кишечнике , кишечнике, желудке и толстой кишке.Эти бактерии называются вашим микробиомом , и такие симптомы, как нарушение работы кишечника или газы, возникают, когда баланс бактерий нарушается.
«Количество и разнообразие бактерий, живущих в кишечнике, влияют на ваше общее состояние здоровья и благополучия».
Газ, в частности, является признаком того, что пища ферментируется в кишечнике , поскольку у вас недостаточно кислоты в желудке или дисбаланс бактерий, чтобы расщепить съеденную пищу.
2.Тяга к сахару
Ученые обнаружили, что кишечные бактерии на самом деле выделяют особые белки, похожие на гормоны, регулирующие голод; лептин и грелин. Эти белки влияют как на нашу тягу к еде, так и на настроение.
Подводя итог, бактерии пытаются заставить нас есть пищу, на которой они процветают. Итак, , если вы едите много сахара, вы кормите бесполезные бактерии , которые его любят, и они выделяют белки, чтобы вы еще больше тянули к сахару. Это замкнутый круг.
«Подводя итог, бактерии пытаются заставить нас есть пищу, на которой они процветают».
Это тоже некоторое облегчение. Это не недостаток силы воли, который полностью способствует вашей слабости к сладкому. Исправление кишечника может уничтожить бактерии, из-за которых вы в первую очередь испытываете тягу к этой пище.
Со временем вы действительно можете уменьшить эту тягу.
«Со временем вы действительно сможете уменьшить эту тягу».
3.Неприятный запах изо рта
Хронический неприятный запах изо рта называется галитозом. В большинстве случаев причиной галитоза являются вызывающие запах микробы, которые обитают между вашими зубами и деснами , а также на вашем языке. Это также может быть вызвано бактериями, вызывающими заболевание десен.
Здоровая пищеварительная система имеет решающее значение для оптимального общего состояния здоровья. Соотношение хороших и вредных бактерий — важнейший показатель состояния вашего здоровья.
«Неприятный запах изо рта — признак того, что флора вашего кишечника не оптимальна.«
Менее чем оптимальная кишечная флора может сделать вас уязвимыми для заболеваний, связанных с неприятным запахом изо рта, таких как почечные инфекции и плохо контролируемый диабет.
4. Пищевая аллергия или повышенная чувствительность
Если вы страдаете непереносимостью пищевых продуктов, таких как глютен или молочные продукты, это почти всегда является результатом повышенной кишечной проницаемости. Кишечный барьер — это ваш привратник, который решает, что входит, а что остается.
«Кишечный барьер — это ваш привратник, который решает, что входит, а что остается.«
Если задуматься, наш кишечник — это система, работающая исключительно сама по себе. Это закрытый проход от нашего рта к нашему дну. Технически возможности его взаимодействия с другими органами нашего тела несколько ограничены.
Все, что попадает в рот и не переваривается, сразу выходит из другого конца. Это, собственно, одна из важнейших функций кишечника: предотвращение попадания посторонних веществ в организм.
Когда кишечный барьер становится проницаемым i.е. синдром дырявого кишечника, большие молекулы белка попадают в кровоток. Поскольку эти белки не принадлежат к кишечнику, организм вырабатывает иммунный ответ и атакует их. Этот иммунный ответ проявляется в пищевой непереносимости.
5. Настроение, тревога и депрессия
Отчасти причина, по которой дефицит питательных микроэлементов влияет на психическое здоровье , заключается в нарушении функции кишечника. Даже если у человека с проблемами психического здоровья был доступ к соответствующему питанию или содержанию микронутриентов , негерметичный кишечник может означать, что он не может их усвоить.
Нарушение работы кишечника повлияет на вашу способность использовать серотонин и дофамин — ваши гормоны счастья — и витамин D в вашем организме ».
Нарушение работы кишечника повлияет на вашу способность использовать серотонин — ваш гормон счастья — и витамин D в вашем организме ».
Большая часть серотонина и примерно половина дофамина вырабатывается в кишечнике. Если у вас негерметичный кишечник, ваше тело теряет большую часть производимого им серотонина и дофамина. Лечение любого дисбактериоза кишечника имеет решающее значение для поддержания психического здоровья.
Внутренняя работа вашей пищеварительной системы не только помогает вам переваривать пищу, но и направляет ваши эмоции.
6. Проблемы с кожей, такие как экзема
Распространенным признаком пищевой непереносимости является экзема. Взгляните на эту статью о , что вызывает вашу экзему. исследует связь между здоровьем ваших микробов и состояниями экземы.
7. Диабет
Исследования показывают , что состояние вашей микробиоты может дать ключ к пониманию того, есть ли у вас диабет второго типа. Недавно четыре российских исследователя изучали различия в изменениях микробов толстой кишки, сообщив о своих выводах о связи между кишечными бактериями и диабетом второго типа в журнале Endocrinology Connections.
В ходе исследования микробный состав кишечника и уровень глюкозы были проанализированы у 92 пациентов, включая 20 пациентов с диабетом 2 типа и 48 здоровых субъектов без каких-либо хронических заболеваний. Еще 24 субъекта проявили признаки предиабета.
Ученые сравнили представление кишечных микробов в группах участников исследования, а также различия в диете.При этом они смогли связать уровень непереносимости глюкозы с наличием трех типов микробиоты: бактерий Blautia, Serratia и Akkermansia. Хотя все три обнаруживаются у здоровых людей, их количество «значительно увеличивается там, где присутствует диабет».
«Ученые пришли к выводу, что одна из возможных причин и следствий между кишечными бактериями и диабетом заключается в том, что определенные бактерии вызывают иммунный ответ. В популяции кишечных бактерий есть микробы, которые образуют токсины, которые попадают в кишечник и затем вызывают воспаление по всему телу, включая печень и жировые клетки, которые могут влиять на общий метаболизм и чувствительность к инсулину. ”
8. Аутоиммунные заболевания и подавленный иммунитет
Связь между дырявым кишечником и аутоиммунными заболеваниями огромна.
«Я не видел клиента в клинике BePure с заболеванием щитовидной железы, у которого не было бы повышенной кишечной проницаемости, в частности непереносимости глютена».
Удаление глютена для этих людей и исцеление их кишечника сделало возможным лечение симптомов и обращение болезни почти в каждом отдельном случае.
Наш собственный клинический опыт подтверждается выводами экспертов в области биологии слизистых оболочек, таких как доктор Алессио Фазано, который теперь считает, что дырявый кишечник является предпосылкой для развития аутоиммунитета:
«Появляется все больше доказательств того, что повышенная кишечная проницаемость играет патогенную роль при различных аутоиммунных заболеваниях, включая целиакию и диабет типа 1. Таким образом, мы предполагаем, что помимо генетических факторов и факторов окружающей среды, потеря кишечной барьерной функции необходима для развития аутоиммунитета.«
Вы также можете страдать от частых болезней или инфекций. Опять же, причина этого в подавленной иммунной системе. Мы написали полезный блог о связи между здоровьем кишечника и иммунитетом .
Что вы можете сделать, чтобы поддержать здоровье кишечника?
Есть еще много признаков и симптомов нарушения функции кишечника, на самом деле это только верхушка айсберга. Недавно Бена пригласили в офис Les Mills International , чтобы он представил своей команде 10 лучших советов по здоровью кишечника.
Вы можете посмотреть полное видео здесь.
Микробиом кишечника человека в условиях здоровья и болезней
Integr Med (Encinitas). 2014 Dec; 13 (6): 17–22.
Мэтью Дж. Булл, бакалавр наук, доктор наук, — научный сотрудник отдела организмов и окружающей среды Кардиффского университета в Уэльсе, Соединенное Королевство. Найджел Т. Пламмер, доктор философии, является одним из ключевых участников исследований компании Pharmax.
Copyright © 2014 InnoVision Professional MediaЭта статья цитируется в других статьях PMC.
Abstract
Бактериальные клетки желудочно-кишечного тракта человека (ЖКТ) в 10 раз превосходят количество клеток-хозяев, а количество генов, кодируемых бактериями, проживающими в ЖКТ, превышает количество генов хозяина более чем в 100 раз. Эти микробы, связанные с пищеварительным трактом человека, называются кишечным микробиомом . Микробиом кишечника человека и его роль как в здоровье, так и в болезнях были предметом обширных исследований, в ходе которых было установлено его участие в метаболизме, питании, физиологии и иммунной функции человека.Дисбаланс нормальной микробиоты кишечника был связан с желудочно-кишечными заболеваниями, такими как воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), а также с более широкими системными проявлениями заболевания, такими как ожирение, диабет 2 типа и атопия. В первой части этого обзора мы оцениваем наши развивающиеся знания о развитии, сложности и функциональности здоровой микробиоты кишечника, а также о том, каким образом микробное сообщество нарушается при состояниях дисбиотических заболеваний; вторая часть этого обзора посвящена роли вмешательств, которые, как было показано, модулируют и стабилизируют микробиоту кишечника, а также восстанавливают ее до здорового состава в результате дисбиотических состояний, наблюдаемых при СРК, ВЗК, ожирении, диабете 2 типа и атопии.
Бактериальные клетки, расположенные в желудочно-кишечном тракте человека (ЖКТ), в 10 раз превышают количество клеток-хозяев, а количество генов, кодируемых бактериями, проживающими в ЖКТ, превышает количество генов хозяина более чем в 100 раз. Эти микробы, связанные с пищеварительным трактом человека, называются кишечным микробиомом . Микробиом кишечника человека и его роль как в здоровье, так и в болезнях были предметом обширных исследований, в ходе которых было установлено его участие в метаболизме, питании, физиологии и иммунной функции человека.Дисбаланс нормальной микробиоты кишечника был связан с желудочно-кишечными заболеваниями, такими как воспалительное заболевание кишечника (ВЗК) и синдром раздраженного кишечника (СРК), а также с более широкими системными проявлениями заболевания, такими как ожирение, диабет 2 типа и атопия. В первой части этого обзора мы оцениваем наши развивающиеся знания о развитии, сложности и функциональности здоровой микробиоты кишечника, а также о том, каким образом микробное сообщество нарушается при состояниях дисбиотических заболеваний; вторая часть этого обзора посвящена роли вмешательств, которые, как было показано, модулируют и стабилизируют микробиоту кишечника, а также восстанавливают ее до здорового состава в результате дисбиотических состояний, наблюдаемых при СРК, ВЗК, ожирении, диабете 2 типа и атопии.
Микробиота здорового кишечника
Микробиота кишечника в основном состоит из строгих анаэробов, которых больше, чем факультативных анаэробов — организмов, способных расти как аэробно, так и анаэробно, — и аэробов почти в 100 раз1. на сегодняшний день в кишечнике человека обнаружено более 50 бактериальных типов 2, в микробиоте преобладают только 2 типа: Bacteroidetes и Firmicutes. Оценки количества видов бактерий, присутствующих в кишечнике человека, широко варьируются в разных исследованиях, но общепризнано, что отдельные люди имеют более 1000 микробных филотипов на уровне вида.3–5
Развитие и состав
Микробная колонизация кишечника человека начинается при рождении. Считается, что кишечник младенца стерилен или содержит очень низкий уровень микробов при рождении, 6 но ЖКТ быстро колонизируется во время и после родов. Когда новорожденный проходит по родовым путям, он или она подвергаются воздействию микробной популяции во влагалище матери. Этот процесс влияет на развитие кишечной микробиоты младенца, которая имеет сходство с микробиотой влагалища его или ее матери.Младенцы, родившиеся с помощью кесарева сечения, показали меньшее количество микробов в кишечнике через 1 месяц по сравнению с детьми, родившимися через естественные родовые пути, хотя эти различия не обнаруживаются в возрасте 6 месяцев.7
В течение первого года жизни Состав микробиоты кишечника относительно прост и имеет широкие вариации у разных людей.8 Считается, что первоначальная колонизация кишечника играет важную роль в формировании состава микробиоты кишечника взрослого человека.Этот факт был продемонстрирован Лей и др. 9, которые показали, что микробиота кишечника мышей в их исследовании была тесно связана с микробиотой их матерей, что подразумевает родство как фактор в определении состава микробиоты кишечника.
Микробиота кишечника младенца претерпевает ряд изменений, которые коррелируют со сдвигом режима кормления с грудного вскармливания или искусственного вскармливания на отлучение от груди и введение твердой пищи.8 Несмотря на относительное сходство микробиоты кишечника у матерей и их потомков На микробную последовательность в ЖКТ также влияют многочисленные внешние и внутренние факторы, связанные с хозяином.Внешние факторы включают микробную нагрузку в ближайшем окружении, тип съедаемой пищи и пищевые привычки в дополнение к составу материнской микробиоты. Кроме того, стрессы, связанные с питанием и температурой, могут влиять на последовательность микробов.8 Внутренние факторы включают, но не ограничиваются, pH кишечника; микробные взаимодействия; температура окружающей среды; физиологические факторы, такие как перистальтика; желчные кислоты; секреция хозяина и иммунные ответы; медикаментозная терапия; и бактериальные рецепторы слизистой оболочки.8
Учитывая обилие факторов, влияющих на состав кишечной микробиоты, возможно, неожиданно, что состав микробного сообщества в кишечнике человека достаточно стабилен на уровне филума.10 Bacteroidetes и Firmicutes сохраняются практически во всех индивидуумов, хотя относительные пропорции этих типов могут варьироваться.5 Однако, если рассматривать на уровне бактериальных видов, вариации в составе межиндивидуальных микробных сообществ значительно больше, чем наблюдаемые на уровне филумов.11 Возможное объяснение этого факта, по-видимому, находится в глубокой функциональной избыточности, присущей микробиоте кишечника.5 Хозяин создает избирательное давление для поддержания определенных функций в ЖКТ, и эти функции могут быть приписаны большому количеству видов бактерий. в пределах основных типов. Функциональная избыточность — это способность одной микробной группы выполнять функциональный процесс с той же скоростью, что и другая, при тех же условиях, скорее как резервный вариант, который позволяет варьировать в составе микробиоты между людьми без ущерба для поддержания целостности. функции внутри конкретного человека.10
Бактериальные клетки неравномерно распределены по длине ЖКТ. Количество присутствующих бактерий может варьироваться, начиная от 10-103 бактерий на грамм содержимого желудка и двенадцатиперстной кишки, увеличиваясь до 104-107 бактерий на грамм в тонком кишечнике и повышаясь до 1011-1012 бактерий на грамм в толстом кишечнике. кишечник.10 Более того, состав микробного сообщества варьируется между этими участками, при этом различные типы бактерий обогащены в тонком и толстом кишечнике.Когда были исследованы образцы биопсии из обоих отделов кишечника здоровых людей, было обнаружено, что тонкий кишечник обогащен некоторыми представителями филы Firmicutes, а толстая кишка — представителями филума Bacteroidetes.12
В сочетании с микробной неоднородностью по всей длине При изучении кишечника в поперечном срезе существовало большое количество вариаций в составе микробиоты.13 В кишечнике существовало несколько микроокружений, и микробиота в просвете кишечника значительно отличалась по своему составу от микробиоты в кишечнике. в непосредственной близости и прикрепляется к эпителию.Например, роды Bacteroides , Bifidobacterium , Streptococcus , Enterococcus , Clostridium , Lactobacillus и Lactobacillus , а также Ruminococcus , входящие в состав люминофора, входили в состав люминофора , в то время как все были обнаружены в составе люминофора. только Clostridium , Lactobacillus и Enterococcus были обнаружены в слое слизи и эпителиальных криптах тонкой кишки.13
Функции кишечной микробиоты
Метаболизм
Поскольку кишечная микробиота кодирует значительно большее количество гены, чем его человеческий хозяин, из этого следует, что они способны выполнять множество метаболических функций, которые люди не могут или могут выполнять только в ограниченных возможностях.Кишечные бактерии способны производить различные витамины, синтезировать все незаменимые и заменимые аминокислоты и осуществлять биотрансформацию желчи.14 Кроме того, микробиом обеспечивает жизненно важные биохимические пути метаболизма неперевариваемых углеводов, в том числе крупных полисахаридов, такие как устойчивые крахмалы, целлюлоза, гемицеллюлоза, пектины и камеди; некоторые олигосахариды, которые не перевариваются; неабсорбированные сахара и спирты из рациона15; и муцины хозяина.16 Эта функциональность приводит к восстановлению энергии и абсорбируемых субстратов для хозяина, а также к поставке энергии и питательных веществ для роста и размножения бактерий. 17 Метаболизм углеводов является основным источником энергии в толстой кишке.
Защита хозяина и развитие иммунной системы
Многие кишечные бактерии вырабатывают антимикробные соединения и конкурируют за питательные вещества и места прикрепления в слизистой оболочке кишечника, тем самым предотвращая колонизацию патогенами. Это действие известно как барьер или эффект конкурентного исключения .Клетки-хозяева в стенке кишечника имеют места прикрепления, которые могут использоваться патогенными бактериями для проникновения в эпителиальные клетки. В лабораторных исследованиях можно увидеть, что непатогенные бактерии конкурируют за эти места прикрепления на границе эпителиальных клеток кишечника, предотвращая прикрепление и последующее проникновение патогенных энтероинвазивных бактерий в эпителиальные клетки.17 Кроме того, бактерии конкурируют за питательные вещества в непосредственной близости от них. окружающей среде и поддерживая свою коллективную среду обитания, управляя и потребляя все ресурсы, кишечная микробиота может вытеснить патогенные бактерии за ресурсы исключительно благодаря своей численности.17 Кроме того, бактерии могут подавлять рост своих конкурентов, производя противомикробные вещества, известные как бактериоцины, и способность синтезировать эти бактериоцины широко распространена среди желудочно-кишечных бактерий.17
Кишечный эпителий является основным интерфейсом между иммунной системой и Внешняя среда. На развитие иммунной системы хозяина влияют непрерывные и динамические взаимодействия с кишечной микробиотой и ее метаболитами. Бактерии являются неотъемлемой частью раннего развития иммунной системы кишечника и слизистых оболочек, как с точки зрения ее физических компонентов, так и с точки зрения ее функции, и в дальнейшем продолжают играть роль в ее функционировании.17 Клетки кишечного эпителия предотвращают угрозы со стороны патогенов, передавая сигналы к врожденной иммунной системе через специфические рецепторы14, которые распознают и связываются с конкретными молекулами, связанными с бактериями, что приводит к выработке иммунного ответа хозяина и высвобождению защитных пептидов, цитокинов, и лейкоциты. Результатом может быть защитный ответ на комменсальные бактерии, воспалительный ответ на патогенные организмы или спусковой механизм для гибели клетки-хозяина.
Воздействие кишечных бактерий также способствует предотвращению аллергии (т. Е. Непропорциональной реакции иммунной системы на неопасные антигены).Было обнаружено, что аллергические младенцы и маленькие дети имеют другой состав кишечных бактерий, чем те, у которых нет аллергии. Предполагается, что кишечная микробиота стимулирует иммунную систему и обучает ее реагировать пропорционально на все антигены. Измененный состав кишечной микробиоты в раннем возрасте может привести к недостаточно тренированной иммунной системе, которая может, и часто действительно, чрезмерно реагировать на антигены.18
Ось кишечник – мозг
Ось кишечник – мозг представляет собой систему связи, которая объединяет нервные клетки. , гормональная и иммунологическая передача сигналов между кишечником и мозгом, предлагающая кишечной микробиоте и ее метаболитам потенциальный путь доступа к мозгу.19 Эта система связи является двунаправленной, что позволяет мозгу управлять функциями желудочно-кишечного тракта, такими как перистальтика и выработка муцина, а также иммунными функциями.20 За последнее десятилетие был достигнут значительный прогресс в признании важных способов, которыми микробиота кишечника связана с функцией мозга. .21 Фостер и МакВей Нойфельд21 проанализировали ключевые результаты, показывающие, что стресс влияет на состав микробиоты кишечника и что двунаправленная связь между микробиотой кишечника и центральной нервной системой влияет на стресс-реактивность хозяина.Было показано, что стресс влияет на целостность эпителия кишечника и влияет на перистальтику, секрецию и выработку муцина, тем самым изменяя среду обитания кишечной микробиоты и способствуя изменениям в микробном составе и / или метаболизме19
Кишечная микробиота при заболевании
Установлены связи между микробиотой кишечника человека и, по-видимому, постоянно растущим числом заболеваний, синдромов и функциональных отклонений. Поддержка этих ассоциаций варьируется от отдельных сообщений отдельных лиц до результатов крупных когортных исследований.Следующий раздел посвящен суммированию ассоциаций, которые привлекли наибольшее внимание: возможность связи между кишечной микробиотой и (1) хроническими желудочно-кишечными заболеваниями, такими как IBS и IBD, и (2) системными метаболическими заболеваниями, такими как тип 2 сахарный диабет и ожирение.
Синдром раздраженного кишечника
СРК определяется как группа функциональных расстройств кишечника, при которых дискомфорт или боль в животе связаны с дефекацией или изменением привычек кишечника, а также с признаками нарушения дефекации.Практикующие врачи согласились на дальнейшую классификацию в соответствии с Римскими 3 критериями22 и классифицировали заболевание на основе характеристик стула пациента ().
Таблица 1
Этиологическая классификация симптомов СРК
| Подтип СРК | Характеристики | ||
|---|---|---|---|
| СРК с диареей | СРК-D | ||
| СРК с запором | СРК-C | ||
| Смешанный или циклический | IBS IBS-M | ||
| IBS без подтипа |
СРК , как полагают, поражает примерно от 10% до 20% взрослых и подростков во всем мире.22 Точная причина СРК неизвестна и считается многофакторной. Считается, что генетические факторы, двигательная дисфункция ЖКТ, висцеральная гиперчувствительность, инфекция, воспаление и иммунитет, а также психопатологические факторы играют роль в его развитии.23 Вместе с этими факторами считается, что вариации микробиоты кишечника вносят свой вклад в его развитие. воспаление кишечника низкой степени, связанное с синдромом.24 В здоровом кишечнике кишечная микробиота либо оказывает прямое бактерицидное действие, либо может предотвращать прилипание патогенных бактерий к стенке ЖКТ.25 Кроме того, дисбактериоз (т.е. микробный дисбаланс) в кишечнике может способствовать адгезии кишечных патогенов, которые могут быть связаны с симптомами СРК. 26 Изменение состава нормальной микробиоты и нарушение ферментации толстой кишки у пациентов с СРК могут играть важную роль. при развитии симптомов СРК со значительным двукратным увеличением отношения Firmicutes к Bacteroidetes у пациентов с СРК27.
Воспалительное заболевание кишечника
ВЗК включает болезнь Крона (БК) и язвенный колит (ЯК).БК характеризуется паттерном воспаления, похожим на булыжник (т. Е. Пораженные участки прерываются здоровой тканью), которое может возникать где угодно по длине ЖКТ. Это также типично язвы, которые могут охватывать всю стенку кишечника, что приводит к трещинам, которые могут пробить стенку кишечника и повлиять на другие органы, такие как почки или матка.28 ЯК обычно проявляется как непрерывное воспаление, затрагивающее только поверхностные слои кишечника. стенка кишечника. В основном он локализуется в толстой кишке и чаще всего возникает в прямой кишке.29
Хотя отдельные виды микробов могут играть важную роль в иммуномодуляции, аберрация микробиома кишечника из-за потери или переизбытка играет ключевую роль в сохранении воспалительных реакций при хронических заболеваниях. Роль кишечной микробиоты в патогенезе ВЗК была продемонстрирована исследованиями, показавшими, что использование антибиотиков может уменьшить или предотвратить воспаление как на мышиных моделях болезни, так и у пациентов.30 Кроме того, результаты исследований с пациентами с ЯК, инокулированными стулом, собранным от здоровых доноров указали на ремиссию заболевания в течение 1 недели после получения фекального перевода, с полным выздоровлением через 4 месяца.31
Подобно IBS, дисбиоз IBD связан с крупномасштабными изменениями численности и разнообразия популяции Firmicute, относительная численность которой значительно снижается у пациентов с IBD. Уменьшение количества Firmicutes представляет особый интерес, поскольку они являются известными продуцентами важных короткоцепочечных жирных кислот (SCFA), таких как ацетат и бутират, которые, как известно, обладают сильными противовоспалительными свойствами.32 Нагалингам и Линч38 всесторонне рассмотрели микробные изменения, наблюдаемые у пациентов с ВЗК, с подробным описанием бесчисленных микробных исходов у разных людей и исследований, без очевидных выводов о соответствующих микробных биомаркерах или микробной причине или следствии ВЗК.
Системные метаболические заболевания
Системные метаболические заболевания включают ожирение и диабет 2 типа. Первые признаки того, что микробиота кишечника участвует в ожирении, появились, когда было показано, что у мышей с метаболическим ожирением с мутацией в гене лептина микробиота существенно отличается от мышей без мутации.9 Дальнейшие исследования показали, что соотношение Firmicutes и Bacteroidetes микробиота кишечника мышей с ожирением сместилась в пользу Firmicutes, тогда как у худых мышей преобладали Bacteroidetes.33 В более поздних исследованиях на людях исследователи обнаружили, что состав кишечной микробиоты был изменен у людей с ожирением по сравнению с людьми с нормальным весом и что состав изменялся в ответ на изменения веса тела хозяина34. Последующие исследования, однако, не увенчались успехом. , чтобы продемонстрировать постоянную взаимосвязь между ожирением и соотношением Firmicutes и Bacteroidetes как на уровне типа, так и на уровне видов. Эти исследования были всесторонне рассмотрены Tagliabue и Elli.35
Диабет 2 типа — сложное заболевание, на которое влияют как генетические факторы, так и элементы окружающей среды, которое стало серьезной проблемой общественного здравоохранения во всем мире.36 Исследования, изучающие основные генетические факторы, способствующие развитию диабета 2 типа, в основном включают использование общегеномных данных. ассоциативные исследования, сфокусированные на выявлении генетических компонентов в геноме пациента.37 Недавние исследования показали, что риски, связанные с развитием диабета 2 типа, могут также включать состав кишечной микробиоты.Микробиота кишечника участников с диабетом 2 типа демонстрировала лишь ограниченное отклонение от контрольной группы, хотя наблюдалось снижение количества бактерий, продуцирующих бутират, которые могут быть метаболически полезными.38 Это наблюдение предполагает, что состояние функционального дисбиоза, а не какой-либо специфический виды микробов, могут иметь прямую связь с патофизиологией диабета 2 типа. Также было обнаружено увеличение присутствия нескольких категорий условно-патогенных бактерий, хотя численность этих категорий условно-патогенных микроорганизмов, по-видимому, была весьма изменчивой.38
Микробиота кишечника участвует в усвоении питательных веществ и сборе энергии и производит экзометаболиты, такие как SCFA, которые могут регулировать метаболические процессы хозяина. 39,40 SCFA участвуют в метаболических заболеваниях, включая ожирение39 и диабет 2 типа.41 Выше Уровни SCFAs в кале, в основном бутирата и пропионата, были зарегистрированы у взрослых с ожирением42 и детей 43 по сравнению с худыми людьми. Изменения в концентрации и пропорции отдельных SCFAs могут соответствовать изменениям в присутствующих типах бактерий.42,43
В настоящее время существует множество доказательств, указывающих на тесную связь между метаболической и иммунной системами, а микробиота кишечника все чаще признается важным фактором, связывающим гены, окружающую среду и иммунную систему. Среди многих причин для поддержания здорового веса — появляющаяся парадигма, согласно которой метаболический дисбаланс ведет к иммунному дисбалансу, с голоданием и иммуносупрессией на одном конце спектра и ожирением и воспалительными заболеваниями на другом. при неупорядоченном, а не направленном изменении состава и функциональности кишечных микробов само по себе может играть роль в повышении предрасположенности к болезненному состоянию.38
Атопическая экзема и другие аллергические заболевания
Аллергические заболевания, в частности те, которые вызваны гиперчувствительностью 1-го типа — атопическая экзема, атопическая астма, ринит — и пищевая аллергия 1-го типа, за последние 50 лет выросли во всем мире, в развитых странах в настоящее время показатель заболеваемости составляет 20% населения, что составляет значительную часть общего бремени болезни.44 Атопическая сенсибилизация возникает в основном в первые 2 года жизни и может сохраняться в течение всей жизни, при этом аллергическое заболевание обычно начинается с экземы ( 0–2 года), астма (> 5 лет) и ринит (> 8 лет) в так называемом атопическом марше . 45 Атопическая экзема, воспалительное состояние кожи, поражала до 20% детей в возрасте до 12 месяцев в Англии и Уэльсе в 2006 году46 и обходилась правительству Великобритании почти в 500 миллионов фунтов стерлингов в год в 1996 году.
Причины атопической экземы потенциально многочисленны и недостаточно изучены, хотя известно, что причастны метод родов (например, вагинальное или кесарево сечение) и мутация в конкретном человеческом гене, участвующем в кожно-барьерной функции.47 Характеристика кишечной микробиоты пациентов, страдающих атопической экземой, показали, что младенцы в возрасте 1 месяца с этим заболеванием имели значительно более низкое бактериальное разнообразие, особенно в отношении типа Bacteroidetes, по сравнению с младенцами без атопической экземы.48 Исследование также выявило снижение разнообразия Bacteroidetes в возрасте 12 месяцев в группе атопической экземы, предполагая, что пациенты могут поддерживать более низкий уровень бактериального разнообразия по сравнению со здоровыми людьми из контрольной группы. Кроме того, у младенцев с атопической экземой наблюдалось меньшее количество протеобактерий, клеточные стенки которых содержат молекулы липополисахаридов. Липополисахариды обладают способностью вызывать иммунный ответ хозяина, а низкое воздействие липополисахаридов в младенчестве связано с более высоким риском атопической экземы.49
В качестве объяснения заметного увеличения числа аллергических заболеваний концепция уменьшения количественного и качественного воздействия микробного мира в неонатальный период получила название гигиенической гипотезы и основана на наблюдении за повышением атопии в более мелких, и особенно в урбанизированных семьях50 из-за снижения воздействия микробов. Недостаточное воздействие микробных антигенов приводит к неправильному результату обработки аллергеном иммунологического ответа, а не иммунологической толерантности.45
Выводы и перспективы
Микробиота кишечника человека развивается на протяжении всей жизни и, по-видимому, играет ключевую роль как в здоровье, так и в болезнях. В здоровом состоянии микробиота кишечника выполняет множество положительных функций, включая восстановление энергии в результате метаболизма неперевариваемых компонентов пищи, защиту организма-хозяина от патогенного вторжения и модуляцию иммунной системы. Дисбиотическое состояние микробиоты кишечника становится общепризнанным фактором окружающей среды, который взаимодействует с метаболизмом хозяина и играет роль в патологических состояниях, как системных (ожирение, диабет и атопия), так и связанных с кишечником СРК и ВЗК, хотя конкретный вклад микробиоты кишечника к этим заболеваниям неясно.Гетерогенная этиология метаболических и желудочно-кишечных заболеваний была связана с различными микробами, хотя существует мало информации о причинном направлении этой связи.
Во второй части этого обзора авторы исследуют вмешательства, которые, как было показано, модулируют и стабилизируют микробиоту кишечника, а также восстанавливают ее здоровый состав в результате дисбиотических состояний, наблюдаемых при СРК, ВЗК, ожирении, диабете 2 типа. , и атопия.
Список литературы
3.Клаэссон М.Дж., О’Салливан О., Ван К. и др. Сравнительный анализ пиросеквенирования и филогенетического микрочипа для изучения структур микробного сообщества в дистальном отделе кишечника человека. PLoS One. 2009; 4 (8): e6669. [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Lozupone CA, Stombaugh JI, Gordon JI, Jansson JK, Knight R. Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа. 2012. 489 (7415): 220–230. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Хименес Э., Марин М.Л., Мартин Р. и др.Действительно ли меконий от здоровых новорожденных бесплоден? Res Microbiol. 2008. 159 (3): 187–193. [PubMed] [Google Scholar] 7. Хурре А., Каллиомаки М., Раутава С., Ринне М., Салминен С., Изолаури Э. Способ доставки — воздействие на микробиоту кишечника и гуморальный иммунитет. Неонатология. 2008. 93 (4): 236–240. [PubMed] [Google Scholar] 8. Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999; 69 (5): 1035S – 1045S. [PubMed] [Google Scholar] 9. Ley RE, Bäckhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI.Ожирение изменяет микробную экологию кишечника. Proc Natl Acad Sci U S. A. 2005; 102 (31): 11070–11075. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Секиров И., Рассел С.Л., Antunes LC, Финлей ББ. Микробиота кишечника в здоровье и болезнях. Physiol Rev.2010; 90 (3): 859–904. [PubMed] [Google Scholar] 12. Франк Д. Н., Сент-Аманд А. Л., Фельдман Р. А., Boedeker EC, Harpaz N, Pace NR. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc Natl Acad Sci U S. A. 2007; 104 (34): 13780–13785.[Бесплатная статья PMC] [PubMed] [Google Scholar] 13. Свидсински А., Ленинг-Бауке В., Лохс Х., Хейл Л.П. Пространственная организация бактериальной флоры в нормальном и воспаленном кишечнике: флуоресцентное исследование гибридизации in situ на мышах. Мир Дж. Гастроэнтерол. 2005. 11 (8): 1131–1140. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Каммингс Дж. Х., Помаре Е. В., Филиал В. Дж., Нейлор С. П., Макфарлейн Г. Т.. Короткоцепочечные жирные кислоты в толстой кишке, воротной вене, печеночной и венозной крови человека. Кишечник. 1987. 28 (10): 1221–1227. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16.Коропаткин Н.М., Камерон Е.А., Мартенс Э.С. Как метаболизм гликанов формирует микробиоту кишечника человека. Nat Rev Microbiol. 2012. 10 (5): 323–335. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Guarner F, Malagelada JR. Флора кишечника в норме и при болезнях. Ланцет. 2003. 361 (9356): 512–519. [PubMed] [Google Scholar] 18. Björkstén B, Sepp E, Julge K, Voor T., Mikelsaar M. Развитие аллергии и кишечная микрофлора в течение первого года жизни. J Allergy Clin Immunol. 2001. 108 (4): 516–520. [PubMed] [Google Scholar] 19.Коллинз С.М., Сюретт М., Берчик П. Взаимодействие между кишечной микробиотой и мозгом. Nat Rev Microbiol. 2012; 10 (11): 735–742. [PubMed] [Google Scholar] 21. Фостер Дж. А., Маквей Нойфельд К. А.. Ось кишечник-мозг: как микробиом влияет на тревогу и депрессию. Trends Neurosci. 2013. 36 (5): 305–312. [PubMed] [Google Scholar] 22. Лонгстрет Г.Ф., Томпсон В.Г., Чей В.Д., Хоутон Л.А., Мирин Ф., Спиллер Р.С. Функциональные расстройства кишечника. Гастроэнтерология. 2006. 130 (5): 1480–1491. [PubMed] [Google Scholar] 23. Ghoshal UC, Shukla R, Ghoshal U, Gwee KA, Ng SC, Quigley FM.Микробиота кишечника и синдром раздраженного кишечника: друг или враг? Int J Inflam. 2012; 2012: 151085. [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Guinane CM, Cotter PD. Роль микробиоты кишечника в здоровье и хронических желудочно-кишечных заболеваниях: понимание скрытого метаболического органа. Therap Adv Гастроэнтерол. 2013. 6 (4): 295–308. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Келлоу Дж. Э., Аспироз Ф., Дельво М. и др. Прикладные принципы нейрогастроэнтерологии: физиология / моторика. Гастроэнтерология.2006. 130 (5): 1412–1420. [PubMed] [Google Scholar] 26. Ринттиля Т., Лира А., Крогиус-Курикка Л., Палва А. ПЦР-анализ кишечных патогенов в реальном времени в образцах фекалий субъектов с синдромом раздраженного кишечника. Gut Pathog. 2011; 3 (1): 6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Ponnusamy K, Choi JN, Kim J, Lee SY, Lee CH. Микробное сообщество и метаболомное сравнение фекалий с синдромом раздраженного кишечника. J Med Microbiol. 2011; 60 (pt 6): 817–827. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Нагалингам Н.А., Линч С.В.Роль микробиоты в воспалительных заболеваниях кишечника. Воспаление кишечника. 2012; 18 (5): 968–984. [PubMed] [Google Scholar] 29. Баумгарт, округ Колумбия, Сандборн, WJ. Воспалительное заболевание кишечника: клинические аспекты, а также установленные и развивающиеся методы лечения. Ланцет. 2007. 369 (9573): 1641–1657. [PubMed] [Google Scholar] 30. Свидсински А., Вебер Дж., Ленинг-Бауке В., Хейл Л. П., Лохс Х. Пространственная организация и состав флоры слизистой оболочки у пациентов с воспалительным заболеванием кишечника. J Clin Microbiol. 2005. 43 (7): 3380–3389. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31.Borody TJ, Warren EF, Leis SM, Surace R, Ashman O, Siarakas S. Бактериотерапия с использованием фекальной флоры: игра с движениями человека. J Clin Gastroenterol. 2004. 38 (6): 475–483. [PubMed] [Google Scholar] 32. Barcenilla A, Pryde SE, Martin JC и др. Филогенетические отношения бактерий, продуцирующих бутират, из кишечника человека. Appl Environ Microbiol. 2000. 66 (4): 1654–1661. [Бесплатная статья PMC] [PubMed] [Google Scholar] 33. Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию.Природа. 2006. 444 (7122): 1027–1131. [PubMed] [Google Scholar] 34. Tremaroli V, Bäckhed F. Функциональные взаимодействия между кишечной микробиотой и метаболизмом хозяина. Природа. 2012. 489 (7415): 242–249. [PubMed] [Google Scholar] 35. Tagliabue A, Elli M. Роль кишечной микробиоты в ожирении человека: недавние открытия и перспективы на будущее. Нутр Метаб Кардиоваск Дис. 2013. 23 (3): 160–168. [PubMed] [Google Scholar] 37. Скотт Л.Дж., Молке К.Л., Бонникасл Л.Л. и др. Полногеномное ассоциативное исследование диабета 2 типа у финнов выявило множественные варианты восприимчивости.Наука. 2007. 316 (5829): 1341–1345. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Qin J, Li Y, Cai Z и др. Метагеномное ассоциативное исследование микробиоты кишечника при диабете 2 типа. Природа. 2012. 490 (7418): 55–60. [PubMed] [Google Scholar] 39. Николсон Дж. К., Холмс Э., Кинросс Дж. И др. Метаболические взаимодействия микробиоты кишечника и хозяина. Наука. 2012. 336 (6086): 1262–1267. [PubMed] [Google Scholar] 40. Фернандес Дж., Су В., Рахат-Розенблум С., Волевер ТМ, Комелли Э.М. Ожирение, кишечная микробиота и жирные кислоты с короткой цепью в фекалиях связаны у взрослых людей.Nutr Диабет. 2014 июн; 4: e121. [Бесплатная статья PMC] [PubMed] [Google Scholar] 41. Качмарчик М.М., Миллер М.Дж., Фройнд Г.Г. Польза пищевых волокон для здоровья: помимо обычных подозрений на сахарный диабет 2 типа, сердечно-сосудистые заболевания и рак толстой кишки. Обмен веществ. 2012. 61 (8): 1058–1066. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Швирц А., Тарас Д., Шефер К. и др. Микробиота и SCFA у здоровых людей с худым и избыточным весом. Ожирение (Серебряная весна) 2010; 18 (1): 190–195. [PubMed] [Google Scholar] 43.Пейн А.Н., Чассард С., Циммерманн М., Мюллер П., Стинка С., Лакруа С. Метаболическая активность кишечной микробиоты у детей с ожирением повышена по сравнению с детьми с нормальным весом и демонстрирует более полное использование субстрата. Nutr Диабет. 2011 июл; 1: e12. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Окада Х, Кун С, Фейле Х, Бах Дж. Ф. «Гипотеза гигиены» для аутоиммунных и аллергических заболеваний: обновление. Clin Exp Immunol. 2010; 160 (1): 1–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45.Шен CY, Lin MC, Lin HK, Lin CH, Fu LS, Fu YC. Естественное течение экземы от рождения до 7 лет и связь с астмой и аллергическим ринитом: популяционное когортное исследование. Allergy Asthma Proc. 2013. 34 (1): 78–83. [PubMed] [Google Scholar] 46. Шофилд Дж. К., Флеминг Д., Гриндли Д., Уильямс Х. Кожные заболевания — самая частая новая причина, по которой люди обращаются к врачам общей практики в Англии и Уэльсе. Br J Dermatol. 2011; 165 (5): 1044–1050. [PubMed] [Google Scholar] 47. Уильямс ХК, Гриндлей диджей.Что нового при атопической экземе? Анализ систематических обзоров, опубликованных в 2007 и 2008 годах, I: определения, причины и последствия экземы. Clin Exp Dermatol. 2010. 35 (1): 12–15. [PubMed] [Google Scholar] 48. Abrahamsson TR, Jakobsson HE, Andersson AF, Björkstén B, Engstrand L, Jenmalm MC. Низкое разнообразие кишечной микробиоты у младенцев с атопической экземой. J Allergy Clin Immunol. 2012. 129 (2): 434–440. [PubMed] [Google Scholar] 49. Геринг У., Болте Дж., Борте М. и др. Исследовательская группа LISA. Факторы, связанные с образом жизни, на иммунную систему и развитие аллергии в детстве.Воздействие эндотоксина снижает риск атопической экземы в младенчестве: когортное исследование. J Allergy Clin Immunol. 2001. 108 (5): 847–854. [PubMed] [Google Scholar]
Ваши кишечные бактерии и ваше здоровье
В течение многих лет мы думали о бактериях как о организмах, которых следует избегать. Оказывается, наши тела уже загружены триллионами бактерий. Они помогают переваривать пищу и играют важную роль в вашем благополучии.
Исследования показывают, что кишечные бактерии связаны с вероятностью таких заболеваний, как диабет, ожирение, депрессия и рак толстой кишки.
Что такое кишечные бактерии?
В кишечнике живут от 300 до 500 различных видов бактерий, содержащих почти 2 миллиона генов. В сочетании с другими крошечными организмами, такими как вирусы и грибы, они образуют так называемую микробиоту, или микробиом.
Подобно отпечатку пальца, микробиота каждого человека уникальна: смесь бактерий в вашем теле отличается от смеси всех остальных. Это частично определяется микробиотой вашей матери — окружающей средой, в которой вы находитесь при рождении, — а частично — вашим питанием и образом жизни.
Бактерии живут по всему вашему телу, но те, что находятся в кишечнике, могут иметь наибольшее влияние на ваше самочувствие. Они выстилают всю вашу пищеварительную систему. Большинство из них живут в кишечнике и толстой кишке. Они влияют на все, от вашего метаболизма до настроения и иммунной системы.
Кишечные бактерии и болезни
Исследования показывают, что кишечные бактерии у здоровых людей отличаются от бактерий, страдающих определенными заболеваниями. У больных людей может быть слишком мало или слишком много определенного типа.Или в них может отсутствовать большое количество бактерий. Считается, что некоторые виды могут защитить от болезней, а другие могут повысить риск.
Ученые начали устанавливать связи между следующими заболеваниями и бактериями в кишечнике:
Ожирение, диабет 2 типа и болезни сердца: Кишечные бактерии влияют на метаболизм вашего тела. Они определяют такие вещи, как количество калорий, которые вы получаете из пищи, и какие питательные вещества вы из нее извлекаете. Слишком большое количество кишечных бактерий может заставить вас превратить клетчатку в жирные кислоты.Это может вызвать жировые отложения в печени, что может привести к так называемому «метаболическому синдрому» — состоянию, которое часто приводит к диабету 2 типа, сердечным заболеваниям и ожирению.
Воспалительные заболевания кишечника, включая болезнь Крона и язвенный колит: Считается, что у людей с этими состояниями более низкий уровень некоторых противовоспалительных кишечных бактерий. Точная связь пока неясна. Но считается, что некоторые бактерии могут заставить ваше тело атаковать кишечник и подготовить почву для этих заболеваний.
Продолжение
Рак толстой кишки: Исследования показывают, что у людей с этим заболеванием другая кишечная микробиота, включая более высокий уровень болезнетворных бактерий, чем у здоровых людей.
Беспокойство, депрессия и аутизм: Кишечник заполнен нервными окончаниями, которые взаимодействуют с мозгом. Ваш врач может назвать эту связь «осью кишечник-мозг». Исследования показали связь между кишечными бактериями и расстройствами центральной нервной системы, такими как тревога, депрессия и расстройство аутистического спектра.
Артрит: Считается, что у людей с ревматоидным артритом может быть большее количество бактерий, связанных с воспалением, чем у людей без них.
Что ты умеешь?
Как получить здоровые кишечные бактерии?
Начните с питательной диеты с высоким содержанием пищевых волокон, таких как фрукты, овощи и цельнозерновые продукты. «Западная» диета с высоким содержанием жира и сахара и низким содержанием клетчатки может убить определенные типы кишечных бактерий, что сделает вашу микробиоту менее разнообразной.
Ограничьте использование антибиотиков, которые могут уничтожить здоровые бактерии вместе с проблемными бактериями, только в случае необходимости, как это определено вашим доктором.
Продолжение
Физические упражнения также могут стимулировать рост различных кишечных бактерий. Более разнообразная микробиота кишечника может способствовать лучшему здоровью и, в свою очередь, снизить риск заболевания.
Пробиотики нельзя принимать только для предотвращения диабета или лечения артрита. Эксперты говорят, что необходимо провести дополнительные исследования, чтобы точно определить типы бактерий, которые вызывают определенные заболевания.
Вскоре вы сможете принимать лекарства или добавки, приготовленные из определенного штамма кишечных бактерий, чтобы снизить риск или даже вылечить определенные заболевания.
Роль кишечных бактерий в СРК
Кишечные бактерии могут играть роль в синдроме раздраженного кишечника (СРК). Если вы страдаете СРК, вам иногда может казаться, что внутри вашего тела идет война. Что ж, последнее исследование IBS предполагает, что вы можете что-то понять.
Фото: Rafe Swan / Cultura / Getty Images
Ваша кишечная система наполнена миллиардами бактерий всех видов; Все вместе эти бактерии называются кишечной флорой.В состоянии оптимального здоровья все эти бактерии прекрасно взаимодействуют друг с другом. К сожалению, бывают случаи, когда баланс кишечной флоры нарушается — состояние, известное как дисбактериоз кишечника, что приводит к неприятным желудочно-кишечным симптомам. Это могло произойти по разным причинам, например из-за приступа гастроэнтерита (желудочного гриппа) или в результате приема антибиотиков. В мире исследований есть несколько новых указаний на то, что продолжающееся нарушение кишечной флоры может способствовать возникновению дискомфорта, который вы знаете как СРК.Эти подсказки исходят из четырех взаимосвязанных областей:
Постинфекционный СРК
Накапливаются данные, указывающие на то, что СРК развивается у некоторых людей после острой бактериальной инфекции пищеварительной системы. Исследования людей, переживших такую инфекцию, показали, что примерно 25% будут продолжать испытывать неприятные симптомы со стороны желудочно-кишечного тракта через шесть месяцев после первоначального заболевания. Еще более тревожным является открытие того, что каждый десятый человек, страдающий тяжелой инфекцией желудочно-кишечного тракта, в конечном итоге заболевает хроническим заболеванием, известным как СРК.В этих случаях выявляется четкая связь с острым приступом заболевания пищеварительной системы, классифицируемым как постинфекционный СРК (СРК-ИП).
Лабораторные исследования предлагают некоторые конкретные подсказки относительно IBS-PI. Используя процедуру биопсии слизистой оболочки прямой кишки, исследователи обнаружили больше воспалительных и связанных с серотонином клеток в ткани прямой кишки людей, у которых развился СРК. Это является дополнительным доказательством роли воспаления и связи между мозгом и кишечником в поддержании симптомов СРК.
Пробиотики
Роль вредных бактерий в СРК хорошо известна. Пробиотики известны как «дружественные» бактерии, потому что они считаются полезными для здоровья вашей пищеварительной системы, и появляется все больше доказательств связи пробиотиков с улучшением СРК. симптомы.
Пока еще недостаточно убедительных исследований, чтобы установить прочную связь между пробиотиками и улучшением симптомов СРК, поэтому гастроэнтерологи еще не одобряют добавление пробиотиков для этого состояния.Рекомендации по клинической практике Американской гастроэнтерологической ассоциации на 2020 год рекомендуют пробиотики для лечения СРК только в клинических испытаниях.
По некоторым данным, клинически доказано, что один конкретный тип пробиотика, Bifidobacterium infantis , снижает симптомы СРК. Считается, что прием пробиотических добавок помогает вернуть бактерии кишечной флоры к более оптимальному состоянию баланса.
Избыточный бактериальный рост в тонком кишечнике (СИБР)
Чрезмерный бактериальный рост в тонком кишечнике (СИБР) — это состояние, при котором в тонком кишечнике присутствует аномально высокое количество бактерий.Новая и несколько спорная теория пытается идентифицировать СИБР как первичную причину СРК. Сторонники теории SIBO считают, что SIBO является причиной симптомов вздутия живота, изменений моторики, которые приводят к диарее и запорам, а также висцеральной гиперчувствительности, наблюдаемой у пациентов с СРК.
СИБР обычно диагностируется с помощью теста, который измеряет количество водорода в выдыхаемом воздухе после приема напитков, содержащих лактулозу. Лактулоза — это сахар, который не усваивается нашим организмом, поэтому он ферментируется бактериями в кишечной системе.Если количество водорода в выдыхаемом воздухе высокое через короткое время после употребления раствора лактулозы, считается, что это отражает аномально высокий уровень бактерий в тонком кишечнике.
Разногласия заключаются в противоречивых отчетах о точности водородного дыхательного теста, а также в противоречивых отчетах о том, сколько пациентов с СРК дают аномально высокий результат теста. На данный момент в области исследований СРК сделан вывод о том, что СИБР может быть актуальным для определенной подгруппы пациентов с СРК.
Антибиотики
Другая область исследований, которая указывает на то, что кишечные бактерии играют роль в СРК, вытекает из теории СИБР и успешного использования определенных антибиотиков для лечения СРК. Используются два конкретных антибиотика, рифаксимин и неомицин, при этом рифаксимин показывает небольшое преимущество с точки зрения эффективности. Эти антибиотики были выбраны потому, что они не всасываются в желудке, и поэтому считается, что они способны атаковать любые бактерии, скрывающиеся в тонком кишечнике.Исследования показали, что эти антибиотики приводят к значительному улучшению симптомов, а также могут быть связаны с положительными изменениями в водородном дыхательном тесте. Недостатки использования антибиотиков связаны с их высокой стоимостью, а также с опасением, что они способствуют развитию более устойчивых форм бактерий. Антибиотики будут назначены только тем людям, у которых водородный дыхательный тест указывает на наличие избыточного бактериального роста в тонком кишечнике.
Кишечная микробиота при функциональных расстройствах кишечника: доклад Римского фонда
Введение
Функциональные желудочно-кишечные расстройства (FGID) определяются с помощью диагностических критериев, основанных на симптомах, которые объединяют хронические или повторяющиеся симптомы, относящиеся к желудочно-кишечному тракту, в отсутствие других патологических расстройств.1 FGID подразделяются на шесть основных категорий для взрослых: пищеводный, гастродуоденальный, кишечный, функциональный абдоминальный болевой синдром, билиарный и аноректальный. Из них функциональные расстройства кишечника (FBD) являются одной из наиболее частых причин обращения за медицинской помощью2, и они связаны с низким качеством жизни, связанным со здоровьем3–5, и значительными затратами для общества6–9. Патофизиологические механизмы, лежащие в основе этих заболеваний. расстройства изучены не полностью, но аномальная моторика желудочно-кишечного тракта (ЖКТ), висцеральная гиперчувствительность, нарушение функции головного мозга и кишечника, слабое воспаление, психосоциальные расстройства и кишечные микробы могут вносить свой вклад.10–12
Человеческое тело населяет сложное сообщество микробов, вместе называемых микробиотой.13 По оценкам, человеческая микробиота содержит 10 14 клеток, что в десять раз превышает количество человеческих клеток в нашем организме.14 A подавляющее большинство из них обнаружено в желудочно-кишечном тракте с континуумом от 10 1 –10 3 бактерий на грамм содержимого в желудке и двенадцатиперстной кишке до 10 11 –10 12 клеток на грамм в толстой кишке .15 Более того, микробный состав в этих участках различается, 16 также существуют значительные различия между микробиотой, присутствующей в просвете кишечника, и микробиотой, прикрепленной к слизистому слою желудочно-кишечного тракта и внедренной в него. традиционная биологическая номенклатура (тип — класс — порядок — семейство — род — виды) и в настоящее время описано более 50 бактериальных типов, из которых 10 обитают в толстой кишке и три преобладают: Firmicutes, Bacteroidetes и Actinobacteria; другие сайты демонстрируют другой микробный состав.18, 19 Проблема для исследователей и клиницистов заключается в том, что большая часть микробного разнообразия в желудочно-кишечном тракте человека в настоящее время не представлена доступными культивируемыми видами, 20 но в последние годы использование независимых от культуры методов изучения микробиоты кишечника увеличилось. понимание роли кишечной микробиоты в здоровье и болезнях14.
Несколько линий доказательств указывают на то, что бактерии могут участвовать в патогенезе и патофизиологии FBD через метаболическую способность микробиоты просвета и способность микробиоты, связанной со слизистой оболочкой, влиять на хозяина через иммунно-микробные взаимодействия.21 Например, многие субъекты с синдромом раздраженного кишечника (СРК) сообщают о появлении симптомов после кишечной инфекции.22 Есть также исследования, в которых сообщается о положительных эффектах лечения, направленного на микробиоту кишечника у пациентов с FBD.23, 24 Более того, избыточный бактериальный рост в тонком кишечнике ( SIBO) 25 и измененная кишечная микробиота26 участвуют в подгруппах пациентов с FBD. Однако клиническая значимость этих результатов остается неясной, и поэтому мы стремились критически проанализировать существующую литературу о роли кишечной микробиоты в FBD, уделяя основное внимание СРК, и предоставить рекомендации о том, как внедрить современные знания в клиническую практику. и направлять будущие исследования.
Эта рукопись представляет собой синтез отчета Комитета Римского фонда. Более подробное описание работы, проделанной этой командой, представлено в виде дополнительных онлайн-материалов.
Современные знания о микробиоте
Отношения, часто называемые симбиозом, развивались между хозяином и кишечной микробиотой на протяжении миллионов лет. Генетические и иммунные факторы хозяина, а также факторы окружающей среды влияют на состав кишечной микробиоты, которая, в свою очередь, формирует иммунитет и физиологию хозяина в кишечнике и за его пределами (рис. 1).Недавние исследования на людях демонстрируют невообразимую до сих пор сложность микробиоты кишечника человека с сотнями филотипов, из которых 80% остаются некультивированными.19 Из 10 бактериальных типов, обнаруженных в кишечнике, преобладают Firmicutes, Bacteroidetes и Actinobacteria, из которых Firmicutes являются наиболее распространенными. доминирующий и разнообразный тип в желудочно-кишечном тракте. Факультативные анаэробы составляют <0,1% от общего числа бактерий, обнаруженных в образцах фекалий. В недавней статье было высказано предположение, что микробиоту желудочно-кишечного тракта человека можно разделить на три устойчивых кластера, называемых энтеротипами, образованных группами видов, которые совместно вносят свой вклад в соответствующий предпочтительный состав сообщества.27 Примечательно, что эти энтеротипы не различаются в зависимости от характеристик пациента, таких как нация, пол, возраст или индекс массы тела, хотя эти результаты основаны на относительно небольшом количестве субъектов. Хотя в большинстве исследований использовался фекальный материал, он несколько отличается от бактерий, прикрепленных к слизистой оболочке, которые, вероятно, наиболее сильно взаимодействуют с хозяином.28
фигура 1
Микробиота кишечника и внутренние и внешние факторы, которые могут влиять на ее распределение и состав. В модуляции микробиоты кишечника участвует ряд механизмов хозяина, включая секрецию желудочного сока, выработку жидкости, антикомменсального sIgA и антимикробного пептида, а также моторику желудочно-кишечного тракта (ЖКТ).Лекарства, блокирующие секрецию кислоты и влияющие на моторику ЖКТ, могут косвенно изменять микробиоту. Антибиотики, в зависимости от спектра и дозировки, напрямую влияют на состав микробиоты. Изменения в диете, включая добавки с пробиотиками и клетчаткой, также повлияют на состав микробиоты. ММС, мигрирующие двигательные комплексы; H + ионы водорода; O 2 , парциальное давление кислорода; sIgA, секреторный иммуноглобулин А; ИПП, ингибитор протонной помпы; НПВП, нестероидное противовоспалительное средство.
Младенцы рождаются со стерильным кишечником, но быстро заселяются бактериями из их непосредственного окружения, в первую очередь из влагалища и кишечника их матери.29 Ранние колонизаторы кишечника новорожденных — это в основном аэробы (такие как стафилококки, стрептококки и энтеробактерии), тогда как поздние колонизаторы — строгих анаэробов (таких как эубактерии и клостридии) по мере того, как общая микробиота становится более сложной, более стабильной и сходится к общему паттерну.30, 31 Микробиота продолжает развиваться до зрелого возраста с постепенным увеличением количества Bacteroides spp., снижение количества Lactobacillus spp. после пятилетнего возраста и снижение Bifidobacterium spp. в позднем подростковом возрасте.32 Изменения также происходят в глубокой старости, когда Bacteroides spp. уменьшаются, в то время как Enterococcus spp. и Escherichia coli увеличение.33, 34 Индустриализация изменила как нашу диету, так и микробиоту, о чем свидетельствует сравнение фекальной микробиоты африканских сельских детей с богатой полисахаридами диетой с итальянскими городскими детьми, соблюдающими диету с высоким содержанием жиров и высоким содержанием белка.Африканские дети значительно обогащены Bacteroidetes, особенно родов Prevotella и Xylanibacter , которые, как известно, содержат гены гидролиза ксилана35 (рис. 2). Цельнозерновые злаки, 36 резистентный крахмал47, 38 и диеты с низким содержанием остатков коренным образом меняют микробиоту.39 Хотя есть данные, указывающие на то, что у людей с ожирением наблюдается увеличение количества Firmicutes и уменьшение количества Bacteroidetes (разница, вероятно, частично связана с разными диетами40), другие исследования не подтвердили эти наблюдения.41, 42 Многие диетические пребиотики, включая олигофруктозу, 43 лактулозу, 44, 45 ядро люпина, 46 инулинсодержащих соков47 и арабиноксилан-олигосахариды48, значительно изменяют микробиоту фекалий человека. Концепция плохо усваиваемых, но ферментируемых олиго-, ди- и моносахаридов и полиолов (FODMAP) включает множество веществ, которые являются субстратами для метаболизма бактерий и, следовательно, могут изменять микробиоту, но это еще не изучено.
фигура 2
Состав кишечной микробиоты африканских детей, живущих в сельской местности с богатой полисахаридами пищей, по сравнению с итальянскими городскими детьми.35 (Печатается с разрешения Proc Natl Acad Sci USA).
Большинство диет с высоким содержанием клетчатки изменяют микробиоту и ускоряют транзит. Ускорение транзита с использованием сенны увеличивает производство короткоцепочечных жирных кислот (SCFAs), но снижает фекальные метаногены, что противоположно эффекту лоперамида.49 Ускорение транзита с помощью цизаприда также увеличивает производство SCFAs, особенно пропионовой и масляной кислот.50 Ацетат, который преобладает в содержимом толстой кишки в значительной степени ингибирует.Напротив, пропионат и бутират стимулируют моторику, активируют двигательные паттерны подвздошной моторики у людей51 и обеспечивают продвижение бактерий из подвздошной кишки в толстую кишку. Нормальная микробиота также сильно влияет на иммунную систему слизистых оболочек52, 53, которая недостаточно развита у стерильных животных, у которых снижено количество Т-клеток, В-клеток, продуцирующих иммуноглобулин А, и интраэпителиальных Т-клеток.52, 54–56 Исследования близнецов предполагают, что генотип хозяина влияет на влияние генотипа. микробиота кишечника, хотя результаты остаются противоречивыми из-за невозможности контролировать общие факторы окружающей среды.40, 57 Один из наиболее важных генетических эффектов опосредован врожденным иммунным ответом. Таким образом, мыши, у которых отсутствует белок-2, содержащий нуклеотид-связывающий домен олигомеризации рецептора бактериального сенсорного восприятия, показали значительно больше Bacteroidetes, а также Firmicutes по сравнению с мышами дикого типа.58
Модуляция микробиоты вызывает висцеральную гиперчувствительность у мышей, которая снижается за счет продуктов, секретируемых Lactobacillus paracasei NCC2461.59 Lactobacillus acidophilus NCFM и Lactobacillus paracasei NCC2461 также модулируют восприятие висцеральной боли у крысолов.60, 61 Временное нарушение микробиоты антимикробными препаратами изменяет экспрессию нейротрофического фактора мозга, исследовательское поведение и колонизацию стерильных мышей, что позволяет предположить, что влияние кишечной микробиоты не ограничивается кишечником и иммунной системой, но может затрагивать центральную нервную систему .62 (Примечание: последнее предложение кажется устаревшим, но я не могу понять, как его исправить.)
Подходы к изучению микробиоты
Подходы к изучению микробиоты и относительные преимущества / недостатки представлены во вставке 1.Исследования на основе культур показывают, что микробиота кишечника представляет собой очень сложное сообщество (вставка 1) .63 Хотя культивирование остается ценным для определения функциональных групп и выборочного подсчета (например, патогенов), новые независимые от культуры подходы обеспечивают более эффективные и удобные методологии. для мониторинга изменений в сообществе желудочно-кишечного тракта (таблица 1). Информация о разнообразии микробов, колонизирующих кишечник, быстро расширилась за последние 15 лет, в основном на основе анализа последовательностей генов малой субъединицы рибосомной РНК (16S рРНК для бактерий и архей, 18S рРНК для эукариот), которые могут быть получены с помощью прямая амплификация нуклеиновых кислот, извлеченных из образцов кишечника или стула.64 Эта информация обеспечивает основу для ряда дополнительных методов подсчета кишечных бактерий, включая методы снятия отпечатков пальцев, такие как денатурирующий градиентный гель-электрофорез65, и целевые методы, такие как флуоресцентная гибридизация in situ и количественная ПЦР. Появление новых подходов к высокопроизводительному секвенированию и микроматрификации на основе 16S рРНК еще больше ускорило получение данных, позволяя анализировать амплифицированные последовательности 16S рРНК глубже без необходимости использования «классических» методов клонирования и секвенирования.66, 67 Хотя культивирование может иметь смещение в отношении бактерий, которые трудно выращивать в лаборатории, амплификация ПЦР смещает определенные группы кишечных бактерий. Например, последовательности 16S рРНК бифидобактерий часто недостаточно представлены в амплифицированных продуктах, хотя более надежно подсчитываются с помощью нацеленной на 16S рРНК флуоресцентной гибридизации in situ или количественной ПЦР37. соответствующие гены, например, участвующие в метаногенезе или синтезе бутирата.
Вставка 1 Подходы к изучению микробиоты кишечника
-
Дыхательные тесты не прошли валидацию для точного определения избыточного бактериального роста в тонком кишечнике.
-
Быстрые молекулярные подходы в значительной степени вытеснили культурные подходы к подсчету доминирующей микробиоты желудочно-кишечного тракта (ЖКТ).
-
Культурная микробиология остается решающей для изучения микробного разнообразия и селективного выделения представителей ключевых функциональных групп, включая патогены.
-
Культурально-независимые подходы к изучению микробиоты желудочно-кишечного тракта могут ответить на вопросы:
-
Какие микробы присутствуют в желудочно-кишечном тракте? (Подходы на основе гена 16S рРНК)
-
Какие микробные гены присутствуют в желудочно-кишечном тракте? (метагеномика)
-
Что делают микробы желудочно-кишечного тракта? (метатранскриптомика, метапротеомика, метабономика / метаболомика).
-
-
Возможности использования высокопроизводительных подходов и их глубина анализа быстро увеличиваются, но важно, чтобы они применялись с внимательным отношением к четко определенным научным вопросам.
Таблица 1
Основные характеристики методов определения микробиоты кишечника, не зависящие от культуры
Высокопроизводительное секвенирование ДНК предоставляет совершенно новые возможности для анализа кишечной микробиоты на основе «-омики ».19 Черновые варианты геномов культивируемых кишечных бактерий теперь могут быть получены быстро и с небольшими затратами.68 Кроме того, эти методы могут быть применены к ДНК, выделенная из образцов кишечника или стула, и анализ полученной сложной смеси последовательностей называется метагеномикой.69, 70 Возможность анализа последовательностей нескольких генов из большого количества образцов, дополненная функциональным скринингом и характеристикой случайно клонированных фрагментов ДНК из желудочно-кишечного тракта, в настоящее время используется для выявления изменений в болезненных состояниях, в том числе при воспалительном заболевании кишечника (ВЗК). . Родственная технология, метатранскриптомика, использует высокопроизводительное секвенирование или микроматричный анализ для изучения РНК, экспрессируемой в образцах желудочно-кишечного тракта, с акцентом на бактерии, которые транскрипционно активны.Другой потенциально мощный инструмент, метапротеомика, использует методы разделения и секвенирования белков для описания основных белков, присутствующих в образцах кишечника или стула.71, 72 Эти «мета-омические» подходы основываются на данных первичного секвенирования и аннотации.73, 74 Таким образом, они полагаются на данные. в значительной степени зависит от доступности последовательностей генома и функциональной информации от культивируемых эталонных бактерий, что означает значительные преимущества от сочетания различных подходов к анализу микробиоты кишечника. Последний «омический» подход, метабономика, не связан напрямую с генетической информацией микробов, но изучает профили метаболитов, являющиеся результатом общей микробной активности в кишечнике.Поскольку многие из этих метаболитов оказывают биологические эффекты (некоторые положительные, некоторые отрицательные) на хозяина, такой анализ может обеспечить прямую оценку последствий микробной активности в кишечнике, хотя и исключая клеточно-опосредованные эффекты и прямую идентификацию целевых видов микробов. .
Дыхательный тест использовался для выявления СИБР у пациентов с СРК путем неинвазивного обнаружения бактерий, продуцирующих водород, или архей, продуцирующих метан, в просвете кишечника. Дыхательный тест основан на концепции, согласно которой водородные газы образуются в результате бактериальной ферментации толстой кишки в ответ на прием исследуемого сахара.Они быстро диффундируют в кровь, выделяются с дыханием и могут быть собраны и определены количественно. 75 Если существует SIBO, время этого брожения будет изменено, но критерии аномальных тестов недействительны (рис. 3).
Рисунок 3
Дыхательный тест с водородом лактулозы (LHBT) преимущественно измеряет транзит по тонкому кишечнику, а не избыточный бактериальный рост в тонком кишечнике (SIBO) у пациентов с синдромом раздраженного кишечника (IBS). Верхняя схема показывает прием пробного завтрака с последующим последовательным измерением как газа H 2 , возникающего в результате ферментации лактулозы кишечными бактериями, так и сканирования Tc 99 в слепой кишке.Это последнее измерение определяет, когда пробный завтрак достиг слепой кишки. На приведенном ниже стилизованном рисунке показан типичный результат пациента с СРК с последовательными измерениями с течением времени. Tc 99 уже достиг слепой кишки в больших количествах до того, как уровень H 2 PPM достиг порога для аномального теста. Это демонстрирует, что повышенная продукция H 2 является результатом ферментации бактериями толстой кишки, а не патологическими бактериями тонкой кишки (например, SIBO).94
Различия в микробиоте при FBD и связь с патофизиологией
О микробиоте тонкого кишечника известно немного, так как тонкий кишечник относительно недоступен (суммировано в таблице 2; вставка 2) .75–85 Исследования культур показывают значительно меньше бактерий по сравнению с толстой кишкой с заметным градиентом от двенадцатиперстной кишки к дистальному отделу подвздошной кишки. Бактерии обычно представляют собой грамположительные аэробы проксимально, грамотрицательные и грамположительные анаэробы и факультативные анаэробы в подвздошной кишке.Независимые от культуры исследования микробиоты тонкого кишечника находятся в зачаточном состоянии, но предполагают сложность, не учитываемую стандартными методами культивирования, включая заметные индивидуальные различия, колебания во времени (даже в течение одного дня), возрастные различия и несколько ранее не идентифицированных филотипов. 86–88 Более того, в недавней статье указано, что микробиота тонкого кишечника управляется быстрым поглощением и преобразованием доступных простых углеводов, в которых Streptococcus spp.играют важную роль.89
Таблица 2
Резюме исследований по культивированию микробиома тонкой кишки
Вставка 2 Актуальность исследований, показывающих изменения микробиоты при синдроме раздраженного кишечника
-
Актуальность избыточного бактериального роста в тонком кишечнике при синдроме раздраженного кишечника (СРК) остается неясной из-за методологических проблем, влияния сопутствующих факторов и больших различий между исследованиями.
-
Неоднородность СРК и различия в методах, используемых для изучения фекальной микробиоты, привели к противоречивым сообщениям об отличиях от здоровых людей.
-
Микробиом может способствовать развитию симптомов СРК, изменяя нейромоторно-сенсорную функцию кишечника, барьерную функцию и / или ось мозг-кишечник.
Роль SIBO в патогенезе СРК очень противоречива, поскольку дыхательные тесты, использованные для определения этой роли, не были подтверждены.90, 91 Даже валидность «золотого стандарта», культуры тощей кишки> 10 5 КОЕ / мл с бактериями толстого кишечника, были поставлены под сомнение, в основном потому, что это пороговое значение было установлено на основе образцов после хирургического вмешательства.91 Исследования у пациентов с СРК показали относительно небольшое количество бактерий в двенадцатиперстной кишке и проксимальном отделе тощей кишки и отсутствие явных отличий от контроля (таблица 2). Предварительные исследования показывают, что больше пациентов с СРК имеют СИБР при использовании нижнего порогового значения> 10 3 КОЕ / мл, но необходимы хорошо спланированные исследования.82, 85 Доступные молекулярные исследования неадекватно разработаны, чтобы установить, вовлечен ли СИБР. в IBS, но имеют значительный потенциал.
Несколько смешивающих факторов, включая подавление кислоты ингибиторами протонной помпы (ИПП) и измененную моторику, были задействованы в исследованиях SIBO и IBS.92–94 Некоторые исследования показывают, что использование ИПП может приводить к симптоматическому СИБР или, по крайней мере, к увеличению числа бактерий и что после приема антибиотиков они ускоряют рецидив, но это зависит от используемых тестов и применяемых критериев.95 Хотя связь между СИБР и СРК в значительной степени существует. Основываясь на данных дыхательного теста, большинство положительных дыхательных тестов на лактулозу отражают быстрый переход к слепой кишке, а не истинный SIBO94 (рис. 4). Другие факторы, такие как антибиотики, пробиотики и пребиотики, а также другие диетические продукты, такие как FODMAP, также могут влиять на микробиоту у пациентов с СРК и приводить к потенциально ложной ассоциации.
Рисунок 4
Графическая диаграмма доступных в настоящее время стратегий модификации кишечной микробиоты с целью продемонстрировать взаимосвязь между эффективностью и инвазивностью / безопасностью предлагаемого подхода. FODMAP, ферментируемые олиго-, ди- и моносахариды и полиолы; ИПП, ингибитор протонной помпы.
Более ранняя оценка фекальной микробиоты на основе культуры, полученная от пациентов с СРК, показала уменьшение фекальных лактобацилл и бифидобактерий и увеличение количества факультативных бактерий, в которых преобладают стрептококки и Escherichia coli , а также более высокое количество анаэробных организмов, таких как Clostridium.
96, 97 Исследования с использованием молекулярных методов выявили изменения в составе фекальной микробиоты при СРК по сравнению с контрольной группой (таблица 3). Интересно, что недавнее исследование продемонстрировало, что фекальная микробиота пациентов с СРК может быть сгруппирована в кластер, который полностью отличался от такового у здоровых людей из контрольной группы.114 Тем не менее, результаты на сегодняшний день непоследовательны, а иногда и противоречивы (таблица 3). Это может отражать различия в используемых молекулярных методах, использовании отдельных образцов, которые не связаны с колебаниями симптомов (особенно потому, что исследования показывают, что фекальные микробиомы СРК менее стабильны), и, возможно, другие факторы, такие как диета и фенотипические характеристики пациентов.Кроме того, следует понимать, что образцы фекалий не обязательно отражают другие части желудочно-кишечного тракта.
Таблица 3
Резюме культуральных и молекулярных исследований микробиома толстой кишки
Открытие того, что СРК может развиться после инфекционного гастроэнтерита, побудило к исследованиям, оценивающим роль воспаления в СРК, но существует меньше исследований, посвященных связанным изменениям в микробиоте кишечника, которые могут быть столь же значительными. Инфекционный гастроэнтерит вызывает глубокое истощение комменсальной микробиоты, 118 чья продукция метаболитов, таких как SCFAs и антибиотики, обычно подавляет колонизацию патогенов, что можно увидеть по потере устойчивости к колонизации после приема антибиотиков.119 Неясно, насколько полностью и в течение какого периода времени происходит выздоровление.
Инфекционный гастроэнтерит является обычным явлением, с заболеваемостью 19 из 100 человеко-лет в Великобритании.120 Треть эпизодов являются вирусными (наиболее распространенными являются норовирус / ротавирус). Наиболее распространенные бактериальные инфекции, Campylobacter и Salmonella , составляют 10% и 3% соответственно. Появление новых симптомов СРК после приступа инфекционного гастроэнтерита является относительно частым явлением, о чем сообщают 6–17% пациентов с СРК, 121 в то время как недавний интернет-опрос сообщил, что 18%, 122 примерно 40% начинаются во время путешествия.Клинические признаки постинфекционного СРК в основном связаны с СРК-диареей (СРК-Д) .123, 124 Недавний метаанализ, объединяющий 18 исследований, показал относительный повышенный риск развития СРК через 1 год после бактериального гастроэнтерита (в основном Shigella , Campylobacter и Salmonella ), ОР = 6,5 ДИ (2,6–15,4), эффект все еще проявляется через 36 месяцев, ОР = 3,9 (3,0–5,0) 125. снижение заболеваемости постинфекционным СРК по сравнению с бактериальными инфекциями126, 127, при которых наиболее сильными факторами риска являются бактериальная токсичность 128, длительная продолжительность диареи, 124 ректальное кровотечение129 и лихорадка.125 Острый энтерит связан с длительным увеличением цитотоксических Т-лимфоцитов в слизистой оболочке и увеличением энтероэндокринных клеток.123 Другие исследования показали важность увеличения количества 5НТ-содержащих клеток при СРК-D130 и повышенной чувствительности при СРК-Д с увеличением количества клеток ЭК, 131 ускоренный транзит через кишечник и висцеральная гиперчувствительность.132 Эти эффекты на физиологию кишечника будут влиять на среду кишечной микробиоты. Раннее исследование детей с острым гастроэнтеритом продемонстрировало ощелачивание pH стула, вероятно, из-за снижения бактериальных метаболитов (SCFAs) и уменьшения количества Bacteroides, Bifidobacterium, Lactobacillus и Eubacterium .133 Обычный подсчет фекальных бактерий показал 10-кратное снижение количества анаэробов (Bacteroidaceae и Eubacterium ), небольшое изменение аэробов, но 10 9 КОЕ / г патогенов. Другое исследование с использованием традиционных методов культивирования показало изменение нормального доминирования анаэробов / аэробов во время острой инфекции.134 Более поздние исследования на людях с использованием современных методов, не зависящих от культуры, как правило, подтвердили эти результаты.135, 136 ПЦР-денатурирующий градиентный гель-электрофорез профилирования 16S рРНК гены показали пониженное разнообразие, часто связанное с доминантной полосой, предполагающей чрезмерный рост одного подтипа, который не всегда может быть исходным патогеном.В недавнем клиническом испытании раствора для пероральной регидратации, содержащего пребиотик, устойчивый к амилазе крахмал, при острой диарее в Индии, включая детей в возрасте от 3 месяцев до 5 лет, использовали праймеры для ПЦР, направленные на отдельные бактерии, например, Eubacterium spp. и Faecalibacterium prausnitzii , ключевые бактерии, участвующие в ферментации крахмала. Эти исследования показали снижение численности некоторых анаэробов ( Bacteroides spp., Eubacterium spp. И Faecalibacterium prausnitzii) , в то время как другие роды, включая Bifidobacterium spp.не изменились.135 Это истощение анаэробов могло быть связано с ускорением транзита, что могло привести к потере анаэробной ниши. Поскольку они являются ключевыми бактериями, участвующими в утилизации неабсорбированных углеводов в толстой кишке, 137 это также может вносить вклад в фенотип диареи, предотвращая ферментацию SCFAs, которые, как известно, стимулируют абсорбцию солей и воды в толстой кишке, как напрямую, так и индуцируя повышенную экспрессию переносчиков. 138–140 Предыдущие исследования СРК-Д предполагают снижение концентрации SCFA и скорости продукции при инкубации ex vivo, что также может отражать снижение количества анаэробов.141
Еще одна причина истощения анаэробов — антибиотики широкого спектра действия. РКИ нет, но эпидемиологические исследования показывают связь между применением антибиотиков и повышенным риском PI-IBS.142 Исследование детей показало, что через 3 месяца после заражения Salmonella рвота, боли в животе и диарея были зарегистрированы в 9,5% случаев. те, кто лечился антибиотиками, но только 2,9% тех, кто не получал антибиотики142.
Изменения во взаимодействии между кишечной микробиотой и факторами хозяина (например, возрастом, диетой, транзитом, генетическими факторами хозяина, антибиотиками) могут быть важны для патофизиологии СРК.Эти факторы, в свою очередь, могут быть связаны с изменениями в гомеостатических путях, включая барьерную функцию, нейромоторную сенсорную функцию и ось мозг-кишечник.143, 144 Например, двунаправленная передача сигналов между микробиотой и эпителием регулирует эпителиальную секрецию слизи, а также другие защитные факторы, участвующие в регуляции микробиоты. Изменения этих факторов (например, изменения в слое слизи и повышенное содержание пептида β-дефенсин-2) были обнаружены у пациентов с СРК и функциональной диареей и предполагают взаимодействие микробиоты с иммунной системой хозяина.145, 146 В соответствии с этой концепцией, недавно также было продемонстрировано, что у пациентов с СРК наблюдается повышенная экспрессия в слизистой оболочке толстой кишки рецепторов, распознающих специфические вещества, связанные с микробиотой (например, Toll-подобный рецептор-4, который распознает бактериальные липополисахариды) 147 или повышенные титры циркулирующих антитела против компонентов местной микробиоты (например, антифлагеллиновые антитела) .148 Несколько исследований продемонстрировали слабую активацию врожденного и адаптивного иммунного ответа слизистой оболочки у больших подгрупп пациентов с СРК.12, 149 Повышенное количество активированных тучных клеток, CD3 + ve, CD4 + ve и CD8 + ve Т-клеток было обнаружено как при постинфекционном СРК, так и при неспецифическом СРК. 12, 149 Относительная важность тучных клеток в этих условиях демонстрируется преобладание этого типа иммунных клеток над другими иммуноцитами и повышенное высвобождение гистамина, триптазы и простагландинов из биоптатов слизистой оболочки.150, 151 Тучные клетки располагались ближе к иннервации слизистой оболочки и коррелировали с тяжестью и частотой боли в животе у пациентов с СРК .152 Есть потенциальные последствия активации иммунной системы слизистых оболочек для сенсомоторной дисфункции у пациентов с СРК. Гистамин и триптаза, высвобождаемые из биоптатов слизистой оболочки пациентов с СРК, вызвали повышенную активацию сенсорных афферентных органов брыжейки и индуцировали висцеральную гиперчувствительность через рецепторы гистамина-1 и рецепторы активированных протеиназой-2 при применении к крысам-реципиентам.150, 151 Кишечная микробиота вполне может быть активным участником этот сценарий через стимуляцию иммунной системы, 153 вероятно, в подгруппе субъектов, демонстрирующих повышенную проницаемость эпителия, которая может154 подвергать иммунную систему аномальной микробной антигенной нагрузке.В целом, результаты предполагают, что взаимодействия бактерий с хозяином могут быть инициированы компонентами микробиоты, которые могут проходить через слизь и прикрепляться к эпителиальным клеткам, вызывая активацию врожденной системы защиты слизистой оболочки даже при отсутствии разрушения слизистой оболочки.
Использование пробиотиков, особенно в моделях на животных, также демонстрирует, что их секретируемые продукты или метаболиты могут модулировать сократительную способность гладких мышц кишечника и висцеральную чувствительность.59–61 Более того, применение пробиотиков может восстанавливать нейромоторно-сенсорную дисфункцию на моделях, подобных СРК.
Модуляция оси мозг – кишечник особенно актуальна при СРК, потому что психологическая коморбидность является обычным явлением. Некоторые формы психологического стресса в исследованиях на животных могут вызывать сдвиги в бактериальном составе кишечника, которые сопровождаются системным цитокиновым ответом и повышенной кишечной проницаемостью.155 Взаимодействие может быть двунаправленным, как предполагают исследования на животных, показывающие, что микробиота может влиять на химию мозга и поведение.156 Тем не менее, в настоящее время потенциальная значимость взаимодействий мозг-микробиота еще не доказана у людей в целом и у FBD в частности.
Расстройства ЖКТ, имитирующие и перекрывающиеся с FBD
Хотя целиакия, ВЗК или дивертикулит могут сосуществовать с СРК, диагностика «СРК» при наличии органического заболевания может быть сложной задачей.
Глютен вызывает целиакию у генетически предрасположенных людей и вызывает дисфункцию кишечника у мышей и может вызывать симптомы СРК при отсутствии целиакии.157 У некоторых пациентов с СРК отсутствуют антитела к тканевой трансглутаминазе или гистологические маркеры целиакии, но они все еще реагируют симптоматически на глютен. бесплатная диета.Это явление называется «нечувствительностью к глютену, не связанной с глютеном» или «чувствительным к глютену СРК». 157–159 Основные механизмы у людей остаются неясными. Мышиные модели показывают, что глютен может вызывать активацию врожденного иммунитета, повышенную проницаемость тонкого кишечника, 160 нервно-мышечную дисфункцию159 и дисбактериоз161 в отсутствие аутоиммунитета.
Симптомы, подобные СРК, обычны у пациентов с ВЗК в длительной ремиссии или часто наблюдаются у пациентов до постановки диагноза ВЗК.162, 163 Возможно, что СРК и ВЗК сосуществуют с более высокой, чем ожидалось, частотой или могут существовать на континуум, с СРК и ВЗК на разных концах воспалительного спектра.Исследование, посвященное изучению симптомов СРК у пациентов с ВЗК, у которых предполагалась клиническая ремиссия, продемонстрировало высокие уровни кальпротектина; это говорит о том, что в большинстве случаев симптомы СРК являются результатом невыявленного продолжающегося воспаления.164 Основные механистические связи отсутствуют, но есть соблазн выдвинуть гипотезу о том, что кишечная микробиота может быть общим фактором при обоих заболеваниях.165 Фактически, как и в случае с СРК. (таблицы 2 и 3), фекалии166–171 и дисбактериоз слизистых оболочек167, 172–178 были описаны ВЗК.
У значительной части пациентов, госпитализированных с острым дивертикулитом, сохраняются стойкие симптомы, имитирующие СРК179, несмотря на отсутствие осложнений.180 В некоторых неконтролируемых исследованиях утверждается, что антибиотики и / или месалазин благоприятны, что указывает на роль микробиоты в этом синдроме.181
Значение лечения: антибиотики, пробиотики, пребиотики и синбиотики
Поскольку микробиота может нарушаться при функциональных расстройствах желудочно-кишечного тракта, потенциальным подходом к лечению является попытка исправить дисбактериоз путем введения антибиотика или препарата «полезных» бактерий (вставка 3).
Вставка 4 Общие рекомендации по диагностике и лечению
-
В настоящее время нет клинически полезного способа определения того, нарушена ли микробиота у конкретных пациентов с синдромом раздраженного кишечника (СРК).
-
Оценка диеты и исключение возможных источников неабсорбируемых углеводов, включая ферментируемые олиго-, ди- и моносахариды, полиолы и избыточное количество клетчатки, могут быть полезны для отдельных пациентов.
-
Пробиотики имеют разумную доказательную базу, и их следует опробовать в течение не менее 1 месяца в адекватных дозах, прежде чем будет принято решение о реакции на лечение.
-
Полезность теста на избыточный бактериальный рост тонкого кишечника (SIBO) в условиях СРК остается областью неопределенности.
-
Если на основании клинических проявлений имеется серьезное подозрение на SIBO и рассматривается вопрос об обследовании, то лучшим тестом будет использование строгих критериев для дыхательного теста на глюкозу или аспирата тощей кишки.
-
Следует рассмотреть возможность прекращения приема ингибиторов протонной помпы у пациентов с СИБР.
-
Появляются доказательства того, что невсасывающиеся антибиотики могут иметь потенциал для уменьшения симптомов у некоторых пациентов с СРК.
Антибиотики
Несмотря на доказательства того, что предыдущее использование антибиотиков может быть связано с развитием СРК, 182, 183 и тот факт, что лечение антибиотиками может усилить развитие долгосрочных пищеварительных симптомов после бактериального гастроэнтерита, 142 плохо всасываемые антибиотики могут иметь терапевтический потенциал в этом 184, 185, хотя сейчас интерес сосредоточен на неабсорбированном производном рифампицина, называемом рифаксимином.186
Существует три полностью опубликованных двойных слепых плацебо-контролируемых испытания рифаксимина в FBD187–189, и данные свидетельствуют об улучшении симптомов, особенно вздутия живота и метеоризма, в течение примерно 10 недель после лечения187, 189 с терапевтическим преимуществом по сравнению с плацебо примерно на 10%. . Дозы, используемые в этих и других исследованиях, варьируются от 600 до 2400 мг в день в течение 7–14 дней190–195, но остаются опасения по поводу устойчивости к антибиотикам и возможной инфекции, вызванной Clostridium difficile , хотя до сих пор эти проблемы не представлялись проблемой.196–200
Таким образом, короткий курс антибиотиков, специфичных для кишечника, может быть полезен для некоторых пациентов с СРК, но нам нужно больше знать о предикторах реакции на лечение, устойчивости к антибиотикам, эффективности и безопасности режимов повторного лечения, а также об оптимальном режиме дозирования. .201, 202
Пробиотики
Пробиотики — это живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина203, причем наиболее часто используются лактобациллы и бифидобактерии.Пробиотики могут быть упакованы во многие составы, содержащие только один организм или смесь, и обладают широким спектром активности с доказательствами, подтверждающими влияние, по крайней мере, на некоторые предполагаемые патофизиологические механизмы, участвующие в СРК, такие как висцеральная гиперчувствительность, 59, 60, 204, 205 Нарушение моторики желудочно-кишечного тракта, кишечная проницаемость 206–210, 204, 211, 212 кишечная микробиота213, 214 и иммунная функция215, хотя эти эффекты могут значительно различаться между одним организмом и другим. Таким образом, то, что один организм полезен, не означает, что связанные организмы будут вести себя одинаково.Для использования в гастроэнтерологии важно, чтобы препарат содержал достаточное количество микробов, которые должны быть устойчивыми к кислотам и ферментам, при этом хорошее прилипание к слизистой оболочке также является преимуществом.
В таблице 4 перечислены результаты полностью опубликованных на сегодняшний день плацебо-контролируемых исследований пробиотиков.208–210, 212, 214–240 К сожалению, их дизайн значительно различается; 241–244 некоторые из более ранних исследований имеют низкое качество, и лишь немногие пытаются дать определение механизм действия или оценить, сопровождается ли симптоматическое улучшение изменением микробиоты.В недавнем систематическом обзоре сообщалось, что исследования более низкого качества, как правило, демонстрируют более сильные эффекты, а опубликованные данные указывают на предвзятость публикации, при этом в небольших испытаниях не сообщается о негативных эффектах244. детей, хотя различные симптомы улучшились, а терапевтический эффект по сравнению с плацебо в целом был скромным. Кроме того, остается неясным, какие организмы наиболее эффективны, поскольку, например, некоторые в основном уменьшают вздутие живота и метеоризм 209, 210, 218, тогда как другие улучшают частоту кишечника 222, а некоторые положительно влияют на общую оценку симптомов.214, 215, 224, 226, 229, 230, 233 В некоторых исследованиях более высокого качества бифидобактерии, такие как Bifidobacterium infantis 35624,215, 224, 241 Bifidobacterium lactis DN 173010208, 225 и Bifidumbacterium 226 кажутся полезными, а в других случаях пробиотические смеси оказываются полезными 214, 229, 233 Только в одном исследовании наблюдалось ухудшение симптомов221, хотя некоторые крупные исследования высокого качества дали отрицательные результаты221, 231, 234, 235
Таблица 4
Плацебо-контролируемые клинические испытания отдельных или смешанных пробиотических препаратов при СРК
Диета, клетчатка, пребиотики и синбиотики
Имеется несколько надлежащих рандомизированных плацебо-контролируемых испытаний модификации диеты из-за сложности контроля эффекта плацебо.Одно рандомизированное контролируемое исследование показало обострение симптомов отрубей; 245 за исключением отрубей должны помочь, и многие пациенты считают, что это правда.246 Пребиотик — это продукт, который при приеме внутрь стимулирует рост полезных бактерий, уже присутствующих в организме хозяина, что способствует укреплению здоровья. человека.247, 248 Этой функции служат различные олигосахариды, и синбиотик представляет собой комбинированный пребиотик и пробиотик. Одним из первых пребиотиков была лактулоза, неабсорбируемое дисахаридное слабительное, повышающее концентрацию в фекалиях Bifidobacterium spp.45, 249, как и инулин, который, как и лактулоза, увеличивает метеоризм47 и, таким образом, делает маловероятным его помощь пациентам с СРК.
На сегодняшний день было проведено только одно двойное слепое плацебо-контролируемое испытание пребиотика при СРК, в котором использовалась смесь трансгалактоолигосахаридов.250 По сравнению с плацебо этот пребиотик уменьшал симптомы и стимулировал рост бифидобактерий, но очевидно, что необходимы дополнительные исследования дозирования и относительные достоинства других соединений. Что касается синбиотиков, то есть некоторые исследования, но их дизайн недостаточно надежен, чтобы сделать какие-либо твердые выводы251–255, хотя концепция комбинирования пребиотика и пробиотика теоретически привлекательна.Таким образом, попытки изменить микробиоту у пациентов с функциональными расстройствами ЖКТ обнадеживают. Однако нам необходимо знать, как достигается симптоматическое улучшение: отражается ли оно в изменении микробиоты кишечника или задействован какой-то другой механизм?
Клинические рекомендации по модуляции кишечной микробиоты при СРК
В то время как наука о роли микробиоты в FGID остается в зачаточном состоянии, пациенты сталкиваются с противоречивыми заявлениями относительно симптоматической пользы от регулирования микробиоты кишечника.Этот раздел призван помочь клиницистам дать лучший совет, несмотря на ограниченность доказательств (вставка 4).
Диета в корне меняет микробиоту. Снижение потребления fibre256 или FODMAPs257 — один из самых простых и безопасных способов изменения микробиоты кишечника, который может привести к уменьшению вздутия живота и диареи, эффекту, который может длиться годами258. Однако пока имеются доказательства в поддержку широкого использования FODMAP. снижение у пациентов с СРК ограничено и исходит в основном от одной исследовательской группы. Систематические исключающие диеты также могут помочь258, но они трудоемки; Целевое исключение подозреваемых, регулярно употребляемых в пищу, таких как молочные продукты, пшеница, фрукты и овощи, может быть более практичным.
Безопасность пробиотиков при СРК приемлема, но некоторые симптомы усугубляются221, поэтому пациентов следует предупреждать об этой возможности. В настоящее время наиболее убедительными доказательствами являются Bifidobacterium infantis 35624 в дозе 1 × 10 8 КОЕ / день в течение не менее 4 недель224. Остается неясным, кому какой вид пробиотиков приносит пользу, поскольку на многие из них даны неполные ответы. вопросы, связанные с этим терапевтическим подходом, в том числе:
-
Отдельные организмы лучше смесей или наоборот?
-
Содержат ли некоторые смеси организмов штаммы, которые являются конкурентными или антагонистическими без дополнительных эффектов?
-
Можно ли одновременно принимать пробиотические продукты и напитки?
-
Какие системы доставки лучше всего — жидкости или капсулы?
-
Как можно обеспечить жизнеспособность и биодоступность?
-
Каковы оптимальные режимы дозирования и их продолжительность?
-
Какова частота колонизации хозяев?
-
Пробиотики не являются сильнодействующими фармакологическими средствами: на какую группу пациентов следует воздействовать?
-
Существуют ли группы пациентов, которым пробиотики могут быть противопоказаны, например, новорожденные, пациенты с ослабленным иммунитетом или тяжелобольные?
-
Есть ли какие-либо вопросы безопасности в отношении некоторых штаммов пробиотиков, например, штаммов Escherichia coli ?
-
Следует ли назначать разные пробиотики отдельным подгруппам пациентов с СРК?
-
Какие симптомы СРК должны быть основной целью терапии?
-
Каковы возможные механизмы улучшения симптомов?
-
Как следует информировать врачей и пациентов об их применении?
Значительное подавление кислоты, вызванное ИПП, может изменить микробиоту верхнего отдела кишечника и потенциально может вызвать симптомы СРК.92 Таким образом, стоит рассмотреть возможность отмены ИПП у отдельных пациентов с СРК, принимающих ИПП, по неясным причинам, особенно если их симптомы начались с терапии ИПП.
Самый прямой способ изменить микробиоту кишечника — это использовать антибиотики широкого спектра действия. Однако быстрое развитие устойчивости к антибиотикам вызывает опасения по поводу использования антибиотиков при таком повсеместном и хроническом состоянии. Более того, вполне вероятно, что пациентам могут потребоваться повторные курсы терапии, поскольку данные испытаний свидетельствуют о том, что польза уменьшается к 12 неделям.189 Наилучшим доказательством является применение рифаксимина в дозе 550 мг трижды в день в течение 2 недель.189 Число пациентов, нуждающихся в лечении, составило 11, что следует сравнить с 4 для плацебо без обмана, 259 7 для алозетрона, 260 8 для линаклотида 261 и 14 для тегасерод.262
Хотя рифаксимин, по-видимому, хорошо переносится и безопасен, учитывая его относительно низкую эффективность, его использование должно быть ограничено в сложных случаях, поскольку его широкое использование может способствовать развитию устойчивости, такой как устойчивые к рифампину штаммы стапиголококков.196 На рисунке 4 представлена диаграмма доступных в настоящее время стратегий изменения микробиоты кишечника в соответствии с эффективностью и инвазивностью предлагаемого подхода, а общие рекомендации представлены во вставке 4.
Выводы и рекомендации для будущих исследований и разработок
Хотя есть убедительные доказательства, подтверждающие концепцию, что кишечная микробиота нарушена у пациентов с FBD, у нас все еще отсутствуют данные о механизмах, посредством которых взаимодействия хозяина и микробиоты лежат в основе патофизиологии и вызывают симптомы; нам необходимо преодолеть несколько границ, которые сдерживают наши знания в этой области.
Гипотеза SIBO при СРК остается предметом дискуссий, потому что дыхательные тесты и методы посева тонкой кишки не были подтверждены. Кроме того, во многих исследованиях не учитывались смешивающие факторы, включая использование антибиотиков или ИПП. Широкая гетерогенность FBD и индивидуальная изменчивость профилей микробиоты предполагают, что исследования с большим размером выборки (как в патофизиологии, так и в терапевтических условиях) будут иметь ключевое значение в будущем.Следует обратить внимание на оценку корреляции между изменениями микробиоты и симптомами пациента. По возможности, исследования должны быть стратифицированы по факторам, которые, как известно или предполагаются, влияют на микробиоту кишечника (например, возраст, диета, энтеротип), и предназначены для снижения потенциальных мешающих факторов (например, антибиотиков, пробиотиков, слабительных, прокинетиков, ИПП и месалазина). Хотя образцы фекалий получить относительно легко, будущая работа должна лучше охарактеризовать микробные популяции на уровне просвета и слизистой оболочки, которые могут существенно отличаться от микробиоты фекалий.Взаимодействия хозяина и микробиоты — это динамические события, на которые, вероятно, влияют несколько факторов. Это говорит о том, что существует необходимость в продолжительных исследованиях для оценки микробиоты кишечника во время ремиссии и обострения симптомов, стресса, инфекции или после диетических манипуляций и использования пробиотиков, пребиотиков и антибиотиков. Также необходимо оценить влияние кишечного транзита на профили микробиоты и корреляцию с симптомами.
Одним из важных ограничений доступных исследований является их описательный, а не механистический характер.Соответственно, исследования должны быть направлены на выяснение причинно-следственных связей между изменениями микробиоты и дисфункцией кишечника. Таким образом, можно разработать сигнатуры микробиоты, чтобы помочь идентифицировать биомаркеры СРК, которые, в свою очередь, могут предлагать терапевтические цели. Например, теория о том, что просветные бактерии могут вызывать низкую активацию кишечного иммунитета, теперь должна быть подтверждена механистическими и интервенционными исследованиями. Данные на грызунах предполагают наличие двунаправленного взаимодействия между микробиотой мозга и кишечника.144 Кроме того, наличие системных иммунных ответов на микробные люминальные антигены (антифлагеллиновые антитела) 148 дает первоначальное свидетельство того, что микробный гомеостаз может нарушаться за пределами желудочно-кишечного тракта. Эти аспекты требуют дальнейшего изучения, чтобы открыть новые возможности для исследований в области FBD.
В настоящее время есть многообещающие результаты, предполагающие, что подгруппа пациентов с FBD может положительно отреагировать на короткий курс антибиотиков, специфичных для кишечника. Однако большинство исследований пробиотиков и антибиотиков недостаточно мощны и имеют неоптимальный дизайн.Вздутие живота и метеоризм особенно чувствительны к невсасывающимся антибиотикам. Чтобы безопасно направлять эти варианты лечения подходящим пациентам, нам необходимо знать больше о прогностических факторах реакции на лечение, риске развития устойчивости к антибиотикам, эффективности и безопасности схем повторного лечения и оптимальном режиме дозирования.201, 202 Дальнейшие исследования должны также изучить механизм и место действия неабсорбируемых антибиотиков, поскольку уменьшение симптомов, связанных с газами, у пациентов происходило также у пациентов без признаков СИБР.188 Пробиотики, по-видимому, имеют положительный, хотя и умеренный эффект как у детей, так и у взрослых с БЛД, особенно СРК. Тем не менее, прямые сравнения между различными пробиотическими продуктами были бы полезны, и будущие испытания должны быть крупномасштабными, высококачественными и использовать достоверные конечные точки. Испытания также должны изучить механизмы улучшения симптомов.
Трансплантация фекалий эффективна у 145/166 (87%) пациентов с фульминантной и рефрактерной инфекцией C. difficile . Эта процедура также была предложена для лечения СРК, но необходимы дальнейшие исследования.263
В заключение, более точное определение роли кишечной микробиоты в патогенезе и патофизиологии FBD представляет собой задачу на будущее. Хотя это многообещающе, терапевтическое значение должно быть лучше определено в хорошо проведенных крупных клинических испытаниях. Строгое сотрудничество опытных клинических исследователей с микробными экологами следует рассматривать как важный фактор успеха этих будущих исследований.
Благодарности
Авторы хотели бы поблагодарить профессора Виллема де Вос, профессора Эймона Куигли, профессора Патрицию Бриджиди и членов правления Римского фонда за критический пересмотр рукописи.Мы также благодарим Чезаре Кремона за ценную помощь в редактировании рукописей и секретарскую поддержку со стороны Эммы Брэдли.
Вставка 3 Модуляция кишечной микробиоты при функциональных расстройствах кишечника
-
Было показано, что короткий курс неабсорбируемого антибиотика, такого как рифаксимин, умеренно улучшает симптомы синдрома раздраженного кишечника (СРК), особенно вздутие живота и метеоризм. Улучшение сохраняется после прекращения лечения, но точная продолжительность этого эффекта остается неопределенной.
-
Большинство испытаний пробиотиков при СРК демонстрируют некоторую степень эффективности, хотя некоторые из ранних исследований были очень низкого качества.
-
Пребиотики и синбиотики теоретически должны иметь потенциал в лечении функциональных желудочно-кишечных расстройств, но пока нет надежных данных, подтверждающих эту точку зрения.
Профилактика дисбактериоза
Дисбиоз, также называемый дисбактериозом, — это состояние, при котором бактерии в кишечнике не сбалансированы, вызывая широкий спектр симптомов расстройства пищеварения.
Что такое дисбактериоз?
В теле полно колоний безвредных бактерий, называемых микробиотой. Эти бактерии полезны для организма, поскольку они положительно влияют на естественные процессы в организме. Однако, когда эти здоровые бактерии становятся несбалансированными, вредные или патогенные бактерии начинают преобладать, что приводит к болезни.
Кишечные бактерии необходимы для жизни. Микробиом кишечника составляет около 400 видов бактерий. На самом деле бактерий в кишечнике больше, чем клеток в организме человека.Эти кишечные бактерии важны, поскольку они помогают переваривать пищу, защищать от вредных патогенов и синтезировать витамины.
Дисбиоз возникает, когда бактерии в желудочно-кишечном тракте выходят из равновесия, что приводит к широкому спектру симптомов нарушения пищеварения. Дисбиоз связывают с другими заболеваниями, которые могут поражать кишечник, такими как воспалительные заболевания кишечника и другие желудочно-кишечные заболевания. К ним относятся гастрит, синдром раздраженного кишечника (СРК), язвенная болезнь и рак желудка или толстой кишки.
Последствия дисбактериоза кишечника. Дисбактериоз толстой кишки. Кредит изображения: Тимонина / Shutterstock
Причины и риски
Когда происходит нарушение баланса микробиоты, это может привести к дисбактериозу. Есть много возможных причин этого состояния. Изменение диеты с повышенным потреблением сахара, белка и пищевых добавок может привести к дисбактериозу. К другим причинам относятся частое употребление антибиотиков, чрезмерное употребление алкоголя, частое употребление антацидов, случайное употребление пестицидов или воздействие химикатов, хронический физический или психологический стресс, предыдущая паразитарная или бактериальная инфекция желудочно-кишечного тракта и диета с низким содержанием клетчатки.
Другие причины включают употребление новых лекарств, которые могут повлиять на флору кишечника, плохую гигиену полости рта, беспокойство и незащищенный секс, который может подвергнуть человека воздействию бактерий. Некоторые исследования связывают кормление смесью и рождение через кесарево сечение, поскольку некоторые факторы могут изменить тип штаммов полезных бактерий, присутствующих у новорожденных. Эти факторы могут увеличить риск развития дисбактериоза кишечника в более позднем возрасте.
# GMFh3016 Франсиско Гварнер — Как бы вы дали определение «дисбактериоз»? Играть
Признаки и симптомы
Общие признаки и симптомы дисбактериоза включают боль в животе, ощущение вздутия живота, спазмы в животе, диарею, запор, несварение желудка и рефлюкс.В некоторых случаях люди могут испытывать пищевую непереносимость, утомляемость, пониженное настроение, изжогу, боли в суставах и кожные заболевания.
Профилактика
Есть много способов предотвратить дисбактериоз. Изменения образа жизни могут помочь поддерживать баланс кишечных бактерий и предотвратить их чрезмерный рост.
Использование антибиотиков только при необходимости
Не злоупотребляйте антибиотиками. Принимайте лекарство только по назначению врача. Если антибиотики не нужны, например, при вирусной инфекции, важно избегать приема этих препаратов.Антибиотики очень разрушительны для здоровых бактерий толстой кишки. Используйте их только в случае крайней необходимости.
Использование пребиотиков или пробиотиков
Поговорите со своим врачом о применении пребиотиков и пробиотиков. Прием пребиотиков, которые представляют собой здоровые растительные волокна, присутствующие во многих продуктах и вызывающие рост полезных бактерий в толстой кишке, может помочь снизить риск дисбактериоза. Прием пробиотиков — живых микроорганизмов, которые при приеме в достаточных количествах могут принести пользу организму и помочь предотвратить и лечить дисбактериоз.
Ограничение потребления алкоголя
Пейте меньше алкоголя или избегайте его совсем. Алкоголь может нарушить баланс кишечных бактерий в желудочно-кишечном тракте.
Соблюдайте правила гигиены полости рта
Регулярно чистите зубы и пользуйтесь зубной нитью. Это может предотвратить неконтролируемое размножение бактерий во рту. Когда во рту наблюдается чрезмерный рост вредных бактерий, это также может повлиять на другие части желудочно-кишечного тракта.


