Какие углеводы находятся в растительной клетке: Самое большое содержание углеводов в растительной клетке. Углеводы и их функции
Гликогены растительные — Справочник химика 21
Глобулярные системы играют важную роль в живых организмах, когда полимер выполняет функции, связанные с питанием или переносом веществ (кровяные тельца, гликоген, растительный белок), когда нужны низкие механические свойства и большая подвижность частиц, характерные для таких систем. [c.433]
Эти соединения, чрезвычайно широко распространенные в животном и особенно растительном мире, встречаются в очень больших количествах и играют роль либо запасных питательных веществ, либо строительного материала организма. К первой группе относятся крахмал, гликоген, инулин, резервная клетчатка (лихенин) во второй группе самой важной является обыкновенная клетчатка (целлюлоза). Отдельные вещества, например некоторые маннаны и галактаны, занимают промежуточное положение между этими группами и могут выполнять обе функции. [c.453]
Функциональное предназначение полисахаридов в живой клетке определяет в значительной степени их структурные особенности. В зависимости от выполняемой ими роли полисахариды можно подразделить на три группы. Структурные полисахариды, такие как целлюлоза или кси-лап в клеточных стенках растений, хитин в наружном скелете членистоногих и насекомых, образуют протяженные цепи, которые, в свою очередь, укладываются в прочные волокна или пластины и служат своего рода каркасом в живом организме. Резервные полисахариды, как амилоза (составная часть растительного крахмала), гликоген (животный крахмал), глюкоманнаны (резервное вещество ряда растений), часто характеризуются разветвленной структурой, где длина наружных и внутренних ветвей варьируется в довольно широких пределах, или состоят из набора линейных цепей с различной степенью полимеризации. Полисахариды данной группы важны для энергетики организма. Наконец, каррагинан, мукополисахариды соединительной ткани и другие гелеобразующие полисахариды часто состоят пз линейных цепей, которые, образуя достаточно большие ассоциаты и удерживая воду, превращаются в плотные гели.
В зависимости от выполняемой ими роли полисахариды можно подразделить на три группы. Структурные полисахариды, такие как целлюлоза или кси-лап в клеточных стенках растений, хитин в наружном скелете членистоногих и насекомых, образуют протяженные цепи, которые, в свою очередь, укладываются в прочные волокна или пластины и служат своего рода каркасом в живом организме. Резервные полисахариды, как амилоза (составная часть растительного крахмала), гликоген (животный крахмал), глюкоманнаны (резервное вещество ряда растений), часто характеризуются разветвленной структурой, где длина наружных и внутренних ветвей варьируется в довольно широких пределах, или состоят из набора линейных цепей с различной степенью полимеризации. Полисахариды данной группы важны для энергетики организма. Наконец, каррагинан, мукополисахариды соединительной ткани и другие гелеобразующие полисахариды часто состоят пз линейных цепей, которые, образуя достаточно большие ассоциаты и удерживая воду, превращаются в плотные гели. [c.17]
[c.17]
В оценке биохимической роли углеводов в последние десятилетия произошли серьезные изменения. Если раньше углеводы рассматривали лишь как источники энергии для животных организмов (глюкоза гликоген как резервное вещество) и пассивный строительный материал для создания остова растительных клеток (клетчатка), то в настоящее время знают о многих других функциях углеводов. [c.304]
Они служат источником запасной энергии (в растениях— крахмал, в животных организмах — гликоген). В растительных организмах углеводы являются основой клеточных мембран. В качестве одного из структурных компонентов остатки углеводов входят в состав нуклеиновых кислот. [c.607]
Важнейшими полисахаридами являются крахмал, гликоген и целлюлоза. Они все построены на базе Д-глюкозы и служат в растительных и животных организмах резервными углеводами питания или углеводами для построения остова клеточной ткани. [c.642]
[c.642]
Гликоген — структурный и функциональный аналог растительного крахмала у животных, еще более разветвленный, чем амилопектин. Имеет исключительно высокую молекулярную массу — до 100 млн. Гликоген служит прекрасным хранилищем углеводов для животных. Постоянно находится в клетке и благодаря огромным размерам молекулы и большому числу концевых групп поддерживает в клетке устойчивую концентрацию глюкозы. [c.496]
У человека из углеводов перевариваются в основном полисахариды-крахмал и целлюлоза, содержащиеся в растительной пище, и гликоген, содержащийся в пище животного происхождения. Крахмал и гликоген полностью расщепляются ферментами желудочно-кишечного тракта до составляющих их структурных блоков, а именно свободной D-глюкозы. Этот процесс начинается во рту во время пережевывания пищи благодаря действию фермента амилазы, вьщеляемого [c.745]
Несахароподобные сложные углеводы, или высшие полисахариды. Эта группа углеводов совершенно не похожа по своим свойствам на простые сахара. Высшие полисахариды не дают истинных растворов, они либо совсем нерастворимы в воде (как клетчатка, образующая стенки растительных клеток), либо растворяются с образованием коллоидных растворов (как крахмал и гликоген — животный крахмал). Высшие полисахариды не обладают сладким вкусом (обычно безвкусны) они, как правило, не образуют видимых кристаллов. При гид- [c.353]
Высшие полисахариды не дают истинных растворов, они либо совсем нерастворимы в воде (как клетчатка, образующая стенки растительных клеток), либо растворяются с образованием коллоидных растворов (как крахмал и гликоген — животный крахмал). Высшие полисахариды не обладают сладким вкусом (обычно безвкусны) они, как правило, не образуют видимых кристаллов. При гид- [c.353]
Мальтоза, или солодовый сахар (от латинского таНит — солод), встречается в свободном виде в некоторых растениях. В промышленном масштабе ее получают при неполном гидролизе растительного крахмала действием на него растительного фермента диастаза последний содержится в солоде, представляющем проросшие и высушенные зер-на ячменя. Этот процесс используют в ряде производств, основанных на брожении сахаристых веществ, в частности в пивоварении и винокурении. Животный крахмал — гликоген — также расщепляется диастазом. Такое же гидролизующее действие на крахмал оказывают и ферменты, содержащиеся в слюне. Благодаря этому крахмал усваивается человеческим организмом. [c.316]
Благодаря этому крахмал усваивается человеческим организмом. [c.316]
D-глюкоза — наиболее распространенная альдогексоза, встречающаяся как в свободном виде в виноградном соке и многих сладких плодах, так и в виде сложных сахаров — дисахаридов (сахароза, лактоза) и особенно часто — в виде полисахаридов растительного происхождения (крахмал, клетчатка) и животного происхождения (гликоген). В промышленности глюкозу получают гидролизом крахмала с разбавленной серной кислотой. Серную кислоту потом нейтрализуют мелом и отфильтровывают в виде труднорастворимого сульфата кальция. Упаренный сироп называют патокой. Частично патока идет непосредственно в кондитерское производство, частично из нее получают кристаллизованную очищенную глюкозу для медицинских и технических целей. [c.207]
Основным источником углеводов являются растительные продукты, В пищевых продуктах животного происхождения их содержится немного. Присутствующий в печени животных гликоген при убое животных быстро расщепляется до глюкозы.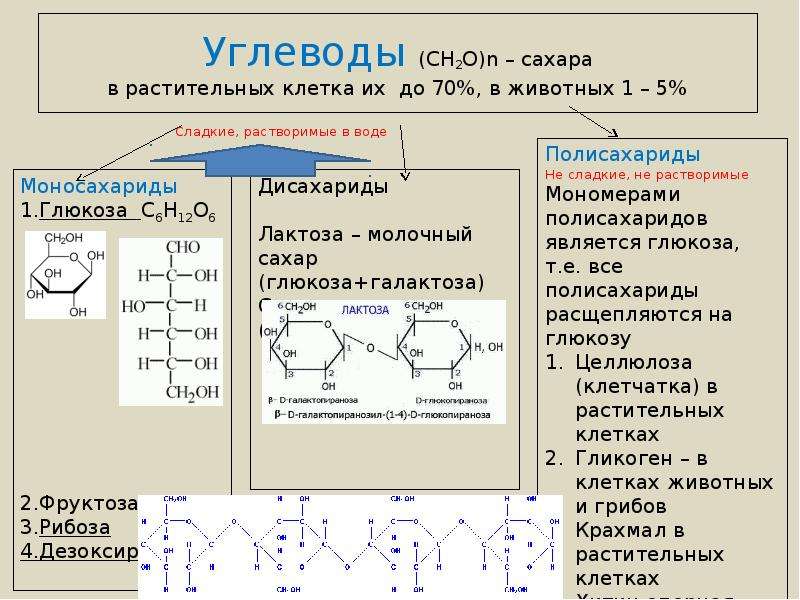 Источником молочного сахара — лактозы является молоко, в котором содержание лактозы по сухому веществу составляет /з- [c.16]
Источником молочного сахара — лактозы является молоко, в котором содержание лактозы по сухому веществу составляет /з- [c.16]
Если бы однажды удалось превратить уксусную кислоту в спирт, а из последнего получить сахар и гликоген , то мы были бы, очевидно, в состоянии собирать искусственным путем самые главные составные части растительного мира из фрагментов, имеющих к ним отдаленное отношение. [c.150]
Принцип метода. Крахмал экстрагируют из растительного материала хлорной кислотой и осаждают его в виде йодного комплекса. Другие полисахариды, в том числе и гликоген, не осаждаются йодом. Затем йодный комплекс разлагают и крахмал гидролизуют до глюкозы. Глюкозу определяют методом Бертрана. По количеству найденной глюкозы вычисляют содержание крахма- [c.85]
Амилазы действуют на высокомолекулярные полисахариды— крахмал и гликоген. Представителями растительных амилаз являются а-амилаза и -амилаза, которые могут встречаться в растительных объектах вместе или отдельно. Действие этих двух ферментов на крахмал резко различно. При действии на один из компонентов крахмала —нацело до мальтозы, а если субстратом действия -амилазы является амилопектин, то она расщепляет до мальтозы только концевые цепочки амилопектина и не действует на точки ветвления, и обычно под действием -амилазы до мальтозы расщепляется 50—54% амилопектина. [c.148]
Действие этих двух ферментов на крахмал резко различно. При действии на один из компонентов крахмала —нацело до мальтозы, а если субстратом действия -амилазы является амилопектин, то она расщепляет до мальтозы только концевые цепочки амилопектина и не действует на точки ветвления, и обычно под действием -амилазы до мальтозы расщепляется 50—54% амилопектина. [c.148]
Полиозы играют в растениях различную роль. Они бывают структурными веществами, придающими организму растений плотность, гибкость, например целлюлоза, пектиновые вещества и пр. Резервные полисахариды являются источником питания растений, например крахмал, гликоген, инулин и пр. Некоторые полисахариды имеют неясную биологическую функцию — растительные слизи, камеди и т. д. [c.77]
К веществам углеводной природы относятся также пектиновые вещества, растительные камеди, слизи. Среди У. имеется много так называемых стереоизомеров — правых и левых форм (обозначаемых знаками -f и —) и форм, отличающихся конфигурацией, пространственным расположением групп Н и ОН (обозначаемых буквами В и Ь). Гликоген — единственный полисахарид, встречающийся в животных организмах (в печени). [c.299]
Гликоген — единственный полисахарид, встречающийся в животных организмах (в печени). [c.299]
Значение этих веществ в жизнедеятельности растений далеко не одинаково. Одни полисахариды служат запасными питательными веществами и источником энергии, необходимой для жизнедеятельности организма, принимают широкое участие в общем обмене веществ. К таким веществам относятся крахмал, инулин, гликоген, гемицеллюлозы. Другие полисахариды образуют скелетное вещество растительных органов, участвуя в построении клеточных стенок (клетчатка, гемицеллюлозы, пентозаны). Третьи представляют продукты переработки, выделяемые растениями в виде слизи и гумми. [c.295]
ГЛИКОГЕН (животный крахмал) (СвН,о05)л — полисахарид, состоящий из остатков глюкозы имеет разветвленную структуру и содержит молекулы различной степени полимеризации. Г. распространен в организмах животных и представляет собой резервное питательное вещество для организма. Откладывается, главным образом, в печени и мышцах. Г. хорошо растворяется в горячей воде, образуя коллоидный растгор. Иод окрашивает Г. в красно-бурый цвет (в отличие от растительного крахмала, дающего синюю окраску). Г. гидролизуется с образованием глюкозы. [c.76]
Г. хорошо растворяется в горячей воде, образуя коллоидный растгор. Иод окрашивает Г. в красно-бурый цвет (в отличие от растительного крахмала, дающего синюю окраску). Г. гидролизуется с образованием глюкозы. [c.76]
Упомянем также гликоген— углевод, вырабатывающийся в животном организме и часто называемый животным крахмалом. Формула гликогена отвечает растительному крахмалу — (СбНюОб) , однако молекулярный вес его значительно выше и может достигать 4 ООО ООО. [c.239]
К углеводам относятся простейшие сахара (обыкновенный свекловичный, или тростниковый, сахар — сахароза, виноградный сахар — глюкоза, фруктовый сахар — фруктоза, молочный сахар — лактоза), крахмал и гликоген, клетчатка, из которой строится оболочка растительных клеток (отсюда и название клечатка или целлюлоза ), известная в обыденной жизни в почти чистом состоянии в виде ваты и фильтровальной бумаги, а в связанном с лигнином состоянии — в виде древесины. [c.439]
Тривиальные названия полисахаридов обычно отражают источник их нахождения в природе так, целлюлоза является основным компонентом клеточной стенки ell — клетка) у растений, а дерматан (обычно в сульфированной форме) впервые обнаружен в дермальном слое кожи. Тривиальные названия могут отражать некоторые свойства выделенного полимера например, английское название star h (крахмал) происходит от слова ster an (придавать жесткость). Для природных полисахаридов одного и того же типа обычно указывают нх происхождение. Так, например, крахмалы из различных растительных источников можно легко различить химическими методами, поэтому в их названиях указывают источник выделения (например, маисовый крахмал). Такие традиционные названия, как целлюлоза, гликоген и амилоза, [c.208]
Тривиальные названия могут отражать некоторые свойства выделенного полимера например, английское название star h (крахмал) происходит от слова ster an (придавать жесткость). Для природных полисахаридов одного и того же типа обычно указывают нх происхождение. Так, например, крахмалы из различных растительных источников можно легко различить химическими методами, поэтому в их названиях указывают источник выделения (например, маисовый крахмал). Такие традиционные названия, как целлюлоза, гликоген и амилоза, [c.208]
Заслуживает особого внимания применение высокомолекулярных комплексообразователей для выделения полисахаридов. Простейшим примером могут служить комплексы целлюлозы с амилозой или растительными галактоманнанами , образование которых объясняется сходством линейно построенных молекул этих соединений. Некоторые белки образуют нерастворимые комплексы с полисахаридами, например, кон-канавалин-А осаждает гликоген и некоторые другие высокоразветвлен-ные полисахариды . Наиболее избирательным методом осаждения полисахаридов является действие соответствующих антисывороток , применяемое в аналитических и, гораздо реже, в препаративных целях (подробнее об антигенных свойствах полисахаридов и явлении иммунитета см. стр. 518 и 604). [c.485]
Наиболее избирательным методом осаждения полисахаридов является действие соответствующих антисывороток , применяемое в аналитических и, гораздо реже, в препаративных целях (подробнее об антигенных свойствах полисахаридов и явлении иммунитета см. стр. 518 и 604). [c.485]
Родственным растительному крахмалу веществом является живот ный крахмал — гликоген, который содержится в различных тканя и органах животных. Гликогена также много и в некоторых растениях в зерне сахарной кукурузы, дрожжах и грибах. В настоящее врем разработаны методы определения количества крахмала. Их можш разделить на пять групп методы, основанные на прямом определени [c.162]
К гомополисахаридам относятся многие полисахариды растительного (крахмал, целлюлоза, пектиновые вещества), животного (гликоген, хитин) и бактериального (декстраны) происхождения. [c.414]
Гликоген. В животных организмах этот полисахари является структурным и функциональным аналого растительного крахмала. По строению подобен амиле X. пектину, но имеет еще большее разветвление цепе [c.416]
По строению подобен амиле X. пектину, но имеет еще большее разветвление цепе [c.416]
Полисахариды — высокомолекулярные вещества, состоящие из повторяющихся структурных единиц. Отличаются друг от друга структурой моноса-харидных звеньев, молекулярной массой, а также гликозидных связей. Благодаря наличию большого числа полярных групп, полисахариды после набухания растворяются в воде и образуют коллоидные растворы. Они присутствуют почти во всех клетках и выполняют многообразные функции. Велика их роль в образовании биологических структур. Так, хитин образует панцири членистоногих, целлюлоза является основной структурой зеленых растений, мукополисахариды — важнейшие компоненты соединительной ткани. Гликоген в животных, а крахмал в растительных организмах являются важнейшими резервными полисахаридами. Их делят на гомо- и гетерополисахариды. Примером гомополисахаридов может служить крахмал, состоящий из остатков только одного типа (глюкозы), а примером гетерополисахаридов — гиалуроновая кислота, которая состоит из остатков глюкуроновой кислоты, чередующихся с -ацетилглюкозамином. [c.9]
[c.9]
Белки, обеспечивающие все эти функции, а также и многие другие, обладают свойством, отсутствуюпщм у других соединений, а именно специфичностью. Белки различных животных и растительных родов являются типичными только для последних и отличаются от белков других родов, тогда как крахмал, гликоген и жиры очень мало отличаются друг от друга у различных родов. Иногда наблюдаются различия даже между белками индивидуальных представителей одного и того же рода. Следовательно, число встречающихся в природе белков крайне велико. Наконец, особенно характерным свойством белков является способность к денатурации — глубокому, в некоторых случаях необратимому превращению, которое претерпевают белки под действием тех же физических и химических агентов, которые убивают или повреждают живые организмы. Легкость, с которой это происходит, позволила сделать вывод, что белки имеют исключительно сложную и лабильную структуру, или, точнее, конформацию, присушую только этому классу соединений. [c.415]
[c.415]
В растительных организмах полисахариды, или полиозы, откладываются или как запасные (резервные) вещества (крахмал, инулин), или же входят в состав стенки растительной клетки (целлюлоза), и в таком случае играют существенную, роль в построении твердого остова растений. В организме жи-зотных встречаются полиозы, являющиеся резервными углеводами (гликоген) и полиозы, имеющие значение структурных веществ (туницин оболочников и моллюсков, хитин насекомых и ракообразных). [c.93]
Полисахариды представляют собой длинные цепи, образованные сотнями или тысячами моносахаридных единиц. Некоторые полисахариды, например целлюлоза, имеют линейные цепи, тогда как другие, например гликоген,- разветвленные. Наиболее распространенные в растительном мире углеводы-крахлразличие между ними состоит лишь в способах связи остатков D-глюкозы между собой. [c.303]
Целлюлоза является линейным, нераз-ветвленным гомополисахаридом, состоящим из 10000 и более остатков В-глю-козы, связанных друг с другом (1 -+4)-гликозидными связями в этом отношении она сходна с амилозой и линейными участками цепей гликогена. о между этими полисахаридами существует одно очень важное различие в целлюлозе (1 4)-связи имеют р-кон-фйгурацию, а в амилозе, амилопектине и гликогене-а-конфигурадию. Это, казалось бы, незначительное различие в строении целлюлозы и амилозы приводит к весьма существенным различиям в их свойствах (рис. 11-16). Благодаря геометрическим особенностям а(1 -> — 4)-связей лийейные участки полимерных цепей в молекулах гликогена и крахмала стремятся принять скрученную, спиральную конформацию, что способствует образованию плотных гранул, которые и обнаруживаются в больщин-стве животных и растительных клеток. [c.315]
о между этими полисахаридами существует одно очень важное различие в целлюлозе (1 4)-связи имеют р-кон-фйгурацию, а в амилозе, амилопектине и гликогене-а-конфигурадию. Это, казалось бы, незначительное различие в строении целлюлозы и амилозы приводит к весьма существенным различиям в их свойствах (рис. 11-16). Благодаря геометрическим особенностям а(1 -> — 4)-связей лийейные участки полимерных цепей в молекулах гликогена и крахмала стремятся принять скрученную, спиральную конформацию, что способствует образованию плотных гранул, которые и обнаруживаются в больщин-стве животных и растительных клеток. [c.315]
Основная функция триацилглицеролов -запасание липидов. В большинстве растительных и животных клеток три-ацилглицеролы находятся в цитозоле в виде мелкодисперсных эмульгированных маслянистых капелек (рис. 12-5). В спе-циализированньк клетках соединительной ткани животных, а именно в адипо-цитах, или жировых клетках, огромное количество триацилглицеролов может запасаться в виде жировых капелек, заполняющих почти весь объем клетки (рис. 12-5, Л). В большом числе жировые клетки обнаруживаются под кожей, в брюшной полости и в молочных железах. У тучных людей в жировых клетках накапливаются килограммы триацилглицеролов, энергии которых могло бы хватить на обеспечение основного обмена организма в течение нескольких месяцев. В отличие от этого в форме гликогена организм может запасти энергию не более чем на сутки (гл. 21). Трнацилглицеролы значительно лучше, чем гликоген, приспособлены для запа- [c.331]
12-5, Л). В большом числе жировые клетки обнаруживаются под кожей, в брюшной полости и в молочных железах. У тучных людей в жировых клетках накапливаются килограммы триацилглицеролов, энергии которых могло бы хватить на обеспечение основного обмена организма в течение нескольких месяцев. В отличие от этого в форме гликогена организм может запасти энергию не более чем на сутки (гл. 21). Трнацилглицеролы значительно лучше, чем гликоген, приспособлены для запа- [c.331]
Наиболее важными сложными углеводами растительных и животных тканей являются клетчатка, крахмал и гликоген. Большое значение имеют сахара сахароза, мальтоза, лактоза, глюкоза, фруктоза, галактоза, манноза, рибоза и дезоксирибоза. Другие углеводы представляют для биологов и врачей несколько меньший интерес. [c.71]
Гликоген также представляет собой полиглюкозу и также играет роль депо питательных веществ, хго только в отличие от крахмала он служит запасным углеводом не в растительных, а в животных тканях. По своей структуре гликоген сходен с амилопектином, так как его молекулы сильно разветвлены. Молекулярные веса препаратов гликогена колеблются от нескольких сотен тысяч до приблизительно 100 млн. В пределах препарата обычно наблюдается значительная полидисперсность. [c.268]
По своей структуре гликоген сходен с амилопектином, так как его молекулы сильно разветвлены. Молекулярные веса препаратов гликогена колеблются от нескольких сотен тысяч до приблизительно 100 млн. В пределах препарата обычно наблюдается значительная полидисперсность. [c.268]
Несахароподобные сложные уг.геводы, пли высшие по.гисахариды. Эта группа углеводов совершенно не похожа по своим свойствам на простые сахара. Высшие полисахариды ие дают истинных растворов, они либо совсем не растворимы в воде (как клетчатка, образующая стенки растительных клеток), либо растворяются с образованием коллоидных растворов (как крахмал и гликоген — животный крахмал). Высшие полисахариды не обладают сладким вкусом (обычно безвкусны) они, как правило, не образуют видимых кристаллов. При гидролизе высших полиоз из каждой молекулы полисахарида образуется большее число молекул моносахарида, часто измеряемое сотнями и тысячами. [c.237]
Гликоген, как и растительный крахмал, содержит основную цепь остатков а-й-глюкопиранозы, соединенных по типу мальтозы, но в нем содержится еще больше боковых ответвлений, состоящих из подобных, но более коротких цепей, соединенных эфк рообразно с углеродными атомами 2, 3 и 6 пиранозных ядер основной цепи. Более разветвленная структура гликогена способствует его легкому распаду и усвоению животным организмом. [c.321]
Более разветвленная структура гликогена способствует его легкому распаду и усвоению животным организмом. [c.321]
Изоамилаза — фермент, открытый сравнительно недавно в дрожжах [183], гидролизует 1 6-связи в полисахаридах и в этом отношении сходен с растительным R-ферментом и животной амилр-1,6-глюко-зилазой. Однако в то время как первый действует только на амилопектин (и не ра сщепляет гликоген), а второй — лишь на единичные 1,6-связи, обнаженные в ветвистых полисахаридах после действия других ферментов, изоамилаза способна отщеплять длинные наружные А-вет-ви (см. с. 112) как в амилопектине, так и в гликогене. [c.198]
Совокупность химических реакций, протекающих в живом организме, называется обменом веществ, или метаболизмом (от греческого слова т 1аЪо1е — изменение). Это реакции самых различных типов. Рассмотрим, например, что происходит с пищей, потребляемой человеком. Пища может содержать сложные углеводы, в частности крахмал которые расщепляются в процессе пищеварения на простые сахара и затем через стенки желудочно-кишечного тракта попадают в ток крови. Далее эти простые сахара в печени превращаются в гликоген (животный крахмал), имеющий ту же формулу, что и обычный растительный крахмал (СдНюОб) , где X — большое число. Гликоген и другие полисахариды — важные источники энергии в организмах животных. При окислении кислородом они образуют двуокись углерода и воду одна часть освобождаемой при этом энергии идет на производство работы, а другая — на согревание тела живого организма. [c.690]
Далее эти простые сахара в печени превращаются в гликоген (животный крахмал), имеющий ту же формулу, что и обычный растительный крахмал (СдНюОб) , где X — большое число. Гликоген и другие полисахариды — важные источники энергии в организмах животных. При окислении кислородом они образуют двуокись углерода и воду одна часть освобождаемой при этом энергии идет на производство работы, а другая — на согревание тела живого организма. [c.690]
Гликоген (крахмал печени) представляет собой глюкозан, широко распространенный в животном мире и встречающийся иногда в растительном мире. Образует водные коллоидальные растворы, дает фиолетово-красное окрашивание с иодом и при гидролизе разбавленными кислотами распадается, образуя глюкозу. В больших количествах накапливается в печени и мышцах и является одним из наиболее важных питательных веществ в животном мире. [c.195]
Введение в биологию (VIa) — caenogenesis — LiveJournal
Тема VI
УГЛЕВОДЫ (продолжение)
Все углеводы делятся на моносахариды (простые сахара), олигосахариды (цепочки, содержащие от 2 до 10 моносахаридных остатков) и полисахариды (полимеры, в которых число моносахаридных остатков может достигать многих тысяч). Один из самых известных полисахаридов — крахмал, представляющий собой длинную цепь остатков глюкозы, соединенных гликозидными связями. Это важнейшее запасное вещество у растений.
Один из самых известных полисахаридов — крахмал, представляющий собой длинную цепь остатков глюкозы, соединенных гликозидными связями. Это важнейшее запасное вещество у растений.
Животный аналог крахмала — гликоген, тоже важный запасной углевод. У нас он накапливается в первую очередь в печени и в случае надобности быстро расщепляется до мономеров глюкозы, которые уходят в кровь. Гликоген тоже состоит из остатков глюкозы, соединенных гликозидными связями. Серьезное отличие гликозидных связей, например, от пептидных — в том, что образованный с их помощью полимер может гораздо легче ветвиться. «По умолчанию» гликозидная связь образуется между гидроксилами 1-го и 4-го атомов углерода глюкозы (1-4-гликозидная связь), и тогде получается линейная цепочка. Но в глюкозе есть и другие гидроксилы, между которыми образование гликозидной связи тоже запросто возможно. На 1-6-гликозидной связи полимерная цепочка обычно как раз и разветвляется. В гликогене такое ветвление выражено сильнее, чем в крахмале, хотя оно есть и там и там.
Цвета на этой картинке, на самом деле, никакого значения сейчас не имеют, она просто красивая. Это — структура гликогена. Зеленым тут обозначен остаток глюкозы, с которого начинается боковая цепь, красным — концевые остатки, ну а все остальное нам сейчас уже должно быть понятно и так.
Совершенно особый интерес представляют полисахариды, участвующие в образовании клеточных стенок. Ни в коем случае нельзя путать клеточную стенку с клеточной мембраной! Клеточная стенка — это внеклеточная структура, состоящая из полимеров, расположенная снаружи от мембраны и заключающая в себе клетку целиком (не считая отверстий, обеспечивающих межклеточные контакты, если организм многоклеточный). Клеточная стенка может состоять из целлюлозы (у растений), из хитина (у грибов), из сложных полимеров, в состав которых входят углеводы и аминокислоты (у бактерий) или из белков (у архей). У некоторых организмов, например у животных, клеточных стенок нет вообще — это позволяет их клеткам легко менять форму.
Основной компонент клеточных стенок растений — целлюлоза — это полимер глюкозы, так же как и крахмал. Но, в отличие от крахмала, она состоит не из α-глюкозы, а из β-глюкозы. Кроме того, молекулы целлюлозы не ветвятся. Образующиеся между остатками β-глюкозы β-гликозидные связи — на схеме молекулы целлюлозы они выглядят зигзагообразными — гораздо прочнее α-гликозидных и расщепляются только очень немногими ферментами. Например, никто из животных, питающихся растениями, не может самостоятельно переваривать целлюлозу; тем, кто берется ее усваивать, приходится заводить для этой цели симбионтов-бактерий, у которых есть нужный фермент — целлюлаза (Гиляров, 2008).
Растительная клеточная стенка может быть гораздо толще мембраны. Если растение многоклеточное, то между клетками обычно есть плазмодесмы — проходящие сквозь отверстия в клеточных стенках цитоплазматические мостики (цитоплазмой называется все внутреннее содержимое клетки, кроме ядра). Через плазмодесмы растительные клетки общаются и обмениваются разными веществами.
На самом деле клеточная стенка растений вовсе не состоит из чистой целлюлозы. Во-первых, в нее еще входят короткие ветвящиеся полимеры, включающие не только глюкозу, но и другие моносахариды (эти полимеры собирательно называются гемицеллюлозами), а во-вторых — некоторые структурные белки. Целлюлоза вместе с гемицеллюлозами и белками образует сложную сеть, усиленную к тому же водородными связями — между длинными молекулами целлюлозы, в которых много гидроксильных групп, они возникают очень легко.
С точки зрения жизни на Земле в целом самая интересная составляющая клеточной стенки растений — это лигнин. Он не имеет никакой общей формулы. Лигнин — сложный полимер, сшитый из нескольких разновидностей спиртов с ароматическими ядрами и углеводородными цепочками. Все мономеры лигнина синтезируются из аминокислоты фенилаланина, которая превращается сначала в коричную кислоту — вещество, входящее в состав масла корицы, — а потом в разнообразные спирты (на схеме показаны только два из них):
Образование лигнина — признак сосудистых растений, то есть папоротников, плаунов, хвощей, хвойных и цветковых. Это эволюционное «изобретение», сделанное только после выхода растений на сушу, и то далеко не сразу. Дело в том, что лигнин придает клеточным стенкам огромную механическую прочность. Он необходим, чтобы сделать ствол наземного растения высоким, вплоть до многометрового, и создать транспортную систему из микроскопических трубочек, качающую воду на всю эту высоту. Именно с «изобретением» биосинтеза лигнина связано одно из крупнейших событий, поменявших лик Земли — появление лесов (Еськов, 2000).
Это эволюционное «изобретение», сделанное только после выхода растений на сушу, и то далеко не сразу. Дело в том, что лигнин придает клеточным стенкам огромную механическую прочность. Он необходим, чтобы сделать ствол наземного растения высоким, вплоть до многометрового, и создать транспортную систему из микроскопических трубочек, качающую воду на всю эту высоту. Именно с «изобретением» биосинтеза лигнина связано одно из крупнейших событий, поменявших лик Земли — появление лесов (Еськов, 2000).
Кроме того, появление лигнина сильно изменило глобальный круговорот углерода. Тут дело в том, что лигнин с его разнообразными мономерами и перепутанными химическими связями исключительно неподатлив к действию ферментов. Поэтому растительной тканью, в которой много лигнина, почти невозможно питаться. Из всех земных живых организмов эффективно разлагать лигнин «научились» только грибы, причем не все и не сразу (Robinson, 1990). Именно они и стали разрушителями мертвых деревьев. До этого вся огромная биомасса лигнифицированной древесины просто захоранивалась как есть, создавая залежи каменного угля, в честь которых получил название целый геологический период — каменноугольный, или карбон.
Карбоновые леса непрерывно вели фотосинтез и выделяли в атмосферу огромное, немыслимое в более ранние эпохи количество кислорода, который не расходовался на окисление стволов погибших деревьев, потому что перерабатывать их было еще некому. В результате доля кислорода в атмосфере достигла уникальной в истории Земли цифры 35% (Beerling et al., 2002). Как известно, современная атмосфера Земли содержит «всего» 21% кислорода. На самом деле по космическим меркам и это очень много, но в карбоне было в полтора раза больше. Связано это именно с тем, что огромная биомасса стволов деревьев со всеми содержащимися там полимерами не съедалась никакими живыми существами, в отличие от современной ситуации, когда упавшие стволы измельчаются насекомыми, перерабатываются грибами и в итоге их углеродные соединения окисляются дыханием до углекислого газа (CO2) — при этом расходуется кислород (O2), а углекислый газ уходит в атмосферу. А вот до той биомассы, которая успела захорониться в виде каменного угля до возникновения эффективных деструкторов, биосфера смогла «добраться» только с появлением человека, который неутомимо откапывает каменный уголь и жжет его. Процессы дыхания и горения описываются одним и тем же суммарным уравнением: C6H12O6 (глюкоза) + 6O2 → 6CO2 + 6H2O. Так что в итоге получается тот же самый углекислый газ, из которого фотосинтезирующие организмы (то есть растения) могут заново создать более сложные углеродные соединения, пригодные для построения тел живых существ.
Процессы дыхания и горения описываются одним и тем же суммарным уравнением: C6H12O6 (глюкоза) + 6O2 → 6CO2 + 6H2O. Так что в итоге получается тот же самый углекислый газ, из которого фотосинтезирующие организмы (то есть растения) могут заново создать более сложные углеродные соединения, пригодные для построения тел живых существ.
Еще один очень распространенный в природе полисахарид — хитин, из которого состоят клеточные стенки грибов и наружные панцири очень многих многоклеточных животных. Это полимер, во многом похожий на целлюлозу. Он тоже состоит из остатков β-глюкозы, но только модифицированных. Хитин — азотсодержащий полисахарид. Его мономер — строго говоря, не глюкоза, а ацетилглюкозамин, производное глюкозы, где ко 2-му атому углерода вместо гидроксила присоединена аминоацетильная группа -NH-CO-CH3.
В состав клеточных стенок бактерий входят еще более сложные азотсодержащие производные глюкозы, к которым дополнительно ковалентно «пришиты» цепочки аминокислот. Такой многокомпонентный полимер называется пептидогликаном. Запоминать детали тут не имеет никакого смысла, единственное, что стоит обязательно отметить — в состав пептидогликанов входят не только L-, но и D-аминокислоты. Это тот редкий случай, когда D-аминокислоты в живых организмах все-таки встречаются. Пептидные цепочки, входящие в пептидогликан — именно пептиды, но не белки.
Такой многокомпонентный полимер называется пептидогликаном. Запоминать детали тут не имеет никакого смысла, единственное, что стоит обязательно отметить — в состав пептидогликанов входят не только L-, но и D-аминокислоты. Это тот редкий случай, когда D-аминокислоты в живых организмах все-таки встречаются. Пептидные цепочки, входящие в пептидогликан — именно пептиды, но не белки.
Со времен работавшего еще в XIX веке ученого-медика Ганса Христиана Грама (Hans Christian Joachim Gram) бактерий делят на грамположительных и грамотрицательных, в зависимости от того, окрашиваются ли они определенным химическим методом, который Грам изобрел. Чем они отличаются по строению клеток — показано на картинке; из еще не встречавшихся нам слов здесь стоит пояснить липопротеин (белок с липидной частью), липотейхоевую кислоту (спиртовой полимер, связанный с липидами) и порины — транспортные белки, создающие в мембране как бы поры для воды и растворенных в ней мелких молекул. Но эти детали не должны заслонять от нас интереснейшую проблему. У грамположительных бактерий снаружи от мембраны находится толстая пептидогликановая клеточная стенка — в этом плане их клетка похожа, скажем, на растительную, не считая того, что материал клеточной стенки другой. А вот у грамотрицательных бактерий есть две полноценные билипидные мембраны — внутренняя и наружная — и относительно тонкая пептидогликановая клеточная стенка между ними! Так не устроены никакие другие клетки. Есть гипотеза, что первые на Земле живые организмы были именно грамотрицательными бактериями, и только у их потомков вторая — наружная — мембрана исчезла (Cavalier-Smith, 2006). Независимо от того, верна эта гипотеза или нет, эволюционный зигзаг тут получился очень занятный.
Но эти детали не должны заслонять от нас интереснейшую проблему. У грамположительных бактерий снаружи от мембраны находится толстая пептидогликановая клеточная стенка — в этом плане их клетка похожа, скажем, на растительную, не считая того, что материал клеточной стенки другой. А вот у грамотрицательных бактерий есть две полноценные билипидные мембраны — внутренняя и наружная — и относительно тонкая пептидогликановая клеточная стенка между ними! Так не устроены никакие другие клетки. Есть гипотеза, что первые на Земле живые организмы были именно грамотрицательными бактериями, и только у их потомков вторая — наружная — мембрана исчезла (Cavalier-Smith, 2006). Независимо от того, верна эта гипотеза или нет, эволюционный зигзаг тут получился очень занятный.
(PDF) Растворимые углеводы и холодовая акклимация растений
РАСТВОРИМЫЕ УГЛЕВОДЫ И ХОЛОДОВАЯ АККЛИМАЦИЯ РАСТЕНИЙ
26
Udomdee W., Wen, P. J., Lee C.Y., Chin S.W.,
Chen F.C. 2014. Effect of sucrose concentration and
seed maturity on in vitro germination of Dendrobi-
um nobile hybrids. Plant Growth Regul. 72 (3) :
Plant Growth Regul. 72 (3) :
249-255.
Van den Ende W. 2013. Multifunctional fructans and
raffinose family oligosaccharides. Front. Plant Sci. 4
: 247.
Van den Ende W., El-Esawe S. K. 2014. Sucrose signal-
ing pathways leading to fructan and anthocyanin ac-
cumulation: a dual function in abiotic and biotic
stress responses? Environ. Exp. Bot. 108 : 4-13.
Van Dingenen, J., Vermeersch, M., De Milde, L.,
Hulsmans, S., De Winne, N., Van Leene, J., Inzé, D.
2019. The role of HEXOKINASE1 in Arabidopsis
leaf growth. Plant Mol. Biol. 99 (1-2) : 79-93.
Wan H., Wu L., Yang Y., Zhou G., Ruan Y. L. 2018.
Evolution of sucrose metabolism: the dichotomy of
invertases and beyond. Trends Plant Sci. 23 (2) :
163-177.
Wang L. H., Li G. L., Wei S., Li L.J., Zuo S. Y., Liu X.,
Li J. 2019. Effects of exogenous glucose and sucrose
on photosynthesis in triticale seedlings under salt
stress. Photosynthetica. 57 (1) : 286-294.
Photosynthetica. 57 (1) : 286-294.
Wang L., Yao L., Hao X., Li N., Qian W., Yue C.,
Wang X. 2018. Tea plant SWEET transporters: ex-
pression profiling, sugar transport, and the involve-
ment of CsSWEET16 in modifying cold tolerance in
Arabidopsis. Plant Mol Biol. 96 : 577-592.
Wang H., Xin H., Guo J., Gao Y., Liu C., Dai D., Tang
L. 2019. Genome-wide screening of hexokinase
gene family and functional elucidation of HXK2 re-
sponse to cold stress in Jatropha curcas. Mol. Boil.
Rep. 46 (2) : 1649-1660.
Weiszmann J., Fürtauer L., Weckwerth W., Nägele T.
2018. Vacuolar sucrose cleavage prevents limitation
of cytosolic carbohydrate metabolism and stabilizes
photosynthesis under abiotic stress. FEBS J. 285
(21) : 4082-4098.
World agricultural production 2018. United States De-
partment of Agriculture, Foreign Agricultural Ser-
vice, Circular Series: December
https://apps. fas.usda.gov/psdonline/circulars/product
fas.usda.gov/psdonline/circulars/product
ion.pdf
Wurzinger B., Nukarinen E., Nägele T., Weckwerth W.,
Teige M. 2018. The SnRK1 kinase as central media-
tor of energy signaling between different organelles.
Plant Physiol. 176 (2) : 1085-1094.
Xalxo R., Yadu B., Chandra J., Chandrakar V., Keshav-
kant S. 2020. Alteration in Carbohydrate Metabo-
lism Modulates Thermotolerance of Plant under
Heat Stress. Heat Stress Tolerance in Plants. In:
Physiological, Molecular and Genetic Perspectives :
77-115.
Xiong, Y., Sheen, J. 2015. Novel links in the plant TOR
kinase signaling network. Curr. Opin. Plant Biol. 28
: 83-91.
Yang G., Xu H., Zou Q., Zhang J., Jiang S., Fang H.,
Chen X. 2020. The vacuolar membrane sucrose
transporter MdSWEET16 plays essential roles in the
cold tolerance of apple. Plant Cell Tiss Organ Cult.
140 : 129-142.
Yue C. , Cao H., Wang L. 2015. Effects of cold acclima-
, Cao H., Wang L. 2015. Effects of cold acclima-
tion on sugar metabolism and sugar-related gene ex-
pression in tea plant during the winter season. Plant
Mol. Biol. 88 : 591-608.
Zhang J., Gu H, Dai H., Zhang Z., Miao M. 2020. Al-
ternative polyadenylation of the stacyose synthase
gene mediates source-sink regulation in cucumber, J.
Plant Physiol. 245 : 153111.
Zhang J., Wu Z., Hu F., Liu L., Huang X., Zhao J.,
Wang H. 2018. Aberrant seed development in Litchi
chinensis is associated with the impaired expression
of cell wall invertase genes. Hort. Res. 5. (1) : 1-13.
Zhang Z-G., Lv G-d., Li B., Wang J-J., Zhao Y.,
Kong F-M. 2017. Isolation and characterization of
the TaSnRK2.10 gene and its association with agro-
nomic traits in wheat (Triticum aestivum L.). PLoS
ONE. 12 (3) : e0174425.
https://doi.org/10.1371/journal. pone.0174425
Zhao L. , Yang T., Xing C., Dong H., Qi K., Gao J.,
, Yang T., Xing C., Dong H., Qi K., Gao J.,
Huang X. 2019. The β-amylase PbrBAM3 from pear
(Pyrus betulaefolia) regulates soluble sugar accumu-
lation and ROS homeostasis in response to cold
stress. Plant Sci. 287 : 110184.
https://doi.org/10.1016/j.plantsci.2019.110184
Zhao Y., Zhou M., Xu K., Li J., Li S., Zhang S.,
Yang X. 2019. Integrated transcriptomics and
metabolomics analyses provide insights into cold
stress response in wheat. Crop J. 7 (6) : 857-866.
Zúñiga-Feest A., Bascuñán-Godoy L., Reyes-Diaz M.
2009. Is survival after ice encasement related with
sugar distribution in organs of the Antarctic plants
Deschampsia antarctica Desv. (Poaceae) and Colo-
banthus quitensis (Kunth) Bartl. (Caryophyllaceae)?
Polar Biol. 32 : 583-591.
Żur I., Gołębiowska G., Dubas E., Golemiec E.,
Matušíková I., Libantová J., Moravčíková J. 2013.
2013.
β-1, 3-glucanase and chitinase activities in winter
triticales during cold hardening and subsequent in-
fection by Microdochium nivale. Biologia. 68 (2) :
241-248.
REFERENCES
Antipina O. V., Astakhova, N. V., Popov, V. N., & Se-
livanov, A. A. 2015. Change in the ultrastructural
organization of chloroplasts of tobacco plants and
Arabidopsis in connection with the formation of re-
sistance to hypothermia. In: New and Non-
Traditional Plants and Prospects for Their Use : 188-
192. (In Russian).
Astakhova N.V., Popov V.N., Selivanov A.A., Bura-
khanova E.A., Alieva G.P., Moshkov I.E. 2014. Re-
organization of chloroplast ultrastructure associated
углеводов — Науки о растениях — Целебные китайские травы
Углеводы — это разнообразная группа соединений, состоящая из элементов углерода (C), водорода (H) и кислорода (O) с эмпирической формулой [Ch3O] n, где n представляет собой количество единиц Ch3O в соединении. Конечным источником всех углеводов является фотосинтез, при котором энергия солнечного света используется для химического превращения атмосферного CO2 в углеводы. Углеводы составляют до 80 процентов от сухой массы растения.Во многом это связано с наличием клеточных стенок, состоящих из сложных углеводов, окружающих каждую растительную клетку.
Конечным источником всех углеводов является фотосинтез, при котором энергия солнечного света используется для химического превращения атмосферного CO2 в углеводы. Углеводы составляют до 80 процентов от сухой массы растения.Во многом это связано с наличием клеточных стенок, состоящих из сложных углеводов, окружающих каждую растительную клетку.
Сахара, также называемые сахаридами, представляют собой углеводы. Обычные сахара, встречающиеся в природе, имеют от трех (глицеральдегид) до семи (седогепту-
).
(потеря) атомов углерода, связанных вместе, чтобы сформировать основу молекулы. Сахара можно химически классифицировать как альдегиды или кетоны, и они содержат группы ОН (гидроксильные), присоединенные к их углеродным основным цепям. Глюкоза (альдегидный сахар) и фруктоза (кетозный сахар) — два примера обычных шестиуглеродных сахаров, которые широко встречаются в растениях.Эти молекулы образуют кольцевые структуры, при этом глюкоза образует шестичленное кольцо, а фруктоза — пятичленное кольцо.
H OH D-глюкоза
OH H D-фруктоза ch3oh
Индивидуальные сахара называются моносахаридами. Два сахара, химически связанные вместе, называются дисахаридами; три — трисахариды; четыре — тетрасахариды и так далее. Общий термин для нескольких сахаров, связанных вместе, — олигосахарид. Молекулы со многими сахарами, соединенными вместе в полимер, называются полисахаридами.Сахароза (столовый сахар) является наиболее распространенным дисахаридом и состоит из глюкозы и фруктозы. Большое количество сахарозы образуется в листьях растений из продуктов фотосинтеза. Сахароза перемещается на большие расстояния в растениях в специализированной проводящей ткани, известной как флоэма. Сахароза может расщепляться, а ее компоненты (глюкоза и фруктоза) метаболизироваться для получения энергии и в качестве исходного сырья для построения клеточных компонентов в растительных клетках, удаленных от фотосинтетических листьев. Сахароза также может храниться.Высокие концентрации обнаружены в органах хранения, таких как фрукты, стебли сахарного тростника и укрупненные корни сахарной свеклы. Последние два являются коммерческими источниками очистки сахарозы.
Последние два являются коммерческими источниками очистки сахарозы.
гидрокси! химическая группа -OH
полимер: большая молекула, состоящая из множества одинаковых частей, перемещается для перемещения, особенно для перемещения сахаров из листа в другие части растения. завода
- Ch3OH
OH OH
Сахароза
ОН ОН
Сахароза
Два важных полисахарида растений, целлюлоза и крахмал, состоят исключительно из связанных вместе единиц глюкозы.Целлюлоза — самый распространенный полисахарид в стенках растительных клеток и, следовательно, самый распространенный полисахарид на Земле. В клеточных стенках целлюлоза встречается вместе с другими сложными полисахаридами, каждый из которых состоит из более чем одного типа сахара. Из-за того, как глюкоза связана в целлюлозе, отдельные цепи, состоящие из сотен молекул глюкозы, могут связываться вместе водородными связями в кристаллической структуре, образуя структуру, подобную кабелю, известную как микрофибриллы. Эти микрофибриллы переплетаются между собой
Эти микрофибриллы переплетаются между собой
и придают целлюлозе ее прочность в стенках растительных клеток, а также в хлопчатобумажной ткани и бумаге.
ch3oh ch3oh ch3oh ch3oh ch3oh ch3oh
Целлюлоза
Целлюлоза
Крахмал и целлюлоза различаются по способу связывания молекул глюкозы. Крахмал — это запасное соединение в растениях, которое при необходимости расщепляется на глюкозу для метаболического использования.
Обработка джинсовой ткани целлулазой в значительной степени заменила пемзу в производстве джинсов, выстиранных с использованием камня.
фермент белок, контролирующий реакцию в клетке
Крахмал
Крахмал
Углеводы играют важную роль в питании человека, часто составляя основной источник калорий в рационе.Глюкоза, фруктоза, сахароза и крахмал легко усваиваются человеком. Целлюлоза и другие сложные углеводы клеточной стенки растений не перевариваются легко, но составляют полезные пищевые волокна.
Целлюлаза, фермент, способный разлагать целлюлозу, вырабатывается многими различными грибами и некоторыми микроорганизмами. Этот фермент позволяет этим организмам разлагать растительный материал, что является важным шагом в переработке материалов в пищевых сетях. см. также «Фотосинтез», «Углеродная фиксация» и; Сахар.
Д. Мейсон Фарр и Джон Д. Уильямсон
Читать дальше: Углеродный цикл
Была ли эта статья полезной?
Идентифицирован сахарный насос на заводах
Исследователи открывают белок, который транспортирует сахарозу по сосудистым путям растения
Растения должны снабжать свои различные ткани углеводами, которые они производят в процессе фотосинтеза в листьях. Однако у них нет мускульного насоса, подобного человеческому сердцу, который помогал бы транспортировать это жизненно важное топливо.Вместо этого они используют для этой цели белки-помпы в своих клеточных мембранах. Вместе с коллегами из Института науки Карнеги в Калифорнии Алисдер Ферни из Института молекулярной физиологии растений им. Макса Планка в Потсдаме идентифицировал неизвестный до сих пор белок в транспортной цепи углеводов. Открытие исследователей может помочь защитить растения от вредителей и повысить урожайность.
Макса Планка в Потсдаме идентифицировал неизвестный до сих пор белок в транспортной цепи углеводов. Открытие исследователей может помочь защитить растения от вредителей и повысить урожайность.
Сосудистые пути, состоящие из взаимосвязанных клеток, действуют как система транспортировки углеводов в растениях.Флоэма, ткань, несущая питательные вещества, состоит, среди прочего, из собственно проводящих клеток, которые также известны как ситовые элементы, а также из окружающих клеток-компаньонов и паренхимных клеток флоэмы. Углеводы в основном транспортируются во флоэме в виде сахарозы. Клеточная мембрана ситовых клеток содержит белки-помпы, которые активно переносят сахарозу в сосудистые пути. До сих пор было неясно, как сахароза перемещалась от клеток паренхимы к транспортным насосам, элементам сита.Таким образом, информация о важном элементе транспортной цепочки отсутствовала.
При участии Института молекулярной физиологии Макса Планка исследовательской группе Научного института Карнеги в Стэнфорде, США, удалось идентифицировать этот ранее неизвестный переносчик сахарозы. Здесь задействованы различные белки, которые принадлежат к недавно идентифицированному семейству белков, известному как SWEET. СЛАДКИ возникают в клеточной мембране клеток паренхимы флоэмы.Они действуют как молекулярные насосы, которые транспортируют сахарозу из клеток паренхимы и направляют ее во вторую транспортную систему, идентифицированную группой 20 лет назад, которая подает сахарозу в фактические проводящие клетки флоэмы.
Здесь задействованы различные белки, которые принадлежат к недавно идентифицированному семейству белков, известному как SWEET. СЛАДКИ возникают в клеточной мембране клеток паренхимы флоэмы.Они действуют как молекулярные насосы, которые транспортируют сахарозу из клеток паренхимы и направляют ее во вторую транспортную систему, идентифицированную группой 20 лет назад, которая подает сахарозу в фактические проводящие клетки флоэмы.
В своих исследованиях исследователи изучили транспорт сахарозы в кресс-салате, Arabidopsis thaliana , и в растениях риса. Чтобы отследить функцию белков SWEET, они отключили соответствующие гены в ряде растений.Это позволило им обнаружить, что когда их СЛАДОСТИ не работают, растения имеют значительно более высокое содержание сахарозы в листьях. «Поскольку сахар не переносится, он накапливается в тканях листьев, а другие части растения, такие как корни и семена, не получают достаточного количества сахарозы», — объясняет Алисдер Ферни из Потсдамского института Макса Планка. .
.
Это открытие представляет собой важный шаг в развитии селекции растений, поскольку во многих случаях части растений, используемые человеком, такие как семена и клубни, сами не образуют углеводов, а вместо этого поставляются листьями.«Теперь мы можем точно регулировать эти молекулярные насосы и тем самым увеличить транспорт сахарозы к семенам растений. Когда-нибудь таким образом можно будет повысить урожайность сельскохозяйственных культур », — объясняет Вольф Фроммер из Института Карнеги. Более того, СЛАДОСТИ представляют собой многообещающую отправную точку для защиты растений от заражения вредителями. Некоторые вредители, например бактерия Xanthomonas oryzae , вызывающая появление полос на листьях риса, неправильно используют эти переносчики для доступа к сахарозе растения и сами питаются ею.По этой причине теперь ученые хотели бы более подробно прояснить роль этих переносчиков в заражении вредителями.
Более того, исследователи подозревают, что соответствующие белки насоса имеют схожую функцию у людей и животных. Если это подтвердится, это станет очень важным открытием для исследований диабета и ожирения, поскольку идентичность белка, ответственного за транспорт углеводов из кишечника в кровь и из клеток печени, еще не известна.
Если это подтвердится, это станет очень важным открытием для исследований диабета и ожирения, поскольку идентичность белка, ответственного за транспорт углеводов из кишечника в кровь и из клеток печени, еще не известна.
CS / EM / HR
Углеводно-активные ферменты в питии и их роль в клеточной стенке растений и деградации полисахаридов при хранении
Филогенетические отношения изученных видов
Байесовский филогенетический анализ, основанный на гене 28S рРНК 11 Stramenopiles, привел к появлению клады диатомей и оомицетов (рис. 1). У оомицетов вид Phytophthora были организованы в монофилетическую кладу, имеющую га в качестве сестринской группы. Виды Pythium были разделены на две клады: одна включает Pyve , которая тесно связана с Phytophthora , а другая содержит две субклады, одна из глобозных спорангиальных видов ( Pyus , Pyuu , Pyiw и ). Pyir ), и один с нитчатыми спорангиальными видами ( Pyar и Pyap ) (рис. 1).
1).
Рисунок 1. Филогенетическое дерево видов Stramenopiles и распределение генов CAZy в геномах оомицетов.
Байесовский анализ был выполнен для 300 000 поколений с использованием GTR / гамма-распределенной модели эволюции гена 28S рРНК с инвариантными сайтами. Рядом с каждой веткой показаны байесовские вероятности. Распределение семи семейств генов, предсказанных на основе генома видов оомицетов и связанных с деградацией углеводов, сравнивали с их филогенетическим родством. Семейства генов: GH54 (оранжевый), α-L-арабинофуранозидаза; GH85 (серый), эндо-β-N-ацетилглюкозаминидаза; Gh21 (коричневый) и Gh20 (зеленый), эндоксиланазы; Gh22 (красный), ксилоглюкан-β-1,4-D-эндоглюканаза; CE8 (синий), пектинметилэстераза; и кутиназа в CE5 (пурпурный).Номера копий гена указаны рядом с полосами. Диатомовые водоросли: Phaeodactylum , Phaeodactylum tricornutum ; и Thalassiosira , Thalassiosira pseudonana . Оомицеты: Ha , Hyaloperonospora arabidopsidis ; Phin , Phytophthora infestans ; Phso , Ph. Sojae ; Phra , Ph. Ramorum ; Pyve , Pythium vexans ; Pyus , Py.ultimum var. sporangiiferum ; Pyuu , Py. ultimum var. ultimum ; Pyiw , Py. iwayamai ; Pyir , Py. irregulare ; Pyar , Py. arrhenomanes ; и Pyap , Py. Ашхабад .
Sojae ; Phra , Ph. Ramorum ; Pyve , Pythium vexans ; Pyus , Py.ultimum var. sporangiiferum ; Pyuu , Py. ultimum var. ultimum ; Pyiw , Py. iwayamai ; Pyir , Py. irregulare ; Pyar , Py. arrhenomanes ; и Pyap , Py. Ашхабад .
https://doi.org/10.1371/journal.pone.0072572.g001
Описание CAZyome
На основании нашего анализа CAZyome оомицетов соответствует диапазону от 271 до 395 CAZymes у Pythium spp., С 582 по 653 в Phytophthora spp. и 249 в га (Таблица 1). Ферменты были разделены на суперсемейства с наиболее распространенным GH, за которыми следуют GT, CE, CBM и PL (таблица 1, таблица S1 и рис. S1A). Чтобы проверить надежность нашей аннотации, мы сравнили предсказание CAZyome пяти видов Pythium ( Pyar , Pyir , Pyiw , Pyuu и Pyve ) с их последовательностями транскриптомов (RNA -seq) (Adhikari, et al. сопутствующий документ, PLoS One, этот выпуск) [12]. Транскриптом Pyuu был получен в различных условиях, включая инфекцию растения ( Arabidopsis thaliana ) [12], и все гены CAZyme имели поддержку экспрессии (Таблица S2). Анализ экспрессии других видов не включал инфекцию растений (Adhikari, и др., Сопутствующая статья , PLoS One, этот выпуск), и их соответствующие последовательности покрывали 77,8–80,5% CAZyomes Pythium (Таблица S2).Несмотря на некоторые расхождения из-за разных стратегий аннотации генов, количество ферментов, которое мы предсказали для Phytophthora spp. и Pyuu с использованием нашего метода были аналогичны значениям, указанным ранее [12], [33]. Количество CAZymes не коррелировало с размером генома. Геном Ha (сборка 81,6 Mb) [13] имел наименьшее количество CAZymes, тогда как геномы Pythium (33,9–44,7 Mb) имели в среднем половину числа CAZymes, идентифицированных в трех Phytophthora.
сопутствующий документ, PLoS One, этот выпуск) [12]. Транскриптом Pyuu был получен в различных условиях, включая инфекцию растения ( Arabidopsis thaliana ) [12], и все гены CAZyme имели поддержку экспрессии (Таблица S2). Анализ экспрессии других видов не включал инфекцию растений (Adhikari, и др., Сопутствующая статья , PLoS One, этот выпуск), и их соответствующие последовательности покрывали 77,8–80,5% CAZyomes Pythium (Таблица S2).Несмотря на некоторые расхождения из-за разных стратегий аннотации генов, количество ферментов, которое мы предсказали для Phytophthora spp. и Pyuu с использованием нашего метода были аналогичны значениям, указанным ранее [12], [33]. Количество CAZymes не коррелировало с размером генома. Геном Ha (сборка 81,6 Mb) [13] имел наименьшее количество CAZymes, тогда как геномы Pythium (33,9–44,7 Mb) имели в среднем половину числа CAZymes, идентифицированных в трех Phytophthora. генома (65–240 МБ) [2], [10] (Таблица 1, Таблица S1 и Рис.S1A), что предполагает экспансию генов CAZymes у Phytophthora [33] по сравнению с Pythium spp. (Адхикари, и др., Сопутствующий документ , PLoS One, этот выпуск) и Ha [13].
генома (65–240 МБ) [2], [10] (Таблица 1, Таблица S1 и Рис.S1A), что предполагает экспансию генов CAZymes у Phytophthora [33] по сравнению с Pythium spp. (Адхикари, и др., Сопутствующий документ , PLoS One, этот выпуск) и Ha [13].
Суперсемейства CAZyme были впоследствии классифицированы на семейства на основе структурных особенностей ферментов в соответствии со схемой классификации CAZy [32]. Диапазон из 82–87, 85–88 и 72 семейств CAZyme был аннотирован в геномах Pythium , Phytophthora и Ha соответственно (таблица S1 и рис.S1B), причем большинство семейств являются общими для всех оомицетов, за некоторыми исключениями (Таблица S1). Более многочисленные семейства и семейства CAZyme, оказывающие большее влияние на клеточную стенку растений и деградацию запасов, подробно описаны ниже. Рост Pythium в среде, содержащей избранные источники углерода, подтвердил большинство наших прогнозов.
Разложение полисахаридов растений
Метаболизм целлюлозы.

Целлюлоза состоит из линейной цепи из нескольких β- (1-4) связанных звеньев D-глюкозы и является одним из основных компонентов стенок оомицетов и растительных клеток [24].В Phytophthora целлюлоза также участвует в формировании аппрессориев и, следовательно, в патогенности [42]. Все геномы оомицетов, проанализированные на сегодняшний день, включая семь видов Pythium , исследованных в этом исследовании, имеют от одной до трех копий генов синтазы целлюлозы в семействе GT2, которое связано с синтезом клеточной стенки оомицетов. Однако целлюлолитическая эффективность Pythium spp., , т.е. , способность разлагать целлюлозу из растений, является спорной и неоднородной среди изолятов одного и того же вида [29], [43], [44], [45], [46], [47], [48], [49], [50], [51].По этой причине Pythium spp. когда-то их называли «сахарными грибами», поскольку считалось, что они не могут разрушать сложные структурные полимеры [48], [52].
Целлюлазы подразделяются на эндо-β-1,4-D-глюканазы, целлобиогидролазы (экзоцеллюлазы) и β-1,4-глюкозидазы [38], [53], [54], [55], [56], [57]. Согласно базе данных CAZy [32], восемь семейств GH содержат потенциальные целлюлазы, аннотированные в геномах эукариот. Основываясь на нашем методе, три из них, GH9, Gh55 и Gh58, не были обнаружены в 11 исследованных геномах оомицетов, но GH5, GH6 и GH7, которые кодируют эндоцеллюлазы и целлобиогидролазы, а также Gh2 и Gh4, кодирующие β-глюкозидазы (Таблица S1 и рис.2), присутствовали. Gh2, Gh4 и GH5 были широко представлены во всех геномах оомицетов (таблица S1 и рис. S1B), но поскольку эти семейства имеют члены, способные разрушать различные субстраты [30], [32], [34], [35], [36], [38], необходима последующая характеристика ферментов, чтобы определить, действительно ли они действуют на целлюлозу, кодируют ли только гены GH6 и GH7 целлюлазу. На основании анализа сигналов секреции, трансмембранных доменов и гликозилфосфатидилинозитола мы определили, были ли предсказанные целлюлазы направлены на метаболизм клеточной стенки оомицетов (мембранные целлюлазы) или экспортированы и, вероятно, связаны с деградацией клеточной стенки растений (внеклеточно-направленные целлюлазы).
Согласно базе данных CAZy [32], восемь семейств GH содержат потенциальные целлюлазы, аннотированные в геномах эукариот. Основываясь на нашем методе, три из них, GH9, Gh55 и Gh58, не были обнаружены в 11 исследованных геномах оомицетов, но GH5, GH6 и GH7, которые кодируют эндоцеллюлазы и целлобиогидролазы, а также Gh2 и Gh4, кодирующие β-глюкозидазы (Таблица S1 и рис.2), присутствовали. Gh2, Gh4 и GH5 были широко представлены во всех геномах оомицетов (таблица S1 и рис. S1B), но поскольку эти семейства имеют члены, способные разрушать различные субстраты [30], [32], [34], [35], [36], [38], необходима последующая характеристика ферментов, чтобы определить, действительно ли они действуют на целлюлозу, кодируют ли только гены GH6 и GH7 целлюлазу. На основании анализа сигналов секреции, трансмембранных доменов и гликозилфосфатидилинозитола мы определили, были ли предсказанные целлюлазы направлены на метаболизм клеточной стенки оомицетов (мембранные целлюлазы) или экспортированы и, вероятно, связаны с деградацией клеточной стенки растений (внеклеточно-направленные целлюлазы). (GPI) анкеры (рис.2). Phytophthora spp. в среднем имел больше генов, потенциально связанных с метаболизмом целлюлозы, чем Pythium , в то время как Ha имел наименьшее число (рис. 2 и таблица S1). Некоторые из семейств GH были значительно больше представлены в геномах Phytophthora , что может быть результатом избирательной экспансии этих генов (рис. 3). Основываясь на их предсказанном клеточном расположении, большинство генов, вероятно, связано с метаболизмом клеточной стенки оомицетов.Напротив, количество внеклеточно-направленных экзо- и эндоглюканаз (GH6 и GH7) генов (2-8 копий), которые задействованы в деградации растительной целлюлозы, невелико у всех оомицетов (Рис. 2). Некоторые монооксигеназы, которые, как известно, усиливают распад целлюлозы [58], [59], также были обнаружены в большинстве геномов (Таблица S1), и, несмотря на то, что они не кодируют гликозидазы, они традиционно классифицируются как GH61 в базе данных CAZy [32].
(GPI) анкеры (рис.2). Phytophthora spp. в среднем имел больше генов, потенциально связанных с метаболизмом целлюлозы, чем Pythium , в то время как Ha имел наименьшее число (рис. 2 и таблица S1). Некоторые из семейств GH были значительно больше представлены в геномах Phytophthora , что может быть результатом избирательной экспансии этих генов (рис. 3). Основываясь на их предсказанном клеточном расположении, большинство генов, вероятно, связано с метаболизмом клеточной стенки оомицетов.Напротив, количество внеклеточно-направленных экзо- и эндоглюканаз (GH6 и GH7) генов (2-8 копий), которые задействованы в деградации растительной целлюлозы, невелико у всех оомицетов (Рис. 2). Некоторые монооксигеназы, которые, как известно, усиливают распад целлюлозы [58], [59], также были обнаружены в большинстве геномов (Таблица S1), и, несмотря на то, что они не кодируют гликозидазы, они традиционно классифицируются как GH61 в базе данных CAZy [32].
Рис. 2. Семейства гликозидгидролаз (GH), связанные с метаболизмом целлюлозы.
2. Семейства гликозидгидролаз (GH), связанные с метаболизмом целлюлозы.
Семейства Gh2, Gh4 и GH5 являются кандидатами на целлюлазу, то есть , они могут быть связаны или не иметь отношения к метаболизму целлюлозы. Гены, принадлежащие GH6 и GH7, кодируют ферменты, которые строго связаны с метаболизмом целлюлозы, либо с клеточной стенкой оомицета (прикреплена мембрана), либо с катаболизмом целлюлозы растений (внеклеточно направленный). Аббревиатуры видов указаны на Рисунке 1.
https://doi.org/10.1371/journal.pone.0072572.g002
Рисунок 3.Среднее количество копий некоторых семейств CAZyme-генов в Pythium и Phytophthora , отсортированных по субстрату.
Черная линия соответствует равному количеству копий в Pythium и Phytophthora . На основании теста GLM (логлинейный / Пуассон) указаны все семейства генов, число копий которых значительно больше у Phytophthora , чем у Pythium : ***, ** и * представляют p <0,001, p <0,01 и р <0,05 соответственно.
https://doi.org/10.1371/journal.pone.0072572.g003
Семь видов Pythium инкубировали на чашках MM, содержащих целлюлозу и целлобиозу (таблица 2). Геном Pyar кодирует наибольшее количество внеклеточно-направленных целлюлаз GH6 и GH7 (7) из всех Pythium spp. (Рисунок 2), и его рост в целлобиозе был высоким, но ограниченным в ММ, содержащем целлюлозу в качестве единственного источника углерода (Таблица 2). Фактически, ограниченный рост целлюлозы наблюдался у всех видов Pythium .Эти данные предполагают, что большинство генов, кодирующих целлюлазу, связаны с метаболизмом клеточной стенки оомицетов (рис.2) и что существует ограниченная способность Pythium разлагать целлюлозу (таблица 2), достаточная для облегчения проникновения гиф в стенки клеток растений. недостаточно для полного переваривания растительной целлюлозы как источника углерода [12], [49]. Эти результаты согласуются с наблюдением, что Pythium spp. преимущественно колонизировать молодые корневые ткани, такие как корневые волоски или кончики корней, в которых отсутствуют сложные полимеры [60], [61], [62].
преимущественно колонизировать молодые корневые ткани, такие как корневые волоски или кончики корней, в которых отсутствуют сложные полимеры [60], [61], [62].
Разложение ксилоглюкана.
Ксилоглюкан — наиболее распространенный полисахарид гемицеллюлозы в первичной клеточной стенке незлокачественных растений [24]. Он связан с микрофибриллами целлюлозы и, следовательно, добавляет структурную целостность клеточной стенке [63]. Благодаря природе своей основной цепи эндоглюканазы и β-глюкозидазы, участвующие в деградации целлюлозы, также способны разрушать ксилоглюкан [63]. Однако набор ферментов связан исключительно с деградацией ксилоглюкана.Например, GH74 и Gh39 / GH95, которые связаны с активностью ксилоглюкан-β-1,4-D-эндоглюканазы и α-L-фукозидазы соответственно, нами не были обнаружены в исследованных геномах оомицетов. Отсутствие GH95 в геномах Phytophthora не согласуется с Ospina-Giraldo и соавторами [33], вероятно, из-за различных методов предсказания и аннотации генов, выбранных двумя группами.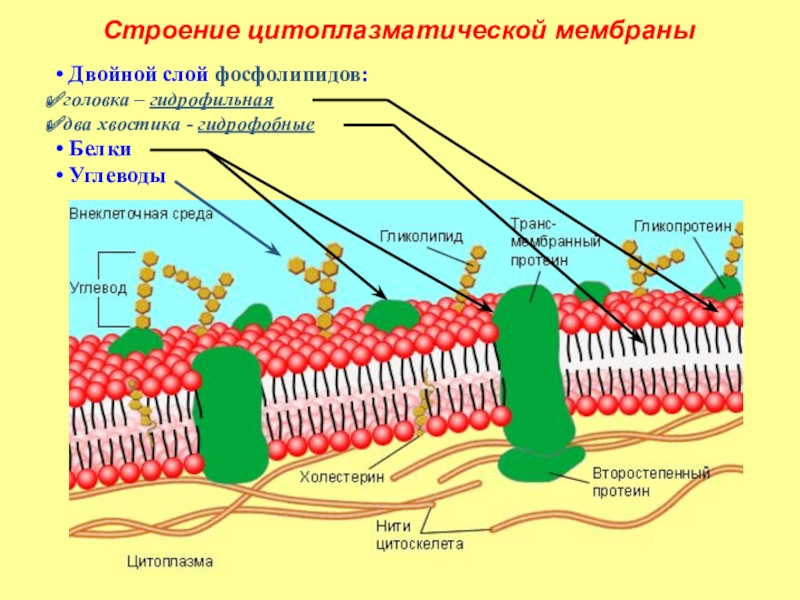 Напротив, мы обнаружили гены ксилоглюкан-β-1,4-D-эндоглюканазы в семействе Gh22 в Ha , Phytophthora spp., и Pyve и Pyar (рис. 1 и таблица S1). Встречаемость этих генов в родоспецифичных кладах (за исключением Ha, 805382) (рис. 4) согласуется с предыдущими сообщениями [13], [64]. Гены Gh41 аннотированы в Pythium spp. (4–6), Phytophthora spp. (5–9) и Ha (3) (Таблица S1) и на основании сходства последовательностей с записями в базе данных Swiss-Prot кодируют как α-D-ксилозидазу, так и α-глюкозидазу [65], [66]. Следовательно, потребуется дальнейшая характеристика ферментов для подтверждения их субстратной специфичности.
Напротив, мы обнаружили гены ксилоглюкан-β-1,4-D-эндоглюканазы в семействе Gh22 в Ha , Phytophthora spp., и Pyve и Pyar (рис. 1 и таблица S1). Встречаемость этих генов в родоспецифичных кладах (за исключением Ha, 805382) (рис. 4) согласуется с предыдущими сообщениями [13], [64]. Гены Gh41 аннотированы в Pythium spp. (4–6), Phytophthora spp. (5–9) и Ha (3) (Таблица S1) и на основании сходства последовательностей с записями в базе данных Swiss-Prot кодируют как α-D-ксилозидазу, так и α-глюкозидазу [65], [66]. Следовательно, потребуется дальнейшая характеристика ферментов для подтверждения их субстратной специфичности.
Рисунок 4. Филогенетические отношения между предсказанными ксилоглюкан-β-1,4-D-эндоглюканазой (Gh22) оомицетов.
Байесовский анализ был проведен для 300 000 поколений с использованием модели эволюции Blosum. Рядом с каждой веткой показаны байесовские вероятности. Эндоглюканаза Aspergillus clavatus (XP_001269687) использовалась в качестве внешней группы. Листья указывают количество локусов предсказанных белков в геномах каждого вида (как показано на рисунке 1).
Листья указывают количество локусов предсказанных белков в геномах каждого вида (как показано на рисунке 1).
https: // doi.org / 10.1371 / journal.pone.0072572.g004
Способность к разложению ксилоглюкана у Pythium spp. кажется ограниченным или полностью отсутствующим [12], [62]. Некоторые из генов Gh22 присутствуют в обследованных Phytophthora spp. геномы у других оомицетов, по-видимому, утрачены (рис. 1), что согласуется с наблюдениями, опубликованными в Baxter et al. [13]. Кроме того, увеличенное количество генов Gh22 в Phytophthora , вероятно, связано с событиями дупликации, как впервые предположили Costanzo et al. [64], более очевиден по сравнению с количеством копий в Pythium (рис. 3 и 4). Разница в количестве может дать большую способность Phytophthora пролиферировать в растительной ткани по сравнению с Pythium [64].
Разложение ксилана.
Ксилан в изобилии присутствует в первичной клеточной стенке злаков и во вторичной клеточной стенке древесных растений, но является второстепенным компонентом первичных клеточных стенок двудольных и незлокачественных однодольных [24]. Разложение ксилана зависит в первую очередь от двух ферментов: эндо-β-1,4-ксиланазы и β-1,4-D-ксилозидазы [63]. Активность ксиланазы была низкой только у Py. sulcatum [29], но ни активность фермента [29], ни гены, связанные исключительно с деградацией ксиланазы, не описаны в Py. ultimum [12]. В наших исследованиях было обнаружено два семейства эндоксиланаз: Gh20 в Ha , Phytophthora spp., Pyve и Pyar ; и единственный экземпляр Gh21 в Pyar и Pyap (рис.1 и таблица S1). Pyve тесно связан с видами Phytophthora [18], а Pyar и Pyap являются частью отдельной клады видов Pythium (рис. 1). Присутствие эндоксиланаз в Pyar и Pyap подтверждает ксиланазную активность, обнаруженную в Py. sulcatum [29], вид, который также является частью нитчатой спорангиальной клады [14], [15].
Разложение ксилана зависит в первую очередь от двух ферментов: эндо-β-1,4-ксиланазы и β-1,4-D-ксилозидазы [63]. Активность ксиланазы была низкой только у Py. sulcatum [29], но ни активность фермента [29], ни гены, связанные исключительно с деградацией ксиланазы, не описаны в Py. ultimum [12]. В наших исследованиях было обнаружено два семейства эндоксиланаз: Gh20 в Ha , Phytophthora spp., Pyve и Pyar ; и единственный экземпляр Gh21 в Pyar и Pyap (рис.1 и таблица S1). Pyve тесно связан с видами Phytophthora [18], а Pyar и Pyap являются частью отдельной клады видов Pythium (рис. 1). Присутствие эндоксиланаз в Pyar и Pyap подтверждает ксиланазную активность, обнаруженную в Py. sulcatum [29], вид, который также является частью нитчатой спорангиальной клады [14], [15].
Филогенетический анализ показал, что эндоксиланазы семейства Gh20 явно отличаются от Gh21 (рис.5). Gh20, вероятно, присутствовал у общего предка Stramenopiles и подвергся расширению в Phytophthora [33] (рис. 3), но был утерян у большинства из видов Pythium и Ha . Напротив, Gh21, скорее всего, был утерян во всех Stramenopiles, но сохранился в Pyar и Pyap , что может быть характеристикой всех нитчатых спорангиальных видов Pythium . Интересно, что ген Gh21 в Pyar и Pyap присутствует в 1.Контиг 5 т.п.н. и каркас 48 т.п.н. соответственно, которые не являются общими с другими геномами Stramenopile.
Рис. 5. Филогенетическая взаимосвязь между предсказанными эндоксиланазами (Gh20 и Gh21) у видов страминипилов.
Байесовский анализ был проведен для 300 000 поколений с использованием модели эволюции Blosum. В качестве внешних групп использовали эндоксиланазу Phaeodactylum tricornutum (XP_002178502) и Thalassiosira pseudonana (XP_0022). Рядом с каждой веткой показаны байесовские вероятности.Листья указывают на предсказанные белки: аббревиатуры видов (как показано на рисунке 1) и номер локуса в соответствующем геноме. Все записи соответствуют эндоксиланазам Gh20, если не представлены как Gh21.
https://doi.org/10.1371/journal.pone.0072572.g005
В целом количество генов эндоксиланаз, присутствующих в геномах оомицетов, было низким по сравнению с прогнозируемым числом (14) у Podospora anserina [38], аскомицет, разлагающий целлюлозу, ксилан и лигнин.Гены семейства Gh4 были многочисленны (Таблица S1) с некоторыми аннотированными как β-1,4-D-ксилозидазы. Однако трудно сделать вывод, основываясь только на анализе in silico , участвуют ли они в метаболизме ксилана или других субстратов [29], [30], [34], [35], [36]. Некоторые гены, кодирующие удаление или модификацию боковой цепи ксилана, принадлежащие семействам углеводных эстераз (CE1, CE2 и CE3), были автоматически обнаружены скрытыми марковскими моделями [41], тогда как другие гены отсутствовали (, например, GH62, GH67 и Gh215) ( Таблица S1).
Анализ
CAZyome, показывающий, что виды Pythium могут быть неэффективными деструкторами ксилана, согласуется с исследованиями роста in vitro , в которых большинство видов имело ограниченный рост в среде, содержащей ксилан (Таблица 2).
(Галакто) (глюко) деградация маннана.
Маннозосодержащие полисахариды состоят из 1,4-β-связанной D-маннановой основной цепи, которая может быть перемежена 1,4-β-связанной D-глюкозой и замещениями 1,6-α-связанной D-галактозил [ 63].Галактоманнаны чаще всего встречаются в семенах бобовых, а глюкоманнаны в изобилии присутствуют во вторичной клеточной стенке древесных растений, тогда как галакто-глюкоманнаны обычно обнаруживаются как в первичных, так и во вторичных клеточных стенках растений и являются основными гемицеллюлозами в древесине голосеменных растений [24], [63], [67]. Геномы оомицетов кодируют несколько генов, связанных с деградацией (галакто) (глюко) маннана (Таблица S1). Согласно базе данных CAZy, семейства Gh3, GH5 и Gh36 включают β-маннозидазу и β-манназу среди других ферментов [32].Гены Gh36 не были обнаружены ни в одном геноме оомицетов, а восемь генов GH5 (одна копия в Pyve и Ha и две копии в Phra , Phso и Phin ) были отнесены к β-маннозидазам после по сравнению с базой данных Swiss-Prot. Напротив, за исключением Ha , все геномы содержали одну копию гена Gh3, кодирующего β-маннозидазу (PTHR10066: SF12) (Таблица S1). В геномах оомицетов не было обнаружено кандидатов в ген α-галактозидазы (Gh37 и Gh46).Основываясь на исследованиях настоящих грибов, небольшое количество генов, обнаруженных в Pythium , может быть достаточным для деградации маннана [38], [68], [69].
Ни один из видов Pythium не рос хорошо в среде, содержащей D-маннозу (таблица 2), но Pyir , Pyuu и Pyus действительно продемонстрировали устойчивый рост на гуаровой камеди (галактоманнан). Соответственно, эти виды постоянно связаны с гнилью семян и усыханием бобовых растений, богатых галактоманнаном [70], [71], [72], [73], [74].Однако мы не обнаружили вариаций в количестве предсказанных генов у Pyir , Pyuu и Pyus (таблица S1), гипотетически задействованных в деградации галактоманнана, по сравнению с другими видами Pythium , что могло бы объяснить их рост. на эти источники углеводов.
Разложение пектина.
Пектины представляют собой сложные гетерополисахариды, которые являются важными компонентами клеточной стенки и средней ламеллы растений [24]. Самый простой тип пектина состоит из основной цепи α-1,4-связанной D-галактуроновой кислоты, которая может быть ацетилирована или метилирована.В других типах пектина каркас представляет собой замены D-ксилозы или прерывается остатками L-рамнозы, к которым могут быть присоединены арабинановые и галактановые цепи [63], [75]. Полигалактуроназы разрушают 1,4-гликозидные связи пектина и пектатов и считаются основной причиной мацерации тканей при заболеваниях мягкой гнилью [46]. В Ph. Infestans полигалактуроназы экспрессировались как на стадии до инфицирования, так и на стадии инфицирования [76], а в Ph. Parasitica экспрессия этого фермента была четко связана с патогенностью [77].Пектиновый каркас по существу разрушен ферментами Gh38, состоящими из экзо- и эндополигалактуроназ и рамногалактуроназ, а также семейств пектинлиаз 1, 3 и 4, которые кодируют пектин / пектатлиазы, пектатлиазы и рамногалактуронанлиазы, соответственно. Все эти семейства присутствовали в геномах Phytophthora [2], [10], [33], и большинство из них также присутствовало в гораздо меньших количествах в Pythium spp. и га (Таблица 1, Таблица S1 и Рис. 6). Напротив, геномы Phytophthora кодируют большинство ферментов, нацеленных на различные остатки и боковые цепи, тогда как в других родах некоторые из этих генов отсутствуют (таблица S1 и рис.6). Гены, кодирующие ненасыщенную рамногалактуронилгидролазу (Gh205) и d-4,5-ненасыщенную β-глюкуронилгидролазу (GH88), участвующие в осахаривании продуктов пектина и пектатлиаз, не были обнаружены ни в одном из геномов Pythium или Ha . тогда как Gh205 присутствовал у всех видов Phytophthora (рис. 6). Pythium spp., В отличие от Phytophthora и Ha , лишены пектин-метилэстеразной активности [29], [43], [45], [46] и, соответственно, гены семейства CE8 были обнаружены в Ha [13] и Phytophthora [33], но не в Pythium (таблица 1, рис.1 и рис.6). Baxter et al. [13] предположил, что некоторые копии генов пектин-метилэстеразы были потеряны в Ha , и мы полагаем, что полная потеря гена произошла у общего предка Pythium . Напротив, эти гены, вероятно, подверглись генной экспансии в Phytophthora spp. Десять семейств CAZy, участвующих в деградации пектина, были значительно более многочисленны в Phytophthora spp. чем в Pythium spp. (Рис. 3), что может указывать на предвзятую дупликацию связанных с пектином генов в геномах видов Phytophthora [2], [10], [33] (Adhikari, et al. сопутствующий документ, PLoS One, этот выпуск).
Рис. 6. Ферменты, разлагающие пектин, у оомицетов.
Столбцы соответствуют одной копии гена, если не указано иное. Семейства генов углеводной эстеразы (CE), пектин / пектатлиазы (PL) и гликозидгидролазы (GH): CE1 = ферулоилэстераза и другие; PL3 = пектатлиаза; PL1 = пектин / пектатлиаза; Gh38 = полигалактуроназа; CE8 = пектинметилэстераза; CE12 = пектинацетилэстераза; Gh53 = эндо-1,5-α-L-арабинозидаза и β-ксилозидаза; CE13 = пектинацетилэстераза; GH53 = эндо-β-1,4-галактаназа; GH78 = α-L-рамнозидаза; PL4 = рамногалактуронанлиаза; Gh45 = β-галактозидаза; GH54 = арабинофурозидаза и β-ксилозидаза; Gh205 = ненасыщенная рамногалактуронилгидролаза.Аббревиатуры видов указаны на Рисунке 1.
https://doi.org/10.1371/journal.pone.0072572.g006
Распад пектина был зарегистрирован у многих видов Pythium [29], [43], [45], [46], [49], [51] и наш анализ генома и исследования использования углерода подтверждают этот вывод (таблица 2). Единственным исключением был Pyiw , слабопатогенный вид, способный расти и паразитировать на растениях при низких температурах. У него было наименьшее количество предсказанных ферментов, разлагающих пектин (таблица S1 и рис.6) и соответственно его рост на среде с пектином был минимальным. Рост Pythium в среде, содержащей моносахариды, обычно присутствующие в боковых цепях пектина или заменах основной цепи (D-галактоза, L-арабиноза, D-ксилоза и L-рамноза), был ограничен (Таблица 2), что подтверждает нашу гипотезу о разложении пектина. важно для Pythium , чтобы получить доступ к растительным клеткам [12], [49], [62], но не для полного осахаривания этого сложного сахара.
Деградация кутина.
Кутин представляет собой полимер гидроксильных жирных кислот, который особенно присутствует на клетках, покрывающих надземные поверхности высших растений [78]. Деградация кутина способствует проникновению в пробуренные корни, листья и ткани стебля [12]. Ранее сообщалось об активности кутиназы у видов Phytophthora [33], [79], [80], [81], Ha [13], Pyap и Pyar [82], но активность незначительна или отсутствует. был обнаружен в Pyuu [29], [82]. В г.infestans , гены кутиназ активируются во время инфекции хозяина, но не было продемонстрировано убедительной связи между патогенностью и активностью кутиназы [83]. Мы идентифицировали гены, кодирующие кутиназу (IPR000675) в семействе CE5 у Ha , Phytophthora spp. И Pyar и Pyap (Таблица 1, Таблица S1 и Рис.1) (Adhikari, et al. сопутствующий документ, PLoS One, этот выпуск), согласующийся с отчетами об активности кутиназ. Кутиназы, присутствующие в Phytophthora spp.и Ha, были сгруппированы в монофилетическую группу, в отличие от кутиназ из Pythium spp. геномы (рис. 7), отражающие полифилетическую природу последней группы [14], [15]. Наш филогенетический анализ (рис. 7) подтверждает экспансию гена, описанную в Phytophthora [83], а также раскрывает ту же закономерность в Pyap и Pyar . Шаровидные спорангиальные виды Pythium , вероятно, потеряли гены кутиназ, в то время как они сохранились у нитевидно-спорангиальных видов, аналогично тому, что наблюдалось с генами Gh21-эндоксиланазы и ксилоглюкан-специфической эндоглюканазы (рис.1).
Рис. 7. Филогенетические отношения между предсказанными кутиназами видов оомицетов.
Гены, кодирующие кутиназу, идентифицированные из Hyaloperonospora arabidopsidis , Phytophthora spp. и Pythium spp. геномы были использованы для филогенетических анализов. Последовательность кутиназы из Frankia sp. EUN1f (ZP_06415970) использовался как внешняя группа. Филогения была выведена с использованием модели эволюции Blosum (300000 поколений) и отображена с помощью веб-сервера Interactive Tree of Life (iTOL) (http: // itol.embl.de/). Один и тот же цвет указывает на кутиназу одного рода, разные оттенки — на разные виды. Аббревиатуры видов указаны на Рисунке 1.
https://doi.org/10.1371/journal.pone.0072572.g007
Распад крахмала, сахарозы и инулина.
Крахмал представляет собой α-1,4-связанный полимер D-глюкозы, который является наиболее важным резервным углеводом у большинства высших растений [84], а инулин, полимер, состоящий в основном из фруктозы с концевой глюкозой, альтернативно используется некоторые растения в корнях и корневищах [85].Сахароза, невосстанавливающий дисахарид α-D-глюкозы и β-D-фруктозы, является основной формой углерода, перемещаемого из фотосинтетических клеток [84].
У оомицетов есть набор ферментов, предназначенных для разложения крахмала, инулина и сахарозы. Гены, кодирующие α-глюкозидазу (Gh41), участвуют в метаболизме как крахмала, так и сахарозы и присутствуют во всех геномах оомицетов (Таблица S1). Гены, кодирующие α-амилазу (Gh23), α-глюкоамилазу (Gh25) и N-концевые крахмалосвязывающие модули (CBM20, 21 и 25), связаны с метаболизмом крахмала и присутствуют в большинстве геномов (Таблица S1).β-фруктозидаза (Gh42), которая может быть связана с катаболизмом сахарозы и инулина, была представлена одной копией во всех геномах Pythium и тремя копиями в Phytophthora spp. и га . Число генов, участвующих в деградации крахмала, сахарозы и инулина (исключая CBM) в Ha (7), Pythium (7–11) и Phytophthora (10–13) spp. (Таблица S1), как правило, ниже, чем у настоящих грибов (11–37) [38]. В то время как виды Phytophthora больше оснащены ферментами, участвующими в деградации сложных углеводов, чем Pythium , большинство генов, участвующих в деградации простых сахаров, равномерно распределены во всех геномах оомицетов (рис.3). Большинство из видов Pythium имели устойчивый рост в крахмале и сахарозе (таблица 2), что делает эти растительные сахариды основным источником углерода для роста.
Метаболизм других полисахаридов
Хитин и метаболизм хитозана.
Количество генов, связанных с метаболизмом хитина или хитосахаридов, в геномах оомицетов ограничено, что согласуется с предыдущими сообщениями [9], [12], [49], [62]. Это согласуется с редкостью хитина в клеточных стенках оомицетов [86] и его отсутствием в клеточных стенках растений.Кодирующие хитиназу гены в семействах Gh28 или Gh29, хитиндеацетилазы (CE4) и N-ацетилглюкозамин-6-фосфатдеацетилазы (CE9) присутствовали в небольшом количестве в CAZyomes оомицетов, но CE9 был обнаружен только у Pythium spp. (Таблица S1). Одна копия GH85, которая кодирует эндо-β-N-ацетилглюкозаминидазу, была аннотирована во всех геномах, кроме Pyap , Pyar и Ha (рис. 1 и таблица S1). Гены, принадлежащие к семействам Gh30 и Gh58, кодирующие β-1,6-N-ацетилглюкозаминидазу и хитиназу, соответственно, отсутствовали.Число генов, кодирующих хитинсинтазу в GT2, варьировалось от одной копии в Ha до 1-2 у видов Pythium и Phytophthora . CBM18 (хитин-связывающие модули) не было идентифицировано (таблица S1). Никаких генов, связанных исключительно с метаболизмом хитозана (Gh56, GH75 и GH80), обнаружено не было. Было бы интересно сравнить количество генов, связанных с хитином, в геномах микопаразита Py. oligandrum и мясоед Py. Козловой .
метаболизм β-1,3 и β-1,6 глюканов.
Каллоза, полисахарид, состоящий из β-1,3-связанных глюканов, синтезируется в растениях только во время цитокинеза, развития пыльцы и в ответ на стресс [87]. Однако основная масса стенок гиф оомицетов состоит из β-1,3- и β-1,6-глюканов [88]. Миколаминаран, полисахаридная форма хранения у оомицетов, также состоит из цепей β-1,3-глюкана [89]. Все геномы содержат множественные копии эндо-1,3-β-глюканазы и глюкан-1,3-β-глюкозидазы в пределах семейств Gh26 и Gh27 (таблица S1 и рис.3). β-1,3-глюканозилтрансгликозилазы (GH72) и (эндо) β-1,3-глюканазы (GH81), которые связаны с модификацией и перекрестным связыванием линейных β-1,3-глюканов, также широко распространены ( Таблица S1 и рис. 3). Точно так же геномы оомицетов богаты генами, кодирующими 1,3-β-глюкансинтазу (GT48) (7-13 копий) (таблица S1), что согласуется с гипотезой о том, что большинство генов этого класса связано с клеткой оомицета. метаболизм в стенке или накопление углеводов, а не разложение растительного β-1,3-глюкана.Гены Gh40 могут быть связаны с метаболизмом β-1,6-глюканаз, глюкозилцерамидазы, β-ксилозидазы и других [90], и это семейство было широко распространено во всех геномах оомицетов (Таблица S1), особенно в Phytophthora spp. (Рис. 3). Параллельный анализ показал, что некоторые семейства, связанные с метаболизмом β-1,3 и β-1,6 глюканов, были либо обогащены специфическим набором генов Pythium или Pythium — Phytophthora , либо были истощены в геномах фотосинтезирующих Stramenopiles, при сравнении генного арсенала оомицетов и диатомовых водорослей (Adhikari, et al. сопутствующий документ, PLoS One, этот выпуск).
Какие технологические растения используются для производства углеводов? | Home Guides
Автор: SF Gate Contributor Обновлено 2 декабря 2020 г.
Зеленые растения сами создают углеводы в процессе фотосинтеза. Функция углеводов в растениях и животных заключается в том, что они являются источником топлива для роста. Если хотя бы один базовый ингредиент, необходимый растению для фотосинтеза, отсутствует или отсутствует, здоровье растения может пострадать, что приведет к задержке роста или снижению продуктивности.Садовник, который обеспечивает растение водой и светом в количестве, необходимом для производства продуктов питания, получает в награду здоровое растение.
Tip
Растения используют процесс фотосинтеза для создания углеводов.
Листья, которые дышат
Люди вдыхают кислород и углекислый газ, но для того, чтобы растение вырабатывало углеводы, листья поглощают углекислый газ через устьица на поверхности листьев. Из устьиц клетки мезофилла используют углекислый газ, чтобы объединить его с водой и светом для фотосинтеза.После того, как растение использует углекислый газ в фотосинтезе, продуктом жизнедеятельности является кислород, который выделяется через устьица на листьях.
Транспирация воды от корней
Чтобы вода двигалась против силы тяжести вверх по растению от корней, растение использует транспирацию, то есть испарение воды через устьица на листьях. В этом процессе используется до 90 процентов воды растения, из которых менее 10 процентов остается для фотосинтеза и роста.
Солнечный свет в фотосинтезе
Электроны, высвобождающиеся при разрыве этих связей, отправляются в клеточный процесс, называемый цепочкой переноса электронов. Эта система образует АТФ, который представляет собой тип энергетической молекулы, необходимой клетке для соединения водорода из воды, углерода и кислорода из диоксида углерода для производства глюкозы.
Фотосинтез создает углеводы
Фотосинтез требует солнечного света, углекислого газа и воды для производства глюкозы.Этот простой сахар представляет собой углевод, который в сочетании с другими сахарами формирует структуру растения и сохраняет энергию для использования в будущем.
Глюкоза, образующаяся в результате фотосинтеза, течет к остальной части растения через флоэму, которая представляет собой небольшие трубочки, проходящие по всему растению. Растение хранит излишки углеводов в кроне и корнях, где они будут оставаться до тех пор, пока они не потребуются растению в темное время суток или зимой, когда лиственным деревьям не хватает листьев для производства большего количества пищи посредством фотосинтеза.
Использование и хранение углеводов
Помимо использования сложных углеводов для создания структуры растения, растения накапливают углеводы или используют их для получения энергии для роста. Чтобы использовать накопленные углеводы, растения берут глюкозу, образовавшуюся во время фотосинтеза, и объединяют углевод с кислородом — процесс, называемый дыханием, — для высвобождения энергии. В отличие от фотосинтеза, который происходит только в зеленых частях растения, дыхание происходит во всех живых тканях, включая подземные корни.
Влияние накопления углеводов на фотосинтез различается между раковыми и исходными листьями Phaseolus vulgaris L. | Физиология растений и клетки
Абстрактные
Накопление неструктурных углеводов в листьях подавляет фотосинтез. Тем не менее, степень подавления должна быть разной для сливных листьев (потребители сахара) и исходных листьев (экспортеры сахара). Мы исследовали влияние накопления углеводов на фотосинтез в первичных листьях фасоли ( Phaseolus vulgaris L.) во время раскрытия листа. Чтобы увеличить содержание углеводов в листьях, мы подавали корням 20 мМ раствор сахарозы на 5 дней (обработка сахаром). В качестве контроля использовали растения, снабженные только водой и питательными веществами. Содержание углеводов, которые представляют собой сумму глюкозы, сахарозы и крахмала, в листьях, обработанных сахаром, было в 1,5–3 раза выше, чем в контрольных листьях на всех стадиях развития. В молодых сливных листьях скорость фотосинтеза при насыщающем свете и при окружающей концентрации CO 2 (A 360 ) не различалась между обработанными сахаром и контрольными листьями.A 360 исходных листьев, обработанных сахаром, постепенно уменьшалось по сравнению с контрольными исходными листьями с расширением листа. Начальный наклон кривой A – C i (концентрация CO 2 в межклеточном пространстве) и содержание Рубиско (рибулозо-1,5-бисфосфаткарбоксилаза / оксигеназа) на площадь листа показали тенденции, аналогичные таковым для A 360 . Различия в A max между видами лечения были немного меньше, чем в A 360 . Эти результаты показывают, что влияние накопления углеводов на фотосинтез является значительным в исходных листьях, но не в молодых тонких листьях, и что снижение содержания Rubisco было основной причиной угнетения фотосинтеза углеводами.
Введение
Накопление неструктурных углеводов в листьях часто подавляет фотосинтез (Krapp et al. 1991, Krapp and Stitt 1995, Jeannette et al. 2000). Было предложено три механизма углеводного подавления фотосинтеза.
Накопление углеводов в листьях часто вызывает подавление синтеза сахарозы по обратной связи и накопление фосфатов сахара в цитозоле. Накопление сахарных фосфатов снижает концентрацию ортофосфата в цитозоле и тем самым подавляет антипорт триозофосфата / ортофосфата через хлоропластную оболочку (Stitt and Quick 1989).Низкая доступность ортофосфата в строме подавляет синтез АТФ и восстановление PGA (фосфоглицериновой кислоты) до триозофосфата и тем самым фотосинтез (Stitt 1986, Sharkey and Vanderveer 1989). Ограниченный фосфатами фотосинтез наиболее вероятен при насыщающих концентрациях CO 2 (Sharkey 1985). Низкие концентрации ортофосфата в строме могут также снизить состояние активации рибулозо-1,5-бисфосфаткарбоксилазы / оксигеназы (Rubisco) (Sawada et al. 1992). Однако некоторые мутанты Arabidopsis thaliana с нарушенным синтезом сахарозы не проявляли признаков снижения фотосинтеза из-за истощения ортофосфатов, хотя они накапливали фосфорилированные промежуточные соединения (Strand et al.2000, Чен и др. 2005). Таким образом, ограничение фосфата не всегда происходит в ответ на ингибирование синтеза сахарозы.
Нафцигер и Коллер (1976) заявили, что накопление крахмала в хлоропластах вызывает деформацию хлоропластов и тем самым снижает проводимость диффузии CO 2 из межклеточного пространства к каталитическому центру Рубиско (g i ). Накано и др. (2000) также предположили, что само накопление крахмала, а не снижение количества фотосинтетических ферментов, вызывает подавление фотосинтеза в листьях растений фасоли с удаленными стручками.
Экспрессия фотосинтетических генов подавляется растворимыми сахарами, которые в конечном итоге подавляют фотосинтез (Sheen 1990, Pego et al. 2000). Длительное культивирование растений при повышенном CO 2 увеличивает уровень углеводов в листьях многих растений, и часто сообщается, что экспрессия фотосинтетических генов подавляется (Nie et al. 1995, Miller et al. 1997, Chang и др. 1998).
Углеводное подавление фотосинтеза, однако, редко исследовалось в отношении стадий развития листа, хотя метаболическая роль углеводов резко меняется в зависимости от стадий развития листа.Молодые листья-приемники импортируют углеводы для построения своих фотосинтетических систем, в то время как зрелые листья-источники с высокой фотосинтетической активностью экспортируют фотосинтаты в органы-приемники. В одном из таких исследований Krapp et al. (1991) вводили 50 мМ раствор глюкозы для поглощения и получения листьев шпината из их черешков через поток транспирации. Скорость фотосинтеза на площадь листа исходных листьев, получавших глюкозу, составляла 30% от таковой у контрольных листьев источника, в то время как скорость фотосинтеза сливных листьев, получавших питание глюкозой, не отличалась от таковой у контрольных сливных листьев.Результаты показывают, что эффект накопления углеводов на фотосинтез различается для стоковых и исходных листьев.
В настоящем исследовании мы исследовали влияние накопления углеводов на фотосинтез в листьях фасоли ( Phaseolus vulgaris L.) на различных стадиях развития во время разрастания листьев. Переход «сток-источник» в первичных листьях фасоли был исследован ранее (Miyazawa et al. 2003), и этот переход произошел, когда площадь листа составляла около 40% от полностью развернутой площади листа.Мы скармливали горшечным растениям с первичными листьями на различных стадиях развития раствор сахарозы, чтобы увеличить содержание углеводов в листьях, и сравнили фотосинтетические свойства обработанных сахаром и контрольных листьев. Отдельно оценивали влияние на способность к регенерации рибулозо-1,5-бисфосфата (RuBP) и на способность к карбоксилированию RuBP. Чтобы определить механизмы, ответственные за снижение этих возможностей, мы исследовали фотосинтетические параметры, включая содержание ортофосфата, g и и содержание Рубиско в связи с тремя потенциальными механизмами, упомянутыми выше.На основании этих результатов обсуждается важность репрессии фотосинтеза, зависящей от стадии развития.
Результаты
Мы обозначили день начала всасывания семян фасоли как день 0 (рис. 1). Молодые растения фасоли высаживали в вермикулит на 4-е сутки и поливали каждый день. Раствор Хогланда половинной концентрации подавали каждый день, начиная с 7-го дня. Первичные листья появлялись на 7–9-й день и полностью разрастались на 23-й день. Согласно Miyazawa et al.(2003), переход «сток-источник» первичных листьев одних и тех же растений фасоли произошел, когда площадь листа достигла 40% от полностью развернутой площади. В настоящем исследовании площадь листьев достигла 40% примерно на 10-й день. Суточный чистый фотосинтез, рассчитанный из скорости темнового дыхания и скорости фотосинтеза при росте плотности потока фотосинтетических фотонов (PPFD) 300 мкмоль м -2 с — 1 и CO 2 концентрация 360 мкмоль моль -1 постепенно увеличивалась по мере развития листьев и стала положительной примерно на 10 день (данные не показаны).Мы подавали 50 мл 20 мМ раствора сахарозы в горшок каждый день в течение 5 дней перед измерением фотосинтеза и взятием образцов. Мы называем это лечение «сахарным лечением». Листья, собранные на 12-й день, обрабатывали раствором сахарозы в течение 5 дней, когда листья находились в основном в фазе опускания. С расширением листьев период обработки сахаром сместился от фазы поглощения к фазе источника, и мы смогли увидеть влияние обработки сахаром на фотосинтетические свойства листьев на различных стадиях с точки зрения перехода от стока к источнику.
Содержание углеводов
Изменения содержания углеводов на площадь листа по мере развития листа показаны на рис. 2. Мы отбирали образцы листьев ближе к концу дня. Таким образом, содержание углеводов на рис. 2 можно рассматривать как максимальные значения в пределах суточного цикла. Содержание глюкозы в контрольных листьях было высоким, когда листья были молодыми, и постепенно снижалось по мере развития листьев (рис. 2А). Напротив, содержание глюкозы в листьях, обработанных сахаром, снизилось лишь незначительно.Содержание глюкозы в листьях, обработанных сахаром, было выше, чем в контрольных листьях, но различия на 12 день были небольшими. Различия между обработками на 14-й и 16-й дни были статистически значимыми.
Содержание сахарозы в листьях, обработанных сахаром, было выше, чем в контрольных листьях на любой стадии (рис. 2B). Разница в содержании сахарозы между контрольными листьями и листьями, обработанными сахаром, была относительно небольшой на 12-й день и увеличивалась по мере развития листьев.
Содержание крахмала было относительно низким на 12 и 14 дни как в листьях, обработанных сахаром, так и в контрольных листьях, и увеличивалось с увеличением листьев (рис. 2С). Содержание крахмала в листьях, обработанных сахаром, было в 1,5–3 раза выше, чем в контрольных листьях. Общее содержание углеводов, сумма содержания глюкозы, сахарозы и крахмала, также показало тенденции, аналогичные содержанию крахмала (рис. 2D).
Масса листа на единицу площади (LMA)
В контрольных листьях LMA была почти постоянной на протяжении всех экспериментальных периодов (таблица 1).LMA не различалась между обработками на 12 или 14 день. LMA обработанных сахаром листьев была немного выше, чем LMA контрольных листьев на 16, 18 и 20 сутки. Увеличение LMA в листьях, обработанных сахаром. в основном объясняется увеличением содержания углеводов (рис. 2D).
Фотосинтез
Изменения скорости фотосинтеза на единицу площади листа при PPFD 1000 мкмоль м –2 с –1 и при концентрации CO 2 в окружающей среде (C a ) 360 мкмоль моль –1 (A 360 ) показаны на рис.3А. A 360 постепенно уменьшался по мере развития. A 360 не отличался между обработанными сахаром и контрольными листьями на 12 день, но был ниже в листьях, обработанных сахаром, чем в контрольных листьях в другие дни. Разница в A 360 между обработками постепенно увеличивалась с расширением листа, и различия были статистически значимыми на 18 и 20 дни. Начальный наклон A – C i (концентрация CO 2 в межклеточном пространстве) Кривая, показывающая способность карбоксилирования Rubisco in vivo, показала тенденцию, аналогичную таковой для A 360 (рис.3Б).
В качестве индикатора регенерационной способности RuBP in vivo мы измерили скорость фотосинтеза при 1000 мкмоль фотона m –2 с –1 и при насыщении C a 1500 мкмоль моль –1 (A макс ) (Рис. 3C). Значение A max для контрольных листьев было почти постоянным после 14-го дня. Напротив, значение A max для листьев, обработанных сахаром, постепенно снижалось, а значения A max для листьев, обработанных сахаром, были значительно ниже, чем для листьев, обработанных сахаром. контроль уходит на 18 и 20 сутки.
Содержание хлорофилла и флуоресценция хлорофилла
Содержание
Хл на площадь листа уменьшалось по мере развития листа, а соотношение Хл a / b не изменялось в течение экспериментальных периодов (Таблица 1). Не было различий в содержании Chl и соотношении a / b между обработками, за исключением отношения Chl a / b на 20 день. Максимальный квантовый выход ФСII (F v / F m ), измеренный сразу после предварительной обработки в темноте в течение 20 минут при C , , равный 360 мкмоль моль -1 , не изменился во время развития листа (Таблица 1).Хотя значения F v / F m в листьях, обработанных сахаром, были немного выше, чем у контрольных листьев, они не различались статистически между обработками.
Большая субъединица Рубиско (LSU) и светособирающий Chl-связывающий белок PSII (LHCII), содержание
Изменения в Rubisco LSU и содержании LHCII на площадь листа показаны на рис. 4. Содержание Rubisco LSU уменьшалось по мере развития листа (рис. 4A). Уменьшение содержания LSU Rubisco продемонстрировало тенденцию, аналогичную таковой для A 360 , и начальный наклон кривой A – C i (рис.3A, B), хотя уменьшение содержания LSU Rubisco было немного быстрее, чем уменьшение A 360 и начального наклона. В то время как содержание Rubisco LSU не отличалось между обработанными сахаром и контрольными листьями на 12-й день, содержание Rubisco LSU в обработанных сахаром листьях было ниже, чем в контрольных листьях после 14-го дня. возраст листьев. Содержание LHCII также снижалось по мере развития листа (рис. 4B). Не было различий в содержании LHCII между обработками.
Содержание азота и углерода
Содержание азота в листьях, обработанных сахаром, было немного ниже, чем в контрольных листьях, на 12 день, и разница между обработками увеличивалась по мере развития листьев (Таблица 1). Содержание углерода показало тенденцию, аналогичную тенденции LMA (данные не показаны). Отношение азота / углерода (N / C) в листьях, обработанных сахаром, всегда было ниже, чем в контрольных листьях, и различия между обработками были больше на более поздних стадиях развития листа.
Содержание ортофосфатов
Содержание ортофосфатов постепенно увеличивалось по мере развития листьев (рис. 5А). На 12-й день содержание ортофосфатов не различалось между обработками. Напротив, содержание ортофосфата в листьях, обработанных сахаром, было немного ниже, чем в контрольных листьях после 14 дня, и разница между обработками постепенно увеличивалась по мере развития листьев.
Внутренняя проводимость для CO
2 диффузия
Изменения внутренней проводимости для диффузии CO 2 из межклеточного пространства в каталитический центр Рубиско, g i , с развитием листьев показаны на рис.5Б. g i контрольных листьев постепенно отмирают по мере развития листьев. Напротив, g i листьев, обработанных сахаром, на 12-й день было немного выше, чем в другие дни. С 14 дня содержание g – в листьях, обработанных сахаром, было почти постоянным.
Обсуждение
В настоящем исследовании мы разделяем раскрытие листа на три стадии. Листья, исследованные на 12-й день, обрабатывали сахаром, когда они находились в основном в фазе опускания, и поэтому называются «опускающимися листьями» (см. Первый абзац результатов; см. Также Miyazawa et al.2003 г.). Листья, исследованные на 14-й день, обрабатывались, когда они находились в состоянии перехода сток-источник, и поэтому называются «переходными листьями». Листья, исследованные после 16-го дня, называются «исходными листьями».
Хотя содержание углеводов в обработанных сахаром сливных листьях, исследованных на 12 день, было примерно в два раза выше, чем в контрольных сливных листьях (рис. 2D), обработка сахаром не повлияла на скорость фотосинтеза (рис. 3). Однако содержание углеводов даже в листьях, обработанных сахаром, было ниже, чем в переходных и исходных листьях.Таким образом, вполне вероятно, что уровень углеводов в опускных листьях был ниже порога, который вызывает влияние сахара на фотосинтез. Низкая скорость фотосинтеза и высокая скорость дыхания при росте опадающих листьев, особенно до 10 дня (данные не показаны), будут поддерживать низкое содержание углеводов в первичных листьях. В отдельных экспериментах мы загружали в горшки раствор сахарозы в концентрации 60 или 120 мМ. Однако общее содержание углеводов в таких «тонких» первичных листьях существенно не отличалось от содержания в растении, получавшем 20 мМ раствор сахарозы.Подкормка более высоких концентраций раствора сахарозы также вызвала сморщивание первичных листьев. Таким образом, мы использовали раствор 20 мМ. В исследовании Krapp et al. (1991), сливные листья, получавшие сахарную подкормку, также содержали меньше углеводов, чем исходные листья, подкормленные сахаром. За исключением чрезмерного количества растворимых сахаров, которое использовалось в некоторых исследованиях (Jang and Sheen 1997), углеводы не накапливались до уровней, достаточных для того, чтобы вызвать сахарную репрессию фотосинтеза в сливных листьях.
Однако в сливных листьях уровни глюкозы, которые подавляют фотосинтетические гены (Jang and Sheen 1997), были самыми высокими в экспериментальные периоды. Таким образом, также вероятно, что глюкозная репрессия фотосинтетических генов не происходит в сливных листьях.
В переходных листьях содержание растворимого сахара было увеличено обработкой сахаром, хотя содержание крахмала в листьях не увеличилось заметно. А 360 переходных листьев, обработанных сахаром, был немного ниже, чем у контрольных переходных листьев (рис.3А). Начальный наклон кривой A – C i также уменьшился на листьях, обработанных сахаром, но на A max обработка сахаром не повлияла (рис. 3B, C). Таким образом, снижение A 360 было приписано уменьшению начального наклона кривой A – C i , которая отражает способность листа к карбоксилированию RuBP, но не Amax.
Начальный наклон кривых A – C и , который отражает способность Рубиско карбоксилировать RuBP (Farquhar et al.1980), в основном определяется содержанием и свойствами Рубиско и г и . Однако в переходных листьях накопление крахмала, которое, как считается, вызывает снижение g — (Nafziger and Koller, 1976), не было отмечено. Более того, g и переходных листьев, обработанных сахаром, было даже немного больше, чем у контрольных листьев (фиг. 5B). Таким образом, снижения g и с накоплением крахмала в переходных листьях не произошло.
С другой стороны, содержание Rubisco LSU в обработанных сахаром переходных листьях немного снизилось (рис. 4A). Таким образом, уменьшение начального наклона кривой A – C i в переходных листьях, обработанных сахаром, в основном объясняется меньшим количеством Рубиско. Уменьшение содержания Rubisco, вероятно, было связано с подавлением сахаром экспрессии генов Rubisco (Koch 1996). В рисе белок Rubisco в основном синтезируется во время разрастания листьев (Mae et al. 1983).Таким образом, снижение содержания рубиско в переходных листьях, обработанных сахаром, вероятно, вызвано снижением синтеза рубиско de novo. Содержание азота в листьях, обработанных сахаром, также несколько снизилось на переходной стадии (Таблица 1). Это снижение содержания азота может быть частично связано с уменьшением содержания Rubisco (рис. 4A). Поскольку содержание Chl, соотношение Chl a / b или содержание LHCII не различались между обработками (таблица 1, рис. 4B), содержание белков Chl, вероятно, не реагировало на обработку сахаром.Таким образом, снижение содержания азота в листьях, обработанных сахаром, не привело к общему снижению содержания белка.
В исходных листьях содержание растворимого сахара и крахмала было увеличено обработкой сахаром (рис. 2). Это увеличение также влияет на LMA обработанных сахаром листьев (Таблица 1). A 360 исходных листьев, обработанных сахаром, был ниже, чем у контрольных листьев (фиг. 3A). Уменьшение A 360 будет связано с уменьшением как способности карбоксилирования, так и регенерации RuBP, поскольку уменьшились как A max , так и индикатор регенерационной способности RuBP, и начальный наклон кривой A – C i . в листьях, обработанных сахаром (рис.3Б, В). Кроме того, анализ A – C и показал, что A 360 был ограничен карбоксилированием и регенерацией RuBP (данные не показаны). Содержание Rubisco в исходных листьях было уменьшено обработкой сахаром (фиг. 4A). Напротив, g и исходных листьев не были затронуты сахарной обработкой (фиг. 5B), хотя крахмал заметно накапливался в обработанных сахаром листьях. Таким образом, как и в случае с переходными листьями, снижение способности карбоксилирования RuBP может быть результатом сахарной репрессии фотосинтетических генов из-за накопления растворимого сахара.Снижение g и с накоплением крахмала не было очевидным в этом исследовании.
A max был уменьшен обработкой сахаром только исходных листьев (рис. 3C). Кроме того, заметное и значительное накопление крахмала наблюдалось только в исходных листьях (рис. 2С). Эти результаты предполагают возможность того, что накопление крахмала снижает A max , хотя крахмал сам по себе является твердым и биохимически неактивным. Связь между накоплением крахмала и снижением A max неясна, но глюкоза, которая влияет на экспрессию фотосинтетических генов через гексокиназу (Jang and Sheen 1997), генерируется деградацией крахмала в ночное время.Предполагается, что это образование глюкозы при деградации крахмала влияет на уровень экспрессии фотосинтетических генов (Chang et al. 1998). Кроме того, компоненты фотосинтетической цепи переноса электронов, которые влияют на A max , более стабильны, чем Rubisco в стареющих листьях (Hidema et al. 1991, Mae et al. 1993). Стабильность частично объясняет тот факт, что значительное снижение A max происходит только в исходных листьях.
Считается, что max ограничивается скоростью фотосинтетического транспорта электронов.На содержание Chl, соотношение Chl a / b и LHCII не влияла сахарная обработка исходных листьев (таблица 1, рис. 4B). Таким образом, накопление углеводов не повлияет на содержание белка Chl. F v / F m , который представляет активность PSII, также не изменился при обработке сахаром. Эти результаты предполагают, что снижение количества или активности других компонентов цепи переноса электронов, таких как пластоцианин (Dijkwel et al.1996) и H + -АТФаза (Krapp et al. 1993) вызваны накоплением углеводов. Известно, что ген LHCII ( cab ) подавляется растворимыми сахарами (Dijkwel et al. 1996), но в настоящем исследовании эффект не наблюдался. Некоторые исследования показали, что на содержание белка LHCII мало влияет уровень мРНК гена cab (Flachmann and Kühlbrandt 1995).
Содержание ортофосфатов в листьях, которое также влияет на скорость фотосинтеза при насыщенной концентрации CO 2 , немного снизилось из-за обработки сахаром (рис.5А). Однако содержание ортофосфатов в листьях увеличивалось по мере развития листьев. Таким образом, ортофосфат не будет истощен, по крайней мере, в исходных листьях, и низкий уровень содержания ортофосфата в исходных листьях, обработанных сахаром, не может полностью объяснить снижение A max . Кроме того, поскольку ортофосфат высвобождается при синтезе крахмала (Stitt et al. 1990), чрезмерное накопление крахмала из-за обработки сахаром (рис. 2C) может вызвать значительное высвобождение ортофосфата.Следовательно, наиболее вероятно, что содержание ортофосфата не будет истощено в хлоропластах в данном эксперименте.
В настоящем исследовании мы продемонстрировали, что поступление сахарозы в корни бобов влияет на фотосинтез в исходных листьях, но не в опорных листьях. Наиболее вероятно, что накопление растворимых сахаров в обработанных сахаром листьях на переходной и исходной стадии привело к снижению содержания Rubisco в листьях.
Материалы и методы
Растительный материал
Семена P.vulgaris L. cv. Ямаширо-Куросандо пропитывали влажной бумагой в течение 4 дней перед посевом. Первый день всасывания семян был назван днем 0. На 4 день проросшие сеянцы высаживали в вермикулит в горшки диаметром 12,7 см (шесть сеянцев на горшок) и поливали каждый день. На 10-й день прореживали пять из них. Растения выращивали в помещении с регулируемым освещением и флуоресцентным освещением (FPL36EX-W, Matsushita Electric Industrial Co. Ltd, Кадома, Япония) при PPFD 300 мкмоль м –2 с –1 в течение светового периода 14 ч (6: 00–20: 00 ч), относительной влажности 50–70% и температуре воздуха 25 ° C.Начиная с 7-го дня, растения удобряли каждый день 50 мл раствора Хогланда половинной концентрации, содержащего 2 мМ KNO 3 , 2 мМ Ca (NO 3 ) 2 , 0,75 мМ MgSO 4 , 0,665 мМ NaHPO. 4 , 25 мкМ Fe-EDTA, 5 мкМ ZnSO 4 , 0,5 мкМ CuSO 4 , 0,25 мкМ NaMoO 4 , 50 мкМ NaCl и 0,1 мкМ CoSO 4 .
Сахарная обработка
Чтобы увеличить содержание углеводов в первичном листе, мы подавали 50 мл 20 мМ раствора сахарозы к корням фасоли каждый день в течение 5 дней, начиная с 7, 9, 11, 13 и 15 дней (рис.1). Раствор сахарозы подавали между 15:00 и 17:00 часами. Одновременно подавали воду и питательный раствор. Мы называем это лечение «сахарным лечением». Бобовые растения, которые получали только воду и питательный раствор, использовали в качестве контроля. После обработки сахаром в течение 5 дней мы измерили различные фотосинтетические свойства первичных листьев: измерения проводились на 12, 14, 16, 18 и 20 дни.
Измерение содержания азота и углерода в листьях
Содержание азота и углерода в сухих листовых дисках анализировали с помощью анализатора NC (vario EL III, Elementar Analysensysteme GmbH, Ханау, Германия).
Измерения фотосинтеза
Скорость фотосинтеза измеряли с помощью портативного инфракрасного газоанализатора CO 2 (LI-6400, Li-Cor, Lincoln, NE, USA). Первичный лист был заключен в ассимиляционную камеру, в которой содержание C a составляло 360 мкмоль моль -1 . Температура листа 25 ° C. Лист освещали при PPFD 1000 мкмоль м –2 с –1 в течение 20 мин, и скорости фотосинтеза измеряли при различных C и с в диапазоне от 50 до 1500 мкмоль моль –1 .C i был рассчитан согласно фон Каммереру и Фаркухару (1981). Наклон линии регрессии кривой A – C i для C i ниже 150 мкмоль моль –1 был рассчитан методом наименьших квадратов и считался начальным наклоном кривой A – C i кривая.
Флуоресценция хлорофилла и внутренняя проводимость для CO
2 диффузия (г i )
Флуоресценцию
Chl измеряли с помощью флуориметра с амплитудно-импульсной модуляцией (PAM-101, Waltz, Effeltrich, Германия).Лист был помещен в ассимиляционную камеру LI-6400 при температуре воздуха 25 ° C и C и 360 мкмоль моль –1 . После выдерживания листа в темноте в течение 20 минут измеряли F v / F m .
Мы рассчитали g и по методу Терашима и Оно (2002). Мы измерили кривую A – C i и флуоресценцию Chl при PPFD 500 мкмоль м –2 с –1 . Предполагается, что оптическая плотность листьев составляет 85%.
После измерения скорости фотосинтеза и флуоресценции Chl были взяты образцы дисков диаметром 1 см и быстро заморожены в жидкости N 2 в 17: 00–20: 00 ч для последующих анализов.
Измерение содержания хлорофилла
Замороженный листовой диск хорошо растирали пестиком в ступке в жидкости N 2 . Хл экстрагировали 80% ацетоном и центрифугировали при 15000 × g . Поглощение супернатанта измеряли согласно Porra et al.(1989).
Содержание неструктурных углеводов
Содержание глюкозы, сахарозы и крахмала в листе измеряли, как описано Ono et al. (1996). Замороженные листовые диски (1,57 см, 2 ) измельчали в жидком N 2 до порошка, а углеводы экстрагировали 80% этанолом. Суспензию инкубировали при 80 ° C в течение 1 ч и центрифугировали при 15000 × g в течение 10 мин. Осадки этих экстрактов использовали для оценки крахмала.Супернатант выпаривали для удаления этанола с помощью центробежного концентратора (CC-105, Tomy Seiko, Tokyo, Japan). Такие же объемы дистиллированной воды и хлороформа добавляли к концентрированному супернатанту и хорошо перемешивали. Смесь центрифугировали при 15000 × g , и верхнюю прозрачную фазу использовали для определения глюкозы и сахарозы.
Содержание ортофосфатов
Концентрацию ортофосфата измеряли, как описано Sawada et al.(1992) и Saheki et al. (1985). Замороженный листовой диск (0,785 см, 2 ) измельчали в жидком N 2 и суспендировали в 1 мл 1% хлорной кислоты. Экстракт центрифугировали при 750 × g и супернатант разбавляли в 10 раз 1% хлорной кислотой. 400 мкл этого разбавленного экстракта смешивали с 400 мкл молибдатного реагента, содержащего 15 мМ молибдата аммония, 100 мМ ацетат цинка (pH 5,0), 0,25% (мас. / Об.) SDS и 2,5% (мас. / Об.) Аскорбиновой кислоты (pH 5.0). После инкубации в течение 15 минут при 30 ° C измеряли A 850 .В качестве стандарта использовали раствор КН 2 ПО 4 .
Содержание LSU и LHCII
Замороженные листовые диски (2,355 см 2 ) измельчали в жидкости N 2 . Растворимый белок экстрагировали 300 мкл буфера для экстракции, содержащего 100 мМ Na-фосфатный буфер (pH 7,5), 50 мМ дитиотреитол (DTT), 1 мМ фенилметилсульфонилфторид (PMSF), одну таблетку / 50 мл полного коктейля ингибиторов протеазы (Roche Diagnostics , Мангейм, Германия), 1% (мас. / Об.) Поливинилпирролидона, 0.7% (мас. / Об.) Полиэтиленгликоля и 5% (мас. / Об.) Triton X-100. Экстракт центрифугировали при 750 × g и супернатант использовали для анализа с помощью SDS-PAGE.
Содержание LSU и LHCII было измерено согласно Makino et al. (1986) с некоторыми модификациями. Гель окрашивали бриллиантовым синим кумасси R-250. Полоса 47 кДа LSU и полоса 27 кДа LHCII были вырезаны, и бриллиантовый синий Кумасси R-250 этих блоков элюировали формамидом при 55 ° C в течение 5 часов. Было измерено A 595 этих элюатов.В качестве стандарта использовали бычий сывороточный альбумин.
Статистический анализ
Разницу между обработками анализировали с помощью теста Стьюдента t .
Благодарности
Мы благодарим докторов наук. Т. Какимото, К. Оно и С.-И. Миядзаве за бесконечные полезные советы. Мы также благодарим доктора А. Макино за предоставление первичных антител против LSU.
Рис. 1 График обработки сахара.День 0 был первым днем всасывания семян фасоли. Бобы высаживали на 4-й день и поливали каждый день. Шесть растений были посажены в один горшок, и они были прорежены на 10-й день. 50 мл раствора Хогланда половинной концентрации подавали каждый день, начиная с 7-го дня. Черный ящик показывает периоды, когда 50 мл 20 мМ раствора сахарозы подавались в корни фасоли. День 10, обозначенный сплошной линией, является точкой перехода сток-источник, прогнозируемой Миядзавой и др. (2003) и дневной скорости фотосинтеза.
Рис. 1 График обработки сахара. День 0 был первым днем всасывания семян фасоли. Бобы высаживали на 4-й день и поливали каждый день. Шесть растений были посажены в один горшок, и они были прорежены на 10-й день. 50 мл раствора Хогланда половинной концентрации подавали каждый день, начиная с 7-го дня. Черный ящик показывает периоды, когда 50 мл 20 мМ раствора сахарозы подавались в корни фасоли. День 10, обозначенный сплошной линией, является точкой перехода сток-источник, прогнозируемой Миядзавой и др.(2003) и дневной скорости фотосинтеза.
Рис. 2 Изменения содержания углеводов в первичных листьях фасоли в зависимости от площади листа. (A) глюкоза, (B) сахароза, (C) крахмал и (D) общий углевод. Общие углеводы — это сумма содержания глюкозы, сахарозы и крахмала. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки ошибок обозначают SE ( n = 3–6). * и ** указывают на значительную разницу при P <0.05 и P <0,01, соответственно, с тестом Стьюдента t .
Рис. 2 Изменения содержания углеводов в первичных листьях фасоли в зависимости от площади листа. (A) глюкоза, (B) сахароза, (C) крахмал и (D) общий углевод. Общие углеводы — это сумма содержания глюкозы, сахарозы и крахмала. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки ошибок обозначают SE ( n = 3–6). * и ** указывают на значительную разницу при P <0.05 и P <0,01, соответственно, с тестом Стьюдента t .
Рис. 3 Изменение скорости фотосинтеза в зависимости от площади первичных листьев фасоли. (A) Скорость фотосинтеза при PPFD 1000 мкмоль м -2 с -1 и концентрация CO 2 360 мкмоль моль -1 (A 360 ). (B) Наклон линии регрессии кривой A – C i для диапазона C i ниже 150 мкмоль-моль –1 , измеренный при PPFD 1000 мкмоль м –2 с –1 .(C) Скорость фотосинтеза при PPFD 1000 мкмоль м –2 с –1 и концентрация CO 2 1500 мкмоль моль –1 (Amax). Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки ошибок обозначают SE ( n = 3–6). *, ** и *** указывают на значительные различия при P <0,05, P <0,01 и P <0,001, соответственно, с тестом Стьюдента t .
Рис. 3 Изменения скорости фотосинтеза на основе площади листа в первичных листьях фасоли.(A) Скорость фотосинтеза при PPFD 1000 мкмоль м -2 с -1 и концентрация CO 2 360 мкмоль моль -1 (A 360 ). (B) Наклон линии регрессии кривой A – C i для диапазона C i ниже 150 мкмоль-моль –1 , измеренный при PPFD 1000 мкмоль м –2 с –1 . (C) Скорость фотосинтеза при PPFD 1000 мкмоль м –2 с –1 и концентрация CO 2 1500 мкмоль моль –1 (Amax).Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки ошибок обозначают SE ( n = 3–6). *, ** и *** указывают на значительные различия при P <0,05, P <0,01 и P <0,001, соответственно, с тестом Стьюдента t .
Рис. 4 Изменения содержания большой субъединицы Rubisco (A) и светособирающего chl-связывающего белка содержания PSII (B) первичных листьев фасоли.Это содержимое отображается на основе площади листа. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки ошибок обозначают SE ( n = 3–6). * указывает на значительную разницу при P <0,05 с тестом Стьюдента t .
Рис. 4 Изменения содержания большой субъединицы Rubisco (A) и светособирающего chl-связывающего белка содержания ФСII (B) первичных листьев фасоли. Это содержимое отображается на основе площади листа. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром.Планки ошибок обозначают SE ( n = 3–6). * указывает на значительную разницу при P <0,05 с тестом Стьюдента t .
Рис. 5 Изменения содержания ортофосфатов (A) и внутренней проводимости (g i ; B) в зависимости от площади листа. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки погрешностей обозначают SE [ n = 3–6, за исключением g i контрольных листьев на 20-й день ( n = 2)].** указывает на значительную разницу при P <0,01 с тестом Стьюдента t .
Рис. 5 Изменения содержания ортофосфатов (A) и внутренней проводимости (g i ; B) в зависимости от площади листа. Закрашенные кружки, контрольные листья; открытые круги, листья, обработанные сахаром. Планки погрешностей обозначают SE [ n = 3–6, за исключением g i контрольных листьев на 20-й день ( n = 2)]. ** указывает на значительную разницу при P <0.01 с тестом Студента т .
Таблица 1
LMA, содержание азота на площадь листа, соотношение азот / углерод (N / C), содержание Chl, отношение Chl a / b и F v / F m первичных листьев фасоль
| 12 | 14 | 16 | 18 | 20 | ||||||||||
| LMA (гм –2 ) | Контроль | 0 ± 1,57 | 24,3 ± 1,45 | 24,3 ± 1,13 ** | 28,9 ± 1,63 | 25,8 ± 3,12 | ||||||||
| Suc | 26,5 ± 0,65 | 25,5 ± 1,96 | ± 2,59 | 30,8 ± 2,88 | ||||||||||
| Содержание азота (гм -2 ) | Контроль | 1,74 ± 0,11 | 1,34 ± 0,09 | 1,23 ± 0,08 | 1,17 ± 0,03 ** 11294.35 ± 0,09 | |||||||||
| Suc | 1,68 ± 0,08 | 1,23 ± 0,13 | 1,07 ± 0,09 | 0,90 ± 0,05 | 0,89 ± 0,13 | |||||||||
| ± 0,13 | Контроль отношения N / C 0,006 | 0,121 ± 0,011 | 0,116 ± 0,011 * | 0,097 ± 0,006 * | 0,125 ± 0,010 ** | |||||||||
| Suc | 0,131 ± 0,006 | 0,10712 ± 0,017 9,1294 | 0,061 ± 0,008 | 0,065 ± 0,004 | ||||||||||
| Chl a + b (ммоль м –2 ) | Контрольный | 0,45 ± 0,01 | 0,38 ± 0,04 | 0,30 ± 0,01 | 0,23 ± 0,01 | |||||||||
| Suc | 0,44 ± 0,03 | 0,40 ± 0,01 | 0,34 ± 0,02 | 0,34 ± 0,03 | 0,21 | 0,21 / b (моль-моль –1 ) | Контроль | 3.29 ± 0,08 | 3,55 ± 0,08 | 3,41 ± 0,03 | 3,47 ± 0,01 | 3,22 ± 0,05 * | ||
| Suc | 3,45 ± 0,05 | 3,49 ± 0,04 | 3,49 ± 0,04 | 3,34 ± 0,02 | ||||||||||
| F v / F м | Контроль | 0,66 ± 0,01 | 0,73 ± 0,02 | 0,68 ± 0,02 | 0,71 ± 0,02 | |||||||||
| Suc | 0,74 ± 0,02 | 0,77 ± 0,01 | 0,72 ± 0,01 | 0,70 ± 0,06 | 0,72 ± 0,02 |
93
м 2 )
01293 1,6808
0,011
± 0,03
Таблица 1
LMA, содержание азота на площади листа, отношение азота / углерода (N / C), содержание Chl, Chl a / b Соотношение и F v / F м первичных листьев фасоли
| 12 | 14 | 16 | 18 | 20 | ||||||||||
| Контроль | 24.0 ± 1,57 | 24,3 ± 1,45 | 24,3 ± 1,13 ** | 28,9 ± 1,63 | 25,8 ± 3,12 | |||||||||
| Suc | 26,5 ± 0,65 | 25,5 ± 1,96 | ± 2,59 | 30,8 ± 2,88 | ||||||||||
| Содержание азота (гм -2 ) | Контроль | 1,74 ± 0,11 | 1,34 ± 0,09 | 1,23 ± 0,08 | 1,17 ± 0,03 ** 11294.35 ± 0,09 | |||||||||
| Suc | 1,68 ± 0,08 | 1,23 ± 0,13 | 1,07 ± 0,09 | 0,90 ± 0,05 | 0,89 ± 0,13 | |||||||||
| ± 0,13 | Контроль отношения N / C 0,006 | 0,121 ± 0,011 | 0,116 ± 0,011 * | 0,097 ± 0,006 * | 0,125 ± 0,010 ** | |||||||||
| Suc | 0,131 ± 0,006 | 0,10712 ± 0,017 9,1294 | 0,061 ± 0,008 | 0,065 ± 0,004 | ||||||||||
| Chl a + b (ммоль м –2 ) | Контрольный | 0,45 ± 0,01 | 0,38 ± 0,04 | 0,30 ± 0,01 | 0,23 ± 0,01 | |||||||||
| Suc | 0,44 ± 0,03 | 0,40 ± 0,01 | 0,34 ± 0,02 | 0,34 ± 0,03 | 0,21 | 0,21 / b (моль-моль –1 ) | Контроль | 3.29 ± 0,08 | 3,55 ± 0,08 | 3,41 ± 0,03 | 3,47 ± 0,01 | 3,22 ± 0,05 * | ||
| Suc | 3,45 ± 0,05 | 3,49 ± 0,04 | 3,49 ± 0,04 | 3,34 ± 0,02 | ||||||||||
| F v / F м | Контроль | 0,66 ± 0,01 | 0,73 ± 0,02 | 0,68 ± 0,02 | 0,71 ± 0,02 | |||||||||
| Suc | 0,74 ± 0,02 | 0,77 ± 0,01 | 0,72 ± 0,01 | 0,70 ± 0,06 | 0,72 ± 0,02 |
93
м 2 )
01293 1,6808
0,011
± 0,03
Сокращения
-
A 360
Скорость фотосинтеза при PPFD 1000 мкмоль м -2 с -1 и CO 2 концентрация 360 мкмоль моль -1
-
Скорость фотосинтеза Amax при PPFD 1000 мкмоль м –2 с –1 и концентрация CO 2 1500 мкмоль моль –1
-
C a
CO 2
C i
CO 2 концентрация в межклеточном пространстве
-
F v / F m
Максимальный квантовый выход PSII
-
g i
CO проводимость между межклеточным пространством и каталитическим центром Rubisco
-
LHCII
светособирающий хлорофилл-связывающий белок PSII
-
L MA
-
LSU
-
PPFD
Плотность фотосинтетического потока фотонов
-
Рубиско
рибулозо-1,5-бисфосфаткарбоксилаза / оксигеназа
-бисфосфат-
P
-
48 Ru
Список литературы
Чанг, С.-H., Мур, Б.Д. и Seemann, JR (
1998
) Влияние краткосрочного и долгосрочного повышенного CO 2 на экспрессию генов рибулозо-1,5-бисфосфаткарбоксилазы / оксигеназы и накопление углеводов в листьях Arabidopsis thaliana (L .) Heynh.
Plant Physiol.
116
:
715
–723.
Chen, S., Hajirezaei, M., Peisker, M., Tschersch, H., Sonnewald, U. и Börnke, F. (
2005
) Пониженный уровень сахарозо-6-фосфатфосфатазы в трансгенном табаке подавляет фотосинтез, изменяет распределение углеводов и снижает рост.
Planta
221
:
479
–492.
Cheng, C.-L., Acedo, G.N., Cristinsin, M. и Conkling, M.A. (
1992
) Сахароза имитирует световую индукцию транскрипции гена нитратредуктазы Arabidopsis .
Proc. Natl Acad. Sci. США
89
:
1861
–1864.
Dijkwel, P.P., Kock, P.A.M., Bezemer, R., Weisbeek, P.J. и Smeekens, S. (
1996
) Сахароза подавляет контролируемую развитием временную активацию гена пластоцианина в проростках Arabidopsis thaliana .
Plant Physiol.
110
:
455
–463.
Farquhar, G.D., von Caemmerer, S. and Berry, J.A. (
1980
) Биохимическая модель фотосинтетической ассимиляции CO 2 в листьях растений C 3 .
Planta
149
:
78
–90.
Flachmann, R. и Kühlbrandt, W. (
1995
) Накопление антенных комплексов растений регулируется посттранскрипционным механизмом в табаке.
Plant Cell
7
:
149
–160.
Хидема, Дж., Макино А., Мэй, Т. и Одзима, К. (
1991
) Фотосинтетические характеристики рисовых листьев, выдержанных при разном освещении от полного расширения до старения.
Plant Physiol.
97
:
1287
–1293.
Jang, J.-C. and Sheen, J. (
1997
) Гексокиназа как сенсор сахара у высших растений.
Plant Cell
9
:
5
–19.
Жанетт, Э., Рейсс, А., Грегори, Н., Ганте, П. и Приул, Дж.-L. (
2000
) Углеводный метаболизм в листе источника кукурузы, опоясанном теплом.
Среда растительных клеток.
23
:
61
–69.
Krapp, A., Hofmann, B., Schäfer, C. и Stitt, M. (
1993
) Регулирование экспрессии rbc S и других фотосинтетических генов углеводами: механизм «регуляции стока» фотосинтеза?
Plant J.
3
:
817
–828.
Krapp, A., Quick, W.P. и Ститт, М.(
1991
) Рибулозо-1,5-бисфосфаткарбоксилаза-оксигеназа, другие ферменты цикла Кальвина и хлорофилл уменьшаются, когда глюкоза поступает к зрелым листьям шпината через поток транспирации.
Планта
186
:
58
–69.
Krapp, A. и Stitt, M. (
1995
) Оценка прямых и косвенных механизмов «сток-регуляции» фотосинтеза в шпинате: изменения газообмена, углеводов, метаболитов, активности ферментов и стационарного состояния. уровни расшифровки после того, как исходник покидает холодное опоясание.
Planta
195
:
313
–323.
Koch, K.E. (
1996
) Углеводно-модулированная экспрессия генов в растениях.
Annu. Rev. Plant Physiol. Завод Мол. Биол.
47
:
509
–540.
Mae, T., Makino, A. и Ohira, K. (
1983
) Изменения количества рибулозо-1,5-бисфосфаткарбоксилазы, синтезируемой и разлагающейся в течение жизни рисового листа ( Oriza sativa L .).
Physiol растительных клеток.
22
:
1067
–1074.
Mae, T., Thomas, H., Gay, A.P., Makino, A. и Hidema, J. (
1993
) Развитие листьев у Lolium temulentum : фотосинтез и фотосинтетические белки в листьях, стареющих под различным освещением.
Physiol растительных клеток.
34
:
391
–399.
Макино А., Мэй Т. и Охира К. (
1986
) Колориметрическое измерение белка, окрашенного кумасси бриллиантовым синим R, при электрофорезе в полиакриламидном геле с додецилсульфатом натрия с элюированием формамидом.
Agric. Биол. Chem.
50
:
1911
–1912.
Миллер, А., Цай, Ч.-Х., Хемфилл, Д., Эндрес, М., Родермель, С. и Сполдинг, М. (
1997
) Повышенный уровень CO 2 эффектов в онтогенезе листа.
Plant Physiol.
115
:
1195
–1200.
Миядзава, С.-И., Макино, А. и Терашима, И. (
2003
) Изменения в анатомии мезофилла и взаимосвязи между поглотителем и источником во время развития листьев у Quercus glauca , вечнозеленого дерева, у которого наблюдается замедленное озеленение листьев.
Среда растительных клеток.
26
:
745
–755.
Nafziger, E.D. и Коллер, Х.Р. (
1976
) Влияние концентрации крахмала в листьях на ассимиляцию СО 2 в сое.
Plant Physiol.
57
:
560
–563.
Накано, Х., Мурамацу, С., Макино, А. и Мэй, Т. (
2000
) Взаимосвязь между подавлением фотосинтеза и накоплением крахмала в фасоли с удаленными стручками.
Aust. J. Plant Physiol.
27
:
167
–173.
Ни, Г., Хендрикс, Д.Л., Уэббер, А.Н., Кимбалл, Б.А. и Лонг, С.П. (
1995
) Повышенное накопление углеводов и снижение уровней транскриптов фотосинтетических генов в пшенице, выращенной при повышенной концентрации CO 2 в поле.
Plant Physiol.
108
:
975
–983.
Оно, К., Терашима, И. и Ватанабе, А. (
1996
) Взаимодействие между дефицитом азота в растении и содержанием азота в старых листьях.
Physiol растительных клеток.
37
:
1083
–1089.
Pego, J.V., Kortstee, A.J., Huijser, C. и Smeekens, S. (
2000
) Фотосинтез, сахара и регуляция экспрессии генов.
J. Exp. Бот.
51
:
407
–416.
Порра, Р.Дж., Томпсон, В.А., Криедеманн, П.Е. (
1989
) Определение точных коэффициентов экстинкции и одновременных уравнений для анализа хлорофиллов a и b , экстрагированных четырьмя различными растворителями: проверка концентрации стандартов хлорофилла с помощью атомно-абсорбционной спектроскопии.
Биохим. Биофиз. Acta
975
:
384
–394.
Saheki, S., Takeda, A. и Shimazu, T. (
1985
) Анализ неорганического фосфата в умеренном диапазоне pH, подходящий для измерения активности гликогенфосфорилазы.
Анал. Biochem.
148
:
277
–281.
Sawada, S., Usuda, H. и Tsukui, T. (
1992
) Участие неорганического ортофосфата в регуляции активности рибулозо-1,5-бисфосфаткарбоксилазы в ответ на изменения в балансе фотосинтетического источника и поглотителя.
Physiol растительных клеток.
33
:
943
–949.
Шарки, Т. Д. (
1985
) Фотосинтез в интактных листьях растений C 3 : физика, физиология и ограничения скорости.
Бот. Ред.
51
:
53
–105.
Шарки Т.Д. и Вандервеер П.Дж. (
1989
) Концентрация стромального фосфата низкая во время фотосинтеза, ограниченного обратной связью.
Plant Physiol.
91
:
679
–684.
Шин, Дж. (
1990
) Метаболическая репрессия транскрипции у высших растений.
Plant Cell
2
:
1027
–1038.
Ститт, М. (
1986
) Ограничение фотосинтеза за счет метаболизма углерода.
Plant Physiol.
81
:
1115
–1122.
Ститт, М. и Квик, В.П. (
1989
) Фотосинтетическое разделение углерода: его регулирование и возможности для манипуляции.
Physiol. Растение.
77
:
633
–641.
Stitt, M., von Schaewen, A. и Willmitzer, L. (
1990
) Регуляция фотосинтетического метаболизма трансгенных растений табака, экспрессирующих дрожжевую инвертазу в их клеточной стенке, включает снижение ферментов цикла Кальвина и увеличение гликолитических ферментов.
Planta
183
:
40
–50.
Strand, A., Zrenner, R., Trevanion, S., Stitt, M., Gustafsson, P. и Gardeström, P. (
2000
) Снижение экспрессии двух ключевых ферментов пути биосинтеза сахарозы, цитозольной фруктозы -1,6-бисфосфатаза и сахарозо-фосфатсинтаза имеют совершенно разные последствия для фотосинтетического метаболизма углерода у трансгенного Arabidopsis thaliana .
Plant J.
23
:
759
–770.
Терашима, И. и Оно, К. (
2002
) Влияние HgCl 2 на зависимость фотосинтеза листьев от CO 2 : данные, указывающие на участие аквапоринов в диффузии CO 2 через плазматическую мембрану.
Physiol растительных клеток.
43
:
70
–78.
фон Каммерер С. и Фаркуар Г.Д. (
1981
) Некоторые взаимосвязи между биохимией фотосинтеза и газообменом листьев.
Planta
153
:
376
–387.
Лекция по углеводам для физиологии растений
Лекция по углеводам для физиологии растений
Физиология растений
Химия углеводов
Введение
Трехуглеродный сахар — основной продукт фотосинтеза.
у большинства растений. Этот сахар, глицеральдегид-3-фосфат , выглядит
нравится:
CH 2 PO 3 -2
|
ОН-С-Н
|
O = C-0PO 3 -2
С этой отправной точки растение может синтезировать другие сахара, в том числе
глюкоза, сахароза и фруктоза, и это лишь некоторые из них.В этой лекции мы
изучить терминологию сахаров и, в частности, соединений, состоящих из
несколько связанных сахаров, называемых полисахаридами . Все
углеводы, так называют эти типы соединений, имеют
базовый состав:
(CH 2 O) n
, где n обозначает количество атомов углерода в молекуле. Большинство
Обычные сахара в растениях — это рибоза, глюкоза, фруктоза и сахароза. Много
другие соединения состоят из полимеров этих и родственных сахаров.В зависимости от
от того, является ли кислород с двойной связью в этих молекулах терминальным или внутренним
среди атомов углерода определяет, являются ли они альдегидными (концевыми)
или кетон (внутренний) сахара. Альдегидсодержащие углеводы
известны как альдозы , а кетонсодержащие — как кетозы .
Моносахариды, дисахариды и полисахариды
Углевод, который не поддается гидролизу (нужно добавить воду для разрушения
его на более мелкие молекулы) известен как моносахарид .Если углевод можно гидролизовать до двух моносахаридов, то это дисахарид .
Если он гидролизуется более чем на два моносахарида, это полисахарид .
Сахара в растениях чаще всего имеют 3-7 атомов углерода. Терминология такая:
Количество атомов углерода
Групповая классификация
3
триоза
4
тетроза
5
пентоза
6
гексоза
7
септоз
Большинство растительных сахаров представляют собой пентозы или гексозы.Углеводы
также классифицируются по тому, могут ли они восстанавливать (отдавать электроны) определенные
реагенты, такие как Бенедикт или Толлен. И альдегиды, и кетоны могут
уменьшить количество этих реагентов (они добавляют электроны к иону меди и раствору
меняет цвет в результате). Это станет важным позже, когда мы обсудим
сахара в растениях, и как определенные реакции работают только с редуцирующими сахарами.
Наиболее распространенной органической молекулой во всем мире, вероятно, является глюкоза,
шестиуглеродный сахар.Формула: C 6 H 12 O 6 .
Таблица 18.1 из другого учебника физиологии растений показывает фактические структуры
глюкозы. Обратите внимание, что может быть две основные формы, L и D. Это потому, что
в них есть асимметричный углерод, а это означает, что стереоизомеры
могут быть сформированы. Живые организмы используют только
D форма!
Соответствие
Моносахариды обычно образуют циклическую, а не линейную форму в
природа.Карбонильный кислород (на углероде 1) реагирует с гидроксильными группами в другом месте.
на молекуле, что приводит к образованию либо пятичленной ( фуранозы )
или шестичленные ( пираноза ) кольца. Из-за вращения некоторыми
атомов углерода кольца различаются по их атомной ориентации, и
для шестичленного кольца могут быть формы как (см.
Часть B, молекулы (1) и (2) — можете ли вы найти разницу между
эти две молекулы?).Посмотрите на рисунок 5.3 (из Кэмпбелла, Риса и Митчелла,
Biology, 5 th Edition, 1999), верхний правый блок. Вот разница
между галактозой и глюкозой заключается в том, что четвертый углерод (считая от
вверху!) повернулся вокруг своей оси. В растворе моносахариды могут свободно
вращаются между формами и, тогда как если они становятся фиксированными как часть
молекулы большего размера, они присоединяются либо в форме, либо в форме. Примечание к рисунку 5.4.
различные формы, которые может принимать молекула глюкозы.
Обратите особое внимание на схему нумерации атомов углерода в глюкозе.
молекула — вы начинаете нумерацию с карбонильного конца.
Реакции дегидратации
Два моносахарида могут быть соединены посредством реакции дегидратации (вода
потерян). Рисунок 5.5a показывает такую реакцию. Здесь соединяются две глюкозы
с образованием мальтозы (является ли мальтоза дисахаридом?). Углерод номер 1 от
одна глюкоза соединяется с углеродом номер 4 другой глюкозы через
гликозидной связью (где атом кислорода соединяет два атома углерода). Если
глюкоза присоединяется к молекуле галактозы, затем образуется лактоза, основная
сахар в молоке.
Если вы сложите вместе две разные гексозы, такие как глюкоза и фрутоза,
можно образовать дисахарид сахарозу (см. рис. 5.5b). Обратите внимание, как на рисунке
упоминает, что фруктоза — одна из тех гексоз, которые образуют пятистороннюю
кольцо, а не шестигранное. Также обратите внимание на то, что в
В этой молекуле связаны 1 и 2 атома углерода, а не 1 и 4 атома углерода.
Сахароза — самый распространенный сахар в растениях и форма, в которой углеводы
переносятся от одного органа растения к другому.
Если у вас есть полимер глюкозы, это соединение будет глюканом. Если
к нему были прикреплены остатки другого типа сахара, такого как ксилоза,
название соединения изменится на ксилоглюкан . Если у вас есть
полимер ксилозы с боковыми цепями арабинозы, тогда у вас будет
соединение называется арабиноксилан . Это станет более важным
позже, когда состав материалов, составляющих стенку растительной клетки,
обсуждается (см. ниже).
Крахмал
Крахмал — это полисахарид, состоящий из единиц глюкозы, соединенных между собой (1-4)
облигация (см. рисунок 5.6). Угол, образованный этим соединением, вызывает
единицы глюкозы сворачиваются в плотную спираль. Это выгодно, так как крахмал
представляет собой запасную молекулу для избыточной глюкозы, а свертывание позволяет производить большое количество
глюкозы должны храниться на относительно небольшой площади. Эта форма крахмала
известна как амилоза . Иногда от глюкозы образуется ветвь.
и там, где это происходит, облигация представляет собой облигацию (1-6) , а не
облигация (1-4).Когда возникают разветвления, крахмал называется амилопектином .
Крахмал нерастворим и поэтому не влияет на осмотический потенциал.
ячейки.
Есть три фермента, которые являются основными разрушителями крахмала. -амилаза
разрывает связи, в которых существуют точки ветвления ((1-6) связи), что оставляет
длинные остатки (1-4) связанных глюкоз. Затем -амилаза атака
концы этих остатков, образующих мальтозу (дисахарид, помните?).Наконец, мальтаза переваривает мальтозу до индивидуальной глюкозы.
молекулы.
Некоторые водоросли синтезируют разновидность типичного растительного крахмала, используя (1-3)
облигации вместо (1-4) облигаций. Это показывает разнообразие биохимических
пути, доступные в группах растений / водорослей.
Целлюлоза
Целлюлоза представляет собой полисахарид, состоящий из единиц глюкозы, соединенных между собой (1-4)
облигации . В этой ориентации глюкозы располагаются в
длинные прямые цепи, а не свернутые, как в крахмале.Это позволяет целлюлозе
синтезируется в виде волокна и придает молекуле большую прочность, в частности
Что касается прочности на разрыв (способность растягиваться без разрыва;
целлюлоза в этом отношении прочна как сталь!).
Существует очень мало ферментов, которые могут разлагать целлюлозу, а люди — нет.
есть такие ферменты, и очень немногие высшие организмы могут их разрушить.
облигации. Это означает, что растения, которые прилагают много усилий, чтобы
древесина (которая в основном состоит из целлюлозы) не будет относительно защищена от атак
большинством организмов.Те организмы, которые потребляют целлюлозу напрямую
(например, термиты и пасущиеся животные) используют бактерии, содержащие целлюлозу
переваривающие ферменты, чтобы добраться до молекул глюкозы. Мы обсудим эти
ферменты позже.
Отдельные цепочки целлюлозы могут тесно совмещаться и связываться между собой.
сами, составляя структуры, называемые микрофибриллами . Эти
микрофибриллы относительно жесткие и могут образовывать кристаллические или полукристаллические
структура, диаметром около 4 нм .Именно эти кристаллические
волокна, очень устойчивые к ферментативной атаке. Окружение и покрытие
Эти микрофибриллы представляют собой два основных класса соединений: гемицеллюлозы
и пектины .
Гемицеллюлозы — гибкие полисахариды, которые часто
связываются с микрофибриллами (см. рисунок 15.4). Они помогают связывать микрофибриллы
вместе, и может препятствовать соединению соседних микрофибрилл с каждым
Другие.
Пектины образуют гель, в котором микрофибриллы и гемицеллюлозы
встроены.Пектины также гидрофильны (в них может растворяться вода).
и пектины в первую очередь отвечают за определение пористости клетки
стенка для макромолекул. Белки также встречаются среди пектиновых
гель, но их функция в настоящее время малоизвестна.
Состав клеточной стенки
Первичная стена (материал стены, впервые уложенный камерой, подробнее
позже) состоит из примерно 25% целлюлозы, 35% гемицеллюлозы,
35% пектинов и, возможно, 1-8% белка.Но есть большие различия между
растения: некоторые травы имеют клеточные стенки с содержанием гемицеллюлозы до 70%, в то время как
ткань эндосперма злаков может на 85% состоять из гемицеллюлозы. Вторичные стены (которые
заложены позже и придают клеткам структурную прочность) содержат
гораздо большее количество целлюлозы.
Не будем забывать, что в стене также много воды .
Матрица, состоящая из гемицеллюлозы и пектинов, окружающих
микрофибриллы могут содержать 75-85% воды по объему! Удаление воды делает
стена более жесткая и может играть роль в поддержании тургора, так как растения
высохнуть.
Возврат
на главную страницу физиологии растений
Вернуться на главную страницу биологии
Почему при транспортировке углеводов в растениях он находится в форме сахарозы, а у животных — в форме глюкозы?
# цвет (синий) «Разница между глюкозой и сахарозой» #
- Глюкоза = моносахарид, один строительный блок из сахаров
- Сахароза = дисахарид, состоящий из моносахаридов глюкозы и фруктозы.
#color (blue) «Почему растения используют сахарозу вместо глюкозы» #
Сахароза образуется в цитозоле фотосинтезирующих клеток из фруктозы и глюкозы и затем транспортируется в другие части растения. Этот процесс благоприятен по двум причинам:
-
Сахароза содержит больше энергии, чем моносахарид, поэтому она на более энергоэффективна как при транспортировке, так и при хранении.
-
Во-вторых, сахароза — это так называемый невосстанавливающий сахар.Это означает, что он не окисляется, т.е. не происходит промежуточных реакций с другими молекулами. Это в отличие от глюкозы, которая является реактивной и может образовывать другие продукты во время транспортировки.
#color (blue) «Почему животные используют глюкозу вместо сахарозы» #
Возникает вопрос, почему животные не используют сахарозу вместо энергии, учитывая вышеупомянутые преимущества.
Это связано с тем, что животные клетки не имеют таких механизмов транспорта и распределения ферментов, как растения:
-
В растениях сахароза превращается обратно в глюкозу и фруктозу с помощью фермента, называемого сахарозой.


