что наука говорит о голоде
Механизм голода и насыщения не так прост, как кажется на первый взгляд, именно поэтому решить проблему переедания одним махом, просто взяв себя в руки, с научной точки зрения, невозможно. В этой статье о том, что влияет на чувство голода, чем оно отличается от аппетита, и как, наконец, почувствовать насыщение.
Содержание
Что такое аппетит и чем он отличается от голода?
Аппетит — это желание поесть, предвкушение приема пищи и удовольствия, которое этот прием доставит. Голод, в свою очередь — это неприятные ощущения: тошнота, «сосание под ложечкой», головокружение, слабость, говорящие нам о том, что организм нуждается в питательных веществах. Аппетит зачастую сопровождает голод, но возникает чуть раньше, как бы предупреждая неприятные ощущения. Именно аппетит рождает в нашей голове мысль «я хочу есть».
Физиология голода и насыщения
Чувство голода возникает, когда возбуждается центр голода, находящийся в гипоталамусе.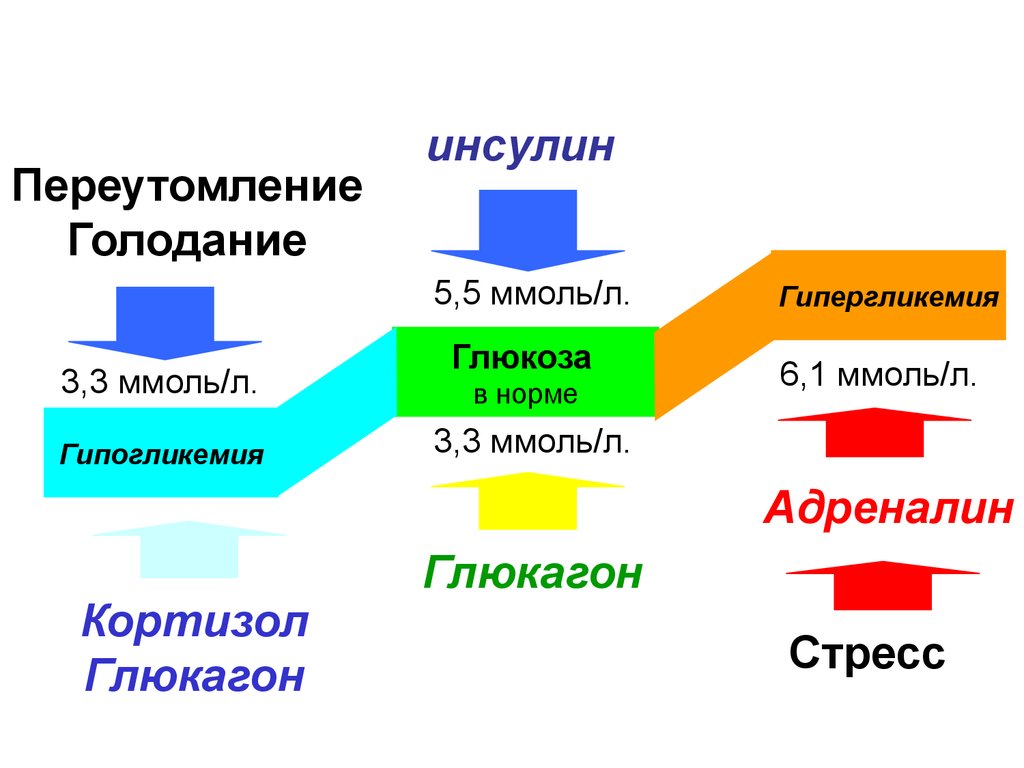 Происходит это в два этапа.
Происходит это в два этапа.
Сначала сигналы к центру голода поступают от пустого желудка и двенадцатиперстной кишки — в это время кровь еще содержит необходимые питательные вещества. Но импульсы, поступающие в мозг из ЖКТ, заставляют включать режим «экономии» — глюкоза, аминокислоты, жирные кислоты и глицериды из крови поступают в депо: печень, жировая клетчатка, мышцы. Кровь, обедненная питательными веществами, передает возбуждение в тот же центр голода через хеморецепторы сосудов и рецепторы самого гипоталамуса.
Сознательное желание что-то съесть, если оно связано с голодом, возникает, когда сигнал из центра голода доходит до коры больших полушарий.
Снижается аппетит в норме при наступлении насыщения. Насыщение тоже приходит в два этапа. Первичное — во время еды, когда нервные импульсы от рецепторов языка, глотки, пищевода и желудка достигают центра насыщения в гипоталамусе. Активность центра голода тормозится, и мы перестаем есть.
Затем через 1,5 часа после еды наступает вторичное насыщение: питательные вещества начинают поступать в кровь, и эта кровь стимулирует гипоталамус.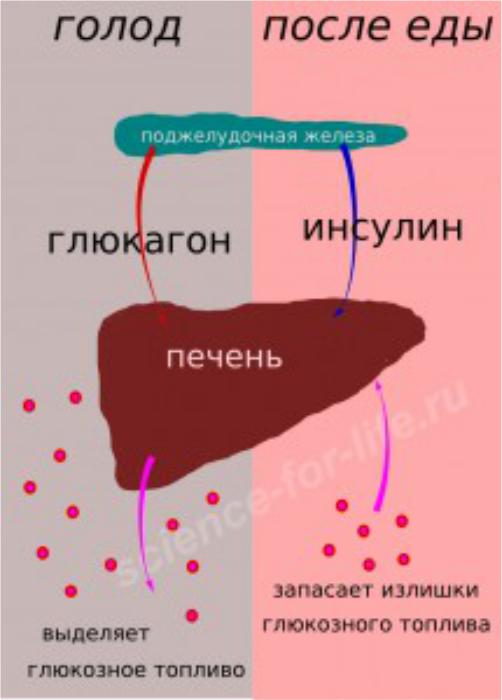 Так чувство сытости сохраняется.
Так чувство сытости сохраняется.
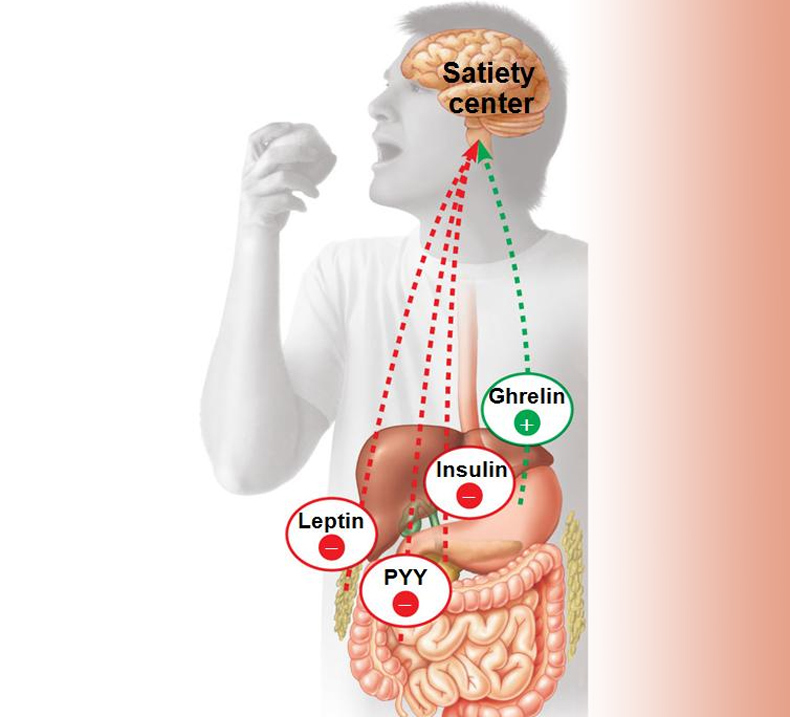
Помимо концентрации питательных веществ в крови постоянно меняется количество гормонов, многие из которых влияют на аппетит. Вот основные из них.
Грелин. Гормон голода. Вырабатывается в основном клетками слизистой оболочки желудка и повышает аппетит. В норме его много перед едой, а после еды — концентрация снижается. Достигая гипоталамуса, стимулирует синтез веществ, вызывающих аппетит (например, нейропептид Y), и веществ, которые аппетит снижают (производные проопимеланокортина).
Нейропептид Y избыточно вырабатывается во время стресса.
Секреция грелина повышается при потере веса — организм стремится восстановить то, что утратил. А когда мы толстеем, синтез грелина снижается. То есть можно сказать, что гормон регулирует пищевое поведение (как минимум пытается) — уменьшает аппетит, если мы набрали вес, и усиливает, если похудели.
Лептин.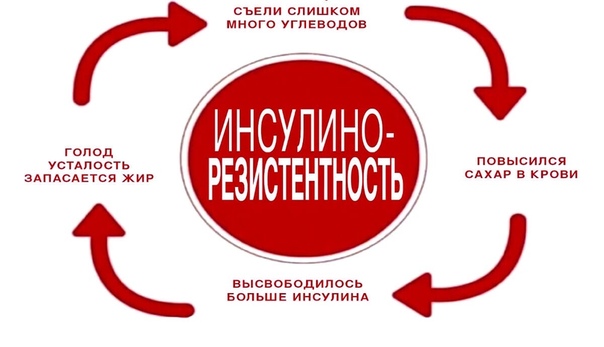 Гормон насыщения. Вырабатывается жировой тканью и желудком и снижает аппетит. Рецепторы лептина также располагаются в гипоталамусе, там он стимулирует синтез проопимеланокортина и подавляет синтез нейропептида Y. То есть лептин — антагонист грелина. В норме концентрация лептина повышается после еды.
Гормон насыщения. Вырабатывается жировой тканью и желудком и снижает аппетит. Рецепторы лептина также располагаются в гипоталамусе, там он стимулирует синтез проопимеланокортина и подавляет синтез нейропептида Y. То есть лептин — антагонист грелина. В норме концентрация лептина повышается после еды.
У людей, страдающих ожирением, мозг часто становится невосприимчив к лептину. При этом самого гормона вырабатывается слишком много. Человек в таком случае испытывает голод даже когда запасов энергии еще достаточно.
Лептин и грелин воздействуют и на дофаминовую систему, связанную с мотивацией и наградой: в данном случае — с желанием что-то съесть и удовольствием от еды.
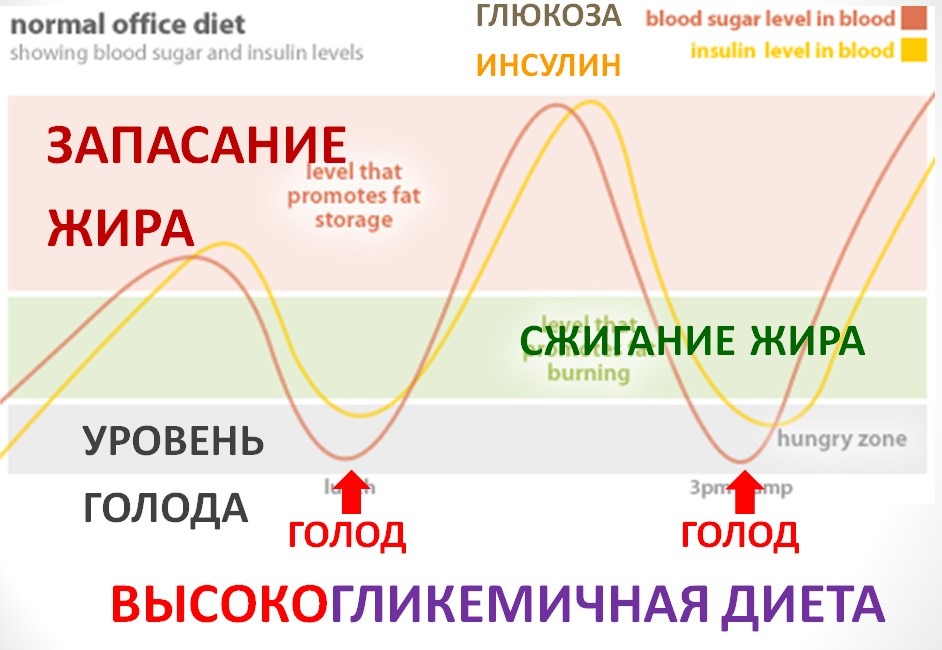
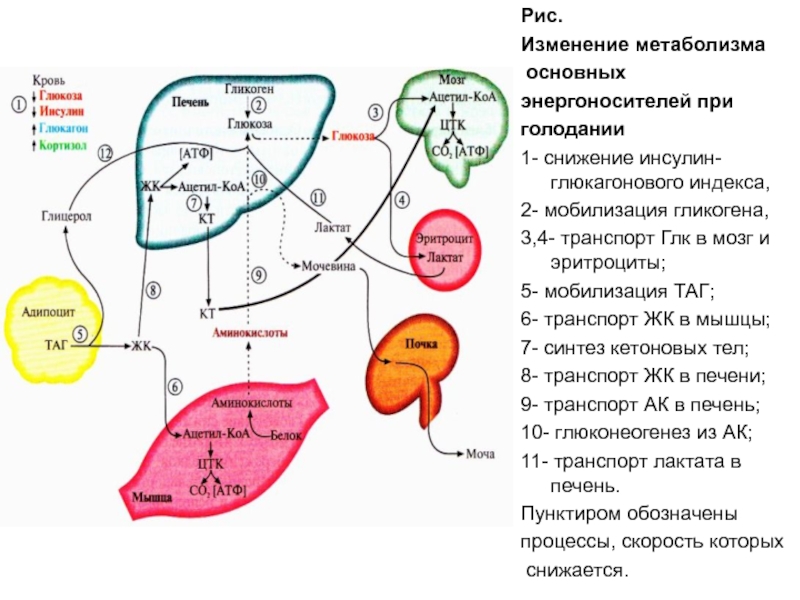
Инсулин. Гормон, вырабатывающийся поджелудочной железой в ответ на повышение уровня глюкозы в крови, т.е. в норме после еды. Инсулин нормализует уровень глюкозы. Вообще повышение инсулина обычно совпадает со снижением голода и аппетита. Затем под действием гормона уровень глюкозы снижается в течение нескольких часов, по прошествии которых мы снова начинаем хотеть есть.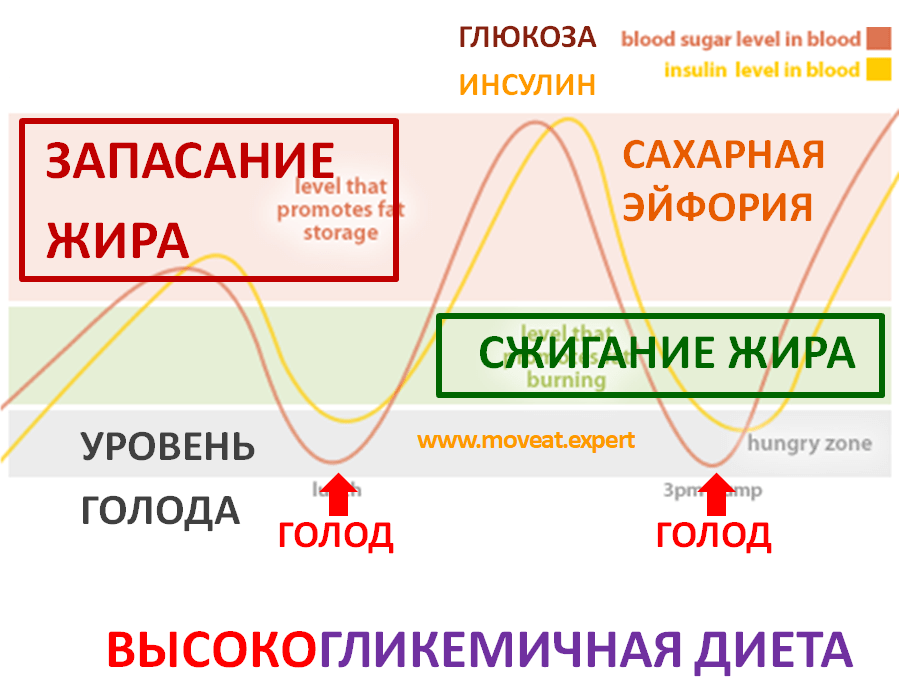 Но если уровень глюкозы снижается слишком быстро, чувство голода возникает рано — через час или два после еды. Обычно это происходит, когда мы едим пищу с высоким гликемическим индексом (в основном это быстрые углеводы: сладкое, хлеб, каши, фрукты).
Но если уровень глюкозы снижается слишком быстро, чувство голода возникает рано — через час или два после еды. Обычно это происходит, когда мы едим пищу с высоким гликемическим индексом (в основном это быстрые углеводы: сладкое, хлеб, каши, фрукты).
Еще на инсулин влияет лептин. Дело в том, что лептин тоже способствует утилизации глюкозы и повышает чувствительность организма к действию инсулина. Из-за лептина синтез инсулина снижается. Резистентность к лептину, возникающая при ожирении, часто приводит и к инсулинорезистентности — состоянию, когда ткани организма не реагируют на инсулин; уровень глюкозы не снижается; человек при этом постоянно хочет есть. Инсулинорезистентность сопровождается повышенным аппетитом и может привести к сахарному диабету.
Что еще влияет на аппетит?
Генетика
Мутации в некоторых генах могут влиять на аппетит.
Например, мутации в гене, кодирующем гормон лептин, приводят к дефициту гормона и неконтролируемому чувств голода. У людей с такими мутациями с раннего возраста наблюдается ожирение, гипотиреоз и задержка полового развития. Эти мутации встречаются у 5-6% страдающих ожирением людей. Применение экзогенного лептина нормализует аппетит, вес и уровень половых гормонов.
Эти мутации встречаются у 5-6% страдающих ожирением людей. Применение экзогенного лептина нормализует аппетит, вес и уровень половых гормонов.
Кроме того, мутации могут затрагивать не гормон, а его рецептор. Клиническая картина будет абсолютно такой же: и в том, и в другом случае гормон не может выполнять свою функцию.
Так, мутации в гене рецептора меланокортина 4-го типа (MC4R) тоже приводят к повышенному аппетиту и вызывают раннее ожирение.
Меланокортины — гормоны, производные проопиомеланокортина. Они подавляют аппетит, воздействуя на рецепторы в мозге.
Привычки
Очевидно, что аппетит просыпается не только когда мы на самом деле голодны. Кроме внутренних сигналов (гормональных и пр.) могут быть и внешние.
Вид, запах, и даже мысли о еде, которая нам нравится, вызывают аппетит. Как и другие ассоциации: если вы регулярно пьете кофе с пирожным в одной и той же кофейне, вероятнее всего вам хочется пирожное, даже когда вы идете мимо по своим делам. То же самое, если вы привыкли есть в определенной компании или поощрять себя шоколадкой в конце рабочего дня. Перекусы, когда вам грустно или совсем нечего делать, и переедание, вызванное стрессом — туда же.
То же самое, если вы привыкли есть в определенной компании или поощрять себя шоколадкой в конце рабочего дня. Перекусы, когда вам грустно или совсем нечего делать, и переедание, вызванное стрессом — туда же.
За многое из перечисленного ответственна дофаминовая система мозга. Та самая, на которую ко всему прочему воздействуют гормоны голода и насыщения. С системой этой все очень сложно, но вот ключевые моменты.
- Дофамин — это нейромедиатор, связанный с удовольствием и предвкушением. Он выделяется еще до того, как это удовольствие будет получено. Стоит нам подумать о пирожном (или о чем-то другом, что кажется нам вкусным) — дофамин выделится и вызовет стремление это получить. Так выглядит ассоциация или привычка.
- Сколько выделится дофамина и когда — очень индивидуально и ситуативно. Биолог Роберт Сапольски приводит наглядный пример в книге «Биология добра и зла». Если человеку показать булочку, пишет он, синтез дофамина увеличится. Но если эту же булочку показать, когда человек уже съел такую и сыт — дофамина не будет.
 Однако у сидящего на диете и сорвавшегося на булочку всплеск гормона случится и при виде второй — так работает ограничение. Стоит добавить, что если человек не любит булочки вовсе — дофамина при ее виде ему не видать. Но он может получить дофамин, если подумает о чем-то, что кажется ему желанным — о стейке, например.
Однако у сидящего на диете и сорвавшегося на булочку всплеск гормона случится и при виде второй — так работает ограничение. Стоит добавить, что если человек не любит булочки вовсе — дофамина при ее виде ему не видать. Но он может получить дофамин, если подумает о чем-то, что кажется ему желанным — о стейке, например. - К дофамину возникает привыкание. Вернее, не к самому гормону, а к его высокому уровню. Еда, особенно вкусная, действует буквально как наркотик — это быстрый и легкий способ получить дофамин. При этом многие другие стимулы вскоре перестают вызывать его сильный всплеск. Проще говоря, мы перестаем получать удовольствие от любимых занятий, общения, хобби — это все сложные способы, на фоне которых идея съесть кусок торта или бургер выглядит намного привлекательнее. Тем более, что удовольствие в таком случае не заставит себя ждать.
Заедание проблем может быть связано с еще одним гормоном — кортизолом. Этот гормон вырабатывается в ответ на стресс и усиливает аппетит. Бывает, что даже незначительный стресс приводит к повышенной секреции гормона, и есть хочется сильнее.
Бывает, что даже незначительный стресс приводит к повышенной секреции гормона, и есть хочется сильнее.
Факторы, на которые можно повлиять
Сбалансированное питание. Очевидный на первый взгляд совет для тех, кому все время хочется есть: съедать достаточно и соблюдать баланс БЖУ (белков, жиров и углеводов), чтобы чувствовать сытость в течение дня. Повышенный аппетит может говорить о том, что еды просто не хватает или что ее энергетическая ценность ниже, чем нужно. Бутерброды на завтрак, перекус яблоком, большое количество быстрых углеводов (сладости, выпечка, снеки и пр.) — признаки того, что питание стоит пересмотреть. Необходимое дневное количество калорий и БЖУ зависит от роста, веса и физической активности. В среднем женщине в день необходимо съедать 2000-2200 ккал, мужчине — 2400-2600 ккал. При этом углеводов должно быть около 45-55%, жиров — 20-35% белков — 10-35%. Рассчитать и отследить это все помогут приложения для подсчета калорий, которые к тому же учтут именно ваши данные.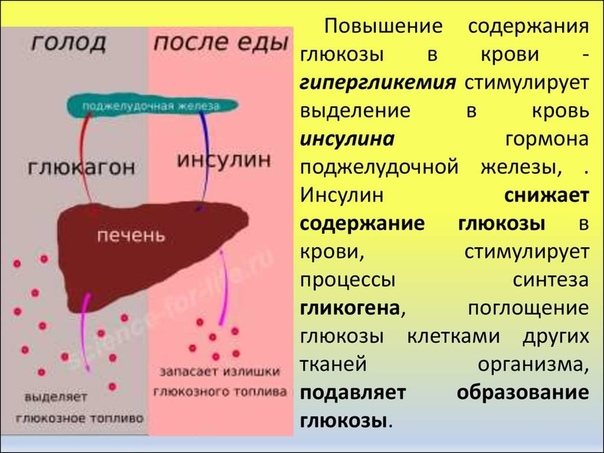
Здоровый сон. Чтобы аппетит был в норме, нужно высыпаться. Недосып приводит к тому, что есть хочется чаще и сильнее. Это происходит из-за нарушения баланса гормонов: у спящих по пять часов людей концентрация грелина в крови становится выше, а лептина — ниже, по сравнению с теми, кто спит по восемь часов. В итоге у тех, кто спит меньше, аппетит и индекс массы тела повышены.
Спорт может привести аппетит в норму. Исследования показывают, что после интенсивной тренировки подавляется синтез грелина — аппетит снижается. Однако длительные занятия спортом приводят к обратному эффекту. Ученые связывают это с потерей веса (частое явление у тренирующихся), которая приводит к повышению синтеза грелина. Но повышенный аппетит у постоянно тренирующихся людей — нормальное явление, ведь и энергозатрат в таком случае больше.
Еда не на автомате. Привычка есть у телевизора или на бегу приводит к тому, что регуляция аппетита нарушается. В эксперименте, где людей просили концентрироваться во время еды на процессе, люди съедали меньше и меньше перекусывали в течение дня. Это говорит о том, что внимание и память тоже участвуют в контроле аппетита, хотя механизмы не совсем ясны.
Это говорит о том, что внимание и память тоже участвуют в контроле аппетита, хотя механизмы не совсем ясны.
Тщательное пережевывание пищи согласно некоторым исследованиям тоже снижает аппетит. Дело может быть в том самом внимании к приему пищи, и в том, что долгое жевание способствует лучшей регуляции метаболических процессов. Проще говоря, это своеобразная калибровка мозга, которая может помочь ему лучше реагировать на насыщение.
Узнать особенности своего обмена веществ можно с помощью Генетического теста Атлас.
- Агаджанян Н., Смирнов В., Нормальная физиология, 2009
- Сапольски Р., Биология добра и зла. Как наука объясняет наши поступки, 2019
- Kelesidis T. et al. Narrative Review: The Role of Leptin in Human Physiology: Emerging Clinical Applications, 2010
- Taheri S. et al., Short sleep duration is associated with reduced leptin, elevated ghrelin, and increased body mass index, 2004
- Friedman J.
 Leptin and the endocrine control of energy balance, 2019
Leptin and the endocrine control of energy balance, 2019 - Pico C. et al., Leptin as a key regulator of the adipose organ, 2021
- Wewer M. et al. Associations between ghrelin and leptin and neural food cue reactivity in a fasted and sated state, 2021
- Zanchi D. et al. The impact of gut hormones on the neural circuit of appetite and satiety: A systematic review, 2017
- Kroc E. et al., Influence of oral processing on appetite and food intake — A systematic review and meta-analysis, 2018
- Ouerghi N. et al., Ghrelin Response to Acute and Chronic Exercise: Insights and Implications from a Systematic Review of the Literature, 2021
- Farooqi I. S. Defining the neural basis of appetite and obesity: from genes to behaviour, 2014
- Berridge K. et al., The tempted brain eats: Pleasure and desire circuits in obesity and eating disorders, 2010
- Berthoud H. et al., Blaming the brain for obesity: Integration of hedonic and homeostatic mechanisms, 2017
- Robinson E.
 et al. Eating ‘attentively’ reduces later energy consumption in overweight and obese females, 2014
et al. Eating ‘attentively’ reduces later energy consumption in overweight and obese females, 2014 - Newman et al. Daily hassles and eating behaviour: the role of cortisol reactivity status, 2007
- Kuo et al. Neuropeptide Y acts directly in the periphery on fat tissue and mediates stress-induced obesity and metabolic syndrome, 2007
- Wise R. Dopamine, learning and motivation, 2004
- Volkow N. et al. The dopamine motive system: implications for drug and food addiction, 2017
- Paz-Filho G et al. Leptin therapy, insulin sensitivity, and glucose homeostasis, 2012
Гипогликемия — Кировский клинико-диагностический центр (бывшая Кировская клиническая больница № 8)
Вторник,
18
Ноября
2014
Гипогликемия –
это состояние, при котором уровень глюкозы (сахара) крови ниже нормы.
Данное состояние возникает при лечении сахарного диабета сахароснижающими препаратами (таблетированные формы или инсулин).
Мероприятия по купированию гипогликемии у больных сахарным диабетом, получающих сахароснижающую терапию, следует начинать при уровне глюкозы плазмы < 3,9ммоль/л.
Биохимическое определение гипогликемии: это уровень глюкозы плазмы < 2,8 ммоль/л, сопровождающийся клинической симптоматикой или < 2,2 ммоль/л независимо от симптомов.
Легкой считается гипогликемия без нарушения сознания, купируемая пациентом самостоятельно. Тяжелая гипогликемия проявляется потерей сознания.
Причины гипогликемии:
- грубые ошибки при введении инсулина (например, введение двойной дозы)
- явная передозировка (неправильно назначенная доза) инсулина или таблетированных препаратов
- введение инсулина (или прием таблетированного сахароснижающего препарата) с последующим пропуском очередного приема пищи
- прием алкоголя (алкоголь на время блокирует печеночную продукцию глюкозы)
- физическая нагрузка (достаточно длительная и интенсивная нагрузка требует уменьшения дозы сахароснижающих препаратов до и после нее)
- некупирование легкой гипогликемии (например, пациент не имеет при себе углеводы)
Симптомы гипогликемии:
1. Учащенное сердцебиение
Учащенное сердцебиение
2. Бледность кожи
3. Озноб, потливость и влажность ладоней
4. Нарушение зрения (помутнение, появление «мушек» в глазах)
5. Слабость, неустойчивость походки, нарушение координации движений
6. Чувство голода
7. Дрожь в теле
8. Тошнота
9. Трудность мышления, неспособность сосредоточиться
10. Покалывание в области рта, онемение губ и языка
11. Головная боль, головокружение
12. Тревога, беспокойство, агрессивность, раздражительность
13. Затрудненность речи, нарушение концентрации внимания
14. Головная боль по утрам после пробуждения может означать гипогликемию ночью!
Ночная гипогликемия может быть вызвана:
1. высокой дозой продленного инсулина на ночь
2. физическими упражнениями после обеда или вечером без снижения дозы инсулина перед сном
3. употреблением алкоголя (риск развития сохраняется в течении 24 часов после употребления алкоголя).
употреблением алкоголя (риск развития сохраняется в течении 24 часов после употребления алкоголя).
Признаки гипогликемии у больного сахарным диабетом:
1. внезапная бледность
2. «остекленевший» или застывший взгляд
3. невнятная речь
4. странное поведение
5. необычное возбуждение, агрессивность или плаксивость
6. неспособность сконцентрировать внимание
7. судороги
8. потеря сознания/кома
Снижение сахара крови может произойти очень быстро, поэтому при возникновении симптомов гипогликемии необходимо немедленно:
1. определить уровень глюкозы крови
2. быстро принять один из следующих продуктов:
1 стакан (200 мл) фруктового (виноградного или яблочного) сока
1 стакан сладкого напитка (содержащего сахар, но не сахарозаменитель)
4 чайные ложки сахара в половине чашки воды
1-1,5 столовых ложек меда, варенья
4-5 больших таблеток глюкозы (15 г) или 3-5 кусков сахара
3-5 конфет (не шоколадные, т. к. шоколад поднимает глюкозу крови очень медленно (25-30 мин), поэтому не должен использоваться для купирования гипогликемии),
к. шоколад поднимает глюкозу крови очень медленно (25-30 мин), поэтому не должен использоваться для купирования гипогликемии),
3. снова измерить уровень глюкозы в крови
4. если состояние не улучшилось через 5-10 минут или содержание сахара крови остается на слишком низком уровне, принять еще одну порцию перечисленных выше продуктов
5. если через 5 минут состояние улучшилось и в течение 30 минут после эпизода гипогликемии не ожидается обычного приема пищи, нужно перекусить (следует съесть продукты, содержащие медленно усваиваемые углеводы, например хлеб, фрукт, печенье, булочку или батончик из злаков, бутерброд)
6. если человек потерял сознание, ни в коем случае нельзя вкладывать или вливать что-то в рот, а
необходимо немедленно вызвать скорую помощь!
7. вождение автомобиля: если развилось состояние гипогликемии, прежде чем сесть за руль, необходимо подождать примерно 45 минут после улучшения самочувствия. Нельзя садиться за руль, пока уровень глюкозы крови менее 5,0 ммоль/л. Если необходимо преодолеть большие расстояния, надо останавливаться каждые 60-90 минут и проверять уровень глюкозы крови. При уровне глюкозы менее 5,0 ммоль/л – принять сахар, конфеты или сладкий напиток.
Если необходимо преодолеть большие расстояния, надо останавливаться каждые 60-90 минут и проверять уровень глюкозы крови. При уровне глюкозы менее 5,0 ммоль/л – принять сахар, конфеты или сладкий напиток.
8. необходимо проинформировать членов семьи и близких о наличии сахарного диабета, о месте хранения средств для купирования гипогликемии; всегда иметь при себе специальную карточку (браслет или кулон), в которой написано, что вы страдаете сахарным диабетом.
Бессимптомная гипогликемия – это развитие гипогликемии без ощущения характерных симптомов. Такое состояние может быть обусловлено диабетическим поражением периферической нервной системы, большим количеством пропущенных гипогликемий и может быть распознано только при измерении глюкозы крови с помощью глюкометра. Поэтому больным сахарным диабетом очень важно регулярно следить за уровнем сахара крови. Если состояние гипогликемии развивается бессимптомно, то необходимо избегать значений глюкозы крови ниже 5,0 ммоль/л.
Как предотвратить гипогликемию:
1. Соблюдать регулярность основных приемов пищи и перекусов.
2. Регулярно придерживаться назначенной схемы лечения диабета, приема сахароснижающих препаратов, соблюдать технику введения инсулина и порядок чередования мест для его введения.
3. Регулярно проводить измерение уровня глюкозы крови при помощи глюкометра (самоконтроль гликемии), дополнительно — до и после физической нагрузки.
4. Дополнительно принимать пищу перед и во время незапланированных или продолжительных физических нагрузок.
С-пептид в сыворотке
Общая информация об исследовании
С-пептид (от англ. сonnecting peptide – «связующий», «соединительный пептид») назван так потому, что соединяет альфа- и бета-пептидные цепи в молекуле проинсулина. Этот белок необходим для осуществления в клетках поджелудочной железы синтеза инсулина – многоступенчатого процесса, на заключительном этапе которого неактивный проинсулин расщепляется с высвобождением активного инсулина. В результате этой реакции также образуется равное инсулину количество С-пептида, в связи с чем этот лабораторный показатель используется для оценки уровня эндогенного инсулина (концентрацию самого инсулина с этой целью измеряют достаточно редко). Это связано с особенностями метаболизма инсулина в норме и при патологии поджелудочной железы. После секреции инсулин с током портальной крови направляется в печень, которая аккумулирует значительную его часть («эффект первого прохождения»), и лишь затем поступает в системный кровоток. В результате этого концентрация инсулина в венозной крови не отражает уровень его секреции поджелудочной железой. Кроме того, уровень инсулина значительно варьируется при многих физиологических состояниях (например, прием пищи стимулирует его выработку, а при голодании она снижена). Его концентрация меняется и при заболеваниях, сопровождающихся значительным снижением уровня инсулина (сахарном диабете). При появлении аутоантител к инсулину проведение химических реакций для его определения весьма затруднительно.
В результате этой реакции также образуется равное инсулину количество С-пептида, в связи с чем этот лабораторный показатель используется для оценки уровня эндогенного инсулина (концентрацию самого инсулина с этой целью измеряют достаточно редко). Это связано с особенностями метаболизма инсулина в норме и при патологии поджелудочной железы. После секреции инсулин с током портальной крови направляется в печень, которая аккумулирует значительную его часть («эффект первого прохождения»), и лишь затем поступает в системный кровоток. В результате этого концентрация инсулина в венозной крови не отражает уровень его секреции поджелудочной железой. Кроме того, уровень инсулина значительно варьируется при многих физиологических состояниях (например, прием пищи стимулирует его выработку, а при голодании она снижена). Его концентрация меняется и при заболеваниях, сопровождающихся значительным снижением уровня инсулина (сахарном диабете). При появлении аутоантител к инсулину проведение химических реакций для его определения весьма затруднительно. Наконец, если в качестве заместительной терапии применяется рекомбинантный инсулин, отличить экзогенный и эндогенный инсулин не представляется возможным. В отличие от инсулина, С-пептид не подвергается «эффекту первого прохождения» в печени, поэтому концентрация С-пептида в крови соответствует его продукции в поджелудочной железе. Так как С-пептид вырабатывается в равном соотношении с инсулином, то концентрация С-пептида в периферической крови соответствует непосредственной продукции инсулина в поджелудочной железе. Кроме того, концентрация С-пептида не зависит от изменения уровня глюкозы в крови и относительно постоянна. Эти особенности позволяют считать анализ на С-пептид наилучшим методом оценить выработку инсулина в поджелудочной железе.
Наконец, если в качестве заместительной терапии применяется рекомбинантный инсулин, отличить экзогенный и эндогенный инсулин не представляется возможным. В отличие от инсулина, С-пептид не подвергается «эффекту первого прохождения» в печени, поэтому концентрация С-пептида в крови соответствует его продукции в поджелудочной железе. Так как С-пептид вырабатывается в равном соотношении с инсулином, то концентрация С-пептида в периферической крови соответствует непосредственной продукции инсулина в поджелудочной железе. Кроме того, концентрация С-пептида не зависит от изменения уровня глюкозы в крови и относительно постоянна. Эти особенности позволяют считать анализ на С-пептид наилучшим методом оценить выработку инсулина в поджелудочной железе.
В норме инсулин производится в бета-клетках поджелудочной железы в ответ на повышение концентрации глюкозы крови. Этот гормон выполняет многие функции, главная из которых, однако, это обеспечение поступления глюкозы в инсулин-зависимые ткани (в печень, жировую и мышечную ткань). Заболевания, при которых происходит абсолютное или относительное снижение уровня инсулина, нарушают утилизацию глюкозы и сопровождаются гипергликемией. Несмотря на то что причины и механизмы развития этих заболеваний различны, гипергликемия является общим метаболическим нарушением, которое обуславливает их клиническую картину; это диагностический критерий сахарного диабета. Различают сахарный диабет 1-го и 2-го типа, а также некоторые другие синдромы, характеризующиеся гипергликемией (LADA, MODY-диабет, диабет беременных и др.).
Заболевания, при которых происходит абсолютное или относительное снижение уровня инсулина, нарушают утилизацию глюкозы и сопровождаются гипергликемией. Несмотря на то что причины и механизмы развития этих заболеваний различны, гипергликемия является общим метаболическим нарушением, которое обуславливает их клиническую картину; это диагностический критерий сахарного диабета. Различают сахарный диабет 1-го и 2-го типа, а также некоторые другие синдромы, характеризующиеся гипергликемией (LADA, MODY-диабет, диабет беременных и др.).
Сахарный диабет 1-го типа характеризуется аутоиммунным разрушением ткани поджелудочной железы. В то время как в основном бета-клетки повреждаются аутореактивными Т-лимфоцитами, в крови больных СД 1-го типа также удается выявить и аутоантитела к некоторым антигенам бета-клеток. Разрушение клеток приводит к снижению концентрации инсулина в крови.
Развитию СД 1-го типа у предрасположенных лиц способствуют такие факторы, как некоторые вирусы (вирус Эпштейна – Барр, вирус Коксаки, парамиксовирус), стресс, гормональные нарушения и др. Распространенность СД 1-го типа среди населения составляет около 0,3-0,4 % и значительно уступает СД 2-го типа. СД 1-го типа чаще возникает до 30 лет и характеризуется выраженной гипергликемией и симптоматикой, причем у детей он чаще развивается внезапно на фоне полного здоровья. Для острого начала СД 1-го типа характерна выраженная полидипсия, полиурия, полифагия и потеря веса. Нередко его первым проявлением является диабетический кетоацидоз. Как правило, такая симптоматика отражает уже состоявшуюся значительную потерю бета-клеток. У молодых людей СД 1-го типа может развиваться более длительно и постепенно. Значительная потеря бета-клеток в начале болезни связана с недостаточным контролем за уровнем глюкозы при лечении препаратами инсулина и быстрым развитием осложнений диабета. И, напротив, наличие остаточной функции бета-клеток ассоциировано с надлежащим контролем за уровнем глюкозы при лечении инсулином, с более поздним развитием осложнений диабета и является хорошим прогностическим признаком.
Распространенность СД 1-го типа среди населения составляет около 0,3-0,4 % и значительно уступает СД 2-го типа. СД 1-го типа чаще возникает до 30 лет и характеризуется выраженной гипергликемией и симптоматикой, причем у детей он чаще развивается внезапно на фоне полного здоровья. Для острого начала СД 1-го типа характерна выраженная полидипсия, полиурия, полифагия и потеря веса. Нередко его первым проявлением является диабетический кетоацидоз. Как правило, такая симптоматика отражает уже состоявшуюся значительную потерю бета-клеток. У молодых людей СД 1-го типа может развиваться более длительно и постепенно. Значительная потеря бета-клеток в начале болезни связана с недостаточным контролем за уровнем глюкозы при лечении препаратами инсулина и быстрым развитием осложнений диабета. И, напротив, наличие остаточной функции бета-клеток ассоциировано с надлежащим контролем за уровнем глюкозы при лечении инсулином, с более поздним развитием осложнений диабета и является хорошим прогностическим признаком.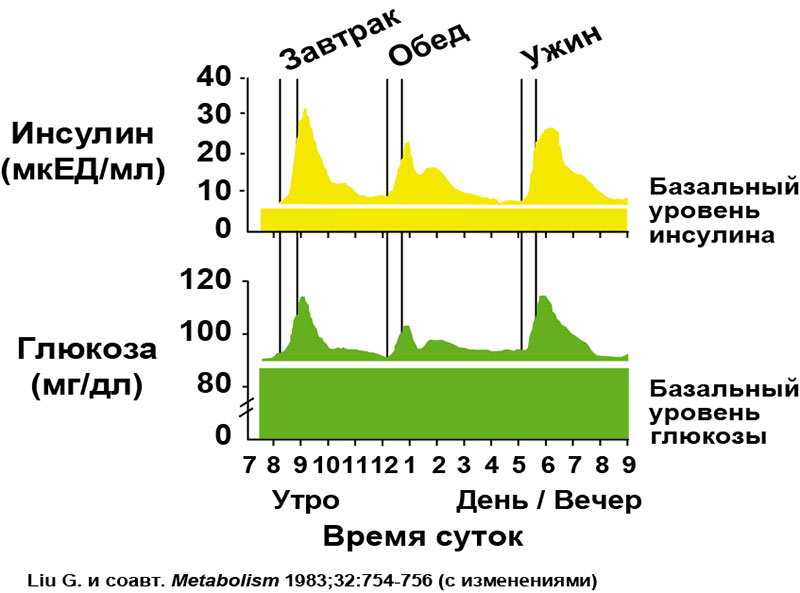 Единственный метод, позволяющий оценить остаточную функцию бета-клеток, – измерение С-пептида, поэтому данный показатель могут использовать, чтобы дать прогноз СД 1-го типа при его первичной диагностике.
Единственный метод, позволяющий оценить остаточную функцию бета-клеток, – измерение С-пептида, поэтому данный показатель могут использовать, чтобы дать прогноз СД 1-го типа при его первичной диагностике.
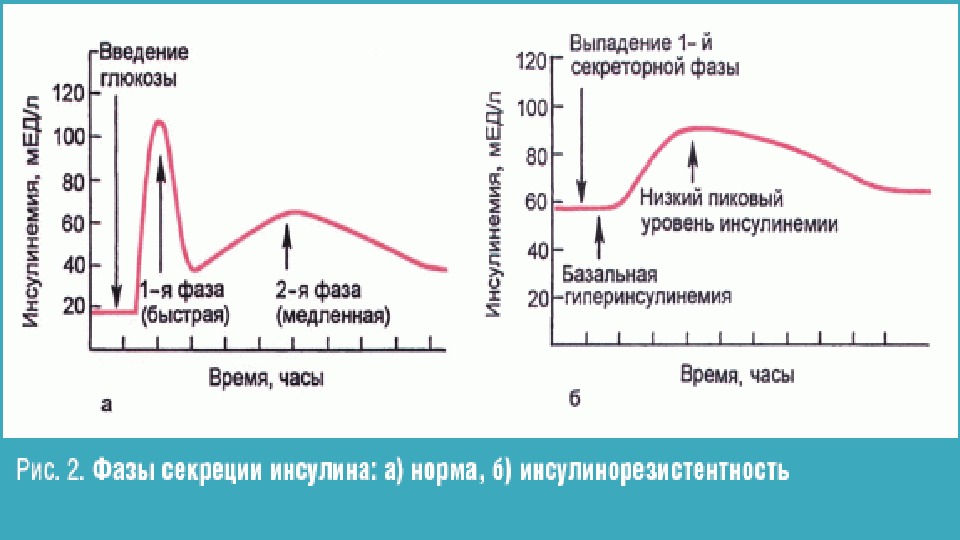
При СД 2-го типа нарушена секреция инсулина и чувствительность периферических тканей к его воздействию. Несмотря на то что уровень инсулина в крови может быть нормальным или даже повышенным, он остается низким на фоне присутствующей гипергликемии (относительная недостаточность инсулина). Кроме того, при СД 2-го типа нарушены физиологические ритмы секреции инсулина (фаза быстрой секреции на ранних этапах болезни и базальная секреция инсулина при прогрессировании заболевания). Причины и механизмы нарушения секреции инсулина при СД 2-го типа до конца не выяснены, однако установлено, что одним из ведущих факторов риска является ожирение, а физические нагрузки значительно понижают вероятность развития СД 2-го типа (или благоприятно влияют на его течение)
Пациенты с СД 2-го типа составляют около 90-95 % всех больных сахарным диабетом.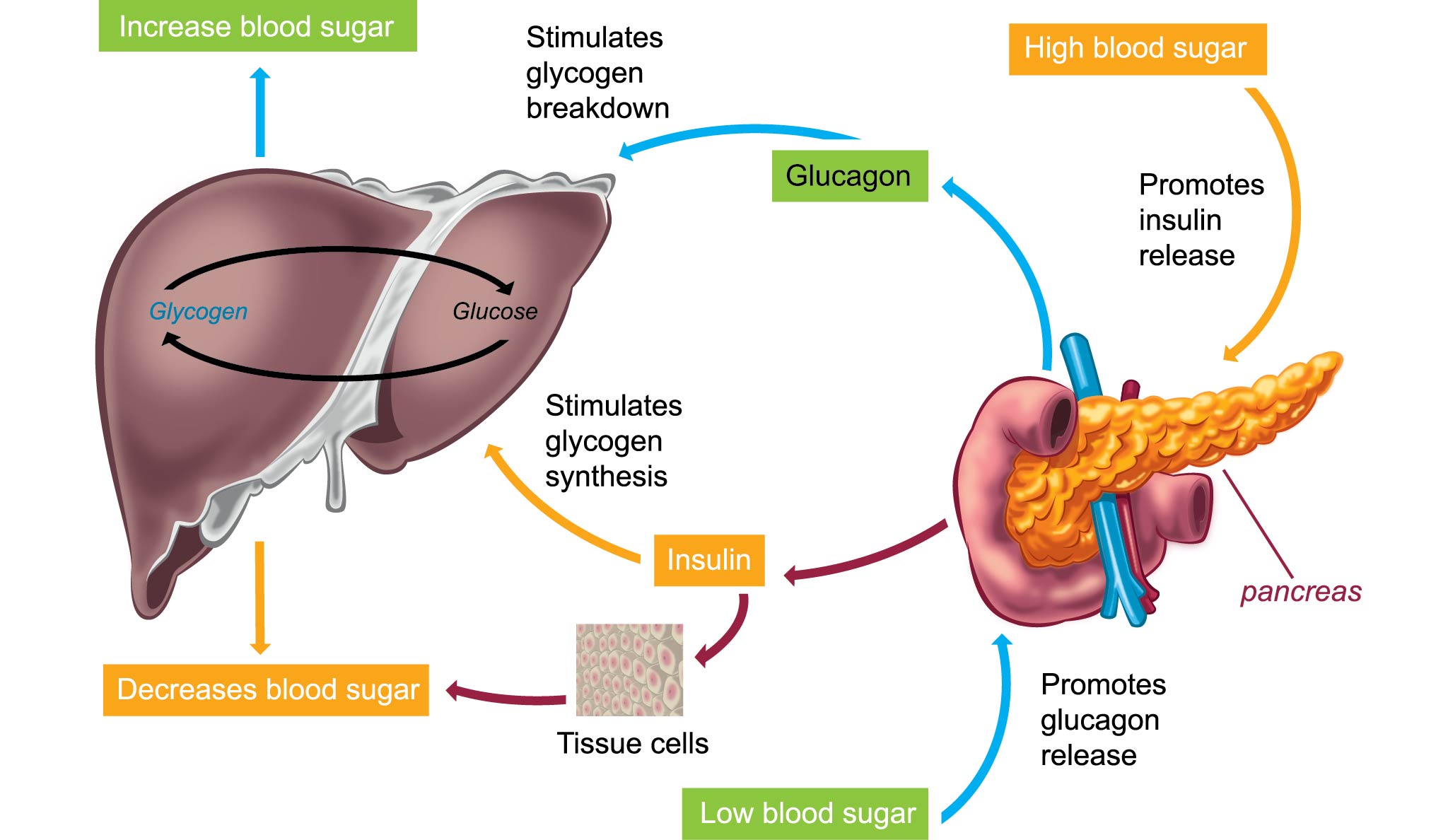 У большинства из них в семье есть больные СД 2-го типа, что подтверждает генетическую предрасположенность к заболеванию. Как правило, СД 2-го типа возникает после 40 лет и развивается постепенно. Гипергликемия не так сильно выражена, как при СД 1-го типа, поэтому осмотический диурез и дегидратация для СД 2-го типа нехарактерны. Ранние этапы болезни сопровождаются неспецифическими симптомами: головокружением, слабостью и нарушениями зрения. Часто пациент не обращает на них внимания, однако в течение нескольких лет заболевание прогрессирует и приводит уже к необратимым изменениям: инфаркту миокарда и гипертоническому кризу, хронической почечной недостаточности, снижению или потере зрения, нарушению чувствительности конечностей с образованием язв.
У большинства из них в семье есть больные СД 2-го типа, что подтверждает генетическую предрасположенность к заболеванию. Как правило, СД 2-го типа возникает после 40 лет и развивается постепенно. Гипергликемия не так сильно выражена, как при СД 1-го типа, поэтому осмотический диурез и дегидратация для СД 2-го типа нехарактерны. Ранние этапы болезни сопровождаются неспецифическими симптомами: головокружением, слабостью и нарушениями зрения. Часто пациент не обращает на них внимания, однако в течение нескольких лет заболевание прогрессирует и приводит уже к необратимым изменениям: инфаркту миокарда и гипертоническому кризу, хронической почечной недостаточности, снижению или потере зрения, нарушению чувствительности конечностей с образованием язв.
Несмотря на наличие характерных особенностей, позволяющих заподозрить СД 1-го или 2-го типа у пациента с впервые диагностированной гипергликемией, единственным методом, позволяющим однозначно оценить степень снижения функции бета-клеток, является измерение С-пептида, поэтому этот показатель используют в дифференциальной диагностике типов сахарного диабета, особенно в педиатрической практике.
С течением времени в клинической картине как СД 2-го, так и СД 1-го типа начинают преобладать проявления длительной хронической гипергликемии — заболевания сердечно-сосудистой системы, почек, сетчатки и периферических нервов. При своевременной диагностике, раннем начале лечения и адекватном контроле уровня глюкозы большинство этих осложнений удается предотвратить. Методы лечения в первую очередь должны быть направлены на сохранение остаточной функции β-клеток, а также на поддержание оптимального уровня глюкозы. Для лечения СД 1-го типа лучшим методом лечения является терапия рекомбинантным инсулином. Показано, что своевременно начатое лечение инсулином замедляет процесс аутоиммунного разрушения β-клеток и снижает риск развития осложнений диабета. Для оценки лечения СД традиционно используют показатели глюкозы и гликозилированного гемоглобина (HbA1c). Однако эти показатели не способны охарактеризовать влияние лечения на сохранение функции β-клеток. Для оценки такого влияния используется измерение С-пептида. Это единственный способ оценки уровня секреции инсулина поджелудочной железой при лечении препаратами экзогенного инсулина. Одним из перспективных способов лечения СД 1-го типа является пересадка (инфузия) донорских клеток поджелудочной железы. Такой метод обеспечивает оптимальный контроль уровня глюкозы без ежедневных многократных инъекций инсулина. Успех операции зависит от многих причин, в том числе и от совместимости тканей донора и реципиента. Функцию донорских β-клеток поджелудочной железы после трансплантации оценивают с помощью измерения концентрации С-пептида. К сожалению, применение этого метода в России пока ограничено.
Это единственный способ оценки уровня секреции инсулина поджелудочной железой при лечении препаратами экзогенного инсулина. Одним из перспективных способов лечения СД 1-го типа является пересадка (инфузия) донорских клеток поджелудочной железы. Такой метод обеспечивает оптимальный контроль уровня глюкозы без ежедневных многократных инъекций инсулина. Успех операции зависит от многих причин, в том числе и от совместимости тканей донора и реципиента. Функцию донорских β-клеток поджелудочной железы после трансплантации оценивают с помощью измерения концентрации С-пептида. К сожалению, применение этого метода в России пока ограничено.
В отличие от СД 1-го типа, СД 2-го типа длительное время не требует лечения инсулином. Контроль над болезнью в течение определенного периода достигается с помощью изменения образа жизни и гипогликемических препаратов. Однако в итоге большинству пациентов с СД 2-го типа для оптимального контроля уровня глюкозы все же необходима заместительная терапия инсулином. Как правило, необходимость перевода пациента на препараты инсулина возникает в результате невозможности контролировать уровень глюкозы даже при применении комбинации гипогликемических средств в максимальных терапевтических дозах. Такое течение заболевания связано со значительным снижением функции β-клеток, которое развивается через несколько лет у пациентов с СД 2-го типа. В этой ситуации измерение С-пептида позволяет обосновать необходимость изменения тактики лечения и своевременно начать лечение препаратами инсулина.
Как правило, необходимость перевода пациента на препараты инсулина возникает в результате невозможности контролировать уровень глюкозы даже при применении комбинации гипогликемических средств в максимальных терапевтических дозах. Такое течение заболевания связано со значительным снижением функции β-клеток, которое развивается через несколько лет у пациентов с СД 2-го типа. В этой ситуации измерение С-пептида позволяет обосновать необходимость изменения тактики лечения и своевременно начать лечение препаратами инсулина.
К достаточно редким заболеваниям поджелудочной железы относятся опухоли. Самой частой опухолью эндокринной части поджелудочной железы является инсулинома. Как правило, она развивается в возрасте 40-60 лет. В подавляющем большинстве случаев инсулинома является доброкачественным образованием. Инсулинома может локализоваться не только в пределах ткани поджелудочной железы, но и в любом другом органе (эктопическая инсулинома). 80% инсулином являются гормонально активными опухолями. Клиническая картина заболевания обусловлена действием избыточного инсулина и гипогликемией. Частыми симптомами инсулиномы являются беспокойство, сердцебиение, повышенная потливость (профузный пот), головокружение, чувство голода и нарушение сознания. Симптомы купируются при приеме пищи. Частые эпизоды гипогликемии приводят к нарушению памяти, сна и изменениям со стороны психики. Выявление повышенного С-пептида помогает в диагностике инсулиномы и может быть использовано в сочетании с другими лабораторными и инструментальными методами. Необходимо отметить, что инсулинома является составляющей синдрома множественной эндокринной неоплазии, а также может сочетаться с другой опухолью поджелудочной железы – гастриномой.
Клиническая картина заболевания обусловлена действием избыточного инсулина и гипогликемией. Частыми симптомами инсулиномы являются беспокойство, сердцебиение, повышенная потливость (профузный пот), головокружение, чувство голода и нарушение сознания. Симптомы купируются при приеме пищи. Частые эпизоды гипогликемии приводят к нарушению памяти, сна и изменениям со стороны психики. Выявление повышенного С-пептида помогает в диагностике инсулиномы и может быть использовано в сочетании с другими лабораторными и инструментальными методами. Необходимо отметить, что инсулинома является составляющей синдрома множественной эндокринной неоплазии, а также может сочетаться с другой опухолью поджелудочной железы – гастриномой.
Для чего используется исследование?
- Для оценки уровня секреции инсулина β-клетками поджелудочной железы при подозрении на сахарный диабет;
- для оценки влияния лечения на сохранение остаточной функции β-клеток поджелудочной железы и оценки прогноза СД 1-го типа;
- для выявления значимого снижения функции β-клеток поджелудочной железы и своевременного начала терапии препаратами инсулина у пациентов с СД 2-го типа;
- для диагностики инсулиномы, а также сочетанных опухолей поджелудочной железы.

Когда назначается исследование?
- При наличии симптомов выраженной гипергликемии при СД 1-го типа: жажда, увеличение объема суточной мочи, прибавка веса, усиление аппетита;
- при наличии симптомов умеренной гипергликемии при СД 2-го типа: нарушения зрения, головокружения, слабости, особенно у лиц с избытком массы тела или ожирением;
- при наличии симптомов хронической гипергликемии: прогрессирующее снижение зрения, снижение чувствительности конечностей, образование длительно не заживающих язв нижних конечностей, развитие хронической почечной недостаточности, ишемической болезни сердца и артериальной гипертензии, особенно у лиц с избытком массы тела или с ожирением;
- при проведении дифференциальной диагностики СД 1-го и 2-го типов, особенно в случае диагностики СД у детей и молодых людей;
- на этапе контроля лечения СД 1-го типа;
- при решении вопроса о необходимости начала терапии инсулином у пациентов с СД 2-го типа, которым не удается достичь оптимального уровня глюкозы с помощью комбинации гипогликемических препаратов в максимально возможных терапевтических дозах;
- при наличии симптомов гипогликемии при инсулиноме: беспокойство, сердцебиение, повышенная потливость, головокружение, чувство голода, нарушения сознания, памяти, сна и психики.
Как распознать у себя диабет второго типа
В переводе с греческого диабет значит «истечение», а сахарный диабет буквально переводится как «теряющий сахар». Сахарный диабет – состояние, при котором организм не может нормально производить или усваивать гормон поджелудочной железы. В результате сахар не усваивается и вместо того, чтобы проникать в клетки, постоянно находится в крови и выделяется с мочой.
Два типа
Различают два основных типа сахарного диабета. Первый тип связан с генетической предрасположенностью к диабету. Иммунная система разрушает инсулиновые клетки поджелудочной железы, и человек нуждается в инъекциях инсулина всю жизнь. При этом можно поддерживать нормальное качество жизни, контролировать болезнь и дожить до старости.
При втором типе диабета в большинстве случаев человек не подозревает, что уже болен, так как диабет возникает практически бессимптомно. Болезнь развивается постепенно, потому что инсулин не отсутствует полностью, но его недостаточно для потребностей организма.
Диабет этого типа может проявляться частыми инфекциями, особенно мочевыводящих путей, возможна жажда, зуд кожи, снижение остроты зрения. Похудание бывает не так часто, а у полных людей (которых при этом типе диабета очень много) его можно и не заметить. При втором типе диабета в первую очередь назначается диета.
Если диеты недостаточно, то прибегают к сахаропонижающим таблеткам, возможна также инсулинотерапия. Обычно сахарным диабетом I типа заболевают в возрасте до 30 лет, II типа – после 40 лет.Сахарный диабет II типа встречается значительно чаще, составляя в настоящее время около 90 % от всего диабета.
Диабет как фоновое заболевание может стать катализатором развития гипертонии, слепоты, гангрены, почечной недостаточности. Поэтому очень важно предупредить это хроническое неинфекционное заболевание, которое грозит перерасти в мире в настоящую эпидемию.
Симптомы
Человек, у которого уже запустился процесс развития диабета, отмечает один или несколько следующих симптомов:
– сухость во рту;
– жажду;
– повышенное мочеотделение;
– похудание;
– слабость;
– снижение трудоспособности;
– повышенный аппетит;
– кожный зуд;
– зуд в промежности.
Часто наблюдаются головная боль, нарушение сна, раздражительность, боль в области сердца, в икроножных мышцах. В группе риска находятся беременные.
В период вынашивания ребенка женщина испытывает сильную функциональную нагрузку, которой подвергаются все органы и системы организма.
В этот период могут обостриться хронические заболевания или сформироваться новые патологические процессы, в том числе гестационный сахарный диабет (или сахарный диабет беременных).
Виноваты сами
При втором типе диабета значительную роль играет наличие избыточного веса. При ожирении нарушается обмен веществ и снижается чувствительность клеток к инсулину. Наступает приобретенная инсулинорезистентность.
Еще здоровая поджелудочная железа получает от клеток сигнал о том, что им не хватает глюкозы, и начинает усиленно работать. Выброс больших доз инсулина вызывает чувство голода, которое заставляет есть еще больше.
Из-за чего масса тела, а с ней и нечувствительность клеток к инсулину растут как на дрожжах. А перегруженная поджелудочная железа постепенно разрушается. Свой вклад в разрушение поджелудочной железы вносит и атеросклероз сосудов, возникающий при ожирении.
А перегруженная поджелудочная железа постепенно разрушается. Свой вклад в разрушение поджелудочной железы вносит и атеросклероз сосудов, возникающий при ожирении.
В том числе и тех, что питают поджелудочную железу. А она, в свою очередь, теряет способность производить инсулин вовремя и в достаточном количестве. В здоровом организме инсулин начинает вырабатываться практически сразу после того, как в кровь из кишечника поступает глюкоза.
А вот при диабете второго типа поджелудочная железа начинает «тормозить» и посылать инсулин слишком поздно, да еще и в количестве, недостаточном для переработки всей поступившей с едой глюкозы. Из-за этого растет уровень сахара в крови, но клетки организма все равно энергии не получают.
Диагностика
Диагноз «диабет» ставится на основании анализа крови на содержание глюкозы. Нормой является 3,3-5,5 ммоль/л натощак. После еды уровень сахара в крови у человека без сахарного диабета может повышаться до 7,8 ммоль/л.
[[gallery_1]]
Предупредить болезнь
Защититься от диабета второго типа просто:
– сократите количество высококалорийной пищи в рационе: откажитесь в основном от фастфуда и переработанных продуктов;
– следите за массой тела: понять, нормальный ли у вас вес, можно, посчитав индекс массы тела;
– регулярно двигайтесь: Всемирная организация здравоохранения рекомендует не менее получаса умеренной физической нагрузки в день.
Читайте новости там, где удобно: Twitter, Fb , Vk, Оk, Яндекс.Дзен.
Эксперт раскрыл пользу чувства голода: Явления: Ценности: Lenta.ru
Британский доктор Майкл Мосли (Michael Mosley) раскрыл пользу чувства голода. Соответствующий материал публикует Daily Mail.
Специалист призвал читателей не бояться испытывать это ощущение. Он объяснил, что «страх проголодаться заставляет нас слишком часто есть».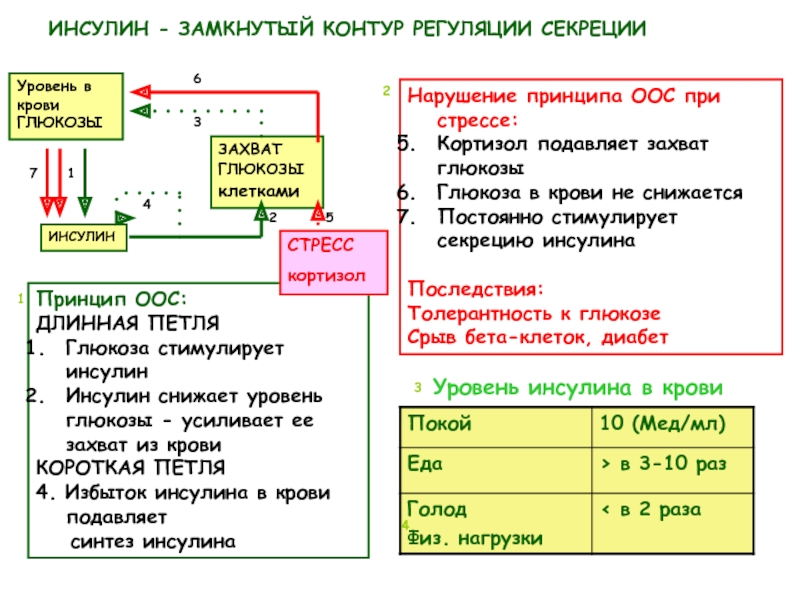 Мосли также добавил, что из-за соблазнов делать частые перекусы у большинства людей резко сократились перерывы между приемами пищи (с четырех с половиной часов до трех с половиной часов). Кроме того, люди съедают за один присест чересчур много еды, в результате чего они перенасыщаются и испытывают дискомфорт.
Мосли также добавил, что из-за соблазнов делать частые перекусы у большинства людей резко сократились перерывы между приемами пищи (с четырех с половиной часов до трех с половиной часов). Кроме того, люди съедают за один присест чересчур много еды, в результате чего они перенасыщаются и испытывают дискомфорт.
«Ваше тело будет благодарить вас за отказ от перекусов и увеличение промежутков времени между приемами пищи. Если не нагружать пищеварение, то разные системы вашего организма смогут исправно работать и восстановиться, это защитит вас от болезней. В ночное время органам нужно отдыхать, поэтому лучше не есть поздно вечером и избегать перекусов перед сном», — подчеркнул доктор.
По словам мужчины, он долгое время практикует интервальное голодание, укладывая все приемы пищи за день в рамках 8-12 часов. «Я думал, что голодание будет меня очень отвлекать. Однако в итоге обнаружил, что это ощущение, наоборот, обостряет мои чувства и работоспособность мозга», — заверил Мосли.
Материалы по теме
00:03 — 25 марта
00:01 — 19 ноября 2020
Голодные до красоты
Наркотики, сигареты и смертельный сон: почему и как люди веками пытаются похудеть
Кроме того, специалист перечислил продукты, которые вызывают ложное чувство голода.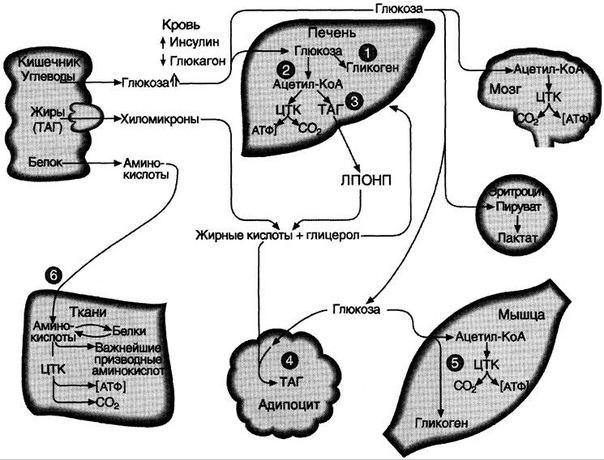 В частности, речь идет о вредной еде: о шоколаде, мороженом, чипсах, пицце, печенье, пирожных, попкорне с маслом и чизбургерах. Употребление большого количества рафинированной сладкой пищи провоцирует выработку инсулина поджелудочной железой, а высокий уровень инсулина вызывает чувство голода, что приводит к частым перекусам.
В частности, речь идет о вредной еде: о шоколаде, мороженом, чипсах, пицце, печенье, пирожных, попкорне с маслом и чизбургерах. Употребление большого количества рафинированной сладкой пищи провоцирует выработку инсулина поджелудочной железой, а высокий уровень инсулина вызывает чувство голода, что приводит к частым перекусам.
«Это знание поможет понять, почему вас продолжает тянуть к вредной еде, и, быть может, вы дадите отпор этим пристрастиям», — заключил мужчина.
В апреле блогерша раскрыла секрет похудения на 20 килограммов без диет. Австралийка Бри Лихан (Bree Lenehan) рассказала, что ест только питательные продукты, которые помогают ей дольше оставаться сытой. Таким образом женщина потребляет в пищу меньше блюд, снижая количество съеденных калорий.
Быстрая доставка новостей — в «Ленте дня» в Telegram
Анализы на уровень лептина в лаборатории СИНЭВО
Важно помнить!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения.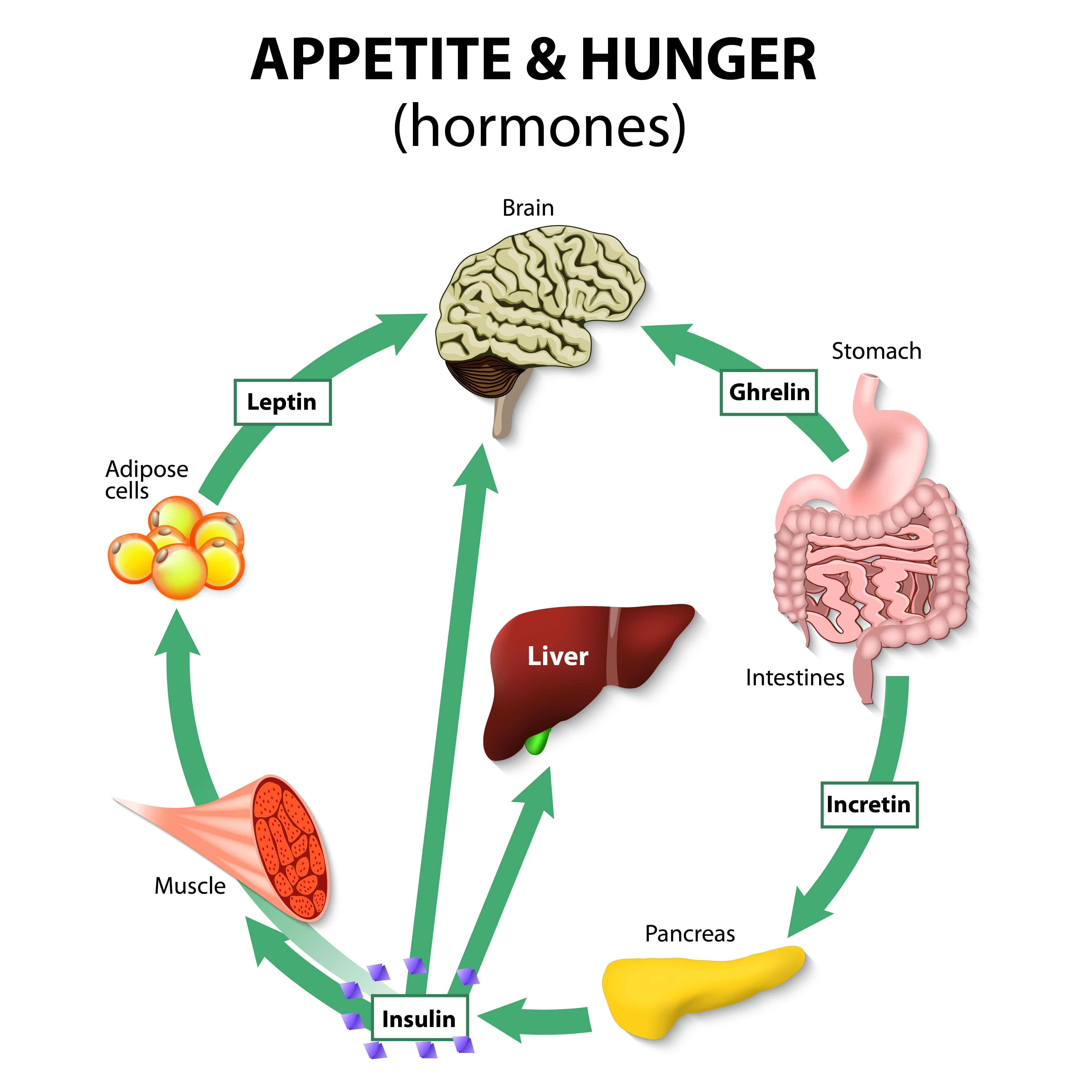 В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Всем без исключения известны чувства голода, а также насыщения, но откуда они появляются? В организме человека вырабатывается множество гормонов и других биологически активных веществ, одним из которых является лептин. Он представляет собой гормон белой жировой ткани, от количества которой и зависит его концентрация в крови. Именно поэтому во время голодания уровень лептина значительно снижается, а при переедании может стремительно увеличиваться. Этот гормон играет важную роль в нормальной жизнедеятельности человека и выполняет следующие функции:
- снижает аппетит;
- уменьшает общее потребление пищи;
- способствует формированию чувства голода;
- ускоряет липолиз или распад жиров;
- увеличивает синтез гликогена в мышечных тканях;
- способствует более быстрой утилизации глюкозы из крови;
- препятствует эктопическому отложению жиров в тканях при переедании.
Любые нарушения в процессе выработки этого важного гормона могут привести к избыточному употреблению пищи, что, в свою очередь, может стать причиной ожирения.
Среди факторов, негативно влияющих на общий уровень лептина в крови, можно выделить такие, как:
- чрезмерное употребление фруктозы;
- стрессовое состояние;
- недостаточное количество сна;
- повышенный уровень инсулина;
- чрезмерные физические нагрузки;
- большое употребление в пищу пектина или мучных изделий;
- переедание.
Стоит обязательно обратиться к врачу и пройти обследование, сдать анализы на уровень гормона в том случае, если вы заметили у себя следующие симптомы:
- очень рано появилось выраженное ожирение, что может свидетельствовать о генетическом дефиците лептина;
- нарушилась репродуктивная функция при чрезмерном снижении питания, а также слишком интенсивных физических нагрузках;
- имеются рецидивирующие тромбозы.

Определить уровень данного гормона в крови может быть полезным и при комплексном исследовании проблем, которые могут быть связаны со снижением или же повышением веса, с ранним выявлением риска различных сердечнососудистых заболеваний или же при диагностике диабета.
В качестве метода исследования лептина применяется иммуноанализ. Для проведения данной процедуры имеются определенные требования. Биоматериал, предназначенный для исследования, сдается только натощак. Причем к моменту забора крови после последнего употребления пищи должно пройти не меньше 8-12 часов. Для получения достоверных результатов прием любых других напитков кроме воды не допускается.
В большинстве случаев повышение уровня рассматриваемого гормона в крови вызывается такими заболеваниями, как:
- метаболический синдром;
- алиментарное ожирение, вызванное нерегулярным и неправильным питанием;
- переедание;
- инсулинонезависимый сахарный диабет (ИНСД).

Уровень ниже нормы может наблюдаться в следующих случаях:
- неполноценное и недостаточное питание;
- нарушения функции выработки гормона;
- нарушения и сбои в процессе работы рецепторов, отвечающих за проведение необходимых гормональных сигналов.
Проведение такой процедуры, как иммуноанализ, является очень важным и необходимым, так как позволяет не только определить причины патогенеза ожирения, но и провести полноценное обследование тех больных, которые страдают от метаболического синдрома.
За уровнем лептина в крови необходимо следить, потому что его повышение может привести к появлению тромбоза, инфарктов или инсультов, особенно у людей с избыточным весом. От него зависит и уровень артериального давления, а также концентрация атерогенных липопротеидов. В связи с тем, что данный гормон оказывает существенное влияние на эластичность артерий, даже при здоровом образе жизни у человека при повышенном его содержании могут появиться серьезные проблемы с сердечнососудистой системой.
Чем еще опасен лептин?
Его высокое содержание в крови активно подавляет выработку инсулина, что приводит к развитию такого заболевания, как сахарный диабет. Также при отказе от приемов пищи низкая концентрация гормона способствует появлению аменореи или отсутствию менструаций.
Исследования указывают на то, что у основной массы людей, страдающих от ожирения, наблюдается увеличение содержания данного гормона в крови в несколько раз. Причем причина этого кроется в потере чувствительности гипоталамуса к действиям вырабатываемого гормонального вещества. Мозг человека продолжает давать ложные сигналы о необходимости запасать энергию. Подобные процессы чаще всего являются генетическим дефектом. В таких случаях требуется квалифицированная помощь эндокринолога и других специалистов.
Где сдать анализ лептин
Сдать анализ лептин можно в любом пункте Синэво в Минске, Барановичах, Бобруйске, Борисове, Бресте, Витебске, Ганцевичах, Гомеле, Гродно, Жлобине, Лиде, Могилеве, Мозыре, Молодечно, Новогрудке, Новополоцке, Орше, Пинске, Полоцке, Речице, Светлогорске, Слуцке, Сморгони, Солигорске.
Эксперты рассказали о первых признаках диабета — Российская газета
Сахарный диабет — это заболевание, при котором в крови больного происходит резкий скачок уровня сахара. Различают четыре типа этого заболевания: преддиабет, гестационный диабет, диабет 1 и 2 типа. Только в США этим заболеванием страдает около 29 миллионов человек, многие из которых даже не осведомлены о наличии у них этой болезни. У некоторых людей диабет не диагностируется на протяжении нескольких лет. Врачи предупреждают, что есть несколько ранних признаков диабета, при которых нужно срочно стоит сдать анализы на сахар крови. Ведь ранняя диагностика — это самый лучший фактор в лечении любого заболевания, отмечает издание My Health Reads.
Первым симптомом, на который стоит обратить внимание при подозрении на диабет — это потеря остроты зрения. Если у вас случаются состояния, при которых вы теряете остроту зрения или видите все вокруг в размытой картинке, то вам обязательно стоит показаться врачу. Не стоит откладывать это визит, даже если позже вам полегчало. Вы можете пропустить важный момент лечения, а со временем не только станете диабетиком, но и можете полностью потерять зрение.
Не стоит откладывать это визит, даже если позже вам полегчало. Вы можете пропустить важный момент лечения, а со временем не только станете диабетиком, но и можете полностью потерять зрение.
Другим опасным симптомом диабета является изменение цвета кожи или кожных складок. Это явление называется черным акантозом. При нем некоторые участки кожи человека и складки кожи темнеют. Это происходит из-за того, что в коже человека с повышенным уровнем сахара в крови, вырабатывается сопротивляемость инсулину. Именно это и приводит к потемнению участков кожи. Этот симптом не стоит игнорировать. Периодически возникающее ощущение сухости во рту, также может быть признаком диабета. Это состояние ни в коем случае нельзя игнорировать. Постоянная сухость в рту не только доставляет неудобство человеку, но может и ускорить развитие диабета за счет повышения уровня глюкозы в крови. А люди, которые пьют недостаточное количество жидкости и часто испытывают сухость во рту, попадают в группу риска возникновения сахарного диабета. Обостренное чувство голода при диабете возникает в результате гликемии — состояния, когда уровень сахара в организме больного диабетом длительное время держится на высокой отметке. Из-за этого глюкоза не поступает в клетки организма, а они в свою очередь не получают необходимую им энергию, и посылают в мозг человека сигнал голода. И несмотря на то, что человек мог поесть совсем недавно, он снова испытывает острое чувство голода.
Обостренное чувство голода при диабете возникает в результате гликемии — состояния, когда уровень сахара в организме больного диабетом длительное время держится на высокой отметке. Из-за этого глюкоза не поступает в клетки организма, а они в свою очередь не получают необходимую им энергию, и посылают в мозг человека сигнал голода. И несмотря на то, что человек мог поесть совсем недавно, он снова испытывает острое чувство голода.
Синдром, известный как полиурия — это состояние, при котором у человека возникают частые позывы к мочеиспусканию. Они не зависят от количества потребляемой жидкости. А виной тому, гипергликемия. Почки человека, в стремлении переработать избыток сахара в крови, начинают работать без остановок. Это, в свою очередь, влечет за собой позывы к мочеиспусканию. Многим такой симптом может показаться незначительным или деликатным. Но если вы заметили его, то обязательно проконсультируйтесь с врачом. Частое мочеиспускание также приводит к значительной потере жидкости в организме человека.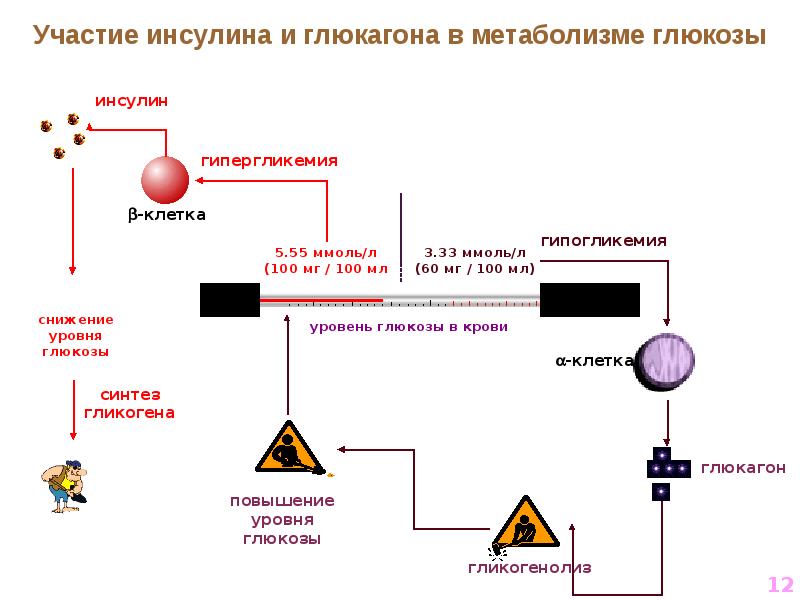 Человек испытывает чувство жажды, пьет воду, которая снова выходит из организма, так как в нем идут активные процессы гипергликемии и полиурии. Этот замкнутый круг, если его игнорировать и не лечить, тот это доставит пациенту много неудобств и поспособствует стремительному развитию диабета.
Человек испытывает чувство жажды, пьет воду, которая снова выходит из организма, так как в нем идут активные процессы гипергликемии и полиурии. Этот замкнутый круг, если его игнорировать и не лечить, тот это доставит пациенту много неудобств и поспособствует стремительному развитию диабета.
Когда в организме человека повышен уровень сахара, то он недополучает энергию из пищи, которую употребляет. Чтобы решить эту проблему, организм человека начинает сжигать жир. Расщепление жира происходит в печени человека. В результате расщепления, жир распадается на несколько разных веществ, одним из которых являются кетоны (ацетон). В небольших количествах кетоны не вредны человеку. Но когда жир расщепляется активно, то кетонов в организме вырабатывается очень много, и они вызывают чувство тошноты. Кожа диабетика также испытывает дефицит питания кровью. В результате у больного диабетом возникает чувство зуда в коже рук и ног. Именно кожа конечностей тела человека, первой испытывает проблемы с кровообращением. Наиболее часто, первыми, заметны симптомы на ступнях ног. Их кожа теряет цвет и становится сухой.
Наиболее часто, первыми, заметны симптомы на ступнях ног. Их кожа теряет цвет и становится сухой.
Многие диабетики испытывают диабетическую нейропатию — это состояние, при котором происходит временное поражение нервных клеток, ответственных за моторику конечностей человеческого тела. Чаще всего диабетическая нейропатия, начинается с онемения в ступнях и ногах больного. Повышенное количество глюкозы в организме диабетика также приводит к нарушению процессов кровообращения в клетках кожи. Лишенные необходимого количества крови, участки кожи, особенно те, на которых имеются порезы и ранки, испытывают острый дефицит крови, который им так необходим для заживления ран. Как следствие, раны долго заживают, а кожа вокруг них шелушится. Многие больные диабетом могут столкнуться с такой проблемой, как волдыри. Они появляются даже на таких ранних стадиях, как преддиабет. Выглядят они, как обычные ожоговые волдыри, как правило, небольшого размера и плотно наполненные прозрачной жидкостью. Чаще всего они появляются на руках, ступнях и предплечьях больного, но бывают и исключения.
Если вы ощущаете усталость после малейшей физической нагрузки — это серьезный повод обратиться к врачу, так как это может быть одним из ранних симптомов диабета. Организм диабетика испытывает постоянный дефицит энергии, а малейшая физическая нагрузка тратит и без того малые запасы энергии, которые имеются в организме. В итоге организм с высоким содержанием сахара получает его еще больше, что провоцирует активное развитие болезни. Многие больные диабетом, в качество одной из первых жалоб также отмечают странный сладковатый запах изо рта. Другие описывают его, как запах ацетона. Он в организме больного диабетом вырабатывается в печени в результате распада жировых клеток. Длительный процесс распада клеток жира на кетоны, называется кетоацидозом. Дурной запах изо рта — явный симптом заболевания и требует обращения к врачу.
Доказано, что больные диабетом чаще других болеют грибковыми инфекциями. Ввиду ослабленности организма диабетика, эти инфекции быстрее поражают его организм, и на его полное излечение требуется больше времени и усилий. Поэтому частый грибковые инфекции должны насторожить как мужчин, так и женщин. Сдать анализ на сахар совсем не сложно, и своевременная диагностика диабета на ранних стадиях, гарантирует высокие шансы на полное излечение.
Поэтому частый грибковые инфекции должны насторожить как мужчин, так и женщин. Сдать анализ на сахар совсем не сложно, и своевременная диагностика диабета на ранних стадиях, гарантирует высокие шансы на полное излечение.
Наконец, диабетики 2-го типа часто страдают от внезапной и резкой потери веса. Это происходит потому, что высокий уровень сахара в крови человека больного диабетом, препятствует доставке энергии в клетки человека через кровь. Организм человека испытывает острую нехватку энергии и пытается компенсировать ее недостаток, сжигая запасы жира в организме. Продолжительный процесс сжигания жира резко отражается на общей массе тела человека.
Гормональные регуляторы аппетита
3.1. Роль гипоталамуса в регулировании аппетита
Гипоталамус также является главным регулятором насыщения через производство
POMC и CART. Ген POMC
экспрессируется несколькими тканями, включая кожу и иммунную систему, а также
гипофиз и дугообразное ядро гипоталамуса. POMC подвергается тканеспецифической
посттрансляционное расщепление, при этом продукт зависит от эндопротеаз
выражается в этой ткани. Например,
Например,
в передней доле гипофиза POMC в первую очередь превращается в АКТГ посредством
прогормон конвертаза 1. У млекопитающих
кроме приматов, прогормон конвертаза 2 в промежуточном гипофизе
расщепляет АКТГ с образованием α -меланоцит-стимулирующего гормона ( α -MSH), который участвует
в контроле цвета шерсти / кожи. С участием
Что касается гипоталамуса у людей, лептин (пептид, продуцируемый жировой
ткани), как полагают, стимулирует превращение ПОМК в α -MSH в дугообразной
ядро.Нейромедиатор в свою очередь
связывается с рецептором меланокортина-4 (MC4R), ключевым рецептором, участвующим в
контроль аппетита и энергетический гомеостаз, в паравентрикулярном ядре и в
множество других участков мозга. Внутрицеребровентрикулярное введение α -MSH грызунам подавляет
кормление и снижает массу тела. Как упоминалось ранее, AgRP является антагонистом MC4R. Таким образом, мыши со сверхэкспрессией
Мыши с нокаутом по AgRP или MC4R гиперфагичны и страдают ожирением.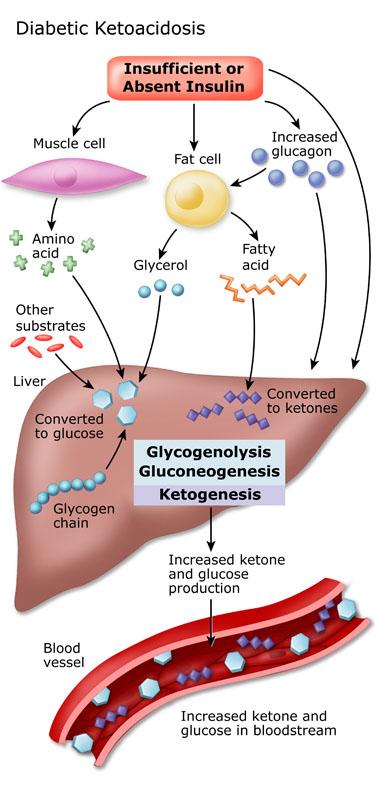
[41] и нечувствительны к α -MSH.
Мутации MC4R были обнаружены у 5,8% взрослых с тяжелой формой
ожирение в детском возрасте [42]. POMC
дефицит также приводит к ожирению (из-за отсутствия связывания MC4R),
гипокортизолизм (из-за отсутствия связывания АКТГ с MC2R в надпочечниках
железы) и изменение пигмента (из-за отсутствия связывания MC1R в
кожа). Этот синдром определяется
тяжелое раннее начало ожирения, надпочечниковая недостаточность и рыжие волосы [43]. Соответственно, на моделях рака и грызунов
почечной недостаточности, антагонисты рецепторов MC4R ослабляют симптомы кахексии за счет
поддержание аппетита, безжировой массы тела и базального расхода энергии [44].Таким образом, антагонисты MC4R могут быть полезными клиническими
лечения кахексии [45], в то время как агонисты разрабатываются для лечения
ожирение.
Еще одним важным регулятором сытости в гипоталамусе является кокаин и
транскрипт, регулируемый амфетамином (CART), который коэкспрессируется с POMC в дугообразных нейронах на животных моделях и несколько парадоксально с AgRP и NPY у людей [46].
Подобно нейронам POMC, нейроны CART напрямую стимулируются лептином.
[47]. Целевые области нейронов CART
по всему гипоталамусу и связаны с подкреплением и вознаграждением [48],
сенсорная обработка, стресс и эндокринная регуляция [47, 49].Животные, лишенные еды, уменьшили выражение
мРНК CART [47]. Вдоль тех же самых
линии, блокирующие CART с антисывороткой, увеличивают кормление у нормальных крыс [50]. Внутрицеребровентрикулярное введение
КОРЗИНА у крыс препятствует нормальному кормлению и кормлению, вызванному голоданием, а также
блокирует ответную реакцию питания NPY [47, 50].
На данный момент нам не известно о каких-либо клинических испытаниях с использованием CART.
агонисты или антагонисты для регулирования веса, возможно, из-за значительного
неаппетитные эффекты, связанные с CART.
3.2. Известно, что периферические пептиды контролируют сытость
В отличие от грелина, единственный периферический пептид, который, как известно, стимулирует
голод, есть много периферических пептидов, которые связаны с
сытость. Эти
Эти
гормоны, в том числе желудочно-кишечного тракта, поджелудочной железы и жировой ткани
ткань. Список гормонов сытости
слишком обширны, чтобы обсуждать их в этом обзоре.
Поэтому мы сосредоточимся на ключевых игроках, начиная с
холецистокинин (ХЦК), первый открытый гормон сытости.
Холецистокинин (CCK) был первоначально открыт в 1928 году и был одним из
первые пептиды, обнаруженные в кишечнике [51].
Помимо ингибирования приема пищи, CCK стимулирует секрецию поджелудочной железы,
сокращение желчного пузыря, перистальтика кишечника и угнетение желудочного
мобильность. Введение ХЦК крысам
подавляет прием пищи за счет уменьшения размера и продолжительности приема пищи [52], что усиливается
растяжением желудка [53]. В
период полувыведения CCK составляет всего 1-2 минуты, поэтому он неэффективен для снижения
размер еды, если принимать более чем за 15 минут до еды [52].
CCK синтезируется в желудочно-кишечном тракте, но в основном в
двенадцатиперстная кишка и тощая кишка. Несколько
биоактивные формы получены из одного и того же генного продукта посттрансляционным или
внеклеточная обработка. CCK быстро
CCK быстро
высвобождается локально и в кровоток в ответ на питательные вещества в кишечнике,
особенно жир и белок, с постепенным увеличением уровня в течение 10–30 минут
после начала приема пищи, остается повышенным до 5 часов [54].
CCK-чувствительные участки мозга включают латеральный гипоталамус, медиальный мост,
и латеральный продолговатый мозг.Эти области
участвует в поощрении поведения, памяти и беспокойства, а также в чувстве насыщения [55, 56]. Существует два типа CCK, связанных с G-белком.
рецепторы: CCK-A и CCK-B [57]. CCK-A участвует в насыщении, тогда как CCK-B участвует в
нет. CCK-A находится на афферентном
вагусные нейроны, оказывающие непосредственное влияние на прием пищи. Крысы с дефицитом CCK-A (Otsuka Long Evans
Крысы Tokushima Fatty (OLETF)) страдают гиперфагией, страдают ожирением и заболевают диабетом.
mellitus тип 2 [58].
Другой пептид насыщения, пептид YY (PYY), является частью поджелудочной железы.
полипептидное (PP-) семейство складчатых пептидов (NPY, PYY, PP), все из которых имеют 36
аминокислоты, содержат несколько остатков тирозина и требуют С-конца
амидирование для биологической активности. В
В
Семейство PP-складок проявляет свои эффекты через семейство Y G-белков, связанных
рецепторы (Y1, Y2, Y4, Y5), которые экспрессируются в гипоталамусе. PYY продуцируется L-клетками кишечника
подвздошная, толстая и прямая кишка. Следующий
потребление пищи, PYY выпускается в кровоток и достигает пика через 1-2 часа
после еды [59]. Концентрации PYY
пропорциональны содержанию энергии в пище и, следовательно, выше после жира
потребление по сравнению с углеводами и белками [60]. Циркулирующий PYY существует в двух формах: PYY 1-36 и PYY 3-36 .PYY 3-36 — периферийно активный
аноректический сигнал и создается за счет расщепления N-концевых остатков Tyr-Pro
дипептидилпептидазой IV (DPP-IV) [61].
PYY 3-36 связывается с рецепторами Y2, что приводит к ингибированию NPY
нейроны и стимуляция нейронов POMC.
Введение PYY задерживает опорожнение желудка, подавляет секрецию
поджелудочной железы и желудка, подавляет сокращение желчного пузыря и увеличивает
абсорбция жидкости и электролитов из подвздошной кишки [62]. У грызунов введение PYY
У грызунов введение PYY
снижает потребление пищи и снижает прибавку в весе [63], а также улучшает гликемический контроль на моделях диабета на грызунах.
[64]. PYY-дефицитные мыши устойчивы
к насыщению и развитию выраженного ожирения, которое устраняется экзогенным PYY
администрация [65]. Наоборот,
интрацеребровентрикулярное введение полноразмерного PYY стимулирует питание
потребление. Считается, что это действие
на рецепторы Y1 и Y5 в паравентрикулярном ядре нейроны, нацеленные на
нейроны NPY орексигенного дугообразного ядра.
У тучных и худых людей введение PYY 3-36 уменьшается
прием пищи со значительным снижением кумулятивной калорийности за 24 часа
потребление [66]. Однако тучные субъекты
иметь более низкий эндогенный PYY-ответ при каждом приеме пищи по сравнению с нормальным весом
волонтеры [67]. Этот родственник ПГГ
дефицит может снизить чувство насыщения и, таким образом, усилить ожирение. Пациенты с ожирением, получавшие лечение тощей кишкой
хирургия [68] или гастропластика с вертикальными полосами [69] имеют повышенный уровень PYY,
что может способствовать потере аппетита.
Полипептид поджелудочной железы (PP), другой член PP-складчатого пептида
семьи, вырабатывается в основном эндокринной поджелудочной железой, а также экзокринной
поджелудочная железа, толстая и прямая кишка. PP также
высвобождается в ответ на прием пищи пропорционально калорийной нагрузке и подавляет
аппетит [70]. Высвобождение ПП стимулируется
грелином, а также мотилином (пептид, секретируемый тонким кишечником, который
усиливает перистальтику желудочно-кишечного тракта) и секретин (пептид, секретируемый
двенадцатиперстной кишки, который стимулирует секрецию кислоты желудочного сока), тогда как соматостатин (a
гормон, который снижает скорость опорожнения желудка и уменьшает гладкую мускулатуру
сокращение и кровоток в кишечнике) и его аналоги значительно
уменьшить секрецию PP.PP связывается с
наибольшее сродство к рецепторам Y4 и Y5 [71]. Периферическое введение ПП в норме
мыши снижают потребление пищи, опорожнение желудка и экспрессию грелина в желудке,
при этом повышается тонус блуждающего нерва [72].
Подобно PYY, инъекция PP в третий желудочек стимулирует
дневной прием пищи [73]. Интересно,
у пациентов с синдромом Прадера-Вилли подавлено базальное и постпрандиальное PP
уровни [74]. Администрирование ПП в
Пациенты Прадера-Вилли снижают потребление пищи [75].
Инкретины — это гормоны, выделяемые из желудочно-кишечного тракта в
кровообращение в ответ на прием питательных веществ.
Инкретины усиливают секрецию инсулина, стимулированную глюкозой. Препроглюкагон экспрессируется в α клетках
эндокринная поджелудочная железа, L-клетки кишечника (дистальный отдел подвздошной кишки и толстой кишки) и
нейроны, расположенные в хвостовом стволе мозга и гипоталамусе. Он раскололся на несколько разных
продукты, включая глюкагон и два инкретина, оксинтомодулин и
глюкагоноподобный пептид-1 (GLP-1).Оксинтомодулин и GLP-1 высвобождаются из L-клеток в дистальном отделе подвздошной кишки.
и толстой кишки в ответ на прием питательных веществ. Оксинтомодулин связывает рецептор GLP-1, который
выражается в ядре солитарного тракта в стволе мозга и в
дугообразное ядро. Оксинтомодулин подавляет
секреция желудочного сока, уменьшает опорожнение желудка и уменьшает поджелудочную железу.
секреция ферментов, которая, вероятно, связана со снижением желудочного выброса [76]. Введение оксинтомодулина людям имеет
было обнаружено, что подавляет уровень грелина [77], снижает массу тела и аппетит,
снижение лептина и повышение уровня адипонектина предположительно вторично по отношению к потере
жировой ткани [78].
GLP-1 приводит к задержке опорожнения желудка, стимуляции
глюкозозависимая секреция инсулина, ингибирование секреции глюкагона и
стимуляция секреции соматостатина.
GLP-1 связывается со своим рецептором, рецептором, связанным с G-белком, который принадлежит
к семейству класса B, включая рецепторы глюкагона и GIP [79]. Рецептор GLP-1 экспрессируется в широком
ряд тканей, включая островковые клетки поджелудочной железы, легкие, сердце, почки,
желудок, кишечник, гипофиз, кожа, блуждающий нерв и несколько областей
ЦНС, включая гипоталамус и ствол мозга. Периферическое и центральное введение GLP-1 активирует нейроны в
Периферическое и центральное введение GLP-1 активирует нейроны в
дугообразное и паравентрикулярное ядра, ядро солитарного тракта и область
postrema [80], что приводит к снижению аппетита.
Введение GLP-1 способствует насыщению и благотворно влияет на
гомеостаз глюкозы.
Свойства GLP-1 сделали его полезной лекарственной мишенью. GLP-1 быстро высвобождается в
кровообращение после перорального приема питательного вещества, а его секреция происходит в
двухфазный паттерн, начинающийся с ранней (в пределах 10–15 минут) фазы, то есть
с последующей более длительной (30–60 минут) фазой [81].Период полувыведения GLP-1 составляет менее 2 минут.
из-за быстрой инактивации ферментом DPP-IV, который также расщепляет PYY. Это основа для развития
экзенатид (Byetta), подкожно вводимый DPP-IV-устойчивый GLP-1
агонист рецепторов.
Глюкозозависимый инсулинотропный полипептид (GIP) — еще один инкретин.
который секретируется желудком и К-клетками двенадцатиперстной и тощей кишки в
реакция на прием питательных веществ. Период полураспада
Период полураспада
GIP составляет 7 минут у здоровых людей и 5 минут у пациентов с типом
2 сахарный диабет [82].GIP также инактивирован
по ДПП-IV [82, 83]. Рецептор GIP
ген экспрессируется в поджелудочной железе, желудке, тонком кишечнике, жировой ткани,
кора надпочечников, гипофиз, сердце, яичко, эндотелиальные клетки, кость, трахея,
селезенка, тимус, легкие, почки, щитовидная железа и некоторые области ЦНС. GIP приводит к глюкозозависимому инсулину
секреция, индукция пролиферации клеток β , стимулирование накопления энергии через
прямое воздействие на жировую ткань и усиление костеобразования за счет
стимуляция пролиферации остеобластов и подавление апоптоза.В ЦНС GIP выражается в
экспрессия гиппокампа и рецептора GIP обнаруживается в коре головного мозга,
гиппокамп и обонятельная луковица. GIP
действие в ЦНС может играть роль в пролиферации нервных клеток-предшественников и
модификация поведения [84].
Инсулин — еще один гормональный регулятор аппетита. Уровень инсулина быстро повышается после еды
и напрямую зависят от изменения ожирения.
Инсулин проникает через гематоэнцефалический барьер через насыщаемый,
рецептор-опосредованный процесс на уровнях, пропорциональных циркулирующему инсулину
[85].Рецепторы инсулина широко распространены.
распределены в головном мозге, а самые высокие концентрации обнаруживаются в обонятельной
луковицы и дугообразное ядро. Как только инсулин
попадает в мозг, действует как анорексигенный сигнал [86]. Мыши с нейрон-специфическим нарушением
ген рецептора инсулина имеют повышенное потребление пищи, ожирение с увеличением тела
уровни жира и лептина в плазме, а также нарушение сперматогенеза и яичников
созревание фолликула [87]. Есть
несколько субстратов рецептора инсулина (IRS), которые активируются фосфорилированием
рецептором инсулина на их тирозиновых остатках [88].IRS-1 и IRS-2 были идентифицированы в
нейроны. Мыши с нокаутом IRS-2 были
обнаружено повышенное потребление пищи, увеличение жировых отложений и бесплодие [89].
Лептин, также называемый белком OB,
еще один важный регулятор аппетита. Это
Это
вырабатывается белой и коричневой жировой тканью, желудком, плацентой, молочными железами.
железы, фолликулов яичников и некоторых органов плода, таких как сердце, кости или
хрящ и, возможно, мозг. Об
ген экспрессируется во всей жировой ткани, но в большей степени в
подкожно-жировая клетчатка, чем сальниковый жир.Уровни лептина положительно коррелируют с
количество жировой массы тела. Лептин
секреция, по-видимому, не зависит от режима приема пищи. Вместо этого циркадный ритм
характеризуется высокими уровнями между полуночью и ранним утром и
от полудня до полудня [90].
Лептин секретируется пульсирующе с 32 пиками за 24 часа.
период и длительность импульса 32,8 мин [91]. Это означает, что нервные и нейрогормональные
компоненты мозга могут регулировать секрецию лептина адипоцитами.
Лептиновые рецепторы относятся к суперсемейству цитокиновых рецепторов, в котором используются
преобразователь сигнала активирующей киназы Януса (JAK-) и активатор
транскрипционный (STAT) путь передачи сигнала. Рецепторы лептина имеют множество различных
Рецепторы лептина имеют множество различных
варианты стыковки. Ob-Rb — полная форма
рецептора и имеет длинный внутриклеточный домен, необходимый для
действие лептина на аппетит. Об-Рб — это
экспрессируется в нескольких разных участках гипоталамуса, включая
дугообразное ядро, паравентрикулярное ядро, дорсомедиальный гипоталамический
ядро и боковая область гипоталамуса.Короткие формы рецептора Ob могут играть роль в транспорте лептина.
через гематоэнцефалический барьер [92].
После связывания рецептора лептин стимулирует специфическую сигнализацию.
каскад, который приводит к ингибированию орексигенных пептидов (NPY и AgRP) [93, 94], одновременно стимулируя аноректические пептиды (включая POMC и CART) [93, 95]. В конечном итоге это приводит к снижению аппетита.
и повышенный расход энергии. дб / дб
мыши имеют мутацию во внутриклеточной части Ob-Rb и поэтому
неспособность реагировать на сигнал лептина и в результате развивается глубокое ожирение
[96].Кроме того, было обнаружено
что до 3% людей с тяжелым ранним началом ожирения имеют патогенные
мутации в гене рецептора лептина [97].
Ob-дефицитные мыши не имеют циркулирующего лептина и развиваются
тяжелое ожирение из-за повышенного потребления пищи и снижения калорийности
расходы [98], оба из которых могут быть нормализованы администрацией
лептин [99]. Отсутствие лептина в
у людей приводит к тяжелому ожирению, гипогонадизму и нарушению иммунитета, опосредованного Т-клетками,
которые излечимы введением рекомбинантного лептина [100].Около 5% людей с ожирением
«Относительно» дефицит лептина, и возможно, что эти люди могли
получают пользу от терапии лептином [101].
Наконец, гормон адипонектин секретируется зрелыми
адипоцит. Рецепторы адипонектина
экспрессируется в головном мозге, особенно в паравентрикулярном ядре, миндалине,
area postrema и диффузно в перивентрикулярных областях. По неясным причинам адипонектин
концентрация в кровотоке чрезвычайно высока, примерно в 1000 раз выше, чем у других
полипептидные гормоны.Его структура
очень похож на коллаген C1q и типов VIII и X. Как правило, адипонектин сам связывается с
образуют гомотримеры, которые затем димеризуются с образованием гексамеров. Повышенный уровень адипонектина у грызунов
по всей видимости, снижает жировую массу тела за счет стимуляции окисления жирных кислот в
мышца [102]. Адипонектин также снижает
потребление пищи и ожирение у крыс с ожирением [103], а также улучшает чувствительность к инсулину
за счет снижения выхода глюкозы в печень [104].
У людей высокомолекулярный адипонектин (который, как полагают,
активная форма) снижается у пациентов с сахарным диабетом 2 типа и увеличивает
доля высокомолекулярного адипонектина при потере веса и лечении
с тиазолиндионами приводит к повышению чувствительности к инсулину [105].
Гормональные регуляторы аппетита
3.1. Роль гипоталамуса в регулировании аппетита
Гипоталамус также является главным регулятором насыщения через производство
POMC и CART. Ген POMC
экспрессируется несколькими тканями, включая кожу и иммунную систему, а также
гипофиз и дугообразное ядро гипоталамуса. POMC подвергается тканеспецифической
посттрансляционное расщепление, при этом продукт зависит от эндопротеаз
выражается в этой ткани.Например,
в передней доле гипофиза POMC в первую очередь превращается в АКТГ посредством
прогормон конвертаза 1. У млекопитающих
кроме приматов, прогормон конвертаза 2 в промежуточном гипофизе
расщепляет АКТГ с образованием α -меланоцит-стимулирующего гормона ( α -MSH), который участвует
в контроле цвета шерсти / кожи. С участием
Что касается гипоталамуса у людей, лептин (пептид, продуцируемый жировой
ткани), как полагают, стимулирует превращение ПОМК в α -MSH в дугообразной
ядро.Нейромедиатор в свою очередь
связывается с рецептором меланокортина-4 (MC4R), ключевым рецептором, участвующим в
контроль аппетита и энергетический гомеостаз, в паравентрикулярном ядре и в
множество других участков мозга. Внутрицеребровентрикулярное введение α -MSH грызунам подавляет
кормление и снижает массу тела. Как упоминалось ранее, AgRP является антагонистом MC4R. Таким образом, мыши со сверхэкспрессией
Мыши с нокаутом по AgRP или MC4R гиперфагичны и страдают ожирением.
[41] и нечувствительны к α -MSH.
Мутации MC4R были обнаружены у 5,8% взрослых с тяжелой формой
ожирение в детском возрасте [42]. POMC
дефицит также приводит к ожирению (из-за отсутствия связывания MC4R),
гипокортизолизм (из-за отсутствия связывания АКТГ с MC2R в надпочечниках
железы) и изменение пигмента (из-за отсутствия связывания MC1R в
кожа). Этот синдром определяется
тяжелое раннее начало ожирения, надпочечниковая недостаточность и рыжие волосы [43]. Соответственно, на моделях рака и грызунов
почечной недостаточности, антагонисты рецепторов MC4R ослабляют симптомы кахексии за счет
поддержание аппетита, безжировой массы тела и базального расхода энергии [44].Таким образом, антагонисты MC4R могут быть полезными клиническими
лечения кахексии [45], в то время как агонисты разрабатываются для лечения
ожирение.
Еще одним важным регулятором сытости в гипоталамусе является кокаин и
транскрипт, регулируемый амфетамином (CART), который коэкспрессируется с POMC в дугообразных нейронах на животных моделях и несколько парадоксально с AgRP и NPY у людей [46].
Подобно нейронам POMC, нейроны CART напрямую стимулируются лептином.
[47]. Целевые области нейронов CART
по всему гипоталамусу и связаны с подкреплением и вознаграждением [48],
сенсорная обработка, стресс и эндокринная регуляция [47, 49].Животные, лишенные еды, уменьшили выражение
мРНК CART [47]. Вдоль тех же самых
линии, блокирующие CART с антисывороткой, увеличивают кормление у нормальных крыс [50]. Внутрицеребровентрикулярное введение
КОРЗИНА у крыс препятствует нормальному кормлению и кормлению, вызванному голоданием, а также
блокирует ответную реакцию питания NPY [47, 50].
На данный момент нам не известно о каких-либо клинических испытаниях с использованием CART.
агонисты или антагонисты для регулирования веса, возможно, из-за значительного
неаппетитные эффекты, связанные с CART.
3.2. Известно, что периферические пептиды контролируют сытость
В отличие от грелина, единственный периферический пептид, который, как известно, стимулирует
голод, есть много периферических пептидов, которые связаны с
сытость. Эти
гормоны, в том числе желудочно-кишечного тракта, поджелудочной железы и жировой ткани
ткань. Список гормонов сытости
слишком обширны, чтобы обсуждать их в этом обзоре.
Поэтому мы сосредоточимся на ключевых игроках, начиная с
холецистокинин (ХЦК), первый открытый гормон сытости.
Холецистокинин (CCK) был первоначально открыт в 1928 году и был одним из
первые пептиды, обнаруженные в кишечнике [51].
Помимо ингибирования приема пищи, CCK стимулирует секрецию поджелудочной железы,
сокращение желчного пузыря, перистальтика кишечника и угнетение желудочного
мобильность. Введение ХЦК крысам
подавляет прием пищи за счет уменьшения размера и продолжительности приема пищи [52], что усиливается
растяжением желудка [53]. В
период полувыведения CCK составляет всего 1-2 минуты, поэтому он неэффективен для снижения
размер еды, если принимать более чем за 15 минут до еды [52].
CCK синтезируется в желудочно-кишечном тракте, но в основном в
двенадцатиперстная кишка и тощая кишка. Несколько
биоактивные формы получены из одного и того же генного продукта посттрансляционным или
внеклеточная обработка. CCK быстро
высвобождается локально и в кровоток в ответ на питательные вещества в кишечнике,
особенно жир и белок, с постепенным увеличением уровня в течение 10–30 минут
после начала приема пищи, остается повышенным до 5 часов [54].
CCK-чувствительные участки мозга включают латеральный гипоталамус, медиальный мост,
и латеральный продолговатый мозг.Эти области
участвует в поощрении поведения, памяти и беспокойства, а также в чувстве насыщения [55, 56]. Существует два типа CCK, связанных с G-белком.
рецепторы: CCK-A и CCK-B [57]. CCK-A участвует в насыщении, тогда как CCK-B участвует в
нет. CCK-A находится на афферентном
вагусные нейроны, оказывающие непосредственное влияние на прием пищи. Крысы с дефицитом CCK-A (Otsuka Long Evans
Крысы Tokushima Fatty (OLETF)) страдают гиперфагией, страдают ожирением и заболевают диабетом.
mellitus тип 2 [58].
Другой пептид насыщения, пептид YY (PYY), является частью поджелудочной железы.
полипептидное (PP-) семейство складчатых пептидов (NPY, PYY, PP), все из которых имеют 36
аминокислоты, содержат несколько остатков тирозина и требуют С-конца
амидирование для биологической активности.В
Семейство PP-складок проявляет свои эффекты через семейство Y G-белков, связанных
рецепторы (Y1, Y2, Y4, Y5), которые экспрессируются в гипоталамусе. PYY продуцируется L-клетками кишечника
подвздошная, толстая и прямая кишка. Следующий
потребление пищи, PYY выпускается в кровоток и достигает пика через 1-2 часа
после еды [59]. Концентрации PYY
пропорциональны содержанию энергии в пище и, следовательно, выше после жира
потребление по сравнению с углеводами и белками [60]. Циркулирующий PYY существует в двух формах: PYY 1-36 и PYY 3-36 .PYY 3-36 — периферийно активный
аноректический сигнал и создается за счет расщепления N-концевых остатков Tyr-Pro
дипептидилпептидазой IV (DPP-IV) [61].
PYY 3-36 связывается с рецепторами Y2, что приводит к ингибированию NPY
нейроны и стимуляция нейронов POMC.
Введение PYY задерживает опорожнение желудка, подавляет секрецию
поджелудочной железы и желудка, подавляет сокращение желчного пузыря и увеличивает
абсорбция жидкости и электролитов из подвздошной кишки [62].У грызунов введение PYY
снижает потребление пищи и снижает прибавку в весе [63], а также улучшает гликемический контроль на моделях диабета на грызунах.
[64]. PYY-дефицитные мыши устойчивы
к насыщению и развитию выраженного ожирения, которое устраняется экзогенным PYY
администрация [65]. Наоборот,
интрацеребровентрикулярное введение полноразмерного PYY стимулирует питание
потребление. Считается, что это действие
на рецепторы Y1 и Y5 в паравентрикулярном ядре нейроны, нацеленные на
нейроны NPY орексигенного дугообразного ядра.
У тучных и худых людей введение PYY 3-36 уменьшается
прием пищи со значительным снижением кумулятивной калорийности за 24 часа
потребление [66]. Однако тучные субъекты
иметь более низкий эндогенный PYY-ответ при каждом приеме пищи по сравнению с нормальным весом
волонтеры [67]. Этот родственник ПГГ
дефицит может снизить чувство насыщения и, таким образом, усилить ожирение. Пациенты с ожирением, получавшие лечение тощей кишкой
хирургия [68] или гастропластика с вертикальными полосами [69] имеют повышенный уровень PYY,
что может способствовать потере аппетита.
Полипептид поджелудочной железы (PP), другой член PP-складчатого пептида
семьи, вырабатывается в основном эндокринной поджелудочной железой, а также экзокринной
поджелудочная железа, толстая и прямая кишка. PP также
высвобождается в ответ на прием пищи пропорционально калорийной нагрузке и подавляет
аппетит [70]. Высвобождение ПП стимулируется
грелином, а также мотилином (пептид, секретируемый тонким кишечником, который
усиливает перистальтику желудочно-кишечного тракта) и секретин (пептид, секретируемый
двенадцатиперстной кишки, который стимулирует секрецию кислоты желудочного сока), тогда как соматостатин (a
гормон, который снижает скорость опорожнения желудка и уменьшает гладкую мускулатуру
сокращение и кровоток в кишечнике) и его аналоги значительно
уменьшить секрецию PP.PP связывается с
наибольшее сродство к рецепторам Y4 и Y5 [71]. Периферическое введение ПП в норме
мыши снижают потребление пищи, опорожнение желудка и экспрессию грелина в желудке,
при этом повышается тонус блуждающего нерва [72].
Подобно PYY, инъекция PP в третий желудочек стимулирует
дневной прием пищи [73]. Интересно,
у пациентов с синдромом Прадера-Вилли подавлено базальное и постпрандиальное PP
уровни [74]. Администрирование ПП в
Пациенты Прадера-Вилли снижают потребление пищи [75].
Инкретины — это гормоны, выделяемые из желудочно-кишечного тракта в
кровообращение в ответ на прием питательных веществ.
Инкретины усиливают секрецию инсулина, стимулированную глюкозой. Препроглюкагон экспрессируется в α клетках
эндокринная поджелудочная железа, L-клетки кишечника (дистальный отдел подвздошной кишки и толстой кишки) и
нейроны, расположенные в хвостовом стволе мозга и гипоталамусе. Он раскололся на несколько разных
продукты, включая глюкагон и два инкретина, оксинтомодулин и
глюкагоноподобный пептид-1 (GLP-1).Оксинтомодулин и GLP-1 высвобождаются из L-клеток в дистальном отделе подвздошной кишки.
и толстой кишки в ответ на прием питательных веществ. Оксинтомодулин связывает рецептор GLP-1, который
выражается в ядре солитарного тракта в стволе мозга и в
дугообразное ядро. Оксинтомодулин подавляет
секреция желудочного сока, уменьшает опорожнение желудка и уменьшает поджелудочную железу.
секреция ферментов, которая, вероятно, связана со снижением желудочного выброса [76]. Введение оксинтомодулина людям имеет
было обнаружено, что подавляет уровень грелина [77], снижает массу тела и аппетит,
снижение лептина и повышение уровня адипонектина предположительно вторично по отношению к потере
жировой ткани [78].
GLP-1 приводит к задержке опорожнения желудка, стимуляции
глюкозозависимая секреция инсулина, ингибирование секреции глюкагона и
стимуляция секреции соматостатина.
GLP-1 связывается со своим рецептором, рецептором, связанным с G-белком, который принадлежит
к семейству класса B, включая рецепторы глюкагона и GIP [79]. Рецептор GLP-1 экспрессируется в широком
ряд тканей, включая островковые клетки поджелудочной железы, легкие, сердце, почки,
желудок, кишечник, гипофиз, кожа, блуждающий нерв и несколько областей
ЦНС, включая гипоталамус и ствол мозга.Периферическое и центральное введение GLP-1 активирует нейроны в
дугообразное и паравентрикулярное ядра, ядро солитарного тракта и область
postrema [80], что приводит к снижению аппетита.
Введение GLP-1 способствует насыщению и благотворно влияет на
гомеостаз глюкозы.
Свойства GLP-1 сделали его полезной лекарственной мишенью. GLP-1 быстро высвобождается в
кровообращение после перорального приема питательного вещества, а его секреция происходит в
двухфазный паттерн, начинающийся с ранней (в пределах 10–15 минут) фазы, то есть
с последующей более длительной (30–60 минут) фазой [81].Период полувыведения GLP-1 составляет менее 2 минут.
из-за быстрой инактивации ферментом DPP-IV, который также расщепляет PYY. Это основа для развития
экзенатид (Byetta), подкожно вводимый DPP-IV-устойчивый GLP-1
агонист рецепторов.
Глюкозозависимый инсулинотропный полипептид (GIP) — еще один инкретин.
который секретируется желудком и К-клетками двенадцатиперстной и тощей кишки в
реакция на прием питательных веществ. Период полураспада
GIP составляет 7 минут у здоровых людей и 5 минут у пациентов с типом
2 сахарный диабет [82].GIP также инактивирован
по ДПП-IV [82, 83]. Рецептор GIP
ген экспрессируется в поджелудочной железе, желудке, тонком кишечнике, жировой ткани,
кора надпочечников, гипофиз, сердце, яичко, эндотелиальные клетки, кость, трахея,
селезенка, тимус, легкие, почки, щитовидная железа и некоторые области ЦНС. GIP приводит к глюкозозависимому инсулину
секреция, индукция пролиферации клеток β , стимулирование накопления энергии через
прямое воздействие на жировую ткань и усиление костеобразования за счет
стимуляция пролиферации остеобластов и подавление апоптоза.В ЦНС GIP выражается в
экспрессия гиппокампа и рецептора GIP обнаруживается в коре головного мозга,
гиппокамп и обонятельная луковица. GIP
действие в ЦНС может играть роль в пролиферации нервных клеток-предшественников и
модификация поведения [84].
Инсулин — еще один гормональный регулятор аппетита. Уровень инсулина быстро повышается после еды
и напрямую зависят от изменения ожирения.
Инсулин проникает через гематоэнцефалический барьер через насыщаемый,
рецептор-опосредованный процесс на уровнях, пропорциональных циркулирующему инсулину
[85].Рецепторы инсулина широко распространены.
распределены в головном мозге, а самые высокие концентрации обнаруживаются в обонятельной
луковицы и дугообразное ядро. Как только инсулин
попадает в мозг, действует как анорексигенный сигнал [86]. Мыши с нейрон-специфическим нарушением
ген рецептора инсулина имеют повышенное потребление пищи, ожирение с увеличением тела
уровни жира и лептина в плазме, а также нарушение сперматогенеза и яичников
созревание фолликула [87]. Есть
несколько субстратов рецептора инсулина (IRS), которые активируются фосфорилированием
рецептором инсулина на их тирозиновых остатках [88].IRS-1 и IRS-2 были идентифицированы в
нейроны. Мыши с нокаутом IRS-2 были
обнаружено повышенное потребление пищи, увеличение жировых отложений и бесплодие [89].
Лептин, также называемый белком OB,
еще один важный регулятор аппетита. Это
вырабатывается белой и коричневой жировой тканью, желудком, плацентой, молочными железами.
железы, фолликулов яичников и некоторых органов плода, таких как сердце, кости или
хрящ и, возможно, мозг. Об
ген экспрессируется во всей жировой ткани, но в большей степени в
подкожно-жировая клетчатка, чем сальниковый жир.Уровни лептина положительно коррелируют с
количество жировой массы тела. Лептин
секреция, по-видимому, не зависит от режима приема пищи. Вместо этого циркадный ритм
характеризуется высокими уровнями между полуночью и ранним утром и
от полудня до полудня [90].
Лептин секретируется пульсирующе с 32 пиками за 24 часа.
период и длительность импульса 32,8 мин [91]. Это означает, что нервные и нейрогормональные
компоненты мозга могут регулировать секрецию лептина адипоцитами.
Лептиновые рецепторы относятся к суперсемейству цитокиновых рецепторов, в котором используются
преобразователь сигнала активирующей киназы Януса (JAK-) и активатор
транскрипционный (STAT) путь передачи сигнала. Рецепторы лептина имеют множество различных
варианты стыковки. Ob-Rb — полная форма
рецептора и имеет длинный внутриклеточный домен, необходимый для
действие лептина на аппетит. Об-Рб — это
экспрессируется в нескольких разных участках гипоталамуса, включая
дугообразное ядро, паравентрикулярное ядро, дорсомедиальный гипоталамический
ядро и боковая область гипоталамуса.Короткие формы рецептора Ob могут играть роль в транспорте лептина.
через гематоэнцефалический барьер [92].
После связывания рецептора лептин стимулирует специфическую сигнализацию.
каскад, который приводит к ингибированию орексигенных пептидов (NPY и AgRP) [93, 94], одновременно стимулируя аноректические пептиды (включая POMC и CART) [93, 95]. В конечном итоге это приводит к снижению аппетита.
и повышенный расход энергии. дб / дб
мыши имеют мутацию во внутриклеточной части Ob-Rb и поэтому
неспособность реагировать на сигнал лептина и в результате развивается глубокое ожирение
[96].Кроме того, было обнаружено
что до 3% людей с тяжелым ранним началом ожирения имеют патогенные
мутации в гене рецептора лептина [97].
Ob-дефицитные мыши не имеют циркулирующего лептина и развиваются
тяжелое ожирение из-за повышенного потребления пищи и снижения калорийности
расходы [98], оба из которых могут быть нормализованы администрацией
лептин [99]. Отсутствие лептина в
у людей приводит к тяжелому ожирению, гипогонадизму и нарушению иммунитета, опосредованного Т-клетками,
которые излечимы введением рекомбинантного лептина [100].Около 5% людей с ожирением
«Относительно» дефицит лептина, и возможно, что эти люди могли
получают пользу от терапии лептином [101].
Наконец, гормон адипонектин секретируется зрелыми
адипоцит. Рецепторы адипонектина
экспрессируется в головном мозге, особенно в паравентрикулярном ядре, миндалине,
area postrema и диффузно в перивентрикулярных областях. По неясным причинам адипонектин
концентрация в кровотоке чрезвычайно высока, примерно в 1000 раз выше, чем у других
полипептидные гормоны.Его структура
очень похож на коллаген C1q и типов VIII и X. Как правило, адипонектин сам связывается с
образуют гомотримеры, которые затем димеризуются с образованием гексамеров. Повышенный уровень адипонектина у грызунов
по всей видимости, снижает жировую массу тела за счет стимуляции окисления жирных кислот в
мышца [102]. Адипонектин также снижает
потребление пищи и ожирение у крыс с ожирением [103], а также улучшает чувствительность к инсулину
за счет снижения выхода глюкозы в печень [104].
У людей высокомолекулярный адипонектин (который, как полагают,
активная форма) снижается у пациентов с сахарным диабетом 2 типа и увеличивает
доля высокомолекулярного адипонектина при потере веса и лечении
с тиазолиндионами приводит к повышению чувствительности к инсулину [105].
Гормональные регуляторы аппетита
3.1. Роль гипоталамуса в регулировании аппетита
Гипоталамус также является главным регулятором насыщения через производство
POMC и CART. Ген POMC
экспрессируется несколькими тканями, включая кожу и иммунную систему, а также
гипофиз и дугообразное ядро гипоталамуса. POMC подвергается тканеспецифической
посттрансляционное расщепление, при этом продукт зависит от эндопротеаз
выражается в этой ткани.Например,
в передней доле гипофиза POMC в первую очередь превращается в АКТГ посредством
прогормон конвертаза 1. У млекопитающих
кроме приматов, прогормон конвертаза 2 в промежуточном гипофизе
расщепляет АКТГ с образованием α -меланоцит-стимулирующего гормона ( α -MSH), который участвует
в контроле цвета шерсти / кожи. С участием
Что касается гипоталамуса у людей, лептин (пептид, продуцируемый жировой
ткани), как полагают, стимулирует превращение ПОМК в α -MSH в дугообразной
ядро.Нейромедиатор в свою очередь
связывается с рецептором меланокортина-4 (MC4R), ключевым рецептором, участвующим в
контроль аппетита и энергетический гомеостаз, в паравентрикулярном ядре и в
множество других участков мозга. Внутрицеребровентрикулярное введение α -MSH грызунам подавляет
кормление и снижает массу тела. Как упоминалось ранее, AgRP является антагонистом MC4R. Таким образом, мыши со сверхэкспрессией
Мыши с нокаутом по AgRP или MC4R гиперфагичны и страдают ожирением.
[41] и нечувствительны к α -MSH.
Мутации MC4R были обнаружены у 5,8% взрослых с тяжелой формой
ожирение в детском возрасте [42]. POMC
дефицит также приводит к ожирению (из-за отсутствия связывания MC4R),
гипокортизолизм (из-за отсутствия связывания АКТГ с MC2R в надпочечниках
железы) и изменение пигмента (из-за отсутствия связывания MC1R в
кожа). Этот синдром определяется
тяжелое раннее начало ожирения, надпочечниковая недостаточность и рыжие волосы [43]. Соответственно, на моделях рака и грызунов
почечной недостаточности, антагонисты рецепторов MC4R ослабляют симптомы кахексии за счет
поддержание аппетита, безжировой массы тела и базального расхода энергии [44].Таким образом, антагонисты MC4R могут быть полезными клиническими
лечения кахексии [45], в то время как агонисты разрабатываются для лечения
ожирение.
Еще одним важным регулятором сытости в гипоталамусе является кокаин и
транскрипт, регулируемый амфетамином (CART), который коэкспрессируется с POMC в дугообразных нейронах на животных моделях и несколько парадоксально с AgRP и NPY у людей [46].
Подобно нейронам POMC, нейроны CART напрямую стимулируются лептином.
[47]. Целевые области нейронов CART
по всему гипоталамусу и связаны с подкреплением и вознаграждением [48],
сенсорная обработка, стресс и эндокринная регуляция [47, 49].Животные, лишенные еды, уменьшили выражение
мРНК CART [47]. Вдоль тех же самых
линии, блокирующие CART с антисывороткой, увеличивают кормление у нормальных крыс [50]. Внутрицеребровентрикулярное введение
КОРЗИНА у крыс препятствует нормальному кормлению и кормлению, вызванному голоданием, а также
блокирует ответную реакцию питания NPY [47, 50].
На данный момент нам не известно о каких-либо клинических испытаниях с использованием CART.
агонисты или антагонисты для регулирования веса, возможно, из-за значительного
неаппетитные эффекты, связанные с CART.
3.2. Известно, что периферические пептиды контролируют сытость
В отличие от грелина, единственный периферический пептид, который, как известно, стимулирует
голод, есть много периферических пептидов, которые связаны с
сытость. Эти
гормоны, в том числе желудочно-кишечного тракта, поджелудочной железы и жировой ткани
ткань. Список гормонов сытости
слишком обширны, чтобы обсуждать их в этом обзоре.
Поэтому мы сосредоточимся на ключевых игроках, начиная с
холецистокинин (ХЦК), первый открытый гормон сытости.
Холецистокинин (CCK) был первоначально открыт в 1928 году и был одним из
первые пептиды, обнаруженные в кишечнике [51].
Помимо ингибирования приема пищи, CCK стимулирует секрецию поджелудочной железы,
сокращение желчного пузыря, перистальтика кишечника и угнетение желудочного
мобильность. Введение ХЦК крысам
подавляет прием пищи за счет уменьшения размера и продолжительности приема пищи [52], что усиливается
растяжением желудка [53]. В
период полувыведения CCK составляет всего 1-2 минуты, поэтому он неэффективен для снижения
размер еды, если принимать более чем за 15 минут до еды [52].
CCK синтезируется в желудочно-кишечном тракте, но в основном в
двенадцатиперстная кишка и тощая кишка. Несколько
биоактивные формы получены из одного и того же генного продукта посттрансляционным или
внеклеточная обработка. CCK быстро
высвобождается локально и в кровоток в ответ на питательные вещества в кишечнике,
особенно жир и белок, с постепенным увеличением уровня в течение 10–30 минут
после начала приема пищи, остается повышенным до 5 часов [54].
CCK-чувствительные участки мозга включают латеральный гипоталамус, медиальный мост,
и латеральный продолговатый мозг.Эти области
участвует в поощрении поведения, памяти и беспокойства, а также в чувстве насыщения [55, 56]. Существует два типа CCK, связанных с G-белком.
рецепторы: CCK-A и CCK-B [57]. CCK-A участвует в насыщении, тогда как CCK-B участвует в
нет. CCK-A находится на афферентном
вагусные нейроны, оказывающие непосредственное влияние на прием пищи. Крысы с дефицитом CCK-A (Otsuka Long Evans
Крысы Tokushima Fatty (OLETF)) страдают гиперфагией, страдают ожирением и заболевают диабетом.
mellitus тип 2 [58].
Другой пептид насыщения, пептид YY (PYY), является частью поджелудочной железы.
полипептидное (PP-) семейство складчатых пептидов (NPY, PYY, PP), все из которых имеют 36
аминокислоты, содержат несколько остатков тирозина и требуют С-конца
амидирование для биологической активности.В
Семейство PP-складок проявляет свои эффекты через семейство Y G-белков, связанных
рецепторы (Y1, Y2, Y4, Y5), которые экспрессируются в гипоталамусе. PYY продуцируется L-клетками кишечника
подвздошная, толстая и прямая кишка. Следующий
потребление пищи, PYY выпускается в кровоток и достигает пика через 1-2 часа
после еды [59]. Концентрации PYY
пропорциональны содержанию энергии в пище и, следовательно, выше после жира
потребление по сравнению с углеводами и белками [60]. Циркулирующий PYY существует в двух формах: PYY 1-36 и PYY 3-36 .PYY 3-36 — периферийно активный
аноректический сигнал и создается за счет расщепления N-концевых остатков Tyr-Pro
дипептидилпептидазой IV (DPP-IV) [61].
PYY 3-36 связывается с рецепторами Y2, что приводит к ингибированию NPY
нейроны и стимуляция нейронов POMC.
Введение PYY задерживает опорожнение желудка, подавляет секрецию
поджелудочной железы и желудка, подавляет сокращение желчного пузыря и увеличивает
абсорбция жидкости и электролитов из подвздошной кишки [62].У грызунов введение PYY
снижает потребление пищи и снижает прибавку в весе [63], а также улучшает гликемический контроль на моделях диабета на грызунах.
[64]. PYY-дефицитные мыши устойчивы
к насыщению и развитию выраженного ожирения, которое устраняется экзогенным PYY
администрация [65]. Наоборот,
интрацеребровентрикулярное введение полноразмерного PYY стимулирует питание
потребление. Считается, что это действие
на рецепторы Y1 и Y5 в паравентрикулярном ядре нейроны, нацеленные на
нейроны NPY орексигенного дугообразного ядра.
У тучных и худых людей введение PYY 3-36 уменьшается
прием пищи со значительным снижением кумулятивной калорийности за 24 часа
потребление [66]. Однако тучные субъекты
иметь более низкий эндогенный PYY-ответ при каждом приеме пищи по сравнению с нормальным весом
волонтеры [67]. Этот родственник ПГГ
дефицит может снизить чувство насыщения и, таким образом, усилить ожирение. Пациенты с ожирением, получавшие лечение тощей кишкой
хирургия [68] или гастропластика с вертикальными полосами [69] имеют повышенный уровень PYY,
что может способствовать потере аппетита.
Полипептид поджелудочной железы (PP), другой член PP-складчатого пептида
семьи, вырабатывается в основном эндокринной поджелудочной железой, а также экзокринной
поджелудочная железа, толстая и прямая кишка. PP также
высвобождается в ответ на прием пищи пропорционально калорийной нагрузке и подавляет
аппетит [70]. Высвобождение ПП стимулируется
грелином, а также мотилином (пептид, секретируемый тонким кишечником, который
усиливает перистальтику желудочно-кишечного тракта) и секретин (пептид, секретируемый
двенадцатиперстной кишки, который стимулирует секрецию кислоты желудочного сока), тогда как соматостатин (a
гормон, который снижает скорость опорожнения желудка и уменьшает гладкую мускулатуру
сокращение и кровоток в кишечнике) и его аналоги значительно
уменьшить секрецию PP.PP связывается с
наибольшее сродство к рецепторам Y4 и Y5 [71]. Периферическое введение ПП в норме
мыши снижают потребление пищи, опорожнение желудка и экспрессию грелина в желудке,
при этом повышается тонус блуждающего нерва [72].
Подобно PYY, инъекция PP в третий желудочек стимулирует
дневной прием пищи [73]. Интересно,
у пациентов с синдромом Прадера-Вилли подавлено базальное и постпрандиальное PP
уровни [74]. Администрирование ПП в
Пациенты Прадера-Вилли снижают потребление пищи [75].
Инкретины — это гормоны, выделяемые из желудочно-кишечного тракта в
кровообращение в ответ на прием питательных веществ.
Инкретины усиливают секрецию инсулина, стимулированную глюкозой. Препроглюкагон экспрессируется в α клетках
эндокринная поджелудочная железа, L-клетки кишечника (дистальный отдел подвздошной кишки и толстой кишки) и
нейроны, расположенные в хвостовом стволе мозга и гипоталамусе. Он раскололся на несколько разных
продукты, включая глюкагон и два инкретина, оксинтомодулин и
глюкагоноподобный пептид-1 (GLP-1).Оксинтомодулин и GLP-1 высвобождаются из L-клеток в дистальном отделе подвздошной кишки.
и толстой кишки в ответ на прием питательных веществ. Оксинтомодулин связывает рецептор GLP-1, который
выражается в ядре солитарного тракта в стволе мозга и в
дугообразное ядро. Оксинтомодулин подавляет
секреция желудочного сока, уменьшает опорожнение желудка и уменьшает поджелудочную железу.
секреция ферментов, которая, вероятно, связана со снижением желудочного выброса [76]. Введение оксинтомодулина людям имеет
было обнаружено, что подавляет уровень грелина [77], снижает массу тела и аппетит,
снижение лептина и повышение уровня адипонектина предположительно вторично по отношению к потере
жировой ткани [78].
GLP-1 приводит к задержке опорожнения желудка, стимуляции
глюкозозависимая секреция инсулина, ингибирование секреции глюкагона и
стимуляция секреции соматостатина.
GLP-1 связывается со своим рецептором, рецептором, связанным с G-белком, который принадлежит
к семейству класса B, включая рецепторы глюкагона и GIP [79]. Рецептор GLP-1 экспрессируется в широком
ряд тканей, включая островковые клетки поджелудочной железы, легкие, сердце, почки,
желудок, кишечник, гипофиз, кожа, блуждающий нерв и несколько областей
ЦНС, включая гипоталамус и ствол мозга.Периферическое и центральное введение GLP-1 активирует нейроны в
дугообразное и паравентрикулярное ядра, ядро солитарного тракта и область
postrema [80], что приводит к снижению аппетита.
Введение GLP-1 способствует насыщению и благотворно влияет на
гомеостаз глюкозы.
Свойства GLP-1 сделали его полезной лекарственной мишенью. GLP-1 быстро высвобождается в
кровообращение после перорального приема питательного вещества, а его секреция происходит в
двухфазный паттерн, начинающийся с ранней (в пределах 10–15 минут) фазы, то есть
с последующей более длительной (30–60 минут) фазой [81].Период полувыведения GLP-1 составляет менее 2 минут.
из-за быстрой инактивации ферментом DPP-IV, который также расщепляет PYY. Это основа для развития
экзенатид (Byetta), подкожно вводимый DPP-IV-устойчивый GLP-1
агонист рецепторов.
Глюкозозависимый инсулинотропный полипептид (GIP) — еще один инкретин.
который секретируется желудком и К-клетками двенадцатиперстной и тощей кишки в
реакция на прием питательных веществ. Период полураспада
GIP составляет 7 минут у здоровых людей и 5 минут у пациентов с типом
2 сахарный диабет [82].GIP также инактивирован
по ДПП-IV [82, 83]. Рецептор GIP
ген экспрессируется в поджелудочной железе, желудке, тонком кишечнике, жировой ткани,
кора надпочечников, гипофиз, сердце, яичко, эндотелиальные клетки, кость, трахея,
селезенка, тимус, легкие, почки, щитовидная железа и некоторые области ЦНС. GIP приводит к глюкозозависимому инсулину
секреция, индукция пролиферации клеток β , стимулирование накопления энергии через
прямое воздействие на жировую ткань и усиление костеобразования за счет
стимуляция пролиферации остеобластов и подавление апоптоза.В ЦНС GIP выражается в
экспрессия гиппокампа и рецептора GIP обнаруживается в коре головного мозга,
гиппокамп и обонятельная луковица. GIP
действие в ЦНС может играть роль в пролиферации нервных клеток-предшественников и
модификация поведения [84].
Инсулин — еще один гормональный регулятор аппетита. Уровень инсулина быстро повышается после еды
и напрямую зависят от изменения ожирения.
Инсулин проникает через гематоэнцефалический барьер через насыщаемый,
рецептор-опосредованный процесс на уровнях, пропорциональных циркулирующему инсулину
[85].Рецепторы инсулина широко распространены.
распределены в головном мозге, а самые высокие концентрации обнаруживаются в обонятельной
луковицы и дугообразное ядро. Как только инсулин
попадает в мозг, действует как анорексигенный сигнал [86]. Мыши с нейрон-специфическим нарушением
ген рецептора инсулина имеют повышенное потребление пищи, ожирение с увеличением тела
уровни жира и лептина в плазме, а также нарушение сперматогенеза и яичников
созревание фолликула [87]. Есть
несколько субстратов рецептора инсулина (IRS), которые активируются фосфорилированием
рецептором инсулина на их тирозиновых остатках [88].IRS-1 и IRS-2 были идентифицированы в
нейроны. Мыши с нокаутом IRS-2 были
обнаружено повышенное потребление пищи, увеличение жировых отложений и бесплодие [89].
Лептин, также называемый белком OB,
еще один важный регулятор аппетита. Это
вырабатывается белой и коричневой жировой тканью, желудком, плацентой, молочными железами.
железы, фолликулов яичников и некоторых органов плода, таких как сердце, кости или
хрящ и, возможно, мозг. Об
ген экспрессируется во всей жировой ткани, но в большей степени в
подкожно-жировая клетчатка, чем сальниковый жир.Уровни лептина положительно коррелируют с
количество жировой массы тела. Лептин
секреция, по-видимому, не зависит от режима приема пищи. Вместо этого циркадный ритм
характеризуется высокими уровнями между полуночью и ранним утром и
от полудня до полудня [90].
Лептин секретируется пульсирующе с 32 пиками за 24 часа.
период и длительность импульса 32,8 мин [91]. Это означает, что нервные и нейрогормональные
компоненты мозга могут регулировать секрецию лептина адипоцитами.
Лептиновые рецепторы относятся к суперсемейству цитокиновых рецепторов, в котором используются
преобразователь сигнала активирующей киназы Януса (JAK-) и активатор
транскрипционный (STAT) путь передачи сигнала. Рецепторы лептина имеют множество различных
варианты стыковки. Ob-Rb — полная форма
рецептора и имеет длинный внутриклеточный домен, необходимый для
действие лептина на аппетит. Об-Рб — это
экспрессируется в нескольких разных участках гипоталамуса, включая
дугообразное ядро, паравентрикулярное ядро, дорсомедиальный гипоталамический
ядро и боковая область гипоталамуса.Короткие формы рецептора Ob могут играть роль в транспорте лептина.
через гематоэнцефалический барьер [92].
После связывания рецептора лептин стимулирует специфическую сигнализацию.
каскад, который приводит к ингибированию орексигенных пептидов (NPY и AgRP) [93, 94], одновременно стимулируя аноректические пептиды (включая POMC и CART) [93, 95]. В конечном итоге это приводит к снижению аппетита.
и повышенный расход энергии. дб / дб
мыши имеют мутацию во внутриклеточной части Ob-Rb и поэтому
неспособность реагировать на сигнал лептина и в результате развивается глубокое ожирение
[96].Кроме того, было обнаружено
что до 3% людей с тяжелым ранним началом ожирения имеют патогенные
мутации в гене рецептора лептина [97].
Ob-дефицитные мыши не имеют циркулирующего лептина и развиваются
тяжелое ожирение из-за повышенного потребления пищи и снижения калорийности
расходы [98], оба из которых могут быть нормализованы администрацией
лептин [99]. Отсутствие лептина в
у людей приводит к тяжелому ожирению, гипогонадизму и нарушению иммунитета, опосредованного Т-клетками,
которые излечимы введением рекомбинантного лептина [100].Около 5% людей с ожирением
«Относительно» дефицит лептина, и возможно, что эти люди могли
получают пользу от терапии лептином [101].
Наконец, гормон адипонектин секретируется зрелыми
адипоцит. Рецепторы адипонектина
экспрессируется в головном мозге, особенно в паравентрикулярном ядре, миндалине,
area postrema и диффузно в перивентрикулярных областях. По неясным причинам адипонектин
концентрация в кровотоке чрезвычайно высока, примерно в 1000 раз выше, чем у других
полипептидные гормоны.Его структура
очень похож на коллаген C1q и типов VIII и X. Как правило, адипонектин сам связывается с
образуют гомотримеры, которые затем димеризуются с образованием гексамеров. Повышенный уровень адипонектина у грызунов
по всей видимости, снижает жировую массу тела за счет стимуляции окисления жирных кислот в
мышца [102]. Адипонектин также снижает
потребление пищи и ожирение у крыс с ожирением [103], а также улучшает чувствительность к инсулину
за счет снижения выхода глюкозы в печень [104].
У людей высокомолекулярный адипонектин (который, как полагают,
активная форма) снижается у пациентов с сахарным диабетом 2 типа и увеличивает
доля высокомолекулярного адипонектина при потере веса и лечении
с тиазолиндионами приводит к повышению чувствительности к инсулину [105].
Гормональные регуляторы аппетита
3.1. Роль гипоталамуса в регулировании аппетита
Гипоталамус также является главным регулятором насыщения через производство
POMC и CART. Ген POMC
экспрессируется несколькими тканями, включая кожу и иммунную систему, а также
гипофиз и дугообразное ядро гипоталамуса. POMC подвергается тканеспецифической
посттрансляционное расщепление, при этом продукт зависит от эндопротеаз
выражается в этой ткани.Например,
в передней доле гипофиза POMC в первую очередь превращается в АКТГ посредством
прогормон конвертаза 1. У млекопитающих
кроме приматов, прогормон конвертаза 2 в промежуточном гипофизе
расщепляет АКТГ с образованием α -меланоцит-стимулирующего гормона ( α -MSH), который участвует
в контроле цвета шерсти / кожи. С участием
Что касается гипоталамуса у людей, лептин (пептид, продуцируемый жировой
ткани), как полагают, стимулирует превращение ПОМК в α -MSH в дугообразной
ядро.Нейромедиатор в свою очередь
связывается с рецептором меланокортина-4 (MC4R), ключевым рецептором, участвующим в
контроль аппетита и энергетический гомеостаз, в паравентрикулярном ядре и в
множество других участков мозга. Внутрицеребровентрикулярное введение α -MSH грызунам подавляет
кормление и снижает массу тела. Как упоминалось ранее, AgRP является антагонистом MC4R. Таким образом, мыши со сверхэкспрессией
Мыши с нокаутом по AgRP или MC4R гиперфагичны и страдают ожирением.
[41] и нечувствительны к α -MSH.
Мутации MC4R были обнаружены у 5,8% взрослых с тяжелой формой
ожирение в детском возрасте [42]. POMC
дефицит также приводит к ожирению (из-за отсутствия связывания MC4R),
гипокортизолизм (из-за отсутствия связывания АКТГ с MC2R в надпочечниках
железы) и изменение пигмента (из-за отсутствия связывания MC1R в
кожа). Этот синдром определяется
тяжелое раннее начало ожирения, надпочечниковая недостаточность и рыжие волосы [43]. Соответственно, на моделях рака и грызунов
почечной недостаточности, антагонисты рецепторов MC4R ослабляют симптомы кахексии за счет
поддержание аппетита, безжировой массы тела и базального расхода энергии [44].Таким образом, антагонисты MC4R могут быть полезными клиническими
лечения кахексии [45], в то время как агонисты разрабатываются для лечения
ожирение.
Еще одним важным регулятором сытости в гипоталамусе является кокаин и
транскрипт, регулируемый амфетамином (CART), который коэкспрессируется с POMC в дугообразных нейронах на животных моделях и несколько парадоксально с AgRP и NPY у людей [46].
Подобно нейронам POMC, нейроны CART напрямую стимулируются лептином.
[47]. Целевые области нейронов CART
по всему гипоталамусу и связаны с подкреплением и вознаграждением [48],
сенсорная обработка, стресс и эндокринная регуляция [47, 49].Животные, лишенные еды, уменьшили выражение
мРНК CART [47]. Вдоль тех же самых
линии, блокирующие CART с антисывороткой, увеличивают кормление у нормальных крыс [50]. Внутрицеребровентрикулярное введение
КОРЗИНА у крыс препятствует нормальному кормлению и кормлению, вызванному голоданием, а также
блокирует ответную реакцию питания NPY [47, 50].
На данный момент нам не известно о каких-либо клинических испытаниях с использованием CART.
агонисты или антагонисты для регулирования веса, возможно, из-за значительного
неаппетитные эффекты, связанные с CART.
3.2. Известно, что периферические пептиды контролируют сытость
В отличие от грелина, единственный периферический пептид, который, как известно, стимулирует
голод, есть много периферических пептидов, которые связаны с
сытость. Эти
гормоны, в том числе желудочно-кишечного тракта, поджелудочной железы и жировой ткани
ткань. Список гормонов сытости
слишком обширны, чтобы обсуждать их в этом обзоре.
Поэтому мы сосредоточимся на ключевых игроках, начиная с
холецистокинин (ХЦК), первый открытый гормон сытости.
Холецистокинин (CCK) был первоначально открыт в 1928 году и был одним из
первые пептиды, обнаруженные в кишечнике [51].
Помимо ингибирования приема пищи, CCK стимулирует секрецию поджелудочной железы,
сокращение желчного пузыря, перистальтика кишечника и угнетение желудочного
мобильность. Введение ХЦК крысам
подавляет прием пищи за счет уменьшения размера и продолжительности приема пищи [52], что усиливается
растяжением желудка [53]. В
период полувыведения CCK составляет всего 1-2 минуты, поэтому он неэффективен для снижения
размер еды, если принимать более чем за 15 минут до еды [52].
CCK синтезируется в желудочно-кишечном тракте, но в основном в
двенадцатиперстная кишка и тощая кишка. Несколько
биоактивные формы получены из одного и того же генного продукта посттрансляционным или
внеклеточная обработка. CCK быстро
высвобождается локально и в кровоток в ответ на питательные вещества в кишечнике,
особенно жир и белок, с постепенным увеличением уровня в течение 10–30 минут
после начала приема пищи, остается повышенным до 5 часов [54].
CCK-чувствительные участки мозга включают латеральный гипоталамус, медиальный мост,
и латеральный продолговатый мозг.Эти области
участвует в поощрении поведения, памяти и беспокойства, а также в чувстве насыщения [55, 56]. Существует два типа CCK, связанных с G-белком.
рецепторы: CCK-A и CCK-B [57]. CCK-A участвует в насыщении, тогда как CCK-B участвует в
нет. CCK-A находится на афферентном
вагусные нейроны, оказывающие непосредственное влияние на прием пищи. Крысы с дефицитом CCK-A (Otsuka Long Evans
Крысы Tokushima Fatty (OLETF)) страдают гиперфагией, страдают ожирением и заболевают диабетом.
mellitus тип 2 [58].
Другой пептид насыщения, пептид YY (PYY), является частью поджелудочной железы.
полипептидное (PP-) семейство складчатых пептидов (NPY, PYY, PP), все из которых имеют 36
аминокислоты, содержат несколько остатков тирозина и требуют С-конца
амидирование для биологической активности.В
Семейство PP-складок проявляет свои эффекты через семейство Y G-белков, связанных
рецепторы (Y1, Y2, Y4, Y5), которые экспрессируются в гипоталамусе. PYY продуцируется L-клетками кишечника
подвздошная, толстая и прямая кишка. Следующий
потребление пищи, PYY выпускается в кровоток и достигает пика через 1-2 часа
после еды [59]. Концентрации PYY
пропорциональны содержанию энергии в пище и, следовательно, выше после жира
потребление по сравнению с углеводами и белками [60]. Циркулирующий PYY существует в двух формах: PYY 1-36 и PYY 3-36 .PYY 3-36 — периферийно активный
аноректический сигнал и создается за счет расщепления N-концевых остатков Tyr-Pro
дипептидилпептидазой IV (DPP-IV) [61].
PYY 3-36 связывается с рецепторами Y2, что приводит к ингибированию NPY
нейроны и стимуляция нейронов POMC.
Введение PYY задерживает опорожнение желудка, подавляет секрецию
поджелудочной железы и желудка, подавляет сокращение желчного пузыря и увеличивает
абсорбция жидкости и электролитов из подвздошной кишки [62].У грызунов введение PYY
снижает потребление пищи и снижает прибавку в весе [63], а также улучшает гликемический контроль на моделях диабета на грызунах.
[64]. PYY-дефицитные мыши устойчивы
к насыщению и развитию выраженного ожирения, которое устраняется экзогенным PYY
администрация [65]. Наоборот,
интрацеребровентрикулярное введение полноразмерного PYY стимулирует питание
потребление. Считается, что это действие
на рецепторы Y1 и Y5 в паравентрикулярном ядре нейроны, нацеленные на
нейроны NPY орексигенного дугообразного ядра.
У тучных и худых людей введение PYY 3-36 уменьшается
прием пищи со значительным снижением кумулятивной калорийности за 24 часа
потребление [66]. Однако тучные субъекты
иметь более низкий эндогенный PYY-ответ при каждом приеме пищи по сравнению с нормальным весом
волонтеры [67]. Этот родственник ПГГ
дефицит может снизить чувство насыщения и, таким образом, усилить ожирение. Пациенты с ожирением, получавшие лечение тощей кишкой
хирургия [68] или гастропластика с вертикальными полосами [69] имеют повышенный уровень PYY,
что может способствовать потере аппетита.
Полипептид поджелудочной железы (PP), другой член PP-складчатого пептида
семьи, вырабатывается в основном эндокринной поджелудочной железой, а также экзокринной
поджелудочная железа, толстая и прямая кишка. PP также
высвобождается в ответ на прием пищи пропорционально калорийной нагрузке и подавляет
аппетит [70]. Высвобождение ПП стимулируется
грелином, а также мотилином (пептид, секретируемый тонким кишечником, который
усиливает перистальтику желудочно-кишечного тракта) и секретин (пептид, секретируемый
двенадцатиперстной кишки, который стимулирует секрецию кислоты желудочного сока), тогда как соматостатин (a
гормон, который снижает скорость опорожнения желудка и уменьшает гладкую мускулатуру
сокращение и кровоток в кишечнике) и его аналоги значительно
уменьшить секрецию PP.PP связывается с
наибольшее сродство к рецепторам Y4 и Y5 [71]. Периферическое введение ПП в норме
мыши снижают потребление пищи, опорожнение желудка и экспрессию грелина в желудке,
при этом повышается тонус блуждающего нерва [72].
Подобно PYY, инъекция PP в третий желудочек стимулирует
дневной прием пищи [73]. Интересно,
у пациентов с синдромом Прадера-Вилли подавлено базальное и постпрандиальное PP
уровни [74]. Администрирование ПП в
Пациенты Прадера-Вилли снижают потребление пищи [75].
Инкретины — это гормоны, выделяемые из желудочно-кишечного тракта в
кровообращение в ответ на прием питательных веществ.
Инкретины усиливают секрецию инсулина, стимулированную глюкозой. Препроглюкагон экспрессируется в α клетках
эндокринная поджелудочная железа, L-клетки кишечника (дистальный отдел подвздошной кишки и толстой кишки) и
нейроны, расположенные в хвостовом стволе мозга и гипоталамусе. Он раскололся на несколько разных
продукты, включая глюкагон и два инкретина, оксинтомодулин и
глюкагоноподобный пептид-1 (GLP-1).Оксинтомодулин и GLP-1 высвобождаются из L-клеток в дистальном отделе подвздошной кишки.
и толстой кишки в ответ на прием питательных веществ. Оксинтомодулин связывает рецептор GLP-1, который
выражается в ядре солитарного тракта в стволе мозга и в
дугообразное ядро. Оксинтомодулин подавляет
секреция желудочного сока, уменьшает опорожнение желудка и уменьшает поджелудочную железу.
секреция ферментов, которая, вероятно, связана со снижением желудочного выброса [76]. Введение оксинтомодулина людям имеет
было обнаружено, что подавляет уровень грелина [77], снижает массу тела и аппетит,
снижение лептина и повышение уровня адипонектина предположительно вторично по отношению к потере
жировой ткани [78].
GLP-1 приводит к задержке опорожнения желудка, стимуляции
глюкозозависимая секреция инсулина, ингибирование секреции глюкагона и
стимуляция секреции соматостатина.
GLP-1 связывается со своим рецептором, рецептором, связанным с G-белком, который принадлежит
к семейству класса B, включая рецепторы глюкагона и GIP [79]. Рецептор GLP-1 экспрессируется в широком
ряд тканей, включая островковые клетки поджелудочной железы, легкие, сердце, почки,
желудок, кишечник, гипофиз, кожа, блуждающий нерв и несколько областей
ЦНС, включая гипоталамус и ствол мозга.Периферическое и центральное введение GLP-1 активирует нейроны в
дугообразное и паравентрикулярное ядра, ядро солитарного тракта и область
postrema [80], что приводит к снижению аппетита.
Введение GLP-1 способствует насыщению и благотворно влияет на
гомеостаз глюкозы.
Свойства GLP-1 сделали его полезной лекарственной мишенью. GLP-1 быстро высвобождается в
кровообращение после перорального приема питательного вещества, а его секреция происходит в
двухфазный паттерн, начинающийся с ранней (в пределах 10–15 минут) фазы, то есть
с последующей более длительной (30–60 минут) фазой [81].Период полувыведения GLP-1 составляет менее 2 минут.
из-за быстрой инактивации ферментом DPP-IV, который также расщепляет PYY. Это основа для развития
экзенатид (Byetta), подкожно вводимый DPP-IV-устойчивый GLP-1
агонист рецепторов.
Глюкозозависимый инсулинотропный полипептид (GIP) — еще один инкретин.
который секретируется желудком и К-клетками двенадцатиперстной и тощей кишки в
реакция на прием питательных веществ. Период полураспада
GIP составляет 7 минут у здоровых людей и 5 минут у пациентов с типом
2 сахарный диабет [82].GIP также инактивирован
по ДПП-IV [82, 83]. Рецептор GIP
ген экспрессируется в поджелудочной железе, желудке, тонком кишечнике, жировой ткани,
кора надпочечников, гипофиз, сердце, яичко, эндотелиальные клетки, кость, трахея,
селезенка, тимус, легкие, почки, щитовидная железа и некоторые области ЦНС. GIP приводит к глюкозозависимому инсулину
секреция, индукция пролиферации клеток β , стимулирование накопления энергии через
прямое воздействие на жировую ткань и усиление костеобразования за счет
стимуляция пролиферации остеобластов и подавление апоптоза.В ЦНС GIP выражается в
экспрессия гиппокампа и рецептора GIP обнаруживается в коре головного мозга,
гиппокамп и обонятельная луковица. GIP
действие в ЦНС может играть роль в пролиферации нервных клеток-предшественников и
модификация поведения [84].
Инсулин — еще один гормональный регулятор аппетита. Уровень инсулина быстро повышается после еды
и напрямую зависят от изменения ожирения.
Инсулин проникает через гематоэнцефалический барьер через насыщаемый,
рецептор-опосредованный процесс на уровнях, пропорциональных циркулирующему инсулину
[85].Рецепторы инсулина широко распространены.
распределены в головном мозге, а самые высокие концентрации обнаруживаются в обонятельной
луковицы и дугообразное ядро. Как только инсулин
попадает в мозг, действует как анорексигенный сигнал [86]. Мыши с нейрон-специфическим нарушением
ген рецептора инсулина имеют повышенное потребление пищи, ожирение с увеличением тела
уровни жира и лептина в плазме, а также нарушение сперматогенеза и яичников
созревание фолликула [87]. Есть
несколько субстратов рецептора инсулина (IRS), которые активируются фосфорилированием
рецептором инсулина на их тирозиновых остатках [88].IRS-1 и IRS-2 были идентифицированы в
нейроны. Мыши с нокаутом IRS-2 были
обнаружено повышенное потребление пищи, увеличение жировых отложений и бесплодие [89].
Лептин, также называемый белком OB,
еще один важный регулятор аппетита. Это
вырабатывается белой и коричневой жировой тканью, желудком, плацентой, молочными железами.
железы, фолликулов яичников и некоторых органов плода, таких как сердце, кости или
хрящ и, возможно, мозг. Об
ген экспрессируется во всей жировой ткани, но в большей степени в
подкожно-жировая клетчатка, чем сальниковый жир.Уровни лептина положительно коррелируют с
количество жировой массы тела. Лептин
секреция, по-видимому, не зависит от режима приема пищи. Вместо этого циркадный ритм
характеризуется высокими уровнями между полуночью и ранним утром и
от полудня до полудня [90].
Лептин секретируется пульсирующе с 32 пиками за 24 часа.
период и длительность импульса 32,8 мин [91]. Это означает, что нервные и нейрогормональные
компоненты мозга могут регулировать секрецию лептина адипоцитами.
Лептиновые рецепторы относятся к суперсемейству цитокиновых рецепторов, в котором используются
преобразователь сигнала активирующей киназы Януса (JAK-) и активатор
транскрипционный (STAT) путь передачи сигнала. Рецепторы лептина имеют множество различных
варианты стыковки. Ob-Rb — полная форма
рецептора и имеет длинный внутриклеточный домен, необходимый для
действие лептина на аппетит. Об-Рб — это
экспрессируется в нескольких разных участках гипоталамуса, включая
дугообразное ядро, паравентрикулярное ядро, дорсомедиальный гипоталамический
ядро и боковая область гипоталамуса.Короткие формы рецептора Ob могут играть роль в транспорте лептина.
через гематоэнцефалический барьер [92].
После связывания рецептора лептин стимулирует специфическую сигнализацию.
каскад, который приводит к ингибированию орексигенных пептидов (NPY и AgRP) [93, 94], одновременно стимулируя аноректические пептиды (включая POMC и CART) [93, 95]. В конечном итоге это приводит к снижению аппетита.
и повышенный расход энергии. дб / дб
мыши имеют мутацию во внутриклеточной части Ob-Rb и поэтому
неспособность реагировать на сигнал лептина и в результате развивается глубокое ожирение
[96].Кроме того, было обнаружено
что до 3% людей с тяжелым ранним началом ожирения имеют патогенные
мутации в гене рецептора лептина [97].
Ob-дефицитные мыши не имеют циркулирующего лептина и развиваются
тяжелое ожирение из-за повышенного потребления пищи и снижения калорийности
расходы [98], оба из которых могут быть нормализованы администрацией
лептин [99]. Отсутствие лептина в
у людей приводит к тяжелому ожирению, гипогонадизму и нарушению иммунитета, опосредованного Т-клетками,
которые излечимы введением рекомбинантного лептина [100].Около 5% людей с ожирением
«Относительно» дефицит лептина, и возможно, что эти люди могли
получают пользу от терапии лептином [101].
Наконец, гормон адипонектин секретируется зрелыми
адипоцит. Рецепторы адипонектина
экспрессируется в головном мозге, особенно в паравентрикулярном ядре, миндалине,
area postrema и диффузно в перивентрикулярных областях. По неясным причинам адипонектин
концентрация в кровотоке чрезвычайно высока, примерно в 1000 раз выше, чем у других
полипептидные гормоны.Его структура
очень похож на коллаген C1q и типов VIII и X. Как правило, адипонектин сам связывается с
образуют гомотримеры, которые затем димеризуются с образованием гексамеров. Повышенный уровень адипонектина у грызунов
по всей видимости, снижает жировую массу тела за счет стимуляции окисления жирных кислот в
мышца [102]. Адипонектин также снижает
потребление пищи и ожирение у крыс с ожирением [103], а также улучшает чувствительность к инсулину
за счет снижения выхода глюкозы в печень [104].
У людей высокомолекулярный адипонектин (который, как полагают,
активная форма) снижается у пациентов с сахарным диабетом 2 типа и увеличивает
доля высокомолекулярного адипонектина при потере веса и лечении
с тиазолиндионами приводит к повышению чувствительности к инсулину [105].
Гормональные регуляторы аппетита
3.1. Роль гипоталамуса в регулировании аппетита
Гипоталамус также является главным регулятором насыщения через производство
POMC и CART. Ген POMC
экспрессируется несколькими тканями, включая кожу и иммунную систему, а также
гипофиз и дугообразное ядро гипоталамуса. POMC подвергается тканеспецифической
посттрансляционное расщепление, при этом продукт зависит от эндопротеаз
выражается в этой ткани.Например,
в передней доле гипофиза POMC в первую очередь превращается в АКТГ посредством
прогормон конвертаза 1. У млекопитающих
кроме приматов, прогормон конвертаза 2 в промежуточном гипофизе
расщепляет АКТГ с образованием α -меланоцит-стимулирующего гормона ( α -MSH), который участвует
в контроле цвета шерсти / кожи. С участием
Что касается гипоталамуса у людей, лептин (пептид, продуцируемый жировой
ткани), как полагают, стимулирует превращение ПОМК в α -MSH в дугообразной
ядро.Нейромедиатор в свою очередь
связывается с рецептором меланокортина-4 (MC4R), ключевым рецептором, участвующим в
контроль аппетита и энергетический гомеостаз, в паравентрикулярном ядре и в
множество других участков мозга. Внутрицеребровентрикулярное введение α -MSH грызунам подавляет
кормление и снижает массу тела. Как упоминалось ранее, AgRP является антагонистом MC4R. Таким образом, мыши со сверхэкспрессией
Мыши с нокаутом по AgRP или MC4R гиперфагичны и страдают ожирением.
[41] и нечувствительны к α -MSH.
Мутации MC4R были обнаружены у 5,8% взрослых с тяжелой формой
ожирение в детском возрасте [42]. POMC
дефицит также приводит к ожирению (из-за отсутствия связывания MC4R),
гипокортизолизм (из-за отсутствия связывания АКТГ с MC2R в надпочечниках
железы) и изменение пигмента (из-за отсутствия связывания MC1R в
кожа). Этот синдром определяется
тяжелое раннее начало ожирения, надпочечниковая недостаточность и рыжие волосы [43]. Соответственно, на моделях рака и грызунов
почечной недостаточности, антагонисты рецепторов MC4R ослабляют симптомы кахексии за счет
поддержание аппетита, безжировой массы тела и базального расхода энергии [44].Таким образом, антагонисты MC4R могут быть полезными клиническими
лечения кахексии [45], в то время как агонисты разрабатываются для лечения
ожирение.
Еще одним важным регулятором сытости в гипоталамусе является кокаин и
транскрипт, регулируемый амфетамином (CART), который коэкспрессируется с POMC в дугообразных нейронах на животных моделях и несколько парадоксально с AgRP и NPY у людей [46].
Подобно нейронам POMC, нейроны CART напрямую стимулируются лептином.
[47]. Целевые области нейронов CART
по всему гипоталамусу и связаны с подкреплением и вознаграждением [48],
сенсорная обработка, стресс и эндокринная регуляция [47, 49].Животные, лишенные еды, уменьшили выражение
мРНК CART [47]. Вдоль тех же самых
линии, блокирующие CART с антисывороткой, увеличивают кормление у нормальных крыс [50]. Внутрицеребровентрикулярное введение
КОРЗИНА у крыс препятствует нормальному кормлению и кормлению, вызванному голоданием, а также
блокирует ответную реакцию питания NPY [47, 50].
На данный момент нам не известно о каких-либо клинических испытаниях с использованием CART.
агонисты или антагонисты для регулирования веса, возможно, из-за значительного
неаппетитные эффекты, связанные с CART.
3.2. Известно, что периферические пептиды контролируют сытость
В отличие от грелина, единственный периферический пептид, который, как известно, стимулирует
голод, есть много периферических пептидов, которые связаны с
сытость. Эти
гормоны, в том числе желудочно-кишечного тракта, поджелудочной железы и жировой ткани
ткань. Список гормонов сытости
слишком обширны, чтобы обсуждать их в этом обзоре.
Поэтому мы сосредоточимся на ключевых игроках, начиная с
холецистокинин (ХЦК), первый открытый гормон сытости.
Холецистокинин (CCK) был первоначально открыт в 1928 году и был одним из
первые пептиды, обнаруженные в кишечнике [51].
Помимо ингибирования приема пищи, CCK стимулирует секрецию поджелудочной железы,
сокращение желчного пузыря, перистальтика кишечника и угнетение желудочного
мобильность. Введение ХЦК крысам
подавляет прием пищи за счет уменьшения размера и продолжительности приема пищи [52], что усиливается
растяжением желудка [53]. В
период полувыведения CCK составляет всего 1-2 минуты, поэтому он неэффективен для снижения
размер еды, если принимать более чем за 15 минут до еды [52].
CCK синтезируется в желудочно-кишечном тракте, но в основном в
двенадцатиперстная кишка и тощая кишка. Несколько
биоактивные формы получены из одного и того же генного продукта посттрансляционным или
внеклеточная обработка. CCK быстро
высвобождается локально и в кровоток в ответ на питательные вещества в кишечнике,
особенно жир и белок, с постепенным увеличением уровня в течение 10–30 минут
после начала приема пищи, остается повышенным до 5 часов [54].
CCK-чувствительные участки мозга включают латеральный гипоталамус, медиальный мост,
и латеральный продолговатый мозг.Эти области
участвует в поощрении поведения, памяти и беспокойства, а также в чувстве насыщения [55, 56]. Существует два типа CCK, связанных с G-белком.
рецепторы: CCK-A и CCK-B [57]. CCK-A участвует в насыщении, тогда как CCK-B участвует в
нет. CCK-A находится на афферентном
вагусные нейроны, оказывающие непосредственное влияние на прием пищи. Крысы с дефицитом CCK-A (Otsuka Long Evans
Крысы Tokushima Fatty (OLETF)) страдают гиперфагией, страдают ожирением и заболевают диабетом.
mellitus тип 2 [58].
Другой пептид насыщения, пептид YY (PYY), является частью поджелудочной железы.
полипептидное (PP-) семейство складчатых пептидов (NPY, PYY, PP), все из которых имеют 36
аминокислоты, содержат несколько остатков тирозина и требуют С-конца
амидирование для биологической активности.В
Семейство PP-складок проявляет свои эффекты через семейство Y G-белков, связанных
рецепторы (Y1, Y2, Y4, Y5), которые экспрессируются в гипоталамусе. PYY продуцируется L-клетками кишечника
подвздошная, толстая и прямая кишка. Следующий
потребление пищи, PYY выпускается в кровоток и достигает пика через 1-2 часа
после еды [59]. Концентрации PYY
пропорциональны содержанию энергии в пище и, следовательно, выше после жира
потребление по сравнению с углеводами и белками [60]. Циркулирующий PYY существует в двух формах: PYY 1-36 и PYY 3-36 .PYY 3-36 — периферийно активный
аноректический сигнал и создается за счет расщепления N-концевых остатков Tyr-Pro
дипептидилпептидазой IV (DPP-IV) [61].
PYY 3-36 связывается с рецепторами Y2, что приводит к ингибированию NPY
нейроны и стимуляция нейронов POMC.
Введение PYY задерживает опорожнение желудка, подавляет секрецию
поджелудочной железы и желудка, подавляет сокращение желчного пузыря и увеличивает
абсорбция жидкости и электролитов из подвздошной кишки [62].У грызунов введение PYY
снижает потребление пищи и снижает прибавку в весе [63], а также улучшает гликемический контроль на моделях диабета на грызунах.
[64]. PYY-дефицитные мыши устойчивы
к насыщению и развитию выраженного ожирения, которое устраняется экзогенным PYY
администрация [65]. Наоборот,
интрацеребровентрикулярное введение полноразмерного PYY стимулирует питание
потребление. Считается, что это действие
на рецепторы Y1 и Y5 в паравентрикулярном ядре нейроны, нацеленные на
нейроны NPY орексигенного дугообразного ядра.
У тучных и худых людей введение PYY 3-36 уменьшается
прием пищи со значительным снижением кумулятивной калорийности за 24 часа
потребление [66]. Однако тучные субъекты
иметь более низкий эндогенный PYY-ответ при каждом приеме пищи по сравнению с нормальным весом
волонтеры [67]. Этот родственник ПГГ
дефицит может снизить чувство насыщения и, таким образом, усилить ожирение. Пациенты с ожирением, получавшие лечение тощей кишкой
хирургия [68] или гастропластика с вертикальными полосами [69] имеют повышенный уровень PYY,
что может способствовать потере аппетита.
Полипептид поджелудочной железы (PP), другой член PP-складчатого пептида
семьи, вырабатывается в основном эндокринной поджелудочной железой, а также экзокринной
поджелудочная железа, толстая и прямая кишка. PP также
высвобождается в ответ на прием пищи пропорционально калорийной нагрузке и подавляет
аппетит [70]. Высвобождение ПП стимулируется
грелином, а также мотилином (пептид, секретируемый тонким кишечником, который
усиливает перистальтику желудочно-кишечного тракта) и секретин (пептид, секретируемый
двенадцатиперстной кишки, который стимулирует секрецию кислоты желудочного сока), тогда как соматостатин (a
гормон, который снижает скорость опорожнения желудка и уменьшает гладкую мускулатуру
сокращение и кровоток в кишечнике) и его аналоги значительно
уменьшить секрецию PP.PP связывается с
наибольшее сродство к рецепторам Y4 и Y5 [71]. Периферическое введение ПП в норме
мыши снижают потребление пищи, опорожнение желудка и экспрессию грелина в желудке,
при этом повышается тонус блуждающего нерва [72].
Подобно PYY, инъекция PP в третий желудочек стимулирует
дневной прием пищи [73]. Интересно,
у пациентов с синдромом Прадера-Вилли подавлено базальное и постпрандиальное PP
уровни [74]. Администрирование ПП в
Пациенты Прадера-Вилли снижают потребление пищи [75].
Инкретины — это гормоны, выделяемые из желудочно-кишечного тракта в
кровообращение в ответ на прием питательных веществ.
Инкретины усиливают секрецию инсулина, стимулированную глюкозой. Препроглюкагон экспрессируется в α клетках
эндокринная поджелудочная железа, L-клетки кишечника (дистальный отдел подвздошной кишки и толстой кишки) и
нейроны, расположенные в хвостовом стволе мозга и гипоталамусе. Он раскололся на несколько разных
продукты, включая глюкагон и два инкретина, оксинтомодулин и
глюкагоноподобный пептид-1 (GLP-1).Оксинтомодулин и GLP-1 высвобождаются из L-клеток в дистальном отделе подвздошной кишки.
и толстой кишки в ответ на прием питательных веществ. Оксинтомодулин связывает рецептор GLP-1, который
выражается в ядре солитарного тракта в стволе мозга и в
дугообразное ядро. Оксинтомодулин подавляет
секреция желудочного сока, уменьшает опорожнение желудка и уменьшает поджелудочную железу.
секреция ферментов, которая, вероятно, связана со снижением желудочного выброса [76]. Введение оксинтомодулина людям имеет
было обнаружено, что подавляет уровень грелина [77], снижает массу тела и аппетит,
снижение лептина и повышение уровня адипонектина предположительно вторично по отношению к потере
жировой ткани [78].
GLP-1 приводит к задержке опорожнения желудка, стимуляции
глюкозозависимая секреция инсулина, ингибирование секреции глюкагона и
стимуляция секреции соматостатина.
GLP-1 связывается со своим рецептором, рецептором, связанным с G-белком, который принадлежит
к семейству класса B, включая рецепторы глюкагона и GIP [79]. Рецептор GLP-1 экспрессируется в широком
ряд тканей, включая островковые клетки поджелудочной железы, легкие, сердце, почки,
желудок, кишечник, гипофиз, кожа, блуждающий нерв и несколько областей
ЦНС, включая гипоталамус и ствол мозга.Периферическое и центральное введение GLP-1 активирует нейроны в
дугообразное и паравентрикулярное ядра, ядро солитарного тракта и область
postrema [80], что приводит к снижению аппетита.
Введение GLP-1 способствует насыщению и благотворно влияет на
гомеостаз глюкозы.
Свойства GLP-1 сделали его полезной лекарственной мишенью. GLP-1 быстро высвобождается в
кровообращение после перорального приема питательного вещества, а его секреция происходит в
двухфазный паттерн, начинающийся с ранней (в пределах 10–15 минут) фазы, то есть
с последующей более длительной (30–60 минут) фазой [81].Период полувыведения GLP-1 составляет менее 2 минут.
из-за быстрой инактивации ферментом DPP-IV, который также расщепляет PYY. Это основа для развития
экзенатид (Byetta), подкожно вводимый DPP-IV-устойчивый GLP-1
агонист рецепторов.
Глюкозозависимый инсулинотропный полипептид (GIP) — еще один инкретин.
который секретируется желудком и К-клетками двенадцатиперстной и тощей кишки в
реакция на прием питательных веществ. Период полураспада
GIP составляет 7 минут у здоровых людей и 5 минут у пациентов с типом
2 сахарный диабет [82].GIP также инактивирован
по ДПП-IV [82, 83]. Рецептор GIP
ген экспрессируется в поджелудочной железе, желудке, тонком кишечнике, жировой ткани,
кора надпочечников, гипофиз, сердце, яичко, эндотелиальные клетки, кость, трахея,
селезенка, тимус, легкие, почки, щитовидная железа и некоторые области ЦНС. GIP приводит к глюкозозависимому инсулину
секреция, индукция пролиферации клеток β , стимулирование накопления энергии через
прямое воздействие на жировую ткань и усиление костеобразования за счет
стимуляция пролиферации остеобластов и подавление апоптоза.В ЦНС GIP выражается в
экспрессия гиппокампа и рецептора GIP обнаруживается в коре головного мозга,
гиппокамп и обонятельная луковица. GIP
действие в ЦНС может играть роль в пролиферации нервных клеток-предшественников и
модификация поведения [84].
Инсулин — еще один гормональный регулятор аппетита. Уровень инсулина быстро повышается после еды
и напрямую зависят от изменения ожирения.
Инсулин проникает через гематоэнцефалический барьер через насыщаемый,
рецептор-опосредованный процесс на уровнях, пропорциональных циркулирующему инсулину
[85].Рецепторы инсулина широко распространены.
распределены в головном мозге, а самые высокие концентрации обнаруживаются в обонятельной
луковицы и дугообразное ядро. Как только инсулин
попадает в мозг, действует как анорексигенный сигнал [86]. Мыши с нейрон-специфическим нарушением
ген рецептора инсулина имеют повышенное потребление пищи, ожирение с увеличением тела
уровни жира и лептина в плазме, а также нарушение сперматогенеза и яичников
созревание фолликула [87]. Есть
несколько субстратов рецептора инсулина (IRS), которые активируются фосфорилированием
рецептором инсулина на их тирозиновых остатках [88].IRS-1 и IRS-2 были идентифицированы в
нейроны. Мыши с нокаутом IRS-2 были
обнаружено повышенное потребление пищи, увеличение жировых отложений и бесплодие [89].
Лептин, также называемый белком OB,
еще один важный регулятор аппетита. Это
вырабатывается белой и коричневой жировой тканью, желудком, плацентой, молочными железами.
железы, фолликулов яичников и некоторых органов плода, таких как сердце, кости или
хрящ и, возможно, мозг. Об
ген экспрессируется во всей жировой ткани, но в большей степени в
подкожно-жировая клетчатка, чем сальниковый жир.Уровни лептина положительно коррелируют с
количество жировой массы тела. Лептин
секреция, по-видимому, не зависит от режима приема пищи. Вместо этого циркадный ритм
характеризуется высокими уровнями между полуночью и ранним утром и
от полудня до полудня [90].
Лептин секретируется пульсирующе с 32 пиками за 24 часа.
период и длительность импульса 32,8 мин [91]. Это означает, что нервные и нейрогормональные
компоненты мозга могут регулировать секрецию лептина адипоцитами.
Лептиновые рецепторы относятся к суперсемейству цитокиновых рецепторов, в котором используются
преобразователь сигнала активирующей киназы Януса (JAK-) и активатор
транскрипционный (STAT) путь передачи сигнала. Рецепторы лептина имеют множество различных
варианты стыковки. Ob-Rb — полная форма
рецептора и имеет длинный внутриклеточный домен, необходимый для
действие лептина на аппетит. Об-Рб — это
экспрессируется в нескольких разных участках гипоталамуса, включая
дугообразное ядро, паравентрикулярное ядро, дорсомедиальный гипоталамический
ядро и боковая область гипоталамуса.Короткие формы рецептора Ob могут играть роль в транспорте лептина.
через гематоэнцефалический барьер [92].
После связывания рецептора лептин стимулирует специфическую сигнализацию.
каскад, который приводит к ингибированию орексигенных пептидов (NPY и AgRP) [93, 94], одновременно стимулируя аноректические пептиды (включая POMC и CART) [93, 95]. В конечном итоге это приводит к снижению аппетита.
и повышенный расход энергии. дб / дб
мыши имеют мутацию во внутриклеточной части Ob-Rb и поэтому
неспособность реагировать на сигнал лептина и в результате развивается глубокое ожирение
[96].Кроме того, было обнаружено
что до 3% людей с тяжелым ранним началом ожирения имеют патогенные
мутации в гене рецептора лептина [97].
Ob-дефицитные мыши не имеют циркулирующего лептина и развиваются
тяжелое ожирение из-за повышенного потребления пищи и снижения калорийности
расходы [98], оба из которых могут быть нормализованы администрацией
лептин [99]. Отсутствие лептина в
у людей приводит к тяжелому ожирению, гипогонадизму и нарушению иммунитета, опосредованного Т-клетками,
которые излечимы введением рекомбинантного лептина [100].Около 5% людей с ожирением
«Относительно» дефицит лептина, и возможно, что эти люди могли
получают пользу от терапии лептином [101].
Наконец, гормон адипонектин секретируется зрелыми
адипоцит. Рецепторы адипонектина
экспрессируется в головном мозге, особенно в паравентрикулярном ядре, миндалине,
area postrema и диффузно в перивентрикулярных областях. По неясным причинам адипонектин
концентрация в кровотоке чрезвычайно высока, примерно в 1000 раз выше, чем у других
полипептидные гормоны.Его структура
очень похож на коллаген C1q и типов VIII и X. Как правило, адипонектин сам связывается с
образуют гомотримеры, которые затем димеризуются с образованием гексамеров. Повышенный уровень адипонектина у грызунов
по всей видимости, снижает жировую массу тела за счет стимуляции окисления жирных кислот в
мышца [102]. Адипонектин также снижает
потребление пищи и ожирение у крыс с ожирением [103], а также улучшает чувствительность к инсулину
за счет снижения выхода глюкозы в печень [104].
У людей высокомолекулярный адипонектин (который, как полагают,
активная форма) снижается у пациентов с сахарным диабетом 2 типа и увеличивает
доля высокомолекулярного адипонектина при потере веса и лечении
с тиазолиндионами приводит к повышению чувствительности к инсулину [105].
Всегда голодны? Это может быть инсулинорезистентность
Всегда чувствуете себя вялым, что бы вы ни кушали? У вас может быть инсулинорезистентность.
Вы съели свой обед, но через 30 минут вы снова проголодались — чувствуете себя слабым и дрожащим. Вы спускаетесь к торговому автомату и пытаетесь получить немного энергии от плитки шоколада, но вскоре после этого снова чувствуете себя вялым.
Это ты?
Возможно, вы совершенно не подозреваете о заболевании, которое увеличивает риск развития диабета 2 типа.
Какова роль инсулина?
Инсулинорезистентность возникает, когда организм не может абсорбировать и использовать производимый им инсулин, что приводит к повышению уровня глюкозы в крови.
По данным Национального института диабета, болезней органов пищеварения и почек, инсулин — это гормон, вырабатываемый поджелудочной железой, органом, расположенным за желудком.
Роль инсулина заключается в том, чтобы позволить клеткам тела поглощать глюкозу, которая может использоваться в качестве топлива или накапливаться в виде телесного жира.Когда уровень глюкозы в крови повышается после еды, поджелудочная железа вырабатывает инсулин, который помогает печени, мышцам и жировым клеткам поглощать глюкозу.
Инсулин также снижает уровень глюкозы в крови за счет уменьшения выработки глюкозы в печени. Если вы здоровы, ваш инсулин автоматически регулирует уровень глюкозы в крови.
Что происходит при инсулинорезистентности?
Все становится грушевидным, когда клетки не реагируют должным образом на инсулин и не могут поглощать глюкозу из кровотока.Вашему организму необходим более высокий уровень инсулина, чтобы помочь усвоению глюкозы. Поскольку ваша поджелудочная железа пытается удовлетворить потребность в большем количестве инсулина, она может начать давать сбои, что приводит к предиабету и, в конечном итоге, к диабету 2 типа.
Каковы симптомы?
Инсулинорезистентность часто не проявляется симптомами, или симптомы могут проявиться через некоторое время.
Однако есть некоторые признаки, которые могут указывать на то, что ваш инсулин не функционирует оптимально:
- Вялость, особенно после еды
- Регулярная тяга к сахару
- Проблемы с концентрацией внимания
- Увеличение веса вокруг живота
- Низкий уровень » «хороший» холестерин
- Невозможность похудеть, несмотря на большие усилия
Может ли быть инсулинорезистентность? Это критерии, которые увеличивают риск инсулинорезистентности в соответствии с рекомендациями, опубликованными Американской кардиологической ассоциацией:
1.Обхват талии более 102 см у мужчин и более 88 см у женщин.
2. Анализ крови, показывающий, что у вас уровень триглицеридов (тип жира в крови, связанный с ишемической болезнью сердца) выше 1,7 ммоль / л, или если вы принимаете лекарства от повышенного уровня триглицеридов.
3. Анализ крови, показывающий, что у вас низкий уровень «хорошего холестерина», также известного как холестерин ЛПВП. Это уровень менее 1,03 ммоль / л у мужчин и менее 1,3 ммоль / л у женщин или если вы принимаете лекарственные препараты от низкого холестерина ЛПВП.
4. Если у вас высокое или незначительно повышенное артериальное давление на 130 мм рт. Ст. Систолическое артериальное давление и / или диастолическое артериальное давление 85 мм рт. , с анализом крови, показывающим повышенный уровень глюкозы в крови более 5,6 ммоль / л после ночного голодания.
Когда инсулинорезистентность достигает преддиабета, у вас могут возникнуть следующие симптомы:
- Повышенный уровень сахара в крови
- Чрезмерная жажда
- Повышенное мочеиспускание
- Затуманенное зрение
- Усталость
Кто подвержен риску инсулинорезистентности?
Инсулинорезистентность часто связана с нездоровым образом жизни.У вас может быть повышенный риск инсулинорезистентности и, возможно, преддиабета, если вы:
- имеете избыточный вес или страдаете ожирением
- ведете в основном малоподвижный образ жизни
- имеете родителей или братьев и сестер с диабетом
- страдаете высоким кровяным давлением
Что вы можете сделать с инсулинорезистентностью?
Есть способы обратить вспять инсулинорезистентность. Сюда входит изменение диеты и режима упражнений:
- Проконсультируйтесь с диетологом, который поможет вам перейти на низкоуглеводную диету.
- Соблюдайте сбалансированную диету, включающую фрукты, овощи, цельнозерновые продукты, клетчатку, нежирный белок и полезные жиры.
- Попросите врача проверить вас на предиабет и регулярно контролировать уровень глюкозы в крови.
- Бросить курить.
- Управляйте уровнем стресса и снижайте его.
- Регулярно следите за своим кровяным давлением и уровнем холестерина.
Изображение предоставлено: iStock
Как инсулин в мозге может подавить субъективное чувство голода
Интраназальный инсулин усиливает функциональную связь в определенных когнитивных областях мозга (сеть стандартного режима, DMN), а также в гиппокампе и гипоталамусе.Источник изображения: IDM Кредит: © IDM
Инсулин в мозге может помочь регулировать чувство голода и улучшить функциональную связь в сети режима по умолчанию (DMN), а также в гиппокампе и гипоталамусе. Это открытие нового исследования, проведенного учеными из Немецкого центра исследований диабета (DZD) в Тюбингене.
Кулинарное поведение и субъективное чувство голода регулируются различными гормонами.Здесь ключевую роль играет гормон инсулин, который активен в головном мозге. Ранее было известно, что инсулин действует на гомеостатическую область (гипоталамус). Однако теперь ученые обнаружили, что гормон активен и в других областях мозга. Исследователи из Института исследований диабета и метаболических заболеваний Helmholtz Zentrum München при Тюбингенском университете дополнительно расшифровали функцию инсулина в мозге, а также его влияние на субъективное чувство голода и опубликовали свои результаты в Scientific Reports , журнал исследований природы.
Чтобы лучше понять механизм действия инсулина, исследователи вводили инсулин интраназально здоровым молодым людям. Благодаря применению гормона через назальный спрей, гематоэнцефалический барьер был преодолен, и инсулин напрямую достигал мозга. В исследовании 25 худых, 10 человек с избыточным весом и 12 участников с ожирением «нюхали» инсулин или плацебо. Затем активность мозга визуализировали и регистрировали с помощью сканирования функциональной магнитно-резонансной томографии (фМРТ). У всех участников исследования было обнаружено, что интраназальный инсулин улучшает функциональную связь в префронтальных областях сети стандартного режима (DMN), группы областей мозга, которые активируются, когда человек находится в состоянии покоя и не выполняет никаких задач.Эта область занимает центральное место в когнитивных процессах. Кроме того, усиливается функциональная связь между DMN, гиппокампом и гипоталамусом.
Эти изменения в мозге также влияют на пищевое поведение и изменяют взаимосвязь между ожирением и чувством голода. На самом деле, люди с большим количеством висцеральной жировой ткани испытывают повышенное чувство голода. «Инсулино-усиленная связь между DMN и гиппокампом подавляет взаимосвязь между жировой тканью и субъективным чувством голода», — сказала Стефани Куллманн, автор исследования.Участники исследования меньше чувствовали голода после интраназального введения инсулина.
Кроме того, ученые заметили, что инсулин в головном мозге также улучшает действие гормона в организме. Участники исследования с индуцированным инсулином повышенной функциональной связностью в DMN имеют более высокую чувствительность к инсулину в организме. Это противодействует ожирению и диабету 2 типа.
Текущие результаты показывают, что инсулин в головном мозге — из-за повышенной функциональной связи между когнитивными и гомеостатическими областями — может помочь регулировать пищевое поведение и способствовать снижению веса.
Инсулин увеличивает функциональную связность в состоянии покоя при СД2
Дополнительная информация:
Стефани Куллманн и др., Интраназальный инсулин усиливает функциональные связи мозга, опосредуя связь между ожирением и субъективным чувством голода, Scientific Reports (2017).DOI: 10.1038 / s41598-017-01907-w
Предоставлено
Deutsches Zentrum fuer Diabetesforschung DZD
Ссылка :
Как инсулин в мозге может подавить субъективное чувство голода (2017, 26 июня)
получено 6 декабря 2021 г.


