Понятие о гликемических индексах | Официальный сайт Метода Монтиньяка
Определение ГИ
Гликемический индекс продукта выражает, насколько данный продукт повысит уровень гликемии при поступлении в организм человека.
Значение гликемического индекса продукта является результатом сравнения гипергликемии, вызываемой этим продуктом, с гипергликемией, вызываемой чистой глюкозой.
Определение гликемии
Гликемия – это количество глюкозы (или «сахара»), содержащейся в крови. Натощак гликемия человека составляет примерно 1 грамм глюкозы на литр крови. Когда в организм поступает продукт, содержащий углеводы, при его переваривании образуется глюкоза, которая, проникая в кровь, повышает гликемию (то есть вызывает временную гипергликемию).
Уровень глюкозы в крови — чрезвычайно важный параметр регулирования веса. Дело в том, что повышение гликемии — следствие переваривания углеводов — вызывает выработку гормона инсулина, количество которого определяет, будет ли приведён в действие механизм набирания веса или нет.
Расчёт гликемического индекса
В течение длительного времени считалось, что любые углеводсодержащие продукты при равных порциях вызывают одинаковый инсулиновый ответ. В середине 70-х годов ХХ века калифорнийский учёный Крапо (Crapo) из Станфордского университета открыл, что, имея одинаковую концентрацию чистого углевода, разные продукты неодинаково влияют на гликемию.
На следующем этапе исследований предстояло выяснить, насколько каждый углевод способен повышать гликемию (другими словами, определить гипергликемичный потенциал каждого углеводсодержащего продукта), и затем сравнить их между собой.
В 1981 году Дженкинс (Jenkins) разработал способ расчёта и классификации гликемических индексов продуктов, основываясь на работах Крапо, опубликованных с 1976 года.
Дженкинс не просто оценил значение гипергликемии, вызываемой поступлением в организм каждого отдельного углеводсодержащего продукта. Он принял в расчёт площадь треугольника, образуемого осями графика и кривой гипергликемии, появляющейся после расщепления продукта, поступившего в организм натощак.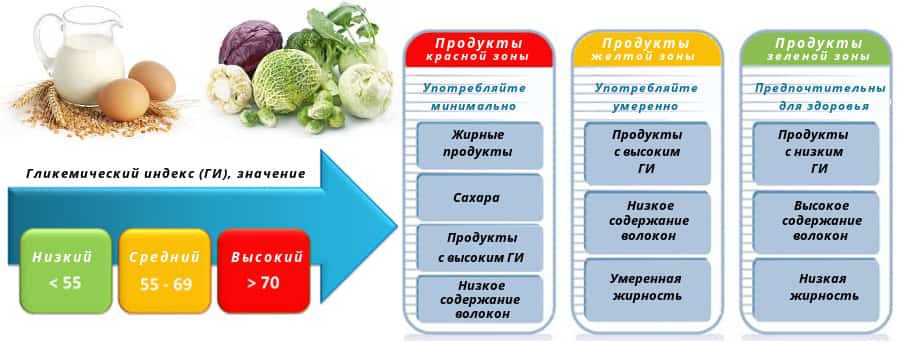
Для того чтобы составить шкалу гликемических индексов, Дженкинс произвольно присвоил глюкозе индекс 100 (точно так же, как значение 0° когда-то было произвольно присвоено термометру Цельсия). Кроме того, число 100 соответствует стопроцентной всасываемости глюкозы.
Значение гликемических индексов продуктов, при одинаковом количестве чистого углевода, рассчитывается по следующей формуле:
|
|
|
Итак, гликемический индекс продукта показывает величину гипергликемии, вызываемой данным продуктом при его поступлении в организм человека; другими словами, ГИ выражает то количество глюкозы, которое образуется при переваривании продукта. Можно также сказать, что ГИ показывает степень биодоступности углеводсодержащего продукта для его усвоения организмом в форме глюкозы.
Можно также сказать, что ГИ показывает степень биодоступности углеводсодержащего продукта для его усвоения организмом в форме глюкозы.
Подробнее о переваривании и всасывании пищи.
Высокий гликемический индекс продукта (например, картофеля), означает, что за его всасыванием последует значительный подъём уровня глюкозы в крови.
Низкий гликемический индекс продукта (например, у чечевицы) показывает, что его усваивание организмом повысит гликемию незначительно.
Так, относительно гликемического индекса глюкозы, равного 100, жареный картофель будет иметь гликемический индекс 95, тогда как зелёная чечевица – всего 25.
Тем не менее, важно понимать, что гликемический индекс не является постоянной величиной. Его значение зависит от ряда параметров, в число которых входят: происхождение, сорт и разновидность продукта (для злаковых, фруктов), степень созревания (для фруктов), термическая и гидротермическая обработка, а также вид переработки продукта (дробление, измельчение до муки…).
Подробнее о факторах, влияющих на изменение гликемического индекса
В чём польза гликемических индексов?
Как уже отмечалось выше, ГИ указывает на гипергликемический потенциал содержащего углеводы продукта, и следовательно на способность данного продукта вызывать выработку инсулина (количество которого будет сообразно величине гипергликемии). Чем значительней инсулиновый ответ, тем выше риск появления лишнего веса.
Грубая ошибка современных нутриционистов
Несмотря на предостережения со стороны некоторых специалистов в области гликемических индексов, например, профессора Жерара Слама (Gérard Slama), нутриционисты по-прежнему, как только речь заходит об углеводах, ссылаются на скорость их всасывания. В целом есть две категории диетологов-нутриционистов.
-
Первые – «неисправимые» традиционалисты. Они до сих пор не знают о гликемических индексах, а если и знают, то не понимают их важности для метаболизма. Так что они упорно продолжают пользоваться терминами «быстрых» и «медленных сахаров». Такие консерваторы часто встречаются среди диетологов, особенно в спортивной сфере, а также в журналистике. В своём неведении эти люди поддерживают у широкой публики абсолютно неверное представление о правильном питании.
Так что они упорно продолжают пользоваться терминами «быстрых» и «медленных сахаров». Такие консерваторы часто встречаются среди диетологов, особенно в спортивной сфере, а также в журналистике. В своём неведении эти люди поддерживают у широкой публики абсолютно неверное представление о правильном питании.
-
Ко второй категории относятся притворщики, хотя большинство из них являются таковыми по неведению или непониманию. Они приняли и даже ввели в свою практику новую классификацию углеводов по гликемическому индексу. Но несмотря на это, они продолжают пользоваться терминами «быстрых» и «медленных сахаров», сделав из них некий терминологический сплав с понятием о гликемических индексах.
Гликемический индекс, как они считают, выражает не что иное, как скорость усваивания углевода. В их понимании, вся доля углевода в продукте будет преобразована в глюкозу при переваривании, но чем ниже гликемический индекс продукта, тем медленнее будет проходить его всасывание, что вызовет более слабую, но продолжительную по времени гипергликемию.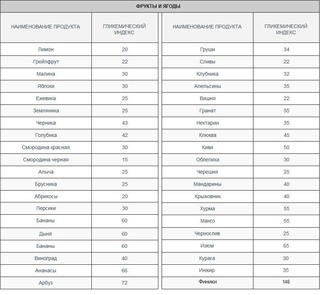 Таким образом, гликемический индекс нужен лишь для измерения длительности всасывания глюкозы, полученной из продукта питания.
Таким образом, гликемический индекс нужен лишь для измерения длительности всасывания глюкозы, полученной из продукта питания.
Такое понимание ошибочно, так как не соответствует никакой физиологической реальности.
Напротив, все исследования, связанные с гликемическими индексами, и в частности исследование Дженкинса, показали, что низкий гликемический индекс продукта означает не то, что его всасывание требует более долгого времени, а то, что при его переваривании организм получает и усваивает меньшее количество глюкозы.
К сожалению, ошибочное представление о гликемических индексах разделяют и распространяют вокруг себя многие специалисты.
В своей книге «La diététique du cerveau» («Диететика мозга»), выпущенной в апреле 2003 года издательством Odile Jacob, профессор Жан-Мари Бур (Jean-Marie Bourre), член Французской Национальной Академии Медицины, ясно пишет, что гликемический индекс выражает скорость всасывания глюкозы, что абсолютно не соответствует реальности.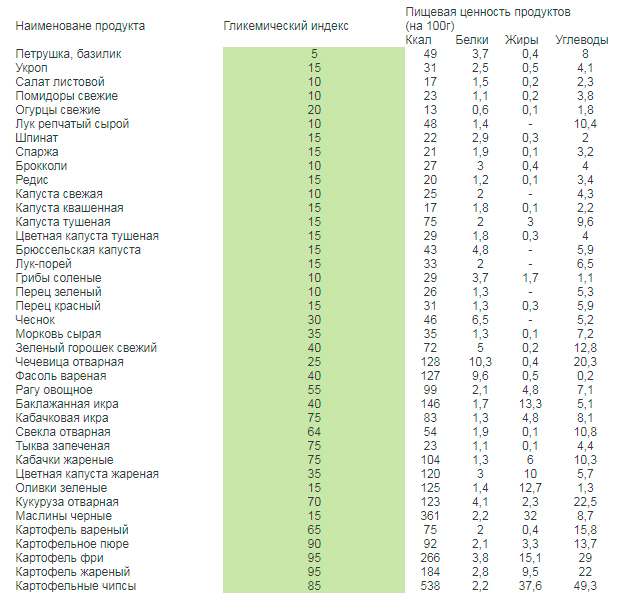
В заключение можно лишь пожалеть о том, что врачи настолько плохо разбираются в проблеме гликемических индексов и не отдают себе отчёта в том, насколько тесно связан этот параметр с инсулиновым обменом, который в свою очередь является решающим фактором регулирования веса и профилактики диабета.
Перейти к таблице гликемических индексов продуктов.
Гликемический индекс: что это такое и с чем его едят?
Давайте для начала разберемся, что же это такое? Гликемический индекс (ГИ) – показатель, который определяет насколько повысится уровень глюкозы в крови при употреблении того или иного продукта.
Это очень важный параметр, когда вы регулируете свой вес.
Индекс условно делится на три категории:
Низкий ГИ – до 40 – углеводы продуктов с низким гликемическим индексом преобразуются в энергию равномерно, и организм успевает ее потратить.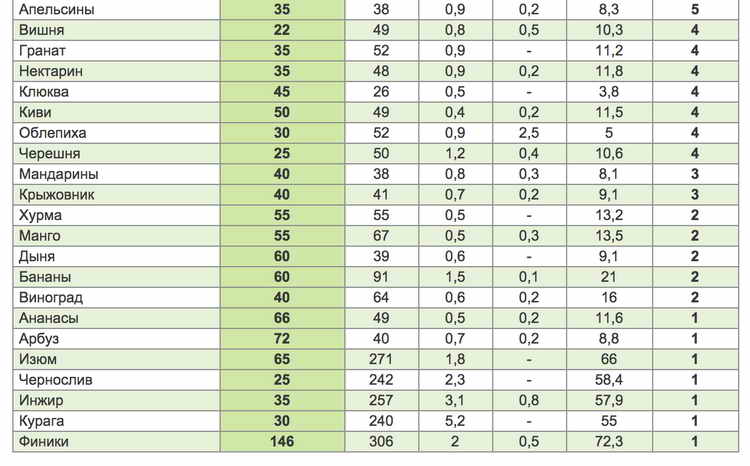 Примеры продуктов: орехи, ягоды, цитрусовые, зеленая гречка.
Примеры продуктов: орехи, ягоды, цитрусовые, зеленая гречка.
Средний ГИ – до 55 – углеводы со средним гликемическим индексом лучше сочетать с белками и углеводами с низким гликемическим индексом. Примеры продуктов: банан, овсянка, цельнозерновой хлеб.
Высокий ГИ – выше 55 – углеводы из продуктов с высоким гликемическим индексом усваиваются слишком быстро, поэтому организм часть из них преобразует в энергию, а другую запасает. Примеры продуктов: арбуз, мед, белый рис, картофель и всевозможные продукты с рафинированным сахаром.
Продукты с высоким гликемическим индексом быстро отдают свою энергию организму, тогда как продукты с низким ГИ содержат клетчатку и усваиваются медленно.
Энергию, полученную от углеводов, организм использует одним из трех способов: 1) для текущих энергетических нужд; 2) для пополнения запасов гликолена в мышцах; 3) для резерва в будущем. Основным источником хранения резервной энергии в теле являются жировые отложения.
И вот сейчас в голове лишь одна мысль о том, что нужно выкинуть теперь из холодильника все продукты с высоким ГИ и наслаждаться жизнью, но не тут-то было.
Давайте разберемся, что происходит в организме, когда мы едим углеводную пищу.
Углеводы – это основной источник энергии для человека. Попадая в организм, углеводы превращаются в глюкозу, которая используется клетками для получения энергии. Доставка происходит с помощью транспортного гормона – инсулина. Если инсулина не хватает, в крови повышается уровень сахара. В ответ на это здоровый организм вырабатывает ещё инсулин, пока не приведёт сахар в норму.
Но здесь есть проблема: когда уровень инсулина высокий, доставка питательных веществ превышает потребности клеток. А это значит, что всё лишнее откладывается про запас.
Есть и другой негативный аспект резких скачков уровня сахара. Замечали, как улучшается настроение от съеденной конфеты? Но эффект длится недолго: редко больше получаса. Сразу после выброса инсулина настроение падает, и вы тянетесь за новой порцией сладкого. Эти качели можно раскачивать хоть весь день, формируя зависимость от сахара.
Сразу после выброса инсулина настроение падает, и вы тянетесь за новой порцией сладкого. Эти качели можно раскачивать хоть весь день, формируя зависимость от сахара.
Чтобы составить меню с учётом гликемического индекса, нужно помнить, что процент углеводов в продуктах разный
А вот сахар – это углевод на 100%!
Так что же делать?
Раскроем эту тему в мифах, которые обычно появляются:
Миф№1. Продукты с высоким ГИ – это плохо.
Когда говорят о ГИ, то забывают про то, что существует еще и гликемическая нагрузка (ГН) – количество углеводов в порции. Далеко не все соотносят эти понятия вместе и подходят к формированию своего рациона питания однобоко.
То есть знают, что высокий ГИ – это плохо, и выкидывают продукт из своей корзины. Например, арбуз имеет ГИ = 72, что плохо с точки зрения депонирования жира, однако его ГН = 4гр.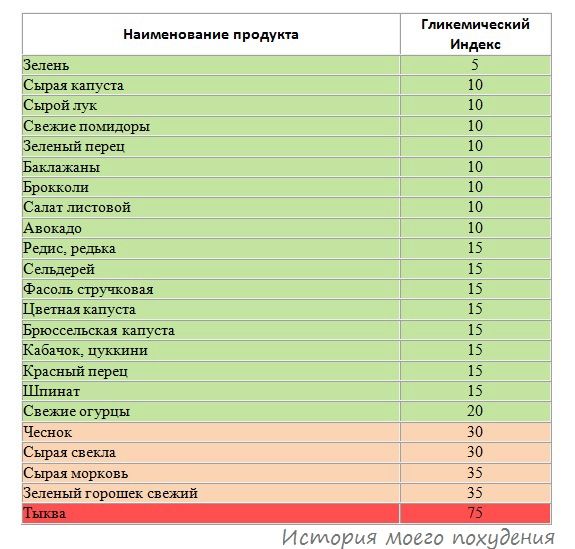 угл/100 гр. арбуза, что является крайне низким показателем. Анализ этих двух показателей говорит о полезности этого продукта в рационе человека.
угл/100 гр. арбуза, что является крайне низким показателем. Анализ этих двух показателей говорит о полезности этого продукта в рационе человека.
Миф№2. ГИ – неизменная величина.
Существуют таблицы, в которых приведены рассчитанные для продуктов цифровые значения, однако они могут изменяться. И зависит это от процесса готовки, вернее – способа обработки продуктов. При термической (сушка, варка, жарка) ГИ некоторых продуктов, например, морковь/свекла резко повышается. ГИ сырой моркови = 35, вареной = 85. Последнее происходит в следствии разрушения клетчатки от температуры и распадение ее на простые сахара.
Вывод: некоторые продукты, если вы хотите похудеть, лучше есть сырыми.
Миф№3. Клетчатка никак не влияет на гликемический индекс.
Очередной миф, влияет причем очень сильно. Пищевые волокна – это различные включения в продукте, которые не перевариваются и придают ему структурность и полезность. Чем меньше клетчатки в еде, тем больше ее ГИ. В частности, булочки имеют ГИ = 95, а хлеб из грубой муки ГИ = 50. Если же мука цельная/необдирная (сохранена первоначальная структура зерна), то такой продукт может иметь ГИ около 35-40.
В процессе обработки продуктов (очистка, пропарка и т.д.) большая часть пищевых волокон не сохраняется. Получается, что чем меньше производственная обработка продукта, тем меньше его гликемический индекс, и тем меньше он поднимает уровень глюкозы крови.
Вывод: ищите на товарах информацию об обработке (жареный, очищенный) и старайтесь выбирать менее обработанные продукты, а лучше цельные.
Еще раз подытожим всю и информацию:
· предпочтение отдавайте свежим (нежели вареным) овощам и фруктам;
· клетчатка в продуктах снижает суммарный ГИ, а также способствует удержанию пищевого комка в желудке, т.е. продлевая чувство насыщения;
· крахмал денатурирует в процессе тепловой обработки, поэтому излишнее разваривание приводит к повышению ГИ;
· белки в сочетании с углеводами снижают общий ГИ;
· степень измельчения продукта оказывает влияние на ГИ, чем мельче, тем индекс выше;
· чем тщательнее пережевывается пища, тем медленней усваиваются углеводы;
· при составлении своей пирамиды питания обращайте внимание на множество параметров продуктов (ГН, пищевая ценность, калорийность и тп), а не только на гликемический индекс;
· добавление кислоты в пищу замедляет процесс ее усвоения, поэтому ГИ незрелых фруктов ниже, чем у их спелых собратьев;
· на ГИ оказывает влияние скорость переваривания продукта в ЖКТ, чем оно дольше, тем медленнее проходит повышение сахара;
· высококалорийный продукт (но с низким ГИ) может способствовать похудению, а низкокалорийный – наоборот, может увеличить объем талии.
Поэтому совсем не стоит боятся высокого гликемического индекса, а просто надо правильно изучить вопрос и грамотно составить рацион. Таблицы ГИ можно найти в интернете, либо скачать приложение на свой телефон.
Будьте счастливы, здоровы и любите себя!
Что такое гликемический индекс и как он влияет на наше здоровье
У каждого из нас рано или поздно наступает день, когда мы решаем оздоровить свой организм, который уже устал от стрессов и неправильного питания, или же похудеть, найдя на бедрах несколько лишних сантиметров. Что мы для этого делаем? Правильно — идем в спортзал, убираем из рациона максимум бесполезных жиров и легких углеводов, стараемся пить побольше чистой воды и качественно спать. Все делаем верно, но не все так просто: мы забываем, что простые углеводы могут содержаться и в на первый взгляд вполне полезных невинных продуктах. Именно поэтому, выбирая для себя диетический рацион, базировать его стоит на продуктах с низким гликемическим индексом.
Гликемический индекс имеет достаточно большое значение для нашего организма — он характеризует способность различных продуктов питания повышать уровень глюкозы в крови. Эталоном в определении ГИ принято считать глюкозу в чистом виде, которая полностью усваивается. То есть, 100 г глюкозы иметь значение ГИ — 100. Так, чем выше гликемический индекс продукта — тем он богаче на быстрые углеводы, и тем сильнее разгоняет аппетит. Это обусловлено быстрым выбросом инсулина в кровь, а вслед за ним — быстрым падением глюкозы. Вот почему мы можем так быстро снова проголодаться, даже если поели только несколько минут назад.
Интересно, что на гликемический индекс влияет не только сам продукт, но и способ его обработки. Термическая обработка, например: под воздействием температуры клеточные мембраны распадаются, что приводит к более быстрому перевариванию и всасыванию. Именно поэтому вареная морковь имеет более высокий гликемический индекс, чем сырая.
Гликемический индекс является хорошим способом ранжирования продуктов и подается 100-балльной шкалой:
Продукты с низким Г И (55 и ниже) — рекомендуются для ежедневного рациона.
Продукты со средним Г И (55-70) — можно есть время от времени.
Продуктов с высоким Г И (более 70) — употреблять очень редко, или вообще убрать из рациона.
Сахар, заложенный в продукты питания самой природой, представляет для нас гораздо меньший вред, чем сахар, добавляемый к пище штучно. Фрукты, к примеру, хотя и содержат в себе большое количество простых сахаров, однако насыщают организм клетчаткой, замедляя всасывание сахара в кровь. Современные производители практически не задумываются о составе продуктов, которые изготавливают и продают, поэтому множество лишнего сахара можно найти в магазинных сладостях, хлебобулочных изделиях, соках и газированных напитках, фруктовых йогуртах, консервах, готовых завтраках, колбасных изделиях … и этот список можно продолжать очень долго!
Читайте такжe: Волшебное авокадо — полезные свойства и интересные рецепты
Итак, для правильного питания важно помнить о сознательном выборе продуктов, принимая во внимание как можно менее обработанные продукты, натуральныe, и пытаться потреблять их чаще в свежем виде.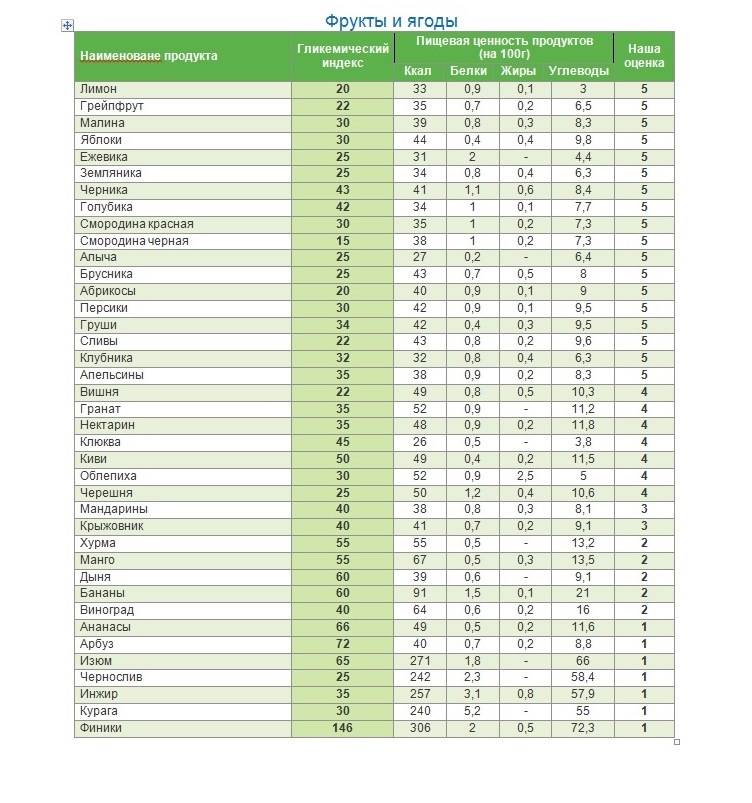
Вот таблица гликемического индексa некоторых продуктов.
Продукты с высоким гликемическим индексом:
- пиво 110
- финики 103
- Белый хлеб 100
- Сдобные булочки 95
- блины 95
- Картофель запеченный 95
- Рисовая лапша 95
- Консервированные абрикосы 95
- Рис быстрого приготовления 90
- мед 90
- Морковь (вареная или тушеная) 85
- Кукурузные хлопья 85
- Картофельное пюре, вареный картофель 85
- Мюсли с орехами и изюмом 80
- Сладкая выпечка (вафли, пончики) 75
- тыква 75
- арбуз 75
- дыня 75
- Рисовая каша на молоке 75
- пшено 70
- Шоколадный батончик (Mars, Snickers) 70
- Молочный шоколад 70
- Сладкие газированные напитки (Pepsi, Coca-Cola) 70
- Лапша из мягких сортов пшеницы 70
- Белый рис 70
- Картофельные чипсы 70
- Сахар (белый или бурый) 70
- кускус 70
- манка 70
Продукты со средним гликемическим индексом:
- ананас 66
- Пшеничная мука 65
- Сок апельсиновый (пакетированный) 65
- Варенье и джемы 65
- Черный дрожжевой хлеб 65
- мармелад 65
- хлеб черный 65
- изюм 65
- Ржаной хлеб 65
- Картофель вареный в мундире 65
- Цельнозерновой хлеб 65
- Консервированные овощи 65
- зерна пшеничные, пророщенные 63
- Пицца margarita 60
- банан 60
- Мороженое (с добавлением сахара) 60
- Длиннозерный рис 60
- Mайонез 60
- Виноград и виноградный сок 55
- кетчуп 55
- спагетти 55
- Консервированные персики 55
- Песочное печенье 55
Продукты с низким гликемическим индексом:
- Сладкий картофель (батат) 50
- Свининa (жареная) 50
- Гречка зеленая 50
- Рис басмати 50
- Клюквенный сок (без сахара) 50
- Апельсины 50
- Киви 50
- Манго 50
- Коричневый неочищенный рис 50
- Яблочный сок (без сахара) 50
- Гречка 50
- Овсянка 49
- Булгур 48
- Грейпфрут 45
- Кокос 45
- Сок ананасовый, без сахара 45
- Свежий апельсиновый сок 45
- Хлеб зерновой пшеничный, хлеб ржаной 40
- Говядина (жареная) 40
- Сушеный инжир 40
- Макароны твердых сортов, сваренные «al dente» 40
- Морковный сок (без сахара) 40
- Курага 40
- Чернослив 40
- Дикий (черный) рис 35
- Свежая слива 35
- Свежая айва 35
- Йогурт натуральный 35
- Йогурт обезжиренный 35
- Киноа 35
- Фасоль 35
- Свежий нектарин 35
- Гранат 35
- Свежий персик 35
- Зерна ржаные, пророщенные 34
- Бананы зеленые 30
- Курица поджаренная 30
- Обезжиренный творог 30
- Томатный сок 30
- Свежий абрикос 30
- Перловая крупа 30
- Коричневая чечевица 30
- Зеленая фасоль 30
- Груша свежая 30
- Томат (свежий) 30
- Желтая чечевица 30
- Черника, брусника, голубика 30
- Молоко (любой жирности) 30
- Маракуйя 30
- Мандарин свежий 30
- Яблоки 30
- Ежевика 20
- Вишня 25
- Зеленая и красная чечевица 25
- Золотистая фасоль 25
- Малина свежая 25
- Красная смородина 25
- Соевая мука 25
- Клубника, земляника 25
- Тыквенные семечки 25
- Крыжовник 25
- Шоколад черный (70% какао) 22
- Арахисовая паста (без сахара) 20
- Артишок 20
- Баклажан 20
- Соевый йогурт 20
- Миндаль 15
- Брокколи 15
- Капуста белокочанная 15
- Кешью 15
- Сельдерей 15
- Отруби 15
- Брюссельская капуста 15
- Цветная капуста 15
- Перец чили 15
- Огурец свежий 15
- Фундук, кедровый орех, фисташки, грецкий орех 15
- Спаржа 15
- Имбирь 15
- Грибы 15
- Кабачок 15
- Репчатый лук 15
- Песто соус 15
- Зеленый лук 15
- Оливки 15
- Арахис 15
- Ревень 15
- Тофу (соевый творог) 15
- Соя 15
- Шпинат 15
- Авокадо 10
- Листовой салат 10
- Семян подсолнечника 8
- Петрушка, базилик, ванилин, руккола, корица, орегано 5
Как вы заметили — мясо и птица (в отварном виде), рыба и яйца отсутствуют в списке, так как практически не содержат в себе углеводов. То есть, фактически — это продукты с нулевым гликемическим индексом.
Важно помнить о том, что гликемический индекс также зависит и от количества жиров, которые мы добавляем к продуктам во время их приготовления. К примеру, куриное филе в отварном виде не содержит углеводов, поэтому гликемического индекса нет, как такового. Однако, если обжарить его на растительном масле, или запечь с ее использованием — он вырастет до 30 и больше!
Информация и рецепты, изложенные в этом Блоге, могут не соответствовать ожиданиям пользователя, представлены к использованию без учета индивидуальных особенностей здоровья пользователя и применяются им по своему усмотрению и под личную ответственность.
Информация, документы и сопутствующие графические материалы и рецепты, взятые из других источников и опубликованные на этом сайте https://milkalliance.com.ua/, могут содержать технические погрешности и опечатки
Что такое гликемический индекс продуктов, список продуктов с высоким и низким индексом
Ветеринарные диетологи утверждают: многих проблем со здоровьем у наших питомцев, даже таких тяжелых, как сахарный диабет, можно избежать, если знать, как те или иные продукты усваиваются организмом животного.
Одним из важнейших показателей в питании млекопитающих является, с какой скоростью тот или иной продукт расщепляется в организме и преобразуется в глюкозу. В конце ХХ века диетологи определили этот фактор как гликемический индекс продуктов. Он создан для оценки продуктов в соответствии с их влиянием на уровень сахара в крови.
Изучение гликемического индекса показало, что изменения уровня глюкозы в крови после потребления пищевых продуктов далеки от тех, которые можно было предположить, основываясь только на составе их углеводов. Например, подъем уровня глюкозы в крови после употребления в пищу белого хлеба оказался выше, чем после сахара или макаронных изделий. А вот продукты из бобовых повышают содержание глюкозы в крови примерно в 2 раза меньше, чем продукты из зерновых культур. Низкие гликемические индексы (менее 40) характерны для большинства овощей, многих фруктов и ягод, бобовых, мяса и рыбы.
Из приведенного ниже графика понятно, как осуществляется влияние на уровень сахара в крови «быстрых» и замедленно действующих углеводов.
Становится понятно, почему в рационе домашних животных не должны содержаться такие высоко гликемические ингредиенты, как белый рис, кукуруза, ячмень. Резкие скачки сахара при употреблении этих продуктов чреваты проблемами со здоровьем. Дело в том, что после употребления продуктов с высоким гликемическим индексом уровень сахара в крови резко поднимается, появляется ощущение сытости. Затем сахар в крови так же быстро падает под действием вырабатываемого поджелудочной железой инсулина, порой ниже предельно допустимого значения – чувство голода возникает опять. С течением времени, вследствие подобных скачков, может развиться сахарный диабет. Одновременно возрастает и риск ожирения: организм стремится к стабильности и «запасает» жиры впрок, вновь требуя еды через все более короткие временные интервалы.
Поэтому владельцам домашних животных необходимо помнить: по типу питания наши домашние кошки и собаки относятся к отряду хищников. Их основной пищей в естественной среде является мясо – низко гликемический продукт, который долго переваривается и обеспечивает чувство сытости на долгое время. Растительные углеводы, поступающие в организм из корней или стеблей растений, овощей и т.д., дикие животные употребляют в минимальных количествах. Они нужны в качестве источника жизненно важных витаминов и клетчатки для улучшения пищеварения.
Растительные углеводы, поступающие в организм из корней или стеблей растений, овощей и т.д., дикие животные употребляют в минимальных количествах. Они нужны в качестве источника жизненно важных витаминов и клетчатки для улучшения пищеварения.
Таким образом, чтобы наши питомцы много лет радовали нас своим обществом и отменным здоровьем, необходимо организовать их рацион по принципу биологического соответствия. В мисках домашних животных должны присутствовать только те продукты, к которым их организмы адаптировались в процессе эволюции. Для плотоядных хищников это высокобелковый рацион, где основная часть питательных веществ, белков животного происхождения, поступает из мяса, а углеводы, включаемые в состав корма для повышения его пищевой ценности, должны обладать низким гликемическим индексом.
* Биологически соответствующий корм – это корм, состоящий из свежих, цельных продуктов, которые являются естественной пищей данного вида животных (в правильном соотношении и количестве). В биологически соответствующем корме не содержатся составляющие, которые этот вид животных не употребляет в пищу в природе.
В биологически соответствующем корме не содержатся составляющие, которые этот вид животных не употребляет в пищу в природе.
Мороженое состав, калорийность, гликемический индекс и витамины.
Основываясь на числах из Международных таблиц значений гликемического индекса,
средний ГИ морожено составляет 62, что является средним показателем.
ГИ ванильного австралийского мороженого варьируется в диапазоне 47±5. (1)
Гликемический индекс итальянского мороженого равен 57. (1)
Согласно данным исследований, небольшое количество мороженого может быть включено в диету для поддержания веса инсулинозависимых диабетиков. Небольшие дозы инсулина быстрого действия предотвращают любое неблагоприятное влияние мороженого на контроль уровня глюкозы в крови. (2)
Результаты исследования показали, что пациенты с высоким уровнем сахара 223 мг / дл могут употреблять мороженое со льдом с низким содержанием сахара. (3)
Другое исследование было проведено в доме престарелых. Целью исследования было изучить перспективы жителей домов престарелых с сахарным диабетом при уменьшении ограничений в еде (в том числе мороженого). Поскольку существует мало доказательств того, что диетические ограничения улучшают результаты лечения, может быть целесообразным уменьшение диетических ограничений. (4)
Для списка данных по гликемическому индексы для других продуктов посетите нашу страницу Полная таблица гликемического индекса.
Источники։
- https://care.diabetesjournals.org/content/diacare/suppl/2008/09/18/dc08-1239.DC1/TableA2_1.pdf
- https://jamanetwork.com/journals/jama/article-abstract/393057
- https://www.sciencedirect.com/science/article/pii/S1877050915005633
- https://pubmed.ncbi.nlm.nih.gov/26813788/
Специальность: Ереванский государственный медицинский университет
Обновлено: Май 19, 2021
Что такое гликированный гемоглобин и какая его норма
Многие люди не знают, для чего сдают гликированный гемоглобин. На самом деле это важный показатель, с помощью которого можно отслеживать развитие сахарного диабета. По такому коэффициенту несложно обнаружить заболевание на самых ранних стадиях, и начать лечение.
На самом деле это важный показатель, с помощью которого можно отслеживать развитие сахарного диабета. По такому коэффициенту несложно обнаружить заболевание на самых ранних стадиях, и начать лечение.
Что значит гликированный гемоглобин?
Часто даже люди, имеющие диабет, не знают, что это за гликированный гемоглобин. Все очень просто. Когда человек употребляет углеводы, сахара попадают в кровь. Они проходят сквозь мембрану эритроцитов. Их аминокислоты вступают в реакцию с сахарами, образуют гликированный гемоглобин. Соединение очень стабильное, его концентрация сохраняется на протяжении 120 суток, после чего эритроциты разрушаются.
Гликированный гемоглобин есть у всех людей. Разница между здоровыми и лицами с диабетом только в его концентрации. Этот показатель отображает, насколько правильно в организме проходят процессы углеводного обмена. Если есть сбои и уровень сахара повышен, то и показатель будет больше нормы.
Эти цифры можно использовать для обнаружения скрытого диабета, ведь параметр отображает уровень сахара не в конкретный момент, когда его легко понизить, а за 3 месяца. Он важен во время лечения, для отслеживания состояния пациента.
Он важен во время лечения, для отслеживания состояния пациента.
Поэтому, что такое гликированный гемоглобин в анализе крови, должен знать каждый человек, особенно те, кто уже находятся в группе риска или больны диабетом.
Как правильно сдать кровь на гликированный гемоглобин?
Какой-либо специфической подготовки анализ на гликированный гемоглобин не требует. Его сдают утром, кровь забирается из вены. Повлиять на результаты могут болезни щитовидной железы, систематический прием витаминов, анемия.
Съеденная пища результат не искажает, ровно, как и алкоголь, стрессы накануне, ОРВи и грипп.
Какая норма гликированного гемоглобина?
Чтобы не ухудшить свое состояние, нужно знать не только, что означает гликированный гемоглобин в крови, но и знать свою норму.
Показатель зависит от возраста:
- Какая норма для диабетиков?
- Правильно питаться. В рационе должно быть поменьше жирной и жареной пище. Дозировку свежих фруктов и овощей необходимо увеличить. Полезны бобовые, бананы, обезжиренные молочные продукт, нежирная рыба, орехи.
- Заниматься спортом. В день физическая активность должна занимать не менее 30 минут. Это оптимизирует вес, и защитит сердце от развития осложнений.
- Справляться со стрессом. Любые потрясения негативно сказываются обмене веществ и сердце. Поэтому со стрессом нужно бороться при помощи дыхательной гимнастики, медитации.
Для врачей показатель гликированного гемоглобина может сказать о многом. Определение его уровня обеспечивает более тщательный контроль сахара и коррекцию диеты, схемы лечения, дозировки лекарств. Для тех, у кого диагностирован диабет, нормой является уровень менее 8%. Параметр, который выше этого значения, говорит о возможности серьезных осложнений. Но и слишком резко понижать его нельзя, будет только хуже, т.к. организм уже привык к высокой концентрации глюкозы.
В молодом возрасте нужно стремиться удерживать его в рамках 6,5-7%, в среднем от 7 до 7,5%, после 50 следить, чтобы показатель не был выше 7,5-8%.
Как снизить уровень гликированного гемоглобина?
Следует помнить, что определяет гликированный гемоглобин, чтобы привести эти цифры в норму. Он показывает средний уровень глюкозы на протяжении 3 месяцев, а не в конкретный момент времени. Поэтому данный показатель в домашних условиях можно снизить только за счет уменьшения лишнего веса и улучшения обмена веществ.
А для этого нужно:
Зная, что показывает гликированный гемоглобин в анализе крови, можно следить за своим здоровьем и самочувствием. Это касается как здоровых людей, так и диабетиков.
Гликемический индекс сыра.
К какому веку можно отнести первые упоминание о сыре, сказать сложно, хотя бы потому, что сортов и видов сыров существует великое множество.
Почти в каждой стране или, правильней сказать, у каждого народа присутствует свой сорт или вид сыра.
Это и мягкая греческая фета, и болгарская брынза, широко известная у нас, и русский домашний сыр, не говоря уже о разнообразии сыров, которое подарили нам французы.
Несмотря на все, есть у всех сыров одно общее, объединяющее начало — все они сделаны с использованием молока.
Гликемический индекс сыра равен 0. Да, да, это не опечатка! Твердые сорта сыров, классическая брынза, сулугуни — информация касается именно этих сортов сыра.
Однако, гликемический индекс сыра тофу составляет 15 единиц, что, согласитесь, не так уж и много.
Полезные свойства сыра.
В этой публикации мы не станем говорить о каком-либо отдельном сорте сыра, остановимся на общей характеристике этого замечательного продукта, который способен дополнить любой стол.
Кстати, существует мнение, что если вам совсем не нравится сыр, это означает лишь одно: вам не попался тот сорт, который подходит именно вам.
Низкий гликемический индекс сыра сделал появление этого продукта в рационе диабетиков вполне законным. Правда, низкий ГИ сыров не отменяет наличия калорийности, которая, порой, бывает довольно высокой. Поэтому усердствовать, балуя себя различными сортами этого продукта, не рекомендуется. Но 20-30 грамм сыра в день допустимы даже в том случае, если вы придерживаетесь экстремально строгой диеты.
Продукты сырного ряда богаты различными минералами, в числе которых фосфор, кальций, цинк, сочетание которых вполне позволяет заменить ими рыбные блюда.
Что касается витаминов, тут тоже многое зависит от сорта. Одни сыры богаты витамином А, другие содержат в своем составе приличное количество витаминов группы В.
А еще в сырах содержится вещество триптофан, которое способствует позитивному настроению и улучшает качество сна.
Вред сыра.
Как мы уже упоминали, низкий гликемический индекс сыров не отменяет высокой калорийности некоторых сортов этого продукта. Особенно это касается жирных сортов сыра, к числу которых можно отнести тот же камамбер и некоторые другие.
Особенно это касается жирных сортов сыра, к числу которых можно отнести тот же камамбер и некоторые другие.
Поэтому для тех, кто стремится избавиться от лишнего веса, имеет смысл обратить свое внимание на рикотту, брынзу, некоторые сорта твердых сыров. Даже в этом случае дневная норма потребления не должна быть выше 70-100 г.
Беременным женщинам, кормящим матерям и людям с заболеванием ЖКТ следует с опаской относиться к различным экзотическим сортам этого продукта. В этих случаях врачи-диетологи советуют ограничить или вовсе отказаться от употребления острых, пряных сортов и сыра с плесенью.
«Плохой» холестерин и повышенная жирность сыра имеют, к сожалению, прямую связь. Кроме этого жирные сорта не рекомендуются при различных заболеваниях печени.
Триптофан, о котором мы упоминали выше, аминокислота, которая содержится в сыре, при передозировке способен вызвать нарушение сна. Поэтому, балуя себя различными сортами этого продукта, необходимо помнить о том, что во всем надо соблюдать меру.
Количественная оценка внутриклеточной скорости производства и потребления гликолитического и окислительного АТФ с использованием измерений внеклеточного потока
Рисунок 1.
Максимальные выходы внемитохондриального АТФ и…
Рисунок 1.
Максимальные выходы внемитохондриального АТФ и отношения P / O для катаболизма обычных субстратов…
Рисунок 1.
Максимальные выходы внемитохондриального АТФ и отношения P / O для катаболизма обычных субстратов изолированными митохондриями млекопитающих и физиологических субстратов клетками млекопитающих и расчет скоростей продукции АТФ в результате гликолиза, цикла трикарбоновых кислот, β -окисления и окислительного фосфорилирование с использованием скорости потребления кислорода.
A , максимальные выходы внемитохондриального АТФ и отношения P / O. Максимальный чистый выход гликолитического АТФ / моль глюкозы или гликогена, преобразованного в пируват (а затем в лактат или окисленный в ходе цикла TCA), ATP glyc , указан в столбце g после поправки на АТФ, используемый для активации глюкозы. или гликоген (вычислено с использованием столбцов b и c и столбцов e и f ). Колонка дает ATP ox , максимальный окислительный выход АТФ / моль субстрата, окисляемого пируватдегидрогеназой, цикл TCA, β-окисление и цепь переноса электронов, включая связанное с субстратом фосфорилирование в цикле TCA и импортируемые эквиваленты NADH из гликолитических реакций и с поправкой на АТФ, использованный для активации субстратов, отличных от глюкозы (рассчитано с использованием столбцов b и c и столбцов h и n ). Значения приведены для бар ( i.е. 1,63 = 1,636363…), чтобы подчеркнуть, что это не целые числа или приближения, а точные значения, возникающие из арифметики малых целых чисел, как показано (значения для гликогена включают предположение о ветвлении, поэтому они менее точны и поэтому округляются до двух десятичных знаков. ). Колонка p дает максимальный общий выход АТФ на моль субстрата (сумма колонок g и o ). Колонка q выражает этот максимальный выход АТФ на моль израсходованных атомов кислорода [O] ( i.е. максимальное отношение P / O для реакций в колонке b (). Значения в каждом столбце вычисляются построчно следующим образом. Во время окисления сукцината в малат изолированными митохондриями сукцинат входит в дикарбоксилатный носитель в обмен на малат и окисляется до фумарата сукцинатдегидрогеназой, восстанавливая Q до QH 2 . QH 2 окисляется цепочкой переноса электронов, восстанавливая 1 [O] до H 2 O и перемещая 6 H + из матрицы в межмембранное пространство.Фумарат гидратируется до малата фумаразой и выходит в обмен на поступающий сукцинат. 6 H + повторно входят в матрицу через механизм синтеза АТФ, который перемещает 8 H + через АТФ-синтазу и 3 H + через носители фосфатных и адениновых нуклеотидов на каждые 3 генерируемых АТФ, давая H Соотношение + / АТФ 11: 3 (см. «Результаты»). Таким образом, окисление сукцината вызывает фосфорилирование 6 H + / O × 3/11 ATP / H + = 1.63 молекулы АТФ / [O] восстановлены до воды. Это максимальное соотношение P / O для окисления сукцината митохондриями. Во время окисления глицерин-3-фосфата до дигидроксиацетонфосфата изолированными митохондриями митохондриальная глицерин-3-фосфатдегидрогеназа восстанавливает Q до QH 2 , который окисляется, как указано выше, с тем же P / O max 1,63. Во время окисления пирувата плюс малат изолированными митохондриями пируват проникает в митохондрии на пируватном носителе (электронейтрально с протоном) и окисляется до ацетил-КоА и CO 2 пируватдегидрогеназой.Малат поступает в обмен на цитрат и окисляется до оксалоацетата под действием малатдегидрогеназы. Две реакции дегидрирования образуют всего 2 НАДН. Цитрат-синтаза использует ацетил-КоА и оксалоацетат для образования цитрата, который выходит из митохондрий с протоном (уравновешивая импортированный протон с пируватом) на трикарбоксилатном носителе в обмен на поступающий малат. 2 НАДН окисляются, вызывая перекачку 20 H + и генерируя 20 × 3/11 = 5,45 АТФ с P / O max , равным 2.72. Во время окисления малата плюс глутамата изолированными митохондриями малат электронейтрально входит в дикарбоксилатный носитель в обмен на 2-оксоглутарат, а глутамат входит в глутамат-аспартатный носитель электрогенно с протоном (который, следовательно, недоступен для синтеза АТФ; column l ) в обмен на аспартат. Малатдегидрогеназа производит оксалоацетат плюс 1 НАДН, который окисляется, вызывая перекачку 10 H + , а затем аспартатаминотрансфераза использует оксалоацетат и глутамат для образования 2-оксоглутарата и аспартата, которые выходят в обмен на поступающие малат и глутамат.В целом, 9 H + перемещаются, управляя синтезом 9 × 3/11 = 2,45 АТФ / [O]. Во время гликолиза глюкозы в лактат клетками 1 АТФ потребляется гексокиназой, а 1 АТФ потребляется фосфофруктокиназой с образованием 2 триоз, каждая из которых генерирует 1 АТФ на фосфоглицераткиназе и 1 АТФ на пируваткиназе, с чистым выходом 2 АТФ / глюкоза. 2 НАДН, образующиеся при глицеральдегидфосфатдегидрогеназе, повторно окисляются во время восстановления пирувата до лактата лактатдегидрогеназой, и 2 лактата выводятся из клетки вместе с 2 H + , генерируемыми преобразованием 1 незаряженной глюкозы в 2 анионных лактата — молекул.В целом, гликолиз до лактата производит 2 АТФ / глюкозу (1 АТФ / лактат). Во время гликолиза глюкозы в пируват клетками с последующим окислением пирувата до бикарбоната пируватдегидрогеназой и циклом TCA в результате гликолитических реакций образуется 2 АТФ на глюкозу. Кроме того, 2 АТФ образуются в митохондриальном матриксе во время окислительного метаболизма в результате связанной с субстратом реакции сукцинил-КоА-синтетазы. Каждый из этих АТФ экспортируется в цитозоль, используя в процессе 1 H + , что дает чистый цитозольный выход АТФ из сукцинил-КоА синтетазы 2 × (1 — 3/11) = 1.45 АТФ / глюкоза. НАДН, генерируемый глицеральдегидфосфатдегидрогеназой, попадает в митохондрии на малат-аспартатном челноке, управляемый повторным входом 2 из 20 последовательно транслоцированных H + ( колонка l ), или на глицерин-3-фосфатном челноке (что позволяет восстанавливающие эквиваленты входят в цепь переноса электронов, не проходя через комплекс I, поэтому накачка 12 H + , на 8 меньше, чем обычно для матрицы NADH; столбец l ). 2 пирувата от гликолиза полностью окисляются пируватдегидрогеназой и циклом TCA, образуя 8 НАДН и 2 QH 2 (приводная перекачка 92 H + ).Сумма 110 (или 104, если используется глицерин-3-фосфатный челнок) транслоцированных H + дает максимум 110 × 3/11 = 30 (или 104 × 3/11 = 28,36 АТФ, что вместе с субстратом -связанное производство АТФ, дает чистый окислительный выход 31,45 (или 28,81) АТФ / глюкоза. Общий выход АТФ является суммой гликолитического и окислительного выходов: 33,45 (или 31,81) АТФ / глюкоза или P / O макс. 2,78 (или 2,651). При катаболизме гликогена выходы такие же, как и при катаболизме глюкозы, за исключением того, что для начальных реакций активации требуется меньше АТФ.Около 90% связей в гликогене представляют собой α-1,4, которые расщепляются добавлением фосфата, давая глюкозо-1-фосфат и минуя потребление АТФ на гексокиназе. Остальные — это α-1,6, которые гидролизуются с образованием глюкозы, которая требует активации гексокиназой. Следовательно, в среднем для активации требуется ~ 0,1 АТФ на гексокиназе и 1 АТФ на фосфофруктокиназу, что увеличивает выход АТФ при катаболизме гликогена на ~ 0,9 АТФ / глюкоза по сравнению с катаболизмом самой глюкозы, что дает выход АТФ / глюкозная единица и P / O . показаны макс. коэффициенты .Полное окисление пирувата клетками происходит в обход гликолиза и генерирует 1 АТФ / пируват на сукцинил-КоА-синтетазе в матрице (0,72 АТФ / пируват после экспорта АТФ). Протонная накачка дает 46 × 3/11 = 12,54 АТФ / пируват для суммы 13,27 АТФ / пируват или P / O max , равного 2,654. Во время полного окисления пальмитата клетками активация пальмитата до пальмитоил-КоА генерирует АМФ из АТФ, эффективно используя 2 АТФ / пальмитат. Пальмитоил-КоА входит в матрицу электронейтрально в виде пальмитоилкарнитина на переносчике карнитина, а затем β-окисление до 8 ацетил-КоА дает 7 НАДН и 7 QH 2 , а окисление 8 ацетил-КоА в цикле ТСА дает 24 НАДН, 8 QH 2 и 8 матричный АТФ.Максимальный общий выход составляет 112,90 АТФ / пальмитат и P / O max 2,45. Окисление других жирных кислот дает несколько другие выходы и значения P / O max ; мононенасыщенный олеат, окисление которого дает на 1 меньше транслоцированных QH 2 и на 6 транслоцированных H + , чем соответствующая насыщенная жирная кислота, вычисляется в качестве примера. HK , гексокиназа; PFK , фосфофруктокиназа; PK , пируваткиназа; PGK , фосфоглицераткиназа; ACS , ацил-КоА-синтаза; SCS , сукцинил-КоА синтетаза. Purple выделяет изолированные митохондрии; серый цвет выделяет клетки (а более темная полоса подчеркивает полное окисление глюкозы клетками). B , расчет выхода АТФ на расход кислорода. Неповторяющиеся значения округляются до двух десятичных знаков для предполагаемых оценок и до трех десятичных знаков для действительных чисел. Столбцы s – u делят общее соотношение P / O в A ( столбец q ) на компоненты, зависящие от различных подмножеств общего потребления кислорода митохондриями, чтобы можно было рассчитать выход гликолитического и окислительного АТФ на основе экспериментальных данных о потреблении кислорода. (Выходы гликолитического АТФ от гликолиза до лактата рассчитываются по внеклеточному подкислению, но выходы гликолитического АТФ от гликолиза до пирувата (впоследствии окисленного) рассчитываются по потреблению кислорода). Колонка s показывает выход гликолитического АТФ от превращения глюкозы или гликогена в пируват, впоследствии окисляемый до бикарбоната (который зависит от общего потребления кислорода митохондриями). В столбце t указано соотношение P / O для реакций, связанных с субстратом в цикле TCA и β-окисления (которое зависит от общего потребления кислорода митохондриями), а в столбце u указано соотношение P / O для окисления NADH и QH. 2 происходит из пируватдегидрогеназы, цикла TCA и β-окисления (которое зависит от сопряженного потребления кислорода митохондриями). Столбец v дает общую сумму этих частичных соотношений P / O, которые аналогичны столбцу q в A . β -ox , β-окисление; oxphos , окислительное фосфорилирование. C , общая скорость производства АТФ, Дж Производство АТФ , представляет собой сумму измеряемых внеклеточных скоростей (PPR и OCR), умноженных на соответствующее соотношение АТФ / лактат из A или соотношение P / O из В .
границ | Высокая экспрессия гликолитических генов при циррозе коррелирует с риском развития рака печени
Введение
Гепатоцеллюлярная карцинома (ГЦК) является основным типом первичного рака печени и второй ведущей причиной смертности от рака во всем мире, от которой ежегодно умирает более 700000 человек (El-Serag, 2011; Jemal et al., 2011; Форнер и др., 2018). Заболеваемость ГЦК значительно выросла за последние два десятилетия, особенно в США и Европе (El-Serag, 2011; Jemal et al., 2011). В настоящее время варианты лечения в основном включают резекцию опухоли, трансплантацию печени, химиотерапию и радиологическое вмешательство, которые доступны только пациентам с ранней стадией заболевания. Однако подавляющее большинство пациентов с ГЦК обычно диагностируются на поздних стадиях, на которых отсутствуют лечебные методы лечения (Llovet et al., 2008; Улаханнан и др., 2014; Форнер и др., 2018). Следовательно, для снижения высокого уровня смертности требуется раннее выявление и профилактика ГЦК. Лучшее понимание молекулярной основы образования ГЦК и идентификация маркеров необходимы для разработки профилактических методов лечения, направленных на специфические факторы, способствующие развитию ГЦК, и, таким образом, улучшения прогноза.
Развитие ГЦК тесно связано с циррозом, воспалительным заболеванием печени, при котором нормальная ткань печени замещается рубцовой тканью и регенеративными узелками после длительного повреждения, вызванного различной этиологией, включая гепатит B (HBV) или C (HCV). вирусная инфекция, хроническое употребление алкоголя или неалкогольная жировая болезнь печени (Wright, 1991; Borzio et al., 1995; Донато и др., 2001). Фактически, до 90% всех случаев ГЦК развивается у пациентов с циррозом, что предполагает роль этого состояния печени в процессе гепатоканцерогенеза (El-Serag, 2011; Jemal et al., 2011; Forner et al., 2018 ). На клеточном уровне возникновение цирроза тесно связано с множественными циклами гибели гепатоцитов, воспалительными реакциями и компенсаторной пролиферацией гепатоцитов, что приводит к образованию регенеративных узелков, окруженных фиброзными полосами, характерными для цирроза печени.Теперь ясно, что регенеративные узелки состоят из смешанной популяции пролиферативных клеток-предшественников, вновь образованных гепатоцитов и устойчивых к апоптозу (поврежденных) гепатоцитов, которые со временем, вероятно, разовьются в диспластические узелки, что приведет к развитию ГЦК (Borzio et al. др., 1995; Schuppan, Afdhal, 2008). Таким образом, цирроз печени считается предраковым состоянием и важен для исследования молекулярных маркеров развития ГЦК и стратегий профилактики. Хотя этиология и патологические характеристики цирроза печени описаны полностью, молекулярные механизмы, лежащие в основе его прогрессирования в ГЦК, гораздо менее изучены.
Как и многие другие виды рака, ГЦК развивается медленно после прогрессирующего накопления генетических и эпигенетических изменений в клетках печени, сопровождаемых существенными изменениями энергетического метаболизма, ведущими к неограниченной пролиферации зрелых гепатоцитов. Одним из наиболее распространенных метаболических изменений, наблюдаемых в клетках ГЦК, является увеличение скорости гликолиза с последующей выработкой лактата (Kitamura et al., 2011; Huang et al., 2013; Iansante et al., 2015; обзор Hay, 2016). ). Это метаболическое явление, известное как эффект Варбурга или аэробный гликолиз, происходит даже в присутствии большого количества кислорода и функциональных митохондрий (Gatenby and Gillies, 2004; Lunt and Vander Heiden, 2011; DeBerardinis and Chandel, 2016; Liberti and Locasale, 2016).Действительно, в аэробных условиях нормальные дифференцированные гепатоциты обычно метаболизируют глюкозу в пируват, который далее метаболизируется до диоксида углерода в митохондриях через цикл трикарбоновой кислоты (TCA) и окислительное фосфорилирование (OXPHOS) для производства АТФ, тогда как в условиях низкого содержания кислорода гепатоциты превращают пируват, полученный в результате гликолиза, в лактат. Таким образом, клетки HCC, по-видимому, повторно регулируют свой энергетический метаболизм, переходя в сторону гликолиза независимо от наличия кислорода, аналогично практически всем раковым клеткам (Iansante et al., 2015; Hay, 2016). Этот метаболический сдвиг позволяет высокопролиферирующим клеткам HCC накапливать промежуточные метаболиты глюкозы, которые могут быть направлены в биосинтетические пути, такие как пентозофосфатный путь (PPP), который генерирует клеточный восстановитель НАДФН и необходимые макромолекулы (нуклеотиды, аминокислоты и жирные кислоты). для удвоения биомассы и подавления апоптоза (Jones, Thompson, 2009; Hay, 2016; Kowalik et al., 2017). Существует множество доказательств того, что перестройка клеточного метаболизма происходит в результате активации онкогенов или потери опухолевых супрессоров, которые влияют на экспрессию и активность метаболических ферментов, стимулирующих потребление глюкозы (Hay, 2016).Более того, повышенная скорость поглощения глюкозы, которая связана с повышающей регуляцией основного транспорта глюкозы GLUT1, также является примечательной особенностью, наблюдаемой в клетках HCC (Hay, 2016). Тем не менее, ограниченные данные доступны об измененной экспрессии генов ферментов, участвующих в гликолизе и окислительном митохондриальном метаболизме in vivo . Кроме того, полностью не выяснено, действует ли аэробный гликолитический метаболизм на ранней стадии печеночного канцерогенеза, особенно при циррозе, и коррелирует ли он с плохим прогнозом пациента.Такой фон побудил нас исследовать уровень экспрессии ферментов, необходимых для гликолитического и митохондриального метаболизма, в образцах печени от пациентов с циррозом и пациентов с ГЦК, доступных из шести наборов данных из открытых источников.
Материалы и методы
Обзор наборов данных
Анализ дифференциальной экспрессии генов с участием нескольких клинических образцов проводился с использованием различных наборов данных, доступных через базу данных Gene Expression Omnibus (GEO) (Barrett, 2013).Независимо от возраста, пола, расы и региона мы выбрали один набор данных по ГЦК (GSE36376) и три набора данных по циррозу (GSE25097, GSE6764 и GSE14323) (по состоянию на март – май 2018 г.) (Wurmbach et al., 2007; Sung et al., 2012; Lim et al., 2013; Levy et al., 2016), поскольку они содержали самую большую когорту печени с ГЦК по сравнению с соседней неопухолевой печенью и циррозной печенью по сравнению с нормальной здоровой печенью соответственно. Набор данных GSE36376 состоит из опухоли и прилегающих неопухолевых тканей печени, не содержащих некроза или кровоизлияния, от 240 пациентов с первичным ГЦК, которым была проведена хирургическая резекция или трансплантация печени.Ни один из пациентов не получал предоперационную химиотерапию (Lim et al., 2013). Набор данных GSE25097 состоит из шести образцов печени от здоровых доноров и 40 образцов печени с циррозом (Sung et al., 2012). Набор данных GSE6764 состоит из 13 тканей печени с циррозом, связанных с HCV, по сравнению со здоровой печенью 10 пациентов, перенесших резекцию: один пациент с гемангиомой печени, три пациента с фокальной узловой гиперплазией, два с аденомой / цистаденомой, один с нейроэндокринной опухолью и один живой донор. трансплантация печени (Wurmbach et al., 2007). Набор данных GSE14323 состоит из 41 ткани печени с циррозом, ассоциированной с HCV, по сравнению со здоровой печенью 18 пациентов (Levy et al., 2016). Для HCC мы также использовали второй независимый набор данных из базы данных The Cancer Genome Atlas-Liver Hepatocellular Carcinoma (TCGA-LIHC), которая содержала когорту из более чем 350 образцов HCC по сравнению с 50 нормальными здоровыми печени (Ally et al., 2017 ). Набор данных TCGA-LIHC состоит из хирургической резекции биоптатов биопсии, собранных у пациентов с диагнозом ГЦК, не получавших ранее лечения от своего заболевания (абляция, химиотерапия или лучевая терапия).К каждому замороженному образцу первичной опухоли прилагался сопутствующий образец нормальной ткани (кровь или компоненты крови, включая ДНК, выделенную в месте источника ткани). Контроль качества патологии проводился на каждом образце опухоли и нормальной ткани. Окрашенные гематоксилином и эозином (H&E) срезы каждого образца подвергали независимому патологическому анализу, чтобы подтвердить, что образец опухоли гистологически соответствовал допустимым ГЦК, а образец соседней ткани не содержал опухолевых клеток. Соседняя ткань с цирротическими изменениями была неприемлема в качестве контроля зародышевой линии (Ally et al., 2017). Набор данных GSE15654 использовался для оценки ассоциации риска ГЦК у пациентов с циррозом печени. Набор данных состоит из 216 печени пациентов с циррозом на ранней стадии (класс А по шкале Чайлд-Пью), связанных с гепатитом С, за которыми проспективно наблюдали в среднем в течение 10 лет (Hoshida et al., 2013). Клинико-патологические особенности каждой когорты, проанализированной в этом исследовании, показаны в соответствующих цитируемых исследованиях.
Анализ наборов данных
Для анализа наборов данных GEO необработанные данные каждого набора данных были загружены по ссылкам доступа GEO.Образцы каждого набора данных были разделены на две группы: больные пациенты и контрольная ткань. Дифференциальную экспрессию генов между двумя группами рассчитывали с использованием непараметрического критерия Манна-Уитни U , устанавливая определенный порог (значение P <0,05). Как сообщалось ранее, анализ проводился в пакетах Prism GraphPad (Barbarulo et al., 2013).
Для анализа дифференциальной экспрессии генов TGCA-LIHC мы использовали удобный интерактивный веб-ресурс для анализа данных транскриптома рака, доступный по адресу http: // ualcan.path.uab.edu/index.html (по состоянию на апрель / май 2018 г.) (Chandrashekar et al., 2017). Для построения графиков общей выживаемости из набора данных TGCA-LIHC мы использовали GEPIA, недавно разработанный интерактивный веб-сервер, доступный по адресу http://gepia.cancer-pku.cn/index.html (по состоянию на апрель / май 2018 г.) (Tang et al. др., 2017). Плоттер KM (доступен по адресу http://kmplot.com/analysis/index.php?p=service&cancer=liver_rnaseq) (по состоянию на август 2018 г.) использовался для создания графиков Каплана-Мейера дополнительного набора данных по ГЦК в печени (Szász et al. ., 2016). В обоих случаях среднее значение экспрессии гена использовалось для организации групп с низкой и высокой экспрессией. Общую значимость выживаемости между двумя группами рассчитывали с использованием лог-рангового критерия, устанавливая определенный порог ( P -значение <0,05).
Результаты
Отличительной особенностью клеток ГЦК является то, что они регулируют свой метаболический профиль для удовлетворения биоэнергетических и анаболических требований высокой скорости пролиферации (Kitamura et al., 2011; Huang et al., 2013; Янсанте и др., 2015; Hay, 2016). Тем не менее, мало что известно о метаболических изменениях на предраковых стадиях заболевания. Чтобы получить полный обзор метаболических генов, экспрессируемых при HCC и предраковых стадиях заболевания, мы проанализировали профили транскрипции ферментов, участвующих в гликолизе, PPP, TCA и OXPHOS в образцах печени пациентов с HCC и пациентов с циррозом.
Экспрессия гена гликолиза и ферментов PPP при HCC
Гликолитический путь состоит из десяти ферментативных реакций, посредством которых глюкоза превращается в пируват.Среди множества изоформ ферментов, которые катализируют каждую гликолитическую реакцию, мы оценили уровни экспрессии мРНК тех, которые преимущественно экспрессируются в печени (Рисунок 1A; Gatenby and Gillies, 2004; Lunt and Vander Heiden, 2011; Hay, 2016). Как показано на рисунке 1B, экспрессия большинства гликолитических транскриптов, включая ограничивающий скорость гликолитический фермент HK2 [гексокиназа 2], ALDOA [альдолаза, фруктозобисфосфат A], PFKL [6-фосфофруктокиназа, печеночный тип], GAPDH [глицеральдегид 3 -фосфатдегидрогеназа], PKM2 [пируваткиназа M2]) была значительно увеличена в печени с ГЦК по сравнению с соседними неопухолевыми тканями ( P <0.0001). Исключением была экспрессия транскриптов PGAM1, которая все еще была значительно выше ( P = 0,0021), но с меньшей степенью по сравнению с другими ферментами. Фермент LDHA [лактатдегидрогеназа A] превращает пируват в лактат в реакции, которая генерирует NAD +, отвлекая производный гликолизом пируват от митохондриального окислительного пути (Gatenby and Gillies, 2004; Hay, 2016). Таким образом, снижение экспрессии и активности LDHA будет способствовать направлению пирувата в митохондрии, где он может далее метаболизироваться посредством TCA и окислительного фосфорилирования.Экспрессия LDHA была значительно снижена в образцах HCC по сравнению с прилегающими к ним неопухолевыми тканями. Напротив, экспрессия мРНК другой изоформы лактатдегидрогеназы, LDHB, не показала значительных изменений ( P = 0,0797; данные не показаны). Аналогичные результаты были также получены в наборе данных Атласа генома рака (TCGA), состоящего из 371 первичной опухоли HCC и 50 образцов нормальной печени (когорта LIHC) (Ally et al., 2017). Мы наблюдали значительно более высокую экспрессию всех гликолитических ферментов в образцах первичной ГЦК по сравнению с нормальной печенью; единственными исключениями были LDHA и LDHB (рисунок 1C и данные не показаны).
РИСУНОК 1. Гликолитические гены сверхэкспрессируются при ГЦК. (A) Упрощенное изображение, изображающее гликолитический путь в опухолях печени. Аббревиатуры ферментов следующие: гексокиназа 2 (HK2), глюкозо-6-фосфат-изомераза (GPI), изоформа фосфофруктокиназы печени (PFKL), альдолаза A (ALDOA), глицеральдегид-3-фосфатдегидрогеназа (GAPDH), фосфоглифосфат-фосфат-1 PGK1 ), фосфоглицератмутаза 1 (PGAM), енолаза 1 (ENO1) и пируваткиназа M2 (PKM2), лактатдегидрогеназа (LDH).Сокращения метаболитов следующие: глюкозо-6-фосфат (G6P), фруктозо-6-фосфат (F6P), фруктозо-1,6-бифосфат (F1,6BP), глицеральдегид-3-фосфат (GAP) и дигидроксиацетонфосфат ( DHAP), 1,3-бифосфоглицерат (1,3BPG), глицерин-3-фосфат (3-PG), глицерин-2-фосфат (2-PG), фосфоенолпируват (PEP). (B) Диаграммы рассеяния, показывающие уровни транскриптов различных гликолитических ферментов в наборе клинических данных GSE36376, состоящем из HCC ( n = 240) и прилегающей неопухолевой ( n = 193) ткани печени (Lim et al., 2013). Горизонтальные линии показывают среднее значение ± SEM P — значения были рассчитаны с помощью непараметрических тестов Манна-Уитни. (C) Коробчатые диаграммы, показывающие дифференциальную экспрессию генов гликолитических ферментов среди нормальных тканей печени ( n = 50) по сравнению с тканями первичной опухоли ( n = 371) (образцы TGA-LIHC), проанализированные с использованием биоинформатического инструмента UALCAN для геномных исследований. база данных (Ally et al., 2017; Chandrashekar et al., 2017). Значения выражены в расчете на миллион. На каждой прямоугольной диаграмме усы представляют 2.Диапазон значений 5–97,5-го процентиля, нижняя и верхняя границы обозначают 25-й и 75-й процентиль каждого набора данных, соответственно, а горизонтальная линия представляет собой медианное значение для каждой группы. P -значения были рассчитаны по t -тест.
Мы также оценили уровни мРНК ферментов, участвующих в окислительной фазе PPP. На этой фазе две молекулы NADP + восстанавливаются до NADPH, используя энергию превращения глюкозо-6-фосфата в рибулозо-5-фосфат, который затем входит в неокислительную фазу, приводящую к предшественникам синтеза нуклеотидов (рис. 2A; Hay , 2016; Ковалик и др., 2017). Мы обнаружили, что в образцах ГЦК уровни транскрипта ограничивающего скорость фермента глюкозо-6-фосфатдегидрогеназы (G6PD) были значительно выше, чем в соседней неопухолевой ( P <0,0001) и нормальной печени ( P <0,0001). образцы соответственно (рисунки 2B, C). Подобно G6PD, уровни мРНК двух других ферментов, участвующих в окислительной фазе PPP, 6-фосфоглюконолактоназы (PGLS) и 6-фосфоглюконатдегидрогеназы (PGD), были выше в образцах HCC по сравнению с контрольной тканью (Рисунки 2B, C). .В целом эти анализы согласуются с увеличением путей гликолиза и PPP, что приводит к устойчивому производству АТФ и клеточных строительных блоков, необходимых для аномальной пролиферации гепатоцитов (Gatenby and Gillies, 2004; Kowalik et al., 2017).
РИСУНОК 2. Экспрессия генов пентозофосфатного пути (PPP). (A) Схема окислительной фазы PPP. Аббревиатуры ферментов следующие: глюкозо-6-фосфатдегидрогеназа (G6PD), 6-фосфоглюконолактоназа (PGLS), 6-фосфоглюконатдегидрогеназа (PGD).Активация двух ферментов дегидрогеназы, G6PD — фермента, ограничивающего скорость, — и PGD, приводит к продукции NADPH, ионов H + и рибозо-5-фосфата. (B, C) Анализ экспрессии генов, показывающий повышенную экспрессию G6PD, PGLS и PGD в образцах первичной опухоли HCC по сравнению либо с соседними неопухолевыми образцами в наборе данных GSE36376 (B) , либо с нормальными тканями печени в TGA-LIHC набор данных (C) соответственно. P -значения были рассчитаны с помощью непараметрических критериев Манна – Уитни в (A) или t -тест (B) .
Экспрессия генов ферментов, участвующих в окислительном метаболизме митохондрий при ГЦК
Попав в митохондрии, пируват может превращаться в ацетил-КоА комплексом пируватдегидрогеназы (PDH). Затем ацетил-КоА входит в цикл TCA для генерации NADH и FADh3, которые переносят свои электроны в цепь переноса электронов для генерации АТФ через OXPHOS (Lunt and Vander Heiden, 2011; Ahn and Metallo, 2015; Liberti and Locasale, 2016). В двух различных наборах данных мы наблюдали, что в образцах печени с ГЦК экспрессия гена PDHA1, который кодирует альфа-1 субъединицу E1 комплекса PDH, была значительно выше, чем в неопухолевой ткани ( P <0.0001) или нормальной печени ( P <0,0001), тогда как в образцах HCC экспрессия сукцинатдегидрогеназы (SDHB), которая превращает сукцинат в фумарат в TCA, была значительно ниже, чем в неопухолевой ткани ( P <0,0001) или нормальной печени ( P <0,0001) (Рисунки 3A, B). Эти наблюдения согласуются с недавним исследованием, показывающим, что снижение уровней экспрессии SDHB при ГЦК способствует эффекту Варбурга (Tseng et al., 2018). Менее ясна картина экспрессии гена изоцитратдегидрогеназы 2 (IDh3), которая превращает изоцитрат в альфа-кетоглутарат в TCA.Уровни экспрессии IDh3 были выше в образцах HCC по сравнению с соседними неопухолевыми образцами ( P = 0,0010) из набора данных GSE36376, в то время как экспрессия IDh3 не показала изменений в наборе данных TGA-LIHC ( P = 0,7106) ( Рисунки 3А, Б).
РИСУНОК 3. Анализ экспрессии генов окислительного митохондриального метаболизма при ГЦК. (A, C) Диаграммы рассеяния, показывающие уровни транскриптов репрезентативных ферментов TCA (A) и OXPHOS (C) в наборе клинических данных GSE36376, состоящем из HCC ( n = 240) и прилегающих неопухолевых ( n = 193) ткани печени (Lim et al., 2013). Горизонтальные линии показывают среднее значение ± SEM . Значения P были рассчитаны с помощью непараметрических критериев Манна-Уитни. (B, D) Коробчатые диаграммы, показывающие дифференциальную экспрессию генов TCA (B) и OXPHOS (D) среди нормальных тканей печени ( n = 50) по сравнению с тканями первичной опухоли ( n = 371) ( Образцы TGA-LIHC), проанализированные с помощью биоинформатического инструмента UALCAN из геномной базы данных (Ally et al., 2017; Chandrashekar et al., 2017). Значения выражены в расчете на миллион.Для каждого прямоугольного графика усы представляют диапазон значений 2,5–97,5-го процентиля, нижняя и верхняя границы обозначают 25-й и 75-й процентиль каждого набора данных, соответственно, а горизонтальная линия представляет собой медианное значение для каждой группы. P -значения были рассчитаны по t -тест.
Окислительное фосфорилирование сочетается с транспортом электронов, который организован в четыре больших встроенных в мембрану белковых комплексов от I до IV (Alberts et al., 2002), чтобы генерировать АТФ.Поскольку недавние исследования показали, что определенные типы рака зависят как от гликолитического, так и от митохондриального метаболизма для производства АТФ (Lunt and Vander Heiden, 2011; Liberti and Locasale, 2016; Gentric et al., 2017), мы изучили, верно ли это для HCC. Мы проанализировали профиль экспрессии репрезентативных генов, участвующих в формировании комплексов электронно-транспортной цепи, включая NDUFA5 (комплекс I), UQCRB (комплекс III) и COXA5 (комплекс IV). За исключением COXA5, экспрессия NDUFA5 и UQCRB была либо постоянной (NDUAF5; P = 0.4934) или значительно снижается (UQCRB; P <0,0001) при ГЦК по сравнению с соседней неопухолевой тканью в когорте GSE36376 (рис. 3C). Однако уровни экспрессии всех трех генов показали значительное увеличение в образцах HCC по сравнению с нормальными образцами печени (Рисунок 3D).
В совокупности наши результаты показывают, что в печени с ГЦК экспрессия генов, участвующих в гликолитическом и окислительном метаболизме, выше по сравнению с нормальной печенью, в то время как экспрессия генов окислительного метаболизма сопоставима или снижена по сравнению с окружающей неопухолевой тканью (рис. –3).Поскольку ГЦК развивается в условиях цирроза, вполне вероятно, что окружающая неопухолевая ткань действительно является цирротической тканью с наличием поблизости опухолевых узлов (Hoshida et al., 2013). Таким образом, очевидное несоответствие между результатами, полученными в результате нашего анализа двух различных наборов данных, может отражать различные микросреды, которые отличают нормальную печень от печени, прилегающей к опухоли.
Важно отметить, что Айдл и его коллеги (Beyoglu et al., 2013) измерили экспрессию различных тканевых метаболитов (включая глюкозу, глицерин-3 и 2-фосфат, малат, аланин) на панели из 31 печени с ГЦК и обнаружили, что при ГЦК наблюдается четырехкратное увеличение гликолиза по сравнению с митохондриальным OXPHOS по сравнению с соответствующей неопухолевой тканью печени.Эти метаболические исследования тканей согласуются с нашим анализом, согласно которому изменения в экспрессии транскриптов гликолиза, но не OXPHOS, при ГЦК согласуются с метаболизмом типа Варбурга.
Экспрессия ферментов гликолиза и PPP коррелирует с низкой выживаемостью пациентов при ГЦК
Затем мы оценили прогностическую ценность ключевых регуляторов аэробного гликолиза и митохондриального метаболизма в наборе данных HCC (TCGA-LIHC) с помощью онлайн-инструмента GEPIA, веб-сервера для профилирования рака и нормальной экспрессии генов и интерактивного анализа (Tang et al., 2017). Кривые кумулятивной выживаемости пациентов были исследованы с использованием метода Каплана-Мейера, и различия во времени выживаемости были рассчитаны в соответствии с лог-ранговым тестом. Как показано на рисунке 4A, когда пациенты с ГЦК были разделены на две группы в соответствии со средним значением транскрипта каждого гена, который представляет собой HK2, PKM2, ALDOA и LDHA, мы обнаружили, что общая выживаемость была значительно ниже в группах с высокой экспрессией в Когорта пациентов TCGA-LIHC ( P <0,05). Аналогичные тенденции были обнаружены и для других гликолитических генов, некоторые из которых достигли достаточной значимости ( P <0.05; т.е. GAPDH, PGK1, ENO1) и очень немногие, не достигающие значимости (GPI, P = 0,100; PGAM1, P = 0,052; LDHB, P = 0,058) (данные не показаны). Напротив, PFKL следует обратной тенденции. Высокая экспрессия PFKL действительно была обратно пропорционально связана с плохой общей выживаемостью, но это не было статистически значимым ( P = 0,420) (Рисунок 4A). Более того, хотя в нашем анализе дифференциальной экспрессии генов экспрессия мРНК LDHA была недостаточно высока в печени с HCC по сравнению со здоровой и окружающей неопухолевой печенью (рисунки 1B, C), похоже, что экспрессия LDHA имеет прогностическое значение при HCC (рисунок 4A). .Это согласуется с предыдущими исследованиями, демонстрирующими, что высокий уровень ЛДГ в сыворотке крови связан с плохой общей выживаемостью пациентов при нескольких злокачественных новообразованиях, включая ГЦК (Wulaningsih et al., 2015).
РИСУНОК 4. Экспрессия гликолитического гена связана с плохим прогнозом пациента. (A, B) Высокая экспрессия генов, связанных с гликолизом и окислительной фазой PPP, значительно коррелирует с плохой общей выживаемостью пациентов. Показаны кривые общей выживаемости Каплана-Мейера пациентов с ГЦК в соответствии с обозначенными уровнями экспрессии генов выше или ниже среднего значения, основанными на наборе данных TGA-LIHC и проанализированных с помощью биоинформатического инструмента GEPIA из геномной базы данных (Ally et al., 2017; Tang et al., 2017). (C, D) Кривые общей выживаемости Каплана-Мейера пациентов с ГЦК в наборе данных TGA-LIHC, показывающие однородную прогностическую значимость генов TCA и OXPHOS.
При изучении отдельных генов, функционирующих в окислительной фазе PPP, мы обнаружили, что общая выживаемость была значительно ниже в группе пациентов, которые экспрессировали высокие уровни G6PD, фермента, ограничивающего скорость PPP, и мРНК PGD ( Рисунок 4B). Следует отметить, что хотя экспрессия PGLS не имела прогностической ценности ( P = 0.055; Рисунок 4B), кажется, что по крайней мере ограничивающий скорость фермент G6PD окислительной фазы PPP имеет важное клиническое значение для пациентов с HCC. Удивительно, но метаболические гены, участвующие в митохондриальном метаболизме, не имеют прогностической ценности при ГЦК, поскольку ни экспрессия генов, связанных с циклом ТЦА, ни OXPHOS не были связаны с плохой общей выживаемостью пациентов (Рисунки 4C, D), несмотря на их значительное увеличение в образцах ГЦК по сравнению с нормальной печенью. (Рисунок 3). Это может указывать на то, что ферменты TCA и OXPHOS могут подвергаться строгой посттрансляционной регуляции, которая отделяет уровни мРНК от фактической функции фермента в печени с ГЦК.
Интересно, что аналогичная тенденция была получена при анализе выживаемости пациентов с ГЦК с использованием отдельного набора данных с помощью инструмента веб-сервера KM plotter (Szász et al., 2016) (дополнительный рисунок S1). В целом эти данные указывают на прогностическую роль гликолитических генов при ГЦК.
Экспрессия генов гликолиза и ферментов PPP в цирротической печени
Цирроз печени — это предраковое состояние ГЦК (Wright, 1991; Borzio et al., 1995; Donato et al., 2001; El-Serag, 2011; Jemal et al., 2011; Форнер и др., 2018). Таким образом, цирроз печени является уникальной моделью для исследования маркеров раннего обнаружения HCC in vivo (El-Serag, 2011; Forner et al., 2018; Fujiwara et al., 2018). Чтобы лучше понять метаболические изменения в раннем канцерогенезе печени, мы исследовали экспрессию гликолитических транскриптов, а также транскрипты митохондриального метаболизма в трех независимых наборах клинических данных, в общей сложности 94 циррозных печени и 34 здоровых печени. Мы исследовали уровни транскриптов репрезентативных ферментов гликолиза.Как показано на рисунке 5A, статистически значимые различия в уровнях мРНК были обнаружены между цирротической и нормальной печенью для HK2, ALDOA и PKM2 в трех проанализированных наборах данных. Поскольку зонд LDHA не был обнаружен в когорте GSE25097, мы проанализировали экспрессию LDHB и обнаружили, что (как и другие гликолитические ферменты) экспрессия LDHB также была увеличена в образцах циррозной печени по сравнению с нормальной печенью (рис. 5A). Напротив, уровни экспрессии PFKL были значительно выше в цирротической печени по сравнению со здоровыми образцами в когорте GSE25097 ( P = 0.0086), но в двух других наборах данных было найдено постоянное значение ( P = 0,1824 и P = 0,9888). В совокупности эти результаты согласуются с результатами, наблюдаемыми при ГЦК. Действительно, хотя экспрессия транскриптов HK2, ALDOA и PKM2 повышена при HCC по сравнению с нормальной печенью и связана с плохой общей выживаемостью пациентов, повышенные уровни PFKL, оцененные при HCC, не имели прогностической ценности (см. Рисунок 4). Это предполагает, что экспрессия этих генов в цирротической печени напоминает сигнатуру экспрессии генов HCC (рис. 5A).
РИСУНОК 5. Экспрессия генов гликолиза и ферментов PPP в цирротической печени и печени с ГЦК. (A) Диаграммы рассеяния, показывающие повышенную экспрессию уровней транскриптов репрезентативных гликолитических ферментов в печени с циррозом печени по сравнению с печенью с ГЦК и нормальными здоровыми тканями печени в трех независимых наборах клинических данных GSE25097, GSE6764 и GSE14323 (Wurmbach et al., 2007; Sung et al., 2012; Levy et al., 2016). (B) Диаграммы рассеяния, показывающие дифференциальную экспрессию генов, связанных с окислительным PPP, в печени с циррозом по сравнению с печенью с HCC и нормальными здоровыми тканями печени в трех независимых наборах клинических данных GSE25097, GSE6764 и GSE14323 (Wurmbach et al., 2007; Sung et al., 2012; Леви и др., 2016). Горизонтальные линии показывают среднее значение ± SEM P — значения были рассчитаны с помощью непараметрических тестов Манна-Уитни.
Мы также оценили уровни транскриптов, кодирующих гены в окислительной фазе PPP, и обнаружили, что хотя в наборе данных GSE25097 наблюдалось значительное увеличение трех проанализированных генов PPP (включая ферменты, ограничивающие скорость G6PD), никаких изменений не наблюдалось в два других набора данных, за исключением PGLS, экспрессия которого была значительно ниже в цирротической печени (рис. 5B).Примечательно, что при ГЦК не наблюдалось значительного увеличения экспрессии гена гликолита и РРР по сравнению с циррозом печени (рис. 5A, B), что позволяет предположить, что перепрограммирование метаболизма глюкозы может происходить на предраковых стадиях. Для ферментов TCA уровни мРНК PDHA1, IDh3 и SHDB были постоянными в обоих наборах данных цирротической печени по сравнению с нормальной печенью (рис. 6А). Точно так же уровни транскриптов репрезентативных генов OXPHOS, которые были высоко экспрессированы при ГЦК, не были обнаружены по-разному экспрессируемыми в циррозной печени по сравнению со здоровой печенью (рис. 6В).В совокупности эти результаты предполагают, что, в отличие от общего увеличения количества генов гликолиза, гены TCA и OXPHOS оставались на том же уровне при циррозе. Эти наблюдения предполагают сдвиг в сторону аэробного гликолиза и PPP по сравнению с окислительным фосфорилированием в цирротической печени. Это также подтверждается тем фактом, что, в отличие от ГЦК (рис. 1), цирротическая печень демонстрирует повышенную экспрессию ЛДГБ по сравнению со здоровой печенью (рис. 5А), что позволяет предположить, что пируват может отводиться от митохондрий для производства АТФ.
РИСУНОК 6. Экспрессия генов ферментов TCA и OXPHOS в цирротической печени. (A, B) Диаграммы рассеяния, показывающие гомогенную экспрессию репрезентативных биомаркеров TCA и OXPHOS в цирротической печени по сравнению с нормальными здоровыми тканями печени в трех независимых наборах клинических данных GSE25097, GSE6764 и GSE14323 (Wurmbach et al., 2007; Sung et al. , 2012; Леви и др., 2016). Горизонтальные линии показывают среднее значение ± SEM P — значения были рассчитаны с помощью непараметрических тестов Манна-Уитни.
Кроме того, как описано для HCC, Nishikawa et al. (2014) продемонстрировали, что гепатоциты, выделенные из печени крыс с ранними признаками цирроза, демонстрируют метаболический сдвиг от OXPHOS к гликолизу для производства АТФ, в то время как нормальные гепатоциты крысы продолжают использовать OXPHOS для выработки АТФ. Было также показано, что экспрессия гликолитических генов сильно снижена в цирротических гепатоцитах с декомпенсированной функцией печени, что позволяет предположить, что недостаточная печень не требует гликолиза для преодоления ранних признаков повреждения.В целом эти исследования (Beyoglu et al., 2013; Nishikawa et al., 2014) согласуются с нашим анализом, согласно которому повышенная экспрессия транскриптов гликолиза, но не транскриптов OXPHOS, обнаруживается как в HCC, так и в цирротической печени по сравнению с нормальной печенью.
Экспрессия гликолитического гена в цирротической печени связана с риском развития ГЦК
Затем мы исследовали, связаны ли гены, участвующие в гликолизе, PPP, цикле TCA и OXPHOS с прогрессированием цирроза до HCC и выживаемостью пациентов.Набор клинических данных GSE15654 состоит из биопсий, полученных от пациентов с циррозом Чайлд-Пью А, связанных с гепатитом С, которые проспективно наблюдались в программе наблюдения за ГЦК в течение в среднем 10 лет и классифицировались как низкие ( n = 55) и высокие ( n = 60) Риск ГЦК на основе показателей выживаемости пациентов и частоты развития ГЦК (таблица 1; Hoshida et al., 2013). Мы исследовали экспрессию транскриптов HK2, PFKL, ALDOA, PKM2 и LDHB, опросив эту общедоступную базу данных экспрессии генов.Как показано на фиг. 7A и в таблице 1, высокая экспрессия мРНК HK2, PFKL, ALDOA и PKM2 положительно коррелировала с прогрессированием цирроза до HCC и худшей выживаемостью. Исключением был LDHB, который не выражается по-разному в двух прогностических группах.
ТАБЛИЦА 1. Сводка клинических параметров, связанных с каждой группой цирроза печени.
РИСУНОК 7. Повышенный риск развития ГЦК у пациентов с циррозом печени значительно коррелирует с высокой экспрессией гликолитических генов. (A – D) Уровни транскриптов в наборе клинических данных GSE15654, состоящего из 115 пациентов с впервые диагностированным циррозом печени, которые проспективно наблюдались в программе наблюдения за ГЦК и классифицировались как имеющие низкий ( n = 55) и высокий () n = 60) Риск ГЦК на основе показателей выживаемости пациентов и риска развития ГЦК (Hoshida et al., 2013). Горизонтальные линии показывают среднее значение ± SEM P — значения были рассчитаны с помощью непараметрических тестов Манна-Уитни.
Для окислительной фазы ферментов PPP было обнаружено, что высокие уровни экспрессии мРНК G6PD связаны с прогрессированием цирроза до HCC и снижением выживаемости ( P = 0,0209), в то время как PGLS и PGD не показывают дифференциальной экспрессии ( P > 0,050; рисунок 7B). Наконец, в соответствии с результатами, показанными на Фигуре 6, не наблюдалось увеличения экспрессии метаболических генов в цикле TCA и OXPHOS между группами низкого и высокого риска ГЦК (Фигуры 7C, D). Напротив, экспрессия IDh3, SDHB и COXA5 обратно коррелировала с плохим прогнозом (Фигуры 7C, D).Таким образом, в цирротической печени высокая экспрессия генов гликолиза связана с повышенным риском развития ГЦК, что позволяет предположить, что гликолитический фенотип может иметь прогностическую роль у пациентов с циррозом. Более того, уровни HK2, PFKL, ALDOA, PKM2 и LDHB демонстрируют слабую дифференциальную экспрессию в цирротической и HCC печени (фиг. 5A), что указывает на то, что приобретение гликолитического фенотипа происходит как во время инициации, так и во время поддержания HCC. В совокупности эти результаты предполагают, что гликолитические ферменты могут представлять собой потенциальные мишени для химиопрофилактики ГЦК.
Обсуждение
Более чем в 80% случаев ГЦК возникает на фоне цирроза (El-Serag, 2011; Jemal et al., 2011; Forner et al., 2018; Fujiwara et al., 2018). Следовательно, понимание того, как цирроз печени развивается из нормальной печени и прогрессирует в ГЦК, особенно важно для определения химиопрофилактических методов лечения. Сообщалось, что вирусная инфекция гепатита B (HBV) или C (HCV), хроническое употребление алкоголя и неалкогольная жировая болезнь печени являются основными причинами развития цирроза (El-Serag, 2011).Тем не менее, ранние биохимические и молекулярные события, лежащие в основе прогрессирования цирроза печени в ГЦК, остаются в значительной степени неясными.
Примечательные особенности злокачественных гепатоцитов — преобладающих паренхиматозных клеток печени — включают высокий пролиферативный потенциал. Чтобы пролиферировать ГЦК, гепатоциты корректируют свою метаболическую активность, чтобы удовлетворить биоэнергетические и анаболические потребности в удвоении массы (Gatenby and Gillies, 2004; Lunt and Vander Heiden, 2011; Hay, 2016). Однако неясно, как и когда клетки ГЦК приобретают эти метаболические изменения во время гепатоканцерогенного процесса.
Здесь мы сообщаем об изменениях в экспрессии транскриптов генов гликолиза и PPP при циррозе, согласующихся с метаболизмом типа Варбурга, и демонстрируем положительную корреляцию между экспрессией гликолитических генов и риском развития ГЦК и плохой выживаемостью пациентов.
По сравнению с нормальной печенью в образцах печени пациентов с ГЦК была обнаружена повышенная экспрессия мРНК ключевых метаболических генов гликолиза, PPP, TCA и OXPHOS, что указывает на патогенную роль метаболизма глюкозы в этом заболевании.Отличительной функцией нормальных гепатоцитов является превращение неуглеводных углеродных субстратов, таких как лактат и пируват, в глюкозу посредством пути глюконеогенеза. Известно, что некоторые глюконеогенные ферменты, такие как глюкозо-6-фосфатаза (G6Pase), фруктозо-1,6-бисфосфатаза (FBP1) и PEP карбоксикиназа (PEPCK), обходят первую, вторую и третью необратимые реакции гликолитического пути соответственно. приводя к замедлению скорости гликолиза в нормальных гепатоцитах (рис. 8; Hay, 2016).При HCC подавляются G6Pase, FBP1 и PEPCK вместе с гексокиназой 4 с низким сродством (HK4), тогда как гексокиназа HK2 с высоким сродством сверхэкспрессируется (Wang et al., 2012; Hay, 2016). В соответствии с этим мы обнаружили, что HK2 высоко экспрессируется не только при ГЦК, но и при циррозе по сравнению с нормальными образцами печени, что позволяет предположить возникновение гликолитического фенотипа на ранней стадии гепатоканцерогенного процесса. Эта гипотеза подтверждается наблюдением, что уровни экспрессии других ключевых гликолитических ферментов, таких как ALDOA и PKM2, также сверхэкспрессируются в циррозной печени.Среди трех известных изоформ гликолитического фермента альдолазы (ALDOA, ALDOB и ALDOC), который катализирует обратимое превращение фруктозо-1,6-бисфосфата (F1,6BP) в дигидроксиацетонфосфат (DHAP) и глицеральдегид-3-фосфат (G3P). , ALDOA более эффективно катализирует эту реакцию, тем самым ускоряя поток за счет гликолиза (Castaldo et al., 2000; Hay, 2016). Действительно, сообщалось, что ALDOA является основной изоформой, экспрессируемой при большинстве типов рака (Asaka et al., 1994). Наше открытие, что уровни ALDOA повышаются в образцах с циррозом и HCC, предполагает, что фенотип с высоким содержанием гликолита является замечательной особенностью как предраковых, так и раковых состояний.
РИСУНОК 8. Упрощенная модель, показывающая транскрипционные изменения в экспрессии генов метаболических ферментов, которые характеризуют прогрессирование от нормальной печени к циррозу, который завершается ГЦК. Одним из наиболее выраженных изменений транскрипции при переходе от нормального к HCC является подавление HK4 и ALDOB с последующей индукцией высокоаффинных HK2 и ALDOA. Это позволяет глюкозе проникать в клетки и превращаться в пируват. PKM2 и лактатдегидрогеназа (LDHA / LDHB), последние два фермента в гликолитическом пути, по существу необходимы для поддержания высокой скорости гликолиза карцином печени за счет быстрого удаления накапливающихся промежуточных продуктов, чтобы способствовать входу в другие метаболические пути, такие как окислительный фаза ГЧП.Удивительно, но эти метаболические изменения чаще всего возникают на ранней стадии предраковых заболеваний (цирроза печени) во время гепатоканцерогенеза. В то время как в цирротической печени гликолиз обеспечивает как биосинтетические строительные блоки, так и антиоксидантную защиту, необходимую для выживания (в отличие от апоптоза) поврежденных клеток, в печени с ГЦК гликолиз взаимодействует с OXPHOS и циклом TCA для поддержания энергии, необходимой для быстрой пролиферации и метастазирования. Наши анализы показывают, что экспрессия гликолитических ферментов, таких как HK2, ALDOA и PKM2 (отмечены звездочками) в предраковых, хронически воспаленных печени, может рассматриваться как новые прогностические биомаркеры для предотвращения развития рака печени.Рисунок был создан с изменением иллюстраций, предоставленных Сервье (http://smart.servier.com) в соответствии с лицензией Creative Commons Attribution 3.0 Unported.
Недавние работы установили, что изоформа пируваткиназы M2 (PKM2), которая катализирует синтез пирувата и АТФ, используя фосфоенолпируват (PEP) и ADP в качестве субстратов, является критическим фактором эффекта Варбурга (Christofk et al., 2008; Cortés-Cros et al., 2013; Israelsen et al., 2013; обзор в Wiese and Hitosugi, 2018).Действительно, подобно другим типам раковых клеток, клетки HCC экспрессируют PKM2, пируватная активность (PK) которого поддерживается на низком уровне с помощью сигнальных путей, способствующих выживанию (обзор в Papa and Bubici, 2016). Низкая активность PKM2 позволяет накапливать промежуточные продукты гликолита, которые могут направляться в пути биосинтеза с образованием аминокислот, нуклеиновых кислот и липидов (Christofk et al., 2008; Cortés-Cros et al., 2013; Israelsen et al. , 2013). Способствуя этим биосинтетическим путям, низкая активность PKM2 также способствует повышению уровней восстановленного никотинамидадениндинуклеотидфосфата (НАДФН) и антиоксидантно восстановленного глутатиона (GSH), который служит для детоксикации активных форм кислорода (АФК), накопление которых приводит к хроническому апоптозу. поврежденные и опухолевые ткани (Papa, Bubici, 2016).
Мы действительно наблюдали значительно более высокие уровни экспрессии PKM2 в печени с циррозом и ГЦК по сравнению с нормальной печенью. Таким образом, хотя требуются дальнейшие исследования, разумно предположить, что повышенная экспрессия PKM2 в цирротической печени может способствовать устойчивости к апоптозу поврежденных (поврежденных) гепатоцитов, которые продолжают выживать, пролиферировать и накапливаться, пока не станут злокачественными ГЦК. Следует отметить также наблюдение, что экспрессия LDHA (или LDHB) (гликолитических ферментов, превращающих пируват в лактат) не связана с риском ГЦК у пациентов с циррозом (рис.7), что позволяет предположить, что пируват гликолитического происхождения не может полностью превращаться в лактат. и поэтому передается другим метаболическим путям (т.е. мевалонатный путь; обсуждается ниже).
Хотя долгое время считалось, что аэробный гликолитический фенотип связан с нарушением митохондриального окислительного метаболизма (Lunt and Vander Heiden, 2011), недавние исследования в этой области продемонстрировали, что и гликолитический, и митохондриальный метаболизм используются раковыми клетками для производства АТФ и синтез макромолекул (Weinberg et al., 2010; Ahn, Metallo, 2015; Gentric et al., 2017; Takahashi et al., 2018). В соответствии с этими исследованиями, наш анализ образцов ГЦК показывает высокие уровни экспрессии генов, связанных с метаболизмом митохондрий, по сравнению с нормальной печенью.Тот факт, что при циррозе уровни экспрессии генов TCA и OXPHOS ниже, чем в нормальной печени, или остаются неизменными, предполагает наличие как гликолитического, так и митохондриального метаболизма только при ГЦК. Напротив, циррозная печень имеет высокую экспрессию HK2, ALDOA, PKM2 и LDHB, а также демонстрирует значительное увеличение экспрессии G6PD. Похоже, что при циррозе происходят метаболические перестройки (то есть сдвиг гликолиза).
На самом деле это можно объяснить тем фактом, что хронически пораженные ткани, такие как цирроз печени, имеют более естественную тенденцию запускать защитные программы против гибели клеток, вызванной АФК (через некроз или апоптоз), а не митохондриальный метаболизм, который способствует образованию АФК. (Папа и др., 2009; Luedde et al., 2014; ДеБерардини и Чандель, 2016).
Действительно, было высказано предположение, что в раковых клетках продукция ROS комплексом I, II и III цепи переноса электронов способствует повреждению ДНК и необходима для выживания раковых клеток, индуцированной Kras клеточной трансформации и метастазирования рака (Weinberg et al., 2010; Takahashi et al., 2018; обзор в Lunt and Vander Heiden, 2011; Reczek and Chandel, 2015; DeBerardinis and Chandel, 2016). Таким образом, похоже, что в воспаленной печени регуляция транскрипции генов, участвующих в гликолизе, запускает клеточные защитные программы, которые служат для противодействия хроническому повреждению.Помимо регуляции транскрипции, метаболические ферменты, как известно, жестко регулируются посттранскрипционными модификациями, включая фосфорилирование, ацетилирование, гликозилирование, которые влияют на метаболическую активность клеток и не исследовались в этом исследовании. Следует отметить, что гипоксия (через активацию фактора транскрипции HIF-1α) и другие внутриклеточные сигнальные пути (например, PI3K / AKT, JNK, ERK, PTEN, p53) также, как было показано, регулируют метаболический сдвиг в сторону аэробного гликолиза HCC. клетки (Iansante et al., 2015; Cassim et al., 2018). Следует поучительно оценить дифференциальную сигнатуру этих метаболических регуляторов в нормальной и циррозной печени и проверить, активируются ли эти пути в циррозной печени. Поэтому необходимы дальнейшие исследования, такие как анализ экспрессии белка, чтобы понять конкретные механизмы, лежащие в основе метаболических изменений, наблюдаемых при ГЦК и циррозе, хотя это может быть затруднительно из-за нехватки доступных образцов цирроза у человека.
Профилактика ГЦК — неудовлетворенная медицинская потребность (El-Serag, 2011; Jemal et al., 2011; Форнер и др., 2018). Интересно отметить, что уровни экспрессии HK2, ALDOA и PKM2, по-видимому, имеют важное клиническое значение для пациентов с циррозом, поскольку анализ цирроза печени пациентов, наблюдавшихся в течение 10 лет, показал положительную корреляцию между высокой экспрессией генов гликолиза и прогрессированием цирроза. HCC. Это предполагает, что экспрессия этих гликолитических ферментов может быть использована в качестве нового биомаркера риска развития ГЦК. Напротив, ни TCA, ни экспрессия генов OXPHOS, проанализированная в этом исследовании, не была связана с повышенным риском ГЦК.
Хотя существуют потенциальные ограничения, связанные с характером анализов, проведенных в этом исследовании, мы стремились обнаружить ранние признаки метаболических изменений в развитии ГЦК и показать, что уровни экспрессии HK2, ALDOA и PKM2 в цирротической печени могут быть использованы. как новые прогностические биомаркеры развития ГЦК. Ранние исследования показали, что цирроз печени крыс демонстрирует метаболический сдвиг от OXPHOS к гликолизу, в то время как нормальные гепатоциты крысы продолжают использовать OXPHOS (Chen et al., 2012; Бейоглу и др., 2013; Нисикава и др., 2014; Гао и др., 2015). Дополнительную поддержку нашим наблюдениям дают продолжающиеся клинические испытания по предотвращению развития и рецидивов ГЦК. В настоящее время продолжаются рандомизированные клинические испытания по изучению использования статинов (например, симвастатина, аторвастатина) для предотвращения либо развития ГЦК у пациентов с циррозом (предраком), либо рецидива ГЦК у пациентов без ГЦК, которым хирургическим путем была проведена лечебная абляция или гепатэктомия (Goodman, 2016; Chen, 2017; Fujiwara et al., 2018). Статины представляют собой класс гиполипидемических препаратов, которые нацелены на регулирующий скорость фермент (NADH / NADPH-зависимый) 3-гидрокси-3-метил-глутарил-кофермент A (HMG-CoA) редуктазу мевалонатного пути, в котором холестерин и другие образуются изопреноиды (Clendending, Penn, 2012; Fujiwara et al., 2018). Мевалонатный путь начинается с ацетил-КоА и заканчивается образованием изопентенилпирофосфата (IPP) и диметилаллилпирофосфата (DMAPP), предшественников изопреноидов. Важно отметить, что аэробный гликолиз положительно регулирует мевалонатный путь, продуцируя пируват, который необходим для начального образования ацетил-КоА (Clennding and Penn, 2012).Таким образом, весьма вероятно, что, блокируя мевалонатный путь посредством ингибирования HMG-CoA редуктазы, статины могут вносить вклад в подавление аэробного гликолиза посредством отрицательной обратной связи (Clennding and Penn, 2012). Если эти клинические испытания будут полезны для снижения риска ГЦК, потребуются дальнейшие исследования, чтобы напрямую связать пути мевалоната с аэробным гликолизом при циррозе печени.
Заявление об этике
Исследование включает анализ общедоступных наборов данных с использованием людей.Таким образом, разрешение на использование человеческого объекта было предоставлено третьим сторонам, которые депонировали общедоступные наборы данных, которые были должным образом процитированы в тексте.
Авторские взносы
NL, MC, CB и SP проводили эксперименты. CB и SP являются старшими авторами, разработали идею, в основном провели анализ и интерпретацию данных, координируют исследование и написали рукопись, которую прокомментировали все авторы.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы выражают признательность за финансирование исследований от Brunel Research Initiative & Enterprise Fund, Лондонского университета Брунеля (CB), стипендии 250 Great Minds, Университета Лидса (SP), AMMF Cholangiocarcinoma Charity (SP) и частично Bloodwise (17014) (SP и CB). МС был поддержан образовательной программой Erasmus + EU.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https: // www.frontiersin.org/articles/10.3389/fcell.2018.00138/full#supplementary-material
Список литературы
Альбертс Б., Джонсон А., Льюис Дж. И др. (2002) «Электронно-транспортные цепи и их протонные насосы», в Molecular Biology of the Cell , 4th Edn, (New York, NY: Garland Science).
Google Scholar
Элли А., Баласундарам М., Карлсен Р., Чуа Э., Кларк А., Дхалла Н. и др. (2017). Комплексная и интегративная геномная характеристика гепатоцеллюлярной карциномы. Ячейка 169, 1327–1341. DOI: 10.1016 / j.cell.2017.05.046
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Асака, М., Кимура, Т., Мегуро, Т., Като, М., Кудо, М., Миядзаки, Т. и др. (1994). Изменение изоферментов альдолазы в сыворотке и тканях больных раком и другими заболеваниями. J. Clin. Лаборатория. Анальный. 8, 144–148. DOI: 10.1002 / jcla.1860080306
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барбаруло, А., Янсанте, В., Чайдос, А., Нареш, К., Рахемтулла, А., Франзозо, Г. и др. (2013). Член 14 семейства поли (АДФ-рибоза) полимеразы (PARP14) представляет собой новый эффектор JNK2-зависимого сигнала про выживание при множественной миеломе. Онкоген 32, 4231–4242. DOI: 10.1038 / onc.2012.448
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барретт Т. (2013). «Омнибус экспрессии генов (GEO)», в Справочник NCBI , 2-е изд. (Бетесда, Мэриленд: Национальный центр биотехнологической информации).
Google Scholar
Beyoglu, D., Imbeaud, S., Maurhofer, O., Bioulac-Sage, P., Zucman-Rossi, J., Dufour, J. F., et al. (2013). Тканевая метаболомика гепатоцеллюлярной карциномы: энергетический метаболизм опухоли и роль транскриптомной классификации. Гепатология 58, 229–238. DOI: 10.1002 / hep.26350
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Borzio, M., Bruno, S., Roncalli, M., Mels, G.C., Ramella, G., Borzio, F., et al. (1995).Дисплазия клеток печени является основным фактором риска гепатоцеллюлярной карциномы при циррозе: проспективное исследование. Гастроэнтерология 108, 812–817. DOI: 10.1016 / 0016-5085 (95)
-7
CrossRef Полный текст | Google Scholar
Кастальдо Г., Кальканьо Г., Сибилло Р., Куомо Р., Нардоне Г., Кастеллано Л. и др. (2000). Количественный анализ мРНК альдолазы А в печени позволяет различать гепатоцеллюлярную карциному и цирроз. Clin. Chem. 46, 901–906.
PubMed Аннотация | Google Scholar
Кассим, С., Раймонд В. А., Лакост Б., Лапьер П. и Билодо М. (2018). Профилирование метаболитов идентифицирует признак канцерогенности гепатоцеллюлярной карциномы. Oncotarget 9, 26868–26883. DOI: 10.18632 / oncotarget.25525
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чандрашекар, Д. С., Башел, Б., Баласубраманья, С. А. Х., Крейтон, К. Дж., Понсе-Родригес И., Чакраварти, Б. В. С. К. и др. (2017). UALCAN: портал для облегчения анализа экспрессии генов подгруппы опухолей и анализа выживаемости. Неоплазия 19, 649–658. DOI: 10.1016 / j.neo.2017.05.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chen, Y., Choi, S. S., Michelotti, G. A., Chan, I. S., Swiderska-Syn, M., Karaca, G. F., et al. (2012). Hedgehog контролирует судьбу звездчатых клеток печени, регулируя метаболизм. Гастроэнтерология 143: 1319–1329. DOI: 10.1053 / j.gastro.2012.07.115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кристофк, Х.R., Vander Heiden, M.G., Harris, M.H., Ramanathan, A., Gerszten, R.E., Wei, R., et al. (2008). Изоформа сплайсинга M2 пируваткиназы важна для метаболизма рака и роста опухоли. Природа 452, 230–233. DOI: 10.1038 / nature06734
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cortés-Cros, M., Hemmerlin, C., Ferretti, S., Zhang, J., Gounarides, J. S., Yin, H., et al. (2013). Изоформа M2 пируваткиназы незаменима для поддержания и роста опухоли. Proc. Natl. Акад. Sci. США 110, 489–494. DOI: 10.1073 / pnas.1212780110
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Донато М. Ф., Арозио Э., Дель Нинно Э., Ронки Г., Лампертико П., Морабито А. и др. (2001). Высокие показатели гепатоцеллюлярной карциномы у пациентов с циррозом и высокой пролиферативной активностью клеток печени. Гепатология 34, 523–528. DOI: 10.1053 / jhep.2001.26820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Форнер, А., Рейг М. и Брюикс Дж. (2018). Гепатоцеллюлярная карцинома. Ланцет 391, 1301–1314. DOI: 10.1016 / S0140-6736 (18) 30010-2
CrossRef Полный текст | Google Scholar
Фудзивара, Н., Фридман, С. Л., Гуссенс, Н., Хошида, Ю. (2018). Факторы риска и профилактика гепатоцеллюлярной карциномы в эпоху точной медицины. J. Hepatol. 68, 526–549. DOI: 10.1016 / j.jhep.2017.09.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гао, Р., Cheng, J., Fan, C., Shi, X., Cao, Y., Sun, B., et al. (2015). Метаболомика сыворотки для определения биомаркеров, специфичных для заболевания печени, для прогрессирования гепатита в гепатоцеллюлярную карциному. Sci. Отчет 5: 18175. DOI: 10.1038 / srep18175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gentric, G., Mieulet, V., and Mechta-Grigoriou, F. (2017). Неоднородность метаболизма рака: новые концепции в старой области. Антиоксид. Редокс-сигнал. 26, 462–485.DOI: 10.1089 / ars.2016.6750
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хошида Ю., Вильянуэва А., Сангиованни А., Соле М., Хур К., Андерссон К. Л. и др. (2013). Сигнатура прогностической экспрессии генов для пациентов с циррозом на ранней стадии, связанным с гепатитом С. Гастроэнтерология 144, 1024–1030. DOI: 10.1053 / j.gastro.2013.01.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хуан, К., Тан, Ю., Инь, П., Е, Г., Гао, П., Лу, X., Ван, Х., Сюй, Г. (2013). Метаболическая характеристика гепатоцеллюлярной карциномы с использованием ненаправленной тканевой метаболомики. Cancer Res. 73, 4992–5002. DOI: 10.1158 / 0008-5472.CAN-13-0308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Янсанте В., Чой П. М., Фунг С. В., Лю Ю., Чай Дж. Г., Дайсон Дж. И др. (2015). PARP14 способствует эффекту Варбурга при гепатоцеллюлярной карциноме путем ингибирования JNK1-зависимого фосфорилирования и активации PKM2. Nat. Commun. 6: 7882. DOI: 10.1038 / ncomms8882
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Израэльсен, У. Дж., Дейтон, Т. Л., Дэвидсон, С. М., Фиск, Б. П., Хосиос, А. М., Беллинджер, Г. и др. (2013). Специфическая делеция изоформы PKM2 выявляет дифференциальную потребность в пируваткиназе в опухолевых клетках. Ячейка 155, 397–409. DOI: 10.1016 / j.cell.2013.09.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джемаль, А., Брей, Ф., Центр, М. М., Ферли, Дж., Уорд, Э. и Форман, Д. (2011). Глобальная статистика рака. CA Cancer J. Clin. 61, 69–90. DOI: 10.3322 / caac.20107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Китамура К., Хатано Э., Хигаси Т., Нарита М., Сео С., Накамото Ю. и др. (2011). Пролиферативная активность при гепатоцеллюлярной карциноме тесно связана с метаболизмом глюкозы, но не с ангиогенезом. J. Hepatol. 55, 846–857. DOI: 10.1016 / j.jhep.2011.01.038
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Леви Г., Хабиб Н., Гуззарди М. А., Китсберг Д., Бомзе Д., Эзра Э. и др. (2016). Ядерные рецепторы контролируют провирусные и противовирусные метаболические реакции на вирусную инфекцию гепатита С. Nat. Chem. Биол. 12, 1037–1045. DOI: 10.1038 / nchembio.2193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лим, Х. Ю., Сон, И., Дэн, С., Ли, Дж., Юнг, С.Х., Мао, М. и др. (2013). Прогнозирование безрецидивной выживаемости при гепатоцеллюлярной карциноме с помощью профилирования экспрессии генов. Ann. Surg. Онкол. 20, 3747–3753. DOI: 10.1245 / s10434-013-3070-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Llovet, J. M., Ricci, S., Mazzaferro, V., Hilgard, P., Gane, E., Blanc, J. F., et al. (2008). Сорафениб при запущенной гепатоцеллюлярной карциноме. N. Engl. J. Med. 359, 378–390. DOI: 10.1056 / NEJMoa0708857
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Люэдде, Т., Капловиц, Н., Швабе, Р. Ф. (2014). Смерть клеток и ответы на гибель клеток при заболевании печени: механизмы и клиническое значение. Гастроэнтерология 147, 765–783. DOI: 10.1053 / j.gastro.2014.07.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лунт, С. Ю., Вандер Хайден, М. Г. (2011). Аэробный гликолиз: удовлетворение метаболических требований клеточной пролиферации. Annu. Rev. Cell Dev. Биол. 27, 441–464. DOI: 10.1146 / annurev-cellbio-0
-154237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нисикава Т., Белланс, Н., Дамм, А., Бинг, Х., Чжу, З., Ханда, К. и др. (2014). Переключение источника выработки АТФ и потеря способности выполнять гликолиз являются отличительными признаками гепатоцитарной недостаточности, предшествующей заболеванию печени. J. Hepatol. 60, 1203–1211. DOI: 10.1016 / j.jhep.2014.02.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Папа С., Бубичи К., Заззерони Ф. и Франзозо Г. (2009). Механизмы заболевания печени: перекрестная связь между путями NF-kappaB и JNK. Biol. Chem. 390, 965–976. DOI: 10.1515 / BC.2009.111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sung, W. K., Zheng, H., Li, S., Chen, R., Liu, X., Li, Y., et al. (2012). Полногеномное исследование рецидивирующей интеграции HBV в гепатоцеллюлярную карциному. Nat. Genet. 44, 765–769. DOI: 10,1038 / нг.2295
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сас, А. М., Ланцки, А., Надь, А., Ферстер, С., Харк, К., Грин Дж. Э., Буссиутас А. и др. (2016). Перекрестная проверка биомаркеров выживания при раке желудка с использованием транскриптомных данных 1065 пациентов. Oncotarget 7, 49322–49333. DOI: 10.18632 / oncotarget.10337
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Такахаши Н., Чен Х. Ю., Харрис И. С., Стовер Д. Г., Селфорс Л. М., Бронсон Р. Т. и др. (2018). Раковые клетки кооптируют нейрональный окислительно-восстановительный канал TRPA1, чтобы способствовать толерантности к окислительному стрессу. Раковые клетки 33, 985–1003. DOI: 10.1016 / j.ccell.2018.05.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тан З., Ли, К., Кан, Б., Гао, Г., Ли, К., Чжан, З. (2017). GEPIA: веб-сервер для профилирования рака и нормальной экспрессии генов и интерактивного анализа. Nucleic Acids Res. 45, W98 – W102. DOI: 10.1093 / nar / gkx247
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ценг, П. Л., Ву, В. Х., Ху, Т.H., Chen, C.W., Cheng, H.C., Li, C.F. и др. (2018). Снижение уровня сукцинатдегидрогеназы B при гепатоцеллюлярной карциноме человека ускоряет злокачественность опухоли, вызывая эффект Варбурга. Sci. Отчет 8: 3081. DOI: 10.1038 / s41598-018-21361-6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Улаханнан, С. В., Даффи, А. Г., МакНил, Т. С., Киш, Дж. К., Дики, Л. А., Рахма, О. Е. и др. (2014). Более ранняя презентация и применение лечебных методов лечения гепатоцеллюлярной карциномы. Гепатология 60, 1637–1644. DOI: 10.1002 / hep.27288
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Б., Сюй С. Х., Франкель В., Гошал К. и Джейкоб С. Т. (2012). Stat3-опосредованная активация микроРНК-23a подавляет глюконеогенез в гепатоцеллюлярной карциноме путем подавления глюкозо-6-фосфатазы и рецептора, активируемого пролифератором пероксисом, гамма, коактиватора 1 альфа. Гепатология 56, 186–197. DOI: 10.1002 / hep.25632
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вайнберг, Ф., Hamanaka, R., Wheaton, W. W., Weinberg, S., Joseph, J., Lopez, M., et al. (2010). Метаболизм митохондрий и генерация АФК важны для опосредованной Kras онкогенности. Proc. Natl. Акад. Sci. США 107, 8788–8793. DOI: 10.1073 / pnas.1003428107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Визе, Э. К., и Хитосуги, Т. (2018). Передача сигналов тирозинкиназы в метаболизме рака: парадокс PKM2 в эффекте Варбурга. Фронт. Cell Dev. Биол. 6:79. DOI: 10.3389 / fcell.2018.00079
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райт, Т. Л. (1991). Регенерирующие узелки — это предраковые образования? Гепатология 13, 1254–1255. DOI: 10.1016 / 0270-9139 (91)
-W
CrossRef Полный текст | Google Scholar
Wulaningsih, W., Holmberg, L., Garmo, H., Malmstrom, H., Lambe, M., Hammar, N., et al. (2015). Лактатдегидрогеназа сыворотки и выживаемость после диагностики рака. руб. J. Cancer 113, 1389–1396. DOI: 10.1038 / bjc.2015.361
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wurmbach, E., Chen, Y. B., Khitrov, G., Zhang, W., Roayaie, S., Schwartz, M., et al. (2007). Полногеномные молекулярные профили дисплазии, вызванной HCV, и гепатоцеллюлярной карциномы. Гепатология 45, 938–947. DOI: 10.1002 / hep.21622
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Заметка нашего диетолога о гликемическом индексе макаронных изделий
Заметка нашего диетолога о гликемическом индексе макаронных изделий
Паста — это питательный и вкусный компонент сбалансированного питания.Он содержит жизненно важные питательные вещества, является отличным источником энергии и имеет низкий гликемический индекс. Хотя многие люди понимают содержание питательных веществ и энергетические преимущества макаронных изделий, часто возникает некоторая путаница в отношении макарон и гликемического индекса.
Что такое гликемический индекс? Гликемический индекс (ГИ) — это показатель того, насколько быстро углеводсодержащая пища вызывает повышение уровня сахара в крови. Чем выше число, тем быстрее поднимается сахар. Скачки сахара в крови могут привести к перепроизводству инсулина, гормона, который расщепляет сахар в крови в организме, и может привести к быстрому падению энергии, часто снова вызывая чувство голода.Продукты с высоким ГИ обычно оцениваются на уровне 70 или выше. Углеводные продукты с низким ГИ, имеющие уровень 55 или ниже, медленно расщепляются, перевариваются дольше и вызывают только постепенное повышение уровня сахара в крови (при этом вырабатывается меньше инсулина).
Так где же здесь макаронные изделия? Паста имеет гликемический индекс примерно от 50 до 55, что считается низким. Добавьте другие полезные продукты с низким ГИ, такие как брокколи и нут с высоким содержанием клетчатки, и вы обязательно насладитесь отличной едой, которая не только великолепна на вкус, но и оставит вас сытым и удовлетворенным еще долгое время после того, как она будет готова.
На самом деле, сочетание макарон с правильными ингредиентами даже важнее, чем беспокоиться о гликемическом индексе отдельного продукта. Что делает макаронные изделия лучшими партнерами? Такие продукты, как красочные овощи, различные бобовые и другие макаронные изделия, могут не только создавать великолепные блюда, которые понравятся вашей семье, но также заставят вас чувствовать себя хорошо, уменьшив риск вашей семьи заболеть хроническими заболеваниями, такими как сердечные заболевания, рак и т. Д. диабет, сток и высокое кровяное давление. Сочетая макароны с этими другими полезными компонентами, вы можете обеспечить здоровую диету с низким содержанием сахара, высоким содержанием питательных веществ, сытную и вкусную.Для получения дополнительной информации о макаронах и питании посетите нашу страницу о питании: / diet-Nutrition /
.
A бой Diane Welland MS, RD
Дайан Велланд — зарегистрированный диетолог, работающий в Национальной ассоциации макарон. В этой роли Дайан тесно работает над интерпретацией новых исследований и информации о питании, относящейся к индустрии макаронных изделий. Она также работает напрямую с диетологами по множеству вопросов, а также следит за последними исследованиями в области питания.Дайан часто выступает по вопросам питания.
В свободное время Дайан любит готовить, заниматься садоводством и путешествовать по ресторанам для гурманов.
29 ноября 2018 г.
Метаболический скрининг метаболизма раковых клеток
Реферат
1181
Цели
Охарактеризовать метаболические индексы как потенциальные биомаркеры химиорезистентных раковых клеток или раковых стволовых клеток.
Методы
18F-FDG (FDG), 14C-ацетат (ACE) и 3H-глутамин (GLN) или 14C-лейцин (LEU) обеспечивают показатели гликолиза, метаболизма жирных кислот (FA) и аминокислот (AA). % Поглощения радиоактивного индикатора оптимизировали и измеряли в трехкратных клеточных анализах. Для оценки ингибирования EGFR2 лапатинибом были включены линии клеток рака молочной железы EGFR2 +: родительский контроль (BT474), краткосрочное лечение (tBT474 = 24-часовой лапатиниб), резистентный (rBT474 = культивирование> 2 недель в лапатинибе) и высвобожденная резистентность (RrBT474 = культивирование> 2 недели приема лапатиниба с последующей отменой лапатиниба).Также были протестированы метаболические индексы в аналогичным образом обработанных EGRF2 + skBr3.
Результаты
Базовый гликолитический индекс BT474 был умеренным (% поглощения FDG <5%). По сравнению с исходным уровнем,% поглощения FDG ингибировался 24-часовым лапатинибом tBT474 (p = 0,0002), возвращался к исходным уровням после хронического воздействия лапатиниба rBT474 (p = 0,41) и повышался по сравнению с исходным уровнем после отмены лапатиниба RrBT474 (p = 0,002). Индекс FA показал высокий исходный уровень АПФ (13.9 + 2,2%). % поглощения АПФ снизился после лечения tBT474 (6,5 + 0,6; p = 0,004), вернулся к исходному уровню после хронического воздействия rBT474 (10,5 + 2,4%; p = 0,14), но остался на исходном уровне после отмены RrBT474 (13,4 + 1,7%; p = 0,75). Индекс AA LEU показал самый высокий исходный% поглощения BT474 (37,9 + 2,3). НОУ снизился при лечении tBT474 (21,9 + 1,8; p = 0,0007), вернулся к исходному уровню после хронического воздействия rBT474 (41,9 + 3,1%; p = 0,15) и значительно увеличился после отмены RrBT474 (46,5 + 2,7%; p = 0,01). Индекс AA GLN показал результаты, аналогичные результатам для BT474.
Выводы
Все метаболические индексы демонстрируют значительные изменения при воздействии лекарств. Индексы AA показали самый высокий общий исходный уровень поглощения и являются многообещающими альтернативными метаболическими субстратами для выявления острых и хронических эффектов лекарств, включая химиорезистентный рак и раковые стволовые клетки.
Поддержка исследований
Премия Министерства обороны США W81XWH-08-1-051
влияние лечения метформином in vivo на острый и долгосрочный энергетический обмен и продукцию прогестерона in vitro гранулезными клетками женщин с синдромом поликистозных яичников | Репродукция человека
Абстрактные
ВОПРОС ДЛЯ ИССЛЕДОВАНИЯ
Каковы последствия патологии синдрома поликистозных яичников (СПКЯ) и предварительного лечения метформином in vivo у женщин с СПКЯ на метаболизм и продукцию стероидов фолликулярным фенотипом и долгосрочными культивированными гранулезными клетками (ГК) ?
КРАТКИЙ ОТВЕТ
Патология СПКЯ значительно нарушила метаболизм глюкозы и способность синтезировать прогестерон фолликулярными ГК и ГК в длительном культивировании, а метаболическое влияние СПКЯ на функцию ГК было смягчено предварительной обработкой метформином in vivo .
ЧТО УЖЕ ИЗВЕСТНО
Было показано, что клетки гранулезы женщин с СПКЯ нарушают инсулино-стимулированное усвоение глюкозы и выработку лактата in vitro. Однако эти результаты были получены путем помещения ГХ в нефизиологические условия в культуральную среду, содержащую высокие концентрации глюкозы и инсулина. Более того, существующие данные о продукции инсулино-чувствительных стероидов in vitro с помощью ГК PCOS различаются.
ДИЗАЙН, РАЗМЕР И ПРОДОЛЖИТЕЛЬНОСТЬ ИССЛЕДОВАНИЯ
Экспериментальное исследование случай-контроль, сравнивающее поглощение глюкозы, выработку пирувата и лактата и выработку прогестерона in vitro ГХ из трех этиологических групп, все подвергались ЭКО; здоровые контрольные женщины (контроль, n = 12), женщины с СПКЯ, получавшие метформин in vivo (метформин, n = 8) и женщины с СПКЯ, не подвергавшиеся воздействию метформина (СПКЯ, n = 8).Исследование проводилось в течение 3 лет с 2007 по 2010 год.
УЧАСТНИКИ / МАТЕРИАЛЫ, УСЛОВИЯ, МЕТОДЫ
Роттердамские критерии использовались для диагностики СПКЯ; все субъекты были сопоставлены по возрасту, ИМТ и исходному уровню ФСГ. Культивирование отдельных пациентов проводилось с клетками, инкубированными в проверенной физиологической бессывороточной культуральной среде, содержащей дозы 0–6 мМ глюкозы и 0–100 нг / мл инсулина в течение 6 и 144 часов для количественной оценки воздействия лечения на острые и острые состояния. длительный метаболизм, соответственно, и выработка прогестерона.Содержание метаболитов в отработанной среде измеряли с помощью спектрофотометрического анализа на планшет-ридере. Содержание прогестерона в отработанной среде измеряли с помощью иммуноферментного анализа. Количество жизнеспособных GC определяли через 144 часа культивирования с помощью анализа поглощения нейтрального красного красителя.
ОСНОВНЫЕ РЕЗУЛЬТАТЫ И РОЛЬ ШАНСА
Клетки гранулезы женщин с патологией СПКЯ выявили снижение продукции пирувата и преимущественное производство лактата в дополнение к снижению поглощения глюкозы во время культур ( P <0.05). Предварительная обработка метформином облегчила это метаболическое поражение ( P <0,05) и увеличила пролиферацию клеток in vitro ( P <0,05), но клетки сохранили значительно сниженную способность к синтезу прогестерона по сравнению с контролем ( P <0,05).
ОГРАНИЧЕНИЯ, ПРИЧИНЫ ПРЕДОСТЕРЕЖЕНИЯ
Хотя в этой небольшой когорте были обнаружены значительные лечебные эффекты, необходимы дальнейшие исследования для обоснования молекулярных механизмов воздействия метформина на ГК.
РАСШИРЕННОЕ ПРИМЕНЕНИЕ РЕЗУЛЬТАТОВ
Стратегия культивирования отдельных пациентов в сочетании с многофакторным дизайном экспериментов усиливает биологическую интерпретацию данных. В совокупности эти результаты подтверждают мнение о врожденном нарушении биосинтетической способности прогестерона ГК женщин с СПКЯ. Положительный, острый метаболический эффект и отрицательный долгосрочное стероидогенное действие на ГК после воздействия метформина in vivo могут иметь важные последствия для развития фолликулов и лютеинизированной функции ГК при использовании препарата в клинической практике.
ФИНАНСИРОВАНИЕ ИССЛЕДОВАНИЯ / КОНКУРЕНЦИЯ ИНТЕРЕСОВ
Нет конкурирующих интересов. Эта работа была поддержана справочным номером гранта Совета медицинских исследований Великобритании G0800250.
Введение
Синдром поликистозных яичников (СПКЯ) — это состояние первичной овуляторной дисфункции, связанное с метаболическими нарушениями (Wild et al. , 2000; Venkatesan et al. , 2001; Wijeyaratne et al. , 2002; ESHRE / ASRM, 2004 г.). Согласованное определение СПКЯ, принятое Европейским обществом репродукции человека и эмбриологии и Американским обществом репродуктивной медицины (ESHRE / ASRM) (ESHRE / ASRM, 2004), широко используется на практике и требует наличия двух из трех характеристик: олиго / аменорея, клинические или биохимические признаки гиперандрогении и / или ультразвуковые признаки поликистозных яичников.У женщин с СПКЯ может наблюдаться состояние инсулинорезистентности, компенсаторная гиперинсулинемия и нарушенный метаболизм глюкозы в соматических клетках (Book and Dunaif, 1999; Shulman, 2000). Инсулино-опосредованное поглощение глюкозы периферическими тканями снижается на 35–45% у женщин с СПКЯ по сравнению с контрольной группой того же возраста и веса (Dunaif, 1997).
Недавно были обнаружены заметные различия в способах метаболизма энергетических субстратов фолликулярными ГК овцы по сравнению с другими видами (Campbell et al., 2010 г.). Было показано, что глюкоза, метаболизирующаяся в бескислородных условиях до лактата, является предпочтительным энергетическим субстратом, необходимым для поддержки индуцированной гонадотропином дифференцировки овечьих GC in vitro ; фруктоза и пируват, но не галактоза, потреблялись в качестве альтернативных источников энергии. В нормальных яичниках человека установлено, что ГК метаболизируют глюкозу путем гликолиза, что приводит к выработке лактата и пирувата (Billig et al. , 1983; Harlow et al., 1987; Boland et al. , 1993). В то время как полученный таким образом пируват используется ооцитами в качестве источника энергии, лактат либо диффундирует в кровь, либо превращается обратно в пируват (Leese and Lenton, 1990; Boland et al. , 1994). Степень аберрантного метаболизма, присутствующего в GC у женщин с СПКЯ, полностью не исследована (Willis and Franks, 1995; Rice et al. , 2005). Действительно, Purcell et al. продемонстрировал притупление стимулированного инсулином захвата глюкозы in vitro кумулюсными клетками женщин с СПКЯ (Purcell et al., 2012). Предыдущие исследователи также показали, что у женщин с СПКЯ наблюдается нарушение стимулируемого инсулином производства лактата, но при этом сохраняется инсулино-чувствительное производство стероидов фолликулярными ГК (Lin et al. , 1997; Fedorcsak et al. , 2000; Rice ). и др., , 2005). Предыдущие исследования, в которых культивировали ГК в течение 48 часов in vitro , показали, что индуцированное инсулином поглощение глюкозы ГК в ответ на увеличивающиеся дозы инсулина намного ниже в ГК от ановуляторных пациентов с СПКЯ, чем от женщин с нормальными яичниками или овуляторным поликистозом. яичники (Rice et al., 2005). Однако следует проявлять осторожность, поскольку многие из этих результатов были получены при помещении клеток в крайне нефизиологические условия в среде, содержащей сыворотку с высокими концентрациями глюкозы и инсулина.
Хотя инсулин давно признан гормоном утилизации глюкозы (Lieberman and Marks, 2009), его роль в метаболизме и созревании глюкозы в фолликулах плохо изучена у женщин с нормальной функцией яичников, а также у женщин с СПКЯ. Кроме того, в яичниках овец были обнаружены как инсулиннезависимые, так и инсулинозависимые переносчики глюкозы (GLUT), переименованные в SLC2A1 и SLC2A4 соответственно (Campbell et al., 2010 г.). Более того, экспрессия SLC2A1 и 4 in vitro овечьими GC модулировалась дозой глюкозы в среде. Таким образом, существуют другие внутренние механизмы, помимо инсулино-опосредованного, которые могут быть задействованы в транспорте глюкозы с помощью ГК. Однако в тканях, чувствительных к инсулину, инсулин играет ключевую роль в передаче сигналов для мобилизации GLUT на клеточную мембрану, облегчая проникновение глюкозы в клетку (Venkatesan et al. , 2001). Фактором, ограничивающим скорость инсулино-опосредованного поглощения глюкозы, является перенос GLUT на плазматическую мембрану (Girard et al., 1992; Таката, 1996; Scheepers et al. , 2004). Фосфорилирование тирозина рецептора инсулина (IR) активирует весь инсулиновый каскад и приводит к поглощению глюкозы клетками (Dunaif, 2006). Альтернативно, фосфорилирование серина IR может ингибировать каскад инсулина (Book and Dunaif, 1999). Несмотря на то, что существует несогласованность в отношении того, какой компонент инсулино-опосредованного гликолитического пути затрагивается в ГК у женщин с СПКЯ, чрезмерное фосфорилирование серина объясняется постсвязывающим дефектом и инсулинорезистентностью, наблюдаемыми у этих женщин (Prelevic, 1997; Shulman, 2000; Порецкий и др., 2001; Seto-Young et al. , 2003).
Поскольку инсулинорезистентность и гиперинсулинемия играют центральную роль в патогенезе СПКЯ, естественно ожидать, что сенсибилизаторы к инсулину будут полезны при лечении этого состояния (Pasquali and Gambineri, 2009). Метформин, сенсибилизатор к инсулину, является пероральным антигипергликемическим препаратом первой линии, используемым при лечении сахарного диабета 2 типа. У пациентов с диабетом 2 типа, принимающих инсулин, добавление метформина улучшает чувствительность к инсулину и гликемический контроль, позволяя снизить суточную дозу инсулина (Cusi and DeFronzo, 1998).Один только метформин снижает концентрацию глюкозы в плазме натощак до 4–4,5 мМ и HbA1c на 1,5–2,0% у пациентов с сахарным диабетом 2 типа. Кроме того, сообщалось, что метформин снижает окисление липидов и уровни свободных жирных кислот в плазме, тем самым улучшая профиль риска сердечно-сосудистых заболеваний у пациентов с диабетом 2 типа. В Проспективном исследовании диабета в Великобритании лечение метформином показало значительное снижение смертности от диабета, сердечных приступов и инсультов (Wright et al. , 1998).
Метформин метаболическое действие на клетки включает увеличение чувствительности к инсулину чувствительных тканей, числа ИР и сродства в скелетных мышцах и жировых клетках, превращение глюкозы в лактат эритроцитами, активность тирозинкиназы и поглощение глюкозы (Cusi and DeFronzo, 1998; Musi и др. , 2002). И наоборот, метформин приводит к снижению абсорбции глюкозы кишечником, уровням глюкагона в плазме, глюконеогенезу и гликогенолизу в печени (Sarabia et al., 1992; Santos et al. , 1997; Куси и ДеФронцо, 1998; Wiernsperger и Bailey, 1999; Musi et al. , 2002).
Химически метформин принадлежит к группе соединений бигуанидов и состоит из N , N -диметилимидодикарбонимид гидрохлорида диамида, как указано ниже.
Метформин имеет абсолютную пероральную биодоступность 40–60% в течение 6 часов после приема внутрь и период полувыведения 4,0–8,7 часа (Robert et al. , 2003). Общая суточная терапевтическая доза метформина может составлять 0.Обычно 5–3 г разделяют на 2 или 3 приема (Scheen, 1996). Он не связан с каким-либо белком, и не было обнаружено метаболитов, циркулирующих в кровотоке (Scheen, 1996). Побочные эффекты метформина в основном ограничиваются желудочно-кишечным трактом, например дискомфорт в животе и диарея (Stadtmauer et al. , 2001; Tang et al. , 2006a, b). Лактоацидоз встречается редко, с частотой 3 случая на 100 000 пациенто-лет терапии, в основном у пациентов с нарушением функции почек (Wiholm and Myrhed, 1993).
Ключевым нарушением у женщин с СПКЯ является чрезмерное производство андрогенов яичниками и, как следствие, чрезмерное производство эстрогенов ГК. Хотя улучшение концентрации андрогенов в циркулирующей и фолликулярной среде у женщин с СПКЯ, получавших метформин, может оказывать косвенное положительное влияние на развивающиеся ооциты (Moghetti et al. , 2000; Palomba et al. , 2010), любое прямое влияние метформина на метаболизм глюкозы глюкозы еще предстоит идентифицировать.Недавно свиньи GCs, культивированные in vitro в течение 24 часов в присутствии метформина и инсулина, продемонстрировали усиленную экспрессию мРНК субстрата-1 рецептора инсулина (IRS-1) и рецептора инсулиноподобного фактора роста-1 (IGF-1R), что позволяет предположить что метформин может изменять метаболическую емкость яичниковых ГК (Lee et al. , 2012). В яичнике в более ранних сообщениях также были охарактеризованы различные субъединицы AMP-активируемой протеинкиназы (AMPK) в GC, theca-клетках, ооцитах и желтых телах коров (Fryer et al., 2002). Было показано, что метформин активирует каскад AMPK, который, в свою очередь, принимает участие в транспорте глюкозы в мышечные клетки (Fryer et al. , 2002). Действительно, было показано, что воздействие метформина приводит к увеличению активности тирозинкиназы и транспорта 2-дезоксиглюкозы дозозависимым образом в гладкомышечных клетках гладких сосудов крыс, что предполагает повышенную чувствительность к инсулину и IGF-1 (Dominguez et al. ). , 1996).
Таким образом, цель этого исследования заключалась в изучении способности поглощения и использования глюкозы человеческими ГК у здоровых женщин и женщин с СПКЯ с или без предварительного лечения in vivo метформином с целью понимания последствий патологии СПКЯ. на метаболизм энергетических ресурсов, доступных ооциту во время его развития в фолликуле.Для этого было проведено количественное определение поглощения глюкозы, а также продукции пирувата и лактата GC в течение длительного периода времени и после длительного культивирования. Острые показатели метаболизма GC и продукции прогестерона через 6 часов после извлечения ооцитов (OR) отражают функциональную способность GC фолликулярного фенотипа во время сбора ооцитов. Напротив, метаболические и стероидные измерения, сделанные после длительного культивирования, отражают присущую GC способность адаптироваться и реагировать на определенные среды глюкозы и инсулина in vitro .Культуры были получены из GC, собранных у отдельных пациентов, чтобы облегчить прямое сравнение метаболизма GC in vitro с метаболитами фолликулярной жидкости плазмы у того же пациента.
Материалы и методы
Этическое одобрение
Йоркский комитет по этике исследований одобрил протокол исследования. Справочный номер: 06 / Q1108 / 76. Письменное информированное согласие было получено от всех участников.
Пациенты
В исследуемую популяцию входили три этиологические подгруппы, а именно: женщины с нормальными яичниками (контроль n = 12), женщины с СПКЯ, не получавшие метформин во время лечения ЭКО / ИКСИ (СПКЯ n = 8), и женщины с СПКЯ, получавшие лечение. с метформином во время лечения ЭКО / ИКСИ (метформин n = 8).В каждой этиологической группе количество субъектов, выполнивших различные компоненты исследования GC, варьировалось. Соответствующие значения n приведены в соответствующих таблицах и графиках.
Женщины в возрасте 20–39 лет с нормальной концентрацией ФСГ в сыворотке крови (1–8 МЕ / л), посещающие отделения вспомогательного оплодотворения в больнице общего профиля Лидса и больнице Сент-Джеймсского университета, были привлечены для передачи своих ГХ для исследования. Те женщины, которые соответствовали Роттердамским критериям (ESHRE / ASRM, 2004), были классифицированы как имеющие СПКЯ.Перед приемом метформина у женщин с СПКЯ проводились полный анализ крови и функциональные пробы печени. Женщины с ИМТ> 30 кг / м 2 также прошли тест на толерантность к глюкозе и липидный профиль натощак (Wijeyaratne et al. , 2002). Женщины с нарушенной толерантностью к глюкозе и диабетом были исключены из исследования.
Участники исследования получили длительный протокол лечения ЭКО с использованием агонистов. Нафарелин ацетат (200 мкг три раза в день, Pharmacia, Милтон-Кейнс, Великобритания), бусерелин (0.5 мг в день, Pharmacia, Milton Keynes, UK) или лейпролина ацетат (разовая доза Prostap 3,75 мг, Wyeth Laboratories, Hants, UK) использовали для подавления гипофиза. Контролируемая гиперстимуляция яичников была достигнута после доставки с мочой или рекомбинантного ФСГ. Ни один из участников не получил протокол смешанной стимуляции. Для женщин, получавших метформин, лечение начинали с дозы 850 мг два раза в день со дня начала снижения регуляции агонистом GnRH и продолжали до дня OR.Фолликулярный ответ считался удовлетворительным для адекватного выхода ГК, когда на трансвагинальном ультразвуковом сканировании присутствовало не менее 10 фолликулов диаметром не менее 13 мм в последний день стимуляции, из которых не менее 3 фолликулов были ≥17 мм. в диаметре. Овуляция была вызвана у всех субъектов из трех групп инъекцией 5000–10 000 МЕ одного и того же препарата ХГЧ (прегнил, Органон, Велвин Гарден Сити, Хертс, Великобритания), а трансвагинальное извлечение ооцитов было выполнено через 34–36 часов.В день операции были взяты образцы периферической крови для оценки концентрации глюкозы в сыворотке крови и инсулина натощак. Во время трансвагинальной операции чистый образец фолликулярной жидкости был взят из одного или обоих яичников. Клеточные контаминанты удаляли центрифугированием при 900 g в течение 10 минут перед хранением супернатанта при -80 ° C для последующего анализа. После извлечения ооцитов остаточные GC в фолликулярных аспиратах отдельных пациентов обрабатывали для культивирования.
Сбор и культивирование клеток Granulosa
Реагенты были приобретены у Sigma-Aldrich Company Ltd, (Дорсет, Великобритания), если не указано иное.Модифицированная среда МакКоя 5A (SAFC Biosciences, Хэмпшир, Великобритания) без глюкозы и глутамина была использована в качестве базовой среды для подготовки и культивирования ГХ. В среду добавляли l-глутамин (210 мг / л), 0,1% сывороточный альбумин человека (CAF-DCF cvba-scrl, Брюссель, Бельгия), пенициллин-G / стрептомицин (100 МЕ / мл / 100 мкг / мл), HEPES. , человеческий трансферрин (5 мкг / мл), селен селенит натрия (5 нг / мл), Long R3 IGF-I (100 нг / мл), рекомбинантный ФСГ (0,5 мЕ / мл) (Gonal-F: Merck-Serono, UK ) и рекомбинантный ХГЧ (0.05 мЕд / мл) (Овитрелл: Merck-Serono, Великобритания). Все среды были предварительно уравновешены до 37 ° C и 5% CO 2 на воздухе в увлажненном инкубаторе.
Фолликулярные аспираты от отдельных пациентов центрифугировали при 900 g при комнатной температуре. Загрязнения крови удаляли из ГХ центрифугированием в градиенте Histopaque 1700 при 900 g при комнатной температуре. Осадок GC ресуспендировали в объеме 20 мл среды и промывали дополнительным 10-минутным центрифугированием. Осадок ГХ ресуспендировали в 1 мл подготовительной среды ГХ, содержащей 0.02% (мас. / Об.) ЭДТА и осторожное повторное пипетирование проводили для разрушения клеточных скоплений. После дополнительной промывки клеточный сток, наконец, ресуспендировали в 1 мл культуральной среды для ГХ.
Число жизнеспособных GC подсчитывали путем исключения красителя трипанового синего (Picton et al. , 1999), и клетки высевали при концентрации 1 × 10 5 жизнеспособных клеток на лунку в 250 мкл культуральной среды McCoy 5A, которая имела дополнительно добавлялись различные дозы инсулина (0, 0,01, 0,1, 1, 10 и 100 нг / мл) и глюкозы (0, 3 и 6 мМ).Клетки культивировали в 96-луночных планшетах для культивирования с плоским дном Nunc (NUNC, Scientific Laboratory Supplies, Wilford, Nottingham, UK) при 37 ° C и 5% CO 2 в увлажненном инкубаторе. Каждую терапию глюкозой / инсулином тестировали в трех экземплярах для каждого пациента. В физиологических, бессывороточных условиях культивирования, используемых в настоящих экспериментах, GC не прикреплялись к пластиковому матрице культуральной чашки и не образовывали уплощенных фибробластных монослоев, которые типичны для культуры на основе сыворотки и / или внеклеточного матрикса. системы.В условиях культивирования, описанных здесь, GC образовывали дискретные, свободно плавающие, трехмерные скопления округлых клеток, которые были резонансными фолликулярному фенотипу GCs, наблюдаемых in vivo . Эти неприлипающие культуры GC не достигли слияния in vitro .
Для оценки острого метаболизма GC, отражающего фолликулярную среду, использованные культуральные среды собирали через 6 часов инкубации путем удаления и замены 140 мкл среды. После этого культуральную среду обновляли через 48, 96 и 144 часа, удаляя и заменяя 150, 200 и 150 мкл среды соответственно.6-часовое время инкубации, используемое для количественной оценки острого фолликулярного метаболизма GC во время OR, было основано на результате серии из 10 повторных, отдельных проверочных культур пациентов и отражало минимальное время, необходимое для точной количественной оценки обмена всех трех метаболитов с помощью 1 × 10 5 жизнеспособных GC in vitro . В долгосрочных исследованиях культивирования промежуточные временные точки смены среды и общая продолжительность культивирования (144 часа) были тщательно проверены для одной и той же системы культивирования с использованием ГХ овец, свиней и крупного рогатого скота, и было показано, что они обеспечивают точные временные точки для измерение стероидогенеза и метаболизма с помощью GC в ответ на определенные условия культивирования in vitro (Campbell et al., 1996; Пиктон и др. , 1999). Отработанные среды хранили при –80 ° C для анализа обмена глюкозы, пирувата и лактата, а также продукции прогестерона. Через 144 часа культивирования количество GC и жизнеспособность оценивали путем измерения поглощения жизненно важного красителя, нейтрального красного (Campbell и др. , 1996; Picton и др. , 1999).
Ожидается, что соотношение гликолитического индекса будет 2: 1, когда глюкоза полностью метаболизируется кислороднезависимым гликолизом до конечного конечного продукта — лактата через пируват (Harris et al., 2007). Более низкое соотношение указывает на снижение образования лактата, тогда как более высокое соотношение указывает на продукцию лактата из дополнительных источников, таких как внутриклеточный гликоген, в дополнение к кислородно-независимому гликолизу экзогенной глюкозы, поступающей в клетки.
Анализы глюкозы и инсулина в сыворотке и фолликулярной жидкости
Анализы на глюкозу и инсулин в сыворотке и фолликулярной жидкости проводились в лаборатории клинической биохимии больницы общего профиля Лидса.Уровень глюкозы в сыворотке и фолликулярной жидкости измерялся методом глюкозооксидазы с использованием систем ADVIA (Siemens Healthcare Diagnostics, Inc., Camberley, UK), предназначенных для оценки в сыворотке, плазме, моче и других жидкостях организма человека. Аналитический диапазон 0–41,6 ммоль / л. Все анализы были выполнены в соответствии с инструкциями производителя. Глюкозу измеряли после ферментативного окисления в присутствии глюкозооксидазы. Регулярный контроль качества (КК), как внутренний, так и внешний, проводился в соответствии с лабораторными стандартами качества.Коэффициент вариации между партиями (CV) составлял <5%.
Концентрации инсулина в сыворотке измеряли иммунохемилюминометрическим анализом с использованием инсулина ADVIA Centaur Insulin (Siemens Healthcare Diagnostics), предназначенного для измерения инсулина в сыворотке и плазме. Результаты были представлены в мЕд / л и преобразованы в нг / мл для представления. Инсулинорезистентность рассчитывалась с использованием метода количественного индекса проверки чувствительности к инсулину (QUICKI = 1 / ((log (инсулин натощак, мкЕ / мл) + log (глюкоза натощак, мг / дл))) (Mather et al., 2001).
Для подтверждения измерения инсулина в фолликулярной жидкости стандарты инсулина были приготовлены с использованием рекомбинантного человеческого инсулина, 3 МЕ / флакон (Национальный институт биологических стандартов и контроля (NIBSC), 1-й международный эталонный препарат 66/304). Извлечение инсулина из разбавленной фолликулярной жидкости проверялось трижды и составляло от 81 до 98%. Восстановление экзогенного инсулина было подтверждено добавлением 10 мкл исходного инсулина с известной концентрацией инсулина к 1 мл фолликулярной жидкости с последующим серийным разведением, и степень восстановления варьировала от 91 до 118%.После валидации анализы выполняли в соответствии со справочным руководством ADVIA Centaur. Все образцы фолликулярной жидкости были проанализированы за одну серию. CV внутри анализа составляли 3, 5 и 4% при низкой (18,6–27,9 пмоль / л), средней (69,6–86,6 пмоль / л) и высокой (203,1–252,1 пмоль / л) концентрациях инсулина-QC соответственно.
Анализ метаболизма ГХ
Метаболиты
измеряли с использованием ферментно-связанных спектрофотометрических / флуориметрических анализов на 96-луночном планшете-ридере (планшет-ридер Biolinx MRX, Dynatech Laboratories, Сан-Диего, Калифорния, США).Концентрации метаболитов, измеренные в отработанной среде в каждый момент времени, использовали для расчета скорости метаболизма жизнеспособных клеток на лунку после 144 часов культивирования с учетом любого переноса метаболитов во время смены среды в промежуточные моменты времени. Изменения цвета для каждого метаболита были пропорциональны количеству глюкозы, пирувата и лактата в отработанной среде. Лактат измеряли путем мониторинга увеличения флуоресценции из-за превращения НАД в НАДН; пируват за счет снижения флуоресценции за счет окисления НАДН; и глюкоза за счет увеличения флуоресценции из-за образования НАДФН из НАДФ (Hugentobler et al., 2008 г.). Чувствительность анализа составляла 0–10 мМ для глюкозы / лактата и 0–2 мМ для пирувата. Время реакции анализа составляло 10, 30 и 5 мин для глюкозы, лактата и пирувата соответственно. Каждый анализ метаболизма включал бесклеточные контрольные культуры и контрольные образцы для контроля качества с добавлением известных концентраций метаболитов (низкой и высокой концентрации в пределах диапазона чувствительности). CV внутри и между анализами составляли <10% для всех метаболитов, за исключением анализов на пируват в острой культуре, где CV составлял <20%.
Анализы на прогестерон
Измерения прогестерона проводились с использованием иммуноферментного анализа в лаборатории отделения акушерства и гинекологии Школы клинических наук Медицинского центра Квинса Ноттингемского университета. Анализы выполняли с использованием антитела к прогестерону (SAPU R7044X), ранее одобренного для радиоиммуноанализа (Campbell et al. , 1998), в комбинации с конъюгатом прогестерон-3-пероксидаза хрена, полученным от Abiox plc (Newberg OR, США).Предел обнаружения составлял <39 пг / мл, а CV внутри анализа и между анализами составляли 5 и 11% соответственно. Скорость продуцирования прогестерона на клетку в час рассчитывали из концентраций прогестерона, измеренных после поправки на эффекты переноса во время смены среды.
Статистический анализ
Все данные о продукции / потреблении метаболитов и гормонов были выражены в час на 1 × 10 5 жизнеспособных ГК. Категориальные данные демографических данных пациентов перед анализом были преобразованы в проценты.Тест хи-квадрат использовался для исследования различий между категориальными переменными, такими как частота оплодотворения и частота наступления беременности. Данные метаболитов и стероидов из всех трех групп были нормализованы логарифмическим преобразованием (логарифм 10 ( x + 1)). Данные о количестве жизнеспособных клеток после 144 ч культивирования были преобразованы в журнал перед анализом. Многофакторный дисперсионный анализ (ANOVA) был использован для проверки влияния обработки культур на клеточный метаболизм; Тест Bonferroni post hoc использовался для проверки разницы между средними значениями.Однофакторно-повторяющийся анализ ANOVA проводили для определения влияния концентраций инсулина и глюкозы на культивируемые GC между 6 и 144 часами культивирования. Во всех случаях статистически значимым считалось P <0,05. Для анализа данных надлежащим образом использовались статистические пакеты STATA 10.2 и SYSTAT 15. Гликолитический индекс рассчитывали как отношение количества молей лактата, полученного из одного моля потребленной глюкозы.
Результаты
Демографические данные пациента
Субъекты из всех трех групп были сопоставлены по возрасту, продолжительности бесплодия, ИМТ и исходному уровню ФСГ в сыворотке (Таблица I).Все группы пациентов получали сопоставимую общую дозу ФСГ в течение аналогичного периода времени для контролируемой гиперстимуляции яичников. Число зрелых ооцитов на пациента было ниже в группе с СПКЯ, чем в контрольной, и разница только что достигла значимости ( P = 0,046). Частота оплодотворения на ооцит в метафазе II, частота положительных беременностей и частота клинических беременностей были одинаковыми во всех трех группах.
Таблица I
Демография участников исследований метаболизма гранулезных клеток.
| Клинические данные . |
Контроль ( n = 12) . |
СПКЯ ( n = 8) . |
Метформин ( n = 8) . |
Значение . |
|||||
|---|---|---|---|---|---|---|---|---|---|
| Возраст (лет) | 34,4 ± 1,4 | 31,5 ± 1,2 | 34,4 ± 1,3 | нс | |||||
| Продолжительность бесплодия (лет) | 3.2 ± 0,7 | 4,1 ± 0,8 | 3,4 ± 0,7 | нс | |||||
| ИМТ (кг / м 2 ) | 25,5 ± 1,6 | 26,0 ± 1,9 | 29,8 ± 1,5 | Сывороточный ФСГ (МЕ / л) | 6,8 ± 0,6 | 5,5 ± 0,5 | 5,7 ± 0,5 | нс | |
| Всего дней стимуляции | 10,2 ± 0,2 | 12,4 ± 0,9 | нс | ||||||
| Общая доза экзогенного ФСГ МЕ | 2405 ± 264 | 2692 ± 382 | 1885 ± 303 | нс | |||||
| Общее количество сформировавшихся фолликулов | 23.3 ± 2,0 | 31,1 ± 3,0 | 23,8 ± 4,0 | нс | |||||
| Число ооцитов MII / пациент | 16,3 ± 2,0 | 12,4 ± 2,8 | 11,1 ± 1,0 | СПКЯ по сравнению с контролем 9018 908 = 0,046 Другие — нс | |||||
| Частота оплодотворения / MII ооцит | 67 ± 0,2% | 67 ± 0,2% | 60 ± 0,2% | нс | |||||
| Частота положительных беременностей за начатый цикл | 50% | 75% | 63% | нс | |||||
| Частота клинической беременности на начало цикла | 50% | 57% | 44% | нс |
| Клинические данные . |
Контроль ( n = 12) . |
СПКЯ ( n = 8) . |
Метформин ( n = 8) . |
Значение . |
|---|---|---|---|---|
| Возраст (лет) | 34,4 ± 1,4 | 31,5 ± 1,2 | 34,4 ± 1,3 | нс |
| Продолжительность бесплодия (лет) | 3,2 ± 0,7 | 3,2 ± 0,7 ± 0,8 3.4 ± 0,7 | нс | |
| ИМТ (кг / м 2 ) | 25,5 ± 1,6 | 26,0 ± 1,9 | 29,8 ± 1,5 | нс |
| Сыворотка ФСГ12 (МЕ / л) | 6,8 ± 0,6 | 5,5 ± 0,5 | 5,7 ± 0,5 | нс |
| Всего дней стимуляции | 10,2 ± 0,2 | 12,4 ± 0,9 | 10,4 ± 0,5 | нс |
| 2405 ± 264 | 2692 ± 382 | 1885 ± 303 | нс | |
| Общее количество сформировавшихся фолликулов | 23.3 ± 2,0 | 31,1 ± 3,0 | 23,8 ± 4,0 | нс |
| Число ооцитов MII / пациент | 16,3 ± 2,0 | 12,4 ± 2,8 | 11,1 ± 1,0 | СПКЯ по сравнению с контролем 9018 908 = 0,046 Другие — нс |
| Частота оплодотворения / MII ооцит | 67 ± 0,2% | 67 ± 0,2% | 60 ± 0,2% | нс |
| Частота положительных беременностей за начатый цикл | 50% | 75% | 63% | ns |
| Частота клинических беременностей на начало цикла | 50% | 57% | 44% | ns |
Таблица I
Демография клеток исследования метаболизма.
| Клинические данные . |
Контроль ( n = 12) . |
СПКЯ ( n = 8) . |
Метформин ( n = 8) . |
Значение . |
|||||
|---|---|---|---|---|---|---|---|---|---|
| Возраст (лет) | 34,4 ± 1,4 | 31,5 ± 1,2 | 34,4 ± 1,3 | нс | |||||
| Продолжительность бесплодия (лет) | 3.2 ± 0,7 | 4,1 ± 0,8 | 3,4 ± 0,7 | нс | |||||
| ИМТ (кг / м 2 ) | 25,5 ± 1,6 | 26,0 ± 1,9 | 29,8 ± 1,5 | Сывороточный ФСГ (МЕ / л) | 6,8 ± 0,6 | 5,5 ± 0,5 | 5,7 ± 0,5 | нс | |
| Всего дней стимуляции | 10,2 ± 0,2 | 12,4 ± 0,9 | нс | ||||||
| Общая доза экзогенного ФСГ МЕ | 2405 ± 264 | 2692 ± 382 | 1885 ± 303 | нс | |||||
| Общее количество сформировавшихся фолликулов | 23.3 ± 2,0 | 31,1 ± 3,0 | 23,8 ± 4,0 | нс | |||||
| Число ооцитов MII / пациент | 16,3 ± 2,0 | 12,4 ± 2,8 | 11,1 ± 1,0 | СПКЯ по сравнению с контролем 9018 908 = 0,046 Другие — нс | |||||
| Частота оплодотворения / MII ооцит | 67 ± 0,2% | 67 ± 0,2% | 60 ± 0,2% | нс | |||||
| Частота положительных беременностей за начатый цикл | 50% | 75% | 63% | нс | |||||
| Частота клинической беременности на начало цикла | 50% | 57% | 44% | нс |
| Клинические данные . |
Контроль ( n = 12) . |
СПКЯ ( n = 8) . |
Метформин ( n = 8) . |
Значение . |
|---|---|---|---|---|
| Возраст (лет) | 34,4 ± 1,4 | 31,5 ± 1,2 | 34,4 ± 1,3 | нс |
| Продолжительность бесплодия (лет) | 3,2 ± 0,7 | 3,2 ± 0,7 ± 0,8 3.4 ± 0,7 | нс | |
| ИМТ (кг / м 2 ) | 25,5 ± 1,6 | 26,0 ± 1,9 | 29,8 ± 1,5 | нс |
| Сыворотка ФСГ12 (МЕ / л) | 6,8 ± 0,6 | 5,5 ± 0,5 | 5,7 ± 0,5 | нс |
| Всего дней стимуляции | 10,2 ± 0,2 | 12,4 ± 0,9 | 10,4 ± 0,5 | нс |
| 2405 ± 264 | 2692 ± 382 | 1885 ± 303 | нс | |
| Общее количество сформировавшихся фолликулов | 23.3 ± 2,0 | 31,1 ± 3,0 | 23,8 ± 4,0 | нс |
| Число ооцитов MII на пациента | 16,3 ± 2,0 | 12,4 ± 2,8 | 11,1 ± 1,0 | PCOS по сравнению с контролем 9018 908 = 0,046 Другие — нс |
| Частота оплодотворения / MII ооцит | 67 ± 0,2% | 67 ± 0,2% | 60 ± 0,2% | нс |
| Частота положительных беременностей за начатый цикл | 50% | 75% | 63% | нс |
| Частота клинической беременности на начало цикла | 50% | 57% | 44% | нс |
Разницы в средних концентрациях сыворотки натощак не выявлено. индекса глюкозы, инсулина или инсулинорезистентности между тремя группами лечения (Таблица II).Точно так же не было значительных различий в средних концентрациях глюкозы в фолликулярной жидкости и инсулина между тремя группами, а также не было статистически значимой взаимосвязи между сывороткой и глюкозой фолликулярной жидкости и инсулином.
Таблица II
Сравнение биохимических показателей между тремя группами.
| . | Тип образца . |
Контроль . |
СПКЯ . |
метформин . |
Значение . |
|---|---|---|---|---|---|
| Глюкоза натощак (мМ) | Сыворотка | 4,5 ± 0,1 ( n = 9) | 4,2 ± 0,1 ( n = 8) | 4,5 ± 0,3 ( n = 8) | нс |
| Инсулин натощак (нг / мл) | Сыворотка | 0,2 ± 0,1 ( n = 9) | 0,4 ± 0,1 ( n = 8) | 0.3 ± 0,1 ( n = 8) | нс |
| Индекс инсулинорезистентности QUICKI | Сыворотка | 0,41 ± 0,1 ( n = 9) | 0,4 ± 0,3 ( n = 8) | 0,4 ± 0,2 ( n = 8) | нс |
| Глюкоза (мМ) | Фолликулярная жидкость | 2,7 ± 0,9 ( n = 4) | 3,2 ± 0,2 ( n = 5) | 3,3 ± 0,5 ( n = 6) | нс |
| Инсулин (нг / мл) | Фолликулярная жидкость | 50 ± 21 ( n = 4) | 14 ± 10 ( n = 5) | 41 ± 9 ( n = 6) | нс |
| . | Тип образца . |
Контроль . |
СПКЯ . |
метформин . |
Значение . |
|---|---|---|---|---|---|
| Глюкоза натощак (мМ) | Сыворотка | 4,5 ± 0,1 ( n = 9) | 4,2 ± 0,1 ( n = 8) | 4,5 ± 0,3 ( n = 8) | нс |
| Инсулин натощак (нг / мл) | Сыворотка | 0.2 ± 0,1 ( n = 9) | 0,4 ± 0,1 ( n = 8) | 0,3 ± 0,1 ( n = 8) | нс |
| Индекс инсулинорезистентности QUICKI | Сыворотка | 0,41 ± 0,1 ( n = 9) | 0,4 ± 0,3 ( n = 8) | 0,4 ± 0,2 ( n = 8) | нс |
| Глюкоза (мМ) | Фолликулярная жидкость | 2,7 ± 0,9 ( n = 4) | 3.2 ± 0,2 ( n = 5) | 3,3 ± 0,5 ( n = 6) | нс |
| Инсулин (нг / мл) | Фолликулярная жидкость | 50 ± 21 ( n = 4 ) | 14 ± 10 ( n = 5) | 41 ± 9 ( n = 6) | нс |
Таблица II
Сравнение биохимических параметров между тремя группами.
| . | Тип образца . |
Контроль . |
СПКЯ . |
метформин . |
Значение . |
|---|---|---|---|---|---|
| Глюкоза натощак (мМ) | Сыворотка | 4,5 ± 0,1 ( n = 9) | 4,2 ± 0,1 ( n = 8) | 4,5 ± 0,3 ( n = 8) | нс |
| Инсулин натощак (нг / мл) | Сыворотка | 0,2 ± 0.1 ( n = 9) | 0,4 ± 0,1 ( n = 8) | 0,3 ± 0,1 ( n = 8) | нс |
| Индекс инсулинорезистентности QUICKI | Сыворотка | 0,41 ± 0,1 ( n = 9) | 0,4 ± 0,3 ( n = 8) | 0,4 ± 0,2 ( n = 8) | нс |
| Глюкоза (мМ) | Фолликулярная жидкость | 2,7 ± 0,9 ( n = 4) | 3.2 ± 0,2 ( n = 5) | 3,3 ± 0,5 ( n = 6) | нс |
| Инсулин (нг / мл) | Фолликулярная жидкость | 50 ± 21 ( n = 4 ) | 14 ± 10 ( n = 5) | 41 ± 9 ( n = 6) | нс |
| . | Тип образца . |
Контроль . |
СПКЯ . |
метформин . |
Значение . |
|---|---|---|---|---|---|
| Глюкоза натощак (мМ) | Сыворотка | 4,5 ± 0,1 ( n = 9) | 4,2 ± 0,1 ( n = 8) | 4,5 ± 0,3 ( n = 8) | нс |
| Инсулин натощак (нг / мл) | Сыворотка | 0,2 ± 0,1 ( n = 9) | 0,4 ± 0,1 ( n = 8) | 0.3 ± 0,1 ( n = 8) | нс |
| Индекс инсулинорезистентности QUICKI | Сыворотка | 0,41 ± 0,1 ( n = 9) | 0,4 ± 0,3 ( n = 8) | 0,4 ± 0,2 ( n = 8) | нс |
| Глюкоза (мМ) | Фолликулярная жидкость | 2,7 ± 0,9 ( n = 4) | 3,2 ± 0,2 ( n = 5) | 3,3 ± 0,5 ( n = 6) | нс |
| Инсулин (нг / мл) | Фолликулярная жидкость | 50 ± 21 ( n = 4) | 14 ± 10 ( n = 5) | 41 ± 9 ( n = 6) | нс |
Острый метаболизм GC
Влияние этиологии на метаболизм клеток острой гранулезы
Не было очевидного влияния концентрации инсулина в культуральной среде на острое потребление глюкозы или продукцию пирувата и лактата, что оправдывает объединение всех результатов для различных доз инсулина.Однако наблюдалось значительное влияние этиологии пациента на острое (6 ч) потребление глюкозы ГК, а также продукцию пирувата и лактата ( P <0,001, рис. 1A). В целом, потребление глюкозы и продукция пирувата ГК у женщин с СПКЯ были значительно ( P <0,05) ниже, чем у контрольной группы. И наоборот, ГК от женщин с СПКЯ, не подвергавшихся воздействию метформина in vivo , продуцировали значительно ( P <0,05) больше лактата, чем контрольные ГК. Предварительная обработка метформином in vivo , по-видимому, «нормализует» гликолитический путь ГК за счет увеличения их острой продукции пирувата и снижения их средней продукции лактата.Однако продукция лактата ГК, предварительно обработанными метформином, по-прежнему оставалась значительно ( P <0,05) выше, чем у контрольных ГК (рис. 1А).
Рисунок 1
Влияние этиологии ( A ) и этиологии и взаимодействия глюкозы ( B ) на острое потребление глюкозы, продукцию пирувата и лактата гранулезными клетками (ГК) через 6 часов культивирования. Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов.Данные были стандартизированы в соответствии с количеством нанесенных на планшет жизнеспособных клеток. Различные буквы на графиках в (A) указывают на значительные различия между тремя этиологическими группами, протестированными для каждого метаболита ( P <0,05). Различные буквы на графиках в (B) указывают на значительные различия ( P <0,05) между тремя этиологическими группами в пределах каждой дозы глюкозы.
Рисунок 1
Влияние этиологии ( A ) и этиологии и взаимодействия глюкозы ( B ) на острое потребление глюкозы, продукцию пирувата и лактата гранулезными клетками (ГК) через 6 часов культивирования.Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов. Данные были стандартизированы в соответствии с количеством нанесенных на планшет жизнеспособных клеток. Различные буквы на графиках в (A) указывают на значительные различия между тремя этиологическими группами, протестированными для каждого метаболита ( P <0,05). Различные буквы на графиках в (B) указывают на значительные различия ( P <0,05) между тремя этиологическими группами в пределах каждой дозы глюкозы.
Влияние концентрации глюкозы на острый метаболизм ГК
Наблюдался значительный ( P <0,05) эффект концентрации глюкозы в культуральной среде на острое потребление глюкозы, выработку пирувата и лактата человеческими GC in vitro . Как и ожидалось, потребление глюкозы было незначительным в клетках, культивируемых в среде без глюкозы, но не было никакой разницы в поглощении глюкозы между клетками, инкубированными в 3 и 6 мМ глюкозе. Клетки, лишенные глюкозы, продуцировали мало пирувата in vitro , но когда глюкоза была доступна в среде, наблюдалось значительное ( P <0.001) дозозависимое снижение общей продукции пирувата; 3,5 ± 0,1 нмоль / л / ч / 1 × 10 5 жизнеспособных ГХ при 3 мМ глюкозы по сравнению с 2,5 ± 0,1 нмоль / л / ч / 1 × 10 5 жизнеспособных ГХ при 6 мМ глюкозы в среде. Продукция лактата была ограничена (2,8 ± 0,2 нмоль / л / ч / 1 × 10 5 жизнеспособных ГК) в отсутствие глюкозы, возможно, из-за конверсии внутриклеточного резерва гликогена. Было общее значительное ( P <0,001) повышение продукции лактата, что соответствовало увеличению глюкозы в среде (31.1 ± 1,1 нмоль / л / ч / 1 × 10 5 жизнеспособных ГХ для 3 мМ глюкозы и 39,5 ± 1,5 нмоль / л / ч / 1 × 10 5 жизнеспособных ГХ для 6 мМ глюкозы).
Взаимодействие между этиологией и концентрацией глюкозы в остром метаболизме ГК
Наблюдалась значительная ( P <0,001) взаимосвязь между этиологией пациента и концентрацией глюкозы в среде инкубации GC, которая влияла на острый метаболизм GC in vitro (рис. 1B). При физиологической концентрации глюкозы 3 мМ воздействие метформина in vivo на ГК СПКЯ значительно ( P <0.05) увеличивало острую абсорбцию глюкозы и продукцию пирувата, приближая обмен этих двух метаболитов к контрольной группе. Потребление глюкозы ГХ СПКЯ было значительно ( P <0,05) ниже, чем ГХ контроля и метформина при инкубации с 3 мМ глюкозы (рис. 1В).
Не было значительной разницы в потреблении глюкозы между тремя группами, когда концентрация глюкозы в среде составляла 6 мМ. В то время как продукция пирувата контрольными ГХ была значительной ( P <0.001) выше, чем у ГК СПКЯ при 6 мМ глюкозы, ГК, подвергнутые воздействию метформина, находились посередине между группами СПКЯ и контрольной группой при дозе глюкозы 6 мМ (рис. 1В).
Клетки Granulosa от женщин с СПКЯ продуцировали значительно ( P <0,05) больше лактата, чем контрольные GC, как при 3, так и при 6 мМ глюкозе. Кроме того, продукция GC лактата при инкубации с 3 мМ глюкозы in vitro была значительно ( P <0,001) снижена по сравнению с клетками СПКЯ после предварительной обработки метформином in vivo , что соответствует уровням, зарегистрированным для контрольных клеток (рис.1Б).
Эффект воздействия метформина
in vivo на жизнеспособный номер GC in vitro
Жизнеспособность GC была количественно определена у всех тех субъектов, чьи GC успешно завершили 144 часа культивирования. Результаты показали значительное изменение количества жизнеспособных клеток между началом и концом расширенной культуры (рис. 2). Не было никакого эффекта от дозы глюкозы или инсулина, включая нулевые дозы, на количество жизнеспособных GC в конце расширенных культур; поэтому результаты были объединены для всех доз глюкозы и инсулина.Однако наблюдалось сильное влияние этиологии на жизнеспособность GC, так что воздействие метформина in vivo приводило к значительно большему количеству жизнеспособных GC ( P <0,05, рис.2) через 144 часа культивирования по сравнению с ГХ из группы СПКЯ или контрольной группы.
Рисунок 2
Влияние этиологии на жизнеспособность GC через 144 часа культивирования. Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов.Различные буквы на графике указывают на значительные различия ( P <0,05) между этиологией. Пунктирная линия представляет плотность посева жизнеспособных клеток на лунку в начале культивирования.
Рисунок 2
Влияние этиологии на жизнеспособность GC через 144 часа культивирования. Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов. Различные буквы на графике указывают на существенные различия ( P <0.05) между этиологиями. Пунктирная линия представляет плотность посева жизнеспособных клеток на лунку в начале культивирования.
Долгосрочный метаболизм ГК
Метаболизм глюкозы, пирувата и лактата оставался определяемым в GC через 144 часа культивирования. Не было очевидного эффекта инсулина ни в одной из испытанных доз (данные не показаны), что оправдывает объединение данных. Потребление и утилизация глюкозы ГК определялись в отсутствие добавок инсулина.Также не было значительного взаимодействия между этиологией и содержанием инсулина в среде после длительного культивирования ГК.
Влияние этиологии на долгосрочный метаболизм ГК
Общее поглощение глюкозы контрольными ГК было значительно ( P <0,05) выше, чем у ГК СПКЯ и СПКЯ от женщин, предварительно получавших метформин in vivo до восстановления ГК. Контрольные ГК метаболизировали значительно ( P <0,0001) больше глюкозы, чем ГК СПКЯ и метформина (рис.3А). Наблюдалось четкое влияние этиологии на продукцию пирувата, так что контрольные ГХ продуцировали значительно ( P <0,0001) больше пирувата, чем две другие группы при всех испытанных дозах глюкозы и инсулина. Продукция пирувата ГК для СПКЯ была меньше, чем у контрольных ГК, но выше, чем ГК метформина ( P <0,01 и P <0,05, соответственно, фиг. 3A). Среднее производство лактата GC для трех этиологий также показано на фиг. 3A. Хотя ГК для СПКЯ продуцировали больше лактата, чем контрольные ГК, это различие не было значимым ни для 3 мМ, ни для 6 мМ глюкозы.ГК, предварительно обработанные метформином, продуцировали значительно ( P <0,0001) меньше лактата, чем контрольные ГК или их аналоги для СПКЯ для всех испытанных доз глюкозы (рис. 3А).
Рисунок 3
Влияние этиологии ( A ) и дозы глюкозы в культуральной среде ( B ) на потребление глюкозы, продукцию пирувата и лактата в ГХ после 144 часов культивирования. Значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов.Данные были стандартизированы по количеству жизнеспособных клеток, измеренному через 144 часа культивирования. Различные буквы на графиках указывают на значительные различия ( P <0,05) между тремя этиологическими группами и дозами глюкозы, испытанными для каждого метаболита.
Рисунок 3
Влияние этиологии ( A ) и дозы глюкозы в культуральной среде ( B ) на потребление глюкозы, продукцию пирувата и лактата ГК через 144 часа культивирования. Значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов.Данные были стандартизированы по количеству жизнеспособных клеток, измеренному через 144 часа культивирования. Различные буквы на графиках указывают на значительные различия ( P <0,05) между тремя этиологическими группами и дозами глюкозы, испытанными для каждого метаболита.
Влияние концентрации глюкозы на долгосрочный метаболизм ГК
Концентрация глюкозы в среде значительно ( P <0,0001) влияла на общее поглощение глюкозы ГК, но наблюдаемая разница была в основном между ГК, культивированными в отсутствие, и присутствием глюкозы в среде, а не между 3 и 6 мМ. дозы глюкозы (рис.3Б). Хотя наблюдалось дозозависимое падение продукции пирувата по всем трем причинам, когда количество глюкозы в среде увеличивалось с 3 до 6 мМ; этот эффект не был значительным ( P > 0,05). Подобно острому метаболизму GC, наблюдалась тенденция ( P = 0,053) к увеличению общей продукции лактата в ответ на присутствие более высокого содержания глюкозы в среде (рис. 3B).
Взаимодействие между этиологией и дозой глюкозы на долгосрочный метаболизм ГК
Единственный обмен метаболита, который продемонстрировал сильную тенденцию ( P = 0.05) для взаимодействия между этиологией пациента и дозой глюкозы было продуцирование лактата через 144 часа культивирования. Наблюдалось значительное ( P <0,05) увеличение общей скорости продукции лактата в ответ на концентрацию глюкозы в среде в контрольной группе и группе СПКЯ, тогда как прирост не был значительным в группе метформина.
Скорость метаболизма за 144 ч
Чтобы уловить влияние определенных условий культивирования на метаболизм GC, средние процентные различия в скорости метаболизма GC на жизнеспособные клетки между 6 и 144 часами культивирования были проанализированы для всех трех этиологических групп.Результаты демонстрируют значительные различия между этиологией в том, как ГХ утилизируют глюкозу и продуцируют лактат и пируват в течение 144 часов (рис. 4).
Рисунок 4
Влияние этиологии на процентное увеличение (положительные значения) или снижение (отрицательные значения) потребления глюкозы и скорость продукции пирувата и лактата на 1 × 10 5 жизнеспособных ГХ на лунку в течение 144 часов культивирования. Представленные на графике значения представляют собой среднее значение ± SEM данных для числа показанных индивидуальных культур пациентов.Звездочка указывает на значительную разницу ( P <0,05) между этиологией показанного метаболита.
Рисунок 4
Влияние этиологии на процентное увеличение (положительные значения) или снижение (отрицательные значения) потребления глюкозы и скорость продукции пирувата и лактата на 1 × 10 5 жизнеспособных ГХ на лунку в течение 144 часов культивирования. Представленные на графике значения представляют собой среднее значение ± SEM данных для числа показанных индивидуальных культур пациентов. Звездочка указывает на значительную разницу ( P <0.05) между указанными этиологиями метаболита.
Производство прогестерона ГК
Данные о производстве прогестерона были доступны для 24 пациентов. Не было эффекта от доз глюкозы или инсулина, включая нулевые дозы, на выработку прогестерона в острой или долгосрочной перспективе; поэтому данные были объединены для дальнейшего анализа. Измеримая продукция прогестерона была обнаружена для GC через 6 часов культивирования, и между тремя этиологиями наблюдалась значительная разница ( P <0,0001), так что контрольные GC продуцировали значительно ( P <0.0001) больше прогестерона, чем ГК при СПКЯ или ГК, предварительно обработанные метформином (рис. 5). Точно так же через 144 часа культивирования наблюдалась значительная разница ( P <0,0001) в долгосрочном производстве прогестерона ГК трех этиологических групп (рис. 5). После длительного культивирования самый высокий синтез прогестерона был зарегистрирован в контрольных ГК, затем в ГК с СПКЯ и, наконец, в группе, предварительно обработанной метформином. Воздействие метформина in vivo не оказало значительного влияния на выработку прогестерона в остром периоде по сравнению с необработанными ГК СПКЯ.В то время как контрольные ГК и ГК с СПКЯ, не подвергавшиеся воздействию метформина in vivo , сохранили выработку прогестерона с течением времени, ГК метформина значительно ( P <0,0001) снизили выработку прогестерона в течение 144 часов культивирования in vitro .
Рисунок 5
Влияние этиологии и продолжительности культивирования на общую продукцию прогестерона ГК. Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов.Данные были стандартизированы в соответствии с количеством жизнеспособных клеток. a и b указывают на значительную разницу ( P <0,05) между этиологическими группами через 6 часов культивирования (6 часов), а x, y и z указывают на значительную разницу ( P <0,05) между этиологическими группами через 144 часа культивирования. культура (144 ч). Звездочка указывает на значительную разницу ( P <0,05) в этиологии в двух показанных временных точках.
Рисунок 5
Влияние этиологии и продолжительности посева на общую продукцию прогестерона ГК.Представленные на графике значения представляют собой среднее значение ± SEM логарифмически преобразованных данных для числа показанных индивидуальных культур пациентов. Данные были стандартизированы в соответствии с количеством жизнеспособных клеток. a и b указывают на значительную разницу ( P <0,05) между этиологическими группами через 6 часов культивирования (6 часов), а x, y и z указывают на значительную разницу ( P <0,05) между этиологическими группами через 144 часа культивирования. культура (144 ч). Звездочка указывает на значительную разницу ( P <0.05) в рамках этиологии в двух указанных временных точках.
Гликолитический индекс ГК
Как этиология, так и содержание глюкозы в культуральной среде оказали значительное ( P <0,001) влияние на острый гликолитический индекс ГК. ГК СПКЯ продемонстрировали самый высокий гликолитический индекс (2,6 ± 0,2, n = 8) по сравнению с ГК, предварительно обработанными метформином (2,1 ± 0,1, n = 8) и контрольными ГХ (1,8 ± 0,1, n = 9). ) (Рис.6). Различия в гликолитическом индексе между контрольными ГК и ГК с СПКЯ и ГК с СПКЯ, предварительно обработанными метформином, были значительными ( P <0.001; P <0,05 соответственно). Предварительная обработка метформином привела к сдвигу гликолитического индекса ГК по направлению к контрольным ГК, так что не было статистической разницы между двумя группами. Острый гликолитический индекс значительно увеличивался ( P <0,01) с увеличением концентрации глюкозы в среде независимо от этиологии пациента и дозы инсулина (1,8 ± 0,1, n = 25 и 2,3 ± 0,1, n = 25 при 3 мМ и 6 мМ глюкозы соответственно). Повышение гликолитического индекса в ответ на содержание глюкозы в среде согласуется с увеличением лактата и снижением продукции пирувата ГК в ответ на поставку глюкозы.
Рисунок 6
Влияние этиологии и продолжительности культивирования на гликолитический индекс GC. Представленные на графике значения представляют собой среднее значение ± SEM данных для числа показанных индивидуальных культур пациентов. a и b указывают на значительную разницу ( P <0,05) между этиологическими группами через 6 часов культивирования (6 часов), а x и y указывают на значительную разницу ( P <0,05) между этиологическими группами через 144 часа культивирования ( 144 ч).
Рисунок 6
Влияние этиологии и продолжительности культивирования на гликолитический индекс ГК.Представленные на графике значения представляют собой среднее значение ± SEM данных для числа показанных индивидуальных культур пациентов. a и b указывают на значительную разницу ( P <0,05) между этиологическими группами через 6 часов культивирования (6 часов), а x и y указывают на значительную разницу ( P <0,05) между этиологическими группами через 144 часа культивирования ( 144 ч).
В долгосрочных культурах снова наблюдалось сильное и значимое ( P <0,0001) влияние этиологии пациента на гликолитический индекс ГК.Гликолитический индекс был самым низким в контрольных ГК (2,0 ± 0,1, n = 6) и значительно ( P <0,0001) отличался от индекса СПКЯ (2,8 ± 0,2, n = 7) и метформиновых ГК (2,7 ± 0,1, n = 8). В отличие от острой (6 ч) культуры, ни один из ГК не показал заметных изменений гликолитического индекса в ответ на содержание глюкозы в среде после расширенного культивирования (144 ч). Более того, предварительная обработка метформином не вызвала каких-либо изменений гликолитического индекса после расширенного культивирования.В целом результаты метаболизма указали на преимущественную продукцию лактата ГК для СПКЯ по сравнению с контрольными ГК (рис. 6).
Обсуждение
Это исследование впервые предоставило подробные сведения о метаболизме глюкозы в определенных средах in vivo, и in vitro, , с помощью ГК от женщин с СПКЯ с целью определения точного метаболического поражения в этих клетках. Результаты показали, что у женщин с СПКЯ нарушены все три компонента гликолиза, а именно поглощение глюкозы и производство пирувата и лактата.Предыдущие исследования показали, что индуцированная инсулином выработка лактата in vitro с помощью ГК была нарушена у женщин с ановуляторным СПКЯ по сравнению с контрольной группой (Lin et al. , 1997; Fedorcsak et al. , 2000; Rice et al. , 2005). Напротив, результаты текущего исследования острого метаболизма показали более высокую продукцию лактата ГК для СПКЯ, чем контрольными, независимо от концентрации инсулина в культуральной среде. Аналогичным образом, длительная продукция лактата также была сопоставима между контрольными ГК и ГК при СПКЯ без какого-либо очевидного эффекта инсулина.Следует отметить, что ранее сообщалось о нарушении стимулированной инсулином продукции лактата было зарегистрировано только после воздействия на клетки сверхфизиологических доз инсулина, которые были выше, чем максимальная доза (100 нг / мл), использованная в настоящих исследованиях (Lin и др. , 1997; Fedorcsak и др. , 2000; Rice и др. , 2005). Следует с осторожностью проводить прямое сравнение опубликованных исследований и настоящей работы. В текущем исследовании метаболизм GC измеряли через 6 и 144 часа культивирования, тогда как в предыдущих исследованиях метаболиты измеряли только через 48-72 часа культивирования.Более того, текущие данные о метаболизме GC были получены на GC, собранных у отдельных пациентов, культивированных в бессывороточной культуральной системе, содержащей суб- или сверхфизиологические дозы глюкозы и инсулина, а также физиологические концентрации ХГЧ (0,05 мЕд / мл) и ФСГ. (0,5 мЕд / мл) (Picton et al. , 1999). Напротив, Rice et al. (2005) использовал диапазон доз ЛГ 0, 2,5 и 5 нг / мл (что эквивалентно 0, 0,01 мЕ / мл и 0,22 мЕ / мл ЛГ) и диапазон концентраций инсулина вплоть до более высокой максимальной дозы 1000 нг. / мл для стимуляции метаболизма ГК в сывороточной культуральной системе, содержащей 5.5 мМ глюкозы.
В настоящем исследовании также сообщается, что гликолитический индекс контрольных ГК был <2, что позволяет предположить, что каждый моль глюкозы не полностью метаболизировался до лактата, конечного продукта кислороднезависимого гликолиза, а вместо этого метаболизировался в другие молекулы, такие как пируват (Harris и др., , 2009). Индекс был> 2 для ГК PCOS, что свидетельствует о полном гликолизе каждого моля глюкозы до двух молей лактата и дополнительной продукции лактата, возможно, из внутриклеточного гликогена.Результаты позволяют предположить, что преимущественное превращение глюкозы в промежуточный метаболит пируват происходит в контрольных ГК, тогда как преимущественное накопление конечного продукта лактата гликолиза происходит у женщин с СПКЯ. Эти данные относятся к женщинам, подвергшимся искусственному оплодотворению, поскольку пируват является ключевым энергетическим субстратом пентозофосфатного пути и поэтому играет центральную роль в генерации нуклеотидов, которые необходимы для созревания ядра ооцита и компетентности в развитии (Sutton-McDowall et al., 2010 г.). Таким образом, отсутствие продукции пирувата ГК при СПКЯ может поставить под угрозу способность к развитию и, следовательно, качество ооцитов у женщин с этой патологией.
Важным открытием текущих экспериментов было отсутствие очевидных эффектов инсулина в культуральной среде на острый или долгосрочный метаболизм глюкозы человеческими ГК. Это наблюдение предполагает, что инсулинорезистентность является преимущественно феноменом in vivo , который не всегда присутствует в культивируемых клетках лютеина гранулезы, собранных у женщин с СПКЯ, подвергающихся искусственному оплодотворению.В поддержку этого объяснения, инсулинорезистентность не всегда была продемонстрирована in vitro в соматических клетках женщин с СПКЯ. Например, культуры клеток скелетных мышц не смогли показать различий в чувствительности к инсулину между СПКЯ и контрольными субъектами (Corbould et al. , 2005). Точно так же связывание инсулина и инсулино-чувствительный базальный транспорт глюкозы были сопоставимы между контрольными адипоцитами и адипоцитами с СПКЯ, тогда как чувствительность к инсулину, оцениваемая по активности транспорта глюкозы, истощенной аденозином, была нарушена в адипоцитах с СПКЯ (Ciaraldi et al., 1997). Возможное объяснение невозможности продемонстрировать инсулинорезистентность in vitro в этих предыдущих исследованиях заключалось в том, что такие факторы, как гиперинсулинемия, гиперандрогения и гипергликемия, способствующие развитию инсулинорезистентности in vivo , не работали in vitro . Более того, инсулинорезистентность in vivo , как полагают, обусловлена дефектами пострецепторной передачи сигналов при фосфорилировании тирозина, а не проблемой сродства и функции IR (Kausch et al., 2001; Venkatesan et al. , 2001; Дунаиф, 2006). Альтернативно, такие факторы, как IGF-1 и гонадотропины, могут играть более важную роль, чем инсулин, в регулировании поглощения и использования глюкозы человеческими GC, по крайней мере, в настоящих бессывороточных культурах in vitro . В этом контексте включение LR3 IGF-1 в культуральную среду могло бы перекрыть любое влияние инсулина на клеточный метаболизм глюкозы, хотя такой преобладающий эффект мог бы потребовать гораздо более высокой дозы, чем физиологический уровень (100 нг / мл). используется в текущем эксперименте.Действительно, в большинстве опубликованных отчетов о метаболизме глюкозы с помощью ГК СПКЯ тестировалась чувствительность клеток к инсулину в отсутствие IGF-1 (Lin et al. , 1997; Fedorcsak et al. , 2000; Rice и др., , 2005). Когда Wu et al. (2003) сравнил эффекты инсулина и IGF-1 на метаболизм глюкозы глюкозы человека, результаты показали, что сродство и влияние IGF-1 было намного более сильным, чем влияние инсулина на поглощение глюкозы GC у женщин с СПКЯ.Напротив, некоторые исследователи предположили, что реакция GC на инсулин у женщин с СПКЯ опосредуется IR, а не IGF (Willis and Franks, 1995). Тем не менее, существует возрастающая поддержка идеи, что перекрестная связь между IR и IGF-1R может приводить к перекрытию метаболической активности в клетках (Binoux, 1995). Более того, было высказано предположение, что гибридные рецепторы IR / IGF-1R могут присутствовать в GC, что приводит к поглощению глюкозы посредством стимуляции IGF-1 (Lopaczynski, 1999).
Средние концентрации глюкозы в сыворотке и фолликулярной жидкости (4.4 ± 0,1 мМ и 3,1 ± 0,3 мМ соответственно) были сопоставимы с результатами, о которых сообщалось в более ранних исследованиях (Leese and Lenton, 1990; Phy et al., , 2004; Rice et al., , 2005; Nafiye et al. , 2010 г.). Как сообщалось ранее в литературе, концентрация глюкозы в фолликулярной жидкости (фильтрате плазмы) была намного ниже, чем в сыворотке (Leese and Lenton, 1990), тогда как для инсулина наблюдалось обратное. Это наблюдение подтверждает мнение о том, что клетки фолликула могут не содержать чувствительных к инсулину переносчиков глюкозы, что приводит к накоплению инсулина в фолликулярной жидкости (Campbell et al., 2010 г.).
Лечение женщин с СПКЯ метформином во время их циклов ЭКО четко «нормализовало» острый метаболизм глюкозы в ГК, инкубированных с физиологической концентрацией глюкозы (3 мМ). Вероятно, что механизм, с помощью которого метформин увеличивает потребление глюкозы ГК женщин с СПКЯ, может напрямую усиливать продукцию пирувата теми же клетками. Настоящие результаты для ГК согласуются с метаболическим поведением гепатоцитов, обработанных метформином, в культуре, которые показывают увеличение стимулированного инсулином захвата глюкозы, потребления глюкозы, активированного фосфорилированием IR, и гликолиза (Fulgencio et al., 2001; Gunton et al. , 2003). Было высказано предположение, что за такие эффекты метформина ответственна повышенная активность гексокиназы и пируваткиназы. Точно так же лечение метформином в течение 10 недель увеличивало поглощение глюкозы клетками скелетных мышц у субъектов с сахарным диабетом 2 типа через путь AMPK (Musi et al. , 2002). Однако продукция пирувата, наблюдаемая в GC в настоящем исследовании, не была полностью скорректирована до контрольных уровней после воздействия метформина in vivo .Будет ли увеличение клинической дозы метформина улучшить метаболизм ГК — вопрос дальнейших исследований. Более того, вопрос о том, трансформируется ли наблюдаемое метформин-индуцированное улучшение в остром метаболизме ГК в клиническую эффективность, требует дальнейшего изучения. Ранее предварительная обработка метформином in vivo не показала значительного влияния на потенциал созревания in vitro незрелых ооцитов СПКЯ, полученных во время лечения ЭКО (Harris et al., 2010 г.). В соответствии с имеющейся литературой, текущее исследование не показало различий в частоте оплодотворения на зрелый ооцит, частоте положительных беременностей за цикл или частоте клинической беременности за цикл между группами. Недавний метаанализ Palomba et al. (2013) также подтвердил, что использование метформина во время лечения ЭКО / ИКСИ не улучшило частоту беременностей или живорождений. Напротив, лечение метформином, как было показано, удваивает частоту живорождений, наиболее вероятно за счет снижения частоты отмены, когда препарат вводится во время стимуляции овуляции, стимулированной гонадотропином (Palomba et al., 2014).
Механизм, лежащий в основе наблюдаемого увеличения числа жизнеспособных клеток при СПКЯ и ГК, предварительно обработанных метформином, неясен. ГК из ранних антральных фолликулов (0,5–2 мм в диаметре) имеют потенциал для пролиферации в физиологической бессывороточной культуре при соответствующей стимуляции, в то время как клетки из более крупных антральных фолликулов (> 5-6 мм в диаметре) чаще имеют тенденцию к дифференцировке. если количество жизнеспособных клеток поддерживается in vitro , о чем свидетельствует их повышенная способность ароматизировать андрогены до эстрогенов (Breckwoldt et al., 1996; Кэмпбелл и др. , 1996; Havelock et al. , 2004). Клетки лютеина гранулезы, используемые в настоящих экспериментах, преимущественно собирали из более крупных антральных фолликулов, и, кроме того, они уже были окончательно дифференцированы при сборе после воздействия триггера ХГЧ in vivo . Прямое влияние экзогенного ЛГ на развитие терминального фолликула до лютеинизации, вызванной ХГЧ, не измерялось и, возможно, являлось ограничением исследования.По своей сути сниженный апоптоз ГК при СПКЯ может способствовать увеличению числа жизнеспособных клеток, наблюдаемому в конце длительных культур. В поддержку этой идеи женщины с СПКЯ показали более высокую скорость пролиферации и более низкую скорость апоптоза в GC, собранных из нестимулированных фолликулов (диаметром 4-8 мм), по сравнению с нормальным контролем (Das et al. , 2008). Хотя было обнаружено, что активированная каспаза-3, фермент, необходимый для апоптоза клеток, значительно ниже, экспрессия белков выживания клеток, таких как белок, активирующий островки и белок Bcl-гена-2, выше в GC из женщин с СПКЯ по сравнению со здоровыми женщинами.Недавний отчет также предполагает, что предварительная обработка метформином во время ЭКО может напрямую сенсибилизировать человеческие ГК и, таким образом, приводить к повышенной пролиферации первичных ГК-линий в культуре, а также к повышению жизнеспособности базальных клеток лютеиновых клеток гранулезы человека in vitro в отсутствие любого стимулирующего эффекта от инсулина или IGF-1 в среде (Sonntag et al. , 2005). Действительно, увеличение числа жизнеспособных клеток также может быть связано с влиянием метформина на путь AKT (Hennessy et al., 2005) или прямое подавление остановки клеточного цикла метформином, которое не зависит от инсулина (Jalving et al. , 2010).
Поразительно, что ГК с СПКЯ, изученные в нашей экспериментальной серии, стабильно вырабатывали меньше прогестерона, чем контрольные ГК, как в острой, так и в расширенной культуре, что позволяет предположить, что способность синтезировать прогестерон в этой этиологии изначально снижена. В поддержку этой идеи Doldi et al. (1998) сообщил о снижении синтеза прогестерона in vitro лютеинизированными ГК СПКЯ.Кроме того, индуцированная ФСГ и / или ИФР-1 секреция прогестерона в культурах ГК размером от 8 до 10 мм без лютеинизированных фолликулов от женщин с СПКЯ была значительно ниже, чем в контрольных ГК, что свидетельствует о врожденном нарушении стероидогенной способности ГК СПКЯ ( Erickson и др. , 1992). Важным проявлением наблюдаемого сниженного биосинтеза прогестерона PCOS GC in vivo может быть дефицит синтеза прогестерона в лютеиновой фазе и связанный с этим неблагоприятный исход беременности (Meenakumari et al., 2004; Unfer et al. , 2005). Действительно, измерение соотношения прегнандиола и креатинина в лютеиновой фазе в моче как показателя секреции прогестерона показало, что женщины с СПКЯ секретируют значительно более низкие уровни прогестерона в ранней лютеиновой фазе (Joseph-Horne et al. , 2002), несмотря на широкий разброс. в индексе секреции прогестерона. Значительно сниженный сывороточный индекс прогестерона также наблюдался в ранней лютеиновой фазе у естественно овулирующих олигоменореей женщин с СПКЯ по сравнению с нормальными фертильными женщинами (Fleming et al., 1995). В совокупности эти результаты подтверждают мнение о врожденном нарушении биосинтетической способности прогестерона ГК женщин с СПКЯ.
Интересно, что этот отчет показал, что выработка прогестерона ГК у женщин с СПКЯ не претерпела резких изменений в результате предшествующего воздействия метформина in vivo . Более того, после 144 ч культивирования синтез прогестерона и превращение глюкозы в пируват и лактат с помощью ГК, предварительно обработанных метформином, были ниже, чем их аналоги для СПКЯ и контрольные ГХ, после того, как данные были скорректированы на количество жизнеспособных клеток.Эти результаты предполагают, что воздействие метформина in vivo не только увеличивало пролиферацию клеток in vitro , но также постоянно замедляло метаболизм и способность к синтезу прогестерона GCs in vitro . Неясно, был ли этот отрицательный метаболический эффект вызван: снижением функции эндотелия в густонаселенных жизнеспособных ГК; ограничение субстрата in vitro ; или к прямому действию метформина на клетки. Эти параметры не могут быть взаимоисключающими.О значительном снижении выработки прогестерона, стимулированного как инсулином, так и IGF-1 in vitro сообщалось в двух предыдущих исследованиях, в которых контрольные ГК и ГК для СПКЯ инкубировали с метформином в культуральной среде (Mansfield et al. , 2003; Tosca и др., , 2007). Кроме того, экспрессия человеческого GC IGF-1 была ниже после лечения метформином перед ЭКО по сравнению с контрольными женщинами с СПКЯ (Santana et al. , 2007). Устойчивый ингибирующий эффект метформина на продукцию андрогенов тека-клетками был также зарегистрирован во время in vitro воздействия метформина (Attia et al., 2001). Более того, метформин, по-видимому, оказывает инсулиннезависимое подавляющее действие на продукцию CYP17-лиазы и андростендиона тека-подобными опухолевыми клетками яичников человека (Attia et al. , 2001). Также было показано, что метформин при добавлении в культуральную среду снижает уровни экспрессии стероидного острого регуляторного белка (StAR) в ГК крыс (Tosca et al. , 2006). В то время как оценка уровней белка StAR с помощью вестерн-блоттинга ГК из текущей серии экспериментов была бы информативной в отношении механизма действия метформина, анализ такого рода был невозможен в текущей работе из-за: (i) ограниченного количество ГХ, доступных для анализа при использовании индивидуальной стратегии культивирования пациентов; и (ii) необходимость точной количественной оценки метаболизма GC и стероидогенеза по отношению к количеству жизнеспособных клеток, по оценке с помощью анализа нейтрального красного, в конце культивирования.Необходимы дальнейшие исследования для изучения молекулярных механизмов действия метформина на ГК.
В клинических исследованиях сообщалось о значительном снижении сывороточных концентраций IGF-1 и прогестерона у женщин с СПКЯ, получавших метформин в дозе 850 мг три раза в день в течение 16 недель (Berker et al. ). , 2004). Напротив, в обсервационном исследовании сообщалось о значительном увеличении секреции прогестерона при продолжении приема метформина (сывороточный уровень 16.97 нг / мл) во время лютеиновой фазы в отличие от более низкой концентрации прогестерона в сыворотке крови у женщин с СПКЯ, не получавших метформин (4,9 нг / мл) (Meenakumari et al. , 2004). Было высказано предположение, что метформин может оказывать прямое ингибирующее действие на активность ферментов 3-гидроксистероиддегидрогеназы, StAR и ароматазы, тем самым снижая продукцию стероидов человеческими ГК (Nestler and Jakubowicz, 1997; la Marca et al. , 2002; Mansfield ). и др., , 2003). Наконец, активация AMPK метформином является механизмом, одобренным Tosca et al. (2007) для учета снижения синтеза стероидов ГК крысы. Клинические последствия «эффекта метформина» на ГК человека, наблюдаемые в настоящем исследовании, требуют дальнейших клинических исследований.
Заключение
В заключение, это исследование продемонстрировало, что независимо от этиологии пациента, дозы инсулина 0,01–100 нг / мл не влияли на острый или долгосрочный метаболизм ГК или на продукцию прогестерона ГК, культивированными в физиологических, бессывороточных условиях.Напротив, добавление сред с 3–6 мМ глюкозы постоянно влияло на потребление глюкозы, а также на продукцию пирувата и лактата фолликулярными ГК и долгосрочно культивируемыми ГК. Этиология СПКЯ поставила под угрозу способность фолликулярных и культивируемых GC потреблять глюкозу in vitro , и этот метаболический эффект был облегчен предварительной обработкой метформином in vivo . Предыдущее воздействие метформина in vivo также усиливало пролиферацию GC in vitro. ГК от пациентов с СПКЯ постоянно имели значительно сниженную способность синтезировать прогестерон по сравнению с контролем.Эти результаты значительно расширяют существующие знания о нарушении метаболизма глюкозы ГК у женщин с СПКЯ, показывая снижение выработки пирувата и преимущественное производство лактата этими клетками в дополнение к снижению поглощения ими глюкозы. Это метаболическое поражение может поставить под угрозу доступность производного GC пирувата, ключевого энергетического субстрата для развития и созревания ооцитов, и, таким образом, негативно повлиять на качество ооцитов. Новые данные о том, что предварительная обработка метформином in vivo улучшила потребление и утилизацию глюкозы ГК и вызвала снижение выработки прогестерона ГК в долгосрочной перспективе.Необходимы дальнейшие исследования для обоснования молекулярных механизмов воздействия метформина на ГК с целью оптимизации клинического применения этого препарата.
Роли авторов
Д.М. выполнил исследование, проанализировал данные и подготовил рукопись. S.E.H. помогли с культурами GC и валидацией анализов метаболизма GC. A.H.B. руководил клиническими аспектами исследования и редактировал рукопись. J.H.B. провели анализы инсулина и глюкозы в сыворотке и фолликулярной жидкости.B.K.C. провела анализ прогестерона в лаборатории Ноттингемского университета. H.M.P. разработал экспериментальную стратегию и методологию исследования, а также поддержал анализ данных и составление рукописи.
Финансирование
Эта работа была поддержана справочным номером гранта Совета медицинских исследований Великобритании G0800250. Финансирование для оплаты публикаций в открытом доступе для этой статьи было предоставлено Университетом Лидса, Accounts Payable, EC Stoner Building, Leeds, LS2 9JT, UK.
Доступ к данным исследований
Доступ к данным можно получить по электронной почте, связавшись с [email protected]
Конфликт интересов
Не объявлено.
Благодарности
Авторы благодарят г-жу Пинг Джин, г-жу Кэтрин Пинкотт-Аллен, г-на Джонатана Брента, г-жу В. Шарма и г-на А.Дж. Резерфорда за их помощь в приготовлении сред, анализах прогестерона, анализах фолликулярной жидкости и поддержку при наборе пациентов.
Список литературы
,,.
Метформин напрямую подавляет выработку андрогенов в текальных клетках человека
,
Fertil Steril
,
2001
, vol.
3
(стр.
517
—
524
),,,,,.
Повышенный уровень инсулиноподобного фактора роста-i у женщин с синдромом поликистозных яичников и положительные эффекты терапии метформином
,
Гинекол эндокринол
,
2004
, vol.
3
(стр.
125
—
133
),,.
Гонадотропины стимулируют выработку лактата кумулюсами и гранулезными клетками крысы
,
Acta Endocrinol
,
1983
, vol.
4
(стр.
562
—
566
).
Система IGF в регуляции метаболизма
,
Diabetes Metab
,
1995
, vol.
5
(стр.
330
—
337
),,,.
Характер продукции лактата и стероидогенеза во время роста и созревания фолликулов яичников мыши in vitro
,
Biol Reprod
,
1993
, vol.
4
(стр.
798
—
806
),,,.
Характеристика энергетического метаболизма фолликулов
,
Hum Reprod
,
1994
, т.
4
(стр.
604
—
609
),.
Избирательная инсулинорезистентность при синдроме поликистозных яичников
,
J Clin Endocrinol Metab
,
1999
, vol.
9
(стр.
3110
—
3116
),,,,,,.
Экспрессия фермента расщепления боковой цепи ad4-bp / цитохрома p450 и индукция гибели клеток в долговременных культурах клеток гранулезы человека
,
Mol Hum Reprod
,
1996
, vol.
6
(стр.
391
—
400
),,.
Индукция и поддержание продукции эстрадиола и иммунореактивного ингибина с помощью ФСГ клетками гранулезы овцы, культивируемыми в бессывороточной среде
,
J Reprod Fertil
,
1996
, vol.
1
(стр.
7
—
16
),,.
Влияние дозы ЛГ на продукцию андрогенов и лютеинизацию клеток теки овцы, культивируемых в бессывороточной системе
,
J Reprod Fertil
,
1998
, vol.
1
(стр.
69
—
77
),,,,.
Влияние моносахаридных сахаров и пирувата на дифференцировку и метаболизм клеток гранулезы овцы in vitro
,
Репродукция
,
2010
, vol.
4
(стр.
541
—
550
),,,,,.
Клеточная инсулинорезистентность адипоцитов у субъектов с синдромом поликистозных яичников с ожирением включает аденозиновую модуляцию чувствительности к инсулину
,
J Clin Endocrinol Metab
,
1997
, vol.
5
(стр.
1421
—
1425
),,,,,,.
Инсулинорезистентность скелетных мышц женщин с СПКЯ включает в себя внутренние и приобретенные дефекты передачи сигналов инсулина
,
Am J Physiol Endocrinol Metab
,
2005
, vol.
5
(стр.
E1047
—
E1054
),.
Метформин: обзор его метаболических эффектов
,
Диабет Ред.
,
1998
, т.
2
(стр.
89
—
131
),,,,,,,.
Выживание и пролиферация клеток гранулезы при синдроме поликистозных яичников изменяются
,
J Clin Endocrinol Metab
,
2008
, vol.
3
(стр.
881
—
887
),,,,.
Синдром поликистозных яичников: аномалии выработки прогестерона
,
Hum Reprod
,
1998
, т.
2
(стр.
290
—
293
),,,,,.
Влияние метформина на активность тирозинкиназы, транспорт глюкозы и внутриклеточный кальций в гладких мышцах сосудов крыс
,
Endocrinology
,
1996
, vol.
1
(стр.
113
—
121
).
Инсулинорезистентность и синдром поликистозных яичников: механизм и значение для патогенеза
,
Endocr Rev
,
1997
, vol.
6
(стр.
774
—
800
).
Инсулинорезистентность у женщин с синдромом поликистозных яичников
,
Fertil Steril
,
2006
, vol.
86
(стр.
S13
—
S14
),,,,.
Гранулезные клетки поликистозных яичников: нормальные они или ненормальные?
,
Hum Reprod
,
1992
, т.
3
(стр.
293
—
299
).
Пересмотренный консенсус 2003 года по диагностическим критериям и долгосрочным рискам для здоровья, связанным с синдромом поликистозных яичников (СПКЯ)
,
Hum Reprod
,
2004
, vol.
1
(стр.
41
—
47
),,,,.
Нарушение действия инсулина на гранулезо-лютеиновые клетки у женщин с синдромом поликистозных яичников и инсулинорезистентностью
,
Гинекол эндокринол
,
2000
, vol.
5
(стр.
327
—
336
),,,.
Спонтанная фолликулярная и лютеиновая функция у бесплодных женщин с олигоменореей: роль лютеинизирующего гормона
,
Clin Endocrinol
,
1995
, vol.
6
(стр.
735
—
739
),,.
Противодиабетические препараты розиглитазон и метформин стимулируют amp-активируемую протеинкиназу через различные сигнальные пути
,
J Biol Chem
,
2002
, vol.
28
(стр.
25226
—
25232
),,,.
Влияние метформина на метаболизм жирных кислот и глюкозы в свежевыделенных гепатоцитах и на экспрессию специфических генов в культивируемых гепатоцитах
,
Biochem Pharmacol
,
2001
, vol.
4
(стр.
439
—
446
),,,,.
Транспортеры глюкозы. Физиология и физиопатология
,
Presse Med
,
1992
, vol.
42
(стр.
2053
—
2059
),,,.
Метформин быстро увеличивает активацию рецептора инсулина в печени человека и передает сигналы преимущественно через субстрат-2 рецептора инсулина
,
J Clin Endocrinol Metab
,
2003
, vol.
3
(стр.
1323
—
1332
),,,.
Гонадотропный контроль гликолиза гранулезных клеток человека
,
Hum Reprod
,
1987
, vol.
8
(стр.
649
—
653
),,,,.
Углеводный обмен фолликулами и ооцитами яичников мыши, выращенными in vitro
,
Репродукция
,
2007
, vol.
3
(стр.
415
—
424
),,,.
Потребление пирувата и кислорода в процессе роста и развития ооцитов мышей
,
Mol Reprod Dev
,
2009
, vol.
3
(стр.
231
—
238
),,,,.
Анализ метаболизма и кариотипа ооцитов пациентов с синдромом поликистозных яичников
,
Hum Reprod
,
2010
, vol.
9
(стр.
2305
—
2315
),,.
Клеточные линии гранулезы яичников
,
Mol Cell Endocrinol
,
2004
, vol.
1–2
(стр.
67
—
78
),,,,.
Использование пути pi3k / akt для открытия лекарств от рака
,
Nat Rev Drug Discov
,
2005
, vol.
12
(стр.
988
—
1004
),,,,.
Энергетические субстраты в яйцеводе крупного рогатого скота, маточной жидкости и плазме крови во время эстрального цикла
,
Mol Reprod Dev
,
2008
, vol.
3
(стр.
496
—
503
),,,,,,.
Метформин: забирая леденец от рака?
,
Eur J Cancer
,
2010
, vol.
13
(стр.
2369
—
2380
),,,,,,.
Экскреция прогестерона в лютеиновой фазе у овуляторных женщин с поликистозом яичников
,
Hum Reprod
,
2002
, vol.
6
(стр.
1459
—
1463
),,,,,,,,,.
Влияние троглитазона на клеточную дифференцировку, передачу сигналов инсулина и метаболизм глюкозы в культивируемых клетках скелетных мышц человека
,
Biochem Biophys Res Commun
,
2001
, vol.
3
(стр.
664
—
674
),,,,,.
Инсулинснижающая терапия снижает активность ароматазы в ответ на фолликулостимулирующий гормон у женщин с синдромом поликистозных яичников
,
Fertil Steril
,
2002
, vol.
6
(стр.
1234
—
1239
),,,,.
Метформин усиливает действие инсулина на гранулезно-лютеиновые клетки свиней in vitro
,
Anim Reprod Sci
,
2012
, vol.
1–2
(стр.
100
—
107
),.
Глюкоза и лактат в фолликулярной жидкости человека: концентрации и взаимосвязь
,
Hum Reprod
,
1990
, vol.
8
(стр.
915
—
919
),. ,.
Основные концепции регуляции топливного обмена с помощью инсулина, глюкагона и других гормонов
,
Базовая медицинская биохимия Марка — клинический подход
,
2009
(стр.
483
—
498
),,.
Стимуляция инсулином накопления лактата в изолированных гранулезо-лютеиновых клетках человека: сравнение нормальных и поликистозных яичников
,
Hum Reprod
,
1997
, vol.
11
(стр.
2469
—
2472
).
Дифференциальная регуляция сигнальных путей для инсулина и инсулиноподобного фактора роста I
,
Acta Biochim Pol
,
1999
, vol.
1
(стр.
51
—
60
),,,,.
Метформин оказывает прямое влияние на стероидогенез яичников человека
,
Fertil Steril
,
2003
, vol.
4
(стр.
956
—
962
),,,,,,,.
Характеристики повторяемости простых индексов инсулинорезистентности: значение для исследовательских приложений
,
J Clin Endocrinol Metab
,
2001
, vol.
11
(стр.
5457
—
5464
),,,.
Влияние лечения метформином на концентрацию прогестерона в лютеиновой фазе при синдроме поликистозных яичников
,
Braz J Med Biol Res
,
2004
, vol.
11
(стр.
1637
—
1644
),,,,,,,.
Влияние метформина на клинические особенности, эндокринные и метаболические профили и чувствительность к инсулину при синдроме поликистозных яичников: рандомизированное двойное слепое плацебо-контролируемое 6-месячное исследование с последующим открытым долгосрочным клиническим исследованием
,
J Clin Endocrinol Метаб
,
2000
, т.
1
(стр.
139
—
146
),,,,,,,,, и др.
Метформин увеличивает активность АМФ-активированной протеинкиназы в скелетных мышцах субъектов с диабетом 2 типа
,
Диабет
,
2002
, vol.
7
(стр.
2074
—
2081
),,,,,.
Влияние параметров сывороточной и внутрифолликулярной инсулинорезистентности и уровней гомоцистеина у пациентов с синдромом поликистозных яичников, не страдающим ожирением, негиперандрогенемией, на исход экстракорпорального оплодотворения
,
Fertil Steril
,
2010
, vol.
6
(стр.
1864
—
1869
),.
Худые женщины с синдромом поликистозных яичников реагируют на снижение уровня инсулина снижением активности яичников p450c17 альфа и сывороточных андрогенов
,
J Clin Endocrinol Metab
,
1997
, vol.
12
(стр.
4075
—
4079
),,,,,.
Системные и местные эффекты введения метформина у пациентов с синдромом поликистозных яичников (СПКЯ): связь с овуляторной реакцией
,
Hum Reprod
,
2010
, vol.
4
(стр.
1005
—
1013
),,.
Эффекты метформина у женщин с синдромом поликистозных яичников, получавших гонадотропины для оплодотворения in vitro и циклов интрацитоплазматической инъекции сперматозоидов: систематический обзор и метаанализ рандомизированных контролируемых исследований
,
BJOG
,
2013
, vol.
3
(стр.
267
—
276
),,.
Метформин и гонадотропины для индукции овуляции у пациентов с синдромом поликистозных яичников: систематический обзор с метаанализом рандомизированных контролируемых исследований
,
Reprod Biol Endocrinol
,
2014
, vol.
12
стр.
3
,.
Ориентация на чувствительность к инсулину при лечении синдрома поликистозных яичников
,
Экспертное заключение Ther Targets
,
2009
, vol.
10
(стр.
1205
—
1226
),,,,,,,,,.
Экспрессия инсулина и мессенджера рибонуклеиновой кислоты изоформ инсулиновых рецепторов в фолликулах яичников безволосых овуляторных женщин и пациентов с синдромом поликистозных яичников
,
J Clin Endocrinol Metab
,
2004
, vol.
7
(стр.
3561
—
3566
),,.
Поддержание продукции эстрадиола и экспрессии мРНК фермента ароматазы цитохрома p450 в долговременных бессывороточных культурах клеток гранулезы свиней
,
J Reprod Fertil
,
1999
, vol.
1
(стр.
67
—
77
),,,,,,,.
Фосфатидилинозитол-3-киназа-независимый путь (пути) действия инсулина в яичниках человека
,
J Clin Endocrinol Metab
,
2001
, vol.
7
(стр.
3115
—
3119
).
Инсулинорезистентность при синдроме поликистозных яичников
,
Curr Opin Obstet Gynecol
,
1997
, vol.
3
(стр.
193
—
201
),,,.
Инсулино-стимулированный захват глюкозы происходит в специализированных клетках комплекса кумулюсных ооцитов
,
Endocrinology
,
2012
, vol.
5
(стр.
2444
—
2454
),,,,,,,,.
Нарушение инсулинозависимого метаболизма глюкозы в гранулезо-лютеиновых клетках от ановуляторных женщин с поликистозом яичников
,
Hum Reprod
,
2005
, vol.
2
(стр.
373
—
381
),,,,,.
Кинетика метформина в плазме и эритроцитах после острого введения у здоровых субъектов
,
Diabetes Metab
,
2003
, vol.
3
(стр.
279
—
283
),,,,,.
Экспрессия гена рецептора IGF-1 в кумулюсных клетках лютеинизированной гранулезы человека от не страдающих ожирением и инсулинорезистентных женщин с синдромом поликистозных яичников (СПКЯ) с лечением метформином и без него
,
Fertil Steril
,
2007
, vol.
88
(стр.
S183
—
S183
),,,,,.
Влияние метформина на инсулино-стимулированную тирозинкиназную активность эритроцитов женщин с ожирением и нормальной толерантностью к глюкозе
,
Diabetes Metab
,
1997
, vol.
2
(стр.
143
—
148
),,,,.
Транспорт глюкозы в клетках скелетных мышц человека в культуре — стимуляция инсулином и метформином
,
J Clin Invest
,
1992
, vol.
4
(стр.
1386
—
1395
).
Клиническая фармакокинетика метформина
,
Clin Pharmacokinet
,
1996
, vol.
5
(стр.
359
—
371
),,.
Семейства переносчиков глюкозы SGLT и GLUT: молекулярная основа нормальной и аберрантной функции
,
JPEN J Parenter Enteral Nutr
,
2004
, vol.
5
(стр.
364
—
371
),,,,.
Роль митоген-активируемой протеинкиназы в сигнальных каскадах инсулина и инсулиноподобного фактора роста I (IGF-I) для выработки прогестерона и IGF-связывающего белка-1 в клетках гранулезы человека
,
J Clin Endocrinol Metab
,
2003
, т.
7
(стр.
3385
—
3391
).
Клеточные механизмы инсулинорезистентности
,
J Clin Invest
,
2000
, vol.
2
(стр.
171
—
176
),,,,,.
Метформин изменяет передачу сигналов инсулина и жизнеспособность клеток гранулезы человека
,
Fertil Steril
,
2005
, vol.
84
(стр.
1173
—
1179
),,,.
Лечение метформином пациентов с синдромом поликистозных яичников, перенесших оплодотворение in vitro , улучшает результаты и связано с модуляцией инсулиноподобных факторов роста
,
Fertil Steril
,
2001
, vol.
3
(стр.
505
—
509
),,.
Ключевая роль метаболизма глюкозы в определении компетентности ооцитов в развитии
,
Репродукция
,
2010
, vol.
4
(стр.
685
—
695
).
Транспортеры глюкозы в трансэпителиальном транспорте глюкозы
,
J Electron Microsc (Tokyo)
,
1996
, vol.
4
(стр.
275
—
284
),,,,,.
Комбинированное изменение образа жизни и метформин у пациентов с ожирением и синдромом поликистозных яичников.Рандомизированное плацебо-контролируемое двойное слепое многоцентровое исследование
,
Hum Reprod
,
2006a
, vol.
1
(стр.
80
—
89
),,,,.
Использование метформина у женщин с СПКЯ, находящихся на лечении ЭКО
,
Hum Reprod
,
2006b
, vol.
6
(стр.
1416
—
1425
),,,,.
Метформин-индуцированная стимуляция аденозин-5′-монофосфат-активируемой протеинкиназы (PRKA) нарушает секрецию прогестерона в гранулезных клетках крыс
,
Biol Reprod
,
2006
, vol.
3
(стр.
342
—
351
),,,.
Влияние метформина на стероидогенез клеток гранулезы крупного рогатого скота: возможное участие аденозин-5′-монофосфат-активируемой протеинкиназы (AMPK)
,
Biol Reprod
,
2007
, vol.
3
(стр.
368
—
378
),,,,,.
Различные пути введения прогестерона и синдром поликистозных яичников: обзор литературы
,
Gynecol Endocrinol
,
2005
, vol.
2
(стр.
119
—
127
),,.
Инсулинорезистентность при синдроме поликистозных яичников: прогресс и парадоксы
,
Recent Prog Horm Res
,
2001
, vol.
56
(стр.
295
—
308
),.
Антигипергликемический эффект метформина — терапевтические и клеточные механизмы
,
Лекарства
,
1999
, т.
58
(стр.
31
—
39
),.
Метформин-ассоциированный лактоацидоз в Швеции 1977–1991
,
Eur J Clin Pharmacol
,
1993
, vol.
6
(стр.
589
—
591
),,,.
Клинические проявления и инсулинорезистентность (ИР) при синдроме поликистозных яичников (СПКЯ) у выходцев из Южной Азии и кавказцев: есть ли разница?
,
Clin Endocrinol (Oxf)
,
2002
, т.
3
(стр.
343
—
350
),,,.
Отдаленные последствия синдрома поликистозных яичников: результаты контрольного исследования через 31 год
,
Hum Fertil (Camb)
,
2000
, vol.
2
(стр.
101
—
105
),.
Действие инсулина на клетки гранулезы человека нормальных и поликистозных яичников опосредуется рецептором инсулина, а не рецептором инсулиноподобного фактора роста I типа
,
J Clin Endocrinol Metab
,
1995
, vol.
12
(стр.
3788
—
3790
),,,.
UKPDS 28: рандомизированное исследование эффективности раннего добавления метформина при лечении сульфонилмочевиной диабета 2 типа
,
Diabetes Care
,
1998
, vol.
1
(стр.
87
—
92
),,,,,,.
Избирательная резистентность яичников к передаче сигналов инсулина у женщин с синдромом поликистозных яичников
,
Fertil Steril
,
2003
, vol.
4
(стр.
954
—
965
)
© Автор, 2014. Опубликовано Oxford University Press от имени Европейского общества репродукции человека и эмбриологии.
Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License (http: // creativecommons.org / licenses / by / 4.0 /), который разрешает неограниченное повторное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Представляет ли авидность FDG-PET опухоли усиление гликолитического метаболизма при немелкоклеточном раке легкого? — Юго-западный медицинский центр Техасского университета
TY — JOUR
T1 — Представляет ли авидность FDG-PET опухоли усиление гликолитического метаболизма при немелкоклеточном раке легкого?
AU — Кернстин, Кемп Х.
AU — Faubert, Brandon
AU — Do, Quyen N.
AU — Rogers, Thomas J.
AU — Hensley, Christopher T.
AU — Cai, Ling
AU — Torrealba, Jose
AU — Оливер, Дуайт
AU — Wachsmann, Jason W.
AU — Lenkinski, Robert E.
AU — Malloy, Craig R.
AU — Deberardinis, Ralph J.
N1 — Информация о финансировании:
К.Х.К. является заведующим кафедрой кардиоторакальной хирургии Роберта Такера Хейса.R.J.D. является научным сотрудником факультета Роберта Л. Муди-старшего в Юго-Западном Техасском университете и медицинским исследователем Говарда Хьюза. Он финансируется Национальным институтом рака (R35-CA-220449) Национального института здоровья. K.H.K и R.J.D получили премию за переводческие исследования от V Foundation.
Информация о финансировании:
К.Х.К. является заведующим кафедрой кардиоторакальной хирургии Роберта Такера Хейса. R.J.D. является научным сотрудником факультета Роберта Л. Муди-старшего в Юго-Западном Техасском университете и медицинским исследователем Говарда Хьюза.Он финансируется Национальным институтом рака (R35-CA-220449) Национального института здоровья. K.H.K и R.J.D получили премию за переводческие исследования от V Foundation.
Авторские права издателя:
© 2020 Общество торакальных хирургов
PY — 2020/4
Y1 — 2020/4
N2 — Предпосылки: при немелкоклеточном раке легкого (NSCLC), 18-фтор-2-дезоксиглюкоза – позитронно-эмиссионная томография (FDG- ПЭТ) помогает в диагностике, постановке диагноза и оценке реакции на лечение. Одна из переменных FDG-PET, максимальное стандартное значение поглощения (SUVm), считается объективной мерой поглощения глюкозы.Однако мало что известно о судьбе глюкозы в опухолях легких, страдающих ФДГ, in vivo. В этом исследовании использовалось отслеживание стабильных изотопов глюкозы, чтобы определить, предсказывает ли SUVm гликолитический метаболизм или другие судьбы глюкозы в опухолях. Методы. В этом проспективном клиническом исследовании, одобренном институциональным наблюдательным советом, 52 нелеченым потенциально операбельным пациентам с подтвержденным НМРЛ была проведена компьютерная томография FDG-PET. Во время хирургической процедуры пациентам вводили глюкозу, меченную 13C. Образцы крови, опухоли и нормального легкого анализировали с помощью масс-спектрометрии для определения обогащения 13C промежуточными продуктами гликолиза.Эти значения сравнивали с клиническими переменными, включая SUVm, максимальный диаметр опухоли, стадию, степень и индекс пролиферации MIB-1 / Ki67. Результаты: для каждого пациента сравнивали обогащение 13C каждым метаболитом между опухолью и прилегающим легким. Хотя все опухоли метаболизируют глюкозу, SUVm не коррелирует с маркировкой гликолитических промежуточных продуктов. Скорее, SUVm коррелировал с маркерами, указывающими на использование других респираторных субстратов, включая лактат, и с индексом пролиферации. Выводы: SUVm не коррелирует с гликолитическим метаболизмом при НМРЛ человека, но действительно коррелирует с индексом пролиферации, предполагая, что SUVm предсказывает использование глюкозы другими путями, кроме гликолиза.Эти пути могут предлагать альтернативные терапевтические мишени, включая пути биосинтеза, необходимые для пролиферации клеток. Методы исследования в этом исследовании дают возможность понять взаимосвязь между SUVm, метаболизмом опухоли и терапевтической уязвимостью НМРЛ человека.
AB — Предпосылки: при немелкоклеточном раке легкого (НМРЛ) 18-фтор-2-дезоксиглюкоза-позитронно-эмиссионная томография (ФДГ-ПЭТ) помогает в диагностике, постановке стадий и оценке ответа на лечение. Одна из переменных FDG-PET, максимальное стандартное значение поглощения (SUVm), считается объективной мерой поглощения глюкозы.Однако мало что известно о судьбе глюкозы в опухолях легких, страдающих ФДГ, in vivo. В этом исследовании использовалось отслеживание стабильных изотопов глюкозы, чтобы определить, предсказывает ли SUVm гликолитический метаболизм или другие судьбы глюкозы в опухолях. Методы. В этом проспективном клиническом исследовании, одобренном институциональным наблюдательным советом, 52 нелеченым потенциально операбельным пациентам с подтвержденным НМРЛ была проведена компьютерная томография FDG-PET. Во время хирургической процедуры пациентам вводили глюкозу, меченную 13C. Образцы крови, опухоли и нормального легкого анализировали с помощью масс-спектрометрии для определения обогащения 13C промежуточными продуктами гликолиза.Эти значения сравнивали с клиническими переменными, включая SUVm, максимальный диаметр опухоли, стадию, степень и индекс пролиферации MIB-1 / Ki67. Результаты: для каждого пациента сравнивали обогащение 13C каждым метаболитом между опухолью и прилегающим легким. Хотя все опухоли метаболизируют глюкозу, SUVm не коррелирует с маркировкой гликолитических промежуточных продуктов. Скорее, SUVm коррелировал с маркерами, указывающими на использование других респираторных субстратов, включая лактат, и с индексом пролиферации. Выводы: SUVm не коррелирует с гликолитическим метаболизмом при НМРЛ человека, но действительно коррелирует с индексом пролиферации, предполагая, что SUVm предсказывает использование глюкозы другими путями, кроме гликолиза.Эти пути могут предлагать альтернативные терапевтические мишени, включая пути биосинтеза, необходимые для пролиферации клеток. Методы исследования в этом исследовании дают возможность понять взаимосвязь между SUVm, метаболизмом опухоли и терапевтической уязвимостью НМРЛ человека.
UR — http://www.scopus.com/inward/record.url?scp=85081654771&partnerID=8YFLogxK
UR — http://www.scopus.com/inward/citedby.url?scp=85081654771&partnerLogx=8YK
У2 — 10.1016 / j.athoracsur.2019.10.061
DO — 10.1016 / j.athoracsur.2019.10.061
M3 — Артикул
C2 — 31846640
AN — SCOPUS: 85081654771
VL — 109
SP
EP — 1025
JO — Annals of Thoracic Surgery
JF — Annals of Thoracic Surgery
SN — 0003-4975
IS — 4
ER —
Гипоксия-опосредованная активация фенотипической экспрессии MCT1 поддерживает глиобластомы
Абстрактный
РЕФЕРАТ
Предпосылки: Глиобластомы (GBM) представляют собой высокую клеточную гетерогенность с заметными некротическими областями, связанными с гипоксией, которая связана с агрессивностью опухоли.Опухоли GBM демонстрируют высокий уровень гликолитического метаболизма с повышенным продуцированием лактата, который экструдируется в микроокружение опухоли через переносчики монокарбоксилата (MCT). Хотя гипоксия-опосредованная регуляция MCT4 была охарактеризована, роль MCT1 все еще остается спорной. Таким образом, мы стремились понять роль гипоксии в регуляции экспрессии и функции MCT в GBM, в частности MCT1.
Методы: Экспрессия маркеров, связанных с гипоксией и гликолитом, а также изоформ MCT1 и MCT4 оценивалась на моделях in vitro и in vivo ортотопической глиомы, а также в тканях GBM человека с помощью иммунофлуоресценции и иммунофлюоресценции. Вестерн-блоттинг.После ингибирования MCT1 либо фармакологически с помощью CHC (α-циано-4-гидроксиннаминовая кислота), либо генетически с помощью siRNA, мы оценили жизнеспособность, пролиферацию, метаболизм, миграцию и инвазию клеток GBM в условиях нормоксии и гипоксии.
Результаты: Гипоксия индуцировала увеличение экспрессии плазматической мембраны MCT1 в клетках глиомы как в моделях in vitro, и in vivo, так и .


