12/л (10 в ст. 12/л), г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь и лекарственные препараты (по согласованию с врачом) за сутки до сдачи крови.
- Не принимать пищу в течение 8 часов перед исследованием, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общий анализ крови, как правило, включает в себя от 8 до 30 пунктов: подсчет количества эритроцитов, лейкоцитов, тромбоцитов в 1 микролитре или литре крови, а также ряд других показателей, описывающих форму, объем и другие характеристики этих клеток.
Обычно в дополнение к этому назначается лейкоцитарная формула (процентное соотношение различных форм лейкоцитов) и подсчет скорости оседания эритроцитов (СОЭ).
Основные показатели, которые входят в общий анализ крови:
- количество лейкоцитов (white blood cells, WBC),
- количество эритроцитов (red blood cells, RBC),
- уровень гемоглобина (hemoglobin content, Hb),
- гематокрит (рematocrit, Hct),
- средний объем эритроцита (MCV),
- среднее содержание гемоглобина в эритроците (MCH),
- средняя концентрация гемоглобина в эритроцитах (MCHC),
- тромбоциты (platelet count, PC).
Кровь состоит из клеток (форменных элементов) и жидкой части – плазмы. Эти клетки – эритроциты, лейкоциты и тромбоциты – образуются и созревают в костном мозге и должны попадать в системный кровоток по мере необходимости.
При изучении мазка крови под микроскопом капля крови помещается на стекло, размазывается шпателем, а затем окрашивается специальным красителем и высушивается. После этого врач лаборатории может детально рассмотреть ее под микроскопом.
Отношение объема форменных элементов к плазме называется гематокритом. Изменение этого показателя характеризует степень «разжижения» или «сгущения» крови.
Изменение этого показателя характеризует степень «разжижения» или «сгущения» крови.
Лейкоциты
Лейкоциты – клетки, помогающие организму бороться с инфекцией. Они способны определять чужеродные агенты (бактерии, вирусы) в организме и уничтожать их.
Выделяют 5 различных видов лейкоцитов: эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты. Подсчет количества лейкоцитов, входящий в общий анализ крови, позволяет узнать суммарное количество всех типов клеток, лейкоцитарная формула – каждого типа в отдельности.
Общее количество лейкоцитов, как правило, повышено при остром инфекционном процессе, вызванном бактериями. Если лейкоцитов слишком мало, то организм становится более подверженным различным инфекциям.
Эритроциты
Эритроциты – клетки, имеющие форму бублика с более тонкой частью в центре вместо дырки. В их составе есть гемоглобин – белок, содержащий железо, который обладает способностью переносить кислород от легких к тканям и органам, а углекислый газ – от тканей и органов к легким, из которых он выдыхается. Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12— или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12— или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Тромбоциты
Тромбоциты – клетки, играющие значительную роль в свертывании крови. Если у человека снижено количество тромбоцитов, риск кровотечения и образования синяков у него повышен.
Для чего используется исследование?
Данный тест применяют для общей оценки состояния здоровья, диагностики анемии, инфекций и множества других заболеваний. Фактически это совокупность анализов, оценивающих различные показатели крови.
- Подсчет количества лейкоцитов определяет количество лейкоцитов в единице крови (литре или микролитре). Его повышение или понижение может иметь значение в диагностике инфекций или, например, заболеваний костного мозга.
- Соответственно, количество эритроцитов в единице крови (литре или микролитре) определяет подсчет количества эритроцитов. Он необходим для диагностики анемии или полицитемии и дифференциальной диагностики различных типов анемий.
- Уровень гемоглобина важен для оценки тяжести анемии или полицитемии и для контроля за эффективностью терапии этих состояний.
- Гематокрит – процентное соотношение клеток крови (форменных элементов) к жидкой ее части. Используется в комплексной оценке анемий и полицитемий, для принятия решения о переливании крови и оценки результатов этой процедуры.
- Подсчет количества тромбоцитов определяет количество тромбоцитов в единице крови (литре или микролитре). Используется для выявления нарушений свертывания или заболеваний костного мозга.
- Средний объем эритроцита (MCV) – усредненный показатель, отражающий размер эритроцитов. Он необходим для дифференциальной диагностики различных типов анемий. Так, при B12-дефицитной анемии размер эритроцитов увеличивается, при железодефицитной – уменьшается.
- Среднее содержание гемоглобина в эритроците (MCH) – показатель того, сколько гемоглобина в среднем содержится в одном эритроците. При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
- Средняя концентрация гемоглобина в эритроците (MCHC) отражает насыщение эритроцита гемоглобином. Это более чувствительный параметр для определения нарушений образования гемоглобина, чем MCH, так как он не зависит от среднего объема эритроцита.
- Распределение эритроцитов по объему (RDW) – показатель, определяющий степень различия эритроцитов по размеру. Имеет значение в диагностике анемий.
- Средний объем тромбоцита (MPV) – характеристика тромбоцитов, которая может косвенно свидетельствовать об их повышенной активности или о наличии чрезмерного количества молодых тромбоцитов.

Когда назначается исследование?
Общий анализ крови – самый распространенный лабораторный анализ, используемый для оценки общего состояния здоровья. Он выполняется при плановых медицинских осмотрах, при подготовке к оперативному вмешательству, входит в медкомиссию при устройстве на работу.
Если человек жалуется на утомляемость, слабость или у него есть признаки инфекционного заболевания, воспаления, повышенная температура тела, то, как правило, назначается общий анализ крови.
Значительное повышение количества лейкоцитов обычно подтверждает воспаление. Снижение эритроцитов и гемоглобина говорит об анемии и требует дополнительных обследований для уточнения ее причины.
Множество различных патологических состояний могут приводить к изменениям количества основных клеточных популяций в крови. Общий анализ крови назначается для контроля за эффективностью лечения анемии или инфекционного заболевания, а также для оценки негативного влияния на клетки крови некоторых лекарств. 12/л
12/л
RDW-SD (распределение эритроцитов по объёму, стандартное отклонение): 37 — 54.
RDW-CV (распределение эритроцитов по объёму, коэффициент вариации): 11,5 — 14,5.
Гемоглобин
|
Возраст |
Референсные значения |
||
|
Меньше 2 недель |
134 — 198 г/л |
||
|
2 недели – 2 месяца |
124 — 166 г/л |
||
|
2-12 месяцев |
110 — 131 г/л |
||
|
1-2 года |
110 — 132 г/л |
||
|
2-3 года |
111 — 133 г/л |
||
|
3-4 года |
112 — 134 г/л |
||
|
4-5 лет |
114 — 134 г/л |
||
|
5-6 лет |
113 — 135 г/л |
||
|
6-7 лет |
115 — 135 г/л |
||
|
7-8 лет |
116 — 138 г/л |
||
|
8-9 лет |
115 — 137 г/л |
||
|
9-10 лет |
118 — 138 г/л |
||
|
10-11 лет |
114 — 140 г/л |
||
|
11-12 лет |
118 — 142 г/л |
||
|
12-13 лет |
117 — 143 г/л |
||
|
13-14 лет |
121 — 145 г/л |
||
|
14-15 лет |
120 — 144 г/л |
||
|
15-16 лет |
130 — 168 г/л |
||
|
16-17 лет |
130 — 168 г/л |
||
|
17-18 лет |
120 — 148 г/л |
||
|
18-45 лет
|
Мужской |
132 — 173 г/л |
|
| Женский |
117 — 155 г/л |
||
|
45-65 лет
|
Мужской |
131 — 172 г/л |
|
| Женский | 117 — 160 г/л | ||
|
Больше 65 лет
|
Мужской | 126 — 174 г/л | |
| Женский | 117 — 161 г/л | ||
Гематокрит
|
Пол |
Возраст |
Референсные значения |
|
Меньше 1 года |
33 — 41 % |
|
|
1-3 года |
32 — 40 % |
|
|
3-6 лет |
32 — 42 % |
|
|
6-9 лет |
33 — 41 % |
|
|
9-12 лет |
34 — 43 % |
|
|
Женский |
12-15 лет |
34 — 44 % |
|
15-18 лет |
34 — 44 % |
|
|
18-45 лет |
35 — 45 % |
|
|
45-65 лет |
35 — 47 % |
|
|
Больше 65 лет |
35 — 47 % |
|
|
Мужской |
12-15 лет |
35 — 45 % |
|
15-18 лет |
37 — 48 % |
|
|
18-45 лет |
39 — 49 % |
|
|
45-65 лет |
39 — 50 % |
|
|
Больше 65 лет |
39 — 50 % |
Снижение показателей отмечается при железо-, B12-дефицитной и других анемиях, острых и хронических кровотечениях.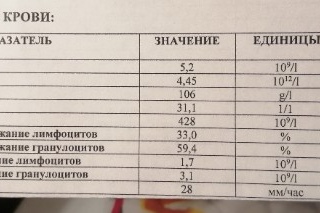
Повышение – при истинной полицитемии, обезвоживании, кислородном голодании.
Средний объем эритроцита (MCV)
|
Пол |
Возраст |
Референсные значения |
|
|
Меньше 1 года |
71 — 112 фл |
|
1-5 лет |
73 — 85 фл |
|
|
5-10 лет |
75 — 87 фл |
|
|
10-12 лет |
76 — 94 фл |
|
|
Женский |
12-15 лет |
73 — 95 фл |
|
15-18 лет |
78 — 98 фл |
|
|
18-45 лет |
81 — 100 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
|
|
Мужской |
12-15 лет |
77 — 94 фл |
|
15-18 лет |
79 — 95 фл |
|
|
18-45 лет |
80 — 99 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
Среднее содержание гемоглобина в эритроците (MCH)
|
Возраст |
Референсные значения |
|
Меньше 1 года |
31 — 37 пг |
|
1-3 года |
24 — 33 пг |
|
3-12 лет |
25 — 33 пг |
|
13-19 лет |
26 — 32 пг |
|
Больше 19 лет |
27 — 31 пг |
Повышение показателя отмечается при B12— и фолиеводефицитной анемии.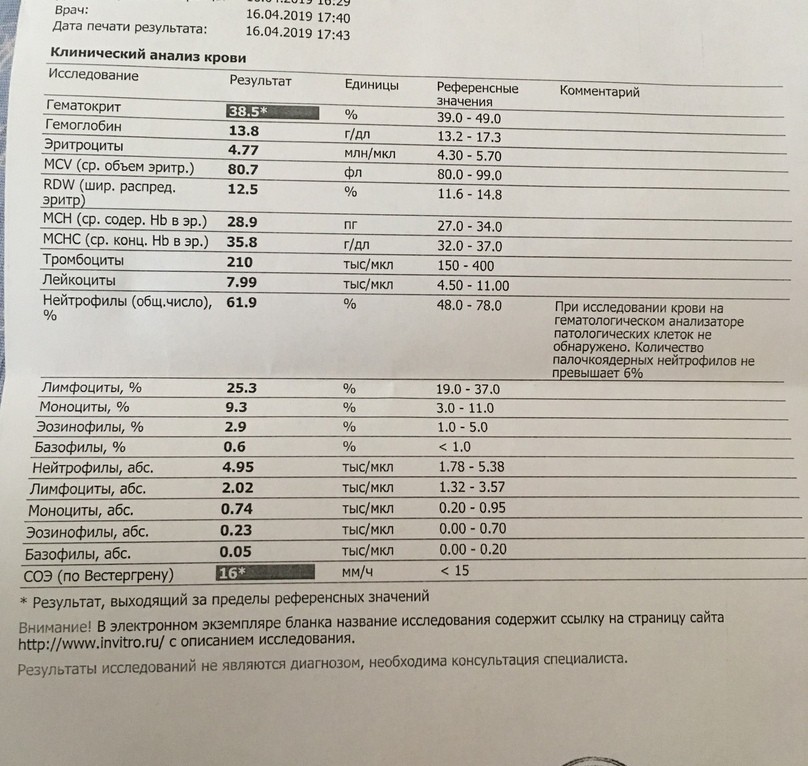
Снижение – при железодефицитной анемии и талассемии.
Средняя концентрация гемоглобина в эритроците (MCHC)
|
Возраст |
Референсные значения |
|
Меньше 1 года |
290 — 370 г/л |
|
1-3 года |
280 — 380 г/л |
|
3-12 лет |
280 — 360 г/л |
|
13-19 лет |
330 — 340 г/л |
|
Больше 19 лет |
300 — 380 г/л |
Понижение показателя отмечается при анемии.9/л
Понижение – при иммунной тромбоцитопенической пурпуре, онкологических заболеваниях костного мозга, сепсисе. Повышение показателя отмечается при истинной полицитемии, онкологических заболеваниях, туберкулезе, удалении селезенки.
Что может влиять на результат?
На различные показатели могут оказывать влияние, соответственно, разные факторы: беременность, курение, прием некоторых лекарств, интенсивная физическая нагрузка.
Также рекомендуется
Кто назначает исследование?
Терапевт, хирург, инфекционист, гематолог, нефролог.
Страница не найдена | Sante Clinic
Медицинские и косметологические услуги
Больше услуг
Клиника расположилась в удобной транспортной доступности по адресу Мневники 23.
Профессиональная деятельность Sante Clinic охватывает более 10 различных направлений, среди которых терапия,
урология, гинекология, гирудотерапия, эндокринология, диетология, педиатрия, неврология, мануальная терапия,
дерматология и косметология.
Зубова
Валентина Юрьевна
Главный врач Sante Clinic
Выгодные предложения для вас в одном месте
Все акции
-
Акция анализы: Витамин Д %
Скидка на анализ (стоимость включает забор)
-
Акция на Губы
Делаем вам губы с хорошей скидкой — звоните чтобы узнать подробности!
-
Акция по вагинопластике! Скидка до конца июня %
Лазерная вагинопластика на самом современном оборудовании! Скидка до конца июня.
-
Армирование лица нитями
Армирование лица нитями — лучшее предложение!
-
Женское здоровье — УЗИ орг м/таза + УЗИ м/желез+ УЗИ щитовидной железы
Женское здоровье — УЗИ орг м/таза + УЗИ м/желез+ УЗИ щитовидной железы 3290 вместо 4700. Выполняется с 5 по 10 день менструального цикла
-
Женское здоровье Check Up
Первичный и повторный прием гинеколога. УЗИ орг м/таза + УЗИ м/желез. Цитологическое исследование мазков с поверхности шейки матки и цервикального канала на атипию. Микроскопическое исследование препаратов отделяемого мочеполовых органов. Кольпоскопия
-
Контурная пластика лица
препаратом Радиес
Контурная пластика лица препаратом Радиес 3 мл — со скидкой!
-
Лечение гипергидроза,
(повышенной потливости)
Лечение гипергидроза ( повышенной потливости ) 100 ед. со скидкой!
-
Обследование ПЦР на 12 инфекций
Обследование ПЦР на 12 инфекций по выгодной цене
-
Скидка на Ботулотоксин!
Ботулотоксин — специальное предложение от SanteClinic (скидка за ед.)
-
Эпиляция : Ноги полностью,
бикини, подмышки
Скидка более 50% на Эпиляцию : Ноги полностью, бикини, подмышки
Гемоглобин — одна из мишеней коронавируса COVID-19
Перевод на русский язык компании Logrus Global: https://logrusglobal.ru
COVID-19: атакует 1-бета-цепь гемоглобина и захватывает порфирин, чтобы ингибировать метаболизм человеческого гема.
14 апреля 2020 г.
Скачать PDF-версию
Авторы: Вэньчжун Лю1,2,*, Хуалань Ли2
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологической и пищевой промышленности, Ибиньский университет, Ибинь, 644000, Китай;
* Адрес для переписки: [email protected].
Конспект
Новая коронавирусная пневмония (COVID-19) представляет собой контагиозную острую респираторную инфекцию, вызванную новым коронавирусом. Этот вирус представляет собой РНК-вирус с позитивной полярностью цепи, имеющий высокую степень гомологии с коронавирусом летучей мыши. В этом исследовании для сравнения биологических ролей некоторых белков нового коронавируса использовали анализ консервативных доменов, гомологическое моделирование и молекулярную стыковку. Результаты показали, что белок ORF8 и поверхностный гликопротеин могут связываться с порфирином. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, становится все меньше и меньше. Клетки легких испытывают чрезвычайно сильное отравление и воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Этот механизм также нарушает нормальный анаболический путь гема в организме человека, что, как ожидается, приводит к развитию заболевания. Согласно валидационному анализу полученных результатов, хлорохин может предотвратить атаку белков orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них, обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
Ключевые слова: новый коронавирус; респираторный дистресс; вид матового стекла изображения легкого; гликопротеин E2; ОRF8; оrf1ab; хлорохин; кровь; диабетический; флуоресцентный резонансный энергоперенос; древний вирус; цитокиновый шторм.
1. Введение
Новая коронавирусная пневмония (COVID-19) — контагиозное острое респираторное инфекционное заболевание. Пациенты с коронавирусной пневмонией страдают от лихорадки с температурой выше 38 градусов с такими симптомами, как сухой кашель, усталость, одышка, затрудненное дыхание, при визуализации легких они имеют вид матового стекла1-3. При морфологическом исследовании образцов тканей можно обнаружить большое количество слизи без явных вирусных включений. Эта пневмония была впервые обнаружена в декабре 2019 года на южнокитайском рынке морепродуктов провинции Хубэй, Китай4. Инфекция имеет высокую контагиозность5,6. Сейчас количество инфицированных людей достигло десятков тысяч по всему миру, и распространение инфекции не ограничено расой и границами. Исследователи провели тесты на выделение вирусов и секвенирование нуклеиновых кислот, чтобы подтвердить, что заболевание было вызвано новым коронавирусом7,8. Отмечено, что нуклеиновая кислота нового коронавируса представляет собой РНК с позитивной полярностью цепи8. Его структурные белки включают: белок-шип (S), белок оболочки (E), мембранный белок (M) и нуклеокапсидный фосфопротеин. Транскрибируемые неструктурные белки включают: orf1ab, ORF3a, ORF6, ORF7a, ORF10 и ORF8. Новый коронавирус высоко гомологичен коронавирусу летучих мышей9,10 и обладает значительной гомологией по отношению к вирусу SARS11,12. Исследователи изучили функцию структурных белков и некоторых неструктурных белков нового коронавируса13,14. Но новый коронавирус обладает целым набором потенциальных геномных характеристик, часть которых в основном является причиной вспышки в человеческой популяции15,16. Например, CoV EIC (белок оболочки коронавируса с функцией ионного канала) участвует в модулировании высвобождения вириона и взаимодействия «CoV — хозяин»17. Шип-белки, белки ORF8 и ORF3a значительно отличаются от белков других известных SARS-подобных коронавирусов, и они могут вызывать более серьезные различия в патогенности и передаче по сравнению с известными для SARS-CoV18. Более ранние исследования показали, что новый коронавирус проникает в эпителиальные клетки с использованием шип-белка, взаимодействующего с рецепторным белком ACE2 человека на поверхности клетки, что и вызывает инфекцию у людей. Однако структурный анализ шип-белка (S) нового коронавируса показывает, что белок S лишь слабо связывается с рецептором ACE2 по сравнению с коронавирусом SARS19. Из-за ограничений существующих экспериментальных методов специфические функции вирусных белков, таких как ORF8 и поверхностный гликопротеин, до сих пор неясны. Механизм патогенности нового коронавируса остается загадочным20.
В литературе21 описаны показатели биохимического исследования 99 пациентов с вызванной новым коронавирусом пневмонией, и в этом отчете отражены аномалии связанных с гемоглобином показателей биохимических анализов пациентов. Согласно отчету, количество гемоглобина и нейтрофилов у большинства пациентов снизилось, а индексные значения сывороточного ферритина, скорости оседания эритроцитов, С-реактивного белка, альбумина и лактатдегидрогеназы у многих пациентов значительно возросли. Эти изменения предполагают, что содержание гемоглобина у пациента уменьшается, а гема увеличивается, и организм будет накапливать слишком много вредных ионов железа, что вызовет воспаление в организме и увеличит уровни С-реактивного белка и альбумина. Клетки реагируют на стресс, вызванный воспалением, производя большое количество сывороточного ферритина для связывания свободных ионов железа, чтобы уменьшить повреждения. Гемоглобин состоит из четырех субъединиц, 2-α и 2-β, и каждая субъединица имеет железосодержащий гем22,23. Гем является важным компонентом гемоглобина. Это порфирин, содержащий железо. Структура без железа называется порфирином. Когда железо находится в двухвалентном состоянии, гемоглобин может отщеплять углекислый газ и связывать атомы кислорода в альвеолярных клетках, при этом железо окисляется до трехвалентного уровня. Когда гемоглобин становится доступен другим клеткам организма через кровь, он может высвобождать атомы кислорода и присоединять углекислый газ, а железо восстанавливается до двухвалентного.
Особо эффективных лекарств и вакцин для борьбы с болезнью, вызванной новым коронавирусом, не существует24. Однако в недавних поисках клинических методов лечения было обнаружено несколько старых препаратов, которые могут подавлять некоторые функции вируса, например, хлорохина фосфат оказывает определенное влияние на новую коронавирусную пневмонию25. Хлорохина фосфат — это противомалярийный препарат, который применяется в клинике уже более 70 лет. Эксперименты показывают, что эритроциты, инфицированные возбудителем малярии, могут накапливать большое количество хлорохина. Препарат приводит к потере фермента гемоглобина и смерти паразита из-за недостаточности аминокислот для его роста и развития. Предполагается, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Между тем мы можем отметить, что хлорохин также широко используется для лечения порфирии26,27.
Поэтому мы предположили, что присоединение вирусных белков к порфиринам вызовет ряд патологических реакций у человека, таких как снижение уровня гемоглобина. Из-за тяжелой эпидемии и существующих условий с ограниченными экспериментальными методами тестирования функций белков большое научное значение имеет анализ функции белков нового коронавируса методами биоинформатики.
В этом исследовании для анализа функций белков, связанных с вирусом, использовались методы прогнозирования консервативных доменов, гомологического моделирования и молекулярной стыковки. Это исследование показало, что белок ORF8 и поверхностный гликопротеин способны объединяться с порфирином с образованием комплекса, в то время как белки orf1ab, ORF10, ORF3a скоординировано атакуют гем на 1-бета-цепи гемоглобина и отщепляют железо с образованием порфирина. Этот механизм вируса подавляет нормальный метаболический путь гема и приводит к проявлению у людей симптомов заболевания. Основываясь на результатах вышеупомянутых исследований, с помощью технологии молекулярной стыковки мы также проверили то, каким образом хлорохина фосфат и фавипиравир могут быть полезны в клинической практике.
2. Материалы и методы
2.1. Набор данных
Следующие последовательности белка загружали из NCBI: все белки нового коронавируса Ухань, гем-связывающий белок; гемоксидаза; для анализа консервативного домена использовали белковые последовательности.
Все белки нового коронавируса Ухань также использовали для конструирования трехмерных структур путем гомологического моделирования.
В то же время следующие файлы были загружены из базы данных PDB: кристаллическая структура MERS-CoV nsp10_nsp16 комплекс—5yn5, гем, оксигемоглобин человека 6bb5; дезоксигемоглобин человека 1a3n; 0TX; Rp. Комплекс MERS-CoV nsp10_nsp16—5yn5 использовался для гомологического моделирования. Гем, 0TX и 1RP использовались для молекулярной стыковки. Два оксигемоглобин был использован для стыковки белков.
2.2. Блок-схема биоинформационного анализа
На основе опубликованных в данном исследовании биологических белковых последовательностей была проведена серия биоинформационного анализа. Этапы показаны на рисунке 1:1. Консервативные домены вирусных белков анализируются28-30 онлайн-сервером МЕМЕ. Консервативные домены использовались для прогнозирования функциональных различий вирусных белков и белков человека. 2. Трехмерная структура вирусных белков была построена путем гомологического моделирования в средстве Swiss-model31,32. Если длина последовательности превышала 5000 нуклеотидов, использовался инструмент гомологического моделирования Discovery-Studio 2016. 3. Использование технологии молекулярной стыковки (инструмент LibDock) Discovery-Studio 201633 позволило смоделировать рецептор-лигандное соединение вирусных белков с гемом человека (или порфиринами). С учетом результатов биоинформационного анализа была построена модель жизненного цикла вируса и предложена соответствующая молекулярная картина заболевания.
Рисунок 1. Блок-схема биоинформационного анализа.
Рабочий процесс основан на эволюционных принципах. Хотя биологическая последовательность, характерная для развитых форм жизни и вируса, отличается, молекулы с аналогичными структурами всегда могут играть аналогичные биологические роли. В методе гомологического моделирования используется принцип, согласно которому аналогичная первичная структура белковых последовательностей имеет аналогичную пространственную структуру. Метод молекулярной стыковки построен на гомологическом моделировании реальных трехмерных молекул.
2.3. Анализ консервативного домена
MEME Suite — это онлайн-сайт, который объединяет множество инструментов прогнозирования и описания мотивов. Алгоритм максимального ожидания (EM) является основой для идентификации мотива на сайте MEMЕ. Мотив представляет собой консервативный домен небольшой последовательности в белке. Модели, основанные на мотивах, помогают оценить надежность филогенетического анализа. После открытия онлайн-инструмента MEME интересующие белковые последовательности объединяют в текстовый файл, при этом сохраняется формат файла .fasta. Затем выбирают нужное количество мотивов и нажимают кнопку «Перейти». В конце анализа консервативные домены отображаются после нажатия на ссылку.
2.4. Гомологическое моделирование
SWISS-MODEL — это полностью автоматический сервер гомологического моделирования структуры белка, доступ к которому можно получить через веб-сервер. Первый шаг — войти на сервер SWISS-MODEL, ввести последовательность и нажать Search Template («Поиск шаблона»), чтобы выполнить простой поиск шаблона. После завершения поиска можно выбрать шаблон для моделирования. Поиск шаблонов выполняется нажатием кнопки Build Model, и модель шаблона выбирается автоматически. Как видно, было найдено несколько шаблонов, а затем построено множество моделей. Здесь выбирается только модель. Модель в формате PDB загружается и визуализируется в VMD. SWISS-MODEL моделирует только белковые модели, соответствующие последовательностям менее 5000 нуклеотидных оснований. Для моделирования белка, соответствующего последовательности более 5000 нуклеотидов, можно использовать инструмент гомологического моделирования Discovery-Studio.
Перед использованием Discovery-Studio для гомологического моделирования неизвестного белка (такого, как orf1ab) файл структуры pdb матричного белка, такого как MERS-CoVnsp10_nsp16 комплекс 5yn5, должен быть загружен из базы данных PDB. Затем для сопоставления гомологичных последовательностей белков 5yn5 и orf1ab был применен инструмент сопоставления последовательностей Discovery-Studio. Затем был построен файл пространственной структуры orf1ab на основе матричного белка 5yn5.
2.5. Технология молекулярной стыковки
Молекулярная стыковка — это процесс нахождения наилучшего соответствия между двумя или более молекулами посредством определения геометрического и энергетического соответствия. Этапы использования молекулярной стыковки LibDock с Discovery-Studio следующие:
1. Подготовка модели лиганда. Откройте файл лиганда, например, гема, и нажмите кнопку Prepare Ligands («Подготовка лигандов») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептор-лиганд»), чтобы создать модель лиганда гема для стыковки. Сначала удалите FE (атом железа) из гема, а затем нажмите кнопку Prepare Ligands («Подготовка лигандов»), после чего будет сгенерирована модель лиганда порфирина. При открытии 0 XT снова нажмите кнопку Prepare Ligands («Подготовка лигандов»), чтобы получить модель хлорохинового лиганда.
2. Подготовьте модель белкового рецептора. Откройте файл pdb белка (сгенерированный с помощью гомологического моделирования) и нажмите Prepare protein («Подготовка белка») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»), чтобы создать модель рецептора белка для стыковки.
3. Установите параметры стыковки для ее достижения. Выберите модель генерируемого белкового рецептора. В подменю Define and Edit Binding Site («Определение и редактирование сайта связывания») в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») нажмите кнопку From receptor Cavities («Из полостей рецептора»). На диаграмме модели рецептора белка появляется красная сфера. После щелчка правой кнопкой мыши по красному шару можно изменить его радиус. Затем в меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом») выберите Dock Ligands (LibDock) («Док-лиганды LibDock») в подменю Dock Ligands («Док-лиганды»). Во всплывающем окне выберите лиганд в качестве вновь созданной модели лиганда (ALL) и выберите рецептор в качестве вновь созданной модели рецептора (ALL), а для сфер сайтов задайте только что установленные координаты сфер. Наконец, нажмите RUN («Выполнить»), чтобы начать стыковку.
4. Рассчитайте энергию связывания и выберите положение с наибольшей энергией связывания. После завершения стыковки будет отображено множество местоположений лиганда. Откройте окно стыковки и нажмите кнопку Caculate Binding Energies («Рассчитать энергии связывания») в подменю Dock Ligands («Док-лиганды») меню Receptor-Ligand Interactions («Взаимодействие рецептора с лигандом»). Во всплывающем окне выберите рецептор в качестве значения по умолчанию, лиганд в качестве стыкуемой модели (ALL), а затем запустите вычисление энергии связывания. Наконец, сравните энергию связывания и выберите положение с наибольшей энергией связывания. Чем выше стабильность комплекса, тем больше энергия связывания.
5. Экспортируйте вид совместного сечения. Для вида в состоянии стыковки после установки стиля отображения области связывания нажмите кнопку Show 2D Map («Показать 2D-карту») в подменю View Interaction («Просмотр взаимодействия») меню Receptor-Ligand Interaction («Взаимодействие между рецептором и лигандом»), чтобы открыть вид участка связывания. Это представление может быть сохранено в виде файла изображения.
2.6. Технология стыковки белков
ZDOCK от Discovery-Studio — это еще один инструмент молекулярной стыковки для изучения взаимодействий белков. Мы использовали его для изучения атаки гемоглобина вирусными неструктурными белками. Ниже приведено описание стыковки orf1ab и гемоглобина, при изучении стыковки с другими неструктурными белками вируса применяли аналогичные методы стыковки. После открытия PBD-файлов человеческого оксигемоглобина 6bb5 и белка orf1ab нажмите кнопку Dock proteins (ZDOCK) в меню Dock and Analyze Protein Comlexes («Стыковка и анализ белковых комплексов»). Во всплывающем интерфейсе выберите человеческий оксигемоглобин 6bb5 в качестве рецептора, а orf1a в качестве лиганда, а затем нажмите кнопку Run («Выполнить»). После того как компьютер закончит вычисления, нажмите на интерфейс proteinpose («положение белка») и выберите положение и кластер с самым высоким баллом ZDOCK. Так можно получить положение белка orf1ab на человеческом оксигемоглобине 6bb5. Дезоксигемоглобин человека 1a3n имеет сходную схему стыковки с белком orf1ab.
3. РЕЗУЛЬТАТЫ
3.1. Вирусные структурные белки, связывающие порфирин
У человека гемоглобин может разлагаться на глобин и гем. Гем состоит из порфирина и иона железа, при этом ион железа находится в середине порфирина. Гем нерастворим в воде и может быть объединен с гем-связывающими белками с образованием комплекса и транспортироваться в печень. Порфирин разлагается до билирубина и выводится через желчный проток, а железо, содержащееся в молекуле, может повторно использоваться организмом. Если вирусные белки могут связываться с порфирином гема, они должны обладать связывающей способностью, аналогичной гем-связывающему белку человека, то есть вирусные белки и гем-связывающие белки должны иметь аналогичные консервативные домены. Для изучения связывания структурных белков вируса и порфирина в настоящей работе были применены следующие методы биоинформатики.
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 2. Консервативные домены в структурных белках и гем-связывающих белках человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембранного гликопротеина. D. Консервативные домены нуклеокапсидного фосфопротеина.
Затем онлайн-сервер Swiss-model смоделировал поверхностные гликопротеины для получения трехмерной структуры, и были выбраны два вида файлов на основе шаблонов Spike и E2. 3D-структурный файл гема был загружен из базы данных PDB.
В конце концов Discovery-Studio реализовала молекулярную стыковку поверхностных гликопротеинов и порфирина. Сначала не удалось стыковать белок-шип с гемом (и порфирином). Гликопротеин Е2 (рисунок 3.A) получен из матриц 1zva.1.A. Стыковка гликопротеина Е2 и гема также была безуспешной. Когда удалили ион железа и гем стал порфирином, удалось выполнить множество видов стыковки между гликопротеином E2 и порфирином. После вычисления энергии связывания за результат была принята позиция стыковки с самой высокой энергией связывания (7 530 186 265,80 ккал/моль). Результат стыковки показан на рисунке 4.A-1, где представлена молекулярная модель связывания гликопротеина E2 с порфирином.
На рисунке 4.A-2 представлен двухмерный вид участка связывания, в котором 18 аминокислот гликопротеина Е2 взаимодействуют с порфирином.
При анализе белка оболочки использовались те же методы. Шаблон 5×29.1. A был выбран в качестве шаблона 3D-структуры белка оболочки (рисунок 3.B). Discovery-Studio обнаружила несколько видов стыковки белка оболочки и порфирина, где было выбрано положение стыковки с самой высокой энергией связывания (219 317,76 ккал/моль). На рисунке 4.B-1 показан результат стыковки, представляющий собой молекулярную модель связывания белка оболочки с порфирином. Рисунок 4.В-2 представляет двухмерный вид участка связывания, в котором 18 аминокислот белка оболочки взаимодействуют с порфирином.
Те же методы использовались для анализа нуклеокапсидного фосфопротеина. В качестве шаблона фосфопротеина нуклеокапсида использовали 1ssk.1.А (рисунок 3.С). Discovery-Studio позволила выявить вариант стыковки между нуклеокапсидным фосфопротеином и порфирином с самой высокой энергией связывания (15 532 506,53 ккал/моль). На рисунке 4.С-1 показан результат стыковки, представляющий собой молекулярную модель связывания нуклеокапсидного фосфопротеина с порфирином. На рисунке 4.C-2 представлен двухмерный вид связывающего участка, где 22 аминокислоты нуклеокапсидного фосфопротеина связаны с порфирином. Мембранный белок получен из шаблонов 1zva.1.A. Состыковать мембранный белок с гемом (и порфирином) не удалось. Полученные результаты свидетельствуют, что поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин могут связываться с порфирином с образованием комплекса.
Было обнаружено, что энергия связывания белка оболочки была самой низкой, энергия связывания гликопротеина Е2 была самой высокой, а энергия связывания нуклеокапсидного фосфопротеина была средней. Это означает, что связывание гликопротеина Е2 с порфирином является наиболее стабильным, связывание нуклеокапсидного фосфопротеина с порфирином является неустойчивым, а связывание белка оболочки с порфирином является наиболее неустойчивым.
После этого был проведен следующий анализ, чтобы выяснить, атакуют ли структурные белки гем с отщеплением атома железа и образованием порфиринов. Гем имеет оксидазу, называемую гемоксидазой, которая окисляет гем и отщепляет ион железа. Если структурные белки могут атаковать гем и отщеплять ионы железа, они должны иметь такой же консервативный домен, как гемоксидаза. Онлайн-сервер MEME был использован для поиска консервативных доменов структурных белков и белков гемоксидазы (NP_002124.1: гемоксигеназы-1; BAA04789.1: гемоксигеназы-2; AAB22110.2: гемоксигеназы-2). В результате консервативных доменов структурных белков обнаружено не было (рисунок 5). Объединяя этот результат с результатом предыдущего анализа, можно предположить, что структурные белки могут объединяться только с порфирином. Можно сделать вывод, что структурные белки не атакуют гем, вызывая диссоциацию атома железа с образованием порфирина.
Рисунок 3. Трехмерные структурные схемы новых белков коронавируса, полученные с помощью гомологического моделирования. A. Гликопротеин E2 поверхностного гликопротеина. B. Белок оболочки. C. Нуклеокапсидный фосфопротеин. D. Белок orf1ab. E. Белок ORF8. F. Белок ORF7a.
Рисунок 4. Результаты молекулярной стыковки структурных белков вируса и порфирина (красная структура). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Рисунок 5. Консервативные домены структурных белков и белков гемоксигеназы человека. A. Консервативные домены поверхностного гликопротеина. B. Консервативные домены белка оболочки. C. Консервативные домены мембраны. D. Консервативные домены нуклеокапсидного фосфопротеина.
3.2. Неструктурные белки вируса, связывающие порфирин
Сначала на онлайн-сервере MEME был выполнен поиск консервативных доменов в каждом структурном белке вируса и человеческом гем-связывающем белке (ID:NP_057071.2 гем-связывающий белок 1, ID: EAW47917.1 гем-связывающий белок 2). На рисунке 2 показано, что три вирусных белка (поверхностный гликопротеин, белок оболочки и нуклеокапсидный фосфопротеин) и белки связывания гема имеют консервативные домены, но мембранный гликопротеин не имеет консервативных доменов, p-значения малы, различия статистически значимы. Домены в трех вирусных белках различны, что позволяет предположить некоторое различие способностей структурных белков связывать порфирин. Мембранный гликопротеин не может связываться с порфирином.
Рисунок 6. Консервативные домены в неструктурных белках и гем-связывающих белках человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
Гомологическое моделирование и технология молекулярной стыковки были применены для изучения способности белка orf1ab связывать гем. Поскольку Swiss-model не может моделировать 3D-структуру белковой последовательности orf1ab из-за ограничения на длину кодирующей последовательности (не более 5000 нуклеотидов), для гомологического моделирования использовалась программа Discovery-Studio. Кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 и гема была загружена из базы данных PDB. В этом исследовании кристаллическая структура комплекса MERS-CoV nsp10_nsp16 5yn5 была взята в качестве матрицы для создания гомологичной структуры белка orf1ab. В качестве 3D-структуры белка orf1ab была выбрана гомологичная структура по умолчанию (рисунок 3.D). Затем в программе Discovery-Studio была проведена молекулярная стыковка белка orf1ab и порфирина. Белок orf1ab и гем не удалось состыковать, но после удаления ионов железа и превращения гема в порфирин радиус действия увеличился и несколько типов стыковки удалось довести до конца. Путем вычисления энергии связывания была выбрана модель стыковки с наибольшей энергией связывания (561 571,10 ккал/моль). Результат стыковки показан на рисунке 7.A-1, где представлена молекулярная модель связывания белка orf1ab с порфирином. Связывающая часть белка orf1ab действует как зажим. Именно этот зажим захватывает порфирин без иона железа. На рисунке 7.A-2 показан двухмерный вид участка связывания. Видно, что 18 аминокислот белка orf1ab связаны с порфирином.
Для изучения свойств связывания белка ORF8 с гемом использовались те же этапы анализа, что и для структурного белкового метода. Файл структуры был создан на основе шаблона ORF7 (рисунок 3.E). Было обнаружено несколько видов стыковки белка ORF8 и порфирина, из которых выбрано стыковочное положение, имеющее наибольшую энергию связывания (12 804 859,25 ккал/моль). Результат стыковки (рисунок 7.В-1) представляет собой молекулярную модель связывания белка ORF8 с порфирином. Рисунок 7.В-2 представляет собой двухмерный вид участка связывания, где 18 аминокислот ORF8 связаны с порфирином.
Для анализа белка ORF7a использовались те же методы, что и при анализе белка ORF8. Шаблон ORF7a — 1yo4.1.A (рис. 3.F). Белок ORF7a и порфирин имели наивысшую энергию связывания (37 123,79 ккал/моль). На рисунке 7.С-1 показана молекулярная модель связи ORF7a с порфирином. Пятнадцать аминокислот ORF7a связаны с порфирином (рис. 7.C-2). Связывающая часть белка ORF7a также действует как зажим.
Swiss-модель не может предоставить шаблон для ORF10. ORF6a и ORF3a получены из шаблонов 3h08.1.A и 2m6n.1.A соответственно, но состыковать ORF6a (ORF3a) с гемом и порфирином не удалось.
Рисунок 7. Результаты молекулярной стыковки неструктурных белков вируса и порфирина (красный). A. Результаты молекулярной стыковки белка orf1ab и порфирина. B. Результаты молекулярной стыковки для белка ORF8 и порфирина. C. Результаты молекулярной стыковки белка ORF7a и порфирина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
Наконец, был проведен следующий анализ, чтобы выяснить, могли ли неструктурные белки атаковать гем и отщеплять атом железа с образованием порфиринов. Здесь для анализа консервативных доменов неструктурных белков и белков гемоксидазы использовался тот же метод, что и для предыдущего структурного белка — онлайн-сервер MEME (NP_002124.1: гемоксигеназа-1; BAA04789.1: гемоксигеназа-2; AAB22110.2: гемоксигеназа-2). Как показано на рисунке 8, ORF10, orf1ab и ORF3a имеют консервативные домены. Учитывая результаты предыдущего анализа, можно сказать, что неструктурные белки ORF10, orf1ab и ORF3a могут атаковать гем и отщеплять атом железа с образованием порфирина. Однако р-значение для orf1ab и ORF3a больше, чем 0,1 %. Поэтому ORF10 может быть основным белком, атакующим гем, тогда как orf1ab и ORF3a захватывают гем или порфирин.
Результаты показали, что orf1ab, ORF7a и ORF8 могут связываться с порфирином, в то время как ORF10, ORF3a и ORF6 не могут связываться с гемом (и порфирином). ORF10, ORF1ab и ORF3a также обладают способностью атаковать гем с образованием порфирина. Энергии связывания orf1ab, ORF7a, ORF8 и порфирина сравнивали между собой. Было обнаружено, что энергия связывания ORF7a была самой низкой, энергия связывания ORF8 была самой высокой, а энергия связывания orf1ab была средней. Это означает, что связывание ORF8 с порфирином является наиболее стабильным, связывание orf1ab с порфирином является неустойчивым, а связывание ORF7a с порфирином является наиболее неустойчивым. Последовательности ORF10 и ORF6 короткие, поэтому они должны быть короткими сигнальными пептидами. Следовательно, механизм, с помощью которого неструктурные белки атакуют гем, может быть такой: ORF10, ORF1ab и ORF3a атакуют гем и образуют порфирин; ORF6 и ORF7a отправляют порфирин в ORF8; и ORF8 и порфирин образуют стабильный комплекс.
Рисунок 8. Консервативные домены неструктурных белков и белков гемоксигеназы человека. A. Консервативные домены orf1ab. B. Консервативные домены ORF3a. C. Консервативные домены ORF6. D. Консервативные домены ORF7a. E. Консервативные домены ORF8. F. Консервативные домены ORF10.
3.3. Вирусный неструктурный белок атакует гем на бета-цепи гемоглобина
Порфирины в организме человека — это в основном железосодержащие порфирины, то есть гем. Большая часть молекул гема не свободна, а связана в составе гемоглобина. Для выживания вирусов им требуется большое количество порфиринов. Поэтому новый коронавирус нацелен на гемоглобин, атакует гем и охотится на порфирины. Результаты предыдущего анализа показали, что ORF1ab, ORF3a и ORF10 имеют домены, сходные с гемоксигеназой, но только ORF1ab может связываться с порфирином. Чтобы изучить атакующее поведение белков orf1ab, ORF3a и ORF10, мы использовали технологию молекулярной стыковки ZDOCK. Технология молекулярной стыковки ZDOCK позволяет анализировать взаимодействия белков и находить приблизительные положения этих трех белков на гемоглобине.
Сначала мы загрузили гемоксигеназу 2 (5UC8) из PDB и использовали ее в качестве шаблона, а затем использовали инструмент гомологического моделирования Discovery-Studio для создания трехмерной структуры ORF10 (рисунок 9). Поскольку гемоглобин имеет две формы: окисленную и восстановленную, в приведенном ниже анализе выполнена молекулярная стыковка белков в этих двух случаях, а в качестве результата принята позиция с наивысшей оценкой ZDOCK.
Рисунок 9. Моделирование гомологии ORF10.
На дезоксигемоглобине orf1ab располагается в нижне-среднем участке 1-альфа- и 2-альфа-цепи вблизи 2-альфа-цепи (рисунок 10.A). ORF3a располагается в нижне-среднем участке 1-альфа и 2-альфа-цепи вблизи 2-альфа цепи (рисунок 10.B). ORF10 располагается в нижне-средней части 1-бета- и 2-бета-цепи вблизи 1-бета-цепи (рисунок 10.C). Предполагается следующий механизм: orf1ab атакует 2-альфа-цепь, вызывая изменения конформации белка глобина. Связывание ORF3A с цепью 2-альфа приводит к атаке ею цепи 1-бета, открывающей гем. ORF10 быстро присоединяется к 1-бета-цепи и непосредственно воздействует на гем 1-бета-цепи. Когда атом железа отщепляется, гем превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет критически важную роль на протяжении всей атаки.
Рисунок 10. Вирусный неструктурный белок атакует гемоглобин. A. orf1ab атакует дезоксигемоглобин. B. ORF3a атакует дезоксигемоглобин. C. ORF10 атакует дезоксигемоглобин. D. orf1ab атакует окисленный гемоглобин. E. ORF10 атакует окисленный гемоглобин. F. ORF3a атакует окисленный гемоглобин.
На окисленном гемоглобине orf1ab располагается в нижне-средней части альфа- и бета-цепи вблизи альфа-цепи (рисунок 10.A). ORF10 располагается в нижней части бета-цепи, ближе к внешней (рисунок 10.B). ORF3a располагается в нижне-средней части альфа- и бета-цепи и приближен к бета-цепи (рисунок 10.C). Возможный механизм состоит в том, что orf1ab связывается с альфа-цепью и атакует бета-цепь, вызывая конфигурационные изменения в альфа- и бета-цепях; ORF3 атакует бета-цепь и обнажает гем. ORF10 быстро прикрепляется к бета-цепи и непосредственно влияет на атомы железа в геме бета-цепи. Гем после отщепления железа превращается в порфирин, и orf1ab получает возможность захватить порфирин. Белок orf1ab играет ключевую роль на протяжении всей атаки.
Атака вирусных белков на оксигемоглобин приводит к прогрессирующему уменьшению количества гемоглобина, который может переносить кислород. Влияние вирусных белков на дезоксигемоглобин будет еще сильнее уменьшать количество гемоглобина, доступного для переноса диоксида углерода и глюкозы крови. Люди с диабетом могут иметь нестабильный уровень глюкозы крови. Состояние пациента дополнительно ухудшается от отравления диоксидом углерода. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится.
3.4. Валидация воздействия хлорохина фосфата
Химические компоненты хлорохина фосфата конкурируют с порфирином и связываются с вирусным белком, тем самым ингибируя атаку вирусного белка на гем или связывание с порфирином. Для проверки влияния хлорохина фосфата на молекулярный механизм действия вируса была принята технология молекулярной стыковки. Структурный файл 0TX (хлорохин) был загружен из базы данных PDB. Затем была использована технология молекулярной стыковки Discovery-Studio 2016 для тестирования эффектов вирусных белков и хлорохина.
Рисунок 11.A-1 представляет собой схему связывания хлорохина с поверхностным гликопротеином вируса. На рисунке 11.A-2 показана область связывания вирусного поверхностного гликопротеина. В связывании участвуют 13 аминокислот. Энергия связывания хлорохина с гликопротеином Е2 вируса составляет 3 325 322 829,64 ккал/моль, что составляет около половины энергии связывания гликопротеина Е2 и порфирина. Согласно результатам рис. 4.А-2, дальнейший анализ показал, что некоторые аминокислоты (например, VAL A:952, ALA A:956, ALA B:956, ASN A:955 и др.) гликопротеина Е2 могут связываться не только с хлорохин-фосфатом, но и с порфиринами. Другими словами, хлорохин имеет одну треть шансов ингибировать вирусный гликопротеин E2 и уменьшить симптомы у пациента.
Вид связывания хлорохина и белка оболочки показан на рисунке 11.В-1. Энергия связывания хлорохина и белка оболочки 7852,58 ккал/моль, что эквивалентно лишь 4 % энергии связывания белка оболочки и порфирина. Участок связывания показан на рисунке 11.B-2. На рисунках 4.В-2 и 11.В-2 представлены некоторые аминокислоты (такие, как LEV E:28, PHE: D:20, VAL E:25) белка оболочки, которые связываются не только с хлорохин-фосфатом, но и с порфирином.
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Рисунок 11. Результаты молекулярной стыковки структурных белков вируса и хлорохина (красный). A. Результаты молекулярной стыковки гликопротеина E2 и порфирина. B. Результаты молекулярной стыковки белка оболочки и порфирина. C. Результаты молекулярной стыковки нуклеокапсидного фосфопротеина и порфирина. 1. Структурные белки вируса. 2. Вид участков связывания.
Принципиальная схема связывания хлорохина с белком orf1ab показана на рисунке 12.A-1. Участок связывания белка orf1ab представлен на рисунке 12.A-2. Энергия связывания хлорохина и белка orf1ab составляет 4 584 302,64 ккал/моль, что в 8 раз больше энергии связывания между orf1ab и порфирином. Согласно результатам на рисунке 7.A-2, было показано, что некоторые аминокислоты, такие как MET 7045, PHE 7043, LYS 6836 белка orf1ab, могут быть связаны не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF8 показана на рисунке 12.B-1. На рисунке 12.B-2 показан участок связывания ORF8. Энергия связывания хлорохина с белком ORF8 составляет 4 707 657,39 ккал/моль, что эквивалентно лишь 37 % энергии связывания белка ORF8 с порфирином. Согласно результату, показанному на рисунке 7.B-2, аминокислоты, такие как ILE A: 74, ASP A:75, LYS A: 53 ORF8, могут связываться не только с фосфатом хлорохина, но и с порфирином.
Принципиальная схема связывания хлорохина с белком ORF7a показана на рисунке 12.C-1. На рисунке 12.C-2 представлен вид участка связывания. Энергия связывания хлорохина с белком ORF7a составляет 497 154,45 ккал/моль, что в 13 раз превышает энергию связи белка ORF7a с порфирином. Согласно результатам, показанным на рисунке 7.C-2, аминокислоты, такие как GLN A:94, ARG A:78 и LEU A:96 белка ORF7 могут связываться не только с фосфатом хлорохина, но и с порфирином.
Стыковка белков ORF3a, ORF6 и ORF10 с хлорохином не удалась.
Эти результаты показали, что хлорохин может в определенной степени ингибировать связывание E2 и ORF8 с порфирином с образованием комплекса. Кроме того, хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина.
Рисунок 12. Результаты молекулярной стыковки вирусных неструктурных белков и хлорохина (красная структура). A. Результаты молекулярной стыковки белка orf1ab и хлорохина. B. Результаты молекулярной стыковки белка ORF8 и хлорохина. C. Результаты молекулярной стыковки белка ORF7a и хлорохина. 1. Неструктурные белки вируса. 2. Вид участков связывания.
3.5. Валидация эффекта фавипиравира
Рисунок 11.С-1 представляет собой схему связывания хлорохина с фосфопротеином нуклеокапсида. Энергия связывания хлорохина с нуклеокапсидным фосфопротеином составляет 198 815,22 ккал/моль, что эквивалентно лишь 1,4 % энергии связывания нуклеокапсидного фосфопротеина и порфирина. ALA A:50 и т. д. нуклеокапсида фосфопротеина участвуют в связывании (рисунок 12.C-2). Рисунки 4.C-2 и 11.C-2 свидетельствуют о том, что аминокислоты нуклеокапсидного фосфопротеина могут связывать порфирин, но не могут связывать хлорохин. Стыковка мембранного белка с хлорохином не произошла.
Таблица 1. Эффект фавипиравира
| Белок вируса | Порфирин (ккал/моль) |
Фавипиравир (ккал/моль) |
Имеет идентичные остатки |
Мишень | Отношение связывания с мишенью (фавипиравир/ порфирин) |
|---|---|---|---|---|---|
| Гликопротеин E2 | 7,530,186,265.80 | — | — | — | — |
| Белок оболочки | 219,317.76 | 597,814,480.55 | Да | Да | 2,725.79 |
| Нуклеокапсид | 15,532,506.53 | — | — | — | — |
| orf1ab | 561,571.10 | 1,052,489.88 | Да | Да | 1.87 |
| ORF8 | 12,804,859.25 | 348,589.80 | Да | — | — |
| ORF7a | 37,123.79 | 17,034,560.60 | Да | Да | 458.86 |
4. Обсуждение
4.1. Новый коронавирус произошел от древнего вируса
Для самых примитивных форм жизни, коими являются вирусы, не так-то просто увидеть их роль в связывании порфирина. Соединения порфирина широко распространены в фотосинтезирующих и нефотосинтезирующих организмах и связаны с критическими физиологическими процессами, такими как катализ, перенос кислорода и энергии. Порфирин также является древним соединением, широко распространенным на Земле. Порфирин впервые обнаружен в сырой нефти и асфальтовой породе в 1934 году. Порфирин обладает уникальными фотоэлектронными свойствами, отличной термостабильностью и имеет широкие перспективы применения в химии материалов, медицине, биохимии и аналитической химии. Его характеристики отлично подходят для применений, связанных с двухфотонным поглощением, флуоресценцией, передачей энергии и других. Перенос энергии флуоресцентного резонанса (FRET) — это безызлучательный процесс, при котором донор в возбужденном состоянии передает энергию реципиенту в основном состоянии посредством дипольного эффекта дальнего действия. FRET-характеристики порфирина могут быть основой способа выживания, на который опирался исходный вирус.
Существует множество теорий о происхождении вирусов, одна из которых называется теорией совместной эволюции, в которой вирусы могут эволюционировать из комплексов белка и нуклеиновой кислоты. Различные методы не объясняют, как вирус выжил независимо от не существовавших в начале жизни клеток, поэтому происхождение вирусов остается загадкой. В этой статье предполагается, что вирус может связываться с порфирином, что может объяснить проблему выживания оригинального вируса. Поскольку порфирин обладает характеристикой передачи энергии флуоресцентного резонанса, вирусы, которые связываются с порфиринами, могут получить энергию с помощью этого светоиндуцированного метода. Вирус, получивший энергию, может использовать ее для минимального перемещения, для выхода из состояния гибернации или перехода в него из активного состояния. Согласно результатам нашего исследования, новый коронавирус был формой жизни, зависящей от порфирина. Поэтому мы можем предположить, что новый коронавирус происходит от древнего вируса, который мог развиваться у летучих мышей на протяжении бесчисленных поколений.
4.2. Более высокая проницаемость порфиринов сквозь клеточные мембраны обуславливает большую инфекционность
Быстрая эволюция нового коронавируса также сопровождается некоторыми парадоксальными особенностями. Нынешняя теория предполагает, что новый коронавирус связывается с рецептором ACE2 человека через белок-шип. Он попадает в клетки человека по механизму фагоцитоза. Модели инфекционных заболеваний показали, что новая коронавирусная пневмония очень контагиозна. Следовательно, способность связывания белка-шипа и белка ACE2 человека должна быть большой, но в литературе имеются сообщения о том, что эта способность связывания является слабой. Что вызывает высокую инфекционность нового коронавируса? Мы считаем, что в дополнение к методу инвазии через взаимодействие шип-ACE2 вирус должен обладать оригинальным механизмом инвазии.
Медицинские работники обнаружили новый коронавирус в моче, слюне, кале и крови. Жизнеспособный вирус также может обнаруживаться в биологических жидкостях. В таких средах порфирин является доминирующим веществом. Порфириновые соединения относятся к классу азотсодержащих полимеров, и существующие исследования показали, что они обладают выраженной способностью обнаруживать клеточные мембраны и проникать сквозь них. В начале жизни молекулы вирусов с порфиринами непосредственно перемещались в исходную мембранную структуру за счет проницаемости порфирина. Это исследование показало, что гликопротеин E2 и белок оболочки нового коронавируса могут хорошо связываться с порфиринами. Поэтому коронавирус в связи с порфирином может также напрямую проникать через клеточную мембрану человека, что делает процесс инфицирования надежным. Наш валидационный анализ показал, что фавипиравир может предотвратить связывание только белка оболочки и порфирина. В то же время хлорохин может предотвращать связывание гликопротеина Е2 с порфирином лишь в определенной степени. Следовательно, инфекционность новой коронавирусной пневмонии не предотвращается этими препаратами полностью, так как связывание гликопротеина E2 и порфирина ингибируется не полностью.
4.3. Сложность индивидуального иммунитета
В некоторых теориях предполагается, что иммунный ответ возникает в организме после того, как у пациента разовьется заболевание. У некоторых пациентов после выздоровления вырабатываются иммунные антитела. Согласно нашему исследованию, гликопротеин E2, белок оболочки, нуклеокапсидный фосфопротеин, orf1ab, ORF7a и ORF8 вируса могут связываться с порфирином. Но из текущего исследования неясно, какие иммунные антитела возникали против вирусных белков.
Кроме того, некоторые пациенты могут погибнуть в результате цитокинового шторма. По сравнению с пациентами с атипичной пневмонией, анатомические характеристики умерших отличаются. Комплекс вирусных белков и порфирина может быть малорастворимым. Избыток слизи в тканях умерших пациентов был причиной избытка муцинового белка. Муцин может превратить слабо соединенные клетки в плотно соединенные и увеличить смазку между ними. Можно предположить, что действующее соединение приводит к уменьшению связи между клетками, в результате чего клетки начинают нуждаться в муцине для укрепления связи между собой в пределах тканей и для обеспечения смазывающего эффекта. Кроме того, когда пациент вступает в тяжелый инфекционный период, вирусные структурные белки, в основном, используются для сборки вирусов. Поэтому мы не можем обнаружить заметных вирусных включений в клетках тканей при аутопсии умерших пациентов.
4.4. Иммунные клетки заражаются и секретируют антитела и вирусные белки
Иммунные клетки, такие как плазматические клетки, также известны как эффекторные В-клетки. Плазматические клетки в основном наблюдаются в соединительной ткани слизистой оболочки как в пищеварительном тракте, так и в дыхательных путях. Это клетки, секретирующие антитела. Плазматические клетки выполняют функцию синтеза и хранения антител, а именно иммуноглобулинов, и участвуют в гуморальных иммунных ответах. В зависимости от источника выработки антител выделяют естественные антитела, такие как антитела анти-А и анти-В в системе групп крови ABO. По способности к участию в процессе агглютинации в ходе антигенной реакции антитела делят на полные антитела IgM и неполные антитела IgG. Обнаружение IgM и IgG в крови помогает определить, является ли организм человека инфицированным вирусом. В крови пациентов с подозрением на новую коронавирусную пневмонию содержится большое количество IgM. При лечении количество IgM у пациента снижается, а количество IgG повышается, указывая на то, что его организм вырабатывает резистентность и иммунитет. Имеются сообщения о том, что плазматические клетки также имеют рецептор ACE2, то есть для них существует путь инфекции шип-ACE2. Учитывая сообщения о том, что селезенка, костный мозг и лимфатические узлы тяжелых пациентов также сильно повреждены, мы предполагаем, что плазматические клетки также тесно связаны с инфекцией и выздоровлением пациентов с коронавирусом.
Плазматические клетки могут секретировать различные антитела, что также объясняет высвобождение вирусных белков в организме. Вирусные белки orf1ab, ORF3a и ORF10 синтезировались в клетках и атаковали гемоглобин и гем вне клеток. Вирусные белки могли покидать клетки через механизмы секреции белков. К числу секретируемых белков в основном относятся пищеварительные ферменты, антитела и некоторые гормоны. Исходя из вышеизложенной точки зрения, что инфицирование было связано с плазматическими клетками, мы полагали, что вирусные белки секретировались главным образом изнутри клетки наружу по механизму секреции антител. Один из возможных путей заключается в том, что после инфицирования плазматической клетки в ней запускаются процессы вирусной транскрипции и трансляции, а затем из клетки секретируются вирусные белки, такие как orf1ab, ORF3a и ORF10. Однако неясно, секретируются ли вирусные белки за пределы клетки путем связывания с антителами группы крови.
Мы планировали смоделировать этот механизм, но объем вычислений оказался слишком велик. После того, как мы ввели «антитела крови» в поисковую строку базы данных PDB, веб-страница показала почти 160 000 записей и почти 47 000 записей, связанных с человеком. Кроме того, моделирование молекулярной стыковки антител и белков, таких как orf1ab, представляет собой стыковку белков, процесс расчета которой является очень сложным. Поэтому мы не можем смоделировать этот механизм. Мы предлагаем другим лабораториям использовать суперкомпьютеры для моделирования этого механизма.
4.5. Вирусный белок атакует гемоглобин, высвобожденный за счет иммунного гемолиза эритроцитов
Эритроциты в основном содержат гемоглобин. Во время гемолиза гемоглобин выходит из клеток и растворяется в плазме. В этот момент способность гемоглобина переносить кислород теряется. Гемолиз происходит из-за разрыва мембран эритроцитов и растворения матрикса. Либо может происходить расширение пор мембраны эритроцита до степени, позволяющей гемоглобину покидать клетку, оставляя за собой двояковогнутую дискообразную клеточную мембрану — «гематоцит». Иммунный гемолиз — это специфический гемолиз, вызванный реакцией «антиген-антитело». Неспецифический гемолиз вызывается физическими, химическими или биологическими факторами. После гемолиза эритроцитов вирусные белки могут атаковать гемоглобин. Учитывая, что некоторые исследователи подсчитали, что люди с кровью типа O хуже заражаются COVID-19, мы предполагаем, что иммунный гемолиз может быть основным методом обеспечения атаки гемоглобина вирусными белками. Вирусные белки атакуют гемоглобин после заражения. Из-за ограниченных возможностей вычислительных инструментов мы не можем смоделировать, атакуют ли вирусные белки гемоглобин снаружи или внутри эритроцитов.
4.6. Более высокий уровень гемоглобина вызывает более высокую болезненность
Показано, что терапевтический эффект хлорохина фосфата в отношении новой коронавирусной пневмонии может быть тесно связан с аномальным метаболизмом гемоглобина у человека. Количество гемоглобина является основным биохимическим показателем крови, и его содержание различается в зависимости от пола. В норме у мужчин его уровень значимо выше, чем у женщин, что также может быть причиной того, почему мужчины заражаются новой коронавирусной пневмонией чаще, чем женщины. Кроме того, большинство пациентов с новой коронавирусной пневмонией составляют людей среднего и старшего возраста. Многие из этих пациентов имеют сопутствующие заболевания, такие как сахарный диабет. Пациенты с диабетом имеют более высокий уровень гликированного гемоглобина. Гликированный гемоглобин представляет собой дезоксигемоглобин. Гликированный гемоглобин представляет собой комбинацию гемоглобина и глюкозы крови, что является еще одной причиной высокого уровня инфицирования среди пожилых людей.
Это исследование подтвердило, что белки orf1ab, ORF3a и ORF10 могут скоординированно атаковать гем на бета-цепи гемоглобина. Атаке подвергаются как оксигенированный, так и дезоксигенированный гемоглобин. Во время атаки позиции orf1ab, ORF3 и ORF10 немного отличаются. Было показано, что, чем выше содержание гемоглобина, тем выше риск заболевания. Однако нет уверенности в том, что частота заболеваний, вызванных аномальным гемоглобином (структурным), относительно невелика. Гемоглобин пациентов и выздоравливающих должен быть объектом дальнейших исследований и лечения.
4.7. Ингибирование анаболического пути гема и развитие заболевания
В данной статье рассматривалось непосредственное вмешательство вируса в сборку гемоглобина человека. Основной причиной был слишком низкий уровень нормального гема. Гем участвует в критических биологических процессах, таких как регуляция экспрессии генов и трансляции белка. Порфирин является важным материалом для синтеза гема. Поскольку существующие данные показывают, что в организме оказывается слишком много свободного железа, это должно быть следствием того, что вирус-продуцирующая молекула конкурирует с железом за порфирин. Ингибирование анаболического пути гема и возникновение симптомов у человека.
Неясно, является ли пространственная молекулярная структура гема и порфирина у пациентов с порфирией такой же, как и у здоровых людей. При наличии аномальной структуры неясно, может ли такой порфирин связываться с вирусным белком с образованием комплекса, и может ли вирусный белок атаковать подобный гем. Эти вопросы должны быть рассмотрены в клинических и экспериментальных исследованиях.
5. Выводы
С момента возникновения эпидемии использование методов биоинформатики имеет большое научное значение для анализа ролей белков нового коронавируса (таких, как ORF8 и поверхностные гликопротеины). В этом исследовании методы прогнозирования доменов применялись для поиска консервативных доменов. Структуру белковых молекул, таких как ORF8 и поверхностных гликопротеинов, получали с помощью методов гомологического моделирования. Технология молекулярной стыковки использовалась для анализа взаимодействия связывающей части вирусных белков с гемом и порфирином. Результаты исследования показывают, что ORF8 и поверхностные гликопротеины могут объединяться с порфирином с образованием комплекса. В то же время белки orf1ab, ORF10 и ORF3a могут координированно атаковать гем, находящийся на 1-бета-цепи гемоглобина, что приводит к отщеплению железа с образованием порфирина. В результате такой атаки количество гемоглобина, который может переносить кислород и углекислый газ, уменьшается. Клетки легких испытывают чрезвычайно сильное воспаление из-за невозможности обеспечения интенсивного обмена углекислым газом и кислородом; в конечном итоге изображения ткани легких принимают вид матового стекла. Состояние пациентов с респираторными расстройствами ухудшится. Пациенты с диабетом и пожилые люди имеют более высокий уровень гликированного гемоглобина. Уровень гликированного гемоглобина снижается в результате вирусной атаки, что делает уровень глюкозы в крови пациентов нестабильным. Поскольку порфириновые комплексы вируса, продуцируемого в организме человека, ингибировали анаболический путь гема, они вызывали широкий спектр инфекций и заболеваний.
С учетом этих выводов дальнейший анализ показал, что хлорохин может предотвратить атаку orf1ab, ORF3a и ORF10 на гем с образованием порфирина и в определенной степени ингибировать связывание ORF8 и поверхностных гликопротеинов с порфиринами, эффективно облегчая симптомы респираторного дистресса. Поскольку способность хлорохина ингибировать структурные белки не слишком велика, терапевтический эффект для разных людей может быть различным. Фавипиравир может ингибировать связывание белка оболочки и белка ORF7a с порфирином, предотвращать проникновение вируса в клетки-хозяева и может связывать свободный порфирин. В связи с побочными действиями таких препаратов, как хлорохин, и возможностью аллергических реакций на них обращайтесь к квалифицированному врачу для получения подробной информации о лечении и не принимайте препарат самостоятельно.
На основании компьютерного моделирования и дискуссионного анализа этого исследования мы выдвинули предположение об основном механизме патогенности этого вируса. Вирус может сначала инфицировать клетки с рецепторами ACE2, включая иммунные клетки. Иммунные клетки производят антитела и вирусные белки. Антитела действуют на эритроциты, вызывая иммунный гемолиз. Гемоглобин высвобождается и подвергается атаке. Вирус захватывает порфирин и ингибирует метаболизм гема. Поэтому мы считаем, что поражение организма человека вирусом носит системный характер, а не ограничивается дыхательной системой.
Данная работа предназначена только для научного обсуждения, правильность выводов должна быть подтверждена другими лабораториями. Мы с нетерпением ожидаем сообщений от лабораторий, которые смогут доказать, является ли эта теория неправильной или правильной из следующих экспериментов: 1) используйте рентгеноструктурный анализ для определения структуры гемоглобина у тяжелобольных пациентов, чтобы выяснить, есть ли какие-либо отклонения; 2) в эксперименте с вирусами должны быть показаны следующие этапы: вирусные белки могут связывать порфирин; вирусные белки могут атаковать гем; вирусные белки могут атаковать гемоглобин в крови.
Заявления/h5>
Согласие этического комитета и согласие на участие
Согласие на публикацию
Доступность данных и материалов
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Финансирование
Эта работа финансировалась за счет гранта Фонда естественных наук для проекта по внедрению талантов Сычуанского университета науки и техники (номер награды 2018RCL20, грантополучатель WZL).
Вклад авторов
Финансирование получил WZL. Дизайн, анализ, написание: WZL. Курирование данных, проверка рукописи: HLL. Все авторы прочитали и согласились с опубликованной версией рукописи.
Благодарности
Об авторах
1 Факультет информатики и инженерии, Сычуаньский инженерно-технический университет, Цзыгун, 643002, Китай;
2 Факультет медико-биологических наук и технологии пищевых продуктов, Ибиньский университет, Ибинь, 644000, Китай.
Список литературы
- Дяо, K., Хань, P., Пан, T., Ли, И. и Ян, Ц. Характерные особенности визуализации HRCT в репрезентативных случаях завозной инфекции новой коронавирусной пневмонии 2019 г. (Diao, K., Han, P., Pang, T., Li, Y. & Yang, Z. HRCT Imaging Features in Representative Imported Cases of 2019 Novel Coronavirus Pneumonia). Precision Clinical Medicine (2020).
- Чан, Д. и др., Эпидемиологические и клинические характеристики новой коронавирусной инфекции на примере 13 пациентов за пределами Уханя. Китай (Chang, D. et al. Epidemiologic and clinical characteristics of novel coronavirus infections involving 13 patients outside Wuhan, China). JAMA (2020).
- Хуан С. и др. Клинические характеристики пациентов, инфицированных новым коронавирусом 2019 в Ухане, Китай (Huang, C. et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China). The Lancet (2020).
- Ли, С., Цай, Цз., Ван, С. и Ли, Ю. Возможность крупномасштабного переноса инфекции 2019 nCov от человека к человеку в первом поколении (Li, X., Zai, J., Wang, X. & Li, Y. Potential of large ‘first generation’human‐to‐human transmission of2019‐nCoV). Journal of Medical Virology (2020).
- Ван, Д. и др., Клинические характеристики 138 госпитализированных пациентов с вирусной пневмонией, вызванной новым коронавирусом 2019, Ухань, Китай (Wang, D. et al. Clinical characteristics of 138 hospitalized patients with 2019 novel coronavirus–infected pneumonia in Wuhan, China). Jama (2020).
- Ли, Ц. и др. Ранняя динамика передачи пневмонии, вызванной новой коронавирусной инфекцией, в Ухане, Китай (Li, Q. et al. Early transmission dynamics in Wuhan, China, of novel coronavirus–infected pneumonia). New England Journal of Medicine (2020).
- Чжу, Н. и др. Новый коронавирус, выделенный у пациентов с пневмонией в Китае в 2019 г. (Zhu, N. et al. A novel coronavirus from patients with pneumonia in China, 2019). New England Journal of Medicine (2020).
- Ву, Ф. и др. Новый коронавирус, ассоциируемый с респираторными заболеваниями людей в Китае (Wu, F. et al. A novel coronavirus associated with human respiratory disease in China). Nature, 1-8 (2020).
- Лу, Х., Страттон, С. У. и Тан, И. В. Вспышка пневмонии неизвестной этиологии в Ухане, Китай: загадка и чудо (Lu, H., Stratton, C. W. & Tang, Y. W. Outbreak of Pneumonia of Unknown Etiology in Wuhan China: the Mystery and the Miracle). Journal of Medical Virology.
- Чу, Н. и др. Исследовательская группа по новому китайскому коронавирусу. Новый коронавирус, выделенный у пациентов с пневмонией в Китае (Zhu, N. et al. China Novel Coronavirus Investigating and Research Team. A novel coronavirus from patients with pneumonia in China, 2019). N Engl J Med (2020).
- Лу, Р. и др. Геномная характеристика и эпидемиология нового коронавируса 2019: заключения по поводу происхождения вируса и связывания его с рецепторами (Lu, R. et al. Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding). The Lancet (2020).
- Ван, М. и др. Прецизионно-медицинский подход в отношении лечения коронавирусной уханьской пневмонии (Wang, M. et al. A precision medicine approach to managing Wuhan Coronavirus pneumonia). Precision Clinical Medicine (2020).
- Шехер, С. Р., Пекош, А. в сборнике «Молекулярная биология коронавируса SARS» (Schaecher, S. R. & Pekosz, A. in Molecular Biology of the SARS-Coronavirus) 153-166 (Springer, 2010).
- МакБрайд, Р. и Филдинг, Б. Ч. Роль вспомогательных белков вируса тяжелого острого респираторного синдрома (ТОРС) в патогенезе вируса (McBride, R. & Fielding, B. C. The role of severe acute respiratory syndrome (SARS)-coronavirus accessory proteins in virus pathogenesis). Viruses 4, 2902-2923 (2012).
- Ву, А. и др. Состав и дивергенция генома нового коронавируса (2019-nCoV) родом из Китая (Wu, A. et al. Genome Composition and Divergence of the Novel Coronavirus (2019-nCoV) Originating in China). Cell Host & Microbe (2020).
- Параскевис, Д. и др. Полногеномный эволюционный анализ нового коронавируса (2019-nCoV) позволяет отклонить гипотезу о его появлении в результате недавнего события рекомбинации (Paraskevis, D. et al. Full-genome evolutionary analysis of the novel corona virus (2019-nCoV) rejects the hypothesis of emergence as a result of a recent recombination event). Infection, Genetics and Evolution, 104212 (2020).
- Ли, С. и др. Регуляция отклика на стресс со стороны эндоплазматического ретикулума активностью ионных каналов, образуемых белком оболочки коронавируса, вызывающего инфекционный бронхит, модуляцией выброса вирионов, влиянием на апоптоз, репликативную способность и патогенез (Li, S. et al. Regulation of the ER Stress Response by the Ion Channel Activity of the Infectious Bronchitis Coronavirus Envelope Protein Modulates Virion Release, Apoptosis, and Pathogenesis). Frontiers in Microbiology 10, 3022 (2020).
- То, К.-К. В. и др. Постоянное выявление нового коронавируса 2019 в слюне (To, K. K.-W. et al. Consistent detection of 2019 novel coronavirus in saliva). Clinical Infectious Diseases (2020).
- Дон, Н. и др. Анализ моделей генома и белковой структуры отображает происхождение и патогенность вируса 2019-nCoV, нового коронавируса, вызвавшего вспышку пневмонии в Ухане, Китай (Dong, N. Et al Genomic and protein structure modelling analysis depicts the origin and pathogenicity of 2019-nCoV, a novel coronavirus which caused a pneumonia outbreak in Wuhan, China). F1000Research 9, 121 (2020).
- Роте, К. и др. Передача инфекции 2019-nCoV при контакте с бессимптомным носителем в Германии (Rothe, C. et al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany). New England Journal of Medicine (2020).
- Чен, Н. и др., Эпидемиологические и клинические характеристики 99 случаев пневмонии, вызванной новым коронавирусом 2019 года в Ухане, Китай: дескриптивное исследование (Chen, N. et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study). The Lancet (2020).
- Дас, Р. и Шарма, П., в сборнике «Клиническая молекулярная медицина» (Das, R. & Sharma, P. in Clinical Molecular Medicine) 327-339 (Elsevier, 2020).
- Казазян-мл., Х. Х. и Вудхэд, А. П. Синтез гемоглобина А в развивающемся плоде (Kazazian Jr, H. H. & Woodhead, A. P. Hemoglobin A synthesis in the developing fetus). New England Journal of Medicine 289, 58-62 (1973).
- Лю, Дж. и др. Общие и отличающиеся аспекты патологии и патогенеза новых патогенных для человека коронавирусных инфекций SARS‐CoV, MERS‐CoV и 2019‐nCoV. (Liu, J. et al. Overlapping and discrete aspects of the pathology and pathogenesis of the emerging human pathogenic coronaviruses SARS‐CoV, MERS‐CoV, and 2019‐nCoV). Journal of Medical Virology (2020).
- Ван, М. и др. Ремдесивир и хлорохин эффективно ингибируют недавно появившийся коронавирус (2019-n-CoV) in vitro (Wang, M. et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro). Cell Research, 1-3 (2020).
- Бернардо-Сейсдедос, Г., Джил, Д., Блуэн, Ж-М., Ришар, Э. и Милле, О. Заболевания белкового гомеостаза (Bernardo-Seisdedos, G., Gil, D., Blouin, J.-M., Richard, E. & Millet, O. in Protein Homeostasis Diseases) 389-413 (Elsevier, 2020).
- Ламеда, И. Л. и Кох, Т. Р в сборнике «Заболевания печени» (Lameda, I. L. P. & Koch, T. R. in Liver Diseases) 107-116 (Springer, 2020).
- Бэйли, Т. Л., Джонсон, Дж., Грант, К. Э., Нобл, У. С. Программа МЕМЕ SUITE (Bailey, T. L., Johnson, J., Grant, C. E. & Noble, W. S. The MEME suite). Nucleic acids research 43, W39-W49 (2015).
- Бэйли, Т. Л. и др. ПРОГРАММА МЕМЕ SUITE: средство поиска известных мотивов и открытия новых (Bailey, T. L. et al. MEME SUITE: tools for motif discovery and searching). Nucleic acids research 37, W202-W208 (2009).
- Бэйли, Т. Л., Уильямс, Н., Мислех, С. и Ли, У. У. МЕМЕ: обнаружение и анализ мотивов с последовательностях ДНК и белков (Bailey, T. L., Williams, N., Misleh, C. & Li, W. W. MEME: discovering and analyzing DNA and protein sequence motifs). Nucleic acids research 34, W369-W373 (2006).
- Шведе, Т., Копп, Й., Гуэ, Н. и Петиш, М. SWISS-MODEL: автоматизированный сервер гомологического моделирования белков (Schwede, T., Kopp, J., Guex, N. & Peitsch, M. C. SWISS-MODEL: an automated protein homology-modeling server). Nucleic acids research 31, 3381-3385 (2003).
- Бьязини, М. и др. SWISS-MODEL: моделирование третичной и четвертичной структуры белков и использованием эволюционной информации (Biasini, M. et al. SWISS-MODEL: modelling protein tertiary and quaternary structure using evolutionary information). Nucleic acids research 42, W252-W258 (2014).
- Studio, D. Discovery Studio. Accelrys [2.1] (2008).
Методы и частота самоконтроля глюкозы крови
Зачем определять уровень глюкозы в крови?
Основной целью лечения является достижение нормального или близкого к таковому уровня гликированного гемоглобина (отражает «средний» уровень глюкозы в крови за 2-3 месяца), чтобы не допустить развития осложнений сахарного диабета.
Индивидуальную цель лечения (гликированный гемоглобин (HbA1c) и уровень глюкозы натощак) вы подбираете вместе с вашим врачом, она будет зависеть от нескольких условий: длительности заболевания и наличия осложнений, возраста и сопутствующих заболеваний и т.д.
Для того, чтобы достичь поставленной цели, необходимо, чтобы уровень глюкозы в крови при самоконтроле не превышал соответствующие значения (см. таблицу).
|
HbA1c,%
|
Глюкоза плазмы
натощак/перед едой/
на ночь/ночью, ммоль/л
|
Глюкоза плазмы
2 часа после еды,
ммоль/л
|
|
< 6.5
|
< 6.5
|
< 8.0
|
|
< 7.0
|
< 7.0
|
< 9.0
|
|
<7.5
|
<7.5
|
< 10.0
|
|
<8.0
|
< 8.0
|
< 11.0
|
|
<8.5
|
< 8.5
|
< 12.0
|
*Данные целевые значения не относятся к детям, подросткам и беременным женщинам.
** Нормальный уровень в соответствии со стандартами DCCT: до 6 %
Самоконтроль глюкозы крови:
- снижает риск развития поздних осложнений сахарного диабета
- обеспечивает хорошее самочувствие
- приостанавливает развитие уже имеющихся осложнений
- позволяет вам вести активный образ жизни.
Как часто проводить самоконтроль глюкозы крови?
Это зависит от нескольких факторов, в том числе следующих: тип диабета; доза и частота приема лекарственных препаратов; осложнения диабета.
Чаще всего, при хорошей компенсации диабета достаточно измерения глюкозы крови не менее 1 раза в сутки в разное время + 1 гликемический профиль (не менее 4 раз в сутки) в неделю.
Проводите дополнительные измерения глюкозы крови:
- при сопутствующих заболеваниях,
- при занятиях спортом,
- при нарушении самочувствия,
- при подозрении на ночную гипогликемию,
- при изменении сахароснижающей терапии,
- при изменении в питании,
- при управлении автомобилем.
Обсудите с врачом индивидуальные цели Вашего лечения и следуйте его рекомендациям.
Страница статьи : Анестезиология и реаниматология
Schwartz S., Frantz R.A., Shoemaker W.C. Sequential hemodynamic and oxygen transport responses in hypovolemia, anemia, and hypoxia. Am. J. Physiol. 1981; 241: H864-71.
Young R.W. Hyperoxia: A review of the risks and benefits in adult cardiac surgery. J. Extra Corpor. Technol. 2012; 44 (4): 241-9.
Stein A., Belettini C.R., Menegazzo W.R., Viégas J.R., Eick R., Araújo L. et al. Fluid overload and changes in serum creatinine after cardiac surgery: predictors of mortality and longer intensive care stay. A prospective cohort study. Crit. Care. 2012; 16 (3): R99.
Murphy G.J., Reeves B.C., Rogers C.A., Rizvi S.I., Culliford L., Angelini G.D. Increased mortality, postoperative morbidity, and cost after red blood cell transfusion in patients having cardiac surgery. Circulation. 2007; 116 (22): 2544-52.
Hajjar L.A., Vincent J.L., Galas F.R., Nakamura R.E., Silva C.M., Santos M.H. et al. Transfusion requirements after cardiac surgery: the TRACS randomized controlled trial. J.A.M.A. 2010; 304: 1559-67.
Rogers M.A., Blumberg N., Saint S., Langa K.M., Nallamothu B.K. Hospital variation in transfusion and infection after cardiac surgery. BMC Med. 2009; 7: 37.
Snyder-Ramos S.A., Möhnle P., Weng Y.S., Böttiger B.W., Kulier A., Levin J. et al. Investigators of the Multicenter Study of Perioperative Ischemia; MCSPI Research Group. The ongoing variability in blood transfusion practices in cardiac surgery. Transfusion. 2008; 48 (7): 1284-99.
Carson J.L., Carless P.A., Hebert P.C. Transfusion thresholds and other strategies for guiding allogeneic red blood cell transfusion. Cochrane Database Syst. Rev. 2012; 18 (4): CD002042.
Freeland K., Jahromi A.H., Duvall L.M., Mancini M.C. Postoperative blood transfusion is an independent predictor of acute kidney injury in cardiac surgery patients. J. Nephropathol. 2015; 4 (4): 121-6.
Engoren M.C., Habib R.H., Zacharias A., Schwann T.A., Riordan C.J., Durham S.J. Effect of blood transfusion on long-term survival after cardiac operation. Ann. Thorac. Surg. 2002; 74 (4): 1180-6.
Reeves B.C., Murphy G.J. Increased mortality, morbidity, and cost associated with red blood cell transfusion after cardiac surgery. Curr. Opin. Cardiol. 2008; 23 (6): 607-12.
McEvoy M.T., Shander A. Anemia, bleeding, and blood transfusion in the intensive care unit: causes, risks, costs, and new strategies. Am. J. Crit. Care. 2013; 22: eS1-13.
Gutsche J.T., Kohl B.A. When to transfuse: is it any surprise that we still don’t know? Crit. Care Med. 2014; 42: 2647-8.
Carson J.L., Grossman B.J., Kleinman S., Tinmouth A.T., Marques M.R., Fung M.K. et al. Red blood cell transfusion: a clinical practice guideline from the AABB. Ann. Intern. Med. 2012; 157: 49-58.
Frank S.M., Savage W.J., Rothschild J.A., Rivers R.J., Ness P.M., Paul S.L. et al. Variability in blood and blood component utilization as assessed by an anesthesia information management system. Anesthesiology. 2012; 117 (1): 99-106.
Ehrenfeld J.M., Henneman J.P., Bulka C.M., Sandberg W.S. Continuous non-invasive hemoglobin monitoring during orthopedic surgery: a randomized trial. J. Blood Disord Transfus. 2014; 5: 237.
Эффективность трансфузий донорских эритроцитов у больных гемобластозами с анемией
Н.А. Романенко, Р.А. Головченко, С.С. Бессмельцев, Н.А. Потихонова, А.В. Чечеткин, К.М. Абдулкадыров
ФГБУ «Российский научно-исследовательский институт гематологии и трансфузиологии Федерального медико биологического агентства России», г. Санкт-Петербург
Трансфузиология №2, 2015
Резюме
В статье представлен анализ результатов коррекции анемии с помощью трансфузий эритроцитов (ТЭ) у 190 пациентов с различными формами гемобластозов. Эффективность ТЭ определялась уменьшением клинической симптоматики анемии и приростом содержания гемоглобина на одну перелитую дозу эритроцитов. Полный ответ на ТЭ в виде прироста содержания гемоглобина на 10 г/л (11,4 ± 0,6 г/л) констатирован у 57 (30%) пациентов, концентрация Hb у которых увеличилась с 70,4 ± 1,7 до 103,4 ± 0,9 г/л после переливания 2,9 ± 0,2 доз эритроцитов. Общая выживаемость (ОВ) за период 4 месяцев составила 94,7%. Частичный ответ на ТЭ в виде прироста содержания Hb на 5–9,9 г/л (6,6 ± 0,2 г/л) на каждую перелитую дозу эритроцитов констатирован у 71 (37,4%) пациента. У них уровень Hb увеличился с 68,7 ± 1,4 до 97,6 ± 1,2 г/л, перелито 4,5 ± 0,3 единицы эритроцитов. ОВ в течение 4 месяцев составила 84,5%. Минимальный ответ в виде прироста гемоглобина на каждую дозу эритроцитов на <5 г/л (2,6 ± 0,2 г/л) констатирован у 62 (32,6%) больных. У них концентрация Hb увеличилась с 72,5 ± 1,6 до 89,2 ± 1,8 г/л, перелито 6,4 ± 0,8 доз эритроцитов. ОВ в течение 4 месяцев составил 66,1%, что существенно ниже, чем в группах больных с полным и частичным ответом. Низкая эффективность ТЭ отмечалась у пациентов с тяжелой депрессией эритропоэза, гемолизом эритроцитов вследствие прогрессирования заболевания и токсического эффекта химиотерапии. Стратификация больных на группы в зависимости от эффективности ТЭ позволяет прогнозировать течение основного заболевания и дифференцированно подходить к терапии анемии при гемобластозах.
Ключевые слова: анемия, эритроциты, трансфузии эритроцитов, содержание гемоглобина, гематокрит, гемобластозы, донорские эритроциты.
Введение
Анемический синдром при онкогематологических заболеваниях является частым проявлением болезни, ухудшает ее прогноз и качество жизни пациентов. Указанный синдром характеризуется многочисленной клинической симптоматикой, приводящей к дезадаптации пациента в эмоциональной, социальной, семейной сферах [1, 2]. Частота анемии варьирует в зависимости от варианта, а также фазы опухолевого процесса и колеблется от 20 до 90%, а в период проведения химиотерапии (ХТ) может возрастать в 1,5–2 раза [3–7].
Основным методом коррекции анемии у больных опухолевыми заболеваниями системы крови являются трансфузии эритроцитов (ТЭ), позволяющие обеспечить адекватное функционирование органов и систем организма и качество жизни больных. Однако переливания донорских компонентов крови нередко осложняются иммунными реакциями с гемолизом, трансмиссивными инфекциями, тромбозами сосудов, а многократные ТЭ могут приводить к гемосидерозу внутренних органов [8–12]. Поэтому в последние годы принята ограничительная тактика к использованию гемотрансфузий [13–15]. Правила переливаний донорских эритроцитов определены Приказами Минздрава РФ № 363 от 25 ноября 2002 года «Об утверждении Инструкции по применению компонентов крови» и № 183н от 2 апреля 2013 г. «Об утверждении правил клинического использования донорской крови и (или) ее компонентов» [14, 15]. Согласно указаниям нормативных документов, показанием к переливанию донорских эритроцитов при острой анемии вследствие массивной кровопотери является потеря 25–30% объема циркулирующей крови, сопровождающаяся снижением уровня гемоглобина ниже 70–80 г/л и гематокрита ниже 25%, а также возникновением циркуляторных нарушений. Пациентам с хронической анемией донорские эритроциты переливают по более строгим показаниям, что обусловлено компенсаторными механизмами организма реципиента (увеличение сердечного выброса, сдвиг кривой диссоциации оксигемоглобина вправо, увеличение отдачи кислорода в тканях). Этим больным переливают эритроциты только для коррекции важнейших симптомов, обусловленных анемией [15].
Однако у пациентов с онкогематологическими заболеваниями в период проведения химиотерапии содержание гемоглобина в крови нередко снижается на 10–40 г/л, усугубляя имеющуюся анемию и функции жизненно важных органов и систем. Течение анемии также усугубляют гемолиз эритроцитов, гипоплазия костного мозга (КМ), интоксикация за счет распада опухолевых клеток [16]. Кроме того, хроническая анемия может нередко приводить к дистрофическим изменениям в миокарде с развитием сердечной недостаточности, что отражается в том числе на прогнозе заболевания и качестве жизни больного [2]. Поэтому таким пациентам необходимо обеспечить адекватную газотранспортную функцию крови, позволяющую избежать осложнений со стороны сердечно-сосудистой системы. Оптимальным ответом на каждую перелитую дозу донорских эритроцитов, содержащую 180–260 мл эритроцитов, принято считать увеличение в периферической крови содержания Hb на 10 г/л у пациента с массой тела 70–80 кг [16–18]. Однако у больных с дефектом эритропоэза, гипоплазией КМ, гемолизом эритроцитов не всегда удается достичь оптимального ответа, что ставит задачу по выявлению причин низкой эффективности ТЭ и влияние ее на общую выживаемость (ОВ) больных гемобластозами.
Материалы и методы
Исследована эффективность ТЭ у 190 пациентов (в возрасте от 18 до 81 года) с гемобластозами, находившихся в гематологической клинике ФГБУ «РосНИИ ГТ» на лечении в период 2006–2013 гг. Среди исследуемых были 39 пациентов с миелодиспластическим синдромом (МДС), 28 – острым миелоидным лейкозом (ОМЛ), 21 – первичным миелофиброзом (ПМФ), 10 – хроническим миелолейкозом (ХМЛ) в фазе бластного криза, 42 – множественной миеломой (ММ) в III стадии, 19 – неходжкинскими лимфомами (НХЛ) в III–IV стадиях, 22 – хроническим лимфолейкозом (ХЛЛ) в стадии C (по J.L. Binet), 9 – острым лимфобластным лейкозом (ОЛЛ). В исследуемую группу входили молодые пациенты со стабильным статусом и больные по- жилого возраста (старше 65 лет) с наличием сопутствующей сердечной, легочной недостаточности, а также больные с нестабильным течением основного заболевания (сепсис, неустойчивые показатели периферической крови, геморрагический синдром, гемолиз). По степени тяжести анемии (по классификации ВОЗ) были выделены 3 группы больных: с умеренной анемией (n = 49), с выраженной анемией (n = 61) и с анемией угрожающей степени тяжести (n = 80).
Переливания донорских эритроцитов и оценка их эффективности проводились в соответствии с «Инструкцией по применению компонентов крови» [15]: после каждой гемотрансфузии эритроцитов исследовали гемограмму, общий анализ мочи. Назначались ТЭ при наличии жалоб на выраженную слабость, сердцебиение, одышку при минимальной физической активности, резкое снижение работоспособности, тахикардию, а также при содержании
гемоглобина <80 г/л, гематокрита <25%. Прекращали трансфузии эритроцитов при достижении содержания гемоглобина 85–95 г/л и выше. Показания расширяли (содержание гемоглобина <95 г/л и гематокрита <30%) у пациентов пожилого возраста с сердечной или легочной недостаточностью. Эффективность ТЭ оценивали по уменьшению клинической симптоматики анемии и приросту концентрации гемоглобина. В зависимости от прироста концентрации Hb на одну дозу перелитых донорских эритроцитов пациентов подразделили на три группы: с положительным (полным) ответом (прирост уровня Hb 10 г/л), частичным (на 5–9,9 г/л) и минимальным (на <5 г/л).
Для коррекции анемии назначали фильтрованную эритроцитную массу (ФЭМ), отмытые эритроциты (ОЭ), размороженные и отмытые эритроциты (РЭМ), а также эритроцитную массу (ЭМ). Учитывая, что часть пациентов получала многократные переливания донорских эритроцитов (в течение >2 мес.), им исследовали кровь на наличие алло- и аутоантиэритроцитарных антител и при наличии подозрения на возможную несовместимость (n = 16) ТЭ производили после индивидуального подбора донорских эритроцитов с учетом комплекса антигенов по системе Резус.
При коррекции анемии учитывались не только симптомы анемии, показатели гемограммы, но и генез развития анемии. Так, в ходе исследования выявлено, что основными причинами анемии были опухолевая инфильтрация КМ и уменьшение плацдарма эритроидного ростка (у 41 пациента число эритроидных предшественников в стернальном пунктате составляло от 0,2 до 9,8%), гемолиз эритроцитов (у 25 больных – повышение непрямой фракции билирубина от 19,2 до 41,9 мкмоль/л), иногда выявлялся дефицит железа (у 24 пациентов сывороточное железо составляло от 4,0 до 8,8 мкмоль/л), наблюдался геморрагический синдром (у 16 больных, включая желудочнокишечные и носовые кровотечения), обусловленный ДВС-синдромом или тромбоцитопенией. При наличии дефицита железа помимо ТЭ назначали препараты железа. Для остановки кровотечения применялись свежезамороженная плазма, концентрат тромбоцитов в терапевтических дозах в комплексе с гемостатическими препаратами.
Статистическую обработку полученных результатов выполняли с использованием прикладных программ Microsoft Windows (Microsoft Excel, Ver. 2007) и STATISTICA 7.0 for Windows. Различия считали достоверными при p < 0,05.
Результаты исследования
В ходе проведенного анализа выявлено, что самой востребованной оказалась фильтрованная эритроцитная масса (табл. 1), которая применялась в 5,5 раза чаще по сравнению с ОЭ или РЭМ (p < 0,02) и в 15 раз чаще, чем ЭМ (p < 0,0001).
На фоне ТЭ у пациентов отмечалась положительная клиническая динамика – существенно уменьшилась симптоматика анемии и улучшились показатели периферической крови (табл. 2). При этом содержание гемоглобина в целом по группе увеличилось с 70,4 ± 0,9 до 98,6 ± 1,0 г/л (p < 0,001), а его прирост констатирован в среднем 28,9 ± 1,2 г/л, что соответствовало 8,0 ±0,4 г/л (1–30 г/л) из расчета на каждую перелитую дозу эритроцитов. Аналогично отмечалось и повышение количества эритроцитов в среднем на 0,92 ± 0,03×10¹²/л и уровня гематокрита в среднем на 8,3 ± 0,3%.
При сравнительном анализе выявлено, что число доз эритроцитов в зависимости от возраста больных существенно не различалось; так, молодым пациентам (от 18 до 65 лет) и пациентам старшего возраста (от 66 до 81 года) для коррекции анемии потребовалось в среднем 5,1 ± 0,5 и 4,3 ± 0,4 дозы соответственно (p > 0,05).
Однако на фоне ТЭ не у всех пациентов одинаково повышались показатели периферической крови, что позволило разделить пациентов на группы в зависимости от увеличения уровня Hb на одно переливание эритроцитов (табл. 3).
Группа больных с полным ответом на ТЭ составила 30,0% (n = 57). Уровень Hb повышался на 10 г/л (в среднем на 11,4 ± 0,6 г/л) после каждого переливания эритроцитов, уменьшалась симптоматика анемии (одышка, слабость, головокружение, сердцебиение, гипотония, гиподинамия и т. д.). В данную группу вошли пациенты с онкогематологическими заболеваниями с благоприятным прогнозом по основному заболеванию и хорошо реагировавшие на противоопухолевую терапию. Этим больным переливались в среднем 2,9 ± 0,2 (1–7) дозы эритроцитов. В результате содержание гемоглобина увеличилось (рис. 1) с 70,4 ± 1,7 до 103,4 ± 0,9 г/л. Необходимо подчеркнуть, что у 41 пациента после трансфузий эритроцитов быстро выросли показатели эритрона (Hb >100 г/л, Ht >30%) не только благодаря высокой эффективности ТЭ, но и регенеративной активности КМ больных. В этой группе пациентов в течение четырех месяцев после ТЭ общая выживаемость составила 94,7%. Летальных исходов в этой группе констатировано 3 (5,3%) из 57 больных; при этом у 2 больных ММ развилась острая почечная недостаточность (1 пациентка с ММ III ст. В) и острая сердечная недостаточность (1 пациентка с ММ III ст. А), и у 1 – с ХЛЛ С стадией по J.L. Binet – развилась тяжелая двусторонняя пневмония.
Группа пациентов с частичным ответом на ТЭ составила 37,4% (n = 71). У этих больных после каждого переливания эритроцитов отмечалось повышение содержания гемоглобина на 5,0–9,7 г/л (в среднем на 6,6 ± 0,2 г/л), уменьшение симптомов анемии, а при отмене переливаний через 10–15 дней наблюдалось умеренное снижение показателей эритрона, как правило, не требующее повторных трансфузий. В данную группу вошли преимущественно пациенты с благоприятным прогнозом (n = 47) и с рецидивами и рефрактерными формами заболевания: МДС (n = 8) – рефрактерная анемия с избытком бластов (РАИБ I и II), ОМЛ из предшествующего МДС (n = 5) и ОМЛ, вызванный предшествующим лечением (n = 3), ХМЛ бластный криз (n = 3), ММ, резистентная к химиотерапии (n = 4), синдром Рихтера при хроническом лимфолейкозе (n = 1). Этим больным переливались в среднем по 4,5 ± 0,3 (1–10) дозы эритроцитов. За время гемотрансфузий содержание гемоглобина повысилось с 68,7 ± 1,4 до 97,6 ± 1,2 г/л. ОВ в пределах 4 месяцев составила 84,5%. Летальные исходы больных (11 из 71, или 15,5%) были обусловлены рефрактерностью к проводимой противоопухолевой терапии и прогрессией основного заболевания.
Группа пациентов с минимальным ответом на переливания эритроцитов составила 32,6% (n = 62). Больные этой группы, как правило, нуждались через 10–14 дней в повторных гемотрансфузиях. Прирост гемоглобина после каждого переливания эритроцитов не превышал 4,9 г/л (в среднем 2,6 ± 0,2 г/л). Повышение концентрации гемоглобина отмечено с 72,5 ± 1,6 до 89,2 ± 1,8 г/л. Низкий прирост уровня Hb в этой группе, а в последующем и быстрое его снижение после ТЭ обусловлены преимущественно гемолизом (повышение общего билирубина 20,5 мкмоль/л – у 19 больных), выраженным угнетением кроветворения (снижение эритроидных элементов КМ менее 5% – у 17 пациентов) за счет рефрактерности заболевания к противоопухолевой терапии, а также токсическим эффектом ХТ (гематологическая токсичность III–IV ст.). Этим пациентам для улучшения состояния в последующем было перелито существенно большее количество доз донорских эритроцитов – в среднем 6,4 ± 0,8 (2–32), за счет чего удалось повысить уровень гемоглобина и гематокрит. В данную группу вошли пациенты с рефрактерными формами гемобластозов. ОВ в течение 4 месяцев составила 66,1%. Летальные исходы пациентов в течение четырех месяцев в этой группе больных (21 из 62 – 33,9%) были обусловлены рефрактерностью к ХТ и прогрессией основного заболевания.
В ходе сравнительного анализа выявлено, что прирост уровня гемоглобина существенно отличался, достигая соответственно 103,4 ± 0,9; 97,6 ± 1,2 г/л (p = 0,004) и 89,2 ± 1,8 г/л (p < 0,001), хотя исходные концентрации Hb были практически одинаковые (70,4 ± 1,7; 68,7 ± 1,4 г/л и 72,5 ± 1,6 г/л; p > 0,3). Значительно отличалась и общая выживаемость (рис. 2) в пределах 4 месяцев (с начала гемотрансфузий).
Так, если в 1-й группе общая выживаемость составила 94,7% (из 57 умерло 3 больных), во 2-й – 84,5% (из 71 умерло 11 пациентов) – без статистически значимой разницы (p = 0,12), то в 3-й – 66,1% (из 62 умерло 21), что существенно различалось c 1-й и 2-й группами (p = 0,0003 и p = 0,023 соответственно). Однако за исследуемый период медиана ОВ не достигнута.
Была исследована связь общей выживаемости с рядом факторов. Методом множественной регрессии установлено влияние объема (R = 0,183; p = 0,036; n = 130) и числа перелитых доз (R = 0,162; p = 0,029; n = 190) донор ских эритроцитов, а также низкого прироста уровня гемоглобина (R =–0,180; p = 0,017; n = 190) на общую выживаемость пациентов. Это указывает на тот факт, что чем более длительно купируется анемия у больного и чем выше потребность в переливаниях донорских эритроцитов для адекватной коррекции анемии, тем хуже прогноз основного заболевания, что позволяет стратифицировать больных на группы риска. В группе больных низкого риска (с полным ответом на переливания донорских эритроцитов – уровень гемоглобина повышался на ×10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ – уровень Hb повышался на 5–9,9 г/л) общая выживаемость констатирована в 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) общая выживаемость – 66,1%.
В то же время не выявлено связи общей выживаемости в течение 4 месяцев ни с возрастом пациентов (R = 0,05; p = 0,51; n = 190), ни с полом (R = 0,011; p = 0,89; n = 186), ни с исходным содержанием гемоглобина (R = 0,017;
p = 0,81; n = 190).
Обсуждение
Анемия при гемобластозах нередко выступает ведущим симптомом заболевания (в 20–98% случаев), снижает противоопухолевый эффект химиотерапии, ухудшает прогноз и качество жизни пациентов [2–7, 19]. В период постановки диагноза при лимфогранулематозе анемия выявляется у 22% больных, увеличиваясь на фоне противоопухолевого лечения до 54,5%; при НХЛ – у 34,9%, увеличиваясь на фоне ХТ до 73,7%; при ХЛЛ – у 30,1%, повышаясь до 72,9%; при ММ – у 56%, возрастая до 77,4% [6, 7]. Еще чаще анемию выявляют у пациентов с острыми миелоидными и лимфоидными лейкозами, МДС. При первичной диагностике ПМФ анемия встречается у 38% пациентов с постепенным возрастанием частоты в процессе прогрессирования заболевания; при эссенциальной тромбоцитемии в фазе бластного криза – у 74% больных; при ХМЛ на фоне терапии ингибиторами тирозинкиназы – от 40 до 83% [5, 19–23]. Причем анемия у больных индолентными формами лимфопролиферативных заболеваний нередко расценивается в качестве «индикатора» для начала ХТ [24].
При выборе тактики корригирующего анемию лечения таких больных необходимо учитывать риск развития опасных для жизни осложнений, возникающих вследствие действия хронической гипоксии из-за неадекватной оксигенации жизненно важных органов, прежде всего мозга, сердца, печени, а также механизмы развития анемии, с учетом которых можно купировать анемию или значительно улучшить общее состояние пациента. У больных онкогематологическими заболеваниями в генезе анемии могут принимать участие сразу несколько факторов: а) опухолевая инфильтрация КМ с вытеснением эритроидных элементов; б) гемолиз эритроцитов; в) супрессия эритроидного ростка провоспалительными цитокинами; г) низкая продукция эндогенного эритропоэтина; д) функциональный дефицит железа вследствие повышения продукции гепсидина; е) свободнорадикальное окисление фосфолипидов клеточных мембран во время проведения ХТ; ж) геморрагический синдром [3, 25–30]. С учетом выявления факторов, участвующих в развитии анемии, в настоящее время возможна ее коррекция патогенетическими методами, например, назначением препаратов эритропоэтина [1, 3]. Однако не для всех пациентов патогенетическая терапия может быть приемлема, ввиду того что эффективность ее, как правило, не превышает 60–70%, а ответ на терапию ожидается через 2–3 месяца [25, 31]. Выжидательная тактика для больных гемобластозами не всегда оправдана вследствие опасности прогрессирования опухолевого процесса и риска для жизни пациента от гипоксии миокарда и других жизненно важных органов, особенно в пожилом возрасте с наличием сопутствующей ишемической болезни сердца. В то же время ТЭ являются универсальным и срочным методом коррекции анемии, независимо от нозологической формы болезни. Следовательно, заместительная гемокомпонентная терапия остается приоритетной, тем более при угрозе жизни больного, так как она позволяет в кратчайшие сроки добиться улучшения общего состояния пациента.
Показаниями для ТЭ служат выраженная клиническая картина анемии и снижение содержания гемоглобина и гематокрита. В настоящее время существуют две тактики: рестриктивная, при которой переливания донорских эритроцитов проводят при содержании гемоглобина менее 70 г/л, поддерживая его в пределах 70–90 г/л, и либеральная – переливания эритроцитов осуществляют при содержании гемоглобина менее 100 г/л [32]. Выбирая одну или другую тактику коррекции хронической анемии у больных гемобластозами, необходимо тщательно взвесить потенциальный риск и выгоду от гемотрансфузий. Так, несмотря на возросшие требования к отбору доноров, использованию высокотехнологичных методов диагностики трансмиссивных инфекций, индивидуальному подбору доноров, тем не менее сохраняется риск передачи инфекций (вирусные гепатиты В, С, ВИЧ и др.) от донора реципиенту, аллоиммунизация пациента антигенами, а также риск перегрузки организма железом с развитием гемосидероза внутренних органов [8–12, 14, 15]. В связи с этим в последние годы у пациентов с хронической анемией донорские эритроциты переливают только для коррекции важнейших симптомов анемии, не поддающихся основной патогенетической терапии [15].
Однако при онкогематологических заболеваниях больные отличаются нестабильностью общего соматического состояния и вариабельностью течения основного опухолевого процесса, они получают цитостатическую терапию, обладающую токсичностью не только на гемопоэз, но и на другие жизненно важные органы и системы, включая сердечно-сосудистую, что приводит к снижению толерантности организма к гипоксии [2, 16]. Поэтому рестриктивная тактика в отношении переливаний эритроцитов у такой категории пациентов, особенно в пожилом возрасте с наличием сопутствующей сердечной недостаточности, небезопасна.
В проведенной работе продемонстрировано, что у 30% онкогематологических больных получен полный ответ на переливания эритроцитов, а прирост содержания Hb составил более 10 г/л; у них быстро происходило восстановление собственного гемопоэза после курсов противоопухолевой терапии и сохранялся эффект от переливаний эритроцитов на длительный период. У таких пациентов без признаков сердечной недостаточности коррекцию анемии проводили при уровне Hb <80 г/л. Стабильного состояния достигали после переливания 2,9 ± 0,2 дозы эритроцитов. У 37,4% больных с частичным ответом также отмечался удовлетворительный эффект от ТЭ с приростом гемоглобина на одну перелитую дозу эритроцитов 5–9,7 г/л. Улучшение состояния в этой группе больных достигалось за счет переливания 4,5 ± 0,3 дозы эритроцитов. Как в первой, так и во второй группе пациентов содержание гемоглобина через 10–14 дней снижалось незначительно. В то же время недостаточная эффективность от переливаний донорских эритроцитов наблюдалась в третьей группе с минимальным ответом. Прирост уровня Hb на одну перелитую дозу эритроцитов констатирован менее 5 г/л. Улучшение состояния и повышение концентрации Hb >80 г/л у таких пациентов удавалось достичь лишь после переливания 6,4 ± 0,8 дозы донорских эритроцитов. У этих больных выявлялись не только продвинутая стадия заболевания с депрессией эритропоэза, обусловленной прогрессированием опухолевого процесса и токсическим эффектом цитостатической терапии, но нередко и гемолиз эритроцитов, как проявление основного заболевания.
При определении тактики заместительной гемокомпонентной терапии следует учитывать также возраст пациентов и наличие сердечной или дыхательной патологии в связи с риском гипоксических осложнений. У пациентов пожилого возраста, даже при более высоких показателях периферической крови (содержание гемоглобина 80–100 г/л, гематокрита 26–30%), чаще наблюдались тахикардия (пульс свыше 90–110 уд/мин), гипотония (артериальное давление менее 120/70 мм рт. ст.), одышка при умеренной нагрузке, а иногда и в покое. В то же время после переливания эритроцитов у них отмечалось значительное улучшение общего состояния и купирование или значительное уменьшение клинической симптоматики. Поэтому для коррекции анемии у пожилых больных, а также у пациентов с наличием сердечной или легочной недостаточности, с признаками неэффективного эритропоэза, переливания эритроцитов необходимо проводить при содержании Hb <90–95 г/л и уровне гематокрита <30%.
При заместительной терапии анемии с помощью гемотрансфузий мы учитывали не только показатели периферической крови, но и генез ее развития. В ходе исследования выявлено, что основными причинами анемии были опухолевая инфильтрация КМ, нарушение гемопоэза, гемолиз эритроцитов, а также токсическое действие ХТ. В то же время у некоторых больных выявлялся дефицит железа, геморрагический синдром, обусловленный ДВС-синдромом и/или тромбоцитопенией. Поэтому таким пациентам помимо переливаний донорских эритроцитов назначали препараты железа; для остановки кровотечения больные получали свежезамороженную плазму, концентрат тромбоцитов в комплексе с гемостатическими препаратами. В последние годы для коррекции анемии, прежде всего обусловленной токсическим эффектом противоопухолевой терапии, а также отрицательным действием опухолевых клеток на эритропоэз, большое внимание уделяется патогенетической терапии с назначением эритропоэзстимулирующих агентов. Их применение позволяет добиться положительного результата у 24–85% больных [1, 25, 31]. Эритропоэзстимулирующая терапия особенно эффективна, если анемия обусловлена низким синтезом эндогенного эритропоэтина [1, 3, 31]. Тем не менее больные, имеющие тяжелую степень анемии с уровнем Hb <80 г/л, Ht <25%, нуждаются в ТЭ, даже если им проводится терапия препаратами рекомбинантного эритропоэтина.
Анемия, трудно поддаваемая коррекции с помощью переливаний донорских эритроцитов, часто была вызвана гемолизом, не позволяющим добиться повышения уровня гемоглобина и гематокрита до необходимых цифр. У этих больных наблюдалось повышение непрямого билирубина (19,2–41,9 мкмоль/л). В качестве патогенетической терапии таким пациентам показано назначение кортикостероидных гормонов и иммуносупрессивных препаратов, что ранее было показано нами у пациента с НХЛ с синдромом Эванса, получившего более 60 переливаний донорских эритроцитов и пролеченного глюкокортикоидными гормонами без эффекта. Однако был получен положительный ответ на применение анти-CD20 моноклональных антител (ритуксимаба) с последующей длительной ремиссией [33].
Необходимо также отметить, что общая выживаемость в течение 4 месяцев от начала трансфузионной терапии существенно отличалась в группе с минимальным ответом на переливания донорских эритроцитов (рис. 2), составляя 66,1% против 94,7 и 84,5% соответственно в группах с полным и частичным ответами. Это подтверждает ту версию, что чем труднее купируется анемия у пациента, т. е. чем ниже эффективность ТЭ, тем хуже прогноз основного заболевания, что позволяет стратифицировать больных на группы риска. В группе больных низкого риска (с полным ответом на ТЭ – уровень гемоглобина повышался на 10 г/л) общая выживаемость составила 94,7%. В группе пациентов промежуточного риска (частичный ответ — уровень Hb повышался на 5–9,9 г/л) ОВ – 84,5%; в группе больных высокого риска (минимальный ответ – уровень Hb повышался на <5 г/л) ОВ – 66,1%. Стратификация пациентов на группы риска может быть взята в качестве
прогностического маркера.
Таким образом, основными причинами анемии у проанализированных больных явились выраженная депрессия эритропоэза, обусловленная проявлением опухолевого заболевания, токсическим действием химиотерапии, гемолизом эритроцитов, а также дефицитом железа и геморрагическим синдромом. Заместительные переливания эритроцитов позволяют корригировать анемию, восстановить уровень гемоглобина и гематокрита у большинства пациентов. Однако после прекращения переливаний возможно снижение уровня гемоглобина, что требует повторных трансфузий. Стратификация пациентов на группы риска в зависимости от эффективности пере-
ливания донорских эритроцитов позволяет прогнозировать течение основного заболевания и дифференцированно подходить к терапии анемии при гемобластозах.
Литература
1. Бессмельцев С.С., Романенко Н.А., Абдулкадыров К.М. Современные подходы к лечению анемии у больных с онкогематологическими заболеваниями // Современная онкология. – 2010. – Т. 12, № 1. – С. 70–75.
2. Oliva E.N., Dimitrov B.D., Benedetto F. et al. Hemoglobin level threshold for cardiac remodeling and quality of life in myelodysplastic syndrome // Leuk. Res. – 2005. – Vol. 29. – P. 1217–1219.
3. Романенко Н.А. Патогенез и терапия анемии препаратами рекомбинантного эритропоэтина у онкогематологических больных (обзор литературы) // Онкогематология. – 2012. – № 3. – С. 20–29.
4. Moullet I., Salles G., Ketterer N. et al. Frequency and significance of anemia in non-Hodgkin’s lymphoma patients // Ann Oncol. – 1998. – Vol. 9. – P. 1109–1115. 5. Santos F.P., Alvarado Y., Kantarjian H. et al. Long-term prognostic impact of the use of erythropoietic-stimulating agents in patients with chronic myeloid leukemia in chronic phase treated with imatinib // Cancer. 2011. – Vol. 117, № 5. – P. 982–991.
6. Steurer M., Wagner H., Gastel G. Prevalence and management of anaemia in haematologic cancer patients receiving cyclic nonplatinum chemotherapy: results of a prospective national chart survey // Wien. Klin. Wochenschr. – 2004. – Vol. 116, № 11–12. – P. 367–372.
7. Truong P.T., Parhar T., Hart J. et al. Population-based analysis of the frequency of anemia and its management before and during chemotherapy in patients with malignant lymphoma // Am. J. Clin. Oncol. – 2010. – Vol. 33, № 5. – P. 465–468.
8. Грицаев С.В., Даваасамбуу Б., Романенко Н.А., Абдулкадыров К.М. Отбор больных для терапии хелаторами железа // Клин. онкогематология. – 2013. – Т. 6, № 2. – С. 204–209.
9. Brecher M.E., Hay S.N. Bacterial contamination of blood components // Clin. Microbiol. Rev. – 2005. – Vol. 18, № 1. – P. 195–204.
10. Dreyfus F. The deleterious of iron overload in patients with myelodysplastic syndromes // Blood Rev. – 2008. – Vol 22, Suppl. 2 – S. 29–34.
11. Khorana A.A., Francis C.W., Blumberg N. et al. Blood Transfusions, Thrombosis, and Mortality in Hospitalized Patients With Cancer // Arch. Intern. Med. – 2008. – Vol. 168, № 21. — P. 2377–2381.
12. Leitch H.A., Vickars L.M. Supportive care and chelation therapy in MDS: are we saving lives or just lowering iron? // Hematology Am. Soc. Hematol. Educ. Program. – 2009. – P. 664–672.
13. Жибурт Е.Б., Караваев А.В., Шестаков Е.А. и др. Правила переливания эритроцитов, основанные на доказательствах // Трансфузиология. – 2012. – Т. 13, № 3. – C. 55.
14. Правила клинического использования донорской крови и (или) ее компонентов // Приказ от 2 апреля 3013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов» [Электронный ресурс] // http://www.transfusion. ru/2013/08-29-1.pdf.
15. Инструкция по применению компонентов крови (Утверждена Приказом Минздрава РФ от 25 ноября 2002 года № 363 «Об утверждении Инструкции по применению компонентов крови») // [Электронный ресурс]// http://www.zdrav.ru/library/regulations/detail.php?ID = 26150.
16. Романенко Н.А. Терапия и профилактика анемии и перегрузки железом у больных миелодиспластическим синдромом // Биомедицинский журнал. – WWW.Medline.ru. – 2013. – Т. 13. – С. 967–986.
17. Техническое руководство американской ассоциации банков крови / Под ред. Ю.Н. Токарева. – Милан: Европейская школа трансфузионной медицины, 2000. – 1056 с.
18. Romanenko N.A. Study of efficacy red cell transfusions and their influencing on quality of life in hematological malignancies patients with anemia // Haematologica – The Hematology journal. – 2012. – Vol. 97, Suppl. 1. – P. 163.
19. Quintás-Cardama A., De Souza Santos F.P., Kantarjian H. et al. Dynamics and management of cytopenias associated with dasatinib therapy in patients with chronic myeloid leukemia in chronic phase after imatinib failure // Cancer. – 2009. – Vol. 115, № 17. – P. 3935–3943.
20. Tefferi A., Lasho T.L., Jimma T. et al. One thousand patients with primary myelofibrosis: the mayo clinic experience // Mayo Clin. Proc. – 2012. – Vol. 87, № 1. – P. 25–33.
21. Passamonti F., Rumi E., Arcaini L. et al. Blast phase of essential thrombocythemia: A single center study // Am. J. Hematol. – 2009. – Vol. 84, № 10. – P. 641–644.
22. Романенко Н.А., Абдулкадыров К.М., Бессмельцев С.С. Эффективность коррекции анемии у больных хроническим миелолейкозом, развившейся на фоне терапии иматинибом // Биомедицинский журнал. – WWW.Medline.ru. – 2010. – Т. 11. – С. 376–389.
23. Cortes J., O’Brien S., Quintas A. et al. Erythropoietin is effective in improving the anemia induced by imatinib mesylate therapy in patients with chronic myeloid leukemia in chronic phase // Cancer. – 2004. –Vol. 100, № 11. – P. 2396–2402. 24. Samuelsson J. Long-standing resolution of anemia in symptomatic low-grade non-Hodgkin’s lymphoma patients treated with recombinant human erythropoietin as sole therapy // Med. Oncol. – 2002. – Vol. 19, № 1. – P. 69 72.
25. Романенко Н.А., Абдулкадыров К.М. Патогенетическая коррекция анемии эритропоэзстимулирующими препаратами у больных лимфопролиферативными заболеваниями // Онкогематология. – 2011. – № 3. – С. 39–49.
26. Рукавицын О.А. Актуальные вопросы диагностики и лечения анемии при хронических заболеваниях // Клинич. онкогематол. – 2012. – Т. 5, № 4. – С. 296–304.
27. Eve H.E., Rule S.A. Autoimmune haemolytic anaemia associated with mantle cell lymphoma // Int. J. Hematol. – 2010. – Vol. 91, № 2. – P. 322–325.
28. Romanenko N.A., Rozanova O.E., Glazanova T.V., Abdulkadyrov K.M. Role of cytokines in resistance to erythropoiesis stimulating agents treatment of anaemia in patients with lymphoproliferative disorders // Haematologica. – 2012. – Vol. 97, Suppl. 1. – P. 550–551.
29. Tsopra O.A., Ziros P.G., Lagadinou E.D. et al. Disease-related anemia in chronic lymphocytic leukemia is not due to intrinsic defects of erythroid precursors: a possible pathogenetic role for tumor necrosis factor-alpha // Acta Haematol. – 2009. – Vol. 121, № 4. – P. 187–195.
30. Zupanić-Krmek D., Lang N., Jurcić D. et al. Analysis of the influence of various factors on anemia in patients with lymphoid malignancies // Acta Clin. Croat. – 2011. – Vol. 50, № 4. – P. 495–500.
31. Романенко Н.А., Бессмельцев С.С., Беркос М.В. и др. Прогностическая значимость ряда лабораторных показателей крови при использовании препаратов, стимулирующих эритропоэз у больных лимфопролиферативными заболеваниями с анемией // Тер. архив. – 2013. – Т. 85, № 8. – С. 81–86.
32. Жибурт Е.Б., Шестаков Е.А. Внедрение правил назначения компонентов крови в клиническую практику // Трансфузиология. – 2007. – Т. 8, № 3–4. – С. 47–59.
33. Романенко Н.А., Бессмельцев С.С., Абдулкадыров К.М. Патогенетическое лечение пациентки с неходжкинской лимфомой маргинальной зоны селезенки, осложненной синдромом Эванса // Каз. мед. журн. – 2012. – Т. XCIII, № 5. – С. 843–846.
Генная терапия серповидно-клеточной анемии у подростков с использованием лентивирусного вектора
В статье New England Journal of Medicine от 2 марта
2017 года опубликован клинический случай об успешном лечении пациента с тяжелой формой
серповидно-клеточной анемией (СКА) посредством генной терапии.
Серповидноклеточная анемия является одним из наиболее распространенных наследственных моногенных
заболеваний. Около 90 000 человек в Соединенных Штатах страдают серповидноклеточной анемией, а
во всем мире более 275 000 детей ежегодно рождаются с данным заболеванием.
СКА – это заболевание в основе, которого лежит изменение формы эритроцитов, вследствие
появления патологического гемоглобина S (HbS), в результате точечной мутации в гене β-цепи
гемоглобина
Клиническими проявлениями являются вазоокклюзионные кризы в жизненно важных органах. Что в итоге
приводит к необратимому поражению органов, низкому качеству жизни, сокращению
продолжительности жизни и даже к смерти.
Основным методом лечения, является использование препарата гидроксимочевины, механизм действия
которой заключается в повышение уровня фетального гемоглобина. У многих пациентов использование
гидроксимочевины, является единственным методом терапии, облегчающей проявления заболевания.
Аллогенная трансплантация, в настоящее время, это единственный метод терапии для пациентов с
тяжелой формой СКА. Однако, менее 18% пациентов имеют полностью совместимого
донора-сиблинга.
Использование генной терапии у пациентов с СКА, может обеспечить длительную клиническую
ремиссию.
Ранее, были сообщения об эффективном лечении СКА у мышей, посредством генной терапии с
использованием вирусного вектора. В данной статье, рассмотрены результаты успешного
лечения пациента, который получил генную терапию в клиническом исследовании HGB-205.
Клинический случай:
Мальчик, 13 лет
Диагноз: тяжелая форма СКА, с генотипом βS / βS (точечная делеция гена 3.7 kb
α-глобина)Клинические проявления: многочисленные вазооклюзионные кризы, эпизода стенокардии,
двусторонний остеонекроз тазобедренных суставов.Операции: холецистэктомия и спленэктомия.
Лечение: с 2 до 9 лет получал терапию гидроксимочевинной, клинические симптомы оставались
прежние. С 2010 года мальчик получал лечение хелатированным железом в дозе 17 мг/кг в
сутки.В октябре 2014 г применена генная терапия с использованием лентивирусного вектора.
Лентивирусный вектор, кодирующий ген βA-глобин человека, подобно гамма-глобину,
субъединице фетального гемоглобина, гасит полимеризацию HbS.Пациенту выполнено миелоаблативное кондиционирование с использованием бусульфана.
После 2-х дневного перерыва реинфузия аутологичных трансдуцированных CD34+ клеток (5,6
× 106/кг МТ CD34+).Заместительные гемотрансфузии продолжались, пока содержание HbA не составило от 25 до 30% от
общего содержания гемоглобина.
Основные лабораторные показатели до генной терапии (при скрининге) и через 3-месячные интервалы
после переливания трансдуцированных аутологичных CD34+ клеток
|
|
Норма |
Скрининг* |
3 меc.* |
6 меc. |
9 мес. |
12 мес. |
15 мес. |
|
Гемоглобин г/дл |
13.0-18.0 |
10.1 |
12.0 |
10.6 |
11.4 |
11.7 |
11.8 |
|
Эритроциты в мм3 |
4.5 – 6.2 млн |
3.7 млн |
3.9 млн |
3.7 млн |
4 млн |
4.2 млн |
4.3 млн |
|
Ретикулоциты в мм3 |
20 – 80 тыс |
238 тыс |
259 тыс |
132 тыс |
131 тыс |
143 тыс |
143 тыс |
|
MCH пг |
25-30 |
28 |
31 |
29 |
28 |
28 |
28 |
|
MCHC г/дл |
31-34 |
35 |
34 |
35 |
36 |
35 |
35 |
|
Тромбоциты в мм3 |
150-450 тыс |
356 тыс |
52 тыс |
122 тыс |
157 тыс |
168 тыс |
201 тыс |
|
Нейтрофилы в мм3 |
1.5-7.0 тыс |
4.2 тыс |
2.4 тыс |
3.1 тыс |
2.5 тыс |
3.0 тыс |
2.2 тыс |
|
Общий билирубин мкмоль/л |
0-17 |
50 |
15 |
20 |
14 |
12 |
12 |
|
ЛДГ МЕ/л |
125-243 |
626 |
285 |
254 |
226 |
274 |
212 |
|
СРБ нг/мл |
<500 |
191 |
814 |
129 |
— |
135 |
158 |
|
Ферритин мкг/л |
22-275 |
265 |
869 |
1095 |
— |
520 |
363 |
|
Трансферрин г/л |
1.9-3.2 |
1.4 |
1.6 |
1.7 |
— |
1.5 |
1.7 |
|
Насыщения трансферрина % |
16-35 |
72 |
— |
— |
35 |
56 |
40 |
|
Рецептор трансферрина сыворотки мг/л |
0.8-1.7 |
5.7 |
3.0 |
2.3 |
— |
2.6 |
2.5 |
|
Железо мкмоль/л |
12-30 |
26 |
18 |
14 |
— |
20 |
17 |
|
Гепсидин нг/мл |
1-20 |
— |
— |
— |
— |
12.9 |
19.9 |
|
АЛТ МЕ/л |
5-45 |
22 |
76 |
125 |
116 |
53 |
41 |
|
АСТ МЕ/л |
5-40 |
53 |
57 |
71 |
50 |
49 |
35 |
*заместительные трансфузии выполнялась до начала генной терапии, а поддерживающие трансфузии
эритроцитов полностью были прекращены через 88 дней после трансплантации.
На данный момент у пациента полная клиническая ремиссия, с полной компенсацией гемолиза и
отсутствием клинических проявлений заболевания.
Преимущество данного подхода — это снижение риска отторжения костного мозга по сравнению с
аллогенной трансплантацией, а также нет необходимости в поиске донора.
«C помощью этого метода лечения можно добиться полной клинической ремиссии» сказал
Steven J. Gray, PhD, from the Gene Therapy Center at the University of North Carolina, Chapel
Hill, для Medscape Medical News.
«Серповидно-клеточная анемия, одно из классических генетических заболеваний, о котором
каждый узнает на первом курсе из биологии. Для тех кто работает в области генной терапии каждый
день, это реальный шанс добиться полного излечения серповидно-клеточной анемии. И это дает
надежду на то, что следующее поколение студентов будет читать об этом неизлечимом заболевании
только в книгах по истории», добавил Steven J. Gray.
Источники:
- http://www.nejm.org/doi/full/10.1056/NEJMoa1609677
- Brousseau DC, Panepinto JA, Nimmer M, Hoffmann RG. The number of people with sickle-cell
disease in the United States: national and state estimates. Am J Hematol 2010;85:77-8. - Modell B, Darlison M. Global epide- miology of haemoglobin disorders and derived service
indicators. Bull World Health Organ 2008;86:480-7. - Ingram VM. A specific chemical dif- ference between the globins of normal human and
sickle-cell anaemia haemo- globin. Nature 1956;178:792-4. - Strouse JJ, Lanzkron S, Beach MC, et al. Hydroxyurea for sickle cell disease: a systematic
review for efficacy and toxicity in children. Pediatrics 2008;122:1332-42. - Bernaudin F, Socie G, Kuentz M, et al. Long-term results of related myeloabla- tive
stem-cell transplantation to cure sickle cell disease. Blood 2007;110:2749-56. - Bhatia M, Walters MC. Hematopoietic cell transplantation for thalassemia and sickle cell
disease: past, present and future. Bone Marrow Transplant 2008;41:109-17. - Krishnamurti L, Abel S, Maiers M, Flesch S. Availability of unrelated donors for
hematopoietic stem cell transplanta- tion for hemoglobinopathies. Bone Mar- row Transplant
2003;31:547-50. - Mentzer WC, Heller S, Pearle PR, Hackney E, Vichinsky E. Availability of related donors for
bone marrow trans- plantation in sickle cell anemia. Am J Pediatr Hematol Oncol
1994;16:27-9.
Материал подготовлен: Субора Антон Юрьевич, врач-гематолог отделения онкологии,
гематологии и трансплантации костного мозга с палатой интенсивной терапии, и клинический ординатор Олейник
Ю.А.
Низкий уровень гемоглобина Когда обратиться к врачу
Некоторые люди узнают, что у них низкий гемоглобин, когда они пытаются сдать кровь. Отказ от сдачи крови — не обязательно повод для беспокойства. У вас может быть гемоглобин, который вам подходит, но не соответствует стандартам, установленным центрами сдачи крови.
Если ваш гемоглобин лишь немного ниже требуемого уровня, особенно если вы принимали участие в сдаче крови в прошлом, вам, возможно, придется подождать пару месяцев и повторить попытку.Если проблема не исчезнет, запишитесь на прием к врачу.
Запишитесь на прием, если у вас есть признаки и симптомы
Если у вас есть признаки и симптомы низкого уровня гемоглобина, запишитесь на прием к врачу. Признаки и симптомы могут включать:
- Усталость
- Слабость
- Бледность кожи и десен
- Одышка
- Учащенное или нерегулярное сердцебиение
Ваш врач может порекомендовать сделать общий анализ крови, чтобы определить, низкий ли у вас уровень гемоглобина.Если ваш тест показывает, что у вас низкий уровень гемоглобина, вам, вероятно, потребуется дополнительное тестирование, чтобы определить причину.
Получите самую свежую информацию о здоровье от экспертов клиники Мэйо.
Зарегистрируйтесь бесплатно и будьте в курсе достижений в области исследований, советов по здоровью и актуальных тем, связанных со здоровьем, таких как COVID-19, а также опыта в области управления здоровьем.
Узнайте больше об использовании данных Mayo Clinic.
Чтобы предоставить вам наиболее актуальную и полезную информацию и понять, какие
информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с
другая имеющаяся у нас информация о вас. Если вы пациент клиники Мэйо, это может
включать защищенную медицинскую информацию.Если мы объединим эту информацию с вашими защищенными
информация о здоровье, мы будем рассматривать всю эту информацию как защищенную
информацию и будет использовать или раскрывать эту информацию только в соответствии с нашим уведомлением о
политика конфиденциальности. Вы можете отказаться от рассылки по электронной почте в любое время, нажав на
ссылку для отказа от подписки в электронном письме.
Подписаться!
Спасибо за подписку
Наш электронный информационный бюллетень Housecall будет держать вас в курсе самой последней информации о здоровье.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить
22 сентября 2020 г.
Показать ссылки
- Гемоглобин.Лабораторные тесты онлайн. https://labtestsonline.org/tests/hemoglobin. По состоянию на 6 марта 2020 г.
- McPherson RA, et al. Эритроцитарные нарушения. В: Клиническая диагностика и лечение Генри лабораторными методами. 23-е изд. Elsevier Inc .; 2017. https://www.clinicalkey.com. По состоянию на 6 марта 2020 г.
- Leung LLK. Подойдите к взрослому с анемией. https://www.uptodate.com/contents/search. По состоянию на 6 марта 2020 г.
- Низкое количество эритроцитов (анемия). Американское онкологическое общество.https://www.cancer.org/treatment/treatments-and-side-effects/physical-side-effects/low-blood-counts/anemia.html. По состоянию на 6 марта 2020 г.
- Доноры отсрочены из-за низкого гемоглобина. Американский Красный Крест. https://www.redcrossblood.org/donate-blood/blood-donation-process/before-during-after/iron-blood-donation/donors-deferred-forlowhemoglobin.html. По состоянию на 20 марта 2020 г.
.
Анемия воспаления или хронического заболевания
На этой странице:
Что такое воспалительная анемия?
Воспалительная анемия, также называемая анемией хронического заболевания или ACD, представляет собой тип анемии, которая поражает людей с состояниями, вызывающими воспаление, такими как инфекции, аутоиммунные заболевания, рак и хроническая болезнь почек (ХБП).
Анемия — это состояние, при котором в вашей крови содержится меньше эритроцитов, чем обычно. В ваших эритроцитах может быть меньше гемоглобина, чем обычно. Гемоглобин — это богатый железом белок, который позволяет эритроцитам переносить кислород из легких во все остальные части тела. Вашему организму нужен кислород для правильной работы. При меньшем количестве эритроцитов или гемоглобина ваше тело может не получать достаточно кислорода.
При воспалительной анемии у вас может быть нормальное, а иногда и повышенное количество железа, запасенного в тканях вашего тела, но низкий уровень железа в крови.Воспаление может помешать вашему организму использовать запасенное железо для выработки достаточного количества здоровых эритроцитов, что приводит к анемии.
Анемия — это состояние, при котором в вашей крови содержится меньше эритроцитов или гемоглобина, чем обычно.
Почему анемию воспаления еще называют анемией хронического заболевания?
Анемия воспаления также называется анемией хронического заболевания, потому что этот тип анемии обычно возникает у людей с хроническими состояниями, которые могут быть связаны с воспалением.
Есть ли другие виды анемии?
Есть много видов анемии. Общие типы включают
- железодефицитная анемия — состояние, при котором запасенное в организме железо расходуется, в результате чего организм вырабатывает меньше здоровых эритроцитов. У людей с железодефицитной анемией уровень железа низкий как в тканях тела, так и в крови. Это самый распространенный вид анемии.
- злокачественная анемия, вызванная недостатком витамина B12.
- апластическая анемия, состояние, при котором костный мозг не вырабатывает достаточно новых эритроцитов, лейкоцитов и тромбоцитов из-за повреждения стволовых клеток костного мозга.
- гемолитическая анемия, состояние, при котором эритроциты разрушаются раньше, чем обычно.
Насколько распространена анемия, вызванная воспалением?
Воспалительная анемия — второй по распространенности тип анемии после железодефицитной анемии. 1
У кого выше вероятность возникновения воспалительной анемии?
В то время как анемия воспаления может поражать людей любого возраста, у пожилых людей больше шансов заболеть этим типом анемии, потому что они с большей вероятностью болеют хроническими заболеваниями, вызывающими воспаление.В Соединенных Штатах около 1 миллиона человек старше 65 лет страдают воспалительной анемией. 2
Приводит ли воспаленная анемия к другим проблемам со здоровьем?
Воспалительная анемия обычно бывает легкой или средней степени тяжести, что означает, что уровень гемоглобина в крови ниже нормы, но не сильно. Если анемия становится тяжелой, недостаток кислорода в крови может вызвать симптомы, например чувство усталости или одышку. Тяжелая анемия может стать опасной для жизни.
У людей с ХБП тяжелая анемия может увеличить вероятность развития проблем с сердцем.
Каковы симптомы воспалительной анемии?
Воспалительная анемия обычно развивается медленно и может вызывать незначительные симптомы или не вызывать их вовсе. Фактически, вы можете испытывать только симптомы болезни, вызывающей анемию, и не замечать дополнительных симптомов.
Симптомы воспалительной анемии такие же, как и при любом типе анемии, и включают
- учащенное сердцебиение
- Боль в теле
- обморок или головокружение
- чувство усталости или слабости
- Легкое утомление во время или после физической активности
- бледная кожа
- одышка
Что вызывает анемию при воспалении?
Эксперты считают, что когда у вас есть инфекция или заболевание, вызывающее воспаление, ваша иммунная система вызывает изменения в работе вашего тела, что может привести к анемии или воспалению.
- Ваше тело не может нормально хранить и использовать утюг.
- Ваши почки могут вырабатывать меньше эритропоэтина (ЭПО), гормона, который сигнализирует вашему костному мозгу — губчатой ткани в большинстве ваших костей — вырабатывать красные кровяные тельца.
- Ваш костный мозг может не реагировать на ЭПО нормально, вырабатывая меньше эритроцитов, чем необходимо.
- Ваши красные кровяные тельца могут жить меньше обычного, в результате чего они умирают быстрее, чем их можно заменить.
Хронические состояния, вызывающие воспалительную анемию
Воспаление, приводящее к анемии, может вызывать множество различных хронических состояний, в том числе
У людей с определенными хроническими состояниями анемия может иметь несколько причин.Например
- Причины анемии при ХБП могут включать воспаление, низкий уровень ЭПО из-за повреждения почек или низкий уровень питательных веществ, необходимых для образования красных кровяных телец. Гемодиализ для лечения ХБП также может привести к железодефицитной анемии.
- Люди с ВЗК могут иметь как железодефицитную анемию из-за кровопотери, так и анемию воспаления.
- У людей, больных раком, анемия может быть вызвана воспалением, кровопотерей или раком, который поражает костный мозг или распространяется на него.Лечение рака, такое как химиотерапия и лучевая терапия, также может вызвать или усугубить анемию.
Другие причины воспалений, которые могут привести к анемии
В то время как анемия воспаления обычно развивается медленно, анемия критического состояния представляет собой тип воспалительной анемии, которая быстро развивается у пациентов, госпитализированных по поводу тяжелых острых инфекций, травм или других состояний, вызывающих воспаление.
В некоторых случаях у пожилых людей развивается воспалительная анемия, не связанная с основной инфекцией или хроническим заболеванием.Специалисты считают, что процесс старения может вызвать воспаление и анемию.
Как медицинские работники диагностируют воспалительную анемию?
Медицинские работники используют историю болезни и анализы крови для диагностики анемии или воспаления.
История болезни
Медицинский работник спросит вас об инфекциях или хронических заболеваниях, которые могут привести к анемии или воспалению.
Анализы крови
Медицинские работники используют анализы крови для выявления признаков анемии, воспаления, других типов анемии или других проблем со здоровьем.Медицинский работник возьмет у вас образец крови и отправит его в лабораторию для анализа.
Анализ крови
позволяет проверить многие части и особенности вашей крови, в том числе
.
- количество эритроцитов
- средний размер эритроцитов
- количество гемоглобина в крови и красных кровяных тельцах
- Количество развивающихся красных кровяных телец, называемых ретикулоцитами, в вашей крови
Некоторые из этих анализов крови и другие могут быть объединены в тест, называемый полным анализом крови.Мазок крови можно использовать для исследования размера, формы и количества эритроцитов в крови.
Медицинский работник может также использовать анализы крови, чтобы проверить количество железа в вашей крови и хранится в вашем теле. Эти тесты могут измерить
- железо в крови
- трансферрин, белок в крови, несущий железо
- ферритин, белок, который хранит железо в клетках вашего тела
Медицинский работник может диагностировать анемию, вызванную воспалением, если результаты анализа крови показывают, что у вас анемия, низкий уровень железа в крови и нормальный уровень железа, хранящегося в тканях вашего тела.
Если результаты анализа крови показывают, что у вас воспаленная анемия, но причина неизвестна, врач может провести дополнительные тесты для поиска причины.
Для анализа крови медицинский работник возьмет у вас образец крови и отправит его в лабораторию.
Как медицинские работники лечат воспалительную анемию?
Специалисты в области здравоохранения лечат анемию, вызванную воспалением, путем лечения основного состояния и лечения анемии лекарствами, а иногда и переливаниями крови.
Лечение основного состояния
Медицинские работники обычно лечат анемию, вызванную воспалением, путем лечения основного состояния, которое вызывает воспаление. Если доступны методы лечения, которые могут уменьшить воспаление, они могут вызвать улучшение или исчезновение анемии. Например, прием лекарств для лечения воспаления при ревматоидном артрите может улучшить анемию.
Лекарства
Медицинский работник может прописать стимулирующие эритропоэз агенты (ЭСС) эпоэтин альфа или дарбэпоэтин альфа для лечения анемии, связанной с ХБП, химиотерапевтического лечения рака или определенных методов лечения ВИЧ.ЭСС заставляют костный мозг производить больше красных кровяных телец. Медицинские работники обычно делают уколы ESA и могут научить вас делать эти уколы в домашних условиях. Медицинский работник может назначить добавки железа в виде таблеток или уколов, чтобы помочь ESAs работать.
Если вы находитесь на гемодиализе, вы можете получать внутривенные (в / в) ЭСС и добавки железа во время гемодиализа. Узнайте больше о лечении анемии при ХБП.
Переливания крови
В некоторых случаях медицинские работники могут использовать переливание крови для лечения тяжелой воспалительной анемии.Переливание крови может быстро увеличить количество гемоглобина в крови и повысить уровень кислорода.
Могу ли я предотвратить анемию воспаления?
Специалисты пока не нашли способа предотвратить анемию воспаления. Для некоторых хронических состояний, вызывающих воспаление, могут быть доступны методы лечения, чтобы уменьшить или предотвратить воспаление, которое может привести к анемии. Поговорите со своим врачом о лечении и следуйте плану лечения, который он рекомендует.
Как еда, диета и питание влияют на воспалительную анемию?
Если у вас хроническое заболевание, которое вызывает анемию или воспаление, следуйте советам врача или диетолога по вопросам здорового питания и питания.
Клинические испытания воспалительной анемии
Национальный институт диабета, болезней органов пищеварения и почек (NIDDK) и другие компоненты Национальных институтов здравоохранения (NIH) проводят и поддерживают исследования многих заболеваний и состояний, включая болезни крови.
Какие клинические испытания проводятся при воспалительной анемии?
Клинические испытания — и другие виды клинических исследований — являются частью медицинских исследований, в которых участвуют такие люди, как вы. Когда вы добровольно принимаете участие в клиническом исследовании, вы помогаете врачам и исследователям больше узнать о болезнях и улучшить медицинское обслуживание людей в будущем.
Исследователи изучают многие аспекты воспалительной анемии, включая новые методы лечения этого состояния.
Узнайте, подходят ли вам клинические исследования.
Какие клинические исследования воспалительной анемии ищут участники?
Вы можете найти клинические исследования воспалительной анемии на сайте www.ClinicalTrials.gov. В дополнение к поиску исследований, финансируемых из федерального бюджета, вы можете расширить или сузить область поиска, включив в нее клинические исследования, проводимые отраслью, университетами и отдельными лицами; однако NIH не рассматривает эти исследования и не может гарантировать их безопасность.Прежде чем участвовать в клиническом исследовании, всегда консультируйтесь со своим врачом.
Список литературы
[1] Немет Э., Ганц Т. Воспалительная анемия. Гематологические / онкологические клиники Северной Америки. 2014; 28 (4): 671–681.
[2] Френкель П.Г. Анемия воспаления: обзор. Медицинские клиники Северной Америки. 2017; 101 (2): 285-296.
Насколько низко слишком низко? Сердечные риски при анемии
Crit Care. 2004; 8 (Дополнение 2): S11 – S14.
1 и 2
Самир М. Фахри
1 Начальник отдела травматологии и реанимации, заместитель заведующего отделом исследований и образования хирургического отделения больницы Инова Фэйрфакс, Фоллс-Черч, Вирджиния, США
Паола Фата
2 Сотрудник по травмам, отделение хирургии, больница Инова Фэйрфакс, Фоллс-Черч, Вирджиния, США
1 Начальник службы травм и реанимации, заместитель председателя по исследованиям и образованию, отделение хирургии, Инова Фэйрфакс Госпиталь, Фоллс-Черч, Вирджиния, США
2 Сотрудник по травмам, отделение хирургии, больница Инова-Фэрфакс, Фолс-Черч, Вирджиния, США
Автор, отвечающий за переписку.
Приложение
Анемия в интенсивной терапии: этиология, лечение и профилактика
Лена Наполитано, Ховард Корвин и Митчелл Финк
Эта статья цитируется в других статьях в PMC.
Abstract
Несмотря на растущую доступность данных, подтверждающих более строгие методы переливания, риски и преимущества переливания крови тяжелобольным пациентам продолжают вызывать споры. Прошлые ретроспективные и наблюдательные исследования показали, что либеральные стратегии переливания были более эффективными у пациентов, у которых уровень гематокрита упал ниже 30%.Растущее количество литературы предполагает, что произвольный запуск переливания («правило 10/30») не рекомендуется. Недавнее рандомизированное контролируемое исследование предоставило убедительные доказательства того, что аналогичные, а в некоторых случаях и лучшие результаты получаются при сохранении ограничительной стратегии переливания крови. Влияние этого накопления доказательств на клиническую практику очевидно в больших отчетах, которые показывают, что средний триггер переливания крови у критически больных пациентов был уровнем гемоглобина в диапазоне 8-8,5 г / дл.Основываясь на имеющихся данных, переливание крови тяжелобольным пациентам без активной ишемической болезни сердца, как правило, следует приостанавливать до тех пор, пока уровень гемоглобина не упадет до 7 г / дл. Переливания следует проводить по клиническим показаниям пациентам с острой продолжающейся кровопотерей и тем, у кого есть объективные признаки и симптомы анемии, несмотря на поддержание эуволемии. Уровень гемоглобина, при котором наблюдается серьезная заболеваемость или смертность у пациентов в критическом состоянии с активной ишемической болезнью сердца, является предметом постоянных дискуссий, но вполне вероятно, что установленный триггер переливания не обеспечит оптимального профиля риск-польза в этой популяции.
Ключевые слова: анемия, кровь, сердечное заболевание, тяжелобольные, гемоглобин, триггер переливания
Введение
В течение многих лет многие врачи твердо верили, что гемоглобин 10 г / дл и гематокрит 30% представляют желаемые цели в пациенты с анемией, особенно пациенты, перенесшие хирургические вмешательства, и пациенты с сердечными заболеваниями. Несмотря на недостаток объективных данных, подтверждающих это утверждение, так называемое «правило 10/30» сохранялось до недавнего времени [1].Большинство авторитетных источников приписывают эту предвзятость отчету Адамса и Ланди от 1942 г. [2], в котором они рекомендовали гемоглобин 10 г / дл и гематокрит 30% в периоперационном периоде на основе своего клинического опыта. Недавние исследования [3-7] предоставили убедительные доказательства против правила 10/30 у пациентов в критическом состоянии, а также в периоперационном периоде. Несмотря на эти данные, многие клиницисты продолжают проводить переливание, используя 30% гематокрит в качестве «триггера переливания» [8]. Однако текущая практика и имеющиеся данные постепенно смещаются от переливания произвольного гемоглобина (10/30) к достижению уровня гемоглобина, необходимого для удовлетворения потребности тканей пациента в кислороде [9,10].
Оптимальный уровень гемоглобина более точно соответствует физиологическим измерениям [11]. У пациентов, которые не находятся в критическом состоянии, большинство исследований продемонстрировало, что значительно более низкий уровень гемоглобина (7 г / дл) может переноситься при сохранении нормоволемии. Опыт работы с пациентами Свидетелей Иеговы позволил оценить переносимость людьми тяжелой острой анемии и продемонстрировал возможность выживания в случае очень низкого гематокрита [12-18]. В обзоре 61 медицинского и хирургического отчета, опубликованного с 1970 по 1993 годы, Виле и Вейскопф [17] выявили 50 смертей, связанных с анемией, у Свидетелей Иеговы без переливания крови с концентрацией гемоглобина 8 г / дл или меньше или гематокритом 24% или меньше.Считалось, что из 50 смертей 23 произошли в основном из-за анемии. За исключением трех пациентов, умерших после кардиохирургии, все пациенты, смерть которых была связана с анемией, умерли с концентрацией гемоглобина 5 г / дл или ниже. Выжили 25 человек с гемоглобином 5 г / дл или меньше.
Недавно Weiskopf и соавторы [19] провели интервенционное исследование, чтобы определить, может ли острое, тяжелое изоволемическое снижение уровня гемоглобина до 5 г / дл у здоровых, отдыхающих людей привести к неадекватным компенсаторным механизмам сердца и, следовательно, к нарушению доставки кислорода.Никаких доказательств недостаточной оксигенации, оцениваемой по отсутствию изменений в потреблении кислорода и концентрации лактата в плазме, не было отмечено у 11 предоперационных пациентов и 21 нехирургического добровольца с уровнем гемоглобина всего 5 г / дл.
Анемия у тяжелобольного пациента
Анемия в условиях критического состояния довольно распространена, 37–44% пациентов получали хотя бы одно переливание крови во время пребывания в отделении интенсивной терапии (ОИТ) [20,21]. В одном репрезентативном исследовании [8] 85% пациентов с длительностью пребывания в ОИТ более 1 недели получили по крайней мере одно переливание крови.Более чем в двух третях этих случаев переливание крови не было связано с острой кровопотерей. Опасения по поводу пагубных последствий анемии все чаще уравновешиваются повышением осведомленности о серьезных, хорошо задокументированных последствиях переливания эритроцитов (эритроцитов) [22].
В основном исследовании, опубликованном в 1999 г., Хеберт с соавторами [3] проспективно рандомизировали 838 тяжелобольных пациентов интенсивной терапии с гемоглобином ниже 9 г / дл на одну из двух стратегий переливания. Контрольная группа («либеральная стратегия») получала переливание упакованных эритроцитов, когда гемоглобин упал ниже 10 г / дл.Исследовательская группа («ограничительная стратегия») получала переливание упакованных эритроцитов, когда гемоглобин упал ниже 7 г / дл. Уровень госпитальной летальности был значительно ниже в группе ограничительной стратегии. Уровень 30-дневной смертности существенно не отличался между группами, но был значительно ниже при применении ограничительной стратегии у менее больных (оценка Acute Physiology and Chronic Health Evaluation II ≤ 20) и пациентов моложе (возраст <55 лет). Не было различий в смертности между группами пациентов с клинически значимым заболеванием сердца.Ограничительная стратегия переливания эритроцитов по крайней мере так же эффективна и, возможно, превосходит либеральную стратегию переливания у пациентов в критическом состоянии, за возможным исключением пациентов с острым инфарктом миокарда и нестабильной стенокардией.
Текущие данные свидетельствуют о том, что врачи пересматривают более консервативные методы переливания в свете этих и подобных данных. Винсент и соавторы [20] провели перекрестное исследование, предназначенное для оценки практики переливания крови в 146 европейских отделениях интенсивной терапии.Они сообщили, что концентрации гемоглобина перед переливанием крови (8,4 г / дл) в настоящее время ниже, чем указанные ранее [20,23]. Данные проспективного многоцентрового наблюдательного исследования [21] предполагают аналогичную тенденцию к более ограничительной практике переливания крови в США. Среднее значение гемоглобина перед переливанием крови составило 8,6 ± 1,7 г / дл [21]. Этот сдвиг в сторону ограничительной политики переливания крови может частично быть связан с работой, опубликованной Canadian Critical Care Trials Group.
Анемия у пациента с сердечно-сосудистыми заболеваниями
Концентрация гемоглобина, при которой возникает риск смерти или серьезного заболевания, была исследована Carson и его коллегами [24] с использованием ретроспективной когорты 1958 пациентов, перенесших операцию и отказавшихся от переливания крови.Первичной переменной результата была 30-дневная смертность. Сердечно-сосудистое заболевание определялось как наличие в анамнезе стенокардии, инфаркта миокарда, застойной сердечной недостаточности или заболевания периферических сосудов. У пациентов с предоперационным уровнем гемоглобина 12 г / дл или выше смертность составляла 1,3%, тогда как у пациентов с предоперационным уровнем гемоглобина менее 6 г / дл уровень смертности составлял 33,3%. Авторы пришли к выводу, что низкий уровень гемоглобина до операции существенно увеличивает риск смерти и серьезных заболеваний [24].
Пороговое значение для переливания крови тяжелобольным или периоперационным пациентам с известным заболеванием коронарной артерии все еще обсуждается. Традиционно считается, что пациенты с анемией и ишемической болезнью сердца имеют высокий риск ишемии или инфаркта миокарда, поскольку они не могут увеличить экстракцию кислорода или коронарный артериальный кровоток. Ретроспективные исследования, проведенные на сегодняшний день в этой популяции, в том числе исследование Carson et al. [24], показывают, что у пациентов в критическом состоянии с сердечными заболеваниями смертность была выше, когда уровень гемоглобина упал с примерно 10 г / дл в периоперационном периоде до 6.0–6,9 г / дл. Фактически, скорректированные шансы смерти у пациентов с сердечно-сосудистыми заболеваниями увеличились в пять раз (с 2,3 до 12,3).
Имеется мало доступных доказательств, подтверждающих использование переливания крови при остром инфаркте миокарда, за исключением ретроспективной работы, основанной на большой базе данных о выписке из административных пациентов, выполненной Wu и его коллегами [25]. Игнорируя существенные ограничения дизайна и методов исследования, Ву и его коллеги сообщили, что пациенты с более низкими значениями гематокрита при поступлении имели более высокие показатели 30-дневной смертности.По крайней мере, одно рандомизированное контролируемое исследование показало, что снижение порога гемоглобина для переливания при аортокоронарном шунтировании до 8 г / дл в послеоперационном периоде не оказывает отрицательного воздействия на исход [26]. Есть предположение, что пациенты с обходным сердечным кровотечением с более высоким уровнем гематокрита в послеоперационном периоде с большей вероятностью перенесут послеоперационный инфаркт миокарда [6]. В этих условиях обе исследуемые группы состояли из пациентов, у которых хирургические поражения были скорректированы, и поэтому они могли вести себя иначе, чем пациенты с фиксированным сердечным заболеванием.Имеются убедительные доказательства положительного эффекта β-блокады у пациентов с ишемической болезнью сердца или из группы риска в плане снижения смертности, а также частоты сердечно-сосудистых осложнений [27]. Однако из недавних исследований по изучению анемии при сердечных заболеваниях не удалось контролировать смешанные переменные, такие как β-блокада и частота сердечных сокращений.
Исследователи в исследовании «Требования к переливанию крови в критических состояниях» (TRICC) [28] провели анализ подгрупп основного исследования, чтобы включить пациентов, которые, как считалось, имели повышенный риск осложнений, связанных с анемией, из-за диагноза, связанного с коронарной артерией. болезнь.Эти исследователи проанализировали 357 пациентов и не обнаружили значительной разницы в 30-дневной смертности между ограничительной и либеральной стратегиями переливания крови. Другие показатели исходов, включая баллы полиорганной дисфункции, интенсивную терапию и продолжительность пребывания в стационаре, были лучше в группе ограничительной стратегии. Более того, в группе либеральной стратегии переливания была более высокая частота отека легких, частого осложнения переливания крови (10,7% против 5,3%), чем в группе ограничительной [3].Интуитивно понятно, что переливание бессимптомного пациента с ишемической болезнью сердца и дисфункцией левого желудочка на самом деле может иметь пагубные последствия, вызывая отек легких. В подгруппе с тяжелой ишемической болезнью сердца ( n = 257) абсолютная выживаемость была ниже в группе ограничительной стратегии, чем в группе либеральной стратегии, но это различие не было статистически значимым. Авторы пришли к выводу, что ограничительная стратегия переливания крови оказалась безопасной для большинства пациентов в критическом состоянии с сердечно-сосудистыми заболеваниями, за возможным исключением пациентов с острым инфарктом миокарда и нестабильной стенокардией.Поскольку этот вывод был сделан на основе анализа подгрупп, следует соблюдать осторожность при интерпретации этих результатов.
Пациент в критическом состоянии с активной ишемической болезнью сердца продолжает оставаться «серой зоной» в литературе. В этих обстоятельствах разумно рекомендовать индивидуальные решения о переливании крови для удовлетворения конкретных потребностей миокарда в кислороде, которые могут изменяться в течение болезни [29]. Произвольное применение правила 10/30 может привести к нежелательным исходам, которых можно избежать, и как таковое больше не может служить триггером переливания крови ни у одной популяции пациентов.
Заключение
Анемия при критических состояниях является распространенным явлением. На основании имеющихся данных представляется целесообразным и безопасным воздерживаться от переливания крови на основании уровня гемоглобина или гематокрита до тех пор, пока гемоглобин пациента не станет 7 г / дл или менее. Что касается пациентов с сердечным заболеванием, но без острого инфаркта миокарда или нестабильной стенокардии, данные исследования TRICC свидетельствуют о том, что этот подход также безопасен для этой группы при условии сохранения эуволемии. Однако по поводу этой группы пациентов все еще существуют разногласия, и необходимы дополнительные исследования, посвященные изучению триггеров переливания крови у пациентов с ишемической болезнью сердца.Учитывая хорошо задокументированные риски, связанные с переливанием крови [22], эти данные укрепляют мнение о том, что переливание крови следует тщательно продумать и что решение о переливании эритроцитов не может быть оправдано правилом 10/30.
Конкурирующие интересы
Не задекларированы.
Сокращения
ОИТ = отделение интенсивной терапии; RBC = эритроцит.
Ссылки
- McFarland JG. Периоперационные переливания крови: показания и варианты.Грудь. 1999; 115 (Дополнение): 113С – 121С. DOI: 10.1378 / Chess.115.suppl_2.113S. [PubMed] [CrossRef] [Google Scholar]
- Adams RC, Lundy JS. Анестезия при низком хирургическом риске. Некоторые предложения по снижению риска. Surg Gynecol Obstet. 1942; 74: 1011–1019. [Google Scholar]
- Hebert PC, Wells G, Blajchman MA, Marshall J, Martin C, Pagliarello G, Tweeddale M, Schweitzer I., Йетисир Э. Многоцентровое рандомизированное контролируемое клиническое исследование требований к переливанию крови в отделениях интенсивной терапии.Требования к переливанию крови у исследователей интенсивной терапии, Canadian Critical Care Trials Group. N Engl J Med. 1999; 340: 409–417. DOI: 10.1056 / NEJM199
3400601. [PubMed] [CrossRef] [Google Scholar]
- Карсон Дж. Л., Дафф А., Берлин Дж. А., Лоуренс В. А., Позы Р. М., Хубер Е. К., О’Хара Д., Новек Х., Стром Б.Л. Периоперационное переливание крови и послеоперационная смертность. ДЖАМА. 1998. 279: 199–205. DOI: 10.1001 / jama.279.3.199. [PubMed] [CrossRef] [Google Scholar]
- Wagoner JR III, Wass CT, Polis TZ, Faust RJ, Schroeder DR, Offord KP, Piepgras DG, Joyner MJ.Влияние изменения практики переливания крови на частоту периоперационного инсульта и инфаркта миокарда у пациентов, перенесших каротидную эндартерэктомию: ретроспективный анализ 1114 пациентов клиники Мэйо. Группа периоперационных результатов Мэйо. Mayo Clin Proc. 2001. 76: 376–383. [PubMed] [Google Scholar]
- Spiess BD, Ley C, Body SC, Siegel LC, Stover EP, Maddi R, D’Ambra M, Jain U, Liu F, Herskowitz A, Mangano DT, Levin J. Значение гематокрита на Поступление в отделение интенсивной терапии влияет на частоту инфаркта миокарда с зубцом Q после аортокоронарного шунтирования.Учреждения Исследовательской группы многоцентрового исследования периоперационной ишемии (McSPI). J Thoac Cardiovasc Surg. 1998. 116: 460–467. [PubMed] [Google Scholar]
- Carson JL, Willett LR. Требуется ли гемоглобин 10 г / дл для операции? Med Clin North Am. 1993; 77: 335–347. [PubMed] [Google Scholar]
- Corwin HL, Parsonnet KC, Gettinger A. Переливание эритроцитов в отделении интенсивной терапии. Есть причина? Грудь. 1995; 108: 767–771. [PubMed] [Google Scholar]
- Сегал Л. Р., Зебала Л. П., Такаги И., Курран Р. Д., Вотапка ТВ, Каприни Дж. А.Оценка коэффициента экстракции кислорода как физиологического триггера трансфузии у пациентов с операциями по аортокоронарному шунтированию. Переливание. 2001; 41: 591–595. DOI: 10.1046 / j.1537-2995.2001.41050591.x. [PubMed] [CrossRef] [Google Scholar]
- Stehling L, Simon TL. Триггер переливания эритроцитов. Физиология и клинические исследования. Arch Pathol Lab Med. 1994; 118: 429–434. [PubMed] [Google Scholar]
- Greenburg AG. Физиологическая основа для принятия решения о переливании эритроцитов. Am J Surg.1995; Дополнение 6A: 44S – 48S. DOI: 10.1016 / S0002-9610 (99) 80058-0. [PubMed] [CrossRef] [Google Scholar]
- Майески Дж. Усовершенствования в области хирургической помощи Свидетелям Иеговы в области общей и сосудистой хирургии. Int Surg. 2000; 85: 257–265. [PubMed] [Google Scholar]
- Гребеник К.Р., Синклер М.Э., Вестаби С. Хирургия сердца с высоким риском у Свидетелей Иеговы. J Cardiovasc Surg. 1996; 37: 511–515. [PubMed] [Google Scholar]
- Кухни CS. Переливания переоценены? Хирургический исход Свидетелей Иеговы.Am J Med. 1993; 94: 117–119. DOI: 10.1016 / 0002-9343 (93)
-K. [PubMed] [CrossRef] [Google Scholar]
- Victorino G, Wisner DH. Свидетели Иеговы: уникальные проблемы в популяции с уникальной травмой. J Am Coll Surg. 1997. 184: 458–468. [PubMed] [Google Scholar]
- Отт Д.А., Кули Д.А. Сердечно-сосудистая хирургия у Свидетелей Иеговы. Отчет о 542 операциях без переливания крови. ДЖАМА. 1977; 238: 1256–1258. DOI: 10.1001 / jama.238.12.1256. [PubMed] [CrossRef] [Google Scholar]
- Viele MK, Weiskopf RB.Что мы можем узнать о необходимости переливания от пациентов, которые отказываются от крови? Опыт со Свидетелями Иеговы. Переливание. 1994; 34: 396–401. DOI: 10.1046 / j.1537-2995.1994.34594249050.x. [PubMed] [CrossRef] [Google Scholar]
- Спенс Р.К., Александр Дж.Б., ДельРосси А.Дж., Чернаану А.Д., Силли Дж. Младший, Пелло М.Дж., Атабек Ю., Камишион Р.К., Вертрис РА. Рекомендации по переливанию крови при сердечно-сосудистой хирургии: уроки, извлеченные из операций Свидетелей Иеговы. J Vasc Surg. 1992; 16: 825–829. DOI: 10.1067 / мва.1992.40968. [PubMed] [CrossRef] [Google Scholar]
- Weiskopf RB, Viele MK, Feiner J, Kelley S, Lieberman J, Noorani M, Leung JM, Fisher DM, Murray WR, Toy P, Moore MA. Сердечно-сосудистая и метаболическая реакция человека на острую тяжелую изоволемическую анемию. ДЖАМА. 1998. 279: 217–221. DOI: 10.1001 / jama.279.3.217. [PubMed] [CrossRef] [Google Scholar]
- Винсент Дж. Л., Барон Дж. Ф., Рейнхарт К., Гаттинони Л., Тийс Л., Уэбб А., Мейер-Хеллманн А., Ноллет Г., Перес-Бота Д. Анемия и переливание крови у тяжелобольных пациенты.ДЖАМА. 2002; 288: 1499–1507. DOI: 10.1001 / jama.288.12.1499. [PubMed] [CrossRef] [Google Scholar]
- Corwin HL, Gettinger A, Pearl RG, Fink MP, Levy MM, Abraham E, MacIntyre NR, Shabot M, Duh M-S, Shapiro MJ. Исследование CRIT: Анемия и переливание крови у тяжелобольных: текущая клиническая практика в США. Crit Care Med. 2004; 32: 39–52. DOI: 10.1097 / 01.CCM.0000104112.34142.79. [PubMed] [CrossRef] [Google Scholar]
- Фахри С.М., Резерфорд Э.Дж., Шелдон Г.Ф. В кн .: В учебнике хирургии: биологические основы современной хирургической практики.16. Таунсенд С. М. Младший, Бошамп Р. Д., Эверс Б. М., Маттокс К. Л., редактор. Филадельфия: W.B. Компания Сондерс; 2001. Гаматологические принципы в хирургии; С. 68–89. [Google Scholar]
- Hebert PC, Wells G, Martin C, Tweeddale M, Marshall J, Blajchman M, Pagliarello G, Schweitzer I., Calder L. Канадский обзор практики переливания крови у тяжелобольных пациентов. Crit Care Med. 1998. 26: 482–487. DOI: 10.1097 / 00003246-199803000-00019. [PubMed] [CrossRef] [Google Scholar]
- Carson JL, Duff RM, Berlin JA, Spence RK, Trout R, Noveck H, Strom BL.Влияние анемии и сердечно-сосудистых заболеваний на хирургическую смертность и заболеваемость. Ланцет. 1996; 348: 1055–1060. DOI: 10.1016 / S0140-6736 (96) 04330-9. [PubMed] [CrossRef] [Google Scholar]
- Wu W-C, Rathore SS, Wang Y, Radford MJ, Krumholz HM. Переливание крови пациентам пожилого возраста с острым инфарктом миокарда. N Engl J Med. 2001; 345: 1230–1236. DOI: 10.1056 / NEJMoa010615. [PubMed] [CrossRef] [Google Scholar]
- Bracey AW, Radovancevic R, Riggs SA, Houston S, Cozart H, Vaughn WK, Radovancevic B, McAllister HA Jr, Cooley DA.Снижение порога гемоглобина для переливания при процедурах аортокоронарного шунтирования: влияние на исход пациента. Переливание. 1999; 39: 1070–1077. DOI: 10.1046 / j.1537-2995.1999.39101070.x. [PubMed] [CrossRef] [Google Scholar]
- Mangano DT, Layug EL, Wallace A, Tateo I. Влияние атенолола на смертность и сердечно-сосудистые заболевания после некардиальных операций. N Engl J Med. 1996; 335: 1713–1720. DOI: 10.1056 / NEJM199612053352301. [PubMed] [CrossRef] [Google Scholar]
- Hebert PC, Йетисир Э, Мартин С., Блайхман М.А., Уэллс Дж., Маршалл Дж., Твиддейл М., Пальярелло Дж., Швейцер И.Безопасен ли низкий порог переливания крови для тяжелобольных пациентов с сердечно-сосудистыми заболеваниями? Crit Care Med. 2001; 29: 227–234. DOI: 10.1097 / 00003246-200102000-00001. [PubMed] [CrossRef] [Google Scholar]
- Уолш Т.С., Макклелланд БД. Когда следует переливать крови тяжелобольным и пациентам в периоперационном периоде с известной ишемической болезнью сердца? Br J Anaesth. 2003. 90: 719–722. DOI: 10.1093 / bja / aeg109. [PubMed] [CrossRef] [Google Scholar]
Почему у женщин уровень эритропоэтина такой же, как у мужчин, но более низкий уровень гемоглобина? | Кровь
Средняя масса эритроцитов и уровни гематокрита у мужчин выше, чем у женщин.Как и почему это так, никогда не объяснялось. Если причиной снижения эритропоэза из-за потери железа или кровопотери у женщин или повышенного эритропоэза из-за андрогенов у мужчин, будет эффект обратной связи на продукцию эритропоэтина, что приведет к более низким уровням эритропоэтина у мужчин. Однако контрольные диапазоны для эритропоэтина не различаются для мужчин и женщин. Это указывает на то, что у женщин более высокий уровень оксигенации тканей при данной массе эритроцитов. Это, в свою очередь, предполагает, что у женщин должна быть более эффективная доставка эритроцитов в ткани.
При сравнении более 36000 парных проб венозной и капиллярной крови у доноров крови, где уровень капиллярного гемоглобина (Hb) был <12,4 г / дл у женщин (n = 25 762) и <13,4 г / дл у мужчин ( n = 10 496), уровень капилляров обычно был ниже венозного, в среднем 1,07 г / дл у мужчин и 0,67 г / дл у женщин. 1 Впоследствии мы наблюдали, что разрыв между уровнями капиллярного и венозного гемоглобина уменьшался как у мужчин, так и у женщин по мере увеличения уровня гемоглобина.Кроме того, кривые для мужчин и женщин были параллельны: они не перекрывались (рис. 1A). При анализе по возрастной группе средний разрыв капиллярно-венозного гемоглобина у женщин увеличивался после возрастного диапазона от 45 до 50 лет. У мужчин с возрастом наблюдалось постепенное снижение (рис. 1В).
Хорошо описано, что существует разрыв между капиллярным и венозным гематокритом. Общий гематокрит тела примерно в 0,91 раза больше венозного гематокрита. 2 Это происходит из-за эффекта Фахреуса, относительного разбавления эритроцитов в капиллярах, вызванного разницей в скоростях потока между более быстро текущими, центрально сконцентрированными клетками и медленнее текущей, периферически смещенной плазмой. 3 Теперь мы показали, что разрыв находится под физиологическим контролем и зависит от пола, возраста и количества эритроцитов. Разрыв в среднем выше у мужчин и увеличивается по мере снижения содержания эритроцитов в капиллярах. В возрастном диапазоне от 45 до 50 лет у женщин разрыв увеличивается до уровня, наблюдаемого у мужчин.
Требуются дальнейшие исследования, чтобы определить, как достигается такая модуляция эффекта Фахреуса. Возможные причинные или способствующие механизмы включают реологические эффекты, в том числе половые различия в скорости кровотока и изменения вязкости крови с концентрацией эритроцитов. Кроме того, повышающая регуляция eNOS эстрогеном у женщин в пременопаузе может модулировать эффект Фахреуса, увеличивая локальную продукцию NO, ведущую к вазодилатации, 4 , а эффект нитритредуктазы дезоксигемоглобина 5 может вызывать аналогичный эффект за счет увеличения вазодилатации, что и красный содержание клеток в капиллярной крови повышается.
Физиологическая модуляция эффекта Фахреуса, ведущая к более эффективной доставке эритроцитов в капиллярное кровообращение, может лежать в основе более низкой потребности в эритроцитах у женщин. Это также может способствовать снижению частоты сердечно-сосудистых заболеваний у женщин в пременопаузе и может иметь важные последствия для лечения сердечно-сосудистых заболеваний и анемий, а также для переливания крови.
Высокопроизводительная оценка полимера гемоглобина в отдельных красных кровяных тельцах от пациентов с серповидными клетками при контролируемом давлении кислорода
Значение
Серповидно-клеточная анемия — это первое «молекулярное заболевание», описанное более 100 лет назад.Все заболеваемость и смертность в конечном итоге вызваны полимеризацией вариантной молекулы серповидного гемоглобина в красных кровяных тельцах (эритроцитах). Однако, несмотря на десятилетия интенсивных исследований, мы не можем измерить количество полимера гемоглобина в отдельных эритроцитах с высокой производительностью при произвольном давлении кислорода. Мы описываем высокопроизводительный метод оценки полимера гемоглобина на уровне отдельных клеток при контролируемом давлении кислорода. Анализ позволяет сделать вывод о фракции полимера гемоглобина путем измерения его влияния на сродство клетки к кислороду.Этот метод предоставляет биомаркеры, обещающие улучшить ведение пациентов с серповидно-клеточной анемией, а также оптимизировать разработку и приоритизацию возможных вариантов лечения.
Abstract
Серповидно-клеточная анемия (SCD) вызывается разновидностью молекулы гемоглобина, которая полимеризуется внутри эритроцитов (RBC) при пониженном давлении кислорода. Разработка методов лечения этого типично тяжелого заболевания идет медленно, но в настоящее время существует оптимизм в отношении стратегий переноса лечебных генов для индукции экспрессии фетального гемоглобина или других изоформ гемоглобина, не вызывающих болезненных ощущений.Вся заболеваемость и смертность от ВСС прямо или косвенно связаны с образованием полимеров в отдельных эритроцитах. Таким образом, для выявления пациентов с наибольшим риском осложнений и кандидатов на лечение с наибольшим лечебным потенциалом необходимо определить количество полимера в отдельных эритроцитах при контролируемом кислороде. Здесь мы сообщаем о полуколичественном измерении полимера гемоглобина в отдельных эритроцитах как функции кислорода. В этом методе используется пониженное сродство полимера гемоглобина к кислороду, чтобы сделать вывод о содержании полимера в тысячах эритроцитов по их общему насыщению кислородом.Метод позволяет разработать подходы к лечению ВСС и прецизионной медицины.
Серповидно-клеточная анемия (ВСС) — это заболевание крови, от которого страдают миллионы людей во всем мире. Ежегодно с этим заболеванием рождается около 300 000 младенцев. Вся патология болезни в конечном итоге вызвана полимеризацией молекул вариантного серповидного гемоглобина (HbS) в отдельных красных кровяных тельцах (эритроцитах) в условиях пониженного давления кислорода. Полимеризация HbS внутри эритроцитов немедленно ставит под угрозу морфологию эритроцитов и реологию крови, а также вызывает долгосрочное усиление воспаления и клеточной адгезии, что в конечном итоге приводит к ишемии, вазоокклюзии, инсульту, повреждению тканей, а также острой и хронической дисфункции органов.Серповидно-клеточная анемия имеет различное клиническое течение у пациентов, при этом у некоторых есть очень тяжелые исходы, а у некоторых — более доброкачественные (1). Несмотря на десятилетия исследований, мы имеем ограниченное понимание причин этой изменчивости, а попытки найти полезные генотипические или клинические предикторы доброкачественного прогноза оказались безуспешными, в результате чего у нас не осталось полезных биомаркеров in vitro (2). Гемоглобин плода (HbF) может ингибировать образование полимера, и опыт с пациентами с генетическими вариантами и пациентами, которые реагируют на лечение гидроксимочевиной повышающей регуляцией гемоглобина плода, показывает, что результаты для пациентов могут быть улучшены за счет уменьшения количества полимера гемоглобина, который будет образовываться в отдельных эритроцитах. при заданном давлении кислорода (3⇓⇓ – 6).
Перспективы улучшения лечения серповидноклетками резко возросли в последние годы благодаря нескольким различным подходам в продвинутых клинических испытаниях и, по крайней мере, 2 сообщениям о лицах, получавших различные экспериментальные стратегии переноса генов, некоторые из которых оставались здоровыми более чем через год после лечения (7⇓ – 9). Хотя эти предварительные индивидуальные результаты обнадеживают, неясно, будут ли они обобщать. Также неясно, какие новые стратегии лечения будут лучше всего работать для каких пациентов, и в настоящее время у нас нет практического метода для сравнения их эффективности.Большинство новых подходов к лечению имеют один и тот же основной механизм действия: уменьшение фракции циркулирующих эритроцитов, в которых значительные количества HbS будут полимеризоваться при физиологическом давлении кислорода. Несмотря на ажиотаж вокруг этих новых экспериментальных методов лечения, у нас все еще отсутствует метод измерения полимера Hb в отдельных эритроцитах, и поэтому мы не можем определить терапевтические окна. Поэтому мы не можем оптимизировать проведение конкретной терапии, и у нас нет точного способа сравнить и определить приоритеты этих экспериментальных методов лечения.Самое главное, что нам остается вести пациентов с грубыми и неточными биомаркерами (2).
Ранее мы сообщали о платформе, способной напрямую измерять гемоглобин-кислородное насыщение отдельных эритроцитов (10, 11). Мы применили этот метод здесь для разработки полуколичественного измерения полимера Hb в отдельных эритроцитах при контролируемом давлении кислорода. Этот метод предполагает наличие внутриклеточного полимеризованного HbS из эффекта полимера по снижению общего гемоглобин-кислородного насыщения эритроцитов.Как показано на рис. 1 A , при заданном давлении кислорода эритроциты, содержащие большое количество полимера Hb, будут иметь более низкое насыщение гемоглобином и кислородом, чем эритроциты, содержащие небольшое количество полимера Hb (12). Следовательно, насыщение эритроцитов кислородом обратно пропорционально количеству содержащегося в нем полимера Hb, как отметили предыдущие исследователи (13, 14). Когда напряжение кислорода падает, все большее количество молекул HbS выделяет кислород, и вероятность образования полимера увеличивается. Полимер гемоглобина имеет некоторое сродство к кислороду.На рис.1 B показаны кривые диссоциации кислорода для мономера гемоглобина и полимера гемоглобина и показано, что полимеризованный гемоглобин (p50 ~ 22%) имеет значительно более низкое сродство к кислороду, чем растворимый гемоглобин (p50 ~ 3,7%), за исключением условий, близких к аноксическим (15). . Измеряя насыщение кислородом отдельных эритроцитов, можно сделать вывод о количестве полимера Hb в каждом эритроците. В этой работе мы демонстрируем применение этого принципа для характеристики распределения полимера Hb в отдельных эритроцитах в популяциях эритроцитов в образцах крови пациентов.Мы сравниваем эти распределения полимера в отдельных эритроцитах при разном давлении кислорода и для 2 разных пациентов с ВСС с разными фракциями HbF. Мы также показываем, как эти измерения могут обеспечить индивидуальную оценку порогового максимального напряжения кислорода, ниже которого определяемая фракция эритроцитов в образце крови конкретного пациента будет образовывать значительные количества полимера гемоглобина.
Рис. 1.
Определение содержания полимера гемоглобина (Hb) в отдельных эритроцитах на основе измерений насыщения гемоглобина и кислорода в отдельных эритроцитах.( A ) Метод основан на том принципе, что эритроциты с меньшим количеством полимера Hb будут иметь более высокую долю Hb, насыщенного кислородом, чем эритроциты с большим количеством полимера Hb при заданном напряжении кислорода. В ячейке слева меньше полимера, и 85% ее Hb насыщено кислородом, в то время как ячейка справа имеет больше полимера Hb, и только 50% ее Hb насыщено кислородом. B показывает кривые диссоциации гемоглобина и кислорода для растворимого Hb (красный), который демонстрирует кооперативность, и полимеризованного Hb, который не является кооперативным (синий).Нормальный диапазон p50, напряжения кислорода, при котором 50% Hb насыщается кислородом, для растворимого гемоглобина составляет от ~ 3,1 до 3,7%, в отличие от полимера Hb, у которого p50 составляет ~ 22%. ( C ) Схема микрофлюидного устройства показывает область деоксигенации газового канала (вертикальные белые змеевидные каналы) и кровяные каналы (красные горизонтальные каналы), где цитометрические измерения выполняются на крайнем правом конце. D показывает поперечное сечение трех слоев устройства, а E показывает оптическую измерительную установку: 2 светодиода (λ L1 = 410 нм и λ L2 = 430 нм) объединены с помощью неполяризующего светоделителя. .Свет, передаваемый клетками, протекающими в микрожидкостном канале, затем проецируется на цветную камеру с помощью объектива микроскопа. См. Исх. 10 для более подробной информации об оптическом методе.
Материалы и методы
Измерение насыщения кислородом отдельных эритроцитов.
Насыщение кислородом отдельных эритроцитов определяется с помощью ранее описанного количественного абсорбционного цитометра (ЧАС), который измеряет оксигенированный и деоксигенированный гемоглобин в отдельных эритроцитах путем количественной оценки ослабления света на 2 разных длинах волн, 410 и 430 нм (10, 11).Вкратце, эритроциты суспендируют в 20% альбуминовом буфере при физиологическом pH и выдерживают при атмосферном давлении кислорода перед визуализацией в микрожидкостной проточной камере на микроскопе при физиологической температуре (37 0 ° C). Образцы крови были взяты в соответствии с протоколом исследования отбракованных образцов, одобренным Советом по надзору учреждений здравоохранения (IRB) компании Partners. Микрожидкостное устройство показано на рис.1 C и D и содержит газообменную область длиной 3 см (рис.1 C ), позволяющую контролировать давление кислорода (рис.1 D ). Применяется такой градиент давления, что эритроциты пересекают канал за ~ 15 с. При выходе из газовой области эритроциты отображаются на двух длинах волн (рис. 1 E ), что позволяет количественно оценить массу оксигенированного гемоглобина и массу деоксигенированного гемоглобина с использованием известного коэффициента экстинкции каждого вида (10). Отношение оксигенированного к общему гемоглобину обеспечивает процент насыщения гемоглобином-кислородом каждого эритроцита. При каждом напряжении кислорода в результатах, представленных ниже, измеряется приблизительно 1000 эритроцитов.См. Дополнительную информацию , Дополнительные методы и Дополнительные результаты для получения более подробной информации. Фиг. 2 A показывает распределение гемоглобин-кислородного насыщения для популяции эритроцитов, содержащих немерпевый гемоглобин (HbA) при напряжении кислорода 5,9%. Для всех эритроцитов в этом образце крови около 80% гемоглобина насыщено кислородом, с небольшими отклонениями от одного эритроцита к другому. То же самое измерение может быть выполнено для эритроцитов, содержащих HbS, чтобы сделать вывод о присутствии полимера Hb.
Рис. 2.
Распределение насыщения кислородом отдельных эритроцитов отражает содержание полимера Hb. ( A ) Нормальный образец крови с HbA при 5,9% кислорода содержит эритроциты с одномодальным распределением насыщения, сгруппированные около ~ 80% насыщения, а фракция i ниже показывает, что все репрезентативные эритроциты имеют нормальную морфологию. Напротив, эритроциты в образце крови в B от пациента с SCD имеют бимодальное распределение насыщения при давлении кислорода 5,9%, с более низким пиком насыщения около 50% насыщения и более высоким пиком насыщения около 80%.Репрезентативные эритроциты из более низкого пика насыщения ( и ) имеют искаженную и серповидную морфологию, соответствующую присутствию значительного количества полимера Hb во всех эритроцитах, в то время как репрезентативные эритроциты из более высокого пика насыщения ( и ) имеют в основном нормальную морфологию.
Результаты
Распределение насыщения кислородом в отдельных эритроцитах показывает распределение полимеров гемоглобина в отдельных эритроцитах.
При промежуточном напряжении кислорода (от ~ 2% до ~ 8%) распределение насыщения отдельных эритроцитов для образцов крови, содержащих HbS, может быть бимодальным.На рис. 2 B показано распределение насыщения для образца крови SCD с 82% HbS, 14% HbF и 4% HbA2 при 5,9% кислорода. Есть один большой пик при более высоком насыщении со средним насыщением около 80%, сравнимым с типичным насыщением, наблюдаемым для HbA-содержащих эритроцитов при таком напряжении кислорода на рис. 2 A . Есть второй пик при более низкой насыщенности, в среднем около 50%. Появление этого более низкого пика насыщения можно объяснить присутствием субпопуляции эритроцитов, которая сформировала достаточное количество полимера Hb на уровне 5.9% кислорода, при котором общее насыщение кислородом каждого эритроцита упало, что ниже уровня, который наблюдается для эритроцитов, не содержащих полимера Hb, например, для эритроцитов, содержащих HbA, на рис. 2 A . Репрезентативные эритроциты, взятые из двух пиков, показаны на рис. 2. Пик более высокого насыщения включает эритроциты с в основном нормальной морфологией, аналогичной тем, что показаны на рис. 2 A , с формой «парашюта» или «тапочка», обычно обнаруживаемой для HbA-содержащие эритроциты в потоке (17), предполагая, что в этих эритроцитах присутствует небольшое количество полимера Hb или его нет.Нижний пик насыщения включает эритроциты с наиболее искаженной морфологией, что свидетельствует о наличии значительного количества полимера. Важно отметить, что морфология может быть нечувствительным и неспецифическим маркером присутствия полимера, и возможно, что некоторые эритроциты с нормальной морфологией содержат полимер, а некоторые эритроциты с искаженной морфологией не содержат полимер (18, 19). Насыщение клеточного гемоглобина кислородом, вероятно, будет более чувствительным и специфическим маркером присутствия полимера, но исследование клеточной морфологии полезно для качественной проверки.При отсутствии общепринятого измерения массы полимера Hb для одного эритроцита трудно откалибровать точное количественное определение массы полимера Hb в каждом эритроците. Кинетика серповидной полимеризации гемоглобина внутри эритроцитов in vitro и in vivo является сложной и клинически значимой (19–23). Некоторые предыдущие исследования предполагают, что большинство полимеров образуется в течение ~ 15 с до измерения, когда клетки полностью дезоксигенированы (20). Этот первоначальный метод не предназначен для исследования этой сложной кинетики полимеризации, но его можно использовать для выявления субпопуляций эритроцитов со значительно увеличенным количеством полимера по сравнению с другими эритроцитами в популяции во время измерения.Таким образом, этот метод обеспечивает полуколичественное измерение полимера Hb в популяции эритроцитов и демонстрирует на уровне одного эритроцита то, что предыдущие исследователи сообщили для популяций эритроцитов: количество полимера гемоглобина обратно пропорционально насыщению кислородом (13, 14). Затем мы можем использовать этот метод для сравнения распределений насыщения и их субпопуляций для образцов крови от разных пациентов с ВСС в зависимости от напряжения кислорода.
Распределение насыщения кислородом для одного эритроцита позволяет сравнить распределение полимера гемоглобина в одном эритроците для разных пациентов.
Традиционные кривые диссоциации гемоглобина и кислорода можно воссоздать, вычислив среднее значение распределения насыщения для отдельных эритроцитов при различном давлении кислорода. Рис. 3 A показывает распределение среднего насыщения гемоглобина и насыщения одиночных эритроцитов при 6 различных значениях давления кислорода для эритроцитов из образца крови здорового HbA (H). Как и ожидалось, насыщение кислородом типичного HbA RBC падает с уменьшением количества кислорода и обычно следует ожидаемой сигмовидной кривой, отражающей совместное связывание кислорода гемоглобином.Гистограммы насыщения отдельных эритроцитов на рис. 3 A показывают, что существует некоторая неоднородность в измеренном насыщении отдельных эритроцитов при каждом фиксированном давлении кислорода. Предыдущий анализ показывает, что большая часть этих вариаций носит биологический характер, а не шум измерений (10). Неоднородность насыщения единичными эритроцитами в образце HbA, по-видимому, достигает максимума около самого крутого участка кривой диссоциации гемоглобина и кислорода, около 2,5–4,5%. На фиг.3 B и C показаны средние значения насыщения и распределения эритроцитов для образцов крови от 2 разных пациентов с SCD (SS1 с 74% HbS, 21% HbF и 5% HbA2; и SS2 с 82% HbS, 14% HbF. и 4% HbA2).Оба образца крови SCD имеют бимодальное распределение насыщения при промежуточном напряжении кислорода.
Рис. 3. Распределение насыщенности отдельных эритроцитов
показывает большие различия в субпопуляциях эритроцитов, несмотря на небольшие различия в средних значениях насыщенности. A показывает среднюю насыщенность гемоглобина одиночных эритроцитов как функцию кислорода (точки в слева ) и гистограммы насыщения одиночных эритроцитов для образца здорового HbA ( H ) при 6 различных напряжениях кислорода. B показывает те же графики для образца серповидно-клеточных клеток (SS1) с 74% HbS, 21% HbF и 5% HbA2.Средние значения насыщения в зависимости от давления кислорода лишь незначительно смещены вниз по сравнению с точками в A , влево для образца H. Формы гистограмм в B заметно отличаются от гистограмм в A на промежуточном этапе. напряжения кислорода, с двумя режимами вместо 1. Точки в Left показывают средние значения верхнего и нижнего пиков распределения насыщения при каждом измеренном напряжении кислорода. Насыщения в верхних пиках обычно соответствуют значениям в образце H, в то время как насыщения в нижнем пике являются промежуточными между насыщениями для образца H и того, что ожидается для чистого полимера гемоглобина, как показано синей кривой на крайней левой панели.(См. Рис. 4 для более подробной информации о подгонках, используемых для определения верхних и нижних пиков.) C показывает результаты для другого образца серповидноклеточных клеток (SS2) с 82% HbS, 14% HbF и 4% HbA2. Точки на крайней левой панели показывают средние значения верхнего и нижнего пиков распределения насыщения при каждом измеренном напряжении кислорода, как в случае B . При промежуточном давлении кислорода (4,5, 5,9 и 7,3%) оба образца SCD демонстрируют бимодальное распределение насыщения кислородом, как описано выше и на рис. 2, но относительные размеры этих двух популяций меняются в зависимости от давления кислорода и у разных пациентов.Кривые в Left в каждом ряду также показывают типичную кривую диссоциации гемоглобина и кислорода для мономерного (красный) и полимерного (синий) Hb.
В то время как средние значения насыщения для образцов SCD лишь немного ниже, чем для образца HbA при промежуточном напряжении кислорода, распределения насыщения для одиночных эритроцитов имеют заметно разные формы. Есть отчетливый второй пик при более низком насыщении, когда напряжение кислорода находится в промежуточном диапазоне (∼2–8%). Как показано выше на рис.2, можно ожидать, что эритроциты в пике более низкого насыщения будут иметь больше полимера Hb, чтобы объяснить их более низкое насыщение, и их морфология согласуется с этим ожиданием (рис. 2). Пики более высокого насыщения имеют насыщение кислородом, аналогичное насыщению здорового контроля при том же давлении кислорода, что согласуется с гораздо меньшим количеством полимера Hb в этих эритроцитах. Разделение между двумя пиками вдоль оси насыщения уменьшается по мере снижения напряжения кислорода до тех пор, пока два пика почти не сольются в точке 2.5% или ниже, при этом не ожидается, что насыщение полимера гемоглобина будет значительно отличаться от насыщения мономера гемоглобина (рис. 1 B ).
Рис. 3 B и C также показывают, что 2 образца SCD различаются по размеру их нижних пиков насыщения при каждом промежуточном напряжении кислорода. Образец SS1 имеет меньше эритроцитов в пике более низкого насыщения. Другими словами, при каждом промежуточном напряжении кислорода SS1, по-видимому, имеет меньше эритроцитов со значительным количеством полимера, чем SS2.SS1 также имеет более высокую фракцию гемоглобина плода. Более высокий уровень HbF в отдельных эритроцитах снижает вероятность полимеризации при заданном давлении кислорода (3⇓⇓ – 6). Таким образом, различия в распределении HbF по эритроцитам могут объяснить измеренные различия в размерах нижних пиков насыщения для SS1 и SS2.
Общее насыщение RBC определяется относительными долями полимера и мономера, которые он содержит, и будет равняться чистому мономерному и полимерному насыщению, взвешенному по этим фракциям.Таким образом, для точного определения фракции полимера для эритроцитов требуются проверенные стандартные кривые для насыщенности чистого мономера и полимера в условиях, идентичных условиям для конкретных эритроцитов в нашей системе измерения, включая историю оксигенации эритроцитов, его внутриклеточную концентрацию гемоглобина, его фракцию HbF, и больше. Точные стандартные кривые недоступны, но мы можем использовать стандартные кривые, представленные ранее при других условиях, для оценки фракции полимера для типичных эритроцитов в пике низкого насыщения для каждого образца крови как функции напряжения кислорода.Для обоих образцов при 7,3%, когда типичный высокий пик RBC насыщен примерно на 80%, средний RBC в низком пике может иметь фракцию полимера ~ 1/3. Предполагаемая доля полимера увеличивается до 1/2 по мере уменьшения содержания кислорода, но неопределенности в точности стандартных кривых становятся более значительными, когда кривые начинают сливаться ниже ~ 4% кислорода. Эта расчетная доля полимера около 1/3 при напряжении кислорода 7,3% и насыщении мономерной фазы или фазы раствора около 80%, а также дальнейшее увеличение доли полимера до 1/2 по мере снижения уровня кислорода, согласуются с тем, что было измеренные (23, 24) и теоретически предсказанные (19, 24, 25) предыдущими исследователями.
Неоднородность распределения насыщенности отдельных эритроцитов связана с фракцией HbF пациента.
Очевидно, что распределения насыщенности одиночных RBC для SCD RBC намного более неоднородны, чем для RBC HbA, которые не образуют полимер (рис. 3). Дальнейший анализ этой неоднородности распределения может также выявить различия между образцами SCD, которые регулируют образование полимера и в конечном итоге могут иметь клиническое значение. Одним из показателей для количественной оценки этой неоднородности является оценка размера доли эритроцитов в пиках более низкого насыщения, которая может быть получена, например, путем подгонки распределений насыщенности к смешанной гауссовской статистической модели.На рис. 4 показаны распределения насыщения и соответствующие смешанные гауссовы аппроксимации для обоих образцов ППД при трех промежуточных значениях напряжения кислорода. При напряжении кислорода ниже 4,5% и выше 7,3% распределения близки к одномодальным, и посадки не показаны. Нижние пики насыщения для SS2 (рис. 4 B ) больше, чем для SS1 (рис. 4 A ) при всех промежуточных напряжениях кислорода. Как отмечалось выше, это упорядочение согласуется с тем, что можно было бы ожидать, учитывая, что SS1 имеет более высокую фракцию HbF, что будет иметь тенденцию уменьшать образование полимера Hb (3⇓⇓ – 6).Для обоих образцов SCD расчетный размер пика нижнего насыщения увеличивается примерно линейно с уменьшением содержания кислорода (рис. 4 C ). Если линейные кривые экстраполировать на более высокое давление кислорода, мы можем оценить максимальное давление кислорода, при котором некоторые эритроциты в каждом образце крови сначала начнут формировать полимер гемоглобина, достаточный для изменения насыщения кислородом эритроцитов. Для SS1 этот метод экстраполяции оценивает, что полимеризация сначала начинается при напряжении кислорода ниже ∼9%, а для SS2 мы оцениваем, что полимеризация сначала начинается при напряжении кислорода ниже ∼10.5%. Более низкий оценочный порог полимеризации гемоглобина для SS1 согласуется с его более высокой фракцией HbF. Оба этих оценочных порога полимеризации находятся в пределах диапазона напряжений кислорода, обычно обнаруживаемого в артериальном кровотоке, что согласуется с предыдущими исследованиями кислородной зависимости образования полимера и реологии крови (26–28).
Рис. 4.
Смешанные гауссовские аппроксимации распределений насыщения кислородом одного эритроцита позволяют оценить размер пиков более низкого насыщения и экстраполировать его на индивидуальное для пациента пороговое давление кислорода, ниже которого может начаться полимеризация. A и B показывают распределения насыщения обоих образцов SCD при трех промежуточных значениях напряжения кислорода. Распределения имеют бимодальную форму и показаны вместе с результатами смешанной гауссовой аппроксимации. На каждом графике также показана (синим цветом) подобранная пропорция эритроцитов, попадающая в нижний пик насыщения. C показывает процент клеток в нижнем пике Гаусса (LG) как функцию напряжения кислорода для обоих образцов. Большие закрашенные кружки представляют собой пересечение x линейной аппроксимации данных каждой выборки.
Еще один более простой способ количественной оценки неоднородности распределений насыщенности кислородом — это сравнение второго и четвертого квинтилей распределений насыщенности (20-й и 80-й перцентили насыщенности). Разница в насыщении между 20-м и 80-м процентилями («квинтильный показатель») при каждом напряжении кислорода показана на рис. 5 A для каждого из 3 образцов крови. Образец H имеет относительно узкое распределение насыщения во всем диапазоне напряжений кислорода, а квинтильный показатель достигает максимума всего на 5%, когда напряжение кислорода уже низкое (~ 2.5%). Образцы SS1 и SS2 имеют большую неоднородность, чем образец H, в соответствии с этим показателем во всех случаях, кроме самого высокого напряжения кислорода, где они одинаковы. Образец SS2 достигает наивысшего максимума из 3 образцов (19% при 5,9% кислорода), что согласуется с его более низким уровнем HbF по сравнению с SS1. Интересно, что образец SS2 показывает максимальную гетерогенность при напряжении кислорода выше его p50, где типичные эритроциты содержат более 50% оксигенированного гемоглобина, что позволяет предположить, что даже когда кровь SS2 насыщена кислородом более чем на 50%, большая часть эритроцитов содержит значительное количество полимера. .
Рис. 5.
Измерение неоднородности распределения насыщенности эритроцитов путем сравнения квинтилей. ( A ) Разница между 80-м и 20-м процентилями («квинтильная метрика») распределений насыщенности для отдельных эритроцитов (рис. 3) нанесена на график для каждого из 3 образцов в зависимости от напряжения кислорода. Образцы SCD имеют максимальные значения намного выше, чем здоровый контрольный образец. B показывает морфологию эритроцитов, взятых случайным образом из второго и четвертого квинтилей при 5,9% кислорода.Во втором квинтиле большинство эритроцитов из SS1 имеют морфологию, совместимую с присутствием полимера, а некоторые имеют нормальную морфологию. Для SS2 даже большая часть эритроцитов во втором квинтиле, по-видимому, имеет морфологию, совместимую с присутствием полимера. В четвертом квинтиле подавляющее большинство эритроцитов имеют нормальную морфологию как для SS1, так и для SS2.
Мы ожидаем найти больше полимера Hb в большем количестве эритроцитов во втором квинтиле по сравнению с эритроцитами в четвертом квинтиле.На рис. 5 B показаны изображения случайно выбранных эритроцитов из второго и четвертого квинтилей для всех 3 образцов при давлении кислорода 5,9%. Для образца H типичная морфология эритроцитов нормальна в обоих квинтилях, с формой «парашюта» или «тапочки», обычно встречающейся для эритроцитов в потоке (17). Для SS1 большинство эритроцитов из второго квинтиля деформированы в соответствии с присутствием полимера, и почти все эритроциты в четвертом квинтиле имеют нормальную морфологию. Для SS2 эритроциты из второго квинтиля почти равномерно деформированы в соответствии с присутствием полимера, и большинство из них в четвертом квинтиле имеют нормальную морфологию.Эти изображения эритроцитов подтверждают вывод о том, что более низкие пики насыщения в распределениях насыщенности SCD связаны с повышенной полимеризацией Hb в субпопуляции эритроцитов, а сравнение квинтилей распределения обеспечивает простую количественную оценку неоднородности распределений насыщенности образца крови в некотором смысле. что, по-видимому, согласуется с общей склонностью этого образца и степенью полимеризации.
Обсуждение
Мы описываем полуколичественный метод сравнения распределений полимера Hb в отдельных эритроцитах, определяемых по дифференциальному сродству к кислороду, в зависимости от контролируемого давления кислорода для отдельных пациентов с ВСС.Мы обнаружили, что образцы крови от 2 пациентов с ВСС показывают бимодальное распределение насыщения в физиологическом диапазоне напряжения кислорода. Более низкие пики насыщения этих распределений, по-видимому, содержат эритроциты со значительно большим количеством полимера Hb, чем более высокие пики насыщения, а средние значения насыщения умеренно снижаются и все еще сравнимы с таковыми для образца крови, содержащего HbA, который не будет полимеризоваться. Мы показываем, что неоднородность в распределении насыщения кислородом может быть количественно оценена с использованием нескольких показателей, чтобы отличить людей с SCD от людей с кровью HbA, а неоднородность в распределениях насыщения также выявляет очевидные индивидуальные для пациента различия в моделях образования полимеров, которые могут коррелировать с Уровни HbF.Дальнейшее развитие платформы будет включать дальнейшую калибровку метода с целью обеспечения абсолютного количественного определения массы или концентрации полимера Hb в каждом эритроците. Дальнейшие исследования необходимы для подтверждения того, что закономерности связи между распределениями насыщенности эритроцитов и объемными фракциями HbF сохраняются, а также для определения связи между распределениями насыщения и конкретными клиническими исходами пациентов.
Это исследование также мотивирует последующие исследования для более детального понимания механизмов бимодальности распределения насыщения SCD при промежуточном давлении кислорода.Основываясь на работе предшествующих исследователей (13, 14), мы ожидаем, что деоксигенация сместит нижние хвосты насыщения в распределении насыщения влево, поскольку полимер образуется в отдельных эритроцитах и снижает их насыщение кислородом. Неясно, можно ли ожидать наблюдаемого скачка насыщения, ведущего ко второму пику. Предыдущие исследования эритроцитов на уровне популяции сообщили о более непрерывном увеличении фракции полимера с уменьшением давления кислорода (19, 24), но исследования фракции полимера на отдельных клетках недоступны.Бимодальность может согласовываться с предыдущими сообщениями о функции прогрессии сигмоидальной полимеризации (29, 30). Нижний пик насыщения растет с уменьшением напряжения кислорода, показывая, что все больше и больше эритроцитов образуют значительные количества полимера при более низком напряжении кислорода.
Полностью количественное и откалиброванное измерение массы и фракции полимера одиночных эритроцитов поможет выявить механизмы наблюдаемой бимодальности, а также позволит изучить роль кинетики серповидной полимеризации гемоглобина.Наши результаты были измерены после постоянной продолжительности воздействия контролируемого кислорода, около 15 с. Известно, что кинетика серповидной полимеризации гемоглобина является сложной и зависит от таких факторов, как концентрация изоформы гемоглобина, лечение гидроксимочевиной, объем клеток и многое другое (20, 21, 23, 31). Для изучения влияния кинетики полимеризации на бимодальность и другие аспекты представленных здесь результатов необходимо провести будущее исследование с полностью количественным измерением, проводимым при многократном воздействии кислорода, и, в идеале, многократным измерением насыщения для одних и тех же отдельных эритроцитов.Альтернативный подход к исследованию полимерных фракций как функции напряжения кислорода независимо от кинетики полимеризации мог бы заключаться в измерении распределений насыщения отдельных клеток эритроцитов, которые сначала были уравновешены в бескислородных условиях, таким образом, начиная с максимально полимеризованного состояния и позволяя сравнивать эффекты сложная кинетика полимеризации с менее сложной кинетикой деполимеризации (32, 33). Текущая система использует буфер с согласованным показателем преломления для ограничения шума от внеклеточного оптического рассеяния, но внутриклеточное рассеяние не устраняется, и в будущих усовершенствованиях также будет исследоваться использование дополнительных длин волн освещения, чтобы обеспечить возможность еще большего снижения шума (16).
Отсутствие в настоящее время теста, который может точно определить уровень HbF в отдельных эритроцитах (3, 34), вероятно, ограничило разработку эффективных методов лечения ВСС за последние несколько десятилетий. Учитывая недавний прогресс в области генетических подходов к лечению (7⇓ – 9), некоторые из которых индуцируют экспрессию синтетических изоформ гемоглобина, которые ингибируют полимеризацию, измерение полимера гемоглобина в одном эритроците может показаться более полезным, чем измерение HbF в одном эритроците. . Измерение полимера с одним эритроцитом также, по-видимому, имеет преимущества для этих целей по сравнению с серповидными анализами или другими оценками на основе морфологии, которые ограничены неопределенной взаимосвязью между морфологией и содержанием полимера (18, 19).Измерения одноклеточной сатурации могут помочь обосновать различия в клиническом течении у пациентов с другими серповидными синдромами, включая гемоглобиновую болезнь SC и талассемию серп-бета-плюс и серп-бета-ноль. Этот подход также может ускорить разработку диагностики и лечения. Способность разрешать полимеризацию в небольшом подмножестве клеток может позволить более четкое сравнение эффективности различных методов лечения, разрабатываемых и используемых, включая экспериментальные подходы, разработанные для увеличения сродства гемоглобина к кислороду или для повышения уровня гемоглобина плода.Этот метод также увеличивает возможность предоставления объективных конечных точек для конкретного пациента, определенных в терминах распределения полимера в отдельных эритроцитах, для лечения с помощью простого или обменного переливания крови.
Благодарности
Часть этой работы была проведена в Миннесотском наноцентре, который поддерживается Национальным научным фондом через Национальную сеть координированной нано-инфраструктуры в рамках награды ECCS-1542202. Работа поддержана грантами HL130818 и HL132906 Национального института сердца, легких и крови.Мы благодарим Чая Пателя и Хасмук Патель за помощь со сбором образцов крови, Карло Бругнару и Фрэнка Банна за полезные обсуждения, а также редактора и двух анонимных рецензентов за полезные комментарии и предложения.
Сноски
-
Вклад авторов: G.D.C., E.S., B.P.G., D.K.W. и J.M.H. спланированное исследование; G.D.C., E.S., B.P.G., D.K.W. и J.M.H. проведенное исследование; J.M.V. внесены новые реагенты / аналитические инструменты; G.D.C., E.S., B.P.G., D.K.W. и J.M.H.проанализированные данные; и G.D.C., E.S., B.P.G., D.K.W. и J.M.H. написал газету.
-
Авторы заявляют об отсутствии конкурирующей заинтересованности.
-
Эта статья представляет собой прямое представление PNAS.
-
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.1073/pnas.1914056116/-/DCSupplemental.
Определение гемоглобина — обзор
9.08.4.2 Гемоглобин и эритропоэтин
Концентрация гемоглобина является одним из основных факторов, влияющих на доставку кислорода к опухолям.Поэтому неудивительно, что низкая концентрация гемоглобина в целом является плохим прогностическим фактором у онкологических больных. В обзоре 51 исследования с участием 17 272 пациентов была проанализирована прогностическая взаимосвязь между концентрацией гемоглобина и локальным контролем опухоли. Из них 39 исследований (14 482 пациента) показали корреляцию, а только 12 (2790 пациентов) нет (Grau and Overgaard, 1998). Более свежие данные датских исследований рака головы и шеи (DAHANCA) 5 и 7 (Hoff, 2012; Hoff et al., 2011a, b) пришли к выводу, что гемоглобин перед лечением был прогностическим фактором для исхода, но что переливание крови до и во время лечения не улучшило результат. Эти наблюдения показывают, что взаимосвязь между анемией и гипоксией опухоли сложна. Имеются данные о том, что на гипоксию опухоли избыточно влияют структурные и метаболические различия между нормальными тканями и солидными опухолями, которые способствуют развитию и поддержанию гипоксии опухоли (Grogan et al., 1999; Hirst, 1986; Vaupel, 2004; Vaupel et al., 1989, 2006). Фактически, оксигенация опухоли перед лечением, измеренная с помощью электродов, и гемоглобин плазмы перед лечением коррелировали не линейной регрессией, а квадратичной регрессией, поскольку низкий гемоглобин коррелировал с низкой средней опухолью p O 2 , а высокий гемоглобин аналогично связан с низкой средней опухолью p О 2 . Этот результат был подтвержден при раке головы и шеи (Becker et al., 2000; Clavo et al., 2003; Nordsmark et al., 2005), раке шейки матки (Fyles et al., 2000; Nordsmark et al., 2006), груди, шейки матки и вульвы (Vaupel et al., 2002, 2006). При анализе результатов в области головы и шеи гемоглобин был прогностическим маркером выживаемости и не зависел от гипоксии опухоли при многомерном анализе. Это сравнение было выполнено на основе измерений до лечения, что может быть не оптимальным временем. Однако измерения оксигенации опухоли до и после переливания в 19 случаях рака шейки матки показали статистически значимое улучшение оксигенации опухоли после переливания только в половине случаев (Sundfor et al., 1997).
Потенциальная польза от увеличения гемоглобина путем переливания крови перед лучевой терапией изучалась в ряде исследований (Thomas, 2002). Первое клиническое исследование этого подхода было проведено на запущенной плоскоклеточной карциноме шейки матки (Evans and Bergsjø, 1965). Переливание крови пациентам с низким уровнем гемоглобина приводило к увеличению давления кислорода в опухоли, которое измерялось поверхностно в опухоли с помощью электродов, потребляющих кислород, первого поколения. Это же исследование было первым, показавшим, что переливание крови до уровня гемоглобина 11 г дл –1 или выше значительно увеличивает выживаемость.Канадское ретроспективное исследование 605 пациентов с раком шейки матки показало, что негативное влияние низкого гемоглобина на прогноз можно преодолеть с помощью переливания крови (Grogan et al., 1999). Однако эти наблюдения не подтверждались данными проспективного исследования III фазы из группы исследования DAHANCA, которые не показали преимущества переливания крови у пациентов с низким уровнем гемоглобина (Hoff, 2012; Hoff et al., 2011a, b).
Концентрация гемоглобина также может быть увеличена путем стимуляции гормоном эритропоэтином (ЭПО).Доклинические исследования показали, что анемию у животных можно исправить с помощью серийных инъекций ЭПО, и что это лечение ЭПО также преодолело вызванную анемией радиационную резистентность (Stuben et al., 2003; Thews et al., 1998). Концепция использования ЭПО для коррекции анемии была проверена в ряде клинических испытаний, и, хотя ЭПО можно эффективно и безопасно улучшить низкий уровень гемоглобина (Hoskin et al., 2009b; Lavey and Dempsey, 1993), ряд исследований в пациенты, проходящие лечение от рака головы и шеи, не продемонстрировали каких-либо преимуществ (Henke et al., 2003; Хоскин и др., 2009b; Machtay et al., 2007; Overgaard et al., 2007). Фактически те пациенты, которые действительно получали ЭПО во время лучевой терапии, чувствовали себя значительно хуже, чем пациенты, которые не получали ЭПО, и в результате все испытания ЭПО и лучевой терапии были прекращены.
Альтернативные «связанные с гемоглобином» методы улучшения оксигенации опухоли включают использование перфторуглеродов (Rockwell, 1985), которые представляют собой небольшие частицы, способные переносить больше кислорода, чем гемоглобин, или изменение способности крови к разгрузке кислорода путем изменения оксигенации. -кривая диссоциации гемоглобина.Этого можно достичь либо путем увеличения содержания 2,3-DPG в красных кровяных тельцах (Siemann and Macler, 1986), 2,3-DPG является одним из наиболее важных аллостерических факторов, контролирующих кривую диссоциации гемоглобина и кислорода, либо с помощью антилипидемических препаратов. наркотики (Hirst and Wood, 1991). Хотя было показано, что каждый из этих подходов улучшает состояние оксигенации экспериментальных опухолей и / или усиливает радиационное повреждение, ни один из них еще не прошел контролируемых клинических испытаний, поэтому их потенциальная полезность в клинике сомнительна.
Эритропоэтин, ферритин, гаптоглобин, гемоглобин и рецепторы трансферрина при метаболическом синдроме: исследование случай-контроль | Сердечно-сосудистая диабетология
Депре Дж. П., Лемье I. Абдоминальное ожирение и метаболический синдром. Природа. 2006, 444 (7121): 881-887. 10.1038 / природа05488.
CAS
Статья
PubMed
Google Scholar
Hermans MP, Ahn SA, Rousseau MF: log (TG) / HDL-C связан как с остаточным кардиометаболическим риском, так и с потерей функции бета-клеток у мужчин с диабетом 2 типа.Кардиоваск Диабетол. 2010, 9: 88-10.1186 / 1475-2840-9-88.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Кан Х. Т., Линтон Дж. А., Шим Дж. Й .: Уровень ферритина в сыворотке связан с распространенностью метаболического синдрома у взрослых корейцев: Национальное обследование здоровья и питания Кореи за 2007–2008 гг. Clin Chim Acta. 2012, 413 (5–6): 636-641.
CAS
Статья
PubMed
Google Scholar
Lecube A, Hernandez C, Pelegri D, Simo R: Факторы, определяющие высокий уровень ферритина при ожирении. Int J Obes (Лондон). 2008, 32 (11): 1665-1669. 10.1038 / ijo.2008.154.
CAS
Статья
Google Scholar
Sun L, Franco OH, Hu FB, Cai L, Yu Z, Li H, Ye X, Qi Q, Wang J, Pan A, Liu Y, Lin X: концентрации ферритина, метаболический синдром и тип 2 сахарный диабет у китайцев среднего и пожилого возраста. J Clin Endocrinol Metab. 2008, 93 (12): 4690-4696.10.1210 / jc.2008-1159.
CAS
Статья
PubMed
Google Scholar
Боззини К., Джирелли Д., Оливьери О, Мартинелли Н., Басси А., Де Маттеис Дж., Тенути I, Лото V, Фризо С., Пиццоло Ф., Коррочер Р. Распространенность избытка железа в организме при метаболическом синдроме. Уход за диабетом. 2005, 28 (8): 2061-2063. 10.2337 / diacare.28.8.2061.
Артикул
PubMed
Google Scholar
Jelkmann W: Эритропоэтин: структура, контроль производства и функции. Physiol Rev.1992, 72 (2): 449-489.
CAS
PubMed
Google Scholar
Pasarica M, Sereda OR, Redman LM, Albarado DC, Hymel DT, Roan LE, Rood JC, Burk DH, Smith SR: Снижение оксигенации жировой ткани при ожирении у человека: доказательства разрежения, хемотаксиса макрофагов и воспаления без ангиогенного ответа. Сахарный диабет. 2009, 58 (3): 718-725.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Regazzetti C, Peraldi P, Gremeaux T, Najem-Lendom R, Ben-Sahra I, Cormont M, Bost F, Le Marchand-Brustel Y, Tanti JF, Giorgetti-Peraldi S: гипоксия снижает сигнальные пути инсулина в адипоцитах. Сахарный диабет. 2009, 58 (1): 95-103. 10.2337 / db08-0457.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Wood IS, de Heredia FP, Wang B, Trayhurn P: Клеточная гипоксия и дисфункция жировой ткани при ожирении. Proc Nutr Soc. 2009, 68 (4): 370-377. 10.1017 / S00296651099
.
CAS
Статья
PubMed
Google Scholar
Ванхала М., Салтево Дж., Сойнинен П., Каутиайнен Х., Кангас А.Дж., Ала-Корпела М., Мантиселка П.: Сывороточные полиненасыщенные жирные кислоты омега-6 и метаболический синдром: продольное популяционное когортное исследование.Am J Epidemiol. 2012, 176 (3): 253-260. 10.1093 / aje / kwr504.
Артикул
PubMed
Google Scholar
Альберти К.Г., Экель Р.Х., Гранди С.М., Зиммет П.З., Климан Дж. И., Донато К.А., Фручарт Дж. К., Джеймс В.П., Лориа С.М., Смит СК: Целевая группа Международной федерации диабета по эпидемиологии и профилактике, Hational Heart, Lung и Институт крови, Американская кардиологическая ассоциация, Всемирная федерация сердца, Международное общество атеросклероза, Международная ассоциация по изучению ожирения: гармонизация метаболического синдрома: совместное промежуточное заявление Целевой группы Международной федерации диабета по эпидемиологии и профилактике; Национальный институт сердца, легких и крови; Американская Ассоциация Сердца; Всемирная федерация сердца; Международное общество атеросклероза; и Международная ассоциация по изучению ожирения.Тираж. 2009, 120 (16): 1640-1645. 10.1161 / CIRCULATIONAHA.109.192644.
CAS
Статья
PubMed
Google Scholar
Cancello R, Henegar C, Viguerie N, Taleb S, Poitou C, Rouault C, Coupaye M, Pelloux V, Hugol D, Bouillot JL, Bouloumie A, Barbatelli G, Cinti S, Svensson PA, Barsh GS , Zucker JD, Basdevant A, Langin D, Clement K: Уменьшение инфильтрации макрофагов и изменений экспрессии гена хемоаттрактанта в белой жировой ткани у субъектов с патологическим ожирением после потери веса, вызванной операцией.Сахарный диабет. 2005, 54 (8): 2277-2286. 10.2337 / диабет. 54.8.2277.
CAS
Статья
PubMed
Google Scholar
Lohsoonthorn V, Jiamjarasrungsi W, Williams MA: Ассоциация гематологических параметров с кластерными компонентами метаболического синдрома среди профессиональных и офисных работников в Бангкоке, Таиланд. Синдр диабета. 2007, 1 (3): 143-149. 10.1016 / j.dsx.2007.05.002.
PubMed Central
Статья
PubMed
Google Scholar
Мураки И., Танигава Т., Ямагиши К., Сакураи С., Охира Т., Имано Х., Кияма М., Китамура А., Сато С., Шимамото Т., Кониси М., Исо Х., Исследователи CIRCS: Ночная перемежающаяся гипоксия и метаболический синдром; эффект лишнего веса: исследование CIRCS. J Atheroscler Thromb. 2010, 17 (4): 369-377. 10.5551 / jat.3319.
Артикул
PubMed
Google Scholar
Cahan C, Decker MJ, Arnold JL, Goldwasser E, Strohl KP: Уровни эритропоэтина при лечении обструктивного апноэ во сне.J Appl Physiol. 1995, 79 (4): 1278-1285.
CAS
PubMed
Google Scholar
Calvin AD, Somers VK, Steensma DP, Rio Perez JA, van der Walt C, Fitz-Gibbon JM, Scott CG, Olson LJ: тяжелая сердечная недостаточность и ночная гипоксемия из-за центрального апноэ во сне связаны с увеличением сывороточный эритропоэтин. Eur J Heart Fail. 2010, 12 (4): 354-359. 10.1093 / eurjhf / hfq005.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Jehn ML, Guallar E, Clark JM, Couper D, Duncan BB, Ballantyne CM, Hoogeveen RC, Harris ZL, Pankow JS: проспективное исследование уровня ферритина в плазме и случаев диабета: исследование риска атеросклероза в сообществах (ARIC). Am J Epidemiol. 2007, 165 (9): 1047-1054. 10.1093 / aje / kwk093.
Артикул
PubMed
Google Scholar
Цзян Р., Мэнсон Дж. Э., Мейгс Дж. Б., Ма Дж., Рифаи Н., Ху Ф.Б .: Запасы железа в организме по отношению к риску диабета 2 типа у практически здоровых женщин.ДЖАМА. 2004, 291 (6): 711-717. 10.1001 / jama.291.6.711.
CAS
Статья
PubMed
Google Scholar
He M, Workalemahu T, Manson JE, Hu FB, Qi L: Генетические детерминанты запаса железа в организме и риска диабета 2 типа у мужчин и женщин в США. PLoS One. 2012, 7 (7): e40919-10.1371 / journal.pone.0040919.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Zuliani G, Volpato S, Galvani M, Ble A, Bandinelli S, Corsi AM, Lauretani F, Maggio M, Guralnik JM, Fellin R, Ferrucci L: Повышенный уровень С-реактивного белка и метаболический синдром у пожилых людей: роль данные о центральном ожирении из исследования InChianti. Атеросклероз. 2009, 203: 626-632. 10.1016 / j.atherosclerosis.2008.07.038.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Лу Б, Ян И, Ян З, Фенг Х, Ван Х, Чжан З, Ху Р: Резистентность к инсулину у китайских пациентов с диабетом 2 типа связана с С-реактивным белком независимо от абдоминального ожирения.Кардиоваск Диабетол. 2010, 9: 92-10.1186 / 1475-2840-9-92.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Frohlich M, Imhof A, Berg G, Hutchinson WL, Pepys MB, Boeing H, Muche R, Brenner H, Koenig W: Связь между С-реактивным белком и особенностями метаболического синдрома: популяционный учиться. Уход за диабетом. 2000, 23: 1835-1839. 10.2337 / diacare.23.12.1835.
CAS
Статья
PubMed
Google Scholar
den Engelsen C, Koekkoek PS, Gorter KJ, van den Donk M, Salome PL, Rutten GE: Высокочувствительный C-реактивный белок для выявления метаболического синдрома у пациентов с центральным ожирением: поперечный анализ. Кардиоваск Диабетол. 2012, 11: 25-10.1186 / 1475-2840-11-25.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Николас Г., Шове С., Виатт Л., Данан Дж. Л., Бигард Х, Дево И., Бомонт С., Кан А., Ваулон С. Ген, кодирующий регуляторный пептид железа гепсидин, регулируется анемией, гипоксией и воспалением. .J Clin Invest. 2002, 110 (7): 1037-1044.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Ganz T: Гепсидин и регулирование железа, 10 лет спустя. Кровь. 2011, 117 (17): 4425-4433. 10.1182 / кровь-2011-01-258467.
PubMed Central
CAS
Статья
PubMed
Google Scholar
Бекри С., Гуаль П., Анти Р., Лучиани Н., Дахман М., Рамеш Б., Ианнелли А., Стаччини-Микс А., Казанова Д., Бен Амор I, Сен-Поль М.К., Хуэт PM, Садул Д.Л., Gugenheim J, Srai SK, Tran A, Le Marchand-Brustel Y: Повышенная экспрессия гепсидина в жировой ткани при тяжелом ожирении не зависит от диабета и НАСГ.Гастроэнтерология. 2006, 131 (3): 788-796. 10.1053 / j.gastro.2006.07.007.
CAS
Статья
PubMed
Google Scholar
Габай С., Кушнер И.: Белки острой фазы и другие системные реакции на воспаление. N Engl J Med. 1999, 340 (6): 448-454. 10.1056 / NEJM199
3400607.
CAS
Статья
PubMed
Google Scholar
Quaye IK: гаптоглобин, воспаление и болезнь.Trans R Soc Trop Med Hyg. 2008, 102 (8): 735-742. 10.1016 / j.trstmh.2008.04.010.
CAS
Статья
PubMed
Google Scholar
Chiellini C, Santini F, Marsili A, Berti P, Bertacca A, Pelosini C, Scartabelli G, Pardini E, Lopez-Soriano J, Centoni R, Ciccarone AM, Benzi L, Vitti P, Del Prato S , Pinchera A, Maffei M: сывороточный гаптоглобин: новый маркер ожирения у людей. J Clin Endocrinol Metab. 2004, 89 (6): 2678-2683.10.1210 / jc.2003-031965.
CAS
Статья
PubMed
Google Scholar
Skikne BS, Flowers CH, Cook JD: Рецептор трансферрина сыворотки: количественный показатель дефицита железа в тканях. Кровь. 1990, 75 (9): 1870-1876.
CAS
PubMed
Google Scholar
Ахлувалия Н., Скикне Б.С., Савин В., Чонко А.: Маркеры замаскированного дефицита железа и эффективность терапии ЭПО при хронической почечной недостаточности.


