Клеточные трагедии. Часть I: на грани самоубийства
Иллюстрация: Ольга Степанюк
«Клеточные трагедии» — это цикл статей о клетках. Почитайте и другие тексты о нелёгкой жизни клеток: в них рассказывается о стрессе, шоке, муках самоопределения, старости, второй молодости и — бессмертии.
В общем виде жизненный путь клетки, как и любого живого существа, довольно прост. Вариантов развития событий немного: покой, размножение или смерть. Активно делиться в нашем организме могут лишь немногие клетки, остальные либо к этому вообще не способны, либо ждут сигнала извне. В последнем случае в клетках обычно присутствуют белки, стимулирующие деление, но в небольших количествах, которые резко могут возрасти, если придет сигнал. В то же время во всех клетках постоянно находятся белки, запускающие клеточную гибель. К счастью, тоже обычно в небольших количествах. То есть залогом спокойной жизни клетки является баланс между белками, запускающими деление, и «белками смерти». Все как у людей: хорошее самочувствие возникает тогда, когда хороших мыслей хотя бы не меньше, чем плохих.
Все как у людей: хорошее самочувствие возникает тогда, когда хороших мыслей хотя бы не меньше, чем плохих.
Но допустим, что-то пошло не так. Как определить, что клетка умирает или уже мертва? В отличие от человека, здесь достаточно посмотреть на ее внешний вид. Если вы заметили, что клетка приобрела неправильную форму и потеряла наружную мембрану, то, кажется, у нее неприятности. А если клетка распалась на кусочки, которые уже поедают ее соседи, то можно смело констатировать ее смерть. Но попробуем отмотать время назад и разобраться, что могло послужить причиной такого бесславного конца.
Несчастный случай
От него не застрахован, увы, никто. Даже маленькую клетку можно случайно раздавить или проткнуть. Кроме этого, ее можно внезапно лишить еды. И если у клетки нет запасов на черный день, то энергия заканчивается моментально. Обычно значительную часть энергии клетка тратит на контроль за транспортом веществ через наружную мембрану. И если энергии нет, то транспорт нарушается и вещества могут фактически бесконтрольно сквозь нее проходить и ее повреждать, а это то же самое, как если бы мембрану проткнули.
Дальше ситуация развивается по стандартному сценарию: в мембране образуется дырка, сквозь нее вода течет в клетку, клетка разбухает и готовится лопнуть. Из дырки наружу выходят разные внутриклеточные вещества, их потихоньку поглощают соседние клетки. Но часть веществ соседи съесть не успевают, и они расплываются по ткани, нередко вызывая воспаление. Такой тип гибели называется некрозом (не путать с некрозом ткани — почернением и распадом, который возникает, например при гангрене).
Интересно, что иногда клетка может пожертвовать собой на благо родины, это назвали некроптозом (по аналогии с апоптозом, о котором речь пойдет дальше). Например, бывает так, что клетка-макрофаг самоотверженно съела бактерию, но не смогла ее переварить. Можно смириться с тем, что бактерия останется жить внутри, а можно проявить трагический героизм. Такая клетка-герой создает комплекс белков, который протыкает ее собственную мембрану изнутри. При этом соседи получают возможность добить бактерию и позвать на помощь другие клетки иммунитета.
Подобные смерти среди клеток учащаются, когда человек болен, например, нейродегенеративным заболеванием, таким как болезнь Паркинсона или Альцгеймера. Ученые полагают, что, блокируя некроптоз, смогут их остановить. В то же время можно применить некроптоз в мирных целях и организовывать несчастные случаи, например, для раковых клеток, устойчивых к другим механизмам гибели.
Профессиональное выгорание
Истории о преднамеренной гибели лучше всего начать с описания долгой и постепенной смерти клетки, которую даже язык не поворачивается назвать самоубийством. Это скорее смерть при исполнении обязанностей. Известно, что некоторые роды деятельности требуют от человека чрезмерного вложения сил, в результате чего на повседневную жизнь их не остается. У клеток тоже есть такая профессия — защищать организм от внешних агрессоров.
Этим, например, занимаются клетки эпидермиса, верхнего слоя кожи. Они образуются в глубине эпидермиса и постепенно движутся наверх, по мере того как их предшественники отшелушиваются. Для того чтобы кожа получилась прочной, клеткам приходится укреплять себя изнутри, накапливая твердые белки и жестко держась друг за друга клеточными контактами. В такой конструкции нет места ни ядру, ни другим органеллам, поэтому они постепенно исчезают, пока клетка поднимается наружу. В конечном счете от клетки остается мешочек из жира, заполненный белками. Так происходит процесс ороговения — самой медленной и неотвратимой клеточной гибели.
Для того чтобы кожа получилась прочной, клеткам приходится укреплять себя изнутри, накапливая твердые белки и жестко держась друг за друга клеточными контактами. В такой конструкции нет места ни ядру, ни другим органеллам, поэтому они постепенно исчезают, пока клетка поднимается наружу. В конечном счете от клетки остается мешочек из жира, заполненный белками. Так происходит процесс ороговения — самой медленной и неотвратимой клеточной гибели.
Истинное самоубийство
Однако самым хорошо изученным остается механизм настоящего самоубийства клетки — апоптоза. Оно происходит, когда клетка по тем или иным причинам «решает», что ее дальнейшее существование небезопасно для организма. Эти причины могут быть самыми разными.
Внешние причины
«Говорят, я не такой, как все». Если клетки иммунитета, например Т-лимфоциты, обнаруживают клетку с неправильными белками на поверхности, ей посылают сигнал смерти через рецепторы на мембране. Обычно после этого клетка послушно умирает. А если нет, то, возможно, перед нами бунтарь и правонарушитель — будущая опухоль.
А если нет, то, возможно, перед нами бунтарь и правонарушитель — будущая опухоль.
«Освободим место другим». В развитии организма немало периодов, когда органы или ткани заменяются на другие или отмирают совсем. В таких случаях самоубийство абсолютно нормально, клетку на него могут уговорить соседи из других тканей. Если оно почему-то не произошло, то остаются рудименты: например, человек рождается со сросшимися пальцами.
«Меня никто не любит». Клетки в организме обмениваются сигналами поддержки, то есть сигнальными молекулами. Часто они выделяются нервными окончаниями. Если нервное окончание повреждено, то окружающие клетки не чувствуют поддержки и заключают, что они больше не находятся в организме. А вне организма жизни нет.
«Земля уходит из-под ног». Кроме общения с соседями, клетке важно закрепиться на межклеточном веществе (за исключением клеток крови). Иногда это помогает ей выполнять свои функции, например ползти, а иногда от этого вещества поступают сигналы выживания. Если клетка ни к чему не прикреплена, она считает себя неработоспособной и погибает.
Если клетка ни к чему не прикреплена, она считает себя неработоспособной и погибает.
Внутренние причины
«Распад личности». Центром клетки, как известно, является ядро с ДНК. Если в ДНК накапливаются ошибки, растет шанс опухолевой трансформации. Поэтому системы репарации, которые чинят ошибки в ДНК, параллельно стимулируют апоптоз. Когда таких сигналов становится много, чинить что-то уже бесполезно, проще умереть.
«Я неуравновешен». Иногда клетке не удается поделить свои хромосомы на две части, тогда наступает так называемая митотическая катастрофа. Опять же дисбаланс генетического материала приводит к образованию опухолей, поэтому такие неуравновешенные клетки должны погибнуть.
«Нечем дышать». Вторая ключевая органелла клетки после ядра — митохондрия. Там происходит клеточное дыхание с образованием энергии. Если митохондрия повреждена, то из ее внутреннего пространства в цитоплазму клетки выходят молекулы, запускающие апоптоз.
«Я слишком возбужден». Это случается с нервными клетками при избытке возбуждающих сигналов. На мембране клетки открывается много ионных каналов, в том числе для кальция, его концентрация в клетке сильно возрастает, от этого рушится мембрана митохондрий — и вот уже нечем дышать.
Это случается с нервными клетками при избытке возбуждающих сигналов. На мембране клетки открывается много ионных каналов, в том числе для кальция, его концентрация в клетке сильно возрастает, от этого рушится мембрана митохондрий — и вот уже нечем дышать.
Чем бы ни запускался апоптоз, итог всегда один. Белки, стимулирующие гибель клетки, запускают ферменты каспазы, которые активируют друг друга и начинают расщеплять все клеточные молекулы подряд. В результате на клетке сначала образуются выпячивания, а потом она вся распадается на мембранные пузырьки — апоптотические тела, которые могут поглотить макрофаги.
(А) Здоровые клетки. (В) Клетки, которые распадаются на апоптотические тела. Изображение адаптировано. Фото: Edelweiss E, Balandin TG, Ivanova JL, Lutsenko GV, Leonova OG, Popenko VI, Sapozhnikov AM, Deyev SM. Edelweiss E, Balandin TG et al Barnase as a New Therapeutic Agent Triggering Apoptosis in Human Cancer Cells, PLoS One. 2008 Jun 18;3(6):e2434 CC BY 2. 5
5
Прелесть гибели клеток апоптозом заключается в том, что при этом они практически не вредят окружающим тканям. Из таких клеток выделяется совсем немного веществ, вызывающих воспаление и загрязняющих межклеточное пространство, — остальное поглощают макрофаги. Однако, чтобы так аккуратно уйти, клетке необходима энергия. Апоптоз — энергозависимая гибель, в отличие от некроза. Во многих из вышеперечисленных случаев клетка может погибнуть и некрозом, то есть просто лопнуть, если ей не хватает энергии.
Еще одно полезное свойство апоптоза — мы точно знаем, как он работает. И, к сожалению, знаем, что именно его нарушение является причиной большинства онкологических заболеваний. Поэтому сейчас многие исследования направлены на то, чтобы избирательно его заблокировать или активировать в тех или иных клетках.
Маленькая смерть во спасение
Не все нарушения в работе клетки обязательно приводят к смерти. Самый выигрышный для клетки вариант — распознать повреждения на ранних стадиях и постараться их заблаговременно починить. Для этого существует аутофагия — процесс постепенного самопоедания, переваривания собственного содержимого. Умереть таким образом практически невозможно — среди клеток гибель такого типа удалось обнаружить в единичных случаях. Зато переваривание собственных испорченных белков или целых органелл позволяет избавиться от ошибок. Это скорее перезагрузка для клетки, похожая на очищение от лишних мыслей, которое испытывает человек, прыгнувший с парашютом и фактически побывавший на грани смерти.
Для этого существует аутофагия — процесс постепенного самопоедания, переваривания собственного содержимого. Умереть таким образом практически невозможно — среди клеток гибель такого типа удалось обнаружить в единичных случаях. Зато переваривание собственных испорченных белков или целых органелл позволяет избавиться от ошибок. Это скорее перезагрузка для клетки, похожая на очищение от лишних мыслей, которое испытывает человек, прыгнувший с парашютом и фактически побывавший на грани смерти.
Типы клеточной гибели, видоизменённая схема Jhayes21 Wikimedia commons CC BY-SA 3.0
Поэтому для большинства клеток организма аутофагия исключительно полезна. Она позволяет стволовым клеткам дольше оставаться стволовыми, замедляет старение клеток и помогает противостоять внешним повреждениям, например, при атеросклерозе. А в клетках мозга, например, особенно важна митофагия — переваривание митохондрий. Если оно нарушено, могут развиваться нейродегенеративные заболевания, такие как болезнь Паркинсона. Также митофагия препятствует росту опухоли на ранних стадиях (правда, к сожалению, способствует на поздних). В некоторых случаях аутофагия помогает и переваривать внутриклеточных патогенов (например, вирусные частицы). Но некоторые вирусы, например ВИЧ, научились подавлять аутофагию или размножаться прямо в пищеварительных вакуолях.
Также митофагия препятствует росту опухоли на ранних стадиях (правда, к сожалению, способствует на поздних). В некоторых случаях аутофагия помогает и переваривать внутриклеточных патогенов (например, вирусные частицы). Но некоторые вирусы, например ВИЧ, научились подавлять аутофагию или размножаться прямо в пищеварительных вакуолях.
Изучение механизмов аутофагии находится сейчас на переднем крае клеточной биологии. Недаром в 2016 году за работу в этом направлении вручили Нобелевскую премию. Среди ближайших перспектив — борьба с инфекциями и нейродегенеративными заболеваниями и продление жизни. В любом случае уже стало понятно, что не во всех ситуациях клетке стоит сразу прыгать с моста. Возможно, иногда достаточно просто прыгнуть с парашютом и жизнь наладится.
Полина Лосева
Внеклеточная ДНК: история в пяти вопросах. Что умеет ДНК, кроме передачи информации, как она работает вне клетки и можем ли мы это использовать
Как это так — ДНК вне клетки?
Клетки бактерий могут выделять ДНК в окружающую среду — это связано с процессами их размножения и обмена информацией. Так, например, распространяется устойчивость к антибиотикам: одна бактерия приобретает соответствующий ген, копирует и делится им с остальной популяцией. У эукариотических (ядерных) организмов подобные процессы долгое время были неизвестны: полагали, что они используют ДНК только для хранения, считывания и передачи информации.
Так, например, распространяется устойчивость к антибиотикам: одна бактерия приобретает соответствующий ген, копирует и делится им с остальной популяцией. У эукариотических (ядерных) организмов подобные процессы долгое время были неизвестны: полагали, что они используют ДНК только для хранения, считывания и передачи информации.
Но в 1948 году в плазме крови обнаружили внеклеточную ДНК — фракцию ДНК, не связанную с клетками и существующую отдельно от них. За последующие годы ученые нашли такую ДНК у всех исследованных организмов, от растений до животных и человека. Ее находили в межклеточном веществе, в циркулирующих жидкостях и даже в отдельно взятых культурах клеток. Похоже, что ДНК вне клеток встречается регулярно и, следовательно, может играть определенную роль в жизни организма.
Внеклеточная ДНК не похожа на обычную.
Геномная ДНК состоит из длинных нитей-хромосом, а вкДНК — набор небольших последовательностей, иногда в миллион раз короче хромосомы.
Случаен ли выбор этих последовательностей или нет — до сих пор остается спорным вопросом.
Внеклеточная ДНК не всегда находится в растворе сама по себе. Иногда она связана с гистонами — белками, которые клетка использует для компактной упаковки нитей ДНК в ядре. В других случаях вкДНК может встречаться внутри экзосом — пузырьков, окруженных мембраной, которые отпочковываются от клеток, путешествуют по организму и могут сливаться с другими клетками. Более того, одна группа ученых выделила из крови животных целый комплекс из ДНК, жиров и белков, отвечающих за ее копирование. То есть, вероятно, по организму плавают целые молекулярные машины, копирующие и распространяющие информацию прямо на ходу. Впрочем, какую часть от общей вкДНК составляют такие структуры, пока неизвестно.
Откуда появляется внеклеточная ДНК?
Кажется логичным, что вкДНК не образуется сама, а выделяется клетками. Что может заставить клетки выбрасывать наружу молекулы, несущие их наследственную информацию?
Гипотеза клеточной гибели предполагает, что ДНК высвобождается, когда разрушаются клетки.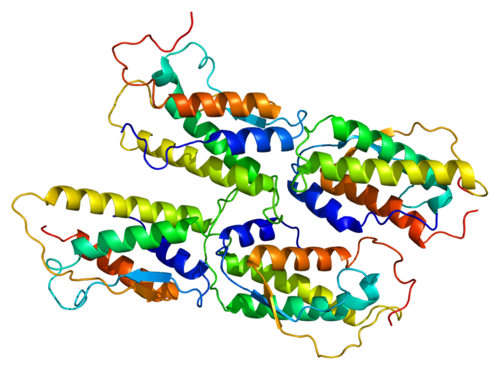 Эта теория помогает объяснить, почему вкДНК представлена маленькими фрагментами: например, при апоптозе (программируемой клеточной гибели) ДНК внутри клетки разрезается на небольшие участки, прежде чем вся клетка распадается. Также это согласуется с тем, что в состояниях, сопровождающихся гибелью клеток (инфаркт миокарда, ожоги), количество вкДНК в крови увеличивается.
Эта теория помогает объяснить, почему вкДНК представлена маленькими фрагментами: например, при апоптозе (программируемой клеточной гибели) ДНК внутри клетки разрезается на небольшие участки, прежде чем вся клетка распадается. Также это согласуется с тем, что в состояниях, сопровождающихся гибелью клеток (инфаркт миокарда, ожоги), количество вкДНК в крови увеличивается.
Но не все так просто: внеклеточную ДНК находили в любых тканевых культурах, даже там, где не было массовой гибели клеток. Это пытается объяснить гипотеза «метаболической ДНК»: вероятно, клетки в ходе своей жизнедеятельности постоянно синтезируют новую ДНК, увеличивая количество копий информации, чтобы удобнее было ее считывать. Cо временем молекулы ДНК изнашиваются и клетки выделяют их в окружающую среду вместе с продуктами обмена веществ.
Существует и мнение, что выделение вкДНК — это способ клеток обмениваться сигналами. Так, например, из разных внутриорганизменных жидкостей были выделены мембранные пузырьки, содержащие небольшие количества ДНК. Такие пузырьки могут сливаться с клетками, передавая им молекулы ДНК.
Такие пузырьки могут сливаться с клетками, передавая им молекулы ДНК.
Изображение: Алиса Муравьева
У меня в крови нашли ДНК. Это плохо?
Внеклеточная ДНК — естественный компонент плазмы крови, и ее можно обнаружить у любого человека. В норме ее концентрация довольно низкая, хотя и может варьировать, но в случае патологических и стрессовых состояний количество вкДНК резко вырастает. Например, при ожогах или заболеваниях, связанных с массовой гибелью клеток, — инфаркте миокарда или ревматоидном артрите. Даже у здорового человека возможны сильные колебания уровня вкДНК, если он подвергается стрессу, например сильной физической нагрузке. Однако после прекращения нагрузки концентрации возвращаются к нормальным значениям.
Сложнее обстоит дело при онкологических заболеваниях. Не до конца понятно, откуда в этом случае возникает вкДНК — в результате гибели здоровых тканей или как продукт целенаправленного выделения опухолевых клеток. Тем не менее ее количество также сильно отличается от нормы.
Пока медицина не научилась диагностировать конкретные заболевания по концентрации вкДНК в крови, однако уже можно оценивать тяжесть состояния и прогнозировать развитие болезни.
Так, если сравнить количества вкДНК у людей, перенесших инфаркт миокарда, то оказывается, что чем больше вкДНК, тем сильнее осложнения и риск повторного инфаркта или остановки сердца.
Возможно, тщательное изучение последовательностей вкДНК поможет ставить более точные диагнозы. На это делают ставку и в области пренатальной диагностики: в крови матери присутствует вкДНК плода, а это значит, что можно получить генетический материал ребенка без оперативного вмешательства. Это открывает широкое поле для генетических анализов — для выявления болезней плода (например, резус-конфликта) или определения пола.
Что клетки «думают» о внеклеточной ДНК?
Внеклеточная ДНК постоянно присутствует вокруг клеток, и можно предположить, что изменение ее концентрации или свойств послужит сигналом, на который другие клетки отреагируют.
На некоторые клетки повышение концентрации вкДНК оказывает активирующий эффект. Клетки иммунной системы способны запускать иммунный ответ при распознавании вкДНК. Это происходит за счет механизма, который в норме отвечает за реакцию на молекулы чужеродной, например вирусной, ДНК в крови. Те же самые рецепторы, которые узнают вирусную ДНК, реагируют и на собственную вкДНК организма, активируя клетки иммунной системы.
Для других клеток вкДНК может работать как сигнал тревоги — в них развивается «эффект свидетеля». Допустим, у нас есть культура клеток, подвергающаяся стрессу: низкий уровень кислорода, облучение или другие аномальные условия. В этих клетках ДНК повреждается и развивается окислительный стресс — накапливаются агрессивные вещества, разрушающие клеточное содержимое. Если перенести вкДНК, выделенную пострадавшими клетками, на культуру здоровых клеток, то в них также начинают обнаруживаться повреждения ДНК и окислительный стресс. Такие клетки называют «свидетелями», так как они переживают стресс, не подвергаясь действию изначальных факторов.
Изображение: Алиса Муравьева
Однако этим эффекты вкДНК не исчерпываются: она может стимулировать или замедлять деление клеток, влиять на активность генов и синтез белка. Судя по всему, вкДНК оказывает на многие клетки системный эффект, изменяя их физиологию, но конкретная его природа пока остается загадочной.
Что мы еще (не)знаем о внеклеточной ДНК?
В последнее время появились данные о том, что клетки животных и человека могут поглощать вкДНК из крови. В некоторых случаях эти молекулы достигают клеточного ядра, проникают внутрь и встраиваются в собственный геном клетки. Часто интеграция такой блуждающей молекулы вкДНК в геном заканчивается повреждением ДНК клетки-реципиента и ее гибелью. Но если встраивание оказывается успешным, процессы считывания информации меняются: фрагменты бывшей вкДНК блокируют работу генов в ядре клетки или запускают считывание собственной информации. Таким образом, перед нами особенный механизм межклеточного взаимодействия — обмен генетической информацией.
Этот механизм, вероятно, играет важную роль в развитии заболеваний. Несколько лет назад была сформулирована концепция «генного метастаза»: предполагается, что опухолевые клетки могут выделять множественные копии своих мутантных генов. Здоровые клетки их поглощают, интегрируют в свой геном и начинают производить мутантные опухолевые белки.
Похожие процессы теоретически могут происходить и при взаимодействии клеток разных организмов. Хотя вкДНК плода обнаруживается в крови матери, пока нет сведений о ее поглощении клетками. Зато обнаружено, что при переливании крови не только клетки донора поселяются в организме реципиента, но и вкДНК донора может интегрировать в клетки реципиента.
Исследования функций внеклеточной ДНК начались относительно недавно, однако уже можно говорить об открытии принципиально нового механизма коммуникации как между клетками в пределах организма, так, вероятно, и между самими организмами.
Полина Лосева
Клеточный транспорт
Раздел посвящённый процессу клеточного транспорта, который принимает участие во многих сферах жизнедеятельности клетки.
Пути транспорта белков в клетке
Пути транспорта в клетке
Синтез белка всегда начинается в цитоплазме. Окончание синтеза происходит в цитоплазме либо на шероховатом эндоплазматическом ретикулуме (ШЭР).
Можно условно выделить два пути транспорта белка в клетке:
1. Из цитоплазмы в некоторые органеллы (ядро, пластиды, митохондрии)
2. Большой путь везикулярного транспорта из ШЭР через аппарат Гольджи (АГ) к другим органеллам (лизосомы, пероксисомы) и через секреторные везикулы во внеклеточную среду. Поскольку синтез всех белков начинается в цитоплазме, а конечная локализация каждого белка может быть различна внутри полипептида имеется система сигналов определяющая его транспортный путь. Первичный сигнал определяет путь из цитоплазмы (в ШЭР, в ядро, в митохондрию или в пластиду), вторичный сигнал определяет дальнейшее направление, например, внешняя или внутренняя мембрана митохондрии или матрикс; лизосома, пероксисома или секреторная гранула.
Сигнальные последовательности белков
Сигнальные последовательности имеют длину 3-80 аминокислот узнаются специфическими рецепторами на мембранах различных компартментов клетки.
Сигнальная последовательность ЭР — гидрофобный участок 5-15 аминокислот на N-конце полипептида.
Сигнал митохондриальных белков 20-80 аминокислот состоящий из спирали и торчащих концов — (+)-заряженного и гидрофобного. 5 (+)-заряженных аминокислот для транспортировки в ядро. Пероксисомные белки имеют последовательность на С-конце Ser-Lys-Leu-COOH.
Имеется класс сигнальных последовательностей которые не позволяют белку достигшему определенной локализации транспортироваться дальше. Например, мотив Lys-Asp-Glu-Leu-COOH (KDEL) не позволяет белкам покидать эндоплазматический ретикулум.
Одна из функций гладкого ЭР — удержание кальция готового для выпуска в цитозоль при стимуляции клетки. Кальретикулин — белок удерживающий ионы кальция. Первые 17 аминокислот включают 14 гидрофобных (синие) — сигнальная последовательность для проникновения в ЭР из цитозоля. Последние четыре аминокислоты KDEL удерживают белок в ЭР.
(Nh3)MLLSVPLLLGLLGLAVAEPAVYFKEQFLDGDGWTSRWIESKHKSDFGKFVLSSGKF
YGDEEKDKGLQTSQDARFYALSASFEPFSNKGQTLVVQFTVKHEQNIDCGGGYVKLFP
NSLDQTDMHGDSEYNIMFGPDICGPGTKKVHVIFNYKGKNVLINKDIRCKDDEFTHLYTLIVRP
DNTYEVKIDNSQVESGSLEDDWDFLPPKKIKDPDASKPEDWDERAKIDDPTDSKP
EDWDKPEHIPDPDAKKPEDWDEEMDGEWEPPVIQNPEYKGEWKPRQI
DNPDYKGTWIHPEIDNPEYSPDPSIYAYDNF
GVLGLDLWQVKSGTIFDNFLITNDEAYAEEFGNETWGVTKAAEKQMKDKQDEEQRL
KEEEEDKKRKEEEEAEDKEDDEDKDEDEEDEEDKEEDEEEDVPGQAKDEL(COOH)
]]>сервер для предсказания сигнальных последовательностей белков]]>
Некоторые белки имеют различные локализации в клетки. Существует несколько путей транспортировки идентичных полипептидов в различные компартменты клетки [Karniely, 2005]:
Существует несколько путей транспортировки идентичных полипептидов в различные компартменты клетки [Karniely, 2005]:
1. Несколько сигнальных последовательностей в одном полипептиде преднозначенные для разных компартментов. Каталаза А дрожжей имеет две сигнальные последовательности — для митохондрий и пероксисом, причем количество фермента в этих органеллах зависит от состава среды. Некоторые цитохромы имеют два сигнала — митохондриальный и ЭР. Митохондриальный сигнал запускается после посттрансляционного фосфорилирования белка. Известно, что белок-предшественник амилоида болезни Альцгеймера также имеет два сигнала локализации — ЭР и митохондрий.
2. Одна сигнальная последовательность узнается различными рецепторами на поверхности компартментов. Например, некоторые белки митохондрий и хлоропластов имеют общую сигнальную последовательность, которая более гидрофобна чем специфические сигналы.
3. Сигнал может быть блокирован другим белком. Апуриновая/апиримидиновая эндонуклеаза 1 (Apn1) — основной фермент эксцизионной репарации репарации ДНК в ядре и митохондриях. С-конец имеет сигнал ядерной локализации (NLS), за которым идет сигнал митохондриальной локализации. белок Pir1 взаимодействует с С-концом Apn1 блокируя NLS.
С-конец имеет сигнал ядерной локализации (NLS), за которым идет сигнал митохондриальной локализации. белок Pir1 взаимодействует с С-концом Apn1 блокируя NLS.
4. Сигнал может быть блокирован специфическим сворачиванием белка. Аденилат-киназа дрожжей Aky2 локализуется в цитоплазме и в небольшом количестве в межмембранном пространстве митохондрий, имеет две сигнальные последовательности, активность которых зависит от конформации белка.
5. Сигнал может быть блокирован после модификации полипептида. Фосфорилированный цитохром CYP2B1, взаимодействует с цитозольным шапероном Hsp70, что приводит к конформационным изменениям и переключает одну сигнальную последовательность на другую.
6. Одна РНК может иметь два сайта инициации трансляции при этом образуются два белка — один с сигнальной последовательностью, другой без нее, что определит различную локализацию белков в клетке. В другом случае может образовываться две различные РНК кодирующие два идентичных белка, но у одного будет сигнальная последовательность, а у другого нет.
Транспорт в ядро
Транспорт в митохондрии и пластиды
Митохондрии и пластиды имеют собственную ДНК и самостоятельно синтезируют некоторые белки. Однако многие из основных белков митохондрий и пластид синтезируются в цитозоле.
Белки проникающие в митохондрии должны нести сигнал, определяющий локализацию — внутрення или наружная мембрана, или матрикс.
Белки преднозначенные для матрикса несут сигнал на N-конце, который узнается рецепторами на внешней мембране. Рецептор связан с комплексом переноса белка, который разворачивает белок и переносит его через мембрану. После переноса белка сигнальная последовательность отрезается и белок снова сворачивается.
Белки шапероны связываются с вновь синтезированным белком предотвращая его сворачивание.
Шаперонины связываются с белком после его транспортировки к месту доставки и способствуют правильному сворачиванию.
В ответ на различные стрессовые воздействия (например повышение температуры) в клетке синтезируются шапероны называемые белками теплового шока — hsp (heat-shock proteins), которые стабилизируют клеточные белки. Hsp обнаружены во всех клеточных компартментах эукариот и у бактерий.
Hsp обнаружены во всех клеточных компартментах эукариот и у бактерий.
Везукулярный транспорт
Из одной органеллы в другую перемещение происходит в везикуле или на ее поверхности в виде интегральных белков.
Донорый компартмент – органелла от которой отрывается мембрана в составе везикулы, акцепторный компартмент – принимает везикулу.
конститутивная секреция – происходит постоянно и не зависит от внешних сигналов.
регулируемая секреция – под ПМ происходит накопление пузырьков, которые сливаются с ПМ при наличии внешних сигналов – гормоны, нервы – и повышении конц. Ca2+ до 1мкм
ретроградный транспорт – возвращение рецепторных белков и липидов из АГ в Эр — восполнение мембраны ЭР.
антероградный транспорт – растворимые грузовые белки двигаются по секреторному пути ЭР→ пузырек?цис-Гольджи?пузырек?транс-Гольджи?пузырек?органелла или секреция
Окаймленные везикулы — покрыты белками, кот узнают и концентрируют специфич.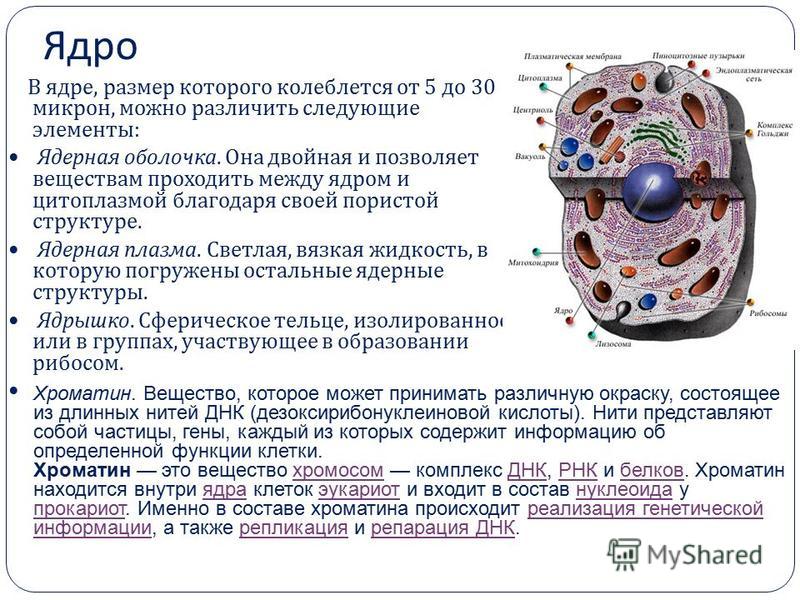 м-ные белки и отделяют м-ну пузырька, формируют решетку и придают форму везикуле: клатриновые, COPI, COPII:
м-ные белки и отделяют м-ну пузырька, формируют решетку и придают форму везикуле: клатриновые, COPI, COPII:
Клатриновые везикулы – ~0,1мкм, транспорт из АГ и ПМ,клатрин — 3типа, 3 большие и 3 малые субъединицы формирующие трискелетон – собирающиеся на поверхности м-ны со стороны цитоплазмы в пента- и гексагоны, кот спонтанно формируют сферу. Адаптин – связывает клатрин с м-ной и ловит различные трансм-ные белки в том числе грузовые рецепторы, кот. захватывают р-римые грузовые белки, кот попадают внутрь везикулы. Имеетя по крайней мере 4 типа адаптинов
динамин — GTP-аза, р-римый цитоплазматический белок, образует кольцо на отделяющейся клатриновой везикуле – регулирует кол-во клатрина отщепляющееся вместе с м-ной в составе везикулы, ассоциирует другие белки помогающие выпучить м-ну и белки модификаторы липидов, изменяющие локально липидный состав м-ны для выпучивания
После отделения везикулы от м-ны клатрин и адипин отделяют шапероны — ATP-азы hsp70 семейства. Ауксилин – прикрепляется к везикуле и активирует АТФ-азу. Т.к кайма формирующейся везикулы сущ. дольше чем кайма отделенной – имеется стабилизирующий механизм. Клатриновая оболочка обеспечивает значительную силу для изгибания м-ны, т.к. везикулы из внутриклеточных компартментов образуются на уже выпученной м-не
Т.к кайма формирующейся везикулы сущ. дольше чем кайма отделенной – имеется стабилизирующий механизм. Клатриновая оболочка обеспечивает значительную силу для изгибания м-ны, т.к. везикулы из внутриклеточных компартментов образуются на уже выпученной м-не
COP-I – транспорт от АГ и ЭР, 8субъединиц, GTP-белок – фактор рибозилирования АДФ –ARF – транспорт
COP-II – транспорт из АГ и ЭР, 5 субъединиц
Везикулы мб не только сферические, часто образуются трубчатые везикулы в которых высокое соотношение S/V
Образование клатриновых и COP везикул регулируется GTP-связывающими белками, которые могут находится в активном GTP- и неактивном GDP-состоянии
Два класса белков обменивают GDP-GTP: GEF-гуанин-нуклеотид-фактор обмена активирует белки заменяя GDF?GTF, GAP- белок активирующий GTP-азы – инактивирует GTP-связывающие белки меняя GTP?GDP.
GTP-азы необходимые для сборки окаймленных везикул перед сборкой пузырьков: мономерные GTP-связывающие белки (GTP-азы):
ARF-белки – необх для клатриновой и COP сборки на пов-ти м-ны АГ. Sar1 белок, необходим для COPII сборки на на ЭР м-не
Sar1 белок, необходим для COPII сборки на на ЭР м-не
тримерные (G белки).
GTP-азы находятся в цитозоле в неактивном состоянии, перед сборкой GEF встраивается в м-ну ЭР и связывает цитозольный SarI, кот обменивает GDF?GTP. В GTP состоянии SarI встраивается остатком жирной к-ты в м-ну ЭР. Ассоциирует белки об-ки и инициирует отпочковывание везикулы. GTP-азы попавшие в м-ну активируют фосфолипазу D, кот преобразует фосфолипиды в фосфотидную к-ту, что усиливает связывание оболочных белков. Вместе белок-белковые и белок-липидные взаимодействия изгибают м-ну
SNARE – белки – отвечают за слияние донорной и акцепторной м-н, более 20, каждая на специфич пов-ти м-ны, трансмембранные белки на пов-ти везикулы — v-SNAR, на пов-ти донора – t-SNAR. Взаимодействуя v- и t-SNAR обвиваются др на друга в транс-SNAR-комплекс, обеспечивающий слияние м-н. SNF-белок разрушает транс-SNAR-комплексы – цитозольный шаперон ATP-аза, использует адаптирующие белки для связывания с комплексом-SNAR
Rab-белки – мономерные GTP-азы, более 30, каждая органелла имеет хотя бы один Rab на м-не со стороны цитоплазмы, регулируют стыковку везикул и связывание v-SNAR-ов и t-SNAR-ов необходимых для слияния м-н. В состоянии GDP-не активны, нах в цитозоле, в состоянии GTP-активны и переходят на пов-ть м-ны органеллы или везикулы. В активном состоянии Rap связываются с м-ной липидным якорем и собирают другие белки участвующие в слиянии м-н
В состоянии GDP-не активны, нах в цитозоле, в состоянии GTP-активны и переходят на пов-ть м-ны органеллы или везикулы. В активном состоянии Rap связываются с м-ной липидным якорем и собирают другие белки участвующие в слиянии м-н
неактивный Rab-GDP связан с GDI – GDP-диссоциирующий ингибитор. Rab-GDP связывается с GEF-гуанин нуклеотид меняющий фактор, связанный с м-ной донорного компартмента – меняет GDP на GTP. Rab-GTP связывается с м-ной формирующейся везикулы и ассоциирует v-SNARE, которые в составе везикулы транспортируются к органелле и связываются с Rab-эффекторами и t-SNARE, связанными с м-ной акцепторного компартмента и обеспечивают слияние м-н
белок органелла
Rab1 ЭР и АГ
Rab2 цис-АГ
Rab3A синаптич везикулы, секрет гранулы
Rab4 ранние эндосомы
Rab5A ПМ, клатриновые везикулы
Rab5C ранние эндосомы
Rab6 промежуточный- и транс-АГ
Rab7 поздние эндосомы
Rab8 секреторные везикулы (базолатеральные)
Rab9 поздние эндосомы, trans-АГ
Слияние м-н происходит не только при везикулярном транспорте: слияние спермия с яйцом, слияние миобластов во время развития мышечной клетки.
Образование клатринового пузырька. Диаметр клатринового пузырька ~0,3 мкм
клатриновая везикула
ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНУ МАЛЫХ МОЛЕКУЛ
унипорт-независимый перенос, симпорт-одновременный, однонаправленный перенос, антипорт-одновременно антинаправленный транспорт | симпорт и антипорт — контранспорт — скорость процесса зависит от двух переносимых в-в
пассивный транспорт — идущий по градиенту концентрации и/или по электрическому градиенту — простая диффузия, канальный транспорт, облегченная диффузия
простая диффузия — липидная м-на обладает малой проницаемостью для ионов и большинства полярных молекул (исключение вода). Неполярные диффундируют Н2О, CO2, O2. Коэффициенты проницаемости для низкомолекулярных соединений коррелируют с отношением их растворимости в неполярных растворителях к растворимости в воде. Эта зависимость дает основание думать, что низкомолекулярные соединения проходят сквозь двуслойную липидную мембрану следующим образом: сначала они теряют окружающую их гидратную оболочку, затем растворяются в углеводородном внутреннем слое мембраны, после чего диффундируют через этот внутренний слой к другой стороне мембраны, где вновь растворяются в воде.
каналы — трансм-ные белки формирующие в м-не сквозные проходы — индиферентные (всегда открыты — каналы чувствительные к давлению), аллостерические (химически регулируемые — при наличии лиганда никотиновый ацетилхолиновый рец-р, рец-р -аминомаслянной к-ты, рец-р глицина) и потенциал-зависимые (при изменении м-ного потенциала Na+-канал, K+-канал, Ca2+-канал)
облегченная диффузия осущ белками переносчиками, кот специфич связывают и переносят молекулы через липидный бислой, путем изменения конформации
активный транспорт — требующий затрат энергии:
первично-активные -непосредственно использует энергию- сопряженные с ох-red р-циями (цитохром с-оксидаза), сопряженные с поглощ. hv (бактериородопсин), АТФ-азы (Na+/K+-АТФ-аза, Ca2+-АТФ-аза, Н+-АТФ-аза, K+-АТФ-аза, H+/K+-АТФ-аза
вторичноактивные по градиенту, созданному в процессе первично-активного транспорта — контранспорты – симпортеры (лактозопермеаза), антипортеры (белок полосы 3)
транспорт некоторых сахаров и аминокислот внутрь животных клеток обусловливается градиентом Na+ через плазматическую мембрану. Всасывание глюкозы в клетки кишечника и почек достигается с помощью системы симпорта, в которой глюкоза и ионы Na+ связываются с различными участками на белке-переносчике глюкозы (рис. 56). Na+ стремится войти в клетку по своему электрохимическому градиенту и как бы «тащит» глюкозу внутрь за собой. Чем выше градиент Na+, тем больше скорость всасывания
Всасывание глюкозы в клетки кишечника и почек достигается с помощью системы симпорта, в которой глюкоза и ионы Na+ связываются с различными участками на белке-переносчике глюкозы (рис. 56). Na+ стремится войти в клетку по своему электрохимическому градиенту и как бы «тащит» глюкозу внутрь за собой. Чем выше градиент Na+, тем больше скорость всасывания
глюкозы. И наоборот, если концентрация Na+ во внеклеточной жидкости заметно уменьшается, транспорт глюкозы останавливается. Ионы Na+, проникающие в клетку вместе с глюкозой, выкачиваются обратно Na+,К+-АТФазой, которая, поддерживая градиент концентрации Na+, косвенным путем контролирует транспорт глюкозы. В плазматических мембранах многих животных клеток существует, по крайней мере, 5 различных белков переносчиков аминокислот, которые действуют как системы симпорта, перенося одновременно ионы Na+, причем каждый из этих белков специфичен для группы родственных аминокислот. У бактерий большинство систем активного транспорта, приводящихся в действие ионными градиентами, использует в качестве котранспортируемого иона Н+, а не Na+. В частности, активный транспорт большей части сахаров и аминокислот в бактериальные клетки обусловлен градиентом Н+ через плазматическую мембрану. Наиболее хорошо изученный пример такого рода — это трансмембранный белок переносчик лактозы (пермеаза, или М-белок), состоящий из одной полипептидной цепи (30 кДа) и осуществляющий Н+-зависимый симпорт: с каждой транспортируемой в клетку молекулой лактозы переносится один протон.
В частности, активный транспорт большей части сахаров и аминокислот в бактериальные клетки обусловлен градиентом Н+ через плазматическую мембрану. Наиболее хорошо изученный пример такого рода — это трансмембранный белок переносчик лактозы (пермеаза, или М-белок), состоящий из одной полипептидной цепи (30 кДа) и осуществляющий Н+-зависимый симпорт: с каждой транспортируемой в клетку молекулой лактозы переносится один протон.
векторный транспорт — способ активного транспорта — молекулы, проникшие в клетку пассивно, химически модифицируются с затратой энергии, так что модифицированные молекулы уже не могут выйти обратно через тот же канал. Встречается у бактерий при транспорте сахаров: при переносе через плазматическую мембрану сахара фосфорилируются, становятся заряженными и не могут выйти обратно, поэтому они начинают накапливаться в клетке. При этом концентрация нефосфорилированных сахаров внутри клетки остается очень низкой, и сахара продолжают поступать в клетку по градиенту концентрации.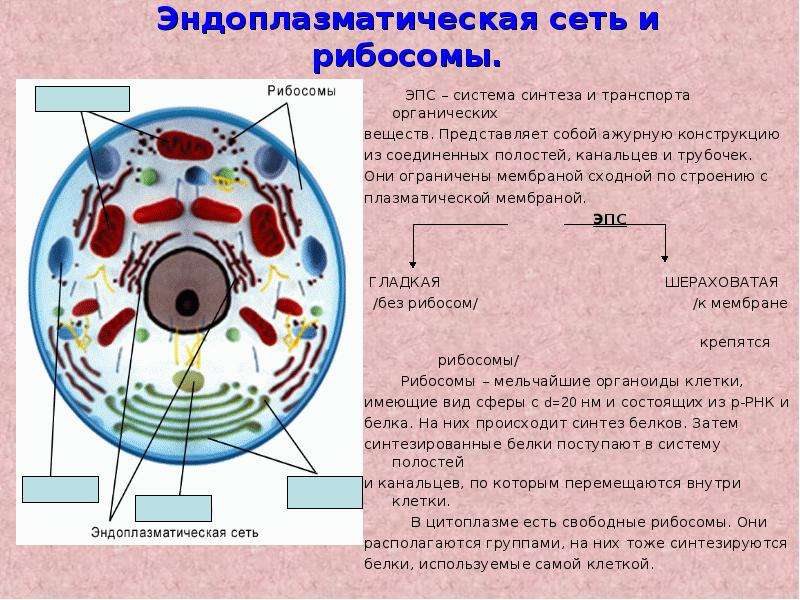 Механизм сопряженного с транспортом фосфорилирования сахаров у бактерий довольно сложен: в нем участвуют, по крайней мере, четыре разных мембранных белка, а в качестве донора фосфатной группы используется не АТФ, а фосфоенолпируват
Механизм сопряженного с транспортом фосфорилирования сахаров у бактерий довольно сложен: в нем участвуют, по крайней мере, четыре разных мембранных белка, а в качестве донора фосфатной группы используется не АТФ, а фосфоенолпируват
ТРАНСПОРТ ЧЕРЕЗ МЕМБРАНЫ МАКРОМОЛЕКУЛ
ТРАНСПОРТ БЕЛКОВ через мембраны
пориновый комплекс – 125000кДа транспорт ч-з ядерную м-ну цитозольных белков, сигнальные посл-ти связ с пк и переносятся с сохранением третичной стр-ры
белки-переносчик – транспорт из цитоплазмы в органеллы, белковые комплекся переносятлинейные пептиды ч-з биомембраны энергозависимым образом посредством связывания сигнальной посл-ти с рецептором, разворачивание и сворачивание белка контролируется шаперонами
Как коронавирус заражает организм (схема)
Коронавирус SARS-CoV-2 ранее 2019-nCoV, вирус, вызывающий коронавирусную инфекцию (COVID-19), в настоящее время распространяется по всему миру. Известно, что по меньшей мере шесть других типов коронавируса заражают людей, причем некоторые вызывают простуду, а две вызывают эпидемии: атипичная пневмония в 2002 году и MERS в 2012 году.
Покрыты шипами
Коронавирус назван в честь короноподобных шипов, выступающих из его поверхности. Вирус заключен в пузырек маслянистых липидных молекул, который распадается при контакте с мылом.
Вход в уязвимую клетку
Вирус попадает в организм через нос, рот или глаза, а затем прикрепляется к клеткам дыхательных путей, которые продуцируют белок, называемый ACE2. Считается, что вирус возник у летучих мышей, где он мог присоединиться к аналогичному белку.
Высвобождение вирусной РНК
Вирус заражает клетку, сливая ее масляную мембрану с мембраной клетки. Оказавшись внутри, коронавирус высвобождает фрагмент генетического материала под названием РНК.
Освобождение камеры
Геном вируса имеет длину менее 30 000 генетических «букв». (У нас более 3 миллиардов.) Зараженная клетка считывает РНК и начинает производить белки, которые будут держать иммунную систему в страхе и помогут собрать новые копии вируса.
Антибиотики убивают бактерии и не действуют против вирусов. Но исследователи тестируют антивирусные препараты, которые могут разрушить вирусные белки и остановить инфекцию.
Создание вирусных белков
По мере прогрессирования инфекции механизм клетки начинает производить новые спайки и другие белки, которые будут образовывать больше копий коронавируса.
Сборка новых копий
Новые копии вируса собираются и переносятся на внешние края клетки.
Распространение инфекции
Каждая зараженная клетка может выпустить миллионы копий вируса, прежде чем клетка окончательно разрушится и умрет. Вирусы могут инфицировать близлежащие клетки или попасть в капли, которые покидают легкие.
Иммунная реакция
Большинство инфекций Covid-19 вызывают лихорадку, поскольку иммунная система борется, чтобы очистить вирус. В тяжелых случаях иммунная система может чрезмерно реагировать и начать атаковать клетки легких. Легкие закупориваются жидкостью и отмирающими клетками, что затрудняет дыхание. Небольшой процент инфекций может привести к острому респираторному дистресс-синдрому и, возможно, смерти.
Легкие закупориваются жидкостью и отмирающими клетками, что затрудняет дыхание. Небольшой процент инфекций может привести к острому респираторному дистресс-синдрому и, возможно, смерти.
Покидая тело
Кашель и чихание могут привести к попаданию вирусных капель на находящихся поблизости людей и поверхности, где вирус может оставаться заразным от нескольких часов до нескольких дней. Зараженные люди могут избежать распространения вируса, надев маску, но здоровым людям не нужно носить маску, если они не заботятся о больном человеке.
Как быть с возможной вакциной
Будущая вакцина может помочь организму вырабатывать антитела, которые нацелены на вирус SARS-CoV-2 и предотвращают его заражение человеческими клетками. Вакцина против гриппа работает аналогичным образом, но антитела, полученные из вакцины против гриппа, не защищают от коронавируса.
Лучший способ избежать заражения коронавирусом и другими вирусами — мыть руки с мылом, избегать прикосновения к лицу, держаться подальше от больных людей и регулярно чистить часто используемые поверхности.
Источники: доктор Мэтью Б. Фриман и доктор Стюарт Уэстон, Univ. Мэрилендской Школы Медицины; Поля вирусологии; Медицинская вирусология Феннера и Уайта; Природа; Наука; Ланцет; Медицинский журнал Новой Англии; Центры по контролю и профилактике заболеваний.
https://www.nytimes.com/interactive/2020/03/11/science/how-coronavirus-hijacks-your-cells.html
|
Белки — полимеры, мономерами которых служат аминокислоты. Белки представляют собой цепочки остатков аминокислот, соединенных между собой пептидными связями. Белки содержат от 100 до 300 тыс. аминокислотных остатков. Молекулярная масса белков колеблется от 17 до 10000 кДа (дальтон — молекулярная масса, равная массе одного атома водорода — 1,67x10-24 г). Разнообразие белков определяется различной последовательностью аминокислотных остатков. Расчеты показывают, что из 20 аминокислот, входящих в состав белковой молекулы, можно составить примерно 2x10-18 комбинаций.
Молекула белка имеет первичную, вторичную, третичную и четвертичную структуру. Первичная структура — это определенная последовательность аминокислотных остатков в белковой молекуле. Между аминокислотами, входящими в полипептидную цепочку, возможны различные взаимодействия: водородные связи, вандер-ваальсовы связи и др. Благодаря этому полипептидная цепочка приобретает особенное расположение в пространстве, особую конформацию — вторичная структура. Л. Поллинг и Р. Кори (1951) установили, что наиболее распространенной конформацией является ос-спираль. Оказалось, что шаг спирали равен 0,54 нм. Отдельные витки спирали стабилизированы водородными связями, диаметр спирали равен 1,05 нм.
Белки отличаются исключительной реакционной способностью, они могут реагировать с различными органическими и неорганическими соединениями и с отдельными ионами. Белки входят в состав мембран, клеточных стенок, рибосом и др. Растительный организм использует белки и как запасное питательное вещество. Важнейшая функция белков заключается в том, что многие из них обладают каталитическими свойствами.
|
Синтез белков в клетке
Биосинтез белков идет в каждой живой клетке. Наиболее активен он в молодых растущих клетках, где синтезируются белки на построение их органоидов, а также в секреторных клетках, где синтезируются белки-ферменты и белки-гормоны.
Основная роль в определении структуры белков принадлежит ДНК. Отрезок ДНК, содержащий информацию о структуре одного белка, называют геном. Молекула ДНК содержит несколько сотен генов. В молекуле ДНК записан код о последовательности аминокислот в белке в виде определенно сочетающихся нуклеотидов. Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Код ДНК удалось расшифровать почти полностью. Сущность его состоит в следующем. Каждой аминокислоте соответствует участок цепи ДНК из трех рядом стоящих нуклеотидов.
Например, участок Т—Т—Т соответствует аминокислоте лизину, отрезок А—Ц—А — цистину, Ц—А—А — валину н т. д. Разных аминокислот — 20, число возможных сочетаний из 4 нуклеотидов по 3 равно 64. Следовательно, триплетов с избытком хватает для кодирования всех аминокислот.
Синтез белка — сложный многоступенчатый процесс, представляющий цепь синтетических реакций, протекающих по принципу матричного синтеза.
Поскольку ДНК находится в ядре клетки, а синтез белка происходит в цитоплазме, существует посредник, передающий информацию с ДНК на рибосомы. Таким посредником является и-РНК. :
В биосинтезе белка определяют следующие этапы, идущие в разных частях клетки:
- Первый этап — синтез и-РНК происходит в ядре, в процессе которого информация, содержащаяся в гене ДНК, переписывается на и-РНК. Этот процесс называется транскрипцией (от лат.
 «транскриптик» — переписывание).
«транскриптик» — переписывание). - На втором этапе происходит соединение аминокислот с молекулами т-РНК, которые последовательно состоят из трех нуклеотидов — антикодонов, с помощью которых определяется свой триплет-кодон.
- Третий этап — это процесс непосредственного синтеза полипептидных связей, называемый трансляцией. Он происходит в рибосомах.
- На четвертом этапе происходит образование вторич ной и третичной структуры белка, то есть формирование окончательной структуры белка.
Таким образом, в процессе биосинтеза белка образуются новые молекулы белка в соответствии с точной информацией, заложенной в ДНК. Этот процесс обеспечивает обновление белков, процессы обмена веществ, рост и развитие клеток, то есть все процессы жизнедеятельности клетки.
Хромосомы (от греч. «хрома» — цвет, «сома» — тело) — очень важные структуры ядра клетки. Играют главную роль в процессе клеточного деления, обеспечивая передачу наследственной информации от одного поколения к другому.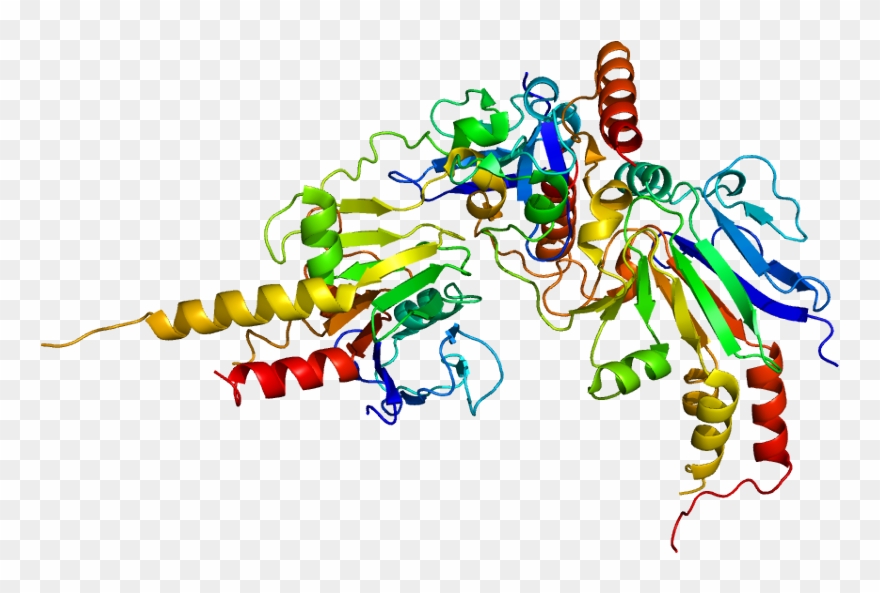 Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
Они представляют собой тонкие нити ДНК, связанные с белками. Нити называются хроматидами, состоящими из ДНК, основных белков (гистонов) и кислых белков.
В неделящейся клетке хромосомы заполняют весь объем ядра и не видны под микроскопом. Перед началом деления происходит спирализация ДНК и каждая хромосома становится различимой под микроскопом. Во время спирализации хромосомы сокращаются в десятки тысяч раз. В таком состоянии хромосомы выглядят как две лежащие рядом одинаковые нити (хроматиды), соединенные общим участком — центромерой.
Для каждого организма характерно постоянное количество и структура хромосом. В соматических клетках хромосомы всегда парные, то есть в ядре есть две одинаковые хромосомы, составляющие одну пару. Такие хромосомы называют гомологичными, а парные наборы хромосом в соматических клетках называют диплоидными.
Так, диплоидный набор хромосом у человека состоит из 46 хромосом, образуя 23 пары. Каждая пара состоит из двух одинаковых (гомологичных) хромосом.
Особенности строения хромосом позволяют выделить их 7 групп, которые обозначаются латинскими буквами А, В, С, D, Е, F, G. Все пары хромосом имеют порядковые номера.
У мужчин и женщин есть 22 пары одинаковых хромосом. Их называют аутосомы. Мужчина и женщина отличаются одной парой хромосом, которые называют половыми. Они обозначаются буквами — большая X (группа С) и маленькая Y (группа С,). В женском организме 22 пары аутосом и одна пара (XX) половых хромосом. У мужчин — 22 пары аутосом н одна пара (XY) половых хромосом.
В отличие от соматических клеток, половые клетки содержат половинный набор хромосом, то есть содержат по одной хромосоме каждой пары! Такой набор называют гаплоидным. Гаплоидный набор хромосом возникает в процессе созревания клеток.
Кто спасает белок в Германии | Культура и стиль жизни в Германии и Европе | DW
После необычно жаркого лета в Германии прогнозируют тяжелую зиму для белок: им может не хватить корма на зиму. Летом зверьки страдали от высоких температур и засухи так, что защитники животных даже призывали горожан выставлять воду возле своих домов. А в холодное время года им понадобится дополнительное питание. Несмотря на то, что во многих немецких садах и парках созрели фундук, каштаны и другие орехи, зверькам этого не будет достаточно. Запастись и закопать в землю зимние запасы они не смогут. Как будут помогать белкам в Германии?
А в холодное время года им понадобится дополнительное питание. Несмотря на то, что во многих немецких садах и парках созрели фундук, каштаны и другие орехи, зверькам этого не будет достаточно. Запастись и закопать в землю зимние запасы они не смогут. Как будут помогать белкам в Германии?
Спасение белок
В Германии существует специальные спасательные службы. Одна из них — беличья «горячая линия» Eichhörnchen Notruf (Тел. 0700 200 200 12). В ее работе задействовано более 10 сотрудников. Специалисты консультируют и выясняют важнейшие вещи, если вы обнаружили белку в тяжелом состоянии: ранено ли животное, есть ли возможность вернуть бельчонка обратно в лес и так далее. Когда зверьку действительно требуется скорая помощь, сотрудник «горячей линии» направляет звонящего в один из филиалов службы, которые расположены по всей стране.
Пациент службы спасения белок
Работников «горячей линии» консультируют профессиональные врачи. Берлинская служба, к примеру, тесно сотрудничает с ветеринарной клиникой Свободного университета Берлина. Станции по приему белок в большинстве случаев размещены в домах у волонтеров и оборудованы вольерами для грызунов. При этом добровольцы находятся в постоянном контакте со специалистами. Белке можно помочь, и не будучи ветеринаром: на сайте организации Eichhörnchen Notruf есть специальная памятка о первых действиях, которые необходимо выполнить при обнаружении раненого или ослабленного животного.
Станции по приему белок в большинстве случаев размещены в домах у волонтеров и оборудованы вольерами для грызунов. При этом добровольцы находятся в постоянном контакте со специалистами. Белке можно помочь, и не будучи ветеринаром: на сайте организации Eichhörnchen Notruf есть специальная памятка о первых действиях, которые необходимо выполнить при обнаружении раненого или ослабленного животного.
Как помочь белкам уже сейчас? Эксперты советуют начать подкармливать животных с середины зимы: на первые месяцы холодов осенних запасов будет достаточно. Самый тяжелый период для белок придется на весну, когда появится новое потомство. В это время звери особенно пугливы и ходят за едой лишь в проверенные места. Но если еще зимой приучить белку к кормушке, которая находится во дворе дома, она будет возвращаться сюда и после появления малышей. Eichhörnchen Notruf не рекомендует давать кукурузу и злаки. Кедровые и грецкие орехи, семечки, фундук идеальны для кормления во время холодов.
Первая помощь животным
Весной защитники животных тоже просят обратить внимание на поведение белок: именно в это время года детеныши лесных зверьков особенно уязвимы и часто теряют своих родителей.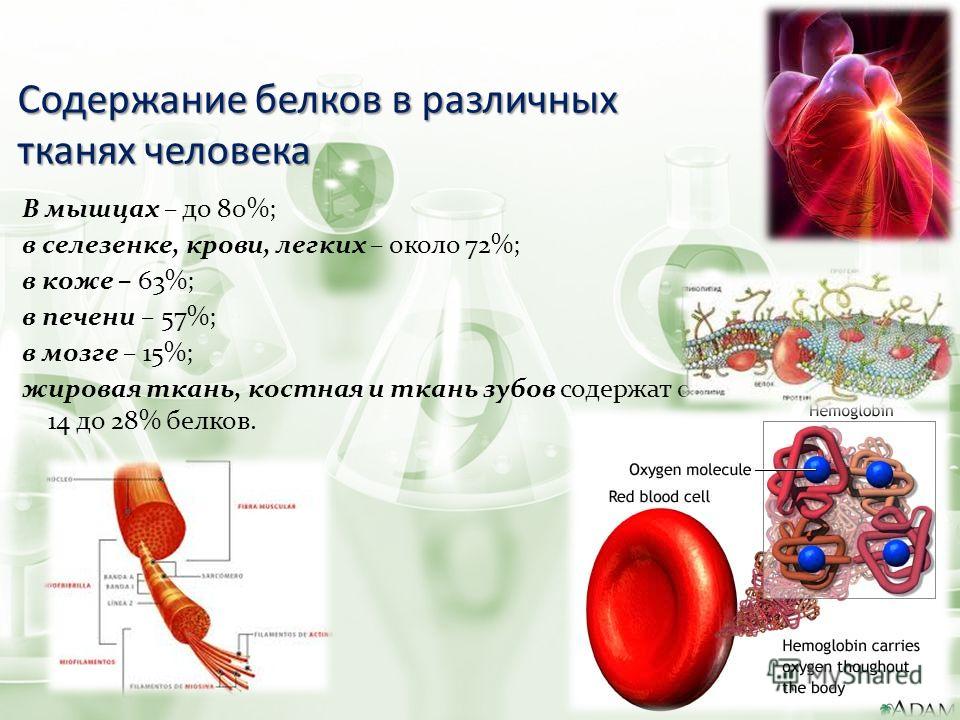 «Если вы нашли потерявшегося бельчонка, самое главное — проверить, есть ли поблизости его мама или другие зверьки. Осмотрите, нет ли повреждений и травм. Детеныша сразу же следует поместить в теплое место, кроме того, надо утолить его жажду, но ни в коем случае не поить молоком. Можно дать кипяченой подсоленной воды и не пытаться сразу же накормить белочку», — объясняет Зарец.
«Если вы нашли потерявшегося бельчонка, самое главное — проверить, есть ли поблизости его мама или другие зверьки. Осмотрите, нет ли повреждений и травм. Детеныша сразу же следует поместить в теплое место, кроме того, надо утолить его жажду, но ни в коем случае не поить молоком. Можно дать кипяченой подсоленной воды и не пытаться сразу же накормить белочку», — объясняет Зарец.
По всей Германии в год находят более тысячи маленьких зверьков, каждый филиал организации Eichhörnchen Notruf принимает около 70-80 животных. «Мы стараемся вернуть детеныша маме, если это возможно, или направить его туда, где ему окажут первую помощь и потом возвратят в лес», — рассказала в интервью DW представитель организации Eichhörnchen Notruf в Берлине Кристине Зарец (Christine Saretz).
Если это детеныш, его помещают к другим малюткам. Животных постарше селят в вольеры на улице. После того, как белку выходили, ее выпускают на волю. Дверь клетки оставляют открытой, и животные выбегают на природу — кто-то сразу, кто-то чуть позже. Были случаи, когда бельчонок оставался там несколько дней. Некоторые из зверьков возвращаются, потому что не могут самостоятельно найти новое жилье и помнят, что в клетке была еда.
Были случаи, когда бельчонок оставался там несколько дней. Некоторые из зверьков возвращаются, потому что не могут самостоятельно найти новое жилье и помнят, что в клетке была еда.
Беличьи опекуны
Беличья «горячая линия» существует исключительно на членские взносы и добровольные пожертвования. Люди обычно переводят по 25 евро, взамен они получают красивое благодарственное письмо.
Бывают и приличные суммы. «Например, недавно одна крупная компания, чье название связано с белками, сделала крупный взнос. Финансирование идет из разных источников, и я скажу, что ситуация очень даже неплохая», — отмечает Кристине Зарец.
Помимо белок немцы, естественно, спасают и других потерявшихся лесных зверей, например, зайцев, ежей и даже диких кабанов. Но следует помнить, что в Германии законодательно запрещено забирать домой диких животных, и поэтому это делают только в тех случаях, если животные действительно нуждаются в помощи.
Смотрите также:
Как животные спасались от жары
-
Жара в Германии — испытание для животных
Arche Warder (Шлезвиг-Гольштейн) — самый крупный в Европе парк редких животных.
 Его местные обитатели Труди и Людвиг, свиньи породы Турополье, любят поваляться в грязи. В жаркие дни они освежают себя в небольшом водоеме, в котором обычно плавают гуси и лебеди. Аномально высокие температуры — испытание для животных. Как немцы им помогают?
Его местные обитатели Труди и Людвиг, свиньи породы Турополье, любят поваляться в грязи. В жаркие дни они освежают себя в небольшом водоеме, в котором обычно плавают гуси и лебеди. Аномально высокие температуры — испытание для животных. Как немцы им помогают? -
Жара в Германии — испытание для животных
В нижнесаксонском городе Ядерберг в парке животных обезьянам дают фруктовое мороженое. Обезьянка рода капуцинов в тридцатиградусную жару с удовольствием ест лакомство изо льда.
-
Жара в Германии — испытание для животных
Белый медведь в зоопарке Мюнхена сидел бы в воде круглые сутки — к таким высоким температурам он явно не привык!
-
Жара в Германии — испытание для животных
В зоопарке Берлина сибирских тигров в эти дни спасают от жары замороженными мясом и рыбой.
-
Жара в Германии — испытание для животных
Жарко и муравьедам в зоопарке Магдебурга. У его сотрудников в эти дни прибавилось работы — они каждый день обливают животных прохладной водой.
-
Жара в Германии — испытание для животных
На снимке, сделанном во Фрайбурге, воробей пьет из фонтана. Экологи призывают жителей городов не забывать в жару о птицах и ставить для них воду в садах и на балконах — причем каждый день свежую.
-
Жара в Германии — испытание для животных
Непривычно высокая температура сказывается и на домашних питомцах. В Лейпциге столбик термометра достигал 38 градусов Цельсия, что было явно не по силам этому выносливому леонбергеру. Во время прогулки пес вынужден сделать перерыв, чтобы перевести дыхание.
-
Жара в Германии — испытание для животных
Укрыть кота Макса мокрым полотенцем его хозяевам в Кельне порекомендовал ветеринар. Кот чувствует себя намного лучше в тени.
-
Жара в Германии — испытание для животных
В Бранденбурге коровы стоят на высохшем от жары поле и пьют воду из специально привезенного для них контейнера. Необычайная жара вызывает тревогу у фермеров. В некоторых регионах из-за отсутствия дождей они оказались на грани разорения.
-
Жара в Германии — испытание для животных
Высохшие пастбища стоят и на западе Германии. Этот снимок сделан под Дортмундом в Северном Рейне — Вестфалии. Из-за нехватки корма некоторым фермерам приходится принимать радикальные меры и сокращать поголовье скота.
-
Жара в Германии — испытание для животных
А так коровам помогают перенести аномальную жару животноводы в коммуне Варенхольц в Нижней Саксонии. Каждый день Хельмут Эверс устраивает для них холодный душ.
-
Жара в Германии — испытание для животных
Этих животных уже не спасти. В городке Рётлен (Баден-Вюртемберг) добровольные помощники вытаскивают из озера мертвых рыб. Нынешним летом вода в водоемах нагревается настолько сильно, что не всякая рыба выдерживает.
Автор: Виктор Вайц
Сворачивание белков: хорошее, плохое и уродливое
Мы часто думаем о белках как о питательных веществах в пище, которые мы едим, или как об основном компоненте мышц, но белки также представляют собой микроскопические молекулы внутри клеток, которые выполняют разнообразные и жизненно важные функции. Завершив проект «Геном человека», ученые обращают внимание на «протеом» человека — каталог всех человеческих белков. Эта работа показала, что мир белков увлекателен, он полон молекул с такими замысловатыми формами и точными функциями, что они кажутся почти фантастическими.
Функция белка зависит от его формы, и, когда образование белка идет не так, получаемые в результате деформированные белки вызывают проблемы, которые варьируются от плохих, когда белки пренебрегают своей важной работой, до уродливых, когда они образуют липкую комковатую массу внутри клеток. Текущие исследования показывают, что мир белков далек от первозданного. Образование белка — это процесс, подверженный ошибкам, и ошибки на этом пути были связаны с рядом заболеваний человека.
Мир белков:
В типичной человеческой клетке содержится от 20 000 до более чем 100 000 уникальных типов белков.Почему так много? Белки — это рабочие лошадки клетки. Каждый мастерски выполняет определенную задачу. Некоторые из них являются структурными, например, придают жесткость мышечным клеткам или длинным тонким нейронам. Другие связываются с определенными молекулами и доставляют их в новые места, а третьи катализируют реакции, которые позволяют клеткам делиться и расти. Такое разнообразие и специфичность функций стало возможным благодаря, казалось бы, простому свойству белков: они сворачиваются.
Белки складываются в функциональную форму
Белок начинается в клетке как длинная цепочка, состоящая в среднем из 300 строительных блоков, называемых аминокислотами.Существует 22 различных типа аминокислот, и их порядок определяет, как белковая цепь будет складываться сама по себе. При складывании первыми обычно образуются конструкции двух типов. Некоторые области белковой цепи сворачиваются в тонкие образования, называемые «альфа-спиралями», в то время как другие области складываются в зигзагообразные узоры, называемые «бета-листами», которые напоминают складки бумажного веера. Эти две структуры могут взаимодействовать, образуя более сложные структуры. Например, в одной структуре белка несколько бета-листов обвиваются вокруг себя, образуя полую трубку с несколькими альфа-спиралями, выступающими из одного конца.Трубка короткая и приземистая, так что общая структура напоминает змей (альфа-спирали), выходящих из банки (бета-листовая трубка). Несколько других белковых структур с описательными названиями включают «бета-ствол», «бета-пропеллер», «альфа / бета-подкову» и «складку желе-ролла».
Эти сложные структуры позволяют белкам выполнять свою разнообразную работу в клетке. Белок «змеи в банке», будучи встроенным в клеточную мембрану, создает туннель, который позволяет входить и выходить из клеток.Другие белки образуют формы с карманами, называемыми «активными центрами», которые идеально подходят для связывания с определенной молекулой, например, с замком и ключом. Сворачиваясь в различные формы, белки могут выполнять очень разные роли, несмотря на то, что они состоят из одних и тех же основных строительных блоков. Чтобы провести аналогию, все автомобили сделаны из стали, но обтекаемая форма гоночного автомобиля побеждает в гонках, в то время как автобус, самосвал, кран или дзамбони имеют форму для выполнения своих уникальных задач.
Почему иногда происходит сбой сворачивания белка?
Сворачивание позволяет белку принимать функциональную форму, но это сложный процесс, который иногда терпит неудачу.Сворачивание белка может пойти не так по трем основным причинам:
1: Человек может обладать мутацией, которая изменяет аминокислоту в белковой цепи, что затрудняет поиск конкретным белком его предпочтительной складки или «нативного» состояния. Это касается наследственных мутаций, например, приводящих к муковисцидозу или серповидно-клеточной анемии. Эти мутации расположены в последовательности ДНК или «гене», кодирующем один конкретный белок. Следовательно, эти типы унаследованных мутаций влияют только на этот конкретный белок и связанные с ним функции.
2: С другой стороны, нарушение сворачивания белков можно рассматривать как продолжающийся и более общий процесс, который влияет на многие белки. Когда создаются белки, машина, считывающая указания ДНК для создания длинных цепочек аминокислот, может делать ошибки. По оценкам ученых, этот механизм, рибосома, допускает ошибки в 1 из каждых 7 белков! Эти ошибки могут снизить вероятность правильного сворачивания полученных белков.
3: Даже если аминокислотная цепь не имеет мутаций или ошибок, она все равно может не достичь своей предпочтительной складчатой формы просто потому, что белки не складываются правильно в 100% случаев.Сворачивание белка становится еще более трудным, если условия в клетке, такие как кислотность и температура, изменяются от тех, к которым привык организм.
Нарушение сворачивания белка вызывает несколько известных заболеваний, и ученые предполагают, что многие другие болезни могут быть связаны с проблемами сворачивания. Есть две совершенно разные проблемы, которые возникают в клетках, когда их белки не сворачиваются должным образом.
Один тип проблемы, называемый «потеря функции», возникает, когда недостаточное количество определенного белка сворачивается должным образом, вызывая нехватку «специализированных работников», необходимых для выполнения конкретной работы.Например, представьте, что правильно сложенный белок имеет идеальную форму, чтобы связывать токсин и расщеплять его на менее токсичные побочные продукты. Без достаточного количества правильно сложенного белка токсин будет накапливаться до разрушительного уровня. В качестве другого примера, белок может отвечать за метаболизм сахара, чтобы клетка могла использовать его для получения энергии. Клетка будет расти медленно из-за недостатка энергии, если в ее функциональном состоянии будет недостаточно белка. Причина, по которой клетка заболевает, в этих случаях связана с нехваткой одного специфического, правильно сложенного, функционального белка.Муковисцидоз, болезнь Тея-Сакса, синдром Марфана и некоторые формы рака являются примерами заболеваний, которые возникают, когда один тип белка не может выполнять свою работу. Кто знал, что один тип белка из десятков тысяч может быть настолько важен?
Белки, которые сворачиваются неправильно, также могут повлиять на здоровье клетки независимо от функции белка. Когда белки не могут свернуться в свое функциональное состояние, полученные неправильно свернутые белки могут принимать форму, неблагоприятную для переполненной клеточной среды.Большинство белков содержат липкие, «ненавидящие воду» аминокислоты, которые они закапывают глубоко внутри своего ядра. Неправильно свернутые белки носят эти внутренние части снаружи, как леденцы в шоколаде, раздавленные, чтобы обнажить липкую карамельную серединку. Эти неправильно свернутые белки часто слипаются, образуя сгустки, называемые «агрегатами». Ученые предполагают, что накопление неправильно свернутых белков играет роль в нескольких неврологических заболеваниях, включая болезнь Альцгеймера, Паркинсона, Хантингтона и болезнь Лу Герига (БАС), но ученые все еще работают над тем, чтобы выяснить, как именно эти неправильно свернутые липкие молекулы наносят ущерб клеткам. .
Один неправильно свернутый белок выделяется среди остальных и заслуживает особого внимания. «Прионный» белок при болезни Крейтцфельдта-Якоба, также известной как болезнь коровьего бешенства, является примером того, что неправильно свернутый белок стал некорректным. Этот белок не только необратимо неправильно свернут, но и превращает другие функциональные белки в свое скрученное состояние.
Как наши клетки защищаются от неправильно свернутых белков?
Недавние исследования показывают, что неправильная укладка белков часто происходит внутри клеток.К счастью, клетки привыкли справляться с этой проблемой и имеют несколько систем для повторного укладки или разрушения аберрантных белковых образований.
Шапероны — одна из таких систем. Правильно названные, они сопровождают белки в процессе сворачивания, улучшая шансы белка на правильное сворачивание и даже позволяя некоторым неправильно свернутым белкам возможность повторно сворачиваться. Интересно, что шапероны сами по себе являются белками! Есть много разных типов шаперонов. Некоторые специально предназначены для того, чтобы помочь одному типу белка сворачиваться, в то время как другие действуют в более общем плане.Некоторые шапероны имеют форму больших полых камер и обеспечивают белкам безопасное пространство, изолированное от других молекул, в котором они могут складываться. Производство нескольких шаперонов усиливается, когда клетка сталкивается с высокими температурами или другими условиями, затрудняющими сворачивание белков, в результате чего эти шапероны получили прозвище «белки теплового шока».
Другая линия защиты клеток от неправильно свернутых белков называется протеасомой. Если неправильно свернутые белки задерживаются в клетке, они будут уничтожены этой машиной, которая пережевывает белки и выплевывает их в виде небольших фрагментов аминокислот.Протеасома похожа на центр переработки, позволяющий клетке повторно использовать аминокислоты для производства большего количества белков. Сама протеасома — это не один белок, а множество действующих вместе. Белки часто взаимодействуют с образованием более крупных структур с важными клеточными функциями. Например, хвост спермы человека представляет собой структуру, состоящую из многих типов белков, которые работают вместе, образуя сложный роторный двигатель, который продвигает сперму вперед.
Будущие исследования сворачивания и неправильного сворачивания белков:
Почему некоторые неправильно свернутые белки способны уклоняться от таких систем, как шапероны и протеасома? Как липкие неправильно свернутые белки могут вызывать перечисленные выше нейродегенеративные заболевания? Некоторые белки неправильно складываются чаще, чем другие? Эти вопросы находятся в авангарде текущих исследований, направленных на понимание основ биологии белков и болезней, которые возникают в результате неправильного сворачивания белка.
Обширный мир белков с большим разнообразием форм наделяет клетки способностями, которые позволяют жизни существовать и допускают ее разнообразие (например, различия между клетками глаза, кожи, легких или сердца, а также различия между видами) . Возможно, по этой причине слово «белок» происходит от греческого слова «протас», что означает «первостепенное значение».
— Подготовлено Керри Гейлер, аспирантом 4-го курса Гарвардского факультета органической и эволюционной биологии
Специализированная клеточная структура и функции: синтез белка
Синтез белка
Создание различных типов белка является одним из наиболее важных событий для клетки, поскольку белок не только формирует структурные компоненты клетки, но и составляет ферменты, которые катализировать производство оставшихся органических биомолекул, необходимых для жизни.В общем, генотип, кодируемый в ДНК, выражается как фенотип с помощью белка и других продуктов, катализируемых ферментами.
ДНК, размещенная в ядре, слишком велика, чтобы проходить через ядерную мембрану, поэтому она должна копироваться более мелкой однонитевой РНК (транскрипция), которая перемещается из ядра в рибосомы, расположенные в цитоплазме и грубой эндоплазме. ретикулум, чтобы направить сборку белка (трансляцию). Гены на самом деле не производят белок, но они обеспечивают план в виде РНК, которая направляет синтез белка.
Транскрипция
Транскрипция происходит в ядре клетки и представляет собой перенос генетического кода от ДНК к комплементарной РНК. Ферментная РНК-полимераза?
- Присоединяется к молекуле ДНК и расстегивает ее, образуя две отдельные нити.
- Связывается с промотором сегментов ДНК, которые указывают начало копируемой одиночной цепи ДНК.
- Перемещается по ДНК и сопоставляет нуклеотиды ДНК с комплементарным нуклеотидом РНК для создания новой молекулы РНК, которая повторяет структуру ДНК.
Копирование ДНК продолжается до тех пор, пока РНК-полимераза не достигнет сигнала терминации , который представляет собой определенный набор нуклеотидов, которые маркируют конец копируемого гена, а также сигнализируют об отключении ДНК от вновь созданной РНК. .
Три типа РНК?
- мРНК (информационная РНК) транскрибируется с ДНК и несет генетическую информацию от ДНК, которая должна быть переведена в аминокислоты.
- тРНК (транспортная РНК)? Интерпретирует? трехбуквенные кодоны нуклеиновых кислот к однобуквенному аминокислотному слову
- рРНК (рибосомная РНК) является наиболее распространенным типом РНК, и вместе с ассоциированными белками составляют рибосомы.
Когда РНК-полимераза заканчивает копирование определенного сегмента ДНК, ДНК реконфигурируется в исходную структуру двойной спирали. Вновь созданная мРНК перемещается из ядра в цитоплазму.
Трансляция
Трансляция — это преобразование информации, содержащейся в последовательности нуклеотидов мРНК, в последовательность аминокислот, которые связываются вместе, образуя белок. МРНК перемещается к рибосомам и «читается». с помощью тРНК, которая анализирует участки трех соседних нуклеотидных последовательностей, называемых кодонами , на мРНК и переносит соответствующую аминокислоту для сборки в растущую полипептидную цепь.Три нуклеотида в кодоне специфичны для конкретной аминокислоты. Следовательно, каждый кодон сигнализирует о включении определенной аминокислоты, которая объединяется в правильной последовательности для создания определенного белка, кодируемого ДНК.
Сборка полипептида начинается, когда рибосома прикрепляется к стартовому кодону , расположенному на мРНК. Затем тРНК переносит аминокислоту к рибосомам, которые состоят из рРНК и белка и имеют три сайта связывания, способствующие синтезу.Первый сайт ориентирует мРНК таким образом, чтобы кодоны были доступны для тРНК, которые занимают оставшиеся два сайта, когда откладывают свои аминокислоты, а затем высвобождаются из мРНК для поиска большего количества аминокислот. Трансляция продолжается до тех пор, пока рибосома не распознает кодон, который сигнализирует о конце аминокислотной последовательности. Полипептид, когда он завершен, находится в своей первичной структуре. Затем он высвобождается из рибосомы, чтобы начать изгибаться, чтобы принять окончательную форму и начать свою функцию.
Bionote
Каждый кодон мРНК определяет конкретную аминокислоту, которая распознается антикодоном комплементарной тРНК.Есть 20 различных аминокислот; есть также 20 различных молекул тРНК.
После того, как белки изготовлены, они упаковываются и транспортируются к их конечному месту назначения интересным путем, который можно описать в три этапа с участием трех органелл:
- Везикулы транспортируют белки из рибосом в аппарат Гольджи , он же комплекс Гольджи, где они упакованы в новые пузырьки.
- Везикулы мигрируют к мембране и высвобождают свой белок за пределы клетки.
- Лизосомы переваривают и перерабатывают отходы для повторного использования клеткой.
Ферменты в аппарате Гольджи модифицируют белки и заключают их в новую везикулу, которая отрастает от поверхности аппарата Гольджи. Аппарат Гольджи часто рассматривается как центр упаковки и распределения ячейки.
Везикулы — это небольшие мембранные оболочки, которые обычно образуются в эндоплазматическом ретикулуме или аппарате Гольджи и используются для транспортировки веществ через клетку.
Лизосомы — это особый тип везикул, которые содержат пищеварительные ферменты клетки и полезны для расщепления оставшихся продуктов жизнедеятельности белков, липидов, углеводов и нуклеиновых кислот на их составные части для повторной сборки и повторного использования клеткой.
Выдержка из The Complete Idiot’s Guide to Biology 2004 Глен Э. Моултон, редактор Д. Все права защищены, включая право на воспроизведение полностью или частично в любой форме. Используется по договоренности с Alpha Books , членом Penguin Group (USA) Inc.
Чтобы заказать эту книгу напрямую у издателя, посетите веб-сайт Penguin USA или позвоните по телефону 1-800-253-6476. Вы также можете приобрести эту книгу на Amazon.com и Barnes & Noble.
клеточная стенка | Описание, свойства, компоненты и связь
Клеточная стенка , особая форма внеклеточного матрикса, окружающая каждую клетку растения. Клеточная стенка отвечает за многие характеристики, которые отличают клетки растений от клеток животных. Хотя клеточная стенка часто воспринимается как неактивный продукт, служащий в основном механическим и структурным целям, на самом деле она выполняет множество функций, от которых зависит жизнь растений.К таким функциям относятся: (1) обеспечение живой клетки механической защитой и химически буферной средой, (2) обеспечение пористой среды для циркуляции и распределения воды, минералов и других небольших молекул питательных веществ, (3) обеспечение жестких строительных блоков. из которых могут быть получены стабильные структуры более высокого порядка, такие как листья и стебли, и (4) обеспечение места хранения регуляторных молекул, которые обнаруживают присутствие патогенных микробов и контролируют развитие тканей.
растительная клетка
Рисунок растительной клетки в разрезе, показывающий клеточную стенку и внутренние органеллы.
Британская энциклопедия, Inc.
Британская викторина
Части клетки
Какой тонкий слой образует внешнюю границу ячейки? Где находится место фотосинтеза в растительной клетке? Проверьте свои знания.Пройдите викторину.
Некоторые прокариоты, водоросли, слизистые, водяные и грибковые также имеют клеточные стенки. Стенки бактериальных клеток характеризуются присутствием пептидогликана, тогда как в стенках архей этот химический элемент обычно отсутствует. Стенки водорослей похожи на стенки растений, и многие из них содержат специфические полисахариды, полезные для таксономии. В отличие от растений и водорослей, клеточные стенки грибов полностью лишены целлюлозы и содержат хитин. Рамки этой статьи ограничиваются стенками растительных клеток.
Механические свойства
Все клеточные стенки содержат два слоя, среднюю пластинку и первичную клеточную стенку, а многие клетки образуют дополнительный слой, называемый вторичной стенкой. Средняя пластинка служит цементирующим слоем между первичными стенками соседних ячеек. Первичная стенка — это слой, содержащий целлюлозу, наложенный клетками, которые делятся и растут. Чтобы обеспечить расширение клеточной стенки во время роста, первичные стенки тоньше и менее жесткие, чем у клеток, которые перестали расти.Полностью выросшая растительная клетка может сохранять свою первичную клеточную стенку (иногда утолщая ее) или может откладывать дополнительный укрепляющий слой другого состава, который является вторичной клеточной стенкой. Вторичные клеточные стенки отвечают за большую часть механической поддержки растений, а также за механические свойства, ценимые в древесине. В отличие от постоянной жесткости и несущей способности толстых вторичных стенок, тонкие первичные стенки способны выполнять структурную, поддерживающую роль только тогда, когда вакуоли внутри ячейки заполнены водой до такой степени, что они оказывают тургорное давление против клеточная стенка.Повышение жесткости первичных стенок, вызванное тургором, аналогично усилению боковых сторон пневматической шины давлением воздуха. Увядание цветов и листьев вызвано потерей тургорного давления, что, в свою очередь, связано с потерей воды клетками растений.
растительная клетка
Клетки кожи лука под микроскопом.
© Maor Winetrob / iStock.com
Компоненты
Хотя первичные и вторичные слои стенки различаются детальным химическим составом и структурной организацией, их основная архитектура одинакова, состоящая из целлюлозных волокон с высокой прочностью на разрыв, заключенных в водонасыщенную матрицу полисахаридов и структурных гликопротеинов.
Получите подписку Britannica Premium и получите доступ к эксклюзивному контенту.
Подпишитесь сейчас
Целлюлоза состоит из нескольких тысяч молекул глюкозы, соединенных встык. Химические связи между отдельными субъединицами глюкозы придают каждой молекуле целлюлозы плоскую ленточную структуру, которая позволяет соседним молекулам соединяться сбоку в микрофибриллы длиной от двух до семи микрометров. Фибриллы целлюлозы синтезируются ферментами, плавающими в клеточной мембране, и расположены в форме розетки.Кажется, что каждая розетка способна «вращать» микрофибриллы в клеточной стенке. Во время этого процесса, когда новые субъединицы глюкозы добавляются к растущему концу фибриллы, розетка проталкивается вокруг клетки на поверхности клеточной мембраны, и ее целлюлозная фибрилла оборачивается вокруг протопласта. Таким образом, каждую растительную клетку можно рассматривать как создающую собственный кокон из целлюлозных фибрилл.
глюкоза; целлюлоза
Целлюлоза состоит из молекул глюкозы, соединенных встык.
Британская энциклопедия, Inc.
Матричные полисахариды
Двумя основными классами полисахаридов матрикса клеточной стенки являются гемицеллюлозы и пектиновые полисахариды или пектины. Оба синтезируются в аппарате Гольджи, выводятся на поверхность клетки в небольших пузырьках и секретируются в клеточную стенку.
Гемицеллюлозы состоят из молекул глюкозы, расположенных встык, как в целлюлозе, с короткими боковыми цепями ксилозы и других незаряженных сахаров, прикрепленных к одной стороне ленты. Другая сторона ленты плотно связывается с поверхностью фибрилл целлюлозы, тем самым покрывая микрофибриллы гемицеллюлозой и предотвращая их неконтролируемое слипание.Было показано, что молекулы гемицеллюлозы регулируют скорость расширения первичных клеточных стенок во время роста.
Гетерогенные, разветвленные и высокогидратированные пектиновые полисахариды во многом отличаются от гемицеллюлоз. В частности, они заряжены отрицательно из-за остатков галактуроновой кислоты, которые вместе с молекулами сахара рамнозы образуют линейную основу всех пектиновых полисахаридов. Основная цепь содержит участки остатков чистой галактуроновой кислоты, прерванные сегментами, в которых чередуются остатки галактуроновой кислоты и рамнозы; к этим последним сегментам присоединены сложные разветвленные боковые цепи сахара.Из-за своего отрицательного заряда пектиновые полисахариды прочно связываются с положительно заряженными ионами или катионами. В клеточных стенках ионы кальция прочно сшивают участки остатков чистой галактуроновой кислоты, оставляя сегменты, содержащие рамнозу, в более открытой, пористой конфигурации. Это сшивание создает свойства полужесткого геля, характерные для матрикса клеточной стенки — процесс, используемый при приготовлении желейных консервов.
Новая вселенная минипротеинов меняет клеточную биологию и генетику | Наука
Митч Лесли,
Мыши посрамляют человеческих бегунов. Несмотря на скромные успехи, грызуны могут преодолевать 10 и более километров за ночь на колесе для упражнений. Но выделялись мыши, которых мышечный биолог Эрик Олсон из Юго-Западного медицинского центра Техасского университета в Далласе и его коллеги представили в 2015 году. На беговой дорожке мыши могли суетиться по крутому склону 10% в течение примерно 90 минут, прежде чем споткнуться, что на 31% дольше, чем у других грызунов. Эти железные мыши отличались от своих собратьев только одним небольшим отличием — исследователи генетически изменили животных, чтобы лишить их одного мышечного белка.Этого было достаточно, чтобы развязать превосходную мышечную производительность. «Это как будто вы отключили тормоза», — говорит Олсон.
Столь же поразительной была природа важнейшего белка. В мышцах содержится огромное количество белков. Дистрофин, структурный белок, ген которого может нести мутации, вызывающие мышечную дистрофию, содержит более 3600 аминокислот. Титин, который действует как пружина, придавая мышцам эластичность, является крупнейшим известным белком, содержащим более 34 000 аминокислот. Белок, отключенный у мышей, имеет ничтожное значение 46.Хотя исследователи изучали, как работают мышцы более 150 лет, они полностью упустили из виду огромное влияние этого крошечного белка, называемого миорегулин, на функцию мышц.
Не только Олсон и его коллеги были ошеломлены белками лилипутов. Как теперь понимают ученые, их первоначальные правила анализа геномов дискриминировали идентификацию этих молекул размером с пинту. Теперь более широкие критерии и лучшие методы обнаружения позволяют обнаруживать крошечные белки тысячами, не только у мышей, но и у многих других видов, включая человека.«Впервые мы собираемся исследовать эту вселенную новых белков, — говорит биохимик Джонатан Вайсман из Калифорнийского университета в Сан-Франциско.
Биологи только начинают изучать функции этих молекул, называемых микропротеинами, микропептидами или минипротеинами. Но их небольшой размер, кажется, позволяет им блокировать сложную работу более крупных белков, подавляя одни клеточные процессы и высвобождая другие. Ранние результаты показывают, что микробелки укрепляют иммунную систему, контролируют разрушение дефектных молекул РНК, защищают бактерии от жары и холода, определяют время цветения растений и обеспечивают токсичный удар для многих типов яда.«Вероятно, там будут небольшие [белки], участвующие во всех биологических процессах. Мы просто не искали их раньше», — говорит биохимик Алан Сагателиан из Института биологических исследований Солка в Сан-Диего, Калифорния.
Яд этого хищного водяного клопа содержит более десятка мелких белков.
ЭНДРЮ УОКЕР
Маленькие белки также обещают пересмотреть текущее понимание генома.Многие из них, по-видимому, закодированы в участках ДНК и РНК, которые, как считалось, не помогают строить какие-либо белки. Некоторые исследователи предполагают, что короткие участки ДНК могут быть генами новорожденных, которые эволюционируют в более крупные гены, которые производят полноразмерные белки. Отчасти благодаря небольшим белкам «Нам нужно переосмыслить, что такое гены», — говорит микробиолог и молекулярный биолог Гизела Сторц из Национального института здоровья детей и развития человека в Бетесде, штат Мэриленд.
Несмотря на остающуюся загадку, ученые уже исследуют потенциальные возможности использования этих молекул.Одна компания продает инсектициды, полученные из небольших белков яда австралийского воронкообразного паука. В ходе клинических испытаний оценивается агент визуализации на основе еще одного крошечного белка в яде скорпиона, предназначенный для выделения границ опухолей, чтобы хирурги могли удалить их более точно. «Многие фармацевтические компании сейчас ищут небольшие белки с медицинским потенциалом», — говорит биохимик Гленн Кинг из Университета Квинсленда в Сент-Люсии, Австралия. «Это одно из самых быстрорастущих направлений.«
Другие короткие аминокислотные цепи, часто называемые пептидами или полипептидами, изобилуют клетками, но они представляют собой урезанные остатки более крупных предшественников. Миорегулин и его миниатюрные собратья, напротив, рождаются маленькими. Насколько они могут быть крошечными, остается неясным. Как отмечает специалист по геномике микробов Ами Бхатт из Стэнфордского университета в Пало-Альто, Калифорния, плодовые мушки полагаются на микропротеин с 11 аминокислотами для роста нормальных ног, а некоторые микробы могут производить белки длиной менее 10 аминокислот.Но даже самые большие маленькие белки не соответствуют белкам среднего размера, таким как альфа-амилаза, фермент из 496 аминокислот в нашей слюне, который расщепляет крахмал.
До недавнего времени было обнаружено несколько небольших белков, поскольку критерий для идентификации генов был установлен около 20 лет назад. Когда ученые анализируют геном организма, они часто сканируют открытые рамки считывания (ORF), которые представляют собой последовательности ДНК, разграниченные сигналами, которые сообщают рибосомам клетки, ее линиям сборки белка, где начать и где остановиться.Отчасти для того, чтобы избежать большого количества данных, прошлые исследователи обычно исключали любую открытую рамку считывания, которая могла бы давать белок, содержащий менее 100 аминокислот у эукариот или 50 аминокислот у бактерий. Например, в дрожжах этот порог ограничивал список ORF примерно до 6000.
Ослабление этого критерия показывает, что клетки несут значительно больше ORF. Ранее в этом году постдок из Стэнфорда Хила Сберро Ливнат, Бхатт и его коллеги исследовали фрагменты генома микробов, населяющих четыре части человеческого тела, включая кишечник и кожу.Путем поиска небольших ORF, которые могут кодировать белки длиной от пяти до 50 аминокислот, исследователи идентифицировали около 4000 семейств потенциальных микробелков. Почти половина из них не похожи на известные белки, но последовательность для одной маленькой ORF предполагала, что соответствующий белок находится в рибосомах — намек на то, что он может играть фундаментальную роль. «Не только гены с эзотерическими функциями были упущены из виду», когда ученые упускали из виду небольшие ОРС, — говорит Бхатт. «Это гены с ключевыми функциями.«
Впервые мы собираемся исследовать эту вселенную новых белков.
Джонатан Вайсман, Калифорнийский университет, Сан-Франциско
Другие клетки также содержат огромное количество коротких открытых рамок считывания — например, дрожжи могут производить более 260 000 молекул, содержащих от двух до 99 аминокислот. Но клетки почти наверняка не используют все эти открытые рамки считывания, и некоторые из производимых ими аминокислотных цепочек могут не работать. В 2011 году, обнаружив более 600000 коротких ORF в геноме плодовой мухи, генетик по вопросам развития Хуан Пабло Кузо из Университета Сассекса в Брайтоне, США.К. и его коллеги пытались сократить число. Они рассудили, что, если конкретная ORF имеет идентичную или почти идентичную копию у родственного вида, вероятность того, что это геномный мусор, меньше. После поиска генома другой плодовой мушки и анализа других доказательств того, что последовательности транслируются, группа в конечном итоге получила более управляемую цифру в 401 короткую ORF, которая может давать микробелки. Это все равно составляет значительную часть белкового репертуара насекомых — они содержат около 22 000 полноразмерных белков.
Вайсман и его коллеги обнаружили микробелки вторым путем, с помощью метода, который они изобрели для широкого определения того, какие белки производят клетки. Чтобы создать любой белок, клетка сначала копирует ген в информационную РНК. Затем рибосомы считывают мРНК и соединяют аминокислоты в указанном порядке. Посредством секвенирования мРНК, прикрепленных к рибосомам, Вайсман и его команда точно определяют, какие из клеток фактически превращаются в белки, а где на РНК рибосома начинает считываться. В исследовании Cell 2011 года он и его команда применили этот метод профилирования рибосом, также называемый Ribo-seq, к эмбриональным стволовым клеткам мыши и обнаружили, что клетки вырабатывают тысячи неожиданных белков, в том числе многие из них ниже 100-аминокислотной — отсечка кислоты.«Было совершенно ясно, что стандартное понимание игнорировало большую вселенную белков, многие из которых были короткими», — говорит Вайсман.
Сагательян и его коллеги применили третий подход, чтобы обнаружить кладезь микробелков в наших собственных клетках. Исследователи использовали масс-спектрометрию, которая включает разбиение белков на части, которые сортируются по массе, чтобы получить отличительный спектр для каждого белка. Сагателян, его тогдашний постдок Сара Славофф и коллеги применили этот метод к смесям белков из человеческих клеток, а затем вычли сигнатуры известных белков.Этот подход позволил выявить спектры 86 ранее не обнаруженных крошечных белков, самые маленькие из которых имеют длину всего 18 аминокислот, сообщили исследователи в 2013 году в журнале « Nature Chemical Biology ».
Малый размер ограничивает возможности белка. Более крупные белки складываются в сложные формы, подходящие для определенной функции, например, для катализирования химических реакций. По словам химика Хулио Камареро из Университета Южной Калифорнии в Лос-Анджелесе, белки с размером меньше 50-60 аминокислот, вероятно, не складываются.Так что они, вероятно, не подходят в качестве ферментов или структурных белков.
Однако их миниатюрный размер также открывает новые возможности. «Они достаточно крошечные, чтобы поместиться в укромных уголках и трещинах более крупных белков, которые функционируют как каналы и рецепторы», — говорит Олсон. Маленькие белки часто разделяют короткие отрезки аминокислот со своими более крупными партнерами и поэтому могут связываться с этими белками и изменять их активность. Связанные микробелки также могут переносить более крупные молекулы в новые места, например, помогая им проникать в клеточные мембраны.
Микропротеин в яде скорпиона-ловца смерти был слит с флуоресцентным красителем, чтобы опухоли испускали свет в ближнем инфракрасном диапазоне. ( 1 ) Опухоль в видимом свете ( 2 ) Та же опухоль в видимом и ближнем инфракрасном свете
(Сверху вниз) ИВАН КУЗЬМИН / НАУЧНЫЙ ИСТОЧНИК; BLAZE BIOSCIENCE (2)
Из-за их притяжения к более крупным белкам маленькие белки могут дать клеткам обратимый способ включать или выключать более крупные белки.В исследовании 2016 года, проведенном в PLOS Genetics , биолог по развитию растений Стефан Венкель из Копенгагенского университета и его коллеги генетически изменили растений Arabidopsis , чтобы произвести дополнительные количества двух небольших белков. Обычно растения зацветают, когда дни достаточно длинные, но когда они производят избыточное количество двух микробелков, их цветение откладывается. Маленькие белки вызвали эту задержку, блокируя здоровенный белок CONSTANS, который запускает цветение. Они связывают CONSTANS с другими ингибирующими белками, которые его отключают.«Клетка использует то, что помогает ей выжить. Если короткий белок выполняет свою работу, это нормально», — говорит Сагателян.
Эти задания включают в себя другие ключевые задачи. В 2016 году Славофф, Сагателян и его коллеги обнаружили, что человеческие клетки производят 68-аминокислотный белок, который они назвали NoBody, который может помочь управлять разрушением неисправных или ненужных молекул мРНК. Название NoBody отражает его роль в предотвращении образования процессинговых телец (P-телец), таинственных кластеров в цитоплазме, где может происходить распад РНК.Когда белок отсутствует, образуется больше Р-телец, что ускоряет разрушение РНК и изменяет внутреннюю структуру клетки. «Это показывает, что небольшие белки могут оказывать огромное влияние на клетку», — говорит Славофф.
Мышцы зависят от множества микробелков. Во время эмбрионального развития отдельные мышечные клетки сливаются в волокна, обеспечивающие сокращение. Миомиксер из 84 аминокислотных белков объединяется с более крупным белком, чтобы объединить клетки, сообщила группа Олсона в 2017 году в журнале Science .Без него эмбриональные мыши не могут формировать мышцы и почти прозрачны.
Позже миорегулин начинает регулировать мышечную активность. Когда мышца получает стимул, клетки-хранилища высыпают кальций, заставляя волокна сокращаться и генерировать силу. Затем ионный насос SERCA начинает возвращать кальций в запасы, позволяя мышечным волокнам расслабиться. Команда Олсона обнаружила, что миорегулин связывается с SERCA и ингибирует его. Эффект ограничивает частоту сокращения мускулов мыши — возможно, гарантируя, что у животного есть запас мускулов на случай чрезвычайной ситуации, например, при побеге от хищника.Другой небольшой белок, DWORF, имеет противоположный эффект, высвобождая SERCA и позволяя мышце многократно сокращаться.
Даже широко изученные организмы, такие как кишечная бактерия Escherichia coli , содержат неожиданные маленькие белки, которые выполняют важные функции. В 2012 году Сторц и ее команда сообщили, что ранее неизвестный белок из 49 аминокислот под названием AcrZ помогает микробу выжить при некоторых антибиотиках, стимулируя насос, который выталкивает лекарства.
А яд, производимый множеством организмов, включая пауков, многоножек, скорпионов и ядовитых моллюсков, изобилует крошечными белками.Многие компоненты яда выводят из строя или убивают, блокируя каналы для натрия или других ионов, которые необходимы для передачи нервных импульсов. Маленькие белки «поражают эти ионные каналы с удивительной специфичностью и эффективностью», — говорит Кинг. «Они являются основными компонентами ядов и ответственны за большинство фармакологических и биологических эффектов».
Австралийский гигантский водяной клоп, убивающий рыбу, например, полагается не только на острые когти и похожие на копья рты, чтобы покорить добычу. Он вводит своим жертвам смесь из более чем 130 белков, 15 из которых содержат менее 100 аминокислот, сообщили Кинг и его коллеги в прошлом году.
В отличие от гигантских белков, таких как антитела, микропротеины, доставляемые с помощью таблеток или инъекций, могут проникать в клетки и изменять их функции. Каптоприл, первый из класса лекарств от высокого кровяного давления, известных как ингибиторы ангиотензинпревращающего фермента, был разработан из небольшого белка в яде бразильской гадюки. Но лекарство, которое Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило для продажи в Соединенных Штатах в 1981 году, было обнаружено случайно, до того, как ученые выделили небольшие белки в отдельную группу.На данный момент только несколько микробелков вышли на рынок или в клинические испытания.
Исследователи рака пытаются извлечь выгоду из микробелка из яда скорпиона-ловца смерти ( Leiurus quinquestriatus ) из Африки и Ближнего Востока. Молекула имеет загадочное притяжение к опухолям. Объединив его с флуоресцентным красителем, ученые надеются осветить границы опухолей головного мозга, чтобы хирурги могли безопасно вырезать раковые ткани. «Он освещает опухоль. Вы можете увидеть края и метастазы», - говорит Кинг.В настоящее время проводится клиническое исследование, посвященное оценке того, может ли двойная молекула помочь хирургам удалять опухоли головного мозга у детей.
Насколько важны малые белки для медицины, пока неизвестно, но они уже опровергли несколько биологических предположений. Генетик Норберт Хюбнер из Центра молекулярной медицины Макса Дельбрюка в Берлине и его коллеги обнаружили десятки новых микропротеинов в клетках сердца человека. Группа проследила их до неожиданного источника: короткие последовательности в длинных некодирующих РНК, разновидность, которая, как считалось, не продуцирует белки.После идентификации 169 длинных некодирующих РНК, которые, вероятно, считывались рибосомами, Хюбнер и его команда использовали тип масс-спектрометрии, чтобы подтвердить, что более половины из них дают микробелки в клетках сердца, результат был сообщен ранее в этом году в Cell .
Бактерии, такие как Escherichia coli , также производят множество микробелков, хотя их функции во многих случаях остаются неясными.
KWANGSIN KIM / НАУЧНЫЙ ИСТОЧНИК
Последовательности ДНК других крошечных белков также встречаются в нетрадиционных местах.Например, некоторые из них находятся рядом с ORF для более крупных белков. Ранее исследователи думали, что эти последовательности помогают управлять производством более крупных белков, но редко дают начало самим белкам. Некоторые кодирующие последовательности для недавно открытых микробелков даже вложены в последовательности, кодирующие другие, более длинные белки.
Эти геномные сюрпризы могут пролить свет на то, как возникают новые гены, говорит системный биолог Анн-Руксандра Карвунис из Университета Питтсбурга в Пенсильвании.Исследователи думали, что большинство новых генов возникает, когда существующие гены дублируются или сливаются, или когда виды обмениваются ДНК. Но для Карвуниса микробелки предполагают, что протогены могут образовываться, когда мутации создают новые сигналы запуска и остановки в некодирующей части генома. Если полученная в результате ORF продуцирует полезный белок, новые последовательности останутся в геноме и будут подвергаться естественному отбору, в конечном итоге превратившись в более крупные гены, которые кодируют более сложные белки.
В исследовании 2012 года Карвунис, который тогда был постдоком в лаборатории Марка Видаля в Институте рака Дана-Фарбер в Бостоне, и его коллеги обнаружили, что дрожжи транслируют более 1000 коротких ORF в белки, подразумевая, что эти последовательности являются протогенами.В новом исследовании Карвунис и ее команда проверили, могут ли молодые ORF быть полезными для клеток. Они генетически изменили дрожжи, чтобы увеличить выход 285 недавно разработанных ORF, большинство из которых кодируют молекулы, которые меньше стандартного порогового значения белка или чуть выше него. Для почти 10% белков увеличение их уровней усиливало рост клеток по крайней мере в одной среде. Результаты, опубликованные на сервере препринтов bioRxiv, предполагают, что эти последовательности могут стать полноценными генами, говорит Карвунис.
Славофф до сих пор вспоминает, как был поражен, когда во время собеседования на постдока с Сагательяном он спросил, не захочет ли она пойти на охоту за маленькими белками. «Я никогда не думал, что может существовать такой размер белков, который до сих пор был для нас темным».
Но ставка окупилась — теперь у нее есть собственная лаборатория по поиску микробелков. Недавно она рассказала некоторым из своих постдоков и аспирантов об одном из наиболее изученных организмов, штамме K12 E.coli. Вскоре команда обнаружила пять новых микробелков. «Мы, вероятно, только царапаем поверхность», — говорит она.
Роль мембранных белков в физиологии
Мембранные белки — это белки, которые являются частью клеточных мембран или взаимодействуют с ними, и они несут ответственность за выполнение большинства функций этих мембран. Мембранные белки составляют примерно одну треть белков человека и отвечают за регулирование процессов, которые помогают биологическим клеткам выжить.
Изображение предоставлено: sciencepics / Shutterstock.com
Мембранные белки имеют ряд различных структур и также расположены в разных областях мембраны. Они выполняют широкий спектр функций, и количество белков и типы белков, присутствующих на конкретной мембране, могут варьироваться.
Структура мембранного белка
Клеточные мембраны состоят из двух фосфолипидных бислоев, которые называются листочками. Эти листочки присутствуют на всех клетках, образуя барьер, окружающий каждую клетку.Мембранные белки находятся на этих бислоев фосфолипидов или они взаимодействуют с этими бислоями фосфолипидов.
Внутри липидного бислоя находятся неполярные мембранные белки, которые являются гидрофобными (водоотталкивающими), и полярные мембранные белки, которые являются гидрофильными (способны смешиваться с водой). Они напрямую связаны с липидными бислоями, которые создают барьер вокруг каждой клетки.
Интегральные мембранные белки прочно закреплены на мембране.
Белки периферической мембраны не являются постоянной частью мембраны и могут иметь гидрофобные, электростатические и другие нековалентные взаимодействия с мембраной или интегральными белками.
Интегральные белки бывают разных типов, например монотопные, битопические, политопные, липидно-заякоренные белки или трансмембранные белки.
Монотопные интегральные белки прикреплены только к одному из двух листочков клетки.
Интегральные белки Bitopic — это трансмембранные белки, которые могут однажды покрывать липидные бислои. Политопные белки также являются трансмембранными белками, которые покрывают липидные бислои более одного раза.
Заякоренный липидом белок имеет ковалентную связь с липидами, которые встроены в фосфолипидный бислой.
Функции мембранного белка
Существует множество функций, которые выполняют мембранные белки. К ним относятся:
- Соединения: соединение двух ячеек вместе
Ферментативные функции
Все ферменты представляют собой белок. В результате мембранный белок, внедренный в мембрану, иногда может быть ферментом, активный сайт которого может быть обращен к веществам за пределами липидного бислоя.
Эти типы ферментных мембранных белков могут работать в группах для выполнения определенных этапов метаболического пути, например, расщепления лактозы на углеводы, а затем на моносахариды.
Транспорт
Мембранные белки могут позволить гидрофильным молекулам проходить через клеточную мембрану. Белки транспортной мембраны бывают разных форм, и некоторым требуется энергия для изменения формы и активного перемещения молекул и других веществ через клеточную мембрану. Они делают это, высвобождая АТФ для использования в качестве источника энергии.
- Крепление: становятся точками прикрепления цитоскелета и внеклеточного матрикса
Преобразование сигнала
Некоторые мембранные белки могут иметь сайт связывания.Эти сайты связывания имеют особую форму, которая соответствует форме химического посредника. Например, эти химические посланники могут быть гормонами.
Когда гормон встречается с клеточной стенкой, он соединяется с рецепторным мембранным белком, встроенным в клеточную стенку. Гормон может изменить рецепторный белок и вызвать определенную реакцию, в зависимости от типа гормона или другого вещества, которая будет иметь место внутри клетки.
Распознавание клеток
Другая важная функция мембранных белков — идентификация и распознавание между клетками.Эта конкретная функция полезна для иммунной системы, поскольку она помогает организму распознавать чужеродные клетки, например, которые могут вызывать инфекцию. Гликопротеины — это один из типов мембранных белков, которые могут распознавать клетки.
Межклеточное соединение
Соседние клетки могут иметь мембранные белки, которые соединяются в различных соединениях. Щелевые и плотные соединения.
Эта функция помогает клеткам общаться друг с другом и передавать материалы между собой.
Приложение
Мембранные белки важны для цитоскелета, системы нитей и волокон в цитоплазме клетки и внеклеточного матрикса (ECM), который представляет собой сеть макромолекул, находящихся вне клеток, таких как коллаген, ферменты и гликопротеины. к мембранным белкам.
Присоединение филаментов или волокон в цитоплазме, обнаруженных по всей клетке, может помочь клетке сохранять свою особую форму. Он также сохраняет стабильное расположение мембранных белков.
Присоединение мембранных белков к внеклеточному матриксу может помочь ЕСМ опосредовать изменения, происходящие во внеклеточной и внутриклеточной среде.
Мембранные белки при болезнях
Некоторые заболевания связаны с мутациями мембранных белков. Одним из примеров является мутация под названием V509A, обнаруженная в рецепторе тиреотропина, причем тиреотропин является гормоном, секретируемым гипофизом, который регулирует выработку гормонов щитовидной железы.
Эта мутация увеличивает активность рецептора тиреотропина и приводит к врожденному гипертиреозу, состоянию, которое может вызывать изменения настроения, проблемы со сном и проблемы с желудком.
Другие заболевания, связанные с мутациями в мембранных белках, включают наследственную глухоту, болезнь Шарко-Мари-Тута, которая повреждает периферические нервы за пределами центральной нервной системы, и синдром Дежерина-Соттаса, который влияет на способность человека двигаться.
Изображение предоставлено: Explode / Shutterstock.com
Сводка
Мембранные белки выполняют ряд важных функций, которые помогают клеткам общаться, поддерживать свою форму, выполнять изменения, вызванные химическими посредниками, а также транспортировать и обмениваться материалами.
Мембранные белки также могут играть роль в прогрессировании заболевания, поскольку иммунная система может использовать мембранные белки для идентификации потенциально вредных чужеродных молекул в организме.
Определение белков клеточной поверхности
Клеточная мембрана защищает клетку и обеспечивает ей структурную поддержку, но клетке по-прежнему необходимо взаимодействовать с внешней средой. Вдоль поверхности клетки расположены важные белки, которые облегчают эти функции и помогают связывать отдельные клетки с сообществом клеток, составляющих более крупный организм.
Поверхностные белки
Поверхностные белки клетки — это белки, которые встроены в слой клеточных мембран более сложных организмов или покрывают его. Эти белки являются неотъемлемой частью того, как клетка взаимодействует с окружающей средой, включая другие клетки. Некоторые из этих белков, особенно те, которые находятся на внешней стороне мембраны, называются гликопротеинами, потому что к их внешней поверхности прикреплены углеводы.
Транспортные белки
Пассивный переносчик позволяет растворенным веществам поступать внутрь или из клетки при условии, что на другой стороне мембраны имеется большая концентрация.Этот белок имеет молекулярные ворота, которые могут открываться и закрываться контролируемым образом. Активный транспорт, с другой стороны, активно прокачивает растворенное вещество через канал. Это требует ввода энергии.
Клеточная интерактивность
Белок распознавания может идентифицировать другие клетки как принадлежащие к ткани и телу или как чужеродные для тела. Коммуникационные белки могут образовывать контакты между соседними клетками, чтобы облегчить межклеточную коммуникацию, через которую могут проходить сигналы.Адгезивный белок позволяет клеткам прилипать к другим клеткам или белкам, которые являются частью ткани.
Прием сигнала
Рецепторный белок обеспечивает связь с веществами, которые служат сигнальными молекулами, такими как гормоны. Эти молекулы связываются с рецепторным белком и изменяют активность внутри клетки, позволяя ей выполнять другие функции, соответствующие потребностям организма. Рецепторные белки состыкованы с внешней стороны клетки.
Ферменты
Одно из основных направлений деятельности многих белков — катализировать внутриклеточные реакции, которые обычно занимают гораздо больше времени или никогда не происходят вообще.Эти белки известны как ферменты. Ферменты клеточной мембраны могут катализировать реакции, непосредственно связанные с клеточной мембраной.
5.6: Клеточные органеллы — Biology LibreTexts
Обзор рибосом
Рисунок \ (\ PageIndex {1} \) представляет важную структуру в живых клетках. Это компонент рибосомы, клеточной структуры, в которой синтезируются белки. Большая рибосомная субъединица (50S) Haloarcula marismortui , обращенная к 30S субъединице. Рибосомные белки показаны синим цветом, рРНК — охрой (оттенки коричневого и желтого), активный центр — красным.Все живые клетки содержат рибосомы, будь то прокариотические или эукариотические клетки. Однако только эукариотические клетки также содержат ядро и несколько других типов органелл.
Рисунок \ (\ PageIndex {1} \): субъединица рибосомы
Органелла — это структура в цитоплазме эукариотической клетки, которая заключена в мембрану и выполняет определенную работу. Органеллы участвуют во многих жизненно важных функциях клеток. Органеллы в клетках животных включают ядро, митохондрии, эндоплазматический ретикулум, аппарат Гольджи, везикулы и вакуоли.Рибосомы не заключены в мембрану, но все еще обычно называются органеллами в эукариотических клетках.
Ядро
Ядро — самая большая органелла в эукариотической клетке и считается центром управления клеткой. Он содержит большую часть ДНК клетки, из которой состоят хромосомы, и кодируется генетическими инструкциями по производству белков. Функция ядра — регулировать экспрессию генов, в том числе контролировать, какие белки вырабатывает клетка.Помимо ДНК, ядро содержит густую жидкость, называемую нуклеоплазмой, которая по составу похожа на цитозоль, обнаруженный в цитоплазме вне ядра (рисунок \ (\ PageIndex {2} \)). Большинство эукариотических клеток содержат только одно ядро, но некоторые типы клеток, такие как красные кровяные тельца, не содержат ядра. Некоторые другие типы клеток, например мышечные, содержат несколько ядер.
Рисунок \ (\ PageIndex {2} \): это крупное изображение ядра клетки показывает, что оно окружено структурой, называемой ядерной оболочкой, которая содержит крошечные перфорации или поры.Ядро также содержит плотный центр, называемый ядрышком.
Как видно из модели на рисунке \ (\ PageIndex {2} \), мембрана, охватывающая ядро, называется ядерной оболочкой . Фактически это двойная мембрана, которая охватывает всю органеллу и изолирует ее содержимое от клеточной цитоплазмы. Крошечные отверстия, называемые ядерными порами , позволяют большим молекулам проходить через ядерную оболочку с помощью специальных белков. Большие белки и молекулы РНК должны иметь возможность проходить через ядерную оболочку, чтобы белки могли синтезироваться в цитоплазме, а генетический материал мог сохраняться внутри ядра.Ядрышко , показанное на модели ниже, в основном участвует в сборке рибосом. После образования в ядрышке рибосомы экспортируются в цитоплазму, где участвуют в синтезе белков.
Митохондрии
Митохондрия , , , (множественное число, , митохондрии), , — это органелла, делающая энергию доступной для клетки (рисунок \ (\ PageIndex {3} \)). Вот почему митохондрии иногда называют энергетическими установками клетки.Они используют энергию органических соединений, таких как глюкоза, для производства молекул АТФ (аденозинтрифосфат) , молекулы, переносящей энергию, которая почти повсеместно используется внутри клеток для получения энергии.
Ученые считают, что митохондрии когда-то были свободноживущими организмами, потому что они содержат собственную ДНК. Они предполагают, что древние прокариоты инфицировали (или были поглощены) более крупными прокариотическими клетками, и эти два организма развили симбиотические отношения, которые принесли пользу им обоим.Более крупные клетки предоставили меньшим прокариотам место для жизни. В свою очередь, более крупные клетки получали дополнительную энергию от более мелких прокариот. В конце концов, более мелкие прокариоты стали постоянными гостями более крупных клеток в качестве органелл внутри них. Эта теория называется эндосимбиотической теорией , , и сегодня она широко принята биологами
.
Рисунок \ (\ PageIndex {3} \): Митохондрии, органеллы, специализированные для выполнения аэробного дыхания, содержат внутреннюю мембрану, свернутую в кристы, которые образуют два отдельных отсека: пространство внутренней мембраны и матрикс.В матрице имеет место цикл Кребса. Цепь переноса электронов встроена во внутреннюю мембрану и использует оба отсека для производства АТФ посредством хемиосмоса. Митохондрии имеют собственную ДНК и рибосомы, напоминающие таковые у прокариотических организмов.
Митохондриальные компартменты
Двойная мембранная природа митохондрий приводит к образованию пяти отдельных компартментов, каждый из которых играет важную роль в клеточном дыхании. Эти отсеки:
- внешняя митохондриальная мембрана,
- межмембранное пространство (пространство между внешней и внутренней мембранами),
- внутренняя митохондриальная мембрана,
- кристы (образованные складками внутренней мембраны) и
- матрица (пространство внутри внутренней мембраны).
Эндоплазматическая сеть
Эндоплазматический ретикулум (ER) (множественное число, ретикулумы) представляет собой сеть фосфолипидных мембран, которые образуют полые трубки, уплощенные листы и круглые мешочки. Эти уплощенные полые складки и мешочки называются цистернами и . ER выполняет две основные функции:
- Транспорт: Молекулы, такие как белки, могут перемещаться с места на место внутри ER, как по внутриклеточной магистрали.
- Синтез: Рибосомы, прикрепленные к ЭР, подобно неприсоединенным рибосомам, образуют белки.Липиды также производятся в ER.
Существует два типа эндоплазматической сети: грубая эндоплазматическая сеть (RER) и гладкая эндоплазматическая сеть (SER):
- Шероховатая эндоплазматическая сеть усеяна рибосомами, что придает ему «грубый» вид. Эти рибосомы производят белки, которые затем транспортируются из ЭПР в небольших мешочках, называемых транспортными пузырьками. Транспортные везикулы защемляют концы ER. Грубый эндоплазматический ретикулум работает с аппаратом Гольджи, чтобы перемещать новые белки в их надлежащие места назначения в клетке.Мембрана RER непрерывна с внешним слоем ядерной оболочки.
- Гладкая эндоплазматическая сеть не имеет прикрепленных к ней рибосом и поэтому имеет гладкий вид. SER выполняет множество различных функций, некоторые из которых включают синтез липидов, накопление ионов кальция и детоксикацию лекарств. Гладкая эндоплазматическая сеть присутствует как в животных, так и в растительных клетках, и в каждой из них она выполняет разные функции. SER состоит из канальцев и пузырьков, которые разветвляются, образуя сеть.В некоторых клетках есть расширенные области, такие как мешочки RER. Гладкая эндоплазматическая сеть и RER образуют взаимосвязанную сеть.
Рисунок \ (\ PageIndex {4} \): ER представляет собой извилистую сеть тонких мембранных мешочков, находящихся в тесной связи с ядром клетки. Гладкая и шероховатая эндоплазматическая сеть очень различаются по внешнему виду и функциям (источник: ткань мыши). (b) Rough ER усеяна многочисленными рибосомами, которые являются участками синтеза белка (источник: ткань мыши). EM × 110000.(c) Smooth ER синтезирует фосфолипиды, стероидные гормоны, регулирует концентрацию клеточного Ca 2 + , метаболизирует некоторые углеводы и расщепляет определенные токсины.
Аппарат Гольджи
Аппарат Гольджи (Рисунок \ (\ PageIndex {5} \)) — это большая органелла, которая обрабатывает белки и подготавливает их для использования внутри и вне клетки. Он был обнаружен в 1898 году итальянским врачом Камилло Гольджи. Аппарат Гольджи модифицирует, сортирует и упаковывает различные вещества для выделения из клетки или для использования внутри клетки.Аппарат Гольджи находится рядом с ядром клетки, где он модифицирует белки, доставленные транспортными пузырьками из грубого эндоплазматического ретикулума. Он также участвует в транспортировке липидов по клетке. Кусочки мембраны Гольджи отщепляются, образуя пузырьки, которые переносят молекулы вокруг клетки. Аппарат Гольджи можно представить себе как почтовое отделение; он упаковывает и маркирует «предметы», а затем отправляет их в разные части ячейки. Аппарат Гольджи имеет тенденцию быть больше и многочисленнее в клетках, которые синтезируют и секретируют большие количества материалов; например, плазматические В-клетки и секретирующие антитела клетки иммунной системы имеют выраженные комплексы Гольджи.
Аппарат Гольджи управляет продуктами из грубого эндоплазматического ретикулума (ER), а также производит новые органеллы, называемые лизосомами. Белки и другие продукты ER отправляются в аппарат Гольджи, который организует, модифицирует, упаковывает и маркирует их. Некоторые из этих продуктов транспортируются в другие области клетки, а некоторые выводятся из клетки посредством экзоцитоза. Ферментные белки упакованы в новые лизосомы.
Рисунок \ (\ PageIndex {5} \): грубый ER является продолжением ядерной оболочки и имеет рибосомы на своей поверхности.Рибосомы продуцируют белки, подобные показанному на рисунке, которые остаются связанными с мембраной грубого ЭПР. Мембрана грубого ЭПР отщипывается, образуя транспортную везикулу, содержащую белок. Везикула сливается с цис-гранью аппарата Гольджи. Теперь белок находится на мембране аппарата Гольджи и перемещается по цистернам. Достигнув трансфокальной оболочки аппарата Гольджи, он упаковывается в секреторный пузырь, который отправляет белок к плазматической мембране.
Стек из цистерн имеет четыре функциональных области: сеть цис-Гольджи, , медиальную сеть Гольджи, эндо-Гольджи и сеть транс-Гольджи. Пузырьки из ER сливаются с сетью и впоследствии проходят через стек от цис- к сети транс-Гольджи , где они упаковываются и отправляются к месту назначения. Каждая цистерна содержит особые ферменты Гольджи, которые модифицируют или помогают модифицировать белки, проходящие через нее. Белки можно модифицировать добавлением углеводной группы (гликозилирование) или фосфатной группы (фосфорилирование).Эти модификации могут формировать сигнальную последовательность на белке, которая определяет конечное предназначение белка. Например, добавление маннозо-6-фосфата сигнализирует белку о лизосомах.
Везикулы и вакуоли
И , везикулы, , и , вакуоли, , представляют собой мешкообразные органеллы, которые хранят и транспортируют материалы в клетке. Везикулы намного меньше вакуолей и выполняют самые разные функции. Везикулы, которые отщепляются от мембран ER и аппарата Гольджи, хранят и транспортируют молекулы белков и липидов.Вы можете увидеть пример транспортного пузырька этого типа на рисунке выше. Некоторые везикулы используются как камеры для биохимических реакций. Другие везикулы включают:
- Лизосомы, которые используют ферменты для разрушения инородных тел и мертвых клеток.
- Пероксисомы, которые используют кислород для расщепления ядов.
- Транспортные везикулы, переносят содержимое между органеллами, а также между внешней и внутренней частью клетки.
Центриоли
Центриоли — органеллы, участвующие в делении клеток.Функция центриолей состоит в том, чтобы помочь организовать хромосомы до того, как произойдет деление клетки, чтобы каждая дочерняя клетка имела правильное количество хромосом после деления клетки. Центриоли встречаются только в клетках животных и располагаются вблизи ядра. Каждая центриоль состоит в основном из белка , тубулина . Центриоль имеет цилиндрическую форму и состоит из множества микротрубочек, как показано на модели, изображенной ниже.
Рисунок \ (\ PageIndex {6} \): Центриоли представляют собой крошечные цилиндры около ядра, увеличенные здесь, чтобы показать их трубчатую структуру.
Рибосомы
Рибосомы — это небольшие структуры, в которых образуются белки. Хотя они не заключены в мембрану, их часто считают органеллами. Каждая рибосома состоит из двух субъединиц, подобных той, что изображена в верхней части этого раздела. Обе субъединицы состоят из белков и РНК. РНК из ядра несет генетический код, скопированный с ДНК, которая остается в ядре. В рибосоме генетический код РНК используется для сборки и соединения аминокислот для образования белков.Рибосомы можно найти по отдельности или группами в цитоплазме, а также на RER.
Обзор
- Определите органеллу.
- Опишите структуру и функцию ядра.
- Объясните, как ядро, рибосомы, грубая эндоплазматическая сеть и аппарат Гольджи работают вместе, чтобы производить и транспортировать белки.
- Почему митохондрии называют электростанциями клетки?
- Какие роли играют везикулы и вакуоли?
- Зачем всем клеткам нужны рибосомы, даже прокариотическим клеткам, лишенным ядра и других клеточных органелл?
- Объясните эндосимбиотическую теорию применительно к митохондриям.Какое доказательство поддерживает эту теорию?
- Лизосомы и пероксисомы относятся к типам:
- A. Органеллы
- Б. Пузырьки
- C. Вакуоли
- D. И A, и B
- Какие из следующих органелл лучше всего подходят для каждого описания функции? Выбирайте только одну органеллу для каждого ответа: аппарат Гольджи, центриоли, ядрышко, ядро, шероховатый эндоплазматический ретикулум.
- а.Содержит генетические инструкции по производству белков
- г. Организует хромосомы до деления клетки
- г. Обеспечивает основу для рибосом
- г. Пакеты и этикетки белки
- e. Собирает рибосомы
- Верно или неверно. Все эукариотические клетки имеют ядро.
- Верно или неверно. Внешняя поверхность ядра эукариотической клетки не полностью твердая.
Узнать больше
Видео ниже показывает анимацию многих клеточных структур и демонстрирует их функции.



 Белки, так же как и составляющие их аминокислоты,— амфотерные соединения. Каждый белок имеет свою изоэлектрическую точку (ИЭТ). Изоэлектрическая точка соответствует значению рН, при котором молекула белка электронейтральиа и имеет минимальную растворимость. В зависимости от характера составляющих белок аминокислот, изоэлектрическая точка белков различна.
Белки, так же как и составляющие их аминокислоты,— амфотерные соединения. Каждый белок имеет свою изоэлектрическую точку (ИЭТ). Изоэлектрическая точка соответствует значению рН, при котором молекула белка электронейтральиа и имеет минимальную растворимость. В зависимости от характера составляющих белок аминокислот, изоэлектрическая точка белков различна. На каждый оборот спирали приходится 3,6 аминокислотных остатков. Спирализованные участки в полипептидной цепочке могут чередоваться с неспирализованными. Некоторые белковые молекулы имеют форму b-спирали (складчатый слой), в этом случае полипептидные цепочки свернуты как бы в виде гармоники. По конформации полипептидной цепи различают фибриллярные и глобулярные белки. Фибриллярные белки сохраняют вытянутую форму а— и b-спирали. Однако большинство белков-ферментов имеет глобулярную форму. У таких белков ос-спираль свернута в определенную глобулу. Форма расположения в пространстве полипептидных цепей, составляющих белковую молекулу, представляет собой третичную структуру белка. Третичная структура поддерживается, кроме водородных связей, гидрофобными взаимодействиями, а также дисульфидными связями, возникающими между двумя сульфгидрильными (SH) группами. Белки могут состоять из нескольких полипептидных цепочек, их взаимное расположение представляет собой четвертичную структуру.
На каждый оборот спирали приходится 3,6 аминокислотных остатков. Спирализованные участки в полипептидной цепочке могут чередоваться с неспирализованными. Некоторые белковые молекулы имеют форму b-спирали (складчатый слой), в этом случае полипептидные цепочки свернуты как бы в виде гармоники. По конформации полипептидной цепи различают фибриллярные и глобулярные белки. Фибриллярные белки сохраняют вытянутую форму а— и b-спирали. Однако большинство белков-ферментов имеет глобулярную форму. У таких белков ос-спираль свернута в определенную глобулу. Форма расположения в пространстве полипептидных цепей, составляющих белковую молекулу, представляет собой третичную структуру белка. Третичная структура поддерживается, кроме водородных связей, гидрофобными взаимодействиями, а также дисульфидными связями, возникающими между двумя сульфгидрильными (SH) группами. Белки могут состоять из нескольких полипептидных цепочек, их взаимное расположение представляет собой четвертичную структуру.