Микробиом человека: возрастные изменения и функции
Введение
Согласно современным представлениям, «микробиом» включает в себя единый микробно-тканевый комплекс, который образуют микроколонии бактерий, грибы, вирусы, простейшие и продуцируемые ими метаболиты, а также слизь (муцин), эпителиальные клетки слизистой оболочки и их гликокаликс, клетки стромы слизистой оболочки (фибробласты, лейкоциты, нейроэндокринные клетки, клетки микроциркуляторного русла и прочее) [1].
До последнего времени изучение состава и функциональной активности микробиоты человека было крайне ограничено в связи с невозможностью культивирования подавляющего большинства микроорганизмов на питательных средах. Однако развитие таких технологий, как секвенирование 16S рибосомальной РНК, а также полногеномное секвенирование позволило (в рамках двух проектов по изучению микробиома человека Human Microbiome Project и Metagenomics of Human Intestinal Tract) получить колоссальную по своим масштабам и значению информацию о составе и метаболической активности микробиоты.
На сегодняшний день считается, что соотношение микробных клеток к клеткам человека составляет 1:1, а суммарное количество клеток в составе микробиоты человека равно 1013—1014. Эти данные основаны на оценке общего количества бактериальных клеток в толстой кишке (примерно 1013), в которой, как известно, наблюдается наивысшая плотность бактериальной колонизации [2—4].
В различных отделах пищеварительного тракта состав и численность микробиоты значительно различаются (рис. 1). Наиболее скудным является микробное сообщество желудка, в котором обнаруживают представителей родов Lactobacillus, Stomatococcus, Sarcina в количестве до 102 в 1 г содержимого. В тонкой кишке, за исключением дистальных отделов подвздошной кишки, количество микроорганизмов не превышает 104—105 клеток на 1 г. Численность микроорганизмов в дистальных отделах подвздошной кишки значительно возрастает, достигая 107—108 на 1 г. При этом в проксимальных отделах тонкой кишки обнаруживаются преимущественно грамположительные аэробные бактерии, в дистальных — грамотрицательные энтеробактерии и анаэробы. Микробиота толстой кишки представлена в основном анаэробными бактериями — их общее количество достигает огромных значений — 1013 на 1 г содержимого [1—4].
При этом в проксимальных отделах тонкой кишки обнаруживаются преимущественно грамположительные аэробные бактерии, в дистальных — грамотрицательные энтеробактерии и анаэробы. Микробиота толстой кишки представлена в основном анаэробными бактериями — их общее количество достигает огромных значений — 1013 на 1 г содержимого [1—4].
Рис. 1. Численность и основные представители микробиоты различных отделов пищеварительного тракта человека [2].
Бактерии, входящие в состав микробиоты желудочно-кишечного тракта (ЖКТ) человека, условно можно разделить на представителей облигатной (около 90%), факультативной (около 10%) и транзиторной (менее 1%) микрофлоры.
К облигатной микрофлоре, постоянно присутствующей в организме человека, выполняющей важную роль в его метаболизме и защите его от возбудителей инфекционных заболеваний, относятся преимущественно анаэробные бактерии, обитающие в толстой кишке (Bifidobacterium, Propionibacterium, Bacteroides). Видовое разнообразие облигатной флоры невелико, крайне консервативно, однако численность (по сравнению с другими представителями) максимальна.
Видовое разнообразие облигатной флоры невелико, крайне консервативно, однако численность (по сравнению с другими представителями) максимальна.
К факультативной (сопутствующей) микрофлоре относятся условно-патогенные бактерии, доля которых в норме не превышает 10% (Escherichia, Enterococcus, Fusobacterium, Peptostreptococcus, Clostridium, Eubacterium и др.). Количественный и качественный состав факультативной флоры подвержен значительным изменениям в зависимости от внешних факторов.
Транзиторная флора составляет менее 1%, представлена стафилококками, клостридиями, протеями, дрожжеподобными грибами и др., в основном состоит из микроорганизмов, занесенных извне и транзитом проходящих ЖКТ. Некоторые представители транзиторной флоры могут обладать высоким адгезивным или токсигенным потенциалом, приводя (при ослаблении защитных функций облигатной микрофлоры) к развитию кишечных инфекций [1, 4].
Представители облигатной микробиоты образуют микроколонии, так называемую пристеночную флору, функционирующую в тесной взаимосвязи с кишечной стенкой. Облигатные анаэробы (бифидобактерии, бактероиды, пропионовокислые бактерии и др.) занимают нишу в непосредственном контакте с эпителием, далее располагаются аэротолерантные анаэробы (лактобациллы и др.), еще выше — факультативные анаэробы, а затем — аэробы [1].
Облигатные анаэробы (бифидобактерии, бактероиды, пропионовокислые бактерии и др.) занимают нишу в непосредственном контакте с эпителием, далее располагаются аэротолерантные анаэробы (лактобациллы и др.), еще выше — факультативные анаэробы, а затем — аэробы [1].
Следует отметить, что бактерии, обитающие в просвете кишки (около 5% от микробной популяции) и являющиеся основными представителями фекальной микрофлоры, не взаимодействуют со слизистой оболочкой. Субстратом для жизнедеятельности полостной микрофлоры являются неперевариваемые пищевые волокна, на которых она и фиксируется. Состав полостной флоры крайне непостоянен, зависит от поступления пищевых веществ и множества других факторов. Полостная флора доминирует в фекальной микрофлоре, что заставляет с особой осторожностью оценивать изменения в различных микробных популяциях, выявляемых при бактериологическом исследовании кала [1].
Крайне важным вопросом при изучении микробиома человека является геном микроорганизмов (в связи с их огромным разнообразием и принадлежностью к разным родам, видам и прочее), который содержит, по меньшей мере, в 50—100 (а по некоторым оценкам в 200) раз больше генов по сравнению с геномом организма-хозяина. Генетическое разнообразие, которое привносит в организм человека микробиота, обусловливает возникновение дополнительных (не закодированных в организме хозяина) ферментативных путей метаболизма, влияя на функционирование организма, процессы адаптации, реактивность [4—6].
Генетическое разнообразие, которое привносит в организм человека микробиота, обусловливает возникновение дополнительных (не закодированных в организме хозяина) ферментативных путей метаболизма, влияя на функционирование организма, процессы адаптации, реактивность [4—6].
Микробиом не только дополняет человеческий генный пул, но и демонстрирует значительно бóльшие пластичность и изменчивость по сравнению с человеческим геномом. Это означает, что состав микробиоты может быстро изменяться, реагируя на иммунную агрессию организма-хозяина, инфекции, новые компоненты пищевого рациона, прием антибиотиков, многие другие факторы. Способность микробиоты быстро приспосабливаться к изменяющимся условиям внешней среды путем изменения своего состава и ферментативной активности в свою очередь обеспечивает лучшую адаптацию человеческого организма к неблагоприятным факторам [6].
Сложно переоценить роль микробиоты в развитии и функционировании иммунной системы организма-хозяина. Существует точка зрения, известная как «гигиеническая теория». Данная теория гласит, что быстрый рост аллергических и аутоиммунных заболеваний, наблюдаемый в последние десятилетия в экономически развитых странах, можно объяснить нарушением формирования микробного разнообразия у современных детей как следствие улучшения гигиенических условий, чрезмерного использования дезинфектантов, моющих средств, антибиотиков. Ограничение контакта с микроорганизмами в ранние периоды развития кишечника ребенка приводит впоследствии к неспособности организма поддерживать необходимый уровень иммунологической толерантности и развитию аллергических и аутоиммунных заболеваний [4, 7—9].
Существует точка зрения, известная как «гигиеническая теория». Данная теория гласит, что быстрый рост аллергических и аутоиммунных заболеваний, наблюдаемый в последние десятилетия в экономически развитых странах, можно объяснить нарушением формирования микробного разнообразия у современных детей как следствие улучшения гигиенических условий, чрезмерного использования дезинфектантов, моющих средств, антибиотиков. Ограничение контакта с микроорганизмами в ранние периоды развития кишечника ребенка приводит впоследствии к неспособности организма поддерживать необходимый уровень иммунологической толерантности и развитию аллергических и аутоиммунных заболеваний [4, 7—9].
Несмотря на многообразие микроорганизмов, обитающих в просвете ЖКТ человека, известно, что более 90% кишечных бактерий у здоровых лиц представлены двумя основными типами (phyla) — Firmicutes и Bacteroidetes. Типы Actinobacteria и Proteobacteria представлены в меньшей мере (рис. 2).
2).
Рис. 2. Преобладающие типы бактерий различных локусов организма [21].
К типу Bacteroidetes относятся грамотрицательные бактерии, принадлежащие почти к 20 родам, к типу Firmicutes — грамположительные бактерии, принадлежащие более чем к 200 родам. Подавляющее большинство лиц в человеческой популяции имеют схожие пропорции каждого из этих типов [6]. Однако на видовом и особенно штаммовом уровне микробиота каждого человека индивидуальна [4, 10, 11].
Следует отметить, что по сей день не существует понятия «нормальной» микробиоты, поскольку состав ее индивидуален, вариабелен и зависит от возраста, пола, расы, места обитания, характера питания и многих других факторов [12].
Энтеротипы
В зависимости от доминирующего рода бактерий в составе микробиоты предложено условное выделение 3 основных ее типов — «энтеротипов». Впервые термин «энтеротип» появился в публикации журнала «Nature» в 2011 г. , получив с тех пор широкое распространение [13].
, получив с тех пор широкое распространение [13].
Энтеротипы отличаются не только составом, но и главными метаболическими путями извлечения энергии из пищевых субстратов. Так, энтеротип 1 (тип с преобладанием бактерий рода Bacteroides) характеризуется высокой сахаролитической активностью, энтеротип 2 (тип с преобладанием бактерий рода Prevotella) — способностью расщеплять гликопротеины слизи, энтеротип 3 (тип с преобладанием бактерий рода Ruminococcus) — расщеплением гликопротеинов и трансмембранным транспортом углеводов.
Основным из ключевых положений концепции об энтеротипах является устойчивость и постоянство микробного состава энтеротипа. Если состав микробиоты и подвержен изменениям в ответ на внешние факторы (прием антибиотиков, изменения пищевого рациона), то происходит это на уровне видового и штаммового разнообразия, но не приводит к смене доминирующего рода бактерий в составе энтеротипа. Считалось, что энтеротипы не имеют континентальной или национальной специфичности, изначально определяясь путем родоразрешения, методом вскармливания в грудничковый период и рационом питания в семье.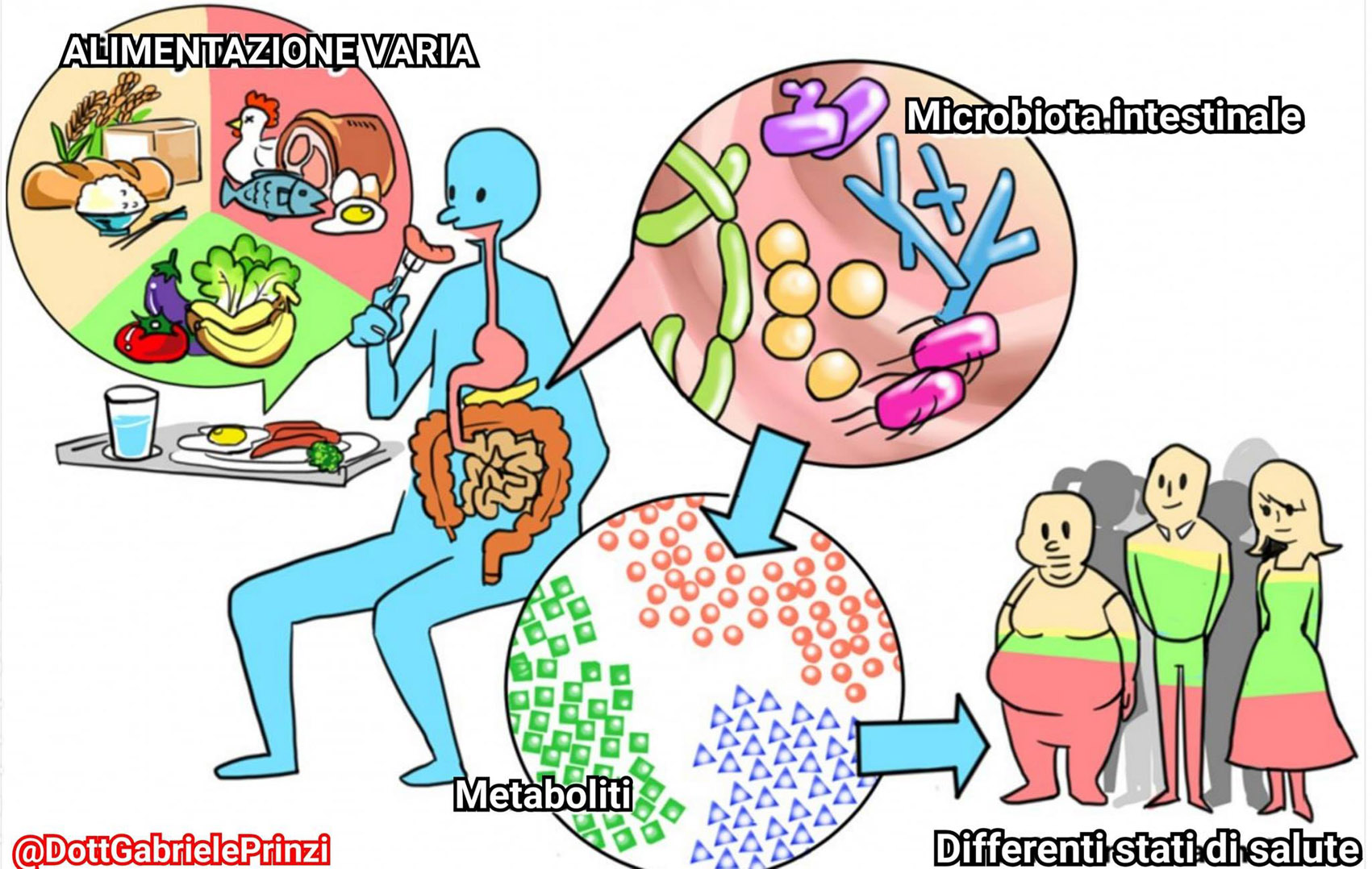 Преобладающий род бактерий в составе микробиома толстой кишки наделялся способностью определять характер метаболизма пищевых и лекарственных веществ и даже склонность к некоторым заболеваниям [13]. Большое количество экспериментальных и клинических исследований посвящено поиску ассоциаций между различными заболеваниями и энтеротипами. Так, например, обнаружено, что ожирение чаще наблюдается у лиц с преобладанием бактерий типа Firmicutes (энтеротип 3).
Преобладающий род бактерий в составе микробиома толстой кишки наделялся способностью определять характер метаболизма пищевых и лекарственных веществ и даже склонность к некоторым заболеваниям [13]. Большое количество экспериментальных и клинических исследований посвящено поиску ассоциаций между различными заболеваниями и энтеротипами. Так, например, обнаружено, что ожирение чаще наблюдается у лиц с преобладанием бактерий типа Firmicutes (энтеротип 3).
Тем не менее в настоящее время накапливается все больше данных, ставящих под сомнение концепцию энтеротипов. Считается, что столь категоричное разделение микробиоты человека на 3 энтеротипа слишком условно, тогда как в большинстве случаев имеет место некий промежуточный вариант, изменяющийся в зависимости от внешних факторов, прежде всего от характера питания, между типами с преобладанием бактерий рода Bacteroides и Prevotella [14—21].
Более того, вопреки предыдущим представлениям о значительной устойчивости энтеротипов, в некоторых экспериментальных работах наглядно показана возможность изменения энтеротипа в течение нескольких дней с дальнейшим сохранением «нового» доминирующего рода бактерий. Так, в работе D. Knights и соавт. под названием «Переосмысливая концепцию энтеротипов» (Rethinking «enterotypes») показана возможность быстрой смены энтеротипа Ruminococcus на энтеротип с преобладанием Bacteroides, а также энтеротипа Bacteroides на энтеротип Prevotella [17]. В целом у большинства наблюдаемых субъектов с течением времени (5—10 лет) зафиксирована смена энтеротипа, что поставило под сомнение идею об устойчивости и постоянстве энтеротипов, а значит и целесообразность подобной классификации [14, 17].
Так, в работе D. Knights и соавт. под названием «Переосмысливая концепцию энтеротипов» (Rethinking «enterotypes») показана возможность быстрой смены энтеротипа Ruminococcus на энтеротип с преобладанием Bacteroides, а также энтеротипа Bacteroides на энтеротип Prevotella [17]. В целом у большинства наблюдаемых субъектов с течением времени (5—10 лет) зафиксирована смена энтеротипа, что поставило под сомнение идею об устойчивости и постоянстве энтеротипов, а значит и целесообразность подобной классификации [14, 17].
В связи с этим возник закономерный вопрос о правомочности рассмотрения тех или иных энтеротипов как маркеров, ассоциированных с развитием определенных заболеваний. Требуются дальнейшие исследования для ответа на указанные вопросы, однако уже сейчас очевидно, что взаимодействия между бактериальными родами в составе микробиоты кишечника значительно сложнее, чем представлялось ранее.
Микробиота здорового человека и ее развитие в течение жизни
Становление микробиоты человека начинается еще в период внутриутробного развития в полости матки. Бактерии обнаруживаются в околоплодной жидкости, пупочном канатике, оболочках плода, плаценте и меконии. Видовой состав этих бактерий в большей степени соответствует микробиоте кишечника и ротовой полости матери (например, Fusobacterium spp. и Bacteroides spp.). Предполагается, что бактерии из полости рта через микроповреждения слизистой оболочки могут попадать в системный кровоток, гематогенным путем достигать плаценты и колонизировать ее [22].
Бактерии обнаруживаются в околоплодной жидкости, пупочном канатике, оболочках плода, плаценте и меконии. Видовой состав этих бактерий в большей степени соответствует микробиоте кишечника и ротовой полости матери (например, Fusobacterium spp. и Bacteroides spp.). Предполагается, что бактерии из полости рта через микроповреждения слизистой оболочки могут попадать в системный кровоток, гематогенным путем достигать плаценты и колонизировать ее [22].
Существуют работы, показывающие ассоциацию между заболеваниями периодонта у матери и повышением риска преждевременных родов и внутриутробных инфекций плода [22, 23]. Таким образом, микробиом матери может быть как источником первых бактерий, колонизирующих ЖКТ плода, так и причиной патологических состояний. В ходе ряда исследований выявлены следующие перинатальные факторы, оказывающие негативное влияние на микробиоту новорожденного и/или плаценты: чрезмерный набор массы тела и избыточное содержание жира в рационе матери во время беременности, инфекционные заболевания, стрессы, сахарный диабет [22, 23].
Активное заселение пищеварительного тракта микробами начинается в процессе родов, и происходит это за счет бактерий, входящих в состав микробиоты влагалища, кожи, кишечника, ротовой полости матери (Lactobacillus, Prevotella, Sneathia). Способ родоразрешения в значительной мере определяет видовой состав микробиоты младенцев. У детей, рожденных посредством кесарева сечения, заселение кишечника бактериями рода Bacteroides и Bifidobacterium запаздывает, по меньшей мере, на 1 мес по сравнению с детьми, рожденными естественным путем (рис. 3). В составе микробиоты таких детей доминируют виды, колонизирующие кожные покровы, а не родовые пути матери, такие как Staphylococcus, Corynebacterium и Propionibacterium, наблюдается активное размножение бактерий вида Clostridium difficile. Для микробиоты детей, родившихся посредством кесарева сечения, характерно снижение микробного разнообразия, у них повышен риск развития аллергических и аутоиммунных заболеваний, таких как бронхиальная астма, аллергический ринит, целиакия и прочее [22, 23].
Рис. 3. Факторы, влияющие на состав микробиоты ЖКТ в течение жизни [23].
Большое значение для состава микробиоты кишечника имеет также срок родоразрешения. У недоношенных детей наблюдается снижение разнообразия кишечной микробиоты, низкое содержание лакто- и бифидобактерий (Lactobacillus spp., Bacteroides spp. и Bifidobacterium spp). Считается, что это может быть связано не столько с недоношенностью, сколько с применением антибиотиков, пребыванием в палатах интенсивной терапии и другими ятрогенными факторами. Нарушение состава кишечной микробиоты у недоношенных детей ассоциировано с развитием некротизирующего энтероколита, тяжелых воспалительных процессов в ЖКТ [22, 23].
Роль питания в раннем детском возрасте в формировании микробиоты толстой кишки
В 1-й год жизни микробиота младенцев характеризуется относительно невысоким микробным разнообразием. Постепенно, в зависимости от метода вскармливания и обширности контакта с окружающей средой (наличие животных в доме, число братьев и сестер, гигиенические условия, применение антибиотиков), таксономическое разнообразие микробиоты толстой кишки значительно обогащается (см. рис. 3) [22, 23]. Большое значение в становлении микробиоты кишечника ребенка имеет метод вскармливания (грудное вскармливание или искусственные смеси). Грудное молоко не стерильно, оно содержит до 600 видов различных бактерий, численность бактерий в 1 мл молока достигает 103—104. Большую часть бактерий грудного молока составляют бактерии родов Lactobacillus, Leuconostoc, Streptococcus, Enterococcus, Lactococcus, Weissella, Bifidobacterium. Кроме того, в грудном молоке могут присутствовать грамотрицательные бактерии Serratia, Pseudomonas, а также типичные представители микробиома полости рта Veillonella, Leptotrichia, Prevotella [24—30].
рис. 3) [22, 23]. Большое значение в становлении микробиоты кишечника ребенка имеет метод вскармливания (грудное вскармливание или искусственные смеси). Грудное молоко не стерильно, оно содержит до 600 видов различных бактерий, численность бактерий в 1 мл молока достигает 103—104. Большую часть бактерий грудного молока составляют бактерии родов Lactobacillus, Leuconostoc, Streptococcus, Enterococcus, Lactococcus, Weissella, Bifidobacterium. Кроме того, в грудном молоке могут присутствовать грамотрицательные бактерии Serratia, Pseudomonas, а также типичные представители микробиома полости рта Veillonella, Leptotrichia, Prevotella [24—30].
Одним из компонентов грудного молока являются олигосахариды (галактоолигосахариды). Незначительно расщепляясь в тонкой кишке, они достигают толстой кишки преимущественно в непереваренном виде, где ферментируются Bifidobacterium с образованием короткоцепочечных жирных кислот (КЦЖК) и молочной кислоты. Таким образом, присутствие в молоке олигосахаридов обусловливает размножение в кишечнике детей, находящихся на грудном вскармливании, грамположительных бактерий типа Actinobacteria (преимущественно бифидобактерий), сдерживающих размножение бактерий других типов [20, 22, 23, 31, 32].
Таким образом, присутствие в молоке олигосахаридов обусловливает размножение в кишечнике детей, находящихся на грудном вскармливании, грамположительных бактерий типа Actinobacteria (преимущественно бифидобактерий), сдерживающих размножение бактерий других типов [20, 22, 23, 31, 32].
Большинство современных молочных смесей обогащено олигосахаридами, что теоретически должно способствовать развитию бактерий рода Bifidobacterium. Однако у детей, находящихся на искусственном вскармливании, обнаруживаются такие изменения состава микробиоты толстой кишки, как чрезмерное развитие представителей Bacteroides и Clostridium, увеличение доли условно-патогенных видов бактерий, например Escherichia coli, Clostridium difficile [33—36]. Вероятно, влияние грудного молока на становление микробиоты толстой кишки младенца обусловлено не только олигосахаридами. Помимо них, грудное молоко содержит иммуноглобулины IgA и IgG, антимикробные вещества — лизоцим и лактоферрин, интерлейкин (ИЛ) ИЛ-10, лимфоциты, фактор роста опухоли TGF-β, модулирующие работу иммунной системы ребенка и влияющие на состав микроорганизмов, которые смогут прижиться в его ЖКТ [29, 37—39]. Известно, что добавление к рациону искусственно вскармливаемых детей пастеризованного человеческого молока способствует становлению микробиоты, близкой по составу к таковой у детей, находящихся на грудном вскармливании [36].
Известно, что добавление к рациону искусственно вскармливаемых детей пастеризованного человеческого молока способствует становлению микробиоты, близкой по составу к таковой у детей, находящихся на грудном вскармливании [36].
После введения прикорма в рацион ребенка происходит значительное изменение микробного сообщества толстой кишки, характеризующееся снижением доли Bifidobacterium наряду с активизацией размножения бактерий, ферментирующих полисахариды (типов Bacteroidetes или Firmicutes) [40—42].
Примерно к 3 годам у ребенка формируется взрослый тип микробиоты, который в отсутствие тяжелых заболеваний, кардинальных изменений в диетических пристрастиях или длительного приема антибиотиков характеризуется постоянством состава на уровне доминирующего типа бактерий.
Влияние антибиотикотерапии в раннем детском возрасте на формирование микробиоты толстой кишки
Применение антибиотиков в раннем детском возрасте приводит к значительному снижению микробного разнообразия, обеднению представителей преобладающего типа Actinobacteria с одновременным увеличением доли Proteobacteria, а также селекции антибиотикорезистентных штаммов [43—45].
В работе S. Tanaka и соавт. проанализирован результат антибиотикотерапии препаратами широкого спектра действия в течение первых 4 дней жизни детей [46]. Согласно полученным данным, в 1-ю неделю в составе микробиоты толстой кишки наблюдалось снижение доли Bifidobacterium наряду с патологической колонизацией Enterococcus. В течение последующего месяца зафиксирован избыточный рост Enterobacteriaceae и Enterococcus.
В целом данные эпидемиологических исследований свидетельствуют о том, что применение антибиотиков в раннем детском возрасте сопровождается значительными изменениями еще несформированной микробиоты, нередко приводя к непрогнозируемым и серьезным последствиям. Известно, что лечение антибиотиками повышает у детей риск развития таких заболеваний, как астма, экзема, сахарный диабет 1-го типа, воспалительные заболевания кишки, ожирение и др. [47].
Факторы, оказывающие влияние на состав микробиоты взрослых людей
Кроме возраста, на состав микробиоты человека влияют такие факторы, как пол, пищевые предпочтения, социально-экономический статус и уровень образования, прием антибиотиков и прочее. Имеют значение и географические различия, предположительно связанные с характером питания. У взрослого человека со сформировавшейся микробиотой характер питания не является главным фактором, определяющим ее состав, но некоторые бактериальные таксоны (например, энтеротип 1 с преобладанием бактерий рода Bacteroidetes) могут быстро реагировать на изменения пищевого рациона [48].
Имеют значение и географические различия, предположительно связанные с характером питания. У взрослого человека со сформировавшейся микробиотой характер питания не является главным фактором, определяющим ее состав, но некоторые бактериальные таксоны (например, энтеротип 1 с преобладанием бактерий рода Bacteroidetes) могут быстро реагировать на изменения пищевого рациона [48].
Так, употребление в пищу продуктов с высоким содержанием пищевых волокон приводит к увеличению в составе микробиоты доли определенных видов бактерий (Roseburia, Blautia, Eubacterium rectale, Faecalibacterium prausnitzii), ферментирующих растительные волокна с образованием бутирата, а также некоторых бактерий, относящихся к типам Actinobacteria (Bifidobacteria, Lactobacilli) и Bacteroidetes [49—52]. Известно, что доминирующими бактериями в микробиоте вегетарианцев являются Prevotella, Clostridium clostridioforme и Faecalibacterium prausnitzii [50, 53]. По сравнению с лицами, употребляющими животные продукты, у вегетарианцев наблюдается снижение доли бактерий, принадлежащих к Bacteroides, Bifidobacteria, Enterobacteriaceae species [54].
По сравнению с лицами, употребляющими животные продукты, у вегетарианцев наблюдается снижение доли бактерий, принадлежащих к Bacteroides, Bifidobacteria, Enterobacteriaceae species [54].
Высокобелковая диета характеризуется увеличением активности протеолитических бактерий, таких как, например, Bacteroides spp. [49, 50]. Богатая жирами диета приводит к синтезу большого количества желчных кислот, что в свою очередь способствует размножению тех бактерий, которые метаболизируют эти кислоты, и угнетает размножение других видов [49, 50]. Диеты с преобладанием животных продуктов способствуют развитию бактерий, устойчивых к желчным кислотам, таких как Bacteroides, Alistipes и Bilophila, а также бутират-продуцирующих клостридий [50, 53].
Таким образом, преобладание в пищевом рационе одного из макронутриентов (белков, жиров, углеводов) детерминирует развитие определенных видов бактерий в составе микробиоты толстой кишки (рис. 4) [22, 23].
4) [22, 23].
Рис. 4. Развитие определенных видов бактерий в составе микробиоты толстой кишки в зависимости от преобладания в пищевом рационе одного из макронутриентов (белков, жиров, углеводов) [58].
Например, «западная диета», распространенная в экономически развитых странах Европы и Северной Америки, изобилует жирами, рафинированными углеводами, животными белками на фоне крайне низкого содержания растительных волокон. Такая диета ассоциирована со снижением микробного разнообразия, увеличением доли Bacteroides и снижением бактерий рода Prevotella [49].
В развивающихся странах с низким социально-экономическим статусом (особенно в сельской местности) пищевой рацион жителей, напротив, богат растительными волокнами, сложными углеводами (за счет наличия большого количества свежих овощей, фруктов и цельнозерновых продуктов). Микробиота толстой кишки людей, проживающих в данных регионах, характеризуется разнообразием видов бактерий (Prevotella, Succinivibrio, Treponema), ферментирующих полисахариды и образующих КЦЖК [22, 23, 53, 55, 56].
КЦЖК, образующиеся в процессе ферментации пищевых волокон, являются ключевыми субстратами в энергетическом метаболизме колоноцитов, играют важнейшую роль в нормальном функционировании барьерной функции кишки, модулируют работу иммунной системы организма-хозяина. Считается, что низкой продукцией КЦЖК у людей, предпочитающих «западную диету», можно объяснить возросшую распространенность аллергических и аутоиммунных заболеваний в экономически развитых странах [57].
Развитие определенных видов бактерий в составе микробиоты толстой кишки в зависимости от преобладания в пищевом рационе одного из макронутриентов (белков, жиров, углеводов) представлено на рис. 4 [58].
Возможность влияния на состав микробиоты и ее метаболическую активность путем изменения характера питания (увеличение доли свежих овощей и фруктов в рационе, применение пищевых волокон, способствующих развитию бутиратпродуцирующей флоры) представляется перспективным направлением современной медицины.
Микробиом у людей пожилого возраста
Микробиом ЖКТ у пожилых людей характеризуется тенденцией к снижению доли бактерий, относящихся к типу Bacteroidetes и роду Bifidobacteria, с одновременным увеличением доли бактерий Firmicutes [59]. Согласно данным нескольких исследований, редукция бактерий видов Bacteroides spp., Prevotella spp., Faecalibacterium prausnitzii наряду с увеличением бактерий семейства Enterobacteriaceae ассоциирована со снижением качества жизни у людей пожилого возраста [59—61]. Считается, что факторами, способствующими изменениям микробиоты кишки в пожилом возрасте, являются прием большого количества медикаментов, изменения гормонального статуса и рациона питания, тяжелые соматические заболевания, пребывание в пансионах для престарелых лиц [62]. Кроме того, неблагоприятные сдвиги состава микробиоты полости рта, происходящие в пожилом возрасте, также оказывают значительное влияние на состояние микробиоты ЖКТ [63].
Функции кишечной микробиоты
Симбиотические отношения между кишечной микробиотой и макроорганизмом включают метаболические, иммунные и нейроэндокринные взаимодействия. Доказано, что микробиота задействована в важнейших процессах жизнедеятельности организма, таких как обмен веществ, развитие, дифференцировка и колонизационная резистентность эпителия, формирование врожденной и адаптивной иммунной систем. Микробиота обеспечивает трофику кишечного эпителия, синтез витаминов, метаболизм пищевых компонентов, холестерина, желчных кислот, регулирует моторику кишечника [4].
Основные функции микробиоты кишечника и связанные с ней ключевые метаболиты представлены в таблице [64].
Метаболиты кишечной микробиоты и их функции [64]
Многие хронические заболевания, например ожирение, воспалительные заболевания кишки, сахарный диабет, метаболический синдром, атеросклероз, неалкогольная болезнь печени и даже цирроз и гепатоцеллюлярная карцинома, ассоциированы с развитием дисбаланса в составе микробиоты ЖКТ (рис. 5) [64].
Рис. 5. Заболевания, ассоциированные с нарушением микробиома [12].
ВЗК — воспалительные заболевания кишечника.
Механизмы, в силу которых симбиотические микроорганизмы могут способствовать или, напротив, препятствовать развитию перечисленных заболеваний, включают следующее [1, 4, 12, 64]:
— увеличение энергетической ценности пищи за счет бактериальной ферментации нутриентов, не подвергающихся расщеплению ферментами пищеварительного тракта человека;
— влияние на аппетит;
— метаболизм ксенобиотиков;
— метаболизм желчных кислот;
— синтез витаминов;
— синтез КЦЖК;
— обеспечение колонизационной резистентности слизистой оболочки кишки и синтез антимикробных веществ;
— участие в развитии и созревании местного иммунитета слизистой оболочки пищеварительного тракта и иммунной системы организма-хозяина;
— участие в развитии и созревании нервной системы;
— регуляция метаболизма липидов и гомеостаза глюкозы.
Метаболизм веществ и энергии
Анализ образцов фекалий человека с использованием секвенирования 16S рибосомальной РНК и методов метагеномного секвенирования показал значительное расширение путей метаболизма белков, полисахаридов, аминокислот, ксенобиотиков и микроэлементов за счет ферментов, синтезируемых микробиотой кишечника [12].
Доказано, что кишечная микробиота значительно повышает эффективность расщепления и усвоения пищевых веществ. И если раньше так называемое симбионтное пищеварение, происходящее при содействии микрофлоры, считалось прерогативой жвачных животных, то теперь стало очевидно, что в процессе бактериальной ферментации неперевариваемых углеводов в анаэробных условиях образуются КЦЖК (уксусная, пропионовая и масляная кислоты), являющиеся важнейшими энергетическими субстратами для эпителиальных тканей человека [12].
Известно, что до 70% молекул АТФ колоноциты синтезируют из КЦЖК, преимущественно бутирата. В целом ферментация бактериями непереваренных пищевых волокон способствует более эффективному извлечению энергии (на 10%) из пищи. В норме микробиота кишечника синтезирует около 50—100 ммоль/л КЦЖК в день, которые практически полностью всасываются в кишечнике [12].
Всосавшиеся в кровоток из просвета кишки КЦЖК оказывают многообразное действие на функционирование различных органов и систем макроорганизма. Например, активизируют моторику кишки, являясь субстратами для глюконеогенеза и липогенеза, регулируют липидный и углеводный обмен в печени, активность воспалительных процессов [12].
Метаболизм желчных кислот
Как известно, в организме человека желчные кислоты синтезируются в печени из холестерина, конъюгируются с таурином или глицином (первичные желчные кислоты) и выделяются в двенадцатиперстную кишку, участвуя в эмульгировании и абсорбции жиров. В дальнейшем 95% первичных желчных кислот реабсорбируется в дистальной части подвздошной кишки, в то время как оставшиеся 5% неабсорбированных первичных желчных кислот подвергаются трансформации (деконъюгации) до вторичных желчных кислот (дезоксихолевая кислота и литохолевая кислота) с участием гидролаз кишечных бактерий (преимущественно за счет ферментов Clostridium perfringens и Clostridium scindens). Часть вторичных желчных кислот в последующем вновь реабсорбируется в печень, где происходит их конъюгация. Неабсорбированные желчные кислоты выводятся с калом.
Важно, что первичные и вторичные желчные кислоты способны активировать ядерный фарнезоидный рецептор Х (FXR) в ядре клеток организма-хозяина. Данный рецептор регулирует синтез желчных кислот, метаболизм глюкозы и даже процессы аутофагии печеночных клеток. Кроме того, вторичные желчные кислоты обладают мощным антимикробным действием, ингибируя рост и размножение бактерий.
Взаимодействие микробиоты с иммунной и нервной системами
Кишечный барьер, состоящий из нескольких функциональных компонентов, включающих физические (эпителиальные и слизистые слои), биохимические (ферменты и антимикробные белки) и иммунологические (IgA и эпителиальные иммунные клетки) факторы, служит границей между внешним миром и внутренней средой организма. Повышение проницаемости кишечного барьера для микробных метаболитов и других компонентов, содержащихся в полости кишки, ведет к развитию воспалительных или патологических иммуновоспалительных реакций [64].
Для поддержания кишечного гомеостаза и толерантности иммунной системы к бактериям-симбионтам разграничения патогенов и комменсальных микробов необходимы соблюдение очень тонкого баланса между регуляторными (Т-лимфоциты супрессоры) и эффекторными (Т-лимфоциты хелперы) клетками, гармоничное сочетание «иммунологической толерантности и продуктивного иммунного ответа». Значительную роль в созревании иммунной системы и развитии иммунологической толерантности отводят кишечной микробиоте.
Исследования, проведенные на мышах-гнотобионтах (безмикробные животные, с рождения выращиваемые в стерильных условиях), показали, что у таких животных имеются тяжелые нарушения развития лимфоидной ткани кишки и других иммунокомпетентных органов, а также нарушена продукция антител [65, 66].
Известно, что некоторые условно-патогенные микроорганизмы, такие как Bacteroides fragilis, Bifidobacterium infantis и Firmicutes, способствуют привлечению в стенку кишки регуляторных Т-лимофцитов (Т-супрессоров), продуцирующих противовоспалительные ИЛ, подавляя развитие патологических иммунных реакций. Такое «толерантное» состояние иммунной системы позволяет симбиотическим микроорганизмам мирно существовать, тесно контактируя с эпителиоцитами кишечной стенки, не вызывая иммунной агрессии со стороны организма-хозяина [64].
В то же время из экспериментов на мышах известно, что так называемые нитевидные бактерии, напротив, обладают мощным иммуностимулирующим действием, активируя Т-хелперы 17, индуцируя продукцию ими провоспалительных ИЛ-17 и ИЛ-22, тем самым усиливая антимикробную защиту и резистентность слизистой оболочки кишки к Citrobacter rodentium [67].
Таким образом, правильное взаимодействие Т-супрессоров/Т-хелперов 17, регулируемое в том числе микробными метаболитами, имеет важнейшее значение в поддержании целостности кишечного барьера, иммунологической толерантности, предотвращении развития патологических иммунных реакций, и в то же время препятствует инвазии патогенов.
Конечно, не все представители микробиоты кишки ведут к здоровому и правильному развитию и функционированию кишечного барьера, некоторые из них, напротив, могут вызывать воспалительные процессы, приводить к возникновению злокачественных новообразований. Однако на современном этапе развития учения о микробиоте наше понимание данных процессов еще далеко от совершенства [12].
Интересно, что кишечная микробиота играет немаловажную роль в созревании и нормальном функционировании нервной системы организма-хозяина.
Механизмы влияния микробиоты на функционирование центральной нервной системы (ЦНС) связаны с выработкой молочной кислоты, аммиака, КЦЖК, нейротрансмиттеров. Так, например, в процессе ферментации углеводов некоторыми молочнокислыми бактериями образуется D-лактат, который в случае повышения кишечной проницаемости способен оказывать нейротоксическое действие [4].
Аммиак — нейротоксин, продуцируемый из мочевины под действием бактериальной уреазы. Аммиак обладает прямыми нейротоксическими свойствами, изменяет функцию гематоэнцефалического барьера, тормозит синтез серотонина и допамина [4].
КЦЖК, продуцируемые микробиотой, напротив, оказывают позитивное влияние на функционирование нервной системы, принимая участие в созревании микроглии (резидентных макрофагов) ЦНС. Исследования, проведенные на мышах с дефектом развития рецепторов к КЦЖК, показали нарушение созревания микроглии в ЦНС у таких животных. В то же время колонизация кишечника мышей гнотобионтов нормальной микробиотой приводила к созреванию первоначально незрелой микроглии [68, 69].
Известно также, что некоторые бактерии способны синтезировать гормоны и нейротрансмиттеры, такие как ацетилхолин и гамма-аминомасляную кислоту (ГАМК), норадреналин, серотонин, мелатонин, допамин, глутамин [4]. Серотонин, продуцируемый микробиотой кишечника, участвует в регуляции перистальтики кишки, рвотного рефлекса и восприятии боли через спинальные афферентные нейроны [4]. Выделение серотонина и других биогенных аминов обусловливает влияние микробиоты кишки на настроение, аппетит, пищевые пристрастия человека [4].
ГАМК — антистрессорный медиатор, продуцируется в больших количествах микробиотой кишки, образуя единый пул с эндогенной фракцией ГАМК. Изменение уровня ГАМК у пациентов с синдромом раздраженного кишечника, возможно, объясняет склонность больных к повышенной возбудимости и тревожности, а также пониженный болевой порог у данной группы пациентов по сравнению со здоровыми субъектами.
Колонизационная резистентность
Еще одной важной ролью микробиоты кишечника является формирование колонизационной резистентности, предотвращающей инвазию патогенных микроорганизмов в слизистую оболочку кишки.
Колонизационная резистентность обеспечивается способностью нормальной микрофлоры адгезироваться на эпителии кишечника, которая образует на ней пристеночный слой и тем самым препятствует прикреплению патогенных и условно-патогенных микроорганизмов. Другой механизм создания колонизационной резистентности связан с синтезом микробиотой кишки антимикробных веществ (органических кислот, перекиси водорода и других биологически активных субстанций), а также с конкуренцией с патогенными микроорганизмами за источники питания [4].
Заключение
До последнего времени изучение состава и функциональной активности микробиоты человека было ограничено в связи с невозможностью культивирования подавляющего большинства микроорганизмов на питательных средах. Однако развитие таких технологий, как секвенирование 16S рибосомальной РНК, а также полногеномное секвенирование, позволило значительно расширить понимание роли кишечной микробиоты и ее уникальных метаболитов в регуляции различных физиологических функций макроорганизма, включая обеспечение колонизационной резистентности слизистых оболочек, метаболизм, развитие и гомеостаз иммунной и нервной систем.
Интерес к микробиому человека за последние десятилетия существенно вырос, и все же на современном этапе развития учения о микробиоте понимание данных процессов еще далеко от совершенства, что обусловливает необходимость дальнейших исследований.
Авторы заявляют об отсутствии конфликта интересов.
Проект «Микробиом человека» установил связь микробиоты с воспалением кишечника, диабетом и преждевременными родами. И предсказал развитие диабета у одной пациентки еще до появления классических симптомов — Наука
«Микробиом человека» — это проект, объединивший десятки ученых с разных концов США для того, чтобы провести всеобщую перепись микроскопических симбионтов человека, настолько подробную, насколько это возможно. А поскольку набор бактерий у людей довольно сильно различается, то, чтобы найти какие-то общие закономерности, приходится собирать тысячи образцов. На первом этапе работы проекта исследователи составили портрет здоровой микрофлоры, а также создали базу геномов бактерий кишечника, кожи и влагалища.
В новом номере Nature проект отчитывается о втором пройденном этапе. На этот раз предметом исследования стали отдельные заболевания, у которых ученые пытались найти бактериальную компоненту.
Первая статья посвящена воспалениям кишечника — болезни Крона и язвенному колиту. Изучив анализы у 132 больных в течение года, авторы обнаружили, что наиболее распространенных жителей кишечника у пациентов становится меньше. Соответственно, становится меньше и производимых этими бактериями короткоцепочечных жирных кислот, которые кормят клетки стенки кишечника и передают сигналы в мозг человека, в том числе сигнал о насыщении. На место привычных бактерий приходят новые оппортунистические виды. В ответ на это в стенке кишечника развивается воспаление, поэтому чужаки в кишечнике надолго не задерживаются. Так или иначе, микрофлора больных людей постоянно изменяется, приближаясь к здоровому составу в периоды ремиссии.
Вторая ветвь проекта работала с преждевременными родами. Исследователи предположили, что они тоже могут быть вызваны изменением состава микробиома. И действительно, в случаях, если беременность закончилась раньше срока, во влагалище матерей было крайне мало бактерий Lactobacillus, в то время как у здоровых матерей, родивших в срок, их популяция была весьма существенна. Как правило, первый триместр беременности сопровождается легким воспалением — реакцией на изменения в стенке матки и появление инородного тела. Затем, во втором триместре, иммунный ответ, наоборот, затихает, чтобы не мешать развитию зародыша, и усиливается в третьем: роды становятся кульминацией отторжения плода. Судя по всему, преждевременные роды вызваны именно воспалением: начавшись в первом триместре, оно больше не прекращается, поскольку бактерий, которые должны его подавлять, оказывается недостаточно. Интересно, что чаще преждевременные роды встречаются у женщин африканского происхождения, поэтому следующим этапом работы должны стать поиски корреляций между микробиотой и генетическими особенностями пациенток.
Третьим направлением исследований стал предиабет — крайне актуальная (по крайней мере для США) проблема. Первые признаки диабета (которые и называют предиабетом) появляются почти у каждого третьего американца, и в 70% случаев они превращаются в полноценную болезнь. Но несмотря на то, что на ранних стадиях пациенты отличаются от здоровых людей почти одной лишь устойчивостью к инсулину, на микробном и иммунологическом уровне различия оказались гораздо сильнее. Выяснилось, что у людей с предиабетом повышено количество провоспалительных белков, то есть организм существует в режиме постоянного «воспаления». Однако когда они заболевают респираторной вирусной инфекцией, то ответ на нее развивается слабее и позже, чем у здоровых людей, а микробный состав носовой полости изменяется гораздо меньше.
В нескольких случаях работа ученых приобрела предсказательную силу. У одного пациента они обнаружили отклонения в анализах крови, свидетельствующих о проблемах с печенью, а пять месяцев спустя медики диагностировали у него стеатоз (накопление жира) в печени. Еще у одной пациентки с предиабетом исследователи заметили повышение провоспалительных маркеров и продукты жизнедеятельности микробов, свидетельствующие о нарушении обмена глюкозы. Официальный диагноз «диабет» ей поставили лишь через 10 месяцев, так что можно считать, что ученым удалось поймать самые ранние признаки болезни по микробиоте задолго до появления симптомов.
Однако над разработкой ранней диагностики болезней по микрофлоре участникам проекта еще только предстоит трудиться. На первых двух этапах они были заняты скорее сбором данных и поиском направлений для будущей работы.
Полина Лосева
может ли человек поменять структуру своего микробиома — РТ на русском
Человек способен изменить структуру своего микробиома — совокупности всех бактерий в организме, если будет вести здоровый образ жизни. К такому выводу пришли учёные израильского Института Вейцмана. Согласно новому исследованию, на генетическом уровне формируется лишь 2%, остальные 98% зависят от внешних факторов. RT разбирался, действительно ли человек может «перевоспитать» свой организм.
Новый взгляд на микробиом человека — совокупность всех бактерий в организме, содержащихся в кишечнике, дыхательных путях, крови и так далее, — предложили генетики из израильского Института Вейцмана. Главную роль в формировании микробиома учёные отвели не генетическим факторам, как считалось раньше, а окружающей среде и привычкам человека. Согласно результатам исследования специалистов, генетике в этом процессе отводится лишь 2%, остальные 98% — это внешние факторы.
Структура микробиома определяет потребность организма в микроэлементах и предрасположенность человека к различным заболеваниям: ожирению, сахарному диабету, заболеваниям кожи, расстройствам психики. Некоторые исследователи считают, что микробиом даже определяет предрасположенность к раку.
«Изучение микробиоты и микробиомы человека и их связи с различными заболеваниями — это мейнстрим современной науки последних пяти лет. Этим вопросом интенсивно занимаются и в нашем институте», — сообщил в беседе с RT заведующий отделом генетических основ биотехнологии Института общей генетики им. Н.И. Вавилова РАН Валерий Даниленко.
Эксперт добавил, что микробиота кишечника — это такой же орган, как сердце, печень, почки и другие органы. Существуют параметры, которые характеризуют нормальное состояние микробиоты: «композиция определённых видов и родов бактерий, композиция конкретных генов, которые содержат эти бактерии».
Также по теме
Вечная молодость: как учёные из России и США ищут способы продления жизни
Российские учёные занимаются активным поиском способов продлить человеческую жизнь, избавив людей от недугов, связанных с возрастом….
Чтобы изучить факторы, формирующие микробиом, израильские специалисты проанализировали базу данных около 1000 жителей страны, участвовавших в долгосрочном исследовании индивидуального питания. В распоряжении учёных имелись генетические данные и составы микробиом испытуемых, а также информация об их образе жизни, питании и принимаемых медикаментах. Анализируя собранные данные, исследователи пришли к выводу, что питание и образ жизни являются определяющими факторами, которые и формируют состав микробиома.
Далее учёные задались вопросом: если микробиом не определяется генетикой, то как он «общается» с генами человека и влияет на здоровье? Для ответа на этот вопрос генетики исследовали связь между микробиомом и уровнем холестерина, глюкозы в крови, весом и другими клиническими показателями. Оказалось, что для большинства этих медицинских факторов связь с геномами бактерий была почти всегда сильнее, чем связь с геномом человека.
- Медицинский работник в генетической лаборатории
- РИА Новости
«Если знать, какие факторы на самом деле формируют наш микробиом, то, вероятно, нам будет легче лечить многие заболевания. Мы не в силах изменить наши гены, но теперь мы знаем, что можем влиять и даже изменять состав различных бактерий в наших телах. Результаты нашего проекта многообещающие: они предполагают, что микробиом может быть весьма сильным инструментом для улучшения здоровья», — сообщил автор исследования Эран Сигал.
Спор о процентах
«Исследования на однояйцевых близнецах, которые проводились в начале 2000-х годов и проводятся до сих пор, показали, что состав структуры микробиоты человека зависит от его генотипа. В какой степени — это уже другой вопрос. Насчёт заявленных израильскими учёными 2% общего мнения пока нет», — сообщил Валерий Даниленко.
По словам эксперта, композиция видов и родов бактерий, кроме генетики, зависит от ряда других факторов: условий питания, иммунного статуса человека, стрессовых условий, экологии, а также частоты приёма антибиотиков.
«Практически при всех заболеваниях наблюдаются изменения состава микробиоты», — отметил Даниленко.
Наша задача — научиться приводить микробиом в нормальное состояние. По словам Даниленко, для этого используется ряд подходов коррекции микробиоты: применение антибиотиков, селективных агентов, фармобиотиков.
«Утверждение, что только 2% зависит от генотипа, на мой взгляд, сомнительное. Есть целый ряд факторов, влияющих на состав микробиоты. Это орган, который взаимодействует с мозгом, иммунной системой, печенью и так далее. Но никто генотип не отменял, персонализированную медицину тоже не отменял. Все эти проблемы будут обсуждаться на мировом конгрессе по микробиому, который пройдёт в июне 2018 года в Ирландии», — заключил Даниленко.
Ученые: у каждого человека — свое личное облако микробов
Автор фото, Thinkstock
Подпись к фото,
В организме любого человека живут десятки тысяч различных бактерий, уверяют ученые
Каждый человек окутан индивидуальным «облаком», состоящим из миллионов его собственных бактерий, утверждают ученые из американского Университета Орегона.
Нельзя пройти мимо другого человека и не унести на своей коже и в легких часть его бактерий. Передача также происходит воздушно-капельным путем или через частички кожи, оставляемые каждым из нас.
Ранее уже было доказано, что микробиом человека – набор бактерий, вирусов и грибков, живущих на коже и в организме – по численности может превосходить его собственные клетки в 10 раз.
Людей на четыре часа поместили в закрытое, вентилируемое помещение, после чего ученые собрали частицы так называемого бактериального облака, осевшие на посуде и других бытовых предметах.
«Мы ожидали, что следы микробиома будут заметны в воздухе вокруг каждого отдельного человека, но, к нашему удивлению, произошло куда большее: мы смогли определить почти всех [участников эксперимента] лишь по частицам, которые они оставили после себя», — заявил один из исследователей, доктор Джеймс Медоу.
Что по нам ползает?
«У каждого человека есть свой особый запах, он обусловлен тем, что по нам ползает. Если задумываться об этом, то жить рядом с другими людьми будет очень противно», — сказал в интервью Би-би-си микробиолог из британского Университета Рединга Бен Ньюман.
По его словам, новые данные абсолютно вписываются в то, что уже известно о микробиоме, и показывают, что путем передачи бактерий люди «все время меняют друг друга».
Так надо ли нам чаще мыться?
«Это не поможет, — уверен ученый. – С таким положением дел либо надо смириться, либо улетать жить в космос».
Метр микробов
Автор фото, Thinkstock
Подпись к фото,
В общественном транспорте мы собираем на себя большое количество чужих микробов
В каждом индивидуальном «облаке» присутствуют бактерии группы стрептококков, обитающих в полости рта и дыхательных путях, и кожные паразиты – пропионовокислые и коринебактерии.
Результаты исследования показывают, что этой комбинации бактерий вполне достаточно, чтобы установить, что кто-то побывал в комнате.
Между тем пока неясно, насколько «бактериальное облако» изменяется со временем.
«Чистюлям будет трудно с этим смириться, но нам всем надо понимать, что мы не стерильны и это абсолютно нормально и полезно для здоровья», — сказал в интервью Би-би-си Адам Алтрихтер из команды исследователей.
По его словам, размеры индивидуального «облака» пока не устанавливались, но, возможно, оно достигает метра.
Ученые обещают совершить переворот в питании, изучая микробиом
https://ria.ru/20190302/1551485940.html
Ученые обещают совершить переворот в питании, изучая микробиом
Ученые обещают совершить переворот в питании, изучая микробиом — РИА Новости, 02.03.2019
Ученые обещают совершить переворот в питании, изучая микробиом
На днях Билл Гейтс объявил о финансировании через свой фонд первой стадии испытания лечебных пробиотиков, предназначенных для младенцев из бедных стран… РИА Новости, 02.03.2019
2019-03-02T08:00
2019-03-02T08:00
2019-03-02T07:57
наука
билл гейтс
бактерии
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/155148/39/1551483983_0:160:3072:1888_1920x0_80_0_0_2ae0a59a3e255b8026093c95dbf8c6ce.jpg
МОСКВА, 2 мар — РИА Новости, Татьяна Пичугина. На днях Билл Гейтс объявил о финансировании через свой фонд первой стадии испытания лечебных пробиотиков, предназначенных для младенцев из бедных стран. Предполагается, что добавка полезных микробов поможет сформировать в детском кишечнике нормальный микробиом — так называют совокупность обитающих там микроорганизмов и вирусов. Они влияют на здоровье, психику и поведение, но как именно, точно неизвестно. Что даст человечеству изучение микробиома — в материале РИА Новости.Полезные микробыЕще недавно считалось, что ребенок рождается практически стерильным, без микробов. Теперь известно, что они населяют плаценту, околоплодные воды, пуповину. В первые минуты жизни на воздухе, еще в роддоме, младенец буквально подвергается микробной атаке. В материнском молоке содержится примерно шестьсот видов бактерий, часть которых передается малышу.Первые недели и месяцы правильного кормления очень важны, именно тогда начинает формироваться желудочно-кишечная микрофлора, или микробиом — это более правильное название для сообщества бактерий, вирусов, архей, грибов. Все они сосуществуют с организмом человека, помогая ему перерабатывать пищу, извлекать оттуда питательные вещества, энергию. Микронаселение желудочно-кишечного тракта (ЖКТ) человека изучают более ста лет со времен открытий Ильи Мечникова. Но что кишечные микробы играют одну из ключевых ролей в здоровье — осознали совсем недавно.Болезни — от кишечникаВ начале 1980-х австралийские ученые доказали, что обитающая в желудках чуть ли не половины населения земного шара бактерия Helicobacter pylori вызывает рак. Здоровому человеку она не вредит, но если иммунная система дает сбой, риск развития болезни повышается. В 1989 году появилась гипотеза о связи микробов и аллергии. Это установили, заметив снижение количества случаев сенной лихорадки и экземы у детей, росших в больших семьях. Позже проследили связь между дисбактериозом (дисбиозом) и атопическими дерматитами. В последнее время ученые говорят о связи между микробиомом и заболеваниями сердечно-сосудистой системы, сахарным диабетом, ожирением, бронхиальной астмой, воспалением кишечника, синдромом раздраженного кишечника, поведенческими нарушениями. На роль посредников между микробиомом и остальным организмом предлагают два соединения — триметиламиноксид и короткоцепочечные жирные кислоты. Например, последние молекулы стимулируют выработку гормонов сытости, которые сигнализируют мозгу о том, что желудок полный. Если происходит сбой, то в мозг идет неверный сигнал. Не исключено, что этот механизм способствует ожирению. На уровне гипотезы рассматривают связь микробиома и ментальных болезней, включая депрессию. В кишечнике перерабатываются питательные вещества — разумеется, это влияет на весь организм, включая мозг, утверждают сторонники этой точки зрения. Коммуникация идет посредством сигнальных молекул, что установили во время опытов на мышах. Проблема пробиотиковВ последние годы очень популярным способом профилактики различных болезней ЖКТ стали пробиотики — полезные для человека микробы. Их охотно выписывают врачи, свободно продают в аптеках. Йогурты, кефир и другие кисломолочные ферментированные продукты активно рекламируют как благотворно влияющие на микрофлору кишечника.Билл Гейтс уже десяток лет инвестирует в проекты по разработке лечебных пробиотиков. Сейчас он поддерживает препарат, который будут использовать как добавку в материнское молоко. Его испытывают в Бангладеш на младенцах с задержкой развития.В таких странах, как Бангладеш, Мадагаскар, большой процент детей до пяти лет растет с задержкой развития, не получая достаточно питательных веществ: железа, цинка, йода, витаминов. Как предполагают ученые, это не позволяет сформироваться нормальному микробиому и ведет к проблемам со здоровьем на всю оставшуюся жизнь. Даже если такой человек в будущем будет питаться хорошо, он не сможет извлекать нужные вещества из еды. Проблема актуальна и для развитых стран, где растет число детей с лишним весом.Идея состоит в том, чтобы поселить в кишечник ребенка хорошие микробы через материнское молоко и помочь микробиому развиваться нормально.Насколько оправданны вложения Гейтса, покажет будущее, а пока во многих случаях эффективность лечения пробиотиками не доказана, что констатируют последние обзоры Кокрейна (Cochrane Collaboration — международная некоммерческая организация, изучающая эффективность медицинских технологий). Один посвящен лечению пробиотиками недоношенных младенцев и их матерей, второй — пересадке микробиома для лечения воспаления кишечника. Их авторы подчеркивают, что необходимо больше данных для строгих выводов. Нынешние пробиотики, видимо, бесполезны и для лечения аллергии. Национальные ассоциации педиатров не рекомендуют их использовать. Всемирная ассоциация по аллергии делает одно исключение — для беременных, кормящих матерей и младенцев из семей, где были случаи аллергии.У науки еще нет полного понимания микробиома, его связь с патологиями только исследуется, разработка лечебных пробиотиков — в начале пути. Однако ученые не сомневаются, что впереди — множество удивительных открытий в этой области.
https://ria.ru/20180710/1524258852.html
https://ria.ru/20180507/1519966267.html
https://ria.ru/20190301/1551452911.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/155148/39/1551483983_171:0:2902:2048_1920x0_80_0_0_a1acbc73bab2880e7bae5e10a9ac404a.jpg
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
билл гейтс, бактерии
МОСКВА, 2 мар — РИА Новости, Татьяна Пичугина. На днях Билл Гейтс объявил о финансировании через свой фонд первой стадии испытания лечебных пробиотиков, предназначенных для младенцев из бедных стран. Предполагается, что добавка полезных микробов поможет сформировать в детском кишечнике нормальный микробиом — так называют совокупность обитающих там микроорганизмов и вирусов. Они влияют на здоровье, психику и поведение, но как именно, точно неизвестно. Что даст человечеству изучение микробиома — в материале РИА Новости.
Полезные микробы
Еще недавно считалось, что ребенок рождается практически стерильным, без микробов. Теперь известно, что они населяют плаценту, околоплодные воды, пуповину. В первые минуты жизни на воздухе, еще в роддоме, младенец буквально подвергается микробной атаке. В материнском молоке содержится примерно шестьсот видов бактерий, часть которых передается малышу.
Первые недели и месяцы правильного кормления очень важны, именно тогда начинает формироваться желудочно-кишечная микрофлора, или микробиом — это более правильное название для сообщества бактерий, вирусов, архей, грибов. Все они сосуществуют с организмом человека, помогая ему перерабатывать пищу, извлекать оттуда питательные вещества, энергию.
Микронаселение желудочно-кишечного тракта (ЖКТ) человека изучают более ста лет со времен открытий Ильи Мечникова. Но что кишечные микробы играют одну из ключевых ролей в здоровье — осознали совсем недавно.
10 июля 2018, 08:00НаукаСерые кардиналы организма: как микробы управляют людьми
Болезни — от кишечника
В начале 1980-х австралийские ученые доказали, что обитающая в желудках чуть ли не половины населения земного шара бактерия Helicobacter pylori вызывает рак. Здоровому человеку она не вредит, но если иммунная система дает сбой, риск развития болезни повышается.
В 1989 году появилась гипотеза о связи микробов и аллергии. Это установили, заметив снижение количества случаев сенной лихорадки и экземы у детей, росших в больших семьях. Позже проследили связь между дисбактериозом (дисбиозом) и атопическими дерматитами.
В последнее время ученые говорят о связи между микробиомом и заболеваниями сердечно-сосудистой системы, сахарным диабетом, ожирением, бронхиальной астмой, воспалением кишечника, синдромом раздраженного кишечника, поведенческими нарушениями.
На роль посредников между микробиомом и остальным организмом предлагают два соединения — триметиламиноксид и короткоцепочечные жирные кислоты. Например, последние молекулы стимулируют выработку гормонов сытости, которые сигнализируют мозгу о том, что желудок полный. Если происходит сбой, то в мозг идет неверный сигнал. Не исключено, что этот механизм способствует ожирению.
На уровне гипотезы рассматривают связь микробиома и ментальных болезней, включая депрессию. В кишечнике перерабатываются питательные вещества — разумеется, это влияет на весь организм, включая мозг, утверждают сторонники этой точки зрения. Коммуникация идет посредством сигнальных молекул, что установили во время опытов на мышах. 7 мая 2018, 08:00НаукаПрирожденные убийцы: почему бактерии выигрывают в борьбе с антибиотиками
Проблема пробиотиков
В последние годы очень популярным способом профилактики различных болезней ЖКТ стали пробиотики — полезные для человека микробы. Их охотно выписывают врачи, свободно продают в аптеках. Йогурты, кефир и другие кисломолочные ферментированные продукты активно рекламируют как благотворно влияющие на микрофлору кишечника.
Билл Гейтс уже десяток лет инвестирует в проекты по разработке лечебных пробиотиков. Сейчас он поддерживает препарат, который будут использовать как добавку в материнское молоко. Его испытывают в Бангладеш на младенцах с задержкой развития.
В таких странах, как Бангладеш, Мадагаскар, большой процент детей до пяти лет растет с задержкой развития, не получая достаточно питательных веществ: железа, цинка, йода, витаминов. Как предполагают ученые, это не позволяет сформироваться нормальному микробиому и ведет к проблемам со здоровьем на всю оставшуюся жизнь. Даже если такой человек в будущем будет питаться хорошо, он не сможет извлекать нужные вещества из еды.
Проблема актуальна и для развитых стран, где растет число детей с лишним весом.
Идея состоит в том, чтобы поселить в кишечник ребенка хорошие микробы через материнское молоко и помочь микробиому развиваться нормально.
Насколько оправданны вложения Гейтса, покажет будущее, а пока во многих случаях эффективность лечения пробиотиками не доказана, что констатируют последние обзоры Кокрейна (Cochrane Collaboration — международная некоммерческая организация, изучающая эффективность медицинских технологий). Один посвящен лечению пробиотиками недоношенных младенцев и их матерей, второй — пересадке микробиома для лечения воспаления кишечника. Их авторы подчеркивают, что необходимо больше данных для строгих выводов. Нынешние пробиотики, видимо, бесполезны и для лечения аллергии. Национальные ассоциации педиатров не рекомендуют их использовать. Всемирная ассоциация по аллергии делает одно исключение — для беременных, кормящих матерей и младенцев из семей, где были случаи аллергии.
У науки еще нет полного понимания микробиома, его связь с патологиями только исследуется, разработка лечебных пробиотиков — в начале пути. Однако ученые не сомневаются, что впереди — множество удивительных открытий в этой области.
1 марта 2019, 08:00НаукаУченые опровергли все мифы о туберкулезе
Микробы внутри нас: Что такое микробиом и как за ним следить?
Что такое микробиом?
Человеческий организм — дом для 39 триллионов бактерий. Помимо них, наше тело населяют археи — одноклеточные организмы, грибки и вирусы, которые составляют микрофлору человека. Совокупность микрофлоры человека и микробных генов называется микробиомом.
По топографии различают микробиом кожи, полости рта, дыхательных путей, урогенитального тракта и кишечника. Больше всего известно о микробах кишечника, но значение остальных типов от этого не становится меньше. К примеру, согласно исследованию, штамм Staphylococcus epidermidis, который обнаружили на коже человека, защищает от рака кожи.
Микробиом каждого человека индивидуален. Он зависит от набора питательных веществ в организме, pH, влажности, температуры и других критериев. «Если рассматривать микробиом двух жителей одного города, в них будут большие различия», — говорит профессор педиатрии, информатики и техники Калифорнийского университета в Сан-Диего — Роб Найт. Схожие микробиомы имеют члены одной семьи, проживающие вместе, домашние животные и их хозяева.
Старые мифы
Не все микробы патогенны. Есть полезные, а также те, которые приносят вред, если оказываются в неположенном месте или их количество резко возросло. К полезным бактериям можно отнести Akkermansia и Christensenellaceae, которые помогают предотвратить набор веса. Methanobrevibacter способствует лучшей усвояемости пищи, а Oxalobacter обеспечивает профилактику появления камней в почках. Напротив, Clostridium perfringens и кишечная палочка E.coli способны вызвать заболевания желудочно-кишечного тракта.
Зачем нам нужны микробы?
Бактерии кишечника позволяют правильно переваривать и поглощать питательные вещества, а некоторые из них помогают бороться с вредными микробами. Большинство бактерий полости рта предотвращают колонизацию ротовой полости вредными организмами. Микроорганизмы на коже помогают предотвратить колонизацию кожи патогенами. Помимо «хороших» микробов, есть и опасные. Например, пропионибактерии акне (Propionibacterium acnes), которые при активном размножении приводят к развитию акне.
Откуда они берутся?
Если раньше считалось, что ребенок в утробе стерилен, сегодня известно, что бактерии присутствуют в плаценте, околоплодных водах и пуповинной крови матери. Но по-настоящему «серьезный» контакт с бактериями приходится на время родов. «Мы приобретаем бактерии в родовых путях. И эти бактерии действительно важны для начала жизни вне утробы», — говорит Джон Крайан, нейрофармаколог и эксперт по микробиому из Университетского колледжа Корка. Бактерии, которые мы приобретаем при рождении, активируют нашу иммунную систему.
На первоначальный состав микроорганизмов в организме новорожденного влияет тип водоразрешения: естественное или с помощью кесарева сечения. «Если ребенок рождается с помощью кесарева сечения, у него будет другая микрофлора»-, говорит Крайан. У такого младенца отмечается низкое бактериальное разнообразие в течение первых 12 месяцев жизни.
Микробиом человека активно меняется первые два года и стабилизируется к трём годам. Он продолжает меняться всю жизнь под действием окружающей среды, антибиотиков, диет и стресса.
Человек — сборище микробов
В исследованиях 70-ых годов говорится, что отношение количества микробов к клеткам человека составляет десять к одному. Однако исследование ученых из Института Вейцмана опровергло это положение. Клетки бактерий (не считая вирусов и вирусных частиц) и человека сожительствуют в отношении 1,3 к 1.
Некоторые считают, что человека можно рассматривать как голобионт (форма созависимых отношений между микробами и человеком). «В эволюционных терминах митохондрии и транспозоны (участки ДНК организмов) являются частью человека, а вот кишечные микробы — нет, так как они могут жить вне человеческого организма», — говорит Эллен Кларк, биолог из Лидского Университета.
В микробиоме человека важен баланс. «Микробиом человека похож на тропический лес: здорово, если у вас растет папоротник, но если это единственное растение в лесу, это плохо скажется на почве, — говорит Тим Спектор, профессор генетической эпидемиологии Королевского колледжа Лондона и автор книги «The Diet Myth».
На что влияет микробиом и зачем его исследовать?
Кишечный микробиом влияет на здоровье человека, в том числе на аппетит, «полезность» еды и иммунную систему. Существует даже несколько механизмов влияния на настроение, один из которых — через блуждающий нерв, который связывает мозг и органы.
От бактерий в кишечнике зависит реакция человека на медицинские препараты, на химиотерапию и даже на сон. А микробиом вагины влияет на эффективность вагинальных препаратов против ВИЧ.
Микробиом уникален как отпечатки пальцев человека, поэтому в последнее время начали говорить о его применении в судебной медицине. Благодаря бактериям можно определить, был ли человек в определенном месте, а также время смерти.
Новые методы лечения
Трансплантация кала уже используется для лечения клостридиоза. При этой процедуре человеку с нарушениями вводится кал здорового донора, что позволяет «перезагрузить» и сделать разнообразнее микробиом человека. Некоторые ученые считают, что процедура может помочь при лечении и других болезней.
Имея ограниченный доступ к трансплантатам кала, люди берут дело в свои руки, об этом говорят ролики на YouTube. Эксперты предупреждают, что попытка трансплантации дома опасна. «Вы подвергаетесь риску передачи действительно серьезных заболеваний. Просто потому, что вы можете что-то делать дома, не значит, что вам следует», — говорит Найт.
Некоторые исследователи, включая Крайана, считают, что исследование микробиома приведёт к развитию новых ментальных терапий. Крайан считает, что в будущем проверка микробиома станет для врачей обычным делом, а изучение бактерий проведет к высокоточной медицине.
Как поддерживать микробиом в хорошем состоянии?
Важно разнообразие микробов в организме, а для этого нужно расширять рацион. Пользу принесут ферментированные пищевые продукты: квашеная капуста, кефир, чайный гриб, и продукты с высоким содержанием пищевых волокон: чернослив, курага, вареная чечевица, фасоль и артишоки.
Значение имеют пребиотики и пробиотики. Первые — вещества, которые питают и способствуют росту полезных микробов. Вторые — лакто- и бифидобактерии, дрожжи, микробы, которые присутствуют в кишечнике здорового человека и считаются полезными для здоровья.
Анализ микробных маркеров методом газовой хромато-масс-спектрометрии
Определение микроэкологического статуса человека и его отклонений от нормы, в ходе которого осуществляется выявление (уточнение) этиологии инфекционно-воспалительных процессов при любых заболеваниях. Относится к новому направлению в микробиологических исследованиях — диагностике инфекции, дисбиозов и воспалительных процессов по специфическим микробным химическим веществам — маркерам. Исследование универсально в отношении разных групп микроорганизмов: не только бактерий, но и микроскопических грибов и вирусов, в том числе анаэробных микроорганизмов, которые составляют основной микробный массив (до 60 % и более).
Синонимы русские
Микроэкологический статус человека, микробиом человека, микроэкология человека.
Метод исследования
Газовая хроматография масс-спектрометрия (ГХ-ХМС).
Какой биоматериал можно использовать для исследования?
Биоптат, венозная кровь, кал, капиллярная кровь, мазок из зева (ротоглотки), мазок с кожных покровов, мазок с конъюнктивы, мазок из носоглотки, мазок из уретры, мазок из цервикального канала, мокрота, ногти, отделяемое влагалища, отделяемое раны, секрет простаты, слюна, первая порция утренней мочи, средняя порция утренней мочи.
Для исследования почек и мочевого пузыря необходима средняя порция мочи, для исследования воспалительных процессов уретры – первая порция утренней мочи.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь в течение 24 часов до исследования.
- Исключить (по согласованию с врачом) прием мочегонных препаратов в течение 48 часов до сбора мочи.
- Исключить прием слабительных препаратов, введение ректальных свечей, масел, ограничить (по согласованию с врачом) прием медикаментов, влияющих на перистальтику кишечника (белладонна, пилокарпин и др.), и препаратов, влияющих на окраску кала (железо, висмут, сернокислый барий), в течение 72 часов до сбора кала.
Общая информация об исследовании
Микроэкологический статус человека является необходимым условием стабильного функционирования всех его органов и систем. Нормальная микробиота — по сути совокупность микробных сообществ локусов, характеризующихся определенным составом и колонизирующих кожу и слизистые оболочки. Это первичный неспецифический барьер, предшествующий активации неспецифических и специфических факторов защиты макроорганизма. Он покрывает кишечную стенку, слизистые оболочки и кожу человека, насчитывая около ста биллионов клеток микроорганизмов. Микробиота выступает как зеркальный показатель физиологического состояния организма в зависимости от воздействия на него различных факторов. Поэтому так важен контроль — и восстановление микробиоценоза, если он оказывается нарушенным.
Микробиота человека сконцентрирована в основном в кишечнике. Известные сведения о природе микробиоценоза кишечника достаточны для понимания его функционирования как физиологически активного органа человека. Однако при патологиях, связанных с дисбиозом, одних их недостаточно — в таких случаях необходимо количественное определение и контроль изменений в составе микроорганизмов. Отсутствие баланса в их продукции связано с патологическими проявлениями самого разного характера: кишечными расстройствами, кожными заболеваниями, половой дисфункцией, сердечной недостаточностью и др.
Исследование относится к новому направлению в микробиологии – диагностике инфекции, дисбиозов и воспалительных процессов по специфическим микробным химическим веществам (маркерам). Эти вещества содержатся в клеточных стенках микроорганизмов или производятся ими в процессе жизнедеятельности. Маркеры отличаются по химическому строению от вещества клеток человека. В данном случае речь идет о разнообразных жирных кислотах, которых у человека немногим более 20 видов, а у микробов – более 200. Поэтому есть возможность определить наличие микробов в организме человека, если имеется достаточно чувствительный метод анализа. Таким методом является газовая хроматография, совмещенная с масс-спектрометрией (ГХ-МС) — с его помощью можно точно определить химическую природу вещества по его масс-спектру. Современное компьютерное обеспечение в совокупности с разработанными методиками позволяет быстро и надежно определять малые доли веществ микробного происхождения в любых биологических жидкостях человека. Исследование используется для определения инфекционных агентов воспалений и оценки дисбиозов различных локализаций. Суть исследования состоит в прямом извлечении высших жирных кислот из образца биоматериала, их разделения на хроматографе в капиллярной колонке высокого разрешения и анализе состава на масс-спектрометре. На основании этих измерений расшифровывается состав микробиоты.
Применение данного метода для изучения микроэкологии человека дает качественно новый вариант микробиологического исследования благодаря возможности одновременного количественного определения большого количества микробных маркеров непосредственно в биологических пробах без предварительного культивирования микроорганизмов и использования биохимических тестовых материалов и генетических праймеров. Получение в реальном времени расширенной информации об анаэробах и труднокультивируемых аэробах, а также актинобактериях, вирусах, дрожжах и микроскопических грибах из одной пробы обеспечивает полную картину микробной этиологии заболевания. Количественные измерения позволяют изучать динамику изменения микробиоты при лечебных мероприятиях, в том числе влияние антибиотиков и пробиотиков на пристеночную микробиоту кишечника.
В ходе исследования определяется более 56 микроорганизмов одновременно в одном анализе; при этом используется количественный экспресс-метод диагностики дисбактериозов и определения возбудителей инфекции. Анализ универсален в отношении разных групп микроорганизмов: бактерий, грибов, вирусов. Чувствительность составляет 104-105 клеток в пробе; селективность – до вида при наличии маркера. Анализ осуществляется непосредственно в материале без высевания микрофлоры и не требует биологических и биохимических тестовых материалов – культуральных сред, ферментов, праймеров и т.п.
Когда назначается исследование?
- При определении микроэкологического статуса организма и его отклонений;
- при выявлении или уточнении этиологии инфекционно-воспалительного процесса при любых нозологических формах заболеваний в клинической практике:
- ОРИТ: сепсис, гнойно-воспалительные очаги, лихорадка неясной этиологии, менингит, бактериурия, полиорганная недостаточность;
- хирургия: инфекция вследствие хирургического вмешательства, абсцессы почек и печени, воспалительные процессы респираторных органов, воспаление внутренних половых органов, ожоговая инфекция, гангрена, перитонит, синовит;
- гинекология: хронический вагинит, цистит, воспаление матки и придатков, кандидоз;
- урология и андрология: пиелонефрит, буллезный цистит, уретрит, простатит, орхит, гонорея;
- репродуктология: мужское и женское бесплодие, связанное с инфекциями половых органов, невынашивание беременности, бесплодие, хронические воспалительные заболевания;
- гастроэнтерология: синдром раздраженного кишечника, гастрит, дисбактериоз, диарея, запор, болезнь Крона;
- пульмонология: муковисцидоз, пневмония, туберкулез, плеврит, лихорадка неясного генеза;
- ЛОР: гайморит, синусит, фарингит, отит;
- гепатология: асцит, дисбактериоз, спонтанный бактериальный перитонит;
- дерматовенерология: угревая болезнь, атопическая экзема, себорея, онихомикоз, псориаз, дерматиты неясной этиологии, сифилис.
Что означают результаты?
Результат исследования выдается в виде списка исследуемых микроорганизмов, допустимых значений нормы и отклонений от нормы, а также диаграммы в сопоставлении с нормой.
+ Прилагается заключение в виде справочной информации по результатам анализа.
Для биоматериалов кал, моча, секрет простаты и мазок из уретры нет референсных значений.
Определение микробиома человека
Nutr Rev. Рукопись автора; доступно в PMC 2013 1 февраля.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC3426293
NIHMSID: NIHMS369735
Люк К. Урселл
1 Департамент химии и биохимии Университета Боулдера Боулдер, Колорадо, 80309, США
Джессика Л. Меткалф
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
Лаура Вегенер Парфри
1 Кафедра химии и химии Биохимия, Университет Колорадо в Боулдере, Боулдер, Колорадо, 80309, США
Роб Найт
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Говард Хьюз Медицинский институт, Боулдер, Колорадо, 80309, США
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Медицинский институт Говарда Хьюза, Боулдер, Колорадо, 80309, США
* Кому следует направлять корреспонденцию: Роб Найт, Департамент химии и биохимии, UCB 215, Университет Колорадо, Боулдер, CO 80309, тел: 303-492-1984, факс: 303-492-7744, уд[email protected] Окончательная отредактированная версия этой статьи издателем доступна на Nutr Rev. См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Быстро развивающиеся методы секвенирования и аналитические методы расширяют нашу способность понимать микробиом человека и, действительно, то, как мы определяем микробиом и его составляющие. В этом обзоре мы выделяем недавние исследования, которые расширяют нашу способность понимать микробиом человека в различных пространственных и временных масштабах, включая ежедневные наборы данных временных рядов, охватывающих месяцы.Кроме того, мы обсуждаем новые концепции, связанные с определением операционных таксономических единиц, индексов разнообразия, основных и временных микробиомов и возможности энтеротипов. Дополнительные достижения в технологии секвенирования и в нашем понимании микробиома откроют захватывающие перспективы для использования микробиоты в персонализированной медицине.
Введение
Микробиота человека состоит из 10–100 триллионов симбиотических микробных клеток, содержащихся в каждом человеке, в первую очередь бактерий в кишечнике; Микробиом человека состоит из генов, содержащихся в этих клетках [1].Проекты микробиома во всем мире были запущены с целью понять роли, которые играют эти симбионты, и их влияние на здоровье человека [2, 3]. Подобно тому, как вопрос «что такое , , чтобы быть человеком?» Беспокоил людей с самого начала записанной истории, вопрос: «что такое , — человеческий микробиом?» вызывает беспокойство у исследователей с тех пор, как этот термин был придуман Джошуа Ледербергом в 2001 году [4]. Уточнение определения микробиома человека осложнилось путаницей в терминологии: например, «микробиота» (таксоны микробов, связанные с людьми) и «микробиом» (каталог этих микробов и их генов) часто используются как синонимы.Кроме того, термин «метагеномика» первоначально относился к характеристике общей ДНК методом дробовика, хотя сейчас он все чаще применяется для изучения маркерных генов, таких как ген 16S рРНК. Однако более фундаментально новые открытия заставляют нас усомниться в концепциях, которые имеют центральное значение для определения микробиома человека, таких как стабильность микробиома человека, определение OTU (операционных таксономических единиц), составляющих микробиоту. , и есть ли у человека один или несколько микробиомов.В этом обзоре мы рассмотрим прогресс в определении микробиома человека в этих различных отношениях.
Изучение разнообразия микробиома человека началось с Антони ван Левенгука, который еще в 1680-х годах сравнивал свою оральную и фекальную микробиоту. Он отметил поразительные различия в микробах между этими двумя средами обитания, а также между образцами, взятыми у людей с состоянием здоровья и болезнью в обоих этих местах [5, 6]. Таким образом, исследования глубоких различий в микробах на разных участках тела и между здоровье и болезни так же стары, как и сама микробиология.Сегодня новым является не способность наблюдать эти очевидные различия, а, скорее, способность использовать мощные молекулярные методы, чтобы понять, почему существуют эти различия, и понять, как мы можем повлиять на преобразования из одного состояния в другое.
Культурально-независимые методы характеристики микробиоты вместе с молекулярным филогенетическим подходом к организации разнообразия жизни обеспечили фундаментальный прорыв, позволив исследователям сравнивать микробные сообщества в разных средах в рамках единого филогенетического контекста (см. Обзор [7]).Хотя связанные с хозяином микробы предположительно попадают в окружающую среду, состав микробиоты млекопитающих, особенно в кишечнике, неожиданно отличается от свободноживущих микробных сообществ [8]. Фактически, анализ бактериального разнообразия свободноживущих сообществ в наземных, морских и пресноводных средах, а также сообществ, связанных с животными, предполагает, что кишечник позвоночных является экстремальным явлением [8]. Напротив, бактериальные сообщества из сред, обычно считающихся экстремальными, таких как кислые горячие источники и гидротермальные источники, похожи на сообщества во многих других средах [9].Это говорит о том, что совместная эволюция между позвоночными и их микробными консорциумами в течение сотен миллионов лет привела к выбору специализированного сообщества микробов, которые процветают в теплой, эвтрофной и стабильной среде кишечника [8]. В кишечнике человека и во всех связанных с человеком средах обитания бактерии составляют основную часть биомассы и разнообразия, хотя археи, эукариоты и вирусы также присутствуют в меньшем количестве, и ими нельзя пренебрегать [10, 11].
Интересно, что оценки каталога генов человека и разнообразия генома человека бледнеют по сравнению с оценками разнообразия микробиома.Например, консорциум Meta-HIT сообщил о каталоге генов из 3,3 миллионов неизбыточных генов только в микробиоме кишечника человека [3] по сравнению с ~ 22 000 генов, присутствующих во всем геноме человека [12]. Точно так же разнообразие микробиома людей огромно по сравнению с вариациями генома: отдельные люди примерно на 99,9% идентичны друг другу с точки зрения генома хозяина [13], но могут отличаться друг от друга на 80-90% с точки зрения генома. микробиом их руки [14] или кишечника [15].Эти результаты показывают, что использование вариаций, содержащихся в микробиоме, будет гораздо более плодотворным в персонализированной медицине, использовании генетических данных отдельного пациента для информирования медицинских решений, чем подходы, нацеленные на относительно постоянный геном хозяина.
Многие фундаментальные вопросы о микробиоме человека до недавнего времени было трудно или невозможно было решить. На некоторые вопросы, такие как вечно популярный «сколько видов обитает на данном участке тела?», Все еще трудно ответить из-за проблем с определениями видов бактерий и скоростью ошибок секвенирования.Другие вопросы, такие как «как разнообразие внутри человека с течением времени соотносится с разнообразием между людьми?» Или «как различие между участками на теле одного и того же человека соотносится с разнообразием между разными людьми на одном участке?» , или «существует ли основной набор видов микробов, которые мы все разделяем?», теперь можно дать окончательный ответ. В следующем разделе мы обсудим некоторые инструменты, которые позволили ответить на эти давние вопросы.
Инструменты для микробного анализа
Резкое сокращение затрат на секвенирование, наблюдавшееся за последние несколько лет, позволило идентифицировать специфические таксоны микробов, обнаруженные в кишечнике человека, которые трудно или невозможно культивировать.Теперь исследователи могут генерировать миллионы последовательностей для каждого образца, чтобы оценить различия в микробных сообществах между участками тела и отдельными людьми. Наша возросшая мощность секвенирования потребовала разработки столь же мощных вычислительных инструментов для обработки растущего количества данных последовательностей, производимых современными технологиями [16]. Существует несколько конвейеров для анализа данных микробного микробного сообщества, таких как mothur [17], w.A.T.E.R.S [18], инструменты RDP pyroseqeuncing [19] и QIIME (произносится «колокольчик») [20].QIIME — это бесплатная платформа с открытым исходным кодом для анализа данных высокопроизводительного секвенирования, которая позволяет пользователям импортировать необработанные данные о последовательностях и быстро производить измерения разнообразия между и внутри образцов. Последовательность в идентификации операционных таксономических единиц (OTU) и установление согласованных мер разнообразия внутри и между выборками имеют решающее значение для сравнения результатов исследований, хотя концепция OTU становится все более проблематичной по мере того, как накапливаются данные о последовательности и приобретаются явные филогенетические подходы. в популярности.
Бета-разнообразие относится к измерению степени различия в членстве или структуре сообщества между двумя выборками. Недавний обзор основанных на таксонах измерений бета-разнообразия показал, что некоторые метрики, в том числе расстояния Канберры и Гауэра, обладают повышенной мощностью для различения кластеров, в то время как другие метрики, такие как хи-квадрат и корреляционные расстояния Пирсона, более подходят для выяснения эффектов. градиентов среды на сообществах [21]. Надежным методом сравнения различий между микробными сообществами является UniFrac, который измеряет долю общих длин ветвей на филогенетическом дереве между образцами [22].Очень похожие микробные сообщества приводят к оценке UniFrac, близкой к 0, в то время как два полностью независимых сообщества, которые не имеют общей длины ветвей (т. Е. Имеют разную эволюционную историю), дают оценку UniFrac, равную 1. Анализ основных координат (PCoA) может затем визуализировать расстояния Unifrac между образцами в двумерном или трехмерном пространстве, что позволяет легко визуально различать кластеризацию похожих сообществ или разделение отдельных сообществ.
UniFrac как мера бета-разнообразия в сочетании с PCoA имеет способность различать различия между сообществами, используя всего 10 последовательностей на образец [23]. Важно понимать, что увеличенная глубина секвенирования не всегда необходима для получения биологически значимых результатов, когда эти результаты очевидны. Таким образом, выбирая измерения разнообразия, которые подходят для дизайна исследования, исследователи, использующие современные методы секвенирования, могут охарактеризовать различия между выборками при относительно низком охвате последовательностей.Это позволяет исследователям оценивать мелкозернистые пространственные и временные закономерности, характеризуя от сотен до тысяч образцов, таких как временные ряды по нескольким пациентам или средам. Функциональность UniFrac, а также множество измерений разнесения доступны в QIIME, и их можно легко сравнить.
В общем, конвейеры для анализа 16S рРНК и метагеномных данных дробовика имеют отдельные рабочие процессы. Некоторые начальные шаги, такие как демультиплексирование (удаление штрих-кодов и разделение объединенных образцов) и качественная фильтрация, являются общими для обоих конвейеров.Однако для данных 16S рРНК последовательности должны быть сгруппированы в OTU, химерные последовательности, генерируемые неполным расширением матрицы, должны быть удалены, и должны быть построены филогенетические деревья. Напротив, в метагеномном конвейере последовательности должны быть назначены функциям, а также таксономии (либо как целые чтения, либо после сборки). Как только таксоны или таблицы функций генов построены, конвейеры начинают сближаться, по крайней мере, концептуально: тогда интерес заключается в 1) составе каждой выборки, 2) поиске таксонов или функций, которые различают группы выборок (например,грамм. в соответствии с клиническими параметрами) и 3) с вопросом, группируются ли образцы в соответствии с какими-либо измеренными клиническими состояниями (или по времени). Одно интересное развивающееся направление — сравнение метагеномной кластеризации и кластеризации 16S рРНК напрямую с использованием метода, называемого анализом Прокруста, который позволяет комбинировать графики PCoA [24]. Еще один мощный инструмент — использование машинного обучения и статистических методов для построения прогнозных моделей таксонов [25] или функций [26], которые различают группы выборок.
Уникальным преимуществом QIIME по сравнению с другими конвейерами является его способность использовать «образцы метаданных», например клиническая информация о субъектах, позволяющая визуализировать основные закономерности в данных. Особый интерес представляет то, что QIIME поддерживает стандарт MIMARKS (минимальная информация о последовательности маркеров) [27], разработанный Консорциумом геномных стандартов [28], который становится все более популярным среди других инструментов для анализа микробов и сообществ, таких как MG-RAST [29]. , и был принят INSDC (Международный консорциум баз данных нуклеотидных последовательностей, который включает GenBank, EBI и DDBJ) в качестве стандарта для метаданных.
С этими инструментами основные закономерности сходства и различия в микробиоте стали обычным делом. Ключевая задача в настоящее время состоит в том, чтобы расширить анализ, включив в него лонгитюдные исследования и понять роль конкретных хозяев и факторов окружающей среды в развитии и поддержании микробиома.
Динамическое взаимодействие между человеческими микробами и окружающей средой
Желудочно-кишечный тракт (ЖКТ) младенца человека обеспечивает совершенно новую среду для микробной колонизации [30].Действительно, микробиота, которую начинает приобретать младенец, сильно зависит от способа родов [31]. Через двадцать минут после рождения микробиота новорожденных, рожденных через естественные родовые пути, напоминает микробиоту влагалища их матери, в то время как младенцы, рожденные с помощью кесарева сечения, содержат микробные сообщества, обычно встречающиеся на коже человека [32]. Приобретение микробиоты продолжается в течение первых нескольких лет жизни, поскольку микробиом желудочно-кишечного тракта младенца начинает напоминать микробиом взрослого уже на первом году жизни [33].В одном тематическом исследовании микробиоты младенца в течение первых 2,5 лет жизни филогенетическое разнообразие значительно и линейно увеличивается со временем [34]. Кроме того, значительные изменения в составе кишечной микробиоты были очевидны в пяти временных точках; переход на грудное молоко, развитие лихорадки на 92 день, введение рисовых хлопьев на 134 день, введение смеси и столовых продуктов на 161 день, а также лечение антибиотиками и диета для взрослых на 371 день [34]. Интересно, что каждое изменение диеты сопровождалось изменениями микробиоты кишечника и обогащением соответствующих генов.Например, когда младенец начал получать полноценную взрослую диету, гены в микробиоме, связанные с биосинтезом витаминов и перевариванием полисахаридов, стали обогащаться [34].
Взаимодействие между микробиотой человека и окружающей средой носит динамичный характер, при этом человеческие микробы свободно перемещаются на поверхности, с которыми мы взаимодействуем каждый день. Fierer et al. показали, что кончики пальцев человека могут переносить сообщества микробов на клавиатуру, и эти сообщества сильно дифференцируют людей [35].Графики PCoA показали, что можно было определить, какие пальцы печатали на каких клавишах и какие люди использовали какие клавиатуры: можно было даже связать руку человека с компьютерной мышью, которую он использует, с точностью до 95% по сравнению с база данных других рук [35]. В целом, это исследование показало, что микробные сообщества постоянно переносятся между поверхностями и что существует динамическое взаимодействие между микробиотой окружающей среды и различными участками человеческого тела.
Внутриличностное микробное разнообразие
Еще один интересный вопрос, на который мы только начинаем отвечать, — насколько стабильным со временем становится микробиом внутри человека.Определив, что составляет нормальные временные изменения у человека с течением времени, мы сможем лучше количественно оценить и понять изменения в микробных сообществах, которые возникают в результате диетических и фармацевтических вмешательств. В самом продолжительном на сегодняшний день исследовании временных рядов Caporaso et al. отобрали образцы микробных сообществ двух индивидуумов в кишечнике, ротовой полости, левой и правой ладонях за 396 временных точек в течение 15 месяцев [36]. Сообщества на разных участках тела можно было легко отличить друг от друга с помощью трехмерных графиков PCoA в течение одного года, даже несмотря на то, что структура сообщества на данном участке сильно варьировала [36].Уровень разнообразия также различается между участками тела, при этом во рту и кишечнике находятся самые разные сообщества [37]. Взятые вместе, эти исследования показывают, что микробиота человека представляет собой сильно изменчивую и разрозненную экосистему.
В целом, еще предстоит окончательно доказать, что отдельные особи или даже участки тела несут в себе «основной» набор специфических бактериальных таксонов. Например, консорциум Meta-HIT определил «основной» набор клонов как те, которые присутствовали у половины изучаемых субъектов, хотя, по существу, у всех изучаемых субъектов гены не присутствовали [3].Конечно, важно понимать, что глубина отбора проб может иметь решающее значение для различения таксонов, которые отсутствуют, от таксонов, которые просто очень редки; динамический диапазон численности микробов также довольно велик, и даже для «основных» генов Meta-HIT 2000-кратные диапазоны численности не были редкостью. Доказать, что таксон полностью отсутствует в кишечнике, невозможно с помощью этих типов исследований, поэтому основные расчеты всегда должны включать в себя предупреждение о глубине секвенирования. Еще один фактор, который следует учитывать при определении разнообразия и ядра, заключается в том, что методологические артефакты могут значительно увеличить видимое количество OTU в выборке (и, следовательно, уменьшить видимую долю, которая разделяется).Как ошибка секвенирования [38, 39], так и проблемы, связанные с выравниванием, особенно множественным выравниванием последовательностей [40-43], могут сильно увеличить количество OTU. Важно убедиться, что при проведении оценок керна использовались одни и те же методологические процедуры с точки зрения доли особей, в которой керн должен быть представлен, минимальной численности и процедуры принятия решения, какие последовательности считаются «одинаковыми». Наконец, существует ключевой вопрос о том, структурированы ли вариации вокруг ядра таким образом, чтобы люди имели лишь несколько общих типов профилей микробиоты на данном участке тела: это хорошо установлено для влагалища [44], но более спорно для кишечника [ 45].В общем, следует проявлять крайнюю осторожность при выполнении процедур кластеризации, так как многие из них разбивают непрерывное изменение на кластеры, которых не существует [21]. Надежные процедуры выбора модели, которые включают возможность существования только непрерывных вариаций, а не дискретных кластеров, еще предстоит разработать в контексте анализа микробного сообщества.
Появляется все больше свидетельств того, что люди на самом деле разделяют «основной микробиом», а не «стержневую микробиоту». В исследовании пар монозиготных и дизиготных близнецов, согласных по ожирению или худобе, у всех индивидуумов была общая подгруппа идентифицируемых микробных генов, но не видов [15].Примечательно, что совершенно разные наборы видов микробов дали очень похожие функциональные пути KEGG. Однако отклонения от этого основного микробиома были очевидны у субъектов с ожирением, что свидетельствует о важности использования метагеномных данных в дополнение к определению состава микробного сообщества с помощью исследований маркерного гена 16S при оценке различий между болезненными состояниями. Будет интересно понять, верен ли этот принцип для других участков тела; кросс-биомные метагеномные сравнения на сегодняшний день чрезвычайно редки [46, 47].
Микробиом кишечника играет важную роль в пищеварении и питании.
Доказательства неразрывной связи между микробиотой, пищеварением и метаболизмом хозяина растут. При анализе людей и 59 дополнительных видов млекопитающих последовательности 16S рРНК сгруппированы вместе плотоядных, всеядных и травоядных в основном координатном пространстве, показывая, что структуры сообщества различаются в зависимости от диеты [48]. Изменения в рационе мышей также могут привести к значительным изменениям в метаболизме бактерий, особенно жирных кислот и аминокислот с небольшой цепью, всего за одну неделю [49] и могут привести к большим изменениям уже через один день [50].Важно отметить, что генетическое разнообразие, обнаруженное в нашей кишечной микробиоте, позволяет нам переваривать соединения посредством метаболических путей, явно не закодированных в геноме млекопитающих, что значительно увеличивает нашу способность извлекать энергию из наших разнообразных диет [51, 52].
Микробиота кишечника также играет важную роль в ожирении. У здоровых мышей, которым трансплантируют кишечную микробиоту от обычных мышей, наблюдается увеличение ожирения без увеличения потребления пищи из-за увеличения извлечения энергии из рациона и увеличения депонирования энергии в адипоцитах хозяина [53].Два основных микробных подразделения, Firmicutes и Bacteriodetes, демонстрируют разную численность в зависимости от фенотипа. Уменьшение Bacteriodetes и увеличение Firmicutes было обнаружено у мышей с генетическим ожирением ( ob / ob ) по сравнению с их худыми коллегами [54], а фенотип ожирения может даже передаваться беспроблемным, но генетически диким типам мышей. микробиоты, а фенотип обусловлен энергетическим балансом: калориметрия фекальных гранул с помощью бомбы показывает, что мыши ob / ob извлекают больше энергии из своего рациона и оставляют меньше с фекалиями [51].Примечательно, что те же эффекты справедливы и для другой модели мышей, мышей с нокаутом TLR5, которые также становятся тучными в некоторых помещениях для мышей (но заболевают колитом в других, предположительно из-за различий в фоновой микробиоте). Мыши с нокаутом TLR5 также обладают фенотипом трансмиссивного ожирения, но никакой разницы в эффективности сбора энергии не происходит. Вместо этого измененная микробиота каким-то образом делает мышей более голодными, и их вызванное микробами ожирение можно вылечить, ограничив количество пищи в их клетках тем, которое потребляется мышами дикого типа, а также антибиотиками [55].Корреляция между микробами и ожирением, возможно, лучше всего иллюстрируется потерей веса. Поскольку разные группы людей были помещены на диету с ограничением жиров или углеводов, их количество Bacteriodetes увеличивалось по мере снижения их массы тела, переходя от характерного «тучного» микробного сообщества к «худому» сообществу [56]. Таким образом, изменение микробиоты пациента может быть терапевтическим вариантом, способствующим снижению веса у пациентов с ожирением или способствующим увеличению веса у детей с недостаточным весом.
Удивительно, но микробы, которые мы поглощаем вместе с пищей, могут обеспечивать наш индивидуальный микробиом новыми генами для переваривания новой пищи. Hehemann et al. обнаружили, что новый класс гликозидгидролаз, используемых для переваривания порфирана, полисахарида, распространенного в красных водорослях, также был обнаружен в образцах стула человека в качестве гена в Bacteriodes plebeius . Более тщательное изучение метаданных стула показало, что образцы стула, содержащие ген, переваривающий порфиран, присутствовали только у японцев; ген не был обнаружен в микробиоме кишечника жителей Соединенных Штатов.Почему в кишечнике человека можно найти морской ген? Авторы пришли к выводу, что водоросли, распространенные в японской, но не американской диете, содержат микроорганизмы, которые передали гены микробиому кишечника [57]. Таким образом, микробы обладают способностью значительно увеличивать количество метаболических инструментов в кишечнике человека, позволяя нам переваривать множество субстратов.
Пластичность кишечника человека
Учитывая относительную стабильность микробиоты кишечника человека, один из ключевых вопросов заключается в том, является ли он достаточно пластичным, чтобы позволить четко определенные вмешательства для улучшения здоровья.Как описано выше, микробиота кишечника после установления остается довольно стабильной во времени, по крайней мере, по сравнению с различиями между людьми. Однако ряд исследований демонстрирует, что внешние силы могут изменять сообщество микробов, расположенных в желудочно-кишечном тракте, и антибиотики являются важным примером.
Антибиотики в основном используются для борьбы с патогенными видами бактерий, которые обитают внутри хозяина или вторглись в него, однако нынешнее поколение антибиотиков имеет широкий спектр действия и нацелено также на широкие слои нормальной микробиоты.Таким образом, антибиотики значительно влияют на врожденную микробиоту кишечника хозяина. Через три-четыре дня после лечения ципрофлоксацином, антибиотиком широкого спектра действия, кишечная микробиота испытывает снижение таксономического богатства, разнообразия и однородности [58, 59]. Значительные изменения микробиоты кишечника продемонстрировали значительную межличностную изменчивость. В то время как микробиота кишечника начала напоминать состояние до лечения через неделю после лечения, между людьми наблюдались различия в том, насколько близко сообщество после лечения напоминало сообщество до лечения, а некоторые таксоны не смогли вернуться в сообщество [59 , 60].Действительно, восстановление некоторых видов может происходить в течение четырех лет после лечения антибиотиками [61]. Тем не менее, общее восстановление микробиоты кишечника после лечения антибиотиками предполагает, что существуют факторы внутри сообщества, биотические или абиотические, которые способствуют устойчивости сообщества, хотя они еще не выяснены.
Другие антибиотики также имеют тенденцию давать результаты, которые существенно различаются между субъектами [62, 63] и даже участками тела [64]. Поскольку более крупные группы населения еще не были изучены, отчасти из-за этических проблем с назначением антибиотиков здоровым людям, причины этих основных различий еще не выяснены.Понимание факторов, определяющих способность микробиоты противостоять возмущениям и восстанавливаться после них, а также понимание факторов, определяющих ее текущее состояние, будет ключом к разработке инструментов, помогающих манипулировать микробиомами. Например, как ни странно, у крыс введение антибиотиков перед трансплантацией слепой кишки фактически снижает вероятность появления новых микробов [65].
Интересным намеком на то, что микробиота может быть более пластичной, чем можно было представить, является недавний успех лечения стойких инфекций Clostridum difficile с помощью трансплантации кала, который был успешным в ряде исследований [66-72] и в целом. обедненное кишечное сообщество, образовавшееся во время C.difficile заменяется донорским сообществом [67, 73]. Успех этой техники впечатляет, особенно если учесть, как мало известно о самом лучшем сообществе, которое можно предоставить. Например, что лучше: получить фекальное сообщество близкого родственника или сожителя или, возможно, сохранить собственный стул перед началом лечения антибиотиками, чтобы его можно было восстановить позже? Подходит ли один и тот же стул для всех, или огромные различия в микробиоте означают, что микробы каждого человека специально адаптированы по сравнению с микробами, которые они могут получить от донора? Как и в случае с группами крови, существуют ли «универсальные доноры» и «универсальные реципиенты»? На эти и многие другие вопросы еще предстоит ответить.
Выводы и проспект
Как и каждый год с момента первоначального секвенирования ДНК, этот год привел к беспрецедентному росту количества данных о последовательностях, собранных с беспрецедентно низкой стоимостью. Также были разработаны или обновлены все более мощные инструменты, используемые для извлечения значимых закономерностей из этого множества данных. Появляются новые технологии, такие как трансплантация стула, 16S рРНК и полногеномное секвенирование на платформе Illumina, возможность с высокой эффективностью трансплантировать человеческие микробные сообщества мышам даже из замороженных образцов [50], а также создание персонализированных коллекций культур [74]. перспектива будущего, в котором методы лечения отдельных людей будут опробоваться на батарее мышей, подвергнутых различным видам лечения, и в которых будут проводиться одноразовые эксперименты, которые выявят эффекты удаления отдельных видов [74] или отдельных генов из внутри вида [75] позволяют понять механизм.Хотя имеющиеся у нас инструменты по-прежнему несовершенны (например, ограниченная длина чтения сегодняшних высокопроизводительных технологий секвенирования ограничивает способность обнаруживать виды и штаммы бактерий, а анализ вирусов и эукариот все еще остается новым рубежом), Перспективы развития механистического понимания факторов, лежащих в основе пластичности микробиома, а затем манипулирования микробиомом для улучшения здоровья, кажутся все более радужными.
Благодарности
Работа, цитируемая в этом обзоре из лаборатории автора, была частично поддержана грантами Национальных институтов здравоохранения [HG4872 (RK)], Американского фонда Крона и колита и Медицинского института Говарда Хьюза [RK] .
Ссылки
2. Петерсон Дж., Гарджес С., Джованни М., Макиннес П., Ван Л., Шлосс Дж. А., Бонацци В., МакИвен Дж. Э., Веттерстранд К. А., Дил С. и др. Проект NIH Human Microbiome Project. Геномные исследования. 2009; 19: 2317–2323. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T., Pons N, Levenez F, Yamada T. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010; 464: 59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Lederberg J, McCray A. Ome sweet ‘omics: — Генеалогическая сокровищница слов. Ученый. 2001; 15: 8. [Google Scholar] 6. ван Левенгук А. Отрывок из письма Антони ван Левенгук от 12 сентября 1683 года. О животных в зубном налете. Философские труды Лондонского королевского общества. 1684; 14: 568–574. [Google Scholar] 7. Pace NR. Молекулярный взгляд на микробное разнообразие и биосферу. Наука. 1997; 276: 734–740. [PubMed] [Google Scholar] 8. Ley RE, Lozupone CA, Hamady M, Knight R, Gordon JI.Миры внутри миров: эволюция микробиоты кишечника позвоночных. Обзоры природы микробиологии. 2008; 6: 776–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Marchesi JR. Прокариотическое и эукариотическое разнообразие кишечника человека. Успехи в прикладной микробиологии, Том 72, 2010; 72: 43–62. [PubMed] [Google Scholar] 11. Брейтбарт М., Хейнс М., Келли С., Энгли Ф., Эдвардс Р. А., Фелтс Б., Махаффи Дж. М., Мюллер Дж., Нултон Дж., Рейхок С. и др. Вирусное разнообразие и динамика в кишечнике младенца. Исследования в микробиологии.2008. 159: 367–373. [PubMed] [Google Scholar] 12. Консорциум IHGS. Завершение эухроматической последовательности генома человека. Природа. 2004; 431: 931–945. [PubMed] [Google Scholar] 13. Уилер Д.А., Сринивасан М., Эгхолм М., Шен Й., Чен Л., МакГуайр А., Хе В., Чен Ю.Дж., Махиджани В., Рот Г.Т. и др. Полный геном человека путем массового параллельного секвенирования ДНК. Природа. 2008; 452: 872–876. [PubMed] [Google Scholar] 14. Фирер Н., Хамади М., Лаубер С.Л., Найт Р. Влияние пола, рукопожатия и стирки на разнообразие бактерий на поверхности рук.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 17994–17999. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Turnbaugh PJ, Hamady M, Yatsunenko T., Cantarel BL, Duncan A, Ley RE, Sogin ML, Jones WJ, Roe BA, Affourtit JP, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009; 457: 480–484. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Kuczynski J, Lauber CL, Walters WA, Parfrey LW, Clemente JC, Gevers D, Knight R. Экспериментальные и аналитические инструменты для изучения микробиома человека.Природа рассматривает генетику. 2012; 13: 47–58. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Schloss PD, Westcott SL, Ryabin T., Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, et al. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом для описания и сравнения сообществ микробов. Прикладная и экологическая микробиология. 2009; 75: 7537–7541. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Хартман А.Л., Риддл С., Макфиллипс Т., Людашер Б., Эйзен Дж.Представляем W.A.T.E.R.S .: рабочий процесс для выравнивания, таксономии и экологии рибосомных последовательностей. Биоинформатика BMC. 2010; 11: 317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б., Фаррис Р. Дж., Кулам-Сайед-Мохидин А. С., МакГаррелл Д. М., Марш Т., ГМ Гаррити, Тидже Дж. М.. Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Исследование нуклеиновых кислот. 2009; 37: D141–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Методы природы. 2010. 7: 335–336. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Kuczynski J, Liu Z, Lozupone C, McDonald D, Fierer N, Knight R. Методы сходства микробных сообществ различаются по своей способности обнаруживать биологически релевантные паттерны. Нат методы. 2010; 7: 813–819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Прикладная и экологическая микробиология.2005; 71: 8228–8235. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Kuczynski J, Costello EK, Nemergut DR, Zaneveld J, Lauber CL, Knights D, Koren O, Fierer N, Kelley ST, Ley RE, et al. Прямое секвенирование микробиома человека легко выявляет различия в сообществах. Геномная биология. 2010; 11 [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Муэгге Б.Д., Кучински Дж., Найтс Д., Клементе Дж. С., Гонсалес А., Фонтана Л., Хенриссат Б., Найт Р., Гордон Дж. И.. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека.Наука. 2011; 332: 970–974. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Найтс Д., Костелло Е.К., Найт Р. Классификация микробиоты человека под руководством. Обзоры микробиологии FEMS. 2011; 35: 343–359. [PubMed] [Google Scholar] 26. Уайт Дж. Р., Нагараджан Н., Поп М. Статистические методы обнаружения дифференциально распространенных особенностей в клинических метагеномных образцах. Вычислительная биология PLoS. 2009; 5: e1000352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз П., Коттманн Р., Филд Д., Найт Р., Коул Дж. Р., Амарал-Цеттлер Л., Гилберт Дж. А., Карш-Мизрахи И., Джонстон А., Кокрейн Дж. И др.Минимум информации о последовательности маркерного гена (MIMARKS) и минимум информации о спецификациях любой (x) последовательности (MIxS). Биотехнология природы. 2011; 29: 415–420. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Йилмаз П., Гилберт Дж., Найт Р., Амарал-Зеттлер Л., Карш-Мизрахи И., Кокрейн Дж., Накамура И., Сансон С.А., Глокнер Ф.О., Филд Д. Консорциум геномных стандартов: воплощение стандартов микробной экологии. Журнал ISME. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мейер Ф., Паарманн Д., Д’Суза М., Олсон Р., Гласс Э.М., Кубал М., Пациан Т., Родригес А., Стивенс Р., Уилке А. и др.RAST-сервер метагеномики — общедоступный ресурс для автоматического филогенетического и функционального анализа метагеномов. BMC Bioinformatics. 2008; 9: 386. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999; 69: 1035S – 1045S. [PubMed] [Google Scholar] 31. Домингес-Белло М.Г., Блазер М.Дж., Лей Р.Е., Найт Р. Развитие микробиоты желудочно-кишечного тракта человека и выводы из высокопроизводительного секвенирования.Гастроэнтерология. 2011; 140: 1713–1719. [PubMed] [Google Scholar] 32. Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 11971–11975. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R, Angenent LT, Ley RE.Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Труды Национальной академии наук США. 2010 [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Фирер Н., Лаубер С.Л., Чжоу Н., Макдональд Д., Костелло Е.К., Найт Р. Криминалистическая идентификация с использованием бактериальных сообществ кожи. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6477–6481. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Caporaso JG, Lauber CL, Costello EK, Berg-Lyons D, Gonzalez A, Stombaugh J, Knights D, Gajer P, Ravel J, Fierer N и др.Движущиеся картинки микробиома человека. Геномная биология. 2011; 12: R50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Костелло Е.К., Лаубер С.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009; 326: 1694–1697. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Кунин В., Энгельбрексон А., Охман Х., Гугенгольц П. Морщины в редкой биосфере: ошибки пиросеквенирования могут привести к искусственному завышению оценок разнообразия. Экологическая микробиология.2010; 12: 118–123. [PubMed] [Google Scholar] 39. Айва К., Ланзен А., Кертис Т.П., Давенпорт Р.Дж., Холл N, руководитель IM, Рид Л.Ф., Слоан В.Т. Точное определение микробного разнообразия по 454 данным пиросеквенирования. Методы природы. 2009; 6: 639–641. [PubMed] [Google Scholar] 40. Sun Y, Cai Y, Huse SM, Knight R, Farmerie WG, Wang X, Mai V. Крупномасштабное эталонное исследование существующих алгоритмов для независимого от таксономии анализа микробного сообщества. Брифинги по биоинформатике. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 41.Schloss PD, Westcott SL. Методы оценки и улучшения, используемые в подходах на основе операционных таксономических единиц для анализа последовательности генов 16S рРНК. Прикладная и экологическая микробиология. 2011; 77: 3219–3226. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Хьюз С.М., Велч Д.М., Моррисон Х.Г., Согин М.Л. Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Экологическая микробиология. 2010; 12: 1889–1898. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Сунь И, Цай И, Лю Л., Ю Ф, Фаррелл М.Л., МакКендри В., Фармери В.ESPRIT: оценка видового богатства с использованием больших коллекций пиросеквенций 16S рРНК. Исследование нуклеиновых кислот. 2009; 37: e76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулл С.Л., Карлебах С., Горле Р., Рассел Дж., Тэкет СО и др. Микробиом влагалища женщин репродуктивного возраста. Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4680–4687. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Arumugam M, Raes J, Pelletier E, Le Paslier D., Yamada T., Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, et al.Энтеротипы микробиома кишечника человека. Природа. 2011; 473: 174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Динсдейл Э.А., Эдвардс Р.А., Холл Д., Энгли Ф., Брейтбарт М., Брюлк Дж. М., Фурлан М., Деснуес С., Хейнс М., Ли Л. и др. Функциональное метагеномное профилирование девяти биомов. Природа. 2008. 452: 629–632. [PubMed] [Google Scholar] 47. Триндж С.Г., фон Меринг Ч., Кобаяши А., Саламов А.А., Чен К., Чанг Х.В., Подар М., Шорт Дж. М., Матур Э. Дж., Деттер Дж. К. и др. Сравнительная метагеномика микробных сообществ. Наука.2005; 308: 554–557. [PubMed] [Google Scholar] 48. Лей Р. Э., Хамади М., Лозупоне С., Тернбо П. Дж., Рэйми Р. Р., Бирчер Дж. С., Шлегель М. Л., Такер Т. А., Шренцель М. Д., Найт Р., Гордон Д. И.. Эволюция млекопитающих и их кишечных микробов. Наука. 2008; 320: 1647–1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Мартин Ф.П., Шпренгер Н., Монтолиу И., Реззи С., Кочхар С., Николсон Дж. Диетическая модуляция функциональной экологии кишечника изучается с помощью фекальной метабономики. Журнал протеомных исследований. 2010; 9: 5284–5295. [PubMed] [Google Scholar] 50.Тернбо П.Дж., Ридаура В.К., Вера Джей-Джей, Рей Ф.И., Рыцарь Р., Гордон Джи. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных мышах-гнотобиотах. Наука трансляционная медицина. 2009; 1: 6ра14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–1031. [PubMed] [Google Scholar] 52. Гилмор М.С., Ферретти Дж. Дж. Микробиология: тонкая грань между кишечным комменсалом и патогеном.Наука. 2003; 299: 1999– +. [PubMed] [Google Scholar] 53. Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S. A. 2004; 101: 15718–15723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Ожирение изменяет микробную экологию кишечника. Труды Национальной академии наук Соединенных Штатов Америки. 2005; 102: 11070–11075.[Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Виджай-Кумар М., Эйткен Д.Д., Карвалью Ф.А., Каллендер Т.С., Мванги С., Сринивасан С., Ситараман С.В., Найт Р., Лей Р.Э., Гевиртц А.Т. Метаболический синдром и измененная микробиота кишечника у мышей, лишенных Toll-подобного рецептора 5. Наука. 2010; 328: 228–231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006; 444: 1022–1023. [PubMed] [Google Scholar] 57. Хехеманн Дж., Коррек Дж., Барбейрон Т., Хельберт В., Чжек М., Мишель Г.Перенос углеводно-активных ферментов от морских бактерий к микробиоте кишечника японцев. Природа. 2010; 464: 908–912. [PubMed] [Google Scholar] 58. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Распространенное влияние антибиотика на микробиоту кишечника человека, выявленное глубоким секвенированием 16S рРНК. Plos Biology. 2008. 6: 2383–2400. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков.Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, что выявлено глубоким секвенированием 16S рРНК. Plos Biology. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека.Журнал ISME. 2007; 1: 56–66. [PubMed] [Google Scholar] 62. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека. Isme Journal. 2007; 1: 56–66. [PubMed] [Google Scholar] 63. Джернберг С., Салливан А., Эдлунд С., Янссон Дж. Мониторинг вызванных антибиотиками изменений в микрофлоре кишечника человека и обнаружение пробиотических штаммов с использованием терминального полиморфизма длины рестрикционных фрагментов. Прикладная и экологическая микробиология.2005. 71: 501–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Jakobsson HE, Jernberg C, Andersson AF, Sjolund-Karlsson M, Jansson JK, Engstrand L. Краткосрочное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS ONE. 2010; 5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Маничан С., Ридер Дж., Гиберт П., Варела Э., Ллопис М., Антолин М., Гиго Р., Найт Р., Гварнер Ф. Изменение микробиома кишечника с помощью бактериальной трансплантации и приема антибиотиков. Геномные исследования.2010; 20: 1411–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Mellow MH, Kanatzar A. Колоноскопическая фекальная бактериотерапия в лечении рецидивирующей инфекции Clostridium difficile — результаты и наблюдение. Журнал Медицинской ассоциации штата Оклахома. 2011; 104: 89–91. [PubMed] [Google Scholar] 67. Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Устойчивое изменение микробиоты толстой кишки путем введения донорской фекальной флоры. Журнал клинической гастроэнтерологии.2010; 44: 551–561. [PubMed] [Google Scholar] 68. Гарборг К., Ваагсбо Б., Сталлемо А., Матре Дж., Сундой А. Результаты инстилляционной терапии фекального донора при рецидивирующей диарее, связанной с Clostridium difficile. Скандинавский журнал инфекционных болезней. 2010; 42: 857–861. [PubMed] [Google Scholar] 69. Сильверман М.С., Дэвис I, Пиллай ДР. Успех самостоятельной трансплантации фекалий в домашних условиях при хронической инфекции Clostridium difficile. Клиническая гастроэнтерология и гепатология: официальный журнал клинической практики Американской гастроэнтерологической ассоциации.2010. 8: 471–473. [PubMed] [Google Scholar] 70. МакКонначи А.А., Фокс Р., Кеннеди Д.Р., Ситон Р.А. Фекальный трансплантат при рецидивирующей диарее, связанной с Clostridium difficile: серия случаев в Великобритании. QJM: ежемесячный журнал Ассоциации врачей. 2009. 102: 781–784. [PubMed] [Google Scholar] 71. Вы DM, Franzos MA, Holman RP. Успешное лечение молниеносной инфекции Clostridium difficile с помощью фекальной бактериотерапии. Анналы внутренней медицины. 2008. 148: 632–633. [PubMed] [Google Scholar] 72. Тведе М, Раск-Мадсен Дж.Бактериотерапия хронической рецидивирующей диареи Clostridium difficile у шести пациентов. Ланцет. 1989; 1: 1156–1160. [PubMed] [Google Scholar] 73. Хоруц А., Диксвед Дж., Янссон Дж. К., Садовски М.Дж. Изменения в составе фекального микробиома человека после бактериотерапии рецидивирующей диареи, связанной с Clostridium difficile. Журнал клинической гастроэнтерологии. 2010; 44: 354–360. [PubMed] [Google Scholar] 74. Вера Дж. Дж., Рей Ф. Е., О’Доннелл Д., Карлссон М., Макналти Н. П., Каллстром Дж., Гудман А. Л., Гордон Дж. И..Создание и характеристика сообществ кишечных микробов человека у мышей-гнотобиотов. Журнал ISME. 2010; 4: 1094–1098. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Гудман А.Л., Макналти Н.П., Чжао Ю., Лейп Д., Митра Р.Д., Лозупоне, Калифорния, Найт Р., Гордон Дж. И.. Определение генетических детерминант, необходимых для создания симбионта кишечника человека в его среде обитания. Клеточный хозяин и микроб. 2009. 6: 279–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Определение микробиома человека
Nutr Rev. Рукопись автора; доступно в PMC 2013 1 февраля.
Опубликовано в окончательной редакции как:
PMCID: PMC3426293
NIHMSID: NIHMS369735
Люк К. Урселл
1 Департамент химии и биохимии, Колорадский университет, 80, Колорадо, США.
Джессика Л. Меткалф
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
Лаура Вегенер Парфри
1 Кафедра химии и биохимии, Колорадский университет в Боулдере , Боулдер, Колорадо, 80309, США
Роб Найт
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Медицинский институт Говарда Хьюза, Боулдер, Колорадо, 80309, США
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Ховард Х. ughes Medical Institute, Боулдер, Колорадо, 80309, США
* Кому следует направлять корреспонденцию: Роб Найт, Департамент химии и биохимии, UCB 215, Университет Колорадо, Боулдер, CO 80309, тел .: 303-492-1984 , Факс: 303-492-7744, уд[email protected] Окончательная отредактированная версия этой статьи издателем доступна на Nutr Rev. См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Быстро развивающиеся методы секвенирования и аналитические методы расширяют нашу способность понимать микробиом человека и, действительно, то, как мы определяем микробиом и его составляющие. В этом обзоре мы выделяем недавние исследования, которые расширяют нашу способность понимать микробиом человека в различных пространственных и временных масштабах, включая ежедневные наборы данных временных рядов, охватывающих месяцы.Кроме того, мы обсуждаем новые концепции, связанные с определением операционных таксономических единиц, индексов разнообразия, основных и временных микробиомов и возможности энтеротипов. Дополнительные достижения в технологии секвенирования и в нашем понимании микробиома откроют захватывающие перспективы для использования микробиоты в персонализированной медицине.
Введение
Микробиота человека состоит из 10–100 триллионов симбиотических микробных клеток, содержащихся в каждом человеке, в первую очередь бактерий в кишечнике; Микробиом человека состоит из генов, содержащихся в этих клетках [1].Проекты микробиома во всем мире были запущены с целью понять роли, которые играют эти симбионты, и их влияние на здоровье человека [2, 3]. Подобно тому, как вопрос «что такое , , чтобы быть человеком?» Беспокоил людей с самого начала записанной истории, вопрос: «что такое , — человеческий микробиом?» вызывает беспокойство у исследователей с тех пор, как этот термин был придуман Джошуа Ледербергом в 2001 году [4]. Уточнение определения микробиома человека осложнилось путаницей в терминологии: например, «микробиота» (таксоны микробов, связанные с людьми) и «микробиом» (каталог этих микробов и их генов) часто используются как синонимы.Кроме того, термин «метагеномика» первоначально относился к характеристике общей ДНК методом дробовика, хотя сейчас он все чаще применяется для изучения маркерных генов, таких как ген 16S рРНК. Однако более фундаментально новые открытия заставляют нас усомниться в концепциях, которые имеют центральное значение для определения микробиома человека, таких как стабильность микробиома человека, определение OTU (операционных таксономических единиц), составляющих микробиоту. , и есть ли у человека один или несколько микробиомов.В этом обзоре мы рассмотрим прогресс в определении микробиома человека в этих различных отношениях.
Изучение разнообразия микробиома человека началось с Антони ван Левенгука, который еще в 1680-х годах сравнивал свою оральную и фекальную микробиоту. Он отметил поразительные различия в микробах между этими двумя средами обитания, а также между образцами, взятыми у людей с состоянием здоровья и болезнью в обоих этих местах [5, 6]. Таким образом, исследования глубоких различий в микробах на разных участках тела и между здоровье и болезни так же стары, как и сама микробиология.Сегодня новым является не способность наблюдать эти очевидные различия, а, скорее, способность использовать мощные молекулярные методы, чтобы понять, почему существуют эти различия, и понять, как мы можем повлиять на преобразования из одного состояния в другое.
Культурально-независимые методы характеристики микробиоты вместе с молекулярным филогенетическим подходом к организации разнообразия жизни обеспечили фундаментальный прорыв, позволив исследователям сравнивать микробные сообщества в разных средах в рамках единого филогенетического контекста (см. Обзор [7]).Хотя связанные с хозяином микробы предположительно попадают в окружающую среду, состав микробиоты млекопитающих, особенно в кишечнике, неожиданно отличается от свободноживущих микробных сообществ [8]. Фактически, анализ бактериального разнообразия свободноживущих сообществ в наземных, морских и пресноводных средах, а также сообществ, связанных с животными, предполагает, что кишечник позвоночных является экстремальным явлением [8]. Напротив, бактериальные сообщества из сред, обычно считающихся экстремальными, таких как кислые горячие источники и гидротермальные источники, похожи на сообщества во многих других средах [9].Это говорит о том, что совместная эволюция между позвоночными и их микробными консорциумами в течение сотен миллионов лет привела к выбору специализированного сообщества микробов, которые процветают в теплой, эвтрофной и стабильной среде кишечника [8]. В кишечнике человека и во всех связанных с человеком средах обитания бактерии составляют основную часть биомассы и разнообразия, хотя археи, эукариоты и вирусы также присутствуют в меньшем количестве, и ими нельзя пренебрегать [10, 11].
Интересно, что оценки каталога генов человека и разнообразия генома человека бледнеют по сравнению с оценками разнообразия микробиома.Например, консорциум Meta-HIT сообщил о каталоге генов из 3,3 миллионов неизбыточных генов только в микробиоме кишечника человека [3] по сравнению с ~ 22 000 генов, присутствующих во всем геноме человека [12]. Точно так же разнообразие микробиома людей огромно по сравнению с вариациями генома: отдельные люди примерно на 99,9% идентичны друг другу с точки зрения генома хозяина [13], но могут отличаться друг от друга на 80-90% с точки зрения генома. микробиом их руки [14] или кишечника [15].Эти результаты показывают, что использование вариаций, содержащихся в микробиоме, будет гораздо более плодотворным в персонализированной медицине, использовании генетических данных отдельного пациента для информирования медицинских решений, чем подходы, нацеленные на относительно постоянный геном хозяина.
Многие фундаментальные вопросы о микробиоме человека до недавнего времени было трудно или невозможно было решить. На некоторые вопросы, такие как вечно популярный «сколько видов обитает на данном участке тела?», Все еще трудно ответить из-за проблем с определениями видов бактерий и скоростью ошибок секвенирования.Другие вопросы, такие как «как разнообразие внутри человека с течением времени соотносится с разнообразием между людьми?» Или «как различие между участками на теле одного и того же человека соотносится с разнообразием между разными людьми на одном участке?» , или «существует ли основной набор видов микробов, которые мы все разделяем?», теперь можно дать окончательный ответ. В следующем разделе мы обсудим некоторые инструменты, которые позволили ответить на эти давние вопросы.
Инструменты для микробного анализа
Резкое сокращение затрат на секвенирование, наблюдавшееся за последние несколько лет, позволило идентифицировать специфические таксоны микробов, обнаруженные в кишечнике человека, которые трудно или невозможно культивировать.Теперь исследователи могут генерировать миллионы последовательностей для каждого образца, чтобы оценить различия в микробных сообществах между участками тела и отдельными людьми. Наша возросшая мощность секвенирования потребовала разработки столь же мощных вычислительных инструментов для обработки растущего количества данных последовательностей, производимых современными технологиями [16]. Существует несколько конвейеров для анализа данных микробного микробного сообщества, таких как mothur [17], w.A.T.E.R.S [18], инструменты RDP pyroseqeuncing [19] и QIIME (произносится «колокольчик») [20].QIIME — это бесплатная платформа с открытым исходным кодом для анализа данных высокопроизводительного секвенирования, которая позволяет пользователям импортировать необработанные данные о последовательностях и быстро производить измерения разнообразия между и внутри образцов. Последовательность в идентификации операционных таксономических единиц (OTU) и установление согласованных мер разнообразия внутри и между выборками имеют решающее значение для сравнения результатов исследований, хотя концепция OTU становится все более проблематичной по мере того, как накапливаются данные о последовательности и приобретаются явные филогенетические подходы. в популярности.
Бета-разнообразие относится к измерению степени различия в членстве или структуре сообщества между двумя выборками. Недавний обзор основанных на таксонах измерений бета-разнообразия показал, что некоторые метрики, в том числе расстояния Канберры и Гауэра, обладают повышенной мощностью для различения кластеров, в то время как другие метрики, такие как хи-квадрат и корреляционные расстояния Пирсона, более подходят для выяснения эффектов. градиентов среды на сообществах [21]. Надежным методом сравнения различий между микробными сообществами является UniFrac, который измеряет долю общих длин ветвей на филогенетическом дереве между образцами [22].Очень похожие микробные сообщества приводят к оценке UniFrac, близкой к 0, в то время как два полностью независимых сообщества, которые не имеют общей длины ветвей (т. Е. Имеют разную эволюционную историю), дают оценку UniFrac, равную 1. Анализ основных координат (PCoA) может затем визуализировать расстояния Unifrac между образцами в двумерном или трехмерном пространстве, что позволяет легко визуально различать кластеризацию похожих сообществ или разделение отдельных сообществ.
UniFrac как мера бета-разнообразия в сочетании с PCoA имеет способность различать различия между сообществами, используя всего 10 последовательностей на образец [23]. Важно понимать, что увеличенная глубина секвенирования не всегда необходима для получения биологически значимых результатов, когда эти результаты очевидны. Таким образом, выбирая измерения разнообразия, которые подходят для дизайна исследования, исследователи, использующие современные методы секвенирования, могут охарактеризовать различия между выборками при относительно низком охвате последовательностей.Это позволяет исследователям оценивать мелкозернистые пространственные и временные закономерности, характеризуя от сотен до тысяч образцов, таких как временные ряды по нескольким пациентам или средам. Функциональность UniFrac, а также множество измерений разнесения доступны в QIIME, и их можно легко сравнить.
В общем, конвейеры для анализа 16S рРНК и метагеномных данных дробовика имеют отдельные рабочие процессы. Некоторые начальные шаги, такие как демультиплексирование (удаление штрих-кодов и разделение объединенных образцов) и качественная фильтрация, являются общими для обоих конвейеров.Однако для данных 16S рРНК последовательности должны быть сгруппированы в OTU, химерные последовательности, генерируемые неполным расширением матрицы, должны быть удалены, и должны быть построены филогенетические деревья. Напротив, в метагеномном конвейере последовательности должны быть назначены функциям, а также таксономии (либо как целые чтения, либо после сборки). Как только таксоны или таблицы функций генов построены, конвейеры начинают сближаться, по крайней мере, концептуально: тогда интерес заключается в 1) составе каждой выборки, 2) поиске таксонов или функций, которые различают группы выборок (например,грамм. в соответствии с клиническими параметрами) и 3) с вопросом, группируются ли образцы в соответствии с какими-либо измеренными клиническими состояниями (или по времени). Одно интересное развивающееся направление — сравнение метагеномной кластеризации и кластеризации 16S рРНК напрямую с использованием метода, называемого анализом Прокруста, который позволяет комбинировать графики PCoA [24]. Еще один мощный инструмент — использование машинного обучения и статистических методов для построения прогнозных моделей таксонов [25] или функций [26], которые различают группы выборок.
Уникальным преимуществом QIIME по сравнению с другими конвейерами является его способность использовать «образцы метаданных», например клиническая информация о субъектах, позволяющая визуализировать основные закономерности в данных. Особый интерес представляет то, что QIIME поддерживает стандарт MIMARKS (минимальная информация о последовательности маркеров) [27], разработанный Консорциумом геномных стандартов [28], который становится все более популярным среди других инструментов для анализа микробов и сообществ, таких как MG-RAST [29]. , и был принят INSDC (Международный консорциум баз данных нуклеотидных последовательностей, который включает GenBank, EBI и DDBJ) в качестве стандарта для метаданных.
С этими инструментами основные закономерности сходства и различия в микробиоте стали обычным делом. Ключевая задача в настоящее время состоит в том, чтобы расширить анализ, включив в него лонгитюдные исследования и понять роль конкретных хозяев и факторов окружающей среды в развитии и поддержании микробиома.
Динамическое взаимодействие между человеческими микробами и окружающей средой
Желудочно-кишечный тракт (ЖКТ) младенца человека обеспечивает совершенно новую среду для микробной колонизации [30].Действительно, микробиота, которую начинает приобретать младенец, сильно зависит от способа родов [31]. Через двадцать минут после рождения микробиота новорожденных, рожденных через естественные родовые пути, напоминает микробиоту влагалища их матери, в то время как младенцы, рожденные с помощью кесарева сечения, содержат микробные сообщества, обычно встречающиеся на коже человека [32]. Приобретение микробиоты продолжается в течение первых нескольких лет жизни, поскольку микробиом желудочно-кишечного тракта младенца начинает напоминать микробиом взрослого уже на первом году жизни [33].В одном тематическом исследовании микробиоты младенца в течение первых 2,5 лет жизни филогенетическое разнообразие значительно и линейно увеличивается со временем [34]. Кроме того, значительные изменения в составе кишечной микробиоты были очевидны в пяти временных точках; переход на грудное молоко, развитие лихорадки на 92 день, введение рисовых хлопьев на 134 день, введение смеси и столовых продуктов на 161 день, а также лечение антибиотиками и диета для взрослых на 371 день [34]. Интересно, что каждое изменение диеты сопровождалось изменениями микробиоты кишечника и обогащением соответствующих генов.Например, когда младенец начал получать полноценную взрослую диету, гены в микробиоме, связанные с биосинтезом витаминов и перевариванием полисахаридов, стали обогащаться [34].
Взаимодействие между микробиотой человека и окружающей средой носит динамичный характер, при этом человеческие микробы свободно перемещаются на поверхности, с которыми мы взаимодействуем каждый день. Fierer et al. показали, что кончики пальцев человека могут переносить сообщества микробов на клавиатуру, и эти сообщества сильно дифференцируют людей [35].Графики PCoA показали, что можно было определить, какие пальцы печатали на каких клавишах и какие люди использовали какие клавиатуры: можно было даже связать руку человека с компьютерной мышью, которую он использует, с точностью до 95% по сравнению с база данных других рук [35]. В целом, это исследование показало, что микробные сообщества постоянно переносятся между поверхностями и что существует динамическое взаимодействие между микробиотой окружающей среды и различными участками человеческого тела.
Внутриличностное микробное разнообразие
Еще один интересный вопрос, на который мы только начинаем отвечать, — насколько стабильным со временем становится микробиом внутри человека.Определив, что составляет нормальные временные изменения у человека с течением времени, мы сможем лучше количественно оценить и понять изменения в микробных сообществах, которые возникают в результате диетических и фармацевтических вмешательств. В самом продолжительном на сегодняшний день исследовании временных рядов Caporaso et al. отобрали образцы микробных сообществ двух индивидуумов в кишечнике, ротовой полости, левой и правой ладонях за 396 временных точек в течение 15 месяцев [36]. Сообщества на разных участках тела можно было легко отличить друг от друга с помощью трехмерных графиков PCoA в течение одного года, даже несмотря на то, что структура сообщества на данном участке сильно варьировала [36].Уровень разнообразия также различается между участками тела, при этом во рту и кишечнике находятся самые разные сообщества [37]. Взятые вместе, эти исследования показывают, что микробиота человека представляет собой сильно изменчивую и разрозненную экосистему.
В целом, еще предстоит окончательно доказать, что отдельные особи или даже участки тела несут в себе «основной» набор специфических бактериальных таксонов. Например, консорциум Meta-HIT определил «основной» набор клонов как те, которые присутствовали у половины изучаемых субъектов, хотя, по существу, у всех изучаемых субъектов гены не присутствовали [3].Конечно, важно понимать, что глубина отбора проб может иметь решающее значение для различения таксонов, которые отсутствуют, от таксонов, которые просто очень редки; динамический диапазон численности микробов также довольно велик, и даже для «основных» генов Meta-HIT 2000-кратные диапазоны численности не были редкостью. Доказать, что таксон полностью отсутствует в кишечнике, невозможно с помощью этих типов исследований, поэтому основные расчеты всегда должны включать в себя предупреждение о глубине секвенирования. Еще один фактор, который следует учитывать при определении разнообразия и ядра, заключается в том, что методологические артефакты могут значительно увеличить видимое количество OTU в выборке (и, следовательно, уменьшить видимую долю, которая разделяется).Как ошибка секвенирования [38, 39], так и проблемы, связанные с выравниванием, особенно множественным выравниванием последовательностей [40-43], могут сильно увеличить количество OTU. Важно убедиться, что при проведении оценок керна использовались одни и те же методологические процедуры с точки зрения доли особей, в которой керн должен быть представлен, минимальной численности и процедуры принятия решения, какие последовательности считаются «одинаковыми». Наконец, существует ключевой вопрос о том, структурированы ли вариации вокруг ядра таким образом, чтобы люди имели лишь несколько общих типов профилей микробиоты на данном участке тела: это хорошо установлено для влагалища [44], но более спорно для кишечника [ 45].В общем, следует проявлять крайнюю осторожность при выполнении процедур кластеризации, так как многие из них разбивают непрерывное изменение на кластеры, которых не существует [21]. Надежные процедуры выбора модели, которые включают возможность существования только непрерывных вариаций, а не дискретных кластеров, еще предстоит разработать в контексте анализа микробного сообщества.
Появляется все больше свидетельств того, что люди на самом деле разделяют «основной микробиом», а не «стержневую микробиоту». В исследовании пар монозиготных и дизиготных близнецов, согласных по ожирению или худобе, у всех индивидуумов была общая подгруппа идентифицируемых микробных генов, но не видов [15].Примечательно, что совершенно разные наборы видов микробов дали очень похожие функциональные пути KEGG. Однако отклонения от этого основного микробиома были очевидны у субъектов с ожирением, что свидетельствует о важности использования метагеномных данных в дополнение к определению состава микробного сообщества с помощью исследований маркерного гена 16S при оценке различий между болезненными состояниями. Будет интересно понять, верен ли этот принцип для других участков тела; кросс-биомные метагеномные сравнения на сегодняшний день чрезвычайно редки [46, 47].
Микробиом кишечника играет важную роль в пищеварении и питании.
Доказательства неразрывной связи между микробиотой, пищеварением и метаболизмом хозяина растут. При анализе людей и 59 дополнительных видов млекопитающих последовательности 16S рРНК сгруппированы вместе плотоядных, всеядных и травоядных в основном координатном пространстве, показывая, что структуры сообщества различаются в зависимости от диеты [48]. Изменения в рационе мышей также могут привести к значительным изменениям в метаболизме бактерий, особенно жирных кислот и аминокислот с небольшой цепью, всего за одну неделю [49] и могут привести к большим изменениям уже через один день [50].Важно отметить, что генетическое разнообразие, обнаруженное в нашей кишечной микробиоте, позволяет нам переваривать соединения посредством метаболических путей, явно не закодированных в геноме млекопитающих, что значительно увеличивает нашу способность извлекать энергию из наших разнообразных диет [51, 52].
Микробиота кишечника также играет важную роль в ожирении. У здоровых мышей, которым трансплантируют кишечную микробиоту от обычных мышей, наблюдается увеличение ожирения без увеличения потребления пищи из-за увеличения извлечения энергии из рациона и увеличения депонирования энергии в адипоцитах хозяина [53].Два основных микробных подразделения, Firmicutes и Bacteriodetes, демонстрируют разную численность в зависимости от фенотипа. Уменьшение Bacteriodetes и увеличение Firmicutes было обнаружено у мышей с генетическим ожирением ( ob / ob ) по сравнению с их худыми коллегами [54], а фенотип ожирения может даже передаваться беспроблемным, но генетически диким типам мышей. микробиоты, а фенотип обусловлен энергетическим балансом: калориметрия фекальных гранул с помощью бомбы показывает, что мыши ob / ob извлекают больше энергии из своего рациона и оставляют меньше с фекалиями [51].Примечательно, что те же эффекты справедливы и для другой модели мышей, мышей с нокаутом TLR5, которые также становятся тучными в некоторых помещениях для мышей (но заболевают колитом в других, предположительно из-за различий в фоновой микробиоте). Мыши с нокаутом TLR5 также обладают фенотипом трансмиссивного ожирения, но никакой разницы в эффективности сбора энергии не происходит. Вместо этого измененная микробиота каким-то образом делает мышей более голодными, и их вызванное микробами ожирение можно вылечить, ограничив количество пищи в их клетках тем, которое потребляется мышами дикого типа, а также антибиотиками [55].Корреляция между микробами и ожирением, возможно, лучше всего иллюстрируется потерей веса. Поскольку разные группы людей были помещены на диету с ограничением жиров или углеводов, их количество Bacteriodetes увеличивалось по мере снижения их массы тела, переходя от характерного «тучного» микробного сообщества к «худому» сообществу [56]. Таким образом, изменение микробиоты пациента может быть терапевтическим вариантом, способствующим снижению веса у пациентов с ожирением или способствующим увеличению веса у детей с недостаточным весом.
Удивительно, но микробы, которые мы поглощаем вместе с пищей, могут обеспечивать наш индивидуальный микробиом новыми генами для переваривания новой пищи. Hehemann et al. обнаружили, что новый класс гликозидгидролаз, используемых для переваривания порфирана, полисахарида, распространенного в красных водорослях, также был обнаружен в образцах стула человека в качестве гена в Bacteriodes plebeius . Более тщательное изучение метаданных стула показало, что образцы стула, содержащие ген, переваривающий порфиран, присутствовали только у японцев; ген не был обнаружен в микробиоме кишечника жителей Соединенных Штатов.Почему в кишечнике человека можно найти морской ген? Авторы пришли к выводу, что водоросли, распространенные в японской, но не американской диете, содержат микроорганизмы, которые передали гены микробиому кишечника [57]. Таким образом, микробы обладают способностью значительно увеличивать количество метаболических инструментов в кишечнике человека, позволяя нам переваривать множество субстратов.
Пластичность кишечника человека
Учитывая относительную стабильность микробиоты кишечника человека, один из ключевых вопросов заключается в том, является ли он достаточно пластичным, чтобы позволить четко определенные вмешательства для улучшения здоровья.Как описано выше, микробиота кишечника после установления остается довольно стабильной во времени, по крайней мере, по сравнению с различиями между людьми. Однако ряд исследований демонстрирует, что внешние силы могут изменять сообщество микробов, расположенных в желудочно-кишечном тракте, и антибиотики являются важным примером.
Антибиотики в основном используются для борьбы с патогенными видами бактерий, которые обитают внутри хозяина или вторглись в него, однако нынешнее поколение антибиотиков имеет широкий спектр действия и нацелено также на широкие слои нормальной микробиоты.Таким образом, антибиотики значительно влияют на врожденную микробиоту кишечника хозяина. Через три-четыре дня после лечения ципрофлоксацином, антибиотиком широкого спектра действия, кишечная микробиота испытывает снижение таксономического богатства, разнообразия и однородности [58, 59]. Значительные изменения микробиоты кишечника продемонстрировали значительную межличностную изменчивость. В то время как микробиота кишечника начала напоминать состояние до лечения через неделю после лечения, между людьми наблюдались различия в том, насколько близко сообщество после лечения напоминало сообщество до лечения, а некоторые таксоны не смогли вернуться в сообщество [59 , 60].Действительно, восстановление некоторых видов может происходить в течение четырех лет после лечения антибиотиками [61]. Тем не менее, общее восстановление микробиоты кишечника после лечения антибиотиками предполагает, что существуют факторы внутри сообщества, биотические или абиотические, которые способствуют устойчивости сообщества, хотя они еще не выяснены.
Другие антибиотики также имеют тенденцию давать результаты, которые существенно различаются между субъектами [62, 63] и даже участками тела [64]. Поскольку более крупные группы населения еще не были изучены, отчасти из-за этических проблем с назначением антибиотиков здоровым людям, причины этих основных различий еще не выяснены.Понимание факторов, определяющих способность микробиоты противостоять возмущениям и восстанавливаться после них, а также понимание факторов, определяющих ее текущее состояние, будет ключом к разработке инструментов, помогающих манипулировать микробиомами. Например, как ни странно, у крыс введение антибиотиков перед трансплантацией слепой кишки фактически снижает вероятность появления новых микробов [65].
Интересным намеком на то, что микробиота может быть более пластичной, чем можно было представить, является недавний успех лечения стойких инфекций Clostridum difficile с помощью трансплантации кала, который был успешным в ряде исследований [66-72] и в целом. обедненное кишечное сообщество, образовавшееся во время C.difficile заменяется донорским сообществом [67, 73]. Успех этой техники впечатляет, особенно если учесть, как мало известно о самом лучшем сообществе, которое можно предоставить. Например, что лучше: получить фекальное сообщество близкого родственника или сожителя или, возможно, сохранить собственный стул перед началом лечения антибиотиками, чтобы его можно было восстановить позже? Подходит ли один и тот же стул для всех, или огромные различия в микробиоте означают, что микробы каждого человека специально адаптированы по сравнению с микробами, которые они могут получить от донора? Как и в случае с группами крови, существуют ли «универсальные доноры» и «универсальные реципиенты»? На эти и многие другие вопросы еще предстоит ответить.
Выводы и проспект
Как и каждый год с момента первоначального секвенирования ДНК, этот год привел к беспрецедентному росту количества данных о последовательностях, собранных с беспрецедентно низкой стоимостью. Также были разработаны или обновлены все более мощные инструменты, используемые для извлечения значимых закономерностей из этого множества данных. Появляются новые технологии, такие как трансплантация стула, 16S рРНК и полногеномное секвенирование на платформе Illumina, возможность с высокой эффективностью трансплантировать человеческие микробные сообщества мышам даже из замороженных образцов [50], а также создание персонализированных коллекций культур [74]. перспектива будущего, в котором методы лечения отдельных людей будут опробоваться на батарее мышей, подвергнутых различным видам лечения, и в которых будут проводиться одноразовые эксперименты, которые выявят эффекты удаления отдельных видов [74] или отдельных генов из внутри вида [75] позволяют понять механизм.Хотя имеющиеся у нас инструменты по-прежнему несовершенны (например, ограниченная длина чтения сегодняшних высокопроизводительных технологий секвенирования ограничивает способность обнаруживать виды и штаммы бактерий, а анализ вирусов и эукариот все еще остается новым рубежом), Перспективы развития механистического понимания факторов, лежащих в основе пластичности микробиома, а затем манипулирования микробиомом для улучшения здоровья, кажутся все более радужными.
Благодарности
Работа, цитируемая в этом обзоре из лаборатории автора, была частично поддержана грантами Национальных институтов здравоохранения [HG4872 (RK)], Американского фонда Крона и колита и Медицинского института Говарда Хьюза [RK] .
Ссылки
2. Петерсон Дж., Гарджес С., Джованни М., Макиннес П., Ван Л., Шлосс Дж. А., Бонацци В., МакИвен Дж. Э., Веттерстранд К. А., Дил С. и др. Проект NIH Human Microbiome Project. Геномные исследования. 2009; 19: 2317–2323. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T., Pons N, Levenez F, Yamada T. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010; 464: 59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Lederberg J, McCray A. Ome sweet ‘omics: — Генеалогическая сокровищница слов. Ученый. 2001; 15: 8. [Google Scholar] 6. ван Левенгук А. Отрывок из письма Антони ван Левенгук от 12 сентября 1683 года. О животных в зубном налете. Философские труды Лондонского королевского общества. 1684; 14: 568–574. [Google Scholar] 7. Pace NR. Молекулярный взгляд на микробное разнообразие и биосферу. Наука. 1997; 276: 734–740. [PubMed] [Google Scholar] 8. Ley RE, Lozupone CA, Hamady M, Knight R, Gordon JI.Миры внутри миров: эволюция микробиоты кишечника позвоночных. Обзоры природы микробиологии. 2008; 6: 776–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Marchesi JR. Прокариотическое и эукариотическое разнообразие кишечника человека. Успехи в прикладной микробиологии, Том 72, 2010; 72: 43–62. [PubMed] [Google Scholar] 11. Брейтбарт М., Хейнс М., Келли С., Энгли Ф., Эдвардс Р. А., Фелтс Б., Махаффи Дж. М., Мюллер Дж., Нултон Дж., Рейхок С. и др. Вирусное разнообразие и динамика в кишечнике младенца. Исследования в микробиологии.2008. 159: 367–373. [PubMed] [Google Scholar] 12. Консорциум IHGS. Завершение эухроматической последовательности генома человека. Природа. 2004; 431: 931–945. [PubMed] [Google Scholar] 13. Уилер Д.А., Сринивасан М., Эгхолм М., Шен Й., Чен Л., МакГуайр А., Хе В., Чен Ю.Дж., Махиджани В., Рот Г.Т. и др. Полный геном человека путем массового параллельного секвенирования ДНК. Природа. 2008; 452: 872–876. [PubMed] [Google Scholar] 14. Фирер Н., Хамади М., Лаубер С.Л., Найт Р. Влияние пола, рукопожатия и стирки на разнообразие бактерий на поверхности рук.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 17994–17999. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Turnbaugh PJ, Hamady M, Yatsunenko T., Cantarel BL, Duncan A, Ley RE, Sogin ML, Jones WJ, Roe BA, Affourtit JP, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009; 457: 480–484. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Kuczynski J, Lauber CL, Walters WA, Parfrey LW, Clemente JC, Gevers D, Knight R. Экспериментальные и аналитические инструменты для изучения микробиома человека.Природа рассматривает генетику. 2012; 13: 47–58. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Schloss PD, Westcott SL, Ryabin T., Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, et al. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом для описания и сравнения сообществ микробов. Прикладная и экологическая микробиология. 2009; 75: 7537–7541. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Хартман А.Л., Риддл С., Макфиллипс Т., Людашер Б., Эйзен Дж.Представляем W.A.T.E.R.S .: рабочий процесс для выравнивания, таксономии и экологии рибосомных последовательностей. Биоинформатика BMC. 2010; 11: 317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б., Фаррис Р. Дж., Кулам-Сайед-Мохидин А. С., МакГаррелл Д. М., Марш Т., ГМ Гаррити, Тидже Дж. М.. Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Исследование нуклеиновых кислот. 2009; 37: D141–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Методы природы. 2010. 7: 335–336. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Kuczynski J, Liu Z, Lozupone C, McDonald D, Fierer N, Knight R. Методы сходства микробных сообществ различаются по своей способности обнаруживать биологически релевантные паттерны. Нат методы. 2010; 7: 813–819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Прикладная и экологическая микробиология.2005; 71: 8228–8235. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Kuczynski J, Costello EK, Nemergut DR, Zaneveld J, Lauber CL, Knights D, Koren O, Fierer N, Kelley ST, Ley RE, et al. Прямое секвенирование микробиома человека легко выявляет различия в сообществах. Геномная биология. 2010; 11 [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Муэгге Б.Д., Кучински Дж., Найтс Д., Клементе Дж. С., Гонсалес А., Фонтана Л., Хенриссат Б., Найт Р., Гордон Дж. И.. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека.Наука. 2011; 332: 970–974. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Найтс Д., Костелло Е.К., Найт Р. Классификация микробиоты человека под руководством. Обзоры микробиологии FEMS. 2011; 35: 343–359. [PubMed] [Google Scholar] 26. Уайт Дж. Р., Нагараджан Н., Поп М. Статистические методы обнаружения дифференциально распространенных особенностей в клинических метагеномных образцах. Вычислительная биология PLoS. 2009; 5: e1000352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз П., Коттманн Р., Филд Д., Найт Р., Коул Дж. Р., Амарал-Цеттлер Л., Гилберт Дж. А., Карш-Мизрахи И., Джонстон А., Кокрейн Дж. И др.Минимум информации о последовательности маркерного гена (MIMARKS) и минимум информации о спецификациях любой (x) последовательности (MIxS). Биотехнология природы. 2011; 29: 415–420. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Йилмаз П., Гилберт Дж., Найт Р., Амарал-Зеттлер Л., Карш-Мизрахи И., Кокрейн Дж., Накамура И., Сансон С.А., Глокнер Ф.О., Филд Д. Консорциум геномных стандартов: воплощение стандартов микробной экологии. Журнал ISME. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мейер Ф., Паарманн Д., Д’Суза М., Олсон Р., Гласс Э.М., Кубал М., Пациан Т., Родригес А., Стивенс Р., Уилке А. и др.RAST-сервер метагеномики — общедоступный ресурс для автоматического филогенетического и функционального анализа метагеномов. BMC Bioinformatics. 2008; 9: 386. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999; 69: 1035S – 1045S. [PubMed] [Google Scholar] 31. Домингес-Белло М.Г., Блазер М.Дж., Лей Р.Е., Найт Р. Развитие микробиоты желудочно-кишечного тракта человека и выводы из высокопроизводительного секвенирования.Гастроэнтерология. 2011; 140: 1713–1719. [PubMed] [Google Scholar] 32. Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 11971–11975. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R, Angenent LT, Ley RE.Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Труды Национальной академии наук США. 2010 [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Фирер Н., Лаубер С.Л., Чжоу Н., Макдональд Д., Костелло Е.К., Найт Р. Криминалистическая идентификация с использованием бактериальных сообществ кожи. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6477–6481. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Caporaso JG, Lauber CL, Costello EK, Berg-Lyons D, Gonzalez A, Stombaugh J, Knights D, Gajer P, Ravel J, Fierer N и др.Движущиеся картинки микробиома человека. Геномная биология. 2011; 12: R50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Костелло Е.К., Лаубер С.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009; 326: 1694–1697. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Кунин В., Энгельбрексон А., Охман Х., Гугенгольц П. Морщины в редкой биосфере: ошибки пиросеквенирования могут привести к искусственному завышению оценок разнообразия. Экологическая микробиология.2010; 12: 118–123. [PubMed] [Google Scholar] 39. Айва К., Ланзен А., Кертис Т.П., Давенпорт Р.Дж., Холл N, руководитель IM, Рид Л.Ф., Слоан В.Т. Точное определение микробного разнообразия по 454 данным пиросеквенирования. Методы природы. 2009; 6: 639–641. [PubMed] [Google Scholar] 40. Sun Y, Cai Y, Huse SM, Knight R, Farmerie WG, Wang X, Mai V. Крупномасштабное эталонное исследование существующих алгоритмов для независимого от таксономии анализа микробного сообщества. Брифинги по биоинформатике. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 41.Schloss PD, Westcott SL. Методы оценки и улучшения, используемые в подходах на основе операционных таксономических единиц для анализа последовательности генов 16S рРНК. Прикладная и экологическая микробиология. 2011; 77: 3219–3226. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Хьюз С.М., Велч Д.М., Моррисон Х.Г., Согин М.Л. Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Экологическая микробиология. 2010; 12: 1889–1898. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Сунь И, Цай И, Лю Л., Ю Ф, Фаррелл М.Л., МакКендри В., Фармери В.ESPRIT: оценка видового богатства с использованием больших коллекций пиросеквенций 16S рРНК. Исследование нуклеиновых кислот. 2009; 37: e76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулл С.Л., Карлебах С., Горле Р., Рассел Дж., Тэкет СО и др. Микробиом влагалища женщин репродуктивного возраста. Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4680–4687. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Arumugam M, Raes J, Pelletier E, Le Paslier D., Yamada T., Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, et al.Энтеротипы микробиома кишечника человека. Природа. 2011; 473: 174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Динсдейл Э.А., Эдвардс Р.А., Холл Д., Энгли Ф., Брейтбарт М., Брюлк Дж. М., Фурлан М., Деснуес С., Хейнс М., Ли Л. и др. Функциональное метагеномное профилирование девяти биомов. Природа. 2008. 452: 629–632. [PubMed] [Google Scholar] 47. Триндж С.Г., фон Меринг Ч., Кобаяши А., Саламов А.А., Чен К., Чанг Х.В., Подар М., Шорт Дж. М., Матур Э. Дж., Деттер Дж. К. и др. Сравнительная метагеномика микробных сообществ. Наука.2005; 308: 554–557. [PubMed] [Google Scholar] 48. Лей Р. Э., Хамади М., Лозупоне С., Тернбо П. Дж., Рэйми Р. Р., Бирчер Дж. С., Шлегель М. Л., Такер Т. А., Шренцель М. Д., Найт Р., Гордон Д. И.. Эволюция млекопитающих и их кишечных микробов. Наука. 2008; 320: 1647–1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Мартин Ф.П., Шпренгер Н., Монтолиу И., Реззи С., Кочхар С., Николсон Дж. Диетическая модуляция функциональной экологии кишечника изучается с помощью фекальной метабономики. Журнал протеомных исследований. 2010; 9: 5284–5295. [PubMed] [Google Scholar] 50.Тернбо П.Дж., Ридаура В.К., Вера Джей-Джей, Рей Ф.И., Рыцарь Р., Гордон Джи. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных мышах-гнотобиотах. Наука трансляционная медицина. 2009; 1: 6ра14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–1031. [PubMed] [Google Scholar] 52. Гилмор М.С., Ферретти Дж. Дж. Микробиология: тонкая грань между кишечным комменсалом и патогеном.Наука. 2003; 299: 1999– +. [PubMed] [Google Scholar] 53. Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S. A. 2004; 101: 15718–15723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Ожирение изменяет микробную экологию кишечника. Труды Национальной академии наук Соединенных Штатов Америки. 2005; 102: 11070–11075.[Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Виджай-Кумар М., Эйткен Д.Д., Карвалью Ф.А., Каллендер Т.С., Мванги С., Сринивасан С., Ситараман С.В., Найт Р., Лей Р.Э., Гевиртц А.Т. Метаболический синдром и измененная микробиота кишечника у мышей, лишенных Toll-подобного рецептора 5. Наука. 2010; 328: 228–231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006; 444: 1022–1023. [PubMed] [Google Scholar] 57. Хехеманн Дж., Коррек Дж., Барбейрон Т., Хельберт В., Чжек М., Мишель Г.Перенос углеводно-активных ферментов от морских бактерий к микробиоте кишечника японцев. Природа. 2010; 464: 908–912. [PubMed] [Google Scholar] 58. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Распространенное влияние антибиотика на микробиоту кишечника человека, выявленное глубоким секвенированием 16S рРНК. Plos Biology. 2008. 6: 2383–2400. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков.Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, что выявлено глубоким секвенированием 16S рРНК. Plos Biology. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека.Журнал ISME. 2007; 1: 56–66. [PubMed] [Google Scholar] 62. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека. Isme Journal. 2007; 1: 56–66. [PubMed] [Google Scholar] 63. Джернберг С., Салливан А., Эдлунд С., Янссон Дж. Мониторинг вызванных антибиотиками изменений в микрофлоре кишечника человека и обнаружение пробиотических штаммов с использованием терминального полиморфизма длины рестрикционных фрагментов. Прикладная и экологическая микробиология.2005. 71: 501–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Jakobsson HE, Jernberg C, Andersson AF, Sjolund-Karlsson M, Jansson JK, Engstrand L. Краткосрочное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS ONE. 2010; 5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Маничан С., Ридер Дж., Гиберт П., Варела Э., Ллопис М., Антолин М., Гиго Р., Найт Р., Гварнер Ф. Изменение микробиома кишечника с помощью бактериальной трансплантации и приема антибиотиков. Геномные исследования.2010; 20: 1411–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Mellow MH, Kanatzar A. Колоноскопическая фекальная бактериотерапия в лечении рецидивирующей инфекции Clostridium difficile — результаты и наблюдение. Журнал Медицинской ассоциации штата Оклахома. 2011; 104: 89–91. [PubMed] [Google Scholar] 67. Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Устойчивое изменение микробиоты толстой кишки путем введения донорской фекальной флоры. Журнал клинической гастроэнтерологии.2010; 44: 551–561. [PubMed] [Google Scholar] 68. Гарборг К., Ваагсбо Б., Сталлемо А., Матре Дж., Сундой А. Результаты инстилляционной терапии фекального донора при рецидивирующей диарее, связанной с Clostridium difficile. Скандинавский журнал инфекционных болезней. 2010; 42: 857–861. [PubMed] [Google Scholar] 69. Сильверман М.С., Дэвис I, Пиллай ДР. Успех самостоятельной трансплантации фекалий в домашних условиях при хронической инфекции Clostridium difficile. Клиническая гастроэнтерология и гепатология: официальный журнал клинической практики Американской гастроэнтерологической ассоциации.2010. 8: 471–473. [PubMed] [Google Scholar] 70. МакКонначи А.А., Фокс Р., Кеннеди Д.Р., Ситон Р.А. Фекальный трансплантат при рецидивирующей диарее, связанной с Clostridium difficile: серия случаев в Великобритании. QJM: ежемесячный журнал Ассоциации врачей. 2009. 102: 781–784. [PubMed] [Google Scholar] 71. Вы DM, Franzos MA, Holman RP. Успешное лечение молниеносной инфекции Clostridium difficile с помощью фекальной бактериотерапии. Анналы внутренней медицины. 2008. 148: 632–633. [PubMed] [Google Scholar] 72. Тведе М, Раск-Мадсен Дж.Бактериотерапия хронической рецидивирующей диареи Clostridium difficile у шести пациентов. Ланцет. 1989; 1: 1156–1160. [PubMed] [Google Scholar] 73. Хоруц А., Диксвед Дж., Янссон Дж. К., Садовски М.Дж. Изменения в составе фекального микробиома человека после бактериотерапии рецидивирующей диареи, связанной с Clostridium difficile. Журнал клинической гастроэнтерологии. 2010; 44: 354–360. [PubMed] [Google Scholar] 74. Вера Дж. Дж., Рей Ф. Е., О’Доннелл Д., Карлссон М., Макналти Н. П., Каллстром Дж., Гудман А. Л., Гордон Дж. И..Создание и характеристика сообществ кишечных микробов человека у мышей-гнотобиотов. Журнал ISME. 2010; 4: 1094–1098. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Гудман А.Л., Макналти Н.П., Чжао Ю., Лейп Д., Митра Р.Д., Лозупоне, Калифорния, Найт Р., Гордон Дж. И.. Определение генетических детерминант, необходимых для создания симбионта кишечника человека в его среде обитания. Клеточный хозяин и микроб. 2009. 6: 279–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Определение микробиома человека
Nutr Rev. Рукопись автора; доступно в PMC 2013 1 февраля.
Опубликовано в окончательной редакции как:
PMCID: PMC3426293
NIHMSID: NIHMS369735
Люк К. Урселл
1 Департамент химии и биохимии, Колорадский университет, 80, Колорадо, США.
Джессика Л. Меткалф
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
Лаура Вегенер Парфри
1 Кафедра химии и биохимии, Колорадский университет в Боулдере , Боулдер, Колорадо, 80309, США
Роб Найт
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Медицинский институт Говарда Хьюза, Боулдер, Колорадо, 80309, США
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Ховард Х. ughes Medical Institute, Боулдер, Колорадо, 80309, США
* Кому следует направлять корреспонденцию: Роб Найт, Департамент химии и биохимии, UCB 215, Университет Колорадо, Боулдер, CO 80309, тел .: 303-492-1984 , Факс: 303-492-7744, уд[email protected] Окончательная отредактированная версия этой статьи издателем доступна на Nutr Rev. См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Быстро развивающиеся методы секвенирования и аналитические методы расширяют нашу способность понимать микробиом человека и, действительно, то, как мы определяем микробиом и его составляющие. В этом обзоре мы выделяем недавние исследования, которые расширяют нашу способность понимать микробиом человека в различных пространственных и временных масштабах, включая ежедневные наборы данных временных рядов, охватывающих месяцы.Кроме того, мы обсуждаем новые концепции, связанные с определением операционных таксономических единиц, индексов разнообразия, основных и временных микробиомов и возможности энтеротипов. Дополнительные достижения в технологии секвенирования и в нашем понимании микробиома откроют захватывающие перспективы для использования микробиоты в персонализированной медицине.
Введение
Микробиота человека состоит из 10–100 триллионов симбиотических микробных клеток, содержащихся в каждом человеке, в первую очередь бактерий в кишечнике; Микробиом человека состоит из генов, содержащихся в этих клетках [1].Проекты микробиома во всем мире были запущены с целью понять роли, которые играют эти симбионты, и их влияние на здоровье человека [2, 3]. Подобно тому, как вопрос «что такое , , чтобы быть человеком?» Беспокоил людей с самого начала записанной истории, вопрос: «что такое , — человеческий микробиом?» вызывает беспокойство у исследователей с тех пор, как этот термин был придуман Джошуа Ледербергом в 2001 году [4]. Уточнение определения микробиома человека осложнилось путаницей в терминологии: например, «микробиота» (таксоны микробов, связанные с людьми) и «микробиом» (каталог этих микробов и их генов) часто используются как синонимы.Кроме того, термин «метагеномика» первоначально относился к характеристике общей ДНК методом дробовика, хотя сейчас он все чаще применяется для изучения маркерных генов, таких как ген 16S рРНК. Однако более фундаментально новые открытия заставляют нас усомниться в концепциях, которые имеют центральное значение для определения микробиома человека, таких как стабильность микробиома человека, определение OTU (операционных таксономических единиц), составляющих микробиоту. , и есть ли у человека один или несколько микробиомов.В этом обзоре мы рассмотрим прогресс в определении микробиома человека в этих различных отношениях.
Изучение разнообразия микробиома человека началось с Антони ван Левенгука, который еще в 1680-х годах сравнивал свою оральную и фекальную микробиоту. Он отметил поразительные различия в микробах между этими двумя средами обитания, а также между образцами, взятыми у людей с состоянием здоровья и болезнью в обоих этих местах [5, 6]. Таким образом, исследования глубоких различий в микробах на разных участках тела и между здоровье и болезни так же стары, как и сама микробиология.Сегодня новым является не способность наблюдать эти очевидные различия, а, скорее, способность использовать мощные молекулярные методы, чтобы понять, почему существуют эти различия, и понять, как мы можем повлиять на преобразования из одного состояния в другое.
Культурально-независимые методы характеристики микробиоты вместе с молекулярным филогенетическим подходом к организации разнообразия жизни обеспечили фундаментальный прорыв, позволив исследователям сравнивать микробные сообщества в разных средах в рамках единого филогенетического контекста (см. Обзор [7]).Хотя связанные с хозяином микробы предположительно попадают в окружающую среду, состав микробиоты млекопитающих, особенно в кишечнике, неожиданно отличается от свободноживущих микробных сообществ [8]. Фактически, анализ бактериального разнообразия свободноживущих сообществ в наземных, морских и пресноводных средах, а также сообществ, связанных с животными, предполагает, что кишечник позвоночных является экстремальным явлением [8]. Напротив, бактериальные сообщества из сред, обычно считающихся экстремальными, таких как кислые горячие источники и гидротермальные источники, похожи на сообщества во многих других средах [9].Это говорит о том, что совместная эволюция между позвоночными и их микробными консорциумами в течение сотен миллионов лет привела к выбору специализированного сообщества микробов, которые процветают в теплой, эвтрофной и стабильной среде кишечника [8]. В кишечнике человека и во всех связанных с человеком средах обитания бактерии составляют основную часть биомассы и разнообразия, хотя археи, эукариоты и вирусы также присутствуют в меньшем количестве, и ими нельзя пренебрегать [10, 11].
Интересно, что оценки каталога генов человека и разнообразия генома человека бледнеют по сравнению с оценками разнообразия микробиома.Например, консорциум Meta-HIT сообщил о каталоге генов из 3,3 миллионов неизбыточных генов только в микробиоме кишечника человека [3] по сравнению с ~ 22 000 генов, присутствующих во всем геноме человека [12]. Точно так же разнообразие микробиома людей огромно по сравнению с вариациями генома: отдельные люди примерно на 99,9% идентичны друг другу с точки зрения генома хозяина [13], но могут отличаться друг от друга на 80-90% с точки зрения генома. микробиом их руки [14] или кишечника [15].Эти результаты показывают, что использование вариаций, содержащихся в микробиоме, будет гораздо более плодотворным в персонализированной медицине, использовании генетических данных отдельного пациента для информирования медицинских решений, чем подходы, нацеленные на относительно постоянный геном хозяина.
Многие фундаментальные вопросы о микробиоме человека до недавнего времени было трудно или невозможно было решить. На некоторые вопросы, такие как вечно популярный «сколько видов обитает на данном участке тела?», Все еще трудно ответить из-за проблем с определениями видов бактерий и скоростью ошибок секвенирования.Другие вопросы, такие как «как разнообразие внутри человека с течением времени соотносится с разнообразием между людьми?» Или «как различие между участками на теле одного и того же человека соотносится с разнообразием между разными людьми на одном участке?» , или «существует ли основной набор видов микробов, которые мы все разделяем?», теперь можно дать окончательный ответ. В следующем разделе мы обсудим некоторые инструменты, которые позволили ответить на эти давние вопросы.
Инструменты для микробного анализа
Резкое сокращение затрат на секвенирование, наблюдавшееся за последние несколько лет, позволило идентифицировать специфические таксоны микробов, обнаруженные в кишечнике человека, которые трудно или невозможно культивировать.Теперь исследователи могут генерировать миллионы последовательностей для каждого образца, чтобы оценить различия в микробных сообществах между участками тела и отдельными людьми. Наша возросшая мощность секвенирования потребовала разработки столь же мощных вычислительных инструментов для обработки растущего количества данных последовательностей, производимых современными технологиями [16]. Существует несколько конвейеров для анализа данных микробного микробного сообщества, таких как mothur [17], w.A.T.E.R.S [18], инструменты RDP pyroseqeuncing [19] и QIIME (произносится «колокольчик») [20].QIIME — это бесплатная платформа с открытым исходным кодом для анализа данных высокопроизводительного секвенирования, которая позволяет пользователям импортировать необработанные данные о последовательностях и быстро производить измерения разнообразия между и внутри образцов. Последовательность в идентификации операционных таксономических единиц (OTU) и установление согласованных мер разнообразия внутри и между выборками имеют решающее значение для сравнения результатов исследований, хотя концепция OTU становится все более проблематичной по мере того, как накапливаются данные о последовательности и приобретаются явные филогенетические подходы. в популярности.
Бета-разнообразие относится к измерению степени различия в членстве или структуре сообщества между двумя выборками. Недавний обзор основанных на таксонах измерений бета-разнообразия показал, что некоторые метрики, в том числе расстояния Канберры и Гауэра, обладают повышенной мощностью для различения кластеров, в то время как другие метрики, такие как хи-квадрат и корреляционные расстояния Пирсона, более подходят для выяснения эффектов. градиентов среды на сообществах [21]. Надежным методом сравнения различий между микробными сообществами является UniFrac, который измеряет долю общих длин ветвей на филогенетическом дереве между образцами [22].Очень похожие микробные сообщества приводят к оценке UniFrac, близкой к 0, в то время как два полностью независимых сообщества, которые не имеют общей длины ветвей (т. Е. Имеют разную эволюционную историю), дают оценку UniFrac, равную 1. Анализ основных координат (PCoA) может затем визуализировать расстояния Unifrac между образцами в двумерном или трехмерном пространстве, что позволяет легко визуально различать кластеризацию похожих сообществ или разделение отдельных сообществ.
UniFrac как мера бета-разнообразия в сочетании с PCoA имеет способность различать различия между сообществами, используя всего 10 последовательностей на образец [23]. Важно понимать, что увеличенная глубина секвенирования не всегда необходима для получения биологически значимых результатов, когда эти результаты очевидны. Таким образом, выбирая измерения разнообразия, которые подходят для дизайна исследования, исследователи, использующие современные методы секвенирования, могут охарактеризовать различия между выборками при относительно низком охвате последовательностей.Это позволяет исследователям оценивать мелкозернистые пространственные и временные закономерности, характеризуя от сотен до тысяч образцов, таких как временные ряды по нескольким пациентам или средам. Функциональность UniFrac, а также множество измерений разнесения доступны в QIIME, и их можно легко сравнить.
В общем, конвейеры для анализа 16S рРНК и метагеномных данных дробовика имеют отдельные рабочие процессы. Некоторые начальные шаги, такие как демультиплексирование (удаление штрих-кодов и разделение объединенных образцов) и качественная фильтрация, являются общими для обоих конвейеров.Однако для данных 16S рРНК последовательности должны быть сгруппированы в OTU, химерные последовательности, генерируемые неполным расширением матрицы, должны быть удалены, и должны быть построены филогенетические деревья. Напротив, в метагеномном конвейере последовательности должны быть назначены функциям, а также таксономии (либо как целые чтения, либо после сборки). Как только таксоны или таблицы функций генов построены, конвейеры начинают сближаться, по крайней мере, концептуально: тогда интерес заключается в 1) составе каждой выборки, 2) поиске таксонов или функций, которые различают группы выборок (например,грамм. в соответствии с клиническими параметрами) и 3) с вопросом, группируются ли образцы в соответствии с какими-либо измеренными клиническими состояниями (или по времени). Одно интересное развивающееся направление — сравнение метагеномной кластеризации и кластеризации 16S рРНК напрямую с использованием метода, называемого анализом Прокруста, который позволяет комбинировать графики PCoA [24]. Еще один мощный инструмент — использование машинного обучения и статистических методов для построения прогнозных моделей таксонов [25] или функций [26], которые различают группы выборок.
Уникальным преимуществом QIIME по сравнению с другими конвейерами является его способность использовать «образцы метаданных», например клиническая информация о субъектах, позволяющая визуализировать основные закономерности в данных. Особый интерес представляет то, что QIIME поддерживает стандарт MIMARKS (минимальная информация о последовательности маркеров) [27], разработанный Консорциумом геномных стандартов [28], который становится все более популярным среди других инструментов для анализа микробов и сообществ, таких как MG-RAST [29]. , и был принят INSDC (Международный консорциум баз данных нуклеотидных последовательностей, который включает GenBank, EBI и DDBJ) в качестве стандарта для метаданных.
С этими инструментами основные закономерности сходства и различия в микробиоте стали обычным делом. Ключевая задача в настоящее время состоит в том, чтобы расширить анализ, включив в него лонгитюдные исследования и понять роль конкретных хозяев и факторов окружающей среды в развитии и поддержании микробиома.
Динамическое взаимодействие между человеческими микробами и окружающей средой
Желудочно-кишечный тракт (ЖКТ) младенца человека обеспечивает совершенно новую среду для микробной колонизации [30].Действительно, микробиота, которую начинает приобретать младенец, сильно зависит от способа родов [31]. Через двадцать минут после рождения микробиота новорожденных, рожденных через естественные родовые пути, напоминает микробиоту влагалища их матери, в то время как младенцы, рожденные с помощью кесарева сечения, содержат микробные сообщества, обычно встречающиеся на коже человека [32]. Приобретение микробиоты продолжается в течение первых нескольких лет жизни, поскольку микробиом желудочно-кишечного тракта младенца начинает напоминать микробиом взрослого уже на первом году жизни [33].В одном тематическом исследовании микробиоты младенца в течение первых 2,5 лет жизни филогенетическое разнообразие значительно и линейно увеличивается со временем [34]. Кроме того, значительные изменения в составе кишечной микробиоты были очевидны в пяти временных точках; переход на грудное молоко, развитие лихорадки на 92 день, введение рисовых хлопьев на 134 день, введение смеси и столовых продуктов на 161 день, а также лечение антибиотиками и диета для взрослых на 371 день [34]. Интересно, что каждое изменение диеты сопровождалось изменениями микробиоты кишечника и обогащением соответствующих генов.Например, когда младенец начал получать полноценную взрослую диету, гены в микробиоме, связанные с биосинтезом витаминов и перевариванием полисахаридов, стали обогащаться [34].
Взаимодействие между микробиотой человека и окружающей средой носит динамичный характер, при этом человеческие микробы свободно перемещаются на поверхности, с которыми мы взаимодействуем каждый день. Fierer et al. показали, что кончики пальцев человека могут переносить сообщества микробов на клавиатуру, и эти сообщества сильно дифференцируют людей [35].Графики PCoA показали, что можно было определить, какие пальцы печатали на каких клавишах и какие люди использовали какие клавиатуры: можно было даже связать руку человека с компьютерной мышью, которую он использует, с точностью до 95% по сравнению с база данных других рук [35]. В целом, это исследование показало, что микробные сообщества постоянно переносятся между поверхностями и что существует динамическое взаимодействие между микробиотой окружающей среды и различными участками человеческого тела.
Внутриличностное микробное разнообразие
Еще один интересный вопрос, на который мы только начинаем отвечать, — насколько стабильным со временем становится микробиом внутри человека.Определив, что составляет нормальные временные изменения у человека с течением времени, мы сможем лучше количественно оценить и понять изменения в микробных сообществах, которые возникают в результате диетических и фармацевтических вмешательств. В самом продолжительном на сегодняшний день исследовании временных рядов Caporaso et al. отобрали образцы микробных сообществ двух индивидуумов в кишечнике, ротовой полости, левой и правой ладонях за 396 временных точек в течение 15 месяцев [36]. Сообщества на разных участках тела можно было легко отличить друг от друга с помощью трехмерных графиков PCoA в течение одного года, даже несмотря на то, что структура сообщества на данном участке сильно варьировала [36].Уровень разнообразия также различается между участками тела, при этом во рту и кишечнике находятся самые разные сообщества [37]. Взятые вместе, эти исследования показывают, что микробиота человека представляет собой сильно изменчивую и разрозненную экосистему.
В целом, еще предстоит окончательно доказать, что отдельные особи или даже участки тела несут в себе «основной» набор специфических бактериальных таксонов. Например, консорциум Meta-HIT определил «основной» набор клонов как те, которые присутствовали у половины изучаемых субъектов, хотя, по существу, у всех изучаемых субъектов гены не присутствовали [3].Конечно, важно понимать, что глубина отбора проб может иметь решающее значение для различения таксонов, которые отсутствуют, от таксонов, которые просто очень редки; динамический диапазон численности микробов также довольно велик, и даже для «основных» генов Meta-HIT 2000-кратные диапазоны численности не были редкостью. Доказать, что таксон полностью отсутствует в кишечнике, невозможно с помощью этих типов исследований, поэтому основные расчеты всегда должны включать в себя предупреждение о глубине секвенирования. Еще один фактор, который следует учитывать при определении разнообразия и ядра, заключается в том, что методологические артефакты могут значительно увеличить видимое количество OTU в выборке (и, следовательно, уменьшить видимую долю, которая разделяется).Как ошибка секвенирования [38, 39], так и проблемы, связанные с выравниванием, особенно множественным выравниванием последовательностей [40-43], могут сильно увеличить количество OTU. Важно убедиться, что при проведении оценок керна использовались одни и те же методологические процедуры с точки зрения доли особей, в которой керн должен быть представлен, минимальной численности и процедуры принятия решения, какие последовательности считаются «одинаковыми». Наконец, существует ключевой вопрос о том, структурированы ли вариации вокруг ядра таким образом, чтобы люди имели лишь несколько общих типов профилей микробиоты на данном участке тела: это хорошо установлено для влагалища [44], но более спорно для кишечника [ 45].В общем, следует проявлять крайнюю осторожность при выполнении процедур кластеризации, так как многие из них разбивают непрерывное изменение на кластеры, которых не существует [21]. Надежные процедуры выбора модели, которые включают возможность существования только непрерывных вариаций, а не дискретных кластеров, еще предстоит разработать в контексте анализа микробного сообщества.
Появляется все больше свидетельств того, что люди на самом деле разделяют «основной микробиом», а не «стержневую микробиоту». В исследовании пар монозиготных и дизиготных близнецов, согласных по ожирению или худобе, у всех индивидуумов была общая подгруппа идентифицируемых микробных генов, но не видов [15].Примечательно, что совершенно разные наборы видов микробов дали очень похожие функциональные пути KEGG. Однако отклонения от этого основного микробиома были очевидны у субъектов с ожирением, что свидетельствует о важности использования метагеномных данных в дополнение к определению состава микробного сообщества с помощью исследований маркерного гена 16S при оценке различий между болезненными состояниями. Будет интересно понять, верен ли этот принцип для других участков тела; кросс-биомные метагеномные сравнения на сегодняшний день чрезвычайно редки [46, 47].
Микробиом кишечника играет важную роль в пищеварении и питании.
Доказательства неразрывной связи между микробиотой, пищеварением и метаболизмом хозяина растут. При анализе людей и 59 дополнительных видов млекопитающих последовательности 16S рРНК сгруппированы вместе плотоядных, всеядных и травоядных в основном координатном пространстве, показывая, что структуры сообщества различаются в зависимости от диеты [48]. Изменения в рационе мышей также могут привести к значительным изменениям в метаболизме бактерий, особенно жирных кислот и аминокислот с небольшой цепью, всего за одну неделю [49] и могут привести к большим изменениям уже через один день [50].Важно отметить, что генетическое разнообразие, обнаруженное в нашей кишечной микробиоте, позволяет нам переваривать соединения посредством метаболических путей, явно не закодированных в геноме млекопитающих, что значительно увеличивает нашу способность извлекать энергию из наших разнообразных диет [51, 52].
Микробиота кишечника также играет важную роль в ожирении. У здоровых мышей, которым трансплантируют кишечную микробиоту от обычных мышей, наблюдается увеличение ожирения без увеличения потребления пищи из-за увеличения извлечения энергии из рациона и увеличения депонирования энергии в адипоцитах хозяина [53].Два основных микробных подразделения, Firmicutes и Bacteriodetes, демонстрируют разную численность в зависимости от фенотипа. Уменьшение Bacteriodetes и увеличение Firmicutes было обнаружено у мышей с генетическим ожирением ( ob / ob ) по сравнению с их худыми коллегами [54], а фенотип ожирения может даже передаваться беспроблемным, но генетически диким типам мышей. микробиоты, а фенотип обусловлен энергетическим балансом: калориметрия фекальных гранул с помощью бомбы показывает, что мыши ob / ob извлекают больше энергии из своего рациона и оставляют меньше с фекалиями [51].Примечательно, что те же эффекты справедливы и для другой модели мышей, мышей с нокаутом TLR5, которые также становятся тучными в некоторых помещениях для мышей (но заболевают колитом в других, предположительно из-за различий в фоновой микробиоте). Мыши с нокаутом TLR5 также обладают фенотипом трансмиссивного ожирения, но никакой разницы в эффективности сбора энергии не происходит. Вместо этого измененная микробиота каким-то образом делает мышей более голодными, и их вызванное микробами ожирение можно вылечить, ограничив количество пищи в их клетках тем, которое потребляется мышами дикого типа, а также антибиотиками [55].Корреляция между микробами и ожирением, возможно, лучше всего иллюстрируется потерей веса. Поскольку разные группы людей были помещены на диету с ограничением жиров или углеводов, их количество Bacteriodetes увеличивалось по мере снижения их массы тела, переходя от характерного «тучного» микробного сообщества к «худому» сообществу [56]. Таким образом, изменение микробиоты пациента может быть терапевтическим вариантом, способствующим снижению веса у пациентов с ожирением или способствующим увеличению веса у детей с недостаточным весом.
Удивительно, но микробы, которые мы поглощаем вместе с пищей, могут обеспечивать наш индивидуальный микробиом новыми генами для переваривания новой пищи. Hehemann et al. обнаружили, что новый класс гликозидгидролаз, используемых для переваривания порфирана, полисахарида, распространенного в красных водорослях, также был обнаружен в образцах стула человека в качестве гена в Bacteriodes plebeius . Более тщательное изучение метаданных стула показало, что образцы стула, содержащие ген, переваривающий порфиран, присутствовали только у японцев; ген не был обнаружен в микробиоме кишечника жителей Соединенных Штатов.Почему в кишечнике человека можно найти морской ген? Авторы пришли к выводу, что водоросли, распространенные в японской, но не американской диете, содержат микроорганизмы, которые передали гены микробиому кишечника [57]. Таким образом, микробы обладают способностью значительно увеличивать количество метаболических инструментов в кишечнике человека, позволяя нам переваривать множество субстратов.
Пластичность кишечника человека
Учитывая относительную стабильность микробиоты кишечника человека, один из ключевых вопросов заключается в том, является ли он достаточно пластичным, чтобы позволить четко определенные вмешательства для улучшения здоровья.Как описано выше, микробиота кишечника после установления остается довольно стабильной во времени, по крайней мере, по сравнению с различиями между людьми. Однако ряд исследований демонстрирует, что внешние силы могут изменять сообщество микробов, расположенных в желудочно-кишечном тракте, и антибиотики являются важным примером.
Антибиотики в основном используются для борьбы с патогенными видами бактерий, которые обитают внутри хозяина или вторглись в него, однако нынешнее поколение антибиотиков имеет широкий спектр действия и нацелено также на широкие слои нормальной микробиоты.Таким образом, антибиотики значительно влияют на врожденную микробиоту кишечника хозяина. Через три-четыре дня после лечения ципрофлоксацином, антибиотиком широкого спектра действия, кишечная микробиота испытывает снижение таксономического богатства, разнообразия и однородности [58, 59]. Значительные изменения микробиоты кишечника продемонстрировали значительную межличностную изменчивость. В то время как микробиота кишечника начала напоминать состояние до лечения через неделю после лечения, между людьми наблюдались различия в том, насколько близко сообщество после лечения напоминало сообщество до лечения, а некоторые таксоны не смогли вернуться в сообщество [59 , 60].Действительно, восстановление некоторых видов может происходить в течение четырех лет после лечения антибиотиками [61]. Тем не менее, общее восстановление микробиоты кишечника после лечения антибиотиками предполагает, что существуют факторы внутри сообщества, биотические или абиотические, которые способствуют устойчивости сообщества, хотя они еще не выяснены.
Другие антибиотики также имеют тенденцию давать результаты, которые существенно различаются между субъектами [62, 63] и даже участками тела [64]. Поскольку более крупные группы населения еще не были изучены, отчасти из-за этических проблем с назначением антибиотиков здоровым людям, причины этих основных различий еще не выяснены.Понимание факторов, определяющих способность микробиоты противостоять возмущениям и восстанавливаться после них, а также понимание факторов, определяющих ее текущее состояние, будет ключом к разработке инструментов, помогающих манипулировать микробиомами. Например, как ни странно, у крыс введение антибиотиков перед трансплантацией слепой кишки фактически снижает вероятность появления новых микробов [65].
Интересным намеком на то, что микробиота может быть более пластичной, чем можно было представить, является недавний успех лечения стойких инфекций Clostridum difficile с помощью трансплантации кала, который был успешным в ряде исследований [66-72] и в целом. обедненное кишечное сообщество, образовавшееся во время C.difficile заменяется донорским сообществом [67, 73]. Успех этой техники впечатляет, особенно если учесть, как мало известно о самом лучшем сообществе, которое можно предоставить. Например, что лучше: получить фекальное сообщество близкого родственника или сожителя или, возможно, сохранить собственный стул перед началом лечения антибиотиками, чтобы его можно было восстановить позже? Подходит ли один и тот же стул для всех, или огромные различия в микробиоте означают, что микробы каждого человека специально адаптированы по сравнению с микробами, которые они могут получить от донора? Как и в случае с группами крови, существуют ли «универсальные доноры» и «универсальные реципиенты»? На эти и многие другие вопросы еще предстоит ответить.
Выводы и проспект
Как и каждый год с момента первоначального секвенирования ДНК, этот год привел к беспрецедентному росту количества данных о последовательностях, собранных с беспрецедентно низкой стоимостью. Также были разработаны или обновлены все более мощные инструменты, используемые для извлечения значимых закономерностей из этого множества данных. Появляются новые технологии, такие как трансплантация стула, 16S рРНК и полногеномное секвенирование на платформе Illumina, возможность с высокой эффективностью трансплантировать человеческие микробные сообщества мышам даже из замороженных образцов [50], а также создание персонализированных коллекций культур [74]. перспектива будущего, в котором методы лечения отдельных людей будут опробоваться на батарее мышей, подвергнутых различным видам лечения, и в которых будут проводиться одноразовые эксперименты, которые выявят эффекты удаления отдельных видов [74] или отдельных генов из внутри вида [75] позволяют понять механизм.Хотя имеющиеся у нас инструменты по-прежнему несовершенны (например, ограниченная длина чтения сегодняшних высокопроизводительных технологий секвенирования ограничивает способность обнаруживать виды и штаммы бактерий, а анализ вирусов и эукариот все еще остается новым рубежом), Перспективы развития механистического понимания факторов, лежащих в основе пластичности микробиома, а затем манипулирования микробиомом для улучшения здоровья, кажутся все более радужными.
Благодарности
Работа, цитируемая в этом обзоре из лаборатории автора, была частично поддержана грантами Национальных институтов здравоохранения [HG4872 (RK)], Американского фонда Крона и колита и Медицинского института Говарда Хьюза [RK] .
Ссылки
2. Петерсон Дж., Гарджес С., Джованни М., Макиннес П., Ван Л., Шлосс Дж. А., Бонацци В., МакИвен Дж. Э., Веттерстранд К. А., Дил С. и др. Проект NIH Human Microbiome Project. Геномные исследования. 2009; 19: 2317–2323. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T., Pons N, Levenez F, Yamada T. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010; 464: 59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Lederberg J, McCray A. Ome sweet ‘omics: — Генеалогическая сокровищница слов. Ученый. 2001; 15: 8. [Google Scholar] 6. ван Левенгук А. Отрывок из письма Антони ван Левенгук от 12 сентября 1683 года. О животных в зубном налете. Философские труды Лондонского королевского общества. 1684; 14: 568–574. [Google Scholar] 7. Pace NR. Молекулярный взгляд на микробное разнообразие и биосферу. Наука. 1997; 276: 734–740. [PubMed] [Google Scholar] 8. Ley RE, Lozupone CA, Hamady M, Knight R, Gordon JI.Миры внутри миров: эволюция микробиоты кишечника позвоночных. Обзоры природы микробиологии. 2008; 6: 776–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Marchesi JR. Прокариотическое и эукариотическое разнообразие кишечника человека. Успехи в прикладной микробиологии, Том 72, 2010; 72: 43–62. [PubMed] [Google Scholar] 11. Брейтбарт М., Хейнс М., Келли С., Энгли Ф., Эдвардс Р. А., Фелтс Б., Махаффи Дж. М., Мюллер Дж., Нултон Дж., Рейхок С. и др. Вирусное разнообразие и динамика в кишечнике младенца. Исследования в микробиологии.2008. 159: 367–373. [PubMed] [Google Scholar] 12. Консорциум IHGS. Завершение эухроматической последовательности генома человека. Природа. 2004; 431: 931–945. [PubMed] [Google Scholar] 13. Уилер Д.А., Сринивасан М., Эгхолм М., Шен Й., Чен Л., МакГуайр А., Хе В., Чен Ю.Дж., Махиджани В., Рот Г.Т. и др. Полный геном человека путем массового параллельного секвенирования ДНК. Природа. 2008; 452: 872–876. [PubMed] [Google Scholar] 14. Фирер Н., Хамади М., Лаубер С.Л., Найт Р. Влияние пола, рукопожатия и стирки на разнообразие бактерий на поверхности рук.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 17994–17999. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Turnbaugh PJ, Hamady M, Yatsunenko T., Cantarel BL, Duncan A, Ley RE, Sogin ML, Jones WJ, Roe BA, Affourtit JP, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009; 457: 480–484. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Kuczynski J, Lauber CL, Walters WA, Parfrey LW, Clemente JC, Gevers D, Knight R. Экспериментальные и аналитические инструменты для изучения микробиома человека.Природа рассматривает генетику. 2012; 13: 47–58. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Schloss PD, Westcott SL, Ryabin T., Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, et al. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом для описания и сравнения сообществ микробов. Прикладная и экологическая микробиология. 2009; 75: 7537–7541. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Хартман А.Л., Риддл С., Макфиллипс Т., Людашер Б., Эйзен Дж.Представляем W.A.T.E.R.S .: рабочий процесс для выравнивания, таксономии и экологии рибосомных последовательностей. Биоинформатика BMC. 2010; 11: 317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б., Фаррис Р. Дж., Кулам-Сайед-Мохидин А. С., МакГаррелл Д. М., Марш Т., ГМ Гаррити, Тидже Дж. М.. Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Исследование нуклеиновых кислот. 2009; 37: D141–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Методы природы. 2010. 7: 335–336. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Kuczynski J, Liu Z, Lozupone C, McDonald D, Fierer N, Knight R. Методы сходства микробных сообществ различаются по своей способности обнаруживать биологически релевантные паттерны. Нат методы. 2010; 7: 813–819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Прикладная и экологическая микробиология.2005; 71: 8228–8235. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Kuczynski J, Costello EK, Nemergut DR, Zaneveld J, Lauber CL, Knights D, Koren O, Fierer N, Kelley ST, Ley RE, et al. Прямое секвенирование микробиома человека легко выявляет различия в сообществах. Геномная биология. 2010; 11 [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Муэгге Б.Д., Кучински Дж., Найтс Д., Клементе Дж. С., Гонсалес А., Фонтана Л., Хенриссат Б., Найт Р., Гордон Дж. И.. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека.Наука. 2011; 332: 970–974. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Найтс Д., Костелло Е.К., Найт Р. Классификация микробиоты человека под руководством. Обзоры микробиологии FEMS. 2011; 35: 343–359. [PubMed] [Google Scholar] 26. Уайт Дж. Р., Нагараджан Н., Поп М. Статистические методы обнаружения дифференциально распространенных особенностей в клинических метагеномных образцах. Вычислительная биология PLoS. 2009; 5: e1000352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз П., Коттманн Р., Филд Д., Найт Р., Коул Дж. Р., Амарал-Цеттлер Л., Гилберт Дж. А., Карш-Мизрахи И., Джонстон А., Кокрейн Дж. И др.Минимум информации о последовательности маркерного гена (MIMARKS) и минимум информации о спецификациях любой (x) последовательности (MIxS). Биотехнология природы. 2011; 29: 415–420. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Йилмаз П., Гилберт Дж., Найт Р., Амарал-Зеттлер Л., Карш-Мизрахи И., Кокрейн Дж., Накамура И., Сансон С.А., Глокнер Ф.О., Филд Д. Консорциум геномных стандартов: воплощение стандартов микробной экологии. Журнал ISME. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мейер Ф., Паарманн Д., Д’Суза М., Олсон Р., Гласс Э.М., Кубал М., Пациан Т., Родригес А., Стивенс Р., Уилке А. и др.RAST-сервер метагеномики — общедоступный ресурс для автоматического филогенетического и функционального анализа метагеномов. BMC Bioinformatics. 2008; 9: 386. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999; 69: 1035S – 1045S. [PubMed] [Google Scholar] 31. Домингес-Белло М.Г., Блазер М.Дж., Лей Р.Е., Найт Р. Развитие микробиоты желудочно-кишечного тракта человека и выводы из высокопроизводительного секвенирования.Гастроэнтерология. 2011; 140: 1713–1719. [PubMed] [Google Scholar] 32. Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 11971–11975. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R, Angenent LT, Ley RE.Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Труды Национальной академии наук США. 2010 [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Фирер Н., Лаубер С.Л., Чжоу Н., Макдональд Д., Костелло Е.К., Найт Р. Криминалистическая идентификация с использованием бактериальных сообществ кожи. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6477–6481. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Caporaso JG, Lauber CL, Costello EK, Berg-Lyons D, Gonzalez A, Stombaugh J, Knights D, Gajer P, Ravel J, Fierer N и др.Движущиеся картинки микробиома человека. Геномная биология. 2011; 12: R50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Костелло Е.К., Лаубер С.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009; 326: 1694–1697. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Кунин В., Энгельбрексон А., Охман Х., Гугенгольц П. Морщины в редкой биосфере: ошибки пиросеквенирования могут привести к искусственному завышению оценок разнообразия. Экологическая микробиология.2010; 12: 118–123. [PubMed] [Google Scholar] 39. Айва К., Ланзен А., Кертис Т.П., Давенпорт Р.Дж., Холл N, руководитель IM, Рид Л.Ф., Слоан В.Т. Точное определение микробного разнообразия по 454 данным пиросеквенирования. Методы природы. 2009; 6: 639–641. [PubMed] [Google Scholar] 40. Sun Y, Cai Y, Huse SM, Knight R, Farmerie WG, Wang X, Mai V. Крупномасштабное эталонное исследование существующих алгоритмов для независимого от таксономии анализа микробного сообщества. Брифинги по биоинформатике. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 41.Schloss PD, Westcott SL. Методы оценки и улучшения, используемые в подходах на основе операционных таксономических единиц для анализа последовательности генов 16S рРНК. Прикладная и экологическая микробиология. 2011; 77: 3219–3226. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Хьюз С.М., Велч Д.М., Моррисон Х.Г., Согин М.Л. Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Экологическая микробиология. 2010; 12: 1889–1898. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Сунь И, Цай И, Лю Л., Ю Ф, Фаррелл М.Л., МакКендри В., Фармери В.ESPRIT: оценка видового богатства с использованием больших коллекций пиросеквенций 16S рРНК. Исследование нуклеиновых кислот. 2009; 37: e76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулл С.Л., Карлебах С., Горле Р., Рассел Дж., Тэкет СО и др. Микробиом влагалища женщин репродуктивного возраста. Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4680–4687. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Arumugam M, Raes J, Pelletier E, Le Paslier D., Yamada T., Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, et al.Энтеротипы микробиома кишечника человека. Природа. 2011; 473: 174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Динсдейл Э.А., Эдвардс Р.А., Холл Д., Энгли Ф., Брейтбарт М., Брюлк Дж. М., Фурлан М., Деснуес С., Хейнс М., Ли Л. и др. Функциональное метагеномное профилирование девяти биомов. Природа. 2008. 452: 629–632. [PubMed] [Google Scholar] 47. Триндж С.Г., фон Меринг Ч., Кобаяши А., Саламов А.А., Чен К., Чанг Х.В., Подар М., Шорт Дж. М., Матур Э. Дж., Деттер Дж. К. и др. Сравнительная метагеномика микробных сообществ. Наука.2005; 308: 554–557. [PubMed] [Google Scholar] 48. Лей Р. Э., Хамади М., Лозупоне С., Тернбо П. Дж., Рэйми Р. Р., Бирчер Дж. С., Шлегель М. Л., Такер Т. А., Шренцель М. Д., Найт Р., Гордон Д. И.. Эволюция млекопитающих и их кишечных микробов. Наука. 2008; 320: 1647–1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Мартин Ф.П., Шпренгер Н., Монтолиу И., Реззи С., Кочхар С., Николсон Дж. Диетическая модуляция функциональной экологии кишечника изучается с помощью фекальной метабономики. Журнал протеомных исследований. 2010; 9: 5284–5295. [PubMed] [Google Scholar] 50.Тернбо П.Дж., Ридаура В.К., Вера Джей-Джей, Рей Ф.И., Рыцарь Р., Гордон Джи. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных мышах-гнотобиотах. Наука трансляционная медицина. 2009; 1: 6ра14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–1031. [PubMed] [Google Scholar] 52. Гилмор М.С., Ферретти Дж. Дж. Микробиология: тонкая грань между кишечным комменсалом и патогеном.Наука. 2003; 299: 1999– +. [PubMed] [Google Scholar] 53. Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S. A. 2004; 101: 15718–15723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Ожирение изменяет микробную экологию кишечника. Труды Национальной академии наук Соединенных Штатов Америки. 2005; 102: 11070–11075.[Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Виджай-Кумар М., Эйткен Д.Д., Карвалью Ф.А., Каллендер Т.С., Мванги С., Сринивасан С., Ситараман С.В., Найт Р., Лей Р.Э., Гевиртц А.Т. Метаболический синдром и измененная микробиота кишечника у мышей, лишенных Toll-подобного рецептора 5. Наука. 2010; 328: 228–231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006; 444: 1022–1023. [PubMed] [Google Scholar] 57. Хехеманн Дж., Коррек Дж., Барбейрон Т., Хельберт В., Чжек М., Мишель Г.Перенос углеводно-активных ферментов от морских бактерий к микробиоте кишечника японцев. Природа. 2010; 464: 908–912. [PubMed] [Google Scholar] 58. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Распространенное влияние антибиотика на микробиоту кишечника человека, выявленное глубоким секвенированием 16S рРНК. Plos Biology. 2008. 6: 2383–2400. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков.Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, что выявлено глубоким секвенированием 16S рРНК. Plos Biology. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека.Журнал ISME. 2007; 1: 56–66. [PubMed] [Google Scholar] 62. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека. Isme Journal. 2007; 1: 56–66. [PubMed] [Google Scholar] 63. Джернберг С., Салливан А., Эдлунд С., Янссон Дж. Мониторинг вызванных антибиотиками изменений в микрофлоре кишечника человека и обнаружение пробиотических штаммов с использованием терминального полиморфизма длины рестрикционных фрагментов. Прикладная и экологическая микробиология.2005. 71: 501–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Jakobsson HE, Jernberg C, Andersson AF, Sjolund-Karlsson M, Jansson JK, Engstrand L. Краткосрочное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS ONE. 2010; 5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Маничан С., Ридер Дж., Гиберт П., Варела Э., Ллопис М., Антолин М., Гиго Р., Найт Р., Гварнер Ф. Изменение микробиома кишечника с помощью бактериальной трансплантации и приема антибиотиков. Геномные исследования.2010; 20: 1411–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Mellow MH, Kanatzar A. Колоноскопическая фекальная бактериотерапия в лечении рецидивирующей инфекции Clostridium difficile — результаты и наблюдение. Журнал Медицинской ассоциации штата Оклахома. 2011; 104: 89–91. [PubMed] [Google Scholar] 67. Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Устойчивое изменение микробиоты толстой кишки путем введения донорской фекальной флоры. Журнал клинической гастроэнтерологии.2010; 44: 551–561. [PubMed] [Google Scholar] 68. Гарборг К., Ваагсбо Б., Сталлемо А., Матре Дж., Сундой А. Результаты инстилляционной терапии фекального донора при рецидивирующей диарее, связанной с Clostridium difficile. Скандинавский журнал инфекционных болезней. 2010; 42: 857–861. [PubMed] [Google Scholar] 69. Сильверман М.С., Дэвис I, Пиллай ДР. Успех самостоятельной трансплантации фекалий в домашних условиях при хронической инфекции Clostridium difficile. Клиническая гастроэнтерология и гепатология: официальный журнал клинической практики Американской гастроэнтерологической ассоциации.2010. 8: 471–473. [PubMed] [Google Scholar] 70. МакКонначи А.А., Фокс Р., Кеннеди Д.Р., Ситон Р.А. Фекальный трансплантат при рецидивирующей диарее, связанной с Clostridium difficile: серия случаев в Великобритании. QJM: ежемесячный журнал Ассоциации врачей. 2009. 102: 781–784. [PubMed] [Google Scholar] 71. Вы DM, Franzos MA, Holman RP. Успешное лечение молниеносной инфекции Clostridium difficile с помощью фекальной бактериотерапии. Анналы внутренней медицины. 2008. 148: 632–633. [PubMed] [Google Scholar] 72. Тведе М, Раск-Мадсен Дж.Бактериотерапия хронической рецидивирующей диареи Clostridium difficile у шести пациентов. Ланцет. 1989; 1: 1156–1160. [PubMed] [Google Scholar] 73. Хоруц А., Диксвед Дж., Янссон Дж. К., Садовски М.Дж. Изменения в составе фекального микробиома человека после бактериотерапии рецидивирующей диареи, связанной с Clostridium difficile. Журнал клинической гастроэнтерологии. 2010; 44: 354–360. [PubMed] [Google Scholar] 74. Вера Дж. Дж., Рей Ф. Е., О’Доннелл Д., Карлссон М., Макналти Н. П., Каллстром Дж., Гудман А. Л., Гордон Дж. И..Создание и характеристика сообществ кишечных микробов человека у мышей-гнотобиотов. Журнал ISME. 2010; 4: 1094–1098. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Гудман А.Л., Макналти Н.П., Чжао Ю., Лейп Д., Митра Р.Д., Лозупоне, Калифорния, Найт Р., Гордон Дж. И.. Определение генетических детерминант, необходимых для создания симбионта кишечника человека в его среде обитания. Клеточный хозяин и микроб. 2009. 6: 279–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Определение микробиома человека
Nutr Rev. Рукопись автора; доступно в PMC 2013 1 февраля.
Опубликовано в окончательной редакции как:
PMCID: PMC3426293
NIHMSID: NIHMS369735
Люк К. Урселл
1 Департамент химии и биохимии, Колорадский университет, 80, Колорадо, США.
Джессика Л. Меткалф
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
Лаура Вегенер Парфри
1 Кафедра химии и биохимии, Колорадский университет в Боулдере , Боулдер, Колорадо, 80309, США
Роб Найт
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Медицинский институт Говарда Хьюза, Боулдер, Колорадо, 80309, США
1 Кафедра химии и биохимии, Колорадский университет в Боулдере, Боулдер, Колорадо, 80309, США
2 Ховард Х. ughes Medical Institute, Боулдер, Колорадо, 80309, США
* Кому следует направлять корреспонденцию: Роб Найт, Департамент химии и биохимии, UCB 215, Университет Колорадо, Боулдер, CO 80309, тел .: 303-492-1984 , Факс: 303-492-7744, уд[email protected] Окончательная отредактированная версия этой статьи издателем доступна на Nutr Rev. См. другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Быстро развивающиеся методы секвенирования и аналитические методы расширяют нашу способность понимать микробиом человека и, действительно, то, как мы определяем микробиом и его составляющие. В этом обзоре мы выделяем недавние исследования, которые расширяют нашу способность понимать микробиом человека в различных пространственных и временных масштабах, включая ежедневные наборы данных временных рядов, охватывающих месяцы.Кроме того, мы обсуждаем новые концепции, связанные с определением операционных таксономических единиц, индексов разнообразия, основных и временных микробиомов и возможности энтеротипов. Дополнительные достижения в технологии секвенирования и в нашем понимании микробиома откроют захватывающие перспективы для использования микробиоты в персонализированной медицине.
Введение
Микробиота человека состоит из 10–100 триллионов симбиотических микробных клеток, содержащихся в каждом человеке, в первую очередь бактерий в кишечнике; Микробиом человека состоит из генов, содержащихся в этих клетках [1].Проекты микробиома во всем мире были запущены с целью понять роли, которые играют эти симбионты, и их влияние на здоровье человека [2, 3]. Подобно тому, как вопрос «что такое , , чтобы быть человеком?» Беспокоил людей с самого начала записанной истории, вопрос: «что такое , — человеческий микробиом?» вызывает беспокойство у исследователей с тех пор, как этот термин был придуман Джошуа Ледербергом в 2001 году [4]. Уточнение определения микробиома человека осложнилось путаницей в терминологии: например, «микробиота» (таксоны микробов, связанные с людьми) и «микробиом» (каталог этих микробов и их генов) часто используются как синонимы.Кроме того, термин «метагеномика» первоначально относился к характеристике общей ДНК методом дробовика, хотя сейчас он все чаще применяется для изучения маркерных генов, таких как ген 16S рРНК. Однако более фундаментально новые открытия заставляют нас усомниться в концепциях, которые имеют центральное значение для определения микробиома человека, таких как стабильность микробиома человека, определение OTU (операционных таксономических единиц), составляющих микробиоту. , и есть ли у человека один или несколько микробиомов.В этом обзоре мы рассмотрим прогресс в определении микробиома человека в этих различных отношениях.
Изучение разнообразия микробиома человека началось с Антони ван Левенгука, который еще в 1680-х годах сравнивал свою оральную и фекальную микробиоту. Он отметил поразительные различия в микробах между этими двумя средами обитания, а также между образцами, взятыми у людей с состоянием здоровья и болезнью в обоих этих местах [5, 6]. Таким образом, исследования глубоких различий в микробах на разных участках тела и между здоровье и болезни так же стары, как и сама микробиология.Сегодня новым является не способность наблюдать эти очевидные различия, а, скорее, способность использовать мощные молекулярные методы, чтобы понять, почему существуют эти различия, и понять, как мы можем повлиять на преобразования из одного состояния в другое.
Культурально-независимые методы характеристики микробиоты вместе с молекулярным филогенетическим подходом к организации разнообразия жизни обеспечили фундаментальный прорыв, позволив исследователям сравнивать микробные сообщества в разных средах в рамках единого филогенетического контекста (см. Обзор [7]).Хотя связанные с хозяином микробы предположительно попадают в окружающую среду, состав микробиоты млекопитающих, особенно в кишечнике, неожиданно отличается от свободноживущих микробных сообществ [8]. Фактически, анализ бактериального разнообразия свободноживущих сообществ в наземных, морских и пресноводных средах, а также сообществ, связанных с животными, предполагает, что кишечник позвоночных является экстремальным явлением [8]. Напротив, бактериальные сообщества из сред, обычно считающихся экстремальными, таких как кислые горячие источники и гидротермальные источники, похожи на сообщества во многих других средах [9].Это говорит о том, что совместная эволюция между позвоночными и их микробными консорциумами в течение сотен миллионов лет привела к выбору специализированного сообщества микробов, которые процветают в теплой, эвтрофной и стабильной среде кишечника [8]. В кишечнике человека и во всех связанных с человеком средах обитания бактерии составляют основную часть биомассы и разнообразия, хотя археи, эукариоты и вирусы также присутствуют в меньшем количестве, и ими нельзя пренебрегать [10, 11].
Интересно, что оценки каталога генов человека и разнообразия генома человека бледнеют по сравнению с оценками разнообразия микробиома.Например, консорциум Meta-HIT сообщил о каталоге генов из 3,3 миллионов неизбыточных генов только в микробиоме кишечника человека [3] по сравнению с ~ 22 000 генов, присутствующих во всем геноме человека [12]. Точно так же разнообразие микробиома людей огромно по сравнению с вариациями генома: отдельные люди примерно на 99,9% идентичны друг другу с точки зрения генома хозяина [13], но могут отличаться друг от друга на 80-90% с точки зрения генома. микробиом их руки [14] или кишечника [15].Эти результаты показывают, что использование вариаций, содержащихся в микробиоме, будет гораздо более плодотворным в персонализированной медицине, использовании генетических данных отдельного пациента для информирования медицинских решений, чем подходы, нацеленные на относительно постоянный геном хозяина.
Многие фундаментальные вопросы о микробиоме человека до недавнего времени было трудно или невозможно было решить. На некоторые вопросы, такие как вечно популярный «сколько видов обитает на данном участке тела?», Все еще трудно ответить из-за проблем с определениями видов бактерий и скоростью ошибок секвенирования.Другие вопросы, такие как «как разнообразие внутри человека с течением времени соотносится с разнообразием между людьми?» Или «как различие между участками на теле одного и того же человека соотносится с разнообразием между разными людьми на одном участке?» , или «существует ли основной набор видов микробов, которые мы все разделяем?», теперь можно дать окончательный ответ. В следующем разделе мы обсудим некоторые инструменты, которые позволили ответить на эти давние вопросы.
Инструменты для микробного анализа
Резкое сокращение затрат на секвенирование, наблюдавшееся за последние несколько лет, позволило идентифицировать специфические таксоны микробов, обнаруженные в кишечнике человека, которые трудно или невозможно культивировать.Теперь исследователи могут генерировать миллионы последовательностей для каждого образца, чтобы оценить различия в микробных сообществах между участками тела и отдельными людьми. Наша возросшая мощность секвенирования потребовала разработки столь же мощных вычислительных инструментов для обработки растущего количества данных последовательностей, производимых современными технологиями [16]. Существует несколько конвейеров для анализа данных микробного микробного сообщества, таких как mothur [17], w.A.T.E.R.S [18], инструменты RDP pyroseqeuncing [19] и QIIME (произносится «колокольчик») [20].QIIME — это бесплатная платформа с открытым исходным кодом для анализа данных высокопроизводительного секвенирования, которая позволяет пользователям импортировать необработанные данные о последовательностях и быстро производить измерения разнообразия между и внутри образцов. Последовательность в идентификации операционных таксономических единиц (OTU) и установление согласованных мер разнообразия внутри и между выборками имеют решающее значение для сравнения результатов исследований, хотя концепция OTU становится все более проблематичной по мере того, как накапливаются данные о последовательности и приобретаются явные филогенетические подходы. в популярности.
Бета-разнообразие относится к измерению степени различия в членстве или структуре сообщества между двумя выборками. Недавний обзор основанных на таксонах измерений бета-разнообразия показал, что некоторые метрики, в том числе расстояния Канберры и Гауэра, обладают повышенной мощностью для различения кластеров, в то время как другие метрики, такие как хи-квадрат и корреляционные расстояния Пирсона, более подходят для выяснения эффектов. градиентов среды на сообществах [21]. Надежным методом сравнения различий между микробными сообществами является UniFrac, который измеряет долю общих длин ветвей на филогенетическом дереве между образцами [22].Очень похожие микробные сообщества приводят к оценке UniFrac, близкой к 0, в то время как два полностью независимых сообщества, которые не имеют общей длины ветвей (т. Е. Имеют разную эволюционную историю), дают оценку UniFrac, равную 1. Анализ основных координат (PCoA) может затем визуализировать расстояния Unifrac между образцами в двумерном или трехмерном пространстве, что позволяет легко визуально различать кластеризацию похожих сообществ или разделение отдельных сообществ.
UniFrac как мера бета-разнообразия в сочетании с PCoA имеет способность различать различия между сообществами, используя всего 10 последовательностей на образец [23]. Важно понимать, что увеличенная глубина секвенирования не всегда необходима для получения биологически значимых результатов, когда эти результаты очевидны. Таким образом, выбирая измерения разнообразия, которые подходят для дизайна исследования, исследователи, использующие современные методы секвенирования, могут охарактеризовать различия между выборками при относительно низком охвате последовательностей.Это позволяет исследователям оценивать мелкозернистые пространственные и временные закономерности, характеризуя от сотен до тысяч образцов, таких как временные ряды по нескольким пациентам или средам. Функциональность UniFrac, а также множество измерений разнесения доступны в QIIME, и их можно легко сравнить.
В общем, конвейеры для анализа 16S рРНК и метагеномных данных дробовика имеют отдельные рабочие процессы. Некоторые начальные шаги, такие как демультиплексирование (удаление штрих-кодов и разделение объединенных образцов) и качественная фильтрация, являются общими для обоих конвейеров.Однако для данных 16S рРНК последовательности должны быть сгруппированы в OTU, химерные последовательности, генерируемые неполным расширением матрицы, должны быть удалены, и должны быть построены филогенетические деревья. Напротив, в метагеномном конвейере последовательности должны быть назначены функциям, а также таксономии (либо как целые чтения, либо после сборки). Как только таксоны или таблицы функций генов построены, конвейеры начинают сближаться, по крайней мере, концептуально: тогда интерес заключается в 1) составе каждой выборки, 2) поиске таксонов или функций, которые различают группы выборок (например,грамм. в соответствии с клиническими параметрами) и 3) с вопросом, группируются ли образцы в соответствии с какими-либо измеренными клиническими состояниями (или по времени). Одно интересное развивающееся направление — сравнение метагеномной кластеризации и кластеризации 16S рРНК напрямую с использованием метода, называемого анализом Прокруста, который позволяет комбинировать графики PCoA [24]. Еще один мощный инструмент — использование машинного обучения и статистических методов для построения прогнозных моделей таксонов [25] или функций [26], которые различают группы выборок.
Уникальным преимуществом QIIME по сравнению с другими конвейерами является его способность использовать «образцы метаданных», например клиническая информация о субъектах, позволяющая визуализировать основные закономерности в данных. Особый интерес представляет то, что QIIME поддерживает стандарт MIMARKS (минимальная информация о последовательности маркеров) [27], разработанный Консорциумом геномных стандартов [28], который становится все более популярным среди других инструментов для анализа микробов и сообществ, таких как MG-RAST [29]. , и был принят INSDC (Международный консорциум баз данных нуклеотидных последовательностей, который включает GenBank, EBI и DDBJ) в качестве стандарта для метаданных.
С этими инструментами основные закономерности сходства и различия в микробиоте стали обычным делом. Ключевая задача в настоящее время состоит в том, чтобы расширить анализ, включив в него лонгитюдные исследования и понять роль конкретных хозяев и факторов окружающей среды в развитии и поддержании микробиома.
Динамическое взаимодействие между человеческими микробами и окружающей средой
Желудочно-кишечный тракт (ЖКТ) младенца человека обеспечивает совершенно новую среду для микробной колонизации [30].Действительно, микробиота, которую начинает приобретать младенец, сильно зависит от способа родов [31]. Через двадцать минут после рождения микробиота новорожденных, рожденных через естественные родовые пути, напоминает микробиоту влагалища их матери, в то время как младенцы, рожденные с помощью кесарева сечения, содержат микробные сообщества, обычно встречающиеся на коже человека [32]. Приобретение микробиоты продолжается в течение первых нескольких лет жизни, поскольку микробиом желудочно-кишечного тракта младенца начинает напоминать микробиом взрослого уже на первом году жизни [33].В одном тематическом исследовании микробиоты младенца в течение первых 2,5 лет жизни филогенетическое разнообразие значительно и линейно увеличивается со временем [34]. Кроме того, значительные изменения в составе кишечной микробиоты были очевидны в пяти временных точках; переход на грудное молоко, развитие лихорадки на 92 день, введение рисовых хлопьев на 134 день, введение смеси и столовых продуктов на 161 день, а также лечение антибиотиками и диета для взрослых на 371 день [34]. Интересно, что каждое изменение диеты сопровождалось изменениями микробиоты кишечника и обогащением соответствующих генов.Например, когда младенец начал получать полноценную взрослую диету, гены в микробиоме, связанные с биосинтезом витаминов и перевариванием полисахаридов, стали обогащаться [34].
Взаимодействие между микробиотой человека и окружающей средой носит динамичный характер, при этом человеческие микробы свободно перемещаются на поверхности, с которыми мы взаимодействуем каждый день. Fierer et al. показали, что кончики пальцев человека могут переносить сообщества микробов на клавиатуру, и эти сообщества сильно дифференцируют людей [35].Графики PCoA показали, что можно было определить, какие пальцы печатали на каких клавишах и какие люди использовали какие клавиатуры: можно было даже связать руку человека с компьютерной мышью, которую он использует, с точностью до 95% по сравнению с база данных других рук [35]. В целом, это исследование показало, что микробные сообщества постоянно переносятся между поверхностями и что существует динамическое взаимодействие между микробиотой окружающей среды и различными участками человеческого тела.
Внутриличностное микробное разнообразие
Еще один интересный вопрос, на который мы только начинаем отвечать, — насколько стабильным со временем становится микробиом внутри человека.Определив, что составляет нормальные временные изменения у человека с течением времени, мы сможем лучше количественно оценить и понять изменения в микробных сообществах, которые возникают в результате диетических и фармацевтических вмешательств. В самом продолжительном на сегодняшний день исследовании временных рядов Caporaso et al. отобрали образцы микробных сообществ двух индивидуумов в кишечнике, ротовой полости, левой и правой ладонях за 396 временных точек в течение 15 месяцев [36]. Сообщества на разных участках тела можно было легко отличить друг от друга с помощью трехмерных графиков PCoA в течение одного года, даже несмотря на то, что структура сообщества на данном участке сильно варьировала [36].Уровень разнообразия также различается между участками тела, при этом во рту и кишечнике находятся самые разные сообщества [37]. Взятые вместе, эти исследования показывают, что микробиота человека представляет собой сильно изменчивую и разрозненную экосистему.
В целом, еще предстоит окончательно доказать, что отдельные особи или даже участки тела несут в себе «основной» набор специфических бактериальных таксонов. Например, консорциум Meta-HIT определил «основной» набор клонов как те, которые присутствовали у половины изучаемых субъектов, хотя, по существу, у всех изучаемых субъектов гены не присутствовали [3].Конечно, важно понимать, что глубина отбора проб может иметь решающее значение для различения таксонов, которые отсутствуют, от таксонов, которые просто очень редки; динамический диапазон численности микробов также довольно велик, и даже для «основных» генов Meta-HIT 2000-кратные диапазоны численности не были редкостью. Доказать, что таксон полностью отсутствует в кишечнике, невозможно с помощью этих типов исследований, поэтому основные расчеты всегда должны включать в себя предупреждение о глубине секвенирования. Еще один фактор, который следует учитывать при определении разнообразия и ядра, заключается в том, что методологические артефакты могут значительно увеличить видимое количество OTU в выборке (и, следовательно, уменьшить видимую долю, которая разделяется).Как ошибка секвенирования [38, 39], так и проблемы, связанные с выравниванием, особенно множественным выравниванием последовательностей [40-43], могут сильно увеличить количество OTU. Важно убедиться, что при проведении оценок керна использовались одни и те же методологические процедуры с точки зрения доли особей, в которой керн должен быть представлен, минимальной численности и процедуры принятия решения, какие последовательности считаются «одинаковыми». Наконец, существует ключевой вопрос о том, структурированы ли вариации вокруг ядра таким образом, чтобы люди имели лишь несколько общих типов профилей микробиоты на данном участке тела: это хорошо установлено для влагалища [44], но более спорно для кишечника [ 45].В общем, следует проявлять крайнюю осторожность при выполнении процедур кластеризации, так как многие из них разбивают непрерывное изменение на кластеры, которых не существует [21]. Надежные процедуры выбора модели, которые включают возможность существования только непрерывных вариаций, а не дискретных кластеров, еще предстоит разработать в контексте анализа микробного сообщества.
Появляется все больше свидетельств того, что люди на самом деле разделяют «основной микробиом», а не «стержневую микробиоту». В исследовании пар монозиготных и дизиготных близнецов, согласных по ожирению или худобе, у всех индивидуумов была общая подгруппа идентифицируемых микробных генов, но не видов [15].Примечательно, что совершенно разные наборы видов микробов дали очень похожие функциональные пути KEGG. Однако отклонения от этого основного микробиома были очевидны у субъектов с ожирением, что свидетельствует о важности использования метагеномных данных в дополнение к определению состава микробного сообщества с помощью исследований маркерного гена 16S при оценке различий между болезненными состояниями. Будет интересно понять, верен ли этот принцип для других участков тела; кросс-биомные метагеномные сравнения на сегодняшний день чрезвычайно редки [46, 47].
Микробиом кишечника играет важную роль в пищеварении и питании.
Доказательства неразрывной связи между микробиотой, пищеварением и метаболизмом хозяина растут. При анализе людей и 59 дополнительных видов млекопитающих последовательности 16S рРНК сгруппированы вместе плотоядных, всеядных и травоядных в основном координатном пространстве, показывая, что структуры сообщества различаются в зависимости от диеты [48]. Изменения в рационе мышей также могут привести к значительным изменениям в метаболизме бактерий, особенно жирных кислот и аминокислот с небольшой цепью, всего за одну неделю [49] и могут привести к большим изменениям уже через один день [50].Важно отметить, что генетическое разнообразие, обнаруженное в нашей кишечной микробиоте, позволяет нам переваривать соединения посредством метаболических путей, явно не закодированных в геноме млекопитающих, что значительно увеличивает нашу способность извлекать энергию из наших разнообразных диет [51, 52].
Микробиота кишечника также играет важную роль в ожирении. У здоровых мышей, которым трансплантируют кишечную микробиоту от обычных мышей, наблюдается увеличение ожирения без увеличения потребления пищи из-за увеличения извлечения энергии из рациона и увеличения депонирования энергии в адипоцитах хозяина [53].Два основных микробных подразделения, Firmicutes и Bacteriodetes, демонстрируют разную численность в зависимости от фенотипа. Уменьшение Bacteriodetes и увеличение Firmicutes было обнаружено у мышей с генетическим ожирением ( ob / ob ) по сравнению с их худыми коллегами [54], а фенотип ожирения может даже передаваться беспроблемным, но генетически диким типам мышей. микробиоты, а фенотип обусловлен энергетическим балансом: калориметрия фекальных гранул с помощью бомбы показывает, что мыши ob / ob извлекают больше энергии из своего рациона и оставляют меньше с фекалиями [51].Примечательно, что те же эффекты справедливы и для другой модели мышей, мышей с нокаутом TLR5, которые также становятся тучными в некоторых помещениях для мышей (но заболевают колитом в других, предположительно из-за различий в фоновой микробиоте). Мыши с нокаутом TLR5 также обладают фенотипом трансмиссивного ожирения, но никакой разницы в эффективности сбора энергии не происходит. Вместо этого измененная микробиота каким-то образом делает мышей более голодными, и их вызванное микробами ожирение можно вылечить, ограничив количество пищи в их клетках тем, которое потребляется мышами дикого типа, а также антибиотиками [55].Корреляция между микробами и ожирением, возможно, лучше всего иллюстрируется потерей веса. Поскольку разные группы людей были помещены на диету с ограничением жиров или углеводов, их количество Bacteriodetes увеличивалось по мере снижения их массы тела, переходя от характерного «тучного» микробного сообщества к «худому» сообществу [56]. Таким образом, изменение микробиоты пациента может быть терапевтическим вариантом, способствующим снижению веса у пациентов с ожирением или способствующим увеличению веса у детей с недостаточным весом.
Удивительно, но микробы, которые мы поглощаем вместе с пищей, могут обеспечивать наш индивидуальный микробиом новыми генами для переваривания новой пищи. Hehemann et al. обнаружили, что новый класс гликозидгидролаз, используемых для переваривания порфирана, полисахарида, распространенного в красных водорослях, также был обнаружен в образцах стула человека в качестве гена в Bacteriodes plebeius . Более тщательное изучение метаданных стула показало, что образцы стула, содержащие ген, переваривающий порфиран, присутствовали только у японцев; ген не был обнаружен в микробиоме кишечника жителей Соединенных Штатов.Почему в кишечнике человека можно найти морской ген? Авторы пришли к выводу, что водоросли, распространенные в японской, но не американской диете, содержат микроорганизмы, которые передали гены микробиому кишечника [57]. Таким образом, микробы обладают способностью значительно увеличивать количество метаболических инструментов в кишечнике человека, позволяя нам переваривать множество субстратов.
Пластичность кишечника человека
Учитывая относительную стабильность микробиоты кишечника человека, один из ключевых вопросов заключается в том, является ли он достаточно пластичным, чтобы позволить четко определенные вмешательства для улучшения здоровья.Как описано выше, микробиота кишечника после установления остается довольно стабильной во времени, по крайней мере, по сравнению с различиями между людьми. Однако ряд исследований демонстрирует, что внешние силы могут изменять сообщество микробов, расположенных в желудочно-кишечном тракте, и антибиотики являются важным примером.
Антибиотики в основном используются для борьбы с патогенными видами бактерий, которые обитают внутри хозяина или вторглись в него, однако нынешнее поколение антибиотиков имеет широкий спектр действия и нацелено также на широкие слои нормальной микробиоты.Таким образом, антибиотики значительно влияют на врожденную микробиоту кишечника хозяина. Через три-четыре дня после лечения ципрофлоксацином, антибиотиком широкого спектра действия, кишечная микробиота испытывает снижение таксономического богатства, разнообразия и однородности [58, 59]. Значительные изменения микробиоты кишечника продемонстрировали значительную межличностную изменчивость. В то время как микробиота кишечника начала напоминать состояние до лечения через неделю после лечения, между людьми наблюдались различия в том, насколько близко сообщество после лечения напоминало сообщество до лечения, а некоторые таксоны не смогли вернуться в сообщество [59 , 60].Действительно, восстановление некоторых видов может происходить в течение четырех лет после лечения антибиотиками [61]. Тем не менее, общее восстановление микробиоты кишечника после лечения антибиотиками предполагает, что существуют факторы внутри сообщества, биотические или абиотические, которые способствуют устойчивости сообщества, хотя они еще не выяснены.
Другие антибиотики также имеют тенденцию давать результаты, которые существенно различаются между субъектами [62, 63] и даже участками тела [64]. Поскольку более крупные группы населения еще не были изучены, отчасти из-за этических проблем с назначением антибиотиков здоровым людям, причины этих основных различий еще не выяснены.Понимание факторов, определяющих способность микробиоты противостоять возмущениям и восстанавливаться после них, а также понимание факторов, определяющих ее текущее состояние, будет ключом к разработке инструментов, помогающих манипулировать микробиомами. Например, как ни странно, у крыс введение антибиотиков перед трансплантацией слепой кишки фактически снижает вероятность появления новых микробов [65].
Интересным намеком на то, что микробиота может быть более пластичной, чем можно было представить, является недавний успех лечения стойких инфекций Clostridum difficile с помощью трансплантации кала, который был успешным в ряде исследований [66-72] и в целом. обедненное кишечное сообщество, образовавшееся во время C.difficile заменяется донорским сообществом [67, 73]. Успех этой техники впечатляет, особенно если учесть, как мало известно о самом лучшем сообществе, которое можно предоставить. Например, что лучше: получить фекальное сообщество близкого родственника или сожителя или, возможно, сохранить собственный стул перед началом лечения антибиотиками, чтобы его можно было восстановить позже? Подходит ли один и тот же стул для всех, или огромные различия в микробиоте означают, что микробы каждого человека специально адаптированы по сравнению с микробами, которые они могут получить от донора? Как и в случае с группами крови, существуют ли «универсальные доноры» и «универсальные реципиенты»? На эти и многие другие вопросы еще предстоит ответить.
Выводы и проспект
Как и каждый год с момента первоначального секвенирования ДНК, этот год привел к беспрецедентному росту количества данных о последовательностях, собранных с беспрецедентно низкой стоимостью. Также были разработаны или обновлены все более мощные инструменты, используемые для извлечения значимых закономерностей из этого множества данных. Появляются новые технологии, такие как трансплантация стула, 16S рРНК и полногеномное секвенирование на платформе Illumina, возможность с высокой эффективностью трансплантировать человеческие микробные сообщества мышам даже из замороженных образцов [50], а также создание персонализированных коллекций культур [74]. перспектива будущего, в котором методы лечения отдельных людей будут опробоваться на батарее мышей, подвергнутых различным видам лечения, и в которых будут проводиться одноразовые эксперименты, которые выявят эффекты удаления отдельных видов [74] или отдельных генов из внутри вида [75] позволяют понять механизм.Хотя имеющиеся у нас инструменты по-прежнему несовершенны (например, ограниченная длина чтения сегодняшних высокопроизводительных технологий секвенирования ограничивает способность обнаруживать виды и штаммы бактерий, а анализ вирусов и эукариот все еще остается новым рубежом), Перспективы развития механистического понимания факторов, лежащих в основе пластичности микробиома, а затем манипулирования микробиомом для улучшения здоровья, кажутся все более радужными.
Благодарности
Работа, цитируемая в этом обзоре из лаборатории автора, была частично поддержана грантами Национальных институтов здравоохранения [HG4872 (RK)], Американского фонда Крона и колита и Медицинского института Говарда Хьюза [RK] .
Ссылки
2. Петерсон Дж., Гарджес С., Джованни М., Макиннес П., Ван Л., Шлосс Дж. А., Бонацци В., МакИвен Дж. Э., Веттерстранд К. А., Дил С. и др. Проект NIH Human Microbiome Project. Геномные исследования. 2009; 19: 2317–2323. [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Qin J, Li R, Raes J, Arumugam M, Burgdorf KS, Manichanh C, Nielsen T., Pons N, Levenez F, Yamada T. и др. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Природа. 2010; 464: 59–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 4.Lederberg J, McCray A. Ome sweet ‘omics: — Генеалогическая сокровищница слов. Ученый. 2001; 15: 8. [Google Scholar] 6. ван Левенгук А. Отрывок из письма Антони ван Левенгук от 12 сентября 1683 года. О животных в зубном налете. Философские труды Лондонского королевского общества. 1684; 14: 568–574. [Google Scholar] 7. Pace NR. Молекулярный взгляд на микробное разнообразие и биосферу. Наука. 1997; 276: 734–740. [PubMed] [Google Scholar] 8. Ley RE, Lozupone CA, Hamady M, Knight R, Gordon JI.Миры внутри миров: эволюция микробиоты кишечника позвоночных. Обзоры природы микробиологии. 2008; 6: 776–788. [Бесплатная статья PMC] [PubMed] [Google Scholar] 10. Marchesi JR. Прокариотическое и эукариотическое разнообразие кишечника человека. Успехи в прикладной микробиологии, Том 72, 2010; 72: 43–62. [PubMed] [Google Scholar] 11. Брейтбарт М., Хейнс М., Келли С., Энгли Ф., Эдвардс Р. А., Фелтс Б., Махаффи Дж. М., Мюллер Дж., Нултон Дж., Рейхок С. и др. Вирусное разнообразие и динамика в кишечнике младенца. Исследования в микробиологии.2008. 159: 367–373. [PubMed] [Google Scholar] 12. Консорциум IHGS. Завершение эухроматической последовательности генома человека. Природа. 2004; 431: 931–945. [PubMed] [Google Scholar] 13. Уилер Д.А., Сринивасан М., Эгхолм М., Шен Й., Чен Л., МакГуайр А., Хе В., Чен Ю.Дж., Махиджани В., Рот Г.Т. и др. Полный геном человека путем массового параллельного секвенирования ДНК. Природа. 2008; 452: 872–876. [PubMed] [Google Scholar] 14. Фирер Н., Хамади М., Лаубер С.Л., Найт Р. Влияние пола, рукопожатия и стирки на разнообразие бактерий на поверхности рук.Труды Национальной академии наук Соединенных Штатов Америки. 2008; 105: 17994–17999. [Бесплатная статья PMC] [PubMed] [Google Scholar] 15. Turnbaugh PJ, Hamady M, Yatsunenko T., Cantarel BL, Duncan A, Ley RE, Sogin ML, Jones WJ, Roe BA, Affourtit JP, et al. Основной микробиом кишечника у тучных и худых близнецов. Природа. 2009; 457: 480–484. [Бесплатная статья PMC] [PubMed] [Google Scholar] 16. Kuczynski J, Lauber CL, Walters WA, Parfrey LW, Clemente JC, Gevers D, Knight R. Экспериментальные и аналитические инструменты для изучения микробиома человека.Природа рассматривает генетику. 2012; 13: 47–58. [Бесплатная статья PMC] [PubMed] [Google Scholar] 17. Schloss PD, Westcott SL, Ryabin T., Hall JR, Hartmann M, Hollister EB, Lesniewski RA, Oakley BB, Parks DH, Robinson CJ, et al. Представляем mothur: программное обеспечение с открытым исходным кодом, независимое от платформы, поддерживаемое сообществом для описания и сравнения сообществ микробов. Прикладная и экологическая микробиология. 2009; 75: 7537–7541. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Хартман А.Л., Риддл С., Макфиллипс Т., Людашер Б., Эйзен Дж.Представляем W.A.T.E.R.S .: рабочий процесс для выравнивания, таксономии и экологии рибосомных последовательностей. Биоинформатика BMC. 2010; 11: 317. [Бесплатная статья PMC] [PubMed] [Google Scholar] 19. Коул Дж. Р., Ван К., Карденас Э., Фиш Дж., Чай Б., Фаррис Р. Дж., Кулам-Сайед-Мохидин А. С., МакГаррелл Д. М., Марш Т., ГМ Гаррити, Тидже Дж. М.. Проект базы данных рибосом: улучшенное выравнивание и новые инструменты для анализа рРНК. Исследование нуклеиновых кислот. 2009; 37: D141–145. [Бесплатная статья PMC] [PubMed] [Google Scholar] 20. Caporaso JG, Kuczynski J, Stombaugh J, Bittinger K, Bushman FD, Costello EK, Fierer N, Pena AG, Goodrich JK, Gordon JI, et al.QIIME позволяет анализировать данные секвенирования сообщества с высокой пропускной способностью. Методы природы. 2010. 7: 335–336. [Бесплатная статья PMC] [PubMed] [Google Scholar] 21. Kuczynski J, Liu Z, Lozupone C, McDonald D, Fierer N, Knight R. Методы сходства микробных сообществ различаются по своей способности обнаруживать биологически релевантные паттерны. Нат методы. 2010; 7: 813–819. [Бесплатная статья PMC] [PubMed] [Google Scholar] 22. Lozupone C, Knight R. UniFrac: новый филогенетический метод сравнения микробных сообществ. Прикладная и экологическая микробиология.2005; 71: 8228–8235. [Бесплатная статья PMC] [PubMed] [Google Scholar] 23. Kuczynski J, Costello EK, Nemergut DR, Zaneveld J, Lauber CL, Knights D, Koren O, Fierer N, Kelley ST, Ley RE, et al. Прямое секвенирование микробиома человека легко выявляет различия в сообществах. Геномная биология. 2010; 11 [Бесплатная статья PMC] [PubMed] [Google Scholar] 24. Муэгге Б.Д., Кучински Дж., Найтс Д., Клементе Дж. С., Гонсалес А., Фонтана Л., Хенриссат Б., Найт Р., Гордон Дж. И.. Диета способствует сближению функций микробиома кишечника в филогенезе млекопитающих и в организме человека.Наука. 2011; 332: 970–974. [Бесплатная статья PMC] [PubMed] [Google Scholar] 25. Найтс Д., Костелло Е.К., Найт Р. Классификация микробиоты человека под руководством. Обзоры микробиологии FEMS. 2011; 35: 343–359. [PubMed] [Google Scholar] 26. Уайт Дж. Р., Нагараджан Н., Поп М. Статистические методы обнаружения дифференциально распространенных особенностей в клинических метагеномных образцах. Вычислительная биология PLoS. 2009; 5: e1000352. [Бесплатная статья PMC] [PubMed] [Google Scholar] 27. Йилмаз П., Коттманн Р., Филд Д., Найт Р., Коул Дж. Р., Амарал-Цеттлер Л., Гилберт Дж. А., Карш-Мизрахи И., Джонстон А., Кокрейн Дж. И др.Минимум информации о последовательности маркерного гена (MIMARKS) и минимум информации о спецификациях любой (x) последовательности (MIxS). Биотехнология природы. 2011; 29: 415–420. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Йилмаз П., Гилберт Дж., Найт Р., Амарал-Зеттлер Л., Карш-Мизрахи И., Кокрейн Дж., Накамура И., Сансон С.А., Глокнер Ф.О., Филд Д. Консорциум геномных стандартов: воплощение стандартов микробной экологии. Журнал ISME. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 29. Мейер Ф., Паарманн Д., Д’Суза М., Олсон Р., Гласс Э.М., Кубал М., Пациан Т., Родригес А., Стивенс Р., Уилке А. и др.RAST-сервер метагеномики — общедоступный ресурс для автоматического филогенетического и функционального анализа метагеномов. BMC Bioinformatics. 2008; 9: 386. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Маки Р.И., Сгир А., Гаскинс Х.Р. Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr. 1999; 69: 1035S – 1045S. [PubMed] [Google Scholar] 31. Домингес-Белло М.Г., Блазер М.Дж., Лей Р.Е., Найт Р. Развитие микробиоты желудочно-кишечного тракта человека и выводы из высокопроизводительного секвенирования.Гастроэнтерология. 2011; 140: 1713–1719. [PubMed] [Google Scholar] 32. Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н., Найт Р. Режим доставки формирует приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 11971–11975. [Бесплатная статья PMC] [PubMed] [Google Scholar] 34. Koenig JE, Spor A, Scalfone N, Fricker AD, Stombaugh J, Knight R, Angenent LT, Ley RE.Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Труды Национальной академии наук США. 2010 [Бесплатная статья PMC] [PubMed] [Google Scholar] 35. Фирер Н., Лаубер С.Л., Чжоу Н., Макдональд Д., Костелло Е.К., Найт Р. Криминалистическая идентификация с использованием бактериальных сообществ кожи. Труды Национальной академии наук Соединенных Штатов Америки. 2010; 107: 6477–6481. [Бесплатная статья PMC] [PubMed] [Google Scholar] 36. Caporaso JG, Lauber CL, Costello EK, Berg-Lyons D, Gonzalez A, Stombaugh J, Knights D, Gajer P, Ravel J, Fierer N и др.Движущиеся картинки микробиома человека. Геномная биология. 2011; 12: R50. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Костелло Е.К., Лаубер С.Л., Хамади М., Фирер Н., Гордон Дж. И., Найт Р. Изменчивость бактериального сообщества в средах обитания человеческого тела в пространстве и времени. Наука. 2009; 326: 1694–1697. [Бесплатная статья PMC] [PubMed] [Google Scholar] 38. Кунин В., Энгельбрексон А., Охман Х., Гугенгольц П. Морщины в редкой биосфере: ошибки пиросеквенирования могут привести к искусственному завышению оценок разнообразия. Экологическая микробиология.2010; 12: 118–123. [PubMed] [Google Scholar] 39. Айва К., Ланзен А., Кертис Т.П., Давенпорт Р.Дж., Холл N, руководитель IM, Рид Л.Ф., Слоан В.Т. Точное определение микробного разнообразия по 454 данным пиросеквенирования. Методы природы. 2009; 6: 639–641. [PubMed] [Google Scholar] 40. Sun Y, Cai Y, Huse SM, Knight R, Farmerie WG, Wang X, Mai V. Крупномасштабное эталонное исследование существующих алгоритмов для независимого от таксономии анализа микробного сообщества. Брифинги по биоинформатике. 2011 [Бесплатная статья PMC] [PubMed] [Google Scholar] 41.Schloss PD, Westcott SL. Методы оценки и улучшения, используемые в подходах на основе операционных таксономических единиц для анализа последовательности генов 16S рРНК. Прикладная и экологическая микробиология. 2011; 77: 3219–3226. [Бесплатная статья PMC] [PubMed] [Google Scholar] 42. Хьюз С.М., Велч Д.М., Моррисон Х.Г., Согин М.Л. Разглаживание морщин в редкой биосфере за счет улучшенной кластеризации OTU. Экологическая микробиология. 2010; 12: 1889–1898. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Сунь И, Цай И, Лю Л., Ю Ф, Фаррелл М.Л., МакКендри В., Фармери В.ESPRIT: оценка видового богатства с использованием больших коллекций пиросеквенций 16S рРНК. Исследование нуклеиновых кислот. 2009; 37: e76. [Бесплатная статья PMC] [PubMed] [Google Scholar] 44. Равель Дж., Гайер П., Абдо З., Шнайдер Г.М., Кениг С.С., МакКулл С.Л., Карлебах С., Горле Р., Рассел Дж., Тэкет СО и др. Микробиом влагалища женщин репродуктивного возраста. Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4680–4687. [Бесплатная статья PMC] [PubMed] [Google Scholar] 45. Arumugam M, Raes J, Pelletier E, Le Paslier D., Yamada T., Mende DR, Fernandes GR, Tap J, Bruls T, Batto JM, et al.Энтеротипы микробиома кишечника человека. Природа. 2011; 473: 174–180. [Бесплатная статья PMC] [PubMed] [Google Scholar] 46. Динсдейл Э.А., Эдвардс Р.А., Холл Д., Энгли Ф., Брейтбарт М., Брюлк Дж. М., Фурлан М., Деснуес С., Хейнс М., Ли Л. и др. Функциональное метагеномное профилирование девяти биомов. Природа. 2008. 452: 629–632. [PubMed] [Google Scholar] 47. Триндж С.Г., фон Меринг Ч., Кобаяши А., Саламов А.А., Чен К., Чанг Х.В., Подар М., Шорт Дж. М., Матур Э. Дж., Деттер Дж. К. и др. Сравнительная метагеномика микробных сообществ. Наука.2005; 308: 554–557. [PubMed] [Google Scholar] 48. Лей Р. Э., Хамади М., Лозупоне С., Тернбо П. Дж., Рэйми Р. Р., Бирчер Дж. С., Шлегель М. Л., Такер Т. А., Шренцель М. Д., Найт Р., Гордон Д. И.. Эволюция млекопитающих и их кишечных микробов. Наука. 2008; 320: 1647–1651. [Бесплатная статья PMC] [PubMed] [Google Scholar] 49. Мартин Ф.П., Шпренгер Н., Монтолиу И., Реззи С., Кочхар С., Николсон Дж. Диетическая модуляция функциональной экологии кишечника изучается с помощью фекальной метабономики. Журнал протеомных исследований. 2010; 9: 5284–5295. [PubMed] [Google Scholar] 50.Тернбо П.Дж., Ридаура В.К., Вера Джей-Джей, Рей Ф.И., Рыцарь Р., Гордон Джи. Влияние диеты на микробиом кишечника человека: метагеномный анализ на гуманизированных мышах-гнотобиотах. Наука трансляционная медицина. 2009; 1: 6ра14. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–1031. [PubMed] [Google Scholar] 52. Гилмор М.С., Ферретти Дж. Дж. Микробиология: тонкая грань между кишечным комменсалом и патогеном.Наука. 2003; 299: 1999– +. [PubMed] [Google Scholar] 53. Backhed F, Ding H, Wang T, Hooper LV, Koh GY, Nagy A, Semenkovich CF, Gordon JI. Микробиота кишечника как фактор окружающей среды, регулирующий накопление жира. Proc Natl Acad Sci U S. A. 2004; 101: 15718–15723. [Бесплатная статья PMC] [PubMed] [Google Scholar] 54. Ley RE, Backhed F, Turnbaugh P, Lozupone CA, Knight RD, Gordon JI. Ожирение изменяет микробную экологию кишечника. Труды Национальной академии наук Соединенных Штатов Америки. 2005; 102: 11070–11075.[Бесплатная статья PMC] [PubMed] [Google Scholar] 55. Виджай-Кумар М., Эйткен Д.Д., Карвалью Ф.А., Каллендер Т.С., Мванги С., Сринивасан С., Ситараман С.В., Найт Р., Лей Р.Э., Гевиртц А.Т. Метаболический синдром и измененная микробиота кишечника у мышей, лишенных Toll-подобного рецептора 5. Наука. 2010; 328: 228–231. [Бесплатная статья PMC] [PubMed] [Google Scholar] 56. Ley RE, Turnbaugh PJ, Klein S, Gordon JI. Микробная экология: микробы кишечника человека, связанные с ожирением. Природа. 2006; 444: 1022–1023. [PubMed] [Google Scholar] 57. Хехеманн Дж., Коррек Дж., Барбейрон Т., Хельберт В., Чжек М., Мишель Г.Перенос углеводно-активных ферментов от морских бактерий к микробиоте кишечника японцев. Природа. 2010; 464: 908–912. [PubMed] [Google Scholar] 58. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Распространенное влияние антибиотика на микробиоту кишечника человека, выявленное глубоким секвенированием 16S рРНК. Plos Biology. 2008. 6: 2383–2400. [Бесплатная статья PMC] [PubMed] [Google Scholar] 59. Детлефсен Л, Релман Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков.Труды Национальной академии наук Соединенных Штатов Америки. 2011. 108 (1): 4554–4561. [Бесплатная статья PMC] [PubMed] [Google Scholar] 60. Детлефсен Л., Хусе С., Согин М.Л., Рельман Д.А. Всестороннее воздействие антибиотика на микробиоту кишечника человека, что выявлено глубоким секвенированием 16S рРНК. Plos Biology. 2008; 6: e280. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека.Журнал ISME. 2007; 1: 56–66. [PubMed] [Google Scholar] 62. Джернберг С., Лофмарк С., Эдлунд С., Янссон Дж. Долгосрочное экологическое воздействие приема антибиотиков на микробиоту кишечника человека. Isme Journal. 2007; 1: 56–66. [PubMed] [Google Scholar] 63. Джернберг С., Салливан А., Эдлунд С., Янссон Дж. Мониторинг вызванных антибиотиками изменений в микрофлоре кишечника человека и обнаружение пробиотических штаммов с использованием терминального полиморфизма длины рестрикционных фрагментов. Прикладная и экологическая микробиология.2005. 71: 501–506. [Бесплатная статья PMC] [PubMed] [Google Scholar] 64. Jakobsson HE, Jernberg C, Andersson AF, Sjolund-Karlsson M, Jansson JK, Engstrand L. Краткосрочное лечение антибиотиками оказывает различное долгосрочное воздействие на микробиом горла и кишечника человека. PLoS ONE. 2010; 5 [Бесплатная статья PMC] [PubMed] [Google Scholar] 65. Маничан С., Ридер Дж., Гиберт П., Варела Э., Ллопис М., Антолин М., Гиго Р., Найт Р., Гварнер Ф. Изменение микробиома кишечника с помощью бактериальной трансплантации и приема антибиотиков. Геномные исследования.2010; 20: 1411–1419. [Бесплатная статья PMC] [PubMed] [Google Scholar] 66. Mellow MH, Kanatzar A. Колоноскопическая фекальная бактериотерапия в лечении рецидивирующей инфекции Clostridium difficile — результаты и наблюдение. Журнал Медицинской ассоциации штата Оклахома. 2011; 104: 89–91. [PubMed] [Google Scholar] 67. Grehan MJ, Borody TJ, Leis SM, Campbell J, Mitchell H, Wettstein A. Устойчивое изменение микробиоты толстой кишки путем введения донорской фекальной флоры. Журнал клинической гастроэнтерологии.2010; 44: 551–561. [PubMed] [Google Scholar] 68. Гарборг К., Ваагсбо Б., Сталлемо А., Матре Дж., Сундой А. Результаты инстилляционной терапии фекального донора при рецидивирующей диарее, связанной с Clostridium difficile. Скандинавский журнал инфекционных болезней. 2010; 42: 857–861. [PubMed] [Google Scholar] 69. Сильверман М.С., Дэвис I, Пиллай ДР. Успех самостоятельной трансплантации фекалий в домашних условиях при хронической инфекции Clostridium difficile. Клиническая гастроэнтерология и гепатология: официальный журнал клинической практики Американской гастроэнтерологической ассоциации.2010. 8: 471–473. [PubMed] [Google Scholar] 70. МакКонначи А.А., Фокс Р., Кеннеди Д.Р., Ситон Р.А. Фекальный трансплантат при рецидивирующей диарее, связанной с Clostridium difficile: серия случаев в Великобритании. QJM: ежемесячный журнал Ассоциации врачей. 2009. 102: 781–784. [PubMed] [Google Scholar] 71. Вы DM, Franzos MA, Holman RP. Успешное лечение молниеносной инфекции Clostridium difficile с помощью фекальной бактериотерапии. Анналы внутренней медицины. 2008. 148: 632–633. [PubMed] [Google Scholar] 72. Тведе М, Раск-Мадсен Дж.Бактериотерапия хронической рецидивирующей диареи Clostridium difficile у шести пациентов. Ланцет. 1989; 1: 1156–1160. [PubMed] [Google Scholar] 73. Хоруц А., Диксвед Дж., Янссон Дж. К., Садовски М.Дж. Изменения в составе фекального микробиома человека после бактериотерапии рецидивирующей диареи, связанной с Clostridium difficile. Журнал клинической гастроэнтерологии. 2010; 44: 354–360. [PubMed] [Google Scholar] 74. Вера Дж. Дж., Рей Ф. Е., О’Доннелл Д., Карлссон М., Макналти Н. П., Каллстром Дж., Гудман А. Л., Гордон Дж. И..Создание и характеристика сообществ кишечных микробов человека у мышей-гнотобиотов. Журнал ISME. 2010; 4: 1094–1098. [Бесплатная статья PMC] [PubMed] [Google Scholar] 75. Гудман А.Л., Макналти Н.П., Чжао Ю., Лейп Д., Митра Р.Д., Лозупоне, Калифорния, Найт Р., Гордон Дж. И.. Определение генетических детерминант, необходимых для создания симбионта кишечника человека в его среде обитания. Клеточный хозяин и микроб. 2009. 6: 279–289. [Бесплатная статья PMC] [PubMed] [Google Scholar]
Микробиом человека: почему наши микробы могут быть ключом к нашему здоровью | Наука
Что такое микробиомы?
Как внутри, так и снаружи наши тела содержат огромное количество микроорганизмов.Хотя бактерии являются крупнейшими игроками, мы также являемся хозяевами одноклеточных организмов, известных как археи, а также грибов, вирусов и других микробов, включая вирусы, атакующие бактерии. Вместе это называют микробиотой человека. Микробиом вашего тела — это все гены, которые содержит ваша микробиота, однако в просторечии эти два термина часто используются как синонимы.
Погодите, разве микробы не опасны?
Это что-то вроде спектра: некоторые из них являются патогенами, но другие становятся вредными только в том случае, если они попадают в неправильное место или их количество растет, а некоторые очень полезны для организма, например, помогая расщеплять множество вредных организмов. сахара, содержащиеся в грудном молоке человека.«Эти сахара не расщепляются младенцами», — сказал профессор Джон Крайан, нейрофармаколог и эксперт по микробиому из Университетского колледжа Корка. Вместо этого микробы в кишечнике ребенка делают свою работу.
Другие ключевые роли наших микробов включают программирование иммунной системы, обеспечение наших клеток питательными веществами и предотвращение колонизации вредоносными бактериями и вирусами.
Откуда берутся мои кишечные микробы? Я просто заберу их из своего окружения?
Частично.Но все гораздо сложнее. «Это все еще немного спорно, но по большей части считается, что мы бесплодны, когда находимся в утробе матери, и когда мы рождаемся, когда мы выходим через родовые пути от наших мам, мы получаем эти передаточные бактерии, — сказал Крайан. «Это как глоток при рождении. Эти бактерии действительно важны для запуска всего процесса ».
Крайан отмечает, что во время беременности микробиом матери изменяется, очевидно, до оптимального состава для потомства. «Если вы родились не естественным путем, а родились путем [кесарева сечения], все начинается по-другому», — сказал он.Действительно, исследования показали, что эти различия могут быть одной из причин, по которым дети, рожденные с помощью кесарева сечения, имеют более высокий риск заболеваний, включая астму и диабет 1 типа. Тем не менее, врачи предостерегли родителей от попыток засеять младенцев, рожденных путем кесарева сечения, вагинальными бактериями.
Микробиом нашего кишечника быстро меняется в течение первых двух лет жизни, формируется микробами в грудном молоке, окружающей средой и другими факторами, и стабилизируется к тому времени, когда нам исполняется около трех лет.Но наша окружающая среда, наша долгосрочная диета, стресс и лекарства, которые мы принимаем, такие как антибиотики, продолжают играть роль с возрастом, а это означает, что наш микробиом может меняться на протяжении всей нашей жизни.
Микробы на месте преступления
Кажется, микробы повсюду — о скольких мы говорим?
С 1970-х годов число микробов превышает количество наших собственных клеток примерно в 10 раз. Но исследование, проведенное в 2016 году, показывает, что на самом деле микробные клетки и клетки человека сосуществуют примерно в пределах 1.Соотношение 3 к одному — это означает, что они лишь немного превосходят по численности наши собственные клетки, хотя это не включает вирусы и вирусные частицы.
Означает ли это, что я не человек?
Некоторые говорят, что нас следует рассматривать как холобионт , термин, отражающий близкие, созависимые отношения человека с микробами. «Я рассказываю анекдот о том, что в следующий раз, когда кто-то пойдет в ванную и избавится от некоторых своих микробов, он станет более человечным», — сказал Крайан.
Но Эллен Кларк, философа биологии из Университета Лидса, не убеждена.«Все зависит в первую очередь от того, что вы подразумеваете под словом« человек »», — сказала она. «Если вы думаете, что человек — это совокупность клеток, каждая из которых имеет копии одних и тех же хромосом, то вам шокирует тот факт, что наши тела содержат клетки с бактериальной ДНК».
Но, как указывает Кларк, человеческие клетки не только содержат хромосомы, но также несут ДНК в наших клеточных электростанциях, митохондриях, которые являются эволюционными потомками бактерий. Наш геном также содержит участки генетического материала, называемые транспозонами, которые, по крайней мере, в некоторых случаях, как считается, были введены вирусами давным-давно.«Я предпочитаю определять человека в терминах эволюции, и если мы сделаем это, то митохондрии станут частями человека, как и транспозоны, но кишечные микробы — нет, и ни протезы конечностей, ни будущие плоды не являются», — сказал Кларк, указывая на что микробы могут покинуть тело и жить без нас.
Микробы в кишечнике такие же, как и на коже?
Нет, разные части тела — кожа, влагалище, кишечник — имеют очень разные, различные сообщества микробов.Хотя кишечные микробы привлекли большое внимание, микробы в других местах также важны: в недавних исследованиях ученые обнаружили, что бактерии, обычно встречающиеся на коже, могут помочь защитить от рака кожи.
Микробиомы также различаются от человека к человеку. «Когда вы смотрите на общий активный микробиом двух здоровых людей, даже если они живут в одном городе, вы видите огромное количество разногласий в их микробиоме», — сказал Роб Найт, профессор педиатрии, информатики и инженерии в Калифорнийский университет в Сан-Диего и эксперт по микробиому человека.
Изменчивость микробиома кишечника, отмечает Найт, помогает объяснить, почему люди по-разному реагируют на одни и те же продукты. «Полезны ли помидоры для вас или вредны, полезен ли для вас рис или хуже, чем мороженое и т. Д., Все зависит от вашего микробиома», — сказал он.
Почему микробиом стал такой горячей темой для исследований?
В последние годы микробиом кишечника, в частности, был связан с множеством заболеваний и состояний, от диабета до аутизма и от тревоги до ожирения.
Микробиом кишечника также был связан с тем, как люди реагируют на определенные лекарства, в том числе с тем, как больные раком реагируют на химиотерапию, и даже предварительно предполагалось, что это может быть связано с тем, насколько хорошо мы спим.
Между тем, ряд исследований повысил важность других аспектов нашего микробиома, в том числе того, что микробиом влагалища важен для эффективности препарата для профилактики ВИЧ, наносимого во влагалище.
Почему мы думаем, что микробиом связан со всеми этими условиями?
Хотя некоторые ссылки были получены при сравнении микробиомов разных групп людей, например, людей с определенным заболеванием, и здоровых людей, крупным игроком в исследованиях микробиома является стерильная мышь.
Этот организм выращивается в стерильной среде и затем может подвергаться воздействию определенных микробов или групп микробов для изучения их воздействия. Такие исследования сыграли ключевую роль в выявлении возможных связей между микробиомом кишечника и многими аспектами нашего здоровья, включая настроение и ожирение.
Важны ли отдельные микробы или микробное сообщество в целом?
Это сложная проблема. В некоторых экспериментах определенные штаммы бактерий были связаны с определенными эффектами или условиями, в то время как другие показали, что большое значение имеет разнообразие микробиома или относительная численность видов.
«Это немного похоже на тропический лес: у вас может быть очень красивый папоротник, который очень счастлив, но если это единственное, что есть в вашем тропическом лесу, и у вас нет разнообразия, это не будет хорошо [для ] почвы », — сказал Тим Спектор, профессор генетической эпидемиологии Королевского колледжа Лондона и автор книги« Миф о диете ». Когда дело доходит до микробиома, «это правильное сообщество бактерий, которые работают вместе и вместе производят нужные химические вещества для вашего тела».
Так могут ли микробы влиять на наш вес или даже на наш мозг? Звучит немного по-фантастическому.
Когда дело доходит до ожирения, кишечные микробы могут влиять на вещи несколькими способами, в том числе через аппетит, образование газов, эффективность употребления пищи, а также влияние на иммунную систему и воспаление.
Есть несколько механизмов, влияющих на настроение. Один проходит через блуждающий нерв, двустороннюю магистраль, идущую от мозга к различным органам тела, включая кишечник.
Учитывая, что микробиом связан с таким количеством состояний, обещает ли возня с ним целый ряд новых методов лечения?
Следует проявлять осторожность: многие исследования показывают ассоциации, а не причинно-следственные связи, а некоторые основаны только на исследованиях на стерильных мышах и не изучались на людях.Даже с мышами все не так просто — эффекты не всегда одинаковы для обоих полов и могут различаться для разных линий мышей.
Есть и другие факторы, которые следует учитывать: «Что касается ожирения, как оно выглядит в разных человеческих популяциях, разные виды микробов участвуют в различиях между худыми и тучными людьми», — сказал Найт.
Спектор сказал: «Я думаю, что все правы в том, что относятся к скептикам, и многие ссылки могут заключаться только в том, что [микробы] не обязательно являются причиной [болезни], но они могут быть ее вторичным следствием.
Другие говорят, что неудивительно, что наш микробиом может быть тесно связан с нашим здоровьем. «Все человеческое развитие и все системы в организме эволюционировали или эволюционировали вместе с нашими микробами», — сказал Крайан. «Как люди, мы в значительной степени ориентированы на человека и чувствуем, что человеческие клетки и гены имеют первостепенное значение, но микробы были первыми».
Pass the poo
Фактически влияет ли что-либо из этого на пациентов?
До определенного момента. Эта область уже привела к успехам в лечении C difficile — инфекции, которая вызывает серьезную диарею и может оказаться смертельной.Теперь пациенты могут получить фекальные трансплантаты от донора со здоровым микробиомом, чтобы «перезагрузить» их внутреннее сообщество — процедура, которая, как было доказано, позволяет быстро вылечить это состояние.
Некоторые исследователи, в том числе Крайан, считают, что исследования микробиома могут привести к разработке новых методов лечения психического здоровья. «Мы придумали термин« психобиотик »[под которым мы подразумеваем] целевое вмешательство микробиома в здоровье мозга», — сказал он.
Хотя это может быть далеко, Крайан считает, что для врачей станет обычным делом следить за составом микробиомов пациентов.«Я лично считаю, что медицина на основе бактерий или микробиомов — это будущее точной медицины», — сказал он.
Давайте перейдем к делу: что я могу сделать, чтобы поддерживать свой микробиом в хорошей форме?
Вот где появляются пребиотики и пробиотики: первые представляют собой вещества, такие как инулин клетчатки, на которых могут процветать полезные микробы, а вторые — это сами микробы, которые считаются полезными для здоровья, например, Lactobacillus и Bifidobacterium видов.
В то время как и пребиотики, и пробиотики можно принимать в качестве добавок, стоит ли вам раскошелиться на них — другой вопрос: существует мало рекомендаций о том, какие пребиотики или пробиотики следует употреблять в конкретной ситуации, а что касается пробиотиков, это не так. Мертвая уверенность в том, что микробы колонизируют ваш кишечник, когда попадут туда, или принесут пользу уже здоровым людям, например, предотвратят болезни. Тем не менее, если вы принимаете антибиотики или страдаете СРК, есть некоторые свидетельства того, что пробиотики могут быть хорошей идеей.
«Пока не ясно, лучше ли вам просто есть много йогурта и других ферментированных продуктов или принимать эти составы», — сказал Спектор, добавив, что в целом он рекомендует изменить свой рацион, чтобы получить дозу пробиотиков. , поскольку неясно, какие штаммы следует принимать людям. То же самое и с пребиотиками: «Пища более разнообразна с точки зрения клетчатки, следовательно, больше разнообразия микробов», — сказал он. «В идеале вы сочетаете пребиотик и пробиотик: что-то вроде квашеной капусты или кимчи.”
Что дальше?
В центре внимания находятся механизмы, с помощью которых микробы связаны со здоровьем человека. Среди загадок — то, как и почему разные штаммы бактерий имеют разные эффекты, в то время как исследователи также проводят исследования, чтобы изучить, как микробиом влияет на нашу реакцию на пищу и как разные диеты могут настроить микробиом. Также необходимо взять больше захватывающих результатов исследований на мышах и исследовать их на людях, предпочтительно с помощью рандомизированных контрольных испытаний.
Дополнительная литература:
Я содержу множество, Эд Йонг
Кишечник: внутренняя история самого недооцененного органа нашего тела, Джулия Эндерс
Психобиотическая революция, Скотт К. Андерсон, Джон Крайан и Тед Динан
Следуй за своим кишечником: как экосистема в кишечнике определяет ваше здоровье, настроение и многое другое, Роб Найт
Иллюстрации: Пит Гэмлен
Расширение определения того, что представляет собой человек
Прогресс месяца в геноме
Проект «Микробиом человека»: расширение определения того, что представляет собой человек.
Джой Ян гены, примерно пятая часть того числа, которое ожидали найти исследователи.Чтобы найти недостающие части, которые могли бы объяснить это несоответствие, исследователи начали искать другие источники генетического материала, которые способствуют функционированию человека. Одним из таких источников был микробиом человека.
Микробиом определяется как коллективные геномы микробов (состоящих из бактерий, бактериофагов, грибов, простейших и вирусов), которые живут внутри и на теле человека. У нас примерно в 10 раз больше микробных клеток, чем клеток человека. Итак, чтобы изучить человека как «супраорганизм», состоящий как из нечеловеческих, так и из человеческих клеток, в 2007 году Национальные институты здравоохранения (NIH) запустили проект «Микробиом человека» (HMP) как концептуальное расширение проекта «Геном человека».
Хотя на сегодняшний день PubMed включает более 200 статей по HMP, в этом месяце Консорциум HMP координировал публикацию двух крупных научных отчетов в Nature (Human Microbiota) и набора из 14 сопутствующих статей Public Library of Science (PLoS) (The Human Microbiome Project Collection), чтобы сообщить об исследованиях за последние пять лет.
Результаты, представленные в статьях Nature , являются частью более крупного когортного исследования микробиомов 300 здоровых взрослых мужчин и женщин в Соединенных Штатах в возрасте от 18 до 40 лет.Данные в этих статьях взяты из анализа 4788 клинических образцов от 242 здоровых взрослых: 129 мужчин и 113 женщин. У добровольцев мужского пола были взяты пробы в 15 точках, а у женщин — в 18 точках изо рта, носа, кожи, нижних отделов желудочно-кишечного тракта и влагалища. Примерно 200 дней спустя у 131 из этих людей снова были взяты образцы для оценки стабильности их микробиомов. Ни один из этих субъектов не принимал антибиотики или иммуномодуляторы во время исследования, и все субъекты были клинически проверены на отсутствие явных заболеваний на всех участках тела перед взятием образцов.
Первый сюрприз от этого исследования: анализ полного содержания генов и состава этих микробиомов (то есть метагенома) предсказывает, что может существовать более 8 миллионов уникальных микробных генов, связанных с микробиомами в организме этих здоровых взрослых людей. . По сравнению с общим числом генов человека это говорит о том, что генетический вклад микробиома в супраорганизм человека может быть во много сотен раз больше, чем генетический вклад генома человека.
Кроме того, несколько неожиданно, исследователи обнаружили, что у этих здоровых людей преобладали условно-патогенные микроорганизмы, которые вызывают заболевание, используя преимущества ослабленной иммунной системы. Однако никаких высоковирулентных микробов, таких как патогены категории A-C NIAID, в том числе эбола (A), сальмонелла (B) или бешенство (C), обнаружено не было. Кертис Хаттенхауэр, доктор философии из Гарвардской школы общественного здравоохранения, и его сотрудники сравнили эти патогены с генетическими признаками: генетические варианты, приводящие к слегка пагубным признакам, распространены даже среди здоровых людей, тогда как генетические варианты высокого риска очень распространены. редкий.
В соответствующем исследовании Кристин Вайли, доктор философии, Медицинский факультет Вашингтонского университета, Сент-Луис, аспирантка лаборатории Джорджа Вайнстока, доктора философии, обнаружила увеличение вирусной нагрузки, поскольку а также вирусное разнообразие у детей до 3 лет с необъяснимой лихорадкой. Поскольку антибиотики убивают только бактерии и не влияют на вирусы, понимание того, что необъяснимая лихорадка может быть вызвана вирусами, может уменьшить ненужное использование антибиотиков, сказал доктор Уайли.
Большинство микробов в микробиоме не вызывают болезней.Фактически, люди полагаются на микробы для выполнения многих важных функций, которые мы не можем выполнить сами. Микробы переваривают пищу для выработки питательных веществ для клеток-хозяев, синтезируют витамины, метаболизируют лекарства, выводят токсины из канцерогенов, стимулируют обновление клеток слизистой оболочки кишечника, активируют и поддерживают иммунную систему. Чтобы лучше понять эти взаимодействия, исследователи HMP определили не только таксономический состав, но и метаболические пути микробных сообществ, обнаруженных в этих участках тела.Это было достигнуто посредством анализа коллективных последовательностей генома микробов в этих сообществах. Фактически, применение технологий секвенирования следующего поколения, которые обеспечили достаточную глубину секвенирования, позволило провести такой анализ. HMP произвел более 3,5 терабаз (каждая тера равна тысяче гигабайт) последовательности метагенома, что на порядок больше последовательности микробиома, чем любое другое исследование такого рода в мире.
Ни один обычный микроб не присутствовал на всех участках тела или у всех людей.Возможно, это парадоксально, но исследователи обнаружили, что микробные сообщества наиболее похожи между похожими участками тела. Например, между двумя субъектами микробы на коже первого субъекта были наиболее похожи на микробы на коже второго субъекта. Что интересно, они не делают различий между мужчинами и женщинами. И даже у близнецов могут быть разные микробиомы, поэтому генетика человека не может играть важную роль в определении состава микробиома.
Метагеномный анализ также дал список метаболических путей, присутствующих в этих микробиомах.Что особенно интересно, это то, что состав микробов сильно различается у здоровых людей, но метаболические пути их микробиомов очень похожи. В микробиомах здоровых взрослых эти возможности включают в себя все общие «хозяйственные» свойства для поддержания функции клеток и другие свойства, необходимые для поддержания экосистемы участка тела.
Микробы окружающей среды могут адаптироваться к использованию новых мест обитания. Например, разлагающие углеводороды микробы часто цветут в океане после разлива нефти, хотя разлагающие нефть микробы обычно редки в океане.Это потому, что масло стимулирует рост тех микробов, которые могут разлагать масло, и поэтому они перерастают остальные микробы, которые этого не могут. Есть ли доказательства того, что микробные сообщества человека также приспосабливаются к определенным средам обитания тела? Брэнди Кантарел, доктор философии, научный сотрудник Медицинской школы Университета Мэриленда в Балтиморе, заметила, что определенный класс ферментов (CAZymes, расщепляющих сложные углеводы) очень похож на одинаковые участки тела, даже если состав этих сообществ было иначе.Это наблюдение предполагает, что сообщества микробов человека действительно приспосабливаются к совместному расщеплению определенных углеводов, присутствующих на определенных участках тела. Углеводный состав, по-видимому, стимулирует колонизацию микробами, которые обладают способностью метаболизировать эти углеводы, специфичные для конкретного участка тела.
Определение того, что составляет здоровый микробиом, важно, потому что высокое или низкое микробное разнообразие может иметь различные последствия для здоровья или болезни, в зависимости от участка тела.Например, было показано, что низкое микробное разнообразие в кишечнике связано с ожирением, воспалительными заболеваниями кишечника и болезнью Крона, тогда как высокое микробное разнообразие во влагалище часто связано с бактериальным вагинозом, наиболее распространенным типом вагинальной инфекции.
Кроме того, микробное разнообразие — не единственное свойство микробиома, которое изменяется в зависимости от состояния здоровья или болезни. Например, значительная потеря метаболических возможностей, по-видимому, происходит в микробиомах, связанных с определенными заболеваниями, такими как болезнь Крона, язвенный колит или некротический энтероколит новорожденных, разрушительное заболевание недоношенных детей.Также представляется, что нарушения метаболических возможностей микробиомов могут быть более предсказуемыми для состояния болезни, чем один только микробный состав, поскольку микробный состав может изменяться без потери метаболической функции, но как правило, наоборот. Анализ здоровых метагеномов, такой как был завершен в HMP, предоставляет справочные данные, необходимые в этой области, чтобы отличить метаболические свойства здоровых микробиомов, которые отсутствуют в нарушенных микробиомах в пораженной ткани.
Эти 16 крупных исследований, а также более 200 статей, появившихся в результате HMP, заложили основу для поддержки дальнейших исследований в этой молодой области. В первом документе HMP Nature описан широкий спектр данных, вычислительных инструментов и научных подходов, созданных в качестве ресурса сообщества для поддержки области человеческого микробиома. В публикациях HMP удалось продемонстрировать, что микробиом является основным генетическим сигналом в организме человека и вносит вклад в ключевые свойства, необходимые для функционирования человека.
Это только начало. Мы узнали, что бактерии, живущие внутри нас и на нас, не захватчики, а полезные колонизаторы. Есть надежда, что по мере продвижения исследований мы узнаем, как заботиться о наших микроскопических колонизаторах, чтобы они, в свою очередь, могли заботиться о нашем здоровье.
Размещено: 16 июля 2012 г.
Текущее понимание микробиома человека
Сендер, Р., Фукс, С. и Майло, Р. Действительно ли нас намного меньше числа? Возвращаясь к соотношению бактериальных клеток и клеток-хозяев у людей. Ячейка 164 , 337–340 (2016).
CAS
PubMed
Google ученый
Turnbaugh, P.J. et al. Проект микробиома человека. Nature 449 , 804–810 (2007).
CAS
Статья
Google ученый
Locey, K.J. И Леннон, Дж. Законы масштабирования предсказывают глобальное микробное разнообразие. Proc. Natl. Акад.Sci. США 113 , 5970–5975 (2016).
Артикул
CAS
PubMed
Google ученый
Frank, D.N. et al. Молекулярно-филогенетическая характеристика дисбаланса микробного сообщества при воспалительных заболеваниях кишечника человека. Proc. Natl. Акад. Sci. США 104 , 13780–13785 (2007).
Артикул
CAS
Google ученый
Геверс, Д.и другие. Микробиом, не получавший лечения при впервые возникшей болезни Крона. Клеточный микроб-хозяин 15 , 382–392 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ni, J. et al. Роль бактериальной уреазы в дисбактериозе кишечника и болезни Крона. Sci. Пер. Med. 9 , eaah6888 (2017).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Костич, А.D. et al. Fusobacterium nucleatum усиливает онкогенез кишечника и модулирует иммунное к опухоли микроокружение. Клеточный микроб-хозяин 14 , 207–215 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Jiang, H. et al. Измененный состав фекальной микробиоты у пациентов с большим депрессивным расстройством. Brain Behav. Иммун. 48 , 186–194 (2015).
Артикул
PubMed
Google ученый
Zheng, P. et al. Ремоделирование кишечного микробиома вызывает депрессивное поведение посредством метаболизма хозяина. Мол. Психиатрия 21 , 786–796 (2016).
Артикул
CAS
PubMed
Google ученый
Гилберт, Дж. А. и другие. Исследования ассоциаций микробиома связывают динамические микробные консорциумы с болезнью. Nature 535 , 94–103 (2016).
Артикул
CAS
PubMed
Google ученый
Punt, C.J.A., Koopman, M. и Vermeulen, L. От неоднородности опухоли до достижений в прецизионном лечении колоректального рака. Нат. Преподобный Clin. Онкол. 14 , 235–246 (2017).
Артикул
CAS
PubMed
Google ученый
Дебелиус, Дж.и другие. Крошечные микробы, огромное воздействие: что важно в исследованиях микробиома кишечника? Genome Biol. 17 , 217 (2016).
Артикул
PubMed
PubMed Central
Google ученый
Консорциум исследовательских сетей интегративного HMP (iHMP). Проект «Интегративный микробиом человека»: динамический анализ профилей микробиома-хозяина в периоды здоровья и болезни человека. Клеточный микроб-хозяин 16 , 276–289 (2014).
Lax, S. et al. Продольный анализ микробного взаимодействия между человеком и окружающей средой в помещении. Наука 345 , 1048–1052 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Goodrich, J.K. и другие. Человеческая генетика формирует микробиом кишечника. Ячейка 159 , 789–799 (2014).
CAS
PubMed
PubMed Central
Google ученый
Ридаура, В.K. et al. Микробиота кишечника близнецов, не согласных с ожирением, модулирует метаболизм у мышей. Наука 341 , 1241214 (2013).
Артикул
CAS
Google ученый
Turnbaugh, P.J. et al. Органические, генетические и транскрипционные вариации в глубоко секвенированных кишечных микробиомах однояйцевых близнецов. Proc. Natl. Акад. Sci. США 107 , 7503–7508 (2010).
Артикул
Google ученый
Тернбо, П.J. et al. Основной микробиом кишечника у тучных и худых близнецов. Nature 457 , 480–484 (2009).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Зеедорф, Х. и др. Бактерии из разных мест обитания колонизируют и конкурируют в кишечнике мышей. Cell 159 , 253–266 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Karczewski, J., Poniedziałek, B., Adamski, Z. & Rzymski, P. Влияние микробиоты на иммунную систему хозяина. Аутоиммунитет 47 , 494–504 (2014).
Артикул
CAS
PubMed
Google ученый
Schirmer, M. et al. Связь микробиома кишечника человека с производительностью воспалительных цитокинов. Ячейка 167 , 1897 (2016).
Артикул
CAS
PubMed
Google ученый
Лозупоне, К.A., Stombaugh, J.I., Gordon, J.I., Jansson, J.K. И Найт, Р. Разнообразие, стабильность и устойчивость микробиоты кишечника человека. Природа 489 , 220–230 (2012).
Артикул
CAS
PubMed
PubMed Central
Google ученый
O’Toole, P.W. Изменения кишечной микробиоты от взрослого до пожилого возраста. Clin. Microbiol. Заразить. 18 (Приложение 4), 44–46 (2012).
Артикул
PubMed
Google ученый
Koenig, J.E. et al. Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4578–4585 (2011).
Артикул
PubMed
PubMed Central
Google ученый
Weng, M. & Walker, W.A. Роль кишечной микробиоты в программировании иммунного фенотипа. J. Dev. Ориг. Health Dis. 4 , 203–214 (2013).
Артикул
CAS
PubMed
Google ученый
Maynard, C.L., Elson, C.O., Hatton, R.D. & Weaver, C.T. Взаимное взаимодействие кишечной микробиоты и иммунной системы. Природа 489 , 231–241 (2012).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Найтс, Д.и другие. Переосмысление «энтеротипов». Клеточный микроб-хозяин 16 , 433–437 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Джеффри, И.Б., Клаессон, М.Дж., О’Тул, П.В. И Шанахан, Ф. Классификация кишечной микробиоты: энтеротипы или градиенты? Нат. Rev. Microbiol. 10 , 591–592 (2012).
Артикул
CAS
Google ученый
Грайс, Э.А. и Сегре, Дж. А. Микробиом кожи. Нат. Rev. Microbiol. 9 , 244–253 (2011).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Grice, E.A. и другие. Топографическое и временное разнообразие микробиома кожи человека. Наука 324 , 1190–1192 (2009).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Капорасо, Дж.G. et al. Движущиеся картинки микробиома человека. Genome Biol. 12 , R50 (2011).
Артикул
PubMed
PubMed Central
Google ученый
Kort, R. et al. Формирование микробиоты полости рта с помощью интимных поцелуев. Микробиом 2 , 41 (2014).
Артикул
PubMed
PubMed Central
Google ученый
Лазаревич, В., Whiteson, K., Hernandez, D., François, P. & Schrenzel, J. Изучение меж- и внутрииндивидуальных вариаций микробиоты слюны. BMC Genomics 11 , 523 (2010).
Артикул
CAS
PubMed
PubMed Central
Google ученый
David, L.A. et al. Образ жизни хозяина ежедневно влияет на микробиоту человека. Genome Biol. 15 , R89 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Дэвид Л.A. et al. Диета быстро и воспроизводимо изменяет микробиом кишечника человека. Природа 505 , 559–563 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Майер Т.В. и др. Влияние диетического резистентного крахмала на микробиом кишечника человека, метапротеом и метаболом. МБио. 8 , e01343 – e17 (2017).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ханниган, Г.D. et al. Виром двухцепочечной ДНК кожи человека: топографическое и временное разнообразие, генетическое обогащение и динамические ассоциации с микробиомом хозяина. MBio 6 , e01578 – e15 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Vandeputte, D. et al. Количественное профилирование микробиома связывает изменчивость кишечного сообщества с микробной нагрузкой. Nature 551 , 507–511 (2017).
Артикул
CAS
PubMed
Google ученый
Vandeputte, D. et al. Консистенция стула тесно связана с богатством и составом кишечной микробиоты, энтеротипами и скоростью роста бактерий. Кишечник 65 , 57–62 (2016).
Артикул
CAS
Google ученый
Ма, Б., Форни, Л.Дж. и Равель, Дж. Микробиом влагалища: переосмысление здоровья и болезней. Annu. Rev. Microbiol. 66 , 371–389 (2012).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ravel, J. et al. Суточная временная динамика микробиоты влагалища до, во время и после эпизодов бактериального вагиноза. Микробиом 1 , 29 (2013).
Артикул
PubMed
PubMed Central
Google ученый
Ромеро, Р.и другие. Состав и стабильность микробиоты влагалища здоровых беременных женщин отличаются от микробиоты небеременных женщин. Микробиом 2 , 4 (2014).
Артикул
PubMed
PubMed Central
Google ученый
Xiao, B. et al. Прогностическая ценность состава влагалищной микробиоты при бактериальном вагинозе, динамическое исследование для выявления флоры, связанной с рецидивами. Sci. Отчетность 6 , 26674 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Albenberg, L.G. И Ву, Г.Д. Диета и микробиом кишечника: ассоциации, функции и значение для здоровья и болезней. Гастроэнтерология 146 , 1564–1572 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ву, Г.D. et al. Связь долгосрочных диетических моделей с кишечными микробными энтеротипами. Наука 334 , 105–108 (2011).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Zeevi, D. et al. Персонализированное питание путем прогнозирования гликемических реакций. Ячейка 163 , 1079–1094 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Чжан, К.и другие. Диетическое изменение микробиоты кишечника способствует облегчению как генетического, так и простого ожирения у детей. EBioMedicine 2 , 968–984 (2015).
Артикул
PubMed
PubMed Central
Google ученый
Моди, С.Р., Коллинз, Дж. Дж. И Рельман, Д.А. Антибиотики и микробиота кишечника. J. Clin. Инвестировать. 124 , 4212–4218 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Детлефсен, Л.И Рельман, Д.А. Неполное восстановление и индивидуальные ответы микробиоты дистальных отделов кишечника человека на повторяющееся воздействие антибиотиков. Proc. Natl. Акад. Sci. США 108 (Приложение 1), 4554–4561 (2011).
Артикул
PubMed
Google ученый
Морис, К.Ф., Хайзер, Х.Дж. и Тернбо, П.Дж. Ксенобиотики формируют физиологию и экспрессию генов активного микробиома кишечника человека. Cell 152 , 39–50 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Trasande, L. et al. Воздействие антибиотиков на младенцев и масса тела в раннем возрасте. Внутр. J. Obes. (Лондон). 37 , 16–23 (2013).
Артикул
CAS
Google ученый
Сонг, С.Дж. и другие. Сожительствующие члены семьи разделяют микробиоту друг с другом и со своими собаками. eLife 2 , e00458 (2013).
Артикул
PubMed
PubMed Central
Google ученый
фон Мутиус, Э. Микробная среда и ее влияние на профилактику астмы в раннем возрасте. J. Allergy Clin. Иммунол. 137 , 680–689 (2016).
Артикул
PubMed
Google ученый
Штейн, М. и другие.Врожденный иммунитет и риск астмы у детей амишей и гуттеритов, проживающих на фермах. N. Engl. J. Med. 375 , 411–421 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Cook, M.D. et al. Физические упражнения и иммунная функция кишечника: свидетельства изменений гомеостаза иммунных клеток толстой кишки и характеристик микробиома при тренировках. Immunol. Cell Biol. 94 , 158–163 (2016).
Артикул
CAS
PubMed
Google ученый
Benedict, C. et al. Микробиота кишечника и глюкометаболические изменения в ответ на периодическое частичное лишение сна у молодых людей с нормальным весом. Мол. Метаб. 5 , 1175–1186 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Карл Дж.P. et al. Изменения в составе и метаболизме кишечной микробиоты совпадают с повышенной проницаемостью кишечника у молодых людей при длительном физиологическом стрессе. Am. J. Physiol. Гастроинтест. Liver Physiol. 312 , G559 – G571 (2017).
Артикул
PubMed
Google ученый
Ying, S. et al. Влияние возраста и пола на микробные сообщества, связанные с кожей, в городских и сельских популяциях людей. PLoS One 10 , e0141842 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Zheng, W. et al. Метагеномное секвенирование выявляет измененные метаболические пути в микробиоте полости рта моряков во время длительного морского путешествия. Sci. Отчетность 5 , 9131 (2015).
Артикул
PubMed
PubMed Central
Google ученый
Зозая, М.и другие. Бактериальные сообщества в коже полового члена, мужской уретре и влагалище гетеросексуальных пар с бактериальным вагинозом и без него. Микробиом 4 , 16 (2016).
Артикул
PubMed
PubMed Central
Google ученый
Fei, N. & Zhao, L. Условно-патогенный микроорганизм, выделенный из кишечника человека с ожирением, вызывает ожирение у стерильных мышей. ISME J. 7 , 880–884 (2013).
Артикул
CAS
PubMed
Google ученый
Leone, V. et al. Влияние суточных колебаний кишечных микробов и питания с высоким содержанием жиров на функцию циркадных часов и метаболизм. Клеточный микроб-хозяин 17 , 681–689 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Knight, R. et al. Раскрытие потенциала метагеномики посредством воспроизводимого экспериментального дизайна. Нат. Biotechnol. 30 , 513–520 (2012).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Fierer, N. et al. Судебно-медицинская идентификация с использованием бактериальных сообществ кожи. Proc. Natl. Акад. Sci. США 107 , 6477–6481 (2010).
Артикул
PubMed
Google ученый
Флорес, Г.E. et al. Временная изменчивость — это индивидуальная особенность микробиома человека. Genome Biol. 15 , 531 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Gajer, P. et al. Временная динамика микробиоты влагалища человека. Sci. Пер. Med. 4 , 132ra52 (2012).
Артикул
PubMed
PubMed Central
Google ученый
Ливанос, А.E. et al. Опосредованное антибиотиками нарушение микробиома кишечника ускоряет развитие диабета 1 типа у мышей. Нат. Microbiol. 1 , 16140 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Sugihara, G. et al. Обнаружение причинно-следственной связи в сложных экосистемах. Наука 338 , 496–500 (2012).
Артикул
CAS
PubMed
Google ученый
Найтс, Д.и другие. Байесовское отслеживание источников микробов в масштабах всего сообщества, не зависящее от культуры. Нат. Методы 8 , 761–763 (2011).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Ларсен П.Э., Филд Д. и Гилберт Дж. А. Прогнозирование сообществ бактериальных сообществ с использованием подхода искусственной нейронной сети. Нат. Методы 9 , 621–625 (2012).
Артикул
CAS
PubMed
Google ученый
Ларсен П.E. & Dai, Y. Метаболом кишечного микробиома человека является прогностическим признаком дисбактериоза хозяина. Gigascience 4 , 42 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Браун, Х.П. и другие. Культивирование «некультивируемой» микробиоты человека обнаруживает новые таксоны и обширное спороношение. Природа 533 , 543–546 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Гева-Заторский, Н.и другие. Изучение микробиоты кишечника человека на наличие иммуномодулирующих организмов. Ячейка 168 , 928–943. e11 (2017).
Артикул
CAS
PubMed
Google ученый
Vatanen, T. et al. Вариабельность иммуногенности ЛПС микробиома способствует развитию аутоиммунитета у людей. Ячейка 165 , 842–853 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Сиван, А.и другие. Commensal Bifidobacterium способствует противоопухолевому иммунитету и повышает эффективность анти-PD-L1. Наука 350 , 1084–1089 (2015).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Дубин К. и др. Анализы кишечного микробиома выявляют пациентов с меланомой, подверженных риску колита, вызванного блокадой контрольных точек. Нат. Commun. 7 , 10391 (2016).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Mueller, N.T. и другие. Снижают ли или усиливают ли вагинальные роды связь между избыточным весом и ожирением, передаваемую из поколения в поколение? Выводы Бостонской когорты рождения. Внутр. J. Obes. (Лондон). 41 , 497–501 (2017).
Артикул
CAS
Google ученый
Раве-Садка, Т.и другие. Кишечные бактерии редко являются общими для госпитализированных недоношенных детей, независимо от развития некротического энтероколита. eLife 4 , 4 (2015).
Артикул
CAS
Google ученый
Zhang, X. et al. Микробиомы полости рта и кишечника нарушаются при ревматоидном артрите и частично нормализуются после лечения. Нат. Med. 21 , 895–905 (2015).
Артикул
CAS
Google ученый
Sinha, R.и другие. Оценка вариации в последовательности ампликонов микробного сообщества консорциумом проекта Microbiome Quality Control (MBQC). Нат. Biotechnol. 35 , 1077–1086 (2017).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Costea, P.I. и другие. К стандартам обработки образцов фекалий человека в метагеномных исследованиях. Нат. Biotechnol. 35 , 1069–1076 (2017).
Артикул
CAS
PubMed
Google ученый
Alivisatos, A.P. et al. МИКРОБИОМ. Единая инициатива по использованию микробиомов Земли. Наука 350 , 507–508 (2015).
Артикул
CAS
PubMed
Google ученый
Biteen, J.S. и другие. Инструменты для микробиома: нано и другие. САУ Нано 10 , 6–37 (2016).
Артикул
CAS
PubMed
Google ученый
Лаки, Т.Д. Введение в микроэкологию кишечника. Am. J. Clin. Nutr. 25 , 1292–1294 (1972).
Артикул
CAS
PubMed
Google ученый
Rosner, J.L. У человека в десять раз больше микробных клеток, чем клеток тела? Микроб 9 , 47 (2014).
Google ученый
Reyes, A. et al. Вирусы фекальной микробиоты однояйцевых близнецов и их матерей. Nature 466 , 334–338 (2010).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Qin, J. et al. Каталог микробных генов кишечника человека, созданный путем метагеномного секвенирования. Nature 464 , 59–65 (2010).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Weingarden, A. et al. Динамические изменения в краткосрочном и долгосрочном бактериальном составе после трансплантации фекальной микробиоты для рецидивирующей инфекции Clostridium difficile . Микробиом 3 , 10 (2015).
Артикул
PubMed
PubMed Central
Google ученый
Кассам, З., Ли, К.Х., Юань, Ю. и Хант, Р.Х. Трансплантация фекальной микробиоты для инфекции, вызванной Clostridium difficile : систематический обзор и метаанализ. Am. J. Gastroenterol. 108 , 500–508 (2013).
Артикул
PubMed
Google ученый
Knights, D., Parfrey, L.W., Zaneveld, J., Lozupone, C. & Knight, R. Связанные с человеком микробные сигнатуры: изучение их прогностической ценности. Клеточный микроб-хозяин 10 , 292–296 (2011).
Артикул
CAS
PubMed
Google ученый
Walters, W.A., Xu, Z. & Knight, R. Мета-анализ кишечных микробов человека, связанных с ожирением и ВЗК. FEBS Lett. 588 , 4223–4233 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Sze, M.A. & Schloss, P.D. Ищем сигнал в шуме: возвращаемся к ожирению и микробиому. MBio 7 (2016).
Сахин М. и Сур М. Гены, схемы и прецизионные методы лечения аутизма и связанных с ним нарушений психического развития. Наука 350 , aab3897 (2015).
Артикул
CAS
PubMed
Google ученый
McDonald, D. et al. К сравнительным исследованиям большой когорты для определения факторов, влияющих на структуру микробного сообщества кишечника пациентов с РАС. Microb. Ecol. Health Dis. 26 , 26555 (2015).
PubMed
Google ученый
Kang, D.-W. и другие. Снижение встречаемости Prevotella и других ферментеров в микрофлоре кишечника аутичных детей. PLoS One 8 , e68322 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Сяо, Э.Y. et al. Микробиота модулирует поведенческие и физиологические аномалии, связанные с нарушениями развития нервной системы. Ячейка 155 , 1451–1463 (2013).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Kang, D.-W. и другие. Терапия с переносом микробиоты изменяет экосистему кишечника и улучшает симптомы желудочно-кишечного тракта и аутизма: открытое исследование. Микробиом 5 , 10 (2017).
Артикул
PubMed
PubMed Central
Google ученый
Снайдерс, А.М. и другие. Влияние воздействия в раннем возрасте, генетики хозяина и диеты на микробиом и метаболом кишечника мышей. Нат. Microbiol. 2 , 16221 (2016).
Артикул
CAS
PubMed
Google ученый
Knights, D. et al. Сложная генетика хозяина влияет на микробиом при воспалительном заболевании кишечника. Genome Med. 6 , 107 (2014).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Halfvarson, J. et al. Динамика микробиома кишечника человека при воспалительном заболевании кишечника. Нат. Microbiol. 2 , 17004 (2017).
Артикул
CAS
PubMed
PubMed Central
Google ученый
Uusitalo, U.и другие. Связь раннего воздействия пробиотиков и островкового аутоиммунитета в исследовании TEDDY. JAMA Pediatr. 170 , 20–28 (2016).
Артикул
PubMed
PubMed Central
Google ученый
Блазер, М.Дж. Теория исчезновения микробиоты и эпидемий хронических заболеваний. Нат. Rev. Immunol. 17 , 461–463 (2017).
Артикул
CAS
PubMed
Google ученый
Арриета, М.


