1.3. Биологическая роль белка и его важнейшие источники
1.3. Биологическая роль белка и его важнейшие источники
Белки – жизненно необходимые и незаменимые вещества, без которых невозможны не только рост и развитие организма, но и сама жизнь. Они являются основным пластическим материалом для построения всех клеток, тканей и органов тела человека, образования ферментов, гормонов и других соединений, выполняющих в организме особо важные и сложные функции.
Белки составляют 54 % массы тела человека. Все ферменты, участвующие в превращениях и усвоении белков и других пищевых веществ, имеют белковую природу, поэтому при недостатке белка в пище снижается ферментативная активность организма и развиваются нарушения как в переваривании, так и в обмене всех веществ – белков, жиров и углеводов. При дефиците белка нарушается образование гормонов и, как следствие, работа сердечно-сосудистой системы, опорно-двигательного аппарата, мочеполовой и других систем организма.
Кроме того, белок в организме играет большую защитную роль. Из особого белка глобулина формируются антитела – вещества, определяющие защитные силы организма, невосприимчивость человека к инфекциям. Белки обезвреживают попавшие в организм человека яды и токсины, выполняют антитоксическую роль. Достаточное количество белка в пище повышает устойчивость к стрессам, которые могут быть причиной многих заболеваний. Помимо перечисленных, белок выполняет много других функций: обеспечение процессов свертывания крови, перенос кислорода с кровью, мышечное сокращение, передача наследственных признаков, транспорт различных веществ в организме, образование макроэргических соединений (АТФ) и т. д.
Из особого белка глобулина формируются антитела – вещества, определяющие защитные силы организма, невосприимчивость человека к инфекциям. Белки обезвреживают попавшие в организм человека яды и токсины, выполняют антитоксическую роль. Достаточное количество белка в пище повышает устойчивость к стрессам, которые могут быть причиной многих заболеваний. Помимо перечисленных, белок выполняет много других функций: обеспечение процессов свертывания крови, перенос кислорода с кровью, мышечное сокращение, передача наследственных признаков, транспорт различных веществ в организме, образование макроэргических соединений (АТФ) и т. д.
Как источник энергии, белки имеют второстепенное значение, так как могут быть заменены жирами и углеводами. При окислении в организме 1 г белка дает 4 ккал (16,7 кДж). Именно многообразие свойств белка, его участие в основных жизненных процессах подтверждают, что белок является основой жизни. Этот факт отмечали еще древние греки: другое название белков – протеины (от слова «протос», что означает «главный, единственный»).
Для того чтобы обеспечить все важнейшие жизненные процессы, необходимо достаточное поступление белка в организм. При этом белок, в отличие, например, от жиров и углеводов, не может синтезироваться в организме, не заменяется другими пищевыми веществами, не накапливается про запас. В то же время он частично расходуется на образование жира и углеводов при их дефиците в пищевом рационе. Единственным источником белков служит пища, поэтому белки пищи являются абсолютно необходимой составной частью рациона человека.
Белки пищи – сложные органические соединения, состоящие из большого количества аминокислот (более 20). Не все аминокислоты равноценны по своему значению для организма. Они делятся на заменимые и незаменимые (или жизненно необходимые). Заменимые аминокислоты названы так потому, что они могут синтезироваться в организме из других, незаменимые – в организме не синтезируются и обязательно должны содержаться в пище в достаточном количестве. Незаменимые аминокислоты (валин, метионин, лейцин, триптофан, лизин и др.) содержатся в наибольшем количестве и наилучших соотношениях в белках животного происхождения (яйца, молоко, мясо, рыба и т. д.), то есть в белках высокой биологической ценности, отличающихся сбалансированностью аминокислот, легкой перевариваемостью и хорошей усвояемостью. Заменимые аминокислоты содержатся преимущественно в белке растительных продуктов (хлеб, крупа, бобовые), и в случае дефицита этих продуктов в рационе на синтез незаменимых аминокислот в организме расходуются заменимые аминокислоты.
Незаменимые аминокислоты (валин, метионин, лейцин, триптофан, лизин и др.) содержатся в наибольшем количестве и наилучших соотношениях в белках животного происхождения (яйца, молоко, мясо, рыба и т. д.), то есть в белках высокой биологической ценности, отличающихся сбалансированностью аминокислот, легкой перевариваемостью и хорошей усвояемостью. Заменимые аминокислоты содержатся преимущественно в белке растительных продуктов (хлеб, крупа, бобовые), и в случае дефицита этих продуктов в рационе на синтез незаменимых аминокислот в организме расходуются заменимые аминокислоты.
Чтобы обеспечить организм достаточным количеством незаменимых и заменимых аминокислот, в состав пищевого рациона должны входить как более полноценные (животные) белки, содержащие все незаменимые аминокислоты, так и менее полноценные (растительные). Наиболее благоприятно соотношение животного и растительного белка в рационе 1:1.
Чтобы избежать дефицита тех или других аминокислот, рекомендуется сочетать в каждом приеме пищи менее ценные растительные белки (хлеб, крупы, бобовые) с белками животного происхождения (молоко, творог, сыр, мясо, рыба, яйца) – это могут быть каши на молоке, хлеб с молоком, мучные изделия с творогом, вареники, мучные изделия с мясом, котлеты с макаронами и т. п. В то же время сочетание круп и злаковых продуктов с капустой, картофелем менее оправданно, так как не улучшает аминокислотного состава рациона. Важен тот факт, что при правильном сочетании растительного и животного белка улучшается усвоение растительных белков, из которых в кишечнике всасывается 60-80 % аминокислот, тогда как из белков животных продуктов – более 90 %.
п. В то же время сочетание круп и злаковых продуктов с капустой, картофелем менее оправданно, так как не улучшает аминокислотного состава рациона. Важен тот факт, что при правильном сочетании растительного и животного белка улучшается усвоение растительных белков, из которых в кишечнике всасывается 60-80 % аминокислот, тогда как из белков животных продуктов – более 90 %.
Наиболее быстро перевариваются белки молочных продуктов и рыбы, затем мяса (белки говядины быстрее, чем свинины и баранины), хлеба и круп (быстрее – белки пшеничного хлеба из муки высших сортов и манной крупы). Нарушают переваривание белка некоторые содержащиеся в горохе, фасоли, сое вещества, которые снижают переваривающую активность пищеварительных ферментов. Тепловая обработка, длительное разваривание, измельчение, протирание улучшают переваривание белков.
Потребность человека в пищевом белке может изменяться в зависимости от пола, возраста, уровня физической активности, интенсивности труда, при некоторых заболеваниях.
В среднем потребность взрослого человека в белке составляет 80-100 г в сутки, или 1,1-1,3 г белка на 1 кг массы тела, что обеспечивает 10-15 % энергетических потребностей организма за счет белка. Потребность растущего организма в белке выше и зависит от возраста. Если на первом году жизни ребенок должен получать более 4 г белка на 1 кг массы тела, то в последующие годы потребность в белке снижается. Так, потребность в белке для девушек составляет в среднем 90 г, для юношей – 100 г в сутки.
Высокая потребность в белке у детей и подростков объясняется тем, что в растущем организме преобладают синтетические процессы и белок пищи необходим не только для поддержания азотистого равновесия, но и для обеспечения роста, увеличения массы тела, формирования скелета и мускулатуры. Количество белков животного происхождения, содержащих незаменимые аминокислоты, которые особенно необходимы для растущего организма, должно составлять не менее 60 % от общего количества белка в рационе.
Химический состав продуктов, используемых в качестве основных источников белка, представлен в таблице 1.
emp1
Таблица 1
Химический состав продуктов, используемых в качестве основных источников белка (в 100 г продукта), и их энергетическая ценность[1]
Необходимо отметить, что однообразное питание, состоящее преимущественно из растительных белков или только из белков животного происхождения, значительно ухудшает усвоение и использование белка в организме. Важны не только общее количество и качество белка в суточном рационе, но и обязательно разнообразие пищи, ежедневное употребление таких источников белка, как молоко, рыба, крупы, зерновые продукты, яйца, мясо.
Белковая недостаточность возникает от резкого уменьшения белков в пище при полном или частичном голодании, систематическом поступлении в организм белков низкой биологической ценности, длительном ограничении приема пищи (у алкоголиков, наркоманов, при болезнях желудочно-кишечного тракта), ведущих к недостаточному перевариванию и всасыванию пищевых белков, потере белков и нарушению их синтеза в организме при различных болезнях (активный туберкулез, заболевания органов пищеварения, инфекции и др. ). Белковая недостаточность ведет к ухудшению функций пищеварительной, эндокринной, кроветворной и других систем организма, атрофии мышц. Снижается работоспособность, сопротивляемость к инфекциям, замедляется выздоровление при различных заболеваниях. Избыточное поступление пищевых белков также сказывается на организме. Оно ведет к перегрузке печени и почек продуктами распада белка, перенапряжению секреторной функции пищеварительного аппарата, накоплению в организме продуктов азотистого обмена и др.
). Белковая недостаточность ведет к ухудшению функций пищеварительной, эндокринной, кроветворной и других систем организма, атрофии мышц. Снижается работоспособность, сопротивляемость к инфекциям, замедляется выздоровление при различных заболеваниях. Избыточное поступление пищевых белков также сказывается на организме. Оно ведет к перегрузке печени и почек продуктами распада белка, перенапряжению секреторной функции пищеварительного аппарата, накоплению в организме продуктов азотистого обмена и др.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Ученые узнали, как организм защищается от появления мутаций в генах — Газета.Ru
Российские биологи выяснили, что стресс вызывает появление многочисленных мутаций при синтезе РНК, и описали предотвращающий их механизм. В будущем это может пролить свет на природу некоторых наследственных заболеваний, в том числе врожденных деформаций костей. Исследование проходило в рамках проекта, поддержанного грантом Президентской программы исследовательских проектов Российского научного фонда, а его результаты опубликованы в журнале Nucleic Acids Research.
В будущем это может пролить свет на природу некоторых наследственных заболеваний, в том числе врожденных деформаций костей. Исследование проходило в рамках проекта, поддержанного грантом Президентской программы исследовательских проектов Российского научного фонда, а его результаты опубликованы в журнале Nucleic Acids Research.
Наша наследственная информация хранится в виде генов, продукты которых – белки – управляют всеми процессами в организме. Чтобы реализовать программу, организму нужно считать информацию с ДНК и переписать ее в форму РНК. Этот процесс называется транскрипцией. На матрице РНК происходит синтез белка (трансляция), который осуществляют особые молекулярные машины – рибосомы. Они состоят из белка и РНК, зашифрованной в рибосомных генах, считающихся самыми активно-транскрибируемыми – их транскрипция наиболее эффективна.
В ходе работы сотрудники Института биологии гена РАН и Московского государственного университета имени М. В. Ломоносова изучили, как стресс влияет на процесс считывания рибосомных генов. Для этого они подвергали культуры раковых и нормальных клеток человека несильному гипотоническому стрессу, при котором объем клетки увеличивается в результате поступления воды внутрь.
Для этого они подвергали культуры раковых и нормальных клеток человека несильному гипотоническому стрессу, при котором объем клетки увеличивается в результате поступления воды внутрь.
«Мы выяснили, что при гипотоническом стрессе в участках активно-транскрибирующихся рибосомных генов формируются аномальные структуры – «R-петли»», – рассказал один из авторов статьи Омар Кантидзе, руководитель проекта, доктор биологических наук, заведующий лабораторией стабильности генома Института биологии гена РАН.
R-петли появляются, в частности, из-за нарушения нормального процесса транскрипции и представляют собой гибриды ДНК и РНК. Когда клетки подвергаются стрессу, вероятность возникновения таких ошибок повышается. R-петли очень опасны, потому что часто вызывают разрывы в ДНК и провоцируют тем самым геномную нестабильность. Тогда в организме возникает много мутаций, которые могут привести к разным заболеваниям, в том числе онкологическим.
Кроме того, авторы нашли механизм защиты от формирования этих структур и описали его. В условиях гипотонического шока белок-«доктор» TopBP1 распознает R-петли и активирует специальный фермент, который подавляет транскрипцию рибосомных генов. В результате мутации перестают накапливаться в клетке. Также ученые предположили, что своеобразной платформой для сборки белка-«доктора» и выработки фермента служит белок Treacle, без которого этот защитный механизм просто не работает. Исследователи отмечают, что мутации в этом белке вызывают синдром Тричера — Коллинза – врожденную черепно-лицевую деформацию. Он встречается у одного из 50 000 младенцев и характеризуется эффектом «затонувшего» лица: крупный нос, маленькие губы и подбородок, в отдельных случаях – волчья пасть. У некоторых пациентов нет слуха, так как структура уха тоже деформируется.
В условиях гипотонического шока белок-«доктор» TopBP1 распознает R-петли и активирует специальный фермент, который подавляет транскрипцию рибосомных генов. В результате мутации перестают накапливаться в клетке. Также ученые предположили, что своеобразной платформой для сборки белка-«доктора» и выработки фермента служит белок Treacle, без которого этот защитный механизм просто не работает. Исследователи отмечают, что мутации в этом белке вызывают синдром Тричера — Коллинза – врожденную черепно-лицевую деформацию. Он встречается у одного из 50 000 младенцев и характеризуется эффектом «затонувшего» лица: крупный нос, маленькие губы и подбородок, в отдельных случаях – волчья пасть. У некоторых пациентов нет слуха, так как структура уха тоже деформируется.
«Мы впервые описали механизм подавления транскрипции рибосомных генов при стрессе. Результаты работы расширяют наше понимание функциональной значимости белка Treacle и его роли в клеточном ответе на неблагоприятные факторы. Мы надеемся, что изучение этих молекулярных механизмов поможет в понимании природы, а возможно, и в лечении синдрома Тричера — Коллинза», – заключил один из авторов статьи Артем Величко, старший научный сотрудник лаборатории стабильности генома Института биологии гена РАН.
Открыт белок, способный очистить клетки человека от «спящего» ВИЧ — Наука
ТАСС, 4 февраля. Биологи из США выяснили, что один из белков врожденной иммунной системы CARD8 способен распознавать следы присутствия одного из ключевых белков ВИЧ внутри клеток и оповещать об этом остальной организм. Это позволяет использовать его для очистки тела от «спящего» ВИЧ, сообщила в четверг пресс-служба Университета Вашингтона в Сент-Луисе (WUSTL) со ссылкой на статью в журнале Science.
«Обнаружение белка CARD8 открыло возможность использования его для уничтожения всех «спящих» копий ВИЧ в организме пациента вне зависимости от того, насколько сильно мутировал вирус, атакуя ту его часть, которая является одинаковой для всех его версий. Подобная терапия радикально улучшит жизнь даже тех пациентов, в чьем организме ВИЧ остается подавленным благодаря антиретровирусной терапии», — заявил Шань Лян, доцент WUSTL, чьи слова приводит пресс-служба вуза.
ВИЧ проникает в иммунные клетки человека, используя белки, которыми покрыта его оболочка. Структура этих молекул, а также связанных с ними нитей сахаров быстро меняется по мере размножения вируса, что вынуждает иммунитет постоянно вырабатывать новые наборы антител. В конечном итоге в этой гонке почти всегда побеждает вирус, если пациент не принимает антиретровирусных лекарств.
Структура этих молекул, а также связанных с ними нитей сахаров быстро меняется по мере размножения вируса, что вынуждает иммунитет постоянно вырабатывать новые наборы антител. В конечном итоге в этой гонке почти всегда побеждает вирус, если пациент не принимает антиретровирусных лекарств.
В свою очередь их прием ведет к тому, что вирус переходит в своеобразную спячку, не формирует новых вирусных частиц и не проявляет себя в жизни клетки. Это позволяет ему избегать внимания иммунитета и быстро восстанавливать прежние масштабы инфекции после того, как прием лекарств прекращается. Ученые уже два десятилетия пытаются создать способы уничтожения всех следов «спящего» вируса или зараженных им клеток, но пока существенных успехов достичь не удалось.
Шань Лян и его коллеги сделали большой шаг к решению этой задачи, изучая реакцию врожденной иммунной системы клеток на проникновение и размножение частиц ВИЧ внутри них.
Помощь врожденного иммунитета
В частности, их интересовало то, взаимодействуют ли какие-то белки или молекулы РНК, производимые клеткой, с различными компонентами вирусных частиц, из которых собираются новые копии ВИЧ во время активной фазы инфекции. Подобным образом клетки защищают организм от дальнейшего распространения бактериальных инфекций, начиная вырабатывать сигналы опасности при появлении токсинов микробов внутри них, что привлекает внимание иммунитета.
Подобным образом клетки защищают организм от дальнейшего распространения бактериальных инфекций, начиная вырабатывать сигналы опасности при появлении токсинов микробов внутри них, что привлекает внимание иммунитета.
Оказалось, что подобную роль в случае с вирусом иммунодефицита может исполнять белок CARD8, распознающий молекулы ВИЧ-протеазы — белка, играющего ключевую роль в сборке новых вирусных частиц. Этот фермент разрезает на части заготовки белков вируса, из которых формируются его оболочка, и его вывод из строя лишает ВИЧ способности заражать другие клетки.
Как обнаружили Шань Лян и его коллеги, CARD8 похож по устройству на некоторые компоненты вируса, что заставляет ВИЧ-протеазу захватывать и разрезать его. Это запускает цепочку реакций, которая одновременно заставляет клетку самоуничтожиться и выработать большое количество сигнальных молекул, привлекающих внимание иммунных телец, специализирующихся на уничтожении зараженных клеток.
Проблема заключается в том, что для этого необходимо вывести вирус из «спящего режима», так как в противном случае ВИЧ-протеаза находится в неактивной форме и не взаимодействует с CARD8.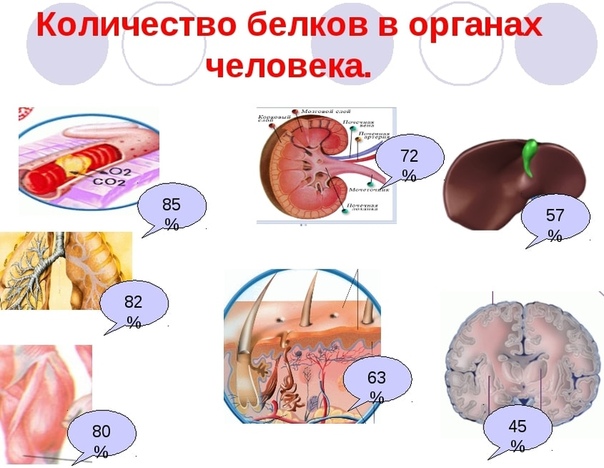 Этого, как выяснили ученые, можно добиться, если обработать зараженные клетки большими дозами эфавиренца, одного из первых лекарств от ВИЧ, которое сейчас почти не применяется в клинической практике.
Этого, как выяснили ученые, можно добиться, если обработать зараженные клетки большими дозами эфавиренца, одного из первых лекарств от ВИЧ, которое сейчас почти не применяется в клинической практике.
«Мы намерены найти или создать вещества, которые бы еще лучше справлялись с этой задачей, чем эфавиренц или другие препараты, блокирующие работу обратной транскриптазы ВИЧ. Данные, которые мы собрали в рамках этого исследования, помогут нам создать препараты, способные полностью очистить организм больных от вируса», — подытожил Шань Лян.
Роль белков в жизнедеятельности организма
Редко можно встретить человека, не слыхавшего о белках. О них упоминается почти во всех работах по питанию, о них же в своих выступлениях говорят диетологи – и медики, и натуропаты.
С точки зрения химика, белки – одни из самых сложных компонентов в пище. Значение их чрезвычайно велико, недаром Ф. Энгельс определил нашу биологическую жизнь как «способ существования белковых тел». В клетках человека их содержится в среднем около 20% от общей массы.
В клетках человека их содержится в среднем около 20% от общей массы.
Одна из важнейших функций белков – строительная. Все органоиды клетки, мембраны и внеклеточные структуры в своей основе имеют белок. Нет белка – нет и органической жизни на Земле. (По крайней мере в том виде, в каком мы привыкли воспринимать жизнь.)
Белки выполняют и роль катализаторов (ферментов, или энзимов). Почти все химические превращения в живой природе протекают с участием ферментов. Причем каталитическая активность белков весьма специфична. Практически для каждой (!) реакции существуют свои ферменты. Без них реакции идти просто не могут, ведь энзимы ускоряют процессы в десятки и сотни миллионов раз.
Еще одна функция белков – транспортировка необходимых соединений или химических элементов. Гемоглобин, например, переносит кислород, доставляя его в самые удаленные уголки тела, он же транспортирует углекислый газ.
Двигаемся мы также благодаря белкам. Все движения, на которые способны живые организмы – от поворота листьев растений и биения жгутиков простейших до перемещений животных, – все без исключения производятся за счет специального сократительного белка.
Белки выполняют и защитную функцию. При попадании в организм чужих белков или клеток вырабатываются особые белки – антитела, которые связывают и обеззараживают чужеродные вещества.
И наконец, белки могут служить источником энергии. Но это самое невыгодное «топливо».
Все белки построены из более-менее простых составляющих – аминокислот. Каждая из них наряду с углеродом, водородом и кислородом, входящими в органические соединения, обязательно содержит азот.
Известно около 80 природных аминокислот, но в обычной пище встречаются лишь 22 из них. Из этих элементарных «кирпичиков», стыкуемых в различном порядке, состоит все огромное многообразие белковых молекул. По оценкам ученых, в природе насчитывается около 10 10 –10 12 различных видов белков.
Помимо природных, существуют и синтетические аминокислоты. Из такой искусственной аминокислоты состоит, например, капрон, из которого делают и автомобильные покрышки, и одежду (ходить в которой йоги не советуют).
В природе же аминокислоты производятся живыми организмами. Считается, что 12 аминокислот может синтезировать и человек, поэтому они называются заменимыми. Остальные 10 аминокислот в обычных условиях человеческий организм не производит. Их называют незаменимыми.
Понятно, что незаменимые аминокислоты должны поступать с пищей. В зависимости от их наличия все белки даже подразделяют на «полноценные» (в которых эти аминокислоты присутствуют) и «неполноценные» (где их нет). Однако на практике об этом можно особо не задумываться. При более-менее разнообразном меню мы почти всегда получаем достаточное количество различных аминокислот, к тому же существует кишечная микрофлора, поставляющая массу необходимых соединений, плюс ко всему сам организм в экстремальных условиях или после соответствующей тренировки начинает их синтезировать. Потому-то сам факт «незаменимости» аминокислот некоторые ученые ставят под сомнение.
Серьезные нарушения, вызванные неправильным обменом какой-либо аминокислоты, обычно встречаются только в результате некоторых заболеваний или при злоупотреблении лекарствами, а также при вынужденном недоедании или вынужденном однообразном питании.
Белки содержатся практически во всех натуральных продуктах. При переваривании белки расщепляются на аминокислоты, которые либо используются организмом для синтеза собственных белков, либо окисляются, то есть сжигаются как топливо. При окислении в числе прочих веществ образуется мочевая кислота, которая поступает в кровь и, по идее, должна выводиться почками. Если же организм ослаблен, а мочевой кислоты много (и то и другое – обычный результат злоупотребления мясным), она откладывается в тканях, вызывая подагру.
Часто говорят о «норме потребления» белков. Действительно, в каждый период жизни организм, несомненно, нуждается в каком-то определенном их количестве. Но эти потребности зависят от возраста, наследственности, темперамента, нагрузок, климата и множества других причин. Поэтому понятие «норма» здесь совершенно неприменимо.
В раннем детстве, когда потребность в белках наибольшая (за первый год жизни вес тела утраивается), все необходимые вещества ребенок получает с материнским молоком. Нельзя не признать, что это идеальный продукт, отлично обеспечивающий столь интенсивный рост. Между тем на долю белков в грудном молоке приходится лишь 7,4% его общей калорийности.
Нельзя не признать, что это идеальный продукт, отлично обеспечивающий столь интенсивный рост. Между тем на долю белков в грудном молоке приходится лишь 7,4% его общей калорийности.
С возрастом, естественно, потребность в белках снижается. Ткани наращиваются все медленнее и медленнее, и к моменту зрелости на первый план выдвигается уже не строительная функция пищи, а энергетическая. Главным для организма становится компенсация текущих энергозатрат. Еще более отчетливо это проявляется у взрослых, а тем более у пожилых людей.
Следовательно, доля белка в общей калорийности рациона должна снижаться. Но рассмотрим любопытную таблицу, приводимую Бирхер-Беннером, в которой он демонстрирует распределение калорийности пищи по питательным веществам.
|
Калории
белка, %
|
Калории
жира, %
|
Калории
углеводов, %
|
|
|
В материнском молоке
|
7,4
|
43,9
|
48,7
|
|
В коровьем молоке
|
21,3
|
49,8
|
28,9
|
|
В пище богатого человека
|
19,2
|
29,8
|
51,0
|
|
В пище бедного человека
|
16,7
|
16,3
|
66,9
|
|
В пище, крайне бедной белками
|
8,3
|
38,7
|
52,8
|
То есть получается, что потребление белков с возрастом не уменьшается, а увеличивается! Организм не может принять больше белка, чем ему необходимо, – это уже яд, и избыток обязательно должен быть сожжен. Так и образуются шлаки – конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и другие. При избытке этих соединений выведение их затрудняется, и они задерживаются в организме, постепенно накапливаясь и нарушая все обменные процессы.
Так и образуются шлаки – конечные продукты белкового обмена: мочевая кислота, мочевина, аммиак, креатинин, креатин и другие. При избытке этих соединений выведение их затрудняется, и они задерживаются в организме, постепенно накапливаясь и нарушая все обменные процессы.
Разумеется, скорость освобождения от шлаков зависит от множества причин: соотношения прихода и расхода энергии, наличия витаминов, макро- и микроэлементов, физической активности, состояния органов и т. п. Но в любом случае белок – самое невыгодное «топливо». Его энергетическая ценность при окислении в организме составляет (по А. А. Покровскому) лишь 70,8 % от полной теплоты сгорания. Для жиров и усвояемых углеводов эти цифры соответственно 96,3 % и 100 %. Это значит, что 1 г белка при простом сжигании дает 5,65 ккал, а при окислении в организме – 4,0 ккал. А куда исчезает остальное? Остальное – шлаки.
Если учесть также, что избыток белка ведет к неоправданной интенсификации обменных процессов (а это способствует преждевременному изнашиванию, то есть старению тканей), то не таким уж парадоксальным кажется вывод Бирхер-Беннера – белок уменьшает ценность пищи.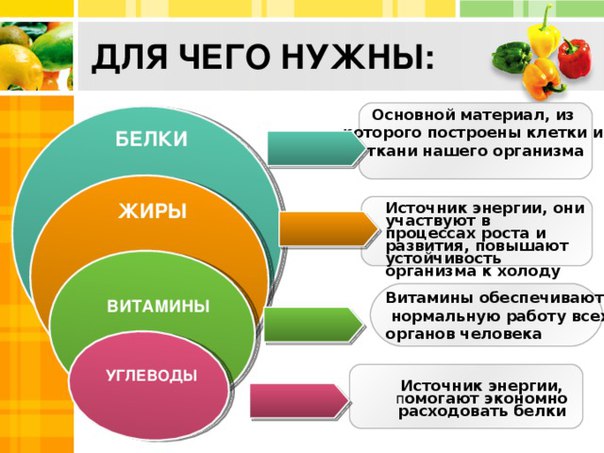 (По данным К. С. Петровского, белки на 30–40 % повышают основной обмен, жиры – на 4–14 %, углеводы – на 4–7 %.)
(По данным К. С. Петровского, белки на 30–40 % повышают основной обмен, жиры – на 4–14 %, углеводы – на 4–7 %.)
Разумеется, какое-то количество белков, и притом разнообразных, необходимо и взрослому человеку. Но даже в «обычной» пище их значительно больше, чем нужно. Иногда действительно не хватает какой-нибудь аминокислоты, но тогда человек инстинктивно набрасывается на нужную еду, и не надо следить за «достаточностью» белка, не надо «питать» организм белком, именно это и приносит вред.
Источник: В. А. Тутельян, А. И. Вялков, А. Н. Разумов, В. И. Михайлов, К. А. Москаленко, А. Г. Одинец, В. Г. Сбежнева, В. Н. Сергеев «Научные основы здорового питания»
Сдать анализ на общий белок в лаборатории KDL. Норма, повышен и понижен
Белки являются основным строительным материалом для клеток и тканей и входят в состав всего организма. Они составляют структурную часть большинства органов, к ним так же относятся ферменты и гормоны, которые регулируют все физиологические процессы. В плазме крови постоянно присутствуют два класса белков: альбумины и глобулины. Альбумин составляет около 60% от общего количества белка в крови. Он производится в печени и выполняет множество функций, в том числе, является переносчиком малых молекул и ионов веществ, источником аминокислот для метаболизма тканей и основным компонентом, участвующим в поддержании осмотического давления. Оставшиеся 40% белков крови — глобулины. К ним относятся ферменты, антитела, гормоны, белки-переносчики и т.д.
В плазме крови постоянно присутствуют два класса белков: альбумины и глобулины. Альбумин составляет около 60% от общего количества белка в крови. Он производится в печени и выполняет множество функций, в том числе, является переносчиком малых молекул и ионов веществ, источником аминокислот для метаболизма тканей и основным компонентом, участвующим в поддержании осмотического давления. Оставшиеся 40% белков крови — глобулины. К ним относятся ферменты, антитела, гормоны, белки-переносчики и т.д.
В каких случаях обычно назначают исследование?
Анализ на общий белок крови является частью скрининговых биохимических панелей, которые назначаются в рамках медицинского обследования, диспансеризаций, при госпитализации, после перенесенных заболеваний и т.д. для оценки общего состояния здоровья пациента. Используется как диагностический тест при оценке функции печени и почек
В случае отклонения результата от нормы необходимо проводить дополнительные исследования, чтобы определить, какой конкретный тип белков находится за пределами норм, чтобы можно было установить конкретный диагноз. Такими тестами могут быть альбумин и белковые фракции (электрофорез белков).
Такими тестами могут быть альбумин и белковые фракции (электрофорез белков).
Что означают результаты теста?
Результаты анализа на общий обычно рассматриваются вместе с результатами других тестов и могут дать врачу информацию об общем состоянии здоровья пациента.
Низкий уровень общего белка наблюдается при расстройствах работы печени или почек чаще всего связан либо с недостаточным синтезом или с потерями белка в организме. К таким состояниям можно отнести печеночную недостаточность, голодание, целиакию, мальабсорбцию, воспалительные заболевания кишечника, заболевания почек
Высокий общий уровень белка может наблюдаться на определенном этапе текущего воспаления или может быть связан с рядом гематологических и онкологических заболеваний (например, множественная миелома и т.д.).
Сроки выполнения теста.
Обычно результат можно получить в течение 1-2 дней.
Как подготовиться к анализу?
Специальной подготовки не требуется. Можно сдать анализ через 3 часа после еды или натощак.
Белок яичный
Белок цельного яичного белка имеет наивысшую усвояемость. Некоторые называют его идеальным белком из-за аминокислотного состава и способности организма использовать его должным образом.
Яичный белок особо богат аминокислотами с разветвленными цепями, которые способствуют процессу синтеза белка. Исследования показали, что яичный белок стимулирует белковый синтез подобно молочным белкам.
Он также богат аргинином — аминокислотой, которая стимулирует выработку окиси азота (NO). NO расширяет кровеносные сосуды, что увеличивает приток крови к мышцам и доставляет к ним больше кислорода, питательных веществ и анаболических гормонов.
В итоге это обеспечит энергией и улучшит работу во время тренировок, а также усилит восстановление мышц и рост мышечной массы после тренировки. Кроме того, аргинин повышает уровень гормона роста, что крайне важно как во время тренировок, так и после них.
Кроме того, аргинин повышает уровень гормона роста, что крайне важно как во время тренировок, так и после них.
Яичный белок имеет высокое содержание серосодержащих белков, играющих важную роль при выделении гормонов в организме, то есть он может способствовать дальнейшему усилению мышечного роста.
Яичный белок содержит до 40 различных видов белков. Хотя большинство из них не определены, те несколько, которые в нем составляют белковое большинство, хорошо изучены.
Яичный белок усваивается в умеренном темпе. Он находится между быстро усваиваемым белком сыворотки и белком казеина, отличающимся очень медленной усвояемостью.
Клиническими испытаниями было доказано, что умеренный темп усвояемости яичного белка не только повышает синтез белка, но и предотвращает распад мышц. Яичный белок практически лишен углеводов и жиров, что делает его хорошим выбором для тех, кто соблюдает определенную диету.
Яичный белок — это альтернатива для тех, у кого аллергия на молочные белки, непереносимость лактозы или сывороточных белков и казеина. Это также отличный выбор для тех, кому не нравится вкус приготовленных яиц, кто боится хлопот, связанных с сохранностью свежих яиц, а это дает еще несколько очков в пользу яичного белка.
Литература:
http://bodysportal.com/sportivnoe-pitanie/protein/yaichnyj-belok
Путь к идеальному белку | Friso Russia
Давайте сегодня поговорим о белке, одном из наиболее важных компонентов питания ребенка первого года жизни. Функции белка разнообразны. Он является основным пластическим («строительным») материалом, поэтому, конечно же, очень важен в периоды бурного роста Вашего малыша. Белок играет огромную роль в работе практически всех органов и систем организма человека. От его количества и качества в большой степени зависит то, как Ваш ребенок будет расти, развиваться, справляться с инфекциями.
От его количества и качества в большой степени зависит то, как Ваш ребенок будет расти, развиваться, справляться с инфекциями.
Молекулы белка являются, пожалуй, самыми сложными в организме человека. Белки состоят из 20 различных аминокислот, которые собираются в цепочки, как бусы, в различных комбинациях, чем определяют различные свойства белков. Некоторые из аминокислот являются незаменимыми, т.е. организм не может их синтезировать самостоятельно и должен получать с пищей. У детей таких незаменимых аминокислот больше, чем у взрослых. В процессе пищеварения специальные протеолитические ферменты расщепляют белки, поступившие с пищей, до аминокислот. В дальнейшем из этих аминокислот организм синтезирует собственные белки, необходимые для его жизнедеятельности.
Потребность в белке у детей разного возраста отличается. Более всего в белке нуждаются грудные и дети раннего возраста. Существуют строгие рекомендации по количеству этого компонента в рационе малыша, которых придерживаются все производители детского питания. Поэтому при выборе продуктов питания для Вашего ребенка обязательно обращайте внимание на маркировку, для какого возраста рекомендуется тот или иной продукт. Для правильного роста и развития ребенку нужно именно оптимальное количество белка, не должно быть как недостатка, так и избытка этого компонента.
Поэтому при выборе продуктов питания для Вашего ребенка обязательно обращайте внимание на маркировку, для какого возраста рекомендуется тот или иной продукт. Для правильного роста и развития ребенку нужно именно оптимальное количество белка, не должно быть как недостатка, так и избытка этого компонента.
Наряду с этим крайне важным является полноценность белка, которая определяется присутствием в его составе всех необходимых аминокислот в определенном количестве и соотношении. Возможно, что это звучит очень сложно и не понятно, как определить, качественный ли белок входит в рацион Вашего ребенка. В случае грудного вскармливания Вы можете быть уверены, что малыш получает полноценный белок в достаточном количестве. Именно грудное молоко является лучшим питанием на первом году жизни человека. Белок грудного молока имеет идеальный состав, в него входит весь спектр необходимых аминокислот, он прекрасно переваривается и усваивается. Доказано, что белок материнского молока не вызывает аллергических реакций и нарушений пищеварения. Дорогие мамы, кормите своего малыша грудью!
Дорогие мамы, кормите своего малыша грудью!
В тоже время, переход на искусственное вскармливание может быть связан с рядом сложностей, поскольку не все смеси одинаково перевариваются и усваиваются. Лучше сразу выбрать продукт, который будет хорошо переноситься ребенком, поскольку частая смена искусственных смесей может приводить к развитию запоров и других нарушений пищеварения. Но как это сделать? На что стоит обратить внимание при выборе детской молочной смеси для здорового ребенка?
Основой хорошей переносимости ребенком того или иного продукта, в первую очередь, является качество белкового компонента. Особенности переваривания белка зависят от нескольких факторов: это и рекомендуемый уровень белка в смеси, а этот показатель, как уже говорилось выше, обязательно соблюдается в рекомендованных пределах всеми производителями. Это и соотношение белковых фракций, поскольку для детей первого года жизни рекомендуется преобладание сывороточной фракции над казеином. А также качество молока, ведь именно молоко является источником белка в детской молочной смеси. Но как это может повлиять на усвоение белка из смеси? Для того, чтобы ответить на этот вопрос позвольте немного рассказать вам о том, как происходит создание тех детских молочных продуктов, которые вы видите на полках детских магазинов.
Но как это может повлиять на усвоение белка из смеси? Для того, чтобы ответить на этот вопрос позвольте немного рассказать вам о том, как происходит создание тех детских молочных продуктов, которые вы видите на полках детских магазинов.
В процессе производства любой детской молочной смеси молоко подвергается температурной обработке, что в первую очередь оказывает влияние на свойства белка. Под длительным воздействием высоких температур происходит денатурация белка -изменение строения белковой молекулы, которая приобретает новые свойства. Такой измененный белок плохо усваивается ребенком, не расщепляется полностью пищеварительными ферментами, может приводить к развитию пищевой аллергии, возникновению запоров и кишечных колик.
Каким образом можно избежать этих негативных изменений белка в процессе производства? Ответственные производители прилагают много усилий для решения этого вопроса. Особого внимания заслуживает опыт голландской компании ФризлендКампина, которая производит современные детские молочные смеси Фрисо, обладающие как прекрасной переносимостью, так и отличными вкусовыми качествами. Компания ФризлендКампина начала свой путь к идеальному белку с полного контроля всей технологической цепочки, начиная с коровьего молока, которое получают на собственных фермах компании, и, заканчивая конечным продуктом, который родители покупают для своего ребенка.
Компания ФризлендКампина начала свой путь к идеальному белку с полного контроля всей технологической цепочки, начиная с коровьего молока, которое получают на собственных фермах компании, и, заканчивая конечным продуктом, который родители покупают для своего ребенка.
В компании ФризлендКампина действуют строгие требования к состоянию здоровья коров, условиям их содержания и, конечно, качеству получаемого молока. Компания использует только свежее молоко с собственных фермерских хозяйств, что дает возможность использовать щадящую температурную обработку в процессе производства. Это позволяет добиться максимального сохранения натуральных свойств белка, хорошей переносимости, а также прекрасных вкусовых качеств детских молочных смесей Фрисо.
Помните, что правильное питание на первом году жизни человека – это залог здоровья в будущем!
Синтез белка | Hepatitis C Trust
Печень — один из важнейших органов для производства белков. Он производит или трансформирует миллионы белковых молекул каждый день. Белки состоят из аминокислот. Некоторые из этих аминокислот уже находятся в организме. Другие, называемые незаменимыми аминокислотами, можно получить только с пищей.
Белки состоят из аминокислот. Некоторые из этих аминокислот уже находятся в организме. Другие, называемые незаменимыми аминокислотами, можно получить только с пищей.
Белки выполняют множество жизненно важных функций. Мы используем их для роста и поддержания тканей тела, таких как мышцы, сердце, почки и стенки кровеносных сосудов.Печень производит сотни различных белков с разными функциями. Некоторые переносят витамины и минералы по телу. Некоторые действуют как катализаторы, ускоряющие метаболические реакции (эти белки называются ферментами). Другие регулируют структуру всех видов деятельности внутри клетки.
Альбумин
Альбумин обычно присутствует в крови в больших количествах. Он используется для связывания гормонов, некоторых химических веществ и лекарств. Альбумин также регулирует обмен воды между кровью и тканями.Если концентрация воды в жидкостях организма отличается от концентрации в клетках, существует риск того, что жидкость вырвется из клеток.
В течение нашей жизни печень постоянно контролирует уровень давления в организме, чтобы обеспечить его баланс. Если печень не может синтезировать достаточное количество альбумина, может произойти накопление жидкости в тканях. Обычно это симптом, связанный с декомпенсированным циррозом печени, когда жидкость может скапливаться в лодыжках, ступнях или ногах (отек) или в брюшной полости (асцит).
Утюг
Печень накапливает и выделяет железо по всему телу по мере необходимости. Само по себе железо токсично для клеток организма, поэтому организм связывает его с белком. В печени железо связано с белком ферритином.
Когда заболевание печени связано с увеличением количества ферритина в печени, оно может вызывать повреждение тканей и органов. Это называется гемохроматозом.
Железо также необходимо для образования гемоглобина.Это помогает транспортировать кислород в кровоток. Если железа недостаточно для образования гемоглобина, это может привести к летаргии и анемии.
Конверсия аммиака
Аммиак — токсичное вещество, получаемое в результате метаболизма белков. Печень превращает аммиак в мочевину, которая водорастворима, нетоксична и выводится почками. Дисфункция печени при декомпенсированном циррозе может привести к неспособности преобразовать этот аммиак, который затем накапливается в крови.
Ученые проливают свет на малый белок и его роль в иммунном ответе
Иммунная система — это защита организма от болезнетворных микроорганизмов. Он защищает от болезней и потенциально повреждает инородные тела. Теперь группа исследователей разработала новый метод, чтобы пролить свет на основной защитный механизм иммунной системы.
Исследователи из Университета Айовы (США) и Медицинского центра VIB-UGent при Гентском университете идентифицировали ISG15, интерферон-стимулированный убиквитин-подобный белок, обладающий противовирусными и антибактериальными свойствами.
Новый метод, который был описан в исследовании, опубликованном в журнале Nature Communications, может помочь ученым определять и изучать белки, помеченные ISG15. Этот метод может раскрыть множество функций ISG15 в борьбе с инфекциями и болезнями, что в конечном итоге приведет к разработке новых противомикробных препаратов.
ISG15 тегирует белки
Белки — важные молекулы в организме, специфически экспрессируемые клетками во время биологических процессов.Химическая метка работает, прикрепляясь к белку, чтобы изменять и регулировать его активность. Таким образом, организм контролирует экспрессированные белки.
Убиквитин — это небольшой регуляторный белок, который содержится почти во всех клеточных тканях. Он помогает регулировать процессы других белков в организме.
Теперь ученые обнаружили убиквитиноподобную модификацию, получившую название ISG15, которая прикрепляется к белкам-мишеням. Хотя ubiquitin и ISG15 имеют одни и те же аминокислотные последовательности на их конце, молекулярная функция ISG15 все еще неясна, поскольку точные сайты модификации и модифицированные белки все еще неизвестны.
Чтобы подтвердить свои выводы, ученые разработали новую технологию для определения сайтов модификации убиквитина и использования их для отслеживания и обнаружения сайтов модификации ISG15.
Отслеживание ISG15
Хотя эти два имеют общие характеристики, как указывалось ранее, ISG15 не присутствует в нормальных условиях и проявляется только при определенных стрессах, включая инфекцию, вызванную вирусами или бактериями. Исследователям необходимо протестировать свой подход или новый метод на модели заражения.
Исследователи протестировали новый подход после заражения мышей Listeria monocytogenes, грамположительной бактерией, вызывающей листериоз. Затем они картировали эндогенный ISGylome in vivo в печени после заражения, комбинируя мышиные модели пониженного или повышенного ISGylation с количественной протеомикой.
«В качестве модели инфекции мы выбрали жучок Listeria monocytogenes . Листерия, ведущая к« старой французской сырной болезни », представляет собой бактериальный патоген пищевого происхождения, скрывающийся от иммунной системы внутри клеток-хозяев.- сказал Фабьен Тери из лаборатории Impens и соавтор исследования.
Исследователи выбрали печень, поскольку она играет центральную роль в метаболизме и в то же время работает как фильтр крови для обнаружения и устранения любых потенциальных угроз в организме, включая патогены.
Они идентифицировали около 930 сайтов ISG15 в 434 белках и в то же время обнаружили изменения в убиквитиломе хозяина. Они также обнаружили, что ISG15 нацелен на многие ферменты, которые играют важную роль в метаболических процессах.Они также действуют на ключевые регуляторы аутофагии, способ организма очищать поврежденные клетки для восстановления более здоровых. Этот процесс может помочь в антибактериальном действии, и исследование указывает на то, что ISG15 контролирует этот процесс.
Исследователи пришли к выводу, что существует связь между ISG15, аутофагией и клеточным метаболизмом. Теперь исследователи работают над исследованием конкретных мишеней белковой метки во время заражения другими болезнетворными микроорганизмами, такими как вирус Коксаки и вирус гриппа.
Результаты нового исследования могут помочь раскрыть новые методы, которые могут помочь в разработке лекарств. Сегодня инфекции становятся все более распространенными и появляются новые болезни, что затрудняет врачам лечение своих пациентов. Поиск дополнительных способов укрепления иммунной системы или изучение того, как она работает, могут помочь в разработке новых лекарств для борьбы с этими патогенами.
Ссылка на журнал:
Zhang, Y., Thery, F., Wu, N.C. et al. ISGylome in vivo связывает ISG15 с метаболическими путями и аутофагией при инфицировании Listeria monocytogenes.Nat Commun 10, 5383 (2019) doi: 10.1038 / s41467-019-13393-x, https://www.nature.com/articles/s41467-019-13393-x
Фазовое разделение белков и его роль в онкогенезе
Сигнальные пути играют важную роль в регуляции экспрессии генов. Многие мембранные рецепторы и нижестоящие сигнальные молекулы собираются в двумерные (2D) кластеры после инициации передачи сигналов (Bienz, 2014; Wu, 2013). Хорошо известными примерами являются сигнальные кластеры рецепторов Т-клеток (Ditlev et al., 2019; Хуанг и др., 2019; Su et al., 2016) и кластеры, связанные с рецепторами адгезии (Banjade, Rosen, 2014; Beutel et al., 2019; Case et al., 2019a; Li et al., 2012). Сборка кластеров на мембранах часто важна для активации нижестоящих сигнальных эффекторов. Например, разделение фаз фосфорилированного рецептора нефрина вместе с его последующими эффекторными молекулами NCK и N-WASP способствует сборке актина. Это усиление сборки актина было связано с более длительным временем пребывания на мембране N-WASP в этих кластерах.В более общем плане время пребывания компонентов кластера зависело от состава кластера и концентрации составляющих кластера (Case et al., 2019b), что позволяет предположить, что существует оптимальный состав конденсата для достижения полной активации. Точно так же сигнальные конденсаты, образованные из линкера фосфорилированного каркасного белка для активации Т-клеток (LAT) и двух его адаптеров, белка, связанного с рецептором фактора роста 2 (GRB2) и гомолога Son of Sevenless (SOS), способствовали активации Ras за счет увеличения времени пребывания на мембране SOS (Хуанг и др.
Хорошо известными примерами являются сигнальные кластеры рецепторов Т-клеток (Ditlev et al., 2019; Хуанг и др., 2019; Su et al., 2016) и кластеры, связанные с рецепторами адгезии (Banjade, Rosen, 2014; Beutel et al., 2019; Case et al., 2019a; Li et al., 2012). Сборка кластеров на мембранах часто важна для активации нижестоящих сигнальных эффекторов. Например, разделение фаз фосфорилированного рецептора нефрина вместе с его последующими эффекторными молекулами NCK и N-WASP способствует сборке актина. Это усиление сборки актина было связано с более длительным временем пребывания на мембране N-WASP в этих кластерах.В более общем плане время пребывания компонентов кластера зависело от состава кластера и концентрации составляющих кластера (Case et al., 2019b), что позволяет предположить, что существует оптимальный состав конденсата для достижения полной активации. Точно так же сигнальные конденсаты, образованные из линкера фосфорилированного каркасного белка для активации Т-клеток (LAT) и двух его адаптеров, белка, связанного с рецептором фактора роста 2 (GRB2) и гомолога Son of Sevenless (SOS), способствовали активации Ras за счет увеличения времени пребывания на мембране SOS (Хуанг и др. , 2019). Оба случая предполагают, что увеличенное время пребывания сигнальных эффекторов за счет конденсации может быть общим механизмом для полной активации сигнального пути, в то же время обеспечивая специфичность передачи сигналов.
, 2019). Оба случая предполагают, что увеличенное время пребывания сигнальных эффекторов за счет конденсации может быть общим механизмом для полной активации сигнального пути, в то же время обеспечивая специфичность передачи сигналов.
Примечательно, что GRB2, SOS и некоторые изоформы Ras участвуют в нижестоящих сигнальных эффекторах рецептора эпидермального фактора роста (EGFR). EGFR часто мутирует или сверхэкспрессируется в раковых клетках (Sigismund et al., 2018), а аномальная активация Ras в пути EGFR приводит к про-онкогенной пролиферации и миграции (Martinelli et al., 2017). Учитывая, что активация EGFR связана с мембраносвязанными кластерами (Liang et al., 2018), весьма вероятно, что образование конденсата EGFR регулирует проколкогенную активацию Ras.
Компоненты др. Онкогенных сигнальных путей, по-видимому, способны образовывать 2D кластеры на плазматической мембране (Figure 2). Одним из примеров является сигнальный путь Wnt / β-катенин, который определяет многочисленные решения клеточных судеб во время развития животных и не регулируется при многих формах рака толстой кишки, желудка, груди и печени (Sanchez-Vega et al. , 2018; Шефер и Пайфер, 2019; Жан и др., 2017). В отсутствие сигнала Wnt β-катенин фосфорилируется комплексом деструкции, который состоит из аксина, опухолевого супрессора аденоматозного полипоза кишечной палочки (APC) и некоторых дополнительных компонентов. Фосфорилированный β-катенин распознается Cullin-based E3 Ligase SCF βTrCP , способствуя деградации β-catenin протеасомой (Stamos and Weis, 2013). В присутствии сигнала Wnt активность комплекса деструкции подавляется.Важно отметить, что связывание Wnt с рецепторами на его клеточной поверхности запускает сборку сигнаносомы, которая опосредуется белком Disheveled (Dvl) (Bienz, 2020; Bilic et al., 2007; Fiedler et al., 2011; Gammons et al. , 2016; Madrzak et al., 2015; Schwarz-Romond et al., 2007). Комплекс Axin впоследствии рекрутируется в сигналосомы, которые дестабилизируют комплекс деструкции и блокируют фосфорилирование β-catenin (Stamos et al., 2014).
, 2018; Шефер и Пайфер, 2019; Жан и др., 2017). В отсутствие сигнала Wnt β-катенин фосфорилируется комплексом деструкции, который состоит из аксина, опухолевого супрессора аденоматозного полипоза кишечной палочки (APC) и некоторых дополнительных компонентов. Фосфорилированный β-катенин распознается Cullin-based E3 Ligase SCF βTrCP , способствуя деградации β-catenin протеасомой (Stamos and Weis, 2013). В присутствии сигнала Wnt активность комплекса деструкции подавляется.Важно отметить, что связывание Wnt с рецепторами на его клеточной поверхности запускает сборку сигнаносомы, которая опосредуется белком Disheveled (Dvl) (Bienz, 2020; Bilic et al., 2007; Fiedler et al., 2011; Gammons et al. , 2016; Madrzak et al., 2015; Schwarz-Romond et al., 2007). Комплекс Axin впоследствии рекрутируется в сигналосомы, которые дестабилизируют комплекс деструкции и блокируют фосфорилирование β-catenin (Stamos et al., 2014).
Растущее количество доказательств указывает на то, что и деструктивный комплекс, и сигналосомы Wnt обладают свойствами конденсатов (Schaefer and Peifer, 2019; Figure 5). В отсутствие Wnt Axin обнаруживается в пунктах цитоплазмы, которые также содержат APC, а также другие компоненты деструктивного комплекса (Schaefer et al., 2018). Напротив, в клетках, принимающих сигналы Wnt, Dvl и Axin совместно локализуются в точках рядом с плазматической мембраной (Cliffe et al., 2003). Сборки растут путем слияния (Kunttas-Tatli et al., 2014; Schwarz-Romond et al., 2005), а анализ FRAP дополнительно показал, что Dvl, Axin и APC внутри точки обмениваются динамически (Pronobis et al., 2015; Schwarz -Romond et al., 2005). Важно, что сигнальная активность Dvl сильно коррелирует со способностью образовывать эти точки (Schwarz-Romond et al., 2005). Сходным образом сборка точек критически важна для функции комплекса деструкции (Faux et al., 2008; Schaefer and Peifer, 2019). APC необходим для сборки точек и взаимодействует с Axin, чтобы гарантировать эффективное разрушение β-catenin (Pronobis et al., 2015). Поразительно, что мутации в APC инициируют> 80% рака толстой кишки (Zhang and Shay, 2017).
В отсутствие Wnt Axin обнаруживается в пунктах цитоплазмы, которые также содержат APC, а также другие компоненты деструктивного комплекса (Schaefer et al., 2018). Напротив, в клетках, принимающих сигналы Wnt, Dvl и Axin совместно локализуются в точках рядом с плазматической мембраной (Cliffe et al., 2003). Сборки растут путем слияния (Kunttas-Tatli et al., 2014; Schwarz-Romond et al., 2005), а анализ FRAP дополнительно показал, что Dvl, Axin и APC внутри точки обмениваются динамически (Pronobis et al., 2015; Schwarz -Romond et al., 2005). Важно, что сигнальная активность Dvl сильно коррелирует со способностью образовывать эти точки (Schwarz-Romond et al., 2005). Сходным образом сборка точек критически важна для функции комплекса деструкции (Faux et al., 2008; Schaefer and Peifer, 2019). APC необходим для сборки точек и взаимодействует с Axin, чтобы гарантировать эффективное разрушение β-catenin (Pronobis et al., 2015). Поразительно, что мутации в APC инициируют> 80% рака толстой кишки (Zhang and Shay, 2017). Точный механизм того, как эти мутации способствуют онкогенезу, еще предстоит определить.Здесь возникает ряд дополнительных неотложных вопросов, например, как мутации APC влияют на сборку и свойства конденсатов комплекса разрушения и взаимосвязь между конденсатами комплекса аберрантного разрушения и инициированием рака.
Точный механизм того, как эти мутации способствуют онкогенезу, еще предстоит определить.Здесь возникает ряд дополнительных неотложных вопросов, например, как мутации APC влияют на сборку и свойства конденсатов комплекса разрушения и взаимосвязь между конденсатами комплекса аберрантного разрушения и инициированием рака.
Связанные с сигнализацией конденсаты, которые могут образовываться в сигнальном пути Wnt / β-catenin.
(слева) передача сигналов Wnt запускает сборку 2D мембранных кластеров, содержащих рецепторы Frizzled и LRP, а также Dvl, Axin и др. Компоненты комплекса деструкции, тем самым нарушая комплекс деструкции, регулирующий деградацию β-catenin.Следовательно, β-катенин накапливается и проникает в ядро, где он может локализоваться в конденсатах на суперэнхансерах, чтобы вызвать транскрипцию генов-мишеней. (Справа) В отсутствие лиганда Wnt, Axin и APC собираются в конденсат деструктивного комплекса, который рекрутирует киназы, такие как GSK3 и казеинкиназа I (CKI). Это, в свою очередь, способствует фосфорилированию β-катенина и последующей убиквитин-опосредованной деградации β-катенина протеасомой. Убиквитинирование фосфорилированного β-катенина опосредуется убиквитинлигазой SCFβTrCP.
(Справа) В отсутствие лиганда Wnt, Axin и APC собираются в конденсат деструктивного комплекса, который рекрутирует киназы, такие как GSK3 и казеинкиназа I (CKI). Это, в свою очередь, способствует фосфорилированию β-катенина и последующей убиквитин-опосредованной деградации β-катенина протеасомой. Убиквитинирование фосфорилированного β-катенина опосредуется убиквитинлигазой SCFβTrCP.
Недавние работы показали, что конденсаты участвуют в другом аспекте пути передачи сигналов Wnt. В присутствии Wnt β-катенин накапливается в ядре и активирует транскрипцию генов-мишеней Wnt (Gammons, Bienz, 2018). Отчеты показали, что β-катенин использует свои IDR для избирательного разделения на транскрипционные конденсаты на суперэнхансерах (Zamudio et al., 2019; Table 1). Некоторые связанные с раком мутации в β-катенине предотвращают зависимое от фосфорилирования убиквитинирование β-катенина, что приводит к накоплению β-катенина в ядре (Kim and Jeong, 2019).Это говорит о том, что в раковых клетках β-катенин может образовывать аберрантные ядерные конденсаты из-за повышенных уровней белка и что это может способствовать онкогенезу за счет широко распространенных изменений в экспрессии генов.
Аутофагия и ее роль в секреции белка: значение для терапии рака
Аутофагия — это путь разложения белков и органелл, важный для поддержания цитоплазматического гомеостаза и обеспечения питательными веществами для выживания в ответ на стрессовые условия.Недавно было показано, что аутофагия важна для секреции различных белков, участвующих в воспалении, межклеточной передаче сигналов и прогрессировании рака. Роль аутофагии при раке зависит от стадии онкогенеза, выполняя роль супрессора опухоли до трансформации и функцию выживания опухоли после того, как опухоль образовалась. Мы рассматриваем недавние доказательства, демонстрирующие сложность регуляции аутофагии во время рака, учитывая взаимодействие аутофагии с путями секреции белка.Манипуляции с аутофагией во время лечения рака, вероятно, повлияют на секрецию белка и межклеточную передачу сигналов либо к соседним раковым клеткам, либо на противоопухолевый иммунный ответ. Это будет важным соображением во время лечения рака, поскольку в нескольких клинических испытаниях пытаются управлять аутофагией в сочетании с химиотерапией для лечения различных типов рака.
1. Введение
Макроаутофагия (называемая здесь аутофагией) — это эволюционно законсервированный катаболический процесс и процесс контроля качества, который включает образование двухмембранных везикул, известных как аутофагосомы, которые поглощают цитоплазматические белки и органеллы для их деградации в лизосоме [1] .Базальные уровни аутофагии обычно низкие, но индуцируются голоданием или различными видами стресса, что указывает на важную роль аутофагии во время метаболического гомеостаза [2]. Хозяйственная роль базовой аутофагии подтверждается накоплением субстратов аутофагии, таких как поврежденные белки и органеллы, после генетического устранения процесса в различных моделях [2]. Кроме того, при стимуляции аутофагии, вызванной стрессом, клетки используют продукты своего распада для получения энергии и выработки метаболических предшественников для выживания клеток [3].
Важность аутофагии для здоровья и болезней была подтверждена присуждением Нобелевской премии по физиологии и медицине 2016 г. доктору Йошимори Осуми за открытие белков Atg, белков, регулирующих аутофагический процесс [4]. Открытие доктора Осуми привело к исследованию аутофагии в различных областях исследований и к более глубокому пониманию этого процесса и его регуляторов, что привело к исследованиям, которые предполагают возможность терапевтического воздействия на аутофагию для лечения различных заболеваний.
доктору Йошимори Осуми за открытие белков Atg, белков, регулирующих аутофагический процесс [4]. Открытие доктора Осуми привело к исследованию аутофагии в различных областях исследований и к более глубокому пониманию этого процесса и его регуляторов, что привело к исследованиям, которые предполагают возможность терапевтического воздействия на аутофагию для лечения различных заболеваний.
Развитие мутантных мышей, дефицитных по белкам ATG, продемонстрировало, что аутофагия необходима для выживания на неонатальной стадии развития у млекопитающих [5]. Первыми мутантными мышами, полученными с нокаутом гена Atg , были мыши с нокаутом Atg5 [6]. Эти мыши показали пониженный уровень аминокислот в тканях и плазме, умерли новорожденным с отсутствием очевидных анатомических аномалий при рождении и имели дефект сосания. Поскольку аутофагия массово индуцируется после рождения в ответ на голодание, вызванное прекращением трансплацентарного снабжения питательными веществами, отсутствие аутофагии вместе с дефектом сосания у мутантных мышей было предложено как ответственность за неспособность восстановить снабжение питательными веществами, и наблюдаемые неонатальная летальность [6]. Хотя искусственное вскармливание молока частично увеличивало выживаемость Atg5--нулевых новорожденных, -Atg5--нулевые мыши также демонстрировали дефекты в удалении апоптозных трупов и в развитии сердца и легких. Совсем недавно было продемонстрировано, что дисфункция нейронов у мышей с нокаутом Atg5 является основной причиной неонатальной летальности, поскольку повторная экспрессия Atg5 в головном мозге была достаточной, чтобы избежать летальности в этой модели [7]. Эти данные подчеркивают важность аутофагического пути для правильного развития организма и в качестве основного генератора аминокислот в условиях голодания для поддержания жизнеспособности клеток и организма.
Хотя искусственное вскармливание молока частично увеличивало выживаемость Atg5--нулевых новорожденных, -Atg5--нулевые мыши также демонстрировали дефекты в удалении апоптозных трупов и в развитии сердца и легких. Совсем недавно было продемонстрировано, что дисфункция нейронов у мышей с нокаутом Atg5 является основной причиной неонатальной летальности, поскольку повторная экспрессия Atg5 в головном мозге была достаточной, чтобы избежать летальности в этой модели [7]. Эти данные подчеркивают важность аутофагического пути для правильного развития организма и в качестве основного генератора аминокислот в условиях голодания для поддержания жизнеспособности клеток и организма.
Сходный фенотип наблюдался у мышей Atg3 , Atg7 , Atg12 и Atg16L1 с нокаутом и Ulk1 / 2 с двойным нокаутом мышей [5, 8]. Тем не менее, мыши с нокаутом беклин1 , Ambra1 и Rb1cc1 / FIP200 не могут производить гомозиготное потомство из-за ранней эмбриональной летальности, что позволяет предположить, что эти гены выполняют другие важные функции во время развития в дополнение к их участию в аутофагии [5, 7].
Для исследования роли аутофагии в полностью развитом организме были получены взрослые мыши, подвергшиеся условной делеции всего тела Atg7 [9]. У этих мышей развилось повреждение тканей, включая увеличение печени, уменьшение количества крупных пирамидных нейронов и клеток Пуркинье, дегенеративные изменения в мышцах и вакуолизацию поджелудочной железы. Мыши с условным нокаутом Atg7 умерли либо от инфекции Streptococcus вскоре после делеции Atg7 , либо от нейродегенерации через 2–3 месяца [9].Важно отметить, что после инактивации Atg7 мыши не выдерживали голодания в течение 24 часов. Таким образом, взрослые мыши менее зависимы от аутофагии, чем новорожденные, поскольку они могут выжить дольше в отсутствие аутофагии. Однако аутофагический процесс необходим для поддержания тканей взрослого человека, особенно для поддержания нейронов у полностью развитых организмов, и необходим для выживания организма во время голодания [2, 9].
Тот факт, что аутофагический процесс играет центральную роль в поддержании взрослых нейронов и в удалении белковых включений в нейронах (таких как те, которые возникают при болезнях Альцгеймера, Хунтингтона и Паркинсона), а также в удалении поврежденных митохондрий (например, накапливающиеся при некоторых известных формах болезни Паркинсона [10]) привели к многочисленным клиническим испытаниям, в которых пытались вызвать аутофагию различными способами при нейродегенеративных заболеваниях [11]. Таким образом, похоже, что заболевания, которые, скорее всего, вскоре будут излечены модуляторами аутофагии в клинике, включают нейродегенеративные заболевания, а также рак [11]. Важно отметить, что, как мы обсудим позже, было показано, что аутофагия также важна для образования внеклеточных бляшек и латеральной передачи заболевания во время нейродегенерации, что подчеркивает важность рассмотрения всех последствий манипуляции аутофагией в клинике.
Таким образом, похоже, что заболевания, которые, скорее всего, вскоре будут излечены модуляторами аутофагии в клинике, включают нейродегенеративные заболевания, а также рак [11]. Важно отметить, что, как мы обсудим позже, было показано, что аутофагия также важна для образования внеклеточных бляшек и латеральной передачи заболевания во время нейродегенерации, что подчеркивает важность рассмотрения всех последствий манипуляции аутофагией в клинике.
Терапевтическое воздействие на аутофагию при раке непросто, и данные свидетельствуют о том, что при попытке манипулировать аутофагией для лечения рака необходимо проводить тщательный отбор пациентов на основе характеристик их опухоли.Однако в большинстве клинических испытаний, пытающихся модулировать аутофагию для лечения рака, используются различные препараты с целью подавления аутофагии [11]. Противоречия в области манипуляции аутофагией для лечения рака возникают из-за того факта, что аутофагия участвует в нескольких стадиях онкогенного процесса, где были описаны как способствующие опухоли, так и опухолевые супрессорные функции для аутофагии [12]. Совсем недавно аутофагия также была связана с внеклеточным высвобождением цитоплазматических компонентов, включая белки и субстраты в виде частиц в процессе, называемом секреторной аутофагией [13], что усложняет множественные роли аутофагии в гомеостазе клетки, передаче сигналов и ее изменениях в клеточном гомеостазе. болезнь.Здесь мы рассматриваем недавние данные, касающиеся аутофагического механизма и клеточной секреции, с особым акцентом на канцерогенез, прогрессирование рака и возможные возможности для улучшения лечения рака.
Совсем недавно аутофагия также была связана с внеклеточным высвобождением цитоплазматических компонентов, включая белки и субстраты в виде частиц в процессе, называемом секреторной аутофагией [13], что усложняет множественные роли аутофагии в гомеостазе клетки, передаче сигналов и ее изменениях в клеточном гомеостазе. болезнь.Здесь мы рассматриваем недавние данные, касающиеся аутофагического механизма и клеточной секреции, с особым акцентом на канцерогенез, прогрессирование рака и возможные возможности для улучшения лечения рака.
2. Аутофагический путь
Аутофагический процесс регулируется набором эволюционно консервативных генов, называемых ATG или генами, «связанными с аутофагией», и он включает следующие этапы: инициация образования аутофагосомы, нуклеация, расширение и удлинение аутофагосомной мембраны, закрытие и слияние с лизосомой, заканчивающееся деградацией внутрипузырных продуктов (Рисунок 1).За подробным обзором этого процесса читатели могут обратиться к прекрасным опубликованным обзорам [1, 14, 15].
Вкратце, киназный комплекс Atg1 / ULK1 / 2 (у млекопитающих, образованный ULK1 / 2, ATG13, FIP200 и ATG101) регулирует индукцию образования аутофагосом. Во время первой стадии инициации аутофагии комплекс ULK1 формирует точечные структуры вблизи ER (эндоплазматический ретикулум), где формируется комплекс нуклеации. Активированный ULK1 / 2 затем фосфорилирует компоненты комплекса нуклеации PI3K класса III (фосфатидилинозитол-3-киназа).Этот комплекс состоит из класса III PI3K (VPS34), беклина 1, VPS15 и ATG14L. Этот киназный комплекс отвечает за продукцию фосфолипид-фосфатидилинозитол-3-фосфата (PI3P) в месте образования аутофагосом, который служит сигнальной молекулой для рекрутирования PI3P-связывающих белков [16]. Удлинение везикул опосредуется двумя убиквитиноподобными системами конъюгации белков: ATG5-ATG12 и ATG8 / LC3-PE. Обе системы необходимы для расширения мембран аутофагосом и состоят из следующих белков: ATG12 и ATG8 / LC3 (убиквитин-подобные белки), ATG7 (E1-подобный фермент), ATG10 и ATG3 (E2-подобные ферменты), ATG5 и ATG16 (модифицированные мишени. ) и ATG4 (протеаза).Система ATG5-ATG12 вместе с ATG16 частично определяет внутриклеточную локализацию конъюгации ATG8 / LC3-PE. ATG8 / LC3 конъюгирован с липидным фосфатидилэтаноламином (PE) с образованием LC3II, который рекрутируется на аутофагосомную мембрану и в настоящее время является наиболее широко используемым тестом для оценки аутофагии [15, 17]. LC3II также распознает адаптерные белки, такие как p62 / SQSTM1, который связывает убиквитинированные белки и транспортирует их в аутофагосому. В конечном итоге аутофагосомы перемещаются по микротрубочкам под действием динеина и сливаются с лизосомами, и их содержимое разрушается.Для слияния необходимы ESCRT (эндосомные сортировочные комплексы, необходимые для транспорта), SNAREs (STX17), белки семейства VPS и RAB7 [18]. Нарушение функции лизосом предотвращает полный аутофагический поток. Следовательно, лизосомотропные агенты, такие как хлорохин или гидроксихлорохин, которые ухудшают деградацию аутофагосом и аутофагический поток за счет увеличения pH лизосомы, используются экспериментально и в клинике в нескольких клинических испытаниях для ингибирования аутофагии [11, 18].
) и ATG4 (протеаза).Система ATG5-ATG12 вместе с ATG16 частично определяет внутриклеточную локализацию конъюгации ATG8 / LC3-PE. ATG8 / LC3 конъюгирован с липидным фосфатидилэтаноламином (PE) с образованием LC3II, который рекрутируется на аутофагосомную мембрану и в настоящее время является наиболее широко используемым тестом для оценки аутофагии [15, 17]. LC3II также распознает адаптерные белки, такие как p62 / SQSTM1, который связывает убиквитинированные белки и транспортирует их в аутофагосому. В конечном итоге аутофагосомы перемещаются по микротрубочкам под действием динеина и сливаются с лизосомами, и их содержимое разрушается.Для слияния необходимы ESCRT (эндосомные сортировочные комплексы, необходимые для транспорта), SNAREs (STX17), белки семейства VPS и RAB7 [18]. Нарушение функции лизосом предотвращает полный аутофагический поток. Следовательно, лизосомотропные агенты, такие как хлорохин или гидроксихлорохин, которые ухудшают деградацию аутофагосом и аутофагический поток за счет увеличения pH лизосомы, используются экспериментально и в клинике в нескольких клинических испытаниях для ингибирования аутофагии [11, 18].
Аутофагия регулируется в зависимости от доступности питательных веществ, а также других сигналов клеточного стресса.Главный регулятор аутофагии в ответ на доступность питательных веществ — комплекс 1 mTOR (механистическая мишень рапамицина) (mTORC1), серин / треониновая протеинкиназа, ответственная за регулирование роста и метаболизма клеток. В присутствии аминокислот mTORC1 активен и ингибирует аутофагию, фосфорилируя ULK1, а также ATG13 по нескольким остаткам [16]. После аминокислотной депривации активация mTORC1 на лизосомной поверхности нарушается, и как ULK1, так и ATG13 дефосфорилируются, что приводит к активации ULK1 и индукции аутофагии [16].Другим важным регулятором аутофагии является AMPK (AMP-активируемая протеинкиназа), которая активируется низким уровнем АТФ или увеличением соотношения AMP: ATP. AMPK может инактивировать mTORC1 посредством его фосфорилирования, а также может непосредственно фосфорилировать и активировать ULK1 по нескольким остаткам, вызывая аутофагию. Другие регуляторы комплекса ULK1 включают GSK3-TIP60, AKT, Cul3-KLHL20 и NEDD4L [16].
Другие регуляторы комплекса ULK1 включают GSK3-TIP60, AKT, Cul3-KLHL20 и NEDD4L [16].
3. Аутофагия и рак
Исследования аутофагии в области биологии рака привели к общему мнению о том, что роль аутофагии при раке зависит от стадии онкогенеза [12].Как правило, до появления опухоли аутофагия выполняет функцию подавления опухоли в нормальных клетках, устраняя поврежденные органеллы и белковые агрегаты, которые могут способствовать нестабильности генома и туморогенезу. С другой стороны, как только опухоль установлена, аутофагия выполняет функцию выживания раковых клеток, что помогает им пережить гипоксию, метаболический стресс и анойкис [12]. Таким образом, гомеостатическая функция базовой аутофагии, происходящей в нормальных клетках, обеспечивает непрерывное удаление лишних, эктопических или поврежденных (и потенциально опасных) объектов, включая органеллы или белки, действуя как система контроля качества, которая поддерживает клеточную приспособленность [12].Кроме того, аутофагический поток может усиливаться в ответ на стрессовые стимулы, такие как пищевой, метаболический, окислительный, патогенный, генотоксический или протеотоксический стресс [12]. Эта индуцированная стимулом аутофагия выполняет цитопротекторную функцию, помогая клеткам адаптироваться к стрессу и позволяя им выжить.
В соответствии с ролью домашнего хозяйства аутофагии, рак был первым заболеванием, которое было связано с дефицитом аутофагического пути с предположением, что Beclin1 функционирует как ген-супрессор опухоли, поскольку было обнаружено, что он моноаллельно удален в высокий процент рака яичников, груди и простаты [10, 19].Хотя это предложение недавно было оспорено, а опухолевые супрессивные функции Beclin1 остаются спорными [20], различные модели мышей с дефектами в механизме аутофагии, вызванными гетерозиготным или гомозиготным нокаутом генов Atg в целом или тканях, демонстрируют повышенное заболеваемость некоторыми злокачественными новообразованиями или повышенная восприимчивость к канцерогенам [10, 12]. Итак, гетерозиготная делеция беклин1 была связана с повышенной восприимчивостью к раку груди, яичников и простаты у людей и увеличением спонтанных злокачественных новообразований у мышей [21]; Было показано, что мыши с нокаутом Atg4C более склонны к развитию химически индуцированных фибросарком [22]; мозаичная делеция Atg5 у мышей вызывала развитие доброкачественной опухоли в печени [23]; и тканеспецифичный нокаут Atg5 или Atg7 увеличивал появление карцином легких, вызываемых KRAS G12D или BRAF V600E [24, 25], а также предраковых поражений поджелудочной железы, вызванных KRAS G12D [26, 27].Интересно, что у мышей с условным нокаутом Atg7 в печени развились множественные опухоли в этой ткани, и этот фенотип был обращен нокаутом p62 , указывая на то, что накопление p62 из-за подавления аутофагии вносит вклад в образование опухолей [23].
Таким образом, до появления злокачественного образования аутофагия выполняет функцию подавления опухоли. Предлагаемый механизм включает деградацию поврежденных митохондрий, которая в противном случае могла бы вызвать окислительный стресс, повреждение ДНК и геномную нестабильность.Эти элементы хронического повреждения тканей также могут спровоцировать воспалительную реакцию, которая может еще больше способствовать росту опухоли [28]. В связи с этим было показано, что p62 / SQSTM1, один из наиболее охарактеризованных субстратов избирательной аутофагии, который взаимодействует с LC3 на изолирующей мембране, а также с убиквитинированными белками, играет роль в индукции туморогенеза. p62 может функционировать как узел передачи сигналов через свои взаимодействующие белки. Среди них он может активировать путь TRAF6-Nf κ B, способствовать агрегации каспазы-8, связывать Keap1, убиквитин-лигазу Cullin3-типа для Nrf2 и способствовать образованию внутриклеточных телец включения [29–31].Таким образом, избыточное накопление p62 из-за дефектной аутофагии приводит к гиперактивации этих сигнальных путей, которые могут вносить дополнительный вклад в протуморигенную передачу сигналов.
С другой стороны, как только опухоль образуется, имеется достаточно доказательств того, что опухолевым клеткам требуется повышенный уровень аутофагии, чтобы выжить под воздействием стрессоров, обнаруженных внутри опухоли и во время метастатического процесса [32]. Действительно, было показано, что аутофагия способствует выживанию раковых клеток в условиях гипоксии [33, 34], недостатка питательных веществ [35] и анойкиса [36], что указывает на важность этого процесса для выживания опухолевой клетки перед воздействием стрессоров, которым она подвержена. подвергается воздействию и предполагает потенциальное использование для лечения рака в сочетании с ингибиторами аутофагии.Также было показано, что аутофагия является путем выживания клеток, активируемым во время химиотерапии, лучевой терапии и таргетной терапии [37], что позволяет предположить многообещающие результаты клинических испытаний с использованием ингибиторов аутофагии хлорохина или гидроксихлорохина в сочетании с другими методами лечения при различных типах рака [11]. . Кроме того, аутофагия участвует в развитии устойчивости к терапии [1, 38, 39], что дополнительно поддерживает использование фармакологических ингибиторов аутофагии в сочетании с традиционной химиотерапией или у пациентов, которые рецидивируют.Это последнее свидетельство также согласуется с предположением, что аутофагия является важным процессом для поддержания раковых стволовых клеток [40–43]. Тем не менее, сенсибилизация к терапии ингибиторами аутофагии может зависеть от типа клеток или лечения [44, 45] и даже может проявлять антагонистические эффекты при химиотерапии в зависимости от типа клеток [45]. В отличие от предыдущих доказательств, которые предполагают потенциальное использование ингибирования аутофагии в терапии рака, также было показано, что ингибирование аутофагии в раковых клетках, обработанных радиацией [46] или иммуногенной химиотерапией [47], может ослабить индуцированный терапией противоопухолевый иммунный ответ. .Кроме того, есть доказательства того, что ингибирование аутофагии само по себе способствует переходу эпителия в мезенхиму в раковых клетках [48]. Таким образом, остается неясным, следует ли нацеливать аутофагию во время терапии рака при каждом типе рака или с какими методами лечения ее следует использовать в сочетании.
Что касается типа раковых клеток, на которые должна быть нацелена аутофагия, было показано, что раковые клетки с определенным онкогенным фоном могут быть особенно чувствительны к ингибированию аутофагии даже в условиях, богатых питательными веществами.Итак, клетки с активирующими мутациями в пути MAPK были предложены как «зависимые» от аутофагии, поскольку они демонстрируют высокий уровень аутофагии в базальных, богатых питательными веществами условиях и зависят от этого пути для выживания [49, 50]. Таким образом, ингибирование аутофагии для лечения рака кажется многообещающим для лечения опухолей с активирующими мутациями в KRAS или его последующих мишенях, таких как BRAF, таких как легкое [25, 51], поджелудочная железа [52], опухоли мозга [53] или меланома [ 54].
Важно отметить, что некоторые из опосредованных аутофагией эффектов, наблюдаемых во время лечения рака, по-видимому, включают активацию или модуляцию противоопухолевого иммунного ответа [24, 55, 56].Более того, некоторые из протуморигенных эффектов аутофагии, по-видимому, требуют высвобождения регулируемых аутофагией секретируемых факторов, которые могут действовать аутокринным или паракринным образом в раковых клетках [40, 57]. Таким образом, точное понимание секретируемых факторов, регулируемых аутофагией, предоставит важные знания о влиянии аутофагии на опухолевые клетки, а также о регуляции опухолевого микроокружения компетентными в отношении аутофагии или дефицитными по аутофагией опухолевыми клетками.
4. Обычные и нетрадиционные пути секреции белков
Секреция клеток — это фундаментальный физиологический процесс, который доставляет растворимые белки и грузы во внеклеточное пространство.Необходимость изгнания веществ из клетки служит различным целям, включая рост клеток, гомеостаз, цитокинез, защиту, гормональное высвобождение и нейротрансмиссию [58]. У эукариот классическая секреция, также известная как обычный путь секреции, включает высвобождение или экзоцитоз запасающих везикул или секреторных гранул во внеклеточное пространство [58]. Во время этого процесса вновь синтезированные белки перемещаются в просвет эндоплазматического ретикулума (ЭПР). Белки, секретируемые классической секрецией, содержат в своей последовательности характерный пептид с одной или несколькими положительно заряженными аминокислотами на их аминоконцевых концах, за которыми следуют 6–12 гидрофобных остатков [59].Сигнальная последовательность инициирует транспорт растущего полипептида через мембрану ER в просвет ER. Обычно классически секретируемые белки синтезируются как предшественники белков, а последовательность N-концевого сигнального пептида отщепляется от белка, когда полипептидная цепь растет в рибосоме [59]. Затем белки олигомеризуются и упаковываются в везикулы-носители, которые выходят из ER в специализированных областях. Везикулы собираются в промежуточные звенья везикулотубулярной структуры, известные как промежуточные компартменты ER-to-Golgi, которые сортируют белки для дальнейшего антероградного потока в комплекс Golgi.В системе Гольджи белки гликозилированы для обеспечения правильной структуры белка и повышенной стабильности, а также для взаимодействия с белками-мишенями. В сети транс-Гольджи секреторные белки сортируются в секреторные пузырьки, которые доставляют свое содержимое к плазматической мембране, что приводит к секреции [60]. Важно, что интегральные белки плазматической мембраны доставляются и интегрируются в плазматическую мембрану посредством слияния мембран одним и тем же путем доставки [58].
Секреторные везикулы и секреторные гранулы являются отдельными везикулярными носителями, используемыми в конститутивной и регулируемой секреции соответственно.В то время как конститутивная секреция постоянно происходит в каждой эукариотической клетке, регулируемая секреция дополнительно присутствует в особых типах клеток животных, таких как эндокринные и экзокринные клетки и нейроны, и запускается исключительно внеклеточными стимулами [58]. Примеры регулируемой секреции включают секрецию инсулина эндокринными клетками поджелудочной железы β , секрецию зимогена экзокринными клетками поджелудочной железы для переваривания пищи, секрецию гормона роста клетками гипофиза и высвобождение нейротрансмиттеров в синапсе [58].Хотя было идентифицировано, что многие секретируемые белки высвобождаются обычным путем, многие другие растворимые белки, которые секретируются во внеклеточное пространство, не имеют типичного сигнального пептида и секретируются, не вступая в обычный путь секреции белка ER-to-Golgi.
5. Аутофагия и нетрадиционная секреция белков
Аутофагия недавно была связана с секрецией белков из разных клеток. В связи с этим известно, что многие белки, секретируемые нетрадиционным путем, регулируются аутофагией, или на их высвобождение влияет нокдаун белков ATG.Здесь мы рассмотрим белки, секреция которых, как было показано, регулируется аутофагией (рис. 2, таблица 1), и позже обсудим последствия модуляции аутофагии в секреции белков для прогрессирования и лечения рака. Важно отметить, что термин «секреторная аутофагия» используется для описания процесса, в котором канонический аутофагический путь принимает участие в секреции белков, транспортируя их в аутофагосоме непосредственно к плазматической мембране, в MVB (мультивезикулярные тельца) или в секреторные лизосомы. для их внеклеточного высвобождения.Таким образом, вместо того, чтобы вызывать деградацию аутофагосомного груза, секреторная аутофагия приводит к изгнанию содержимого аутофагосом во внеклеточное пространство и положительно влияет на секрецию белка, поскольку ингибирование аутофагии снижает секрецию белка (Таблица 1). Для этого пути необходимы специфические рецепторы груза, а также специфические везикулярные слитые белки SNARE. С другой стороны, был описан другой путь, в котором ингибирование аутофагии приводит к изменениям в секреции белка, особенно к увеличению продукции цитокинов в иммунных клетках.В этом случае аутофагия оказывает негативное влияние на секрецию белка, поскольку ингибирование аутофагии увеличивает секрецию белка (таблица 1), и было предложено, что этот эффект опосредован увеличением количества активных форм кислорода в митохондриях (АФК), вызванным снижением митофагии. В следующих разделах мы обсуждаем белки, секреция которых, как известно, модулируется аутофагическим путем, либо потому, что они высвобождаются посредством секреторной аутофагии, либо потому, что ингибирование аутофагии регулирует их секрецию, поскольку на оба пути влияет модуляция аутофагии для противораковая терапия.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6. Секреторная аутофагия
Одно из первых свидетельств того, что аутофагия участвует в секреции белков, было получено в исследованиях на мышиной модели болезни Хрона, a сложное воспалительное заболевание кишечника, при котором ATG16L1 является одним из многих известных аллелей риска у пациентов [61].Так, у кишечных гипоморфных мышей ATG16L1 и кишечных Atg5 — / — дефицит аутофагии в основном затрагивал клетки Панета в кишечном эпителии. Эти клетки, нормальной функцией которых является секретирование как лизоцима, так и антимикробных пептидов, представляют собой дезорганизованные или уменьшенные лизоцим-содержащие гранулы и повышенное диффузное внутрицитоплазматическое окрашивание лизоцима [61]. Таким образом, было показано, что процесс аутофагии играет важную роль в поддержании пути экзоцитоза гранул в клетках Панета.Совсем недавно было обнаружено, что лизоцим локализован в аутофагосомах (двойные мембраны, везикулы LC3 + / p62 — ) инфицированных S. typhimurium клеток Панета. Эти аутофагосомы не были нацелены на лизосомную деградацию, но накапливались на апикальной поверхности клеток Панета для секреции лизоцима, что указывает на важную роль аутофагии в секреции этого антимикробного белка [62]. В этой работе секреция лизоцима была нарушена в кишечных криптах S.typhimurium -инфицированные мыши, получавшие 3MA, или мыши, мутантные по Atg16L1 T300A , что нарушало аутофагию, но не лечением хлорохином, что указывает на важную роль для начальных этапов аутофагического пути, но не для стадии деградации аутофагии. секреция этого белка. Секреторная аутофагия была вызвана стрессом ER и зависела от Myd88, адаптера toll-подобного рецептора (TLR), но, в частности, от дендритных клеток. Обработка мышей Myd88 — / — рекомбинантным IL-22 восстановила секреторную аутофагию лизоцима в клетках Панета, что указывает на то, что секреторная аутофагия клеток Панета требует активации дендритных клеток для обеспечения секреции при стрессе ER в клетках Панета.Поскольку клетки Панета представляют собой специализированные кишечные клетки, которые секретируют антимикробные белки, в том числе лизоцим, и поскольку патогенные микробы могут вызывать стресс ER (эндоплазматический ретикулум), который мешает секреции белка, авторы предполагают, что во время инфекции S. typhimurium индуцируется аутофагия в Панете. клетки, в которых секреция лизоцима перенаправляется на альтернативный путь секреции, который включает транспорт лизоцима внутри специализированной секреторной аутофагосомы, которая не является мишенью для деградации (поскольку он был отрицательным для p62, который нацелен на белки, разлагаемые аутофагией), сохраняя антимикробный функция клеток Панета [62].
Было проведено больше механистических исследований роли секреторной аутофагии в высвобождении IL-1 β из клеток млекопитающих. У этого провоспалительного цитокина отсутствует пептид ER-локализации, он накапливается в цитозоле в неактивной форме и позже активируется расщеплением каспазой-1 для секреции нетрадиционным путем, который включает активацию инфламмасом и аутофагию [63–65]. Таким образом, индукция аутофагии голоданием в ответ на обычные агонисты инфламмасомы NLRP3, как было показано, приводит к усилению секреции IL-1 β в LPS-стимулированных макрофагах [64], а опосредованная аутофагией секреция зависит от компонентов воспаления ASC и NLRP3.В соответствии с предыдущим наблюдением, другие инфламмасомы-зависимые цитокины, такие как IL-18, также показали усиленную секрецию после индукции аутофагии [64]. Важно отметить, что в том же исследовании было обнаружено, что IL-1 β колокализируется с Rab8a и LC3, и секреция IL-1 β была снижена посредством Cre-опосредованного иссечения Atg5 за счет лизосомного ингибирования аутофагии с помощью бафиломицина A или с помощью Rab8a (регулятор поляризованной сортировки на плазматической мембране) или GRASP55 (связанный с Гольджи белок, необходимый для нетрадиционной секреции), нокдаун.Также было обнаружено, что катепсин B секретируется вместе с субстратами инфламмасом. Указанные данные свидетельствуют о модели, в которой аутофагосомы играют прямую роль в доставке белков, активированных инфламмасомами, к плазматической мембране и указывают на положительную роль катепсина B в активации IL-1 β и внеклеточной доставке посредством аутофагии.
Важно отметить, что специализированные секреторные аутофагосомы, участвующие в секреции IL-1 β или ферритина, уже идентифицированы [66].В этой работе при повреждении лизосом TRIM16 вместе с галектином-8 действовал как рецептор для IL-1 β , направляя его на LC3II-положительные аутофагосомы. Слияние с плазматической мембраной зависело от Sec22b на аутофагосоме и от SNAP23 / 29 и STX 3/4 на плазматической мембране. Важно отметить, что секреция IL-1 β не зависела от STX17 (SNARE, участвующего в слиянии с лизосомой), что позволяет предположить, что секреторная аутофагия использует специализированные «секреторные» аутофагосомы, которые в конечном итоге сливаются с плазматической мембраной и которые предотвращают деградацию грузов в лизосомы [66].
В дрожжевых клетках идентифицирован еще один белок, секреция которого зависит от аутофагии [67, 68]. Связывающий ацилкофермент А белок, Acb1, представляет собой секретируемый белок, лишенный последовательности ER-локализации, участвующей в споруляции дрожжей в ответ на азотное голодание. Было обнаружено, что секреция Acb1 не зависит от обычного секреторного пути, зависит от присутствия генов и белков ATG на Grh2 (GRASP), а также индуцируется обработкой рапамицином [67, 68]. Интересно, что секреция Acb1 не требует слияния с вакуолью и требует компонентов мультивезикулярного эндосомного компартмента тела, указывая тем самым, что Acb1-содержащие аутофагосомы обходят слияние и вместо этого они сливаются с эндосомами или MVBs на пути к плазматической мембране [68].Дрожжевые мутанты, которые не смогли секретировать Acb1, показали аналогичные уровни внутриклеточного белка Acb1 и были недостаточны в его секреции, но не в его процессинге, что указывает на то, что описанный путь был секрецией белка, а не путем деградации [67].
Секреция, опосредованная аутофагией, также связана с основными нейродегенеративными заболеваниями. При болезни Паркинсона (БП), когда и протеасома, и аутофагия участвуют в деградации агрегатов α -синуклеина, аутофагия также связана с секрецией α -синуклеина, что указывает на его потенциальную роль в межнейрональной передаче α -синуклеин и PD [69, 70].В связи с этим, в модели PD, включающей сверхэкспрессию склонного к агрегации α -синуклеина и TPPP / p25a, белка, связывающего микротрубочки, участвующего в формировании α -синуклеинового агрегата, α -синуклеин был локализован в аутофагосомы, поскольку они колокализованы с маркерами аутофагии LC3 и p62 / SQSTM1, но эти аутофагосомы не сливаются с лизосомами. Это исследование показало, что TPPP / p25a нарушает аутофагический поток на уровне лизосомного слияния и индуцирует секрецию α -синуклеина, аналогично лечению ингибитором аутофагического потока.Важно отметить, что секреция α -синуклеина снижалась при нокдауне ATG5 [69]. В аналогичном исследовании в различных моделях БП нейронов, сверхэкспрессирующих α -синуклеин, лизосомное ингибирование увеличивало секрецию α -синуклеина и его локализацию в LC3II- и p62 / SQSTM1-положительных внеклеточных везикулах [70]. Другими белками, обнаруженными во внеклеточных везикулах нейронов, обработанных бафиломицином, были VPS35, ATP6V1A и LAMP2 [70]. Оба исследования предполагают важную роль образования аутофагосом и слияния аутофагосом с лизосомами в регуляции секреции внеклеточных везикул.Таким образом, хотя образование аутофагосом может напрямую доставлять содержимое к мультивезикулярному телу, а также к лизосомам, ингибирование аутофагического потока с помощью лизосомных ингибиторов может способствовать усиленной доставке аутофагосомного материала к везикулам и их внеклеточному высвобождению.
Аутофагия также была тесно связана с болезнью Альцгеймера (БА). Патология головного мозга при БА включает образование внутриклеточного пептида бета-амилоида (A β ) и агрегатов тау-белка, а также внеклеточных бляшек A β [71, 72].Нарушение аутофагического потока было описано в нейронах мышей с БА, а аутофагосомы были связаны с генерацией пептида A β [71]. В соответствии с нарушением аутофагического потока при запущенной AD, индукция аутофагии рапамицином снижает внутриклеточное накопление A β и нагрузку на внеклеточные бляшки и предотвращает дефицит обучения и памяти в модели БА у мышей, но только при профилактическом введении, а не у мышей с установленными бляшками. и клубки [73].Более того, трансгенные мыши, трансгенные по белку-предшественнику амилоида с условным нокаутом Atg7 в возбуждающих нейронах переднего мозга, резко накапливали внутриклеточный A β и демонстрировали снижение образования внеклеточных бляшек A β из-за нарушения секреции A β [72]. В целом, эти данные подчеркивают важность аутофагии для поддержания нейронального гомеостаза, но могут способствовать патологии БА, способствуя образованию внеклеточных бляшек A β .
Несколько исследований также связали аутофагический путь с высвобождением секреторных лизосом в физиологических условиях. Напр., Связанные с аутофагией белки, как было показано, опосредуют образование взъерошенных границ остеокластов и их секреторную функцию, направляя секреторные лизосомы к плазматической мембране для слияния и секреции катепсина К [74]. Кроме того, было обнаружено, что секреторные гранулы тучных клеток представляют собой LC3II + и CD63 + (маркер секреторных лизосом), и было обнаружено, что аутофагия играет решающую роль в дегрануляции тучных клеток и высвобождении гистамина и β . -гексозаминидаза [75].
В заключение, секреторная аутофагия включает образование специализированной аутофагосомы (LC3II + , двухмембранная структура), которая изолирует цитоплазматический груз для секреции вместо деградации. Точное понимание того, как секреторные лизосомы обходят слияние с лизосомами, чтобы избежать деградации, еще предстоит описать. Открытие специализированных рецепторов и слитых белков, которые опосредуют секрецию, которые позволяют модулировать этот секреторный путь, вероятно, будет иметь значение в патологической обстановке.
7. Повышенная секреция белка, вызванная ингибированием аутофагии
В отличие от предыдущих исследований, в которых индукция аутофагии приводит к усиленной секреции белков, другие исследования сообщают об обратном: фармакологическое или генетическое ингибирование аутофагии вызывает увеличение секреции белка. разнообразных белков, особенно провоспалительных цитокинов. Особый интерес представляет случай IL-1 β , поскольку мы ранее упоминали исследования, в которых индукция аутофагии голоданием в ответ на обычные агонисты инфламмасомы NLRP3 увеличивала секрецию IL-1 β в LPS-активированных макрофагах [64, 65] .В этом отношении также был описан противоположный эффект: усиленная секреция IL-1 β также была описана после ингибирования аутофагии, также в макрофагах, стимулированных LPS. Первое сообщение, связывающее аутофагический путь с секрецией IL-1 β , было получено от Saitoh et al. в 2008 г. [63]. В этом исследовании авторы обнаружили, что макрофаги с дефицитом Atg16L1 показали повышенную секрецию IL-1 β , но не других провоспалительных белков (IL-6, TNF α и IFN β ) в культуральную среду после LPS. стимуляция [63].В этом исследовании дефицит Atg16L1 вызывал накопление АФК после воздействия ЛПС, а также активацию каспазы-1 и расщепление IL-1 β [63]. Хотя точный механизм, с помощью которого продукция АФК индуцировала активацию инфламмасомы, не был полностью описан в этой работе, другая группа также описала повышенную секрецию IL-1 β и IL-18, но не секрецию TNF, после ингибирования аутофагии с нокаутом. of Карта 1lc3b или Becn1 в LPS-активированных макрофагах [76].В этой работе Nakahira et al. показали, что активация инфламмасом, вызванная ингибированием аутофагии в LPS-обработанных макрофагах, зависит от присутствия повышенных митохондриальных ROS, снижения потенциала митохондриальной мембраны и высвобождения мтДНК (митохондриальной ДНК) в цитозоль [76]. Авторы также показали, что митохондриальные АФК активируют инфламмасому NLRP3, и эта активация необходима для высвобождения мтДНК в цитоплазму, поскольку она не происходит в макрофагах с дефицитом NLRP3. Попадая в цитоплазму, мтДНК активировала инфламмасому AIM2, что индуцировало секрецию IL-1 β и IL-18 [76].В соответствии с предыдущими наблюдениями Harris et al. описали ROS-зависимую секрецию IL-1 β после фармакологического ингибирования аутофагии с помощью 3MA или нокдауна беклин1 в LPS-активированных макрофагах [77]. Важно отметить, что фармакологическое ингибирование аутофагии с помощью 3MA не влияет на секрецию IL-6, IL-18 или TNF α . Авторы наблюдали совместную локализацию IL-1 β с аутофагосомами, окрашенными GFP-LC3, которые они интерпретируют как про-IL-1 β , разлагаемые аутофагосомами.В той же работе авторы показали, что лечение рапамицином снижает секрецию IL-1 β у мышей, которым вводили LPS, указывая на то, что не только ингибирование аутофагии индуцировало секрецию IL-1 β , но и его индукция уменьшала ее [ 77].
В этом отношении было показано, что окисленная мтДНК является важным активатором инфламмасомы NLRP3 [65]. Инфламмасома NLRP3 представляет собой сенсор специфических молекул патогена, хозяина и окружающей среды, опасного для окружающей среды, который требует начального праймингового сигнала, обычно индуцируемого стимуляцией TLR, необходимого для индукции транскрипции NLRP3 и про-IL-1 β .При праймировании стимуляция функционального NLRP3 может быть вызвана серией триггеров [78]. Что касается индуцированной ЛПС секреции IL-1 β , вызванной ингибированием аутофагии, окисление мтДНК, вызванное накоплением поврежденных митохондрий из-за снижения митофагии, может быть вторым сигналом для активации инфламмасом и увеличения секреции IL-1 β . Хотя обе работы, описывающие роль аутофагии в секреции IL-1 β , кажутся противоречивыми, важно отметить, что в первом случае [64] Dupont et al.использовали обычные агонисты инфламмасомы в качестве нигерицина для активации инфламмасомы, тогда как во втором случае [63] Saitoh et al. использовали ингибирование аутофагии в качестве второго сигнала для активации инфламмасом. Авторы также предположили, что различия могут быть связаны с ингибированием базального голодания по сравнению с аутофагией, индуцированной ингибитором mTOR [64, 79].
Совсем недавно подобный механизм, при котором ингибирование аутофагии увеличивает секрецию провоспалительного цитокина, был описан для фактора ингибирования миграции макрофагов (MIF) из LPS-активированных макрофагов.В этой работе ингибирование аутофагии с помощью 3MA, Atg5 siRNA или Atg7 нокаут увеличивало секрецию MIF в культуральную среду. Эта секреция происходила вместе с увеличением митохондриальных АФК и могла быть уменьшена с помощью антиоксидантов [80]. Важность противовоспалительной роли аутофагии была продемонстрирована in vivo , поскольку дефицит Atg16L1 увеличивал продукцию IL-1 β и IL-18 в модели химически индуцированного колита у мышей [63] и у мышей. модели сепсиса, где отсутствие аутофагии вызывало большую восприимчивость к эндотоксемии с повышенными уровнями IL-1 β и IL-18 в сыворотке [76].
8. Аутофагия и ее взаимодействие с системой везикулярного обмена
Аутофагия взаимодействует на разных уровнях с эндолизосомным, а также с экзосомным биогенезом и аппаратом секреции как в нормальных, так и в раковых клетках [81, 82]. Деградационные аутофагосомы могут сливаться с MVB, давая начало амфисомам, которые позже сливаются с лизосомами для их деградации. Это слияние зависит от RAB11 [83], тогда как RAB27a ассоциировано со слиянием MVB с плазматической мембраной [81].Кроме того, поскольку слияние MVBs с плазматической мембраной приводит к внеклеточному высвобождению экзосом, индукция аутофагии голоданием, как было показано, снижает секрецию экзосом, направляя MVBs на аутофаго-лизосомный путь для их деградации [83].
Было высказано предположение, что различные механизмы аутофагии (макроаутофагия и микроаутофагия) играют важную роль в доставке груза к пузырькам эндосомальной / экзосомальной системы. Было показано, что ингибирование аутофагии снижает количество цитозольных белков в поздних эндосомах, которые являются компонентами MVB, которые могут быть нацелены на деградацию или высвобождены в виде экзосом.С другой стороны, было обнаружено, что цитозольные белки, такие как GAPDH, секретируются в экзосомы даже в отсутствие аутофагии, что указывает на то, что макроаутофагия лишь частично способствует доставке цитоплазматических белков к поздним эндосомам и что в отсутствие аутофагии грузовые белки могут переноситься другим путем [84].
Таким образом, было высказано предположение, что специализированная форма аутофагии играет основную роль в загрузке экзосомного груза. Селективное включение белков во время биогенеза экзосом и механизмы инвагинации, происходящие во время созревания MVB, предположительно включают тип эндосомной микроаутофагии [84, 85].Микроаутофагия — это тип аутофагии, характерный для дрожжей, который включает прямую интернализацию цитозольного груза через инвагинации лизосомальной мембраны [84]. Таким образом, было высказано предположение, что специализированный тип микроаутофагии, эндосомная микроаутофагия, происходящий в поздних эндосомных MVBs, ответственен за доставку цитозольных белков к везикулам. Было показано, что этот процесс опосредуется шапероном hsc70 и системами ESCRT [84]. Эта эндосомная микроаутофагия представляет собой процесс, посредством которого аутофагия способствует секреции цитозольных белков, но, по-видимому, отличается от секреторной аутофагии, поскольку включает прямую доставку цитозольных белков к поздним эндосомам и не зависит от белков ATG, которые участвуют в макроаутофагии, но не в микроаутофагии. .С другой стороны, доставка белков к MVB во время секреторной аутофагии требует их транспорта в аутофагосоме и прямого взаимодействия с MVB, как было показано для Acb1 [67, 68], IL-1 β [64], α -синуклеин [69, 70] и аннексин А2 [86].
Экзосомы характеризуются присутствием белков, участвующих в их биогенезе, таких как Alix, TSG101, HSP70 и тетраспанины, а также белков, специфичных для клеточного типа, ДНК, РНК и липидов [81]. В связи с этим недавно было описано важное взаимодействие аутофагического аппарата с Alix, белком, ассоциированным с ESCRT [87].ATG12 и ATG3 являются основными компонентами аутофагии, и их конъюгация (ATG12-ATG3), как было показано, необходима для базовой, но не вызванной голоданием аутофагии. Это взаимодействие также необходимо для переноса из поздних эндосом в лизосомы и для биогенеза лизосом [87].
9. Секреция, опосредованная аутофагией при раке
Известно, что секретируемые белки играют важную роль в поддержании признаков рака [88]. В связи с этим известно, что аутокринная или паракринная передача сигналов в раковых клетках поддерживает чрезмерную пролиферацию, снижение апоптоза, регуляцию иммунных клеток, ангиогенез, изменения энергетического метаболизма и развитие устойчивости к терапии рака [3, 59].
Было показано, что при раке регуляция аутофагии оказывает важное влияние на секрецию белка. Возможно, первое доказательство того, что аутофагия может регулировать секрецию в условиях, связанных с раком, было получено из исследования индуцированного онкогеном (Ras-) старения фибробластов человека [89]. Клеточное старение — это состояние стабильной остановки клеточного цикла, которое может работать как отказоустойчивая программа в ответ на различные нарушения во время трансформации. В этой работе аутофагия активируется во время старения и отвечает за связанную со старением секрецию IL-6 и IL-8 посредством посттрансляционного механизма, поскольку уровни мРНК IL-6 и 8 были выше в Atg 5/7. нокдаун клеток [89].Механически было предположено, что во время индуцированного онкогеном старения грубая эндоплазматическая сеть и аутофагические вакуоли колокализуются с mTOR в сети транс-Гольджи в области, называемой компартментом пространственного взаимодействия TOR-аутофагии, TASCC [90]. Локализация mTOR в этом комплексе ответственна за синтез IL-6/8. В этой работе истощение аминокислот или доминантно отрицательная экспрессия Rab-GTPases снижали рекрутирование mTOR в TASCC. Авторы предположили, что во время индуцированного онкогеном старения пространственное соединение катаболических (аутофагических вакуолей) клеток с анаболическим (mTOR, ER, Golgi) механизмом усиливает их соответствующие функции и способствует массовому синтезу секреторных белков, таких как IL-6/8 [ 90].Важно отметить, что образование TASCC зависело от brefeldin A [90], который блокирует транспорт ER к белкам Гольджи, указывая на необходимость функционального обычного пути для этого секреторного фенотипа.
В аналогичной работе Lock et al. [57] описали опосредованную аутофагией секрецию протуморигенных факторов в модели инвазивного рака молочной железы, управляемой RAS. В этом исследовании аутофагия была необходима для инвазивности и перехода от эпителия к мезенхиме в RAS-трансформированных клетках рака молочной железы MCF10A, а также была необходима для секреции проинвазивных факторов, таких как IL-6, матриксные металлопротеиназы 2 и 9 и WNT5A [57 ].Кроме того, в соответствии с провоспалительной ролью аутофагии, недавняя работа также описала зависимое от аутофагии воспаление (повышенная секреция CSF3 / G-CSF, CXCL1, IL-6, TREM1, CCL2, CCL3 / MIP-1 α , IL-1 β и CXCL2) в ответ на УФ-В излучение до туморогенеза. Секреция этих цитокинов у мышей, облученных УФ-В, блокировалась условным Atg7 КО в коже [91].
Напротив, хотя большинство доказательств показывает, что аутофагия необходима для секреции провоспалительных цитокинов, таких как IL-6, есть также данные, показывающие, что ингибирование аутофагии путем нокдауна генов ATG снижает секрецию IL-6 при аутофагии. -зависимые клеточные линии рака молочной железы, но увеличивают его секрецию в независимых от аутофагии клетках [40].Это было связано с поддержанием раковых стволовых клеток, поскольку добавление IL-6 увеличивало образование маммосферы в ATG7 shRNA-экспрессирующих клетках и было связано с зависимостью от аутофагии для выживания [45]. Таким образом, то, выполняет ли аутофагия провоспалительную или противовоспалительную функцию, по-видимому, зависит от контекста и типа клеток.
Что касается противовоспалительной роли аутофагии, на мышиной модели рака груди Wei et al. [56] обнаружили, что подавление аутофагии с помощью FIP200 — / — снижает инициацию и прогрессирование опухоли молочной железы.Снижение онкогенеза происходило вместе с повышенной продукцией хемокинов в опухолевых клетках и увеличением Т-лимфоцитов CD8 + и CD4 + (Th2) Т-лимфоцитов, продуцирующих IFN γ , в микроокружении опухоли [56]. В том же исследовании у FIP200 — / — , CD8 + Т-лимфоцитов у животных развились опухоли молочной железы с кинетикой, аналогичной аутофаги-компетентным контрольным мышам, что указывает на снижение туморогенеза у FIP200 — / — мышей произошло из-за повышенной секреции хемокинов и стимулирования противоопухолевого иммунного ответа.
Другие исследования связывают ингибирование аутофагии с повышенной секрецией цитокинов опухолевыми клетками. В связи с этим на мышиной модели немелкоклеточного рака легкого (НМРЛ), вызванной Kras , с одновременной делецией Atg7 для подавления аутофагии в опухолях, авторы обнаружили снижение роста опухоли с накоплением дефектных митохондрий. . Важно отметить, что опухоли, управляемые Kras , которые обычно образуют аденомы и карциномы, в отсутствие A tg7 перешли в более доброкачественные онкоцитомы, что указывает на то, что функциональный статус аутофагии определяет судьбу опухоли [51].Несмотря на снижение опухолевой нагрузки, мыши с нулевыми опухолями Atg7 умерли от пневмонии с повышенной воспалительной реакцией. Интересно, что повышенная общая выживаемость в той же модели наблюдалась только тогда, когда p53 был удален вместе с Atg7 , поскольку эти мыши не проявляли обширных воспалительных реакций [51]. Таким образом, специфические мутации, присутствующие в опухоли, могут определять роль ингибирования аутофагии в воспалении, индуцированном опухолевыми клетками. Это будет важным элементом, который следует учитывать при манипулировании аутофагией, поскольку p53 является наиболее частым геном-супрессором опухолей, мутировавшим при раке человека с разнообразными и зависимыми от контекста эффектами на клеточную функцию [92].
Другой белок, секреция которого, как было показано, регулируется аутофагией, — это HMGB1 [64, 93] (белок-иммуномодулятор группы B1 с высокой подвижностью). Следует отметить, что HMGB1 является ядерным белком, который не секретируется в нормальных условиях и не нуждается в процессинге инфламмасомой [64], что указывает на то, что аутофагический процесс модулирует секрецию, регулируя различные клеточные пути. HMGB1 — это иммуногенный стимулятор, который обычно присутствует в ядре клетки и, как считается, высвобождается вместе с другими аларминами во время некротической гибели клеток при разрыве плазматической мембраны [94].В раковых клетках, подвергающихся гибели клеток под действием целевого токсина, нокдаун белков ATG предотвращает высвобождение HMGB1 [93]. Эти находки указывают на то, что уровни аутофагии в умирающей клетке могут определять иммуногенность этого процесса, по крайней мере частично, за счет регуляции секреции HMGB1 [93]. Другой алармин, секреция которого, как предполагается, регулируется аутофагией, — это АТФ [47]. В связи с этим компетентные аутофаги раковые клетки, обработанные иммуногенной химиотерапией, индуцировали секрецию АТФ и терапевтический иммунный ответ, и этот эффект не наблюдался в раковых клетках с дефицитом аутофагии ( Atg5 или Atg7 нокдаун) [47].
В отличие от вышеупомянутых исследований, которые предполагают, что, по крайней мере, при лечении рака с иммуногенным потенциалом, гибель клеток с аутофагией может способствовать лучшему долгосрочному терапевтическому ответу, новые данные свидетельствуют о том, что в других условиях аутофагия могла иметь важна роль в подавлении противоопухолевого иммунного ответа. В связи с этим было показано, что гипоксия, дисбаланс между повышенным потреблением кислорода опухолевыми клетками и недостаточным снабжением кислородом, вызванным пролиферацией раковых клеток и дефектной васкуляризацией опухоли, является важным регулятором адаптации опухолевых клеток к условиям с низким содержанием кислорода, которые могут изменить форму. опухоли, а также их микроокружение [95].Эти ответы, как известно, опосредуются факторами, индуцируемыми гипоксией (HIF), факторами транскрипции, которые опосредуют сети экспрессии генов, связанные с характеристиками злокачественности, включая индукцию аутофагии [95]. Аутофагия, вызванная гипоксией, связана с резистентностью к терапии [96] и предотвращением разрушения иммунной системы [97]. Что касается последнего, было показано, что HIF-1 α может индуцировать экспрессию PD-L1 (лиганд-1 программируемой гибели клеток), чтобы избежать распознавания цитолитических Т-лимфоцитов (CTL) [95], а также BNIP3 / BNIP3L, который индуцирует аутофагия, связанная с развитием устойчивости к лизису, опосредованному CTL.В связи с этим фармакологическое или генетическое ингибирование аутофагии, вызванной гипоксией, снижает фосфорилирование STAT3 в гипоксических опухолевых клетках и восстанавливает восприимчивость опухолевых клеток к CTL-опосредованному лизису [97]. Хотя в этой работе не исследуется взаимосвязь секреции, регулируемой аутофагией, с устойчивостью к лизису клеток, секреция цитокинов, вероятно, играет роль в этом фенотипе, поскольку известно, что STAT3 играет важную роль в регуляции воспаления [98].
Несмотря на возможную связь аутофагии с противоопухолевым иммунным ответом, который мы обсуждали ранее, недавняя работа не обнаружила изменений в противоопухолевом адаптивном иммунитете на мышиных моделях меланомы и рака груди после ингибирования аутофагии с помощью нокдауна гена Atg или с хлорохином / лечение гидроксихлорохином [99].Таким образом, точная роль аутофагии в обеспечении иммуногенности опухолевых клеток еще предстоит установить.
Наконец, несмотря на противоречивые результаты в литературе и контекстно-зависимую роль аутофагии на секрецию белка, важность идентификации секретируемых белков, регулируемых аутофагией, была подтверждена в недавней работе по меланоме [100]. В этой работе опухолевые клетки меланомы с низкой аутофагией обладали секретомом, отличным от их метастатических производных с высокой аутофагией. Клеточные линии меланомы с высокой аутофагией показали более высокие уровни IL-1 β , CXCL8, LIF, FAM3C и DKK3 с известной ролью в воспалении и онкогенезе.Уровни этих белков увеличивались после индукции аутофагии и снижались с подавлением ATG7 в клетках с высокой аутофагией. Авторы обнаружили высокие уровни регулируемых аутофагией секретируемых белков в сыворотке пациентов с высокой аутофагией и предполагают, что сывороточные уровни этих белков могут быть использованы в качестве маркеров уровней аутофагии в опухолевых клетках, на которые могут быть нацелены ингибиторы аутофагии [100].
10. Обсуждение
Данные свидетельствуют о том, что то, играет ли аутофагия противовоспалительную или воспалительную роль при раке, по-видимому, зависит от стадии онкогенеза, типа рака и изучаемого секретируемого фактора.Важно отметить, что аутофагия связана с секрецией белков, высвобождение которых регулируется как традиционными, так и нетрадиционными путями, а аутофагосомы также тесно связаны с эндосомно-везикулярным путем, что указывает на то, что они могут играть различные или даже противоположные роли в секреции белков в зависимости от в клеточном контексте.
Действительно, аутофагия играет важную роль в регуляции секреции белка в некоторых типах клеток. Механически описаны два основных пути секреции, опосредованные аутофагией.Первый из них, секреторная аутофагия [13], включает остановку аутофагического потока, при котором аутофагосомы не сливаются с лизосомами, а аутофагосомы, содержащие груз, направляются на плазматическую мембрану или в мультивезикулярные тельца для секреции, как было описано для Acb1 [67 , 68], лизоцим [62], IL-1 β [64, 66] и α -синуклеин [69, 70]. Важными медиаторами этого пути являются белки, необходимые для слияния плазматической мембраны, такие как Rab8 α [64, 69], Sec22b, SNAP23 / 29 и STX3 / 4 [66]; отсутствие STX17 [66], необходимого для слияния с лизосомами и белками GRASP [64, 67]; и, возможно, пероксисомальная передача сигналов [61, 67] (Рисунок 2).Во втором пути аутофагия, по-видимому, служит антиоксидантным механизмом, уменьшая поврежденные митохондрии (рис. 2). В этом случае ингибирование аутофагии увеличило бы митохондрии, которые в противном случае были бы разрушены. Цитоплазматическая мтДНК, протекающая из митохондрий с низким межмембранным потенциалом, может затем активировать инфламмасому, как было предложено для секреции провоспалительных цитокинов, таких как IL-1 β , IL-18 [63, 76, 77] или MIF [80]. Если существует конкретный регулируемый аутофагией путь для каждого из описанных секретируемых белков, существуют ли специфические маркеры для вовлеченных везикул или если упоминается комбинация обоих путей, как было предложено для IL-1 β [ 64], еще предстоит определить.
Таким образом, будет важно установить, как аутофагия регулирует секрецию раковых клеток, если эта регуляция аналогична регуляции, наблюдаемой в нетрансформированных клетках, при каких типах рака или стадии рака аутофагия регулирует секрецию, а также является ли она протуморигенной или иммунной. регулирующие факторы модулируются аутофагией, чтобы лучше воздействовать на аутофагию при лечении рака. Важно отметить, что многие провоспалительные цитокины, регулируемые аутофагией в иммунных клетках, не изучались на моделях ингибирования аутофагии в контексте рака.В связи с этим было показано, что IL-1 β индуцирует переход эпителия в мезенхиму в клетках рака молочной железы [101], а передача сигналов IL-1 связана с воспалением и агрессивностью из-за модуляции противоопухолевого иммунитета у одного и того же типа клеток. рак [102]. Кроме того, было обнаружено, что MIF, секреция которого увеличивается после ингибирования аутофагии [80], повышается при различных типах рака человека и, как известно, способствует онкогенезу за счет стимуляции пролиферации, ангиогенеза, метастазирования и ингибирования противоопухолевый иммунный ответ [103].Это будет важным фактором для оценки в клинических испытаниях, в которых в настоящее время используется ингибирование аутофагии для лечения нескольких типов рака, особенно тех типов рака, где противоопухолевый иммунный ответ играет важную роль в реакции пациента.
Важно отметить, что некоторые из белков, которые были идентифицированы как регулируемые аутофагией при раке, например, IL-6 и 8, секретируются обычным путем секреции белков, и их секреция тесно связана с их транскрипцией, что подчеркивает важность понимание взаимосвязи аутофагического пути с обычными путями секреции белка, а также с регуляцией их факторов транскрипции, таких как NF- κ B или STAT3, чтобы установить, как манипуляции с аутофагией во время терапии рака могут влиять на микросреду опухоли.В этом отношении было показано, что как IL-6, так и IL-8 играют важную роль в поддержании онкогенной передачи сигналов в раковых клетках, в обеспечении поддержания раковых стволовых клеток [104–106] и в регуляции микроокружения опухоли [107]. Поскольку было показано, что ингибирование аутофагии снижает секрецию ИЛ-6 и 8, ингибирование аутофагии во время терапии рака уменьшало бы их секрецию в раковых клетках. Тем не менее, повышенная секреция IL-6 также сообщается для некоторых раковых клеток [40], особенно тех, выживание которых не зависит от аутофагии.Это важное последствие, которое необходимо учитывать в клинических испытаниях, управляющих аутофагией при тех типах рака, где аутофагия не доказала свою важность для выживания раковых клеток. В этих случаях ингибирование аутофагии могло бы вызвать секрецию цитокинов и способствовать онкогенезу, а также избежать противоопухолевого иммунного ответа.
Наконец, поскольку межклеточная коммуникация является важной характеристикой агрессивности опухоли, а внеклеточные везикулы, полученные из опухолевых клеток, передают онкогенные сигналы соседним опухолевым клеткам или клеткам в микросреде опухоли, важно понять, как влияет модуляция аутофагии. содержимое экзосом или высвобождение экзосом из опухолевых клеток или из микроокружения опухоли, поскольку вполне вероятно, что по крайней мере некоторые из эффектов, наблюдаемых при модуляции аутофагии во время терапии рака, особенно у иммунокомпетентных животных, будут опосредованы высвобождением внеклеточных везикул.
Вероятно, что секреция, вызванная модуляцией аутофагии во время терапии рака, будет иметь разные и зависящие от контекста или ткани роли, так же как манипулирование аутофагией для лечения рака или регуляция противоопухолевого иммунного ответа. Тем не менее, поскольку некоторые последствия ингибирования аутофагии могут способствовать развитию злокачественных новообразований или иметь другие нежелательные последствия, важно понять, как аутофагия модулирует секрецию и как манипуляции с аутофагией влияют на секрецию, чтобы эффективно регулировать аутофагию и ее влияние на секрецию. для лечения рака, а также для лечения других заболеваний.
Конфликт интересов
Авторы заявляют, что у них нет конфликта интересов, о котором следует раскрывать.
Благодарности
Эта работа была поддержана следующими проектами Мексиканского института безопасности и социальной защиты населения: FIS / IMSS / PROT / PRIO / 15/049; CTFIS / 1ORD / 012/2011 и от CONACYT: CB-2015-01 258123. ICO было поддержано стипендиями CONACYT (461456) и IMSS (97220054). JRL был поддержан стипендией Fundación IMSS, A.C.
Какие биологические роли играют белки? Labmate Online
Белки — это строительные блоки жизни, обеспечивающие живые организмы структурной основой для роста и процветания.Фактически, слово «белок» происходит от греческого слова «протеос», что означает «самый важный». Каждый белок состоит из аминокислот, связанных пептидами друг с другом, образуя длинную цепь. Хотя эти цепи состоят всего из 20 различных типов аминокислот, одно человеческое тело может экспрессировать сотни тысяч уникальных белков.
Хотите узнать больше о связи между белками и биологической функцией? Читайте дальше, от восстановления тканей до катализаторов метаболических реакций, поскольку мы освещаем некоторые из ключевых ролей, которые белок играет в биологических процессах.
Ремонт и сборка тканей
Белок жизненно важен для биологической функции, поскольку он используется для построения и восстановления тканей. Коллаген — один из важнейших биологических белков, используемых для роста и восстановления кожи, костей, связок и сухожилий. Волокнистые белки, такие как кератин и эластин, также используются для создания прочных каркасов и имеют основополагающее значение для здоровья кожи, ногтей и волос. Эластин — еще один незаменимый белок, позволяющий тканям, таким как легкие, артерии и матка, возвращаться к своей исходной форме после сокращения или растяжения.
Доставка сообщений
Многие ключевые гормоны классифицируются как белки и пептиды, включая инсулин, глюкагон и hGH (гормон роста человека). Эти гормоны, производимые и высвобождаемые эндокринными тканями и железами, перемещаются по крови и доставляют химические сообщения к органам и тканям-мишеням. Например, АДГ (антидиуретический гормон) предписывает почкам удерживать воду, в то время как АКТГ (адренокортикотропный гормон) запускает высвобождение кортизола для регулирования метаболизма и подавления иммунологической реакции организма.
Катализатор метаболических реакций
Ферменты, содержащиеся в клетках, представляют собой белки, запускающие биохимические реакции в организме. Они играют фундаментальную роль в поддержании жизни и помогают организму выполнять повседневные задачи. Ферменты не только помогают организму переваривать пищу и расщеплять крупные молекулы, такие как углеводы и жиры, но также поддерживают другие виды биологической активности, такие как дыхание, свертывание крови и размножение.
Поддержание pH уровней
Регулирование концентраций кислот и оснований — основная роль белков.Например, белок, называемый гемоглобином, активно связывается с кислотами, помогая поддерживать нормальный уровень pH крови человека 7,4. Фосфат — еще один буферный белок, нейтрализующий избыточные ионы водорода, если их уровень слишком высок.
Хотя белки поддерживают жизнь, они также являются основной причиной таких заболеваний, как болезнь Альцгеймера, болезнь Хантингтона и кистозный фиброз. Белки также используются вирусами, такими как SARS-CoV-2, для проникновения в клетки и вызывают опасные для жизни осложнения в легких. Узнайте больше о том, как методы анализа белков нового поколения используются для открытия нового понимания болезни, в статье «Глубокая характеристика и количественный анализ белков и посттрансляционных модификаций — как TIMS расширил возможности MS и продемонстрировал значительный потенциал для улучшения PTM». идентификация и критическое понимание знака.’
Что такое ферменты, поджелудочная железа, пищеварение и функция печени
Что такое ферменты?
Ферменты — это белки, которые помогают ускорить метаболизм или химические реакции в нашем организме. Они создают одни вещества и разрушают другие. Все живые существа имеют ферменты.
Наши тела естественным образом вырабатывают ферменты. Но ферменты также присутствуют в промышленных продуктах и продуктах питания.
Что делают ферменты?
Одна из самых важных функций ферментов — способствовать пищеварению.Пищеварение — это процесс превращения пищи, которую мы едим, в энергию. Например, ферменты есть в нашей слюне, поджелудочной железе, кишечнике и желудке. Они расщепляют жиры, белки и углеводы. Ферменты используют эти питательные вещества для роста и восстановления клеток.
Ферменты также помогают с:
- Дыхание.
- Наращивание мышц.
- Нервная функция.
- Избавляем наш организм от токсинов.
Какие бывают ферменты?
В организме тысячи отдельных ферментов.У каждого типа ферментов есть только одна работа. Например, фермент сахараза расщепляет сахар, называемый сахарозой. Лактаза расщепляет лактозу, разновидность сахара, содержащегося в молочных продуктах.
Некоторые из наиболее распространенных пищеварительных ферментов:
- Карбогидраза расщепляет углеводы на сахара.
- Липаза расщепляет жиры на жирные кислоты.
- Протеаза расщепляет белок на аминокислоты.
Части ферментов
Что входит в состав фермента?
Каждый фермент имеет «активный сайт».«Эта территория имеет уникальную форму. Вещество, над которым работает фермент, является субстратом. Подложка также имеет уникальную форму. Фермент и субстрат должны работать вместе.
Как температура и pH влияют на ферменты?
Для работы ферментов необходимы правильные условия. Если условия неподходящие, ферменты могут изменить форму. Затем они перестают подходить к подложкам, поэтому не работают должным образом.
Каждый фермент имеет идеальную температуру и pH:
.
- pH: Ферменты чувствительны к кислотности и щелочности.Они не работают должным образом, если окружающая среда слишком кислая или щелочная. Например, фермент в желудке, называемый пепсином, расщепляет белки. Если в желудке недостаточно кислоты, пепсин не может функционировать оптимально.
- Температура: Ферменты работают лучше всего при нормальной температуре тела, около 98,6 ° F (37 ° C). При повышении температуры усиливаются ферментативные реакции. Но если температура становится слишком высокой, фермент перестает работать. Вот почему высокая температура может нарушить функции организма.
Общие состояния и расстройства
Какие состояния здоровья могут вызывать проблемы с ферментами?
Нарушения обмена веществ часто являются результатом недостатка определенного фермента. Родители могут передать их своим детям через гены (по наследству). Некоторые примеры наследственных нарушений обмена веществ включают:
- Болезнь Фабри препятствует выработке организмом ферментов (альфа-галактозидаза А), расщепляющих жир (липиды).
- Болезнь Краббе (лейкодистрофия глобоидных клеток) влияет на ферменты, необходимые для защитного покрытия (миелин) нервных клеток (центральная нервная система).
- Болезнь мочи кленового сиропа влияет на ферменты, необходимые для расщепления определенных аминокислот разветвленной цепи.
Другие состояния здоровья, связанные с ферментным дисбалансом, включают:
- Болезнь Крона дисбаланс бактерий в кишечнике (микробиом кишечника) может влиять на аутоиммунный ответ кишечного тракта. Это может сыграть роль в проявлении и тяжести болезни Крона.
- Внешнесекреторная недостаточность поджелудочной железы (EPI) — это состояние, при котором в поджелудочной железе не хватает пищеварительных ферментов.Вы не можете расщеплять пищу или усваивать питательные вещества. Хронический панкреатит, рак поджелудочной железы, диабет или муковисцидоз могут привести к EPI.
- Непереносимость лактозы — это нехватка фермента, необходимого для переваривания сахаров в молоке (лактозе) и молочных продуктах.
Как тесты на ферменты используются для диагностики состояний здоровья?
Ваш лечащий врач может использовать различные анализы крови на ферменты и белки для проверки определенных заболеваний. Например, повышенный уровень ферментов печени может быть признаком заболевания печени.
Уход за ферментами
Нужно ли мне принимать ферментные добавки?
Люди без хронических заболеваний обычно могут получать необходимые ферменты из здорового питания. Но если у вас есть определенные проблемы со здоровьем, ваш лечащий врач может порекомендовать принимать ферментные добавки. Например, многие люди с EPI могут принимать пищеварительный фермент перед едой. Это помогает их телу усваивать питательные вещества из пищи. Поговорите со своим врачом, прежде чем принимать какие-либо ферментные добавки.
Могут ли лекарства влиять на уровень ферментов?
Некоторые лекарства влияют на уровень ферментов. Например, антибиотики могут убить определенные бактерии, необходимые для того, чтобы некоторые ферменты работали наилучшим образом. Это причина того, что антибиотики могут вызвать диарею. Чтобы убить бактерии, вызывающие заболевание, они также уничтожают важные полезные бактерии, которые помогают пищеварению.
Статины (лекарства, снижающие уровень холестерина) могут повышать ферменты печени и мышечные ферменты. Они могут увеличить риск повреждения печени или мышц.
Когда вызывать врача
Когда мне следует обратиться к врачу по поводу проблемы с ферментами?
Вы не узнаете, есть ли у вас проблемы с ферментами, без анализа крови. Обратитесь к врачу, если у вас возникнут какие-либо из следующих проблем:
Записка из клиники Кливленда
Ферменты помогают облегчить биохимические реакции в нашем организме. Они помогают во всем, от дыхания до пищеварения. Слишком мало или слишком много определенного фермента может привести к проблемам со здоровьем.Некоторым людям с хроническими заболеваниями может потребоваться прием ферментных добавок, чтобы помочь своему организму работать должным образом. Принимайте ферментные добавки только под наблюдением врача.
Роль белка в организме, других питательных веществ в разном возрасте
Важные питательные вещества для каждой главы вашей жизни.
МАР. 06, 2019
6 МИН. ЧИТАТЬ
Так же, как ваше тело меняется на каждом этапе жизни, меняется и ваше питание.Учитывайте роль белка в организме. В младенчестве это важная часть роста и развития; в зрелом возрасте белок может помочь вам поддерживать здоровый ИМТ или индекс массы тела. А с возрастом это может помочь вам поддерживать сухие мышцы, необходимые для поддержания активности.
То же самое и с другими питательными веществами, такими как витамины, минералы и некоторые жиры. Исследователи Abbott изучали роль питания с раннего младенчества до позднего взросления, чтобы помочь людям лучше питаться на всех этапах жизни.Если вам интересно, какие питательные вещества вам нужны сейчас и в будущем, эти эксперты поделятся последними выводами науки о питании.
Беременные
Диета женщины во время беременности имеет решающее значение для здоровья матери и ребенка.
- Железо играет важную роль в создании красных кровяных телец, необходимых для доставки кислорода растущему ребенку. Старайтесь употреблять 27 миллиграммов в день и принимайте витамины для беременных по указанию врача.
Найдено в: Темно-листовая зелень, нежирное мясо, орехи, тофу и белая фасоль - Фолат — это витамин B, имеющий решающее значение для роста здоровых клеток и предотвращения аномалий спинного мозга, известных как дефекты нервной трубки. Главное — получить достаточно фолиевой кислоты до зачатия и на протяжении всей беременности.
Найдено в: овощах, включая спаржу, брюссельскую капусту и шпинат - DHA — уникальный жир омега-3, который, как известно, поддерживает оптимальную функцию клеток и когнитивные способности или здоровье мозга.
Найдено в: Продукты питания, включая лосось, тунец, яйца, орехи и продукты, обогащенные DHA.
«Питание во время беременности имеет решающее значение. В утробе матери у растущего ребенка разовьется от 100 до 200 миллиардов клеток мозга», — говорит Мэтью Кучан, доктор философии, ученый-исследователь из Abbott.
Младенчество и детство
Здоровый кишечник — это основа здоровой иммунной системы, поэтому очень важно, чтобы ребенок с самого начала получил строительные блоки.
«Олигосахариды грудного молока (HMOs) питают полезные бактерии в кишечнике, где находится 70 процентов иммунной системы ребенка», — объясняет Рэйчел Бак, доктор философии, ученый Abbott и эксперт в области иммунного здоровья.
- Витамин E, DHA и лютеин — это питательные вещества, которые работают вместе на благо развивающегося мозга и глаз ребенка
Найдено в: a im для получения натурального витамина E из растительных масел, яичных желтков, орехового масла и шпината — он может быть более эффективным, чем синтетические добавки витамина Е [1].Лютеин содержится в яйцах, многих ярких овощах и темно-листовой зелени. - Белок — это часто обсуждаемое питательное вещество, и его ценность для детей не следует упускать из виду. Фактически, каждый седьмой ребенок школьного возраста может не получать белок, необходимый для поддержания его быстро растущего организма и развития иммунной системы [2].
Найдено в: сыр, яйца, нежирное мясо, арахисовое масло, йогурт и напитки PediaSure ®
«В первый год жизни мозг ребенка быстро развивается, ежедневно создавая сотни тысяч нейронных связей — быстрее, чем в любой другой период жизни», — говорит Кучан.«Получение важных питательных веществ важно для поддержки этого быстрого окна физического роста и развития».
Здоровые взрослые
Бегаете ли вы в свой первый марафон или просто пытаетесь поддерживать здоровый ИМТ, правильные питательные вещества могут иметь огромное значение.
«Поскольку мы можем начать естественным образом терять мышечную массу после того, как нам исполнится 40 лет — до 8 процентов общей мышечной массы каждые десять лет — ежедневное получение достаточного количества белка становится еще более важным с возрастом», — объясняет Жаклин Бофф, доктор философии.D., MBA, научный сотрудник Abbott.
- Белок необходим в любом возрасте, независимо от того, пытаетесь ли вы нарастить мышцы, сохранить силу или восстановиться после операции. Старайтесь съедать от 25 до 30 граммов белка при каждом приеме пищи, чтобы поддерживать мышцы и утолять голод.
Найдено в: мясо, бобы, молочные продукты, рыба, орехи, семена, тофу и пищевые напитки, такие как Ensure ® Макс.
- Волокно обычно считается средством, поддерживающим здоровье пищеварительной системы, но грубые корма делают больше, чем просто тренируют кишечник.Продукты, богатые клетчаткой, могут помочь снизить уровень холестерина и управлять массой тела, просто сохраняя чувство сытости. Согласно обзорам в The Lancet потребление клетчатки в рекомендованных количествах также может помочь снизить риск развития диабета 2 типа.
Найдено в: фрукты, овощи, бобы и цельное зерно
Старение Взрослые
Согласно обзорной статье в Age and Aging , каждый третий взрослый старше 50 лет испытывает сильную потерю мышечной массы и силы или саркопению, что может увеличить риск падений и переломов, госпитализации и привести к более медленному выздоровлению от болезни или болезни. операция.
Для стареющих взрослых рекомендуется еще более высокое потребление белка для поддержания мышечной массы и потребностей в силе.
- HMB (бета-гидрокси-бета-метилбутират) — это вещество, которое поддерживает здоровье мышц, и наш организм вырабатывает его, когда мы едим продукты, содержащие белок. Но с возрастом в нашем организме вырабатывается меньше HMB.
Найдено в: HMB трудно получить только из пищи, но его можно получить из других источников, включая некоторые пищевые напитки.
- Кальций , 99 процентов этого минерала, содержится в наших зубах и костях, и он играет решающую роль в поддержании их прочности. С возрастом наши кости теряют часть этого кальция, а также часть своей массы, повышая риск остеопороза и переломов. Вот почему потребность в кальции увеличивается с 1000 до 1200 миллиграммов в день для женщин старше 50 и мужчин старше 70 лет.
Найдено в: Молоко, йогурт и сыр
- Витамин D важен для прочности костей, но знаете ли вы, что он также поддерживает здоровье иммунной системы? И, в отличие от других питательных веществ, витамин D — единственный, который мы можем синтезировать, когда наша кожа подвергается воздействию солнечного света.Однако по мере старения мы становимся менее эффективными в этом процессе, что делает диету или добавки более важными, чем когда-либо, для получения достаточного количества витамина D.
Найдено в: e г, жирная рыба, устрицы и креветки, а также обогащены витамином D. молочные продукты
Вы всегда знали, что хорошее питание очень важно. И теперь вы можете стремиться получать нужные вам питательные вещества в своем рационе на каждом важном этапе жизни.
Каталожные номера:
1. Патрик Борель, Дэмиен Преверо и Шарль Десмаршелье. Биодоступность витамина Е у человека: обновленная информация. Обзоры питания, 2013 г .; Том 71 (6): 319–33.
2. Данные в досье. Декабрь 2018 г. Abbott Nutrition. Анализ данных NHANES. Дети школьного возраста определены как 6-13 лет.
.


