Строение белков — урок. Химия, 8–9 класс.
Белки являются обязательной составной частью любого живого организма и играют важнейшую роль в обеспечении процессов жизнедеятельности.
В состав белков обязательно входят четыре химических элемента: углерод, водород, кислород и азот. Многие белки содержат серу. В состав некоторых входит фосфор. Есть белки, содержащие атомы металлов.
Белки — природные высокомолекулярные вещества (полимеры), состоящие из остатков аминокислот.
Аминокислотные остатки соединены в макромолекулах белков пептидной группой −NH−CO−, поэтому белки относят к полипептидам.
В состав белков входят двадцать аминокислот строения Nh3−C|H−COOHR. Аминокислотные остатки соединяются в макромолекулы белков в различной последовательности. Число аминокислотных остатков в молекулах тоже может быть разное. Поэтому разнообразие белков практически безгранично и у каждого живого существа набор белковых молекул особый, неповторимый.
Белковые молекулы могут содержать от одного до нескольких сотен и даже тысяч аминокислотных остатков, поэтому их относительные молекулярные массы изменяются от десятков тысяч до нескольких миллионов. Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Так, относительная молекулярная масса гемоглобина равна \(68 000\), яичного белка — \(44 000\), а вируса гриппа — \(32 000 000\).
Свойства белка в первую очередь определяются порядком соединения аминокислотных остатков в полипептидной цепи.
Последовательность аминокислотных остатков в макромолекуле называется первичной структурой белка.
Первичная структура
Существуют вторичная (спираль) и третичная (клубок) структуры белковых молекул. Они образуются в результате внутримолекулярного взаимодействия частей полипептидной цепи.
Вторичная структура
Третичная структура
Несколько белковых молекул могут соединяться друг с другом и образовывать четвертичную структуру.
Четвертичная структура
Белки, свойства белков
Белки — высокомолекулярные соединения, построенные из аминокислот и являются одними из наиболее сложных по строению и составу среди всех органических соединений.
Биологическая роль белков исключительно велика: они составляют основную массу протоплазмы и ядер живых клеток. Белковые вещества находятся во всех растительных и животных организмах. О запасе белков в природе можно судить по общему количеству живого вещества на нашей планете: масса белков составляет примерно 0,01% от массы земной коры, то есть 1016 тонн.
Молекулы белка
Белки по по своему элементному составу отличаются от углеводов и жиров: кроме углерода, водорода и кислорода они ещё содержат азот. Кроме того, Постоянной составной частью важнейших белковых соединений является сера, а некоторые белки содержат фосфор, железо и йод.
Свойства белков
1. Разная растворимость в воде. Растворимые белки образуют коллоидные растворы.
2. Гидролиз — под действием растворов минеральных кислот или ферментов происходит разрушение первичной структуры белка и образование смеси аминокислот.
3. Денатурация — частичное или полное разрушения пространственной структуры, присущей данной белковой молекуле. Денатурация происходит под действием:
- — высокой температуры
- — растворов кислот, щелочей и концентрированных растворов солей
- — растворов солей тяжёлых металлов
- — некоторых органических веществ (формальдегида, фенола)
- — радиоактивного излучения
Строение белков
Строение белков начали изучать в 19 веке. В 1888г. русский биохимик А.Я.Данилевский высказал гипотезу о наличии в белках амидной связи. Эта мысль в дальнейшем была развита немецким химиком Э.Фишером и в его работах нашла экспериментальное подтверждение. Он предложил полипептидную теорию строения белка. Согласно этой теории молекула белка состоит из одной длинной цепи или нескольких полипептидных цепей, связанных друг с другом. Такие цепи могут быть различной длины.
Такие цепи могут быть различной длины.
Фишером проведена большая экспериментальная работа с полипептидами. Высшие полипептиды, содержащие 15-18 аминокислот, осаждаются из растворов сульфатом аммония (аммиачными квасцами), то есть проявляют свойства, характерные для белков. Было показано, что полипептиды расщепляются теми же ферментами, что и белки, а будучи введёнными в организм животного, подвергаются тем же превращениям, как и белки, а весь их азот выделяется нормально в виде мочевины (карбамида).
Исследования, проведённые в 20 веке, показали, что существует несколько уровней организации белковой молекулы.
Белок тирозин
В организме человека тысячи различных белков и практически все они построены из стандартного набора 20 аминокислот. Последовательность аминокислотных остатков в молекуле белка называют первичной структурой белка. Свойства белков и их биологические функции определяются последовательностью аминокислот. Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков — инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
Работы по выяснению первичной структуры белка впервые были выполнены в Кембриджском университете на примере одного из простейших белков — инсулина. В течение посте 10 лет английский биохимик Ф.Сенгер проводил анализ инсулина. В результате анализа выяснено, что молекула инсулина состоит из двух полипептидных цепей и содержит 51 аминокислотный остаток. Он установил, что инсулин имеет молярную массу 5687 г/моль, а его химический состав отвечает формуле C254H337N65O75S6. Анализ проводился вручную с использованием ферментов, которые избирательно гидролизуют пептидные связи между определёнными аминокислотными остатками.
В настоящее время большая часть работы по определению первичной структуры белков автоматизирована. Так была установлена первичная структура фермента лизоцима.
Тип «укладки» полипептидной цепочки называют вторичной структурой. У большинства белков полипептидная цепь свёртывается в спираль, напоминающую «растянутую пружину» (называют «А-спираль» или «А-стуктура»).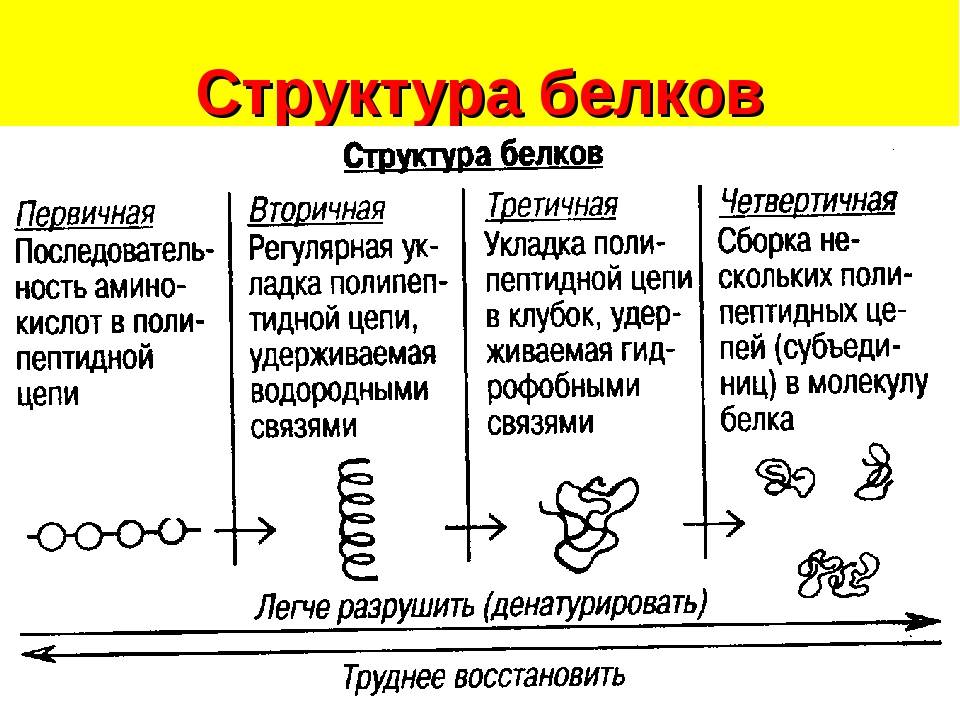 Еще один распространённый тип вторичной структуры — структура складчатого листа (называют «B — структура»). Так, белок шёлка — фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
Еще один распространённый тип вторичной структуры — структура складчатого листа (называют «B — структура»). Так, белок шёлка — фиброин имеет именно такую структуру. Он состоит из ряда полипептидных цепей, которые располагаются параллельно друг-другу и соединяются посредством водородных связей, большое число которых делает шёлк очень гибким и прочным на разрыв.
При всём этом практически не существует белков, молекулы которых на 100% имеют «А-структуру» или «B — структуру».
Белок фиброин — белок натурального шёлка
Пространственное положение полипептидной цепи называют третичной структурой белкой. Большинство белков относят к глобулярным, потому что их молекулы свёрнуты в глобулы. Такую форму белок поддерживает благодаря связям между разнорзаряженными ионами (-COO— и -NH3+ и дисульфидных мостиков. Кроме того, молекула белка свёрнута так, что гидрофобные углеводородные цепи оказываются внутри глобулы, а гидрофильные — снаружи.
Способ объединения нескольких молекул белка в одну макромолекулу называют четвертичной стуктурой белка. Ярким примером такого белка может быть гемоглобин. Было установлено, что, например, для взрослого человека молекула гемоглобина состоит из 4-х отдельных полипептидных цепей и небелковой части — гема.
Свойства белков объясняет их различное строение. Большинство белков аморфно, в спирте, эфире и хлороформе нерастворимо. В воде некоторые белки могут растворяться с образованием коллоидного раствора. Многие белки растворимы в растворах щелочей, некоторые — в растворах солей, а некоторые — в разбавленном спирте. Кристаллическое состояние белов встречается редко: примером могут быть алейроновые зёрна, встречающиеся в клещевине, тыкве, конопле. Кристаллизуется также альбумин куриного яйца и гемоглобин в крови.
Гидролиз белков
При кипячении с кислотами или щелочами, а также под действием ферментов белки распадаются на более простые химические соединения, образуя в конце цепочки превращения смесь A-аминокислот.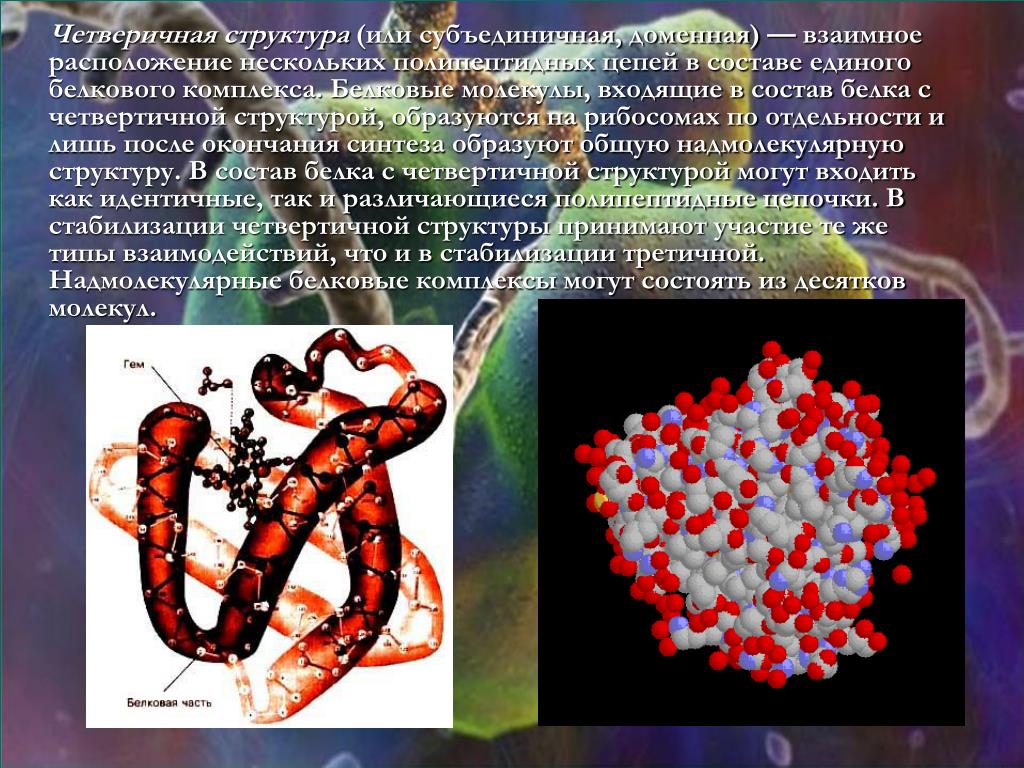 Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
Такое расщепление называется гидролизом белка. Гидролиз белка имеет большое биологическое значение: попадая в желудок и кишечник животного или человека, белок расщепляется под действием ферментов на аминокислоты. Образовавшиеся аминокислоты в дальнейшем под влиянием ферментов снова образуют белки, но уже характерные для данного организма!
В продуктах гидролиза белков кроме аминокислот были найдены углеводы, фосфорная кислота, пуриновые основания. Под влиянием некоторых факторов например, нагревания,растворов солей, кислот и щелочей, действия радиации, встряхивания, может нарушиться пространственная структура, присущая данной белковой молекуле. Денатурация может носить обратимый или необратимый характер, но в любом случае аминокислотная последовательность, то есть первичная структура, остаётся неизменной. В результате денатурации белок перестаёт выполнять присущие ему биологические функции.
Для белков известны некоторые цветные реакции, характерные для их обнаружения. При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
При нагревании мочевины образуется биурет, который с раствором сульфата меди в присутствии щелочи даёт фиолетовое окрашивание или качественная реакция на белок, которую можно провести дома). Биуретовую реакцию даёт вещества, содержащие амидную группу, а в молекуле белка эта группа присутствует.
Ксантопротеиновая реакция заключается в том, что белок от концентрированной азотной кислоты окрашивается в жёлтый цвет. Эта реакция указывает на наличие в белке бензольной группы, которая имеется в таких аминокислотах, как фениланин и тирозин.
При кипячении с водным раствором нитрата ртути и азотистой кислоты, белок даёт красное окрашивание. Эта реакция указывает на наличие в белке тирозина. При отсутствии тирозина красного окрашивания не появляется.
Видеоурок по биологии «Белки»
Белки — это строительные материалы и живые нано-машины нашего тела. По сравнению с липидами и углеводами белки являются наиболее важными для организма.
Каждый из сотен тысяч разных белков обладает неповторимой пространственной структурой. И у каждого белка своя задача и функция. Есть белки костной и мышечной ткани, белки тканей кожи и мозга. Белки ферменты и рецепторы.
Если в организме отсутствует хотя бы один белок (например, белковый гормон инсулин), жизнь человека в опасности, так как инсулин оказывает многогранное влияние на обмен практически во всех тканях. Основное действие инсулина заключается в снижении концентрации глюкозы в крови.
Белки — это самые сложные молекулярные системы, имеющиеся в природе.
Кроме углерода, кислорода, водорода и азота в состав белков могут входить сера, фосфор, железо.
Белки построены из мономеров, которыми являются аминокислоты.
Среди двухсот известных аминокислот только 20 из них участвуют во внутриклеточном синтезе белков. Их называют протеиногенными или стандартными аминокислотами. Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Вопрос, почему именно эти 20 аминокислот стали «избранными», остаётся нерешённым. Не совсем ясно, чем эти аминокислоты оказались предпочтительнее других похожих.
Из 20 аминокислот, входящих в состав белков, может быть образовано вот такое число комбинаций различных белков, которые будут обладать совершенно одинаковым составом, но различным строением.
Все аминокислоты подразделяют на заменимые и незаменимые.
Заменимые аминокислоты синтезируются в организме человека, к ним относят: аланин, аргинин, аспарагин, аспарагиновую кислоту, глицин, глутамин, глутаминовую кислоту, пролин, серин, тирозин и цистеин.
Незаменимые аминокислоты в организме не синтезируются и должны в обязательном порядке поступать с пищей. Это валин, гистидин, изолейцин, лейцин, лизин, метионин, треонин, триптофан, фенилаланин. Содержатся они в основном в продуктах животного происхождения.
Для удобства названия аминокислот имеют общепринятые сокращения.
Молекула аминокислоты состоит из двух одинаковых для всех аминокислот частей, одна из которых является аминогруппой (─ ) с основными свойствами, другая —карбоксильной группой (─COOH) с кислотными свойствами. Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Часть молекулы, которая называется радикалом (в формулах она обычно обозначается большой латинской буквой R), у разных аминокислот имеет различное строение.
Аминокислоты соединяются между собой. Так образуется молекула, которая представляет собой пептид. Эта реакция называется (полимеризацией). В процессе полимеризации выделяется молекула воды, а освободившиеся электроны образуют ковалентную связь, которая получила название пептидной. Это связь между атомами углерода и азота.
Поскольку на одном конце дипептида находится свободная аминогруппа, а на другом — свободная карбоксильная группа, дипептид может присоединять к себе другие аминокислоты.
Также белки могут состоять и из большого числа аминокислотных остатков. И, кроме того, каждая аминокислота может встречаться в белке несколько раз.
В состав белка может входить одна, две и более полипептидные цепи. Например, в молекуле инсулина — две цепи, а иммуноглобулины состоят из четырёх цепей.
Среди белков различают протеины, состоящие только из белков, и протеиды, содержащие не белковую часть. Например, гемоглобин.
Гемоглобин является сложным белком класса хромопротеинов, то есть в качестве небелкового компонента здесь выступает особая пигментная группа, содержащая железо, — гем.
Гемоглобин человека является тетрамером, то есть состоит из четырёх субъединиц. У взрослого человека они представлены полипептидными цепями α1, α2, β1и β2.
Четвертичная структура гемоглобина придаёт ему способность регулировать присоединение и отщепление кислорода.
Гемоглобин является одним из основных белков, которыми питаются малярийные плазмодии — возбудители малярии. В эндемичных по малярии районах земного шара весьма распространены наследственные аномалии строения гемоглобина.
Эритроцит при этом приобретает форму серпа. Из-за этого малярийный плазмодий не проникает в эритроцит и не питается белком-гемоглобином. Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Изменение в форме эритроцита приводит к заболеванию ─ серповидноклеточной анемии.
Если белки состоят только из аминокислот, то их называют простыми.
Если в состав белков входят компоненты неаминокислотной природы, то такие белки относят к сложным.
Если в состав сложных белков входят углеводы, то их называют «гликопротеиды». Если входят липиды — то «липопротеиды», а если нуклеиновые кислоты — «нуклеопротеиды».
Именно строение белковых молекул определяет многообразие функций белков и их особую роль в жизненных процессах. Поэтому исследование структуры белков ─ самая важная стадия познания явлений, происходящих в живой клетке.
Белок можно выявить при помощи его денатурации. Денатурация — это утрата белковой молекулой своей первоначальной структуры.
Денатурация может возникать под воздействием нагревания (температуры), химических веществ (например, кислот, оснований, органических растворителей), обезвоживания, облучения и других факторов, в результате которых свойство белковых молекул резко изменяется.
Зажигаем спиртовку, наливаем в демонстрационную пробирку каллоидный раствор белка в дистиллированной воде. Закрепляем пробирку в держалке и осторожно нагреваем содержимое пробирки. Уже при небольшом нагревании хорошо видны изменения, происходящие в растворе. Он перестаёт быть прозрачным, появляется белый осадок. Это и есть свернувшийся белок. Температура (нагревание) вызывает свёртывание коллоидного раствора белка.
Следующий опыт
В пробирку с коллоидным раствором белка в дистиллированной воде добавляем разбавленный раствор азотной кислоты. Признак реакции — образование осадка. Белок денатурирован.
Третий опыт
Денатурация белка происходит и под действием растворов солей тяжёлых металлов. К раствору белка добавляем раствор сульфата меди. Признаком реакции является образование белого непрозрачного осадка. Это и есть денатурированный белок.
Обнаружив белок, мы ничего не можем сказать о его составе, структуре, свойствах. Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Что бы ответить на все эти вопросы, необходимо, прежде всего, выделить белок — получить его в чистом виде. Существует множество методов получения белков в чистом виде.
Процесс, обратный денатурации, при котором белки возвращают свою природную структуру, называется ренатурацией.
Уровни организации белковой молекулы
Молекулы белков могут принимать различные пространственные формы —конформации, которые представляют собой четыре уровня их организации.
Последовательное чередование различных аминокислотных звеньев в полипептидной цепи называется — первичной структурой белковой молекулы. Она уникальна для любого белка и определяет его форму, свойства и функции.
Молекула белка обладает определённой пространственной формой — это вторичная структура. Такая структура поддерживается водородными связями. Водородные связи возникают межу амино- и карбоксильными группами амикислотных остатков полипептидной цепи.
Водородные связи фиксируют различные пространственные структуры. Хотя они и малопрочные, но из-за того, что их большое количество, — вторичная структура белка достаточно прочна. Части белковой молекулы могут организовываться в спираль или в другие виды вторичной структуры.
Третичная структура белка имеет вид клубка (глобулы). Третичная структура — это трёхмерная организация белковой молекулы. Она поддерживается водородными и дисульфидными (-S-S-) связями между остатками цисцеина (аминокислоты), а также гидрофобными взаимодействиями.
Существует и четвертичная структура белка. Однако она характерна не для всех молекул белка. Четвертичная структура возникает в результате соединения нескольких глобул в сложный комплекс. Например, гемоглобин крови состоит из четырёх таких субъединиц.
Как вы уже поняли, белки многочисленны и многообразны. И у каждого белка своя задача и функция.
Структурная функция белков
Так как белки являются основой всех биологических мембран, они выполняют строительную функцию.
Белок коллаген — важный составной компонент соединительных тканей.
Эластин — эластичный компонент связок, стенок кровеносных сосудов.
Кератин — фибриллярный белок, обладающий механической прочностью, которая среди материалов биологического происхождения уступает лишь хитину. В основном из кератинов состоят роговые производные эпидермиса кожи — такие структуры, как волосы, ногти, рога, перья и роговой чехол, который покрывает клюв птиц.
Ферментативная функция белков
Ферменты — вещества белковой природы. Их молекулы состоят в основном из аминокислотных звеньев. Ферменты специфичны для каждого вещества. Основная функция их — это ускорение биохимических реакций организма, реакций распада и синтеза.
Они действуют в строго определённой последовательности. Почему так? Дело в том, что избирательность действия ферментов на разные химические вещества связана с их строением. Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Ферменты имеют специфические активные участки (центры), с которыми связываются субстраты.
Форма и химическое строение активного центра таково, что с ним могут связаться только определённые молекулы в силу их пространственного соответствия, они подходят друг к другу, как ключ к замку.
Связывание субстрата осуществляется именно в активном центре фермента. Одни ферментные системы направляют процессы биосинтеза. Этот процесс требует затрат энергии.
Другие ферментные системы регулируют распад и окисление веществ. При этих реакциях энергия выделяется.
На заключительном этапе химической реакции комплекс распадается с образованием конечных продуктов и свободного фермента.
Освободившийся при этом активный центр фермента может снова принимать новые молекулы вещества — субстрата.
Многие ферменты, как мы уже сказали, представлены белковыми молекулами. Другие состоят не только из белка, но и из небелкового соединения (кофермента). В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
В качестве кофермента могут выступать различные вещества, но, как правило, это витамины и ионы металлов.
Отсутствие витамина в пище сначала приводит к недостаточному образованию кофермента, а без него не может работать (активироваться) соответствующий фермент. Поэтому скорость биохимической реакции, за которую отвечает этот фермент, значительно падает. Итогом этого становится нарушение обмена веществ.
Транспортная функция белков имеет важное значение. Так, гемоглобин переносит кислород из лёгких к клеткам других тканей.
В мышцах эту функцию выполняет белок миоглобин. Сывороточный альбумин крови способствует переносу липидов и жирных кислот, различных биологически активных веществ.
Белки-переносчики осуществляют перенос веществ через клеточные мембраны.
Специфические белки выполняют защитную функцию. Они предохраняют организм от вторжения чужеродных организмов и от повреждения.
Например, на проникновение в организм чужеродных белков реагирует иммунная система организма. Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
Она бросает против них целую армию своих белков, так называемых антител. Антитела являются особым классом гликопротеинов, имеющихся на поверхности B-лимфоцитов в виде мембраносвязанных рецепторов.
При помощи антиген-связывающих участков антитела присоединяются к вирусам и бактериям, чужеродным белкам, препятствуя их размножению.
Ещё один важный белок нашего организма — интерферон — универсальный противовирусный белок.
Фибриноген и тромбин предохраняют организм от кровопотери, образуя тромб.
Многие живые существа для обеспечения защиты выделяют белки, называемые токсинами, которые в большинстве случаев являются сильными ядами.
Регуляторная функция белков присуща белкам-гормонам (регуляторам). Они регулируют различные физиологические процессы.
Например, наиболее известным гормоном является упомянутый выше инсулин, регулирующий содержание глюкозы в крови. При недостатке инсулина в организме возникает заболевание, известное как сахарный диабет.
Белки могут выполнять энергетическую функцию, являясь одним из источников энергии в клетке. При полном расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии.
Но в качестве источника энергии белки используются в последнюю очередь, после углеводов и жиров. Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Таким образом, роль белков огромна. Современная биология показала, что сходство и различие организмов определяются в конечном счёте набором белков. Чем ближе организмы друг к другу в систематическом положении, тем более сходны их белки.
Белки как молекулы. Состав, структура и функции белков
Белки выполняют ведущую роль в жизни организмов, преобладая в них и количественно. В теле животных они составляют 40-50% сухой массы, в растениях – 20-35%. Это самая разнообразная группа молекул – как химически, так и функционально. Состав и структура белков определяет огромное разнообразие их функций в клетке: их так много, что невозможно перечислить и описать их все. Однако можно сгруппировать эти функции в следующие восемь категорий. Но этот список также будет неполным.
-
- Ферментативная (каталитическая). Ферменты имеют белковое происхождение. Это трёхмерные глобулярные (свёрнутые) белки, плотно прилегающие к молекуле для её расщепления или сборки. Такая подгонка ускоряет специфические химические реакции в клетке.
- Защитная. Другие глобулярные белки используют свою форму для распознавания чужеродных микроорганизмов и раковых клеток. Эти приёмные устройства формируются эндокринной и иммунной системами. Многие живые организмы выделяют белки, ядовитые для других. Токсины синтезируют ряд животных, грибов, растений, микроорганизмов. В свою очередь, некоторые организмы способны вырабатывать антитоксины, которые подавляют действие этих ядов.
- Транспортная. Глобулярные белки присоединяют и транспортируют мелкие молекулы и ионы. Например, транспортный белок гемоглобин переносит кислород и углекислоту с потоком крови. Мембранные транспортные белки помогают молекулам и ионам двигаться через плазмалемму. Альбумины крови транспортируют жирные кислоты, глобулины – ионы металлов и гормоны.
- Структурная. Белковые молекулы входят в состав всех клеточных мембран и органоидов. Из белков построены элементы цитоскелета, сократительные структуры мышечных волокон. Структурными являются кератин в волосах, фибрин в сгустках крови, коллаген в коже, связках, сухожилиях и костях. В состав связок, стенок артерий и лёгких входит также структурный белок эластин.
- Двигательная. Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Мышцы сокращаются за счёт движения двух видов белковых нитей: актина и миозина. Контрактильные (лат. contraho, contractum – стягивать, сокращать) протеины играют ключевую роль в цитоскелете и передвижении веществ внутри клетки. Белок тубулин также входит в состав микротрубочек веретена деления, ресничек и жгутиков эукариотических клеток.
- Регуляторная. Крошечные белки, называемые гормонами, служат межклеточными посланниками в теле животных. Другие белки регулируют синтез РНК на ДНК, включая и выключая гены. Кроме того белки получают информацию, действуя в качестве рецепторов клеточной поверхности (эту функцию иногда считают отдельной, называя рецепторной).
- Запасающая. Кальций и железо хранятся в организме в виде ионов, связанных с белками хранения. В семенах растений запасаются резервные белки, которые используются зародышем при прорастании, а затем и проростком как источник азота.
- Энергетическая. После расщепления до аминокислот белки могут служить источником энергии в клетке. При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и липидов.
Сравнительный размер молекул белков. Слева направо: антитело (IgG) (150 кДа), гемоглобин (66,8 кДа), гормон инсулин, фермент аденилаткиназа и фермент глютаминсинтетаза.
Автор: en:User:Gareth White, CC BY-SA 2.0
|
Функции белков
|
|||
| Функция | Класс белка | Образцы | Примеры использования |
| Каталитическая | Ферменты | Карбогидразы | Расщепляют полисахариды |
| Протеазы | Разрушают белки | ||
| Полимеразы | Синтезируют нуклеиновые кислоты | ||
| Киназы | Фосфорилируют сахара и белки | ||
| Защитная | Иммуноглобулины | Антитела | Маркируют чужеродные белки для элиминации (удаления) |
| Токсины | Змеиный яд | Блокирует нервные импульсы | |
| Клеточные белки-антигены | МНС-белки (главный комплекс гистосовместимости) | Опознание чужеродных белков | |
| Транспортная | Циркуляционные транспортёры | Гемоглобин | Переносит кислород и углекислый газ крови |
| Миоглобин | Переносит кислород и углекислый газ в скелетных мышцах и мышце сердца | ||
| Цитохромы | Транспортируют электроны | ||
| Мембранные транспортные белки | Натриево-калиевый насос | Возбуждение мембраны | |
| Протонный насос | Хемиосмос | ||
| Транспортёр глюкозы | Транспортирует глюкозу в клетки | ||
| Структурная | Волокна | Коллаген | Образует хрящ |
| Кератин | Формирует волосы, ногти, перья и др. | ||
| Фибрин | Образует сгустки крови | ||
| Двигательная | Мускулы | Актин | Сокращение мышечных волокон |
| Миозин | Сокращение мышечных волокон | ||
| Регуляционная | Осмотические белки | Сывороточный альбумин | Поддерживает осмотическую концентрацию крови |
| Регуляторы генов | Репрессор | Регулирует транскрипцию | |
| Гормоны | Инсулин | Контролирует уровень глюкозы в крови | |
| Вазопрессин | Увеличивает задержку воды почками | ||
| Окситоцин | Регулирует сокращение матки и выделение молока | ||
| Запасающая | Ион-связывание | Ферритин | Хранит железо, особенно в селезёнке |
| Казеин | Хранит ионы в молоке | ||
| Кальмодулин | Связывает ионы кальция | ||
Белки – это полимеры
Белки, или протеины – это нерегулярные (не имеющие определённой закономерности в последовательности мономеров) полимеры, состоящие из мономеров, называемые аминокислотами. Протеины, в состав молекул которых входит от пятидесяти до нескольких тысяч остатков аминокислот, называются белками. Молекулы с меньшим количеством мономеров именуются пептидами.
Общие сведения о пептидах и белках
Белок состоит из одной или нескольких длинных неразветвлённых цепей. Каждая цепь называется полипептидом и состоит из аминокислот, скреплённых пептидными связями. Термины «белок» и «полипептид» часто используются свободно, что может вызывать путаницу. Для белка, который включает только одну полипептидную цепь, оба термина являются синонимами.
В природе существуют около 500 аминокислот. В образовании белков обычно (но не всегда) участвуют только 20 из них – их называют белокобразующими. Порядок соединения мономеров в белке определяет его структуру и функции. Многие учёные считают, что аминокислоты были первыми органическими молекулами, появившимися на Земле. Возможно, океаны, которые существовали в начале истории нашей планеты, содержали большое их разнообразие.
Белокобразующие аминокислоты
Автотрофные организмы синтезируют все необходимые им аминокислоты из продуктов фотосинтеза и азотсодержащих неорганических соединений. Для гетеротрофов источником аминокислот являются продукты питания. В организме человека и животных некоторые аминокислоты могут синтезироваться из продуктов обмена веществ (в первую очередь — из других аминокислот). Такие аминокислоты называются заменимыми.
Другие же, так называемые незаменимые аминокислоты, не могут быть собраны в организме и поэтому должны постоянно поступать в него в составе белков пищи. Протеины, содержащие остатки всех незаменимых аминокислот, называются полноценными. Неполноценные белки – это те, в составе которых отсутствуют остатки тех или иных незаменимых аминокислот.
Незаменимыми аминокислотами для человека являются: триптофан, лизин, валин, изолейцин, треонин, фенилаланин, метионин и лейцин. Для детей незаменимыми являются также аргинин и гистидин.
Полипептидные цепи могут быть очень длинными и включать самые разные комбинации аминокислотных остатков. Каждый конкретный белок характеризуется строго постоянным составом и последовательностью аминокислот.
Димер мембранного белка кальсеквестрина.
Deposition authors: Wang, S., Trumble, W.R., Liao, H., Wesson, C.R., Dunker, A.K., Kang, C., CC BY 3.0
Белки, образованные только остатками аминокислот, называются простыми. Сложными являются протеины, имеющие в своём составе компонент неаминокислотной природы. Это могут быть ионы металлов (Fe2+, Zn2+, Mg2+, Mn2+), липиды, нуклеотиды, сахара и др. Простыми белками являются альбумины крови, фибрин, некоторые ферменты (трипсин) и др. Сложные белки – это большинство ферментов, иммуноглобулины (антитела).
Состав аминокислот
Аминокислоты, как следует из их названия, содержат основную аминогруппу (— NH2), а также кислотную карбоксильную группу (—COOH), обе они связаны с центральным атомом углерода. Углерод дополнительно скреплен с водородом и функциональной белковой группой, называемой радикалом (R). Эти компоненты полностью заполняют все связи центрального атома углерода.
Общая структура α-аминокислот, составляющих белки (кроме пролина).
Автор: User:X-romix
Уникальный характер каждой аминокислоты определяется природой группы радикала. Обратите внимание, что если группа радикала не содержит атома водорода (Н), как в глицине, то аминокислота хиральна и может существовать в форме двух энантиомеров: d или L. В белках живых систем содержатся обычно α (L)-аминокислоты, а β (d)-аминокислоты встречаются крайне редко.
Группа радикала определяет химические свойства аминокислот – они могут быть полярными или неполярными, гидрофобными или гидрофильными. Серин с радикалом -CH2OH является полярной молекулой, Аланин, который имеет –CH3 как группу радикала – неполярен.
Существуют также основные аминокислоты (более чем с одной аминогруппой) и кислые аминокислоты (более чем с одной карбоксильной группой). Наличие дополнительной амино- или карбоксильной группы оказывает влияние на свойства аминокислоты, которые играют определяющую роль в формировании пространственной структуры белка.
В состав радикала некоторых аминокислот (например, цистеина) входят атомы серы. Все 20 аминокислот сгруппированы в пять химических классов, основанных на группе их радикала.
- Неполярные аминокислоты, такие как лейцин, часто имеют в качестве радикала —CH2 или —CH3.
- Полярные незаряженные аминокислоты, такие как треонин, с радикалом, содержащим кислород или гидроксильную группу (-OH).
- Заряженные аминокислоты, такие как глутаминовая кислота, с радикалом, имеющим кислоты или основания, способные к ионизации.
- Ароматические аминокислоты, такие как фенилаланин, имеющий группу радикала, содержащую органическое (углеродное) кольцо с чередованием одиночных и двойных связей. Они также неполярны.
- Аминокислоты, обладающие особыми функциями и свойствами. Например, метионин, который часто является первой аминокислотой в цепи белков, пролин, вызывающий перегибы в цепях, цистин, связывающий цепи вместе.
Каждая аминокислота влияет на форму белка по-разному, в зависимости от химической природы боковых групп. Например, части белковой цепи с многочисленными неполярными аминокислотами сворачиваются внутрь своей цепи путём гидрофобного исключения.
Белки и пептидные связи
В дополнении к группе радикала каждая аминокислота имеет положительно заряженную аминогруппу (NH3 +) на одном конце и отрицательно заряженную гидроксильную группу (COO -) на другом. Амино- и карбоксильные группы у пары аминокислот могут подвергаться реакции дегидрации (выделение молекулы воды) с образованием ковалентной связи. Ковалентная связь, скрепляющая две аминокислоты, называется пептидной. Скреплённые таким способом аминокислоты не могут свободно вращаться вокруг N-C связи. Этот факт является основным фактором образования конструкции белковых молекул.
Пептидная связь
Наличие как основной, так и кислотной групп обусловливает амфотерность (проявление как кислотных, так и основных свойств) и высокую реакционную способность аминокислот.
При соединении двух аминокислот образуется дипептид. На одном конце молекулы дипептида находится свободная аминогруппа, на другом — свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты, образуя олигопептиды. Если таким образом соединяется более 10 остатков аминокислот, то образуется полипептид.
Новаторская работа Фредерика Сангера в начале 1950-х годов доказала, что каждый вид белка имеет определённую аминокислотную последовательность. Для отщепления аминокислот он использовал химические методы, после этого определял их. Сангер преуспел в расшифровке аминокислотной последовательности инсулина. Он продемонстрировал, что все молекулы инсулина имеют одинаковый состав аминокислот.
Уровни структурной организации белков
Форма белка определяет его функцию. Один из способов изучить что-то столь же маленькое как белок – посмотреть на него при помощи коротковолнового излучения, которое представлено рентгеновскими лучами. Рентгеновские лучи пропускают через белок для получения дифракции его узора. Эта картинка кропотливо анализируется и позволяет исследователю построить трёхмерное изображение молекулы с положением каждого её атома. Первым белком, проанализированным таким образом, был миоглобин; вскоре такому же анализу был подвергнут связанный с ним белок гемоглобин.
Когда было изучено достаточное количество протеинов, стал очевиден общий принцип их строения: в каждом исследованном белке все внутренние аминокислоты, такие как лейцин, валин и фенилаланин, неполярны. Тенденция воды к исключению неполярных молекул буквально толкает такие части цепи аминокислот внутрь протеина. Неполярные аминокислоты вынуждены тесно контактировать друг с другом, оставляя мало свободного места внутри молекулы. Полярные и заряженные аминокислоты концентрируются на поверхности белка, за исключением немногих, играющих ключевые функциональные роли.
Структура белков, как правило, описывается как иерархия четырёх уровней: первичного, вторичного, третичного и четвертичного. Мы рассмотрим эту точку зрения, а затем интегрируем её с более современным подходом, вытекающим из расширяющихся знаний о белковой структуре.
Уровни организации молекул белка
Первичная структура белков
Первичная структура белка – это его аминокислотная последовательность, т. е. это цепочка из множества аминокислотных остатков, соединённых пептидными связями. Это наиболее важная структура, так как именно она определяет форму, свойства и функции белка. На основе первичной структуры создаются другие формы молекулы.
Группы радикалов, которыми отличаются аминокислоты, не играют роли в пептидной цепи белков и протеин может включать любую последовательность аминокислот. Так как любая из 20 аминокислот может появиться в любом месте, белок, содержащий 100 мономеров, может образовать любую из 20 100 различных аминокислотных последовательностей. Это важное свойство белков позволяет им быть разнообразными, но каждый из них функционирует только при определённой аминокислотной последовательности.
Вторичная структура белка
Боковые и пептидные группы полипептидных цепей могут образовывать водородные связи. Вторичная структура белка возникает в результате связывания атомов водорода NH-групп и кислорода CO-групп. Полипептидная цепь при этом спирально закручивается. Водородные связи слабые, но благодаря их большому числу они обеспечивают стабильность этой структуры. Спиральную конфигурацию имеют, например, молекулы кератина, миозина и коллагена.
Водородные связи пептидов могут образовываться с водой. Если связей с водой будет слишком много, белки не смогут приобрести глобулярной структуры. Лайнус Полинг предположил, что пептидные группы могут взаимодействовать друг с другом, если пептид свёрнут в спираль, которую он назвал α-спиралью. Этот вид регулярного взаимодействия в пептиде формирует его вторичную структуру.
Вторичная структура инсулина
Другая форма вторичной структуры формируется между зонами пептида, расположенными в один ряд, в результате чего получается плоская молекула, собранная в складки, называемая β-листом. Части белка могут быть либо параллельными, либо антипараллельными – в зависимости от того, являются ли смежные участки пептида ориентированными в одном или в противоположном направлении.
Эти два вида вторичной структуры создают зоны белка – цилиндрические (α-спирали) и плоские (β-листы). Конечная структура белка может включать области каждого типа вторичной структуры. Например ДНК-связывающие белки обычно имеют области α-спирали, которые могут лежать поперёк ДНК и взаимодействовать непосредственно с основаниями ДНК. Белки порины, образующие отверстия в мембранах, состоят из β-листов. В гемоглобине α и β-структуры (глобины) имеют в молекуле свои зоны.
Вторичная структура белков
Третичная структура белков
Окончательная структура химически связанных белков называется третичной. Третичная структура формируется за счет образования водородных, ионных и других связей, возникающих в водной среде между разными группами атомов белковой молекулы вторичной структуры.
У некоторых белков важную роль в образовании третичной структуры играют S – S связи (дисульфидные) между остатками цистеина (аминокислоты, содержащей серу). При этом полипептидная спираль укладывается в своеобразный клубок (глобулу) таким образом, что гидрофобные аминокислотные радикалы погружаются внутрь глобулы, а гидрофильные располагаются на поверхности и взаимодействуют с молекулами воды. Третичной структурой определяются специфичность белковых молекул, их биологическая активность. Её имеют многие белки, например миоглобин (белок, который участвует в создании запаса кислорода в мышцах) и трипсин (фермент, расщепляющий белки пищи в кишечнике).
Третичная структура стабилизируется рядом сил, в том числе:
- водородными связами между радикалами различных аминокислот;
- электростатическим притяжением радикалов с противоположными зарядами;
- гидрофобным исключением неполярных радикалов;
- ковалентными дисульфидными связами.
На стадии третичной структуры по форме молекул белки можно разделить на две группы:
- глобулярные – имеют округлую форму. Такую форму имеют глобулины и альбумины крови, фибриноген, гемоглобин;
- фибриллярные – характеризуются вытянутой, нитевидной формой молекул. Это кератин, коллаген, миозин, эластин и др.
Четвертичная структура белка
Когда два или более полипептида связываются с образованием функционального белка, отдельные его цепи называются субъединицами. Расположение этих субъединиц и есть четвертичная структура. Субъединицы в таких белках чаще всего неполярны, поэтому они не связаны химически и отвечают за отдельные виды деятельности. Прочность четвертичной структуры обеспечивается взаимодействием слабых межмолекулярных сил.
Четвертичная структура характерна для белка гемоглобина. Вспомните, что гемоглобин состоит из двух α-цепей и двух β-цепей, а ещё в его состав входит небелковый компонент – гем.
Субъединицы располагаются в их окончательной четвертичной структуре. Это конечная структура некоторых, но не всех белков. У протеинов, которые состоят только из одной полипептидной цепи, например у фермента лизоцима, конечной структурой является третичная.
Мотивы и домены – структурные элементы белков
Ручное определение последовательности аминокислот в белке – трудоёмкая работа. Эту ситуацию изменило открытие способности хранения информации о белке молекулой ДНК. Первоначально геном человека был расшифрован вручную. Появление технологий следующего поколения привело к заметному ускорению секвенирования.
Сегодня расшифрованы более 40 000 бактериальных геномов и почти 8 000 геномов эукариот, в том числе 80 последовательностей генов млекопитающих. Так как состав ДНК имеет непосредственное отношение к последовательности аминокислот в белках, у биологов теперь есть огромная база данных строения протеинов.
Новая информация заставила задуматься о логике генетического кода и основных закономерностях структуры белка. Исследователи до сих пор рассматривают иерархическую систему из четырёх уровней как важную, но в лексикон биологов вошли и новые термины: мотив укладки и белковый домен.
Мотив укладки белковых молекул
Когда биологи обнаружили третичную структуру белка (ещё более трудоёмкая работа, чем определение последовательности аминокислот в цепи), они заметили сходные элементы, расположенные в непохожих белках. Подобные структуры называются мотивами, а иногда «сверхсекундными структурами». Термин «мотив» заимствован из искусства и относится к тематическому повторяющемуся элементу в музыке или дизайне.
Один общий мотив β-α-β образует так называемую «складку Россмана» у большого количества протеинов. Вторым часто встречающимся мотивом является β-баррель, который представляет собой β-лист, сложенный по кругу, чтобы сформировать трубку. Третий тип мотива – спираль-поворот-спираль, состоит из двух α-спиралей, разделённых изгибом. Его используют белки для связывания с молекулой ДНК.
Логику структуры мотивов укладки исследователи до сих пор не могут понять. Вероятно, если аминокислоты являются буквами в языке белков, то мотивы представляют собой повторяющиеся слова или фразы. Мотивы укладки помогли определить неизвестные функции белков, а база данных белковых мотивов используется для поиска новых неизвестных протеинов.
Мотивы укладки являются довольно консервативными и встречаются в белках, которые не имеют ни функциональных, ни эволюционных связей. Определение мотивов укладки лежит в основе физической, или рациональной классификации белков.
Белковые домены
Домены – это функциональные единицы в виде глобулы внутри более крупной структуры белков. Их можно рассматривать как субструктуры внутри третичной структуры белка. В языке белков это «абзацы». Большинство белков состоит из нескольких доменов, которые выполняют различные части функций протеинов.
Во многих структурах эти домены могут быть физически разделены. Например, так устроены факторы транскрипции – белки, которые связываются с ДНК и инициируют построение РНК по комплементарной ей ДНК. Было выяснено, что если ДНК-связывающие области поменять местами с факторами транскрипции, специфичность фактора может быть изменена без изменения его способности стимулировать транскрипцию. Эксперименты по замене доменов были проведены со многими факторами транскрипции, и они указывают, что активационные и ДНК-связывающие домены действуют отдельно.
Эти образования также могут помогать протеинам складываться. По мере того, как полипептидная цепь приобретает свою структуру, домены принимают правильную форму. Это действие может быть продемонстрировано экспериментально. Искусственное продуцирование фрагмента полипептида, который образует домен в интактном белке, показывает, что фрагмент складывается, чтобы сформировать такую же структуру, как у прототипа.
Процесс складывания, белки-шапероны
Первоначально биохимики думали, что новоиспечённые белки сворачиваются спонтанно, пробуя различные конфигурации, как гидрофобные взаимодействия с водой толкают неполярные аминокислоты внутрь белков до тех пор, пока не будет достигнута их окончательная структура. Оказалось, что эта точка зрения слишком проста. Цепи протеинов могут быть сложены многими способами, поэтому пробы и ошибки заняли бы слишком много времени. По мере того как первичная цепь складывается, приобретая финальную структуру, неполярные «липкие» внутренние участки во время промежуточных стадий обнажаются. Если эти промежуточные формы поместить в пробирку со средой, идентичной той, что внутри клетки, они прилипают к другим, и нежелательные белки-партнёры образуют клейкую массу.
Как клетки избегают того, чтобы их белки слипались в массу? Ответ на вопрос появился во время изучения необычных мутаций, которые спасают бактериальные клетки от размножения внутри них вирусов. При этом белки вирусов, произведённые внутри клетки, не могут сложиться как следует. Дальнейшее исследование помогло выяснить, что клетки содержат белки-шапероны, помогающие другим белкам складываться правильно.
Свёртывание белков
В настоящее время молекулярные биологи выявили массу белков, действующих как шапероны. Это большой класс полимеров, который можно разделить на подклассы. Представители шаперонов были найдены в каждом исследуемом организме. Некоторые из них, называемые тепловыми шоковыми белками, вырабатывается в ответ на повышение температуры тела. Высокие температуры служат фактором денатурации белков, шоковые белки-шопероны помогают белкам правильно сворачиваться и в такой ситуации.
Один из хорошо изученных классов этих белков, названных шаперонинами, был изучен у кишечной палочки (Escherichia coli). У мутантов при инактивации шаперонинов 30% бактериального белка не складывались должным образом. Шаперонины собираются в комплекс, напоминающий цилиндрический контейнер. Белки могут заходить в этот контейнер, и даже неправильно сложенные молекулы складываются там заново.
Исследователи склонны думать о белках как о фиксированных структурах, но это не относится к шаперонинам. Их гибкость поразительна. Видимо, это нужно им для выполнения своих функций. Клетки используют эти белки для складывания некоторых молекул протеинов и восстановления их неправильной структуры.
Денатурация инактивирует белки
Еще одной важной особенностью белков является то, что они проявляют свою активность лишь в узких температурных рамках и в определённом диапазоне кислотности среды.
Если условия, окружающие белок, изменяются, то он может частично потерять свою структуру или полностью развернуться. Этот процесс называется денатурацией. Белки могут быть денатурированы, когда рН, температура или ионная концентрация окружающего раствора изменена. Денатурация происходит вследствие разрыва водородных, ионных, дисульфидных и других связей, стабилизирующих пространственную структуру белковых молекул. При этом может утрачиваться их четвертичная, третичная и даже вторичная структуры.
Денатурированные белки как правило биологически неактивны. Это особенно значимо в отношении ферментов: так как почти каждая химическая реакция происходит при их помощи, жизненно важно, чтобы они функционировали нормально.
До появления морозильников и холодильников единственным способом предохранения продуктов от размножения в них микроорганизмов было хранение их внутри раствора, содержащего высокую концентрацию соли или уксуса, которые денатурировали ферменты микроорганизмов и предотвращали их рост.
Большинство ферментов функционирует в очень узком диапазоне условий окружающей среды. У каждого энзима этот диапазон специфичен. Ферменты крови, которые работают при рН около 7,4, быстро денатурируют в кислой среде желудка. И наоборот, протеолитические ферменты желудка, работающие при рН=2 или менее, разбираются в основной среде крови. Аналогично у организмов, живущих вблизи океанических гидротермальных источников, есть ферменты, которые хорошо работают только в экстремальных температурах (до 100°С). Эти организмы не могут выжить в более прохладных водах, потому что их энзимы не функционируют должным образом при относительно низких температурах.
Если нормальные показатели окружающего раствора восстанавливаются, небольшой белок, не потерявший первичной структуры, может восстановиться. Этот процесс называется ренатурацией, он происходит благодаря взаимодействию неполярных аминокислот и воды. Первоначально этот процесс был установлен для энзима рибонуклеазы, его ренатурация привела к выводу, что первичная структура определяет третичную структуру белка. Более сложные белки редко складываются вновь из-за их сложной окончательной структуры. Их денатурация носит необратимый характер.
Важно отличать денатурацию от диссоциации. Субъединицы белков с четвертичной структурой могут быть диссоциированы (разделены) без потери своей индивидуальной третичной структуры. Например, молекула гемоглобина может диссоциировать на 4 молекулы (2 α-глобина и 2 β-глобина) без денатурации свёрнутых глобиновых белков. Они легко восстанавливают свою четвертичную структуру из четырёх субъединиц.
Вам будет интересно
Приложения: Последние новости России и мира – Коммерсантъ Review (117933)
В основе всей жизни лежат белки: они обеспечивают существование клетки, ее рост и развитие, они же защищают ее от внешних неблагоприятных факторов, в том числе ядов. Ученым очень важно разглядеть белки и понять, как они работают. Эту задачу решают в Курчатовском институте.
Юлия Дьякова, кандидат физико-математических наук, руководитель Курчатовского комплекса НБИКС-природоподобных технологий
Молекула белка представляет собой последовательность аминокислотных остатков, информация о которой записана в ДНК. Благодаря внутримолекулярному взаимодействию такая полипетпидная цепочка саморганизуется в трехмерную структуру. Взаимодействуя между аминокислотными остатками, вся полипептидная (белковая) цепь белка самоорганизуется в трехмерную структуру.
Взаиимодействие белков с целевыми молекулами основано на принципе «замок—ключ», поэтому биологическая функция белка определяется именно трехмерной структурой его молекулы. Для понимания роли каждого из белков и ее корректировки (если по какой-то причине функция белка была нарушена) нужно иметь точную информацию о взаимном расположении всех атомов (с точностью до ангстрема!), из которых состоит белковая молекула.
Исследование белковой структуры позволяет также определить, как взаимодействует белок с различными веществами. Все эти знания необходимы в медицинской диагностике, особенно для распознавания болезни на ранней стадии, для разработки новых лекарственных препаратов и, конечно, для создания природоподобных гибридных систем, в которых основной функциональный элемент — белок.
Искусственное чувственное восприятие
Когда наши органы чувств принимают от внешнего мира какой-то сигнал или когда внутреннее состояние организма претерпевает изменения, «биологический сигнал» воздействует в первую очередь на белковые молекулы. Если использовать эту удивительную особенность белков — способность детектировать свет, запах, вкус, механические смещения, звук, можно создать бионические аналоги каждого из органов чувств.
В Курчатовском комплексе НБИКС-природоподобных технологий проводятся исследования, охватывающие полную цепчку работ с белками: от постановки задачи, получения белковых объектов (клонирование необходимого гена, экспрессия, то есть синтез, функционального белкового продукта, его выделение и очистка) до точнейшего определения их структуры с помощью самого полного комплекса методов, существующих в мире на сегодняшний день.
Оборудование, имеющееся в Курчатовском институте, дает ученым возможность совершать фундаментальные открытия. Например, исследователь может воспользоваться единственным в России специализированным источником синхротронного излучения, единственным в России криоэлектронным микроскопом, спектрометром ядерного магнитного резонанса (ЯМР-спектрометр). Такой набор инструментов целиком охватывает все методики исследования структуры белковых молекул, доступные современной науке.
Из белка сделать кристалл
Самый популярный метод определения трехмерной структуры белковых молекул сегодня — метод рентгеноструктурного анализа. Чтобы им воспользоваться на практике, нужно вначале получить белковые кристаллы, что само по себе является довольно трудной задачей. В формировании белковых кристаллов участвует множество факторов, и до сих пор не существует общепризнанной системы подбора параметров для роста кристаллов.
В Курчатовском институте для этого используется специальная роботизированная система, которая позволяет быстро перебрать большое количество условий, а расходует она минимальное количество белка. Полученные кристаллы «просвечивают» пучком синхротронного излучения на станции «Белок» Курчатовского источника синхротронного излучения. Чтобы минимизировать повреждения молекулы от действия радиации, сам кристалл помещают в пары кипящего азота. Анализ дифракционных картин позволяет ученым восстановить структуру с разрешением от одного до нескольких ангстрем.
Вторым по популярности после рентгеноструктурного анализа методом определения структур биомолекул стал метод ядерного магнитного резонанса. Спектроскопия ядерного магнитного резонанса позволяет ученым определить структуру белков относительно небольшого размера, причем непосредственно в растворе. В НИЦ «Курчатовский институт» работает самый современный ЯМР-спектрометр, благодаря которому можно, например, определить структуру белковых соединений даже в том случае, если не удается или принципиально невозможно получить кристалл белка.
Зафиксировать и разглядеть
За прошлый год экспоненциально увеличилось число белков и биомолекул (рибосомы, вирусы и тому подобные объекты), структуру которых удается определить с помощью метода просвечивающей криоэлектронной микроскопии. Биологические молекулы специальным образом «замораживаются», а затем просвечиваются пучком электронов. Анализ картинок, получаемых на детекторе, позволяет восстановить трехмерную структуру молекул. Все это осуществляется при помощи криоэлектронного микроскопа, который оснащен корректором сферических аберраций. Этот же микроскоп используется и в исследованиях, когда необходимо определить структуру больших биологических молекул и белков — вирусов, рибо-, дезоксирибонуклеиновых кислот и других соединений, кристаллизация которых по естественным причинам затруднена.
Огромные массивы экспериментальных данных ученые Курчатовского института обрабатывают при помощи Комплекса моделирования и обработки данных исследовательских установок мега-класса. У этого комплекса небывалое количество функций и возможностей — к примеру, с его помощью можно предсказывать поведение биологических объектов и биомолекул на траекториях в несколько микросекунд, можно даже моделировать биологические процессы в живых клетках!
Краткий конспект подготовки к ЗНО по химии №39 Белки
Белки – это природные полимеры, построенные из остатков аминокислот.
Гидролиз белков
Пептидная связь гидролизуется в кислой или щелочной среде. При этом образуются соли аминокислот по карбоксильной группе или по аминогруппе.
Белки гидролизуются и под действием ферментов
Функции белков в организме
Функции белков в организме.
Строение белков
Первичная структура белка – это последовательность аминокислотных остатков.
Вторичная структура белка – расположение полипептидной цепи в пространстве, обусловленное водородными связями между атомом кислорода карбоксильной группы и атомом водорода аминогруппы разных аминокислотных остатков.
Третичная структура белка – расположение вторичной структуры в пространстве, обусловленное дополнительными взаимодействиями между различными участками полипептидной цепи.
Четвертичная структура белка – объединение нескольких полипептидных цепей в один белок.
Например, гемоглобин состоит из 4 пептидных цепочек, каждая из которых содержит по 140 остатков аминокислот.
Химические свойства белков
1. Денатурация белка
Денатурация – разрушение вторичной, третичной и четвертичной структуры белка при различных воздействиях (нагревании, действии растворителей, иногда даже при энергичном встряхивании). Первичная структура при этом не разрушается.
При снятии неблагоприятных воздействий наступает – ренатурация – восстановление до четвертичной структуры.
Деструкция – полное разрушение, затрагивающее даже первичную структуру.
Деструкция происходит при варке яйца, скисании молока.
2. Качественные реакции на белок
А. При нагревании белки разлагаются с выделением летучих продуктов, издавая характерный запах жженых перьев.
Б. Ксантопротеиновая реакция – пожелтение белка при действии концентрированной азотной кислоты (окраска появляется за счет нитрования бензольных колец, входящих в состав остатков ароматических аминокислот).
В. Биуретовая реакция – окрашивание в ярко-фиолетовый цвет при действии раствора соли меди(II) в щелочной среде – обусловлена образованием комплексов иона меди(II) с боковыми аминогруппами.
Тайная жизнь белков коронавируса | Euronews
Ультрафиолетовые лазеры, масс-спектрометрия, ДНК, платформы для вакцин, белковые структуры….. Европейские исследователи в поиске эффективного орудия борьбы с ковидом используют весь имеющийся арсенал знаний и инструментов. Глобальные усилия в области фундаментальных исследований, объединяющие, безусловно, вирусологов, но также физиков, химиков, генетиков программистов начнут, по мнению наблюдателей, приносить плоды. Посмотрим на прогресс научного сообщества ближе
В Гамбурге исследователи (Heinrich Pette institute — Leibniz institute) спешат разгадать секрет структуры белков, позволяющих коронавирусам, включая новый подтип, так быстро размножаться в клетках человека. Чем лучше ученые поймут глубинную природу этих веществ, тем увереннее продвинутся на пути разработки вакцины или метопов лечения. Первый шаг — исследование процесса воспроизводства белков в клетках разного типа.
Вирусолог Борис Крихель отмечает: «Белки должны воспроизводиться в разных типах клеток, но некоторые сопротивляются нашим усилиям. Это немного сложно. Речь, по-видимому, идет о слишком крупных или модифицированных белках. Вот почему мы должны брать строго определенные виды клеток, которые представляют адекватный контекст для наших исследований».
Специалисты говорят, что их сегодняшние усилия имеют определяющее значение для поиска эффективного антидота.
«Миссия этих белков — в размножении вирусного генома, — уточняет Крихель. — Когда мы поймем, как функционируют различные элементы белка, из чего они состоят, мы получим бесценную информацию для разработки препаратов, блокирующих их активность».
Синтезированные белки специалисты анализируют с помощью секретного оружия — масс-спектрометра. Молекулярный биолог Кира Шамони рассказывает: «Я могу сначала использовать масс-спектрометр для замеров белка, а затем — для анализа вещества, которое, возможно, связывается с белком. То есть сначала я работаю только с белком, а затем — с соединением. С помощью масс-спектрометра я вижу, насколько увязаны эти элементы, насколько сильна эта связь. И это важно, например, для разработки вакцины или лекарств».
Обычно белки исследуют с помощью кристаллографии или с опорой на электронные микроскопы. Для ученых преимущества масс-спектрометрии очевидны.
Вирусолог Шарлотт Утрехт поясняет: «С помощью масс-спектрометрии мы можем одновременно увидеть различные состояния функционирования белка. Мы можем увидеть, был ли он модифицирован, изменилось ли его состояние из-за этой модификации. В рамках проекта мы пытаемся разработать масс-спектрометрию так, чтобы она не только дополнила методы исследования электронным микроскопом, другие структурные анализы, но и достигла аналогичного уровня разрешения детализации».
«Я могу использовать масс-спектрометр для оценки активного состояния белка, — добавляет Кира Шамони. — Могу видеть вещество в динамике. Другие инструменты структурной биологии не позволяют мне провести наблюдения такого типа».
Проект по изучению белковых структур коронавируса, патронируемый Евросоюзом, стартовал еще до пандемии, в 2018 году. На пике кризиса ученые активизировали работу; уже пройденный путь дал им много важнейших элементов, касающихся понимания механизмов размножения вируса.
«Коронавирусы — крепкий орешек для исследователей из-за особенностей их генетического материала, — добавляет Шарлотт Утрехт. — Мы начали проект с SARS-вирусов и родственных им представителей, а сегодня экстраполируем исследования на ковид-19. Надо сказать, что вирусы семейства очень схожи, так что перед нами фактически — те же задачи».
Проект входит в десятки программ ЕС, нацеленных на борьбу с пандемией. По словам Марии Габриэль, комиссара ЕС по исследованиям и инновациям, все они ориентированы на разработку вакцины, поиск методов в лечения и улучшение диагностики.
«Европа- это 7% населения планеты, при это мы обеспечиваем 20% мировых инвестиций в исследования и инновации и 21% научных работ высокого уровня, — напомнила комиссар Габриэль. — Мы должны продолжать поддерживать усилия Европейского исследовательского совета и так обеспечить рабочее состояние нашему исследовательскому мотору. Его приводит в действие любопытство, подталкивающее ученых предельно расширять границы знаний, чтобы предвидеть, что же нас ждет в будущем».
Потребности в науке и исследованиях сегодняшнего и завтрашнего дня будут учтены в готовящейся рамочной программе исследований и инноваций «Горизонт Европа», которая стартует в чрезвычайно сложном контексте. «У нас есть две основные задачи, — рассказывает Мария Габриэль. — Первая — продолжать инвестировать в исследования и инновации; пандемия показала, насколько это важно для поиска решений, которые позволят нашей экономике и обществу лучше подготовиться к следующим кризисам. Вторая задача — сотрудничество и координация. Мы все прекрасно понимаем: вирус не знает границ. Важно сохранить акцент на этом аспекте глобального сотрудничества и координации, чтобы доказать: исследования, патронируемые Евросоюзом, в конечном итоге служат общему благу».
Мы вновь в Гамбурге: исследователи говорят, что их методика не ограничивается коронавирусами или вирусами вообще, она может использоваться применительно к любому биологическому белковому комплексу. Вирусолог Шарлотт Утрехт приводит следующую аналогию: «Возьмем машину. Если мы просто посмотрим на нее снаружи, просто послушаем ее урчание при работе, мы не узнаем, как именно она функционирует. Для этого нам придется рассмотреть двигатель, увидеть его в действии, возможно, разобрать, понять функцию отдельных компонентов. Именно это пытается делать структурная биология: наблюдая за отдельными белками или их соединениями, постигать общую картину, видеть весь клеточный механизм в работе».
Исследователи говорят, что довольны имеющимися в их распоряжении технологиями, однако намерены идти дальше и максимально расширить границы знания. Их проект по наблюдению за белками в структуре клетки рассчитан до 2022 года.
белков
белков
Белки — одна из основных составляющих живого вещества. Они состоят из
длинные цепи аминокислот, которые связаны пептидными связями и
таким образом называемые полипептиды. Аминокислот около 20, и больше всего атомов.
среди них преобладают углерод, водород, кислород, азот и сера. Каждый
аминокислота содержит конец карбоновой кислоты и конец амино. При pH 6-7 (
pH тела 7,3) амино-конец протонирован, а карбоксильный конец остается
анион; это называется цвиттерионом.Некоторые аминокислоты не могут быть синтезированы
телом и должны быть получены с пищей; это аргинин, гистидин, изолейцин,
лизин, метионин, фенилаланин, треонин, триптофан и валин.
Простейшая аминокислота, глицин, показана ниже.
Пептидная связь возникает, когда конец карбоновой кислоты одной аминокислоты связывается с
амино-конец другого. В результате получается огромная цепочка, молекулярная масса которой
колеблется от 5000 до 1000000. Карбонильная группа, азот и водород
вокруг пептидной связи, а также два атома углерода, к которым
и карбонильные группы связаны, лежат в плоскости.Отрицательный заряд электронов
делокализован вокруг всей пептидной связи, явление, называемое резонансом,
и как карбонильная, так и углерод-азотная связи обладают характером двойной связи.
Поскольку связь углерод-азот частично является двойной связью, не может быть
свободное вращение вокруг него.
Порядок линейных связей между аминокислотами в белке называется
его первичная структура. Однако сама молекула изгибается и принимает определенное
строение, называемое его вторичной структурой.Такая общая конформация
альфа-спираль, предложенная в 1951 году Линусом Полингом и Р. Кори, как показано
здесь.
Эта цепочка образует
правая катушка, имеющая 3,7 аминокислот на полную
перемена. Водородная связь существует между водородом, связанным с азотом, и
карбонильная группа аминокислоты на четыре звена вниз по цепи, обеспечивая
жесткость и устойчивость конструкции.
Несколько альфа-спиралей могут
наматываются друг на друга, образуя пряди, которые удерживаются вместе
дисульфидные мостики, такие как в
белки, называемые альфа-кератинами.
Увеличенное изображение этого белка.
Белки также могут существовать в виде складчатых листов или бета-кератинов. В них водород
связь существует между соседними цепями, поскольку они лежат бок о бок. Другая конформация
коллаген или волокнистый белок; это тройная спираль полипептидов,
каждая из которых представляет собой левую спираль.
Иллюстрация субъединицы белка с пятью дисульфидными связями:
показано выше.
Увеличенное изображение этого белка.
Когда несколько полипептидных единиц связаны друг с другом и с другим
более простые молекулы, такие как сахара, неорганические остатки или коферменты, белок
считается, что он имеет четвертичную структуру.Функция белка зависит от
как порядка аминокислот, так и «топографии» его поверхности;
каждый фактор одинаково важен. Эта взаимозависимость основных единиц с
общая форма иллюстрирует тему архитектоники нашего семинара, которая
важность частей и целого как единой функции.
Выше проиллюстрирована структура белка инсулина свиньи.
Увеличенное изображение этого белка.
Эллисон Смит ’99.
Возвращение в архитектонику
25 мая 1996 г.
1.12: Белки — Биология LibreTexts
-
- Последнее обновление
- Сохранить как PDF
- Белки
- Структура белка
- Функции белков
- Белки и диета
- Резюме
- Узнать больше
- Узнать больше I
- Узнать больше II
- Обзор
Вы можете сказали, что белки полезны для вас.Вам они нравятся?
Белки в пищу. Для вас они могут не выглядеть аппетитно (или могут), но они обеспечивают хороший запас аминокислот, строительных блоков белков. Белки выполняют множество важных функций: от транспортировки, передачи сигналов, приема и катализирования до хранения, защиты и обеспечения движения. Где вы берете аминокислоты, необходимые для того, чтобы ваши клетки могли вырабатывать собственные белки? Если вы не можете его приготовить, вы должны его съесть.
Белки
Белок — это органическое соединение, состоящее из небольших молекул, называемых аминокислотами .В белках живых организмов обычно содержится 20 различных аминокислот. Маленькие белки могут содержать всего несколько сотен аминокислот, тогда как большие белки могут содержать тысячи аминокислот. Самые большие известные белки — это тайтины, обнаруженные в мышцах, которые состоят из более чем 27 000 аминокислот.
Общая структура аминокислот. Эта модель показывает общую структуру всех аминокислот. Только боковая цепь R варьируется от одной аминокислоты к другой. Например, в аминокислоте глицине боковая цепь представляет собой просто водород (H).Напротив, в глутаминовой кислоте боковая цепь представляет собой CH 2 CH 2 COOH. Различные боковые цепи придают аминокислотам разные химические свойства. Порядок аминокислот вместе со свойствами аминокислот определяет форму белка, а форма белка определяет функцию белка. КЛЮЧ: H = водород, N = азот, C = углерод, O = кислород, R = вариабельная боковая цепь
Структура белка
Когда аминокислоты связываются вместе, они образуют длинную цепь, называемую полипептидом .Белок состоит из одной или нескольких полипептидных цепей. Белок может иметь до четырех уровней структуры. Самый низкий уровень, первичная структура белка, — это последовательность аминокислот. Более высокие уровни структуры белка описаны на рис. ниже. Сложная структура различных белков придает им уникальные свойства, которые необходимы им для выполнения различных функций в живых организмах. Вы можете узнать больше о структуре белка, просмотрев анимацию по следующей ссылке: http: // www.stolaf.edu/people/giannini/flashanimat/proteins/protein%20structure.swf.
Структура белка. Структура белка начинается с его последовательности аминокислот. Что определяет вторичную структуру белка? Каковы два типа вторичной структуры белка?
Функции белков
Белки играют важную роль в живых организмах. Некоторые белки помогают клеткам сохранять свою форму (структурные белки), некоторые, такие как соединительные и моторные белки, составляют мышечные ткани, а некоторые транспортируют элементы в клетки и из них (транспортные белки).Некоторые белки действуют как сигналы, а другие белки принимают эти сигналы. Ферменты — это белки, которые ускоряют химические реакции в клетках. Другие белки — это антитела , которые связываются с чужеродными веществами, такими как бактерии, и нацелены на их разрушение. Третьи белки несут сообщения или транспортируют материалы. Например, красные кровяные тельца человека содержат белок под названием гемоглобин , который связывается с кислородом. Гемоглобин позволяет крови переносить кислород от легких к клеткам по всему телу.Модель молекулы гемоглобина показана на рис. ниже.
Молекула гемоглобина. Эта модель представляет собой белок гемоглобин. Фиолетовая часть молекулы содержит железо. Железо связывается с молекулами кислорода.
Короткое видео с описанием функции белков можно посмотреть на http://www.youtube.com/watch?v=T500B5yTy58 (4:02).
«Когда вы рассматриваете функции белков в организме, сосредотачивает внимание на следующих концепциях:
- количество белка в каждой клетке,
- роли различных типов белков.«
Белки и диета
Белки в рационе необходимы для жизни. Пищевые белки расщепляются на составляющие их аминокислоты при переваривании пищи. Затем клетки могут использовать эти компоненты для создания новых белков. Люди способны синтезировать все, кроме восьми из двадцати обычных аминокислот. Эти восемь аминокислот, называемые незаменимыми аминокислотами , необходимо употреблять с пищей. Как и пищевые углеводы и липиды, пищевые белки также могут расщепляться, чтобы обеспечить клетки энергией.
Резюме
- Белки — это органические соединения, состоящие из аминокислот.
- Белок может иметь до четырех уровней структуры. Сложная структура различных белков придает им уникальные свойства.
- Ферменты — это белки, ускоряющие биохимические реакции в клетках. Антитела — это белки, нацеленные на уничтожение патогенов.
Узнать больше
Используйте эти ресурсы, чтобы ответить на следующие вопросы.
Узнать больше I
- Приведите 3 примера белков.
- Что определяет первичную структуру белка?
- Что определяет функцию белка?
- Как можно нарушить конформацию белка?
Узнать больше II
- Сколько различных белков содержится в клетке?
- Какую функцию рецепторные белки и структурные белки выполняют в нервных клетках?
- Какая информация используется для создания отдельного белка?
- В какой части клетки производятся белки?
Обзор
- Белки сделаны из ____________.
- Что определяет первичную структуру белка?
- Укажите две функции белков.
- Что такое ферменты?
- Опишите роль гемоглобина.
Определение белка по Merriam-Webster
защита
| \ ˈPrō-ˌtēn
также ˈprō-tē-ən
\
1
: любое из различных природных чрезвычайно сложных веществ, которые состоят из аминокислотных остатков, соединенных пептидными связями, содержат элементы углерод, водород, азот, кислород, обычно серу, а иногда и другие элементы (такие как фосфор или железо), и включают многие важные биологические соединения (такие как ферменты, гормоны или антитела)
2
: общее азотистое вещество в растительных или животных веществах
История и этимология белка
заимствовано из французского protéine, из позднегреческого prōteîos «первого качества» (от греческого prôtos «прежде всего» + -eios, суффикс прилагательного , первоначально от s-основы) + -ine -ine entry 1 — подробнее на proto-
Примечание:
Термин белок был введен голландским химиком Йоханнесом Герардусом Малдером (1802-80) в качестве французского protéine в статье «Sur laposition de quelquesents animales» ( Bulletin des Sciences Physiques et naturelles en Néerlande, vol. .1 [1838], pp. 104-19), и как голландский белок в статье «Over Proteine en hare Verbindingen en Ontleidingsproducten» ( Natuuren scheikundig Archief, vol. 6 [1838], pp. 87- 162). Хотя Малдер в начале статей выражает благодарность Йонсу Якобу Берцелиусу за его поддержку, он не упоминает никакой связи между Берцелиусом и новым словом. Однако в двадцатом веке было обнаружено, что Берцелиус предложил слово Малдеру в письме, написанном 10 июля 1838 г. voulais le dériver de πρωτειος, parce qu’il paraît être la element primitive or Principale de la food animale que les plantes préparent for les herbivores et que ceux-ci fournissent ensuite aux carnassiers.»(» Название протеин, которое я предлагаю для органического оксида фибрина и альбумина, я хочу получить от prōteios, , потому что это, по-видимому, примитивное или основное вещество питания животных, которое растения готовят для травоядных и которое последние затем обеспечивают плотоядных животных », — цитируется в HB Vickery,« Происхождение слова протеин », Йельский журнал биологии и медицины, том 22, № 5 [май, 1950], стр. 387-93 .) Во французской статье Малдер смешивает слово prōteîos с латинским primarius «первичный»: «Органический материал, являющийся основным элементом всех составных частей тела животного и находящийся, как мы увидим позже. , в растительном царстве, может быть назван протеином от prōteîos… »(La matière organique, étant un principe général de toutes les party constituantes du corps animal, et se Trouvant, come nous verrons tantôt, dans le règne végétal, pourrait se nommer Protéine de πρωτεῖος primarius.Это, по-видимому, собственное толкование греческого слова Малдером, поскольку в ведущем греческом словаре того времени в книге Франца Пассова Handwörterbuch der griechischen Sprache (4. Ausgabe, 1831) оно определяется только как существительное мужского рода: «первый ранг, первое место, первенство, приоритет »(« erster Rang, erster Platz, Vorrang, Vorzug »). Подробнее см. цитируемую выше статью HB Vickery и Гарольда Хартли« Происхождение слова «белок» », Nature, том 168, выпуск 4267 (11 августа 1951 г.), стр.244.
Глава 3.Белки и аминокислоты
Глава 3. Белки и аминокислоты
1. БЕЛКИ
2. ПИЩЕВАРЕНИЕ БЕЛКОВ
И МЕТАБОЛИЗМ
3. ОБЩИЕ ТРЕБОВАНИЯ К БЕЛКАМ
4. АМИНОКИСЛОТЫ
5. КОЛИЧЕСТВО
ТРЕБОВАНИЯ К АМИНОКИСЛОТЕ
6. ДОБАВКА
ДИЕТЫ С АМИНОКИСЛОТАМИ
7. ССЫЛКИ
J. E. Halver
Вашингтонский университет
Сиэтл, Вашингтон
1.1 Классификация
1.2 Структура
1.3 Свойства
1.4 Химическое определение
Белки представляют собой сложные органические соединения, состоящие из множества аминокислот, связанных вместе пептидными связями и поперечно связанных между цепями сульфгидрильными связями, водородными связями и силами Ван-дер-Ваальса. Химический состав белков больше, чем у любой другой группы биологически активных соединений. Белки в различных клетках животных и растений придают этим тканям их биологическую специфичность.
1.1 Классификация
Белки можно разделить на:
(а) Простые белки. При гидролизе они дают только аминокислоты и иногда небольшие углеводные соединения. Примеры: альбумины, глобулины, глютелины, альбуминоиды, гистоны и протамины.
(b) Конъюгированные белки. Это простые белки в сочетании с некоторыми небелковыми веществами в организме. Примеры: нуклеопротеины, гликопротеины, фосфопротеины, гемоглобины и лецитопротеины.
(c) Производные белки. Это белки, полученные из простых или конъюгированных белков физическими или химическими способами. Примеры: денатурированные белки и пептиды.
1,2 Конструкция
Потенциальная конфигурация белковых молекул настолько сложна, что многие типы белковых молекул могут быть сконструированы и обнаружены в биологических материалах с различными физическими характеристиками. Глобулярные белки обнаруживаются в крови и тканевых жидкостях в аморфной глобулярной форме с очень тонкими или отсутствующими мембранами.Коллагеновые белки находятся в соединительной ткани, такой как кожа или клеточные мембраны. Волокнистые белки содержатся в волосах, мышцах и соединительной ткани. Кристаллические белки представлены хрусталиком глаза и подобными тканями. Ферменты — это белки с определенными химическими функциями, которые опосредуют большинство физиологических процессов жизни. Несколько небольших полипептидов действуют как гормоны в тканевых системах, контролирующих различные химические или физиологические процессы. Мышечный белок состоит из нескольких форм полипептидов, которые позволяют мышцам сокращаться и расслабляться при физических движениях.
1.3 Недвижимость
Белки также можно охарактеризовать по их химическим реакциям. Большинство белков растворимы в воде, спирте, разбавленной основе или в различных концентрациях солевых растворов. Белки имеют характерную спиралевидную структуру, которая определяется последовательностью аминокислот в первичной полипептидной цепи и стереоконфигурацией радикальных групп, присоединенных к альфа-углероду каждой аминокислоты. Белки термолабильны, проявляя различную степень лабильности в зависимости от типа белка, раствора и температурного профиля.Белки могут быть обратимыми или необратимыми, денатурированными при нагревании, концентрации соли, замораживании, ультразвуковом воздействии или старении. Белки подвергаются характерному связыванию с другими белками в так называемой пластеиновой реакции и соединяются со свободными альдегидными и гидроксильными группами углеводов с образованием соединений типа Майяра.
1.4 Химическое определение
Содержание азота в большинстве белков, обнаруженных в тканях животных, орехов и зерна, составляет около 16 процентов; поэтому содержание белка обычно выражается как содержание азота × 6.25.
Проглоченные белки сначала расщепляются на более мелкие фрагменты пепсином в желудке или трипсином или химотрипсином из поджелудочной железы. Эти пептиды затем дополнительно восстанавливаются под действием карбоксипептидазы, которая гидролизует одну аминокислоту за раз, начиная со свободного карбоксильного конца молекулы, или с помощью аминопептидазы, которая отщепляет одну аминокислоту за раз, начиная со свободного амино-конца полипептида. цепь. Свободные аминокислоты, высвобождаемые в пищеварительную систему, затем всасываются через стенки желудочно-кишечного тракта в кровоток, где они затем повторно синтезируются в новые тканевые белки или катаболизируются для получения энергии или фрагментов для дальнейшего тканевого метаболизма.
Валовая потребность в белке была определена для нескольких видов рыб (см. Таблицу 1). Имитация цельного яичного протеина в тестовых диетах содержит избыток незаменимых аминокислот. Эти диеты поддерживались приблизительно изокалорийными за счет корректировки общего белка и усвояемых углеводных компонентов до фиксированного количества, поскольку лечение белковыми диетами варьировалось в испытанных диапазонах. Испытания на кормлении мальков, сеголетков и годовалых рыб показали, что общие потребности в белке наиболее высоки у начальных кормовых мальков и что они уменьшаются по мере увеличения размера рыбы.Чтобы расти с максимальной скоростью, мальки должны иметь диету, в которой почти половина легкоусвояемых ингредиентов состоит из сбалансированного белка; через 6-8 недель это требование снижается примерно до 40 процентов рациона лосося и форели и примерно до 35 процентов рациона годовалых лососевых, выращенных при стандартной температуре окружающей среды (SET). См. Рисунки 1 и 2. Общие потребности в белке молоди сома, по-видимому, меньше, чем у лососевых. Первоначально кормление мальков требует, чтобы около 50 процентов усвояемых компонентов рациона составлял белок, и потребность в них уменьшается с увеличением размера.Некоторые испытания кормления лососем показали прямую связь между изменениями потребности в белке молоди рыбы и изменениями температуры воды. Лосось чавычи в воде с температурой 7 ° C требует около 40 процентов цельного яичного белка для максимального роста; той же рыбе в воде с температурой 15 ° C требуется около 50% белка. Лосось, форель и сом могут использовать больше белка, чем требуется для максимального роста, благодаря эффективному удалению азотистых отходов в виде растворимых соединений аммиака через ткань жабр непосредственно в водную среду.Эта система удаления азота более эффективна, чем система, доступная для птиц и млекопитающих. Птица и млекопитающие потребляют энергию для синтеза мочевины, мочевой кислоты или других соединений азота, которые выводятся через ткань почек и выводятся с мочой. Перевариваемые углеводы и жиры сохранят избыток белка в рационе до тех пор, пока удовлетворяются потребности в белке для максимального роста (рисунки 1 и 2).
Таблица 1 — Расчетная потребность в белке с пищей для некоторых видов рыб 1/
|
Виды |
Уровень сырого протеина в рационе для оптимального роста (г / кг) |
|
Форель радужная ( Salmo gairdneri ) |
400-460 |
|
Карп ( Cyprinus carpio ) |
380 |
|
Чавыча ( Oncorhynchus tshawytscha ) |
400 |
|
Угорь ( Ангилья японский ) |
445 |
|
Камбала ( Pleuronectes platessa ) |
500 |
|
Золотистый лещ ( Chrysophrys aurata ) |
400 |
|
Белый амур ( Ctenopharyngodon idella ) |
410-430 |
|
Brycon sp. |
356 |
|
Морской лещ ( Chrysophrys major ) |
550 |
|
Желтохвост ( Seriola quinqueradiata ) |
550 |
1/ По материалам C.B. Cowey, 1978
Рис. 1. Потребность в белке чавычи при 47 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы, 1.5г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,6 г.
Рис. 2. Потребность в белке чавычи при температуре 58 ° F. Верхняя кривая: исходный индивидуальный средний вес рыбы 2,6 г. Нижняя кривая: исходная индивидуальная средняя масса рыбы 5,8 г.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr ., 65: 589-99)
Обычно рыбе нужно давать диету, содержащую градуированные уровни высококачественного белка и энергии и адекватный баланс незаменимых жирных кислот, витаминов и минералов в течение длительного периода времени.Из полученной кривой доза / ответ потребность в белке обычно получают по графику Альмквиста. Считается, что эти различия в очевидной потребности в белке связаны с различиями в методах культивирования и составе рациона.
Относительно высокий уровень пищевого белка, необходимый для максимального роста некоторых рыб, таких как белый амур, Ctenopharyngodon idella, и Brycon spp. Удивительны тем, что эти рыбы всеядны. Brycon spp.выращиваются на нежелательных фруктах и другом растительном материале с низким содержанием белка, и в этих условиях, по-видимому, существенный вклад в потребление ими белка вносит естественная пищевая цепь.
Потребность в белке эвриталиновых рыб, таких как радужная форель, Salmo gairdneri, и кижуч, Oncorhynchus кисач, , выращенных в воде с соленостью 20 ppt, примерно такая же, как потребность в пресной воде. Нет данных о потребности этих видов в белке в морской воде с полной концентрацией.(35 п.
4.1 Essential
и заменимые аминокислоты
4.2 Незаменимые
Аминокислоты и качество протеина
Аминокислоты являются строительными блоками белков; около 23 аминокислот были выделены из природных белков. Десять из них незаменимы для рыб. Животное не способно синтезировать незаменимые аминокислоты и поэтому должно получать их с пищей.
4.1 Незаменимые и заменимые аминокислоты
Корм для лосося, форели и канального сома, лишенный аргинина, гистидина, изолейцина, лейцина, лизина, метионина, фенилаланина, треонина, триптофана или валина, не рос (рис.3). Те же самые рыбы, которых кормили рационами, лишенными других L-аминокислот, росли так же, как и рыбы, получавшие все 18 протестированных аминокислот (рис. 4). Азотный компонент в тестируемых диетах состоял из 18 L-аминокислот по образцу цельного яичного белка. Вся тестируемая рыба быстро выздоравливала, когда в рационе была заменена недостающая аминокислота. Наклон кривой роста в группе восстановления был идентичен таковому у рыб, получавших полный тест на аминокислотный рацион.
Испытывали незаменимые аминокислоты: аланин, аспарагиновая кислота, цистин, глутаминовая кислота, глицин, пролин, серин и тирозин.Было обнаружено, что эти аминокислоты не являются необходимыми для роста лосося, форели и канального сома.
Для количественных исследований потребностей в 10 незаменимых аминокислотах использовалась смесь казеина и желатина с добавлением кристаллических L-аминокислот. Тестовая диета содержала 40 процентов цельного яичного белка для азотного компонента. Эксперименты, проведенные с карпом и угрем, показали аналогичное отсутствие роста, когда в рационе отсутствовала незаменимая аминокислота.
Рис. 3. Рост рыб с дефицитом аргинина. Группа с дефицитом была разделена через шесть недель на диете с дефицитом, и недостающая аминокислота была заменена в одной из двух частей.
Рис. 4. Рост рыб с дефицитом цистина.
(Оба рисунка взяты из: DeLong, D.C., J.E. Halver and E.T. Mertz, 1958, J.Nutr., 65: 589-99)
4.2 Основные аминокислоты и качество белка
Если известны потребности рыбы в незаменимых аминокислотах, должно быть возможно удовлетворить эти потребности в системах культивирования различными способами за счет различных пищевых белков или комбинаций пищевых белков.
Фенилаланин избавлен от тирозина. Неизвестно, что он химически модифицирован или становится недоступным из-за суровых условий, которым обычно подвергаются кормовые белки во время обработки. Измерение фенилаланина в белках несложно, поэтому обеспечение и оценка фенилаланина в белках в практических диетах не представляет особых трудностей.
Лизин — основная аминокислота. В дополнение к -аминокислотной группе, обычно связанной пептидной связью, он также содержит вторую, -аминогруппу.Эта альфа-аминогруппа должна быть свободной и реакционной, иначе лизин, хотя и поддается химическому измерению, не будет доступен биологически. Во время обработки белков корма α-аминогруппа лизина может реагировать с небелковыми молекулами, присутствующими в корме, с образованием дополнительных соединений, которые делают лизин биологически недоступным.
Цистин избавлен от метионина. Однако измерить содержание метионина в кормовых белках непросто, поскольку аминокислота подвержена окислению во время обработки.После обработки метионин может присутствовать как таковой, или в виде сульфоксида, или в виде сульфона. Сульфоксид может образовываться из метионина во время кислотного гидролиза кормового белка перед измерением его кислотного состава, не содержащего кислоты. Кислотный гидролиз белков перед анализом нарушает исходное равновесие между двумя соединениями, так что состав гидролизата больше не отражает состав белка. При определении содержания метионина в чистых белках окисление аминокислоты до метионинсульфона обычно является количественным.В случае кормовых белков, однако, это не покажет, сколько метионина или сульфоксида метионина присутствовало в белке до его окисления и гидролиза.
Сульфоксид метионина может иметь некоторую биологическую ценность для рыб, которая может иметь некоторую способность обратного преобразования его в метионин и, таким образом, частично восполнять часть метионина, окисленного во время обработки.
Недавно появились сообщения о методах измерения метионина в белках с использованием йодоплатинатного реагента до и после восстановления трихлоридом титана, чтобы получить значения как для метионина, так и для сульфоксида в исходном белке.Также был описан способ измерения метионина конкретно по расщеплению цианогенбромида. Оба метода еще предстоит оценить независимо. Микробиологический анализ метионина в белках кормов является ценным инструментом, хотя существует опасность того, что оксиды метионина могут различаться по своей активности в отношении микроорганизмов и искажать значения.
Количественные потребности лососевых в десяти незаменимых аминокислотах были определены путем кормления линейными приращениями одной аминокислоты за раз в тестируемой диете, содержащей аминокислотный профиль, идентичный цельному яичному белку, за исключением тестируемой аминокислоты.Повторяющиеся группы рыб подвергались диетическому лечению до тех пор, пока не появлялись большие различия в росте исследуемых партий. График реакции роста Альмквиста показывает уровень аминокислот, необходимый для максимального роста в этих конкретных условиях испытания. Рационы были разработаны таким образом, чтобы содержать белок на уровне или немного ниже оптимальной потребности в белке для данного вида и условий тестирования, чтобы гарантировать максимальное использование ограничивающей аминокислоты. Сравнение требований к десяти незаменимым аминокислотам между видами показано в таблице 2.
Недавним нововведением стало использование в тестовых диетах белков, относительно дефицитных по данной незаменимой аминокислоте. Таким образом, комбинации рыбной муки и зеина использовались в тестовых диетах для определения потребности радужной форели в аргинине. Рационы, содержащие различные относительные количества казеина и желатина, показали, что увеличение уровня связанного с белками аргинина с 11 до 17 г / кг привело к значительному увеличению роста канального сома.
Таблица 2 Потребность семи животных в аминокислотах 1/
|
Аминокислота |
Молодь угря |
Мальки карпа |
Сом канальный |
Молодь чавычи |
Цыпленок |
Молодой поросенок |
Крыса |
|
Аргинин |
3.9 (1,7 / 42) |
4,3 (1,65 / 38,5) |
6,0 (2,4 / 40) |
6,1 (1,1 / 18) |
1,5 (0,2 / 13) |
1,0 (0,2 / 19) |
|
|
Гистидин |
1,9 (0,8 / 42) |
1,8 (0,7 / 40) |
1,7 (0,3 / 18) |
1.5 (0,2 / 13) |
2,1 (0,4 / 19) |
||
|
Изолейцин |
3,6 (1,5 / 42) |
2,6 (1,0 / 38,5) |
2,2 (0,9 / 41) |
4,4 (0,8 / 18) |
4,6 (0,6 / 13) |
3,9 (0,5 / 13) |
|
|
лейцин |
4.1 (1,7 / 42) |
3,9 (1,5 / 38,5) |
3,9 (1,6 / 41) |
6,7 (1,2 / 18) |
4,6 (0,6 / 13) |
4,5 (0,9 / 19) |
|
|
Лизин |
4,8 (2,0 / 42) |
5,1 (1,23 / 24,0) |
5,0 (2,0 / 40) |
6.1 (1.1 / 18) |
4,7 (0,65 / 13) |
5,4 (1,0 / 19) |
|
|
метионин 2/ |
4,5 (2,1 / 42) 3/ |
3,1 (1,2 / 38,5) |
2,3 (0,56 / 24,0) |
4,0 (1,6 / 40) 3/ |
4.4 (0,8 / 18) |
3,0 (0,6 / 20) |
3,0 (0,6 / 20) |
|
Фенилаланин 4/ |
5,1 (2,1 / 41) 5/ |
7,2 (1,3 / 18) |
3.6 (0,45 / 13) |
5,3 (0,9 / 17) |
|||
|
Треонин |
3,6 (1,5 / 42) |
2,2 (0,9 / 40) |
3,3 (0,6 / 18) |
3,0 (0,4 / 13) |
3,1 (0,2 / 19) |
||
|
Триптофан |
1,0 (0,4 / 42) |
0.5 (0,2 / 40) |
1,1 (0,2 / 18) |
0,8 (0,2 / 25) |
1,0 (0,2 / 19) |
||
|
Валин |
3,6 (1,5 / 42) |
3,2 (1,3 / 40) |
4,4 (0,8 / 18) |
3,1 (0,4 / 13) |
3,1 (0,4 / 13) |
1/ Выражается в процентах от диетического белка.В скобках числители — это потребности в процентах от сухого рациона, а знаменатели — это процент общего содержания белка в рационе.
2/ При отсутствии цистина
3/ Метионин плюс цистин
4/ При отсутствии tyro sine
5/ Фенилаланин плюс тирозин
(по материалам: Национальный исследовательский совет, 1977 г.)
Потребность радужной форели в аргинине была определена по стандартной кривой доза / реакция (рост), а также путем измерения уровней свободного аргинина в тканях (крови и мышцах) в группах форели, получавших возрастающее количество аргинина в рационе.После того, как диетическая потребность форели в аргинине была удовлетворена, любое дальнейшее увеличение потребления аргинина привело к увеличению концентрации свободного аргинина в крови и мышцах. Было получено хорошее согласие между двумя методами.
Данные, представленные в таблице 2, позволяют предположить, что между видами рыб существуют реальные различия в их потребностях в определенных аминокислотах. Это приводит к трудностям при составлении белкового компонента практического рациона для тех видов, потребности которых в аминокислотах еще не известны.Возможное решение — использовать для каждой аминокислоты наивысший уровень, необходимый для любого из тех видов, по которым имеются данные. Необходимость дополнительных количественных данных о потребностях рыб в аминокислотах, особенно тех, которые действительно или потенциально могут использоваться в качестве сельскохозяйственных животных, очевидна.
Одним из решений использования белков, которые относительно дефицитны по одной или нескольким аминокислотам, является добавление в белок соответствующих количеств аминокислоты, необходимых в практических диетах. Рыба, по-видимому, использует свободные аминокислоты с разной степенью эффективности.
Молодой карп, Cyprinus carpio, оказался неспособным расти на диетах, в которых белковый компонент (казеин, желатин) был заменен смесью аминокислот, аналогичных по общему составу. Гидролизат трипсина казеина также оказался неэффективным. Однако, если диета, содержащая свободные аминокислоты в качестве белкового компонента, тщательно нейтрализуется NaOH до pH 6,5-6,7, то некоторый рост молоди карпа действительно происходит. Этот рост был заметно ниже, чем при сопоставимой казеиновой диете в тех же условиях.
Канальный сом также не может использовать свободные аминокислоты в качестве добавок к дефицитным белкам. При изонитрогенной замене соевого шрота на муку менхадена рост и эффективность корма канального сома существенно снизились. Добавление свободного метионина, цистина или лизина, наиболее ограничивающих аминокислот, к этим заменителям сои не привело к увеличению веса.
Повышение уровня аргинина в рационах сома с 11 до 17 г / кг путем изонитрогенной замены желатина на казеин значительно увеличивало набор веса, но добавление свободного аргинина, цистина, триптофана или метионина к казеину мало влияло на рост или преобразование пищи.
Лососевые могут использовать свободные аминокислоты для роста. Было показано, что зеин-желатиновая диета с добавлением лизина и тритофана заметно превосходит зеин-желатиновую диету для радужной форели, когда в качестве критериев использовались прибавка в весе и использование белка.
Несколько исследователей продемонстрировали возможность дополнения белков с дефицитом аминокислот ограничивающими аминокислотами в рационах лососевых. Казеин с добавкой шести аминокислот давал коэффициенты конверсии корма для атлантического лосося, аналогичные тем, которые были получены при использовании изолированного рыбного белка в качестве источника пищевого белка.Соевый шрот с добавлением пяти или более аминокислот (включая метионин и лизин) был лучшим источником белка для радужной форели по сравнению с соевым шротом. Однако однократное добавление метионина и лизина не привело к повышению ценности соевого шрота. Эти результаты позволяют предположить, что аминокислотный спектр выделенного рыбьего белка, который они использовали, может приблизительно соответствовать потребности в аминокислотах радужной форели. Пищевая ценность изолята соевого белка может быть увеличена путем добавления в него первой ограничивающей аминокислоты; я.е., метионин.
Рационы, содержащие в качестве белкового компонента рыбную муку, мясокостную муку, а также дрожжевую и соевую муку, можно улучшить путем одновременного добавления цистина (10 г / кг) и триптофана (5 г / кг). Рыбную муку можно полностью заменить без снижения конверсии корма в рационах для радужной форели смесью из субпродуктов домашней птицы и перьевой муки вместе с 17 г лизина HCL / кг, 4,8 г DL-метионина / кг и 1,44 г DL. -триптофан / кг.
Коуи, К.Б. и Дж. Р. Сардженты, 1972 Кормление рыб. Adv.Mar.Biol., 10: 383-492
Коуи, К. Б., 1979 Потребности рыб в белках и аминокислотах. В Технология кормления и кормления рыб, под редакцией Дж. Э. Халвера и К. Тьюса. Материалы Всемирного симпозиума, спонсируемого EIFAC / FAO, ICES и IUNS, Гамбург, 20-23 июня 1978 г. Schr . Bundesforschungsanst . Fisch ., Hamb ., (14/15) vol. 1: 3-16
Мерц, Э.Т., 1972 г. Потребности в белке и аминокислотах. В Питание рыб, под редакцией Дж. Э. Халвера. Нью-Йорк, Academic Press, стр. 106-43.
Национальный исследовательский совет, Подкомитет по тепловодным рыбам 1977 года, Потребности теплопроводных рыб в питательных веществах. Вашингтон, округ Колумбия, Национальная академия наук (потребности домашних животных в питательных веществах) 78 стр.
|
Набор проблем с большими молекулами Проблема 3: третичная структура белка
Третичная структура белка относится к:
Учебник
Биологический проект http: // www.biology.arizona.edu |
|
NASA Astrobiology Institute
На основе пресс-релиза NASA Ames Research Center
Благодаря новому суперкомпьютеру ученые могут стать на шаг ближе к пониманию одной из наиболее сложных загадок природы. Ученые из Исследовательского центра Эймса НАСА используют SGI 512-процессор Origin 3000, самый мощный параллельный суперкомпьютер в своем роде, чтобы попытаться определить структуру белков.
Белки играют фундаментальную роль в живых клетках, выступая в качестве катализаторов всех химических реакций. Белки также действуют как своего рода «нервная система» клетки, передавая сигналы из внешней среды. Они помогают транспортировать питательные вещества в клетку, а также помогают преобразовывать эту пищу в энергию.
Функция конкретного белка определяется его формой. Белок состоит из жесткой основы, состоящей из атомов углерода, кислорода и азота. К этой основной цепи слабо прикреплены цепочки аминокислот (связь между каждой аминокислотой называется пептидной связью).Эта цепочечная молекула, которая может содержать от 50 до нескольких сотен аминокислот, называется полипептидом. Некоторые белки состоят только из одной полипептидной цепи, в то время как другие состоят из нескольких цепей, удерживаемых вместе слабыми молекулярными связями. Эти цепочки аминокислот определяют форму белка.
«Исходя из информации об аминокислотной последовательности, должно быть возможно, используя вычислительные методы, определить структуру белка только на основе этой последовательности», — говорит Эндрю Похорилл, ученый из Исследовательского центра Эймса.
Но ученые обнаружили, что очень трудно определить структуру белка, даже зная последовательность его аминокислот, потому что каждая аминокислота может иметь пять возможных различных ориентаций. Поскольку белки содержат не менее 50 аминокислот, даже самые короткие белки могут иметь аминокислоты, расположенные в тысячах различных возможных комбинаций.
Цепочки аминокислот петляют друг вокруг друга множеством способов, складываясь в характерную форму. То, как они складываются друг в друга, определяет как структуру, так и функцию белка.Сложность определения структуры белка по составляющим его аминокислотам известна как «проблема сворачивания белка».
Похорилл говорит, что существует множество вычислительных методов, которые пытаются решить проблему сворачивания белков. Самый прямой метод пытается определить серию маленьких шагов, которые привели к тому, что белок сложился в определенную форму.
Однако этот метод требует очень много времени, поскольку он состоит примерно из тысячи триллионов шагов.Компьютер, способный вычислять один миллион таких шагов в секунду, должен был бы работать круглосуточно в течение 32 лет, чтобы выполнить эту задачу. Крупнейшие компьютерные симуляции, выполненные до сих пор, охватывают всего триллион шагов.
«Мы надеемся, что благодаря сочетанию новых мощных компьютеров, эффективного параллельного программирования и новых алгоритмов мы сможем достичь нашей цели», — говорит Похорилл. «Методы трехмерной визуализации и манипулирования структурами, которые разрабатываются Крисом Хенце и его группой, должны в значительной степени помочь нашим усилиям.”
«То, что раньше занимало год для расчета на одном процессоре, может быть выполнено менее чем за день на машине с 512 процессорами», — говорит Хенце, другой ученый из Эймса, который работает над моделированием образования белка с помощью Pohorille. «Тем не менее, при нынешних мощностях суперкомпьютеров потребуются месяцы или годы расчетов, чтобы смоделировать, как даже небольшая молекула белка складывается в определенную форму».
Это исследование является частью более широкого проекта, финансируемого Институтом астробиологии НАСА, по созданию лабораторных моделей протоклеток (предков первых клеток) путем сочетания экспериментальных и вычислительных исследований.Белки в современных клетках намного сложнее, чем они были бы в примитивных протоклетках. Поскольку протоклеток сегодня не существует, единственный способ понять, как они могли работать, — это реконструировать их в лаборатории.
«Одна из целей астробиологии — понять происхождение жизни на Земле и в других местах Вселенной», — говорит Похорилл. «Несомненно, важную роль в этом процессе сыграли белки. До сих пор попытки конструировать простые, но все же функциональные белки были в основном безуспешными.Мы хотим разработать такие белки ».
Что дальше?
Похорилл и его команда сотрудничают с Гарвардской медицинской школой над новой экспериментальной техникой создания белков. Похорилл говорит, что исследователи из Гарварда разработали небольшие белки, которые выполняют определенные желаемые функции. Результаты исследования будут опубликованы в следующем номере журнала Nature.
«Однако структура этого нового белка остается неизвестной», — говорит Похорилл. «Мы хотим иметь возможность сворачивать этот белок и другие подобные белки, которые вскоре появятся.”
Pohorille также работает над проектом, который включает моделирование небольшого белка. Этот белок способен внедряться в клеточную мембрану и формировать каналы, по которым протоны поступают в клетку. Такой перенос протонов является важным шагом в преобразовании энергии для управления химией клетки.
«Мы уже получили некоторое представление о том, как работает этот белок — в прошлом году об этом была написана короткая статья в New Scientist», — говорит Похорилл. «Однако, чтобы сделать его полезным для протоклеток, белок необходимо несколько переработать.Новый компьютер должен сделать это возможным ».
ОТПРАВИТЬ ЭТУ ИСТОРИЮ ДРУГУ
аминокислот и белковых последовательностей
Каждый белок или пептид состоит из линейной последовательности аминокислот. Первичная структура белка обычно начинается на аминоконцевом (N) конце и продолжается до карбоксильного (C) конца. Структура белка может быть непосредственно секвенирована или выведена из последовательности ДНК.
Аминокислотная последовательность белка или пептида является полезной информацией для понимания белка или пептида, идентификации его в образце и классификации его посттрансляционных модификаций.Процесс определения аминокислотной последовательности известен как секвенирование белков.
Обозначение
Последовательность белка обычно обозначается строкой букв в соответствии с порядком аминокислот от амино-конца к карбоксильному концу белка. Для представления каждой аминокислоты в последовательности можно использовать одно- или трехбуквенный код.
В природе существует 20 аминокислот, которые могут быть представлены трех- или однобуквенным кодом, как показано ниже:
- Аланин (Ала, А)
- Аргинин (Arg, R)
- Аспарагин (Asn, N)
- Аспарагиновая кислота (Asp, D)
- Цистеин (Cys, C)
- Глутаминовая кислота (Glu, E)
- Глютамин (Gln, Q)
- Глицин (Gly, G)
- Гистидин (His, H)
- Изолейцин (Иль, I)
- Лейцин (Leu, L)
- Лизин (Lys, K)
- Метионин (Met, M)
- Фенилаланин (Phe, F)
- Пролайн (Pro, P)
- Серин (Ser, S)
- Треонин (Thr, T)
- Триптофан (Trp, Вт)
- Тирозин (Tyr, Y)
- Валин (Val, V)
Методы секвенирования белков
Есть два основных метода, используемых для поиска аминокислотных последовательностей белков.В настоящее время масс-спектрометрия является наиболее распространенным методом из-за простоты ее использования. Деградация по Эдману с использованием секвенатора белка является вторым методом, который наиболее полезен, если необходимо охарактеризовать N-конец белка.
Полезно знать, какая аминокислота находится на N-конце белка, как для упорядочивания пептидных фрагментов во всей цепи, так и для уменьшения влияния примесей, которые обычно возникают в первом раунде деградации по Эдману. N-конец можно идентифицировать по:
- Использование реагента для маркировки аминокислоты на конце белка.
- Гидролиз белка
- Использование хроматографии и других методов сравнения для идентификации меченого белка.
Существует меньше методов, которые практически можно использовать для идентификации С-конца белка. Однако один из методов, который можно использовать, включает добавление карбоксипептидаз к раствору белка и регулярный отбор образцов. График зависимости концентрации аминокислот от времени может помочь идентифицировать аминокислоту на С-конце.
Деградация по Эдману позволяет обнаруживать последовательность аминокислот в белке с помощью секвенаторов Эдмана, которые в настоящее время способны секвенировать пептиды длиной примерно до 50 аминокислот. Это включает в себя несколько шагов, чтобы:
- Используйте восстановитель, чтобы разорвать дисульфидные мостики в белке.
- Разделите цепь (и) белкового комплекса и очистите их.
- Определите состав и концевые аминокислоты каждой цепи.
- Разорвать каждую цепь на небольшие фрагменты (менее 50 аминокислот в каждом)
- Разделите фрагменты и очистите их.
- Используйте фрагменты для определения аминокислотной последовательности.
- Предыдущие шаги следует повторить с другим шаблоном фрагментов, чтобы можно было восстановить полную последовательность белка с минимальными ошибками.
Аминокислотный состав и анализ
Неупорядоченный состав аминокислоты часто является полезной информацией при попытке определить упорядоченную последовательность белка. Это потому, что он может помочь выявить ошибки и интерпретировать неоднозначные результаты.Кроме того, частота встречаемости аминокислот также может помочь выбрать протеазу, которая больше подходит для переваривания белка.
Есть два основных шага для определения частоты встречаемости аминокислот в процессе, известном как аминокислотный анализ. Во-первых, гидролиз известного количества белка должен расщепить его на мономеры аминокислот. Затем их можно разделить и количественно оценить с помощью различных методов.
Гидролиз обычно проводят путем нагревания образца белка до температуры более 100 ° C в соляной кислоте в течение длительного периода времени (не менее 24 часов), что дает больше времени для белков с объемными гидрофобными группами.Поскольку в этих условиях существует риск деградации белков, особенно цистеина, глутамина, серина, треонина, триптофана и тирозина, рекомендуется использовать несколько образцов и нагревать их в течение разного времени.


