Какие функции выполняет белок в организме человека – блог justfood
Роль белков для организма человека
Для начала следует пояснить: все живое во Вселенной состоит из протеина (он же – белок). Не просто так, пытаясь обнаружить признаки жизни где-то еще, кроме Земли, ученые в первую очередь ищут молекулы воды и белка. Именно белок в составе организмов свидетельствует о том, что они живые.
Одним словом, белки – это основа жизни. Проникая внутрь вместе с едой, он проходит длинный и удивительный процесс всевозможных преобразований: последовательное расщепление на полипептиды и олигопептиды, а уже в конце мы получаем давно знакомые нам аминокислоты.
Ещё недавно ученые знали о 150 видах аминокислот, но ежегодно их перечень растёт. Вариации столь неповторимы и разнообразны, что в нашем теле невозможно найти две идентичных молекулы.
Белки – основополагающий стройматериал для женского тела. Они сохраняют упругость и здоровье кожи, ногтей и волос. Вдобавок, белковый рацион помогает при создании желаемой фигуры: именно на их основе формируется мускулатура, а на стадии их переваривания происходит интенсивный расход калорий, что также способствует похудению. Однако полезные свойства этим не ограничиваются. Что же еще они умеют?
Однако полезные свойства этим не ограничиваются. Что же еще они умеют?
Защищают
Для свертывания крови задействованы специальные белки, имеющие названия фибриноген и тромбин. Благодаря им осуществляется защита кожи (дермы) и предотвращается кровопотеря при повреждениях капилляров и сосудов. Одновременно, они предоставляют нам защиту на химическом уровне, непосредственно принимая участие в генерировании важнейших нам антител.
Регулируют
Существует ряд белков, не представляющих собой энергетический источник и их нельзя назвать «строительным материалом». Они призваны выполнять регулирующую функцию во внутриклеточных процессах. В этом и заключается их основная задача.
Сигнализируют
Белок передает сигналы между тканями, внутренними органами и на клеточном уровне и сообщает о подступающей опасности. Яркая иллюстрация этому – инсулин, который оповещает печень и кишечник о том, что сейчас не требуется перерабатывать белки, поступившие внутрь, в глюкозу.
Помогают нам двигаться
Актин и миозин — эти белки при соединении образуют актомиозин – ключевой элемент сократительных мышц. Нельзя не упомянуть про ключевой компонент хрящей и сухожилий – белок коллаген, который славится своей сверхвысокой прочностью.
Участвуют в производстве потомства.
Гены и хромосомы – вы не поверите, но и это — белок, принимающий активное участие в создании новых форм жизни. А ведь для этого требуется колоссальное количество белка в сочетании с непрерывным притоком свободных аминокислот. В случае, если эти поступления нерегулярны, функция продолжения рода становится невозможной.
Способствуют выработке энергии
В ситуации голодания роль белков резко увеличивается. Их запас обеспечивает нас столь необходимой человеку энергией.
Строят
Белки – это первостепенный клеточный строительный материал. Большинство плотных тканей – мышечная, волосы, опорные – состоят именно из них. При образовании мембран клеток также всегда используются белки.
Продукты, с высоким белковым содержанием
Куриную грудку недаром называют главным блюдом в холодильнике спортсмена. В одной порции содержится примерно 200 ккал, 40 г белка и всего лишь 2 г жира. К её неоспоримым достоинствам можно отнести быстрое время приготовления и универсальность: на основе куриной грудки можно приготовить множество интересных блюд и закусок.
Еще один продукт, насыщенный белком – это обычное яйцо. Употреблять его без желтка нет смысла: именно желток даёт возможность белку хорошо и быстро усваиваться. Всегда держите в холодильнике упаковку яиц на случай, если нет времени готовить, а безвредный и сытный перекус желателен.
Лосось – тот самый случай, когда вкусное сочетается с полезным. В филе лосося в среднем присутствует примерно 370 ккал, 40 грамм белка и 28 – жиров. Ну и, конечно, огромное количество необходимых кислот Омега-3.
Признаки нехватка белка
В первую очередь их поможет установить врач: анализ крови расскажет, какой из показателей выбивается из нормы и нуждается в коррекции. Так, о нехватке могут сигнализировать заниженные показатели гемоглобина: нарушается транспортная функция этого вещества, происходит кислородное голодание, может развиться анемия. Кроме того, вычислить недостаток можно и по косвенным критериям: состоянию ногтей, зубов и волосяного покрова. Если оно сильно испортилось в последнее время, есть смысл сдать анализы и произвести над этим работу.
Так, о нехватке могут сигнализировать заниженные показатели гемоглобина: нарушается транспортная функция этого вещества, происходит кислородное голодание, может развиться анемия. Кроме того, вычислить недостаток можно и по косвенным критериям: состоянию ногтей, зубов и волосяного покрова. Если оно сильно испортилось в последнее время, есть смысл сдать анализы и произвести над этим работу.
Если хотите готовый рацион питания, наши специалисты по правильному питанию подготовят для вас готовую сбалансированную еду и доставят в любую точку Москвы.
Функции белков | Кинезиолог
Лекция 4. Функции белков
Определение:
Белок — это отдельный полипептид или агрегат нескольких полипептидов, выполняющий биологическую функцию.
Полипетид — понятие химическое. Белок — понятие биологическое.
Например, иммуноглобулин состоит из четырех полипептидных цепей, которые по отдельности не являются белками, белок — только их функциональный агрегат.
Функции белков
1. Структурная функция.
Белки входят в состав всех клеточных органелл: мембранных — плазмалемма, ядерная оболочка, эндоплазматическая или ретику-лярная сеть (ЭР), комплекс Гольджи, лизосомы, пероксисомы, вакуоль, митохондрии, пластиды — и немембранных — хромосомы, рибосомы, клеточный центр (центриоли), реснички и жгутики, микрофиламенты.
2. Каталитическая функция.
Все ферменты — белки. Эта функция в 1982 году перестала считаться уникальной. Выяснилось, что некоторые РНК тоже обладают каталитической активностью. Их называют РНКзимами.
3. Защитная функция (пока уникальна).
Антитела — это белки особого класса (иммуноглобулины).
Иммуноглобулины «склеивают» антигены и образуется преципитат
4. Регуляторная функция.
На клеточном уровне: белки — репрессоры и белки – активаторы транскрипции.
На организменном уровне: некоторые гормоны — белки.
Например, инсулин — гормон поджелудочной железы. Регулирует переход глюкозы через плазмалемму. При недостаточной секреции инсулина развивается тяжелое заболевание — сахарный диабет.
При недостаточной секреции инсулина развивается тяжелое заболевание — сахарный диабет.
Соматотропин — гормон роста. Образуется в передней доле гипофиза.
Там же образуется и адренокортикотропный гормон (АКТГ). Он действует на кору надпочечников, регулируя синтез стероидных гормонов.
5. Трансформация энергии.
Белки сетчатки глаза родопсин и ретинен трансформируют световую энергию в электрическую. Актино-миозиновые комплексы в мышцах преобразуют энергию химических связей в механическую.
6. Транспортная функция.
Гемоглобин осуществляет транспорт О2, СО2.
Трансферрин — транспорт железа.
Системы пермеаз — это мембранные белки, которые переносят полярные соединения через мембрану как по, так и против градиента концентрации.
7. Энергетическая функция.
11 из 20 аминокислот, входящих в состав белков, в организме человека «сгорают» с выделением энергии. Это — заменимые аминокислоты. Они могут быть синтезированы в клетке из продуктов расщепления углеводов и липидов.
8. Питательная функция.
а) Поставка незаменимых аминокислот. У человека 9 из 20 аминокислот не
могут быть синтезированы в организме. Они должны поступать извне.
Понятие «заменимые и незаменимые аминокислоты» видоспецифическое и касается только животных и грибов.
б) Запасные белки для развития зародыша и вскармливания младенца.
Например, казеин — белок молока, овальбумин — яичный белок, глиадин —
белок зерен пшеницы.
9. Буферная функция.
Любой белок — амфотерный полиэлектролит. Белки способствуют поддержанию определенных значений рН в разных отсеках клетки, обеспечивая этим компартментализацию.
Источники: Дымшиц Г.М. Молекулярная биология: http://www.medliter.ru/?page=get&id=012131
Видеолекция: Общие свойства прионов. Лектор: Виталий Кушниров, д.б.н., ведущий научный сотрудник лаборатории молекулярной генетики, Институт биохимии имени А.Н. Баха РАН, Федеральный исследовательский центр «Фундаментальные основы биотехнологии» РАН, 27. 08.2015
08.2015
Строение и функции белков — конспект
|
|
Вернуться к теме «Строение и функции белков»
Белки – полимеры, мономерами которых являются аминокислоты.
Среди органических веществ белки занимают первое место по количеству и по значению. В организме человека встречаются 5 млн разнообразных белковых молекул, отличающихся не только друг от друга, но и от белков других организмов. Несмотря на такое разнообразие и сложность строения они построены всего из 20 различных аминокислот.
Строение аминокислоты:
В левой части молекулы расположены группа h3N–, которая обладает свойствами основания; справа — группа –COOH — кислотная, характерная для всех органических кислот. Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Следовательно, аминокислоты – амфотерные соединения, совмещающие свойства и кислоты и основания. Этим обусловлена их способность взаимодействовать друг с другом. Соединяясь, молекулы аминокислот образуют связи между углеродом кислотной и азотом основной групп. Такие связи называются ковалентными, а в данном случае – пептидными связями:
Соединение двух аминокислот в одну молекулу называется дипептидом, трех аминокислот – трипептидом и т. д., а соединение, состоящее из 20 и более аминокислотных остатков, – полипептидом.
Последовательность аминокислот в полипептидной цепи принято называть первичной структурой белка.
Однако молекула белка в виде цепи аминокислотных остатков, последовательно соединенных между собой пептидными связями, еще не способна выполнять специфические функции. Для этого необходима более высокая структурная организация. Путем образования водородных связей между остатками карбоксильных и аминогрупп разных аминокислот белковая молекула принимает вид спирали (α-структура) или складчатого слоя – «гармошки» (β-структура). Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Это вторичная структура белка. Но и ее часто недостаточно для приобретения характерной биологической активности.
Часто только молекула, обладающая третичной структурой, может выполнять роль катализатора или любую другую. Третичная структура образуется благодаря взаимодействию радикалов, в частности радикалов аминокислоты цистеина, которые содержат серу. Атомы серы двух аминокислот, находящихся на некотором расстоянии друг от друга в полипептидной цепи, соединяются, образуя так называемые дисульфидные, или S–S, связи. Благодаря этим взаимодействиям, а также другим, менее сильным связям, белковая спираль сворачивается и приобретает форму шарика, или глобулы. Способ укладки полипептидных спиралей в глобуле называют третичной структурой белка. Многие белки, обладающие третичной структурой, могут выполнять свою биологическую роль в клетке. Однако для осуществления некоторых функций организма требуется участие белков с еще более высоким уровнем организации.
Такую организацию называют четвертичной структурой. Присутствует не у всех белков. Она представляет собой функциональное объединение нескольких (двух, трех и более) молекул белка, обладающих третичной структурной организацией. Пример такого сложного белка – гемоглобин. Его молекула состоит из четырех связанных между собой молекул. Другим примером может служить гормон поджелудочной железы – инсулин, включающий два компонента. В состав четвертичной структуры некоторых белков включаются помимо белковых субъединиц и разнообразные небелковые компоненты. Тот же гемоглобин содержит сложное гетероциклическое соединение, в состав которого входит железо.
Строение белковой молекулы: А – первичная; Б – вторичная; В – третичная; Г – четвертичная структура
Строение молекулы гемоглобина
Гемоглобин – белок четвертичной структуры. В молекуле гемоглобина белковый компонент представлен белком глобином, небелковый компонент – гем. Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Глобин состоит из 4 субъединиц. Внутри каждой субъединицы имеется гидрофобный «карман», в котором располагается гем. Содержащийся в геме атом железа связывает кислород.
Свойства белка
Белки, как и другие неорганические и органические соединения, обладают рядом физико-химических свойств:
- Белки – преимущественно водорастворимые молекулы и, следовательно, могут проявлять свою функциональную активность только в водных растворах.
- Белковые молекулы несут большой поверхностный заряд. Это определяет целый ряд электрохимических эффектов, например изменение проницаемости мембран каталитической активности и других функций.
- Белки термолабильны, то есть проявляют свою активность в узких температурных рамках.
Денатурация и ренатурация белков
Денатурация – это утрата белковой молекулой своей структурной организации: четвертичной, третичной, вторичной, а при более жестких условиях – и первичной структуры. В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
В результате денатурации белок теряет способность выполнять свою функцию. Причинами денатурации могут быть высокая температура, ультрафиолетовое излучение, действие сильных кислот и щелочей, тяжелых металлов и органических растворителей. Если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий среды полностью воссоздается структура белка и его функциональная активность. Такой процесс носит название ренатурации.
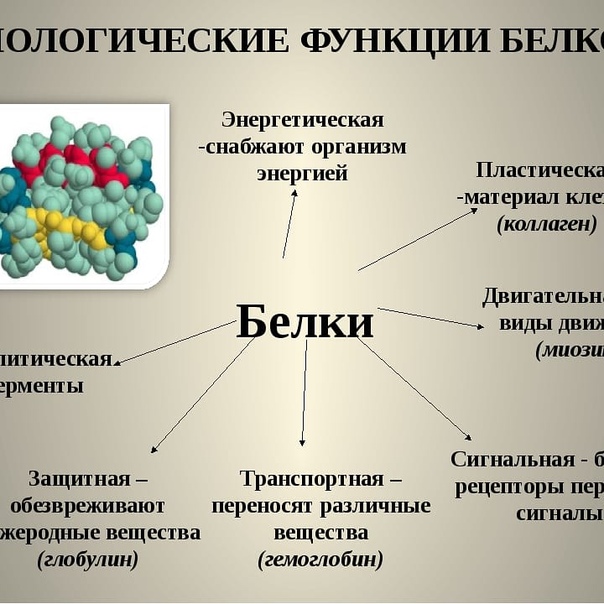
Функции белков
1. Каталитическая (ферментативная) функция:
Многие белки являются ферментами. Ферменты — это биологические катализаторы, т. е. вещества, ускоряющие протекание химических реакций в живых организмах. Ферменты участвуют в процессах синтеза и расщепления различных веществ. Они обеспечивают фиксацию углерода в процессе фотосинтеза, расщепление питательных веществ в пищеварительном тракте и т. д.
д.
2. Транспортная функция
Многие белки способны присоединять и переносить различные вещества. Гемоглобин связывает и переносит кислород и углекислый газ. Альбумины крови транспортируют жирные кислоты, глобулины — ионы металлов и гормоны. Многие белки, входящие в состав цитоплазматической мембраны, участвуют в транспорте веществ в клетку и из нее.
3. Защитная функция
Белки предохраняют организм от вторжения чужеродных организмов и от повреждений. Так, в ответ на проникновение чужеродных объектов (антигенов) определенные лейкоциты вырабатывают специфические белки — иммуноглобулины (антитела), участвующие в иммунном ответе организма. Белок плазмы крови фибриноген, участвуя в свертывании крови и тем самым уменьшая кровопотери.
4. Двигательная (сократительная) функция
Сократительные белки обеспечивают способность клеток, тканей, органов и целых организмов изменять форму, двигаться. Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
Так, актин и миозин обеспечивают работу мышц и немышечные внутриклеточные сокращения.
5. Структурная (строительная, пластическая) функция
Белки входят в состав всех клеток и тканей живых организмов. Белки являются обязательным компонентом всех клеточных мембран и органоидов клетки. Из белков построены элементы цитоскелета, сократительные элементы мышечных волокон. Преимущественно из белков состоят хрящи и сухожилия. В их состав входит белок коллаген. Важнейшим структурным компонентом перьев, волос, ногтей, когтей, рогов, копыт у животных является белок кератин. В состав связок, стенок артерий и лёгких входит структурный белок эластин.
6. Сигнальная (рецепторная) функция
Некоторые белки клеточных мембран способны изменять свою структуру в ответ на действие внешних факторов. С помощью этих белков происходит прием сигналов из внешней среды и передача информации в клетку.
7. Регуляторная функция
Некоторые белки являются гормонами. Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
Они влияют на различные физиологические процессы. Например, инсулин и глюкагон регулируют содержание глюкозы в крови, а соматотропин (гормон роста) — процессы роста и физического развития.
8. Запасающая (питательная) функция
В семенах растений запасаются резервные белки, которые используются при прорастании зародышем.
9. Энергетическая функция
При полном окислении 1 г белка выделяется 17,6 кДж энергии. Однако белки расходуются на энергетические нужды лишь в крайних случаях, когда исчерпаны запасы углеводов и жиров.
Основные биологические функции белков
Белки входят в состав каждой клетки и составляют около 50% ее сухой массы. Они играют ключевую роль в обмене веществ, реализуют важнейшие биологические функции, лежащие в основе жизнедеятельности всех организмов.
Среди большого разнообразия функций, выполняемых белками, первостепенное значение имеют структурная, или пластическая, и каталитическая. Это универсальные функции, поскольку они присущи всем живым организмам.
Это универсальные функции, поскольку они присущи всем живым организмам.
Структурные белки формируют каркас внутриклеточных органелл и внеклеточных структур, а также участвуют в стабилизации клеточных мембран. Такие структурные белки, как коллаген и эластин составляют основу соединительной и костной тканей высших животных и человека. Структурными белками, в частности, являются кератины кожи, волос, ногтей, шерсти, когтей, рогов, копыт, перьев, клювов, а также фиброин шелка, паутины.
Каталитически активными белками являются ферменты. Они ускоряют химические реакции, обеспечивая тем самым необходимые скорости протекания обменных процессов в клетке.
Многие белки, присущие отдельным живым организмам, выполняют специфические функции, среди которых наиболее важными являются транспортная, регуляторная, защитная, рецепторная, сократительная, запасная и некоторые др.
Транспортные белки переносят различные молекулы и ионы внутри организма. Например: гемоглобин — кислород от легких к тканям; миоглобин — кислород внутри клеток; сывороточный альбумин с током крови — жирные кислоты, а также ионы некоторых металлов. Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Ту же функцию выполняют специфические белки, транспортирующие различные вещества через клеточные мембраны.
Регуляторные белки участвуют в регуляции обмена веществ как внутри клеток, так и в целом организме. Например, такие сложные процессы, как биосинтез белков и нуклеиновых кислот, протекают под строгим «контролем» множества регуляторных белков. Специфические белковые ингибиторы регулируют активность многих ферментов.
Защитные белки формируют защитную систему живых организмов. Например, иммуноглобулины (антитела) и интерфероны предохраняют организм от проникновения в его внутреннюю среду вирусов, бактерий, чужеродных соединений, клеток и тканей. Белки свертывающей системы крови — фибриноген, тромбин — препятствуют потере крови при повреждениях кровеносных сосудов.
Рецепторные белки воспринимают сигналы, поступающие из внешней среды, и воздействуют на внутриклеточные процессы. Например, белки-рецепторы, сосредоточенные на поверхности клеточных мембран, избирательно взаимодействуют с регуляторными молекулами (например, гормонами).
Рецепторными белками являются родопсин, участвующий в зрительном акте, вкусовой сладкочувствительный и обонятельный белки.
Сократительные белки способны преобразовывать свободную химическую энергию в механическую работу. Например, белки мышц миозин и актин обеспечивают мышечное сокращение.
Запасные белки представляют собой резервный материал, предназначенный для питания развивающихся клеток. Запасными белками являются яичный альбумин, глиадин пшеницы,
Казеин кукурузы, казеин молока и многие другие. Запасные белки — существенный источник пищевого белка для человека.
Некоторые организмы вырабатывают токсические белки. Таковы яды змей, дифтерийный токсин, рицин семян клещевины, лектины семян бобовых и др.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Роль белка — Exponenta
Только полноценный высококачественный белок содержит все незаменимые аминокислоты, которые не синтезирует наш организм. В каждой из них важные свойства, которые определяют качество нашей жизни и состояние здоровья:
В каждой из них важные свойства, которые определяют качество нашей жизни и состояние здоровья:
Изолейцин играет важную роль в формировании мышечной ткани, служит источником энергии для ее клеток. Способствует увеличению выносливости, восполнению затраченной при физической нагрузке энергии, восстановлению мышц, синтезу наружного слоя кожи, регулированию уровня сахара в крови. Дефицит изолейцина выражается в потере мышечной массы, может развиться гипогликемия.
Лейцин предотвращает усталость, способствует укреплению иммунной системы, повышению работоспособности, увеличению мышечной массы. Понижает содержание сахара в крови и способствует быстрейшему заживлению ран и костей. Недостаток лейцина является причиной нарушения обмена веществ, ослабления иммунитета, быстрого утомления, патологических процессов почках и щитовидной железе.
Лизин – участвует в образовании коллагена и восстановлении тканей, а также выработке антител, гормонов и ферментов. Имеет противовирусное действие, способствует повышению иммунитета. Дефицит приводит к утомляемости, усталости и слабости, неспособности к концентрации, раздражительности, потере волос, головокружение.
Дефицит приводит к утомляемости, усталости и слабости, неспособности к концентрации, раздражительности, потере волос, головокружение.
Метионин способствует укреплению структуры ногтей и волос, укреплению иммунитета, предотвращению жировых отложений в печени. Ускоряет регенеративные процессы, участвует в выводе тяжелых металлов из организма. Недостаток метионина сопровождается серьезным нарушением обмена веществ, является причиной поражения печени.
Валин служит источником энергии в мышечных клетках, препятствует снижению уровня серотонина. Используется для лечения депрессий и множественного склероза.
Треонин участвует в синтезе иммуноглобулинов и антител, способствует ускорению метаболических процессов в организме, выработке антител, прочности и упругости соединительных тканей и мышц, принимает участие в создании коллагена, эластина и мышечной ткани. Недостаток треонина в организме человека может проявляться такими симптомами, как мышечная слабость, нарушение концентрации внимания, потеря мышечной массы, задержка роста и развития, депрессия.
Фенилаланин способствует регулированию скорости обмена веществ, улучшению ментальной концентрации, регуляции аппетита. Недостаток фенилаланина в организме может привести к потере мышечной массы, гормональным сбоям, нарушению работы щитовидной железы и надпочечников, понижению умственной способности.
Аргинин — частично незаменимая аминокислота, которая играет важную роль в улучшении обменных процессов, стимулирует синтез соматотропного гормона, ускоряет метаболизм жиров и снижает концентрацию холестерина в крови. Недостаток приводит к возрастанию риска развития тромбов, нарушению мозговой деятельности, раннему старению, ожирению, атеросклерозам и гипертонии.
Гистидин — частично незаменимая аминокислота, которая играет важную роль в метаболизме белков, синтезе гемоглобина, красных и белых кровяных телец, является одним из регуляторов свертывания крови. Используется при лечении аллергий, предотвращает псориаз, экзему, нейродермиты. Недостаток приводит к нарушению обмена веществ, торможению синтеза гемоглобина, ослаблению слуха.
Триптофан в организме человека непосредственно преобразуется в серотонин, соединение, которое вызывает умственное расслабление и создает ощущение эмоционального благополучия. Триптофан способен уменьшать болевую чувствительность, стимулирует выработку гормона роста, который необходим для увеличения мышечной массы и уменьшения массы жира. Низкое содержание триптофана в организме вызывает депрессию, тревожность, бессонницу, расстройства внимания, гиперактивность, головные боли.
Белки
Белок – это фундамент организма. Он целиком построен из маленьких строительных блоков, называемых аминокислотами. Аминокислоты являются основными составными частями и строительными элементами белковой молекулы.
Название «протеины» (от греч. protos – первый, важнейший) более точно отражает первостепенное биологическое значение этого класса веществ, хотя в отечественной литературе их принято называть белками или белковыми веществами по аналогии с белком куриного яйца, приобретающего при кипячении (денатурации) белый цвет.
Молекула белка построена из 100 или более остатков аминокислот, ковалентно связанных в полимерные цепи. В человеческом организме 5 миллионов белков, причем ни один из белков человека не идентичен с белком любого другого живого организма.
Несмотря на такое разнообразие белковых структур для их построения необходимы всего 22 аминокислоты, 9 из которых незаменимы, то есть должны поступать с пищей человека, они не синтезируются в организме человека, остальные аминокислоты могут образовываться в нашем организме из других аминокислот. Таким образом, необходимо обеспечить адекватную поставку организму этих аминокислот соответствующим питанием с хорошо сбалансированным составом животных и растительных белков.
Большинство растительных белков, даже очень важных, содержит лишь незначительное число незаменимых аминокислот – именно поэтому строгие вегетарианцы (не потребляющие даже яиц и молочных продуктов) могут испытывать дефицит данных аминокислот. Невозможно переоценить важность сбалансированного питания для обеспечения достаточного уровня всех незаменимых аминокислот. Это существенный фактор здоровья!
Это существенный фактор здоровья!
Биологические функции белков очень разнообразны. Они выполняют каталитические, регуляторные, структурные, двигательные, транспортные, защитные, запасные и другие функции. Белки составляют основу биомембран, важнейшей составной части клетки и клеточных компонентов.
Исключительное свойство белков – самоорганизация структуры, то есть способность самопроизвольно создавать определенную свойственную только данному белку структуру. Для того, чтобы организм мог эффективно использовать и синтезировать белок, должны присутствовать все незаменимые аминокислоты и в необходимой пропорции. Даже временное отсутствие одной незаменимой аминокислоты может отрицательно сказаться на синтезе белка. При уменьшении количества любой незаменимой аминокислоты или ее отсутствии пропорционально уменьшается эффективность всех остальных аминокислот.
Девять незаменимых аминокислот – гистидин (необходим для детей), изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. Организм в состоянии строить белки только при наличии достаточных количеств их всех. При отсутствии хотя бы одной из этих кислот белки уже не синтезируются, а пища используется как источник энергии или сохраняется в жировых отложениях.
Организм в состоянии строить белки только при наличии достаточных количеств их всех. При отсутствии хотя бы одной из этих кислот белки уже не синтезируются, а пища используется как источник энергии или сохраняется в жировых отложениях.
Остальные 13 аминокислот синтезируются в организме человека в реакциях трансаминации. Эти аминокислоты – аланин, аргинин, аспарагин, карнитин, цистеин, цистин, глутаминовая кислота, глутамин, глицин, гидроксипролин, пролин, серин, тирозин.
Помимо 22 аминокислот, входящих в состав белков, известно свыше 150 других, которые встречаются в различных клетках и тканях либо в свободном, либо в связанном виде, но никогда не встречаются в составе белков.
Значение аминокислот не ограничивается их ролью в синтезе тканевых белков. Каждая из них выполняет в организме свои особые функции, направленные на поддержание гомеостаза организма.
Лишение всех аминокислот приводит к совершенной потере белка организмом, истощению, полной потере энергии, потере веса, анемии, разрушению мышц, в самом тяжелом случае – к смерти.
ФУНКЦИИ БЕЛКОВ
- Белки выполняют множество самых разнообразных функций, характерных для живых организмов. Здесь будут перечислены главные и в некотором смысле уникальные для жизнедеятельности человека функции, не свойственные или лишь частично присущие другим классам биополимеров.
- Каталитическая функция белков. Все до сих пор открытые биологические катализаторы – ферменты являются белками. Эта функция белков является уникальной, не свойственной другим полимерным молекулам.
- Питательная (резервная) функция белков. К таким белкам относятся так называемые резервные белки, являющиеся источниками питания для развития плода; белки яйца (овальбумины) и основной белок молока (казеин) также выполняют главным образом питательную функцию. Ряд других белков несомненно используется в организме в качестве источника аминокислот, которые в свою очередь являются предшественниками биологически активных веществ, регулирующих процессы обмена веществ.

- Транспортная функция белков. Дыхательная функция крови, в частности перенос кислорода, целиком осуществляется молекулами гемоглобина – белка эритроцитов. В транспорте липидов принимают участие альбумины сыворотки крови. Ряд других сывороточных белков образует комплексы с жирами, медью, железом, тироксином, витамином A и другими соединениями, обеспечивая их доставку в соответствующие органы-мишени.
- Защитная функция белков. Основную функцию защиты в организме выполняет иммунологическая система, которая обеспечивает синтез специфических защитных белков – антител в отвег на поступление в организм бактерий, токсинов или вирусов. Высокая специфичность взаимодействия антител с антигенами (чужеродными веществами) по типу белок – белковое взаимодействие способствует нейтрализации их биологического действия и сохранению нормального состояния. В качестве другого примера защитной роли можно привести способность ряда белков крови к свертыванию. Свертывание белка плазмы крови фибриногена приводит к образованию сгустка крови, что предохраняет от потери крови при ранениях.

- Сократительная функция белков. В акте мышечного сокращения и расслабления участвует множество белковых веществ тела. Однако главную роль в этих жизненно важных процессах играют актин и миозин – специфические белки мышечной ткани. Сократительная функция присуща не только мышечным белкам, но и белкам ряда субклеточных структур, что обеспечивает тончайшие процессы жизнедеятельности клеток.
- Структурная функция белков. Данная функция белков многопланова. Белки со структурными функциями занимают по количеству первое место среди других белков тела человека. Широко распространены такие важные структурные белки, как коллаген в соединительной ткани, кератин в волосах, ногтях, коже, эластин в сосудистой стенке и др. Не менее важную роль выполняют белки в комплексе с углеводами в формировании ряда секретов – мукоидов, муцинов и т. д. Наконец, в комплексе с липидами (в частности, фосфолипидами) белки участвуют в образовании биомембран клеток.
- Гормональная функция белков.
 Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например, гормоны гипофиза, поджелудочной железы и др.
Обмен веществ в организме регулируется разнообразными механизмами. В этой регуляции важное место занимают гормоны, вырабатываемые в железах внутренней секреции. Ряд гормонов представлен белками или полипептидами, например, гормоны гипофиза, поджелудочной железы и др.
Можно указать еще на некоторые другие жизненно важные функции белков, в частности, на способность белков к сохранению онкотического давления в клетках и в крови, на буферные свойства белков, регулирующие физиологическое значение pH внутренней среды, и др.
Строение и функции белков
Строение белков
Определение 1
Белки – сложные органические соединения (биополимеры), в состав молекул которых входят углерод, водород, кислород и азот (иногда серы). Их мономеры — аминокислоты.
Белки играют первостепенное значение в жизни всех организмов. Они характеризуются неисчерпаемым разнообразием, которое одновременно очень специфично.
Замечание 1
Белки и нуклеиновые кислоты являются материальной основой всего богатства организмов окружающей среды. Их доля составляет 50 – 80% сухой массы клетки.
Их доля составляет 50 – 80% сухой массы клетки.
Молекулы белков похожи на длинные цепи, состоящие из 50 – 1500 остатков аминокислот, соединённых крепкой ковалентной азотно-углеродной (пептидной) связью. В результате образуется первичная структура белка — полипептидная цепь.
Замечание 2
Молекула белка — это полипептид, молекулярная масса которого составляет от 5 тыс. до 150 тыс. Бывает и больше.
Простые белки состоят лишь из аминокислот, а сложные белки, кроме аминокислот, могут содержать нуклеиновые кислоты (нуклеопротеиды), липиды (липопротеиды), углеводы (гликопротеиды), окрашенные химические соединения (хромопротеиды) и т.п.
Все свойства клетки (химические, морфологические, функциональные) зависят от специфических белков, содержащихся в ней.
Замечание 3
Именно набор аминокислот, их количество и последовательность расположения в полипептидной цепи и определяет специфичность белка.
Замена лишь одной аминокислоты в составе белковой молекулы или изменение последовательности расположения аминокислот может привести к изменению функций белка. Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Этим и объясняется большое разнообразие в строении белковой молекулы первичной структуры. Потому не удивительно, что живой организм, чтобы иметь возможность выполнять свои функции, использует особенный виды белков и его возможности в этом отношении неограниченные.
Готовые работы на аналогичную тему
Пространственное расположение полипептидных цепей также определяет свойства белков. В живой клетке полипептидные цепи скрученные или согнутые, имеют вторичную или третичную структуру.
Вторичная структура представлена спирально закрученной белковой цепочкой. Витки спирали удерживаются благодаря водородным связям, образующимся между расположенными на соседних витках СО – и NH – группами.
В результате дальнейшего закручивания спирали возникает специфическая конфигурация каждого белка — третичная структура. Образуется она благодаря связям между белковыми радикалами аминокислотных остатков:
- ковалентным дисульфидным (S – S-связям) между остатками цистеина,
- водородным,
- ионными.

- гидрофобным взаимодействиям.
В количественном соотношении наиболее важными являются гидрофобные взаимодействия, вызванные тем, что неполярные боковые цепи аминокислот стремятся объединиться друг с другом, не смешиваясь с водной средой. Белок при этом свёртывается так, чтобы его гидрофобные боковые цепи были спрятаны внутри молекулы, то есть защищены от контакта с водой, а наружу, наоборот, выставлены боковые гидрофильные цепи.
Для каждого белка специфичны количество молекуламинокислот с гидрофобными радикалами и количество молекул цистеина и характер их взаимного расположения в полипептидной цепи.
Взаимное расположение групп атомов, обходимое для проявления активности белка как катализатора, его гормональных функций и др. обеспечивается сохранением определённой формы молекулы. Потому стойкость макромолекул – не случайное свойство, а один из важнейших способовстабилизации организма.
Биологическая активность белка может проявлятся лишь когда он имеет третичную структуру, потому при замене в полипептидной цепи даже одной аминокислоты могут возникнуть изменения в конфигурации белка, а его биологическая активность снизится или же исчезнет совсем.
Иногда две, три, и больше белковых молекул с третичной структурой могут объединиться в единый комплекс. Подобные образования являются четвертичной структурой белка.
Пример 1
Примером такого сложного белка является гемоглобин, который состоит из четырёх субединиц и небелковой части – гема. Он способен выполнять свои функции только в такой форме.
В четвертичной структуре белковые субединицы не связаны химически, однако вся структура достаточно крепкая благодаря действию слабых межмолекулярных сил.
Под влиянием разнообразных физических и химических факторов (обработка щелочами, кислотами, спиртом, ацетоном, влияние высоких температур и давления и пр.) третичная и четвертичная структуры белка изменяются, потому что разрываются водородные и ионные связи.
Определение 2
Денатурация – нарушение естественной (нативной) структуры белка.
При денатурации уменьшается растворимость белков, изменяется форма и размеры молекул, теряется ферментативная активность и т. п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
п. Процесс денатурации оборотный, то есть возвращение нормальных условий сопровождается непроизвольным оновлением естественной (природной) структуры белка. Этот процесс называют ренатурацией.
Замечание 4
Все особенности строения и функционирования белковой макромолекулы зависят от его первичной структуры.
Функции белков в клетке
- Строительная (пластическая) функция белковых молекул является одной из важнейших.Они являются составным компонентом клеточных мембран и органел. Стенки кровеносных сосудов, сухожилия, хрящи высших животных также состоят в основном из белка.
- Двигательная функция обеспечивается особенными сократительными белками, благодаря которым осуществляются движения жгутиков и ресничек, перемещение хромосом во время деления клеток, сокращение мускулатуры, движения органов растений и т.п., пространственные изменения положения различных структур организма.
-
Транспортная функция белков обеспечивается их способностью связывать и переносить с течением крови химические соединения.

Пример 2
Белок крови гемоглобин переносит кислород из лёгких в клетки других органов и тканей (аналогичную функцию в мышцах выполняет миоглобин).
Белки сыворотки крови переносят липиды и жирные кислоты, различные биологически активные вещества.
Молекулы белков, входящих в состав плазматической мембраны, берут участие в транспорте веществ как в клетку, так и из неё.
Белки выполняют и защитную функцию. Как ответ на проникновение внутрь чужеродных веществ (антигенов – белков или высокомолекулярных полисахаридов бактерий, вирусов) в клетке вырабатываются особенные белки – иммуноглобулины (антитела), которые нейтрализуют чужеродные вещества и осуществляют иммунологичную защиту организма.
Благодаря функционированию иммунной системы организма обеспечивается распознавание антигенов антигенным детерминантам (характерным участкам их молекул). Благодаря этому специфически связываются и обеззараживаются чужеродные вещества за.
Замечание 5
Внешнюю защитную функцию могут выполнять также и белки, токсические для других организмов ( белок яда змей).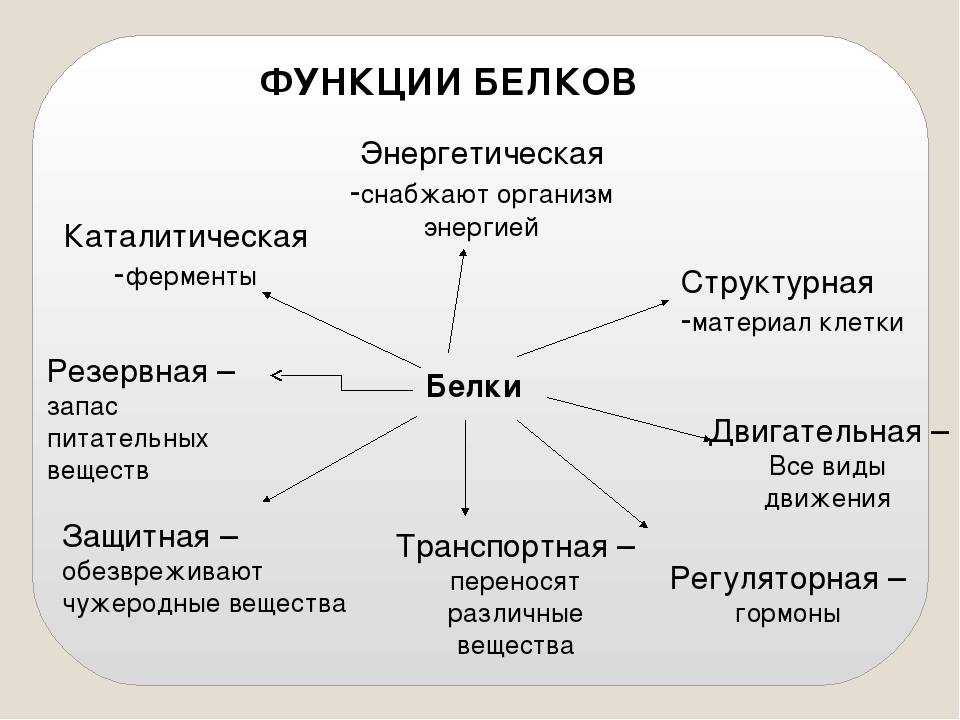
Белкам свойственна также сигнальная функция. В поверхность клеточной мембранны встроены молекулы белков, которые в ответ на действия факторов внешней среды способны к изменению свей третичной структуры. Так происходит восприятие сигналов из внешней среды и передача команд в клетку.
Регуляторная функция свойственна белкам-гормонам, которые влияют на обмен веществ. Гормоны поддерживают постоянную концентрацию веществ в крови, учавствуют в росте размножении и других жизненно важных процессах.
Пример 3
Одним из наиболее известных гормонов является инсулин, понижающий содержание сахара в крови. В случае стойкой недостаточности инсулина содержание сахара в крови увеличивается и развивается сахарны диабет. Главными регуляторами биохимических процессов в организме могут быть и многочисленные белки-ферменты (каталитическая функция).
Белки являются и энергетическим материалом. При расщеплении 1 г белка до конечных продуктов выделяется 17,6 кДж энергии, необходимой для большинства жизненно важных процессов в клетке.
Ферменти, их роль в клетке
Определение 3
Ферменты (энзимы) – это специфические белки, присутствующие во всех организмах и выполняющие функцию биологических катализаторов.
Химические реакции в живой клетке происходят при умеренной температуре нормальном давлении и в нейтральной среде. При таких условиях течение реакций синтеза или распада веществ в клетке был быочень медленным, если бы не действие ферментов. Ферменты ускоряют реакции за счёт снижения энергии активации не измененяя их общего результата, то есть при их наличии для придания молекулам, вступающим в реакцию, реакционной способности, необходимо значительно меньше энергии
Все процессы в живом организме прямо или косвенно происходят с участием ферментов.
Под действием ферментов составляющие компоненты пищи (белки, липиды, углеводы и др.) расщепляются до простейших соединений, а из них позже синтезируются новые, свойственные данному виду макромолекулы. Потому нарушение образования и активности ферментов часто становятся причиной тяжёлых заболеваний.
Ферментативный катализ подчиняется тем же законам, что и неферментативный катализ в химической промышленности, однако в отличие от последнего характеризируется чрезвычайно высокой степенью специфичности (фермент катализирует только одну реакцию или действует
лишь на один тип связи). Этим обеспечивается тонкое регулирование всех жизненно важных процессов (дыхание, пищеварение, фотосинтез и т. п.), происходящих в клетке и организме.
Пример 4
Фермент уреаза катализирует расщепление только одного вещества – мочевины, но не действует каталитически на структурно родственные соединения.
Для понятия механизма действия ферментов, которые имеют высокую специфичность, чрезвычайно важна теория активного центра. Согласно с ней, в молекуле каждого фермента есть один или больше участков, в которых катализ происходит за счёт тесного (во многих местах) контакта между молекулами фермента и субстрата (специфического вещества), а функциональная группа (пример – ОН – группа аминокислоты серина), или же отдельная аминокислота, выступает активным центром.
Обычно для действия катализатора необходимо, чтобы объединились несколько аминокислотных остатков, расположенных в определённой последовательности (в среднем 3 – 12).
Активный центр также может формироваться благодаря связи ферментов с ионами металов, витаминами и другими соединениями небелковой природы – так называемыми коферментами, или кофакторами.
Химическое строение и форма активного центра такова, что с ним способны связывать лишь определённые субстраты благодаря их идеальному соответствию (взаимодополняемости, или комплементарности) друг другу.
Остальные аминокислотные остатки обеспечивают большой молекуле ферментп соответствующую глобулярную форму, необходимую для эффективной работы самого центра.
Кроме того, вокруг большой молекулы фермента возникает сильное электрическое поле. В таком поле становится возможной ориентация молекул субстрата и приобретение ими ассиметрической формы. В результате ослабевают химические связи и начальная затрата энергии на реакцию, которая катализируется, будет меньше, а значит, значительно увеличится её скорость.
Пример 5
Одна молекула фермента каталазы способна за 1 мин расщепить более 5 млн. молекул перекиси водорода, которая возникает во время окисления в организме различных соединений.
Активный центр некоторых ферментов в присутствии субстрата может изменять конфигурацию: для обеспечения наибольшей каталитической активности такой фермент специально ориентирует свои функциональные группы. Молекулы субстрата, присоединяясь к ферменту, также в определённых пределах изменяют свою конфигурацию для увеличения реакционной способностит функциональных групп центра. На заключительном этапе химической реакции комплекс фермента и субстрата распадается, образуются конечные продукты и свободный фермент. Активный центр при этом освобождается и способен снова принимать новые молекулы субстрата.
Скорость реакций с участием ферментов зависит от многих факторов: от концентрации фермента, от природы субстрата, от давления, температуры, кислотности среды, от наличия ингибиторов.
При температурах, близких к 0˚С, до минимума замедляется скорость биохимических реакций. Это свойство широко используют в различных отраслях, особенно в медицине и сельском хозяйстве.
Пример 6
Для консервации органы человека (почки, серце, селезёнка, печень) перед пересадкой больному подвергают охлаждению, чтобы понизить интенсивность биохимических реакций и тем самым продлить время жизни этих органов. При быстром замораживании пищевых продуктов предотвращается размножение микроорганизмов, а так же инактивируются их ферменты, потому они уже не способны вызывать разложение пищевых продуктов.
3.3A: Типы и функции белков
Белки выполняют многие важные физиологические функции, в том числе катализируют биохимические реакции.
Цели обучения
- Различать типы и функции белков
Ключевые моменты
- Белки необходимы для основных физиологических процессов жизни и выполняют функции во всех системах человеческого тела.
- Форма белка определяет его функцию.
- Белки состоят из аминокислотных субъединиц, которые образуют полипептидные цепи.
- Ферменты катализируют биохимические реакции, ускоряя химические реакции, и могут либо разрушать свой субстрат, либо строить более крупные молекулы из субстрата.
- Форма активного центра фермента соответствует форме субстрата.
- Гормоны — это тип белков, используемых для передачи сигналов и коммуникации клеток.
Ключевые термины
- аминокислота : Любая из 20 встречающихся в природе α-аминокислот (имеющих амино- и карбоксильные группы на одном атоме углерода) и различных боковых цепей, которые объединяются через пептидные связи с образованием белков.
- полипептид : любой полимер (одинаковых или разных) аминокислот, соединенных пептидными связями.
- катализатор : для ускорения процесса.
Типы и функции белков
Белки выполняют важные функции во всех системах человеческого тела. Эти длинные цепи аминокислот критически важны для:
Эти длинные цепи аминокислот критически важны для:
- катализирующие химические реакции
- синтез и восстановление ДНК
- транспортировка материалов по камере
- прием и отправка химических сигналов
- отвечает на раздражители
- обеспечивает структурную поддержку
Белки (полимеры) представляют собой макромолекулы, состоящие из аминокислотных субъединиц (мономеров).Эти аминокислоты ковалентно связаны друг с другом с образованием длинных линейных цепей, называемых полипептидами, которые затем складываются в определенную трехмерную форму. Иногда эти свернутые полипептидные цепи функционируют сами по себе. В других случаях они объединяются с дополнительными полипептидными цепями, чтобы сформировать окончательную структуру белка. Иногда в конечном белке также требуются неполипептидные группы. Например, гемогобин белка крови состоит из четырех полипептидных цепей, каждая из которых также содержит молекулу гема, имеющую кольцевую структуру с атомом железа в центре.
Белки имеют разную форму и молекулярную массу в зависимости от аминокислотной последовательности. Например, гемоглобин представляет собой глобулярный белок, что означает, что он сворачивается в компактную шарообразную структуру, но коллаген, обнаруженный в нашей коже, представляет собой волокнистый белок, что означает, что он складывается в длинную вытянутую волоконно-подобную цепь. Вы, вероятно, похожи на членов своей семьи, потому что у вас одинаковые белки, но вы выглядите иначе, чем посторонние, потому что белки в ваших глазах, волосах и остальном теле различны.
Рисунок \ (\ PageIndex {1} \): Гемоглобин человека : Структура гемоглобина человека. Α- и β-субъединицы белков выделены красным и синим, а железосодержащие гемовые группы — зеленым. Из базы данных по белкам.
Поскольку форма определяет функцию, любое небольшое изменение формы белка может привести к нарушению функции белка. Небольшие изменения в аминокислотной последовательности белка могут вызвать разрушительные генетические заболевания, такие как болезнь Хантингтона или серповидно-клеточная анемия.
Ферменты
Ферменты — это белки, которые катализируют биохимические реакции, которые в противном случае не имели бы места.Эти ферменты необходимы для химических процессов, таких как пищеварение и клеточный метаболизм. Без ферментов большинство физиологических процессов протекало бы так медленно (или не протекало бы совсем), что жизнь не могла бы существовать.
Поскольку форма определяет функцию, каждый фермент специфичен для своих субстратов. Субстраты — это реагенты, которые подвергаются химической реакции, катализируемой ферментом. Место, где субстраты связываются с ферментом или взаимодействуют с ним, называется активным сайтом, потому что это место, где происходит химия.Когда субстрат связывается со своим активным центром на ферменте, фермент может помочь в его распаде, перегруппировке или синтезе. Помещая субстрату определенную форму и микроокружение в активном центре, фермент стимулирует протекание химической реакции. Существует два основных класса ферментов:
Рисунок \ (\ PageIndex {1} \): Ферментная реакция : Катаболическая ферментативная реакция, показывающая, что субстрат точно соответствует форме активного центра.
- Катаболические ферменты: ферменты, расщепляющие субстрат
- Анаболические ферменты: ферменты, которые строят более сложные молекулы из своих субстратов
Ферменты необходимы для пищеварения: процесс расщепления более крупных молекул пищи на субъединицы, достаточно мелкие, чтобы диффундировать через клеточную мембрану и использоваться клеткой.Эти ферменты включают амилазу, которая катализирует переваривание углеводов во рту и тонком кишечнике; пепсин, катализирующий переваривание белков в желудке; липаза, катализирующая реакции, необходимые для эмульгирования жиров в тонком кишечнике; и трипсин, который катализирует дальнейшее переваривание белков в тонком кишечнике.
Ферменты также необходимы для биосинтеза: процесса создания новых сложных молекул из более мелких субъединиц, которые поставляются или генерируются клеткой.Эти биосинтетические ферменты включают ДНК-полимеразу, которая катализирует синтез новых цепей генетического материала до деления клетки; синтетаза жирных кислот, которая синтезирует новые жирные кислоты для образования жиров или мембранных липидов; и компоненты рибосомы, которая катализирует образование новых полипептидов из мономеров аминокислот.
Гормоны
Некоторые белки действуют как химические сигнальные молекулы, называемые гормонами. Эти белки секретируются эндокринными клетками, которые контролируют или регулируют определенные физиологические процессы, включая рост, развитие, метаболизм и размножение.Например, инсулин — это белковый гормон, который помогает регулировать уровень глюкозы в крови. Другие белки действуют как рецепторы для определения концентрации химических веществ и отправки сигналов для ответа. Некоторые типы гормонов, такие как эстроген и тестостерон, являются липидными стероидами, а не белками.
Другие функции белков
Белки выполняют важные функции во всех системах человеческого тела. В дыхательной системе гемоглобин (состоящий из четырех белковых субъединиц) транспортирует кислород для использования в клеточном метаболизме.Дополнительные белки в плазме крови и лимфе переносят питательные вещества и продукты обмена веществ по всему телу. Белки актин и тубулин образуют клеточные структуры, а кератин формирует структурную опору для мертвых клеток, которые становятся ногтями и волосами. Антитела, также называемые иммуноглобинами, помогают распознавать и уничтожать чужеродные патогены в иммунной системе. Актин и миозин позволяют мышцам сокращаться, а альбумин питает раннее развитие эмбриона или проростка.
Рисунок \ (\ PageIndex {1} \): Тубулин : структурный белок тубулин, окрашенный в красный цвет в клетках мыши.
Структура и функции белков
Белки — очень важные молекулы, которые необходимы всем живым организмам. По сухому весу белки — самая крупная единица клеток. Белки участвуют практически во всех функциях клетки, и каждой роли отводится отдельный тип белка, задачи которого варьируются от общей клеточной поддержки до передачи сигналов и передвижения. Всего существует семь типов белков.
Белки
- Белки — это биомолекулы, состоящие из аминокислот, которые участвуют почти во всех клеточных действиях.
- Происходит в цитоплазме, трансляция — это процесс, посредством которого синтезируются белки .
- Типичный белок состоит из единственного набора из аминокислот . Каждый белок специально приспособлен для своей функции.
- Любой белок в организме человека может быть создан из перестановок только 20 аминокислот.
- Существует семь типов белков: антитела , сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки .
Синтез белка
Белки синтезируются в организме посредством процесса, называемого трансляцией . Трансляция происходит в цитоплазме и включает преобразование генетических кодов в белки. Генетические коды собираются во время транскрипции ДНК, где ДНК расшифровывается в РНК. Затем клеточные структуры, называемые рибосомами, помогают транскрибировать РНК в полипептидные цепи, которые необходимо модифицировать, чтобы они стали функционирующими белками.
Аминокислоты и полипептидные цепи
Аминокислоты являются строительными блоками всех белков, независимо от их функции.Белки обычно представляют собой цепочку из 20 аминокислот. Человеческое тело может использовать комбинации этих 20 аминокислот для производства любого необходимого ему белка. Большинство аминокислот следуют структурному шаблону, в котором альфа-углерод связан со следующими формами:
- Атом водорода (H)
- Карбоксильная группа (-COOH)
- Аминогруппа (-Nh3)
- Группа «переменная»
Среди различных типов аминокислот «вариабельная» группа наиболее ответственна за вариации, поскольку все они имеют водородные, карбоксильные группы и связи аминогруппы.
Аминокислоты соединяются посредством синтеза дегидратации, пока не образуют пептидные связи. Когда несколько аминокислот связаны между собой этими связями, образуется полипептидная цепь. Одна или несколько полипептидных цепей, скрученных в трехмерную форму, образуют белок.
Структура белка
Структура белка может быть глобулярной или волокнистой в зависимости от его конкретной роли (каждый белок является специализированным). Глобулярные белки обычно компактны, растворимы и имеют сферическую форму.Волокнистые белки обычно имеют удлиненную форму и нерастворимы. Глобулярные и волокнистые белки могут иметь один или несколько типов белковых структур.
Существует четыре структурных уровня белка: первичный, вторичный, третичный и четвертичный. Эти уровни определяют форму и функцию белка и отличаются друг от друга степенью сложности полипептидной цепи. Первичный уровень является самым основным и рудиментарным, в то время как четвертичный уровень описывает сложные связи.
Отдельная белковая молекула может содержать один или несколько из этих уровней структуры белка, и структура и сложность белка определяют его функцию. Коллаген, например, имеет суперскрученную спиральную форму, длинную, тягучую, прочную и похожую на веревку — коллаген отлично подходит для обеспечения поддержки. Гемоглобин, с другой стороны, представляет собой сложенный и компактный глобулярный белок. Его сферическая форма полезна для маневрирования по кровеносным сосудам.
Типы белков
Всего существует семь различных типов белков, к которым относятся все белки.К ним относятся антитела, сократительные белки, ферменты, гормональные белки, структурные белки, запасные белки и транспортные белки.
Антитела
Антитела — это специализированные белки, которые защищают организм от антигенов или чужеродных захватчиков. Их способность перемещаться по кровотоку позволяет им использоваться иммунной системой для идентификации и защиты от бактерий, вирусов и других чужеродных злоумышленников в крови. Один из способов, которым антитела противодействуют антигенам, — это их иммобилизация, чтобы они могли быть уничтожены лейкоцитами.
Сократительные белки
Сократительные белки отвечают за сокращение и движение мышц. Примеры этих белков включают актин и миозин. Эукариоты, как правило, обладают обильным количеством актина, который контролирует сокращение мышц, а также процессы клеточного движения и деления. Миозин приводит в действие задачи, выполняемые актином, снабжая его энергией.
Ферменты
Ферменты — это белки, которые облегчают и ускоряют биохимические реакции, поэтому их часто называют катализаторами.Известные ферменты включают лактазу и пепсин, белки, которые известны своей ролью в заболеваниях пищеварительной системы и в специальных диетах. Непереносимость лактозы вызвана дефицитом лактазы — фермента, расщепляющего сахарную лактозу, содержащуюся в молоке. Пепсин — это пищеварительный фермент, который в желудке расщепляет белки в пище. Нехватка этого фермента приводит к расстройству пищеварения.
Другими примерами пищеварительных ферментов являются ферменты, присутствующие в слюне: амилаза слюны, калликреин слюны и лингвальная липаза — все они выполняют важные биологические функции.Амилаза слюны — это основной фермент слюны, который расщепляет крахмал на сахар.
Гормональные белки
Гормональные белки — это белки-мессенджеры, которые помогают координировать определенные функции организма. Примеры включают инсулин, окситоцин и соматотропин.
Инсулин регулирует метаболизм глюкозы, контролируя концентрацию сахара в крови в организме, окситоцин стимулирует схватки во время родов, а соматотропин — гормон роста, который стимулирует выработку белка в мышечных клетках.
Структурные белки
Структурные белки волокнистые и вязкие, это образование делает их идеальными для поддержки различных других белков, таких как кератин, коллаген и эластин.
Кератины укрепляют защитные покрытия, такие как кожа, волосы, иглы, перья, рога и клювы. Коллаген и эластин поддерживают соединительные ткани, такие как сухожилия и связки.
Хранение белков
Запасные белки резервируют аминокислоты для организма до тех пор, пока они не будут готовы к употреблению.Примеры запасных белков включают яичный альбумин, который содержится в яичных белках, и казеин, белок на основе молока. Ферритин — еще один белок, который хранит железо в транспортном белке, гемоглобине.
Транспортные белки
Транспортные белки — это белки-переносчики, которые перемещают молекулы из одного места в другое в организме. Гемоглобин является одним из них и отвечает за транспортировку кислорода через кровь через красные кровяные тельца. Цитохромы, другой тип транспортных белков, действуют в цепи переноса электронов как белки-переносчики электронов.
Что такое белок? Биолог объясняет
Примечание редактора: Натан Альгрен — доцент кафедры биологии в Университете Кларка. В этом интервью он подробно объясняет, что такое белки, как они производятся, а также широкий спектр функций, которые они выполняют в организме человека.
Натан Альгрен объясняет, что делают белки в нашем организме.
Что такое белок?
Белок — это основная структура, которая встречается во всем живом.Это молекула. И главное в белке — это то, что он состоит из более мелких компонентов, называемых аминокислотами. Мне нравится думать о них как о бусинах разного цвета. Каждая бусинка представляет собой аминокислоту, представляющую собой более мелкие молекулы, содержащие атомы углерода, кислорода, водорода и иногда атомы серы. Итак, белок — это, по сути, цепочка, состоящая из этих маленьких отдельных аминокислот. Есть 22 различных аминокислоты, которые вы можете комбинировать по-разному.
Белок обычно не существует в виде цепочки, но фактически сворачивается в определенную форму в зависимости от порядка и того, как эти разные аминокислоты взаимодействуют друг с другом.Эта форма влияет на то, что белок делает в нашем организме.
Откуда берутся аминокислоты?
Аминокислоты в нашем организме поступают из пищи, которую мы едим. Мы также производим их в нашем теле. Например, другие животные производят белки, а мы их едим. Наше тело берет эту цепочку и разбивает ее на отдельные аминокислоты. Затем он может преобразовать их в любой белок, который нам нужен.
После того, как белки расщепляются на аминокислоты в пищеварительной системе, они попадают в наши клетки и как бы плавают внутри клетки, как эти маленькие отдельные шарики в нашей аналогии.А внутри клетки ваше тело в основном связывает их вместе, чтобы вырабатывать белки, необходимые вашему организму.
Примерно половину необходимых нам аминокислот мы можем производить самостоятельно, а остальные мы должны получать из пищи.
Что делают белки в нашем организме?
Ученые не совсем уверены, но большинство из них согласны с тем, что в нашем организме около 20 000 различных белков. Некоторые исследования предполагают, что их может быть даже больше. Они выполняют множество функций — от некоторых метаболических преобразований до удержания ваших клеток вместе и заставляя ваши мышцы работать.
Их функции делятся на несколько широких категорий. Один структурный. Ваше тело состоит из множества различных структур — представьте себе струнные структуры, шарики, якоря и т. Д. Они образуют вещество, которое скрепляет ваше тело. Коллаген — это белок, который придает структуру вашей коже, костям и даже зубам. Интегрин — это белок, который обеспечивает гибкие связи между вашими клетками. Ваши волосы и ногти состоят из протеина, называемого кератином.
Еще одна важная роль, которую они берут на себя, — это биохимия — то, как ваше тело выполняет определенные реакции в вашей клетке, такие как расщепление жиров или аминокислот.Помните, я сказал, что наше тело расщепляет белок из пищи, которую мы едим? Даже эту функцию выполняют такие белки, как пепсин. Другой пример — гемоглобин — белок, переносящий кислород в крови. Итак, они проводят эти особые химические реакции внутри вас.
Белки также могут обрабатывать сигналы и информацию, например белки циркадных часов, которые отслеживают время в наших клетках, но это несколько основных категорий функций, которые белки выполняют в клетке.
Почему белок часто ассоциируется с мышцами и мясом?
В разных продуктах есть разное содержание белка. В таких растениях, как пшеница и рис, много углеводов, но они менее богаты белком. Но в мясе вообще больше белка. Для создания мышц вашего тела требуется много белка. Вот почему белок часто ассоциируется с употреблением мяса и наращиванием мышечной массы, но на самом деле белки участвуют в гораздо большем, чем это.
[ Получайте удовольствие от разговора каждые выходные. Подпишитесь на нашу еженедельную рассылку.]
5 видов протеина | Наука
Обновлено 5 декабря 2018 г.
Автор: Джанет Рене
Питательные вещества необходимы всем живым организмам. Белки — это сложные молекулы, которые помогают вашему телу выполнять широкий спектр биологических функций. Каждый тип белка выполняет определенную функцию. Белки состоят из строительных блоков, известных как аминокислоты, которые были впервые выделены в начале 1900-х годов.Ваше тело использует около 22 аминокислот, хотя их больше. Белки содержат разное количество этих первичных аминокислот. Белок обеспечивает необходимые элементы для функционирования клеток.
Структурные
Самый большой класс белков — это структурные белки. Эти типы белков служат важными компонентами для построения вашего тела. Кератин и коллаген — самые распространенные структурные белки. Это прочные волокнистые белки. Кератин формирует структуру вашей кожи, ногтей, волос и зубов.В то время как коллаген служит соединительной структурой для ваших сухожилий, костей, мышц, хрящей и кожи, в частности.
Хранилище
Хранилище белков содержит важные элементы, которые необходимы вашим клеткам. Гемоглобин — это жизненно важный белок, который хранит кислород в красных кровяных тельцах. Этот критически важный белок транспортируется ко всем вашим клеткам и тканям по мере циркуляции крови. Ферритин — это запасной белок, в котором содержится важнейший элемент — железо, которое помогает организму вырабатывать здоровые эритроциты.Он состоит из сложных полипептидных цепей и высвобождается при необходимости.
Гормональные
Гормональные белки действуют как химические посредники. Они передают сигналы через сложный коммуникационный процесс, известный как эндокринная и экзокринная системы. Эта система состоит из желез и клеток, вырабатывающих гормоны. Поджелудочная железа выделяет гормон инсулин, который, например, вырабатывается в ответ на уровень сахара в крови. Инсулин транспортируется через кровоток, чтобы удалить сахар, когда уровень сахара в крови повышен.
Фермент
Ферменты служат в качестве биологических катализаторов, необходимых для химических реакций. Например, пищеварительные ферменты помогают организму переваривать пищу. Они расщепляют сложные молекулы на простые формы для вашего тела. Амилолитические пищеварительные ферменты восстанавливают углеводы и крахмалы до глюкозы, а протеолитические ферменты восстанавливают белки до аминокислот.
Иммуноглобулины
Ваше тело должно защищать себя от захватчиков и других посторонних веществ. Этой цели служат иммуноглобулины.Они действуют как антитела, высвобождаясь в ответ на распознавание антигена. Каждый иммуноглобулин защищает от разных типов антигенов. Иммуноглобулин А обеспечивает защиту от антигенов слизистой оболочки. Например, это бактерии или вирусы, обнаруженные в вашей слюне.
Сворачивание белков: хорошее, плохое и уродливое
Мы часто думаем о белках как о питательных веществах в пище, которые мы едим, или как о главном компоненте мышц, но белки также представляют собой микроскопические молекулы внутри клеток, которые выполняют разнообразные и жизненно важные функции.Завершив проект «Геном человека», ученые обращают свое внимание на «протеом» человека — каталог всех человеческих белков. Эта работа показала, что мир белков увлекателен, он полон молекул с такими замысловатыми формами и точными функциями, что они кажутся почти фантастическими.
Функция белка зависит от его формы, и, когда образование белка идет не так, получаемые в результате деформированные белки вызывают проблемы, которые варьируются от плохих, когда белки пренебрегают своей важной работой, до уродливых, когда они образуют липкую комковатую массу внутри клеток.Текущие исследования показывают, что мир белков далек от первозданного. Образование белка — это процесс, подверженный ошибкам, и ошибки на этом пути были связаны с рядом заболеваний человека.
Мир белков:
В типичной человеческой клетке содержится от 20 000 до более чем 100 000 уникальных типов белков. Почему так много? Белки — это рабочие лошадки клетки. Каждый мастерски выполняет определенную задачу. Некоторые из них являются структурными, например, придают жесткость мышечным клеткам или длинным тонким нейронам.Другие связываются с определенными молекулами и доставляют их в новые места, а третьи катализируют реакции, которые позволяют клеткам делиться и расти. Такое разнообразие и специфичность функций стало возможным благодаря, казалось бы, простому свойству белков: они сворачиваются.
Белки складываются в функциональную форму
Белок начинается в клетке как длинная цепочка, состоящая в среднем из 300 строительных блоков, называемых аминокислотами. Существует 22 различных типа аминокислот, и их порядок определяет, как белковая цепь будет складываться сама по себе.При складывании первыми обычно образуются конструкции двух типов. Некоторые области белковой цепи сворачиваются в тонкие образования, называемые «альфа-спиралями», в то время как другие области складываются в зигзагообразные узоры, называемые «бета-листами», которые напоминают складки бумажного веера. Эти две структуры могут взаимодействовать, образуя более сложные структуры. Например, в одной структуре белка несколько бета-листов обвиваются вокруг себя, образуя полую трубку с несколькими альфа-спиралями, выступающими из одного конца. Трубка короткая и приземистая, так что общая структура напоминает змей (альфа-спирали), выходящих из банки (бета-листовая трубка).Несколько других белковых структур с описательными названиями включают «бета-ствол», «бета-пропеллер», «альфа / бета-подкову» и «складку желе-ролла».
Эти сложные структуры позволяют белкам выполнять свою разнообразную работу в клетке. Белок «змеи в банке», будучи встроенным в клеточную мембрану, создает туннель, который позволяет входить и выходить из клеток. Другие белки образуют формы с карманами, называемыми «активными центрами», которые идеально подходят для связывания с определенной молекулой, например, с замком и ключом.Сворачиваясь в различные формы, белки могут выполнять очень разные роли, несмотря на то, что они состоят из одних и тех же основных строительных блоков. Чтобы провести аналогию, все автомобили сделаны из стали, но обтекаемая форма гоночного автомобиля побеждает в гонках, в то время как автобус, самосвал, кран или дзамбони имеют форму для выполнения своих уникальных задач.
Почему иногда происходит сбой сворачивания белка?
Сворачивание позволяет белку принимать функциональную форму, но это сложный процесс, который иногда терпит неудачу. Сворачивание белка может пойти не так по трем основным причинам:
1: Человек может обладать мутацией, которая изменяет аминокислоту в белковой цепи, что затрудняет поиск конкретного белка его предпочтительной складки или «нативного» состояния.Это касается наследственных мутаций, например, приводящих к муковисцидозу или серповидно-клеточной анемии. Эти мутации расположены в последовательности ДНК или «гене», кодирующем один конкретный белок. Следовательно, эти типы унаследованных мутаций влияют только на этот конкретный белок и связанные с ним функции.
2: С другой стороны, нарушение сворачивания белков можно рассматривать как продолжающийся и более общий процесс, который влияет на многие белки. Когда создаются белки, машина, считывающая указания ДНК для создания длинных цепочек аминокислот, может делать ошибки.По оценкам ученых, этот механизм, рибосома, допускает ошибки в 1 из каждых 7 белков! Эти ошибки могут снизить вероятность правильного сворачивания полученных белков.
3: Даже если аминокислотная цепь не имеет мутаций или ошибок, она все равно может не достичь своей предпочтительной складчатой формы просто потому, что белки не складываются правильно в 100% случаев. Сворачивание белка становится еще более трудным, если условия в клетке, такие как кислотность и температура, изменяются от тех, к которым привык организм.
Нарушение сворачивания белка вызывает несколько известных заболеваний, и ученые предполагают, что многие другие болезни могут быть связаны с проблемами сворачивания. Есть две совершенно разные проблемы, которые возникают в клетках, когда их белки не сворачиваются должным образом.
Один тип проблемы, называемый «потеря функции», возникает, когда недостаточное количество определенного белка сворачивается должным образом, вызывая нехватку «специализированных работников», необходимых для выполнения конкретной работы. Например, представьте, что правильно сложенный белок имеет идеальную форму, чтобы связывать токсин и расщеплять его на менее токсичные побочные продукты.Без достаточного количества правильно сложенного белка токсин будет накапливаться до разрушительного уровня. В качестве другого примера, белок может отвечать за метаболизм сахара, так что клетка может использовать его для получения энергии. Клетка будет расти медленно из-за недостатка энергии, если в ее функциональном состоянии будет недостаточно белка. Причина, по которой клетка заболевает, в этих случаях связана с нехваткой одного специфического, правильно сложенного функционального белка. Муковисцидоз, болезнь Тея-Сакса, синдром Марфана и некоторые формы рака являются примерами заболеваний, которые возникают, когда один тип белка не может выполнять свою работу.Кто знал, что один тип белка из десятков тысяч может быть настолько важен?
Белки, которые сворачиваются неправильно, также могут повлиять на здоровье клетки независимо от функции белка. Когда белки не могут свернуться в свое функциональное состояние, полученные неправильно свернутые белки могут принимать форму, неблагоприятную для переполненной клеточной среды. Большинство белков содержат липкие, «ненавидящие воду» аминокислоты, которые они закапывают глубоко внутри своего ядра. Неправильно свернутые белки изнашиваются этими внутренними частями снаружи, как леденцы в шоколаде, раздавленные, чтобы обнажить липкую карамельную серединку.Эти неправильно свернутые белки часто слипаются, образуя сгустки, называемые «агрегатами». Ученые предполагают, что накопление неправильно свернутых белков играет роль в нескольких неврологических заболеваниях, включая болезнь Альцгеймера, Паркинсона, Хантингтона и болезнь Лу Герига (БАС), но ученые все еще работают над тем, чтобы выяснить, как именно эти неправильно свернутые липкие молекулы наносят ущерб клеткам. .
Один неправильно свернутый белок выделяется среди остальных и заслуживает особого внимания. «Прионный» белок при болезни Крейтцфельдта-Якоба, также известной как болезнь коровьего бешенства, является примером неправильно свернутого белка.Этот белок не только необратимо неправильно свернут, но и превращает другие функциональные белки в свое скрученное состояние.
Как наши клетки защищаются от неправильно свернутых белков?
Недавние исследования показывают, что неправильная укладка белков часто происходит внутри клеток. К счастью, клетки привыкли справляться с этой проблемой и имеют несколько систем для повторного укладки или разрушения аберрантных белковых образований.
Шапероны — одна из таких систем. Правильно названные, они сопровождают белки в процессе сворачивания, улучшая шансы белка на правильное сворачивание и даже позволяя некоторым неправильно свернутым белкам возможность повторно укладываться.Интересно, что шапероны сами по себе являются белками! Есть много разных типов шаперонов. Некоторые специально предназначены для того, чтобы помочь одному типу белка сворачиваться, в то время как другие действуют в более общем плане. Некоторые шапероны имеют форму больших полых камер и обеспечивают белкам безопасное пространство, изолированное от других молекул, в котором они могут складываться. Производство нескольких шаперонов усиливается, когда клетка сталкивается с высокими температурами или другими условиями, затрудняющими сворачивание белка, таким образом, эти шапероны получили прозвище «белки теплового шока».”
Другая линия защиты клеток от неправильно свернутых белков называется протеасомой. Если неправильно свернутые белки задерживаются в клетке, они будут уничтожены этой машиной, которая пережевывает белки и выплевывает их в виде небольших фрагментов аминокислот. Протеасома похожа на центр переработки, позволяя клетке повторно использовать аминокислоты для производства большего количества белков. Сама протеасома — это не один белок, а множество действующих вместе. Белки часто взаимодействуют с образованием более крупных структур с важными клеточными функциями.Например, хвост спермы человека представляет собой структуру, состоящую из многих типов белков, которые работают вместе, образуя сложный роторный двигатель, который продвигает сперму вперед.
Будущие исследования сворачивания и неправильного сворачивания белков:
Почему некоторые неправильно свернутые белки способны уклоняться от таких систем, как шапероны и протеасома? Как липкие неправильно свернутые белки могут вызывать перечисленные выше нейродегенеративные заболевания? Некоторые белки неправильно складываются чаще, чем другие? Эти вопросы находятся в авангарде текущих исследований, направленных на понимание основ биологии белков и болезней, которые возникают в результате неправильного сворачивания белка.
Обширный мир белков с большим разнообразием форм наделяет клетки способностями, которые позволяют жизни существовать и допускают ее разнообразие (например, различия между клетками глаза, кожи, легких или сердца, а также различия между видами) . Возможно, по этой причине слово «белок» происходит от греческого слова «протас», что означает «первостепенное значение».
— Предоставлено Керри Гейлер, аспирантом 4-го курса Гарвардского факультета органической и эволюционной биологии
Какие примеры функции белков?
Сводка таблицы:
1) Ферменты. Каждый процесс, происходящий в организме, в какой-то момент или полностью включает химическую реакцию. Химические реакции протекают в соответствии с физическим законом, известным как свободная энергия Гиббса. Этот закон гласит, что для протекания химической реакции в систему должна быть вложена энергия. Количество энергии, необходимое для начала реакции, называется «энергией активации». Эта энергия активации не всегда доступна; этот тип реакции не является спонтанным. Вот почему существует ферментов .Ферменты катализируют реакцию, что означает, что они ускоряют ее и позволяют ей протекать быстрее, чем это могло бы произойти спонтанно.
а. Фермент — это специализированный белок, который снижает энергию активации . Он не добавляет энергии системе, он уменьшает количество энергии, необходимое для начала реакции. Особое внимание следует уделить тому факту, что требования снижены, поскольку именно здесь учащиеся часто ошибаются. (Ферменты не добавляют энергии реакции ).
Ферменты понижающие энергию активации:
Ферменты снижают энергию активации, необходимую для реакции, связываясь со своим «субстратом» (молекулой, с помощью которой ферменты участвуют в реакции). Субстраты обычно подходят для определенных ферментов, что делает ферменты очень точными инструментами.
Примечание: фермент может иметь более одного субстрата.
В химических реакциях ничего не может произойти, пока молекулы не окажутся в непосредственной близости друг от друга. Следовательно, ферменты снижают энергию активации, связываясь с двумя соединениями, которые необходимы для химической реакции, — объединяя их.Это значительно увеличивает продуктивность клетки, так как избавляет от необходимости ждать, пока молекулы «столкнутся» друг с другом.
Примечание: если бы все реакции, необходимые для жизни, протекали без ферментов, даже самые простые бактерии не смогли бы выжить! Ферменты абсолютно необходимы.
Есть и другие способы, которыми фермент может способствовать реакции. Один из таких механизмов заключается в связывании с субстратом и последующем вскрытии субстрата, чтобы обнажить его функциональные группы.Это позволяет протекать реакции, которая обычно вообще не протекает (из-за закупоренного участка реакции).
2) Структурные белки. Ферменты включают большую часть функциональных белков, но белки также могут быть использованы во многих других областях. Например, клетки и ткани не могут поддерживать свою структуру без структурных белков . Коллаген — хорошо известный структурный белок. Этот белок часто находится во внеклеточном матриксе (пространстве за пределами клетки), удерживающем вместе такие вещи, как сухожилия и связки.
Другой структурный белок, обнаруженный в организме человека, называется актин. Это жизненно важная часть цитоскелета наших клеток и, следовательно, очень важна для их формы и конформации.
3) Транспортные белки. Кислород, гормоны и многие другие вещества не могут перемещаться по телу без посторонней помощи. Для этого очень пригодятся транспортные белки. Думайте о них как о такси. Иногда человек оказывается в незнакомом месте и не может добраться до желаемого.Итак, он вызывает такси. Транспортные белки — это кабины. Кислород не может свободно плавать в крови человека по разным причинам, поэтому белок, называемый гемоглобином, связывается с ним и доставляет его к месту назначения.
4) Моторные белки. Мышцы важны, потому что они работают вместе, чтобы производить сложные движения. Эти движения были бы невозможны без существования моторных белков . Белки, такие как миозин, способны изменять свою конформацию в ответ на химический стимул, позволяя клеткам, обладающим ими, изменять свою форму.Так они ускоряют свое положение в трехмерном пространстве.
5) Белки хранения. Некоторые вещества, от которых зависит выживание нашего тела, опасны для окружающих тканей, если их беспрепятственно дрейфовать. Для этого есть запасных белков . Например, железо хранится в печени с помощью белка, известного как ферритин.
6) Сигнальные белки. Гормональная система организма функционирует как очень сложная почтовая система. Сигнальные белки , часто гормоны, представляют собой специализированные соединения, синтезированные для отправки сообщения в определенное или обширное место.Некоторые сигнальные белки , посылают сообщение каждой клетке тела, а некоторые настолько специфичны, что их может распознать только один тип клеток. Эти белки несут такие команды, как фактор роста нервов ( NGF ), эпидермальный фактор роста ( EGF ) и многие другие.
7) рецепторных белков. Если есть сигнальные белки, должен быть кто-то, кто их получит. Хорошо известным примером является рецептор ацетилхолина , обнаруженный в мышечных клетках в нервно-мышечных соединениях.Они содержат определенные конформации, способные распознавать определенные сигнальные белки.
8) Гены, регулирующие белки. Экспрессия гена очень сложна; он регулируется белками, редактируется, иногда повреждается, повторно редактируется и иногда заглушается. Для того, чтобы ген мог правильно транскрибироваться РНК-полимеразой, необходимо определенное направление. Если бы все гены экспрессировались одновременно, биологические организмы действительно были бы скоплением белков!
Чтобы исправить это, клетка использует белки, называемые регуляторными белками .Они связываются с молекулой ДНК и делают одно из двух: активируют экспрессию генов или подавляют ее. Бактерии содержат репрессор лактозы, который предотвращает экспрессию фермента, необходимого для катаболизма лактозы, когда такой сахар недоступен. Точно так же существуют белки, которые связываются с цепью ДНК, когда необходимо экспрессировать определенный ген — обычно это выполняется белком, участвующим в пути передачи сигнала.
Регуляторный белок, ингибирующий или отключающий ген:
9) Разное. Как было сказано выше, клетки содержат гораздо больше, чем восемь категорий белков. Однако, помимо восьми широких категорий, белки, которые не входят в границы, обычно создаются специально для клетки / организма, которые их содержат. У некоторых медуз, например, есть белок, называемый зеленый флуоресцентный белок ( GFP ), который придает им мистические, зеленые свойства свечения в темноте.
Этот список ссылается на учебник под названием Essential Cell Biology, Fourth Edition во всем своем составе.Основная часть материала была найдена на странице 122. Среди авторов этой книги: Брюс Альбертс, Деннис Брей, Карен Хопкин, Александр Джонсон, Джулиан Льюис, Мартин Рафф, Кейт Робертс и Питер Уолтер. Для дальнейшего чтения этот учебник можно приобрести в Google Книгах [здесь]
(https://play.google.com/store/books/details/Bruce_Alberts_Essential_Cell_Biology_Fourth_Editio?id=Cg4WAgAAQBAJ).
Типы белков и их функции | Здоровое питание
Кирстен Нуньес Обновлено 6 декабря 2018 г.
Белок — это основной макроэлемент, состоящий из небольших единиц, называемых аминокислотами, которые содержатся в каждой клетке.Фактически, белки часто называют строительными блоками жизни. Аминокислоты подразделяются на незаменимые, заменимые или условные. Наш организм не может производить незаменимые аминокислоты, поэтому мы должны получать их с пищей. Незаменимые аминокислоты вырабатываются организмом, тогда как условные аминокислоты необходимы только тогда, когда вы больны. Источники белка считаются полными или неполными в зависимости от того, какие аминокислоты они обеспечивают. По данным Национальной медицинской библиотеки США, от 10 до 35 процентов суточного потребления калорий должно составлять белок.Наш организм не накапливает белок, как жиры или углеводы, поэтому важно получать его достаточно каждый день.
Полные протеины
Полные протеины содержат все девять незаменимых кислот, которые наш организм не может вырабатывать. Основные источники полноценного белка — это продукты животного происхождения, такие как мясо, птица и морепродукты. Примеры включают стейк, индейку и лосось. Другие продукты животного происхождения, такие как яйца и нежирные молочные продукты, также являются хорошими источниками полноценного белка. Но имейте в виду, что некоторые продукты с высоким содержанием белка могут также содержать много насыщенных жиров.Например, стейк содержит 40 граммов белка, но 12 граммов насыщенных жиров. Чтобы употреблять в пищу более питательные полноценные белки, Министерство сельского хозяйства США предлагает выбирать нежирное или нежирное мясо и птицу. Вы также можете есть морепродукты два раза в неделю, чтобы увеличить потребление полезных жиров. Использование здоровых методов приготовления, таких как жарка и жарка, позволит избежать добавления лишних жиров.
Неполные белки
Неполные белки не имеют одной или нескольких незаменимых аминокислот. Почти все растительные белки неполноценны.Фасоль, горох, семена, орехи, соевые продукты и некоторые зерна являются растительными белками. Примеры фасоли и гороха включают белую фасоль, нут, хумус и зеленый горошек. Семена и орехи включают такие продукты, как миндаль, грецкие орехи и семена подсолнечника. USDA рекомендует есть несоленые орехи и семена, чтобы избежать лишнего натрия. Примеры соевых продуктов включают тофу, темпе и соевое молоко. Квиноа, семя, которое употребляют в пищу как зерно, является исключительно богатым источником белка. Если вы не едите продукты животного происхождения, важно употреблять много различных видов растительных белков, чтобы получить достаточно незаменимых аминокислот.


