Гормон белки — Справочник химика 21
Белки — составляющая часть всего живого. На долю белка приходится приблизительно 50% сухого веса клетки. Из природных источников выделяют белки-ферменты, белки-гормоны, белки-токсины, белки-антигены и другие. Осуществляя ферментативную функцию, белки обусловливают динамичность обмена веществ. Белки — органические соединения. Элементарный состав белка углерод —50 — 55,5% водород — 6,5—7,3% азот — 15—18% кислород — 21—24% сера — 0—2,4%. Характерный показатель — содержание азота, в среднем его принимают равным 16%. При определении содержания белка по азоту количество азота умножают на фактор пересчета 6,25(100 16= 6,25). [c.12]
Адсорбционная иммобилизация антигенов. Многие макромоле-кулярные антигены — пептидные гормоны, белки, ферменты, липо-полисахариды, денатурированная ДНК н т. д., а также целые вирусные частицы, компоненты клеток (например, рибосомы) и целые клетки могут быть связаны с поверхностью полимерных н неорганических носителей путем адсорбции в условиях, идентичных описанным для иммобилизации антител. Различия чаш,е всего относятся к оптимальным значениям pH, которые могут изменяться от нейтральных до ш,елочных (pH 6,8—9,6) в зависимости от заряда сорбируемой молекулы. Длительность процесса адсорбции и максимальное количество связанного с поверхностью антигена являются характеристиками, индивидуальными для каждого процесса и зависящими от гидрофобности, заряда и молекулярной массы Молекулы. Однако для многих антигенов время, необ- [c.212]
Различия чаш,е всего относятся к оптимальным значениям pH, которые могут изменяться от нейтральных до ш,елочных (pH 6,8—9,6) в зависимости от заряда сорбируемой молекулы. Длительность процесса адсорбции и максимальное количество связанного с поверхностью антигена являются характеристиками, индивидуальными для каждого процесса и зависящими от гидрофобности, заряда и молекулярной массы Молекулы. Однако для многих антигенов время, необ- [c.212]
Экспрессия самых разных генов может регулироваться путем выбора альтернативных путей сплайсинга. Например, яв.ление альтернативного сплайсинга обнаружено при экспрессии гена, кодирующего основной белок миелиновых мембран, окружающих аксон и обеспечивающих эффективное проведение сигнала на большие расстояния. В результате сплайсинга синтезируются четыре формы основного белка миелина, специальные функции которых пока не исследованы, Альтернативный сплайсинг обеспечивает также разные п ти экспрессии генов, кодирующих полипептидные гормоны, белки ионных каналов клетки, а также ядерные белки, участвующие в регуляции действия генов, определяющих ключевые стадии развития. [c.183]
[c.183]
Гликопротеины входят в состав всех органов, тканей и клеток организма человека и животных они содержатся в секреторных жидкостях и плазме крови. Функции гликопротеинов чрезвычайно разнообразны. Среди них встречаются ферменты, гормоны, белки иммунной системы, компоиенты плазмы крови, муцины, рецепторы клеточных мембран и т. д. [c.471]
Сложные высокомолекулярные вещества, применяемые в косметике жиры, углеводы и другие могут влиять на состояние организма и на процессы тканевого обмена только в том случае, если при этом участвуют биологически активные вещества (биологические катализаторы). К таким веществам относятся витамины, ферменты, гормоны, белки, аминокислоты, микроэлементы и ряд других веществ. [c.141]
B. Гормоны. Многие (но не все ) гормоны — белки. [c.331]
Белки являются носителями жизни. Просто или сложно построен организм, он обязательно содержит белковые вещества. Белки входят в состав сыворотки крови, гемоглобина, мышц, волос, ферментов и некоторых гормонов. Белки являются источником энергии. [c.293]
Белки входят в состав сыворотки крови, гемоглобина, мышц, волос, ферментов и некоторых гормонов. Белки являются источником энергии. [c.293]
Связывание гормонов белками-рецепторами [c.207]
Вот эти-то гормоны наряду с нервной системой и дирижируют , согласовывают протекание различных процессов в человеческом теле. Многие гормоны— белки. И здесь, мы видим, как и в любом процессе жизни, белки играют важную роль. Таких белковых гормонов в организме вырабатывается больще трех десятков, и рассказать о каждом из них просто нет возможности, тем более что сейчас еще далеко не ясно, как они работают . Обычно, для того чтобы понять, какое значение железа имеет для регулирования жизненных процессов, ее частично или полностью удаляют. Или же, наоборот, вводят в тело животного, как говорят — подсаживают, дополнительно кусочек железы. Так и выясняли роль, которую играют гормоны, выделяемые различными железами. [c.66]
Биология размножения людей, как и животных, управляется сложной гормональной системой. Схематически ее можно представить так производимые промежуточным мозгом рилизинг-гормоны вызывают образование гонадотропинов в железах гипофиза, а те уже действуют на половые железы, выделяющие в свою очередь половые гормоны. Гонадотропины — это гормоны-белки, а половые гормоны представляют собой стероиды. Когда концентрация гормона достигает обычного значения, сра- [c.345]
Схематически ее можно представить так производимые промежуточным мозгом рилизинг-гормоны вызывают образование гонадотропинов в железах гипофиза, а те уже действуют на половые железы, выделяющие в свою очередь половые гормоны. Гонадотропины — это гормоны-белки, а половые гормоны представляют собой стероиды. Когда концентрация гормона достигает обычного значения, сра- [c.345]
Физиологическая активность самих биополимеров (ферментов, гормонов, белков гепарина и т. д.) в этой книге не рассматривается. Для синтетических или искусственных полимеров, составляющих предмет дальнейшего изложения, ясно прослеживается специфичность проявляемой физиологической активности. По структуре эти полимеры могут быть разделены на пять больших групп. [c.11]
Возможен перенос вещества из среды в клетку вместе с частью плазматической мембраны (эндо-цитоз), например поглощение липопротеинов крови тканями или перенос вещества из клетки в среду (экзоцитоз), например секреция инсулина, тироксина, других гормонов, белка коллагена. [c.101]
[c.101]
В биотехнологии моноклональные антитела используются в качестве лигандов для аффинной хроматографии. Присоединение интерфероновых мкАТ к се-фарозе позволило разработать метод получения интерферона человека, очищенного в 5000 раз. При помощи мкАТ можно получать гомогенные препараты гормонов, белков, токсинов и других веществ. [c.495]
Белки-регуляторы белковые гормоны, белки, регулирующие действие генов, белковые ингибиторы и активаторы ферментов и других белков. [c.49]
Анаболизм — это превращение более простых веществ в более сложные, служащие структурно-функциональными компонентами клетки, такие, как коферменты, гормоны, белки, нуклеиновые кислоты и др. Многие реакции анаболизма относятся к числу эндергонических источником энергии для них служит процесс [c.186]
Многие клетки синтезируют макромолекулы на экспорт , т. е. для использования в других частях организма. К ним относятся белки и гетерополисахариды межклеточного матрикса, белки плазмы крови, пищеварительные ферменты, белковые гормоны, белки и липиды молока. Поскольку мембрана для макромолекул непроницаема, то их секреция происходит путем экзоцитоза, т. е. путем образования внутри клетки мембранных пузырьков, наполненных секретируемым веществом, и их опорожнения во внеклеточную среду. Таким же способом выделяются из клеток и некоторые низкомолекулярные вещества, накапливающиеся и хранящиеся внутри мембранных пузырьков, например адреналин в клетках мозгового вещества надпочечников, нейромедиаторы в синапсах. [c.223]
Поскольку мембрана для макромолекул непроницаема, то их секреция происходит путем экзоцитоза, т. е. путем образования внутри клетки мембранных пузырьков, наполненных секретируемым веществом, и их опорожнения во внеклеточную среду. Таким же способом выделяются из клеток и некоторые низкомолекулярные вещества, накапливающиеся и хранящиеся внутри мембранных пузырьков, например адреналин в клетках мозгового вещества надпочечников, нейромедиаторы в синапсах. [c.223]
В сложных многоклеточных организмах роль сигнальных, регуляторных веществ играют гормоны. В организмах животных имеются две большие группы гормонов — белки, полипептиды и их производные и стероиды. К первой группе относится тирео-глобулин — белок щитовидной железы, содержащий иодированный тироксин, инсулин, регулирующий уровень сахара в крови, окситоцин, вызывающий сокращение матки, вазопрессин, регулирующий кровяное давление, и т. д. Гормоны синтезируются в железах внутренней секреции и осуществляют регуляцию на уровне организма. Стероиды — соединения, содержащие углеродный скелет циклопентанофенантрена [c.50]
Стероиды — соединения, содержащие углеродный скелет циклопентанофенантрена [c.50]
Среди гормонов белками являются инсулин, секретируемый поджелудочной железой, паратиреоидный гормон щитовидной железы, а также ряд гормонов гипофиза — гормон роста, липотропин, про-лактин. гонадотропин, лютеинизирующий и фолликулостимулирующий гормоны, тиреотропин белковую природу имеют и некоторые, пока мало изученные гормоны кишечника. Значительное число известных гормонов являются пептидами — окситоцин, вазопрессин, адренокортикотропный гормон, а- и -меланоцитстимулирующие гормоны (гипофиз), глюкагон (поджелудочная железа), гастрин, секретин и холецистокинин (желудочно-кишечный тракт), кальци-тонин (щитовидная железа), тканевые гормоны брашкинин и ангиотензин, вещества гормонального характера глутатион и офтальмовая кислота и др. [c.21]
Необходимая стадия прн выделении большинства Б.— механич, разрушение клеток и экстракция требуемого Б. Иногда экстракции предшествует фракционирование содержимого клетки но субклеточным фракциям с помощью препаративного ультрацентрифугиро-вания. Известны также методики выделения, согласно к-рым механич. разрушения клеток не происходит. Такие методики применяют обычно для выделения внеклеточных Б. (напр., протеолитич. ферментов, гормонов, белков, гликопротеидов и липопротеидов плазмы крови, гликопротеидов соединительной ткани). Именно этот класс Б. наиболее доступен. [c.129]
Иногда экстракции предшествует фракционирование содержимого клетки но субклеточным фракциям с помощью препаративного ультрацентрифугиро-вания. Известны также методики выделения, согласно к-рым механич. разрушения клеток не происходит. Такие методики применяют обычно для выделения внеклеточных Б. (напр., протеолитич. ферментов, гормонов, белков, гликопротеидов и липопротеидов плазмы крови, гликопротеидов соединительной ткани). Именно этот класс Б. наиболее доступен. [c.129]
А. г. регулируют развитие мужских половых органов, их функцию, в.пи яют на развитие вторичных половых признаков. Основное действие А. г. соответствует деятельности семенников (testis), в свяаи с чем эти гормоны наз. тестоидными. Андрогенная активность А. г. проявляется почти на всех кивотных и ма.ло зависит от вида. Образование А. г. в половых железах (гонадах) нроисходит под стимулирующим действием гормонов — белков передней доли гипофиза, т. п. гонадотропных гормонов. А. г. влияют пе только па половую сферу, они являются также регуляторами роста и необходимы для жизнодеяте. льности организмов в женском организме А. г. содержатся в меньших количествах. Различают первичные и вторичные А. г. К первичным относят гормоны, образующиеся в железах внутренней секреции у особи мужского по.ла— в семенниках и в корковом слое надпочечников, у особи женского пола — в яичниках и в корковом слое надпочечников к первичным А. г. относится тестостерон. Вторичными называют А. г., к-рые являются продуктами превращения в организме [c.112]
льности организмов в женском организме А. г. содержатся в меньших количествах. Различают первичные и вторичные А. г. К первичным относят гормоны, образующиеся в железах внутренней секреции у особи мужского по.ла— в семенниках и в корковом слое надпочечников, у особи женского пола — в яичниках и в корковом слое надпочечников к первичным А. г. относится тестостерон. Вторичными называют А. г., к-рые являются продуктами превращения в организме [c.112]
Обилие фактических данных и ограниченный объем книги заставили нас дифференцированно подойти к описанию поведения отдельных классов соединений поведение одних, таких, например, как углеводороды, по электрохимии и полярографии которых имеются прекрасные обзорные статьи, рассмотрено лишь очень кратко, поведение других — подробнее. По этой же причине мы сознательно не включили в книгу разделы по применению полярографии в химии сложных биологически активных веществ витаминов, гормонов, белков, алкалоидов и т. п., — так как вследствие особой специфики их полярографического и химического поведения для его описания требуется отдельная большая монография (которая, кстати, и была более 20 лет назад написана Бржезиной и Зуманом и вышла на английском и немецком языках). [c.142]
[c.142]
Анаболические превращения (от греч. anabole — подъем) направлены на образование и обновление структурно-функциональных компонентов клетки, т. е. на синтез сложных биомолекул (коферменты, гормоны, белки, нуклеиновые кислоты и др.) из более простых. Это восстановительные, эндергонические процессы, протекающие с увеличением свободной энергии. [c.312]
Обнаруженные в последние годы воэ.можносъи синтеза физиологически активных полимеров приблизили химию полимеров к биохимии. Для проникновения в эту область требуется кропотливое изучение условий синтеза разнообразных природных соединений. Объектом научных исследований макромоле-кулярной химии становятся антибиотики, витамины, гормоны, белки, углеводы, жиры, липоиды, алкалоиды, пуриновые осно-шания, нуклеотиды, ферменты. Сейчас невозможно предвидеть, где границы возможностей синтеза веществ,, связанных с жизнедеятельностью человека, и как это повлияет на дальнейшие пуш развития биохимии и биофизики. [c.20]
[c.20]
Na+. Кроме того, альдостерон увеличивает активность ряда митохондриальных ферментов, что должно способствовать выработке АТР, необходимого для работы Ка/К+-насоса мембраны на серозной стороне клетки. В результате действия альдостерона возрастают как соотношение КАВН КАО, так и активность некоторых митохондриальных ферментов, в том числе цитратсинтазы. Повышение цитратсин-тазной активности обусловлено истинной индукцией фермента (вероятно, опосредованной влиянием на транскрипцию генов), причем транзиторное возрастание количества этого белка тесно коррелирует с эффектом гормона на транспорт Ыа+. Исходя из того, что прямого эффекта альдостерона на Ка+-насос не было выявлено, представляется вероятным, что гормон действует через увеличение внутриклеточной концентрации Ка+ и создание источника энергии, необходимой для удаления этого иона. Воздействие альдостерона на транспорт К + и Н + может осуществляться с помощью иных механизмов, в которых участвуют различные, регулируемые этим гормоном белки. [c.219]
[c.219]
Природа захватываемого материала Инородные частицы, бактерии, клетки, липосомы, вирусы, молекулярные комплексы Малая капля жидкости, белки, гликопротеины, макромо лекулы Мелкая капля жидкости, гормоны, белки, лектины, ток сины, вирусы, гликопротенны [c.9]
Сэндвич-ИФА пригоден для количественного определения веществ, содержащих много антигенных детерминант, например для антител, ревматоидных факторов, полипептидных гормонов, белков и поверхностных антигенов гепатита В. С точки зрения точности, чувствительности и удобства сэндвич-ИФА сопоставим с радиоиммунологическим анализом. При помощи сэндвич-ме-тода были количественно определены макромолекулярные антигены на уровне аттомолей (Ishikawa et al., 1980). [c.26]
Этап молодости характеризуется полным отсутствием цветения или цветение слабо выражено даже при самых благоприятных для этого условиях. Здесь ярко проявляется роль компетенции, т. е. готовности специфически реагировать на то или иное индуцирующее воздействие. В данном случае ювенильное растение не обладает компетенцией к факторам, вызывающим закладку органов полового или вегетар1Вного размножения. Это может быть связано с отсутствием в органах-мишенях, воспринимающих гормоны, белков-рецепторов, участвующих в индукции генеративного развития. [c.340]
В данном случае ювенильное растение не обладает компетенцией к факторам, вызывающим закладку органов полового или вегетар1Вного размножения. Это может быть связано с отсутствием в органах-мишенях, воспринимающих гормоны, белков-рецепторов, участвующих в индукции генеративного развития. [c.340]
Добиться определенных целей при помощи питания
Как приблизиться к своему идеальному весу и жить в гармонии? Как набрать вес? Как питаться правильно и выстраивать своё питание максимально эффективно? На эти и массу других вопросов знает ответ эксперт «Планеты Спорт» Ульяна Ерохина — эксперт здорового образа жизни, нутрициолог и обладательница премии Президента РФ как представитель талантливой молодежи России. В материале статьи она расскажет о том, от чего зависят колебания нашего веса, как рассчитывать суточный калораж и регулировать содержание белков, жиров и углеводов в зависимости от состояния организма и уровня физической активности.
Для того, чтобы понять, почему у нас «накапливается жир», давайте разберёмся с факторами, которые напрямую влияют на это. Мы поговорим именно о здоровом человеке, анализы и уровень гормонов которого в норме, но он все равно набирает лишний вес.
Мы поговорим именно о здоровом человеке, анализы и уровень гормонов которого в норме, но он все равно набирает лишний вес.
Факторы, влияющие на возникновение лишнего веса:
1. Биологические ритмы.
Нам придется осознать и принять тот фактор, что генетически мы сформированы так, что охотнее едим вечером. Так как после 16:00 энергия «запасается» на завтра. Да, организм активно тратит энергию до 16:00, после же происходит обратный процесс. Вот почему бывает, что нам очень хочется есть вечером, особенно, если за день мы не получили все макро- и микроэлементы вместе с пищей.
2. Сезонные биоритмы.
Охотнее и скорее мы запасаем жир в осенне-зимний период, а легче расстаемся с ним — в весенне-летний. И вы можете заметить по себе, как в период холодов тянет на более жирную и обильную пищу.
3. Двигательная активность человека.
Чем меньше мы двигаемся, тем меньше мышц в нашем теле. Мышцы — это та ткань, которая эффективно расходует жир для извлечения энергии (особенно, если гликогеновое депо пусто). Не менее 80% жира в нашем организме окисляется именно в мышцах. Т.е. чем ниже мышечная масса и двигательная активность, тем больше жира мы откладываем «про запас».
Не менее 80% жира в нашем организме окисляется именно в мышцах. Т.е. чем ниже мышечная масса и двигательная активность, тем больше жира мы откладываем «про запас».
4. Психо-эмоциональный настрой.
На фоне тревоги, депрессии и выработки в связи с этим большего количества кортизола аппетит у нас выше, чем на фоне хорошего настроения и самочувствия.
5. Хроническое недосыпание.
Во время сна происходит максимальное восстановление всех систем нашего организма, а также регуляция гормонов: мелатонина, соматропина, лептина, грелина, гормона молодости и роста и др. Недосыпание же приводит к снижению их уровня, а также провоцирует выработку гормона стресса — кортизола, который в связке с инсулином «танцует кадриль», повышая наш аппетит, увеличивая тревожность и плохое самочувствие! Полноценный сон — одно из главных условий синтеза мелатонина. А ведь главная его функция — регуляция биоритмов: суточных, месячных и сезонных колебаний обмена веществ.
6. Фаза цикла у женщин.
Фаза цикла у женщин.
У женщин во вторую фазу цикла аппетит выше, чем в первую. Поэтому важно начинать период снижения веса именно в первую фазу цикла и стараться удержать его во вторую.
7. Алкоголь.
На фоне алкогольного опьянения аппетит повышается. Спирт повышает чувствительность клеточных мембран к глюкозе, уровень сахара в крови резко снижается, и мы ощущаем голод.
8. Возраст.
После 30 лет необходимо снижать общую калорийность рациона! Можно воспользоваться основным правилом: на 10 % меньше, чем мы питались в 20 лет. И так уменьшать калорийность каждые последующие 10 лет, так как после 25-30 лет наш организм запрограммирован на «старение». Соответственно, все процессы начинают идти в более замедленном ритме, в т.ч. обмен веществ и вывод токсинов из организма. Это генетическая наследственность, и, к сожалению, в ближайшие 50 лет мы вряд ли ее изменим. Но поменять качество жизни нам вполне под силу! Питание с возрастом должно становиться все более «чистым». Желательно исключать полностью или есть в минимальных количествах закисляющую пищу, отказаться от вредных привычек, не переедать.
Желательно исключать полностью или есть в минимальных количествах закисляющую пищу, отказаться от вредных привычек, не переедать.
Так сколько же нам необходимо есть, чтобы оставаться в форме? И сколько требуется, чтобы не накапливать лишнего? Поговорим о том, как рассчитать ежедневный калораж и свой основной метаболизм. Метаболизм (обмен веществ) в современном понимании — это целый комплекс взаимозависимых биохимических и энергетических процессов, обеспечивающих использование пищи и прочих поступлений в наш организм, их переработку для нужд организма и вывод продуктов распада.
Метаболизм — это, по сути, тот обмен веществ нашего организма, без которого мы жить не сможем. С помощью него у нас формируются новые ткани, растут мышцы, волосы, ногти, а также высвобождаются токсины и энергия, дающая нам жизнь.
Метаболизм состоит из двух процессов: катаболизм и анаболизм. С помощью этих двух процессов можно точно понять, как мы можем сформировать новый мышечный корсет или сделать наше тело более стройным и подтянутым.
Любое вещество, которое попадает в наш организм, не сразу идет на обеспечение наших нужд, сначала оно распадается на ферменты. Допустим, съели мы кусок курицы или орехи, молоко — в общем, любой вид белка — для того, чтобы нарастить мышечную массу. Когда белок попадает в наш организм, он, к сожалению, не идентичен составу нашей мышцы, поэтому сначала под действием ферментов нашего организма «раскладывается» на маленькие «кирпичики» — аминокислоты. И при этом выделяется энергия. Процесс выделения энергии при расщеплении поступающей пищи в наш организм и есть катаболизм. Т.е. все съеденное расщепляется, высвобождая энергию. Энергия у нас измеряется в килокалориях. Зная энергетическую ценность пищи, мы, соответственно, знаем, сколько килокалорий поступает в наш организм.
Также у нас есть обратный процесс: когда мы складываем «кирпичики» для построения наших клеток, мышц и тканей. Аминокислоты строят, например, нашу новую мышцу — и для построения также расходуют энергию. Процесс, при котором энергия расходуется для обеспечения нужд нашего организма, и есть анаболизм. Соответственно, если мы будем съедать больше, чем требуется для обеспечения нужд нашего организма, и не тратить все это, то «излишки» будут переходить непосредственно в жировое депо! Грубо говоря, вес нашего тела — это, в принципе, катаболизм минус анаболизм.
Процесс, при котором энергия расходуется для обеспечения нужд нашего организма, и есть анаболизм. Соответственно, если мы будем съедать больше, чем требуется для обеспечения нужд нашего организма, и не тратить все это, то «излишки» будут переходить непосредственно в жировое депо! Грубо говоря, вес нашего тела — это, в принципе, катаболизм минус анаболизм.
При этом важно отметить, что на формирование жировой ткани наш организм расходует меньше энергии, чем на формирование костной или мышечной. Поэтому съеденные в большем объеме, чем требуется нашему организму, жиры (1 г — 9 ккал) быстрее «прилипнут» к жировому депо, при этом не особо напрягаясь.
Теперь перейдем более к детальным примерам. Мы съедаем бутерброд и ложимся на диван: полученные калории в этом случае наш организм будет тратить на расщепление пищи и поддержание жизнедеятельности — дыхание и физиологические процессы. Из съеденного бутерброда пищевой ценностью в 150 ккал 50 будут израсходованы, а оставшиеся уйдут в «запас»: либо в гликоген, либо в жир. Скорее в жир! И абсолютно другая ситуация, если мы после съеденного бутерброда прогуляемся или займемся повседневными делами!
Скорее в жир! И абсолютно другая ситуация, если мы после съеденного бутерброда прогуляемся или займемся повседневными делами!
Вся наша жизнь — это баланс катаболизма и анаболизма. Поэтому для того, чтобы научиться им управлять, необходимо знать наш Основной Метаболизм (ОМ). Итак, давайте посчитаем его.
Я обычно использую и всем советую достаточно простую формулу, выведенную американской ассоциацией нутрициологов, т.к. она достаточно точна:
1) для мужчин — ваш вес в кг.*1*24;
2) для женщин — ваш вес в кг.*0,9*24.
Затем умножаем полученную величину на коэффициент активности, который можно легко найти в интернете. Итогом и будет ваш ОМ. Т.е. тот калораж, ниже которого не желательно опускаться для того, чтобы сохранить организм в текущем весе.
Возьмем девушку весом 60 кг, которая мало занимается спортом. Основной метаболизм ее будет равен: 60*0,9*24=1296 ккал.
Теперь эту величину умножаем на коэффициент активности. У нее малоподвижный образ жизни, поэтому коэффициент будет 1,2.
ОМ=1296*1,2=1555,2 ккал.
Это тот минимальный уровень килокалорий, ниже которого ей опускаться нельзя для того, чтобы поддерживать свой организм в имеющемся весе.
Если нам необходимо снизить вес, то мы также просчитываем свой ОМ для текущего веса, а также для того веса, который мы хотели бы иметь. Далее каждые две недели вычитаем от ОМ 10% и в итоге доходим до того веса, который нам необходим. Не делаем резкое снижение килокалорий. Иначе все процессы в организме затормозятся, что грозит печальными последствиями для всех систем. По 10% от текущего веса каждые две недели — это самый оптимальный, комфортный и безопасный режим, который приведет вас к хорошему, крепкому и длительному результату.
То же касается и набора веса. Действуем по такой же схеме, как и с похуданием, только каждые две недели увеличиваем свой калораж на 10%. До того момента, пока наш вес не будет соответствовать норме!
Зная наш ОМ, мы наконец-то можем выстроить систему питания. Рассмотрим на примере все той же девушки в 60 кг с низким коэффициентом активности. Зная, что ей необходимо съедать по 1560 ккал, рассчитываем, сколько необходимо организму белков, жиров и углеводов.
Рассмотрим на примере все той же девушки в 60 кг с низким коэффициентом активности. Зная, что ей необходимо съедать по 1560 ккал, рассчитываем, сколько необходимо организму белков, жиров и углеводов.
Жиры — это наши гормоны, регенерация наших клеток, иммунитет и т.д. Поэтому жиры, как и белки, мы просчитываем всего один раз. В идеале для нормального здорового человека оптимальная норма жиров будет такова: 1 г жира на 1 кг тела. Т.е. для нашей девушки в 60 кг весом достаточно употреблять от 40 г до 60 г жиров. Этого вполне хватит, чтобы закрыть потребности организма.
Белки — это наш строительный материал. Их желательно употреблять в каждый прием пищи. Белки мы также рассчитываем всего один раз. Но здесь учитываем нашу активность и цели. Если тренировка не более пяти раз в неделю, то достаточно 1,5 г белка на 1 кг тела. Если ваша активность максимальна, то 2 г белка на 1 кг тела будет достаточно, чтобы заполнить все потребности организма. Если вы к тому же «растите» мышечную массу, то можете дополнительно пропить аминокислоты.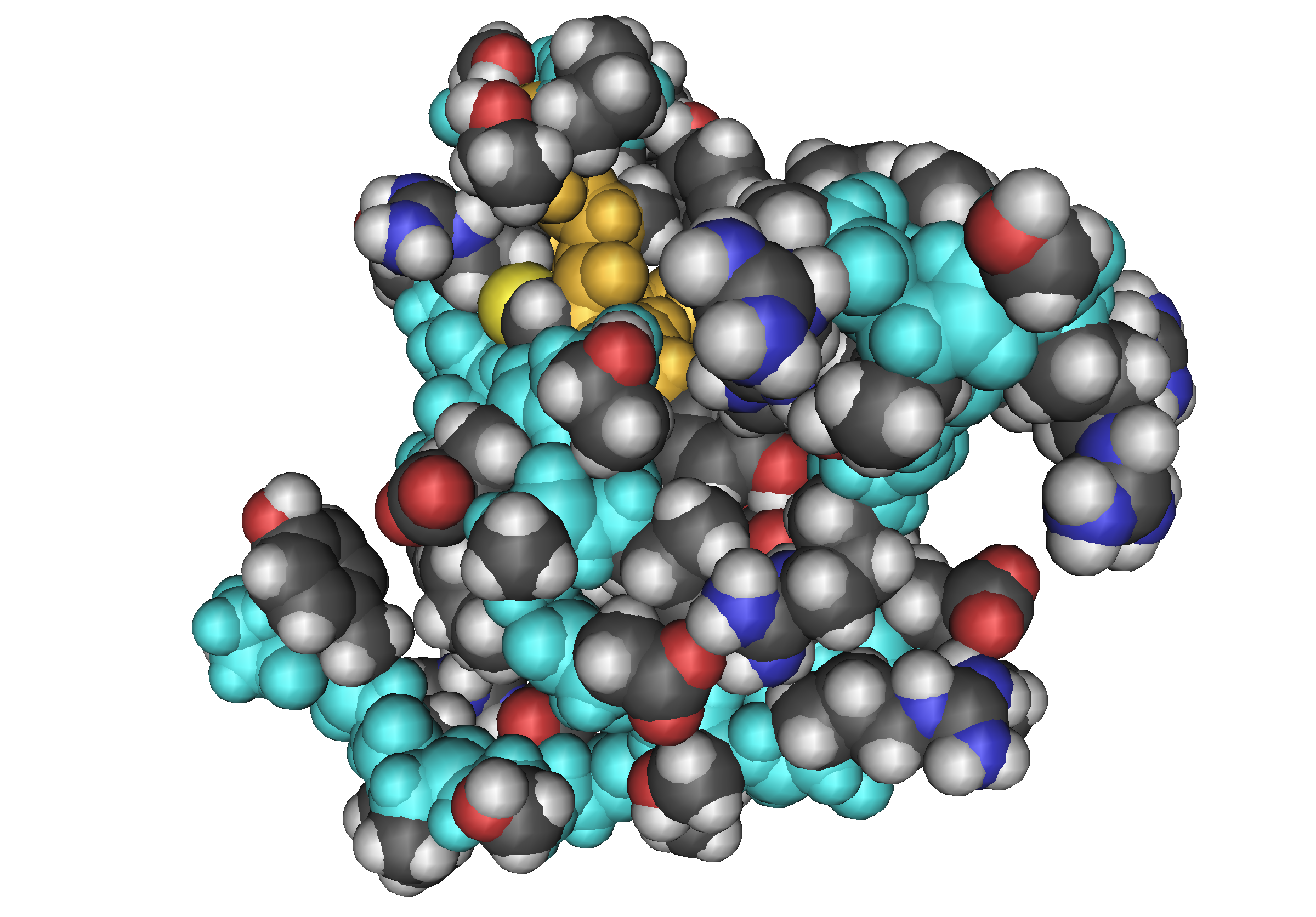 Для тех, у кого низкий уровень физической активности, достаточно 1 г белка на 1 кг тела. В случае с нашей девушкой 60 г белка будет достаточно для ее организма.
Для тех, у кого низкий уровень физической активности, достаточно 1 г белка на 1 кг тела. В случае с нашей девушкой 60 г белка будет достаточно для ее организма.
Переходим к углеводам. И это как раз тот «рабочий» продукт, с которым мы и будем работать при балансировании нашего меню. Важно учесть, что нижняя планка по углеводам — это 2 г на 1 кг тела. Если мы резко урежем в рационе углеводы, это грозит нам гипогликемией, отечностью, слабостью, головокружением. Поэтому нижнюю планку углеводов при составлении меню удерживаем обязательно, а вот с остальным можно поиграть — в зависимости от ваших целей. Для поддержания нормального состояния жизнедеятельности девушке из нашего примера достаточно 2 г на 1 кг тела, следовательно, углеводов потребуется всего 120 г.
Зная о том, сколько нам требуется белков, жиров и углеводов, мы можем посчитать наш суточный калораж. Но помним о том, что он должен быть не меньше нашего ОМ. Для девушки из примера калораж будет равен: 1 г жиров*масса тела в кг*9 ккал + 1 г белков*масса тела в кг*4,1+ 2г углеводов*масса тела в кг*4,1.
То есть (1*60*9)+(1*60*4,1)+(2*60*4,1) = 540+246+492 = 1278 ккал.
Теперь умножаем на коэффициент активности 1,2, получаем 1533,6 ккал. Мы практически попали в ее основной метаболизм. И это норма для того, чтобы держать 60 кг веса.
Не надо паниковать на старте, так как придерживаться уровня суточной калорийности практически нереально. Поэтому стремитесь попадать в норму приблизительно и смотрите среднюю цифру на неделе. Однако если вы начнете чувствовать сильную усталость, нехватку сил и т.д., то смело увеличивайте в своем рационе углеводы. Если чувствуете, что начинаете заболевать, то увеличивайте в рационе насыщенные жиры. Если видите, что худеете за счет мышц, то увеличивайте долю белков! Суточный калораж делите приблизительно так: на завтрак — 23-30%, перекус — 15%, обед — 40-45%, второй перекус — 10%, ужин — 25-30%.
Если вы хотите добиться при помощи питания определенных целей, то будьте последовательны. Все рекомендации проверены практикой и наиболее грамотно приведут вас к цели! Не бойтесь пробовать новое, экспериментируйте со вкусами, планируйте и составляйте рацион на неделю или две. Это, как минимум, облегчит вам жизнь, и, как максимум, принесет пользу и сэкономит бюджет! Делайте свое питание сбалансированным и вкусным, перекрывайте все физиологические потребности организма. Я желаю вам чистого здорового питания без срывов и откатов назад, с хорошим самочувствием и прекрасным настроением. И помните, наш организм обновляется ежегодно, поэтому лишь вам решать, каким вы будете завтра!
Это, как минимум, облегчит вам жизнь, и, как максимум, принесет пользу и сэкономит бюджет! Делайте свое питание сбалансированным и вкусным, перекрывайте все физиологические потребности организма. Я желаю вам чистого здорового питания без срывов и откатов назад, с хорошим самочувствием и прекрасным настроением. И помните, наш организм обновляется ежегодно, поэтому лишь вам решать, каким вы будете завтра!
Белки, связывающие тиреоидные гормоны и их физиологическая роль | Свиридов
Стероидные и тиреоидные гормоны окалывают регуляторное действие на целый комплекс физиологических процессов, составляющих основу нормального развития и функционирования организма. В русле крови человека от 96 до 99,9% общих масс кортизола, прогестерона, тироксина (Т- и трийодтиронина (Т3) циркулируют в виде комплексов с гормонсвязывающими транспортными белками (53]. Гипотеза «свободных гормонов» [68, 70] отводит этим транспортным белкам пассивную функцию поддержания стационарного пула биологически активных несвязанных гормонов за счет быстрой диссоциации комплексов в ответ на потребности тканей-мишеней. Исследования последних лет выявили активную роль транспортных белков и их рецепторов на поверхности клеточных мембран во взаимодействии стероидных и тиреоидных гормонов с компетентными тканями.
Исследования последних лет выявили активную роль транспортных белков и их рецепторов на поверхности клеточных мембран во взаимодействии стероидных и тиреоидных гормонов с компетентными тканями.
Структурные аспекты биологической активности комплексов кортикостероидсвязывающего и сексстероидсвязывающего глобулинов с природными лигандами подробно изложены в обзорной статье [76]. Настоящий обзор литературы посвящен описанию физико-химических свойств и биомедицинских характеристик многокомпонентной системы белков, связывающих тиреоидные гормоны в плазме крови человека. Особое внимание уделено рассмотрению физиологического значения этих белков в рамках гипотезы свободных гормонов и в свете их недавно обнаруженных специфических транспортных функций.
- Гипотеза: свободных горооиов о роли Т4—
связывающих Осикло оиааоы чсилвска
Содержание не связанных с белками тиреоидных гормонов в сыворотке человека не превышает 0,4% от их общей концентрации. Однако тиреоидный статус человека в норме и при заболеваниях, а также механизмы многих физиологических процессов с участием Т, и Т, можно объяснить биологической активностью свободных гормонов и количественно оценить путем определения их концентрации. Гипотеза о свободных гормонах, которая была выдвинута еще в 50-х годах [68], получила затем экспериментальное и теоретическое развитие, а недавно была представлена в виде физиологически обоснованной математической модели [53].
Однако тиреоидный статус человека в норме и при заболеваниях, а также механизмы многих физиологических процессов с участием Т, и Т, можно объяснить биологической активностью свободных гормонов и количественно оценить путем определения их концентрации. Гипотеза о свободных гормонах, которая была выдвинута еще в 50-х годах [68], получила затем экспериментальное и теоретическое развитие, а недавно была представлена в виде физиологически обоснованной математической модели [53].
Рассмотрим, придерживаясь сложившейся в этой области терминологии, как гипотеза свободных гормонов в свете накопленных за длительный период экспериментальных данных определяет (физиологическое значение транспортных белков плазмы [53, 68, 70].
- Резервная функция. Тироксинсвязывающис белки обеспечивают накопление и хранение тиреоидных гормонов вне щитовидной железы.
- Буферная функция.Ткани защищены от неконтролируемого избыточного поступления гормона и захватывают его из постоянно возобновляемого свободного пула в соответствии с метаболической потребностью.

- Высвобождающая функция. Связана со второй функцией и основана на том, что кинетические характеристики обратимого гормон-белкового взаимодействия обеспечивают за счет быстрой диссоциации комплексов постоянное возобновление функции свободных гормонов.
1 Автор выражает благодарность д-ру Jacob Robbins (отдел генетики и биохимии, Национальный институт здоровья США) за методическую помощь в подготовке этого обзора.
Резервная функция вносит существенный вклад в тиреоидный гомеостаз, который заключается в поддержании постоянства поступления тиреоидного гормона в ткани и обеспечивает стационарный характер гормонального действия. Биохимическим индикатором резервной функции служит отношение средней концентрации общего Т, (100 нМ) к средней концентрации свободного Т- (30 пМ)в сыворотке. При отсутствии высокоаффинного Т—связывающего глобулина (ТСГ) в сыворотке это отношение уменьшается более чем в 3 раза, тогда как удаление среднеаффинного Т—связывающего преальбумина (ТСПА, транстиретин) или низкоаффинного альбумина дает лишь незначительный эффект. Значит, ТСГ сыворотки является главным периферическим запасающим белком для Т-, секретированного щитовидной железой. Соответствующий биохимический индекс для Т3 (2 нМ/8 пМ) мал и может обсуждаться в связи с механизмом доставки гормона тканям, а не с его резервированием в сыворотке. Существенный вклад в понимание важности резервной функции Т—Связз1вающих белков внесли данные о том, что транспортные белки обеспечивают равномерное распределение поступившего тиреоидного гормона по всем клеткам органа [51, 53]. Хотя альбумин в принципе сам способен выполнить эту роль, действие ТСГ может быть более эффективным из-за меньшей чувствительности к физиологическим вариациям содержания жирных кислот [53].
Значит, ТСГ сыворотки является главным периферическим запасающим белком для Т-, секретированного щитовидной железой. Соответствующий биохимический индекс для Т3 (2 нМ/8 пМ) мал и может обсуждаться в связи с механизмом доставки гормона тканям, а не с его резервированием в сыворотке. Существенный вклад в понимание важности резервной функции Т—Связз1вающих белков внесли данные о том, что транспортные белки обеспечивают равномерное распределение поступившего тиреоидного гормона по всем клеткам органа [51, 53]. Хотя альбумин в принципе сам способен выполнить эту роль, действие ТСГ может быть более эффективным из-за меньшей чувствительности к физиологическим вариациям содержания жирных кислот [53].
Эффективность выполнения транспортным белком буферной функции зависит от величины К4 его комплекса с тиреоидным гормоном, которая должна быть одного порядка с концентрацией свободного гормона в сыворотке. Сравнение значений концентрации свободного Т- (3,4 -10-11 М) и Ка ТСГ (10_10 М) показывает, что, хотя ТСГ и не самый оптимальный буфер, но все же более подходящий для этой роли, чем остальные гораздо менее аффинные Т—связывающие белки. Физиологическое значение буферной функции ТСГ выведено, в частности, из наблюдений за больными с наследственным отсутствием ТСГ. Эти больные имели повышенные концентрации тиреоглобулина в сыворотке вследствие ответной реакции щитовидной железы на увеличенную секрецию тиреотропина из-за больших флюктуаций содержания свободного Т- в сыворотке, лишенной ТСГ и обладающей пониженной буферной емкостью [70].
Физиологическое значение буферной функции ТСГ выведено, в частности, из наблюдений за больными с наследственным отсутствием ТСГ. Эти больные имели повышенные концентрации тиреоглобулина в сыворотке вследствие ответной реакции щитовидной железы на увеличенную секрецию тиреотропина из-за больших флюктуаций содержания свободного Т- в сыворотке, лишенной ТСГ и обладающей пониженной буферной емкостью [70].
Физиологическая роль и механизм проявления гормонвысво- бождающей функции ТСГ явились предметом дискуссии, что нашло отражение в ряде противоречивых публикаций [32, 52, 55, 56]. W.Pardridge и соавт. [55, 56], основываясь на результатах экспериментов по перфузии органов in vivo, сделали вывод, что Т-, связанный с ТСГ, поступает только в некоторые органы, например печень, и недоступен для других, в частности для мозга, тогда как комплекс Т- с альбумином является главным источником гормона для всех тканей. Высвобождение тиреоидного гормона происходит внутри капилляров из-за резкого снижения гормон-белкового сродства под действием ингибирующих факторов [55]. Другие авторы [32, 52, 70], исходя из теоретических расчетов и собственных экспериментальных данных, показали, что скорость диссоциации комплекса и количество высвобождающегося гормона в равновесных условиях достаточны для удовлетворения потребностей любой ткани, т.е. избирательная доставка гормона в ткань за счет усиленной диссоциации в специфических условиях капиллярного транзита не может играть определяющую роль.
Другие авторы [32, 52, 70], исходя из теоретических расчетов и собственных экспериментальных данных, показали, что скорость диссоциации комплекса и количество высвобождающегося гормона в равновесных условиях достаточны для удовлетворения потребностей любой ткани, т.е. избирательная доставка гормона в ткань за счет усиленной диссоциации в специфических условиях капиллярного транзита не может играть определяющую роль.
Трудно усомниться в фундаментальном положении гипотезы активных свободных гормонов о том, что связанные в системе транспортных белков Т- и Т3 могут переходить по законам термодинамики в свободный пул и следовать далее по пути метаболизма, включающему взаимодействие со своими мембранными рецепторами. Однако эта гипотеза оставляет открытым во-
Таблица i Многокомпонентная система белков, связывающих тиреоидные гормоны в плазме человека
|
Белок |
Концентрация в плазме1, мг/л |
Молекулярная масса, кД |
К. |
Ссылка |
|
|
для Т4 |
для Tj |
||||
|
ТСПА |
250 |
53 |
700“ |
100“ |
169.70] |
|
Альбумин |
42 000 |
66 |
5“ |
1“ |
158,70] |
|
ТСГ |
15 |
54 |
100 000 |
5 000 |
169.701 |
|
АпоА-1 |
1 500 |
28 |
750 |
-7 |
[17,71] |
|
АпоА-И |
350 |
17,5 |
-10 |
— |
[22,71] |
|
AnoA-IV |
18 |
46 |
-10 |
— |
[22,71| |
|
АлоВ-100 |
1 000 |
550 |
25 |
— |
[18,711 |
|
АпоС-1 |
50 |
6,6 |
-10 |
— |
117,711 |
|
АпоС-П |
40 |
8,8 |
-10 |
— |
[17,7Ц |
|
АпоС-Ш |
130 |
8,8 |
-10 |
— |
117,71] |
|
АпоЕ |
45 |
34 |
-10 |
— |
[22,711 |
|
IgA |
2 100 |
160 |
14 |
— |
18. |
|
IgG |
12 500 |
150 |
20 |
— |
[8,611 |
|
IgM |
1 250 |
950 |
1 100 |
70 |
18.61] |
* Даны средние значения из диапазонов, приведенных в литературе |61, 70, 71|.
“ Равновесный параметр для первого высокоаффинного центра связывания.
прос о специфических функциях транспортных белков, присутствующих во внеклеточных жидкостях , в процессах взаимодействия тиреоидных гормонов с компетентными клетками. Дело в том, что данная гипотеза принимает во внимание главным образом кинетические и термодинамические аспекты гормон-бел- ковых взаимодействий, определяемые микроструктурой активных центров, оставляя на втором плане специфические физико-химические свойства макромолекулы в целом и ее характерные структурные элементы. Поэтому в следующем разделе нашей статьи перед тем, кай рассмотреть данные литературы об активной роли некоторых транспортных белков во взаимодействии тиреоидных гормонов с клеткой, мы остановимся на обсуждении макромолекулярных свойств отдельных компонентов системы Т4-связывающих белков плазмы.
- Свойства и специфические транспортные функции многокомпонентной системы бслкоо, тоязыонющех тетсоедныс оор- мосы о елнзмс еслооскн
Долгое время считали, что плазма крови человека содержит только три белка, взаимодействующих с тиреоидными гормонами: ТСГ, ТСПА и альбумин [68, 69]. В последнее время обнаружено новое свойство известных белков — аполипопротеинов и нормальных иммуноглобулинов плазмы — способность специфически связывать тиреоидные гормоны и регулировать их поступление в ткани-мишени [4, 6, 8, 19, 22]. Выявлена также активная роль “классических” Т4-связывающих белков во взаимодействии тиреоидных гормонов с клеткой [1, 30, 41, 51]. Таким образом, в настоящее время можно говорить о системе транспортных белков плазмы, компоненты которой связаны между собой и тиреоидными гормонами общим термодинамическим соотношением и в то же время выполняют индивидуальные функции по направленной доставке одного из двух гормонов в специфические ткани.
Подвижность компонентов системы Т4-связывающих белков сыворотки человека при электрофорезе в полиакриламидном геле уменьшается в следующем ряду: ТСПА, альбумин, ТСГ, липопротеины, иммуноглобулины. Применение элекрофоретической техники высокого разрешения позволяет провести анализ распределения связанных \ треоидных гормонов в этом ряду и сделать полезные для медицинской диагностики выводы о содержании и биологической активности как отдельных транспортных белков, так и системы в целом. Мы же используем указанный порядок при описании свойств компонентов системы Т — связывающих белков сыворотки человека, чтобы избежать произвольного разделения этих белков на важные и второстепенные поскольку их биологически обоснованная иерархия будет создана, судя по темпам исследований только в ближайшем будущем. В табл. 1 приведены основные характеристики системы транспорта тиреоидных гормонов в плазме человека.
Применение элекрофоретической техники высокого разрешения позволяет провести анализ распределения связанных \ треоидных гормонов в этом ряду и сделать полезные для медицинской диагностики выводы о содержании и биологической активности как отдельных транспортных белков, так и системы в целом. Мы же используем указанный порядок при описании свойств компонентов системы Т — связывающих белков сыворотки человека, чтобы избежать произвольного разделения этих белков на важные и второстепенные поскольку их биологически обоснованная иерархия будет создана, судя по темпам исследований только в ближайшем будущем. В табл. 1 приведены основные характеристики системы транспорта тиреоидных гормонов в плазме человека.
II.1. ТСПА
ТСПА имеет мол. м—53 кД и является негликозилированным тетрамером четырех идентичных субъединиц, каждая из которых состоит из 127 аминокислотных остатков [46].
Высокоочищенный ТСПА доступен в больших количествах благодаря разработке эффективных способов его выделения традиционными методами белковой химии [14] и хроматографией по сродству к тиолсефарозе и иммобилизованному ретинолсвязывающему белку [34]. Однако из-за особенностей строения своего активного центра ТСПА практически не взаимодействует с биоспецифическими сорбентами, содержащими иммобилизованный тиреоидный гормон [6, 37].
Однако из-за особенностей строения своего активного центра ТСПА практически не взаимодействует с биоспецифическими сорбентами, содержащими иммобилизованный тиреоидный гормон [6, 37].
Аминокислотная последовательность ТСПА, определенная прямым секвенированием белка [46], полностью соответствует последовательности нуклеотидов в клонированной кДНК для ТСПА [50]. Кристаллографические исследования белка при высоком разрешении (1, 8 А) дали исчерпывающую информацию о структурах высокого порядка, в частности о необычно большом вкладе Р-структуры, наличии короткого а-спирального участка и о пространственной организации Т4-связывающих центров [23, 24]. ТСПА — очень стабильный белок: по данным спектроскопии ‘Н-ЯМР [66] его вторичная и третичная структуры устойчивы даже при 80°С.
ТСПА имеет два одинаковых по строению [23], но различающихся по сродству и емкости центра связывания тиреоидных гормонов с К-7-10 7 и 710s M_1 (для Т4), 1 ТО7 и 6 -10s М_1 (для Т3) при pH 7,4 и 37°С [70]. Взаимодействие Т4или Т3 с одним из центров вызывает отрицательную кооперативность связывания по другому центру, и поэтому почти все молекулы ТСПА несут только по одной молекуле гормона [69]. Время полужизни комплекса ТСПА с Т4и Т3 составляет 7,4 и1,0 с соответственно [70]. Молекула ТСПА содержит на своей поверхности четыре идентичных, независимых от Т, центра взаимодействия с ретинолсвязывающим белком (Ke~106— 107 м_|), из которых in vivo занят только один [42].
Взаимодействие Т4или Т3 с одним из центров вызывает отрицательную кооперативность связывания по другому центру, и поэтому почти все молекулы ТСПА несут только по одной молекуле гормона [69]. Время полужизни комплекса ТСПА с Т4и Т3 составляет 7,4 и1,0 с соответственно [70]. Молекула ТСПА содержит на своей поверхности четыре идентичных, независимых от Т, центра взаимодействия с ретинолсвязывающим белком (Ke~106— 107 м_|), из которых in vivo занят только один [42].
Соединения, существенно отличающиеся по структуре от йод- тиронинов, также способны взаимодействовать с Т4-ввязьшаю- щим центром ТСПА. Среди них наиболее изучены барбитал, 8- анилин-1-нафталинсульфокислота, 2,4-динитрофенол, салицилаты и пенициллин [68, 70]. Недавно [54] было проведено системное исследование различных классов химических соединений, обладающих лекарственными свойствами, которые конкурируют со [1И1|-Т4 за связывание с ТСПА и другим высокоаффинным транспортным белком ТСГ. Показано, что эти два белка существенно различаются по сродству к изученным лекарствам. Так, с ТСПА особенно сильно взаимодействуют соединения ряда антраниловой кислоты (потенциал связывания 175—20% относительно Т4), причем флуфенамовая кислота связывается активнее самого Т4. В отличие от связывания с ТСГ комплексообразование ТСПА с Т4в существенной степени ингибируется салицилатом и ацетилсалициловой кислотой и не подвержено влиянию дифенилгидантоина [54].
Показано, что эти два белка существенно различаются по сродству к изученным лекарствам. Так, с ТСПА особенно сильно взаимодействуют соединения ряда антраниловой кислоты (потенциал связывания 175—20% относительно Т4), причем флуфенамовая кислота связывается активнее самого Т4. В отличие от связывания с ТСГ комплексообразование ТСПА с Т4в существенной степени ингибируется салицилатом и ацетилсалициловой кислотой и не подвержено влиянию дифенилгидантоина [54].
Биосинтез ТСПА происходит главным образом в печени [25], центральной нервной системе [29] и в глазу [49] млекопитающих. Время полужизни этого белка в системе кровообращения человека составляет около 2 сут. Концентрация ТСПА в нормальной сыворотке варьирует от 100 до 400 мг/л. Регуляторное действие на биосинтез ТСПА оказывают половые и анаболические стероиды, половые стероидные гормоны и наркотические вещества [69]. Концентрации ТСПА и ТСГ в сыворотке изменяются под действием этих соединений в противоположных направлениях. Эстрогены, в частности, при беременности вызывают умеренное снижение уровня ТСПА, тогда как андрогены стимулируют увеличение содержания этого белка. Пониженные концентрации ТСПА были выявлены в сыворотке людей, принимающих героин и метадон [69]. Интересной с медицинской точки зрения характеристикой метаболизма ТСПА является снижение его концентрации при некоторых нетиреоидных заболеваниях, травмах, реакции острой фазы и недостатке питания [72]. Повышенное содержание ТСПА в сыворотке наблюдается при некоторых формах рака, в частности при карциноме поджелудочной железы [62].
Эстрогены, в частности, при беременности вызывают умеренное снижение уровня ТСПА, тогда как андрогены стимулируют увеличение содержания этого белка. Пониженные концентрации ТСПА были выявлены в сыворотке людей, принимающих героин и метадон [69]. Интересной с медицинской точки зрения характеристикой метаболизма ТСПА является снижение его концентрации при некоторых нетиреоидных заболеваниях, травмах, реакции острой фазы и недостатке питания [72]. Повышенное содержание ТСПА в сыворотке наблюдается при некоторых формах рака, в частности при карциноме поджелудочной железы [62].
Относительно небольшой по размерам ген ТСПА (7300 пар оснований) состоит из четырех эксонов и отличается высокой эволюционной стабильностью. Так, выявлено 90% гомологичных структур в ТСПА человека и крысы [36]. Некоторые авторы [45] на основании данных о структурной гомологии относят ТСПА к семейству гастроинтестинальных пептидов, к которому принадлежат глюкагон, секретин, вазоактивный пептид кишечника, ингибиторный пептид желудка и глицентин.
Неизвестны генетические нарушения, проявляющиеся при полном отсутствии ТСПА у человека. Вместе с тем обнаружены шесть генетических вариантов ТСПА с заменами одного аминокислотного остатка в полипептидной цепи. Один из вариантов имеет повышенное сродство к Т4, четыре других варианта у больных с наследственной амилоидотической полинейропатией и молекулярный вариант ТСПА при системном сенильном амилоидозе обладают более низким или нормальным сродством к Т4 [13, 64, 72].
Микрогетерогенность ТСПА, не связанная с генетическими факторами и посттрансляционной модификацией, обнаружена при изоэлектрическом фокусировании сыворотки [59]. Два химических агента, не относящихся к аминокислотам, и компоненты глутатиона способны ассоциировать с ТСПА, обусловливая микрогстерогенность белка и изменение сродства кТ4 [60]. Этим же методом в присутствии 8 М мочевины выявлены два компонента в пуле высокоочищенного ТСПА, введение которых в русло крови кролика существенно увеличивает обратный ток тиреоидных гормонов из внесосудистого пространства в кровоток. По мнению авторов [48], усиление обмена тиреоидных гормонов под действием экзогенно вводимых связывающих белков может иметь терапевтическое значение при плазмаферезе и гемофильтрации в случаях тяжелого тиреотоксикоза.
По мнению авторов [48], усиление обмена тиреоидных гормонов под действием экзогенно вводимых связывающих белков может иметь терапевтическое значение при плазмаферезе и гемофильтрации в случаях тяжелого тиреотоксикоза.
В литературе [13] обсуждалась особая функция ТСПА в центральной нервной системе. Предполагалось, что ТСПА переносит связанный тиреоидный гормон в спинномозговую жидкость. Однако позднее на биологической модели in vivo было показано, что ТСПА человека, химически конъюгированный с N-бро- мацетил-[1251 ]-Т4, не проникает из плазмы в спинномозговую жидкость крысы [28]. Тем не менее весьма вероятно, что Т4, поступающий из плазмы в эпителиальные клетки хориоидного сплетения, связывается с синтезированным in situ ТСПА, образовавшийся комплекс секретируется в спинномозговую жидкость и распределяется в мозге [29].
В цикле работ Ш.С.Азимовой и соавт. [1—3] с использованием биологической модели in vivo н очищенных гомологичных ТСПА человека и крысы изучена физиологическая роль комплексов тиреоидных гормонов с ТСПА. Комплекс ТСПА — тиреоидный гормон из сыворотки проникает через плазматическую мембрану в клетки-мишени [1]. В компетентных клетках комплекс локализуется на рибосомах, митохондриях, в липидных каплях и аппарате Гольджи. В клетках, не чувствительных к тиреоидным гормонам, небольшое количество поступившего ТСПА концентрируется- в лизосомах. Исследование транслокации ТСПА в различные субмптохондриальные фракции показало, что белок из цитоплазмы проникает через внешнюю мембрану и локализуется на внутренней мембране и матриксе митохондрий [2]. Найдено также, что ТСПА поступает в клетки печени, мозга и легких, транслоцируется из цитозоля в ядро и акцентируется хроматином, не подвергаясь при этом модификациям, затрагивающим его антигенные детерминанты [3]. На основании результатов сравнительного изучения структур ТСПА и клеточных рецепторов тиреоидных гормонов, а также данных о транслокации через плазматическую мембрану и внутриклеточном транспорте ТСПА сделан вывод о том, что ТСПА представляет собой базовую часть истинного рецептора тиреоидных гормонов.
Комплекс ТСПА — тиреоидный гормон из сыворотки проникает через плазматическую мембрану в клетки-мишени [1]. В компетентных клетках комплекс локализуется на рибосомах, митохондриях, в липидных каплях и аппарате Гольджи. В клетках, не чувствительных к тиреоидным гормонам, небольшое количество поступившего ТСПА концентрируется- в лизосомах. Исследование транслокации ТСПА в различные субмптохондриальные фракции показало, что белок из цитоплазмы проникает через внешнюю мембрану и локализуется на внутренней мембране и матриксе митохондрий [2]. Найдено также, что ТСПА поступает в клетки печени, мозга и легких, транслоцируется из цитозоля в ядро и акцентируется хроматином, не подвергаясь при этом модификациям, затрагивающим его антигенные детерминанты [3]. На основании результатов сравнительного изучения структур ТСПА и клеточных рецепторов тиреоидных гормонов, а также данных о транслокации через плазматическую мембрану и внутриклеточном транспорте ТСПА сделан вывод о том, что ТСПА представляет собой базовую часть истинного рецептора тиреоидных гормонов.
По мнению авторов [55], механизм проникновения Т4 в орган может состоять либо в диссоциации комплекса под действием неконкурентного ингибитора в микроциркуляции печени, либо во взаимодействии ТСПА со специфическим рецептором на внешней поверхности клеточной мембраны.
С-Divino и G.Schussler [30] показали, что ТСПА, добавленный в разбавленную сыворотку или раствор альбумина человека, усиливает поглощение Т4 в культуре клеток гепатомы НЕр G2 человека. Это побудило авторов [30] изучить возможность прямого взаимодействия ТСПА со специфическими связывающими центрами на поверхности клеток НЕр G2. Найдено, что связывание ТСПА с клетками данной линии зависит от температуры и времени, причем термодинамическое равновесие наступает через 2 ч инкубации. Анализ взаимодействия по методу Скетчарда выявил один класс эквивалентных центров связывания с К„~5 нМ при 4°С и 14 нМ при 37°С. После протеолитического разрушения ТСПА, связанного на поверхности клеточной мембраны, определили, что 88% белка иитернализусгся клеткой. Насыщение связывающих центров ТСПА гормоном усиливало захват и интернализацию белка. Т4 и негормональные лиганды (салицилат и синтетический флавон EMD 21388) стимулировали поглощение нормального ТСПА и его молекулярного варианта с точечной заменой в положении 30 полипептидной цепи клетками астроцитомы и гепатомы [73]. Сделан вывод о том, что взаимодействие между ТСПА и его клеточным рецептором является частью механизма активного транспорта Т4 в клетку и может обусловливать дополнительные метаболические эффекты гормона.
Насыщение связывающих центров ТСПА гормоном усиливало захват и интернализацию белка. Т4 и негормональные лиганды (салицилат и синтетический флавон EMD 21388) стимулировали поглощение нормального ТСПА и его молекулярного варианта с точечной заменой в положении 30 полипептидной цепи клетками астроцитомы и гепатомы [73]. Сделан вывод о том, что взаимодействие между ТСПА и его клеточным рецептором является частью механизма активного транспорта Т4 в клетку и может обусловливать дополнительные метаболические эффекты гормона.
II.2. Альбумин
Альбумин человека состоит из одной негликозилированной полипептидной цепи с мол. м. 66 кД. Известна последовательность 548 аминокислотных остатков этого белка. Из них 48% составляют (-структуру, а 15% образуют а-спиральные участки. Охарактеризованы три главных домена в полипептидной цепи с повторяющимися аминокислотными последовательностями. В русле крови альбумин транспортирует многие низкомолекулярные физиологически активные вещества, в том числе жирные кислоты, аминокислоты, билирубин, ионы металлов, стероиды и йодтиронины. Ген альбумина расположен на длинном плече хромосомы 4. Из 15 эксонов гена два кодируют сигнальный пептид из 18 аминокислотных остатков и пропептад из 6 остатков [58]. Альбумин продуцируется печенью в 25 и 1250 раз более интенсивно, чем соответственно ТСПА и ТСГ. Его концентрация в нормальной сыворотке составляет в среднем 4200 мг/мл, а время полужизни в кровообращении — 13 сут. Содержание альбумина в сыворотке умеренно снижается при циррозе печени, нефрозе, воспалительных реакциях, травмах [70]. В одном [58] из множества обзоров, посвященных альбумину, можно найти полные сведения о его структуре, физико-химических свойствах, молекулярной генетике и метаболизме. Мы же остановимся далее на описании свойств комплексов альбумина с тиреоидными гормонами.
Ген альбумина расположен на длинном плече хромосомы 4. Из 15 эксонов гена два кодируют сигнальный пептид из 18 аминокислотных остатков и пропептад из 6 остатков [58]. Альбумин продуцируется печенью в 25 и 1250 раз более интенсивно, чем соответственно ТСПА и ТСГ. Его концентрация в нормальной сыворотке составляет в среднем 4200 мг/мл, а время полужизни в кровообращении — 13 сут. Содержание альбумина в сыворотке умеренно снижается при циррозе печени, нефрозе, воспалительных реакциях, травмах [70]. В одном [58] из множества обзоров, посвященных альбумину, можно найти полные сведения о его структуре, физико-химических свойствах, молекулярной генетике и метаболизме. Мы же остановимся далее на описании свойств комплексов альбумина с тиреоидными гормонами.
Альбумин содержит один относительно высокоаффинный центр связывания йодтиронинов с Ка 5 46s М~’ (для Т4) и Г ■105 М“‘ (для Т,), а также от 2 до 6 центров низкого сродства с Ко 5 ТО4 М-1 (для Т4) и 5 ТО3 М—‘ (для Т3) [70]. Связывание тиреоидных гормонов с альбумином ингибируется жирными кислотами и другими органическими анионами [70], а также ЫаС1 в физиологических концентрациях [77].
Связывание тиреоидных гормонов с альбумином ингибируется жирными кислотами и другими органическими анионами [70], а также ЫаС1 в физиологических концентрациях [77].
В дополнение к “нормальным” центрам связывания Т4 при генетических повреждениях молекулы альбумина обнаружен центр с Ка 7 10е М_‘. Этот аналог в небольших количествах присутствует в нормальной сыворотке, и его концентрация резко повышается при дисальбуминемической гипертироксинемии [42]. При этом заболевании около 25% общего альбумина проявляет повышенное сродство к Т4, что приводит к существенному увеличению количества гормона, переносимого этим транспортным белком [42]. Важное для медицинской диагностики аномальное связывание Ри1]-Т4 с альбумином легко выявляется после ингибирования ТСПА барбиталом и инактивации ТСГ обработкой сыворотки при pH 3,0 [12].
О специфической роли альбумина в транспорте тиреоидных гормонов в ткани сообщалось лишь в нескольких публикациях [47,51, 81]. Было высказано предположение, что альбумин может опосредовать усиленное поглощение связанных с ним йод- тироиинов печенью за счет взаимодействия белка со своим рецептором на гепатоцитах [81]. В другой работе [47] отмечают факт интернализации комплекса Т3—альбумин периферическими лейкоцитами человека. С.Мепбс1 и соавт. [51] в экспериментах на крысах показали, что 4% раствор альбумина человека, не содержащий ТСПА и ТСГ, при введении вместе со [ |г55]-Т, через портальную вену в печень обеспечивает равномерное распределение меченого гормона по всем клеткам органа, тогда как при перфузии печени не связанным с альбумином [ч51]-Т4 весь гормон захватывается перипортальными клетками.
Было высказано предположение, что альбумин может опосредовать усиленное поглощение связанных с ним йод- тироиинов печенью за счет взаимодействия белка со своим рецептором на гепатоцитах [81]. В другой работе [47] отмечают факт интернализации комплекса Т3—альбумин периферическими лейкоцитами человека. С.Мепбс1 и соавт. [51] в экспериментах на крысах показали, что 4% раствор альбумина человека, не содержащий ТСПА и ТСГ, при введении вместе со [ |г55]-Т, через портальную вену в печень обеспечивает равномерное распределение меченого гормона по всем клеткам органа, тогда как при перфузии печени не связанным с альбумином [ч51]-Т4 весь гормон захватывается перипортальными клетками.
П.3. ТСГ
ТСГ имеет мол. м. 54 кД и в отличие от ТСПА и альбумина является гликопротеином, содержащим 23% сахаров по массе.
Современные эффективные методики выделения и очистки ТСГ основаны на лигацд-аффинной хроматографии [6, 37]. -антихимотрипсином (58% гомологии),а,-антитрипсином (53%) и антитромбином III (27%) [35]. Интересно, что к тому же семейству относится и транскортин человека [40], хотя ни ТСГ, ни транскортин не обладают свойствами антипротеаз. Ген ТСГ расположен в средней части длинного плеча хромосомы X между полосами Xq 11 и Xq 23 [79]. Кодирующая область гена ТСГ состоит из 1245 пар оснований, организованных в 4 эксона [35]. Сведения о вторичной структуре ТСГ получены на основании характеристик кругового дихроизма и флюоресцентных свойств белка [38, 74]. ТСГ содержит примерно равные доли а-спирали и [3-структуры. Расчеты термодинамических параметров плавления третичной структуры ТСГ по данным микрокалориметрии показывают, что в ТСГ присутствуют два близких по пространственной организации домена.
-антихимотрипсином (58% гомологии),а,-антитрипсином (53%) и антитромбином III (27%) [35]. Интересно, что к тому же семейству относится и транскортин человека [40], хотя ни ТСГ, ни транскортин не обладают свойствами антипротеаз. Ген ТСГ расположен в средней части длинного плеча хромосомы X между полосами Xq 11 и Xq 23 [79]. Кодирующая область гена ТСГ состоит из 1245 пар оснований, организованных в 4 эксона [35]. Сведения о вторичной структуре ТСГ получены на основании характеристик кругового дихроизма и флюоресцентных свойств белка [38, 74]. ТСГ содержит примерно равные доли а-спирали и [3-структуры. Расчеты термодинамических параметров плавления третичной структуры ТСГ по данным микрокалориметрии показывают, что в ТСГ присутствуют два близких по пространственной организации домена.
Оба тиреоидных гормона и их структурные аналоги связывают по одному центру в молекуле ТСГ. При 37°С и pH 7,4 значения К составляют 1 1010 и 5 -10® М-1 для Т4 и Т3 соответственно [70]. Несмотря на очень высокую энергию связывания, прибл!гжающуюся по порядку к энергии химических реакций, взаимодействие является обратимым. Диссоциация комплексов ТСГ с тиреоидными гормонами протекает достаточно быстро: время полужизни равно 4 и 39 с соответственно для Т, и Т4 [70|. Т4 имеет структуру наиболее предпочтительного лиганда для ТСГ. Тем не менее этот белок способен связывать, хотя и с невысоким сродством, многие соединения, которые имеют лишь частичное структурное сходство с Т4. Так, сообщалось о взаимодействии с Т4-связывающим центром ТСГ лекарственных препаратов 5,5‘-дифенилгидантоина, фенклофенака, диазепама, салицилатов [69]. Кроме того, ТСГ связывает 8-анилин-1-нафталинсульфонат, что используется в исследованиях комплексообразования методами флюоресцентной спектроскопии и для вытеснения Т4 из комплекса с ТСГ при иммуноанализе [70].
Несмотря на очень высокую энергию связывания, прибл!гжающуюся по порядку к энергии химических реакций, взаимодействие является обратимым. Диссоциация комплексов ТСГ с тиреоидными гормонами протекает достаточно быстро: время полужизни равно 4 и 39 с соответственно для Т, и Т4 [70|. Т4 имеет структуру наиболее предпочтительного лиганда для ТСГ. Тем не менее этот белок способен связывать, хотя и с невысоким сродством, многие соединения, которые имеют лишь частичное структурное сходство с Т4. Так, сообщалось о взаимодействии с Т4-связывающим центром ТСГ лекарственных препаратов 5,5‘-дифенилгидантоина, фенклофенака, диазепама, салицилатов [69]. Кроме того, ТСГ связывает 8-анилин-1-нафталинсульфонат, что используется в исследованиях комплексообразования методами флюоресцентной спектроскопии и для вытеснения Т4 из комплекса с ТСГ при иммуноанализе [70].
ТСГ синтезируется в печени [13]. Его концентрация в нормальной сыворотке составляет 15—30 мг/л. Время полужизни ТСГ в кровообращении 5 дней [63]. Ряд природных и синтетических препаратов способны увеличивать (эстрогены, героин, метадон, 5-фторурацил, перфеназин, клофибрат) или уменьшать (андрогены, глюкокортикоиды, анаболические стероиды) содержание ТСГ в организме человека [69]. Высокие концентрации ТСГ в сыворотке обнаружены при остром вирусном гепатите, хроническом активном гепатите и первичном циррозе печени [72]. Поскольку повышенные концентрации ТСГ были выявлены у 92% больных с гепатоклеточной карциномой, то его можно считать надежным, хотя и неспецифическим, онкомаркером [78]. Скорость продуцирования этого белка снижается как при гипотиреозе, так и при тяжелом тиреотоксикозе. Клиренс замедляется при состояниях с аномально низкими концентрациями тиреоидных гормонов в плазме и усиливается при тиреотоксикозе. Этот сложный эффект тиреоидных гормонов обусловливает значительные колебания концентраций ТСГ в плазме людей с нарушениями функции щитовидной железы [70].
Время полужизни ТСГ в кровообращении 5 дней [63]. Ряд природных и синтетических препаратов способны увеличивать (эстрогены, героин, метадон, 5-фторурацил, перфеназин, клофибрат) или уменьшать (андрогены, глюкокортикоиды, анаболические стероиды) содержание ТСГ в организме человека [69]. Высокие концентрации ТСГ в сыворотке обнаружены при остром вирусном гепатите, хроническом активном гепатите и первичном циррозе печени [72]. Поскольку повышенные концентрации ТСГ были выявлены у 92% больных с гепатоклеточной карциномой, то его можно считать надежным, хотя и неспецифическим, онкомаркером [78]. Скорость продуцирования этого белка снижается как при гипотиреозе, так и при тяжелом тиреотоксикозе. Клиренс замедляется при состояниях с аномально низкими концентрациями тиреоидных гормонов в плазме и усиливается при тиреотоксикозе. Этот сложный эффект тиреоидных гормонов обусловливает значительные колебания концентраций ТСГ в плазме людей с нарушениями функции щитовидной железы [70].
В последнее время интенсивно изучаются генетические варианты ТСГ. На молекулярном уровне установлены три типа альтераций гена ТСГ: делеция одного нуклеотида, замещение одного нуклеотида и замещение двух нуклеотидов [44]. Эти аномалии гена проявляются как наследственное полное отсутствие ТСГ в плазме человека или в виде генетических вариантов с заменами соответственно одного или двух аминокислотных остатков, пониженным сродством к тиреоидным гормонам, измененными зарядовыми свойствами и повышенной термолабильностью [65].
На молекулярном уровне установлены три типа альтераций гена ТСГ: делеция одного нуклеотида, замещение одного нуклеотида и замещение двух нуклеотидов [44]. Эти аномалии гена проявляются как наследственное полное отсутствие ТСГ в плазме человека или в виде генетических вариантов с заменами соответственно одного или двух аминокислотных остатков, пониженным сродством к тиреоидным гормонам, измененными зарядовыми свойствами и повышенной термолабильностью [65].
Из девяти описанных в литературе молекулярных вариантов ТСГ три имеют общую замену лейцина на фенилаланин в положении 283 наряду со специфичными для них мутациями. Такая же замена в положении 283 характерна и для ТСГ, обладающего всеми свойствами нативного белка [44]. Это позволяет говорить о полиморфизме ТСГ по кодону 283. Такой полиморфизм ТСГ характерен для всех этнических групп населения [44]. Вместе с тем можно сделать неблагоприятный прогноз о том, что замещение в положении 283 в принципе может быть важным для появления иных специфических мутаций гена ТСГ.
Олигосахаридные цени ответственны за микрогетерогенность ТСГ и в существенной степени определяют скорость выведения этого гликопротеина из кровообращения [13]. В процессе клиренса особенно важны концевые сиаловые кислоты. Десиали- рованный ТСГ с экспонированными остатками галактозы имеет очень высокую скорость клиренса за счет быстрого поглощения гепатоцитов поверхностными рецепторами, способными связывать многие асиалогликопротеины [63].
Особую роль углеводный компонент играет в функционировании ТСГ при беременности. Гиперэстрогенемия, характерная для этого физиологического состояния организма, влияет на углеводную структуру ТСГ, что в свою очередь приводит к уменьшению на 15% скорости клиренса ТСГ [9]. Этим, однако, нельзя объяснить двукратное повышение содержания ТСГ при беременности [69]. По-видимому, как усиленный синтез, так и замедленный клиренс определяют повышенные концентрации этого гликопротеина в сыворотке беременных женщин.
При хроматографии чистого ТСГ из сыворотки ретроплацен- тарной (послеродовой) крови на конканавалин А-сефарозе гликопротеин разделяется на две фракции, одна из которых (ТСГ- 1), составляющая около 10% от общей массы, не взаимодействует с иммобилизованным лектином и элюируется в свободном объеме, а другая адсорбируется на аффинной колонке [10, 75]. Установлено, что ТСГ-1 является характерным для беременности структурным вариантом ТСГ с особым строением углеводного компонента и специфической микрогетерогенной структурой. В то же время ТСГ-1 не отличается от ТСГ нормальной сыворотки по аминокислотному составу, вторичной и третичной структурам полипептидной цепи, а также по строению и свойствам гормонсвязывающего центра. Изучение в модельных системах in vivo клиренса вариантов ТСГ показало, что ТСГ-1 и характерная для беременности высокосиалированная фракция ТСГ [9] выводятся из кровообращения крысы в 1,5—2,5 раза медленнее, чем вариант, соответствующий ТСГ нормальной сыворотки.
Установлено, что ТСГ-1 является характерным для беременности структурным вариантом ТСГ с особым строением углеводного компонента и специфической микрогетерогенной структурой. В то же время ТСГ-1 не отличается от ТСГ нормальной сыворотки по аминокислотному составу, вторичной и третичной структурам полипептидной цепи, а также по строению и свойствам гормонсвязывающего центра. Изучение в модельных системах in vivo клиренса вариантов ТСГ показало, что ТСГ-1 и характерная для беременности высокосиалированная фракция ТСГ [9] выводятся из кровообращения крысы в 1,5—2,5 раза медленнее, чем вариант, соответствующий ТСГ нормальной сыворотки.
Разработана радиоиммунологическая система для количественного определения ТСГ-1 в сыворотке крови человека. Найдено, что в сыворотке крови здоровых доноров доля ТСГ-1 составляет в среднем 1,2% от уровня общего ТСГ, к сроку разрешения от беременности эта величина повышается до 8 % в сыворотке и 9,5% в амниотической жидкости и медленно снижается после родов, достигая через 5 мес значения, характерного для нормы [5]. По данным двух групп авторов [9], при злокачественных новообразованиях различной локализации и нарушениях функции печени доля ТСГ-1 составляет 3—10%.
По данным двух групп авторов [9], при злокачественных новообразованиях различной локализации и нарушениях функции печени доля ТСГ-1 составляет 3—10%.
Таким образом, ТСГ-1 является минорным компонентом плазмы крови человека в норме. Повышение концентрации общего ТСГ, вызываемое различными ненаследственными причинами, сопровождается увеличением доли ТСГ-1. Высказано предположение, что биосинтез структурного варианта ТСГ, содержащего только трехантенные олигосахаридные цепи со специфической микрогетерогенной структурой, представляет собой один из способов физиологической адаптации к увеличению потребности организма в ТСГ. Если возникает необходимость в увеличении концентрации ТСГ в крови, то реакция синтезирующего органа может состоять в избирательном усилении биосинтеза долгоживущего структурного варианта за счет изменения механизмов посттрансляционного гликозилирования полипептидной цепи.
Биологический смысл обсуждавшейся выше структурной гомологии между ТСГ и серпинами рассматривается в работе [57]. Ингибиторы сериновых протеаз в активной форме имеют напряженную (S) конформацию. В этой конформации у а -антитрипсина действию протеазы доступна петля, в которой надлежащим образом сближены остатки активного центра Met-358 и Ser-359. Под действием фермента петля разрывается и молекула антипротеазы претерпевает необратимый переход в расслабленную (R) конформацию, в которой эти два аминокислотных остатка удалены друг от друга. Такой конформационный переход сопровождается существенным увеличением термостабильности макромолекулы. По данным авторов [57], ТСГ и транскортин, имея родственную а.-антитрипсину третичную структуру, расщепляются эластазой нейтрофилов и приобретают повышенную тепловую устойчивость. При этом у транскортина в отличие от ТСГ существенно снижается сродство к лиганду. Таким образом, в случае комплекса транскортина с кортизолом S — R-переход in vivo с участием компетентных лейкоцитов при воспалительной реакции может приводить к высвобождению гормона и обеспечению доставки повышенных количеств глюкокортикоида к месту воспаления.
Ингибиторы сериновых протеаз в активной форме имеют напряженную (S) конформацию. В этой конформации у а -антитрипсина действию протеазы доступна петля, в которой надлежащим образом сближены остатки активного центра Met-358 и Ser-359. Под действием фермента петля разрывается и молекула антипротеазы претерпевает необратимый переход в расслабленную (R) конформацию, в которой эти два аминокислотных остатка удалены друг от друга. Такой конформационный переход сопровождается существенным увеличением термостабильности макромолекулы. По данным авторов [57], ТСГ и транскортин, имея родственную а.-антитрипсину третичную структуру, расщепляются эластазой нейтрофилов и приобретают повышенную тепловую устойчивость. При этом у транскортина в отличие от ТСГ существенно снижается сродство к лиганду. Таким образом, в случае комплекса транскортина с кортизолом S — R-переход in vivo с участием компетентных лейкоцитов при воспалительной реакции может приводить к высвобождению гормона и обеспечению доставки повышенных количеств глюкокортикоида к месту воспаления. Хотя у ТСГ и не выявлено изменений сродства к лиганду в результате конформационного S— R-персхода, возможность сайтспецифичного ферментативного расщепления этого белка может реализовываться в ходе взаимодействий с клетками-мишенями направленного транспорта тиреоидного гормона.
Хотя у ТСГ и не выявлено изменений сродства к лиганду в результате конформационного S— R-персхода, возможность сайтспецифичного ферментативного расщепления этого белка может реализовываться в ходе взаимодействий с клетками-мишенями направленного транспорта тиреоидного гормона.
К.Hashizume и соавт. [41]впервые высказали экспериментально обоснованное предположение о том, что ТСГ выполняет транспортную функцию не только в сыворотке крови, но и на уровне плазматической мембраны клетки. В их работе изучено взаимодействие in vitro между периферическими моноядерными клетками человека и комплексами [12‘1 |-Т4 с интактным и дсси- ащроввнным ТСГ. Найдено, что связанный с белком гормон способен проникать в клетку. Процесс поглощения комплекса клеткой зависит от температуры, времени инкубации и состояния углеводных цепей связывающего белка. Механизм трансмембранного переноса может включать интернализацию тройного комплекса Т, — ТСГ — рецептор ТСГ.
Важной функцией ТСГ при беременности может быть его участие в переносе тиреоидных гормонов из плазмы матери в кровообращение плода [31]. Т, играет ключевую роль в раннем нейрогенезе, и ТСГ может опосредовать гормональную связь между матерью и плодом путем регуляции трансплацентарного переноса Т, [31, 33]. В этой связи особую функцию в фетопла- центарной системе может выполнять характерный для беременности структурный вариант гликопротеина ТСГ-1, которым обогащен общий ТСГ, обнаруженный в амниотической жидкости [5].
Т, играет ключевую роль в раннем нейрогенезе, и ТСГ может опосредовать гормональную связь между матерью и плодом путем регуляции трансплацентарного переноса Т, [31, 33]. В этой связи особую функцию в фетопла- центарной системе может выполнять характерный для беременности структурный вариант гликопротеина ТСГ-1, которым обогащен общий ТСГ, обнаруженный в амниотической жидкости [5].
- Аполипопротеины
Аполипопротеины составляют один из самых представительных классов белков плазмы крови человека. Благодаря своей амфифильной структуре эти белки обладают способностью связывать и тем самым обеспечивать солюбилизацию липидов в водном окружении плазмы. В известном обзоре [71] подробно описаны структурно-функциональные свойства и биомедицинское значение аполипопротеинов.
Ранние наблюдения показали, что Т, и Т3 способны ассоциировать с липопротеидными частицами плазмы человека [43]. Позже с помощью аффинной хроматографии плазмы на Т,-сефарозе [11,39] и фотоаффинного ковалентного мечения липопротеинов высокой, низкой и очень низкой плотности (соответственно ЛПВП, ЛПНП и ЛПОНП) [|251]-Т4 [17, 18, 22, 39] было найдено, что апоА-I, апоА-П, anoA-IV, апоВ-100, апоС-1, апоС-П, апоС-Ш и апоЕ являются Т,-связывающими компонентами липопротеидных частиц. На основании результатов кинетических и равновесных экспериментов [7, 17, 18, 39] сделан вывод о том, что связывание тиреоидных гормонов с аполипопротеинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом взаимодействия со структурно обособленным центром в белке, комплементарным лиганду. Число таких центров в макромолекуле варьирует от I в апоА-1 [21] до 3 в апоВ-100 [18, 20]. Из изученных аполипопротеинов только апоА-I и его липидный комплекс апоА-I—ЛПВП проявляют достаточно высокое сродство к гормону (Ка 107 — 108 М_|) [7, 17].
На основании результатов кинетических и равновесных экспериментов [7, 17, 18, 39] сделан вывод о том, что связывание тиреоидных гормонов с аполипопротеинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом взаимодействия со структурно обособленным центром в белке, комплементарным лиганду. Число таких центров в макромолекуле варьирует от I в апоА-1 [21] до 3 в апоВ-100 [18, 20]. Из изученных аполипопротеинов только апоА-I и его липидный комплекс апоА-I—ЛПВП проявляют достаточно высокое сродство к гормону (Ка 107 — 108 М_|) [7, 17].
Известно, что многие типы клеток человека имеют поверхностные рецепторы апоВ-100 и апоЕ, участвующие в доставке холестерина в клетку путем связывания и последующей интернализации комплекса ЛПНП — рецептор [71]. Па основе этого механизма был создана гипотеза о физиологической роли комплекса тиреоидного гормона с ЛППП, которая недавно получила экспериментальную проверку [19]. Авторы изучили поглощение [|251]-Т3 и [ШТ, фибробластами кожи человека, выращенными в присутствии обедненной липопротеинами сыворотки. При добавлении в среду фракции ЛПНП, апоВ-100 или апоЕ в концентрациях, достаточных для связывания гормона, но не превышающих емкость клеточного рецептора, наблюдали увеличение на 27—63% начальной скорости поглощения и количества поглощенного Т, (но не Т3) в состоянии равновесия. Этот эффект отсутствовал у клеток с дефицитом рецепторов (наследственная гиперхолестеринемия, низкая экспрессия рецепторов при избытке холестерина в среде). Специфический характер действия ЛПНП и соответствующих аполипопротеинов подтверждался тем фактом, что другие Т,-связывающие белки, наоборот, пропорционально своим концентрациям в среде снижали количество Т,, проникающего в клетку. Авторы [19] предположили, что существуют два пути транспорта Т, в фибробласты. Первый — через центры связывания свободного гормона на клеточной поверхности, второй, дополнительный путь, недоступный для Т3, — через рецепцию комплекса Т, — ЛПНП и интернализацию последнего.
Авторы изучили поглощение [|251]-Т3 и [ШТ, фибробластами кожи человека, выращенными в присутствии обедненной липопротеинами сыворотки. При добавлении в среду фракции ЛПНП, апоВ-100 или апоЕ в концентрациях, достаточных для связывания гормона, но не превышающих емкость клеточного рецептора, наблюдали увеличение на 27—63% начальной скорости поглощения и количества поглощенного Т, (но не Т3) в состоянии равновесия. Этот эффект отсутствовал у клеток с дефицитом рецепторов (наследственная гиперхолестеринемия, низкая экспрессия рецепторов при избытке холестерина в среде). Специфический характер действия ЛПНП и соответствующих аполипопротеинов подтверждался тем фактом, что другие Т,-связывающие белки, наоборот, пропорционально своим концентрациям в среде снижали количество Т,, проникающего в клетку. Авторы [19] предположили, что существуют два пути транспорта Т, в фибробласты. Первый — через центры связывания свободного гормона на клеточной поверхности, второй, дополнительный путь, недоступный для Т3, — через рецепцию комплекса Т, — ЛПНП и интернализацию последнего.
- Иммуноглобулины
Иммуноглобулины образуют обширное семейство структурно родственных белков, которые состоят из двух пар полипеп- тидных цепей, удерживаемых дисульфидными мостиками и нековалентными связями. Пять таких стандартных четырехцепочных фрагментов, соединенных J-цепыо, присутствуют в IgM. Тяжелые цепи, включающие около 450 аминокислотных остатков, по своему строению разделяются на пять классов, что лежит в основе классификации иммуноглобулинов: IgG, IgA, IgM, IgD и IgE; Кроме того, существуют 4 подкласса IgG и 2 подкласса IgA. Легкие цепи (около 214 остатков) являются общими для всех классов иммуноглобулинов, хотя и могут различаться соотношением типов К и X. В семейство иммуноглобулинов входят также белки, которые не обладают активностью антител. Это миеломные белки, свободные субъединицы иммуноглобулинов и белки Бенс-Джонса. Подробные сведения о структурных, функциональных и генетических характеристиках иммуноглобулинов можно почерпнуть из авторитетного источника [61] и соотнести с излагаемыми ниже гормонсвязывающими свойствами этих гликопротеинов.
Впервые уникальный клинический случай связывания Т, с фракцией иммуноглобулинов сыворотки больного карциномой щитовидной железы был описан J.Robbins и соавт. [67]. В последовавших затем многочисленных наблюдениях и системных исследованиях охарактеризованы приобретенные изменения в системе транспорта тиреоидных гормонов у человека, которые заключаются в появлении аномальных связывающих белков, аутоантител, относящихся к иммуноглобулинам различных классов [16]. Относительное число случаев (частотность) обнаружения аутоантител к тиреоидным гормонам при массовых обследованиях взрослого населения не превышает долей процента, но при тиреоидных заболеваниях такие аутоантитела присутствуют у 5% больных [16].
В ходе работ по изучению “патологического” связывания гормонов щитовидной железы с аномальными белками были полу- чены.отдельные сведения о взаимодействии Т, и Т3 с нормальными иммуноглобулинами человека. Так, при оценке методики детекции анти-Т, (Т3) аутоантител в очищенной фракции иммуноглобулинов нормальной сыворотки отмечалось “неспецифи- чсское” связывание Т, и Т3 с нормальными IgG [27]. При экспериментальной проверке предположения об “иммуноглобулиновой” природе ингибитора связывания тиреоидных гормонов в сыворотке были получены данные, косвенно свидетельствующие о Т,-связывающих свойствах нормального IgM человека [15].
При экспериментальной проверке предположения об “иммуноглобулиновой” природе ингибитора связывания тиреоидных гормонов в сыворотке были получены данные, косвенно свидетельствующие о Т,-связывающих свойствах нормального IgM человека [15].
В ходе системного исследования Т4-связывающих белков плазмы человека с помощью нового методического подхода, основанного на использовании лиганд-аффинной хроматографии, было показано, что постоянными компонентами белковой смеси, биоспецифически выделяемой из рстроплацентарной и нормальной сывороток человека с помощью Т,-сефарозы, являются IgG и IgM [6]. Оставалось неясным, являются ли Т-ссвязы- вающие иммуноглобулины аутоантителами, т.е. аномальными белками, которые появляются при достаточно редких патологических состояниях, или же они относятся к нормальным транспортным белкам плазмы.
С целью ответа на этот вопрос изучены кинетические и равновесные характеристики взаимодействия Т, с IgA, IgG, IgM и белками Бенс-Джонса, выделенными в чистом виде из сыворотки крови человека[8]. Найдено, что комплексообразование Т, с иммуноглобулинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом. Необходимым и достаточным для связывания Т, компонентом молекулярной структуры иммуноглобулина является, по-видимому, L-цепь типа К или X. Ковалентное присоединение Н-цепи может резко увеличивать сродство к тиреоидному гормону (ц-цепь в IgM) или изменять чувствительность участка связывания к химическим агентам и pH среды (ц-цепь в IgM, у- цепь в IgG). Экспериментальные данные показывают, что Т,- связывающий IgM не принадлежит к /‘патологическому” типу белков — анти-Т, аутоантителам: зависимость реакции связывания Т, от физико-химических условий среды является типичной для нормальных траспортных белков; частотность обнаружения Т,-связывающего IgM в случайно выбранных индивидуальных пробах сыворотки здоровых людей составляет 100%; комплекс IgM — Т, структурно отличается от комплекса антиген — антитело, так как не способен взаимодействовать с первым компонентом комплемента.
Найдено, что комплексообразование Т, с иммуноглобулинами является зависимым от времени, обратимым, насыщаемым и чувствительным к специфическим ингибиторам процессом. Необходимым и достаточным для связывания Т, компонентом молекулярной структуры иммуноглобулина является, по-видимому, L-цепь типа К или X. Ковалентное присоединение Н-цепи может резко увеличивать сродство к тиреоидному гормону (ц-цепь в IgM) или изменять чувствительность участка связывания к химическим агентам и pH среды (ц-цепь в IgM, у- цепь в IgG). Экспериментальные данные показывают, что Т,- связывающий IgM не принадлежит к /‘патологическому” типу белков — анти-Т, аутоантителам: зависимость реакции связывания Т, от физико-химических условий среды является типичной для нормальных траспортных белков; частотность обнаружения Т,-связывающего IgM в случайно выбранных индивидуальных пробах сыворотки здоровых людей составляет 100%; комплекс IgM — Т, структурно отличается от комплекса антиген — антитело, так как не способен взаимодействовать с первым компонентом комплемента. Авторы [8] считают, что специфические Т,-связывающие свойства иммуноглобулинов нормальной сыворотки могли долгое время оставаться нераскрытыми из-за недостатков традиционного метода анализа, который не способен обнаружить слабые проявления Т,-связывающей активности этих белков в физиологических жидкостях, содержащих эндогенный ингибитор С1~ и (или) экзогенный ингибитор 8-анм- лин-1-нафталинсульфокислоту.
Авторы [8] считают, что специфические Т,-связывающие свойства иммуноглобулинов нормальной сыворотки могли долгое время оставаться нераскрытыми из-за недостатков традиционного метода анализа, который не способен обнаружить слабые проявления Т,-связывающей активности этих белков в физиологических жидкостях, содержащих эндогенный ингибитор С1~ и (или) экзогенный ингибитор 8-анм- лин-1-нафталинсульфокислоту.
Особая биологическая роль IgM выявлена в ходе экспериментов in vitro с использованием модельной системы тиреоидный гормон — связывающий белок — плазматическая мембрана микроворсинок сннцитиотрофобласта человека [,]. Важно отметить, что выбранная в качестве объекта исследования ткань формирует поверхность контакта между материнской кровью и плодом, является компетентной в отношении тиреоидных гормонов [11] и содержит поверхностные рецепторы иммуноглобулинов [61). В этой модельной системе очищенные ТСПА, альбумин, апоА-I, ТСГ, IgG и IgM при концентрациях, близких к Kj их комплексов с тиреоидными гормонами, оказывали пропорциональное концентрациям ингибирующее действие на свя-
Таблица 2
Активная роль лиганд-бслковых комплексов в трпспорте тиреоидных гормонов в клетки некоторых тканей
|
Бел ox |
Лиганд |
Клстке |
Механизм |
Ссылка |
|
ТСПА |
т„т4 |
Гепатоциты in vivo НЕр G2 in vitro |
Рецепция и интернализация комплекса |
11. |
|
Альбумин |
т4 |
Гепатоциты in vivo |
Равномерное распределение лиганда по всем клеткам органа |
151,531 |
|
ТСГ |
т4 |
Лейкоциты in vitro |
Рецепция и интернализация комплекса |
141) |
|
АпоВ-100 |
Т4 |
Фибробласты in vitro |
То же |
H9J |
|
IgM |
Т, |
Плазматические мембраны плациенты in vitro |
Увеличение числа Т3-связывающих мест за счет рецепции IgM мембранами |
141 |
зывание [,И1]-ТЭ или [1И1]-Т4 с мембранным рецептором тиреоидных гормонов. Зависимость мембранного связывания 1,ИЦ- Т4 от концентрации IgM в системе носила типичный для всех изученных белков характер. В случае Т3 такая зависимость была уникальной для IgM и включала фазу стимулирующего действия IgM (10-11—10~’ М) и фазу ингибирования (10~*—10~’М). В присутствии 30 пМ IgM на 75% увеличивалась концентрация мембранных мест связывания Т3 при снижении Ка в 2,2 раза. В отдельном эксперименте показано [5] , что IgM специфически взаимодействует с двумя типами связывающих центров на плазматических мембранах плаценты с Ка<1)=5,0 -10’ М_|, В =34 фмоль/мг общего мембранного белка и Ка( =2,7 10′ М-1, Вгоах(2)=2,0 пмоль/мг мембранного белка. Авторы [4] считают, что стимулирующий эффект IgM обусловлен увеличением числа Т3— связывающих мест на мембранах микроворсинок за счет образования комплекса IgM с его мембранным рецептором, проявляющего повышенную Т3-связывающую активность.
В случае Т3 такая зависимость была уникальной для IgM и включала фазу стимулирующего действия IgM (10-11—10~’ М) и фазу ингибирования (10~*—10~’М). В присутствии 30 пМ IgM на 75% увеличивалась концентрация мембранных мест связывания Т3 при снижении Ка в 2,2 раза. В отдельном эксперименте показано [5] , что IgM специфически взаимодействует с двумя типами связывающих центров на плазматических мембранах плаценты с Ка<1)=5,0 -10’ М_|, В =34 фмоль/мг общего мембранного белка и Ка( =2,7 10′ М-1, Вгоах(2)=2,0 пмоль/мг мембранного белка. Авторы [4] считают, что стимулирующий эффект IgM обусловлен увеличением числа Т3— связывающих мест на мембранах микроворсинок за счет образования комплекса IgM с его мембранным рецептором, проявляющего повышенную Т3-связывающую активность.
В табл.2 обобщены специфические транспортные функции Т4-связывающих белков плазмы человека.
Система транспортных белков, обратимо связывающих более 99% общей массы Т4 и Т3 в плазме крови человека, включает ТСПА, альбумин, ТСГ, апоА-I, апоА-Н, anoA-IV, апоВ-100, апоС-I, апоС-П,апоС-Ш, апоЕ, IgM, IgYj и IgA. В этот широкий спектр белков входят и их структурные варианты, отличающиеся элементами химического состава, некоторыми физическими свойствами и особенностями взаимодействия с йодтирони- нами. По величине сродства к тиреоидным гормонам связывающие белки можно условно разделить на три группы: низкоаффинные (альбумин, большинство аполипопротеинов, IgG и IgA; К ~105 —106 М~‘), среднеаффинные (ТСПА и апоА-1; К -10’ — 10* М_|) и высокоаффинные (ТСГ и его варианты; Ка —10’ — 10’° М“’). Существуют эффективные методы выделения и очистки этих белков. Известны строение генов, параметры биосинтеза и клиренса, первичная, вторичная и третичная структуры полипептидных цепей, физические свойства молекул.
Т4-связывающие белки плазмы не обладают генетическим родством, различаются по химическому строению и физическим свойствам и выполняют различные основные или дополнительные биологические функции. Их объединяет участие в термодинамическом равновесии со свободными гормонами и наличие структурно обособленного активного центра, в большей или меньшей степени комплементарного структуре йодтирони- на.
Их объединяет участие в термодинамическом равновесии со свободными гормонами и наличие структурно обособленного активного центра, в большей или меньшей степени комплементарного структуре йодтирони- на.
Гипотеза о свободных гормонах объясняет и количественно описывает все клеточные эффекты Т4 и Т3 на основе концентрации несвязанных гормонов в плазме, а связывающим белкам отводит резервную, буферную и гормонвысвобождающую функции. Исследования последн!о< лет выявили активную роль транспортных белков и их клеточных рецепторов в механизмах взаимодействия тиреоидных гормонов с компетентными тканями: комплекс Т4 — ТСГ интернализуется периферическими моноя- дерными клетками, Т3 и Т4, связанные с ТСПА, траислоциру- ются через плазматическую мембрану и распределяются между субклеточными фракциями печени и других органов, апоА-I избирательно усиливает поглощение Т4 фибробластами, a IgM стимулирует связывание Т3 с плазматическими мембранами плаценты.
Понимание фундаментальных основ функционирования многокомпонентной системы Т4-связывающих белков плазмы важно для диагностики заболеваний человека и правильного применения фармакологических средств, которые могут влиять на комплексообразование тиреоидных гормонов с танспортны- ми белками.
Поскольку многие компоненты системы Т4-связывающих белков участвуют в целом ряде хорошо изученных физиологических процессов, казалось бы, не имеющих прямого отношения к метаболизму йодтиронинов, интересно выяснить влияние связанного тиреоидного гормона на эти процессы.
В целом создается впечатление, что каждый отдельный Т4— связывающий белок может выполнять специализированную функцию по доставке одного из двух тиреоидных гормонов в специфическую ткань. Разнообразие транспортных белков и компетентных тканей дает широкий простор исследованиям, результаты которых должны появиться уже в ближайшем будущем.
1. Азимова Ш.С., Умарова Г.Д., Петрова О.С. и др. // Биохимия. — 1984. — Т. 49, № 8. — С. 1350 — 1356.
Азимова Ш.С., Умарова Г.Д., Петрова О.С. и др. // Биохимия. — 1984. — Т. 49, № 8. — С. 1350 — 1356.
2. Азимова Ш.С., Умарова Г.Д., Петрова О. С. и др. // Биохимия. — № 9. — С. 1478 — 1485.
3. Азимова Ш.С., Умарова Г.Д., Тухтаев К.Р., Абдукаримов А.Р. // Биохимия. — № 10. — С. 1640 — 1646.
4. Карпыза Е.И., Киклевич И.Е., Ермоленко М.Н., Свиридов О.В. // Биохимия. — 1993. — Т. 58, № 2. — С. 285 — 293.
5. Свиридов О.В., Ермоленко М.Н., Будникова Л.П., Карпыза И.Е. // Пробл. эндокринол. — 1989. — № 2. — С. 48 — 52.
6. Свиридов О.В., Ермоленко М.Н., Пышко Е. С. и др. // Биохимия. — 1990. — Т. 55, № 2. — С. 329 — 337.
С. и др. // Биохимия. — 1990. — Т. 55, № 2. — С. 329 — 337.
7. Свиридов О.В., Пышко Е.С., Ермоленко М.Н., Стрельченок О.А. // Там же. — № 11. — С. 2002 — 2010.
8. Свиридов О.В., Ермоленко М.Н. // Там же. —1994. — Т. 59, № i. — С. 78-87.
9. Ain К.В., Morí Y., Refetoff S. // J. clin. Endocr. Metab. — 1987. — Vol. 65, N 4. — P. 689-696.
10. Ain K.B., Refetoff S. // Ibid. — 1988.- Vol. 66, N 5. — P. 1037-1043.
11. Alderson R., Pastan I., Cheng S.Y. // Endocrinology. — 1985. — Vol. 116, N 6. — P. 2621-2630.
12.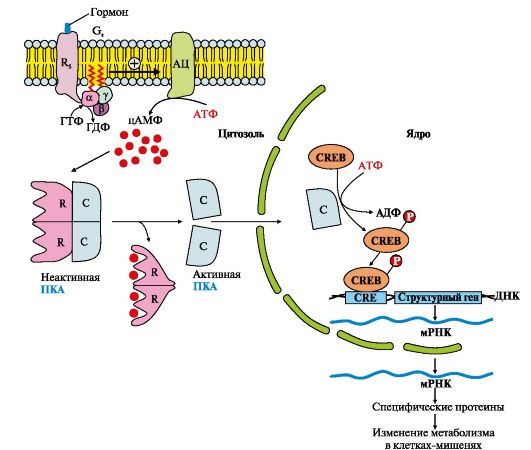 Arevalo G. // Clin. Chem. — 1988. -Vol. 34, N 4. — P. 705- 708.
Arevalo G. // Clin. Chem. — 1988. -Vol. 34, N 4. — P. 705- 708.
13. Bartalena L. // Endocr. Rev. — 1990. — Vol. 11, N 1. — P. 47-63.
14. Bashor M.M., Hewett J., Lackey A. et al. // Prep. Biochem. — 1987. — Vol. 17, N 3. — P. 209-227.
15. Benvenga S., Costante G., Melluso R. et.al. // Acta endocr. (Kbh.). — 1983. — Vol. 103, N 1. — P. 46-52.
16. Benvenga S., Trimarchi F., Robbins J. // J. Endocr. Invest. — 1987. — Vol. 10. — P. 605-619.
17. Benvenga S., Cahnmann H.J., Gregg R.E., Robbins J. // J. clin. Endocr. Metab. — 1989. — Vol. 68, N 6. — P. 1067— 1072.
1067— 1072.
18. Benvenga S., Cahnmann H.J., Gress R.E., Robbins J. // Biochimie. — 1989. — Vol. 71. — P. 263-268.
19. Benvenga S., Robbins J. // Endocrinology. — 1990. — Vol. 126, N 2. — P. 933-941.
20. Benvenga S., Cahnmann H.J., Robbins J. // Ibid. — Vol. 127, N5. — P. 2241-2246.
21. Benvenga S., Cahnmann H. J., Robbins J. Ц Ibid. — 1991. — Vol. 128, N 1. — P. 547-552.
22. Benvenga S., Cahnmann H.J., Rader D. et al. // Ibid. — 1992. — Vol. 131. N 6. — P. 2805-2811.
23. Blake C.C.F., Galley S.J. // Nature. — 1977. — Vol. 268. — P.115-120.
Blake C.C.F., Galley S.J. // Nature. — 1977. — Vol. 268. — P.115-120.
24. Blake C.C.F., Geisow M.J., Oalley S.J. et al. //J. molec. Biol.- 1978. — Vol. 121. — P. 339 356.
25. Bridges C.D.B., Peters T., Smith J.E. et al. // Fed. Proc. — 1986. — Vol. 45, N 9. — P. 2291-2303.
26. Bristow A.F., Gaines-Das R.E., Buttress N. et al. // Clin. Endocr. — 1993. — Vol. 38, N 4. — P. 361-366.
27. Calzi L.L., Benvenga S., Battiato S. et al. // Clin. Chem. — 1988. — Vol. 34, N 12. — P. 2561-2562.
28. Chanoine L.R., Alex S., Fang S.L. // Annual Meeting of the Endocrine Society, 73-rd: Abstracts. — Washington, 1991. — P. 132.
— Washington, 1991. — P. 132.
29. Dickson W.R., Aldred A.R., Menting J.G.T. et al. // J. biol. Chem. — 1987. — Vol. 262, N 29. — P. 13907- 13915.
30. Divino C.M., Schussler G.C. // Ibid. — 1990. — Vol. 265, N 3. — P. 1425-1429.
31. Ekins R. // Lancet. — 1985. — Vol. 1. — P. 1129-1132.
32. Ekins R., Edwards P.R. // Amer. J. Phisiol. — 1988. — Vol. 255. — P. E403-E409.
33. Ekins R. U Endocr. Rev. — 1990. — Vol. 11, N 1. — P. 5- 46.
34. Fex G., Laurell C.-B., Thulin E. // Europ. J. Biochem. — 1977. — Vol. 75, N 1. — P. 181-186.
// Europ. J. Biochem. — 1977. — Vol. 75, N 1. — P. 181-186.
35. Flink I.L., Bailey T.J., Gustafson T.A. et al. // Proc. nat. Akad. Sei. USA. — 1986. — Vol. 83. — P. 7708-7712.
36. Fung W.-P., Thomas T., Dickson P.W. et al. //J. biol. Chem. — 1988. — Vol. 263. — P. 480- 488.
37. Gershengom M. C., Cheng S.-Y., Lippoldt R.E. et al.// Ibid. — 1977,- Vol. 252, N 23. — P. 8713-8718.
38. Gershengom M.C., Lippoldt R.E., Edelhoch ff., Robbins J.U Biochemistry. — 1977.- Vol. 252, N 23. — P. 8719-8723.
39. Grimaldi S., Bartalena L., Carlini F., Robbins J. // Endocrinology. — 1986. — Vol. 118, N 6. — P. 2362—2369.
// Endocrinology. — 1986. — Vol. 118, N 6. — P. 2362—2369.
40. Hammond G.L. // Endocr. Rev. — 1990. — Vol. 11, N1.— P. 65-79.
41. Hashizume K., Sakurai A., Miyamoto T. et al. // Endocr. Jap. — 1986. — Vol. 33, N 5. — P. 665-674.
42. Hennemann G., Docter K. // The Thyroid Gland / Ed. M.A. Greer. — New York, 1990. — P. 221-231.
43. Hoch H., Lewallen C. G. // J. clin. Endocr. Metab. — 1974. — Vol. 38, N 4. — P. 663- 673.
44. Janssen O.E., Bertenshaw R., Takeda K. et al. //Trends Endocr. Metab. — 1991. — Vol. 2. — P. 104 -114.
45.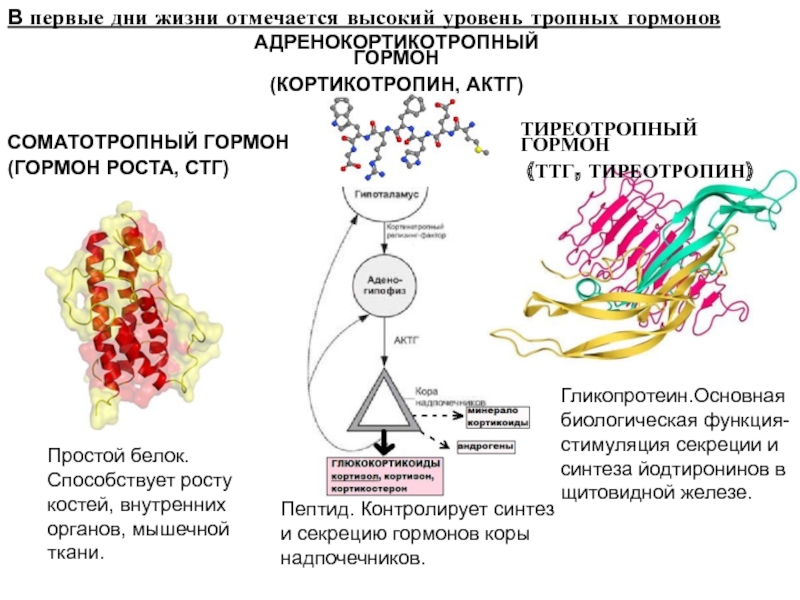 Jornvall H., Carlstrom A., Petterson T. et al. // Nature. — 1981. — Vol. 291. — P. 261-263.
Jornvall H., Carlstrom A., Petterson T. et al. // Nature. — 1981. — Vol. 291. — P. 261-263.
46. Kanda Y,Goodman D.S., Canfield R.E., Morgan F.J. // J. biol. Cem. — 1974. — Vol. 249. — P. 6796-6805.
47. Kostrouch Z., Raska I., Felt V. et al. // Experientia (Basel). — 1987,- Vol. 49, N 10. — P. 1119-1120.
48. Luckebach C., Wahl R., Kallee E. // Europ. J. clin. Chem. clin. Biochem. — 1992. — Vol. 30, N 7. — P. 387 -390.
49. Marione R.L., Herbert J., Dwork A., Shon E.A. // Biochem. biophys. Res. Commun. — 1988. — Vol. 151, N 2. — P. 905— 912.
50. Mita S. , Maeda S., Shimada K., Araki S. // Ibid. — 1984. — Vol. 124. — P. 558-568.
, Maeda S., Shimada K., Araki S. // Ibid. — 1984. — Vol. 124. — P. 558-568.
51. Mendel C.M., Weisiger R.A., Jones A.L., Cavalieri R.R. // Endocrinology. — 1987. — Vol. 120, N 5. — P. 1742—1749.
52. Mendel C.M., Cavalieri R.R., Weisiger R.A. // Ibid. — 1988. — Vol. 123, N 4. — P. 1817-1824.
53. Mendel C.M. ¡/ Endocr. Rev. — 1989. — Vol. 10, N 3. — P. 232—274.
54. Munro S.L., Lim C.F., Hall J.G. et al. // J. clin. Endocr. Mctab. — 1989. — Vol. 68, N 6. — P. 1141 -1147.
55. Pardridge W.M., Premachandra B.M., Fierer G. // Amer. J. Phisiol. — 1985. — Vol. 248. — P. G545-G55O.
248. — P. G545-G55O.
56. Pardridge W.M. // Ibid. — 1987. — Vol. 252. — P. E157 — EI64.
57. Pemberton P.A., Stein P.E., Pepys M.B. et al. // Nature. — 1988. — Vol. 336. — P. 257-258.
58. Peters T.Jr. // Advanc. Protein Chem. — 1985. — Vol. 37. — P. 161- 246.
59. Petterson T., Carlstrom A., Jornvall H. // Biochemistry. — 1987. — Vol. 26, N 14. — P. 4578-4583.
60. Petterson T.M., Carlstrom A., Ehrenberg A., Jornvall H. // Biochem. biophys. Res. Commun. — 1989. — Vol. 158, N 4. — P. 341-347.
61. Putnam F.W. // The Plasma Proteins / Ed. F. W. Putnam. — 2-nd Ed. — New York, 1987. — Vol. 5. — P. 50-140.
62. Rejatanavin R., Liberman C., Lawrence C.D. et al. //J. clin. Endocr. Metab. — 1985. — Vol. 61, N 1. — P. 17—21.
63. Refetojf S., Fang V.S., Marshall J.S. Ц Ibid. — 1975. — Vol. 56. — P. 177-182.
64. Refetojf S., Dwulet F.E., Benson M.D. // Ibid. — 1986. — Vol. 63, N 6. — P. 1432-1437.
65. Refetoff S. // Endocr. Rev. — 1989. — Vol. 10, N 3. — P. 275-293.
66. Reid D.G., Saunders M.R. // J. biol. Chem. — 1989. — Vol. 264, N 4. — P. 2003-2012.
67. Robbins J., Rail J.E., Rawson R.W. // J. clin. Endocr. Metab. — 1956. — Vol. 16, N 5. — P. 573- 579.
68. Robbins J., Rail J.E. // Physiol. Rev. — 1960. — Vol. 40. — P. 415-489.
69. Robbins J., Bartalena L. // Thyroid Hormone Metabolism / Ed. G. Hennemann. — New York, 1986. — P. 3—38.
70. Robbins J. Ц The Thyroid / Ed. R.D.Utiger. — Philadelphia, 1991. — P. 116-127.
71. Scanu A.M. // The Plasma Proteins. — New York,1987. — Vol. 5. — P. 142.
72. Schussler G.C. //Thyroid. — 1990. — Vol. 1, N 1. — P. 25— 34.
73. Schussler G., Divino C.M., Saraiva M.J. // Progress in Thyroid Research / Eds A.Gordon, /.Gross, G.Hennemann. — Rotterdam, 1991. — P. 725—728.
74. Siegel J.S., Villanueva G.B., Korcek L., Tabachnik M. // Int. J. Biochem. — 1984. — Vol. 16. N 5. — P. 575-577.
75. Strel’chyonok G.A., Avvakumov G.V., Akhrem A.A. Ц Carbo- hydr. Res.- 1984. — Vol.134. — P. 133- 140.
76. Strel’chyonok G.A., Avvakumov G.V. // J. Steroid Biochem. — 1990. — Vol.35,N 5. — P. 519-534.
77. Tabachnik M. //J. biol. Chem. — 1967. — Vol. 242, N 7. — P. 1646 -1650.
78. Teru S. I I Europ. J. nucl. Med. — 1984. — Vol. 9, N 3. — P. 121-124.
79. Trent J.M., Flink I.L., Morkin E. et al. // Amer. J. hum. Genet. — 1987. — Vol. 41, N 3. — P. 428-435.
80. Wahl R., Schmidberger H., Fessler E. et al. // Endocrynology. — 1989. — Vol. 124, N 3. — P. 1428-1437.
81. Weisiger R., Gollan J., Ockner R. // Science. — 1981. — Vol.211. — P. 1048-1051.
82. Zinn A.B., Marshall J.S., Carlson D.M. // J. biol. Chem. — 1978. — Vol. 253, N 19. — P. 6768-6773.
Глобулин, связывающий половые гормоны (S-SHBG) – SYNLAB Eesti
SHBG – это основной белок, связывающий стероидные гормоны (тестостерон и эстрадиол). Синтез SHBG происходит в печени и регулируется соотношением андрогенов/ эстрогенов в организме.
Аффинность SHBG по отношению к тестостерону в 10 раз больше, чем к эстрадиолу. Поэтому у женщин концентрация SHBG в сыворотке значительно больше, чем у мужчин. У мужчин 60% тестостерона и 20% эстрадиола от их общего количества связано с SHBG. Эти же показатели у женщин соответственно 80% и 27%. Свободной (биологически активной) фракцией в крови стероидных гормонов только 1-3%.
Показания:
- Бесплодие
- Диагностика гипогонадизма у мужчин, андропауза
- Выяснение причин гирсутизма, вирилизма и нарушении менструального цикла у женщин
Метод анализа: Хемилюминисцентный метод
Референтные значения:
| SHBG | |
| Женщины (небеременные) | 28-146 nmol/L |
| Женщины в постменопаузе | 12-166 nmol/L |
| Мужчины | 17-66 nmol/L |
| FAI (индекс свободного андрогена) | |
| Женщины | 0,8-10 |
| Женщины, использующие пероральные контрацептивы | <3,4 |
| Мужчины | 15-95 |
Интерпретация результата:
Чем меньше содержание SHBG, тем больше количество биологически активного стероидного гормона.
Комбинируя результаты анализов тестостерона и SHBG, возможно рассчитать «индекс свободного андрогена» (FAI), который показывает содержание свободного, то есть биологически активного тестостерона:
FAI = Тесто (nmol/L) / SHBG (nmol/L) × 100
Мужчины:
- Определение SHBG вместе с тестостероном очень важно при нарушениях метаболизма андрогенов.
- У мужчин увеличение концентрации SHBG в организме может быть причиной гипогонадизма, так как уменьшается количество свободного тестостерона, хотя количество общего тестостерона может быть в пределах нормы.
- Концентрация SHBG увеличивается с возрастом.
Женщины:
- У женщин причиной низких значений SHBG может быть количество свободного тестостерона, которое может быть увеличено при синдроме поликистозных яичников, гиперактивности надпочечников (гиперандрогенизм) или при избыточной массе тела.
- Концентрация SHBG увеличивается во время беременности.
Как у мужчин, так и у женщин при наличии гипертиреоза содержание SHBG увеличивается, а при гипотиреозе – уменьшается.
Чем опасен избыток белка в рационе – блог justfood
По статистике половина всего населения Земли недовольна своей внешностью. В стремлении быть сильными, здоровыми и красивыми мы тщательно следим за питанием, посещаем тренажёрный зал и внимательно изучаем свое отражение в зеркале для оценки результатов своих стараний. Все, кто интересуется здоровым питанием и спортом, в курсе, что для наращивания мышечной массы и получения красивого мышечного рельефа необходимо потреблять много белка. Ведь именно он является основным строительным материалом для мышечной ткани.
Белок имеет огромное значение для человеческого организма. Это не только крепкие мышцы, но и упругая кожа, здоровые ногти и волосы. Белки участвуют в большинстве обменных процессов.
Однако иногда желание получить результат как можно скорее пересиливает здравый рассудок. Основываясь на поверхностных сведениях и не придавая должного значения дозировке, режиму приёма пищи, да и вообще не имея понимания необходимости соблюдения баланса КБЖУ, многие стараются просто максимально увеличить содержание белка в своём рационе. К сожалению, такие действия могут привести к нежелательным, а иногда и вовсе неожиданным последствиям.
Если у вас:
- ● Постоянная жажда
- ● Проблемы с пищеварением
- ● Неприятный запах изо рта
- ● Постоянно плохое настроение
то возможно ваш организм страдает от переизбытка белка. Это основные симптомы перенасыщения белковыми соединениями. Во-первых, богатое белками и бедное углеводами и жирами питание создаёт нагрузку на отдельные органы – почки и печень. Отсюда постоянная жажда и проблемы с пищеварением. Они в свою очередь провоцируют сбои в выработке гормонов, которые становятся причиной эмоциональных и в особо запущенных случаях – эндокринных сбоев.
Переизбыток белков провоцирует усиленную работу почек, необходимую для выведения продуктов их распада. Переизбыток белков и недостаток клетчатки – прямой путь к проблемам с желудком со всеми вытекающими: вздутие, тяжесть, диарея, изжога и иже с ними.
Если вышеперечисленные симптомы обошли вас стороной, или их проявления остались незамеченными, то в долгосрочной перспективе повышенное содержание белка и недостаток других питательных веществ в рационе способны провоцировать неблагоприятные изменения в эмоциональном состоянии, вплоть до депрессии и хронической усталости. Дело в том, что для выработки серотонина организму необходимы углеводы. При их недостатке выработка гормона радости существенно сокращается. Ситуацию усугубляют проблемы с пищеварением, дефицит кальция в костных тканях, снижение иммунитета, быстрая утомляемость и потеря мышечного тонуса. То есть результат мы получаем обратный желаемому.
Что же делать? Следовать простой истине «Всё хорошо в меру»! Все основные питательные компоненты организм должен получать с пищей в сбалансированной дозировке. Переизбыток любого способен привести к неблагоприятным последствиям, поэтому нужно следить за своим рационом с особой тщательностью, особенно если вы поставили себе цель добиться с помощью питания тех или иных результатов.
Помните, что норма белка составляет не более 3грамм на килограмм веса, а его общая доля не должна превышать 30% всего рациона. Употребляя максимально допустимую дозу белка, не забывайте дополнять свой рацион богатыми клетчаткой овощами, чтобы дать возможность своему организму правильно переварить довольно сложный в усвоении белок. При этом не забывайте, что на сам процесс расщепления белков потребуется немало энергии, так что вместе с белковой пищей организму необходимо получить и достаточное количество углеводов.
Если у вас нет возможности самостоятельно следить за количеством белка в своём рационе, то воспользуйтесь услугами сервиса доставки готового правильного питания justfood.pro. Кроме выверенного и сбалансированного по КБЖУ рациона в соответствии с вашими целями, так вы получите возможность освободить время, необходимое на подбор и приготовление продуктов. Всё что нужно сделать – это просто открыть нужный контейнер, разогреть своё правильное здоровое питание и съесть его.
Разнообразие программ позволяет получить подходящее питание для любой цели – от простого поддержания веса и состояния организма в норме до усиленного калориями питания для спортсменов, насыщенного белками – для бодибилдеров или со сниженной калорийностью для сушки или похудения. При этом все заботы по расчёту калорийности, содержания белков, жиров и углеводов, веса или размера порции мы берём на себя. Всё что нужно сделать вам – просто выбрать нужную программу.
Белок для гармонии гормонов — Блог
Автор статьи: Эллен Альбертсон, кандидат наук
Чувствуете усталость или вялость? Боретесь с необъяснимыми колебаниями веса, «зажорами» или проблемами пищеварения? Страдаете бессонницей или замечаете, что изменилось состояние кожи, волос и ногтей? Эти симптомы могут быть вызваны гормональными сбоями или дисбалансом.
Некоторые виды гормональной перестройки, например, в период полового созревания, менструации, беременности и перименопаузы, нормальны. Другие возникают, когда эндокринные железы вырабатывают слишком много или слишком мало гормона.
К счастью, есть множество способов исправить гормональный дисбаланс и вернуть организму гармонию. Первым делом стоит поговорить со своим врачом и выявить наличие аномального содержания гормонов в крови. Если будут обнаружены гормональные проблемы, может помочь изменение образа жизни, например, улучшение режима питания и рациона. Почему? Потребляемая вами пища, в том числе типы и количество белка, может увеличивать или снижать уровень гормонов в крови.
Что такое гормоны?
Гормоны — это химические переносчики информации, вырабатываемые в эндокринных железах (включая щитовидную железу, надпочечники, поджелудочную железу, яичники и семенники), которые взаимодействуют с другими частями тела и оказывают мощное влияние на физическое, психическое и эмоциональное здоровье. Существует около 50 различных гормонов, в том числе инсулин, эстроген, прогестерон, кортизол, мелатонин, гормоны щитовидной железы и тестостерон. Они контролируют и регулируют поведение и большинство основных функций организма от метаболизма и аппетита до температуры тела, роста, сна, размножения, сексуальности, настроения и реакции на стресс.
Сколько белка нужно есть?
На необходимый вам уровень потребления белка влияют несколько факторов, включая возраст, пол, уровень активности и состояние здоровья. Информация об оптимальном уровне белка разнится. Суточная норма потребления составляет 0,8 грамма на килограмм веса тела, или 0,36 грамма на фунт. Это составляет около 49 грамм в день для женщины весом 62 кг и 65 грамм в день для мужчины весом 82 кг. Нормы потребления для американцев рекомендуют взрослым получать от 10 до 35% от общего суточного потребления калорий из белка.
Если вы пытаетесь похудеть, потребление достаточного количества белка может вызвать гормональные изменения, которые помогут вам не сбиться с пути. Исследования показывают, что употребление в пищу белка снижает уровень стимулирующего аппетит «гормона голода» грелина и увеличивает выработку пептидов тирозин-тирозин и ГПП-1, которые ускоряют насыщение. Чтобы обеспечить достаточное потребление белка, берите с собой высокобелковую закуску (например, вяленое мясо) или добавляйте в утренний смузи порошковый белок.
Вместе с тем недостаточное или избыточное потребление белка и слишком высокая суточная калорийность потребляемой пищи сами по себе могут стать причиной гормональных изменений. Переедание повышает уровень инсулина и снижает чувствительность к инсулину, особенно для людей с избыточным весом или ожирением. Слишком низкая суточная калорийность может повысить уровень кортизола, гормона стресса, который при высоком уровне способствует набору веса, особенно в районе талии.
Белок для гормонального баланса: за и против
Тип белка, который лучше всего подходит для вас, зависит от ваших индивидуальных гормональных параметров и диетических предпочтений. Коротко о главном.
Отдавайте предпочтение морепродуктам
Морепродукты — это источник нежирного полезного белка, который прекрасно подходит для укрепления здоровья и восстановления гормонального баланса. Важно выбирать морепродукты с низким содержанием загрязняющих веществ, таких как ртуть и ПХД, которые могут негативно влиять как на рецепторы эстрогена, так и на щитовидную железу. Хорошие источники белка — длинноперый тунец, аляскинский лосось, тихоокеанские сардины, выращенные устрицы, радужная форель, пресноводный кижуч и пр. При выборе рыбы старайтесь избегать тунца обыкновенного (синего), патагонского клыкача, большого удильщика, груперов и атлантического большеголова.
Ешьте меньше красного мяса
Избыточное потребление красного мяса может повысить уровень эстрогена, гормона, ответственного за женские характеристики организма. Увеличение уровня эстрогена может быть связано с гормонами, которыми кормят животных, недостатком клетчатки, свойственным рационам с высоким содержанием продуктов животного происхождения, или с потреблением слишком большого количества насыщенных жиров.
Хотя белок животного происхождения вполне может быть частью здорового питания, для оптимизации гормонального баланса сократите потребление мяса и по возможности отдавайте предпочтение нежирным и органическим сортам. К тому же, чтобы улучшить работу кишечника и увеличить объем выведения избыточного эстрогена, следует потреблять 25-30 г клетчатки в день. Можно увеличить потребление клетчатки, добавляя порошковую клетчатку в смузи или дополнив рацион цельно-зерновыми продуктами с высоким содержанием клетчатки.
Откажитесь от глютена
Если у вас проблемы с гормонами щитовидной железы, рекомендуется исключить глютен (белок, содержащийся в некоторых злаках). Глютен ассоциируют с болезнью Хасимото — аутоиммунным заболеванием, которое поражает щитовидную железу и является ведущей причиной гипотиреоза. Старайтесь не есть зерновые, содержащие глютен (пшеница, рожь, ячмень и тритикале). Отдавайте предпочтение зерновым, которые от природы не содержат глютена, таким как кукуруза и рис, и замените привычные продукты (макаронные изделия, снеки, хлеб, крекеры и смеси для выпечки) продуктами без глютена.
Станьте жизнерадостным веганом
Употребление в пищу большего количества растительных источников белка — это прекрасный способ привести в норму гормоны. В отличие от белков животного происхождения, растительные источники белка от природы богаты клетчаткой и не содержат химических веществ, которые могут повышать уровень гормонов. Употребление большего количества клетчатки также может благотворно сказаться на здоровье кишечника, что, в свою очередь, приведет к улучшению общего гормонального баланса. К тому же, клетчатка помогает снизить уровень сахара в крови, что нормализует инсулин.
Один простой способ увеличить потребление растительного белка — добавление в смузи веганского порошкового белка. Такой порошок делают из самых разных источников белка, обычно из горохового белка, бурого риса, сои и конопли. Можно также есть больше бобовых и соевых продуктов — тофу, эдамаме, соевое молоко и соевый белок в гранулах. Некоторые исследования показывают, что употребление соевых продуктов может способствовать уменьшению симптомов менопаузы, таких как приливы.
Источники:
- Aubertin-Leheudre, M, et al. Diets and hormonal levels in postmenopausal women with or without breast cancer. Nutrition and Cancer 63, no. 4 (2011): 514–524.
- Blom, WA, et al. Effect of a high-protein breakfast on the postprandial ghrelin response. Am J Clin Nutr. 2006 Feb;83(2):211–20.
- Belza, A, et al. Contribution of gastroenteropancreatic appetite hormones to protein-induced satiety. Am J Clin Nutr. 2013 May;97(5):980-9. doi: 10.3945/ajcn.112.047563. Epub 2013 Mar 6.
- Fung, T, et al. A dietary pattern derived to correlate with estrogens and risk of postmenopausal breast cancer. Breast cancer research and treatment132, no. 3 (2012): 1157–1162;
- Harmon, BE, et al. Oestrogen levels in serum and urine of premenopausal women eating low and high amounts of meat. Public Health Nutrition 17, no. 09 (2014): 2087–2093.
- Tomiyama, AJ, et al. Low Calorie Dieting Increases Cortisol. Psychosom Med. 2010 May; 72(4): 357–364.
Белок в организме: функции, норма, продукты, признаки дефицита :: Здоровье :: РБК Стиль
Материал проверила и прокомментировала Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
Что такое белок
Белки — главный строительный материал организма. Он участвует в создании мышц, сухожилий, органов и кожи, а также нужен для производства ферментов, гормонов, нейромедиаторов и различных молекул, которые выполняют множество важных функций. Белки состоят из более мелких молекул, аминокислот, которые соединяются вместе, как бусы на нитке. Эти связанные аминокислоты образуют длинные белковые цепи, которые затем складываются в сложные формы. Некоторые аминокислоты организм производит самостоятельно, другие можно восполнить только с помощью еды.
Функции белка в организме
Рост мышц и повышение выносливости
Организму необходим протеин, ведь мышцы в основном состоят из белка. Как и большинство тканей тела, мышцы динамично разрушаются и восстанавливаются, поэтому им необходим строительный материал для роста. Чтобы мышечная масса увеличивалась, в организме должен быть положительный белковый баланс. Его также называют азотным, из-за высокого содержания этого элемента в протеине. Употребление белка помогает не только нарастить мышцы при занятиях спортом, но и предотвратить их потерю, если вы придерживаетесь строгих диет [1] [2].
Биохимические процессы
Белки — ферменты, они помогают тысячам биохимических реакций, происходящих внутри клеток организма [3]. В том числе активируют метаболизм посредством объединения с другими молекулами — субстратами. Ферменты также могут функционировать и вне клетки, например, пищеварительные — лактоза и сахароза, которые помогают переваривать сахар. От их количества зависит пищеварение, свертывание крови и энергетический баланс. Дисбаланс некоторых ферментов может привести к сбоям в работе большинства систем организма [4].
Гормональный баланс
Некоторые белки представляют собой гормоны, которые как химические посредники помогают взаимодействовать различным клеткам организма. Их производят эндокринные ткани и железы, а затем белки транспортируются по внутренним органам. Эти гормоны делят на три группы: белок и пептиды, стероиды и амины [5].
Структура тканей
Некоторые белки являются волокнами, придающими жесткость клеткам: кератин, коллаген и эластин. Они помогают формировать каркас тканей тела [6]. Кератин — строительный материал для кожи, волос и ногтей, коллаген — структурный белок костей, кожи, связок и сухожилий, а эластин позволяет тканям возвращаться в первоначальную форму после растяжений и сокращений.
Правильный pH
Белок играет жизненно важную роль в регулировании концентрации кислот и оснований в крови и других жидкостях организма [7]. Этот баланс измеряется с помощью шкалы pH от 0 до 14, где 0 — максимально кислый, 7 — нейтральный, 14 — наиболее щелочной. Протеины — один из способов регулирования этих показателей. Например, гемоглобин — тоже белок, из которого состоят эритроциты. Он связывает небольшое количество кислоты, помогая поддерживать нормальный уровень pH в крови.
Хороший иммунитет
Белки помогают формировать иммуноглобулины или антитела для борьбы с инфекцией [8] [9]. Антитела — белки в крови, которые помогают защитить организм от бактерий и вирусов. Вырабатывая их в качестве реакции на вторжение чужеродных элементов, клетки в дальнейшем лучше противостоят похожим заболеваниям.
Баланс жидкости
Альбумин и глобулин — белки крови, которые помогают сохранить баланс жидкости в организме, удерживая воду в клетках [10] [11]. При недостатке протеина могут возникать отеки, так как жидкость вытесняется в промежутки между клетками [12].
Нормализация веса
Белок важен для тех, кому необходимо нормализовать вес. Некоторые эксперименты ученых подтверждают, что увеличение количества белка в рационе ведет к повышению скорости метаболизма и снижению аппетита [13]. Протеин хорошо насыщает, в результате чего реже хочется перекусывать, снижается объем порций в основных приемах пищи [14] [15]. В одном из исследований женщины 12 недель употребляли белковую пищу в количестве 30% от дневной калорийности рациона. В среднем каждая из участниц эксперимента потеряла порядка пяти килограмм веса, сохранив здоровые пищевые привычки [16].
Норма белка в день
Если вы каждый день едите продукты животного происхождения, такие как мясо, рыбу, яйца или молочные продукты, вы, вероятно, получаете достаточно белка. Если придерживаетесь растительной диеты, получить незаменимые аминокислоты, необходимые организму, будет сложнее. Среднестатистические нормы протеина в рационе на один килограмм веса:
- для женщин – 60–90 г;
- для мужчин – 80–150 г;
- для дошкольников – 3 г;
- для школьников – 2,5 г.
В некоторых случаях требуется больше белка, например, в периоды болезни, интенсивных занятий спортом, а также при беременности и кормлении грудью [17] [18]. Данные о точном количестве вещества разнятся, поэтому правильно будет проконсультироваться с лечащим врачом, который подберет индивидуальный рацион, исходя из особенностей организма. Так, авторы одного исследования утверждают, что беременным женщинам в день необходимы 1,2–1,52 г протеина на один кг веса [19]. Другие врачи рекомендуют потреблять дополнительно 1,1г белка на кг веса [20]. Суточная норма белка во время грудного вскармливания составляет 1,3 г на килограмм в день плюс 25 дополнительных граммов [21].
Активным людям требуется больше белка, чем тем, кто ведет малоподвижный образ жизни. Спортсменам, предпочитающим тренировки на выносливость, необходимо около 1,2–1,4 г на каждый кг веса [22] [23]. Достаточное количество протеина необходимо для предотвращения развития заболеваний, таких как остеопороз. Пожилым людям, а также тем, кто восстанавливается после травмы или операции, требуется до 1–1,3 г на один кг массы тела [24] [25].
Сколько белка в яйцах, курице и твороге
Эти продукты врачи и диетологи чаще всего упоминают как отличные источники протеина:
-
Яйца. Содержат 6-7 г белка на штуку среднего размера. Содержатся они именно в белковой части яйца. Поэтому в фитнес-меню часто присутствуют блюда без желтка, но на самом деле, при сбалансированном рационе нет смысла от них отказываться.
-
Курица. Если необходимо добавить белка в рацион, выбирайте куриную грудку — в ней больше волокон и меньше жира. На 100 г продукта — 27% белка. Оптимальный ингредиент для повышения уровня белка в организме, если вы не придерживаетесь растительной диеты.
-
Творог. В 200-граммовой пачке творога содержится 35 г белка, что соответствует почти трети среднестатистической дневной нормы. Отдавайте предпочтение творогу средней жирности, так как обезжиренного усваивается меньше необходимым микроэлементов.
Продукты, богатые белком
В первую очередь, протеин попадает в организм из животных продуктов. Средние показатели белка на 100 г продукта:
- птица — 27 г;
- свинина — 27 г;
- говядина — 26 г;
- рыба — 22 г;
- морепродукты — 22 г.
Вегетарианцам и веганам стоит позаботиться о наличии растительного белка в рационе. Это могут быть бобовые, крупы, соевые и цельнозерновые продукты:
- красная чечевица — 18 г белка;
- красная фасоль — 16 г;
- маш, нут, черная фасоль — 14 г;
- гречка и цельнозерновой хлеб — 13 г;
- киноа и тофу — 8 г;
- тыквенные семечки — 5 г в одной порции (горсть 25-30 г).
Норма белка в моче и крови
Лучший способ проверить, хватает ли организму белка, — сдать анализы, например биохимический анализ крови. В норме концентрация белка в крови взрослого человека должна составлять 62–86 г/л, а у детей — от 45 до 80 г/л. Снижение этих показателей возникает в результате ряда заболеваний, в том числе первичных иммунодефицитов, нарушениях обмена веществ, дисфункциях желудочно-кишечного тракта, а также дефицита протеина в рационе.
Превышение нормы встречается редко, но оно может указывать на хронические тяжелые инфекции (такие как туберкулез), ускоренный распад эритроцитов, системные опухоли или обезвоживание организма.
С-реактивный белок — фракция протеинов плазмы, которая повышается при наличии в организме воспалительного процесса. Синтезируется в ответ на попадание в кровь токсинов патологических микроорганизмов и обезвреживает их путем их связывания, а также запускает иммунные реакции. С-реактивный белок в норме отсутствует в крови (либо его показатели не превышают 0,4 мг/л). Большие значения указывают на развитие патологий: инфекционных и вирусных заболеваний, панкреатита, пиелонефрита, гепатита, язвенного колита и онкологии.
Помимо крови, белок учитывают в анализе мочи. Небольшое его количество встречается и у здоровых людей, в норме — до 140 мг/л (до 0,140 г/л). При активной физической нагрузке показатели не должны превышать 250 мг/сутки (0,250 г/л). Для того, что точнее узнать потери белка с мочой, необходимо проводить исследование его концентрации в суточных анализах. Их назначают при заболеваниях мочевыделительной системы и почек, инфекциях, а также для контроля осложнений, в том числе при приеме препаратов, оказывающих нефротоксическое действие — поражение почек.
Переизбыток белка
Высокое потребление белка может нанести вред людям с заболеваниями почек [26]. Двумя основными факторами риска почечной недостаточности являются высокое кровяное давление (гипертония) и диабет. И то, и другое провоцируется переизбытком белка [27] [28]. Точное количество необходимого протеина варьируется в зависимости от возраста, состояния здоровья и образа жизни. Исследование с участием здоровых мужчин, занимающихся силовыми тренировками, показало, что ежедневное употребление 3 г белка на кг массы тела в течение года не имело никаких неблагоприятных последствий для здоровья [29]. Даже 4,4 г на кг веса в течение двух месяцев не вызывало никаких побочных эффектов [30].
Нет никаких доказательств того, что потребление белка в разумных количествах причиняет вред здоровым людям. Напротив, существует множество доказанных преимуществ. Однако, если у вас заболевание почек, следует следовать советам врача и ограничить потребление протеинов.
Богатое белками, но бедное жирами и углеводами питание — нагрузка на почки и печень. Переизбыток белка на фоне нехватки других необходимых организму веществ выражается в проблемах с пищеварением, неприятном запахе изо рта и постоянной жажде.
Недостаток белка
Помимо показателей медицинских анализов есть и другие признаки недостатка протеина, которые вы можете заметить перед походом к врачу.
Постоянный голод
Белки насыщают и заряжают энергией надолго, но в качестве перекуса многие из нас используют не белковые продукты, а содержащие углеводы: бананы, печенье, конфеты, выпечку и бутерброды. Еда, богатая углеводами, приводит к быстрому подъему уровня сахара (и мы чувствуем себя сытыми) и такому же быстрому падению (через полчаса мы снова голодны). Этот же эффект вызывает тягу к сладкому: организму не хватает сил, а конфета — самый быстрый способ их получить. Правда, ненадолго.
Слабые волосы и ногти
Ногти и волосы — это тоже белок, а точнее, кератин. Для их здоровья регулярное потребление белковой пищи абсолютно необходимо, иначе организму неоткуда будет брать строительный материал. При дефиците белка волосы становятся тонкими, слабыми и тусклыми, плохо растут и секутся, а ногти начинают ломаться и расслаиваться.
Медленное заживление ран
Если даже маленькая царапина заживает дольше недели, это тоже может быть признаком недостатка белка. Он входит в состав клеток мышечной ткани, кожи и крови, поэтому, если макроэлемента не хватает, на ремонт повреждений у организма уходит гораздо больше времени.
Частые инфекционные болезни
По мнению доктора Алиссы Рамси из американской Академии питания и диетологии, белок также необходим для построения клеток иммунной системы — если вы едите мало белковых продуктов, со временем защита организма может ослабеть.
Без белка замедляется выработка интерферона и лизоцима, «защитников», отбивающих атаки патогенов. Иммунитет перестает справляться с бактериями и вирусами, и мы болеем чаще. Причем любыми инфекционными заболеваниями: у людей на низкобелковой диете часто диагностируют инфекции.
Отеки
Дефицит белка приводит к нарушению водно-солевого баланса, из-за чего жидкость скапливается в тканях. Результат — мешки под глазами и опухшее по утрам лицо, отеки лодыжек и стоп, чувство тяжести в ногах, которое появляется уже в середине дня, даже если вы носите удобную обувь.
Снижение веса
У нашего организма свои приоритеты. Если белка не хватает, то все поступающие протеины направляются туда, где они жизненно необходимы, то есть к внутренним органам. Мышцам при этом почти ничего не достается, и они начинают уменьшаться в объеме. Правда, снижение мышечной массы при белковой недостаточности заметить трудно — за счет отеков вес может оставаться относительно стабильным или снижаться очень медленно. Зато вы точно заметите другие признаки постепенной атрофии мышечной ткани — слабость и быструю утомляемость. Люди, желающие скорректировать вес, часто отказываются от жиров или белка, но это ошибка. Важно соблюдать баланс: основу правильной диеты составляют мясо, рыба (или продукты с высоким содержанием белка растительного происхождения), крупы и овощи.
Плохое настроение
Белок, помимо всего прочего, важен для синтеза нейромедиатора серотонина. Именно он отвечает за хорошее настроение и стрессоустойчивость. Недостаток серотонина приводит не только к хандре, плаксивости и мрачным мыслям, но и к бессоннице, повышенной тревожности, нервозности и склонности взрываться по пустякам.
Комментарии эксперта
Горбачёва Наталья Леонидовна, диабетолог, диетолог, эндокринолог, ведущий специалист сети клиник «Семейная»
«Правильный белковый обмен веществ — баланс между распадом и синтезом белков. Организму должно хватать аминокислот для построения новых соединений. Степень усвоения белка зависит от его происхождения и способа термической обработки. Элемент не способен накапливаться в организме, его излишки выводятся с помощью почек. Поэтому чрезмерное потребление белка негативно сказывается на их состоянии
Причинами нарушений белкового обмена могут стать наследственные заболевания: подагра, а также тяжелые состояния, такие как онкопатологии, следствие радиационного облучения и прочее. Но в большинстве случаев у взрослого человека симптомы нарушения биосинтеза белков говорят о несбалансированном рационе питания.
Недостаток белков — актуальная проблема. Одних она настигает при избавлении от лишнего веса, других — при вегетарианстве, а третьих — из-за заболеваний пищеварительной и эндокринной систем. Дефицит белков может не проявляться клинически, но последствия недостатка протеина довольно печальны:
- задержка роста и развития у детей;
- малая мышечная масса;
- сердечно-сосудистые заболевания;
- плохой аппетит;
- вялость, апатия, усталость;
- плохое состояние кожи, волос, ногтей.
Если биосинтез белков нарушен на этапе построения, человек может страдать от белкового отравления. Характерными признаками интоксикации являются поражение печени и почек, нарушения работы ЖКТ. Переизбыток белка влияет на центральную нервную систему вплоть до серьезных поражений при врожденных нарушениях обмена веществ. При ухудшении самочувствия необходимо сдать анализы и получить рекомендации специалиста.»
гормонов | ProSpec
О гормонах:
Слово «гормон приходит» означает «подстегивать», что отражает то, как гормоны действуют как катализаторы других химических изменений на клеточном уровне, необходимых для роста, развития и энергии.
Гормоны — это химические посредники, которые переносят и передают сигналы в кровотоке от одной клетки или железы к другим тканям и органам для поддержания химических уровней в кровотоке, которые обеспечивают гомеостаз. Все клеточные организмы производят гормоны.
Гормоны также регулируют функцию своих клеток-мишеней, которые экспрессируют рецептор гормона. Действие гормонов определяется многочисленными факторами, такими как характер их секреции и реакция принимающей ткани (реакция передачи сигнала).
Хотя небольшое количество гормонов циркулирует в кровотоке в растворенном виде, большинство из них переносятся кровью в связке с белками плазмы. Например, стероидные гормоны, которые являются высокогидрофобными, транспортируются связанными с белками плазмы.
Примером антагонистических пар гормонов является инсулин, который вызывает падение уровня глюкозы при его повышении, а глюкагон вызывает повышение уровня сахара в крови при его падении.
Есть два основных класса гормонов: 1. Белки, пептиды и модифицированные аминокислоты. 2. Стероиды. В общем, стероиды — это половые гормоны, связанные с половым созреванием и фертильностью. Стероиды производятся из холестерина через плаценту, наши надпочечники или гонады (яички или яичники). Пептиды регулируют такие функции, как сон и концентрацию сахара.Они состоят из длинных цепочек аминокислот, поэтому иногда их называют «белковыми» гормонами. Например, гормон роста помогает нам сжигать жир и наращивать мышцы. Другой пептидный гормон, инсулин, запускает процесс преобразования сахара в клеточную энергию.
Гормоны прекрасно и эффективно управляют гомеостазом благодаря циклам отрицательной обратной связи. Наша цель — поддерживать концентрацию определенного химического вещества, такого как тестостерон, на постоянном уровне в течение определенного периода времени, как работает термостат.При использовании отрицательной обратной связи изменение условий вызывает ответ, который возвращает условия в их исходное состояние. Когда температура в комнате падает, термостат срабатывает, включая нагрев. В комнате возвращается идеальная температура, и обогреватель выключается, поддерживая относительно постоянные условия.
Эндокринные гормоны секретируются в кровь и переносятся кровью и тканевыми жидкостями к клеткам, на которые они действуют, в то время как экзокринные гормоны выделяются в проток, а затем в кровоток.Экзокринные гормоны передаются от клетки к клетке путем диффузии (паракринная передача сигналов).
Гормоны действуют медленно, с течением времени и влияют на множество различных процессов в организме, таких как рост и развитие, метаболизм, сексуальная функция, репродуктивное настроение,
Эндокринные железы и т. Д. Основными эндокринными железами являются гипофиз, шишковидная железа, вилочковая железа, щитовидная железа, надпочечники и поджелудочная железа. Кроме того, у мужчин вырабатываются гормоны в яичках, а у женщин — в яичниках.
Гормоны оказывают сильное воздействие, и требуются пикограммы, чтобы вызвать большие изменения в клетках или даже во всем теле.Вот почему слишком много или слишком мало определенного гормона может вызвать серьезные проблемы и осложнения. В лабораторных экспериментах можно измерить уровень гормонов в крови, моче или слюне.
Уровни гормонов, циркулирующих в кровотоке, контролируются гомеостатическим механизмом, например, 1 гормон стимулирует выработку 2 nd , 2 nd подавляет выработку 1 st .
Например, ФСГ стимулирует высвобождение эстрогенов из фолликула яичника, но при высоком уровне эстрогена он подавляет дальнейшее производство ФСГ.
1 основной класс гормонов — это белки, пептиды и модифицированные аминокислоты, которые представляют собой гидрофильные (и в основном большие) молекулы гормонов, которые связываются с рецепторами на поверхности «клеток-мишеней», клетки способны реагировать на присутствие гормона. Эти рецепторы являются трансмембранными белками. Связывание гормона с его рецептором инициирует последовательность внутриклеточных сигналов, которые изменяют поведение клетки (открытие или закрытие мембранных каналов) или стимулируют (или подавляют) экспрессию генов в ядре путем включения (или выключения) промоторов и энхансеры генов.
Гормон связывается с участком внеклеточной части рецептора, который действует как трансмембранный белок, проходящий через плазматическую мембрану x7, при этом N-конец открыт снаружи клетки, а С-конец выступает в цитоплазму.
Как только гормон связывается с рецептором, он активирует G-белок, связанный с С-концом цитоплазмы, который инициирует выработку второго мессенджера, такого как циклический АМФ (цАМФ), который продуцируется аденилатциклазой из АТФ и инозитолом 1,4, 5-трифосфат (IP3)
Посланник 2 и инициирует серию внутриклеточных событий, таких как фосфорилирование и активация ферментов, высвобождение Са2 + в цитозоль из запасов внутри эндоплазматического ретикулума.
цАМФ активирует фактор транскрипции CREB (белок, связывающий элемент ответа цАМФ), который включает транскрипцию гена. Клетка начинает продуцировать соответствующие генные продукты в ответ на гормональный сигнал, полученный с ее поверхности.
Стероидные гормоны представляют собой гидрофобные белки / пептиды и свободно диффундируют в клетки. Однако их «клетки-мишени» содержат цитоплазматические и / или ядерные белки, которые служат рецепторами гормона. Гормон связывается с рецептором, а комплекс связывается с элементами ответа на гормон — участками ДНК в промоторах генов, реагирующих на гормон.Комплекс гормон / рецептор действует как фактор транскрипции, «включающий» (или «выключающий») гены-мишени. Гормоны свободно циркулируют в кровотоке, ожидая, пока их распознает клетка-мишень, по назначению. У клетки-мишени есть рецептор, который может активироваться только гормоном определенного типа. После активации клетка знает, что в ее стенках запускается определенная функция. Могут активироваться гены или возобновиться производство энергии. Как особые категории, аутокринные гормоны действуют на клетки секреторной железы, в то время как паракринные гормоны действуют на соседние, но не связанные клетки.
Секреция гормона увеличивается (или уменьшается) тем же веществом, уровень которого снижается (или повышается) гормоном. Повышающийся уровень Ca2 + в кровотоке подавляет выработку ПТГ, но низкий уровень Ca2 + стимулирует его.
Эндокринная система: типы гормонов
Гормоны — это молекулы, которые несут инструкции более чем
дюжина эндокринных желез и тканей в клетки по всему телу.
У людей есть около 50 различных известных гормонов, которые различаются по
их структура, действие и реакция.Они контролируют разнообразие
биологических процессов, включая рост мышц, частоту сердечных сокращений,
менструальные циклы и голод.
Гормоны перемещаются по телу либо с током крови.
или в жидкости вокруг клеток в поисках клеток-мишеней. Один раз
гормоны находят клетку-мишень, они связываются со специфическим белком
рецепторы внутри или на поверхности клетки и особенно
изменить деятельность клетки. Белковый рецептор считывает
сообщение гормона и выполняет инструкции либо
влияние на экспрессию генов или изменение активности клеточного белка.Эти действия вызывают множество быстрых и долгосрочных ответных действий.
эффекты.
Гормоны различаются по диапазону целей. Некоторые виды гормонов
может связываться с совместимыми рецепторами, обнаруженными во многих разных клетках
по всему телу. Другие гормоны более специфичны, нацелены
только одна или несколько тканей. Например, эстрогены, женские
половые гормоны, могут регулировать функцию, связываясь со специальными эстрогенами
рецепторные участки в клетках матки, груди и костей.
Кроме того, одна и та же ячейка может выступать в качестве целевой для многих
разные регуляторные молекулы. Например, та же матка,
клетки груди и кости, принимающие эстрогены, также содержат прогестерон,
рецепторы андрогенов, глюкокортикоидов, витамина D и витамина A.
Гормоны классифицируются (разделены на группы) в соответствии с
на то, как они перемещаются в организме, и на их химическую структуру.
Паракринный, аутокринный и синаптический три типа локальных
гормональная сигнализация. При паракринной передаче сигналов высвобождаются гормоны.
в жидкость между клетками (интерстициальная жидкость) и
распространяются на близлежащие клетки-мишени. Гормоны, влияющие на секрецию
или другие процессы в тех же клетках, которые их выпустили,
говорят автокринные связисты. Более специализированный синаптический
передача сигналов происходит между нейронами (нервными клетками, которые производят
вверх по нервной системе) и между нейронами и мышечными клетками,
позволяя нервным клеткам общаться друг с другом и с мышцами.
КРЕДИТ ИЗОБРАЖЕНИЯ: OpenStax, CNX.
Химическая промышленность
Структуры
Гормоны также сгруппированы по химической структуре. Структуры
определить, предпочитает ли гормон быть окруженным водой или
жир (водный или жирорастворимый), определяющий:
Большинство водорастворимых гормонов, таких как производные аминокислот
и пептиды, могут свободно перемещаться в крови, потому что им «нравится»
вода.Однако они отталкиваются липидными или жировыми структурами.
такие как мембраны, которые окружают клетку и ядро. Так как
из этого, эти гормоны обычно связываются с рецепторными участками на
снаружи клетки и сигнал оттуда.
Жирорастворимые гормоны, такие как половые гормоны, стероиды, эстрогены
и андрогены, являются жирорастворимыми и водоотталкивающими. Это,
им «нравятся» липидные или жировые структуры, такие как
окружающие клетки, но обычно отталкиваются водянистыми участками.Стероиды обычно перемещаются к своим клеткам-мишеням, прикрепленным к
специальный белок-носитель, который «любит» воду (например,
как, глобулин, связывающий половые стероидные гормоны, и сывороточный альбумин).
Гормоны отделяются перед переходом в клетку, где они
связываются с рецепторами.
Чтобы получить более полное представление об этом, представьте себе масло и воду. В
два не смешиваются и разделяются на отдельные слои. В таком случае,
производные аминокислот и пептидные гормоны предпочли бы
находиться в слое воды, и стероидные гормоны предпочли бы
находиться в масляном слое.Специальные белки-носители, которые удобны
как в масле, так и в воде может сопровождать пептид и аминокислоту
производные молекулы в масло, а молекулы стероидов в
вода.
Гормоны — анатомия и физиология
Сообщение, которое посылает гормон, принимается рецептором гормона, белком, расположенным внутри клетки или внутри клеточной мембраны. Рецептор будет обрабатывать сообщение, инициируя другие сигнальные события или клеточные механизмы, которые приводят к ответу клетки-мишени.Рецепторы гормонов распознают молекулы определенной формы и боковых групп и реагируют только на те гормоны, которые распознаются. Один и тот же тип рецептора может располагаться на клетках в разных тканях тела и вызывать несколько разные реакции. Таким образом, реакция, вызванная гормоном, зависит не только от гормона, но и от клетки-мишени.
Как только клетка-мишень получает гормональный сигнал, она может реагировать различными способами. Ответ может включать стимуляцию синтеза белка, активацию или дезактивацию ферментов, изменение проницаемости клеточной мембраны, изменение скорости митоза и роста клеток и стимуляцию секреции продуктов.Более того, один гормон может вызывать разные ответы в данной клетке.
Пути вовлечения рецепторов внутриклеточных гормонов
Рецепторы внутриклеточных гормонов расположены внутри клетки. Гормоны, которые связываются с этим типом рецепторов, должны иметь возможность проникать через клеточную мембрану. Стероидные гормоны получают из холестерина и поэтому могут легко диффундировать через липидный бислой клеточной мембраны, достигая внутриклеточного рецептора ((рисунок)). Гормоны щитовидной железы, которые содержат бензольные кольца, усеянные йодом, также являются жирорастворимыми и могут проникать в клетку.
Расположение связывания стероидов и гормонов щитовидной железы немного отличается: стероидный гормон может связываться со своим рецептором в цитозоле или в ядре. В любом случае это связывание генерирует комплекс гормон-рецептор, который движется к хроматину в ядре клетки и связывается с определенным сегментом клеточной ДНК. Напротив, гормоны щитовидной железы связываются с рецепторами, уже связанными с ДНК. Как для стероидных гормонов, так и для гормонов щитовидной железы связывание комплекса гормон-рецептор с ДНК запускает транскрипцию целевого гена на мРНК, которая перемещается в цитозоль и направляет синтез белка рибосомами.
Связывание жирорастворимых гормонов
Стероидный гормон непосредственно инициирует производство белков в клетке-мишени. Стероидные гормоны легко диффундируют через клеточную мембрану. Гормон связывается со своим рецептором в цитозоле, образуя комплекс рецептор-гормон. Затем рецепторно-гормональный комплекс проникает в ядро и связывается с целевым геном на ДНК. Транскрипция гена создает информационную РНК, которая транслируется в желаемый белок в цитоплазме.
Пути вовлечения рецепторов гормонов клеточной мембраны
Гидрофильные или водорастворимые гормоны не могут диффундировать через липидный бислой клеточной мембраны и поэтому должны передавать свое сообщение рецептору, расположенному на поверхности клетки. За исключением гормонов щитовидной железы, которые растворимы в липидах, все гормоны, производные от аминокислот, связываются с рецепторами клеточной мембраны, которые расположены, по крайней мере частично, на внеклеточной поверхности клеточной мембраны. Следовательно, они не влияют напрямую на транскрипцию генов-мишеней, а вместо этого инициируют сигнальный каскад, который осуществляется молекулой, называемой вторым мессенджером.В этом случае гормон называют первым посланником.
Вторым посредником, используемым большинством гормонов, является циклический аденозинмонофосфат (цАМФ). В системе вторичного мессенджера цАМФ водорастворимый гормон связывается со своим рецептором в клеточной мембране (шаг 1 на (рисунок)). Этот рецептор связан с внутриклеточным компонентом, называемым G-белком, и связывание гормона активирует компонент G-белка (этап 2). Активированный белок G, в свою очередь, активирует фермент под названием аденилатциклаза, также известный как аденилатциклаза (этап 3), который превращает аденозинтрифосфат (АТФ) в цАМФ (этап 4).В качестве второго мессенджера цАМФ активирует тип фермента, называемого протеинкиназой, который присутствует в цитозоле (шаг 5). Активированные протеинкиназы инициируют каскад фосфорилирования, в котором несколько протеинкиназ фосфорилируют (добавляют к ним фосфатную группу) многочисленные и различные клеточные белки, включая другие ферменты (этап 6).
Связывание водорастворимых гормонов
Водорастворимые гормоны не могут диффундировать через клеточную мембрану. Эти гормоны должны связываться с рецептором на поверхности клеточной мембраны.Затем рецептор инициирует внутриклеточный сигнальный путь с участием G-белков, аденилатциклазы, вторичного мессенджера циклического АМФ (цАМФ) и протеинкиназ. На последнем этапе эти протеинкиназы фосфорилируют белки в цитоплазме. Это активирует белки в клетке, которые осуществляют изменения, указанные гормоном.
Фосфорилирование клеточных белков может вызывать самые разные эффекты, от метаболизма питательных веществ до синтеза различных гормонов и других продуктов.Эффекты варьируются в зависимости от типа клетки-мишени, задействованных G-белков и киназ, а также фосфорилирования белков. Примеры гормонов, которые используют цАМФ в качестве второго посредника, включают кальцитонин, который важен для строительства костей и регулирования уровня кальция в крови; глюкагон, который играет роль в уровне глюкозы в крови; и тиреотропный гормон, который вызывает высвобождение Т 3 и Т 4 из щитовидной железы.
В целом, каскад фосфорилирования значительно увеличивает эффективность, скорость и специфичность гормонального ответа, поскольку тысячи сигнальных событий могут инициироваться одновременно в ответ на очень низкую концентрацию гормона в кровотоке.Однако продолжительность гормонального сигнала коротка, поскольку цАМФ быстро дезактивируется ферментом фосфодиэстеразой (ФДЭ), который находится в цитозоле. Действие ФДЭ помогает гарантировать быстрое прекращение ответа клетки-мишени, если новые гормоны не попадут на клеточную мембрану.
Важно отметить, что существуют также G-белки, которые снижают уровни цАМФ в клетке в ответ на связывание гормона. Например, когда гормон, ингибирующий гормон роста (GHIH), также известный как соматостатин, связывается со своими рецепторами в гипофизе, уровень цАМФ снижается, тем самым подавляя секрецию гормона роста человека.
Не все водорастворимые гормоны инициируют систему вторичного мессенджера цАМФ. Одна из распространенных альтернативных систем использует ионы кальция в качестве вторичного посредника. В этой системе G-белки активируют фермент фосфолипазу C (PLC), который действует аналогично аденилатциклазе. После активации PLC расщепляет связанный с мембраной фосфолипид на две молекулы: диацилглицерин (DAG) и инозитолтрифосфат (IP 3 ). Подобно цАМФ, DAG активирует протеинкиназы, которые инициируют каскад фосфорилирования.В то же время IP 3 вызывает высвобождение ионов кальция из мест хранения внутри цитозоля, например из гладкой эндоплазматической сети. Затем ионы кальция действуют как вторичные мессенджеры двумя способами: они могут напрямую влиять на ферментативную и другие клеточные активности или могут связываться с кальцийсвязывающими белками, наиболее распространенным из которых является кальмодулин. Связывая кальций, кальмодулин способен модулировать протеинкиназу внутри клетки. Примеры гормонов, которые используют ионы кальция в качестве вторичной системы посыльного, включают ангиотензин II, который помогает регулировать кровяное давление посредством сужения сосудов, и гормон, высвобождающий гормон роста (GHRH), который заставляет гипофиз выделять гормоны роста.
видов гормонов | Безграничная биология
Гормональные функции
Эндокринная система играет роль в росте, метаболизме и других процессах, высвобождая гормоны в кровь.
Цели обучения
Оценить гормоны и их назначение в организме
Основные выводы
Ключевые моменты
- Гормоны служат в организме как химические посредники и помогают поддерживать гомеостаз.
- Гормоны попадают в жидкости организма, например кровь, и переносят их к клеткам-мишеням.
- Клетки-мишени реагируют на гормон, когда они экспрессируют специфический рецептор этого гормона.
- Гормоны также играют роль в регуляции гибели клеток, иммунной системы, репродуктивного развития, перепадов настроения и тяги к голоду.
- В надпочечниках адреналин и норадреналин регулируют реакцию на стресс; в щитовидной железе гормоны щитовидной железы регулируют скорость метаболизма.
Ключевые термины
- клетка-мишень : любая клетка, имеющая специфический рецептор гормона
- гормон : любое вещество, вырабатываемое одной тканью и переносимое кровотоком в другую для воздействия на физиологическую активность
- эндокринная система : система управления железами без протоков, которые секретируют гормоны, которые циркулируют через кровоток для воздействия на клетки в определенных органах
Эндокринная система: гормоны
Эндокринная система животного контролирует процессы организма посредством выработки, секреции и регулирования гормонов.Гормоны служат химическими «посланниками», которые участвуют в деятельности клеток и органов, поддерживая гомеостаз тела. Поддержание гомеостаза в организме требует координации множества различных систем и органов. Связь между соседними клетками, а также между клетками и тканями в отдаленных частях тела происходит посредством высвобождения гормонов в жидкости организма (обычно в кровь), которые переносят их к своим клеткам-мишеням. Клетки-мишени, имеющие рецептор сигнала, реагируют на гормон, когда они экспрессируют специфический рецептор этого гормона.Клеточные реципиенты определенного гормонального сигнала могут быть одним из нескольких типов клеток, которые находятся в нескольких различных тканях, как в случае с инсулином, который вызывает широкий спектр системных физиологических эффектов. Различные типы тканей также могут по-разному реагировать на один и тот же гормональный сигнал.
Высвобождая гормоны, эндокринная система играет роль в росте, метаболизме и половом развитии. Гормоны также играют роль в индукции или подавлении гибели клеток, активации или подавлении иммунной системы, перепадах настроения и жажде голода.У людей общие заболевания эндокринной системы включают заболевание щитовидной железы и сахарный диабет.
Примеры эндокринных желез: надпочечники, вырабатывающие гормоны, такие как адреналин и норадреналин, регулирующие реакцию на стресс, и щитовидную железу, вырабатывающую гормоны щитовидной железы, регулирующие скорость метаболизма. У организмов, претерпевающих метаморфоз, процесс контролируется эндокринной системой. Например, превращение головастика в лягушку является сложным и тонким, чтобы адаптироваться к конкретным условиям окружающей среды и экологическим обстоятельствам.
Гормоны в метаморфозе : Процесс метаморфоза земноводных, как видно на показанных здесь стадиях превращения головастика в лягушку, осуществляется гормонами.
Липидные, аминокислотные и пептидные гормоны
Все гормоны в организме человека можно разделить на гормоны липидного, аминокислотного и пептидного происхождения.
Цели обучения
Распознавать характеристики, связанные с липидными, аминокислотными и пептидными гормонами
Основные выводы
Ключевые моменты
- Большинство липидных гормонов представляют собой стероидные гормоны, которые обычно представляют собой кетоны или спирты и нерастворимы в воде.
- Стероидные гормоны (оканчивающиеся на «-ол» или «-он») включают эстрадиол, тестостерон, альдостерон и кортизол.
- Гормоны, производные от аминокислот (оканчивающиеся на «-ин»), являются производными тирозина и триптофана и включают адреналин и норадреналин (продуцируемые мозговым веществом надпочечников).
- Гормоны, производные от аминокислот, также включают тироксин (вырабатываемый щитовидной железой) и мелатонин (вырабатываемый шишковидной железой).
- Пептидные гормоны состоят из полипептидной цепи; они включают такие молекулы, как окситоцин (короткая полипептидная цепь) или гормоны роста (белки).
- Гормоны на основе аминокислот и белковые гормоны растворимы в воде и не растворяются в липидах.
Ключевые термины
- окситоцин : гормон, стимулирующий схватки во время родов, а затем выработку молока
- адреналин : (адреналин) гормон аминокислотного происхождения, секретируемый надпочечниками в ответ на стресс
- эстроген : любой из группы стероидов (липидных гормонов), которые секретируются яичниками и действуют как женские половые гормоны
Типы гормонов
Хотя в организме человека существует множество различных гормонов, их можно разделить на три класса в зависимости от их химической структуры: липидные, аминокислотные и пептидные гормоны (включая пептиды и белки).Одной из ключевых отличительных особенностей гормонов липидного происхождения является то, что они могут диффундировать через плазматические мембраны, тогда как гормоны, производные от аминокислот и пептиды, не могут.
Липидные гормоны (или липидорастворимые гормоны)
Большинство липидных гормонов получают из холестерина, поэтому структурно схожи с ним. Основным классом липидных гормонов человека являются стероидные гормоны. По химическому составу эти гормоны обычно представляют собой кетоны или спирты; их химические названия заканчиваются на «-ол» для спиртов или на «-он» для кетонов.Примеры стероидных гормонов включают эстрадиол, который представляет собой эстроген, или женский половой гормон, и тестостерон, который представляет собой андроген, или мужской половой гормон. Эти два гормона выделяются женскими и мужскими репродуктивными органами соответственно. Другие стероидные гормоны включают альдостерон и кортизол, которые выделяются надпочечниками вместе с некоторыми другими типами андрогенов. Стероидные гормоны не растворяются в воде; они переносятся транспортными белками крови. В результате они остаются в кровотоке дольше, чем пептидные гормоны.Например, кортизол имеет период полураспада от 60 до 90 минут, тогда как адреналин, гормон, производный от аминокислоты, имеет период полужизни примерно в одну минуту.
Липидные гормоны : Показанные здесь структуры представляют (а) холестерин плюс стероидные гормоны (б) тестостерон и (в) эстрадиол.
Гормоны, производные аминокислот
Гормоны, производные от аминокислот, представляют собой относительно небольшие молекулы, производные от аминокислот тирозина и триптофана. Если гормон является производным от аминокислоты, его химическое название заканчивается на «-ine».Примеры гормонов, производных от аминокислот, включают адреналин и норэпинефрин, которые синтезируются в мозговом веществе надпочечников, и тироксин, который вырабатывается щитовидной железой. Шишковидная железа в головном мозге вырабатывает и секретирует мелатонин, который регулирует циклы сна.
Гормоны, производные от аминокислот : (a) Гормон адреналин, который вызывает реакцию «бей или беги», происходит из аминокислоты тирозина. (б) Гормон мелатонин, регулирующий циркадные ритмы, происходит из аминокислоты триптофана.
Пептидные гормоны
Структура пептидных гормонов представляет собой структуру полипептидной цепи (цепи аминокислот). Пептидные гормоны включают молекулы, которые представляют собой короткие полипептидные цепи, такие как антидиуретический гормон и окситоцин, продуцируемые в головном мозге и высвобождаемые в кровь в задней доле гипофиза. Этот класс также включает небольшие белки, такие как гормоны роста, вырабатываемые гипофизом, и большие гликопротеины, такие как фолликулостимулирующий гормон, вырабатываемый гипофизом.
Пептидные гормоны : Показаны структуры пептидных гормонов (а) окситоцина, (б) гормона роста и (в) фолликулостимулирующего гормона. Эти пептидные гормоны намного больше, чем те, которые получены из холестерина или аминокислот.
Секретируемые пептиды, такие как инсулин, хранятся в пузырьках в клетках, которые их синтезируют. Затем они высвобождаются в ответ на раздражители (например, в виде высокого уровня глюкозы в крови в случае инсулина). Аминокислотные и полипептидные гормоны растворимы в воде и не растворяются в липидах.Эти гормоны не могут проходить через плазматические мембраны клеток; следовательно, их рецепторы находятся на поверхности клеток-мишеней.
гормонов | Анатомия и физиология II
Цели обучения
К концу этого раздела вы сможете:
- Определить три основных класса гормонов на основе химической структуры
- Сравнить и сопоставить рецепторы гормонов внутриклеточных и клеточных мембран
- Опишите сигнальные пути, которые включают цАМФ и IP3
- Определите несколько факторов, которые влияют на ответ клетки-мишени
- Обсудите роль петель обратной связи и гуморальных, гормональных и нервных стимулов в контроле гормонов
Хотя данный гормон может перемещаться по всему телу с кровотоком, он влияет на активность только своих клеток-мишеней; то есть клетки с рецепторами этого гормона.Как только гормон связывается с рецептором, запускается цепь событий, которая приводит к ответу клетки-мишени. Гормоны играют решающую роль в регуляции физиологических процессов из-за регулируемых ими ответов клеток-мишеней. Эти реакции способствуют воспроизводству человека, росту и развитию тканей тела, метаболизму, жидкостному и электролитному балансу, сну и многим другим функциям организма. Основные гормоны человеческого тела и их эффекты указаны в таблице 1.
| Таблица 1.Эндокринные железы и их основные гормоны | |||
|---|---|---|---|
| Эндокринная железа | Ассоциированные гормоны | Химический класс | Эффект |
| Гипофиз (передний) | Гормон роста (GH) | Белок | Способствует росту тканей тела |
| Гипофиз (передний) | Пролактин (PRL) | Пептид | Способствует производству молока |
| Гипофиз (передний) | Тиреотропный гормон (ТТГ) | Гликопротеин | Стимулирует выработку гормонов щитовидной железы |
| Гипофиз (передний) | Адренокортикотропный гормон (АКТГ) | Пептид | Стимулирует выработку гормонов корой надпочечников |
| Гипофиз (передний) | Фолликулостимулирующий гормон (ФСГ) | Гликопротеин | Стимулирует производство гамет |
| Гипофиз (передний) | Лютеинизирующий гормон (ЛГ) | Гликопротеин | Стимулирует выработку андрогенов гонадами |
| Гипофиз (задний) | Антидиуретический гормон (АДГ) | Пептид | Стимулирует реабсорбцию воды почками |
| Гипофиз (задний) | Окситоцин | Пептид | Стимулирует сокращение матки во время родов |
| Щитовидная железа | Тироксин (T 4 ), трийодтиронин (T 3 ) | Амин | Стимулировать основной обмен веществ |
| Щитовидная железа | Кальцитонин | Пептид | Снижает уровень Ca 2+ |
| Паращитовидные железы | Гормон паращитовидной железы (ПТГ) | Пептид | Повышает уровень Ca 2+ |
| Надпочечники (кора) | Альдостерон | Стероид | Повышает уровень Na в крови + |
| Надпочечники (кора) | Кортизол, кортикостерон, кортизон | Стероид | Повышение уровня глюкозы в крови |
| Надпочечник (мозговое вещество) | Адреналин, норадреналин | Амин | Стимулируйте реакцию «бей или беги» |
| Шишковидная железа | Мелатонин | Амин | Регулирует циклы сна |
| Поджелудочная железа | Инсулин | Белок | Снижает уровень глюкозы в крови |
| Поджелудочная железа | Глюкагон | Белок | Повышает уровень глюкозы в крови |
| Тесты | Тестостерон | Стероид | Стимулирует развитие вторичных половых признаков у мужчин и выработку спермы |
| Яичники | Эстрогены и прогестерон | Стероид | Стимулирует развитие вторичных половых признаков у женщин и подготавливает организм к родам |
Типы гормонов
Гормоны человеческого тела можно разделить на две основные группы на основе их химической структуры. {+} _ Остается {3} [/ latex] или аминная группа.
Аминные гормоны синтезируются из аминокислот триптофана или тирозина. Примером гормона, полученного из триптофана, является мелатонин, который секретируется шишковидной железой и помогает регулировать циркадный ритм. Производные тирозина включают регулирующие метаболизм гормоны щитовидной железы, а также катехоламины, такие как адреналин, норадреналин и дофамин. Адреналин и норадреналин секретируются мозговым веществом надпочечников и играют роль в реакции «бей или беги», тогда как дофамин секретируется гипоталамусом и подавляет высвобождение определенных гормонов передней доли гипофиза.
Пептиды и белковые гормоны
В то время как аминовые гормоны происходят из одной аминокислоты, пептидные и белковые гормоны состоят из нескольких аминокислот, которые соединяются, образуя аминокислотную цепь. Пептидные гормоны состоят из коротких цепочек аминокислот, тогда как белковые гормоны представляют собой более длинные полипептиды. Оба типа синтезируются так же, как и другие белки организма: ДНК транскрибируется в мРНК, которая транслируется в аминокислотную цепь.
Примеры пептидных гормонов включают антидиуретический гормон (АДГ), гормон гипофиза, важный для баланса жидкости, и предсердно-натрийуретический пептид, который вырабатывается сердцем и помогает снизить кровяное давление.Некоторые примеры белковых гормонов включают гормон роста, который вырабатывается гипофизом, и фолликулостимулирующий гормон (ФСГ), который имеет присоединенную углеводную группу и, таким образом, классифицируется как гликопротеин. ФСГ помогает стимулировать созревание яйцеклеток в яичниках и сперматозоидов в яичках.
Стероидные гормоны
Основными гормонами, получаемыми из липидов, являются стероиды. Стероидные гормоны получают из липидного холестерина. Например, половые гормоны тестостерон и эстрогены, вырабатываемые гонадами (семенниками и яичниками), являются стероидными гормонами.Надпочечники вырабатывают стероидный гормон альдостерон, который участвует в осморегуляции, и кортизол, который играет роль в метаболизме.
Как и холестерин, стероидные гормоны не растворяются в воде (они гидрофобны). Поскольку кровь состоит из воды, гормоны, полученные из липидов, должны попасть в свою клетку-мишень, связанную с транспортным белком. Эта более сложная структура продлевает период полужизни стероидных гормонов намного дольше, чем у гормонов, полученных из аминокислот. Период полувыведения гормона — это время, необходимое для разложения половины концентрации гормона.Например, липидный гормон кортизол имеет период полураспада примерно от 60 до 90 минут. Напротив, гормон адреналин, производный от аминокислот, имеет период полураспада примерно одну минуту.
Пути действия гормонов
Сообщение, которое посылает гормон, принимается рецептором гормона, белком, расположенным внутри клетки или внутри клеточной мембраны. Рецептор будет обрабатывать сообщение, инициируя другие сигнальные события или клеточные механизмы, которые приводят к ответу клетки-мишени.Рецепторы гормонов распознают молекулы определенной формы и боковых групп и реагируют только на те гормоны, которые распознаются. Один и тот же тип рецептора может располагаться на клетках в разных тканях тела и вызывать несколько разные реакции. Таким образом, реакция, вызванная гормоном, зависит не только от гормона, но и от клетки-мишени.
Как только клетка-мишень получает гормональный сигнал, она может реагировать различными способами. Ответ может включать стимуляцию синтеза белка, активацию или дезактивацию ферментов, изменение проницаемости клеточной мембраны, изменение скорости митоза и роста клеток и стимуляцию секреции продуктов.Более того, один гормон может вызывать разные ответы в данной клетке.
Пути вовлечения рецепторов внутриклеточных гормонов
Рецепторы внутриклеточных гормонов расположены внутри клетки. Гормоны, которые связываются с этим типом рецепторов, должны иметь возможность проникать через клеточную мембрану. Стероидные гормоны происходят из холестерина и поэтому могут легко диффундировать через липидный бислой клеточной мембраны, достигая внутриклеточного рецептора (рис. 2). Гормоны щитовидной железы, которые содержат бензольные кольца, усеянные йодом, также являются жирорастворимыми и могут проникать в клетку.
Расположение связывания стероидов и гормонов щитовидной железы немного отличается: стероидный гормон может связываться со своим рецептором в цитозоле или в ядре. В любом случае это связывание генерирует комплекс гормон-рецептор, который движется к хроматину в ядре клетки и связывается с определенным сегментом клеточной ДНК. Напротив, гормоны щитовидной железы связываются с рецепторами, уже связанными с ДНК. Как для стероидных гормонов, так и для гормонов щитовидной железы связывание комплекса гормон-рецептор с ДНК запускает транскрипцию целевого гена на мРНК, которая перемещается в цитозоль и направляет синтез белка рибосомами.
Рисунок 2. Связывание жирорастворимых гормонов
Стероидный гормон непосредственно инициирует производство белков в клетке-мишени. Стероидные гормоны легко диффундируют через клеточную мембрану. Гормон связывается со своим рецептором в цитозоле, образуя комплекс рецептор-гормон. Затем рецепторно-гормональный комплекс проникает в ядро и связывается с целевым геном на ДНК. Транскрипция гена создает информационную РНК, которая транслируется в желаемый белок в цитоплазме.
Пути, вовлекающие рецепторы гормонов клеточной мембраны
Гидрофильные или водорастворимые гормоны не могут диффундировать через липидный бислой клеточной мембраны и поэтому должны передавать свое сообщение рецептору, расположенному на поверхности клетки. За исключением гормонов щитовидной железы, которые растворимы в липидах, все гормоны, производные от аминокислот, связываются с рецепторами клеточной мембраны, которые расположены, по крайней мере частично, на внеклеточной поверхности клеточной мембраны. Следовательно, они не влияют напрямую на транскрипцию генов-мишеней, а вместо этого инициируют сигнальный каскад, который осуществляется молекулой, называемой вторичным мессенджером .В этом случае гормон называется первым посланником .
Второй посредник, используемый большинством гормонов, — это циклический аденозинмонофосфат (цАМФ) . В системе вторичного мессенджера цАМФ водорастворимый гормон связывается со своим рецептором в клеточной мембране (шаг 1 на рисунке 3). Этот рецептор связан с внутриклеточным компонентом, называемым белком G , и связывание гормона активирует компонент G-белка (этап 2). Активированный белок G, в свою очередь, активирует фермент под названием аденилатциклаза , также известный как аденилатциклаза (этап 3), который превращает аденозинтрифосфат (АТФ) в цАМФ (этап 4).В качестве второго мессенджера цАМФ активирует тип фермента, называемого протеинкиназой , который присутствует в цитозоле (этап 5). Активированные протеинкиназы инициируют каскад фосфорилирования , в котором несколько протеинкиназ фосфорилируют (добавляют к ним фосфатную группу) многочисленные и различные клеточные белки, включая другие ферменты (этап 6).
Рисунок 3. Связывание водорастворимых гормонов
Водорастворимые гормоны не могут диффундировать через клеточную мембрану. Эти гормоны должны связываться с рецептором на поверхности клеточной мембраны.Затем рецептор инициирует внутриклеточный сигнальный путь с участием G-белков, аденилатциклазы, вторичного мессенджера циклического АМФ (цАМФ) и протеинкиназ. На последнем этапе эти протеинкиназы фосфорилируют белки в цитоплазме. Это активирует белки в клетке, которые осуществляют изменения, указанные гормоном.
Фосфорилирование клеточных белков может вызывать самые разные эффекты, от метаболизма питательных веществ до синтеза различных гормонов и других продуктов.Эффекты варьируются в зависимости от типа клетки-мишени, задействованных G-белков и киназ, а также фосфорилирования белков. Примеры гормонов, которые используют цАМФ в качестве второго посредника, включают кальцитонин, который важен для строительства костей и регулирования уровня кальция в крови; глюкагон, который играет роль в уровне глюкозы в крови; и тиреотропный гормон, который вызывает высвобождение Т 3 и Т 4 из щитовидной железы.
В целом, каскад фосфорилирования значительно увеличивает эффективность, скорость и специфичность гормонального ответа, поскольку тысячи сигнальных событий могут инициироваться одновременно в ответ на очень низкую концентрацию гормона в кровотоке.Однако продолжительность гормонального сигнала коротка, поскольку цАМФ быстро дезактивируется ферментом фосфодиэстераза (PDE) , который находится в цитозоле. Действие ФДЭ помогает гарантировать быстрое прекращение ответа клетки-мишени, если новые гормоны не попадут на клеточную мембрану.
Важно отметить, что существуют также G-белки, которые снижают уровни цАМФ в клетке в ответ на связывание гормона. Например, когда гормон, ингибирующий гормон роста (GHIH), также известный как соматостатин, связывается со своими рецепторами в гипофизе, уровень цАМФ снижается, тем самым подавляя секрецию гормона роста человека.
Не все водорастворимые гормоны инициируют систему вторичного мессенджера цАМФ. Одна из распространенных альтернативных систем использует ионы кальция в качестве вторичного посредника. В этой системе G-белки активируют фермент фосфолипазу C (PLC), который действует аналогично аденилатциклазе. После активации PLC расщепляет мембраносвязанный фосфолипид на две молекулы: диацилглицерин (DAG) и инозитолтрифосфат (IP 3 ) . Подобно цАМФ, DAG активирует протеинкиназы, которые инициируют каскад фосфорилирования.В то же время IP 3 вызывает высвобождение ионов кальция из мест хранения внутри цитозоля, например из гладкой эндоплазматической сети. Затем ионы кальция действуют как вторичные мессенджеры двумя способами: они могут напрямую влиять на ферментативную и другие клеточные активности или могут связываться с кальцийсвязывающими белками, наиболее распространенным из которых является кальмодулин. Связывая кальций, кальмодулин способен модулировать протеинкиназу внутри клетки. Примеры гормонов, которые используют ионы кальция в качестве вторичной системы посыльного, включают ангиотензин II, который помогает регулировать кровяное давление посредством сужения сосудов, и гормон, высвобождающий гормон роста (GHRH), который заставляет гипофиз выделять гормоны роста.
Факторы, влияющие на ответ клеток-мишеней
Как вы помните, клетки-мишени должны иметь рецепторы, специфичные для данного гормона, если этот гормон должен вызывать реакцию. Но несколько других факторов влияют на ответ клетки-мишени. Например, наличие значительного уровня гормона, циркулирующего в кровотоке, может привести к тому, что его клетки-мишени уменьшат количество рецепторов для этого гормона. Этот процесс называется подавлением , и он позволяет клеткам стать менее реактивными на чрезмерный уровень гормонов.Когда уровень гормона хронически снижается, клетки-мишени участвуют в активации , чтобы увеличить количество своих рецепторов. Этот процесс позволяет клеткам быть более чувствительными к присутствующему гормону. Клетки также могут изменять чувствительность самих рецепторов к различным гормонам.
Два или более гормона могут взаимодействовать и влиять на реакцию клеток различными способами. Вот три наиболее распространенных типа взаимодействия:
- Разрешающий эффект, при котором присутствие одного гормона позволяет другому гормону действовать.Например, гормоны щитовидной железы имеют сложные разрешительные отношения с определенными репродуктивными гормонами. Поэтому дефицит йода, компонента гормонов щитовидной железы, может повлиять на развитие и функционирование репродуктивной системы.
- Синергетический эффект, при котором два гормона со схожими эффектами вызывают усиленный ответ. В некоторых случаях для адекватного ответа требуются два гормона. Например, для созревания женских яйцеклеток (яйцеклеток) необходимы два разных репродуктивных гормона — ФСГ из гипофиза и эстрогены из яичников.
- Антагонистический эффект, при котором два гормона оказывают противоположное действие. Знакомый пример — действие двух гормонов поджелудочной железы, инсулина и глюкагона. Инсулин увеличивает запасы глюкозы в печени в виде гликогена, снижая уровень глюкозы в крови, тогда как глюкагон стимулирует расщепление запасов гликогена, повышая уровень глюкозы в крови.
Регуляция секреции гормонов
Для предотвращения аномального уровня гормонов и потенциального заболевания необходимо строго контролировать уровень гормонов.Организм поддерживает этот контроль, уравновешивая выработку и деградацию гормонов. Петли обратной связи управляют инициированием и поддержанием большей части секреции гормонов в ответ на различные стимулы.
Роль петель обратной связи
Здесь будет лишь кратко рассмотрен вклад петель обратной связи в гомеостаз. Петли положительной обратной связи характеризуются высвобождением дополнительного гормона в ответ на первоначальное высвобождение гормона. Высвобождение окситоцина во время родов — это положительная обратная связь.Первоначальный выброс окситоцина начинает давать сигнал мышцам матки сокращаться, что подталкивает плод к шейке матки, заставляя его растягиваться. Это, в свою очередь, сигнализирует гипофизу о высвобождении большего количества окситоцина, вызывая усиление схваток. После рождения ребенка высвобождение окситоцина снижается.
Более распространенный метод гормональной регуляции — это петля отрицательной обратной связи. Отрицательная обратная связь характеризуется ингибированием дальнейшей секреции гормона в ответ на адекватный уровень этого гормона.Это позволяет регулировать уровень гормона в крови в узком диапазоне. Примером отрицательной обратной связи является высвобождение глюкокортикоидных гормонов надпочечниками под действием гипоталамуса и гипофиза. Когда концентрация глюкокортикоидов в крови повышается, гипоталамус и гипофиз снижают передачу сигналов надпочечникам, чтобы предотвратить дополнительную секрецию глюкокортикоидов (рис. 4).
Рисунок 4. Контур отрицательной обратной связи
Высвобождение глюкокортикоидов надпочечников стимулируется высвобождением гормонов из гипоталамуса и гипофиза.Эта передача сигналов подавляется, когда уровни глюкокортикоидов повышаются, вызывая отрицательные сигналы в гипофиз и гипоталамус.
Роль стимулов эндокринных желез
Рефлексы, вызванные как химическими, так и нервными раздражителями, контролируют эндокринную активность. Эти рефлексы могут быть простыми, включая только один гормональный ответ, или они могут быть более сложными и включать множество гормонов, как в случае с гипоталамическим контролем различных гормонов, контролируемых передней долей гипофиза.
Гуморальные стимулы — это изменения уровня в крови негормональных химических веществ, таких как питательные вещества или ионы, которые вызывают высвобождение или ингибирование гормона для, в свою очередь, поддержания гомеостаза. Например, осморецепторы в гипоталамусе обнаруживают изменения осмолярности крови (концентрации растворенных веществ в плазме крови). Если осмолярность крови слишком высока, что означает, что кровь недостаточно разбавлена, осморецепторы сигнализируют гипоталамусу о высвобождении АДГ. Гормон заставляет почки реабсорбировать больше воды и уменьшать объем вырабатываемой мочи.Эта реабсорбция вызывает снижение осмолярности крови, разжижая кровь до соответствующего уровня. Другой пример — регулирование уровня глюкозы в крови. Высокий уровень глюкозы в крови вызывает высвобождение инсулина из поджелудочной железы, что увеличивает поглощение глюкозы клетками и хранение глюкозы в печени в виде гликогена.
Эндокринная железа может также секретировать гормон в ответ на присутствие другого гормона, вырабатываемого другой эндокринной железой. Такие гормональные стимулы часто затрагивают гипоталамус, который производит высвобождающие и ингибирующие гормоны, контролирующие секрецию различных гормонов гипофиза.
Помимо этих химических сигналов, гормоны также могут высвобождаться в ответ на нервные стимулы. Типичным примером нервных стимулов является активация симпатической нервной системы реакции «бей или беги». Когда человек ощущает опасность, симпатические нейроны сигнализируют надпочечникам о секрете норадреналина и адреналина. Два гормона расширяют кровеносные сосуды, увеличивают частоту сердечных сокращений и дыхания и подавляют пищеварительную и иммунную системы. Эти реакции усиливают транспортировку кислорода организмом к мозгу и мышцам, тем самым улучшая способность организма бороться или убегать.
Ежедневные связи
Бисфенол А и нарушение эндокринной системы Возможно, вы слышали новостные сообщения о воздействии химического вещества под названием бисфенол А (BPA) на различные типы упаковки пищевых продуктов. BPA используется в производстве твердых пластмасс и эпоксидных смол. Обычные предметы, связанные с пищевыми продуктами, которые могут содержать BPA, включают облицовку алюминиевых банок, пластиковых контейнеров для хранения продуктов, стаканов для питья, а также детских бутылочек и стаканчиков-поильников. Другие применения BPA включают медицинское оборудование, зубные пломбы и прокладку водопроводных труб.
Исследования показывают, что BPA является эндокринным разрушителем, а это означает, что он отрицательно влияет на эндокринную систему, особенно во время пренатального и постнатального периода развития. В частности, BPA имитирует гормональные эффекты эстрогенов и имеет противоположный эффект — эффект андрогенов. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) отмечает в своем заявлении о безопасности BPA, что, хотя традиционные токсикологические исследования подтверждают безопасность низких уровней воздействия BPA, недавние исследования с использованием новых подходов для проверки тонких эффектов привели к некоторой озабоченности по поводу потенциальные эффекты BPA на мозг, поведение и предстательную железу у плодов, младенцев и маленьких детей.FDA в настоящее время способствует сокращению использования BPA в материалах пищевого назначения. Многие американские компании добровольно удалили BPA из детских бутылочек, стаканчиков-поильников и покрытий банок с детской смесью, и большинство пластиковых бутылочек для воды многоразового использования, продаваемых сегодня, хвастается тем, что они «не содержат BPA». Напротив, и Канада, и Европейский Союз полностью запретили использование BPA в детских товарах.
Потенциальные вредные эффекты BPA были изучены как на животных моделях, так и на людях и включают большое количество различных последствий для здоровья, таких как задержка развития и болезни.Например, пренатальное воздействие BPA в течение первого триместра беременности человека может быть связано с хрипом и агрессивным поведением в детстве. Взрослые, подвергшиеся воздействию высоких уровней BPA, могут испытывать нарушение передачи сигналов щитовидной железы и мужскую сексуальную дисфункцию. Воздействие BPA во время пренатального или послеродового периода развития на животных моделях, как было обнаружено, вызывает задержки в неврологии, изменения в структуре и функции мозга, сексуальную дисфункцию, астму и повышенный риск множественного рака.Исследования in vitro также показали, что воздействие BPA вызывает молекулярные изменения, которые инициируют развитие рака груди, простаты и мозга. Хотя эти исследования выявили причастность BPA к многочисленным последствиям для здоровья, некоторые эксперты предупреждают, что некоторые из этих исследований могут быть ошибочными и что необходимо провести дополнительные исследования. Тем временем FDA рекомендует потребителям принять меры для ограничения воздействия BPA. Помимо покупки продуктов в упаковке, не содержащей бисфенола А, потребители должны избегать переноски или хранения продуктов или жидкостей в бутылках с кодом утилизации 3 или 7.Продукты и жидкости не следует разогревать в микроволновой печи в любом виде пластика: используйте бумагу, стекло или керамику.
Обзор главы
Гормоны получают из аминокислот или липидов. Аминные гормоны происходят из аминокислот триптофана или тирозина. Гормоны с более крупными аминокислотами включают пептиды и белковые гормоны. Стероидные гормоны получают из холестерина.
Стероидные гормоны и гормоны щитовидной железы растворимы в жирах. Все остальные гормоны, производные от аминокислот, растворимы в воде.Гидрофобные гормоны способны диффундировать через мембрану и взаимодействовать с внутриклеточным рецептором. Напротив, гидрофильные гормоны должны взаимодействовать с рецепторами клеточных мембран. Обычно они связаны с G-белком, который активируется, когда гормон связывает рецептор. Это инициирует сигнальный каскад, в котором участвует второй мессенджер, такой как циклический аденозинмонофосфат (цАМФ). Системы вторичного обмена сообщениями значительно усиливают гормональный сигнал, создавая более широкий, более эффективный и быстрый ответ.
Гормоны высвобождаются при стимуляции химического или нервного происхождения. Регулирование высвобождения гормонов в первую очередь достигается за счет отрицательной обратной связи. Различные раздражители могут вызывать выброс гормонов, но есть три основных типа. Гуморальные стимулы — это изменения уровней ионов или питательных веществ в крови. Гормональные стимулы — это изменения уровня гормонов, которые инициируют или подавляют секрецию другого гормона. Наконец, нервный стимул возникает, когда нервный импульс вызывает секрецию или ингибирование гормона.
Самопроверка
Ответьте на вопросы ниже, чтобы увидеть, насколько хорошо вы понимаете темы, затронутые в предыдущем разделе.
Вопросы о критическом мышлении
- 1. Сравните и сопоставьте сигнальные события, связанные с вторичными посредниками cAMP и IP 3 .
- 2. Опишите механизм гормонального ответа в результате связывания гормона с внутриклеточным рецептором.
Показать ответы
- 1. При передаче сигналов как цАМФ, так и IP 3 –кальций гормон связывается с рецептором гормона клеточной мембраны, который связан с G-белком.Белок G активируется при связывании гормона. В случае передачи сигналов цАМФ активированный белок G активирует аденилатциклазу, которая вызывает превращение АТФ в цАМФ. Этот второй мессенджер может затем инициировать другие сигнальные события, такие как каскад фосфорилирования. В случае передачи сигналов IP 3 –calcium активированный белок G активирует фосфолипазу C, которая расщепляет фосфолипидное соединение мембраны на DAG и IP 3 . IP 3 вызывает высвобождение кальция, другого вторичного мессенджера, из внутриклеточных хранилищ.Это вызывает дальнейшие сигнальные события.
- 2. Рецептор внутриклеточного гормона находится внутри клетки. Гидрофобный гормон диффундирует через клеточную мембрану и связывается с рецептором внутриклеточного гормона, который может находиться в цитозоле или в ядре клетки. Этот гормон-рецепторный комплекс связывается с сегментом ДНК. Это инициирует транскрипцию целевого гена, конечным результатом которой является сборка белка и гормональный ответ.
Глоссарий
аденилциклаза: мембраносвязанный фермент, который превращает АТФ в циклический АМФ, создавая цАМФ в результате активации G-белка
циклический аденозинмонофосфат (цАМФ): второй мессенджер, который в ответ на активацию аденилатциклазы запускает каскад фосфорилирования
диацилглицерин (DAG): молекула, которая, как цАМФ, активирует протеинкиназы, тем самым инициируя каскад фосфорилирования
подавление: уменьшение количества рецепторов гормонов, как правило, в ответ на хронически чрезмерный уровень гормона
первый мессенджер: гормон, который связывается с рецептором гормона клеточной мембраны и запускает активацию системы вторичного мессенджера
G-белок: белок , связанный с рецептором гормона клеточной мембраны, который инициирует следующий этап в системе вторичного мессенджера после активации связыванием гормон-рецептор
рецептор гормона: белок внутри клетки или на клеточной мембране, который связывает гормон, инициируя ответ клетки-мишени
инозитолтрифосфат (IP 3 ): молекула , которая инициирует высвобождение ионов кальция из внутриклеточных хранилищ
фосфодиэстераза (PDE): цитозольный фермент, который дезактивирует и расщепляет цАМФ
каскад фосфорилирования: событие передачи сигнала , при котором несколько протеинкиназ фосфорилируют следующий белковый субстрат путем переноса фосфатной группы с АТФ на белок
протеинкиназа: фермент , который инициирует каскад фосфорилирования при активации
второй мессенджер: молекула , которая инициирует сигнальный каскад в ответ на связывание гормона на рецепторе клеточной мембраны и активацию G-белка
повышающая регуляция: увеличение количества рецепторов гормонов, обычно в ответ на хронически сниженный уровень гормона
Белковые гормоны и иммунитет
Brain Behav Immun.Авторская рукопись; доступно в PMC 2008 1 мая.
Опубликован в окончательной отредактированной форме как:
PMCID: PMC1894894
NIHMSID: NIHMS22061
Кейт У. Келли
b Лаборатория иммунофизиологии, Отделение иммунофизиологии наук о животных, 227 Лаборатория Эдварда Р. Мэдигана, 1201 Вест Грегори Драйв, Урбана, Иллинойс 61801 США
Дуглас А. Вейгент
c Университет Алабамы в Бирмингеме, факультет физиологии и биофизики, Университетский бульвар 1918 г., MCLM 894, Бирмингем, AL 35294 USA
Ron Kooijman
d Ron Kooijman, Брюссельский свободный университет (VUB), кафедра фармакологии, здание D, комната
D201B, Laarbeeklaan 103, Бельгия B-1090 Jette, Бельгия
b Лаборатория иммунофизиологии, интегративной иммунологии и программы поведения, Департамент наук о животных, 227 Лаборатория Эдварда Р. Мэдигана, 1201 West Gregory Drive, Urbana, IL 61801 USA
c Университет Алабамы в Бирмингеме, факультет физиологии и биофизики, 1918 University Blvd., MCLM 894, Бирмингем, AL 35294 USA
d Рон Койман, Брюссельский свободный университет (VUB), Фармакологический факультет, здание D, кабинет
D201B, Laarbeeklaan 103, Бельгия B-1090 Jette, Бельгия
a Авторы внесли равный вклад в подготовку этой рукописи.
Окончательная отредактированная версия этой статьи издателя доступна на сайте Brain Behav Immun. См. Другие статьи в PMC, в которых цитируется опубликованная статья.
Abstract
Ряд наблюдений и открытий за последние 20 лет подтверждают концепцию важных физиологических взаимодействий между эндокринной и иммунной системами.Самый известный путь передачи информации от иммунной системы к нейроэндокринной системе — гуморальный в форме цитокинов, хотя нервная передача через афферентный блуждающий нерв также хорошо документирована. В другом направлении эфферентные сигналы от нервной системы к иммунной системе передаются как нейроэндокринной, так и вегетативной нервной системами. Коммуникация возможна, потому что нервная и иммунная системы имеют общий биохимический язык, включающий общие лиганды и рецепторы, включая нейротрансмиттеры, нейропептиды, факторы роста, нейроэндокринные гормоны и цитокины.Это означает, что мозг функционирует как иммунорегулирующий орган, участвующий в иммунных ответах. Накоплено множество доказательств, подтверждающих, что гормоны, секретируемые нейроэндокринной системой, играют важную роль в коммуникации и регуляции клеток иммунной системы. Среди белковых гормонов это наиболее четко задокументировано для пролактина (PRL), гормона роста (GH) и инсулиноподобного фактора роста-1 (IGF-I), но значительное влияние на иммунитет тиреотропного гормона (TSH) также оказывает было продемонстрировано.Здесь мы рассматриваем данные, полученные за последние 20 лет, чтобы четко продемонстрировать, что нейроэндокринные белковые гормоны влияют на иммунитет и что иммунные процессы влияют на нейроэндокринную систему. Новые результаты подчеркивают ранее не обнаруженный путь связи между иммунной и эндокринной системами, который, как теперь известно, происходит на клеточном уровне. Эта система связи активируется, когда воспалительные процессы, вызванные провоспалительными цитокинами, противодействуют функции различных гормонов, что затем вызывает эндокринную резистентность как на периферии, так и в головном мозге.Гомеостаз при воспалении достигается за счет баланса между цитокинами и эндокринными гормонами.
Введение
Мозг может управлять ответами лейкоцитов через вегетативную нервную систему, а также через эндокринную систему. Нейроэндокринные взаимодействия преимущественно происходят на уровне гипоталамо-гипофизарной оси, поэтому гормоны гипофиза могут явно опосредовать влияние центральной нервной системы на иммунные реакции. Однако гормоны гипофиза могут также влиять на иммунную систему независимо от центральной нервной системы.Это происходит через аутокринные или паракринные взаимодействия внутри иммунной системы и в результате регуляции гормонов гипофиза цитокинами, которые действуют непосредственно на уровне гипофиза. Ярким примером является обильная экспрессия рецепторов IL-1 типа I и II, в частности, на GH-секретирующих клетках передней доли гипофиза мыши (French et al., 1996).
Пролактин (ПРЛ) является членом класса родственных белковых гормонов, который включает ПРЛ и плацентарные лактогены (ПЛ). Это плейотропный гормон, который в основном вырабатывается гипофизом.Секреция ПРЛ в гипофизе находится под отрицательным контролем дофамина, но также может стимулироваться рилизинг-гормоном тиротропина. Хотя основными функциями ПРЛ являются развитие молочных желез, инициация и поддержание лактации, рецепторы ПРЛ (ПРЛР) широко распространены во многих различных тканях. Тот факт, что ПРЛ выполняет множество различных функций, согласуется с экспрессией ПРЛ во внегипофизарных тканях, существованием нескольких молекулярных вариантов ПРЛ с разной активностью и тканеспецифической регуляцией ПРЛ.
PRLR принадлежит к большому, гетерогенному семейству цитокин-гематопоэтических рецепторов, известному как семейство цитокиновых рецепторов класса I. Между рецептором гормона роста (GHR) и PRLR существует сильная гомология. Первичная структурная гомология между GHR или PRLR и другими членами этого семейства ограничена двумя внеклеточными доменами из 100 аминокислот и внутриклеточными мотивами, известными как боксы. Грызуны экспрессируют три изоформы PRLR, а люди — четыре. Одна из этих изоформ не может передавать сигналы, что позволяет предположить, что она может действовать как рецептор-ловушка.PRLR, как известно, связывает только PRL, плацентарные лактогены и высокие концентрации GH приматов. В самом деле, праймирующее действие GH на нейтрофилы человека опосредуется не GHR, а скорее PRLR (Fu et al., 1992). Гомодимеризация PRLR через два разных сайта на PRL приводит к последующей активации ассоциированных киназ, которые фосфорилируют нижестоящие мишени. Большинство исследований передачи сигналов сосредоточено на пути передачи сигналов JAK-STAT, который используется всеми рецепторами гемопоэтических цитокинов. Связывание PRL с его рецептором преимущественно вызывает активацию JAK-2, которая приводит к фосфорилированию тирозина в PRLR, что позволяет рекрутировать латентные цитоплазматические факторы транскрипции (STAT).Активация JAK-2 с помощью ПРЛ в основном активирует STAT-5 и в меньшей степени STAT-1 и -3. Обычное использование пути JAK-STAT ПРЛ, ГР и другими цитокинами, вероятно, приводит к избыточности их действий.
GH экспрессируется в первую очередь в гипофизе, но также и клетками иммунной системы, положительно регулируется высвобождающим гормоном гормона роста (GHRH) и отрицательно регулируется соматостатином в гипофизе. Основной эффект GH заключается в стимулировании постнатального продольного роста за счет взаимодействия с GHR, который также является членом семейства рецепторов цитокинов класса I.Связывание GH с GHR вызывает димеризацию рецептора и активацию белков JAK2 и STAT. GH наиболее известен тем, что регулирует метаболизм углеводов, липидов, азота и минералов. Многие из действий GH опосредуются индукцией экспрессии инсулиноподобного фактора роста-I (IGF-I) на локальных участках, но основным источником циркулирующего IGF-I является печень. В последние 20 лет постоянно развивается идея о том, что GH и IGF-I также играют роль в развитии, поддержании и функционировании иммунной системы.Обзор активации рецептора IGF-I (IGF-1R) появился недавно (McCusker et al., 2006).
Тиреотропный гормон (ТТГ) — это пептидный гормон, действующий через типичный серпентиновый рецептор, связанный с G-белком, для стимуляции выработки тироксина (Т4) щитовидной железой. Т4 является прогормоном Т3, который регулирует потребление кислорода, липидный и углеводный обмен, и необходим для нормального роста и созревания. Т3 проникает в клетку и связывается с ядерным рецептором, который затем действует как фактор транскрипции, связываясь с элементами ответа на тироксин в промоторной области генов-мишеней, включая ТТГ и GH.
До 1987 года
Первое указание на то, что гормоны гипофиза играют роль в лимфопоэзе и эффекторных функциях лейкоцитов, было получено в экспериментах на грызунах с дефицитом гипофиза, таких как гипофизэктомированные крысы и карликовые мыши Снелл-Бэгг. Гипофизэктомия приводит к комбинированному дефициту всех гормонов гипофиза, включая гормоны передней доли гипофиза (TSH, GH, PRL, фолликулостимулирующий гормон, лютеинизирующий гормон и пептиды, производные POMC, такие как адренокортикопический гормон (ACTH) и α-меланоцит-стимулирующий гормон ( α-MSH)) и гормоны, полученные из задней доли (окситоцин и вазопрессин).У гипофизэктомированных крыс нарушение развития различных отделов иммунной системы, а также клеточные и гуморальные иммунные ответы могут быть восстановлены путем введения либо ПРЛ, либо ГР (обзор Gala, 1991; Kelley, 1989; Kelley et al., 1992).
У мышей Snell-Bagg-dwarf наблюдается дефицит гормонов передней доли гипофиза ПРЛ, ГР и ТТГ из-за точечной мутации фактора транскрипции гипофиза Pit-1. Экспрессия этих гормонов, а также выработка лактотропов, соматотропов и тиреотропов зависит от Pit-1.Следовательно, иммунологические дефекты у этих мышей могут быть вызваны дефицитом ПРЛ, ГР или ТТГ. Однако важным преимуществом этой модели на животных перед гипофизэктомией является то, что ось АКТГ-надпочечники, которая отвечает за подавление воспаления за счет синтеза и высвобождения эндогенных глюкокортикоидов надпочечников, остается неизменной. Было показано, что все три белковых гормона способствуют, по крайней мере частично, восстановлению клеточного истощения в различных отделах иммунной системы (Gala, 1991; Kelley et al., 1992; Коойман и др., 1996). Хотя в некоторых исследованиях ПРЛ, ГР и Т4 способны восстанавливать гуморальные и клеточные иммунные ответы (Gala, 1991), в других были обнаружены различные эффекты ПРЛ и ГР. Например, лечение карликовых мышей Snell-Bagg ПРЛ усиливает индуцированную антигеном пролиферацию Т-клеток, которая не происходит после лечения гормоном роста, тогда как только гормон роста способен обратить вспять снижение клеточности тимуса (Murphy et al., 1993).
Поскольку продукция ПРЛ гипофизом находится под строгим ингибирующим дофаминергическим контролем, специфическое снижение уровней ПРЛ в сыворотке может быть вызвано дофаминергическим агонистом D2 бромокриптином.Как правило, введение бромокриптина оказывает иммунодепрессивное действие. У мышей он снижает продукцию IFNγ и Т-клеточное уничтожение микроорганизмов макрофагами. Важно отметить, что этот эффект отменяется введением ПРЛ (Gala, 1991; Kelley et al., 1992). У крыс бромокриптин подавляет выработку антител к эритроцитам барана. Примечательно, что негативные эффекты бромокриптина могут быть восстановлены либо ПРЛ, либо ГР (Berczi, 1992), что указывает на то, что их роль в иммунной системе может быть избыточной.
На возможность прямого воздействия ПРЛ на иммунную систему указывает обнаружение высокоаффинных ПРЛР на человеческих моноцитах, Т-клетках, В-клетках (Russell et al., 1985) и NK-клетках (Matera et al., 1988). Сообщалось о нескольких эффектах ПРЛ in vitro на лейкоциты грызунов или человека. Например, ПРЛ запускает окислительный взрыв в гранулоцитах и стимулирует пролиферацию лимфоцитов, активность NK-клеток и экспрессию рецептора IL-2 (Berczi, 1992; Kelley et al., 1992). Однако результаты на первичных клетках не всегда согласуются.Иногда высокие концентрации ПРЛ и определенные эффекты ПРЛ in vitro зависят от гормонального статуса животного, от которого получены клетки (Berczi, 1992). Эти наблюдения в сочетании с вышеупомянутыми данными in vivo привели к гипотезе о том, что ПРЛ играет стимулирующую роль в иммунной системе.
Идея о том, что GH также влияет на иммунную систему, возникла до 1987 года из результатов исследований у животных, подвергшихся гипофизэктомии, а также у людей или животных с дефицитом гормонов гипофиза (Gala, 1991).В целом, у гипофизэктомированных грызунов наблюдались дефекты как гуморального, так и клеточно-опосредованного иммунитета, включая снижение реакции антител и увеличение выживаемости трансплантата. Аналогичные результаты были получены на линиях карликовых мышей Snell-Bagg и Ames, у которых отсутствуют как GH, так и PRL. Исследования замещения гормона GH оценили специфичность его воздействия на иммунный ответ и показали, что GH улучшает иммунологический дефицит у гипофизэктомированных или карликовых животных. Таким образом, очень ранние исследования показали, что GH может играть важную роль в регуляции иммунного ответа.Специфичность вводила в заблуждение, поскольку в некоторых случаях PRL и GH оказывались избыточными при восстановлении иммунодефицита, в то время как в других ситуациях был активен только один из гормонов. Чтобы разобраться в этой путанице, после 1986 года были предприняты более строгие попытки идентифицировать специфические рецепторы на клетках иммунной системы и проанализировать их прямое воздействие на клетки иммунной системы.
1987-1997
В течение этого десятилетия были получены дополнительные доказательства in vitro роли ПРЛ в иммунной системе (Matera et al., 1992). Прежде всего, стало ясно, что иммунная система грызунов, а также человека продуцирует ПРЛ, ГР и ИФР-I (Kooijman et al., 1996). Используя антитела против ПРЛ человека и грызунов, было показано, что пролиферация пролиферации лейкоцитов является функциональной, поскольку эти антитела ингибируют пролиферацию лимфоцитов (Berczi, 1992). Хотя в клетках иммунной системы было обнаружено несколько иммунореактивных вариантов ПРЛ, в конечном итоге было установлено, что лейкоциты продуцируют добросовестный гипофизарно-подобный ПРЛ с нормальной биологической активностью.Наблюдение за тем, что у людей внегипофизарная экспрессия ПРЛ в плаценте, а также в иммунной системе дифференциально регулируется на молекулярном уровне посредством расположенного выше нефизарного промотора (Berwaer et al., 1994; Gellersen et al., 1994), дополнительная поддержка особой роли ПРЛ в иммунной системе.
Было показано, что экспрессия гена PRL в лимфоидных клетках регулируется независимо от фактора транскрипции гипофиза Pit-1. Из-за присутствия 5’-некодирующего экзона (экзон 1a) внегипофизарный транскрипт гена PRL на 150 нуклеотидов длиннее, чем его гипофизарный аналог.Однако пептид ПРЛ, полученный из этой мРНК, неотличим от пептида гипофизарного происхождения. В результате ПРЛ больше не может рассматриваться как иммуностимулирующий эндокринный фактор, но также как аутокринный или паракринный иммунорегулирующий цитокин. Действительно, ПРЛ в иммунных клетках человека может регулироваться цитокинами и другими иммуноспецифическими агонистами.
Ранние исследования показали роль оси гипофиз-щитовидная железа в иммунной системе, продемонстрировав, что обработка Т4 карликовых мышей Snell приводит к увеличению клеточности костного мозга (Pierpaoli et al., 1969). Однако точное влияние Т4 на иммунную систему стало ясно только в конце девяностых, когда стало доступно больше моделей на животных и сложные методы для обнаружения различных стадий развития клеток костного мозга. Путем проточного цитометрического анализа с использованием антител, специфичных к клонам и стадиям, было показано, что карликовые мыши Snell-Bagg обнаруживают дефицит CD45R + / поверхностных IgM-пре-B-клеток костного мозга (Murphy et al., 1992). Более подробный анализ был проведен путем изучения этого явления на мышах с дефицитом различных гормонов, включая карликов Снелла-Бэгга, нокаутов IGF-I, освещенных / освещенных карликовых мышей с мутацией рецептора GH-рилизинг-гормона (GHRHR) и мышей с гипертиреозом, которые плохо реагируют на ТТГ.Было показано, что только карлики Snell-Bagg и мыши с гипотиреозом показали описанное истощение пре-В-клеток (Dorshkind & Horseman, 2000). Более того, дефекты у карликовых мышей Snell-Bagg могут быть восстановлены обработкой T4. Эти результаты предполагают роль оси гипофиз-щитовидная железа в развитии В-клеток мыши. Однако гуморальный иммунный ответ, а также клеточный иммунный ответ не пострадали. Вместо этого результаты показали, что врожденный иммунный ответ был нарушен (Dorshkind and Horseman, 2000).
Хотя отчет еще в 1973 г. указывал, что лимфоциты имеют рецепторы с высоким сродством к GH, потребовалось еще по крайней мере 12 лет, чтобы присутствие GHR на клетках иммунной системы стало общепринятым. Были изучены как первичные лимфоциты, так и линии лимфоидных клеток, и результаты показали, что на клетку приходится 4 000-20 000 сайтов связывания с высоким сродством к GH. GH, связанный с этими сайтами, может частично вытесняться высокими концентрациями PRL. На присутствие специфических GHR также указывают биологические исследования in vitro (Kelley et al., 1992). Было показано, что обработка фагоцитов GH увеличивает содержание лизосомальных ферментов и продукцию супероксид-анионов. Однако следует прояснить, что увеличение продукции супероксида в фагоцитарных клетках, обработанных GH, не может быть обнаружено, если клетки не обрабатываются запускающим стимулом, таким как опсонизированный зимозан (Kelley, 1989). Следовательно, фагоцитарные клетки, подвергшиеся воздействию GH, не выделяют спонтанно супероксид-анионы. Оказалось, что GH может влиять на многие типы клеток иммунной системы.Впоследствии стало ясно, что некоторые из этих эффектов GH были косвенно вызваны действием IGF-I. Например, культура первичных клеток костного мозга человека, а также клеток эритролейкемии с GH показала усиление образования эритоидных колоний, которое может блокироваться антителами к IGF1R. Было также показано, что GH может увеличивать пролиферацию нормальных и лейкемических Т-клеток человека, а также образование цитотоксических Т-клеток.
После этих первоначальных результатов было проведено значительное количество исследований и собраны дополнительные доказательства, подтверждающие роль GH в регуляции активности иммунной системы (Kooijman et al., 1996). Кроме того, новые знания, полученные в течение этого десятилетия о кристаллической структуре GH, димеризации и механизмах внутриклеточной передачи сигналов, в первую очередь из других клеточных систем, значительно усложнили понимание GH и его роли в иммунорегуляции. Открытие GHR, связанных с плазматической мембраной, ядерных GHR и киназ Януса предполагает новые ядерные роли в дополнение к их цитоплазматической активности.
Значительный объем работ появился на GH-связывающем белке (GHBP), о котором впервые было сообщено в 1964 году и выделенном из сыворотки беременных мышей в 1977 году.Было показано, что как альтернативный сплайсинг мРНК, так и ограниченный протеолиз, в зависимости от вида, генерируют GHBP, который соответствует внеклеточному домену GHR. Лимфоциты IM-9 используют протеолиз в образовании GHBP, который, по-видимому, проявляет антагонистические свойства in vitro и агонистические эффекты in vivo. Основные достижения в десятилетие после 1986 года были связаны с механизмом GH на клеточном уровне. Таким образом, мы узнали, что GH способствует быстрой ассоциации GHR с тирозинкиназой JAK2.Фосфорилирование и активация комплексов JAK2 / GHR, в свою очередь, связывает и фосфорилирует ряд белков, включая сигнальные преобразователи и активаторы транскрипции (STATS), субстраты инсулинового рецептора (IRS) -1 и -2 и белки Shc, которые расположены выше RAS и протеинкиназы, активируемые митогеном (MAPK) (Argetsinger and Carter-Su, 1996).
В начале 1980-х было показано, что клетки иммунной системы продуцируют адренокортикотропин, эндорфины, белки тиреотропного гормона, а также мРНК, связанную с пролактином / GH, в митоген-стимулированных лимфоцитах (Weigent and Blalock, 2007).Наши собственные данные о продукции GH клетками иммунной системы ясно показали, что лейкоциты содержат транскрипт мРНК и молекулы GH, идентичные гипофизарному GH с точки зрения антигенности и молекулярной массы (Weigent, 1996). Эта работа была подтверждена и воспроизведена на ряде линий лимфоидных клеток и первичных лимфоидных тканях у нескольких различных видов животных. В нашей модельной системе активация IGF-I и IGF-1R эндогенным GH была критическим компонентом антиапоптотической активности GH.Совсем недавно стало ясно, что эффекты эндогенного GH на рост клеток являются сложными, поскольку индукция IGF-IIR и TGF-β1 также наблюдается в T-клетках EL4, что можно рассматривать как ограничение клеточной пролиферации (Farmer and Weigent , 2007). Таким образом, эндогенный GH может влиять на выживание Т-клеток во время активации и / или поддержания клеток памяти. Все эти новости могут не быть хорошими. Эти же свойства, приобретенные некоторыми Т-клетками, могут способствовать аутоиммунитету, в то время как опухолевые клетки могут показывать повышенную выживаемость.Последующие исследования установили, что клетки селезенки крысы и лимфоциты человека синтезируют и секретируют рилизинг-гормон гормона роста (GHRH) и IGF-I и экспрессируют их соответствующие рецепторы (обзор Farmer and Weigent, 2007). Преобладающим типом лейкоцитов, которые синтезируют и секретируют IGF-I, являются макрофаги, включая микроглию (Arkins et al, 1993). Ряд сообщений других авторов об экзогенном GH, действующем через GHR, а наш собственный — на эндогенный GH из клеточной линии, лишенной GHR, предполагает важную взаимосвязь между GH и регуляцией гибели клеток.В течение этого десятилетия дальнейшие исследования показали, что обработка клеток иммунной системы GH модулирует гуморальные и клеточные иммунные функции, включая секрецию иммуноглобулина B-клетками, секрецию тимулина эпителиальными клетками тимуса, активность NK-клеток, фагоцитоз, окислительный взрыв и убивающую способность нейтрофилы и макрофаги (Kooijman et al., 1996; Weigent, 1996). Вероятно, что по крайней мере вышестоящие компоненты регуляции GH как в Т-, так и в В-клетках схожи в том, что участвуют члены семейства JAK / STAT, но требуется гораздо больше работы для определения конкретных деталей для каждого типа лейкоцитов и их функций.Однако, несмотря на это, у пациентов с дефицитом GH не было обнаружено клинически значимого иммунодефицита, что вызывает разногласия относительно физиологического значения эффектов GH в иммунной системе. Неспособность обнаружить значительный иммунодефицит у пациентов с дефицитом GH вполне может быть из-за нормального количества PRL у этих субъектов, особенно потому, что GH человека активирует PRLR на нейтрофилах человека, а PRL обладает значительными иммунорегуляторными свойствами с GH.
1997-2007
До начала века считалось, что физиологические концентрации IGF-I не имеют серьезных неблагоприятных последствий для организма.Однако становится все более очевидным, что концентрация циркулирующего IGF-I обратно пропорциональна продолжительности жизни и положительно коррелирует с прогрессированием развития нескольких различных типов опухолей. Мы показали, что IGF-I действует в циклических клетках через субстрат-1 рецептора инсулина, фосфатидилинозитол-3′-киназу (PI3-K), AKT и циклин-зависимую киназу 2 (CDK2), а первый и последний белки ингибируются TNFα. (Шен и др., 2004). Недавно было показано, что CDK2 фосфорилирует фактор транскрипции Forkhead box O (FOXO), который активирует ряд генов смерти (Huang et al, 2006).Это фосфорилирование FOXO по серину заставляет его перемещаться из ядра в цитоплазму, где FOXO неактивен. По пока неизвестным причинам, инактивация IGF-I FOXO способствует выживанию клеток, но в то же время, по-видимому, связана с сокращением продолжительности жизни (обзор Kenyon, 2005). Более того, интригует парадокс, заключающийся в том, что IGF-I, который абсолютно необходим для роста и развития, обратно коррелирует с продолжительностью жизни всего организма и положительно коррелирует с прогрессированием многих типов рака.Было высказано предположение, что антагонистическая плейотрофия может объяснить эти находки, согласно которым стоимость более продолжительной жизни заключается в снижении как периферических, так и центральных физиологических функций (Sonntag et al, 2005). Эта гипотеза может объяснить, почему было идентифицировано так много механизмов, которые регулируют активность IGF-I, включая IGF-1R, IGF-2R, рецептор инсулина и шесть белков, связывающих IGF с высоким сродством. Также важно отметить, что почти все мыши с нулевой мутацией в IGF-1R умирают вскоре после рождения, а мутантные мыши с дефицитом IGF-I умирают перинатально.Таким образом, долгосрочное влияние потери IGF-I на иммунные реакции остается неизвестным. Эти коллективные соображения, наряду с отсутствием серьезных иммунологических нарушений у пациентов с дефицитом GH или PRL, ограничили приток новых исследователей и поддержку исследований и привели к медленному прогрессу в течение этого десятилетия.
Роль пролактина, происходящего из лейкоцитов, как аутокринного или паракринного фактора подтверждается недавними наблюдениями, что пролактин регулирует продукцию цитокинов (Dimitrov et al., 2004) и что экспрессия ПРЛ в Т-клетках регулируется IL-2, IL-4. и IL-1β (Gerlo et al., 2005). В конце девяностых годов эксперименты двух разных групп с использованием мышей с нокаутом PRL (Horseman et al., 1997) и PRLR (Bouchard et al., 1999), соответственно, показали, что ни PRL, ни PRLR не требуются для нормального развития или функции иммунная система мышей. Однако иммуномодулирующее действие ПРЛ in vitro как у грызунов, так и у людей было установлено многими различными группами. Вероятно, что избыточность эффектов PRL, GH, IGF-I или специфических цитокинов ответственна за отсутствие иммунных нарушений у мышей с дефицитом PRL или PRLR.
Сравнить роль ПРЛ в иммунной системе у грызунов с ролью человека сложно, поскольку альтернативный внегипофизарный промотор у грызунов не обнаружен. Нельзя исключить, что разработка альтернативной системы молекулярной регуляции экспрессии ПРЛ в иммунной системе человека привела к развитию специфических иммунологических функций для ПРЛ, происходящих из лейкоцитов, которые отсутствуют у грызунов и других неприматов, не имеющих вышестоящий промотор (Gerlo et al., 2006). Например, отсутствие иммунологических нарушений у женщин с дефицитом ПРЛ и отсутствием ПРЛ гипофиза не означает, что ПРЛ не требуется для функционирования иммунной системы. Важно отметить, что в лейкоцитах, а также в плаценте роль экспрессии PRL под контролем альтернативного промотора у людей требует дальнейшего внимания в течение следующего десятилетия (Gerlo et al., 2006).
Наблюдение за тем, что гиперпролактинемия встречается у части пациентов с аутоиммунными заболеваниями, такими как ревматоидный артрит и системная красная волчанка (СКВ), привлекло большое внимание к предполагаемой роли ПРЛ в аутоиммунитете.Предполагается, что при ревматоидном артрите паракринный ПРЛ, продуцируемый синовиальными Т-клетками, играет роль в патофизиологии заболевания (Nagafuchi et al., 1999). Тем не менее, большинство исследований роли ПРЛ в аутоиммунных заболеваниях посвящено СКВ. ПРЛ усугубляет СКВ у новозеландских / черных мышей и увеличивает выживаемость аутореактивных В-клеток в чувствительных линиях (Peeva et al., 2004). Поскольку гиперпролактенемия наблюдается у 20% пациентов с СКВ, было высказано предположение, что роль ПРЛ в СКВ у людей зависит от генетического фона.Недавние наблюдения, показывающие, что ПРЛ влияет на репертуар В-клеток мышей (Peeva et al., 2004), требуют дальнейших исследований для выяснения роли ПРЛ в СКВ и других аутоиммунных нарушениях.
Последние 10 лет предоставили дополнительные клеточные и молекулярные детали действия GH, а также важные достижения в нашем понимании GH и иммунитета благодаря использованию трансгенных и нокаутных животных (Savino et al., 2003). Таким образом, трансгенные мыши со сверхэкспрессией GH или GHRH демонстрируют чрезмерный рост тимуса и селезенки и демонстрируют усиление митогенных ответов на конканавалин А.Усиливающий эффект GH на тимоциты первоначально был зарегистрирован в результате наблюдений на старых крысах, которым вводили сингенные имплантаты GH 3 клеток (Kelley et al, 1986). Высокие уровни тимулина в сыворотке наблюдались у GH-трансгенных мышей, тогда как низкие уровни в сыворотке наблюдались у мышей с нокаутом GHR. Способность GH модулировать экспорт тимоцитов предполагает, что он может быть полезен в качестве терапевтического агента при иммунодефиците Т-клеток. Терапия для пожилых людей, больных СПИДом и пациентов с трансплантацией предлагается благодаря иммуностимулирующему эффекту пероральных стимуляторов секреции GH.В течение последнего десятилетия клинические испытания с участием стимуляторов GH и GH, особенно у пациентов со СПИДом, предполагают, что они могут быть полезными. Только более обширные клинические испытания могут подтвердить эффективность использования стимуляторов секреции гормона роста или гормона роста в качестве иммунотерапевтических средств. Однако следует отметить, что в некоторых случаях результаты с GH не были впечатляющими, особенно во время воспалительных состояний. Скорее всего, это результат TNF-α-индуцированной устойчивости к IGF-I, которая возникает у пациентов со СПИДом (Kelley, 2004).
Важные новые технологии в геномной биологии, такие как микроматричный анализ, только начали применяться к различным тканям животных, получавших GH, и можно ожидать, что вскоре они будут применены к клеткам иммунной системы.В будущих экспериментах на животных моделях старения, аутоиммунитета и рака ДНК и белковые массивы будут идентифицировать гены с точки зрения их регуляции GH. В настоящее время известно, что GHBP находится внутриклеточно и может перемещаться в ядро после стимуляции лигандом и функционировать как мощный усилитель транскрипции, опосредованной STAT-5. Было показано, что GH способствует полимеризации тубулина, стабилизируя сеть микротрубочек, которая может защищать клетки от апоптоза. Действительно, наше понимание эндогенного GH остается очень ограниченным.GH, происходящий из лимфоцитов, регулирует чувствительность лимфоидных клеток и выработку IGF-I и является активным участником защиты клеток от апоптоза. GH лимфоцитов стимулирует продукцию интерферона-γ и может подавляться кортизолом и норадреналином, тогда как анализ промотора GH показывает, что белок специфичности 3 (SP3) действует как негативный фактор транскрипции. Ожидается, что в будущих экспериментах будет определен внутриклеточный сайт действия эндогенного GH. Эти новые знания в значительной степени помогут раскрыть механизм действия и обеспечат дальнейшее понимание контроля иммунного ответа за счет местного производства этого гормона.Роль экзогенного и / или эндогенного GH в развитии неоплазии еще не ясна, но предпринимаются усилия для выявления потенциальных патологий, связанных с производством GH. Недавние исследования показывают, что аутокринный или эндогенно продуцируемый GH, но не экзогенный GH, может быть важным промотором онкогенной трансформации (Zhu et al, 2005).
Вариации жилищных условий, которые могут повлиять на уровень как санитарии, так и стресса, также были предложены для объяснения различий в иммунном статусе гипофизарных карликов, о которых сообщали различные группы исследователей (для обзора см. Dorshkind and Horseman, 2000).Эти данные подтверждают старую и хорошо зарекомендовавшую себя концепцию, согласно которой в физиологических условиях ПРЛ, ГР и ИФР-I обычно действуют, чтобы противодействовать эффектам физиологического стресса или стресса окружающей среды (Kelley and Dantzer, 1991). Эта идея привлекательна, поскольку давно известно, что GH и PRL являются гормонами, чувствительными к стрессу. Например, возможно, что и GH, и PRL ответственны за явление, обнаруженное в начале 1980-х годов, которое заключается в том, что сдерживание, тепловой и холодовой стресс усиливают реакции контактной чувствительности к динитофторбензолу (Blecha et al, 1982 a, b).Большинство ранних данных, подтверждающих идею о том, что GH и PRL противодействуют подавляющему эффекту глюкокортикоидов, были описаны в начале 90-х (Kelley and Dantzer, 1991). Эта концепция в принципе аналогична интерферону-γ, обращая подавляющее действие природных и синтетических глюкокортикоидов (Dunham et al, 1990). Действительно, GH улучшает некоторые аспекты иммунного ответа после лечения крыс дексаметазоном in vivo или после хирургического стресса (Hinton et al, 1995). Позже было обнаружено, что целенаправленное нарушение гена PRL нарушает индуцированную митогеном пролиферацию спленоцитов у термически поврежденных мышей, но не у нормальных контрольных животных (Dugan et al., 2002). Подобные открытия привели к клиническому использованию GH для улучшения роста у детей, проходящих долгосрочное лечение глюкокортикоидами, которое увеличивает катаболизм, вызванный его влиянием на синтез и деградацию тканевого белка, после трансплантации печени (Sarna et al, 1996) и уменьшить потерю мышечной массы у истощенных больных СПИДом и раком (обзор Kelley, 2004).
2007 и позже
Идея о том, что GH, PRL и IGF-I взаимодействуют с иммуносупрессивными гормонами, убедительно свидетельствует о том, что существует «улица с двусторонним движением» в гормонально-гормональных взаимодействиях, а также во взаимодействиях гормонально-иммунной системы.То есть эти белковые гормоны не только должны противодействовать катаболическим эффектам глюкокортикоидов, но глюкокортикоиды могут нарушать действие GH, PRL и IGF-I. Например, индуцированная IGF-I активация ERK 1,2 значительно нарушается дексаметазоном, что может быть связано со сниженной экспрессией критического внутриклеточного мессенджера IGF-1R, субстрата-1 рецептора инсулина (Hanssan, Hehenberger and Thoren, 1996). . Именно этот домашний баланс составляет иену и янь иммунорегуляции гормонами.То, что этот баланс играет решающую роль в восприимчивости к инфекционным заболеваниям, было показано увеличением выживаемости крыс как с дефицитом гипофиза, так и без гипофиза при инъекциях GH крысам, инфицированным Salmonella typhimurium (Edwards et al, 1991). Нарушая таким образом гормональный баланс, GH увеличивал выживаемость инфицированных крыс почти в той же степени, что и при использовании интерферона-γ (Edwards et al, 1992).
Имеются новые существенные доказательства, подтверждающие эту концепцию «улицы с двусторонним движением» не только во взаимодействии гормонов с гормонами, но также и во взаимодействиях гормонально-иммунной системы.Эти новые данные указывают на клиническую важность одновременной костимуляции клеток гормонами и цитокинами, как это обычно происходит у животных и людей. Этот баланс нарушается при инфекционных и аутоиммунных заболеваниях. Обычным клиническим результатом этого изменения в соотношении гормон-цитокин является то, что биологический эффект гормона нарушается провоспалительным цитокином, что приводит к эндокринной резистентности. Например, дексаметазон подавляет пролиферацию Т-клеток человека, и этот эффект частично отменяется увеличением соотношения гормонов путем добавления экзогенного GH и IGF-I (Dobashi et al, 2001).К сожалению, мы еще не знаем критических событий, которые происходят внутри пролиферирующих Т-клеток, когда они подвергаются воздействию как IGF-I, так и дексаметазона.
Эксперименты, проводимые в других системах, таких как раковые и мышечные клетки, дают представление о других клетках в других физиологических системах. Например, IGF-I способствует пролиферации клеток рака груди, и этот эффект ингибируется концентрациями в пикограммах как TNFα, так и IL-1 (Shen et al, 2004). Точно так же эти низкие концентрации обоих цитокинов ингибируют способность IGF-I способствовать дифференцировке предшественников мышечных клеток в более дифференцированные мышечные трубки.Это ингибирующее свойство провоспалительных цитокинов, как недавно было показано, связано с активацией внутриклеточного медиатора, JNK (Strle et al, 2006). Действительно, большинство исследований клеточных культур проводится в присутствии не менее 5% фетальной бычьей сыворотки. Эти сыворотки содержат значительные количества IGF-I и IGF-II, а также гораздо меньшие концентрации GH и PRL. Следовательно, многие из биологических активностей провоспалительных цитокинов, о которых сообщалось in vitro, на самом деле могут иметь место, потому что эти провоспалительные цитокины противодействуют эффектам гормонов, содержащихся в сыворотке плода быка.
В настоящее время широко признано, что врожденная иммунная система в головном мозге не только активна и функциональна, но и участвует во всех основных нарушениях центральной нервной системы, включая болезнь Альцгеймера, деменцию, связанную со СПИДом, рассеянный склероз и невропатическую боль. Новые данные указывают на то, что нейровоспаление даже участвует в подавляющих боль свойствах морфина (Watkins et al, 2007). Роль IGF-I интригует, особенно потому, что он синтезируется мононуклеарными фагоцитами, включая микроглию, в головном мозге (Arkins et al, 1993).Синтез IGF-I в головном мозге, по-видимому, не зависит от регуляции GH (Sun et al, 2005). Действительно, несмотря на то, что у карликовых мышей Эймса наблюдается значительное снижение циркуляции GH и IGF-I, у них увеличена продолжительность жизни, а их когнитивные функции сохраняются до позднего возраста. У этих долгоживущих мышей Эймса не наблюдается снижения уровня IGF-I в головном мозге, но вместо этого они выражают повышенные концентрации IGF-I в гиппокампе по сравнению с контрольной группой того же возраста. Это повышение IGF-I в гиппокампе связано с усилением нейрогенеза в зубчатой извилине у этих карликовых мышей (Sun et al, 2005).Вполне возможно, что задержка возрастного снижения когнитивной функции у мышей Эймса связана с их юношескими уровнями IGF-I в мозге. Недавний метаанализ показал, что лечение гормоном роста также улучшает качество жизни, включая те психологические аспекты, которые связаны с клинической депрессией и тревогой, у взрослых с гипопитуитаризмом (Deijen and Arwert, 2006).
В дополнение к улучшению познания и памяти и уменьшению симптомов болезненного поведения, вызванного провоспалительными цитокинами, IGF-I также рассматривается в клинических условиях для лечения заболеваний как центрального (например,g., рассеянный склероз) и периферической (например, диабетической невропатии) нервной системы (см. McCusker et al., 2006). Уже давно известно, что IGF-I является важным нейротрофическим фактором, который защищает от эксайтотоксических / ишемических поражений. Действительно, одним из компонентов здорового образа жизни являются регулярные физические упражнения. Упражнения защищают от различных поражений мозга у грызунов, и эта нейрозащита обеспечивается IGF-I (Carro et al., 2001). Вполне возможно, что увеличение отношения IGF-I к провоспалительным циокинам, вызванное упражнениями, является важным механизмом, лежащим в основе нейропротекции, вызванной физическими упражнениями, и ее противовоспалительными свойствами.
Все эти данные указывают на важность критического баланса между белковыми гормонами и цитокинами иммунной системы (). Роль провоспалительных цитокинов в индукции устойчивости к IGF-I (Kelley, 2004), GH (Lang, Hong-Brown and Frost, 2005), глюкокортикоидам (Pace, Hu and Miller, 2007), рецепторам, связанным с G-белками, таким как катехоламины (Heijnen, 2007) и инсулин (Hotamisligil, 2003) были недавно выделены. Некоторые из этих взаимодействий гормон-цитокиновый рецептор опосредуются членами семейства супрессоров белков передачи сигналов цитокинов (SOCS) (обзор Auernhammer and Melmed, 2001).Например, липополисахарид, IL-1β, TNFα и IL-6 все стимулируют экспрессию SOCS-3 в печени и подавляют передачу сигналов через GHR. Эти молекулярные события, вероятно, являются одними из основных причин, приводящих к устойчивости к гормона роста и замедлению роста детей и животных во время воспалительных состояний. Возникает тема, что это перекрестное взаимодействие между рецепторами белковых гормонов и провоспалительными цитокинами может противодействовать функции гормонов и приводить к эндокринной резистентности. Эти перекрестные помехи представляют собой ранее неизведанный путь связи между иммунной и эндокринной системами.Эти новые открытия подчеркивают важность понимания молекулярных деталей систем связи между иммунной и эндокринной системами. Чтобы восполнить этот пробел, необходимо гораздо более детально изучить внутриклеточные перекрестные помехи, возникающие между гетерогенными рецепторами, которые экспрессируются в одной клетке.
Недавно открытая регуляторная система между эндокринной и иммунной системами. Перекрестные помехи между гормонами и иммунной системой могут противодействовать биологическим функциям гормонов и вызывать эндокринную резистентность, что в конечном итоге влияет на здоровье и благополучие человека.Во время здоровья наблюдается отсутствие воспаления и оптимальный баланс гормонов и провоспалительных цитокинов. Стероидные глюкокортикоидные гормоны надпочечников действуют во многих периферических тканях, подавляя синтез и действие провоспалительных цитокинов. Этот баланс нарушается во время воспалительных состояний как на периферии, так и в головном мозге. Один из механизмов, с помощью которого это происходит, находится на клеточном уровне, посредством чего провоспалительные цитокины противодействуют сигнальным путям рецептора в мышцах, мозговых и раковых клетках.Организм часто отвечает, производя больше гормонов, чтобы преодолеть эту вызванную цитокинами эндокринную резистентность. Таким образом, путь коммуникации между эндокринной и иммунной системой является взаимным, поскольку повышение концентрации гормонов увеличивает соотношение гормон / цитокин. Это повышение количества гормона по сравнению с цитокином частично преодолевает подавляющее действие как глюкокортикоидов, так и провоспалительных цитокинов. Этот сценарий даже происходит в головном мозге, что демонстрируется отменой TNFα-индуцированного болезненного поведения после центрального введения IGF-I.
Благодарности
Мы приносим свои извинения коллегам, чьи работы, часто важные статьи, не могли быть процитированы из-за нехватки места.
Сноски
‡ Это исследование было поддержано грантами от Национальных институтов здравоохранения K.W.K b (MH51569 и AI50442) и D.A.W c (AI41651).
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации.В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копированию, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования. Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Ссылки
- Argetsinger LS, Carter-Su C. Механизм передачи сигналов рецептором гормона роста.Physiol Rev.1996; 76: 1089–1107. [PubMed] [Google Scholar]
- Аркинс С., Ребеиз Н., Бирагин А., Риз Д.Л., Келли К.В. Мышиные макрофаги в большом количестве экспрессируют транскрипты Ea и Eb класса I инсулиноподобного фактора роста I. Эндокринология. 1993; 133: 2334–2343. [PubMed] [Google Scholar]
- Ауэрнхаммер CJ, Мелмед С. Центральная роль SOCS-3 в интеграции нейро-иммуноэндокринного интерфейса. J Clin Invest. 2001; 108: 1735–1740. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Berczi I.Иммунология пролактина. Семинары по репродуктивной эндокринологии. 1992; 10: 196–219. [Google Scholar]
- Бервэр М., Марсьяль Дж. А., Дэвис, JRE. Характеристика вышестоящего промотора, управляющего внегипофизарной экспрессией гена пролактина человека. Мол Эндокринол. 1994; 8: 635–642. [PubMed] [Google Scholar]
- Blecha F, Barry RA, Kelley KW. Стресс-индуцированные изменения гиперчувствительности замедленного типа к SRBC и контактной чувствительности к DNFB у мышей. Proc Soc Exp Biol Med. 1982а; 169: 239–246.[PubMed] [Google Scholar]
- Блеха Ф., Келли К.В., Саттерли Д.Г. Вовлечение надпочечников в проявление гиперчувствительности замедленного типа к SRBC и контактной чувствительности к DNFB у стрессированных мышей. Proc Soc Exp Biol Med. 1982b; 169: 247–252. [PubMed] [Google Scholar]
- Бушар Б., Орманди С.Дж., Ди Санто Дж. П., Келли, Пенсильвания. Развитие и функция иммунной системы у мышей с дефицитом рецепторов пролактина. J Immunol. 1999; 163: 576–582. [PubMed] [Google Scholar]
- Карро Э., Трехо Дж. Л., Бусигина С., Торрес-Алеман И.Циркулирующий инсулиноподобный фактор роста I опосредует защитные эффекты физических упражнений от поражений мозга различной этиологии и анатомии. J Neurosci. 2001; 21: 5678–6684. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Deijen JB, Arwert LI. Нарушение качества жизни у взрослых с гипогипофизом и дефицитом гормона роста: может ли помочь заместительная терапия соматотропином? Лечите Эндокринол. 2006; 5: 243–250. [PubMed] [Google Scholar]
- Димитров С., Ланге Т., Фем Х.Л., Борн Дж. Регуляторная роль пролактина, гормона роста и кортикостероидов в производстве цитокинов Т-клетками человека.Иммунное поведение мозга. 2004. 18: 368–374. [PubMed] [Google Scholar]
- Добаши Х., Сато М., Танаке Т., Токуда М., Ишида Т. Гормон роста восстанавливает индуцированное глюкокортикоидом подавление Т-клеток. FASEB J. 2001; 15: 1861–1863. [PubMed] [Google Scholar]
- Доршкинд К., Всадник Н.Д. Роль пролактина, гормона роста, инсулиноподобного фактора роста-I и гормонов щитовидной железы в развитии и функции лимфоцитов: выводы из генетических моделей гормонов и дефицита рецепторов гормонов. Endocr Rev.2000; 21: 292–312.[PubMed] [Google Scholar]
- Доршкинд К., Всадник Н.Д. Гормоны передней доли гипофиза, стресс и гомеостаз иммунной системы. Биологические исследования. 2001; 23: 288–294. [PubMed] [Google Scholar]
- Дуган А. Л., Теллин О., Бакли Д. Д., Бакли А. Р., Огл К. К., Конь Н. Д.. Влияние дефицита пролактина на миелопоэз и пролиферацию Т-лимфоцитов селезенки у термически травмированных мышей. Эндокринология. 2002; 143: 4147–4151. [PubMed] [Google Scholar]
- Данхэм Д.М., Аркинс С., Эдвардс К.К., III, Данцер Р., Келли К.В.Роль гамма-интерферона в противодействии подавляющим эффектам трансформирующего фактора роста-бета 2 и глюкокортикоидов на выработку фактора некроза опухоли. J Leukoc Biol. 1990; 48: 473–481. [PubMed] [Google Scholar]
- Эдвардс К.К., III, Гиасуддин С.М., Юнгер Л.М., Лоренс Р.М., Аркинс С., Данцер Р., Келли К.В. In vivo введение рекомбинантного гормона роста или интерферона-γ активирует макрофаги: Повышенная устойчивость к экспериментальной инфекции Salmonella typhimurium коррелирует с образованием реактивных кислородных промежуточных продуктов.Инфекция и иммунитет. 1992; 60: 2514–2521. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Эдвардс К.К., III, Юнгер Л.М., Лоренс Р.М., Данцер Р., Келли К.В. Гипофиз необходим для защиты от летального воздействия Salmonella typhimurium. Proc Natl Acad Sci USA. 1991; 88: 2274–2277. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Farmer JT, Weigent DA. Экспрессия рецепторов инсулиноподобного фактора роста-2 на клетках EL4, сверхэкспрессирующих гормон роста. Иммунное поведение мозга.2007; 21 [PubMed] [Google Scholar]
- French RA, Zachary JF, Dantzer R, Frawley LS, Chizzonite R, Parnet P, Kelley KW. Двойная экспрессия рецепторов интерлейкина-1 p80 типа I и p68 типа II на клетках передней доли гипофиза, синтезирующих гормон роста. Эндокринология. 1996; 137: 4027-4036. [PubMed] [Google Scholar]
- Fu YK, Arkins S, Fuh G, Cunningham BC, Wells JA, Fong S, Cronin MJ, Dantzer R, Kelley KW. Гормон роста увеличивает секрецию супероксид-аниона нейтрофилами человека за счет связывания с рецептором пролактина.J Clin Inves. 1992; 89: 451–457. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Gala RR. Пролактин и гормон роста в регуляции иммунной системы. Proc Soc Exp Biol Med. 1991; 198: 513–527. [PubMed] [Google Scholar]
- Геллерсен Б., Кемпф Р., Телгманн Р., ДиМаттия Г.Э. Транскрипция негипофизарного гена пролактина человека не зависит от Pit-1 и по-разному контролируется в лимфоцитах и в строме эндометрия. Мол Эндокринол. 1994; 8: 356–373. [PubMed] [Google Scholar]
- Герло С., Дэвис JRE, Магер Д., Койман Р.Пролактин в человеке: история двух промоутеров. Биологические исследования. 2006; 28 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Герло С., Вердуд П., Хуг-Петерс Е.Л., Койман Р. Модуляция экспрессии пролактина в Т-лимфоцитах человека цитокинами. J Neuroimmunol. 2005. 162: 190–193. [PubMed] [Google Scholar]
- Ханссон А., Хехенбергер К., Торен М. Длительное лечение швейцарских фибробластов 3T3 дексаметазоном ослабляет активацию киназы MAP, индуцированную инсулиноподобным фактором роста-I (IGF-I) Cell Biochem Funct.1996. 14: 121–129. [PubMed] [Google Scholar]
- Heijnen CJ. Рецепторная регуляция в нейроэндокринно-иммунной коммуникации: текущие знания и перспективы на будущее. Мозг, поведение и иммунитет 2007 [PubMed] [Google Scholar]
- Hinton PS, Peterson CA, Lo HC, Yang H, McCarthy D, Ney DM. Инсулиноподобный фактор роста-I усиливает иммунный ответ у крыс, получавших дексаметазон или подвергшихся хирургическому стрессу, содержащихся при полном парентеральном питании. J Paranter Enteral Nutr. 1995; 19: 444–452. [PubMed] [Google Scholar]
- Horseman ND, Zhao W., Montecino-Rodriguez E, Tanaka M, Nakashima K, Engle SJ, Smith F, Markoff E, Dorshkind K.Дефектный маммопоэз, но нормальный гемопоэз у мышей с целевым нарушением гена пролактина. EMBO J. 1997; 16: 6926–6935. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hotamisligil GS. Воспалительные пути и действие инсулина. Int J Obes Relat Metab Disord. 2003. 27 (Дополнение 3): 53–55. [PubMed] [Google Scholar]
- Хуанг Х., Реган К.М., Лу З., Чен Дж., Тиндалл DJ. CDK2-зависимое фосфорилирование FOXO1 как апоптотический ответ на повреждение ДНК. Наука. 2006; 314: 294–297. [PubMed] [Google Scholar]
- Kelley KW, Brief S, Westly HJ, Novakofski J, Bechtel PJ, Simon J, Walker EB.Имплантаты аденомы гипофиза Gh4 могут обратить вспять старение тимуса. Proc Natl Acad Sci USA. 1986; 83: 5663–5667. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Kelley KW. Гормон роста, лимфоциты и макрофаги. Biochem Pharmacol. 1989; 38: 705–713. [PubMed] [Google Scholar]
- Келли К.В. От гормонов к иммунитету: физиология иммунологии. Иммунное поведение мозга. 2004. 18: 95–113. [PubMed] [Google Scholar]
- Келли К.В., Аркинс С., Ли Ю.М. Гормон роста, пролактин и инсулиноподобные факторы роста: новые рабочие места для старых игроков.Иммунное поведение мозга. 1992; 6: 317–326. [PubMed] [Google Scholar]
- Келли К.В., Данцер Р. Гормон роста и пролактин как естественные антагонисты глюкокортикоидов в иммунорегуляции. В: Plotnikoff N, Murgo A, Faith R, Wybran J, редакторы. Стресс и иммунитет. CRC Press; Бока-Ратон, Флорида: 1991. С. 433–452. [Google Scholar]
- Кеньон С. Пластичность старения: идеи долгоживущих мутантов. Клетка. 2005; 120: 449–460. [PubMed] [Google Scholar]
- Коойман Р., Хуге-Петерс Э.Л., Хоге Р.Пролактин, гормон роста и инсулиноподобный фактор роста-1 в иммунной системе. Adv Immunol. 1996; 63: 377–453. [PubMed] [Google Scholar]
- Lang CH, Hong-Brown L, Frost RA. Цитокиновое ингибирование передачи сигналов JAK-STAT: новый механизм устойчивости к гормону роста. Педиатр Нефрол. 2005. 20: 306–312. [PubMed] [Google Scholar]
- Matera L, Cesano A, Bellone G, Oberholtzer E. Модулирующее действие пролактина на покоящуюся и митоген-индуцированную активность T-, B- и NK-лимфоцитов. Иммунное поведение мозга.1992; 6: 409–417. [PubMed] [Google Scholar]
- Matera L, Muccioli G, Cesano A, Bellussi G, Genazzani E. Рецепторы пролактина на больших гранулярных лимфоцитах: двойная регуляция циклоспорином A. Иммунное поведение мозга. 1988; 2: 1–10. [PubMed] [Google Scholar]
- McCusker RH, Strle K, Broussard SR, Dantzer R, Bluthé RM, Kelley KW. Перекрестное взаимодействие между инсулиноподобными факторами роста и провоспалительными цитокинами В . В: Адер Р., редактор. Психонейроиммунология. Четвертое издание. Эльзевир; Амстердам, Нидерланды: 2006.С. 171–192. [Google Scholar]
- Мерфи В.Дж., Дурум С.К., Анвер М.Р., Лонго Д.Л. Иммунологические и гематологические эффекты нейроэндокринных гормонов. Исследования на карликовых мышах DW / J. J Immunol. 1992; 148: 3799–3805. [PubMed] [Google Scholar]
- Мерфи В.Дж., Дурум С.К., Лонго Д.Л. Дифференциальные эффекты гормона роста и пролактина на развитие и функцию мышиных Т-клеток. J Exp Med. 1993. 178: 231–236. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Nagafuchi H, Suzuki N, Kaneko A, Asai T., Sakane T.Пролактин, локально продуцируемый инфильтрирующими синовиальную оболочку Т-лимфоцитами, вызывает избыточные функции синовиальных клеток у пациентов с ревматоидным артритом. J Rheumatol. 1999; 26: 1890–1900. [PubMed] [Google Scholar]
- Пейс Т., Ху Ф., Миллер А.Х. Цитокиновые эффекты на функцию рецепторов глюкокортикоидов: значение для устойчивости к глюкокортикоидам, патофизиологии и лечения большой депрессии. Мозг, поведение и иммунитет 2007 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Пеева Е., Венкатеш Дж., Майкл Д., Даймонд Б.Пролактин как модулятор функции В-клеток: значение для СКВ. Biomed Pharmacother. 2004. 58: 310–319. [PubMed] [Google Scholar]
- Пьерпаоли В., Барони С., Фабрис Н., Соркин Е. Гормоны и иммунологическая способность. II. Восстановление выработки антител у мышей с гормональным дефицитом соматотропным гормоном, тиреотропным гормоном и тироксином. J Immunol. 1969; 16: 217–230. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Рассел Д.Х., Киблер Р., Матрисиан Л., Ларсон Д.Ф., Поулос Б., Магун Б.Э.Рецепторы пролактина на Т- и В-лимфоцитах человека: антагонизм связывания пролактина циклоспорином. J Immunol. 1985; 134: 3027–3031. [PubMed] [Google Scholar]
- Sarna S, Sipila I, Ronnholm K, Koistinen R, Holmberg C. Рекомбинантный гормон роста человека улучшает рост у детей, получающих лечение глюкокортикоидами после трансплантации печени. J Clin Endocrinol Metab. 1996. 81: 1476–1482. [PubMed] [Google Scholar]
- Савино В., Сманиотто С., Бинарт Н., Постел-Винай М.С., Дарденн М. Эффекты гормона роста на клетки тимуса in vivo.Ann NY Acad Sci. 2003; 992: 179–185. [PubMed] [Google Scholar]
- Шен У.Х., Инь Й., Бруссард С.Р., Маккаскер Р.Х., Фройнд Г.Г., Данцер Р., Келли К.В. Фактор некроза опухоли α ингибирует экспрессию циклина A и гиперфосфорилирование ретинобластомы, вызванное индукцией инсулиноподобным фактором роста-I нового синтеза E2F-1. J Биологическая химия. 2004. 279: 7438–7446. [PubMed] [Google Scholar]
- Sonntag WE, Carter CS, Ikeno Y, Ekenstedt K, Carlson CS, Loeser RF, Chakrabarty S, Lee S, Bennett C, Ingram R, Moore T., Ramsey M.Дефицит гормона роста и инсулиноподобного фактора роста I, возникающий у взрослых, снижает неопластические заболевания, изменяет возрастную патологию и увеличивает продолжительность жизни. Эндокринология. 2005; 146: 2920–2932. [PubMed] [Google Scholar]
- Стрле К., Бруссард С. Р., Маккаскер Р. Х., Шен У. С., Леклер Дж. М., Джонсон Р. У., Фройнд Г. Г., Данцер Р., Келли К. В.. N-концевая киназа C-jun опосредует TNFα-супрессию дифференцировки в миобластах. Эндокринология. 2006; 147: 4363–4373. [PubMed] [Google Scholar]
- Sun LY, Evans MS, Hsieh J, Panici J, Barke A.Увеличение нейрогенеза в зубчатой извилине долгоживущих карликовых мышей Эймса. Эндокринология. 2005; 146: 1138–1144. [PubMed] [Google Scholar]
- Уоткинс Л.Р., Хатчинсон М.Р., Ледебор А., Визелер-Франк Дж., Миллиган Е.Д., Майер С.Ф. Глия как «плохие парни»: значение для улучшения клинического контроля боли и клинической пользы опиоидов. Мозг, поведение и иммунитет 2007 [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Weigent DA. Иммунорегуляторные свойства гормона роста и пролактина.J Pharmacol Therapeut. 1996; 69: 237–257. [PubMed] [Google Scholar]
- Weigent DA, Blalock JE. Двунаправленная связь между мозгом и иммунной системой. В: Панди-Перумал С.Р., Кардинали Д.П., Хрусос Г.П., редакторы. Нейроиммунология сна. Springer; NY: 2007. В печати. [Google Scholar]
- Zhu T, Starling-Emerald B, Zhang X, Lee K-O, Gluckman PD, Mertani HC, Lobie PD. Онкогенная трансформация эпителиальных клеток молочной железы человека аутокринным гормоном роста человека. Cancer Res.2005. 65: 317–324. [PubMed] [Google Scholar]
Что такое белки и для чего они нужны ?: MedlinePlus Genetics
Белки — это большие сложные молекулы, которые играют важную роль в организме. Они выполняют большую часть работы в клетках и необходимы для структуры, функции и регулирования тканей и органов тела.
Белки состоят из сотен или тысяч более мелких единиц, называемых аминокислотами, которые связаны друг с другом длинными цепями. Существует 20 различных типов аминокислот, которые можно комбинировать для получения белка.Последовательность аминокислот определяет уникальную трехмерную структуру каждого белка и его конкретную функцию. Аминокислоты кодируются комбинациями трех строительных блоков ДНК (нуклеотидов), определяемых последовательностью генов.
Белки можно описать в соответствии с их широким спектром функций в организме, перечисленных в алфавитном порядке:
|
Функция |
Описание |
Пример |
|---|---|---|
|
Антитело |
Антитела связываются с определенными инородными частицами, такими как вирусы и бактерии, чтобы защитить организм. |
Иммуноглобулин G (IgG) |
|
Фермент |
Ферменты осуществляют почти все тысячи химических реакций, протекающих в клетках. Они также помогают формированию новых молекул, считывая генетическую информацию, хранящуюся в ДНК. |
Фенилаланингидроксилаза |
|
Мессенджер |
Белки-мессенджеры, такие как некоторые типы гормонов, передают сигналы для координации биологических процессов между различными клетками, тканями и органами. |
Гормон роста |
|
Конструктивный элемент |
Эти белки обеспечивают структуру и поддержку клеток. В большем масштабе они также позволяют телу двигаться. |
Актин |
|
Транспортировка / хранение |
Эти белки связывают и переносят атомы и небольшие молекулы внутри клеток и по всему телу. |
Ферритин |
.



 -ит5, м-‘
-ит5, м-‘ 61]
61]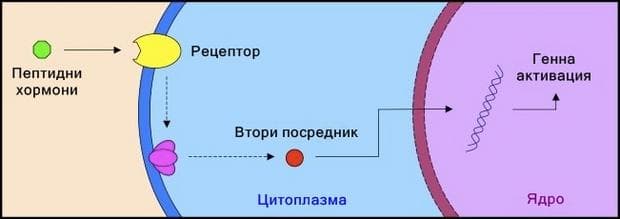 301
301