Врожденная тромбофилия что это такое: цены на лечение, симптомы и диагностика тромбофилии в «СМ-Клиника»
Тромбофилия врожденная и приобретенная, тромбофилия при беременности — лечение и риски
Тромбофилия — что это за болезнь?
Что это такое тромбофилия? С чем связано заболевание и насколько опасно? Эти вопросы волнуют многих людей при обращении к врачу. Тромбофилия является болезнью, при которой повышается риск развития рецидивирующих тромбозов, причем их локализация многообразна. Частое образование тромбов обуславливается приобретенной или врожденной патологией клеток крови.
Тромбообразование — это процесс формирования сгустков крови там, где повреждается сосудистая стенка, его цель — обеспечить сохранность сосудистой системы. Сам по себе данный процесс физиологически нормальный, он препятствует избыточной кровопотере в местах повреждений. Но если тромботический процесс избыточный, то имеет место уже патологический тромбоз. При ответе на вопрос, что это такое тромбофилия, можно привести наглядный пример в виде фото, где показана повышенная активность клеток крови и образование тромба. Болезнь не всегда сопровождается тромбоэмболией или тромбозом, однако сильно повышается риск образования тромбов в различных местах кровеносной системы.
Болезнь не всегда сопровождается тромбоэмболией или тромбозом, однако сильно повышается риск образования тромбов в различных местах кровеносной системы.
Сейчас современная медицина озабочена проблемой данного заболевания, поскольку довольно часто возникают летальные исходы из-за закупорки кровеносного сосуда. Больше всего диагностируется наследственная тромбофилия. По статистике, в Европе около 15% людей страдают этим заболеванием.
Не стоит путать такие понятия как тромбофилия и трипофилия. Это совершенно несвязанные между собой термины. Но иногда можно услышать вопрос: трипофилия, что это такое? Понятие означает фобию, боязнь скопления предметов имеющих закругленную форму, кластерных отверстий. Так что трипофилия — это страх и дискомфорт, связанный, например, с семенами лотоса, сотами, а не заболевание, которое проявляет себя патологиями в организме.
Признаки тромбофилии
При болезни часто не бывает никаких симптомов. Иногда встречаются тромбозы в венах голени. Это вызывает покраснение, отек и неприятные ощущения. Такие признаки тромбофилии называют тромбозом глубоких вен. Сгустки крови или тромбы подлежат лечению при помощи специальных препаратов, разжижающих кровь. Диагностировать данное заболевание при тромбофилии можно на аппаратах, позволяющих получить фото, например, провести ультразвуковое обследование.
Это вызывает покраснение, отек и неприятные ощущения. Такие признаки тромбофилии называют тромбозом глубоких вен. Сгустки крови или тромбы подлежат лечению при помощи специальных препаратов, разжижающих кровь. Диагностировать данное заболевание при тромбофилии можно на аппаратах, позволяющих получить фото, например, провести ультразвуковое обследование.
Тромбы опасны не только для здоровья, они могут привести к летальному исходу, если оторвутся и попадут в кровоток к жизненно важным органам.
При появлении тромба появляются следующие симптомы:
Виды заболевания
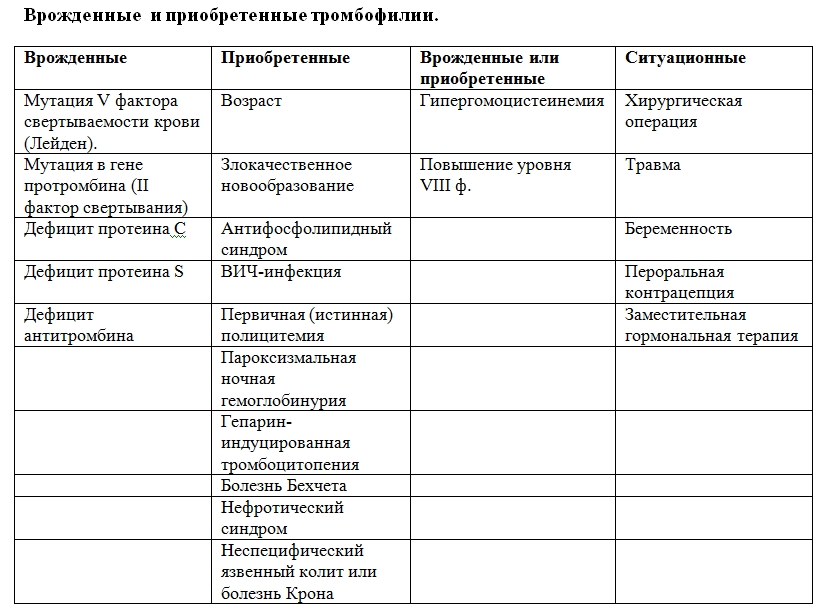
При ответе на вопрос, что такое тромбофилия, необходимо понять то, что развитие болезни может зависеть от многих факторов. Ее носителями, по статистике, являются практически две пятых населения Земли. С каждым годом регистрируется рост болезни. Есть два основных вида патологии — тромбофилия врожденная и приобретенная. При наследственном заболевании в генах обнаруживаются различные аномалии. Больше всего встречаются следующие факторы:
Больше всего встречаются следующие факторы:
- дефицит протеина S и C, а также антитротромбина III. Протеины регулируют интенсивность свертываемости, поэтому при их недостаточности образуется избыточное тромбообразование. Антитромбин III создает соединения с тромбином, это приводит к взаимной инактивации. Компонент является одним из самых важных в противосвертывающей системе;
- молекулярные аномалии фибриногена;
- полиморфизм гена V фактора. Появляется дефект в гене, который несет информацию о пятом факторе свертывания крови. Данный фактор еще называют мутацией Лейдена;
- замена одного нуклеотида G20210A;
- повышение уровня липопротеинов.
Тромбофилии, возникающие в результате приема медикаментов, травм или при сопутствующих болезнях, являются приобретенными. Они не возникают неожиданно и спонтанно, появлению патологии всегда есть причина.
- Выделяют еще некоторые виды заболевания:
- гематогенная тромбофилия.
 Из-за нарушения состава крови, аномалий в системе свертывания или тромбоцитарного гемостаза появляется склонность к повторяющимся тромбозам кровеносных сосудов различной локализации. Это один самых опасных видов болезни. На фото показано, как из-за нарушений, причиной которых стала тромбофилия, образуется тромб. Он может стать причиной тромбоэмболии, т.е. произойдет острая закупорка сосуда. Различают два вида гематогенных тромбофилий. Первая группа связана с изменениями клеточного состава крови и ее реологических свойств. Вторая группа связана с первичными нарушениями в системе гемостаза;
Из-за нарушения состава крови, аномалий в системе свертывания или тромбоцитарного гемостаза появляется склонность к повторяющимся тромбозам кровеносных сосудов различной локализации. Это один самых опасных видов болезни. На фото показано, как из-за нарушений, причиной которых стала тромбофилия, образуется тромб. Он может стать причиной тромбоэмболии, т.е. произойдет острая закупорка сосуда. Различают два вида гематогенных тромбофилий. Первая группа связана с изменениями клеточного состава крови и ее реологических свойств. Вторая группа связана с первичными нарушениями в системе гемостаза; - гемодинамическая тромбофилия связана с нарушениями работы системы кровообращения;
- к сосудистой тромбофилии относят такие заболевания, как васкулит и атеросклероз.
Тромбофилия при беременности
Часто так совпадает, что себя одновременно проявляет наследственная тромбофилия и беременность. Это связывают с тем, что у женщины, которая ждет ребенка, образуется дополнительный круг кровообращения — плацентарный, он имеет свои специфические особенности и дает дополнительную нагрузку на организм. Тромбофилия — это такое заболевание, при котором нарушается система свертывания крови, возникает возможность серьезных осложнений, поэтому беременность и тромбофилия является опасным сочетанием, которое требует к себе повышенного внимания женщины и врачей.
Тромбофилия — это такое заболевание, при котором нарушается система свертывания крови, возникает возможность серьезных осложнений, поэтому беременность и тромбофилия является опасным сочетанием, которое требует к себе повышенного внимания женщины и врачей.
В организме женщины во время развития беременности происходят большие изменения, в частности, повышается свертываемость крови. Это связано с уменьшением кровопотери при родах или такими патологическими состояниями, как отслойка плаценты, выкидыш. При тромбофилии риск образования тромбов является высоким, поэтому, когда к нему присоединяется еще и физиологические особенности течения беременности в виде повышенной свертываемости, то возникает еще большая опасность.
Часто у беременных возникает гематогенный вид болезни, связанный с антифосфолипидным синдромом. При этом течение болезни обычно непредсказуемо и универсальной схемы лечения нет. Обычно тромбофилия может себя никак не проявлять, но при беременности риск тромбозов увеличивается в шесть раз. Главной опасностью может стать выкидыш на небольшом сроке беременности. Чревато это состояние тем, что тромбы могут образоваться в сосудах, которые ведут к плаценте, что вызывает у плода гипоксию и задержку развития. В организм ребенка перестают поступать питательные вещества, что приводит к фетоплацентарной недостаточности, отслоению плаценты, порокам развития, выкидышам и к преждевременным родам.
Главной опасностью может стать выкидыш на небольшом сроке беременности. Чревато это состояние тем, что тромбы могут образоваться в сосудах, которые ведут к плаценте, что вызывает у плода гипоксию и задержку развития. В организм ребенка перестают поступать питательные вещества, что приводит к фетоплацентарной недостаточности, отслоению плаценты, порокам развития, выкидышам и к преждевременным родам.
Считается, что болезнь никак себя не проявляет до десяти недель. Нет данных о влиянии патологии на развитие беременности на ранних сроках. Во втором триместре обычно тромбофилия также ведет себя спокойно, и неприятные последствия редко возникают. Риск развития осложнений увеличивается после 30 недель, тогда может возникнуть отслойка плаценты.
Если при заболевании удается выносить ребенка, то роды обычно происходят раньше положенного срока, на 35-37 неделе. Этот вариант развития событий считается благоприятным.
При постановке диагноза во время беременности врач должен рассказать женщине о том, что такое тромбофилия, и незамедлительно назначить лечение. Курс терапии состоит из медикаментозных препаратов, особой диеты и физических упражнений. При неукоснительном выполнении всех врачебных рекомендаций шансы выносить и родить здорового ребенка велики. Важно помнить о том, что, скорее всего, произойдут преждевременные роды до 40 недель. Но при современном уровне медицины выхаживают младенцев, рождающихся и на более ранних сроках, поэтому тромбофилия не является приговором для женщины, которая хочет иметь детей. Важно при наличии диагноза «генетическая тромбофилия» заранее планировать беременность, и тогда снизятся риски возможных осложнений.
Курс терапии состоит из медикаментозных препаратов, особой диеты и физических упражнений. При неукоснительном выполнении всех врачебных рекомендаций шансы выносить и родить здорового ребенка велики. Важно помнить о том, что, скорее всего, произойдут преждевременные роды до 40 недель. Но при современном уровне медицины выхаживают младенцев, рождающихся и на более ранних сроках, поэтому тромбофилия не является приговором для женщины, которая хочет иметь детей. Важно при наличии диагноза «генетическая тромбофилия» заранее планировать беременность, и тогда снизятся риски возможных осложнений.
Если Вы обнаружили у себя схожие симптомы, незамедлительно обратитесь к врачу. Легче предупредить болезнь, чем бороться с последствиями.
Диагностика заболевания
Обычно диагностика тромбофилии имеет ряд сложностей. В основном это происходит потому, что болезнь может себя никак не проявлять и не давать никаких симптомов. Для уточнения заболевания необходимо обратиться к флебологу, он использует визуальный осмотр больного, аппаратную и лабораторную диагностику.
При первичном осмотре врач определяет месторасположение поврежденного участка и степень его изменений. Обычно пациенты жалуются на отеки, гипертермию в области расположения вен с варикозным расширением, тянущие боли после сидения или ходьбы. При пальпации определяется выраженная болезненность. Уже на основании этих признаков доктор назначает общий анализ крови, исследования на содержание Д-димера, коагулограмму.
Лабораторный анализ на тромбофилию включает в себя исследование генов тромбоцитарных рецепторов, факторов свертываемости крови, фибринолиза и др. По сути, определяются генетические маркеры тромбофилии, которые играют важную роль в появлении врожденного вида болезни. Бывает два вида полиморфизма — гетерозиготный и гомозиготный. Последний из них считается более серьезным в плане проявления осложнений и лечения.
Необходимость проведения анализов на генетические маркеры определяется врачом флебологом индивидуально и зависит от клинической картины. Показаниями для проведения данной лабораторной диагностики является:
Показаниями для проведения данной лабораторной диагностики является:
- наличие в молодом возрасте тромбоэмболических болезней;
- варикозное расширение вен;
- инсульт и инфаркт;
- сердечно-сосудистые заболевания у ближайших родственников;
- нарушения, связанные с течением беременности: фетоплацентарная недостаточность, задержка внутриутробного развития, гибель плода, отслойка плаценты, невынашивание беременности, выкидыши на ранних сроках, токсикозы, тяжелые формы гестоза;
- применение оральных контрацептивов;
- рецидивирующие тромбоэмболии;
- ожирение.
Очень информативна инструментальная диагностика заболевания. Компьютерные программы выдают подробные результаты состоянию вен, клапанов, просветов, тромботических масс.
- Ультразвуковая допплерография позволяет определить скорость и направление кровотока на различных участках сосуда. Данный способ не предоставляет возможности изучить данные о структуре и анатомии вен.

- Ультразвуковая ангиография нижних конечностей. Исследование основано на способности тканей различно отражать и поглощать ультразвуковые волны. Исследование проводится только по серьезным показаниям, поскольку является инвазивным методом диагностики. Во время процедуры в сосуд вводится контрастное вещество, прибор отслеживает его движение, тем самым создается трехмерная картинка всех вен и артерий. Рекомендуется проводить ангиографию уже после проведения допплерографии.
- Флебография — рентгенологическое исследование с применением контрастного йодсодержащего вещества.
- Флебосцинтиграфия — процедура также основана на методе введения контрастного вещества, здесь им является радиоактивный изотоп с малым периодом полураспада.
- Спиральная компьютерная томография — это новый точный способ диагностики. Позволяет создать объемную 3D-реконструкцию и определить состояние и расположение вен. Такая процедура незаменима при экстренной диагностике тромбоэмболии.

- Магнитно-резонансная томография.
После постановки диагноза доктор расскажет, что это за болезнь, тромбофилия, и назначит необходимое лечение. Дополнительно пациентам назначается рентгенография грудной клетки для предупреждения тромбоэмболии легочной артерии. Полноценную диагностику можно пройти в любом современном флебологическом центре.
Тромбофилия — лечение
Лечение тромбофилии начинается с выбора квалифицированного врача, его целью является устранение тромботических осложнений.
Назначаются медикаментозные препараты:
- антикоагулянты (низкомолекулярные гепарины), которые понижают свертывание крови;
- антиагреганты для профилактики тромбоэмболий;
- препараты, улучшающие функцию печени;
- фибринолитические средства;
- фолиевая кислота имеет показания при некоторых видах заболевания;
- при риске отека мозга рекомендуются глюкокортикоидные препараты (дексаметазон).

Для предотвращения осложнений рекомендуется использовать профилактические мероприятия. Особенно это касается периода беременности:
- занятия лечебной физкультурой;
- отсутствие подъема тяжестей, длительного стояния;
- ношение медицинского компрессионного трикотажа или эластичных бинтов;
- плавание;
- электромагнитная терапия;
- самомассаж;
- правильное питание;
- фитотерапия.
При тромбофилии рекомендуется делать следующее упражнение: лежа на спине, поднимать и опускать ноги без резких движений. Возможно использование гирудотерапии, где применяются специальные медицинские пиявки.
Лечение тромбофилии во время беременности
Часто именно в период ожидания ребенка проявляет себя генетическая тромбофилия, поэтому лечение беременных с таким диагнозом должно быть начато как можно раньше. При этом используются примерно такие же препараты, как и для других категорий. В практике применяются следующие основные и вспомогательные медикаментозные средства лечения:
В практике применяются следующие основные и вспомогательные медикаментозные средства лечения:
- Аэсцин;
- Надропарин кальция;
- Троксерутин;
- Маннол;
- Дексаметазон;
- Фраксипарин;
- Фемибион-2;
- Вессел Дуэ Ф;
- иногда при АФС для профилактики тромбозов, а также для предотвращения гестоза назначается аспирин.
Во время беременности существуют определенные показания для госпитализации пациентов:
- дородовая госпитализация в акушерско-гинекологический стационар при тромбозе церебральных вен;
- наблюдается варикозное расширение вен, в этом случае пациентку направляют в хирургический стационар, решается вопрос о сохранении или прерывании беременности;
- больных госпитализируют в нейрохирургический стационар, если произошло неуточненное венозное осложнение.
Тромбофилия — лечение народными средствами
Народный опыт собрал в себя множество рецептов, некоторые из которых будут полезны для снижения свертывания крови.
- Настойка софоры японской. Нужно взять 100 грамм семян и залить их полулитром хорошей водки. Настоять две недели в темном месте. Средство принимают 3 раза в день до приема пищи, 10 капель настойки разводят в четверти стакана воды.
- Хорошо зарекомендовал себя виноградный сок, его ежедневное употребление снижает активность тромбоцитов.
- Настой из лабазника. 2 чайные ложки необходимо залить стаканом кипятка, процедить и пить до еды по одной трети стакана.
- Полезно употреблять настои, варенье, компоты из ягод и листьев малины.
- Чеснок является одним из уникальных природных средств, которые могут разжижать кровь, поэтому можно включить в свой рацион 2-3 зубчика.
- Используется экстракт листьев гинкго билоба.
- Многокомпонентный настой. Череда, зверобой по 20 грамм; плоды кориандра, корень солодки голой, сушеница топяная, ромашка, льнянка, донник по 10 грамм. Смесь трав заливают 500 мл кипятка и делают выдержку в течение 2 часов.
 Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
Затем настой процеживают и пьют, можно добавить мед. Дозировка составляет 200 мл два раза в день через час после еды.
Нельзя использовать при заболевании травы, обладающие кровесвертывающим действием, — водяной перец, крапиву. Перед применением народных средств нужно обязательно проконсультироваться с врачом, многие из них имеют противопоказания.
Диета при тромбофилии
При заболевании назначается специальный антитромботический рацион. Необходимо ограничить продукты, которые могут повысить вязкость крови. Диета должна исключать следующие продукты питания:
- сало, жирное мясо, наваристый бульон;
- шоколад;
- цельное молоко;
- бобовые;
- говяжью печень;
- твердые сорта сыра;
- кофе, большое количество зеленого чая;
- сельдерей, петрушку, шпинат;
- нельзя употреблять в пищу острые и жирные блюда.
Желательно употреблять те продукты, которые снижают свертываемости крови:
- клюкву, калину, бруснику, черноплодную рябину;
- морепродукты;
- имбирь;
- морскую капусту;
- красные морсы и соки;
- злаковые каши — перловую, овсяную, ячневую, гречневую,
- сухофрукты — финики, курагу, инжир, изюм, чернослив.

Опасность и факторы риска возникновения
На развитие заболевания влияет наследственный фактор (тромбофилия генетическая). Но существуют и некоторые приобретенные риски:
- заболевания крови. Эритремия, атеросклероз, варикозное расширение вен нижних конечностей, артериальная гипертензия;
- косвенно на развитие патологии могут повлиять и болезни, влияющие на двигательную активность (болезнь Шляттера), злокачественные образования, аутоиммунные заболевания (антифосфолипидный синдром, системная красная волчанка), поликистоз почек;
- инфекционные процессы;
- перенесенный инфаркт или инсульт;
- хирургические вмешательства;
- катетеризация вен;
- заболевания печени;
- ожирение;
- период беременности;
- нефротический синдром;
- некоторые лекарственные препараты (оральные контрацептивы, преднизолон).
Профилактика осложнений тромбофилии
Насколько бы профессиональный не был врач, нельзя перекладывать ответственность за свое здоровье только на достижения современной медицины, важно помнить, что каждый человек сам тоже должен заботиться о нем. Для того чтобы предотвратить появления осложнений при тромбофилии, нужно выполнять ряд простых правил:
Для того чтобы предотвратить появления осложнений при тромбофилии, нужно выполнять ряд простых правил:
- пересмотреть свой образ жизни. Сегодня риску болезни подвержены все, кто много сидит и мало двигается. Умеренная физическая активность, зарядка, лечебная физкультура только укрепят здоровье;
- правильный рацион питания, отказ от чрезмерного употребления жирного и копченого, а также промышленных полуфабрикатов;
- уменьшить количество потребляемого мяса;
- специальный питьевой режим — необходимо выпивать не менее полутора литра чистой воды в день;
- профилактические врачебные осмотры.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Факторы тромбогенного риска у беременных.
При наличии в анамнезе женщины случаев привычного невынашивания беременности или потери плода в позднем сроке беременности, токсикозов второй
половины беременности, внутриутробной задержки развития плода, отслойки плаценты или инфаркта плаценты, ей показано проведение обследования на тромбофилию.
Гипергомоцистеинемия, которая развивается иногда под влиянием наследственного генетического полиморфизма, ассоциирована с поздним токсикозом и принимает участие в развитии инфарктов и отслойки плаценты. Воспаление эндотелиальной выстилки сосудов на фоне повышенного уровня гомоцистеина, вызывает повышенный риск как венозного, так и артериального тромбоза. К гипергомоцистеинемии может приводить наличие в организме измененных форм фермента метилентетрагидрофолатредуктазы (MTHFR), который в норме участвует в превращении гомоцистеина в метионин.
Наследственный полиморфизм фактора Лейдена (V), имеющий сильную предрасположенность к тромбозам, встречается с повышенной частотой у женщин с привычным невынашиванием.
Среди пациенток с привычным невынашиванием беременности, аномальные формы фактора V Лейден наиболее часто встречаются у женщин, имеющих выкидыши во втором триместре беременности.
Гипергомоцистеинемия сама по себе не имеет значительной ассоциации с потерей плода на раннем сроке беременности, что свидетельствует о том, что дефицит фолиевой кислоты и полиморфизм MTHFR могут действовать через дополнительные, пока еще неизвестные факторы. Повышенный уровень гомоцистеина также выявляется при беременностях, осложненных гестозом, и это повышение сохраняется после родов.
Повышенный уровень гомоцистеина также выявляется при беременностях, осложненных гестозом, и это повышение сохраняется после родов.
Другие причины плацентарного тромбоза.
Беременность может способствовать проявлению генетического дефекта, так как при ней развиваются следующие особенности:
- Физиологическое повышение коагуляции крови.
- Подавление растворения фибринового сгустка (фибринолиза).
- Снижение содержания и активности естественных антикоагулянтов крови.
- Повышение функциональной активности тромбоцитов.
- Эти изменения при беременности имеют охранительное значение, они предотвращают обильную кровопотерю в родах, но при этом они же провоцирую развитие тромбоза в сосудах плаценты, особенно при наличии врожденной патологии в системе гемостаза.
- Низкое сосудистое сопротивление плаценты и медленный кровоток в ее сосудах, является ключевым моментов в обеспечении хорошего кровоснабжения плода, но при этом создаются условия для отложения фибрина и образования тромбов.

- Нормальное увеличение уровня фибриногена и свертывающих белков во время беременности также может провоцировать тромбообразование. Понижение доступности фолиевой кислоты, поступающей с пищей, происходит при курении, и это может вызвать еще большее повышение уровня гомоцистеина.
Риск тромбоза при наследуемых формах тромбофилий может быть снижен путем применения небольших доз аспирина, гепарина, фолиевой кислоты, внутривенного введения иммуноглобулина G, или концентратов гематогенных факторов. Для носителей наследуемой тромбофилии с повторяющимися неблагоприятными исходами беременности, заслуживают внимания два варианта профилактического лечения: назначение низкомолекулярного гепарина (эноксапарина) женщинам с привычной поздней потерей плода и лечение фолиевой кислотой при тяжелом токсикозе 2-ой половины беременности.
У всех лиц — беременных и нет, потребление фолиевой кислоты значительно снижает уровень гомоцистеина. Эффективность является высокой в случаях, когда перед лечением уровень гомоцистеина был самым высоким и наименьшая, если уровень гомоцистеина был сравнительно небольшим. Уменьшение уровня гомоцистеина наблюдается при применении фолиевой кислоты в дозе от 0.5 мг до 5 мг в день в сочетании с витамином B6.
Уменьшение уровня гомоцистеина наблюдается при применении фолиевой кислоты в дозе от 0.5 мг до 5 мг в день в сочетании с витамином B6.
Высока вероятность тромбоэмболических осложнений и при наличии сердечнососудистых заболеваний, избыточной массы тела, анемии, перенесенном позднем токсикозе . Повышается риск тромбоза и у женщин в возрастной группе после 40 лет, при наличии злокачественных образований, малоподвижном образе жизни. Затяжные, длительные роды, кесарево сечение также предрасполагают к осложнениям. К группе очень высокого риска по развитию тромбозов, в том числе и в послеродовом периоде, относятся женщины с варикозной болезнью нижних конечностей.
Причины тромбозов
Прежде всего, развитие послеродового тромбоза связано с изменениями в свертывающей системе крови. Во время естественных родов или кесарева сечения теряется кровь. Объем кровопотери может быть разным — от минимального (физиологического) до значительного (патологического), что зависит от конкретной ситуации. В любом случае, организм стремится прекратить дальнейшее истечение крови, вырабатывая большое количество факторов, способствующих повышению свертывания крови путем образования сгустков-пробок в просвете сосудов. И чем больше кровопотеря, тем активнее эти процессы. Кроме того, при отхождении плаценты или из-за механического повреждения тканей во время операции повреждается и стенка сосудов, происходит выбрасывание в кровь особых белков и ферментов эндотелия (внутренней выстилки сосуда), что также немаловажно для сдвига процессов в сторону повышения свертывания крови.
В любом случае, организм стремится прекратить дальнейшее истечение крови, вырабатывая большое количество факторов, способствующих повышению свертывания крови путем образования сгустков-пробок в просвете сосудов. И чем больше кровопотеря, тем активнее эти процессы. Кроме того, при отхождении плаценты или из-за механического повреждения тканей во время операции повреждается и стенка сосудов, происходит выбрасывание в кровь особых белков и ферментов эндотелия (внутренней выстилки сосуда), что также немаловажно для сдвига процессов в сторону повышения свертывания крови.
Для снижения риска венозных тромбоэмболических осложнений во время беременности рекомендуется применение низкомолекулярных гепаринов (НМГ) в профилактических и промежуточных дозах в виде подкожных инъекций. Однако в настоящее время решение о назначении НМГ беременным женщинам принимается лишь на основании наличия тромботического анамнеза или при выявлении той или иной тромбофилии (мутации фактор V Лейден, мутации протромбина, дефицита антитромбина, носительства антифосфолипидных антител и др. ). Эти показания для назначения НМГ субъективны, поскольку они не основываются на точных лабораторных данных измерения избыточной (тромбоопасной) активации свертывания крови в разные сроки беременности. Соответственно, использование этих показаний приводит к неоправданно широкому применению гепаринов во время беременности.
). Эти показания для назначения НМГ субъективны, поскольку они не основываются на точных лабораторных данных измерения избыточной (тромбоопасной) активации свертывания крови в разные сроки беременности. Соответственно, использование этих показаний приводит к неоправданно широкому применению гепаринов во время беременности.
Вероятность образования тромбов во время беременности увеличивают врожденная тромбофилия (состояние повышенной свертываемости крови), кесарево сечение, зрелый возраст роженицы и избыточный вес. Если женщина ранее рожала три и более раз или имеет многоплодную беременность (двойня и более) риск тромбоза также повышается. Дополнительными факторами риска образования тромбов выступают: гипертония, сердечно-сосудистые заболевания и сахарный диабет; применение оральных контрацептивов перед беременностью; обезвоживание.
Важно отметить, что риск образования тромбов сохраняется в течение двух месяцев после родов.
Лечение тромбозов — сложный процесс, который обязательно должен происходить под контролем врача. Поэтому при наличии факторов риска рекомендуется проводить профилактику тромбоза. Профилактика может быть немедикаментозная и медикаментозная. Врач определяет степень риска для каждого пациента – низкую, умеренную, высокую. После этого подбирается метод профилактики. Как правило, одной немедикаментозной профилактики людям с повышенным риском развития тромбоза мало, поэтому вместе с ней проводится медикаментозная профилактика. В этом случае применяются специальные препараты, препятствующие образованию тромбов.
Поэтому при наличии факторов риска рекомендуется проводить профилактику тромбоза. Профилактика может быть немедикаментозная и медикаментозная. Врач определяет степень риска для каждого пациента – низкую, умеренную, высокую. После этого подбирается метод профилактики. Как правило, одной немедикаментозной профилактики людям с повышенным риском развития тромбоза мало, поэтому вместе с ней проводится медикаментозная профилактика. В этом случае применяются специальные препараты, препятствующие образованию тромбов.
Антифосфолипидный синдром (АФС) является причиной многих акушерских осложнений, таких как синдром потери плода, HELLP-синдром, преждевременные роды. Высокий риск неблагоприятных акушерских исходов при АФС обусловливает необходимость планирования беременности и подбора адекватной терапии беременной с данной патологией.
На сегодняшний день АФС является одной из актуальных проблем в акушерской практике. Клиническими проявлениями АФС в акушерстве являются синдром потери плода, задержка внутриутробного развития плода, HELLP-синдром, маловодие, фето-плацентарная недостаточность, преждевременные роды, гестоз (преэклампсия и эклампсия). Синдром потери плода на сегодняшний день рассматривается как специфический маркер АФС. Прерывание беременности при АФС может произойти на любом сроке беременности, и очень часто самопроизвольный выкидыш является единственным симптомом, позволяющим заподозрить АФС у пациентки.
Синдром потери плода на сегодняшний день рассматривается как специфический маркер АФС. Прерывание беременности при АФС может произойти на любом сроке беременности, и очень часто самопроизвольный выкидыш является единственным симптомом, позволяющим заподозрить АФС у пациентки.
Высокий риск неблагоприятных акушерских исходов при АФС диктует необходимость планирования беременности у данных пациенток, тщательного подбора медикаментозной терапии и постоянного контроля за состоянием матери и плода.
На этапе планирования беременности у пациентки с АФС необходимо исключить сопутствующие факторы риска развития тромбозов. Спектр профилактических мероприятий включает в себя коррекцию избыточного веса, лечение сопутствующей артериальной гипертензии, коррекцию нарушений липидного спектра, отказ от курения, а также использование компрессионного трикотажа при посттромбофлебитическом синдроме.
Беременным с АФС с момента зачатия назначают низкие дозы АСК (50-100 мг в сутки, но не более 150 мг в сутки ) и низкомолекулярные гепарины до момента родов. Отменяют низкомолекулярные гепарины за 12-24 часа до родоразрешения. Лечение гепаринами возобновляют через 12 часов после родов на срок не менее 4-6 недель.
Отменяют низкомолекулярные гепарины за 12-24 часа до родоразрешения. Лечение гепаринами возобновляют через 12 часов после родов на срок не менее 4-6 недель.
Своевременная диагностика и адекватная терапия АФС у беременных, тщательный контроль за показателями системы гемостаза, регулярный контроль за состоянием плода, совместное ведение беременности акушером-гинекологом и смежными специалистами позволяет улучшить перинатальные исходы.
ДНК-тест на тромбофилию | GenEra, ООО
Что такое «тромбофилия»?
Тромбофилия — это патологическая склонность организма к образованию тромбов. Это группа заболеваний, которые характеризуются склонностью образовывать тромбы под влиянием генетических факторов, факторов окружающей среды, а также взаимодействий между ними. Тромбофилия связана с риском как венозного, так и артериального тромбоза, хотя в случае артериального тромбоза генетические факторы риска выражены не так сильно, а потому обычно не тестируются.
Какие генетические факторы могут послужить причиной врожденной тромбофилии?
Врожденные мутации в генах, которыми кодируются белки, участвующие в свертывании крови, могут стать причиной процесса возникновения тромбов. Одними из наиболее распространенных причин врожденного венозного тромбоза являются:
- NM_000130.4(F5):c.1601G>A (p.Arg534Gln), rs6025 (c.1691G>A, FVL, фактор Лейдена)
- NM_000506.4(F2):c.*97G>A (мутация гена протромбина 20210G>A)
Мутация Лейдена V в гене F5, кодирующем фактор V
Распространение этой мутации в популяции европейского происхождения — 3–8%. У пациентов с тромбозами эта мутация встречается в 20–25% случаев. В случае мутации Лейдена V возможна повышенная резистентность к белку C — одна из причин тромбоза.
Мутация c.20210G>A в гене F2, кодирующем фактор II
Распространение этой мутации в популяции европейского происхождения — 2–3%. У пациентов с тромбозами эта мутация встречается в 4–8% случаев. При наличии этой мутации в организме повышается уровень протромбина, что может способствовать образованию тромбина и фибриновых тромбов.
Тип наследования: аутосомно-доминантный, в обеих позициях
Пациенту важно понимать, что присутствие вышеуказанных мутаций в генах F5 или F2 не означает, что в течение их жизни обязательно разовьется тромбоз. Наличие этих мутаций в геноме лишь повышает риск тромбоза.
Зная, что у пациента в геноме есть такие мутации, врач может при необходимости более внимательно наблюдать за пациентом и принять решение о необходимой поддерживающей терапии в различных жизненных ситуациях, а также сообщить пациенту о факторах образа жизни и среды, повышающих риск тромбозов, а также о том, как их устранить.
Факторы, повышающие риск тромбозов
Известно несколько повышающих риск тромбоза мутаций, которые в комбинации с другими факторами риска тромбофилии могут повысить риск венозного тромбоза:
В случае мутаций в гене МТГФР у человека может быть повышен уровень гомоцистеина в крови — что является фактором, способствующим тромбофилии. Больше информации о влиянии мутаций гена МТГФР на организм можно найти в разделе об анализе МТГФР.
Одна аллель гена PAI-1 связана с повышенной активностью плазмы PAI-1, что приводит к снижению фибринолитической активности и, как следствие, к увеличению риска венозного, а также артериального тромбоза у людей с гомозиготным и гетерозиготными вариантами этой аллели. У женщин с гомозиготным вариантом этой аллели немного повышен риск осложнений при беременности.
Факторы среды и образа жизни, повышающие риск тромбофилии:
-
Приобретенная тромбофилия (злокачественное образование, гипергомоцистеинемия, высокий уровень фактора VII)
-
Беременность
-
Употребление оральных контрацептивов
-
Гормонозаместительная терапия
-
Продолжительное нахождение в одной и той же позе (продолжительные поездки, постельный режим)
-
Центральные катетеры, хирургические манипуляции, трансплантации
Кому рекомендуется пройти анализ ДНК на тромбофилию:
-
пациенты с позитивным анамнезом тромбозов (собственный и семейный),
-
тромбозы в нетипичных местах,
-
тромбозы, возникающие при гормонозаместительной терапии или гормональной контрацепции,
-
тромбозы во время беременности.
Во время беременности тромбофилия может привести к преэклампсии, отслаиванию плаценты, внутриутробной задержке развития плода, повторяющейся потере плода, поздней потере плода (обычно в третьем триместре).
сдать анализ в лаборатории KDLmed
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Синонимы русские
Первичная тромбофилия, наследственная тромбофилия, врожденная тромбофилия, вторичная тромбофилия, приобретенная тромбофилия.
Синонимы английские
Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia, acquired thrombophilia, secondary thrombophilia.
Тромбофилия – это наследственно обусловленная или приобретенная предрасположенность к формированию тромбов (кровяных сгустков) в просвете кровеносных сосудов. Тромбофилия не является заболеванием как таковым, а представляет собой состояние, которое в сочетании с факторами риска увеличивает вероятность возникновения тромбов в несколько раз.
Проявления тромбофилии связаны с образованием тромбов в венах и/или артериях, которые нарушают работу внутренних органов и представляют серьезную опасность для здоровья и жизни пациента. Однако многие люди с тромбофилией не испытывают в течение жизни никаких негативных последствий этого состояния.
Специфическое лечение тромбофилии отсутствует. Вопрос необходимости использования профилактической терапии, направленной на предотвращение формирования тромбов, решается индивидуально для каждого пациента. При высоком риске тромбоза профилактическое лечение позволяет предотвратить ряд тяжелых осложнений.
Прогноз тромбофилии зависит от ее типа, наличия и тяжести предшествующих случаев тромбоза, сопутствующих заболеваний.
Симптомы
Большинство пациентов не знают о наличии у них тромбофилии до тех пор, пока не возникнет тромбоз или другие нарушения свертывания крови. Чаще всего при появлении тромба появляются следующие симптомы:
- Отек, покраснение, болезненность, онемение голеней и стоп
- Одышка
- Затруднение дыхания
- Кашель с кровью
- Боль в груди при глубоком вдохе
- Учащенное сердцебиение
- Повторяющиеся выкидыши и другие нарушения течения беременности
Общая информация о заболевании
Тромбофилия представляет собой состояние, при котором сгустки в крови образуются легче, чем в норме. Это происходит за счет изменения соотношения свертывающих и противосвертывающих факторов.
Нормальный процесс свертывания крови необходим для предотвращения кровотечений и заключается в формировании сгустков, которые закупоривают поврежденный сосуд. Процесс формирования сгустка происходит за счет взаимодействия ряда активных веществ – так называемых факторов свертывания. Существуют и противосвертывающие факторы, необходимые для предотвращения избыточного свертывания крови. При тромбофилии баланс этих веществ нарушен – либо повышается количество факторов свертывания, либо снижается количество противосвертывающих веществ. Это может привести к формированию тромбов – сгустков в просвете сосудов (вен или артерий), которые могут закупоривать просвет сосуда, нарушая таким образом кровоснабжение органов и тканей.
Тромбофилии делят на:
- Врожденные (наследственные, первичные). Это тромбофилии, которые обусловлены наличием аномалий в генах, содержащих информацию о белках, участвующих в свертывании крови. Чаще всего встречается дефицит антитротромбина III, протеинов C и S, аномалия фактора V (мутация Лейден), аномалия протромбина G 202110А.
- Дефицит антитромбина III. При этом заболевании нарушен синтез антитромбина III. Является одним из самых распространенных заболеваний среди всех наследственных нарушений свертывания крови. Имеет аутосомно-доминантный тип наследования. Это значит, что передача дефектного гена от родителей к детям происходит независимо от пола, и при наличии хотя бы одного дефектного гена из двух у человека возникнет тромбофилия. Однако ген имеет частичную пенетрантность (проявление), то есть даже при наличии у человека дефектного гена вероятность возникновения тромбоза может быть разной. Антитромбин III – важнейший компонент противосвертывающей системы. Он образует соединения с тромбином, что приводит к их взаимной инактивации. Тромбин – это белок, который участвует в образовании тромба, стимулирует тромбоциты и клетки сосудистой стенки.
- Дефицит протеинов С и S. Протеин С – это белок, который синтезируется в печени. Он активируется тромбином и при взаимодействии с другим важным компонентом крови – протеином S – ограничивает процесс тромбообразования за счет разрушения факторов свертывания V и VIII и прекращения образования фибрина. Таким образом, протеины С и S регулируют интенсивность свертывающей системы крови. Их дефицит приводит к избыточному тромбообразованию.
- Аномалия фактора V (мутация Лейден). При этом заболевании появляется дефект в гене, несущем информацию о пятом факторе свертывания крови. В результате фактор V становится устойчивым к разрушающему действию протеина C. Фактор V является фактором свертывания и участвует в образовании тромбина. При увеличении его количества риск возникновения тромбов повышается.
- Аномалия протромбина. При этом заболевании увеличивается синтез протромбина – предшественника тромбина. В результате активность свертывающей системы крови увеличивается. При подобном нарушении синтеза протромбина часто встречаются не только венозные тромбозы, но и тромбы в артериях сердца и головного мозга, что может привести к инфарктам и инсультам у людей моложе 50 лет.
- Приобретенные. К ним относятся тромбофилии, которые возникли в результате других заболеваний или приема лекарственных препаратов.
- Антифосфолипидный синдром. Это состояние, при котором в организме образуется избыточное количество белков (антител), которые разрушают фосфолипиды – важные компоненты мембраны нервных клеток, тромбоцитов и клеток стенки сосудов. В результате разрушения этих клеток выделяются активные вещества, которые нарушают нормальное взаимодействие свертывающей и противосвертывающей систем крови. В результате возникает повышенная свертываемость и склонность к образованию тромбов. Большое количество антител к фосфолипидам о
Тромбофилия при беременности | Центр (клиника) ЭКО профессора Феськова А.М.
Что такое тромбофилия и как она может повлиять на беременность?
Этот вопрос интересует многих беременных женщин. Тромбофилия — это врожденная либо приобретенная склонность организма к тромбозам. Врожденная тромбофилия обусловлена некоторыми вариантами генов. К приобретенной тромбофилии относят антифосфолипидный синдром и другие заболевания.
Тромбофилия и беременность
На сегодняшний день общепризнаны следующие негативные эффекты, которые может вызвать наследственная тромбофилия при беременности:
• венозные тромбоэмболические осложнения у будущей мамы;
• опасность самопроизвольного аборта на сроке беременности более 10 недель.
Когда нужно обследоваться на наличие тромбофилии?
В том случае, когда есть веские основания предполагать ее наличие и риски ее негативного влияния на течение беременности.
Таким образом, выявлять тромбофилию нужно:
- При наличии тромботических случаев в личном либо семейном анамнезе. Следует отметить, что не все тромбозы являются показанием к такому обследованию, а только те случаи тромбозов, которых «не должно было бы быть». К примеру, тромбоз вен голени после ее перелома имеет конкретную причину, и тромбофилия здесь ни при чем, соответственно искать ее не нужно. Планирование беременности либо прием гормональных контрацептивов сами по себе также не являются основанием для диагностики наличия тромбофилии.
- Повторный выкидыш после 10 недель гестации или наличие тромбозов у беременной.
- Наличие инсультов или инфарктов у ближайших родственников, возникших в молодом возрасте (до 50 лет).
Имплантация эмбриона представляет собой инвазию ворсин трофобласта в спиральные артериолы (мелкие сосуды) эндометрия.
Процесс этот реализуется за счёт ферментов, выделяемых ворсинами трофобласта, которые пробивают слизистую оболочку матки (эндометрий) для прорастания в спиральные артериолы.
Ферментативное расщепление учкастка эндометрия в месте иплантации сопровождается образованием так называемой «раневой поверхности», на которой происходит свёртывание крови вокруг ворсин трофобласта (плодовый фибриноид) с целью прикрепления и дальнейшей инвазии их в артериолы эндометрия.
Имплантация эмбриона => формирование плаценты => физиологическое течение беременности => здоровый ребёнок – являются звеньями одной цепи.
Так формируется фетоплацентарный комплекс необходимый для физиологического течения беременности.
Повышенная свёртываемость крови не позволяет совершить полноценную инвазию ворсин трофобласта.
1. Трофобласт (в месте прилегания к эндометрию это будет плацента, на остальном протяжении — плодовые оболочки)
2. Эмбриобласт — из этой массы клеток формируется в дальнейшем плод
3,4. Железы эндометрия,отвечающие за перестройку внутреннего слоя матки для вынашивания беременности
5,6. Спиральные артериолы эндометрия
6. Спиральная артериола эндометрия, в которой происходит внутрисосудистое свертывание крови
Результат:
- Отрицательный результат программ ЭКО
- Привычное невынашивание беременности
- Осложнённое течение беременности (токсикоз, гестоз )
- Патология фетоплацентарного комплекса (фетоплацентарная нелостаточность, СЗРП (синдром задержки роста и развития плода), преждевременная отслойка нормально расположенной плаценты)
Причины:
- Антифосфолипидный синдром / аутоиммунная патология
- Врождённые дефекты системы гемостаза ( Лейденская мутация, полиморфизм генов факторов свёртывания, протеина С, S, антитромбина ||| )
- Метаболические нарушения (повышение уровня гомоцистеина)
- Повышенная агрегация тромбоцитов
!Повышенная свёртываемость крови — не заболевание. Это состояние предрасполагающее к определённым последствиям (см. выше). Пусковым механизмом служит высокий уровень стероидных гормонов (стимуляция яичников в программе ЭКО, поддержка лютеиновой фазы после переноса), беременность.
Медикаментозная коррекция состоит в подготовке свёртывающей системы (системы гемостаза) к имплантации эмбриона и длительном поддержании её постоянства в зависимости от звена где произошёл сбой.
Областной центр патологии гемостаза
Руководит центром врач высшей категории гематолог-гемостазиолог Валентина Юрьевна Куцемелова. Валентина Юрьевна – ученица основателя российской гемостазиологии Зиновия Соломоновича Баркагана.
Так что же такое гемостаз?
Гемостаз — это биологическая система, обеспечивающая, с одной стороны, сохранение жидкого состояния циркулирующей в сосудах крови и достаточное кровоснабжение органов, а с другой — предупреждение и остановку кровотечений из наиболее ранимых сосудов малого калибра.
Её составляющие:
- Эндотелий, субэндотелий сосудов,
- Клеточные элементы,
- Плазменные системы: свертывающая, фибринолитическая (плазминовая), система физиологических антикоагулянтов, калликреин-кининовая и комплемента.
- Органы синтеза, депонирования и пулирования составляющих — печень, селезенка, костный мозг.
Если система гемостаза не нарушена,
тогда нет клиники кровоточивости и тромбозов
Если же динамическое равновесие нарушается, часа весов отклоняется либо в сторону патологических кровотечений, либо наоборот в сторонутромбозов.
Как можно заподозрить проблему системы гемостаза у человека?
-Спонтанные носовые кровотечения, особенно из обеих ноздрей.
-Образование синяков, гематом без значительных травм.
-Очень обильные и длительные менструации с самого начала их становления.
-Неожиданная большая кровопотеря при операции, экстракции зуба, незначительном ранении.
Возраст пациентов может быть любым
Врожденная склонность к кровотечениям как правило наблюдается уже с детства и юношеского возраста и приводит пациента к педиатру или гематологу. Если же патологические кровотечения манифестируют в более позднем возрасте, как правило, необходима более углубленная диагностика причины состояния.
Но если склонность к кровотечениям обычно проявляется довольно явно, то склонность к тромбозам, т.н. тромбофилии, имеют множество масок.
Тромбофилии – склонность к раннему развитию и рецидивированию внутрисосудистых тромбозов, приводящая к инфарктам и ишемии органов и тканей.
Тромбофилии бывают врожденные и приобретенные.
Когда надо заподозрить тромбофилию?
-Если возникают в раннем и среднем возрасте и\или рецидивируют инсульт, инфаркт миокарда.
-Происходят церебральные транзиторные ишемические атаки без предшествующей гипертонической болезн.
-Возникают тромбозы необычной локализации — тромбоз печеночных и селезеночных сосудов, рецидивирующие мезентериальные тромбозы, тромбозы сосудов сетчатки в молодом возрасте.
-Тромбофлебит вен нижних и\или верхних конечностей без предшествующей венепункции или варикозного изменения вены.
-Тромбофлебит вен нижних конечностей, включая высокие илеофеморальные тромбозы на фоне приема комбинированного орального контрацептива, заместительной гормональной терапии в перименопаузе, во время беременности и в послеоперационном периоде, при наличии гипсовой иммобилизации конечностей.
-Парадоксальные тромбозы при терапии гепарином, варфарином.
Еще один вид реализации тромбофилий-привычное невынашивание беременности или бесплодие.
Почему происходят проблемы в репродуктивной функции?
Эволюционно сложилось так, что при беременности закономерно:
-Повышается концентрация фибриногена,
-Повышается активность факторов Виллебранда, VIII IX X II,
-Повышается агрегация тромбоцитов,
-Угнетается фибринолиз.
Т.е. гиперкоагуляция при беременности — это неизбежное физиологические состояние, которое природой направлено на эффективную имплантацию яйцеклетки, адекватное соединение плаценты с маткой и остановку кровотечения во время родов, но также беременность можно расценивать как тромбофилическое состояние.
Все это дало возможность женщинам не умирать от кровотечения в родах, но с достижениями медицины и социального развития человека мы уже давно живем не в жестких условиях естественного отбора, а с грузом наследственных заболеваний и особенностей конституции, которые ранее не дали бы возможность размножения. И реализуется это таким образом:
Если у женщины имеется нераспознанная фоновая тромбофилия, тогда происходит суммация тромботических факторов и как следствие:
-Привычное невынашивание беременности (самопроизвольные аборты или неразвивающиеся беременности),
-Раннее начало и тяжелое течение гестоза,
-Задержка внутриутробного развития плода,
-Отслойка нормально расположенной плаценты,
-Тромбоз сосудов пуповины-внутриутробная гибель плода,
-Неудачи при ЭКО, первичное бесплодие.
При тромбофилиях:
-изменяются адгезивные характеристики предимплантационого эмбриона
-нарушается слияние синцития
-снижается глубина инвазии трофобласта
-подавляется продукция хорионического гонадотропина
-усиливаются тромботические тенденции за счет предоставления матриц для реакций свертывания.
-Последний момент объясняет положительный эффект от антикоагулянтной терапии с самых ранних сроков.
Эти механизмы также позволяют объяснить неудачные попытки искусственного оплодотворения и пересадки эмбриона у женщин с тромбофилиями
При пролонгировании беременности неуклонно генерируется тромбин не только в сосудах плаценты , но и в др. «шоковых» органах, рано развивается и тяжело протекает гестоз, организм «пытается» избавиться от тромботической ситуации- возникают поздние неудачи
Причем не только так называемая «повышенная свертываемость» может препятствовать развитию беременности, но и врожденные дефекты в генах фолатного цикла, особенно если они выявляются у обоих супругов. При этом эмбрион часто подвержен таким аномалиям развития, которые не совместимы с жизнью и в рамках естественного отбора он погибает, наиболее часто-это неудачи в первом триместре беременности или по типу преэмбрионических (очень краткие задержки менструального цикла, или краткое повышение ХГЧ). При исследовании человеческой популяции, проблема генов фолатного цикла имеется у половины людей, поэтому некоторыми генетиками считается «нормой» и не берется в расчет. Однако тогда следует согласиться, что в мире половина пар имеют проблемы в репродукции и более не лечиться? Нужно понять, что к генетике нужны триггерные механизы, коих несть числа: это употребление алкоголя, инсоляция (интенсивный загар), бесконтрольное употребление БАД-ов, многокомпонентных витаминных комплексов, прием высоких доз ретинола и его производных (например путем употребления широко распространенного препарата аевит, роаккутана, использование ретиноевого пилинга), даже многолетний прием комбинированных оральных контрацептивов ухудшают ситуацию в фолатном цикле, а особенно если в паре есть патология в генах фолатного цикла. Поэтому важно исключить вышеперечисленные ситуации для людей, планирующих репродукцию, а также принимать специальные препараты.
Наиболее часто встречающиеся тромбофилии при синдроме потери плода:
|
Поэтому, при синдроме потери плода, исследование системы гемостаза обязательно, причем еще до наступления ее, чтобы можно было начать лечение еще на этапе фертильного цикла( в период , предшествующий зачатию).
Патологию системы гемостаза можно предположить, но доказать ее можно только с помощью качественной лабораторной диагностики!
Возможности исследования системы гемостаза в ОКДЦ:
|
При выявлении патологии гемостаза, подход к лечению должен быть строго дифференцированным (не навреди!), особенно это касается лечения беременных женщин, а так же пациентов, которых постигла участь парадоксальных тромбозов, т.е. когда тромбозы возникают на фоне лечения Варфарином, гепарином, также в случае массивных спонтанных тромбозов в молодом возрасте:
- Корректировать нужно то звено гемостаза, где есть нарушения.
- Максимально исключить медикаментозную агрессию в период органогенеза.
- Лечение основного заболевания обязательно.
- Максимально снижать риск возможных осложнений терапии — необходим лабораторный контроль эффективности терапии, более широкое использование комбинированных схем лечения.
- Достоверно оценить эффективность лечения.
- Разработать дальнейшую тактику ведения пациента в том числе и на многие годы, если ситуация врожденная или далеко зашедшая.
Если в Вашей клинической практике встречаются пациенты с вышеуказанными заболеваниями, если среди Вашего окружения имеются люди, имеющие вышеуказанные проблемы со здоровьем или данная симптоматика есть у Вас, рекомендуется обследование в рамках специализированного гемостазиологического приема.
Необходимо вовремя распознать нарушение в системе гемостаза, определить какое звено гемостаза страдает, и назначить препараты, подходящие в каждом конкретном случае. Для этого и имеется в ОКДЦ прием терапевта-гемостазиолога, прошедшего специализацию в Федеральном центре по диагностике и лечению патологии гемостаза под руководством З.С. Баркагана.
Также по вопросам системы гемостаза можно обращаться к гематологу ОКДЦ Куцемеловой В.Ю. и терапевту Смоляницкой П.Г.
Правила записи на прием общие для ОКДЦ.
Приоритет обследования по ОМС отдается безусловно первичной дифференциальной диагностике с использованием высокотехнологичных методов обследования, а не выполнению рутинных коагулологических тестов, заменяя ЛПУ первичного звена.
«Внутрисосудистое свертывание крови при COVID-19 определяет весь ход болезни»
Беседа с академиком А.Д. Макацария, крупнейшим специалистом в области клинической гемостазиологии
Сегодня известно, что при COVID-19, в первую очередь, страдает свертывающая система крови. Вот почему у всех умерших от осложнений новой коронавирусной инфекции находят большое количество тромбов. Как это объяснить? Почему это заметили не сразу? Каким образом и почему это происходит? Можно ли предотвратить развитие такого осложнения? Об этом – наш разговор с А.Д. Макацария, академиком РАН, одним из крупнейших в мире специалистов по изучению нарушений свертываемости крови, создателем Школы клинической гемостазиологии, заведующим кафедрой Сеченовского университета. Александр Давидович и его ученики активно сотрудничают с университетом Сорбонны, Венским, Римским, Миланским и Тель-Авивским университетами, Технион в Хайфе. Под его руководителем защищено 150 кандидатских и докторских диссертаций. Автор более 1200 научных трудов, в том числе 40 монографий.
– Александр Давидович, в последнее время во всем мире появляется всё больше сообщений о том, что при COVID-19 страдает свертывающая система крови. Так ли это, и если да, то чем вы объясняете этот феномен?
– Безусловно, это так. Более того, хочу сказать, что практически нет такой инфекции (вирусной или, тем более, бактериальной), которая бы не влияла на свертывание крови. Доказательство тому – учение о сепсисе и септическом шоке как универсальной модели ДВС-синдрома – синдрома диссеминированного внутрисосудистого свертывания крови. Степень тяжести тромботических нарушений зависит от особенностей возбудителя и организма-хозяина (иммунная система, система гемостаза, наличие сопутствующих заболеваний и т.д.).
– Но ведь не у всех пациентов развивается сепсис и септический шок?
– Конечно, не у всех. Поэтому очень актуальным и далеко не изученным в настоящее время является механизм патогенеза осложнений, вызванных коронавирусной инфекцией. Во многом это обусловлено особенностями вируса, а также особенностями организма человека, начиная от количества и качества рецепторов, представленных у человека и их способностью связываться с этим вирусом. Безусловно, на исходы заболевания огромное влияние оказывает коморбидность, то есть наличие сопутствующих хронических заболеваний у пациента.
– Почему, по вашему мнению, эта особенность течения болезни проявилась не сразу?
— Я считаю, что все это проявилось сразу, но не было адекватно оценено врачами изначально: еще не было такого количества вскрытий и широкого тестирования на гемостазиологические маркеры. Надо сказать, мы занимаемся изучением этой проблемы довольно давно, практически с самого начала эпидемии. Еще в самом начале апреля мы опубликовали работу, основанную на первых наблюдениях наших китайских коллег. Работа называлась «COVID-19 и синдром диссеминированного внутрисосудистого свертывания крови». Она имела чрезвычайно широкий резонанс, поскольку уже тогда врачи начали понимать роль свертывающей системы крови в инфекционном процессе.
– Каков механизм тромбообразования при covid-19 и отличается ли он от этого процесса при других патологиях?
– Это очень непростой вопрос. На сегодняшний день однозначно можно утверждать – при этом вирусе с самого начала имеет место активация гемостаза, внутрисосудистое свертывание крови и тромбообразование в сосудах мелкого калибра жизненно важных органов. При этом повреждаются не только легкие, а блокада микроциркуляции и ее необратимый характер определяют исход заболевания. Позднее начало антикоагулянтной терапии является неблагоприятным фактором. Причем этот процесс внутрисосудистого свертывания в капиллярах легкого играет важную роль в развитии острого респираторного дистресс-синдрома (ОРДС), о котором все говорят. Но далеко не все с самого начала уловили связь между внутрисосудистым свертыванием крови и ОРДС.
В западной литературе даже появился термин «легочная интраваскулярная коагуляция». Практически во всех случаях имеет место активация системного воспалительного ответа. Это общебиологическая реакция, которая особенно проявляется в ответ на инфекцию, вирусные возбудители. Международные организации признали, что коронавирусная инфекция – это сепсис.
С другой стороны, международная организация по тромбозу и гемостазу в абсолютном числе случаев признала наличие ДВС-синдрома у тяжелых больных с COVID-19 . Сочетание сепсиса и коагулопатии – это септический шок. Еще китайские коллеги указывали, что в 92% случаев больные умирают от септического шока. Конечно, нельзя отрицать, что наряду с вирусом причиной септического шока может быть присоединение вторичной бактериальной инфекции. У больных COVID-19 и нарушениями в системе гемостаза, как правило, имеет место гиперферритинемия, которая возникает при критических состояниях как реактант острой фазы воспаления и характеризуется цитокиновым штормом вследствие гиперактивации макрофагов и моноцитов. Вследствие этого вырабатывается большое количество ферритина – сложного белкового комплекса, выполняющего роль основного внутриклеточного депо железа у человека и животных. В данном случае это всегда белок острой фазы, маркер тяжелого воспаления, а вовсе не показатель перегрузки железом, как можно подумать на первый взгляд.
Таким образом, цитокиновый и тромботический шторм усугубляют состояние больного и определяют степень тяжести. Но есть и особенности. Возможно, при COVID-19 в первую очередь повреждается фибринолиз – часть системы гемостаза, которая обеспечивает процесс разрушения уже сформированных кровяных сгустков, тем самым, выполняя защитную функцию предотвращения закупорки кровеносных сосудов фибриновыми сгустками. Отсюда синдром фибринирования при меньшей частоте геморрагических осложнений. И отсюда же открывается перспектива применения тромболитиков, о чем сейчас так много говорят и пишут. А впервые предложили такую схему наши американские коллеги.
– А ведь есть немало людей с нарушениями свертываемости крови. Сейчас, во время эпидемии, для них настали трудные времена.
– Это так. В нашей популяции есть люди не только с явными, но и со скрытыми нарушениями гемостаза, предрасполагающими к тромбозам – генетические тромбофилии, антифосфолипидный синдром и ряд других заболеваний, сопровождающихся избыточной активацией системы гемостаза; а также люди с высокой готовностью к супервоспалительному ответу (врожденные факторы и ряд ревматологических и иммунных заболеваний). Им сейчас важно контролировать своё состояние, а врачам не забывать об этом.
И, наконец, COVID-19 – это тромбовоспаление. Это, по сути, вирус-опосредованная модель NET-оза, которая характеризует тесную взаимосвязь таких биологических процессов, как воспаление и тромбообразование. Нейтрофилы и выделяемые ими внеклеточные ловушки нейтрофилов (NET) играют огромную роль в развитии так называемых иммунотромбозов. Это одно из приоритетных научных направлений сегодня , которое мы сейчас вместе с учениками и в том числе зарубежными коллегами также разрабатываем.
Вообще надо сказать, что открытие NET расширило горизонты в понимании биологии нейтрофилов и роли этих клеток в организме. Использование организмом хозяина хроматина в сочетании с внутриклеточными белками в качестве естественного противомикробного агента имеет древнюю историю и меняет наше представление о хроматине как только о носителе генетической информации. Благодаря избыточному и неконтролируемому формированию NET, нейтрофилы могут способствовать развитию патологического венозного и артериального тромбоза, или «иммунотромбоза», а также играют важную роль в процессах атеротромбоза и атеросклероза. Высвобождение NET является, как выяснилось, одной из причин тромбообразования при таких состояниях, как сепсис и рак. Наличие NET при этих заболеваниях и состояниях дает возможность использовать их или отдельные компоненты в качестве потенциальных биомаркеров. NET и их компоненты могут быть привлекательны в качестве терапевтических мишеней. Дальнейшие исследования нейтрофилов и NET необходимы для разработки новых подходов к диагностике и лечению воспалительных и тромботических состояний.
– Размышляя о высокой летальности у пациентов, которым пришлось применить ИВЛ, вы констатируете, что мы, возможно, пошли не тем путем. А какой путь может оказаться более верным?
– Да, я имел в виду, что при оценке вентиляционно-перфузионных нарушений при COVID-19 превалируют перфузионные нарушения, нарушения микроциркуляции, а это значит, что главная терапевтическая мишень – восстановление нормальной перфузии тканей, то есть противотромботическая терапия, а возможно, даже и фибринолитическая. Механическая вентиляция не может решить вопрос перфузионных нарушений.
– Видите ли вы, что в связи с эпидемией стали более частыми проблемы тромбообразования в акушерско-гинекологической практике?
– Случилось так, что во многом и благодаря нашим стараниям (лекциям и публикациям), большинство акушеров сегодня осведомлены о том, что беременность – это состояние так называемой физиологической гиперкоагуляции, и этим пациенткам нередко назначаются антикоагулянты во время беременности. Тем не менее, требуются дальнейшие исследования для вынесения суждения о частоте тромбозов у беременных с COVID-19.
Вообще надо сказать, что большинство осложнений беременности либо обусловлены, либо сочетаются с высоким тромбогенным потенциалом. Генетические факторы свертывания крови, особенно антифосфолипидный синдром, являются факторами риска огромного количества осложнений беременности – это и внутриутробные гибели плода, и неудачи ЭКО, и задержка внутриутробного развития плода, и преждевременная отслойка плаценты, что приводит к тяжелым тромбогеморрагическим осложнениям, это, наконец, тромбозы и тромбоэмболии. Поэтому, конечно, можно ожидать, что в условиях COVID-19 эти осложнения могут представлять собой еще большую опасность. Ведь вирус может быть фактором, активирующим факторы свертываемости крови. Конечно, тут нужны обобщающие исследования, но уже сейчас наши отдельные наблюдения говорят о том, что риск таких осложнений возрастает.
– Являются ли, на ваш взгляд, одним из проявлений этой проблемы случаи тяжелого течения covid-19 в педиатрии (состояния, похожие на синдром Кавасаки)?
–
Глава ВОЗ Тедрос Аданом Гебрейесус призвал врачей всех стран обратить особое внимание на сообщения о том, что у некоторых детей, заразившихся коронавирусом, проявляются симптомы, схожие с еще одним заболеванием — синдромом Кавасаки (мультисистемным воспалительным синдромом). Действительно, в сообщениях из Европы и Северной Америки говорилось, что некоторое число детей поступало в отделения интенсивной терапии с мультисистемным воспалительным состоянием, с некоторыми симптомами, похожими на синдром Кавасаки и синдром токсического шока.
Синдром Кавасаки был впервые описан в 1967 году японским педиатром по имени Томисаку Кавасаки. Он обычно поражает детей до пяти лет. При этом синдроме у пациента начинается воспаление кровеносных сосудов (васкулит) и лихорадка. Болезнь Кавасаки имеет четко выраженный набор симптомов, включая постоянно высокую температуру, покраснение глаз и области вокруг рта, сыпь на теле и покраснение и отек ног и рук.
13 мая нынешнего года в авторитетном медицинском издании The Lancet было опубликовано исследование итальянских врачей, которые сообщили, что в провинции Бергамо, одной из наиболее пострадавших от эпидемии коронавируса, была зафиксирована вспышка синдрома Кавасаки или схожего с ним синдрома.
Важно, что в большинстве случаев дети также имели положительный результат теста на антитела к КОВИД-19, предполагая, что синдром последовал за вирусной инфекцией.
Болезнь Кавасаки имеет тенденцию проявляться в группах генетически похожих детей и может выглядеть немного по-разному в зависимости от генетики, лежащей в основе группы. Это говорит о том, что различные триггеры могут вызывать воспалительную реакцию у детей с определенной генетической предрасположенностью.
Вполне возможно, что атипичная пневмония SARS-COV-2, вызванная вирусом COVID-19, является одним из таких триггеров. Это важный вопрос, требующий пристального изучения.
– Александр Давидович, как вы думаете, почему у всех COVID-19 проявляется по-разному?
– Тут очень важна проблема факторов риска. Всё дело в том, что, помимо видимых болезней типа сахарного диабета или гипертонии, существуют болезни невидимые, о которых мы зачастую даже не подозреваем. В последние годы большое распространение получило учение о генетической тромбофилии. Во всем мире это примерно до 20 процентов людей, которые являются носителями той или иной формы генетической тромбофилии. С этим можно жить сто лет, но если возникает инфекция, травма, делается операция – больной может погибнуть от тромбоэмболии, даже если операция выполнена на высочайшем техническом уровне. Причиной тому – скрытая генетическая тромбофилия – мутация, которая делает её носителя подверженным высокому риску тромбообразования.
Одна из форм тромбофилии – так называемая гипергомоцистеинемия, которая может быть как приобретенной так и генетически обусловленной, также может быть важным фактором тромбозов, инфарктов, инсультов. А сейчас есть данные о том, что гипергомоцистеинемия усугубляется и при SARS-CoV2 инфекции. Соответственно, в группу риска входят все те, у кого повышен уровень гомоцистеина в крови , но человек может не знать об этом. Поэтому мы сейчас начали масштабное исследование по выявлению этих групп риска, выделению различных форм тромбофилии у больных с COVID-19. Наша цель – узнать, входят ли эти люди в группы риска по развитию тяжелых осложнений новой коронавирусной инфекции.
Высокая контагиозность вируса и большое количество заболевших поневоле «позволяет» вирусу выявить людей с изначальной явной или скрытой предрасположенностью к тромбозам. Это пациенты не только с генетической тромбофилией или антифосфолипидным синдромом, но и с сахарным диабетом, ожирением, ревматическими болезнями и другими патологическими состояниями, ассоциированными с повышенным свертыванием и/или воспалением.
– Какие методы профилактики и лечения covid-19 вы считаете перспективными?
– Помимо уже названных, это противовирусная терапия, терапия специфическими иммуноглобулинами, противотромботическая терапия и лечение, направленное на снижение воспаления (так называемые антицитокиновые препараты). Многое нам предстоит ещё понять об этом новом для нас заболевании, но постепенно мы движемся в сторону лучшего объяснения многих его механизмов. Вы знаете, я всегда много работал, но, пожалуй, никогда ещё я не был так занят исследовательской и практической работой, как сейчас. Уверен, что она даст свои важные результаты.
Беседу вела Наталия Лескова.
Связь между врожденной тромбофилией и исходами у пациентов с тромбоэмболией легочной артерии | Кровавые достижения
Легочная эмболия (ТЭЛА), один из основных типов венозной тромбоэмболии (ВТЭ), представляет собой опасное для жизни заболевание. Это также важная проблема общественного здравоохранения, которая стала третьим по распространенности сердечно-сосудистым заболеванием со смертельным исходом в мире. 1 Хотя связь между врожденной тромбофилией и тромбозом глубоких вен (ТГВ) и их этническими различиями была выяснена, 2-4 роль врожденной тромбофилии у пациентов с ТЭЛА еще предстоит определить, независимо от этнической принадлежности.
Наиболее распространенные типы врожденной тромбофилии включают лейденскую мутацию фактора V, мутацию протромбина G20210A, дефицит протеина C (PCD), дефицит протеина S (PSD) и дефицит антитромбина III (ATIII). Распространенность врожденной тромбофилии разнообразна и зависит от этнической принадлежности. 5 Лейденские мутации фактора V и протромбина G20210A составляют> 60% случаев врожденной тромбофилии у белых пациентов, 3,6,7 , в то время как дефицит антикоагулянтов, таких как протеин C, протеин S и ATIII, является основными подтипами врожденной тромбофилии у белых пациентов. Азиатские пациенты. 8-11
Однако большинство предыдущих исследований врожденной тромбофилии в основном были сосредоточены на пациентах с ТГВ. Только в одном небольшом исследовании из Южной Кореи изучалась распространенность и генетический фон тромбофилии у пациентов с ТЭЛА. 12 Влияние врожденной тромбофилии на пациентов с ТЭЛА с факторами риска или без них, а также на исходы пациентов с ТЭЛА не определено. Настоящее исследование направлено на изучение распространенности и распределения 5 известных подтипов врожденной тромбофилии в большой когорте пациентов с ТЭЛА и оценки влияния врожденной тромбофилии на заболеваемость и исходы ТЭЛА.
Это исследование проводилось в Центре тромбозов и сосудистой медицины больницы FuWai при Китайской академии медицинских наук (Пекин, Китай), национальном справочном центре по ПЭ. Исследование проводилось в период с мая 2013 г. по июнь 2018 г. Пациенты с ПЭ последовательно включались в исследование при постановке диагноза ПЭ. Диагноз ТЭЛА был основан на стандартизированной диагностической работе с ТЭЛА следующим образом: пациенты оценивались с помощью компьютерной томографии, ангиографии легких (КТПА) или вентиляции / перфузионного сканирования на предмет ТЭЛА и компрессионного УЗИ для ТГВ.Пациенты, которые отказались участвовать в генетическом тестировании, или те, кто не соответствовал критериям тестирования на врожденные антикоагулянты, были исключены. Это исследование было одобрено наблюдательным советом больницы FuWai.
Выборка состояла из пациентов с ТЭЛА с факторами риска и пациентов с ТЭЛА без факторов риска. Факторы риска были основаны на рекомендациях Европейского общества кардиологов 2019 года, 13 , включая активный рак, застойную сердечную недостаточность, инфаркт миокарда, паралитический инсульт, постельный режим> 3 дней, беременность, послеродовой период, использование оральных контрацептивов, серьезные травмы, хирургические операции, использование гипсовой повязки в течение 3 месяцев до события, антифосфолипидный синдром (APS) и другие аутоиммунные заболевания.
Были собраны данные, касающиеся истории болезни пациента с ВТЭ, места тромбоэмболии (с или без ТГВ) и начального лечения. Всем пациентам был незамедлительно поставлен диагноз, и они наблюдались в течение ≥3 месяцев. Пациенты с диагнозом тромбофилия должны были получать длительную антикоагулянтную терапию, в то время как пациенты без тромбофилии должны были пройти 6 месяцев антикоагулянтной терапии. Общий дизайн исследования представлен на Рисунке 1.
Рисунок 1.
Рисунок 1.
Врожденный дефицит антикоагулянтов определялся снижением антикоагулянтной активности <2 стандартного отклонения (SD) после исключения потенциальных приобретенных факторов, таких как применение дикумарола и гепарина, аутоиммунные заболевания, злокачественные новообразования и беременность. Тесты включали скрининг активности протеина C (HemosIL Protein C, Instrumentation Laboratory Company), активности протеина S (ProS, Instrumentation Laboratory Company) и активности антитромбина III (HemosIL Liquid Antithrombin, Instrumentation Laboratory Company).Белок C и ATIII анализировали с помощью анализов хромогенного субстрата, тогда как белок S определяли с помощью анализа свертывания с использованием ACL TOP 700 (Instrumentation Laboratory Company). Референсные диапазоны были определены в соответствии с нашими лабораторными данными, и тесты были повторены дважды с интервалом не менее 1 недели. Как минимум 1 тест был проведен через 1 месяц после нового события ВТЭ. 4,15 Первый тест на тромбофилию был проведен на следующий день после постановки диагноза ТЭЛА. В случае положительного результата теста на тромбофилию тест повторяли через 7 дней.Пациенты с постоянным снижением антикоагулянтной активности были повторно проверены через 3 месяца наблюдения.
Пациенты находились под наблюдением после возникновения эпизода индексной ТЭЛА в амбулаторном режиме антикоагуляции в больнице FuWai. Специализированная группа WeChat для пациентов была организована врачами из Центра тромбозов и сосудистой медицины для быстрой связи. Пациент был впервые опрошен через 3 месяца после постановки диагноза ТЭЛА, а второе наблюдение было запланировано через 1 год после постановки диагноза ТЭЛА.В дальнейшем пациентка наблюдалась один раз в год. В течение этого периода, если у пациента не было события исхода, последующее наблюдение продолжалось.
Основным исходом была комбинация смерти или рецидива симптоматической ТЭЛА и ТГВ. Было зарегистрировано сильное кровотечение для оценки риска кровотечения при антикоагулянтной терапии. Рецидивирующая симптоматическая ТЭЛА определялась как развитие нового дефекта внутрипросветного наполнения в ≥1 сегментарной или проксимальной ветви при тестировании CTPA или развитие нового дефекта перфузии ≥75% от 1 сегмента по сравнению с нормальным исходным уровнем.Рецидив DVT был определен аномальным дефектом внутрипросветного наполнения при венографии с помощью компрессионного ультразвука. Обильное кровотечение было определено как опасное для жизни кровотечение, требующее переливания ≥2 Ед эритроцитов или приводящее к абсолютному снижению гематокрита> 10% или смерти или геморрагической / субдуральной гематоме.
Всего 513 пациентов с ПЭ, госпитализированных в Центр тромбозной и сосудистой медицины больницы FuWai в период с мая 2013 г. по июнь 2018 г., были проверены на право участия в исследовании.В исследование было включено 436 пациентов, 77 из которых были исключены из-за неполного тестирования на тромбофилию (рис. 1). Из 436 включенных пациентов средний возраст (SD) составил 57,9 (15,8) лет. Большинство пациентов составляли женщины (46,1% мужчин, 53,9% женщин). В общей сложности 277 пациентов (63,5%) имели как ТГВ, так и ТЭЛА на момент постановки диагноза, а 87 пациентов (20%) имели в анамнезе рецидивы ТЭЛА. Новые пероральные антикоагулянты (НОАК), не зависящие от витамина К, в качестве начальной терапии использовали 80,7% пациентов нашего центра.Из 436 включенных пациентов у 117 (26,8%) была диагностирована ПЭ с фактором риска, а у остальных 319 (73,2%) — ПЭ без фактора риска (Таблица 1). Наиболее частым предрасполагающим фактором была недавняя операция или травма, за которыми следовали иммобилизация, рак, APS и другие заболевания соединительной ткани, терапия эстрогенами, послеродовой период, инсульт и застойная сердечная недостаточность (дополнительная таблица 1).
Таблица 1.
Клиническая характеристика пациентов с ПЭ в исследовании
| Характеристики . |
пациентов с ПЭ (N = 436) . |
|---|---|
| Возраст, среднее ± стандартное отклонение , лет | 57,9 ± 15,8 |
| Возраст в первом эпизоде , лет | |
| ≤50 | 134 (30,7 ) |
| > 75 | 40 (9,2) |
| Мужской | 201 (46,1) |
| BMI , кг / м 2 * | |
| ≤18.5 | 13 (3,0) |
| > 18,5-28 | 273 (62,6) |
| > 28 | 93 (21,3) |
| С DVT | 277 (63,5) |
| Предыдущая VTE | 87 (20,0) |
| Первичное лечение † | |
| NOAC | 352 (80,7) |
| Стандартный режим VKA | 81 (18,6) |
| Пациенты с тромболитическая терапия | 25 (5.7) |
| Характеристики . |
пациентов с ПЭ (N = 436) . |
|---|---|
| Возраст, среднее ± стандартное отклонение , лет | 57,9 ± 15,8 |
| Возраст в первом эпизоде , лет | |
| ≤50 | 134 (30,7 ) |
| > 75 | 40 (9,2) |
| Наружный | 201 (46.1) |
| ИМТ , кг / м 2 * | |
| ≤18,5 | 13 (3,0) |
| > 18,5-28 | 273 (62,6) |
| > 28 | 93 (21,3) |
| С ТГВ | 277 (63,5) |
| Предыдущее VTE | 87 (20,0) |
| Первичная обработка † | |
| НОАК | 352 (80.7) |
| Стандартный режим АВК | 81 (18,6) |
| Пациенты, проходящие тромболитическую терапию | 25 (5,7) |
Из 436 пациентов с ПЭ 31 (7,1%) соответствовали диагностическим критериям врожденной тромбофилии (рис. 2). Наиболее частыми типами врожденной тромбофилии были дефициты протеина S (13/436 [3,0%]; 13/31 [42%]) и протеина C (12/436 [2.8%]; 12/31 [39%]). Эти 2 подтипа составляли> 80% пациентов с врожденной тромбофилией, за которыми следовала недостаточность ATIII (5/436 [1,1%]; 5/31 [16%]). Только 1 пациент (1/436 [0,2%]; 1/31 [3%]) имел лейденские мутации фактора V, и ни один (0/436 [0%]; 0/31 [0%]) не имел мутаций протромбина G20102A ( Фигура 2).
Рисунок 2.
Распространенность 5 известных подтипов врожденной тромбофилии у китайских пациентов с ПЭ. (A) Распространенность врожденной тромбофилии у пациентов с симптоматической ТЭЛА. (B) Распределение 5 известных подтипов врожденной тромбофилии. FVL, фактор V Лейден; ПТ, протромбин.
Рисунок 2.
Распространенность 5 известных подтипов врожденной тромбофилии у китайских пациентов с ПЭ. (A) Распространенность врожденной тромбофилии у пациентов с симптоматической ТЭЛА. (B) Распределение 5 известных подтипов врожденной тромбофилии. FVL, фактор V Лейден; ПТ, протромбин.
При сравнении распространенности тромбофилии у пациентов с ТЭЛА с факторами риска и без них, статистически значимых различий между двумя группами не наблюдалось (7.5% против 6,0%, P = 0,68). В многомерном логистическом регрессионном анализе переменными, независимо связанными с прогнозированием возникновения врожденной тромбофилии, были возраст первого эпизода ПЭ ≤50 лет (отношение шансов [OR], 5,43, 95% доверительный интервал [CI], 2,35-13,52; P <0,001) и мужской пол (OR 2,67; 95% ДИ 1,15-6,78; P = 0,03) (Таблица 2).
Таблица 2.
Характеристики пациентов с ПЭ с врожденной тромбофилией и факторами риска возникновения врожденной тромбофилии при ПЭ
| Характеристики . |
Пациенты с тромбофилией (n = 31), n (%) . |
п. . |
Однопараметрический анализ . |
Многопараметрический анализ * . |
||
|---|---|---|---|---|---|---|
| ИЛИ (95% ДИ) . |
п. . |
OR (95% ДИ) . |
п. . |
|||
| PE без фактора риска | .68 | |||||
| Да | 24/319 (7,5) | 1,28 (0,56-3,29) | ,58 | 3,70 (0,14-61,82) | ,36 | |
| № | 7/117 (6,0) | 1 (справка) | 1 (справка) | |||
| Возраст ≤50 лет в первой серии | <0,01 | |||||
| Да | 22/134 (16.4) | 6,39 (2,95-15,04) | <0,001 | 5,43 (2,35-13,52) | <0,001 | |
| Нет | 9/302 (3,0) | 1 (исх. ) | 1 (ссылка) | |||
| Пол | <0,01 | |||||
| Мужской | 23/201 (11,4) | 3.67 (1,67-8,92) | 0,002 | 2,67 (1,15-6,78) | 0,03 | |
| Внутренняя часть | 8/235 (3,4) | 1 (ссылка) | 1 (ссылка ) | |||
| С DVT | .08 | |||||
| Да | 25/277 (9,0) | 2,53 (1,08-6,93) | .05 | 1.73 (0,66-5,13) | ,29 | |
| Нет | 6/159 (3,8) | 1 (ссылка) | 1 (ссылка) | |||
| Причина PE † | ||||||
| Недавняя операция или травма | 1,00 | .64 | ||||
| Да | 2/38 (5 .3) | 0,71 (0,11–2,48) | 2,32 (0,08–38,70) | .55 | ||
| Нет | 29/398 (7,3) | 1 (исх.) | 1 (ссылка) | |||
| Иммобилизация | 1,00 | .57 | ||||
| Да | 1/24 (4,2) | 0,55 (0,03-2.77) | 2,62 (0,09-26,63) | .46 | ||
| Нет | 30/412 (7,3) | 1 (ссылка) | 1 (ссылка) | |||
| Активный рак | 1,00 | NE | .99 | |||
| Да | 0/12 (0,0) | NE | .99 | |||
| Нет | 31/424 (7.3) | |||||
| APS и другие заболевания соединительной ткани | 1,00 | .57 | ||||
| Да | 1/24 (4,2) | 0,55 (0,03–2,77) | 0,86 (0,02–15,15) | 0,92 | ||
| Нет | 30/412 (7,3) | 1 (справка) | 1 (ref) | |||
| Эстрогеновая терапия и послеродовой период | 1.00 | NE | .99 | |||
| Да | 0/2 (0,0) | NE | .99 | |||
| Нет | 31/434 (7,5 ) | |||||
| Ход | 1,00 | NE | .99 | |||
| Да | 0/4 (0.0) | NE | .99 | |||
| Нет | 31/432 (7.2) | |||||
| Застойная сердечная недостаточность | . 17 | ,15 | ||||
| Да | 3/19 (15,8) | 2,60 (0,58-8,42) | 6.96 (0,24-120,40) | ,18 | ||
| Нет | 28/417 (6,7) | 1 (ссылка) | 1 (ссылка) | |||
| Острый коронарный синдром | 1,00 | .95 | ||||
| Да | 1/15 (6,7) | 0,93 (0,05-4,88) | 2,84 (0,07-36,22) | .47 | ||
| № | 30/421 (7,1) | 1 (ссылка) | 1 (ссылка) | |||
| Предыдущий VTE | .06 | |||||
| Да | 11/87 (12,6) | 2,38 (1,06-5,10) | 0,03 | 1,64 (0,65-3,98) | ,28 | |
| Нет | 20/349 (5.7) | 1 (ссылка) | ||||
| Тромболитическая терапия | .70 | |||||
| Да | 2/25 (8,0 ) | 2,71 (0,75-7,75) | 0,09 | 2,31 (0,57-7,73) | ,20 | |
| Нет | 29/411 (7,1) | 1 (ссылка) | 1 (исх.) | |||
| Характеристики . |
Пациенты с тромбофилией (n = 31), n (%) . |
п. . |
Однопараметрический анализ . |
Многопараметрический анализ * . |
||
|---|---|---|---|---|---|---|
| ИЛИ (95% ДИ) . |
п. . |
OR (95% ДИ) . |
п. . |
|||
| PE без фактора риска | .68 | |||||
| Да | 24/319 (7,5) | 1,28 (0,56-3,29) | ,58 | 3,70 (0,14-61,82) | ,36 | |
| № | 7/117 (6,0) | 1 (справка) | 1 (справка) | |||
| Возраст ≤50 лет в первой серии | <0,01 | |||||
| Да | 22/134 (16.4) | 6,39 (2,95-15,04) | <0,001 | 5,43 (2,35-13,52) | <0,001 | |
| Нет | 9/302 (3,0) | 1 (исх. ) | 1 (ссылка) | |||
| Пол | <0,01 | |||||
| Мужской | 23/201 (11,4) | 3.67 (1,67-8,92) | 0,002 | 2,67 (1,15-6,78) | 0,03 | |
| Внутренняя часть | 8/235 (3,4) | 1 (ссылка) | 1 (ссылка ) | |||
| С DVT | .08 | |||||
| Да | 25/277 (9,0) | 2,53 (1,08-6,93) | .05 | 1.73 (0,66-5,13) | ,29 | |
| Нет | 6/159 (3,8) | 1 (ссылка) | 1 (ссылка) | |||
| Причина PE † | ||||||
| Недавняя операция или травма | 1,00 | .64 | ||||
| Да | 2/38 (5 .3) | 0,71 (0,11–2,48) | 2,32 (0,08–38,70) | .55 | ||
| Нет | 29/398 (7,3) | 1 (исх.) | 1 (ссылка) | |||
| Иммобилизация | 1,00 | .57 | ||||
| Да | 1/24 (4,2) | 0,55 (0,03-2.77) | 2,62 (0,09-26,63) | .46 | ||
| Нет | 30/412 (7,3) | 1 (ссылка) | 1 (ссылка) | |||
| Активный рак | 1,00 | NE | .99 | |||
| Да | 0/12 (0,0) | NE | .99 | |||
| Нет | 31/424 (7.3) | |||||
| APS и другие заболевания соединительной ткани | 1,00 | .57 | ||||
| Да | 1/24 (4,2) | 0,55 (0,03–2,77) | 0,86 (0,02–15,15) | 0,92 | ||
| Нет | 30/412 (7,3) | 1 (справка) | 1 (ref) | |||
| Эстрогеновая терапия и послеродовой период | 1.00 | NE | .99 | |||
| Да | 0/2 (0,0) | NE | .99 | |||
| Нет | 31/434 (7,5 ) | |||||
| Ход | 1,00 | NE | .99 | |||
| Да | 0/4 (0.0) | NE | .99 | |||
| Нет | 31/432 (7.2) | |||||
| Застойная сердечная недостаточность | . 17 | ,15 | ||||
| Да | 3/19 (15,8) | 2,60 (0,58-8,42) | 6.96 (0,24-120,40) | ,18 | ||
| Нет | 28/417 (6,7) | 1 (ссылка) | 1 (ссылка) | |||
| Острый коронарный синдром | 1,00 | .95 | ||||
| Да | 1/15 (6,7) | 0,93 (0,05-4,88) | 2,84 (0,07-36,22) | .47 | ||
| № | 30/421 (7,1) | 1 (ссылка) | 1 (ссылка) | |||
| Предыдущий VTE | .06 | |||||
| Да | 11/87 (12,6) | 2,38 (1,06-5,10) | 0,03 | 1,64 (0,65-3,98) | ,28 | |
| Нет | 20/349 (5.7) | 1 (ссылка) | ||||
| Тромболитическая терапия | .70 | |||||
| Да | 2/25 (8,0 ) | 2,71 (0,75-7,75) | ,09 | 2,31 (0,57-7,73) | ,20 | |
| Нет | 29/411 (7,1) | 1 (ссылка) | 1 (ссылка) | |||
Группа тромбофилии была моложе по сравнению с пациентами без тромбофилии (45.4 против 58,9, P <0,01). Более половины пациентов с тромбофилией имели первый приступ ТЭЛА в возрасте <50 лет (71,0% против 27,7%, P <0,01). Кроме того,> 30% пациентов в группе тромбофилии имели в анамнезе ВТЭ в анамнезе, что было значительно выше по сравнению с группой без тромбофилии (35,5% против 18,8%, P = 0,04). Большинство пациентов с тромбофилией были мужчинами (74,2% против 44,0%, P <0,01) (дополнительная таблица 2).
Не было статистически значимых различий в клинических характеристиках среди пациентов с различными подтипами тромбофилии, за исключением того, что у пациентов с ТЭЛА, возникших в результате дефицита ATIII, редко обнаруживался ТГВ ( P <.01) (дополнительная таблица 3).
В течение периода наблюдения 7 пациентов умерли в течение 3 месяцев после постановки диагноза и 16 пациентов были потеряны для последующего наблюдения; остальные пациенты наблюдались в течение ≥3 месяцев. Среднее время наблюдения составило ~ 800 дней (от 11 до 1872 дней). В общей сложности 31 пациент (7,1%) умер, а у 30 пациентов (6,8%) возникли рецидивы тромботических событий. Из 30 пациентов с рецидивом 10 произошли во время антикоагулянтной терапии, а 20 — после прекращения лечения.У четырех пациентов произошло сильное кровотечение, потребовавшее госпитализации и изменения антикоагулянтной терапии (рис. 1).
После сравнения пациентов с ТЭЛА с тромбофилией и без нее мы не обнаружили статистически значимых различий в смертности от всех причин (7,7% против 0,0%, P = 0,15) или частоте рецидивов (7,2% против 3,2%, P =. 71). Что касается пациентов с тромбофилией, только у 1 пациентки с PCD был рецидив ТЭЛА, подтвержденный CTPA, и ни один пациент не умер во время наблюдения (дополнительная таблица 2).Хотя статистически значимой разницы не было, риск комбинированного исхода смерти и рецидива ВТЭ был ниже среди пациентов с врожденной тромбофилией, чем среди пациентов без врожденной тромбофилии (отношение рисков 0,18; 95% ДИ 0,02-5,69; P = 0,08) (Рисунок 3). Между тем, риск кровотечения также был одинаковым между двумя группами (1,0% против 0,0%, P = 1,00). У пациентов с врожденной тромбофилией не было серьезных кровотечений, несмотря на то, что они получали длительную антикоагулянтную терапию (дополнительная таблица 2).
Рисунок 3.
Выживаемость без рецидивов у пациентов с ТЭЛА с врожденной тромбофилией и без нее.
Рисунок 3.
Выживаемость без рецидивов у пациентов с ТЭЛА с врожденной тромбофилией и без нее.
Тромбофилия — это заболевание с нарушением свертывающей системы, которое увеличивает риск тромбоза.Врожденная тромбофилия — это состояние гиперкоагуляции, вызванное различными генетическими факторами риска и триггерами окружающей среды. Распространенность врожденной тромбофилии широко варьируется среди разных этнических групп. 5 У белых пациентов наиболее часто встречается нарушение регуляции прокоагулянта в результате лейденских мутаций фактора V и мутаций протромбина G20210A. 7,16 У азиатов дефицит естественных антикоагулянтов плазмы, включая протеин C, протеин S и ATIII, чаще встречается у пациентов с ВТЭ.Сообщаемая распространенность PSD, PCD и дефицита ATIII у японских пациентов с DVT составляет 17,7%, 8,0% и 5,6% соответственно. 11,17 У китайских ханьских пациентов с ВТЭ распространенность PCD, PSD и дефицита ATIII составляет 10,3%, 13,9% и 1,9% соответственно. 18
В настоящем исследовании у 7,1% пациентов с ТЭЛА была диагностирована врожденная тромбофилия, включая дефицит PCD, PSD и ATIII, а также лейденского фактора V.Интересно, что PSD (3,0%) является наиболее частым подтипом врожденной тромбофилии, за которым следуют PCD (2,8%) и дефицит ATIII (1,1%). Только у 1 пациента (0,2%) была диагностирована гетерозиготная мутация фактора V по Лейдену. Таким образом, распространенность врожденной тромбофилии в нашем центре намного ниже, чем ранее сообщалось для азиатской когорты ВТЭ, в то время как распределение тромбофилии аналогично в 2 группах. Снижение распространенности может быть связано с разными характеристиками пациентов с ТЭЛА и ТГВ.В нашем исследовании пациенты с ТЭЛА с врожденной тромбофилией показали тенденцию к коморбидному ТГВ (80,6% против 62,2%, P = 0,06), особенно при наиболее распространенных подтипах тромбофилии, PCD (83,3%) и PSD (100%) ( дополнительные таблицы 2 и 3). Это предполагало возможное объяснение того, что пациенты с PCD и PSD были склонны к DVT. Другие потенциальные доказательства включали в себя распространенность PCD и PSD более чем в 3 раза выше у пациентов с VTE, чем у пациентов с PE, в то время как распространенность дефицита ATIII была аналогичной в 2 когортах.Более того, согласно Лейденскому парадоксу фактора V, 19-22 врожденный тромбоз, такой как лейденская мутация фактора V, является фактором риска ТГВ, но не ТЭЛА. В качестве крупнейшего скрининга пациентов с ТЭЛА с тромбозом наше исследование подтвердило этот вывод, обнаружив низкую частоту мутаций фактора V Лейдена и протромбина G20210A у пациентов с ТЭЛА. Этот результат указывает на то, что генетический фон изолированной ПЭ не соответствует ТГВ. Незаменимая клиническая ценность генетических исследований изолированной ПЭ.
Многие предыдущие исследования были сосредоточены на пациентах с ВТЭ, сообщая о более молодом возрасте на момент обращения и о более высоком проценте мужчин среди пациентов с врожденной тромбофилией. 4,23 Наши данные согласуются с этими выводами. В нашей когорте мы обнаружили пациентов с преждевременной ТЭЛА (возраст <50 лет) и преобладанием мужчин (74,2%), и эти 2 фактора могли независимо влиять на тромбофилию. Распространенность врожденной тромбофилии у пациентов с ТЭЛА с факторами риска и без них существенно не различалась в нашем исследовании (6.0% против 7,5%, P > 0,05). Это отличается от того, что сообщили Weingarz et al. 4 , в которых тромбофилия чаще встречается среди пациентов с ВТЭ без факторов риска (47,7% против 57,7%, P = 0,001). Такое несоответствие может заключаться в различиях в спектре тромбофилии между двумя исследованиями. Большинство тромбофилий в исследовании Weingarz et al. Были вызваны лейденскими мутациями фактора V и повышенным уровнем фактора VIII, тогда как дефицит антикоагулянтов в плазме был основной причиной врожденной тромбофилии.Наши результаты показывают, что пациенты с врожденной тромбофилией предрасположены к спонтанному развитию ТЭЛА или ТЭЛА, объясняемой наличием фактора риска, что подчеркивает важность скрининга на тромбофилию.
Хотя врожденная тромбофилия, по-видимому, не увеличивает риск рецидива, 24,25 текущие рекомендации рекомендуют антикоагулянтное лечение независимо от наличия или отсутствия врожденной тромбофилии. 26 Роль дефицита природных антикоагулянтов в рецидиве до сих пор неясна. В исследовании Baglin et al, 24 частота рецидивов у пациентов с естественным дефицитом антикоагулянтов составила 17,5%, что выше, чем общая частота рецидивов, составляющая 11%, но не достигла статистической значимости. Исходы пациентов с врожденной тромбофилией в настоящем исследовании не уступали результатам пациентов без тромбофилии, включая смертность от всех причин (0,0% против 7.7%, P = 0,15) и частота рецидивов (3,2% против 7,2%, P = 0,71). Очевидно, что пациенты с врожденной тромбофилией обычно имели первый приступ ТЭЛА в более молодом возрасте и без сопутствующих заболеваний, что снижало риск смерти. Что касается частоты рецидивов, снижение числа пациентов с тромбофилией может быть связано с нашей антикоагулянтной терапией (использование NOAC и расширенное лечение после 3 месяцев без повышенного риска кровотечения). Кроме того, все 16 пациентов, которые были потеряны для последующего наблюдения, были пациентами без тромбофилии, что, возможно, недооценило частоту исходов у пациентов с нетромбофилией.
У нашего исследования есть некоторые ограничения. Во-первых, это одноцентровое исследование с более отобранной группой пациентов больницы FuWai Hospital, национального центра диагностики и лечения сердечно-сосудистых заболеваний в Китае. Результаты одноцентрового исследования обычно подвержены систематической ошибке отбора. Однако пациенты в нашем исследовании были со всего Китая и включались последовательно, что должно обеспечить хорошее представительство пациентов с ПЭ в Китае.В больнице FuWai, специализирующейся на сердечно-сосудистых заболеваниях, пациенты с ПЭ с факторами риска после общей операции или травмы могут быть менее представлены в больнице FuWai, что может привести к некоторой избирательной предвзятости в результатах этого исследования. Во-вторых, настоящее исследование представляет собой предварительное наблюдательное исследование, в котором было выполнено множество статистических тестов. В результате могут быть ложноположительные результаты. В качестве открытого исследования клиницисты, участвовавшие в исследовании, знали о диагнозе тромбофилии.Следовательно, пациенты с тромбофилией могут получать больше внимания и быть более склонными сообщать о событиях исхода. Тем не менее, результат этого исследования — это точная клиническая конечная точка, и его измерение может иметь меньшую предвзятость в отчетности. Кроме того, за диагностику и последующее наблюдение отвечали разные врачи, и последующие врачи могут не знать о статусе тромбофилии пациента, что могло снизить потенциальную систематическую ошибку в отчетности. В-третьих, мы взяли> 10 потенциальных предикторов в многомерный анализ, но нельзя игнорировать возможные ненаблюдаемые смешивающие факторы.Тем не менее, наши результаты действительно предоставляют новое понимание распространенности и основных механизмов врожденной тромбофилии у китайских пациентов и их последующих исходов. Это поможет разработать терапевтическую стратегию, адаптированную к самой большой в мире популяции пациентов.
Авторы благодарят пациентов и их семьи за участие в этом исследовании.
Эта работа была поддержана грантами Национальной программы ключевых исследований и разработок Китая (2016YFC0
2), Инновационного фонда медицинских наук CAMS (2016-I2M-1-002, 2017-12M-3-003, 2017-I2M-B & R -02, 2017-F16-SYS, 2017-I2M-1-004, 2017-I2M-2-001), Проект муниципальной столичной клинической больницы (Z171100001017195 и Z181100001718203) и фонды фундаментальных исследований для центральных университетов Пекина Молодежный фонд Union Medical College (PUMC) (2017310006).
Вклад: Z.-C.J. имеет полный доступ ко всем данным в исследовании и берет на себя ответственность за целостность данных и точность анализа данных, включая любые побочные эффекты; T.-Y.L., D.L., X.-X.Y. и Z.-C.J. способствовал дизайну исследования; D.L., T.W., Y.-J.Z., Y.-P.W., J.-S.T., F.-H.P. и X.J. отвечали за набор пациентов и сбор данных; T.-Y.L. проведенные эксперименты; Т.-Y.L. и К.С. провел анализ данных и написал первый проект отчета; Z.-C.J. и Л.Х. помогли написать и отредактировать рукопись; и все авторы внесли свой вклад в окончательный отчет и одобрили его.
Раскрытие информации о конфликте интересов: Z.-C.J. получил спонсорскую поддержку от GlaxoSmithKline для Конгресса ISTH 2019. T.-Y.L. получила спонсорскую поддержку от компании Bayer для плаката Конгресса ISTH 2019. Остальные авторы заявляют об отсутствии конкурирующих финансовых интересов.
Для корреспонденции: Чжи-Ченг Цзин, отделение кардиологии — ключевая лаборатория легочно-сосудистой медицины, Больница Пекинского медицинского колледжа, Китайская академия медицинских наук — Пекинский союзный медицинский колледж, № 1, Шуай-Фу-Юань, округ Донг-Ченг , Пекин 100730, Китай; электронная почта: [email protected].
Унаследованная тромбофилия: палка о двух концах | Гематология, Образовательная программа ASH
В 1995 году мои коллеги-младшие исследователи в отделении отметили большое количество выкидышей и мертворождений у женщин, которые участвовали в семейном исследовании, которое было организовано для оценки абсолютного риска ВТЭ в семьях с дефицитом антитромбина, протеина С или протеина S. .В самом деле, они обнаружили, что риск у женщин с дефицитом повышается в 2 раза по сравнению с родственниками без дефицита 38 В нашем семейном исследовании фактора V в Лейдене 39 , но не в нашем исследовании протромбина 20210A, 34 мы наблюдали похожее явление. . С тех пор в многочисленных исследованиях изучалась связь между наследственной тромбофилией и различными осложнениями беременности, от единичного выкидыша до внутриутробной гибели плода, преэклампсии, HELLP (гемолиз, повышенные ферменты печени и низкие тромбоциты) и отслойка плаценты. 27,40 Обследование женщин с осложнениями беременности вскоре стало обычной клинической практикой, но основанного на доказательствах ответа о последующих терапевтических последствиях не было. Этот частый клинический вопрос подогревал мой интерес не только к ассоциациям и абсолютным рискам, но и к проверке часто обсуждаемой гипотезы о том, что антикоагуляция низкомолекулярным гепарином (НМГ) может улучшить исход беременности у женщин с наследственной тромбофилией и без нее и с другими необъяснимыми рецидивами. выкидыш.Это был мой первый личный опыт успешного создания и ведения многоцентрового рандомизированного клинического исследования по инициативе исследователя, которое называлось ALIFE. 41 Несмотря на то, что набор и проведение исследования были сложными, а результат был отрицательным, я считаю его завершение, публикацию и влияние на клиническую практику важным моментом в моей карьере. Примерно через 15 лет различных клинических испытаний, проведенных коллегами по всему миру, мы теперь знаем, что НМГ не улучшает вероятность живорождения у женщин с невынашиваемым невынашиванием без объяснения причин. 42-45 Однако мы все еще не уверены в том, что это также относится к женщинам с наследственной тромбофилией. 46,47 В исследовании ALIFE подгруппа женщин с наследственной тромбофилией (n = 47) показала тенденцию к преимуществу НМГ и аспирина (относительный риск живорождения 1,31 [95% ДИ 0,74–2,33] для НМГ и аспирин по сравнению с плацебо: относительный риск живорождения 1,22 [95% ДИ 0,69–2,16] для аспирина с соответствующей абсолютной разницей в коэффициентах живорождения 16.3% [95% ДИ, от –18,2% до 50,8%] и 11,8% [95% ДИ, от –21,1% до 44,6%], соответственно). 41 На основе этих результатов мы инициировали исследование ALIFE2, в которое с 2013 года набирают пациентов в Нидерландах, Великобритании и Бельгии и, надеюсь, вскоре в США и Словении. 48
Что касается других осложнений беременности, опосредованных плацентой, результаты метаанализа индивидуальных данных пациентов AFFIRM включили 963 женщины, которые участвовали в 8 рандомизированных контролируемых исследованиях, включая исследование TIPPS, которое было полностью посвящено женщинам с тромбофилией. 49-51 НМГ существенно не снижали риск повторных осложнений беременности, опосредованных плацентой (14% против 22%; относительный риск 0,64; 95% ДИ 0,36–1,11). Между одноцентровыми и многоцентровыми исследованиями наблюдалась значительная неоднородность. В анализе подгрупп, НМГ значительно снижал первичный исход у женщин с предыдущей отслойкой, но не в любой из других подгрупп с предыдущими осложнениями. Следует отметить, что со временем ассоциации наследственной тромбофилии и осложнений беременности стали менее сильными или даже отсутствовали, когда оценивались более качественные проспективные исследования. 52
Врожденная тромбофилия и тромбоз: исследование в едином центре
Тромбоэмболия — редкое явление в детском возрасте, которое может быть связано со значительной заболеваемостью и смертностью. Сообщается, что частота венозной тромбоэмболии составляет около 0,7 на 100 000 в год 1.
2 с младенцами и подростками из группы наибольшего риска. В большинстве случаев обнаруживается основной провоцирующий фактор, и во многих случаях присутствуют два или более провоцирующих фактора.1-4
Приобретенные факторы, которые, как известно, предрасполагают к тромбозу, часто связаны с центральными венозными линиями, злокачественными новообразованиями и сепсисом. Роль врожденных тромбофилических состояний неясна. В нескольких недавних исследованиях сообщалось о частоте конкретных наследственных протромботических состояний у детей с тромбозами, хотя зарегистрированные случаи, изученные популяции и измеренные тромбофильные параметры значительно различались.
4-7
Наиболее распространенным наследственным заболеванием, которое, как известно, предрасполагает к тромбоэмболическим заболеваниям, является лейденская мутация фактора V (Arg506Gln), которая приводит к устойчивости к активированному протеину C.8 Другие состояния включают дефицит протеина C, протеина S и антитромбина III, некоторые дисфибриногенемии, дисплазминогенемию и другие фибринолитические дефекты. Недавно описанная мутация протромбина 20210A также может быть добавлена к этим расстройствам.9 Гомоцистинурия также связана с тромбозом в детстве. Эти разные условия могут совместно сегрегировать, увеличивая риск10–16.
Мы определили важность врожденных тромбофильных маркеров и приобретенных провоцирующих факторов для тромбоза у детей, поступивших в Детскую больницу Бирмингема в течение 12 месяцев с тромбоэмболией, и провели исследования на тромбофилию.
Пациенты и методы
Мы рассмотрели истории болезни всех пациентов, у которых было тромбоэмболическое событие, и у которых в Детской больнице Бирмингема проводились исследования на тромбофилию в течение 12 месяцев до декабря 1997 года. Собранные данные включали возраст на момент постановки диагноза; основной диагноз; место тромбоза и как это было задокументировано; ассоциированные факторы риска тромбоза, такие как хирургическое вмешательство, постоянная центральная венозная линия, злокачественные новообразования, химиотерапия и сепсис; возникновение других тромботических событий; и семейный анамнез.Исследования тромбофилии включали измерение активности протеина C, общего и свободного антигена протеина S, активности антитромбина III, скрининг фактора V Лейдена и протромбина 20210A, определение уровня гомоцистеина в моче и скрининг на антикоагулянт волчанки.
Белок C измеряли с помощью хромогенного анализа (Chromogenix, Möldndal, Швеция) после активации ядом медноголовой змеи. Белок S анализировали с помощью иммуноферментного анализа (ELISA), в котором измеряли как общий, так и свободный белок S, последний после осаждения полиэтиленгликолем (Dako, Cambridge, UK).Антитромбин III определяли хромогенным методом (Chromogenix) после инкубации с избытком фактора Ха и гепарина. Возрастные диапазоны референсных значений для вышеуказанных исследований были основаны на данных, опубликованных Andrew et al.
17
18
Тестирование волчаночного антикоагулянта состояло из разбавленного яда гадюки Рассела с подтверждением присутствия волчаночного антикоагулянта по его нейтрализации фосфолипидом тромбоцитов.
Гомоцистеин в моче определяли с помощью высоковольтного электрофореза аминокислот после окисления мочи.
Обнаружение лейденской мутации фактора V
проводили с использованием кипяченой крови пациентов с помощью полимеразной цепной реакции (ПЦР) с последующим анализом рестрикционных ферментов с Mnl1, как описано ранее.19 Обнаружение аллеля 20210A гена протромбина проводили таким же образом, но с использованием рестрикционного фермента HindIII.20
Результаты
Тридцать детей с симптоматическими тромбоэмболическими событиями прошли обследование на тромбофилию в течение 12 месяцев исследования.Двадцать два были исследованы после первого тромботического события и восемь после второго или третьего события. Шестнадцать членов семьи из семи детей также прошли обследование на тромбофилию. Не все члены семей каждого индексного случая были исследованы, в основном из-за их недоступности.
Было 16 мальчиков и 14 девочек. Средний возраст постановки диагноза тромботического события составлял 6,5 лет (от 1 дня до 15 лет).
ТИП ТРОМБОЗА
Тромбозы были разнообразными и включали цереброваскулярные события (11), тромбоз сосудов почек (восемь), тромбоз глубоких вен (два), веноокклюзию печени (два), тромбоз сагиттального синуса (два), тромбоз воротной вены (один), тромбоз нижней полой вены (один), тромбоз, связанный с центральной венозной линией (один), молниеносная пурпура (один) и тромбоэмболия легочной артерии (один).Все они были задокументированы одним или несколькими исследованиями, включая ультразвуковое допплеровское исследование, компьютерную томографию, магнитно-резонансную томографию, ангиографию, гистологию или вентиляцию легких: сканирование перфузии.
ПРЕДВАРИТЕЛЬНЫЕ ФАКТОРЫ ТРОМБОЗА
Двадцать семь из 30 пациентов имели один или несколько предрасполагающих факторов во время тромботического события. Четырнадцать имели только приобретенный фактор, два — только врожденный фактор, 11 — как приобретенные, так и врожденные факторы, а у трех не было выявленных предрасполагающих факторов.Наиболее часто наблюдаемыми приобретенными факторами были предшествующее лихорадочное / вирусное заболевание или послеоперационное состояние, оба наблюдались у девяти пациентов. Четыре пациента страдали злокачественным заболеванием и получали химиотерапию через центральные венозные сосуды. У одного ребенка был нефротический синдром, один грамотрицательный сепсис и один общий вариабельный иммунодефицит.
Мы обнаружили лежащее в основе врожденное тромбофилическое состояние у 13 пациентов, хотя не все пациенты прошли полное обследование на тромбофилию.Наиболее частым дефектом была мутация в гене, кодирующем фактор V Лейдена, который был обнаружен у четырех из 30 пациентов, причем все пораженные дети были гетерозиготными. Из протестированных трое из 26 были гетерозиготными по мутации протромбина 20210A, трое из 28 имели дефицит протеина C, два из 28 дефицита протеина S, один из 18 случаев гомоцистинурии и один из 28 дефицит антитромбина III. Ни у одного не было антикоагулянта против волчанки. Один пациент был гетерозиготным как по фактору V Лейдена, так и по протромбину 20210A. Единственными двумя пациентами без дополнительных приобретенных провоцирующих факторов были один с дефицитом протеина S, у которого был тромбоз глубоких вен подвздошно-бедренной артерии (ТГВ), и один с внепеченочным тромбозом воротной вены и дефицитом протеина C.
ДАЛЬНЕЙШИЕ ТРОМБОТИЧЕСКИЕ СОБЫТИЯ
Двенадцать пациентов перенесли более одного тромботического эпизода (ТГВ — три; цереброваскулярное событие (ЦВА) — три; тромбоз почечных сосудов (ТБВ) — три; тромбоз, связанный с центральной венозной линией (ЦВЛ), один; тромбоз селезеночной вены — один; артерия сетчатки). тромбоз, один). Семь из следующих событий были такими же, как и первое (DVT, одно; CVA, три; RVT, три). Среднее время между первым и вторым тромботическим событием составило 21 месяц (диапазон от одного месяца до семи лет).
Из этих пациентов, перенесших более одного тромботического события, у шести была врожденная тромбофилия. У двоих из них не было другого идентифицируемого фактора риска во время тромбоза (дефицит протеина C и протромбина 20210A). Из остальных четырех у одного была гомоцистинурия и вирусное заболевание, у одного лейденского фактора V и трансплантации почки, у одного дефицит антитромбина III и вирусное заболевание, у одного дефицит протеина С и грамотрицательный сепсис. У шести пациентов без врожденной тромбофилии приобретенные провоцирующие факторы были идентифицированы у четырех (вирусное заболевание (один), трансплантат почки (два), общий вариабельный иммунодефицит и центральная венозная линия (один)).Только один из этих пациентов принимал антикоагулянты (варфарин) во время второго события, и тромбоз был связан с центральной венозной линией и отсутствием врожденной тромбофилии. У трех пациентов произошло третье событие, два из которых были связаны только с приобретенным преципитирующим фактором (катетер для гемодиализа; трансплантат почки), а один — только с врожденным тромбофилическим состоянием (протромбин 20210A).
СЕМЕЙНЫЕ ИССЛЕДОВАНИЯ
Из 16 исследованных членов семьи (семь семей) у четырех в анамнезе был тромбоз, у одного из них была врожденная тромбофилия (дефицит антитромбина III).Из 12 без тромботической истории у восьми было обнаружено лежащее в основе врожденное тромбофильное состояние (лейденская мутация фактора V — три; протромбин 20210A — два; лейденская мутация фактора V и дефицит белка S — один; дефицит протеина S — один; протеин C. дефицит, один). В одной семье без тромбоза в анамнезе был обнаружен дополнительный тромбофильный дефект, которого не было в указанном случае.
Обсуждение
Тромбоэмболия — редкое явление в детстве, и ее этиология обычно многофакторна, что подтверждается нашими выводами.Предрасполагающие факторы детского тромбоза обычно приобретены и зависят от возраста. На 1-м году жизни венозный тромбоз обычно возникает либо в сочетании с постоянными венозными катетерами, либо как тромбоз почечной вены, причем последний часто встречается в первые несколько дней после рождения. У детей старшего возраста центральные венозные линии остаются одним из наиболее частых провоцирующих факторов, и в большинстве исследований они являются задействованным пусковым фактором, по крайней мере, у 25% пациентов.1-4 Однако только у одного пациента в нашем исследовании была связана центральная венозная линия. тромбоз.
Среди взрослого населения частота врожденных тромбофилических состояний и связанный с этим риск тромбоэмболических событий относительно хорошо установлены. Унаследованные тромбофильные состояния, вероятно, также способствуют развитию тромбозов у детей, хотя их важность не была определена, а частота унаследованных протромботических состояний при тромбозах у детей неясна, причем в недавних отчетах указывается, что их частота составляет от 3,9% до 83%. Однако в этих публикациях изучаемые тромботические популяции сильно различались, количество изучаемых детей часто было небольшим, не все пациенты в исследовании прошли скрининг на тромбофилию, а измеренные параметры варьировались между исследованиями.Несмотря на эти ограничения, врожденная тромбофилия, по-видимому, играет роль в развитии тромбоза у детей. Как правило, это происходит только тогда, когда присутствует один или несколько приобретенных провоцирующих факторов, тем самым демаскируя лежащий в основе наследственный дефект1.
3-7
Мы обнаружили высокую частоту (43%) врожденной тромбофилии в этой отобранной группе детей с симптоматической тромбоэмболией. Не все пациенты были полностью обследованы, поэтому частота может быть выше, чем мы сообщали. Мы предлагаем провести полное исследование тромбофилии у всех детей с тромбоэмболической болезнью, поскольку у значительного числа детей будет лежать в основе наследственное тромбофилическое состояние, которое может повлиять на их дальнейшее ведение.Семейные исследования, хотя и ограниченные, были информативными, с высоким уровнем выявления врожденной тромбофилии. Члены семьи должны быть обследованы после выявления ребенка с врожденной тромбофилией. Это требует всестороннего консультирования семьи относительно последствий положительных результатов. Высокая частота множественных тромботических событий у наших пациентов ставит под сомнение оптимальную продолжительность антикоагуляции. У половины была основная врожденная тромбофилия, и у четырех из этих шести был идентифицированный приобретенный фактор риска во время второго события.Некоторые из этих дальнейших событий можно было предотвратить с помощью более длительного периода антикоагуляции или селективной антикоагуляции во времена повышенного риска тромбоза. Мы подчеркиваем необходимость контролируемых клинических испытаний для определения как оптимальной продолжительности, так и оптимального диапазона антикоагуляции у детей, перенесших тромботический эпизод.
Наследственная и приобретенная гиперкоагуляция: основы практики, COVID-19, патофизиология
Rosendaal FR. Венозный тромбоз: многокомпонентное заболевание. Ланцет . 1999 г., 3. 353 (9159): 1167-73. [Медлайн].
Ча АЕ. Загадочное осложнение свертывания крови убивает пациентов с коронавирусом. Вашингтон Пост . 22 апреля 2020 г. Доступно по адресу https://www.washingtonpost.com/health/2020/04/22/coronavirus-blood-clots/.
Коэн Э. Врачи пытаются выяснить, почему они наблюдают «беспрецедентное» свертывание крови среди пациентов с Covid-19. CNN . 22 апреля 2020 г. Доступно по адресу https: // www.cnn.com/2020/04/21/health/blood-clots-coronavirus/index.html.
Хан Х, Ян Л., Лю Р., Лю Ф., Ву К.Л., Ли Дж. И др. Выраженные изменения свертывания крови у пациентов с инфекцией SARS-CoV-2. Clin Chem Lab Med . 2020 16 марта. [Medline].
Оксли Т.Дж., Мокко Дж., Маджиди С. и др. Инсульт крупных сосудов как признак Covid-19 у молодых. N Engl J Med . 2020 28 апреля. [Medline]. [Полный текст].
Panigada M, Bottino N, Tagliabue P, Grasselli G, Novembrino C, Chantarangkul V, et al.Гиперкоагуляция пациентов с COVID-19 в отделении интенсивной терапии. Отчет о результатах тромбоэластографии и других параметрах гемостаза. J Тромб Haemost . 2020 17 апреля [Medline]. [Полный текст].
Spiezia L, Boscolo A, Poletto F, Cerruti L, Tiberio I, Campello E, et al. Тяжелая гиперкоагуляция, связанная с COVID-19, у пациентов, поступивших в отделение интенсивной терапии с острой дыхательной недостаточностью. Тромб Хемост . 2020 21 апреля [Medline]. [Полный текст].
Коллиас А., Кириакулис К.Г., Димакакос Э., Поулаку Г., Стергиу Г.С., Сиригос К. Риск тромбоэмболии и антикоагулянтная терапия у пациентов с COVID-19: новые доказательства и призыв к действию. Br J Haematol . 2020 18 апреля. [Medline].
Асакура Х., Огава Х. Возможности комбинированной терапии гепарином и нафамостатом при COVID-19. J Тромб Haemost . 2020 17 апреля [Medline].
[Рекомендации] Тачил Дж., Тан Н., Гандо С., Фаланга А., Каттанео М., Леви М. и др.Временное руководство ISTH по распознаванию и лечению коагулопатии при COVID-19. J Тромб Haemost . 2020 май. 18 (5): 1023-1026. [Медлайн]. [Полный текст].
Zhang Y, Xiao M, Zhang S, et al. Коагулопатия и антифосфолипидные антитела у пациентов с Covid-19. N Engl J Med . 2020 апр 23.382 (17): e38. [Медлайн]. [Полный текст].
Brooks M. Полное отключение фибринолиза при тяжелой форме COVID-19. Медицинские новости Medscape.Доступно на https://www.medscape.com/viewarticle/931316. 28 мая 2020 г .; Дата обращения: 2 июня 2020 г.
Wright FL, Vogler TO, Moore EE, Moore HB, Wohlauer MV, Urban S, et al. Прекращение фибринолиза коррелирует с тромбоэмболическими событиями при тяжелой инфекции COVID-19. Дж. Ам Колл Сург . 2020 15 мая. [Medline]. [Полный текст].
Hillarp A, Dahlback B, Zoller B. Активированная устойчивость к протеину C: от фенотипа к генотипу и клинической практике. Кровь Ред. . 1995 Декабрь 9 (4): 201-12. [Медлайн].
Ву К.К., Тиагараджан П. Роль эндотелия в тромбозе и гемостазе. Анну Рев Мед . 1996. 47: 315-31. [Медлайн].
Колман-Брошу С. Тромбоз глубоких вен при беременности. MCN Am J Matern Детские сестры . 2004 май-июнь. 29 (3): 186-92. [Медлайн].
[Рекомендации] Бейтс С.М., Грир И.А., Мидделдорп С., Винстра Д.Л., Прабулос А.М., Вандвик П.О.ВТЭ, тромбофилия, антитромботическая терапия и беременность: Антитромботическая терапия и профилактика тромбоза, 9-е изд: Руководства по клинической практике Американского колледжа грудных врачей, основанные на фактических данных. Сундук . 2012, февраль 141 (2 доп.): E691S-e736S. [Медлайн]. [Полный текст].
Rand JH, Wolgast LR. Антифосфолипидный синдром. В: Hoffman R, Benz EJ Jr, Silberstein LE, Heslop H, Weitz J, Anastasi J, ред. Гемостаз и тромбоз . 6-е изд. Филадельфия, Пенсильвания: Эльзевьер / Сондерс; 2013.2025-38.
Ortel TL. Тромбоз и антифосфолипидный синдром. Образовательная программа по гематологии и соц. Гематол . 2005. 462-8. [Медлайн]. [Полный текст].
Triplett DA. Антифосфолипидные антитела. Clin Adv Hematol Oncol . 2003 декабрь 1 (12): 726-30. [Медлайн].
Franchini M, Mannucci PM. Группа крови АВО и тромботическая болезнь сосудов. Тромб Хемост . 2014 декабрь 112 (6): 1103-9.[Медлайн].
Heit JA, Cunningham JM, Petterson TM, et al. Генетические вариации антикоагулянтного, прокоагулянтного, фибринолитического и врожденного иммунных путей как факторы риска венозной тромбоэмболии. J Тромб Haemost . 2011 июн.9 (6): 1133-42. [Медлайн]. [Полный текст].
Di Micco P, Scudiero O, Lombardo B, Lodigiani C. Идиопатическая гиперэозинофилия и венозная тромбоэмболия: есть ли патофизиологическая или клиническая связь? Описание интригующего клинического случая. Дж. Кровавая медицина . 2020. 11: 73-76. [Медлайн]. [Полный текст].
Eroglu A, Egin Y, Cam R, Akar N. Делеция 19 пар оснований дигидрофолатредуктазы (DHFR), метилентетрагидрофолатредуктазы (MTHFR) C677T, фактор V Leiden, полиморфизм протромбина G20210A у онкологических больных с тромбозом и без него. Энн Гематол . 2009 Январь 88 (1): 73-6. [Медлайн].
Клиника Мэйо. Активированная устойчивость к протеину C V (APCRV). Медицинские лаборатории Мэйо.Доступно на http://www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/81967. Доступ: 22 марта 2020 г.
Heit JA. Тромбофилия: общие вопросы по лабораторной оценке и ведению. Образовательная программа по гематологии и соц. Гематол . 2007. 127-35. [Медлайн]. [Полный текст].
Couturaud F, Leroyer C, Julian JA, et al. Факторы, предсказывающие риск тромбоза у родственников пациентов с неспровоцированной венозной тромбоэмболией. Сундук . 2009 10 июля. Epub опережает печать. [Медлайн].
Lijfering WM, Veeger NJ, Middeldorp S, et al. Более низкий риск рецидива венозного тромбоза у женщин по сравнению с мужчинами объясняется факторами риска, специфичными для пола во время первого венозного тромбоза в тромбофильных семьях. Кровь . 2009 сентябрь 3. 114 (10): 2031-6. [Медлайн]. [Полный текст].
Робертс Л.Н., Патель Р.К., Арья Р. Венозная тромбоэмболия и этническая принадлежность. Br J Haematol .2009 Август 146 (4): 369-83. [Медлайн].
Hong SN, Yun HC, Yoo JH, Lee SH. Связь между гиперкоагуляцией и тяжелым обструктивным апноэ во сне. JAMA Otolaryngol Head Neck Surg . 2017 г. 1. 143 (10): 996-1002. [Медлайн].
Cushman M. Унаследованные факторы риска венозного тромбоза. Образовательная программа по гематологии и соц. Гематол . 2005. 452-7. [Медлайн]. [Полный текст].
Айах М., Эммеррих Дж.Генетика тромбофилии. Colman RW, Marder VJ, Clowes AW, et al, eds. Гемостаз и тромбоз . 5-е изд. Филадельфия, Пенсильвания: Липпинкотт, Уильямс и Уилкинс; 2006. 779-93.
Колуччи Г., Цакирис Д.А. Скрининг на тромбофилию. Clin Appl Thromb Hemost . 2017 г. 1. 1076029616683803. [Medline].
Прути РК. Оптимальное использование тестирования на тромбофилию. Int J Lab Hematol . 2017 май. 39 Дополнение 1: 104-110.[Медлайн].
ван Оммен С.Х., Новак-Гёттль У. Унаследованная тромбофилия при венозной тромбоэмболической болезни у детей: зачем и кого тестировать. Передний педиатр . 2017. 5:50. [Медлайн]. [Полный текст].
Straczek C, Oger E, Yon de Jonage-Canonico MB, et al. Протромботические мутации, гормональная терапия и венозная тромбоэмболия у женщин в постменопаузе: влияние пути введения эстрогена. Тираж . 2005 29 ноя.112 (22): 3495-500. [Медлайн]. [Полный текст].
Urbanus RT, de Groot PG. Антифосфолипидные антитела — мы еще не закончили. Кровь Ред. . 2011 25 марта (2): 97-106. [Медлайн].
Бейтс С.М. Ведение беременных с тромбофилией или венозной тромбоэмболией в анамнезе. Образовательная программа по гематологии и соц. Гематол . 2007. 143-50. [Медлайн]. [Полный текст].
Коннорс Дж. Тестирование на тромбофилию и венозный тромбоз. N Engl J Med . 2017 7 декабря. 377 (23): 2298. [Медлайн]. [Полный текст].
Douketis J, Tosetto A, Marcucci M, et al. Риск рецидива венозной тромбоэмболии у мужчин и женщин: метаанализ на уровне пациента. BMJ . 2011 24 февраля. 342: d813. [Медлайн]. [Полный текст].
Кеарон С., Джулиан Дж. А., Ковач М. Дж. И др. Влияние тромбофилии на риск рецидива венозной тромбоэмболии при приеме варфарина: результаты рандомизированного исследования. Кровь . 2008 декабрь 1. 112 (12): 4432-6. [Медлайн]. [Полный текст].
Hirsh J, Raschke R. Гепарин и низкомолекулярный гепарин: Седьмая конференция ACCP по антитромботической и тромболитической терапии. Сундук . 2004 Сентябрь 126 (3 доп.): 188С-203С. [Медлайн]. [Полный текст].
Rühle F, Stoll M. Успехи в прогнозировании риска венозной тромбоэмболии у детей. Br J Haematol . 2017 декабрь 19. 82 (1): 25-6. [Медлайн].
Warkentin TE. Средства для лечения гепарин-индуцированной тромбоцитопении. Гематол Онкол Клин Норт Ам . 2010 24 августа (4): 755-75, ix. [Медлайн].
Адам С.С., Макдаффи-младший, Лахевич П.Ф., Ортель Т.Л., Уильямс Дж.В. Сравнительная эффективность новых пероральных антикоагулянтов и стандартных режимов антикоагулянтов для тромбопрофилактики у пациентов, перенесших тотальную замену тазобедренного или коленного сустава [Интернет]. Отчеты программы синтеза, основанные на фактах, Вирджиния .2012 декабрь [Medline].
Perez A, Merli GJ. Использование новых антикоагулянтов при венозной тромбоэмболии: обновление 2013 г. Варианты лечения Curr Cardiovasc Med . 2013 6 февраля [Medline].
Dobesh PP, Oestreich JH. Новые антикоагулянты прямого действия для снижения риска ОКС. Дж. Фарм Практик . 2012 19 ноября [Medline].
Мерли Г.Дж. Новые пероральные антикоагулянты: вызов для больничных формуляров. Госпиталь (Миннеап) . 2012 Август 40 (3): 126-8. [Медлайн].
Komócsi A, Vorobcsuk A, Kehl D, Aradi D. Использование пероральных антикоагулянтов нового поколения у пациентов, получающих антитромбоцитарную терапию после острого коронарного синдрома: систематический обзор и метаанализ рандомизированных контролируемых исследований. Arch Intern Med . 2012 г., 12 ноября 172 (20): 1537-45. [Медлайн].
Kar S, Bhatt DL. Антикоагулянты для лечения острого коронарного синдрома в эпоху новых пероральных средств. Дис. Коронарной артерии . 2012 Сентябрь 23 (6): 380-90. [Медлайн].
Раджасекхар А., Бейт Р., Кроутер Массачусетс. Новые антикоагулянты у тяжелобольных. Клиника интенсивной терапии . 2012 июл.28 (3): 427-51, vii. [Медлайн].
Ли А.Ю. Лечение установленных тромботических событий у онкологических больных. Тромб Рес . 2012 апр. 129 Приложение 1: S146-53. [Медлайн].
Коэн А.Т., Гурвит М.М., Добромирски М.Тромбопрофилактика у онкологических больных без хирургического вмешательства. Тромб Рес . 2012 апр. 129 Приложение 1: S137-45. [Медлайн].
Vande Griend JP, Marcum ZA, Linnebur SA. Год в обзоре: новые лекарства для пожилых людей в 2011 году. Am J Geriatr Pharmacother . 2012 10 августа (4): 258-63. [Медлайн].
Burke DA, Warraich HJ, Pinto DS. Какой антитромбин для кого? Выявление группы пациентов, получающих наибольшую пользу от новых антитромбиновых препаратов. Curr Cardiol Rep . 2012 14 августа (4): 493-501. [Медлайн].
Di Nisio M, Middeldorp S, Büller HR. Прямые ингибиторы тромбина. N Engl J Med . 2005 сентябрь 8. 353 (10): 1028-40. [Медлайн].
Баглин Т., Барроуклифф Т.В., Коэн А., Гривз М. Рекомендации по использованию и мониторингу гепарина. Br J Haematol . 2006 апр. 133 (1): 19-34. [Медлайн]. [Полный текст].
Harenberg J. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? Да. J Тромб Haemost . 2004 г., 2 (4): 547-50. [Медлайн]. [Полный текст].
Bounameaux H, de Moerloose P. Необходим ли лабораторный мониторинг терапии низкомолекулярным гепарином? № J Thromb Haemost . 2004 г., 2 (4): 551-4. [Медлайн]. [Полный текст].
[Рекомендации] Кеарон С., Акл Э.А., Комерота А.Дж., Прандони П., Боунамо Х., Голдхабер С.З. и др. Антитромботическая терапия при ВТЭ: Антитромботическая терапия и профилактика тромбоза, 9-е изд: Руководства по клинической практике Американского колледжа грудных врачей. Сундук . 141 февраля 2012 г. (2 доп.): E419S-94S. [Медлайн]. [Полный текст].
[Рекомендации] Kitchen S, Gray E, Mackie I, Baglin T, Makris M, комитет BCSH. Измерение антикоагулянтов, не относящихся к кумарину, и их влияния на тесты гемостаза: руководство Британского комитета по стандартам в гематологии. Br J Haematol . 2014 Сентябрь 166 (6): 830-41. [Медлайн]. [Полный текст].
Cho L, Kottke-Marchant K, Lincoff AM, et al.Корреляция времени свертывания экарина в месте оказания медицинской помощи и времени активированного свертывания с концентрацией бивалирудина. Ам Дж. Кардиол . 2003 May 1. 91 (9): 1110-3. [Медлайн].
Welsby IJ, McDonnell E, El-Moalem H, Stafford-Smith M, Toffaletti JG. Системы активированного времени свертывания крови различаются по точности и смещению и не являются взаимозаменяемыми при соблюдении протоколов лечения гепарином во время искусственного кровообращения. Дж. Клин Монит Вычислитель . 2002 июл.17 (5): 287-92.[Медлайн].
Чанг Л.С., Ли Х.Ф., Ян З., Ян В.К. Протамин с низким молекулярным весом (LMWP) как нетоксичный гепарин / антидот низкомолекулярного гепарина (I): получение и характеристика. AAPS PharmSci . 2001. 3 (3): E17. [Медлайн].
Schick BP, Maslow D, Moshinski A, San Antonio JD. Новые конкатамерные гепарин-связывающие пептиды обращают активность гепарина и низкомолекулярного гепарина в антикоагулянтную активность в плазме пациентов in vitro и у крыс in vivo. Кровь . 2004 15 февраля. 103 (4): 1356-63. [Медлайн]. [Полный текст].
Welsby IJ, Stafford-Smith M. Мониторинг прямых ингибиторов тромбина: время для стандартизации. Анестезиология . 2004 Октябрь 101 (4): 1048-9. [Медлайн].
Weitz JI. Новые антикоагулянты для лечения венозной тромбоэмболии. Тираж . 2004 31 августа 110 (9 доп. 1): I19-26. [Медлайн]. [Полный текст].
Коннорс Дж.Антидот для антикоагулянтов фактора Ха. N Engl J Med . 2015 17 декабря. 373 (25): 2471-2. [Медлайн]. [Полный текст].
Lassen MR, Raskob GE, Gallus A, Pineo G, Chen D, Hornick P. Сравнение апиксабана с эноксапарином для тромбопрофилактики после замены коленного сустава (ADVANCE-2): рандомизированное двойное слепое исследование. Ланцет . 2010 марта 6. 375 (9717): 807-15. [Медлайн].
Ромуальди Э., Аджено В. Оральные ингибиторы Ха. Гематол Онкол Клин Норт Ам .2010 24 августа (4): 727-37, viii-ix. [Медлайн].
Medi C, Hankey GJ, Freedman SB. Риск инсульта и антитромботические стратегии при фибрилляции предсердий. Ход . 2010 ноябрь 41 (11): 2705-13. [Медлайн].
Бекаттини С., Линьяни А., Аньелли Г. Новые антикоагулянты для профилактики венозной тромбоэмболии. Лекарство Де Девел Тер . 2010. 4: 49-60. [Медлайн].
Desai SS, Massad MG, DiDomenico RJ, et al.Последние достижения в антитромботической терапии: останется ли варфарин натрия лекарством прошлого? Последние данные Pat Cardiovasc Drug Discov . 2006 ноябрь 1 (3): 307-16. [Медлайн].
Хэнли JP. Отмена варфарина. Дж. Клин Патол . 2004 ноябрь 57 (11): 1132-9. [Медлайн]. [Полный текст].
Кини М., Аллан Д.С., Ломанн Р.С., Йи И.Х. Влияние активированного рекомбинантного человеческого фактора 7 (ниастазы) на лабораторные испытания ингибиторов факторов VIII и IX. Лабораторный гематол . 2005. 11 (2): 118-23. [Медлайн].
Malherbe S, Tsui BC, Stobart K, Koller J. Argatroban в качестве антикоагулянта при искусственном кровообращении у младенца и попытка отмены с помощью рекомбинантного активированного фактора VII. Анестезиология . 2004 Февраль 100 (2): 443-5. [Медлайн].
Powner DJ, Hartwell EA, Hoots WK. Противодействие воздействию антикоагулянтов и антиагрегантов во время нейрохирургических неотложных состояний. Нейрохирургия . 2005, ноябрь 57 (5): 823–31; обсуждение 823-31. [Медлайн].
Тромбофилия — лечение сосудов
Что такое тромбофилия?
Тромбофилии можно определить как группу наследственных или приобретенных заболеваний, повышающих риск развития тромбоза (аномального «свертывания крови») в венах или артериях.
Человеческое тело оснащено сложной и хорошо сбалансированной системой свертывания (или свертывания) крови, в которой тромбоциты («свертывающиеся» клетки крови) и несколько белков свертывания крови смешиваются, чтобы избежать как чрезмерного кровотечения, так и чрезмерного свертывания.Образование тромба (сгустка крови) — это хорошо после травм кровеносных сосудов, независимо от того, возникла ли травма в результате случайного пореза, серьезной травмы, перелома кости или хирургического вмешательства. Если бы свертывания крови не произошло, у вас было бы непреодолимое (и даже опасное для жизни) кровотечение. Это нормальное образование тромба должно быть локализовано в области, где произошло повреждение кровеносного сосуда, и должно быть остановлено, как только утечка крови из сосудов будет остановлена и / или повреждение сосуда заживет или восстановлено.При наличии тромбофилий хорошо сбалансированная система свертывания крови имеет предрасположенность к тромбозу, что также называется «гиперкоагуляцией» или «состоянием гиперкоагуляции».
Тромбофилии могут быть наследственными (наследственными), приобретенными (не наследственными) или и тем, и другим. Унаследованные тромбофилии — это аномалии генов, ответственных за выработку белков свертывания (известные как генетические мутации). Приобретенные тромбофилии возникают из-за повышенного уровня определенных веществ свертывания крови в крови или особых белков, называемых антителами, которые также могут приводить к свертыванию.Наиболее распространенные наследственные тромбофилии включают фактор V Лейдена (бессимптомное состояние, повышающее риск тромбоза глубоких вен), мутации гена протромбина, а также необычный, но хорошо известный дефицит протеина C, протеина S или антитромбина. Лица, рожденные с наследственной тромбофилией, также называются «носителями» этой конкретной генетической мутации. Наиболее распространенные приобретенные тромбофилии обычно встречаются во время хирургических операций, травм или заболеваний, включая застойную сердечную недостаточность и определенные респираторные заболевания, и они называются антифосфолипидными антителами (APLA).Они представляют собой семейство из нескольких различных индивидуальных антител, которые могут, как группа, так и независимо, приводить как к событиям свертывания крови, так и к повторяющимся выкидышам. Некоторые тромбофилии могут иметь как генетическую предрасположенность, так и приобретенные. Исследования показали, что около 10% населения мира страдает основной тромбофилией, наиболее распространенными из которых являются лейденские мутации фактора V и гена протромбина.
Как наследственные, так и приобретенные тромбофилии, по-видимому, «наклоняют» хорошо сбалансированную систему свертывания в сторону свертывания (тромбоза).Такой дисбаланс в системе свертывания крови приводит к большему риску событий свертывания крови, таких как тромбоз глубоких вен (ТГВ) или тромбоэмболия легочной артерии (ТЭЛА). Однако тот простой факт, что у человека с тромбофилией больше шансов на развитие аномального свертывания, чем у человека без тромбофилии, не означает, что у первого человека когда-либо будет событие свертывания крови. К счастью, не у всех людей с тромбофилией в течение жизни будет тромб, в то время как, к сожалению, у многих пациентов, у которых действительно наблюдаются тромботические события (такие как ТГВ), может вообще не быть обнаруживаемой тромбофилии.
Что такое тромбофилия? | Everyday Health
Чаще всего свертывание крови — это хорошо — фактически, необходимая реакция, чтобы удержать ваше тело от чрезмерного кровотечения в случае травмы. Но свертывание или коагуляция, как ее еще называют, может быть опасным, когда сгустки образуются, когда они не должны этого делать. Так обстоит дело с тромбозом глубоких вен (ТГВ), тромбами, которые образуются в вене глубоко внутри тела, обычно в ногах.
Особому риску этого заболевания подвержены люди с нарушением тромбообразования, называемым тромбофилией, также известным как гиперкоагуляция.Это состояние повышает вероятность развития аномальных тромбов, которые могут быть опасными для жизни. Тромбофилия увеличивает риск ТГВ. И, если не лечить, сгустки крови могут оторваться, начать движение по крови и заблокировать кровоток к основному органу, что может привести к серьезным повреждениям или смерти. Вот почему так важна правильная диагностика тромбофилии.
Повышенный риск ТГВ при тромбофилии
«Большинство тромбофилий являются генетическими», что означает, что они унаследованы от одного или обоих родителей, — сказал Кейт МакКрэй, доктор медицины, врач отделения гематологической онкологии и заболеваний крови клиники Кливленда. в Огайо.«Существуют также факторы риска образования тромбов, которые не являются генетическими, такие как прием оральных контрацептивов, иммобилизация из-за недавней операции или рак. Но большинство из них передаются по наследству », — сказал д-р МакКрэй.
Тромбофилии, которые присутствуют с рождения, называются врожденными тромбофилиями. Одним из наиболее распространенных из них является фактор V Лейдена.« Фактор V Лейден чаще встречается у людей североевропейского происхождения, «Сказал доктор МакКрэй. «Однако не у всех людей с фактором V Лейден развиваются тромбы.»
Существуют также другие типы наследственных тромбофилий, включая мутацию протромбина G2021A, дефицит антитромбина III, дефицит протеина C и дефицит протеина S.
Тромбофилия не вызывается одной только генетикой.» Тромбофилия возникает в результате взаимодействия между генетикой и человеком. окружающая среда — то, что мы называем многофакторным наследованием, — сказала Мишель Клюге, генетический консультант клиники Mayo в Рочестере, штат Миннесота.
Тромбофилия: генетическое состояние
«В целом тромбофилия наследуется по аутосомно-доминантному типу» сказала Мишель Алабек, генетический консультант Центра гемофилии Западной Пенсильвании в Питтсбурге.Она объяснила: «У каждого человека есть две копии определенных генов, которые должны работать, чтобы должным образом останавливать образование сгустков. Если одна или обе копии гена не работают у человека, он или она будет подвергаться повышенному риску тромбоза »(образование сгустка).
Наличие у человека тромбофилии также зависит от того, сколько копий неработающего гена этот человек унаследовал. «Если у человека есть одна копия гена, которая не работает, и одна копия, которая работает, он гетерозиготен по тромбофилии», — сказал Алабек.«Гетерозиготные люди имеют 50-процентный риск передачи неработающего гена своим детям. Если обе копии генов человека не работают, этот человек гомозиготен, и эти люди всегда передают одну неработающую копию гена своим детям. ”
Алабек добавила, что человек может унаследовать дефектные гены от обеих сторон семьи, что увеличивает риск врожденной тромбофилии. «Также возможно иметь более одной тромбофилии, что еще больше увеличивает риск тромбоза», — сказала она.
Получение диагноза тромбофилии
Некоторые сценарии могут побудить кого-то обратиться за оценкой для возможного диагноза тромбофилии.
«Люди с сильным семейным анамнезом тромбозов могут захотеть пройти обследование у специалиста-генетика, такого как генетический консультант, а также гематолога, особенно если у них есть другие факторы риска тромбофилии, такие как хирургическое вмешательство или прием оральных контрацептивов. , — сказал Клюге. «Эти специалисты могут обсудить индивидуальные факторы риска тромбофилии, как генетические, так и экологические, а также ваш личный риск развития тромба.Они также могут помочь вам определить соответствующие следующие шаги ».
Еще одной причиной обратиться за оценкой для диагностики тромбофилии, по словам МакКрэя, может быть развитие тромба в раннем возрасте.« Частота тромботических событий у кого-то, кто 21 год — это примерно один из 750 000 », — сказал он. «В возрасте 55 или 60 лет это примерно один из 150. Таким образом, возраст является основным фактором риска».
Диагноз тромбофилии также может потребоваться, если сгусток образуется в необычном месте.«Большинство сгустков образуется в ногах, но у человека с врожденной тромбофилией может образоваться сгусток вокруг кишечника или печени — очень необычные места для тромбоза, если только у кого-то нет тромбофилии», — сказал МакКрэй.
У многих людей с тромбофилиями никогда не образуются тромбы, но для тех, у кого есть тромбофилия, существуют эффективные способы борьбы с тромбофилией.
Лечение тромбофилии
«У большинства людей с одной из наиболее распространенных тромбофилий не образуется тромб, и до тех пор, пока у кого-то не образуется сгусток, их обычно не лечат», — сказал МакКрэй.«Как только у человека образуется сгусток, в медицинском сообществе возникают разногласия по поводу лечения тромбофилии. Это зависит от тромбофилии у человека — некоторые из наиболее распространенных тромбофилий, такие как фактор V Лейдена, повышают риск повторных тромбов меньше, чем другие более тяжелые формы, такие как дефицит антитромбина III ».
Текущие рекомендации по лечению тромбофилии рекомендуют не менее трех месяцев антикоагулянтной терапии (антикоагулянты) после образования тромба, а затем повторная оценка.«Сама по себе тромбофилия обычно не является причиной для длительного продолжения антикоагулянтной терапии», — сказал МакКрэй. «Есть несколько систем оценки, которые мы можем использовать, чтобы предсказать, следует ли кому-то принимать длительные антикоагулянты».
Врожденная тромбофилия, связанная с акушерскими осложнениями
Bauer KM. Состояния гиперкоагуляции. In: Hoffman R, Benz EJ Jr, Shattil SJ, Furie B, Cohen HJ, Silberstein LE, McGlave P (Eds.). Гематология: Основные принципы и практика. Черчилль Ливингстон, Филадельфия, 2000: 2009-2039.
Google Scholar
Бик Р., Каплан Х. Современные концепции тромбоза: преобладающие тенденции в диагностике и лечении. Med Clin North Am 1998; 82: 410–458.
Google Scholar
Хемкер Х.С., Леви-Толедано С. Патофизиологические и клинические аспекты венозного и артериального тромбоза. Гемостаз 1999; 29: 76–99.
Google Scholar
Эгеберг О. Труды: Унаследованный дефицит антитромбина III и тромбоэмболия. Thromb Diath Haemorrh 1975; 34: 366.
Google Scholar
Middeldorp S, Büller HR, Prins MH, Hirsh J. Подход к пациенту с тромбофилией. В: Colman RW, Hirsh J, Marder VJ, Clowes AW, George JN (Eds.). Гемостаз и тромбоз. Основные принципы и клиническая практика. Филадельфия, Lippincott Williams & Wilkins, 2001: 1085–1100.
Google Scholar
Páramo JA, Rocha E. Hipercoagulabilidad y estados trombofilicos. Sangre 1991; 36: 477–486.
Google Scholar
Дальбак Б., Карлссон М., Свенссон П.Дж. Семейная тромбофилия из-за ранее неизвестного механизма, характеризующегося плохой антикоагулянтной реакцией на активированный протеин C: прогнозирование кофактора активированного протеина C. Proc Natl Acad Sci USA 1993; 90: 1004–1008.
Google Scholar
Dahlback B. Устойчивость к активированному протеину C, вызванная мутацией фактора V R506Q, является распространенным фактором риска венозного тромбоза. Thromb Haemostas 1997; 78: 483–489.
Google Scholar
Фросст П., Блом Х. Дж., Милос Р. и др. Кандидат в генетический фактор риска сосудистых заболеваний: распространенная мутация метилентетрагидрофолатредуктазы. Нат Генет 1995; 10: 111–113.
Google Scholar
Poort SR, Rosendaal FR, Reitsma PH, Bertina RM. Обычная генетическая вариация в 3-нетранслируемой области гена протромбина связана с повышенными уровнями протромбина в плазме и увеличением венозного тромбоза. Кровь 1996; 88: 3698–3703.
Google Scholar
Lane DA, Grant PJ.Роль полиморфизмов генов гемостаза в венозных и артериальных тромботических заболеваниях. Кровь 2000; 95: 1517–1532.
Google Scholar
Vandenbroucke J, Koster T., Briet E, Reitsma PH, Bertina RM, Rosendaal FR. Повышенный риск венозного тромбоза у пользователей оральных контрацептивов, которые являются носителями лейденской мутации фактора V. Lancet 1994; 344: 1453–1457.
Google Scholar
Томас Д.П., Робертс HR. Гиперкоагуляция при венозных и артериальных тромбозах. Ann Intern Med 1997; 126: 638–644.
Google Scholar
Rosendaal FR. Венозный тромбоз: многокомпонентное заболевание. Lancet 1999; 353: 1167–1173.
Google Scholar
Боннар Дж., Грин Р., Норрис Л. Перинатальные аспекты наследственной тромбофилии. Семинары Thromb Hemostas 1999; 25: 481–485.
Google Scholar
Идентификатор ходока. Тромбофилия при беременности. J Clin Pathol 2000; 53: 573–580.
Google Scholar
Боннар Дж., Грин Р., Норрис Л. Унаследованная тромбофилия и беременность: акушерская перспектива. Семинары Thromb Hemostas 1998; 24: 49–53.
Google Scholar
Баллем П. Приобретенная тромбофилия при беременности. Семинары Thromb Hemostas 1998; 24: 41–47.
Google Scholar
Lindqvisst PG, Svensson PJ, Dahlbäck B, Marsal K. Мутация Q506 фактора V (активированная устойчивость к протеину C), связанная со снижением кровопотери во время родов — возможный механизм эволюционного отбора. Thromb Haemost 1998; 79: 69–73.
Google Scholar
Робертс Дж. М., Тейлор Р. Н., Музыкант Т. Дж., Роджерс Дж. М., Хьюбел, Калифорния, Маклафлин М.К. Преэклампсия: заболевание эндотелиальных клеток. Am J Obstet Gynecol 1989; 161: 1200–1204.
Google Scholar
Salafia CM, Pezzulo JC, López-Zeno JA, Minior VK, Vintzileos AM. Патологические особенности плаценты при преэклампсии. Am J Obstet Gynecol 1995; 173: 1079–1105.
Google Scholar
Grandone E, Margaglione M, Calaizzo D и др. Фактор V Лейден, полиморфизм C-T MTHFR и генетическая предрасположенность к преэклампсии. Thromb Haemost 1997; 77: 1052–1054.
Google Scholar
Mousa HA, Alfiveric Z. Отражают ли поражения плаценты состояние тромбофилии у женщин с неблагоприятным исходом беременности? Репродукция человека 2000; 15: 1830–1833.
Google Scholar
Альфиревич З., Муса Х.А., Мартлью В., Бриско Л., Перес-Касаль М, Тох Ш. Послеродовой скрининг на тромбофилию у женщин с тяжелыми осложнениями беременности. Obstet Gynecol 2001; 97: 753–759.
Google Scholar
Блюменфельд З., Бреннер Б. Прерывание беременности, связанное с тромбофилией. Fertil Steril 1999; 353: 1258–1265.
Google Scholar
Huisjes AJ, Franx A, Bruinse HW. Высокая распространенность нарушений гемостаза у женщин с тяжелой преэклампсией в анамнезе. Am J Obstet Gynecol 2000; 182: 989–990.
Google Scholar
Купферминц М.Дж., Элдор А., Штейнман Н. и др. Повышенная частота генетической тромбофилии у женщин с осложнениями беременности. N Eng J Med 1999; 340: 9–13.
Google Scholar
Купферминц MJ, Fait G, Many A, Gordon D, Eldor A, Lessing JB. Тяжелая преэклампсия и высокая частота генетических тромбофильных мутаций. Obstet Gynecol 2000; 96: 45–49.
Google Scholar
Фон Темпельхофф Г.Ф., Хейлманн Л., Спанут Э., Кунцманн Э., Хоммель Г. Заболеваемость лейденской мутацией фактора V, дефицитом ингибитора свертывания и повышенным уровнем антифосфолипидных антител у пациентов с преэкламсией или HELLP-синдромом. Thromb Res 2000; 100: 363–365.
Google Scholar
Риго Дж. Младший, Надь Б., Финтор Л. и др. Материнские и неонатальные исходы беременностей с преэклампсией: потенциальная роль лейденской мутации фактора V и 5,10-метилентетрагидрофолатредуктазы. Гипертоническая беременность 2000; 19: 163–172.
Google Scholar
Дизон-Таунсон Д.С., Нельсон Л.М., Истон К., Уорд К.Лейденская мутация фактора V может предрасполагать женщин к тяжелой преэклампсии. Am J Obstet Gynecol 1996; 175: 902–905.
Google Scholar
Van Pampus MG, Dekker GA, Wolf H, et al. Высокая распространенность нарушений гемостаза у женщин с тяжелой преэклампсией в анамнезе. Am J Obstet Gynecol 1999; 180: 989–990.
Google Scholar
О’шонесси К.М., Фу Б., Ферраро Ф., Льюис И., Даунинг С., Моррис Н.Х.Фактор V Лейден и варианты гена термолабильной метилентетрагидрофолатредуктазы в когорте восточноанглийской преэклампсии. Гипертония 1999; 33: 1338–1341.
Google Scholar
Ливингстон Дж. С., Бартон Дж. Р., Парк V, Хаддад Б., Филлипс О., Сибай Б.М. Унаследованные от матери и плода тромбофилии не связаны с развитием тяжелой преэклампсии. Am J Obstet Gynecol 2001; 185: 153–157.
Google Scholar
Кобаши Г., Ямада Х, Асано Т. и др. Лейденская мутация фактора V не является частой причиной гипертонии, вызванной беременностью, в Японии. Sem Thromb Hemost 1999; 25: 487–489.
Google Scholar
Clark P, Sattar N, Walker ID, Greer IA. Исследование беременности Glasgow Outcome, APCR и Lipid (GOAL): значение резистентности к активированному протеину C, связанной с беременностью. Thromb Haemost 2001; 85: 30–35.
Google Scholar
Дилли А., Бенито С., Хупер В.С. и др. Мутации в генах фактора V, протромбина и MTHFR не являются факторами риска повторной потери плода. J Matern Fetal Neonatal Med 2002; 11: 176–182.
Google Scholar
Rai R, Regan L, Hadely E, Dave M, Cohen H. Выкидыш во втором триместре связан с активированной резистентностью к протеину C. Br J Haematol 1996; 92: 489–490.
Google Scholar
Preston FE, Rosendaal FR, Walker ID и др. Повышенная потеря плода у женщин с наследственной тромбофилией. Lancet 1996; 75: 387–390.
Google Scholar
Юнис Дж. С., Бреннер Б., Охель Дж., Тал Дж., Ланир Н., Бен-Ами М. Активированная резистентность к протеину С и лейденская мутация фактора V могут быть связаны с повторной потерей беременности как в первом, так и во втором триместре. AmJ Reprod Immunol 2000; 43: 31–35.
Google Scholar
Grandone E, Margagliane M, Calazzio D и др. Фактор V Лейден связан с повторяющимися и повторяющимися необъяснимыми потерями плода. Thromb Haemost 1997; 77: 822–824.
Google Scholar
Ридкер П.М., Милетич Дж. П., Бьюринг Дж. Э. и др. Лейденская мутация фактора V как фактор риска повторной потери беременности. Ann Intern Med 1998; 128: 1000–1003.
Google Scholar
Wilcken DEL, Wilcken B. Патогенез ишемической болезни сердца. Возможная роль в метаболизме метионина. J Clin Invest 1976; 57: 1079–1082.
Google Scholar
Steegers-Theunissen RP, Boers GH, Blom HJ, Trijbels FJ, Eskes TK. Гипергомоцистеинемия и повторный самопроизвольный аборт или отслойка плаценты. Lancet 1992; 339: 1122–1123.
Google Scholar
Д’Анджело А., Селхуб Дж. Гомоцистеин и тромботическая болезнь. Кровь 1997; 90: 1–11.
Google Scholar
Канг С.С., Чжоу Дж., Вонг П.В.К., Ковалисин Дж., Строкош Г. Промежуточная гомоцистеинемия: термолабильный вариант метилентетрагидрофолатредуктазы. Am J Hum Genet 1988; 43: 414–421.
Google Scholar
Фросст П., Блом Х. Дж., Милос Р. и др.Кандидат в генетический фактор риска сосудистых заболеваний: распространенная мутация метилентетрагидрофолатредуктазы. Нат Генет 1995; 10: 111–113.
Google Scholar
Уокер М.С., Смит Г.Н., Перкинс С.Л., Кили Э.Дж., Гарнер ПР. Изменения уровня гомоцистеина при нормальной беременности. Am J Obstet Gynecol 1999; 180: 660–664.
Google Scholar
Малинов М.Р., Райкович А., Друэлл ПБ, Гесс Д.Л., Апсон Б.М. Взаимосвязь между материнским и неонатальным гомоцистеином плазмы пуповины предполагает потенциальную роль материнского гомоцистеина в метаболизме плода. Obstet Gynecol 1998; 178: 228–233.
Google Scholar
Sohda S, Arinami T., Hamada H, Yamada N, Hamaguchi H, Kubo T. Полиморфизм метилентетрагидрофолатредуктазы и преэклампсия. J Med Genet 1997; 34: 525–526.
Google Scholar
Aubard Y, Darodes N, Cantaloube M. Гипергомоцистеинемия и беременность — обзор нашего нынешнего понимания и терапевтических последствий. Eur J Obstet Gynecol Repr Biol 2000; 93: 157–165.
Google Scholar
Лида М., Риязи Н., Де Фрис Дж.П., Якобс К., Ван Гейджн Х.П., Деккер Г.А. Влияние добавок фолиевой кислоты и витамина B6 на женщин с гипергомоцистеинемией и преэклампсией или задержкой роста плода в анамнезе. Am J Obstet Gynecol 1998; 179: 135–139.
Google Scholar
Dekker GA, De Vries JIP, Doelitzch PM, Von Blomberg BME, Jakob C. Основные расстройства, связанные с тяжелой преэклампсией с ранним началом. Am J Obstet Gynecol 1995; 173: 1042–1048.
Google Scholar
Пауэрс Р.У., Эванс Р.В., Майорс А.К. и др. Концентрация гомоцистеина в плазме повышается при преэклампсии и связана с тяжелой преэклампсией с ранним началом. Am J Obstet Gynecol 1998; 179: 1605–1611.
Google Scholar
Wouters MG, Boers GH, Blom HJ, et al. Гипергомоцистеинемия: фактор риска у женщин с неожиданным повторным невынашиванием беременности на ранних сроках. Fertil Steril 1993; 60: 820–825.
Google Scholar
Бреннер Б., Сариг Г., Вайнер З., Юнис Дж., Блюменфельд З., Ланир Н. Тромбофильные полиморфизмы часто встречаются у женщин с потерей плода без видимой причины. Thromb Haemost 1999; 82: 6–9.
Google Scholar
Quere I, Bellet H, Hoffet M, Janbon C, Mares P, Gris JC. Женщина, у которой пять последовательных смертей плода: отчет о клиническом случае и ретроспективный анализ распространенности гипергомоцистеинемии у 100 женщин с повторными выкидышами подряд. Fertil Steril 1998; 69: 152–154.
Google Scholar
Nelen W, Steegers E, Eskes T, Blom H. Генетический фактор риска необъяснимой повторяющейся потери беременности на ранних сроках. Ланцет 1997; 350: 861.
Google Scholar
Steegers-Theunissen RP, Wathen NC, Eskes TK, Van Raaij-Selten B, Chard T. Уровни метионина и гомоцистеина у матери и плода на ранних сроках беременности. Br J Obstet Gynaecol 1997; 104: 20–24.
Google Scholar
Nelen WL, Blom H, Steegers E, Den Heijer M, Eskes T. Гипергомоцистеинемия и повторяющаяся потеря беременности на ранних сроках: метаанализ. Fertil Steril 2000; 74: 1196–1199.
Google Scholar
Holmes ZR, Regan L, Chilcott I, Cohen H. Мутация гена C677T MTHFR не позволяет прогнозировать риск повторной потери плода. Br J Haematol 1999; 105: 98–101.
Google Scholar
Goddijn-Wessel T, Wouters M, Molen E, et al. Гипергомоцистеинемия: фактор риска отслойки плаценты или инфаркта. Eur J Obstet Gynecol Repr Biol 1996; 66: 23–29.
Google Scholar
Martinelli I, Sacchi E, Landi G, Taioli E, Duca F, Mannucci PM. Высокий риск тромбоза вен головного мозга у носителей мутации гена протромбина и у пользователей оральных контрацептивов. N Engl J Med 1998; 338: 1793–1797.
Google Scholar
Ridker PM, Hennekens CH, Miletich JP. Мутация G20210A в гене протромбина и риск инфаркта миокарда, инсульта и венозного тромбоза у большой группы мужчин в США. Тираж 1999; 99: 999–1004.
Google Scholar
Souto JC, Coll I, Llobert D, et al. Аллель протромбина G20210A является наиболее распространенным генетическим фактором риска венозной тромбоэмболии в испанской популяции. Thromb Haemostas 1998; 80: 366–369.
Google Scholar
Martinelli I, Taioli E, Bucciarelli P, Akhavan S, Mannucci M. Взаимодействие между мутацией G20210A гена протромбина и использованием оральных контрацептивов при тромбозе глубоких вен. Артериосклер тромб Vasc Biol 1999; 19: 700–703.
Google Scholar
Grandone E, Margaglione M, Colaizzo D, et al.Генетическая предрасположенность к венозной тромбоэмболии, связанной с беременностью: роль мутаций фактора V Лейдена, протромбина G20210A и метилентетрагидрофолатредуктазы C677T. Am J Obstet Gynecol 1998; 179: 1324–1328.
Google Scholar
Купферминц М.Дж., Пери Х., Цван Э., Ярон Ю., Вольман И., Элдор А. Высокая распространенность мутации гена протромбина у женщин с задержкой внутриутробного роста, отслойкой плаценты и потерей во втором триместре. Acta Obstet Gynecol Scand 2000; 79: 963–967.
Google Scholar
Grandone E, Margaglione M, Colaizzo D, et al. Протромботические генетические факторы риска и возникновение гестационной гипертензии с протеинурией или без нее. Thromb Haemost 1999; 81: 349–352.
Google Scholar
De Groot CJM, Bloemenkamp KWM, Duvekot EJ, et al.Преэклампсия и генетические факторы риска тромбоза: исследование случай-контроль. Am J Obstet Gynaecol 1999; 181: 975–980.
Google Scholar
Хиггинс Дж. Р., Кайзер Т., Моисей Е. К., Норт Р., Бреннеке СП. Мутация протромбина G20210A: связана ли она с преэклампсией? Gynecol Obstet Invest 2000; 50: 254–257.


