Наследственная тромбофилия
Склонность к патологическому свертыванию крови, или тромбофилия может обнаруживаться у пациентов, столкнувшихся с опасным состоянием — тромбозом 1. И у многих из них склонность к повышенному тромбообразованию передалась по наследству. Почему развивается наследственная тромбофилия. Какие симптомы появляются при данном состоянии, как ее диагностировать и лечить?
Генетические факторы
Тромбофилия, которая передается по наследству, — генетически обусловленная склонность к формированию тромбов. При сочетании двух и более нарушений в системе свертывания выраженные тромботические расстройства могут развиваться уже в раннем детстве. Однако чаще наследственное повышение свертываемости крови вызвано одним нарушением, которое выявляется случайно при лабораторном исследовании крови 2.
Выделяют два основных типа тромбофилий: гематогенные, связанные с изменениями свертывающей системы крови, и негематогенные. На сегодня известны как минимум 20 генетических факторов, связанных с развитием заболевания. Их разделяют на три группы2:
-
Установленные:
- фактор V Лейден — мутация, при которой из-за замены аминокислот в белковой цепи V фактора свертывания он становится устойчивым к действию одного из основных противосвертывающих агентов, активированного протеина С.
- Мутация G20210А протромбина II, при которой изменяется уровень фактора свертывания крови II протромбина.
- Дефицит протеина С, инактивирующего факторы свертывания крови Va и VIIIa. Встречается реже, чем две предыдущие мутации, обычно приводит к развитию семейного венозного тромбоза.
- Дефицит протеина S — кофактора протеина С, который усиливает его противосвертывающую и фибринолитическую активность.
- • Дефицит антитромбина, основного белкового фактора, который угнетает свертывание крови. Передается по аутосомно-доминантному типу, то есть проявляется только при наличии хотя бы одного дефектного гена.
-
Неопределённые:
- Дисфибриногенемия — состояние, при котором содержание фибриногена соответствует норме, однако сама молекула фибриногена изменена. Чаще передается по аутосомному типу наследования, то есть для проявления заболевания дефектный ген должен передаться от обоих родителей. Обычно проявляется умеренными кровотечениями на фоне травмы или хирургического вмешательства.
- Гипергомоцистеинемия. Может быть одновременно и наследственным, и приобретенным нарушением 2. Связана с редкими генетическими поломками, которые приводят к повышению концентрации гомоцистеина в моче, плазме крови. Гомоцистеин проявляет выраженный токсический эффект, повреждая внутреннюю поверхность сосудов, значительно увеличивая риск тромбозов.
-
Редкие.
К редким факторам тромбофилии относятся повышение концентрации факторов свертывания крови VIII, IX, XI, VII, XII, дефицит плазминогена, активация тканевого плазминогена, повышение липопротеина А, полиморфизм гликопротеина тромбоцитов, дефект гена тромбомодулина, другие факторы.
Как проявляется тромбофилия?
Наличие тромбофилии можно заподозрить при следующих состояниях 2:
- Повторная венозная тромбоэмболия
- Венозный тромбоз в возрасте младше 40 лет
- Венозная тромбоэмболия у родственников
- Тромбоз необычной локализации, например, брыжеечной вены, почечной вены, печени, церебральный тромбоз.
Необходимо отметить, что чаще всего тромбофилия приводит к тромбозу вен, однако недостаточность протеинов С, S и антитромбина могут проявляться также тромбозами в артериях. Последние становятся причиной инфаркта миокарда и острого нарушения мозгового кровообращения — инсульта.
Диагностика тромбофилии
Своевременная диагностика генетической (наследственной) тромбофилии играет важную роль в прогнозе заболевания. Раннее выявление заболевания позволяет внести необходимые коррективы в образ жизни и таким образом предупредить патологическое тромбообразование.
Поскольку передающаяся по наследству тромбофилия может быть связана с различными генетическими факторами, диагностика ее носит комплексный характер. Задача врача — подтвердить или опровергнуть наличие мутаций, связанных с нарушением свертывающей активности крови.
К числу анализов, которые придется сдать при подозрениях на наследственную тромбофилию, относятся3:
Развернутая коагулограмма с определением уровня факторов свертывания крови, физиологических антикоагулянтов.
Коагулограмма позволяет выявить отклонения в системе гемостаза и определить тип тромбофилии, недостаточность каких именно факторов свертываемости наблюдается.
- Определение уровня гомоцистеина, позволяющее диагностировать гипергомоцистеинемию.
- Определение содержания тромбомодулина, активности фактора Виллебранда, а также концентрации эндотелина-1, необходимые для получения информации о возможном поражении сосудов вследствие тромбофилии.
- Генетическое исследование полиморфизма генов тех факторов, которые участвуют в гемостазе.
Наследственная тромбофилия и беременность
Связь между передаваемыми по наследству тромбофилиями и осложнениями беременности, например, преэклампсией, эклампсией, самопроизвольным прерыванием беременности, задержкой развития плода, отслойкой плаценты до сих пор остается противоречивой4. И тем не менее, некоторые акушерские осложнения все же вызваны тромбофилиями.
Так, ряд исследований свидетельствует о возможной связи между потерей плода во втором и третьем триместрах беременности с наличием наследственной тромбофилии6. Это объясняется нарушением кровообращения в сосудах плаценты вследствие формирования в ней тромбов. Однако важно подчеркнуть, что самопроизвольные потери плода на ранних сроках беременности (в первом триместре) чаще не имеют отношения к тромбофилии.
Тем не менее, наличие тромбофилии, которая заложена генетически, у беременных женщин может повышать риск венозных тромбоэмболических осложнений5. Даже в норме, у здоровых женщин во время беременности свертывающая система крови активируется: наблюдается физиологическая гиперкоагуляция (повышение свертываемости крови), также имеется венозный застой. Однако, у беременных женщин, страдающих тромбофилией, коагуляция еще более увеличивается, что и может приводить к повышению риска тромбообразования, прежде всего в венозных сосудах7.
Даже в норме, у здоровых женщин во время беременности свертывающая система крови активируется: наблюдается физиологическая гиперкоагуляция (повышение свертываемости крови), также имеется венозный застой. Однако, у беременных женщин, страдающих тромбофилией, коагуляция еще более увеличивается, что и может приводить к повышению риска тромбообразования, прежде всего в венозных сосудах7.
Формированию венозного застоя у будущих мам может способствовать и снижение физической активности, например, при некоторых осложнениях беременности, а также после кесарева сечения 7.
Диагностика тромбофилии при беременности затруднена, поскольку ряд показателей повышается как при патологии, так и у здоровых женщин, причем чем больше срок беременности, тем выше риск тромбоза. Чтобы поставить диагноз, прибегают к генетическому исследованию, которое обычно проводится по рекомендации лечащего врача при наличии определенных показаний, например, при наличии перенесенного венозного тромбоза нижних конечностей или наличии венозных тромбозов у близких родственников.
Профилактика тромбозов
Профилактика тромбозов при тромбофилии в большинстве случаев основана на изменении образа жизни. Пациентам рекомендуют избегать тяжелых физических нагрузок и травм, при этом сохраняя прежний объем физической активности. Важная мера профилактики — ношение компрессионного трикотажа. Врачи всегда принимают решение о профилактических мерах строго индивидуально после оценки тромботического риска.
Список литературы
- Kyrle P.A., Rosendaal F.R., Eichinger S. Risk assessment for recurrent venous thrombosis //Elsevier.2010;376(9757):2032–2039.
- Khan S., Dickerman J.D. Hereditary thrombophilia. // Thromb. J. BioMed Central. 2006;4:15.
- Васильев С.А., Виноградов В.Л., и соавт. Тромбозы и тромбофилии: классификация, диагностика, лечение, профилактика // РМЖ — 2013.- № 17. — С.896.
- Robertson L. et al. Thrombophilia in pregnancy: a systematic review // Br.
 J. Haematol. Blackwell Science Ltd.2006;132(2):171–196.
J. Haematol. Blackwell Science Ltd.2006;132(2):171–196. - Sibai B.M., How H.Y., Stella C.L. Thrombophilia in pregnancy: Whom to screen, when to treat. 2007;19(1):50–64.
- Battinelli E.M., Marshall A., Connors J.M. The role of thrombophilia in pregnancy. // Thrombosis. Hindawi.2013; 2013:516420.
- Андрияшкин А.В. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений // Флебология — 2015. –Т. 9. – № 2. –С.1–52.
SARU.ENO.19.03.0436
Анализы в KDL. Генетический риск нарушений системы свертывания
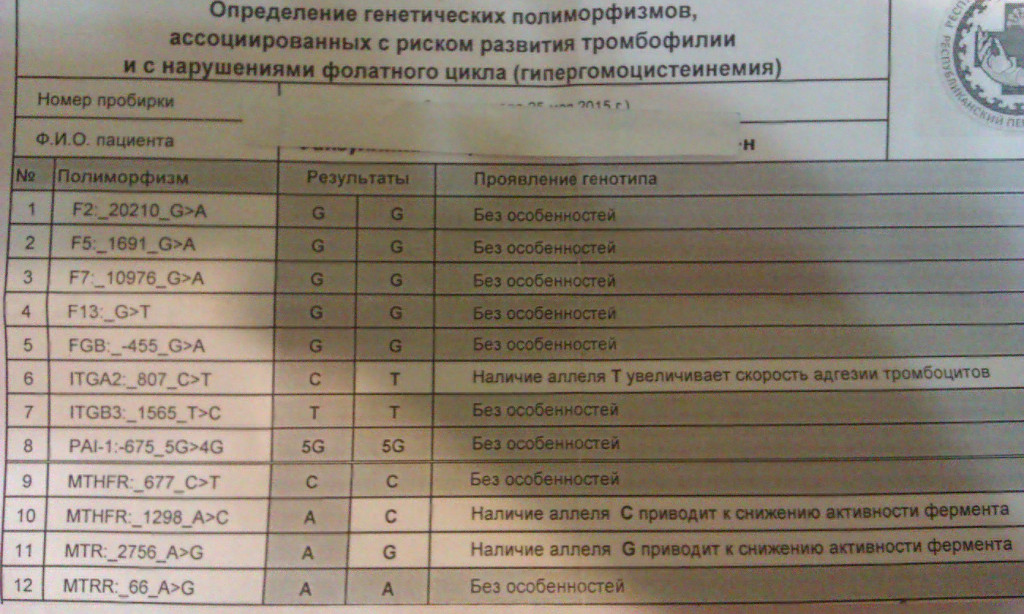
Данное исследование представляет собой выявление полиморфизмов в генах, связанных с наследственной тромбофилией и другими нарушениями системы свертывания крови. Тромбофилия – это повышенная склонность к случайному (без видимых причин) тромбозу глубоких вен и тромбоэмболическим осложнениям. Тромбоз может возникнуть при нарушениях кровообращения (застой крови), повышенной способности крови образовывать тромбы (гиперкоагуляции), повреждениях сосудистой стенки и при сочетании этих факторов. Гиперкоагуляция может быть обусловлена наличием генетической предрасположенности к тромбофилии (наиболее часто встречаются полиморфизмы в генах F2 и F5), которую позволяет выявить этот анализ.
В каких случаях обычно назначают исследование?
Анализ рекомендован следующим категориям пациентов:
- пациенты с семейной историей тромбофилии и других венозных осложнений
- пациенты с наличием в семейной истории сердечно- сосудистых событий (инфарктов и инсультов) у близких родственников в возрасте до 50 лет
- женщины, планирующие прием комбинированных
- пациенты с тромбозами любой локализации в возрасте до 50 лет, даже при наличии предрасполагающих факторов
- пациенты с тромбозами необычных мест (тромбоз мозговых синусов, мезентериальные, печеночные вены)
- пациенты с хроническими заболеваниями вен, в частности с тромбофлебитами
- женщины, планирующие прием комбинированных оральных контрацептивов
- женщины, планирующие гормональную заместительную терапию
- женщины с привычным невынашиванием беременности.
Что именно определяется в процессе анализа?
В данном исследовании выявляются полиморфизмы следующих генов:
- F2 — ген протромбина.
- F5 – ген фактора V свертывания крови.
- F7 – ген проконвертина.
- F13A1 – ген, кодирующий A-субъединицу XIII фактора свертывания.
- FGB – ген, кодирующий бета- субъединицу фибриногена.
- ITGA2 – ген, кодирующий тромбоцитарный гликопротеин Iа.
- ITGB3 – ген, кодирующий белок интегрин бета- 3, являющийся компонентом тромбоцитарного гликопротеина IIb/IIIа.
- SERPINE1 (PAI-I)– ген ингибитора активатора плазминогена 1 типа.
Что означают результаты теста?
В качестве заключения выдается генетическая карта здоровья, составленная профессиональным врачом-генетиком нашей лаборатории. В ней представлены результаты анализа с расшифровкой, дано подробное описание исследуемых полиморфизмов и их влияния на риски развития нарушений системы свертывания крови, сердечно-сосудистых заболеваний и патологий беременности, советы по проведению дополнительных исследований и подробные клинические рекомендации для лечащего врача.
Результаты анализа интерпретируются лечащим врачом. Опираясь на них, врач может скорректировать питание и образ жизни пациента, назначить лекарственные препараты и дополнительные исследования.
Сроки выполнения теста.
Результат генетического исследования можно получить спустя 10-11 дней после взятия крови.
Как подготовиться к анализу?
Следует придерживаться общих правил подготовки к взятию крови из вены. Кровь можно сдавать не ранее, чем через 3 часа после приема пищи в течение дня, или утром натощак. Чистую воду можно пить в обычном режиме.
Сдать анализ на гены системы гемостаза (с описанием результатов врачом- генетиком)
Метод определения
Real-time-PCR.
Исследуемый материал
Цельная кровь (с ЭДТА)
Доступен выезд на дом
Расширенное исследование генов системы гемостаза: F2, F5, MTHFR, MTR, MTRR, F13, FGB, ITGA2, ITGВ3, F7, PAI-1
Комплексное исследование генетических факторов риска развития нарушений в системе свертывания крови и фолатном цикле.
Различные изменения в генах системы гемостаза и цикла обмена фолатов предрасполагают к развитию большого числа патологических состояний: инфаркты, инсульты, тромбоэмболии, кровотечения, патология беременности и родов, осложнения послеоперационного периода и т.д.
Профиль включает в себя исследование основных полиморфизмов в генах системы гемостаза и фолатного цикла:
- F2 c.*97G>A (20210 G>A; rs1799963),
- F5 c.1601G>A (Arg534Gln; 1691 G>A; rs6025),
- MTHFR c.665C>T (Ala222Val; 677 C>T; rs1801133),
- MTHFR c.1286A>C (Glu429Ala; 1298 A>C; rs1801131),
- MTR c.2756A>G (Asp919Gly; rs1805087),
- MTRR c.66A>G (Ile22Met; rs1801394),
- F13 с.103G>T (I63Т; rs5985),
- FGB c.-467G>A (-455 G>А; rs1800790),
- ITGA2 c.759C>T (Phe253Phe, 807 C>T; rs1126643),
- ITGB3 c.176T>C (Leu59Pro; 1565 T>C; rs5918),
- F7 c.1238G>A (Arg353Gln; 10976 G>A; rs6046),
- PAI-1 (SERPINE1) –675 5G>4G (rs1799889).
Ген F2 кодирует аминокислотную последовательность белка протромбина. Полиморфизм F2 c.*97G>A приводит к повышенной экспрессии гена. Клинически неблагоприятный вариант полиморфизма (c.*97A) наследуется по аутосомно-доминантному типу. Наличие полиморфизма F2 c.*97G>A в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне курения — в 40 и более раз) увеличивает риск возникновения венозных тромбозов, в том числе тромбозов сосудов мозга и сердца, особенно в молодом возрасте. У пациентов-носителей данного полиморфизма повышен риск развития тромбоэмболий после хирургических вмешательств. Приём оральных контрацептивов у данной группы лиц также увеличивает риск тромбозов (относительный риск развития тромбофилии и венозной тромбоэмболии у гетерозиготных носительниц полиморфизма c.*97G>A возрастает в 16 раз).
Ген F5 кодирует аминокислотную последовательность белка проакцелерина — коагуляционного фактора 5. Нуклеотидная замена c.1601G>A («мутация Лейден») приводит к аминокислотной замене аргинина на глутамин в позиции 534, что придает устойчивость активной форме проакцелерина. Клинически это проявляется рецидивирующими венозными тромбозами и тромбоэмболиями. Наличие полиморфизма в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне заместительной гормонотерапии или приема оральных контрацептивов — в 30 и более раз) увеличивает риск венозных тромбозов. Риск инфаркта миокарда увеличивается в 2 и более раз, риск развития патологии беременности (прерывание беременности, преэклампсия, хроническая плацентарная недостаточность и синдром задержки роста плода) увеличивается в 3 и более раз.
Нуклеотидная замена c.1601G>A («мутация Лейден») приводит к аминокислотной замене аргинина на глутамин в позиции 534, что придает устойчивость активной форме проакцелерина. Клинически это проявляется рецидивирующими венозными тромбозами и тромбоэмболиями. Наличие полиморфизма в гомозиготной или гетерозиготной форме значительно (в 3 и более раз, а на фоне заместительной гормонотерапии или приема оральных контрацептивов — в 30 и более раз) увеличивает риск венозных тромбозов. Риск инфаркта миокарда увеличивается в 2 и более раз, риск развития патологии беременности (прерывание беременности, преэклампсия, хроническая плацентарная недостаточность и синдром задержки роста плода) увеличивается в 3 и более раз.
Также, пациенты, являющиеся одновременно носителями полиморфизма c.*97G>A гена протромбина и «мутации Лейден», еще в большей степени подвержены риску развития тромбозов и тромбоэмболий.
Ген MTHFR кодирует аминокислотную последовательность фермента метилентетрагидрофолатредуктазы, играющего ключевую роль в метаболизме фолиевой кислоты. Полиморфизм c.665C>T гена MTHFR связан с заменой нуклеотида цитозина (С) на тимин (Т), что приводит к аминокислотной замене аланина на валин в позиции 222. Вариант c.665Т связан с четырьмя группами мультифакториальных заболеваний: сердечно-сосудистыми, дефектами развития плода, колоректальной аденомой и раком молочной железы и яичников. У женщин с генотипом c.665Т/Т дефицит фолиевой кислоты во время беременности может приводить к порокам развития плода, в том числе незаращению нервной трубки. Неблагоприятное воздействие варианта c.665Т- зависит от внешних факторов: низкого содержания в пище фолатов, курения, приема алкоголя. Сочетание генотипа c.665Т/Т и папилломавирусной инфекции увеличивает риск цервикальной дисплазии. Назначение препаратов фолиевой кислоты может значительно снизить негативное влияние данного варианта полиморфизма.
Полиморфизм MTHFR c.1286A>C связан с точечной заменой нуклеотида аденина (А) на цитозин (С), что приводит к замене аминокислотного остатка глутаминовой кислоты на аланин в позиции 429, относящейся к регулирующей области молекулы фермента. При наличии данного полиморфизма отмечается снижение активности фермента MTHFR. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови у носителей дикого варианта полиморфизма c.665C>T, однако сочетание аллельного варианта* c.1286C с аллелем c.665T приводит к снижению уровня фолиевой кислоты и соответствует по своему эффекту гомозиготному состоянию MTHFR c.665Т/T. При этом риск развития дефектов нервной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно оба полиморфных варианта, также снижена.
При наличии данного полиморфизма отмечается снижение активности фермента MTHFR. Это снижение обычно не сопровождается изменением уровня гомоцистеина в плазме крови у носителей дикого варианта полиморфизма c.665C>T, однако сочетание аллельного варианта* c.1286C с аллелем c.665T приводит к снижению уровня фолиевой кислоты и соответствует по своему эффекту гомозиготному состоянию MTHFR c.665Т/T. При этом риск развития дефектов нервной трубки повышается в 2 раза. Жизнеспособность плодов, имеющих одновременно оба полиморфных варианта, также снижена.
Ген MTR кодирует аминокислотную последовательность фермента метионин синтазы. Полиморфизм c.2756A>G связан с аминокислотной заменой (аспарагиновой кислоты на глицин) в молекуле фермента. В результате этой замены функциональная активность фермента изменяется, что приводит к повышению риска формирования пороков развития у плода. Влияние полиморфизма усугубляется повышенным уровнем гомоцистеина.
Ген MTRR кодирует аминокислотную последовательность фермента редуктазы метионинсинтазы. Полиморфизм c.66A>G связан с аминокислотной заменой в молекуле фермента. В результате этой замены функциональная активность фермента снижается, что приводит к повышению риска развития дефектов нервной трубки у плода. Влияние полиморфизма усугубляется дефицитом витамина В12. При сочетании полиморфизма c.66A>G гена MTRR с полиморфизмом c.665C>T в гене MTHFR риск spina bifida увеличивается. Полиморфизм c.66A>G гена MTRR усиливает гипергомоцистеинемию, вызываемую полиморфизмом c.665C>T в гене MTHFR.
Ген фибриназы (F13) кодирует синтез трансглютаминазы, участвующей в стабилизации фибринового сгустка и в формировании соединительной ткани. Аллельные варианты с.103G/Т и с.103Т/Т приводят к снижению уровня трансглютаминазы с образованием сетчатой структуры фибрина с более тонкими волокнами, меньшими порами, и изменением характеристик проникновения, которое в сочетании с другими факторами риска ассоциируется с возможным риском внутричерепных кровоизлияний и кровотечений из внутренних органов, а также привычным невынашиванием беременности. При этом аллельный вариант с.103Т может выступать в роли протективного фактора в отношении инфаркта миокарда и венозных тромбозов.
При этом аллельный вариант с.103Т может выступать в роли протективного фактора в отношении инфаркта миокарда и венозных тромбозов.
Ген FGB кодирует β-цепь фибриногена, являющегося предшественником фибрина. Аллельный вариант c.-467А обусловливает усиленную транскрипцию гена и может приводить к увеличению уровня фибриногена в крови и повышению вероятности образования тромбов при наличии дополнительных факторов риска. Гетерозиготный вариант c.-467G/А связывают с повышенным риском ишемического инсульта и лакунарными инфарктами церебральных сосудов. Гомозиготный вариант c.-467A/А связывают с повышенным риском инфаркта миокарда.
Ген гликопротеина Gp1a (ITGA2) кодирует синтез альфа-2-субъединицы интегринов – специализированных рецепторов тромбоцитов. Аллельный вариант c.759Т вызывает изменение первичной структуры субъединицы и свойств рецепторов. При гетерозиготном (c.759C/T) варианте отмечается увеличение скорости адгезии тромбоцитов к коллагену I типа, что может приводить к повышенному риску тромбофилии, инфаркта миокарда и других сердечно-сосудистых заболеваний. Аллельный вариант c.759Т связывают со случаями резистентности к аспирину. Помимо этого, при гомозиготном (c.759Т/T) варианте значительно увеличивается количество рецепторов на поверхности тромбоцитов. В совокупности, при гомозиготном варианте данного полиморфизма значительно повышен риск тромбофилии, инфаркта миокарда и развития других острых эпизодов тромбообразования в возрасте до 50 лет, даже по сравнению с гетерозиготным вариантом.
Ген гликопротеина Gp3a (ITGB3) кодирует синтез бета-3 цепи интегринового комплекса GP2b\3a, участвующего в разнообразных межклеточных взаимодействиях (адгезии и сигнализации).
Аллельный вариант c.176С (гетерозигота c.176T/C) обусловливает повышенную адгезию тромбоцитов и может приводить к увеличению риска развития острого коронарного синдрома, а также связан с синдромом привычного невынашивания беременности. Гомозиготный вариант c.176С/C обусловливает повышенную адгезию тромбоцитов и может приводить к значительному увеличению риска развития острого коронарного синдрома в возрасте до 50 лет.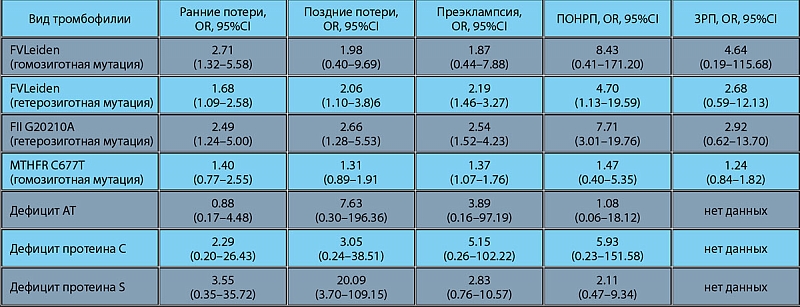 У лиц с полиморфными аллельными вариантами часто отмечается пониженная эффективность аспирина.
У лиц с полиморфными аллельными вариантами часто отмечается пониженная эффективность аспирина.
Аллельный вариант c.1238A (гетерозигота c.1238G/A и гомозигота c.1238А/A) гена F7 приводит к понижению экспрессии гена и снижению уровня фактора 7 в крови, рассматривается как протективный маркёр в отношении развития тромбозов и инфаркта миокарда.
Ген ингибитора активатора плазминогена (PAI-1) кодирует белок-антагонист тканевого и урокиназного активатора плазминогена. Преобладающим в популяции вариантом исследуемого полиморфизма является гетерозиготный вариант -675 5G/4G. В связи с этим данный полиморфизм самостоятельного диагностического значения не имеет, эффект возможно оценить в сочетании с другими факторами предрасполагающими к развитию патологии (например в сочетании с FGB c.-467A). Аллельный вариант -675 4G сопровождается большей активностью гена, чем -675 5G, что обусловливает более высокую концентрацию PAI-1 и уменьшение активности противосвёртывающей системы. Гомозигота -675 4G/4G ассоциирована с повышением риска тромбообразования, преэклампсии, нарушением функции плаценты и самопроизвольного прерывания беременности.
*Примечание: иногда в научной литературе при описании однонуклеотидных замен, характерных для генных полиморфизмов, встречается термин «мутантный аллель». Это терминологическая неточность, так как в классической генетике термин «мутантный аллель» традиционно рассматривается как синоним термина «мутация». При мутациях, как известно, изменение структуры гена приводит к образованию (экспрессии) нефункциональных белков и к неизбежному развитию наследственного заболевания. При полиморфизмах изменение в структуре гена приводит лишь к появлению белков с немного изменёнными физико-химическими свойствами. Такие изменения, как известно, проявляют себя при воздействии на организм различных факторов внешней среды или при изменении функционального состояния организма человека. И только в таких ситуациях функционирование белков со структурными особенностями может, либо способствовать ускорению развития заболевания, либо, напротив, тормозить формирование патологических процессов. Поэтому, на наш взгляд, для разграничения изменений в генах столь очень похожих структурно, но приводящих к несоизмеримо разным последствиям для организма, корректнее в отношении генных полиморфизмов применять понятие «аллельный вариант гена», а не «мутантный аллель».
Поэтому, на наш взгляд, для разграничения изменений в генах столь очень похожих структурно, но приводящих к несоизмеримо разным последствиям для организма, корректнее в отношении генных полиморфизмов применять понятие «аллельный вариант гена», а не «мутантный аллель».
Тромбофилия, Фактор Лейдена, протромбин — GenEra DNS testēšanas laboratorija
С направлением от гинеколога, онколога и других специалистов (см. в разделе «цены») анализ оплачивается государством.
- NM_000130.4(F5):c.1601G>A (p.Arg534Gln), rs6025 (c.1691G>A, FVL, фактор Лейдена)
- NM_000506.4(F2):c.*97G>A (мутация гена протромбина 20210G>A)
- NM_005957.4(MTHFR):c.665C>T (p.Ala222Val), rs1801133 (полиморфизм гена MTHFR 677C>T)
- NM_005957.4(MTHFR):c.1286A>C (p.Glu429Ala), rs1801131 (полиморфизм гена MTHFR 1298A>C)
- NM_000602.4(SERPINE1):c.-820_-817G(4_5) (PAI-1 4G/5G)
Что такое тромбофилия?
Тромбофилия – патологическая склонность к образованию тромбов. Это группа заболеваний, при которых склонность к образованию тромбов может возникнуть в результате генетических факторов, влияния факторов окружающей среды, а также взаимодействия генов и окружающей среды. Тромбофилия связана с риском как венозного, так и артериального тромбоза, однако факторы генетического риска артериального не так выражены, поэтому обычно не анализируются.
Что может быть генетической причиной врожденной тромбофилии?
Врожденная мутация генов, кодированные белки которых участвуют в разжижении крови, могут быть причиной процесса образования тромбов. Некоторые наиболее часто встречающиеся причины врожденных венозных тромбозов:
- т. н. мутация Лейдена c.1691G>A в кодирующем фактор V гене F5 (rs6025),
- мутация g.20210G>A в кодирующем фактор II гене F2 (rs1799963)
Mутация Лейдена V в кодирующем фактор V гене F5;
В популяции европейского происхождения эта мутация встречается у 3–8%. У пациентов с тромбозами эта мутация встречается в 20–25% случаев. В случае мутации Лейдена V возможна повышенная резистентность белка С, что является одной из причин тромбоза.
У пациентов с тромбозами эта мутация встречается в 20–25% случаев. В случае мутации Лейдена V возможна повышенная резистентность белка С, что является одной из причин тромбоза.
Мутация c.20210G>A в кодирующем фактор II гене F2;
В популяции европейского происхождения эта мутация встречается у 2–3%. У пациентов с тромбозами эта мутация встречается в 4–8% случаев. В случае мутации в организме повышен уровень протромбина, что может способствовать образованию тромбина и образованию фибриновых тромбов. Тип наследования: аутосомно-доминантный в обеих позициях.
Пациентам важно понимать, что наличие вышеупомянутых мутаций в гене F5 или F2 не означает, что в течение жизни обязательно разовьется тромбоз. Наличие этих мутаций в геном только увеличивает риск тромбозов.
Зная, что у пациента есть эти мутации в геноме, врач при необходимости может усиленно наблюдать пациента и принять решение о необходимой поддерживающей терапии в различных жизненных ситуациях, а также информировать пациента о повышающих риск тромбозов факторах образа жизни и окружающей среды и о том, как от них избавиться.
Факторы, повышающие риск тромбоза.
*Известно несколько повышающих риск тромбоза мутаций, которые в комбинации с другими факторами риска тромбофилии могут увеличить риск венозных тромбозов:
- в гене MTHFR: 677C>T или rs1801133 (Ala222Val)
- в гене MTHFR: 1298A>C или rs1801131 (Glu429Ala)
- Полиморфизм SERPINE1 (PAI-1) 4G/5G или rs587776796
В случае MTHFR 677 TT или MTHFT 677CT-1298AC у индивида может быть повышенный уровень гомоцистеина в крови , что является фактором, способствующим тромбофилии. Чтобы узнать больше о влиянии мутаций MTHFR на организм, см. Анализ MTHFR.
4G-аллель гена PAI-1 связана с большей активностью плазмы PAI-1, что вызывает пониженную фибринолитическую активность и, соответственно у гетерозигот 4G и гомозигот 4G/5G повышается риск венозного и артериального тромбоза. У гомозиготных женщин 4G несколько повышается риск осложнений при беременности.
У гомозиготных женщин 4G несколько повышается риск осложнений при беременности.
**Усиливающие тромбофилию факторы окружающей среды и образа жизни:
- Приобретенная тромбофилия (злокачественность, гипергомоцистеинемия, высокий риск фактора VII)
- Беременность
- Использование оральных контрацептивов
- Гормонозаместительная терапия
- Продолжительное пребывание в одной позе (долгие путешествия, постельный режим)
- Центральные катетеры, хирургические манипуляции, трансплантации
Кому рекомендуется делать анализ ДНК на тромбофилию:
Анализ рекомендуется пациентам с историей тромбозов (у самих ив семье), тромбозами в нетипичных местах, тромбозами, связанными с гормонозаместительной терапией или гормональной контрацепцией, а также во время беременности.
Во время беременности тромбофилия может вызвать преэклампсию, отслоение плаценты, задержку внутриутробного развития плода, потерю беременности на позднем сроке (обычно в 3-м триместре).
Конфиденциальность и этические принципы
Результаты анализа являются строго конфиденциальными. Они будут отправлены только назначившему тест лечащему врачу или пациенту. По результатам анализа ДНК пациент может проконсультироваться со своим врачом. С образцом конкретного пациента будет проведен только назначенный тест, для других целей он не будет использоваться ни при каких обстоятельствах.
Для посещения нашей лаборатории и сдачи образцов для выполнения какого-либо анализа, просьба звонить по тел. +371 26267833 или писать на эл. почту [email protected] с указанием интересующего вас анализа; имени, фамилии и года рождения человека, которому необходим анализ; желаемых даты и времени посещения лаборатории; номера контактного телефона.
Литература:
-
Bertina, R. M., Koeleman, B. P. C.
 , Koster, T., Rosendaal, F. R., Dirven, R. J., de Ronde, H., van der Velden, P. A., Reitsma, P. H. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 369: 64-67, 1994. [PubMed: 8164741]
, Koster, T., Rosendaal, F. R., Dirven, R. J., de Ronde, H., van der Velden, P. A., Reitsma, P. H. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature 369: 64-67, 1994. [PubMed: 8164741] -
De Stefano, V., Martinelli, I., Mannucci, P. M., Paciaroni, K., Chiusolo, P., Casorelli, I., Rossi, E., Leone, G. The risk of recurrent deep venous thrombosis among heterozygous carriers of both factor V Leiden and the G20210A prothrombin mutation. New Eng. J. Med. 341: 801-806, 1999. [PubMed: 10477778]
-
Zivelin, A., Mor-Cohen, R., Kovalsky, V., Kornbrot, N., Conard, J., Peyvandi, F., Kyrle, P. A., Bertina, R., Peyvandi, F., Emmerich, J., Seligsohn, U. Prothrombin 20210G-A is an ancestral prothrombotic mutation that occurred in whites approximately 24,000 years ago. Blood 107: 4666-4668, 2006. [PubMed: 16493002]
-
Poort, S. R., Rosendaal, F. R., Reitsma, P. H., Bertina, R. M. A common genetic variation in the 3-prime-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood 88: 3698-3703, 1996. [PubMed: 8916933]
-
Rosendaal, F. R., Doggen, C. J. M., Zivelin, A., Arruda, V. R., Aiach, M., Siscovick, D. S., Hillarp, A., Watzke, H. H., Bernardi, F., Cumming, A. M., Preston, F. E., Reitsma, P. H. Geographic distribution of the 20210 G to A prothrombin variant. Thromb. Haemost. 79: 706-708, 1998. [PubMed: 9569177]
Генетика тромбофилий (8 аллелей) | Медицинский центр ЛМД
Описание
Синонимы (rus): Первичная тромбофилия, наследственная тромбофилия, врождённая тромбофилия
Синонимы (eng): Hypercoagulability, coagulability, hypercoagulable state, hereditary thrombophilia, familial thrombophilia, primary thrombophilia
Биоматериал: Венозная кровь
Показатель(и): Мутации в генах FGB, FII (протромбин), FV (мутация Лейдена), FVII, FXIII, ITGA2, ITGB3 и PAI-1
Метод(и): Полимеразная цепная реакция (ПЦР)
Тип контейнера и особенности преаналитики: Пробирка для гематологических исследований с EDTA, 2 мл (фиолетовая крышечка)
Тромбофилия – это патологическое состояние, при котором происходит нарушение системы свертывания крови и повышается риск тромбозов. Таким образом, у больных развивается повышенный риск осложнений беременности, хирургических операций, чаще наблюдается формирование тромбоэмболий и ишемических поражений органов. Заболевание может быть наследственным или же развиться вторично, например, при онкологических заболеваниях, приеме оральных контрацептивов, длительном ограничении подвижности. В 30-50% случаев причиной является генетическая предрасположенность, обусловленная мутациями в генах F2, F5, F7, F13, FGB (плазменное звено системы гемостаза) и ITGA2, ITGB3, PAI-1 (сосудисто-тромбоцитарное звено). Проведение скрининга на мутации в этих генах необходимо для оценки риска развития тромботических осложнений и своевременной коррекции проводимой терапии.
Таким образом, у больных развивается повышенный риск осложнений беременности, хирургических операций, чаще наблюдается формирование тромбоэмболий и ишемических поражений органов. Заболевание может быть наследственным или же развиться вторично, например, при онкологических заболеваниях, приеме оральных контрацептивов, длительном ограничении подвижности. В 30-50% случаев причиной является генетическая предрасположенность, обусловленная мутациями в генах F2, F5, F7, F13, FGB (плазменное звено системы гемостаза) и ITGA2, ITGB3, PAI-1 (сосудисто-тромбоцитарное звено). Проведение скрининга на мутации в этих генах необходимо для оценки риска развития тромботических осложнений и своевременной коррекции проводимой терапии.
Ген FGB (фибриноген). Исследуется полиморфизм 455 G>A, мутация заключается в замене гуанина на аденин. Данная мутация приводит к умеренно повышенному уровню фибриногена в плазме.
Ген FII (протромбин). Исследуется полиморфизм 20210 G>A, при мутации отмечается замена гуанина на аденин. Данная мутация увеличивает уровень протромбина на 30%, что способствует повышению свертываемости крови.
Ген FV (проакцелерин). Мутация Лейдена заключается в замене гуанина на аденин в 1691 позиции (1691 G>A), что приводит к синтезу мутантного фактора V. Данная мутация приводит к резистентности к протеину C, поскольку замещает аминокислоту аргинин на гуанин в месте, где протеин C взаимодействует с фактором V. Мутация Лейдена существенно увеличивает риск тромбоза: при генотипе G/A и А/А риск тромбозов возрастает в 7 раз.
Ген FVII (проконвертин). Проконвертин активирует X фактор свертываемости крови. Исследуется полиморфизм 10976 G>A, мутация заключается в замене гуанина аденином. Наличие аллели А является защитным фактором в развитии тромбозов. Генотип A/A и A/G обладает протективной функцией, снижая активность белка.
Ген FXIII (фибриназа). Фактор XIII образует внутримолекулярные сшивки между молекулами фибрина и гамма-глутамил-эпсилон-лизина, стабилизируя кровяные сгустки. Исследуется полиморфизм 103 G>T. При замене гуанина тимином и формировании генотипа G/T и T/T образуется аномальная структура сгустка фибрина, что снижает риск развития инфаркта миокарда и тромбоза глубоких вен..
Исследуется полиморфизм 103 G>T. При замене гуанина тимином и формировании генотипа G/T и T/T образуется аномальная структура сгустка фибрина, что снижает риск развития инфаркта миокарда и тромбоза глубоких вен..
Ген ITGA2 (интегрин). Данный ген ко кодирует белок интегрин α2β1, который является структурным элементом тромбоцитарного рецептора GPIa/GPIIa. Данный рецептор связывается с субэндотелиальным коллагеном и регулирует адгезию и активацию тромбоцитов. Исследуется полиморфизм 807 C>T. Генотипы С/Т и Т/Т приводят к умеренному увеличению скорости адгезии тромбоцитов, что является фактором повышенного риска развития тромбоза.
Ген ITGB3 (интегрин). Данный ген кодирует белок интегрин бета-3 – мембранный гликопротеин IIIа (GP IIIа). Гликопротеин GPIIIa, связываясь с GPIIb, образует тромбоцитарный рецептор фибриногена. Исследуется полиморфизм 1565 T>C. Тромбоциты носителей генотипов T/C и C/C имеют значимо повышенную склонность к агрегации, что приводит к повышенному риску тромбоза.
Ген PAI-I (серпин). Серпин, или активатор плазминогена – 1, относится к ингибиторам сериновой протеиназы и ухудшает растворение сгустков. Исследуется полиморфизм 675 5G>4G . Носители генотипа 4G/5G и 4G/4G имеют повышенный уровень серпина, что приводит к умеренному снижению фибринолитической активности крови и повышенному риску тромбоза.
Когда назначается
Дифференциальный диагноз ранних тромбозов глубоких вен и артерий, превычного невынашивания беременности, ишемического поражения головного мозга.
Подготовка к анализу
Специальной подготовки не требуется. Исследование проводится натощак (не принимать пищу 3 часа до исследования, можно пить воду).
Интерпретация
Исследуется наличие полиморфизмов в указанных генах, на основании чего делается заключение о наличии протромбогенного и протективного генотипа. При мутациях в гене FII генотипы G/A и A/A предрасполагают к повышенной свертываемости крови.
При мутациях в гене FGB генотипы G/A и A/A предрасполагают к повышенной концентрации фибриногена и свертываемости крови.
При мутациях в гене FV генотипы G/A и A/A предрасполагают к повышенной свертываемости крови.
При мутациях в гене FVII генотипы G/A и A/A предрасполагают к пониженной активности проконвертина (протективный генотип).
При мутациях в гене FXIII генотипы G/T и T/T предрасполагают к пониженной активности фибриназы (протективный генотип).
При мутациях в гене ITGA2 генотипы С/T и T/T предрасполагают к повышенной скорости адгезии тромбоцитов.
При мутациях в гене ITGB3 генотипы T/C и C/C предрасполагают к повышенной агрегационной способности тромбоцитов.
При мутациях в гене PAI-I генотипы 4G/5G и 4G/4G предрасполагают к повышенному уровню серпина в плазме и риску тромбоза.
Список литературы
- А.Л. Комаров, О.О. Шахматова, Д.В. Ребриков, Д.Ю. Трофимов, Т.И. Коткина, Т.А. Илющенко, А.Д. Деев, Е.П. Панченко. Влияние генетических факторов, ассоциированных с тромбозами, на долгосрочный прогноз больных хронической ишемической болезнью сердца Рациональная Фармакотерапия в Кардиологии 2011;7(4)
- Murin S, Marelich GP, Arroliga AC, Matthay RA. Hereditary thrombophilia and venous thromboembolism. Am J Respir Crit Care Med. 1998;158(5 I):1369-1373.
- Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016;41(1):154-164. doi:10.1007/s11239-015-1316-1.
- Michiels JJ, Hamulyák K. Laboratory diagnosis of hereditary thrombophilia. Semin Thromb Hemost. 1998;24(4):309-320. doi:10.1055/s-2007-996019.
- Stevens SM, Woller SC, Bauer KA, et al. Guidance for the evaluation and treatment of hereditary and acquired thrombophilia. J Thromb Thrombolysis. 2016;41(1):154-164. doi:10.1007/s11239-015-1316-1.
- Eldor A. Thrombophilia, thrombosis and pregnancy. In: Thrombosis and Haemostasis. Vol 86. ; 2001:104-111.
ЗНАЧЕНИЕ ДИАГНОСТИКИ НАСЛЕДСТВЕННЫХ ТРОМБОФИЛИЙ ПРИ БОЕВОЙ ОГНЕСТРЕЛЬНОЙ ТРАВМЕ | Николаев
ЗНАЧЕНИЕ ДИАГНОСТИКИ НАСЛЕДСТВЕННЫХ ТРОМБОФИЛИЙ ПРИ БОЕВОЙ ОГНЕСТРЕЛЬНОЙ ТРАВМЕ
ЗНАЧЕНИЕ
ДИАГНОСТИКИ НАСЛЕДСТВЕННЫХ ТРОМБОФИЛИЙ ПРИ БОЕВОЙ ОГНЕСТРЕЛЬНОЙ ТРАВМЕ
Николаев К.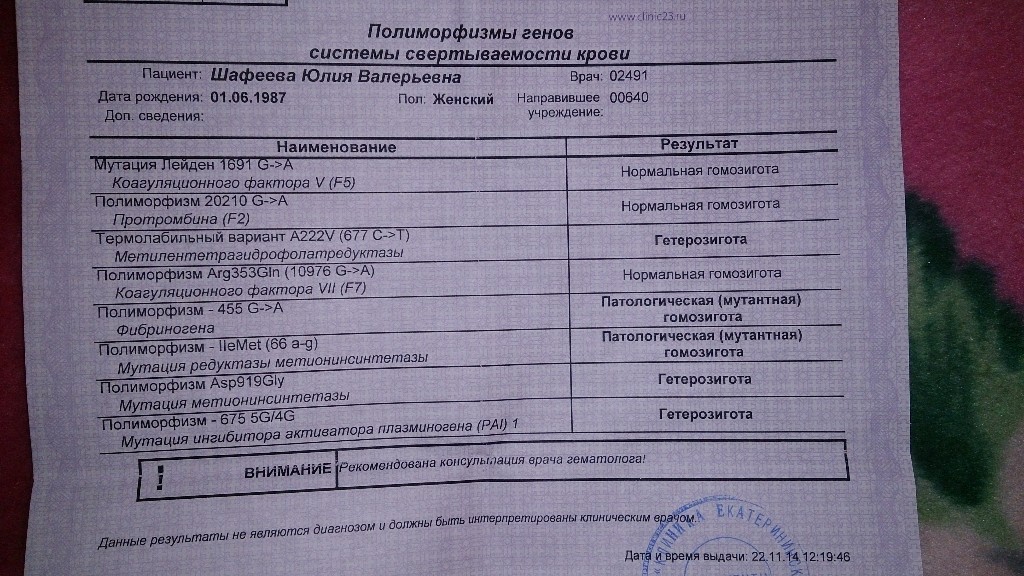
Зубрицкий В.Ф., Колтович А.П., Варданян А.В., Ивченко Д.Р.
ФГКУЗ
«Главный военный клинический госпиталь войск национальной гвардии Российской
Федерации», г.
Балашиха, Россия,
ФГБУ
«Российский научно-исследовательский институт гематологии и трансфузиологии»
ФМБА России, г.
Санкт-Петербург, Россия,
ФКУЗ
«Главный Клинический Госпиталь МВД России», Институт
медико-социальных технологий МГУПП, ФГБОУ ДПО
«Российская медицинская академия непрерывного профессионального образования»
Министерства здравоохранения Российской Федерации, г. Москва,
Россия
Боевая огнестрельная травма является
одним из факторов, инициирующих нарушение равновесия в системе гемостаза.
Наличие тромбофилий у раненых увеличивает вероятность развития патологического
тромбообразования и повышает риск эмболии легочных артерий.
Цель
– изучение влияния
полиморфизма генов компонентов системы гемостаза на развитие венозного тромбоза
у раненых с боевой огнестрельной травмой.
Материал
и методы. Изучены
особенности аллельного полиморфизма 10 генов,
кодирующих различные компоненты системы гемостаза, у 46 раненых с боевой огнестрельной травмой, находившихся
на лечении в Главном клиническом госпитале МВД России и в Главном военном
клиническом госпитале войск национальной гвардии Российской Федерации в период
с 2013 по 2015 год. Изучение аллельного полиморфизма генов,
связанных с процессом образования тромбов, осуществлялось на основе технологии
полимеразной цепной реакции (ПЦР) и анализа полиморфизма длин рестрикционных
фрагментов ПЦР-продукта.
Результаты. Анализ проведенного исследования установил
наличие протромботических генетических вариантов у 42 (91,3 %)
раненых. Было
установлено, что
наиболее значимыми факторами риска венозных тромбоэмболических
осложнений (ВТЭО) у
данной категории лиц являются мутация FII G20210A, носительство аллеля GpIbα 434C,
а также генотип FI-B-455AA.
Заключение. Проведенное исследование является
первой работой в России по изучению встречаемости аллельных вариантов
генов компонентов системы гемостаза у раненых с боевой огнестрельной травмой. Данные о наличии в генотипе лиц,
принимающих участие в боевых действиях, маркеров предрасположенности к тромбозу
могут служить основой для определения «групп риска» и выработки рекомендаций по
профилактике и лечению ВТЭО у раненых – носителей протромботических генотипов.
Ключевые
слова: тромбофилия;
травма; тромбоз; раненый; ранение
Одним из приоритетных направлений
современной медицины является доклиническая диагностика и ранняя профилактика
венозных тромбозов и тромбоэмболии легочных артерий. Эти заболевания в
большинстве развитых стран представляют серьезную медико-социальную проблему.
Более того, в последние годы отмечается факт «омоложения» тромбоза, с
неуклонной тенденцией к манифестации у молодой, трудоспособной части населения
[1].
В Российской Федерации показатели
заболеваемости, смертности и инвалидизации от венозных тромбоэмболических
осложнений (ВТЭО) являются одними из самых высоких в мире. Это свидетельствует
о необходимости коррекции подходов к профилактике и лечению данной патологии с
учетом последних достижений науки [2].
Этиология венозного тромбоэмболизма носит
многофакторный характер. Наряду с приобретенными факторами риска (травма,
иммобилизация, оперативное вмешательство и т.д.) большое значение в его
возникновении имеет генетическая предрасположенность, обусловленная
полиморфизмом генов различных компонентов системы гемостаза [3].
В 1995 году Всемирная организация
здравоохранения ввела понятие «тромбофилии» как состояния с необычной
склонностью к тромбозам с ранним возрастным началом, отягощенным семейным
анамнезом, степенью тяжести тромбоза, непропорциональной известному причинному
фактору, и наличием рецидивов тромбоза [4].
Российские
ученые тромбофилиями считают все наследственные
(первичные, генетически обусловленные) и приобретенные (вторичные,
симптоматические) нарушения гемостаза, которым свойственна предрасположенность
к раннему появлению и рецидивированию тромбозов, тромбоэмболий, ишемий и
инфарктов органов
[5]. В настоящее время известно большое количество врожденных и приобретенных
тромбофилий, отличающихся друг от друга по этиологии, характеру нарушений в системе
гемостаза, осложнениям и прогнозу. Нарушения гемостаза, вызванные экзогенными
воздействиями (инфекция, терапия некоторыми лекарственными препаратами, диета и
т.д.) либо эндогенными факторами приобретенного характера (изменение иммунного
или/и гормонального статуса при травмах, операциях, и т.д.) являются, как
правило, транзиторными. Напротив, тромбофилии, связанные с носительством
дефектов в генетическом аппарате, сопряжены с повышенным риском тромбоза в
течение всей жизни [1].
Наиболее
известными протромботическими аномалиями гемостаза являются дефицит естественных антикоагулянтов (ЕА) – антитромбина III,
протеинов C и S, мутации
в генах протромбина (G20210A), фактора V (G1691A, Лейденская мутация),
гамма-субъединицы фибриногена (FGG rs 2066865), резистентность к
активированному протеину С, дисфибриногенемия и другие. Однако к «классическим» формам наследственной тромбофилии относят лишь дефицит ЕА, а также мутации в генах факторов II и V
[6].
Приобретенные
тромбофилии наблюдаются при травмах, операциях, катетеризации центральных вен,
синдроме диссеминированного внутрисосудистого
свертывания (ДВС) крови,
длительном постельном режиме, хронических инфекциях, сепсисе, курении,
обезвоживании, варикозной болезни вен нижних конечностей, тромбоцитозах, злокачественных
новообразованиях, аллергических заболеваниях и т.д. [7, 8] Установлена взаимосвязь между иммунным воспалением и
протромботическими изменениями в системе гемостаза при различных заболеваниях,
в частности, ДВС-синдроме [9].
В
диагностике наследственных тромбофилий важную информацию представляют данные
анамнеза больных и их родственников, где часто имеются указания на тромбозы,
инфаркт миокарда, инсульт, тромбоэмболии легочных артерий, раннее развитие
варикозной болезни, осложненной тромбофлебитом, развитие тромбозов и
ДВС-синдрома после травм и операций. Эти заболевания нередко манифестируют в
возрасте до 50 лет.
Функционально
значимые генетические вариации могут являться причиной патологических изменений
в системе гемостаза и обусловливать повышенную предрасположенность индивида к
развитию тромбоза. Для реализации тромботического эпизода при наличии генетической предрасположенности имеет значение провоцирующее
воздействие (приобретенные или сопутствующие факторы риска – операции, травмы, воспаление,
кровотечение и др.) [10].
Врожденные дефекты системы гемостаза
обнаруживаются более чем у 40 % больных с ВТЭО [11]. Возникновение в
послеоперационном периоде венозных тромбозов у 57 % пациентов хирургического профиля
связано с наличием генетических мутаций компонентов системы гемостаза [12].
Патогенез
ВТЭО у раненых имеет существенные отличия, обусловленные механизмом получения
боевой огнестрельной травмы, тяжестью состояния, наличием обширных повреждений
органов, тканей, сосудов и нервов, острой массивной кровопотерей и
травматическим шоком. В утвержденных ГОСТом Р 56377-2015
клинических рекомендациях «Профилактика тромбоэмболических синдромов»
представлена шкала индивидуальной оценки риска развития тромбоза глубоких вен
по Caprini, в соответствии с которой раненые с тяжелой боевой огнестрельной
травмой имеют 8-12 баллов факторов
риска и относятся к группе очень высокого риска развития ВТЭО [13]. Вероятность
возникновения тромбоза у этих пострадавших увеличена более чем в 10 раз [14].
Исследование влияния различных врожденных
и приобретенных тромбофилий на возникновение и особенности течения
тромботического процесса, поиск эффективных способов нивелирования
патологического тромбообразования необходимы не только для улучшения качества
жизни пациентов, но и для снижения затрат на лечение, так как в случае развития
ВТЭО в течение первых 3 месяцев после хирургического вмешательства общая
стоимость лечения увеличивается более чем в 2 раза по сравнению с неосложненным
послеоперационным течением и остается незначительно выше в последующие месяцы
[15].
Целью исследования явилось изучение влияния полиморфизма генов компонентов системы
гемостаза на развитие венозного тромбоза у раненых с боевой огнестрельной
травмой.
МАТЕРИАЛ И МЕТОДЫ
В
ходе исследования изучены особенности аллельного полиморфизма 10 генов, кодирующих различные компоненты системы
гемостаза, у 46 раненых
с боевой огнестрельной травмой, находившихся на лечении в Главном клиническом
госпитале МВД России (ГКГ МВД России) и в Главном военном клиническом госпитале
войск национальной гвардии Российской Федерации (ГВКГ ВНГ РФ) в период с 2013
по 2015 год.
Все пациенты – мужчины, средний возраст – 29,5 ± 5,1 лет.
Минно-взрывные ранения получили 33 (71,7 %), пулевые – 13 (28,3 %) пострадавших.
При
поступлении травматический шок диагностирован у 40 (86,9 %) раненых. Шок 1 степени был у 1 (2,5 %), 2 степени
– у 6 (15 %), 3 степени – у 32 (80 %), терминальное состояние – у 1 (2,5 %) пострадавшего. Тяжесть состояния по шкале ISS (Injury
Severity Scale) составила
11,3 ± 1,7,
по шкале ВПХ-П(ОР) – 4,7 ± 0,9 балла.
Срок нахождения раненых на этапе специализированной медицинской помощи
составил 68,3 ± 16,5 дней.
Степень риска развития ВТЭО определялась на основании Российских
клинических рекомендаций по диагностике, лечению и профилактике ВТЭО [14]. Все
раненые были отнесены к группе высокого риска развития ВТЭО и имели 3-4 фактора риска их развития.
В зависимости от наличия венозного тромбоза раненые были разделены на
2 группы. В основную группу вошли 13 (28,3 %)
пострадавших, у которых во время лечения был диагностирован венозный тромбоз, в
контрольную – 33 (71,7 %) без признаков
тромбоза.
Оценка состояния венозной системы раненых и визуализация тромбов
проводилась при помощи ультразвукового ангиосканирования (УЗАС) на аппаратах
экспертного класса с использованием линейных датчиков частотой от 5 до 12 МГц. Также использовался мобильный ультразвуковой сканер MicroMaxx
(Sonosite, USA). УЗАС проводилось в 1-е сутки поступления в стационар и через 5–7 дней в последующем, а также перед хирургическим вмешательством и в
послеоперационном периоде. При выявлении венозных тромбов УЗАС проводилось 1 раз в 2–3 дня.
Изучение аллельного полиморфизма генов, связанных с процессом
образования тромбов, осуществляли на основе технологии полимеразной цепной
реакции (ПЦР) и анализа полиморфизма длин рестрикционных фрагментов ПЦР-продукта.
Исследован аллельный полиморфизм генов, условно разделенных на 3 группы:
1) гены,
кодирующие компоненты плазменного звена гемостаза: факторы I, II, V, XII
свертывания крови, ингибитор активатора плазминогена 1-го типа – PAI-1;
2) гены,
кодирующие компоненты тромбоцитарных рецепторов, опосредующих процессы адгезии
и агрегации кровяных пластинок: GpIa, GpIbα, GpIIIa, P2Y12;
3) гены
компонентов, вовлеченных в патогенез эндотелиальной дисфункции: MTHFR.
Все данные обрабатывали статистическими
методами с помощью компьютерных программ «ЕХСЕL-2010», «STATISTICA-7.0»,
«BioStat для Windows». Для оценки достоверности различий между величинами
использовали критерий χ2 и точный критерий Фишера (двухсторонний),
для оценки силы взаимосвязи исследуемых факторов – критерии φ (фи, phi) и V
Крамера (Cramer’s V), интерпретация значений которых представлена в таблице 1.
Исследование проводилось в соответствии с требованиями этических комитетов ГКГ
МВД России и ГВКГ ВНГ РФ.
Таблица 1. Интерпретация
значений критериев φ и V Крамера согласно рекомендациям Rea & Parker [16]
|
Значение критериев φ или V
|
Сила взаимосвязи
|
|
< 0.1
|
Несущественная
|
|
0.1
|
Слабая
|
|
0.2
|
Средняя
|
|
0.4
|
Относительно сильная
|
|
0.6
|
Сильная
|
|
0.8–1.0
|
Очень сильная
|
РЕЗУЛЬТАТЫ
До ранения у обследованных военнослужащих не
наблюдалось заболеваний сосудов, тромбоэмболических осложнений, обследование на
предмет наличия тромбофилий не проводилось. При сборе анамнеза получить точные
данные о наличии заболеваний у их родственников не представлялось возможным
из-за тяжести состояния или низкой информированности. Большинство пострадавших
до службы проживало на территории Северокавказского федерального округа.
Все раненые перенесли от 1 до 33 оперативных
вмешательств, 19 (41,3 %) было выполнено переливание от 330 до 3 000 мл
донорской крови. При огнестрельных переломах костей нижних конечностей 11 (23,9 %)
пострадавшим были наложены аппараты внешней фиксации костных отломков. Средние
сроки начала самостоятельного передвижения раненых составили 29,3 ± 11,7 дня.
Анализ проведенного исследования установил
наличие протромботических генетических вариантов у 42 (91,3 %) раненых.
Данные о распределении генотипов изученных генов представлены в таблице 2.
Таблица 2. Распределение генотипов изученных генов у
раненых
|
Ген,
|
Генотип
|
Раненые с тромбозом
|
Раненые без тромбоза
|
Всего
|
р
|
φ и V Крамера
|
|
FV, G1691A
|
GA
|
1
|
0
|
1
|
0.283
|
0.2 – <0.4
|
|
GG
|
12
|
33
|
45
|
|||
|
FII, G20210A
|
GA
|
3
|
0
|
3
|
0.019
|
0.4 – <0.6
|
|
GG
|
10
|
33
|
43
|
|||
|
GpIbα,
T434C
|
TC
|
8
|
8
|
16
|
0.014
|
0.2 – <0.4
|
|
CC
|
1
|
0
|
1
|
0.167
|
0.4 – <0.6
|
|
|
TT
|
4
|
25
|
29
|
|||
|
FI-B,
-455 G/A
|
AA
|
5
|
1
|
6
|
0.005
|
0.4 – <0.6
|
|
GA
|
2
|
13
|
15
|
0.686
|
0.1 – <0.2
|
|
|
GG
|
6
|
19
|
25
|
|||
|
GpIa,
C807T
|
TT
|
3
|
1
|
4
|
0.062
|
0.2 – <0.4
|
|
CT
|
7
|
18
|
25
|
|||
|
CC
|
3
|
14
|
17
|
|||
|
PAI-1,
-675 4G/5G
|
4G/4G
|
5
|
8
|
13
|
0.469
|
0.1 – <0.2
|
|
4G/5G
|
5
|
14
|
19
|
|||
|
5G/5G
|
3
|
11
|
14
|
|||
|
P2Y12, h2/h3
|
h3/h3
|
1
|
1
|
2
|
0.443
|
0.1 – <0.2
|
|
h2/h3
|
4
|
6
|
10
|
0.422
|
0.1 – <0.2
|
|
|
h2/h2
|
8
|
26
|
34
|
|||
|
FXII,
C46T
|
TT
|
2
|
2
|
4
|
0.566
|
0.1 – <0.2
|
|
CT
|
4
|
15
|
19
|
|||
|
CC
|
7
|
16
|
23
|
|||
|
GpIIIa,
T1565C
|
TC
|
3
|
5
|
8
|
0.669
|
<0.1
|
|
TT
|
10
|
28
|
38
|
|||
|
MTHFR,
C677T
|
TT
|
1
|
2
|
3
|
1.000
|
<0.1
|
|
CT
|
3
|
10
|
13
|
|||
|
CC
|
9
|
21
|
30
|
Примечание: серым цветом выделены протромботические варианты
генотипа.
Наиболее интересными и важными
представляются результаты исследования генотипов факторов I, II, V, GpIbα и GpIa.
Мутация FV Leiden была обнаружена у 1 раненого в
группе пациентов с тромбозом, тогда как в контрольной группе носителей этого маркера
наследственной тромбофилии не наблюдалось. Выявленные различия не были
статистически значимыми ввиду редкой встречаемости данной мутации в
обследованной группе. Тем не менее, «средняя» (0,2 – <0,4) сила взаимосвязи
между наличием мутации FV Leiden и вероятностью развития тромбоза
указывает на необходимость определения этого генетического маркера при
прогнозировании риска ВТЭО.
При анализе полиморфизма гена
протромбина генотип FII 20210 GA был выявлен у 3 (23,1 %)
раненых с диагностированным тромбозом, в то время как ни один из пациентов
контрольной группы не являлся носителем этого протромботического варианта (р =
0,019). Для указанного генотипа выявлен достоверный риск развития тромбоза (OR = 22,3; 95 % CI: 1,1–468,7; р = 0,019), имеется
«относительно сильная» (0,4 – <0,6) корреляционная связь между наличием
мутации FII G20210A и вероятностью развития
тромбоза.
При анализе генотипов GpIbα вариант 434С обнаруживался у 9 (69,2 %)
раненых из основной группы, т.е. почти в 3 раза чаще, чем в контрольной группе
– 24,2 % (OR =
7,0; 95 % CI:
1,7–29,2; p =
0,007). Для генотипа 434 TC выявлен достоверный риск развития тромбоза (OR = 6,3; 95 % CI: 1,5–26,4; p = 0,014), установлена «средняя»
(0,2 – <0,4) сила взаимосвязи между наличием данного варианта и вероятностью
развития тромбоза. Для генотипа 434 СC результат оказался статистически не
значимым (р > 0,05) в связи с его редкой встречаемостью. Однако в этом
случае была обнаружена «относительно сильная» (0,4 – <0,6) взаимосвязь между
наличием генетического варианта (GpIbα 434 СC) и вероятностью развития тромбоза.
При анализе полиморфизма гена
β-субъединицы фибриногена для генотипа -455 АA был выявлен статистически значимый риск развития ВТЭО и
«относительно сильная» (0,4 – <0,6) взаимосвязь между наличием данного
варианта и вероятностью развития тромбоза. В основной группе гомозиготы по
аллелю -455A встречались почти в 13 раз
чаще, чем в группе сравнения (38,5 % против 3,0 % соответственно; OR = 20,0; 95 % CI: 2,0–196,1; p = 0,005). Гетерозиготный
генотип FI-B -455 GA обнаруживался у 15,4 % раненых
с тромбозом и у 39,4 % лиц контрольной группы и, таким образом, не
оказывал значимого влияния на риск развития ВТЭО. Для этого генотипа была
выявлена «низкая» (0,1 – <0,2) сила взаимосвязи этих признаков.
При анализе полиморфизма гена GpIa
выявлено почти 8-кратное увеличение частоты встречаемости генотипа 807ТТ в
основной группе по сравнению с группой раненых без тромбоза (23,1 % против
3,0 % соответственно; OR = 9,6; 95 % CI: 0,9–103,0; p = 0,062). Установлено наличие
«средней» (0,2 – <0,4) силы взаимосвязи между указанным генотипом и
вероятностью развития тромбоза.
Анализ распределения генотипов других
генов не выявил существенных различий между обследованными группами раненых.
ОБСУЖДЕНИЕ
В доступной медицинской литературе
имеются лишь единичные материалы, посвященные изучению наследственных
тромбофилий у раненых с боевой огнестрельной травмой [17, 18]. Клинический
интерес к данной категории пострадавших связан с тем, что:
1) раненые
являются молодыми мужчинами возрастом от 20 до 35 лет, прошедшими
медицинское обследование и признанными годными по состоянию здоровья к военной
службе, не имеющими тромботических эпизодов в анамнезе;
2) тромботический
процесс протекает у всех раненых и является защитной ответной реакцией организма
на огнестрельную травму; однако во многих случаях имеет место патологическое
тромбообразование, приводящее к развитию тромбозов и тромбоэмболии легочных
артерий;
3) современные
боеприпасы оказывают мощное разрушительное воздействие на органы и ткани
человека, вызывая их обширные повреждения не только в точке приложения, но и на
значительном расстоянии от места ранения;
4) после
ранения у пострадавших развиваются нарушения гемостаза, степень выраженности проявлений которых во
многом определяется объемом полученных повреждений, величиной острой массивной
кровопотери и тяжестью травматического шока;
5) наличие
скрытых факторов риска развития осложнений при тяжелой огнестрельной травме
может оказаться решающим в определении исхода лечения.
В настоящее время для комплексной оценки
протромботического потенциала генотипа индивидуума может проводиться анализ
аллельного полиморфизма нескольких десятков генов, которые кодируют компоненты
тромбоцитарного и плазменного звеньев гемостаза, а также различных метаболических
систем, влияющих на целостность и функциональную активность сосудистого
эндотелия, и, таким образом, во многом определяют риск развития ВТЭО. Для
повышения объективности и информативности результатов генотипирования
разработаны и апробированы методы статистической обработки значительных
массивов генетических данных, позволяющие проводить анализ так называемых «ген-генных
взаимодействий» и выявлять неблагоприятные сочетания аллельных вариантов
различных генов [6].
В прогнозировании тромбоопасности генотипа
человека важную роль играет регион проживания. Установлены различия
наследственных факторов риска развития тромбоза у пациентов западных и
восточных стран [19]. Так, вариант FV Leiden (FV R506Q), связанный с
резистентностью к активированному протеину С (APC-R) [20, 21], и мутация G20210A в гене протромбина являются наиболее распространенными
генетическими факторами риска ВТЭО в западных популяциях и отсутствуют или
очень редки среди жителей восточных стран [23-28].
В то же время врожденный дефицит основных естественных антикоагулянтов –
антитромбина III, протеина С и протеина S
– является довольно редким в Западных странах и, напротив, представляет серьезную
опасность в странах Азии [29-33]. Также
установлено, что ВТЭО выявляются у чернокожих пациентов на 40 %
чаще, чем у белокожих [34]. Учитывая значительную
протяженность территории России, в локальных вооруженных конфликтах у раненых
военнослужащих вероятность наличия тех или иных генетических факторов риска
может существенно различаться в зависимости от их постоянного места жительства.
В нашем исследовании было установлено,
что наличие в генотипе мутации FII G20210A,
вариантов GpIbα 434Cи FI-B -455AA ассоциировано с достоверным увеличением риска ВТЭО
у раненых. Мутация FV Leiden и генотип GpIa 807ТT также встречались чаще в
группе лиц, у которых развился тромбоз, однако в данном случае различия с
контрольной группой не были статистически значимыми.
Тромбофилия определяется как
предрасположенность к тромбозу, и ее следует рассматривать в контексте других
факторов риска развития тромбоза, связанных с течением заболеваний,
воздействием лекарственных средств или возникновением определенных состояний
(травмы, ранения) [7].
Большое число пострадавших без признаков
тромбоза в данном исследовании (71,7 %) связано с наличием в группе
легкораненых и средним незначительным ISS (11,3 ± 1,7). Установлено, что
при тяжести травмы, соответствующей 23-31 баллу по шкале ISS, происходит
скачкообразное увеличение вероятности возникновения венозного тромбоза до 52,9 %
случаев [35].
Повышенная склонность к развитию ВТЭО у
пострадавших с наследственными тромбофилиями делает актуальным рассмотрение
вопроса о предотвращении их развития путем проведения профилактических
мероприятий. Некоторые авторы предлагают при назначении профилактики таким
пациентам в первую очередь ориентироваться на генотип [11]. В тоже время
исследование степени влияния гомозиготных и гетерозиготных вариантов мутации
фактора FV на тяжесть течения венозного тромбоза не выявило
статистически значимых отличий между рассматриваемыми вариантами, что позволило
рекомендовать проведение профилактических мероприятий по одинаковой схеме
пациентам с различными вариантами генетического полиморфизма [36].
Анализ научной медицинской литературы
показал, что в настоящее время нет однозначного мнения в вопросе профилактики
ВТЭО у пациентов с наследственными тромбофилиями. Существенным отличием при
проведении профилактики венозных тромбозов у некоторых групп пациентов с генетическими
мутациями в системе гемостаза, по сравнению с пациентами без генетических
мутаций, является необходимость использования в профилактических целях более
высоких (лечебных) доз антикоагулянтов [14].
Вопрос профилактики тромботических
осложнений у раненых с врожденными тромбофилиями находится в стадии разработки
и до настоящего времени не решен. Полученные в данном исследовании результаты
показывают необходимость проведения целенаправленной профилактики ВТЭО с учетом
риска возможных кровотечений вследствие обширной боевой огнестрельной травмы.
ЗАКЛЮЧЕНИЕ
Проведенное исследование является
первой работой в России по изучению встречаемости аллельных вариантов
генов компонентов системы гемостаза у раненых с боевой огнестрельной травмой и
их роли в
патогенезе венозного тромбоза. Анализ полученных результатов показал, что,
несмотря на высокую распространенность (генетические мутации были выявлены у
91,3 % военнослужащих), не все наследственные факторы риска ассоциированы
с развитием тромбоза. Эффект потенцирования действия позволяет предположить,
что наибольшую вероятность развития клинических проявлений тромбоза необходимо
ожидать у раненых с наличием комбинаций из нескольких генетических мутаций.
Было
установлено, что
наиболее значимыми факторами риска ВТЭО у обследованных военнослужащих являются мутация FII G20210A, носительство аллеля GpIbα 434C,
а также генотип FI-B -455AA.
Последующие исследования, возможно, позволят установить неблагоприятные
сочетания протромботических вариантов различных генов, увеличивающие риск
развития тромбоза у раненых.
Данные о наличии в генотипе лиц,
принимающих участие в боевых действиях, маркеров предрасположенности к тромбозу
могут служить основой для определения «групп риска» и выработки рекомендаций по
профилактике и лечению ВТЭО у раненых – носителей протромботических генотипов.
ЛИТЕРАТУРА / REFERENCES:
1. Selivanov EA, Bessmeltsev SS, Kapustin
SI. Molecular diagnostics of hereditary thrombophilia as the basis for
personalized therapy of thromboembolic diseases. Modern Medical Technologies. 2011; (6): 25-27. Russian (Селиванов Е.А., Бессмельцев С.С.,
Капустин С.И. Молекулярная диагностика наследственных тромбофилий как основа
персонализированной терапии тромбоэмболических заболеваний // Современные
медицинские технологии. 2011. № 6. С. 25-27)
2. Harchenko
VI, Kakorina EP, Koryakin MV, Virin MM, Undritsov VM, Smirnova NL, et al.
Mortality from diseases of the circulatory system in Russia and in economically
developed countries. The need to strengthen the cardiological service and
modernize medical statistics in the Russian Federation. Russian Cardiology Journal. 2005; (2): 5-18. Russian (Харченко В.И., Какорина Е.П., Корякин М.В., Вирин М.М., Ундрицов В.М., Смирнова Н.Л. и
др. Смертность от болезней системы кровообращения в России и в
экономически развитых странах. Необходимость усиления кардиологической службы и
модернизации медицинской статистики в Российской Федерации // Российский
кардиологический журнал. 2005.
№ 2. С. 5-18)
3. Rosendaal
FR, Reitsma PH. Genetics of venous thrombosis. Journal of Thrombosis and Haemostasis. 2009; 7: 301-304
4. Momot AP. The problem of thrombophilia in
clinical practice. Russian Journal of
Pediatric Hematology and Oncology. 2015; (1): 36-48. Russian (Момот А. П. Проблема тромбофилии в клинической практике // Российский
журнал детской гематологии и онкологии. 2015. № 1. С. 36-48)
5. Barkagan ZS, Momot AP. Basics of
diagnosis of hemostasis disorders. Moscow: Newdiamed, 1999. 217 p. Russian (Баркаган З.С., Момот А.П. Основы диагностики нарушений гемостаза. М.:
Ньюдиамед,
1999. 217 с.)
6. Kapustin SI. Molecular genetic aspects of
the pathogenesis of venous thromboembolism. Abstracts of doctor of biological
science. St. Petersburg, 2007. 45 p. Russian (Капустин С.И. Молекулярно-генетические
аспекты патогенеза венозного тромбоэмболизма: автореф. дис. … д-ра биол. наук. СПб,
2007. 45 с.)
7. Cohoon KP, Heit JA.
Inherited and Secondary Thrombophilia: Clinician Update. Circulation. 2014; 129(2): 254-257
8. Ursulenko EV, Martynovich NN. A modern
view of thrombophilia. Siberian Medical Journal. 2010; (3): 127-129. Russian (Урсуленко Е.В., Мартынович Н.Н.
Современный взгляд на тромбофилию // Сибирский медицинский журнал. 2010.
№ 3. С.
127-129)
9. Franchini
M, Lippi G, Manzato F. Recent acquisitions in the pathophysiology, diagnosis
and treatment of disseminated intravascular coagulation. Thrombosis J. 2006; 4(1): 4-15
10. Vorobyeva NA, Kapustin SI. The role of
genetic monitoring of the hemostasis system in the severe course of acute DIC
syndrome. Ecology of Human. 2005; (12): 25-30. Russian (Воробьева Н.А., Капустин С.И. Роль
генетического мониторинга системы гемостаза при тяжелом течении острого
ДВС-синдрома // Экология человека 2005. № 12. С. 25-30)
11. De Stefano V, Rossi E, Paciaroni K, Leone G. Screening for inherited thrombophilia:
indications and therapeutic implications. Haematologica.
2002; 87(10): 1095-1098
12. AV, Mumladze RB, Kovalenko TF, Roytman EV,
Patrushev LI. Mutations associated with thrombophilia, as well as affecting the
metabolism of warfarin, in patients undergoing deep vein thrombosis. Bulletin of Bakulev Cardiovascular Surgery
Center. Cardiovascular diseases. 2007; 8 (2): 21-28. Russian (Варданян А.В., Мумладзе Р.Б., Коваленко Т.Ф., Ройтман Е.В., Патрушев Л.И. Мутации, ассоциированные с тромбофилиями, а также влияющие на
метаболизм варфарина, у пациентов, перенесших тромбоз глубоких вен // Бюллетень НЦССХ им. А.Н. Бакулева
РАМН Сердечно-сосудистые заболевания. 2007. № 2. С. 21-28)
13. Prevention of thromboembolic syndromes :
The national standard of the Russian Federation. Clinical recommendations
(protocols of treatment): GOST R 56377-2015. M.: Standartinform. 2015. 46 p. Russian (Профилактика тромбоэмболических синдромов : Национальный стандарт РФ. Клинические
рекомендации (Протоколы лечения): ГОСТ Р 56377-2015. Введен 2016-03-01. М.: Стандартинформ, 2015.
46 с.)
14. Russian clinical guidelines for the
diagnosis, treatment and prevention of venous thromboembolic complications
(VTEC) / Bokeriya LA., Zatevakhin II, Kirienko AI. et al. Phlebology.
2015; 4(2): 2-52. Russian (Российские клинические рекомендации по диагностике, лечению
и профилактике венозных тромбоэмболических осложнений (ВТЭО) / Бокерия Л.А.,
Затевахин И.И., Кириенко А.И. и др. ; Ассоциация флебологов России // Флебология.
2015. № 4, Выпуск № 2. 52 с.)
15. Cohoon KP, Leibson CL, Ransom
JE, Ashrani
AA, Park
MS, Petterson
TM, et al. Direct Medical Costs Attributable to Venous
Thromboembolism among Persons Hospitalized for Major Surgery: A
Population-based Longitudinal Study. Surgery. 2015;
157(3): 423–431
16. Grzhibovskiy
AM. Analysis of nominal data (independent observations). Human Ecology 2008; 6: 58-68. Russian (Гржибовский А.М. Анализ номинальных
данных (независимые наблюдения) // Экология человека. 2008. № 6. С. 58-68)
17. Zubritskiy VF, Koltovich AP, Nikolaev KN,
Kapustin SI, Dvorcevoy SN, Vardanyan AV, et al. Prevention of
venous thromboembolic complications in the wounded persons with gunshot
fractures of the femur. Priorov Herald of
Traumatology and Orthopedics. 2015; (3): 60-65. Russian (Зубрицкий В.Ф., Колтович А.П., Николаев К.Н., Капустин С.И., Дворцевой С.Н., Варданян А.В. и др. Профилактика венозных
тромбоэмболических осложнений у раненых с огнестрельными переломами бедренной
кости // Вестник травматологии и ортопедии им.
Н.Н. Приорова. 2015. № 3. С. 60-65)
18. Zubritskiy VF, Koltovich AP, Shabalin AYu,
Indeykin AV, Nikolaev KN, Kapustin SI, et al. Prevention of venous
thromboembolic complications in gunshot wounds of the stomach and pelvis. Polytrauma. 2016; (3): 24-32. Russian
(Зубрицкий В.Ф., Колтович А.П., Шабалин А.Ю., Индейкин А.В., Николаев К.Н., Капустин С.И. и др. Профилактика венозных
тромбоэмболических осложнений при огнестрельных ранениях живота и таза // Политравма. 2016. № 3. С. 24-32)
19. Kim HJ, Seo JY, Lee KO, Bang SH, Lee ST, Ki CS, et al.
Distinct frequencies and mutation spectrums of genetic thrombophilia in Korea
in comparison with other Asian countries both in patients with thromboembolism
and in the general population. Haematologica. 2014; 99(3): 561-569
20. Manucci
PM. Thrombosis and bleeding disorders outside Western countries. J Thromb
Haemost. 2007; 5(Suppl 1): 68-72
21. Bertina
RM, Koeleman BP, Koster T, Rosendaal FR, Dirven RJ, de Ronde H, et al. Mutation
in blood coagulation factor V associated with resistance to activated protein
C. Nature. 1994;
369(6475): 64-67
22. Dahlbäck B, Villoutreix BO. Regulation of blood
coagulation by the protein C anticoagulant pathway: novel insights into
structure-function relationships and molecular recognition. Arterioscler
Thromb Vasc Biol. 2005; 25(7): 1311-1320
23. Poort SR, Rosendaal FR, Reitsma PH, Bertina RM. A common genetic variation in the 3′-untranslated
region of the prothrombin gene is associated with elevated plasma prothrombin
levels and an increase in venous thrombosis. Blood. 1996;8 8(10):
3698-3703
24. Chan DK,
Hu G, Tao H, Owens D, Vun CM, Woo J, et al. A comparison of polymorphism in the
3′-untranslated region of the prothrombin gene between Chinese and Caucasians
in Australia. Br J Haematol. 2000; 111(4): 1253–1255
25. Hu Y,
Chen F, Xie Q, Jian Z, Wang G, Zuo X, et al. No association between thrombosis
and factor V gene polymorphisms in Chinese Han population. Thromb Haemost. 2003; 89(3): 446-451
26. Zhu T, Ding Q, Bai X, Wang X, Kaguelidou F, Alberti C, et al. Normal ranges and genetic variants of antithrombin,
protein C and protein S in the general Chinese population. Results of the
Chinese Hemostasis Investigation on Natural Anticoagulants Study I Group. Haematologica. 2011 Jul; 96(7): 1033-1040. doi: 10.3324
27. Bauduer
F, Lacombe D. Factor V Leiden, prothrombin 20210A, methylenetetrahydrofolate
reductase 677T, and population genetics. Mol Genet Metab. 2005;
86(1–2): 91-99
28. Lowe GD,
Rumley A, Woodward M, Morrison CE, Philippou H, Lane DA, et al. Epidemiology of
coagulation factors, inhibitors and activation markers: the third Glasgow
MONICA Survey I. Illustrative reference ranges by age, sex and hormone use. Br J
Haematol. 1997; 97(4): 775-784
29. Rodeghiero
F, Tosetto A. The VITA project: population-based distributions of protein C,
antithrombin III, heparin-cofactor II and plasminogen-relationship with
physiological variables and establishment of reference ranges. Thromb
Haemost. 1996; 76(2): 226-233
30. Shen MC,
Lin JS, Tsay W. Protein C and protein S deficiencies are the most important
risk factors associated with thrombosis in Chinese Venous thormbophilic
patients in Taiwan. Thromb Res. 2000;
99(5): 447-452
31. Suehisa
E, Nomura T, Kawasaki T, Kanakura Y. Frequency of natural coagulation inhibitor
(antithrombin III, protein C and protein S) deficiencies in Japanese patients
with spontaneous deep vein thrombosis. Blood Coagul Fibrinolysis. 2001;
12(2): 95-99
32. Akkawat
B, Rojnuckarin P. Protein S deficiency is common in a healthy Thai, population.
J
Med Assoc Thai. 2005;
88(Suppl 4): S249–254
33. Miyata T,
Kimura R, Kokubo Y, Sakata T. Genetic risk factors for deep vein thrombosis
among Japanese: importance of protein S K196E mutation. Int J Hematol. 2006;
83(3): 217-223
34. Heit JA, Beckman MG, Bockenstedt PL, Grant AM, Key NS, Kulkarni R, et al.
Comparison of characteristics from White- and Black-Americans with venous
thromboembolism: a cross-sectional study. Am J Hematol.
2010; 85(7): 467-471
35. Mezhebitskaya LO, Trofimova EYu, Byalik EI,
Semenova MN. The role of dynamic ultrasound examination of the veins of the
lower extremities in the diagnosis and timing of the formation of
thromboembolic complications in patients with polytrauma. Ultrasonic
and Functional
Diagnostics. 2009; 2: 71-77. Russian (Межебицкая Л.О., Трофимова Е.Ю.,
Бялик Е.И., Семенова М.Н. Роль динамического ультразвукового исследования вен
нижних конечностей в диагностике и определении сроков формирования
тромбоэмболических осложнений у пострадавших с политравмой // Ультразвуковая и
функциональная диагностика. 2009. № 2. С. 71-77)
36. Perez Botero J, Ormsby WD, Ashrani AA, McBane RD, Wysokinski WE, Patnaik MM, et al. Do
incident and recurrent venous thromboembolism risks truly differ between
heterozygous and homozygous Factor V Leiden carriers? A retrospective cohort
study. Eur J Intern Med. 2016; 30:
77-81
Статистика просмотров
Загрузка метрик …
Ссылки
- На текущий момент ссылки отсутствуют.
КЛИНИЧЕСКОЕ ЗНАЧЕНИЕ ПОЛИМОРФИЗМА ГЕНОВ ФАКТОРА V И ПРОТРОМБИНА | Колосков
1. Virchow R. Phlogose und Thrombose im Gefäßsystem; Gesammelte Abhandlungen zur Wissenschaftlichen Medizin. Staatsdruckerei. Frankfurt. 1856.
2. Lippi G, Franchini M, Targher G. Arterial thrombus formation in cardiovascular disease. Nat Rev Cardiol. 2011;8:502—12. doi: 10.1038/nrcardio.2011.91
3. Martinelli I, De Stefano V, Mannucci PM. Inherited risk factors for venous thromboembolism. Nat Rev Cardiol. 2014;11:140—56. doi: 10.1038/nrcardio.2013.211
4. Гематология: национальное руководство. Под ред. Руковицина ОА. ГЭОТАР-Медиа. Москва; 2015.
5. Руководство по гематологии. 2-е изд. Под ред. Воробьева АИ. Медицина. Москва; 1985. Т. 2.
6. Nygaard KK, Brown GE. Essential thrombophilia: report of five cases. Arch Intern Med. 1937; 59:82—106.
7. Roemisch J, Gray E, Hoffmann JN, Wiedermann CJ. Antithrombin: a new look at the actions of a serine protease inhibitor. Blood Coagul Fibrinolysis. 2002;13:657—70.
8. Dahlback B, Villoutreix BO. The anticoagulant protein C pathway. FEBS Lett. 2005;79:3310—6.
9. Nesheim M, Wang W, Boffa M, Nagashima J, Bajzar L. Thrombin, thrombomodulin and TAFI in the molecular link between coagulation and fibrinolysis. Thromb Haemost. 1997;78:386—91.
10. Dahlback B, Carlsson M, Svensson PJ. Familial thrombophilia due to a previously unrecognized mechanism characterized by poor anticoagulant response to activated protein C: prediction of a cofactor to activated protein C. Proc Natl Acad Sci USA. 1993;90:1004—8.
11. Bertina R, Koeleman B, Koster T, Rosendaal FR, Driven RJ, de Ronde H et al. Mutation in blood coagulation factor V associated with resistance to activated protein C. Nature. 1994;369:64—7.
12. Poort SR, Rosendaal FR, Reitsma PH, Bertina RM. A common genetic variation in the 3’-untranslated region of the prothrombin gene is associated with elevated plasma prothrombin levels and an increase in venous thrombosis. Blood. 1996;88:3698—703.
13. Griffin JH, Evatt B, Wideman C, Fernandez JA. Anticoagulant protein C pathway defective in majority of thrombophilic patients. Blood. 1993;82:1989—93.
14. Koster T, Rosendaal FR, de Ronde H, Briet E, Vandenbroucke JP, Bertina RM. Venous thrombosis due to poor anticoagulant response to activated protein C: Leiden Thrombophilia Study. Lancet. 1993;342:1503—6.
15. Svensson P, Dahlback B. Resistance to activated protein C as a basis for venous thrombosis. N Engl J Med. 1994;330:517—22.
16. Van Cott EM, Khor B, Zehnder JL. Factor V Leiden. Am J Hematol. 2016;91:46—9. doi: 10.1002/ajh.24222
17. Vos HL. Inherited defects of coagulation factor V: the thrombotic side. J Thromb Haemost. 2006;4:35—40.
18. Asselta R, Tenchini ML, Duga S. Inherited defects of coagulation factor V: the hemorrhagic side. J Thromb Haemost. 2006;4:26—34.
19. Segers K, Dahlback B, Nicolaes GA. Coagulation factor V and thrombophilia: Background and mechanisms. Thromb Haemost. 2007;98:530—42.
20. Cripe LD, Moore KD, Kane WH. Structure of the gene for human coagulation factor V. Biochemistry 1992;31:3777—85.
21. Jenny RJ, Pittman DD, Toole JJ, Kriz RW, Aldape RA, Hewick RM et al. Complete cDNA and derived amino acid sequence of human factor V. Proc Natl Acad Sci USA. 1987;84:4846—50.
22. Tracy PB, Eide LL, Bowie EJ, Mann KG et al. Radioimmunoassay of factor V in human plasma and platelets. Blood. 1982;60:59—63.
23. Suehiro Y, Veljkovic DK, Fuller N, Motomura Y, Masse JM, Cramer EM et al. Endocytosis and storage of plasma factor V by human megakaryocytes. Thromb Haemost. 2005;94:585—92.
24. Greengard J, Sun X., Xu X, Fernandez JA, Griffin JH, Evatt B. Activated protein C resistance caused by Arg506Gln mutation in factor Va. Lancet. 1994;343:1361—2.
25. Zoller B., Dahlback B. Linkage between inherited resistance to activated protein C and factor V gene mutation in venous thrombosis. Lancet. 1994;343:1536—8.
26. De Visser MC, Rosendaal FR, Bertina RM. A reduced sensitivity for activated protein C in the absence of factor V Leiden increases the risk of venous thrombosis. Blood. 1999; 93:1271—6.
27. Zivelin A, Mor-Cohen R, Kovalsky V, Kornbrot N, Conard J, Peyvandi F et al. Prothrombin 20210G>A is an ancestral prothrombotic mutation that occurred in whites approximately 24,000 years ago. Blood. 2006;107:4666—8.
28. Rees DC, Cox M, Clegg JB. World distribution of factor V Leiden. Lancet. 1995;346:1133—4.
29. Rees DC. The population genetics of factor V Leiden (Arg506Gln). Br J Haematol. 1996;95:579—86.
30. Колосков АВ, Филиппова ОИ, Лыщев АА, Батурина ОА, Васильева МЮ, Гуляихина ДЕ и др. Частота встречаемости полиморфизмов гена фактора V (A506G), (G20210A) и гена MTHFR (C677Т и A1298С) у здоровых доноров крови Санкт-Петербурга. Российский биомедицинский журнал. 2015;16:682—9.
31. Российские клинические рекомендации по диагностике, лечению и профилактике венозных тромбоэмболических осложнений. Флебология. 2015;9:2—52.
32. Ekim M, Ekim H, Yılmaz YK. The prevalence of Factor V Leiden, prothrombin G20210A, MTHFR C677T and MTHFR A1298C mutations in healthy Turkish population. Hippokratia. 2015;19:309—13.
33. Emmerich J, Rosendaal F, Cattaneo M, Margaglione M, De Stefano V, Cumming T et al. Combined effect of factor V Leiden and prothrombin 20210A on the risk of venous thromboembolism — Pooled analysis of 8 case-control studies including 2310 cases and 3204 controls. Study Group for Pooled-Analysis in Venous Thromboembolism. Thromb Haemost. 2001;86:809—16.
34. Khor B, Van Cott EM. Laboratory evaluation of hypercoagulability. Clin Lab Med 2009;29:339—66. doi: 10.1016/j.cll.2009.03.002
35. Колосков АВ, Филиппова ОИ. Активность фактора V у женщин в Санкт-Петербурге. Тромбоз, гемостаз и реология. 2016; 3:207—8.
36. Castoldi E, Brugge J, Nicolaes G, Girelli D, Tans G, Rosing J. Impaired APC cofactor activity of factor V plays a major role in the APC resistance associated with the factor V Leiden (R506Q) and R2 (h2299R) mutations. Blood. 2004;103:4173—9.
37. Steen M, Norstrom E, Tholander A, Bolton-Maggs PH, Mumford A, McVey JH et al. Functional characterization of factor V-Ile359Thr: A novel mutation associated with thrombosis. Blood. 2004;103:3381—7.
38. Franco R., Elion J, Tavella M, Santos SE, Zago MA. The prevalence of factor V Arg306–>Thr (factor V Cambridge) and factor V Arg306– >Gly mutations in different human populations. Thromb Haemost. 1999;81:312—3.
39. Norstrom E, Thorelli E, Dahlback B. Functional characterization of recombinant FV Hong Kong and FV Cambridge. Blood. 2002;100:524—30.
40. Butenas S, van’t Veer C, Mann KG. «Normal» thrombin generation. Blood. 1999;94:2169—78.
41. Pozzi N, Di Cera E. Prothrombin structure: unanticipated features and opportunities. Expert Rev Proteomics. 2014;11:653—5. doi: 10.1586/14789450.2014.971763
42. Haynes LM, Bouchard BA, Tracy PB, Mann KG. Prothrombin activation by platelet-associated prothrombinase proceeds through the prethrombin-2 pathway via a concerted mechanism. JBC. 2012;287:38647—55. doi: 10.1074/jbc.M112.407791
43. Tans G, Janssen-Claessen T, Hemker HC, Zwaal RF, Rosing J. Meizothrombin formation during factor Xa-catalyzed prothrombin activation. Formation in a purified system and in plasma. JBC. 1991;266:21864—73.
44. Degen SJ, Davie EW. Nucleotide sequence of the gene for human prothrombin. Biochemistry. 1987;26:6165—77.
45. Pozzi N, Chen Z, Gohara DW, Niu W, Heyduk T, Di Cera E. Crystal structure of prothrombin reveals conformational flexibility and mechanism of activation. JBC. 2013;288:22734—44. doi: 10.1074/jbc.M113.466946
46. Pozzi N, Chen Z, Pelc LA, Shropshire DB, Di Cera E. The linker connecting the two kringles plays a key role in prothrombin activation. Proc Natl Acad Sci USA. 2014;111:7630—5. doi: 10.1073/pnas.1403779111
47. Miranda-Vilela AL. Role of polymorphisms in factor V (FV Leiden), prothrombin, plasminogen activator inhibitor type-1 (PAI-1), methylenetetrahydrofolate reductase (MTHFR) and cystathionine-synthase (CBS) genes as risk factors for thrombophilias. Mini Rev. Med Chem. 2012;12:997—1006.
48. Buchanan GS, Rodgersm GM, Branch DW. The inherited thrombophilias: genetics, epidemiology, and laboratory evaluation. Best Pract Res Clin Obstet Gynaecol. 2003;17:397—411.
49. Lijfering WM, Middeldorp S, Veeger NJGM, Hamulyak K, Prins MH, Buller HR et al. Risk of recurrent venous thrombosis in homozygous carriers and double heterozygous carriers of factor V Leiden and Prothrombin G20210A. Circulation. 2010;121:1706—12. doi: 10.1161/CIRCULATIONAHA.109.906347
50. Bates S, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012;141:e691S-e736S. doi: 10.1378/chest.11-2300
51. Bezemer ID, van der Meer FJ, Eikenboom JC, Rosendaal FR, Doggen CJ. The value of family history as a risk indicator for venous thrombosis. Arch Intern Med. 2009;169:610—5. doi: 10.1001/archinternmed.2008.589
52. Rai R, Regan L. Recurrent miscarriage. Lancet. 2006;368:601—11. doi: 10.1016/S0140-6726(06)69204-0
53. Pritchard AM, Hendrix PW, Paidas MJ. Hereditary Thrombophilia and Recurrent Pregnancy Loss. Clin Obstet Gynecol. 2016;59:487—97. doi: 10.1097/GRF.0000000000000226
54. Robertson L, Wu O, Langhorne P, Twaddle S, Clark P, Lowe GD et al. Thrombophilia in pregnancy: a systematic review. Br J Haematol. 2005;132:171—96. doi: 10.1111/j.1365-2141.2005.05847.x
55. Rodger MA, Betancourt MT, Clark P, Lindgvist PG, Dizon-Townson D, Said J et al. The association of factor V Leiden and prothrombin gene mutation and placenta-mediated pregnancy complications: a systematic review and meta-analysis of prospective cohort studies. PLoS Med. 2010;7:e1000292. doi: 10.1371/journal.pmed.1000292
56. Rey E, Kahn SR, David M, Shrier I. Thrombophilic disorders and fetal loss: a meta-analysis. Lancet. 2003;361:901—8. doi: 10.1016/S0140-6736(03)12771-7
57. Roqueґ H, Paidas MJ, Funai EF, Kuczynski E, Lockwood CJ. Maternal thrombophilias are not associated with early pregnancy loss. Thromb Haemost. 2004;91:290—5. doi: 10.1160/TH-09-0596
58. Pickering W, Marriott K, Regan L. G20210A prothrombin gene mutation: prevalence in a recurrent miscarriage population. Clin Appl Thromb Hemost. 2001;7:25—8.
59. Pihusch R, Buchholz T, Lohse P, Rubsamen H, Rorenhofen N, Hasbargen U et al. Thrombophilic gene mutations and recurrent spontaneous abortion: prothrombin mutation increases the risk in the first trimester. Am J Reprod Immunol. 2001;46:124—31.
60. Колосков АВ, Батурина ОА, Лыщев АА, Филиппова ОИ, Столица АА, Целикова ЕВ и др. Тромботические и геморрагические риски у беременных женщин. Российский биомедицинский журнал. 2013;14:880—90.
тромбофильных мутаций | GENNET Прага, Либерец
Тромбофильные мутации
Тромбофилия — это склонность к повышенной свертываемости крови , на которую влияют как врожденные предрасположенности, так и внешние факторы (спорт, вес, возраст, курение, несчастные случаи или лекарства). Люди с более высокой свертываемостью крови более склонны к образованию тромбов (тромбов), что может привести к частичному или полному закрытию кровеносных сосудов, в основном глубоких вен ног (тромбоз глубоких вен).Части сгустка могут отделяться, перемещаться по кровеносным сосудам и после прохождения через сердце закрывать любую из легочных артерий — тогда возникает тромбоэмболия легочной артерии. Тромбоз плаценты может поставить под угрозу течение беременности.
Внешним стимулом к образованию тромбов могут быть гормональные контрацептивы и гормональное лечение бесплодия или во время беременности. Таким образом, исследование врожденного наследственного компонента тромбофилии относится к основным генетическим тестам до зачатия.Результаты обследования влияют на лечение бесплодия и уход за беременными. Знание врожденной склонности к свертыванию крови может помочь не только в репродуктивном возрасте, но и при операциях, длительной иммобилизации или лечении хронических заболеваний.
Мы исследуем два значимых изменения — тромбофильные мутации генов F5 и F2, которые влияют на структуру и функцию двух белков (фактора V и фактора II). Оба они принимают активное участие в процессе свертывания крови:
- Лейденская мутация (FV Leiden) гена фактора свертывания крови V — мутация в позиции номер 1691 в гене F5 приводит к замене аминокислоты аргинина на глутамин в позиции 506 (R506Q) этого белка
- Мутация гена фактора свертывания крови II (протромбин F II) — мутация в позиции номер 20210 гена F2
Обнаружение мутации означает повышенную врожденную предрасположенность к свертыванию крови.Поэтому необходимо ввести определенные профилактические меры. В чешской популяции 5-10% носителей мутации FV Leiden и 1-2% носителей мутации протромбина FII.
Как передается по наследству тромбофилия?
Тромбофильные мутации передаются от поколения к поколению.
Мы различаем два типа:
- гетерозигота — особи, унаследовавшие мутацию только от одного родителя.Их печень производит смесь нормального фактора и активного фактора свертывания крови или его повышенного количества. В результате повышается риск развития тромбоза.
- — особи, унаследовавшие одну и ту же мутацию от обоих родителей. Их печень производит только активный фактор с более значительным результатом. Поэтому риск развития тромбоза очень высок.
Гомозигота
Это аутосомно-доминантное наследование, гетерозиготы (носители одной мутации) имеют 50% -ный риск передачи мутации своим детям независимо от их пола, гомозиготы всегда передают мутацию своим детям.
Каков риск развития тромбоза?
Наличие врожденной тромбофильной мутации представляет в 3-5 раз более высокий риск развития тромбоза глубоких вен по сравнению с нормальной популяцией. Это не обязательно означает, что каждый носитель будет страдать от тромбоза. Его развитие происходит в основном только после взаимодействия с другими факторами приобретенной тромбофилии:
- возраст старше 45 лет
- ожирение, курение, алкоголь
- Атеросклероз и другие сердечно-сосудистые заболевания
- абдоминальные и ортопедические операции
- ДТП и длительная иммобилизация
- Гормональная контрацепция или лечение половыми гормонами (противопоказано при гомозиготе тромбофильной мутации)
- Беременность и послеродовой период
- онкологические заболевания и их лечение
- потеря или недостаточное потребление жидкости (обезвоживание)
- аутоиммунные заболевания (например, антифосфолипидные антитела)
- Наличие мутаций других генов, связанных со свертыванием крови
Когда присутствуют различные тромбофильные факторы, это может привести к тромбозу у любого человека, но у людей с врожденной тромбофилией достаточно лишь незначительного внешнего воздействия, чтобы вызвать тромбоз.
Какая профилактика развития тромбоза?
Ключевым элементом предотвращения и сведения к минимуму проблем, связанных с образованием тромбоза, является знание генетической предрасположенности. Диета и образ жизни могут быть изменены на основе информации — достаточное количество упражнений, сбалансированная диета с достаточным потреблением жидкости, поддержание оптимальной массы тела и отказ от курения. Риск заболевания может быть значительно снижен благодаря таким элементарным профилактическим мерам.Одновременно проводится гематологический мониторинг или, возможно, терапия в ситуациях повышенного риска, например, во время беременности.
Перед необходимым медицинским вмешательством всегда сообщайте врачу о своей склонности к повышенной свертываемости крови!
Генетика тромбофилии | Сгустки крови
Тромбофилия
Автор: Элизабет Варга, M.S.
Тромбофилия — это медицинский термин, используемый для описания состояния, при котором кровь имеет повышенную тенденцию к свертыванию.Есть много причин, по которым кровь может иметь такую повышенную тенденцию.
Тромбофилию обычно подразделяют на два типа — приобретенную и наследственную. При приобретенной тромбофилии аномальное свертывание крови обычно связано с определенной причиной, например, с длительным постельным режимом после операции, травмой ноги или раком. Люди с наследственной тромбофилией склонны к образованию тромбов из-за генетической предрасположенности, унаследованной от их родителей. Люди с наследственной тромбофилией могут иметь в семейном анамнезе родственников с аномальной или чрезмерной свертываемостью крови.Эта брошюра объяснит, как гены играют роль в свертывании крови и связаны с наследственной тромбофилией.
Свертывание крови (коагуляция)
Свертывание крови — естественная защита организма от кровотечения. Сгусток, или «тромб», развивается всякий раз, когда есть повреждение кровеносного сосуда (артерий и вен). Сгустки образуются в результате серии химических реакций между специальными клетками крови (тромбоцитами) и белками крови (факторами свертывания). Тромбоциты и факторы работают вместе, чтобы регулировать процесс свертывания; Другими словами, они начинают и прекращают свертывание крови по мере того, как это нужно организму.Если процесс протекает неправильно, в кровеносных сосудах может образоваться сгусток, блокирующий приток крови к окружающим тканям. Когда это происходит, сгусток называется тромбозом.
Тромбофилия и процесс свертывания крови
Для того, чтобы процесс свертывания работал, белки факторов свертывания должны присутствовать в нужных количествах и работать правильно. Люди, унаследовавшие тромбофилию, могут не вырабатывать нужное количество определенного фактора свертывания крови, или этот фактор может быть каким-то образом ненормальным.У таких людей тромбоз развивается чаще или чаще, чем у людей, не имеющих наследственной тромбофилии.
Белки и свертывание крови
Белки — это большие молекулы, которые определяют структуру тела, помогают ему функционировать и регулируют его работу. В организме много белков, и каждый из них выполняет уникальную функцию. Процесс свертывания крови — это пример совместной работы белков. Клетки крови, тромбоциты и факторы свертывания крови состоят из белков.Если есть проблемы с этими белками, это может привести к проблемам со свертыванием крови.
Генетика, белки и свертывание крови
Чтобы понять, как генетика влияет на свертываемость крови, важно понимать, как производятся белки:
Белки свертывания крови, как и все белки, образуются путем соединения цепочки химических веществ, называемых аминокислотами. Порядок аминокислот в цепи составляет определенный белок; этот порядок определяется нашими генами, которые унаследованы нами от наших родителей.Гены состоят из ДНК, которая содержит наш генетический код.
ДНК — это молекула в форме витой лестницы, состоящая из триллионов химических оснований. Эти химические основы организованы в группы по три и «читаются» телом во многом как приговор. A, T, G и C — «буквы» «алфавита» или кода ДНК; они обозначают химические вещества аденин, тимин, гуанин и цитозин, соответственно, которые составляют химические основы ДНК. Каждый трехбуквенный код представляет собой определенную аминокислоту.Точно так же, как ваш мозг может определять значение слов, ваше тело может назначать определенные аминокислоты для каждого трехбуквенного кода ДНК.
Сегмент кода ДНК выглядит так:
AGCCGTACGGTTCAACCG
В теле читается как:
ACG-CGG-ACG-GTT-CAA-CCC
Исходя из этого, аминокислоты назначаются, образуя цепочку аминокислот, из которой образуется белок. Проблемы возникают, если в коде ДНК есть орфографическая ошибка (мутация). Мутации в коде ДНК могут привести к неправильному назначению аминокислоты.
ДНК с мутацией вызывает изменение аминокислоты, назначенной в определенном положении:
ACG-CAG-ACG-GTT-CAA-CGG
Если это происходит, то производимый белок изменяется. Это изменение может привести к изменению формы белка или к тому, что организм вырабатывает слишком много белка, поэтому функция белка будет другой.
Унаследованная тромбофилия
- Унаследованная тромбофилия возникает, когда наследственная мутация ДНК приводит к выработке организмом
- слишком много или слишком мало белка свертывания крови
- белок свертывания крови, который не функционирует должным образом
Хотя существует ряд мутаций, которые могут вызывать наследственную тромбофилию, наиболее распространенные мутации ДНК называются фактором V Лейдена и протромбином G20210A.Понимание того, как происходят эти две мутации, можно применить к другим мутациям, которые приводят к наследственной тромбофилии.
Фактор V (пять) Лейден
Все люди вырабатывают белок, называемый фактором V, который помогает свертыванию крови. Однако есть люди, у которых есть мутация ДНК в гене, из которого вырабатывается белок фактора V. Утверждается, что у этих людей есть лейденская мутация фактора V. Мутация была названа в честь города под названием Лейден, где было проведено исследование первой семьи, в которой обнаружена мутация.Лица с лейденской мутацией фактора V унаследовали тромбофилию.
Фактор V Лейден и склонность к образованию тромбов
Обычно белок фактора V вырабатывается, чтобы помочь свертыванию крови, и вырабатывается в больших количествах после повреждения кровеносного сосуда.
Количество продуцируемого протеина фактора V контролируется другими протеинами, включая протеин C и протеин S. Соединение протеина C и протеина S способствует расщеплению фактора V, предотвращая его повторное использование и свертывание крови.
Когда человек имеет фактор V Лейдена, мутация приводит к неправильной форме белка. Эта аномальная форма препятствует его правильному расщеплению белками C и S. Поскольку белок фактора V не расщепляется, он остается в крови на более длительный период времени и увеличивает тенденцию к свертыванию.
Тест на фактор V Лейден
- Тестирование фактора V Лейдена проводится путем взятия образца крови, и есть два типа тестов, которые могут быть выполнены, чтобы определить, есть ли у человека фактор V Лейдена.
- В некоторых случаях образец может быть исследован, чтобы определить, устойчива ли кровь к активированному протеину C (одному из протеинов, который помогает контролировать фактор V).
- Если кровь устойчива к активированному протеину C, вероятность того, что у человека есть мутация в гене фактора V, составляет 90-95%.
- Обычно проводится генетический тест, чтобы подтвердить анализ крови на активированный протеин С. Иногда сначала назначают генетический тест, даже не проводя тестирование на активацию протеина С. В этом случае ДНК выделяется из клеток крови, и ген фактора V исследуется, чтобы увидеть, есть ли мутация в коде ДНК.Если мутация обнаружена, значит, у человека есть фактор V Лейдена.
Распространенность фактора V Лейден
По оценкам, около 5% (1 из 20) кавказцев (белых) имеют фактор V Лейдена, и он чаще встречается у лиц европейского происхождения. В Соединенных Штатах примерно 1-2% (от 1 из 100 до 1 из 50) афроамериканцев, латиноамериканцев и коренных американцев также имеют мутацию. Фактор V Лейден редко встречается у азиатов.
Протромбин G20210A мутация
Все люди вырабатывают протеин протромбин (также называемый фактором два), который помогает свертыванию крови.Однако есть определенные люди, у которых есть мутация ДНК в гене, используемом для образования протромбина (также называемого протромбином G20210A или мутацией фактора II (два)). Говорят, что у них наследственная тромбофилия под названием протромбин G20210A. Когда это происходит, они производят слишком много протеина протромбина.
Протромбин G20210A и склонность к образованию тромбов
- Обычно протеин протромбин вырабатывается, чтобы помочь свертыванию крови, и вырабатывается в больших количествах после повреждения кровеносного сосуда.
- Люди с мутацией в гене протромбина производят больше протеина протромбина, чем обычно. Поскольку в крови больше протеина протромбина, это увеличивает тенденцию к свертыванию.
Тест на протромбин G20210A
Тестирование протромбина проводится путем взятия образца крови и использования генетического теста для определения гена протромбина.
- ДНК выделяется из клеток крови, и ген протромбина исследуется, чтобы увидеть, есть ли мутация в коде ДНК.Если обнаружено изменение гена (20210-я буква изменена с G на A), то у человека есть мутация протромбина (или фактора II).
Распространенность протромбина G20210A
Изменение гена протромбина присутствует у 2-4% (или от 1 из 50 до 1 из 25) кавказцев и чаще встречается у лиц европейского происхождения. В Соединенных Штатах примерно 0,4% (примерно 1 из 250) афроамериканцев также имеют мутацию. Мутация протромбина G20210A в других группах встречается редко.
Наследование фактора V Лейдена и протромбина G20210A
Генетические мутации передаются из поколения в поколение, потому что мы получаем свою ДНК от родителей. Наша генетическая информация передается парами. У каждого гена есть две копии; один идет от нашей матери, а другой — от отца. Различные состояния могут передаваться по-разному; тромбофилия считается доминирующим признаком. Это означает, что у человека с наследственной тромбофилией должна быть мутация только в одной из двух копий его / ее гена, чтобы иметь заболевание.Это также называется доминантным наследованием.
Если человек наследует только одну копию мутации гена, он считается гетерозиготным («гетеро» означает разные, «зиготный» означает тела). Если обе копии гена человека имеют мутацию, они считаются гомозиготными («гомо» означает то же самое, «зиготный» означает тела).
Если человек гомозиготен (то есть он или она наследует мутацию в обеих копиях своего гена, по одной от каждого родителя), он подвергается большему риску развития тромба, чем гетерозиготный человек.
Человек также может иметь больший риск развития тромба, если он унаследует мутацию более чем в одном из генов, приводящих к тромбофилии. Например, у человека повышается риск образования тромба, если у него есть и фактор V Лейдена, и протромбин G20210A.
Вероятность унаследовать тромбофилию
Каждый человек наследует по две копии каждого гена. Одна копия унаследована от матери, другая — от отца. Чтобы предсказать риск для ребенка, необходимо учитывать несколько факторов.
Первый — гетерозиготный вы (только одна из двух копий вашего гена содержит мутацию) или гомозиготный (обе копии двух ваших генов содержат мутацию). Генетический тест может сказать вам, гетерозиготный вы или гомозиготный.
Во-первых, независимо от того, являетесь ли вы гетерозиготным по мутации гена, вероятность того, что ваш ребенок унаследует мутацию гена, составляет 50:50 (или половину), потому что существует равная вероятность передачи копии гена с мутация ИЛИ копия гена без мутации.Копия гена, которую наследует ваш ребенок, возникла случайно, и никто не может изменить этот шанс. (См. Диаграмму ниже.)
Если вы гомозиготны по мутации гена, ваш ребенок унаследует мутацию. Поскольку у вас нет копии гена без мутации, невозможно передать ген без мутации вашему ребенку.
Еще одно соображение заключается в том, несет ли другой родитель ребенка генную мутацию, которая приводит к тромбофилии.Это также повлияет на шансы вашего ребенка унаследовать тромбофилию.
Консультанты-генетики — это профессиональные медики, которые могут помочь интерпретировать генетические концепции. Если вы хотите узнать больше о генетических рисках, вы можете проконсультироваться с генетическим консультантом или медицинским работником, имеющим специальную подготовку в области генетики. Чтобы найти консультанта по генетике в вашем районе, вы можете связаться с Национальным обществом консультантов по генетике по адресу http://www.nsgc.org.
Генетическое тестирование членов семьи
Есть много вопросов, связанных с решением продолжить генетическое тестирование.Перед проведением какого-либо тестирования важно подумать о том, как генетическая информация будет использоваться в медицинском управлении. Рекомендуется обсудить эти вопросы со знающим врачом. Вы также можете просмотреть брошюру NBCA под названием «Семейное тестирование на нарушения свертывания крови» для получения дополнительной информации.
Заявление об ограничении ответственности
Национальный альянс по сгустку крови (NBCA) и его Медицинский и научный консультативный совет (MASAB) не одобряют и не рекомендуют какие-либо коммерческие продукты, процессы или услуги.Взгляды и мнения авторов, выраженные на веб-сайтах NBCA или MASAB или в письменных материалах NBCA или MASAB, не обязательно содержат или отражают точку зрения NBCA или MASAB, и их нельзя использовать в целях рекламы или одобрения продукта.
NBCA или MASAB не намерены предоставлять конкретные медицинские консультации, а, скорее, предоставлять пользователям информацию, чтобы лучше понять их здоровье и диагностированные заболевания. Конкретные медицинские консультации предоставлены не будут, и NBCA и MASAB настоятельно рекомендуют вам проконсультироваться с квалифицированным врачом для постановки диагноза и ответов на ваши личные вопросы.
Тромбофильный риск мутаций фактора V Лейдена, протромбина G20210A, MTHFR и кальретикулина у пациентов из Египта с эссенциальной тромбоцитемией
Цели . Эссенциальная тромбоцитемия (ЭТ) — одно из миелопролиферативных новообразований, характеризующихся стойким повышением количества тромбоцитов с тенденцией к тромбозам и кровоизлияниям. Целью данной работы является установление связи между мутациями кальретикулина, лейденского фактора V, протромбина G20210A и MTHFR у пациентов с ЭТ и тромботическим риском у этих пациентов. Методы . Это исследование проводилось на 120 пациентах с ЭТ и 40 практически здоровых лицах в качестве контрольной группы. Результатов . Было увеличение лейкоцитов, количества PLT, PT, фактора концентрации фибриногена V Leiden и мутации MTHFR у пациентов с ET по сравнению с контрольной группой (). Кроме того, было увеличение лейкоцитов, количества PLT и значения гематокрита у пациентов с тромбированной ЭТ по сравнению с пациентами, не подвергавшимися тромбозу (). Напротив, не было значительных статистических различий у пациентов с ЭТ с положительной мутацией JAK2 V617F по сравнению с группой отрицательных JAK2 () и у пациентов с факторами риска сердечно-сосудистых заболеваний по сравнению с пациентами с факторами риска, не связанными с сердечно-сосудистыми заболеваниями ().Пациенты с ЭТ с лейденским фактором V, геном протромбина и мутациями CALR были более склонны к тромбозу (отношение шансов 5,6, 5,7 и 4,7 соответственно). Напротив, мутации JAk2V 617F и MTHFR не влияют на тромботическое состояние этих пациентов. Заключение . Существует значительный повышенный риск тромбоза у пациентов с ET с мутацией CALR, тромбофильными мутациями, а также с лейденской мутацией фактора V и гена протромбина с риском развития лейкемической трансформации.
1.Введение
Эссенциальная тромбоцитемия (ЭТ) является одним из «миелопролиферативных новообразований» (MPN), характеризующимся клональной гиперпродукцией одной или нескольких линий клеток крови. ЭТ характеризуется стойким повышением количества тромбоцитов со склонностью к тромбозам и кровоизлияниям [1]. ЭТ может протекать бессимптомно или проявляться окклюзией сосудов и кровоизлияниями [1, 2]. Наиболее распространенным молекулярным маркером этих заболеваний является мутация JAK2 V617F, присутствующая в 50–70%, и кальретикулин (CALR), многофункциональный кальций-связывающий белок, мутация которого присутствует в 15–24% [1].
У пациентов с ЭТ часто встречается тромбофилия, которая может быть генетической или приобретенной. Патогенез тромбоза при ЭТ сложен и еще не полностью изучен [2]. Было описано несколько дефектов, в том числе автономное производство тромбоцитов, не регулируемое механизмом физиологической обратной связи, чтобы поддерживать количество в пределах нормального диапазона [3]. Кроме того, у ET наблюдалась повышенная чувствительность к цитокинам (например, интерлейкин-3 (IL-3)) и снижение ингибирования факторов, ингибирующих тромбоциты (например,g., трансформирующий фактор роста (TGF) бета), приводящий к гиперагрегации [4]. Однако Pearson [5] сообщил, что количество тромбоцитов само по себе не коррелирует с частотой тромбообразования.
Тромбофильные гены в форме фактора V Лейдена — это мутация в гене фактора V, на долю которого приходится 40–50% тромбозов [6]. Протромбин G20210A — вторая по распространенности генетическая аномалия, вызывающая тромбофилию [6, 7]. Метилентетрагидрофолатредуктаза (MTHFR) играет важную роль в метаболизме фолиевой кислоты [8, 9].Нарушение функции фермента приводит к гипергомоцистеинемии и может вызвать тромбофилию [7, 10].
Насколько нам известно, связь между мутациями ET и фактора V Лейдена, протромбина G20210A и MTHFR еще полностью не изучена. Итак, цель данной работы — установить связь между мутациями кальретикулина, фактора V Лейдена, протромбина G20210A и MTHFR у пациентов с ЭТ и тромботическим риском у этих пациентов, как независимых факторов или как ковариант с другими биологическими особенностями.
2. Пациенты и методы
Исследование случай-контроль было проведено с участием 160 человек: 120 пациентов (51 мужчина и 69 женщин) в возрасте от 17 до 86 лет (средний возраст 47,7 года) и 40 практически здоровых лиц того же возраста и пола. со средним возрастом 45,1 года, которые служили контрольной группой. Пациентам был поставлен диагноз на основании критериев ВОЗ 2016 для диагностики ЭТ [1], и они были госпитализированы в онкологический центр Мансура.
Все пациенты дали информированное согласие как на лечение, так и на генетический анализ.Образцы были взяты во время постановки диагноза, и пациенты наблюдались в течение 24 месяцев. У 42 пациентов развился тромбоз: у 30 пациентов на момент постановки диагноза и у 12 в течение периода наблюдения. У 40 пациентов был венозный тромбоз, у 2 — артериальный тромбоз. В соответствии с наличием мутации JAK2 пациенты разделились на 78 пациентов с положительной реакцией на JAK2 и 42 пациента с отрицательной реакцией на JAK2; в соответствии с наличием мутации CALR пациенты разделились на 14 пациентов с положительным результатом по CALR и 106 пациентов с отрицательным результатом по CALR, а в соответствии с факторами риска сердечно-сосудистых заболеваний (курение, АГ, СД и гиперлипидемия) пациенты были разделены на 66 пациентов с высоким риском и 54 без факторов риска.Пациентам и контрольной группе проводили сбор анамнеза, клиническое обследование, общий анализ крови (CBC), время кровотечения, протромбиновое время (PT), активированное частичное тромбопластиновое время (APTT), концентрацию фибриногена с помощью метода коагуляции, Va1617Phe JAK-2 мутации, мутации кальретикулина и полиморфизма фактора V Лейдена, протромбина G20210A и генов мутации MTHFR.
Пациенты получали аспирин в низких дозах (АСК, от 40 до 100 мг / день перорально). Гидроксимочевина (начальная доза 15 мг / кг в день перорально, в разделенных дозах и поддерживающих дозах, скорректированных в большую или меньшую сторону в зависимости от баланса между желаемым влиянием на количество тромбоцитов, которое должно поддерживаться в диапазоне от 100000 до 400000 / мкл, и нежелательные эффекты, такие как нейтропения и анемия).Цели лечения этих пациентов состояли в том, чтобы минимизировать патологические клинические, физические и лабораторные признаки, а также минимизировать долгосрочные осложнения заболевания (например, тромботические явления, кровотечение, миелофиброз, острый лейкоз и другие злокачественные новообразования).
2.1. ПЦР-определение мутации V617F JAK-2 с использованием ASO-специфического генетического маркера ПЦР
Обнаружение мутации JAK2 V617F представляло собой мутацию с использованием следующих праймеров (обратный JAK2: 5 ‘CTGAATAGTCCTACAGTGTTTTCAG-TTTCA 3’, JAK2 прямой (специфичный): ‘AGCATTTGGTTTTAAATTATGGAGTATATT 3’ и JAK2 вперед (внутренний контроль): 5 ‘ATCTATAGTCATGCTGAAAGTA-GGAGAAAG 3’).Условия цикла составляли 35 циклов с температурой отжига 58,5 ° C с последующим 2% -ным электрофорезом в агарозном геле для обнаружения полос [11].
2.2. ПЦР-определение мутации кальретикулина
Обнаружение мутации кальретикулина выполняли с использованием следующих праймеров (CALR вперед: 5 ‘TAACAAAGG-TGAGGCCTGGT 3’ и CALR в обратном направлении: 5 ‘GCCTCTCT-ACAGCTCGTCCTT 3’). Условия цикла составляли 35 циклов с температурой отжига 58,5 ° C с последующим циклическим секвенированием продуктов ПЦР с соответствующим прямым и обратным праймером с использованием автоматического секвенатора ДНК ABI 310 [12].
2.3. Фактор V Leiden, Prothrombin G20210A и MTHFR Mutation Detection
Для всех исследованных образцов была проведена экстракция ДНК с последующей амплификацией ПЦР с использованием биотинилированных праймеров, поставляемых в наборе (FV-PTH-MTHFR Strip Assay, Vienna Lab, Австрия, http: // www.viennalab.com). Продукты ПЦР гибридизовали с тест-полоской, содержащей аллель-специфические олигонуклеотидные зонды, иммобилизованные в виде массива параллельных линий [13].
3. Результаты
Настоящее исследование проводилось на 160 человек; 120 пациентов (51 мужчина и 69 женщин) и 40 практически здоровых людей в возрасте от 25 до 60 лет, которые служили контрольной группой.
Что касается тестов гемограммы и профиля коагуляции, было отмечено значительное статистическое увеличение лейкоцитов, количества PLT, протромбинового времени и концентрации фибриногена в группе пациентов по сравнению с контрольными группами () (Таблица 1). Кроме того, наблюдалось значительное статистическое увеличение количества лейкоцитов, количества PLT и значения гематокрита у пациентов с тромбированием по сравнению с пациентами без тромбоза () (Таблица 2). Напротив, не было статистически значимой разницы в отношении нетромбированных и тех, у кого развился тромбоз, у пациентов с ET с положительной мутацией JAK2 V617F по сравнению с группой отрицательных JAK2 () или пациентов с факторами сердечно-сосудистого риска по сравнению с пациентами с факторами риска не сердечно-сосудистых заболеваний () (Таблица 3).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


