Белки содержание в клетке — Справочник химика 21
Мысль о том, что какой-то вид РНК несет генетическую информацию для биосинтеза белка, была первоначально высказана на основании того, что у эукариот почти вся ДНК сосредоточена в ядре, в то время как синтез белка протекает главным образом в цитоплазме на рибосомах. Следовательно, какая-то макромолекула, отличная от ДНК, должна переносить генетическую информацию от ядра к рибосомам. Логическим кандидатом на эту роль была РНК, поскольку ее обнаружили и в ядре, и в цитоплазме. Было также отмечено, что начало синтеза белка в клетке сопровождается увеличением содержания РНК в цитоплазме и увеличением скорости ее обновления. Эти и другие наблюдения привели Френсиса Крика к предположению (ставшему частью центральной догмы молекулярной генетики), что РНК вьшолняет функцию переноса генетической информации от ДНК к рибосомам, где происходит биосинтез белка. Позже, в 1961 г., Франсуа Жакоб и Жак Моно предложили название матричная РНК для той части клеточной РНК, которая переносит генетическую информацию от ДНК к рибосомам, т. е. к месту, где эти молекулы-переносчики служат матрицами для биосинтеза полипептидных цепей с определенной последовательностью аминокислот. [c.910]
е. к месту, где эти молекулы-переносчики служат матрицами для биосинтеза полипептидных цепей с определенной последовательностью аминокислот. [c.910]
Кроме того, необходимо иметь в виду, что конечный уровень содержания конкретных белков в клетке зависит не только от скорости их биосинтеза, но и от скорости внутриклеточной деградации [52]. Поэтому дифференциальная регуляция стабильности белков является важнейшим механизмом, регулирующим экспрессию генов у любого организма. [c.35]
Больше всего в составе микроорганизмов содержится воды (в среднем до 80—85%). Основная масса воды находится в связанном состоянии с коллоидной частицей. Важнейшей составной частью клетки являются белки. Содержание белка колеблется от 8 до 14%. Углеводов очень мало, главным образом в виде моносахаридов и гликогена. Жиров имеется в среднем 1—4%, но некоторые микроорганизмы накапливают их до 30%- [c.267]
Процесс старения организма проявляется в виде функциональных нарушений молекул, клеток, органов, систем. Изменяются не только химический состав, но и количество многих биологических регуляторов (уменьшается биосинтез белка, содержание в тканях гормонов, витаминов, ферментов, аминокислот, катехоламинов, макроэргических соединений), снижается или извращается обмен веществ, возникают дистрофические процессы в клетках и тканях. Вследствие этого снижается возбудимость и функциональная активность клеток и тканей, а также нервной, эндокринной, иммунной систем. Увеличивается риск возникновения острых болезней, их осложнений и обострения хронических заболеваний. [c.233]
Изменяются не только химический состав, но и количество многих биологических регуляторов (уменьшается биосинтез белка, содержание в тканях гормонов, витаминов, ферментов, аминокислот, катехоламинов, макроэргических соединений), снижается или извращается обмен веществ, возникают дистрофические процессы в клетках и тканях. Вследствие этого снижается возбудимость и функциональная активность клеток и тканей, а также нервной, эндокринной, иммунной систем. Увеличивается риск возникновения острых болезней, их осложнений и обострения хронических заболеваний. [c.233]
Основную массу цитоплазматических белков, не входящих в состав частиц, состав.пяют молекулы очень большого числа различных ферментов. Общее число ферментных молекул в типичной клетке составляет что-то около миллиарда сюда входит несколько тысяч (возможно, от одной до десяти тысяч) различных видов ферментных молекул, каждый из которых специфически катализирует определенную химическую реакцию. Таким образом, в типичной растительной клетке по грубому расчету может содержаться 10 молекул десяти тысяч различных ферментов — по сто тысяч молекул каждого вида ферментов.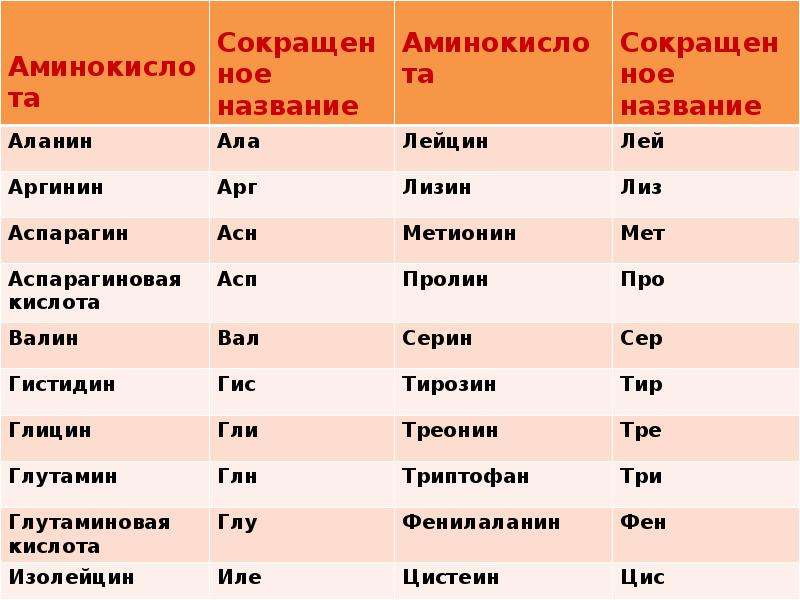 Однако на самом деле относительное содержание каждого из ферментов (по сравнению с общим количеством растворимого белка в клетке), как правило, значительно отличается от 0,001 % — величины, рассчитанной исходя из приведенных выше усредненных цифр. [c.8]
Однако на самом деле относительное содержание каждого из ферментов (по сравнению с общим количеством растворимого белка в клетке), как правило, значительно отличается от 0,001 % — величины, рассчитанной исходя из приведенных выше усредненных цифр. [c.8]
Правда, еще совсем недавно полагали, что бактериальная клетка — это просто-напросто мешок, заполненный ферментами , что она реализует сразу всю информацию и в ней присутствуют все ферменты, гены которых имеются в наличии. Однако сейчас об этом известно больше. Когда в бактериальных клетках определяют количество отдельных ферментов и сравнивают полученные результаты с общим количеством белка, то в некоторых случаях оказывается следующее на долю какого-либо одного ферментного белка приходится от 5 до 8% общего содержания белка в клетке. Следовательно, в таких клетках может содержаться не больше дюжины различных ферментов, тогда как им, безусловно, требуются сотни, если не тысячи ферментов. Конечно, возможно, что на самом деле ферментов в такой клетке больше, около 50, но каждый из них присутствует в очень малом количестве. И все же может ли быть, что все прочие процессы идут нормально, если клетка только на производство одного-единственного фермента начинает затрачивать столько вещества и энергии [c.272]
И все же может ли быть, что все прочие процессы идут нормально, если клетка только на производство одного-единственного фермента начинает затрачивать столько вещества и энергии [c.272]
Все клетки организма имеют идентичный геном и синтезируют от 10 000 до 20 ООО различных белков, однако отличаются между собой наличием специфических для данных клеток белков. Для эритроцитов характерно высокое содержание гемоглобина, для кожи — коллагена, поджелудочной железы — ферментных белков, скелетных мышц — сократительных белков актина и миозина. Концентрация различных белков, а иногда и их спектр, изменяется с возрастом, а также при воздействии внутренних и внешних факторов среды, патологических изменениях обмена веществ. Даже относительно небольшие изменения в спектре синтезируемых белков в клетке способны существенно влиять на ее функции и структуру. Все это свидетельствует о том, что в живых организмах существует контроль белкового синтеза. Механизмы регуляции белкового синтеза играют существенную роль в процессах адаптации организма к мышечной деятельности, так как обеспечивают увеличение или появление новых адаптивных белков в мышцах и других тканях. [c.253]
[c.253]
Соматотропин влияет на ряд метаболических процессов организма. Он стимулирует рост молодых животных, повышает синтез белков во всех клетках и увеличивает содержание рибонуклеиновой кислоты в клетках. Одновременно снижается количество аминокислот в крови и уровень выделяемого с мочой азота. Механизм действия гормона на синтез белков в клетках недостаточно изучен. При введении гормона роста в организм усиливается мобилизация жира из жировых депо и использование его в энергетическом обмене. Под влиянием соматотропина происходит повышение содержания гликогена в мышцах, он участвует в регуляции водно-солевого обмена. [c.195]
Содержание нуклеиновых кислот в различных клетках и тканях животных и растений оказывается неодинаковым. В тех клетках, где идет активный синтез белков, например в различных железах, в особенности в пищеварительных железах, в быстрорастущих клетках эмбриональных тканей и т. п., всегда содержится большое количество РНК. Одновременно с этим установлено, что нуклеиновые кислоты в этих клетках находятся в состоянии активного обмена, подвергаясь интенсивному распаду и синтезу. Синтез белков в клетке осуществляется пространственно неравномерно, он локализован в отдельных структурных элементах клетки — в секреторных гранулах, в микросомах, ядрышке. В них особенно много РНК. [c.277]
Одновременно с этим установлено, что нуклеиновые кислоты в этих клетках находятся в состоянии активного обмена, подвергаясь интенсивному распаду и синтезу. Синтез белков в клетке осуществляется пространственно неравномерно, он локализован в отдельных структурных элементах клетки — в секреторных гранулах, в микросомах, ядрышке. В них особенно много РНК. [c.277]
Уже установлено, что в биосинтезе белков исключительно важную роль играют нуклеиновые кислоты, входящие в состав ядер и цитоплазмы клеток. Содержание нуклеиновых кислот (нуклеопротеидов) в различных клетках и тканях оказывается неодинаковым. В тех клетках, где происходит активный синтез белков, например в железах (пищеварительные железы), в быстрорастущих клетках эмбриональных тканей и т. д., всегда содержится большое количество нуклеопротеидов. Одновременно с этим установлено, что нуклеиновые кислоты в этих клетках находятся в состоянии активного обмена, подвергаясь интенсивному распаду и ресинтезу. Интенсивное обновление нуклеиновых кислот в клетках, физиологически приспособленных к интенсивному синтезу белков, установлено в исследованиях с применением изотопов. Оказалось, что синтез белков в клетке осуществляется пространственно неравномерно, он локализован в отдельных структурных элементах клеток — в секреторных гранулах, в микросомах, ядрышке. Перечисленные структурные элементы клеток особенно богаты рибонуклеиновыми кислотами, в них особенно интенсивно происходит обновление рибонуклеиновых кислот во время синтеза белков. [c.429]
Оказалось, что синтез белков в клетке осуществляется пространственно неравномерно, он локализован в отдельных структурных элементах клеток — в секреторных гранулах, в микросомах, ядрышке. Перечисленные структурные элементы клеток особенно богаты рибонуклеиновыми кислотами, в них особенно интенсивно происходит обновление рибонуклеиновых кислот во время синтеза белков. [c.429]
Клетки, богатые РНК, синтезируют больше белка, чем клетки, имеющие пониженное содержание ее. [c.147]
Синтез белка в клеточном цикле. Если измерять общее содержание белка в клетке на протяжении цикла роста и деления, то [c.80]
РНК, белков определялось уровнем содержания предшественников, активностью РНК-полимераз, структурно-функциональным строением хроматина. Активность РНК-полимераз обнаруживалась уже на первом часу набухания семян. В дальнейшем ходе прорастания семян наблюдалось трехфазное изменение активности этих РНК-полимераз, которое коррелирует с трехфазным изменением биосинтеза РНК. Поэтому наблюдаемая нами периодичность активности ферментов, возможно, обусловлена интенсивностью процессов биосинтеза белков, в том числе и ферментов, и активностью протеолитических ферментов, осуществляющих гидролитическое расщепление белков в клетке. Оценки уровня интенсивности этих процессов можно производить с помощью определения величин V и V. . Отношение V /V. позволяет [c.165]
Поэтому наблюдаемая нами периодичность активности ферментов, возможно, обусловлена интенсивностью процессов биосинтеза белков, в том числе и ферментов, и активностью протеолитических ферментов, осуществляющих гидролитическое расщепление белков в клетке. Оценки уровня интенсивности этих процессов можно производить с помощью определения величин V и V. . Отношение V /V. позволяет [c.165]
Предполагается, что белки, содержание которых контролируется путем репрессии синтеза, постоянно образуются в клетке в виде двух изоформ. Репрессор подавляет синтез одной из изоформ и не влияет на процессы транскрипции и трансляции другой. [c.59]
Молекулярные массы РНК определяют теми же методами, что и ДНК, но, кроме того, используют электрофорез в полиакриламидном геле, так как пробег РНК в геле обратно пропорционален их молекулярным массам. Что касается содержания и локализации РНК в клетках, то оно не отличается ни однообразием, ни стабильностью в клетках, где идет интенсивный биосинтез белков, содержание РНК в несколько раз превышает таковое ДНК (например, в печени крысы РНК в 4 раза больше, чем ДНК), но там, где синтез белка мал, соотношение ДНК и РНК может быть обратным (например, в легких крысы РНК в 2 раза меньше, чем ДНК). [c.195]
[c.195]
По мере увеличения продолжительности закаливания до 9 суток интенсивность полос на электрофореграмме усиливается, что свидетельствует о накоплении соответствующих термостабильных белков в клетках растений озимой пшеницы. При помощи радиоизотопного метода и флюорографии показана низкотемпературная индукция синтеза белков с мол. массами 209, 196, 66 кД уже в течение первых суток. Следовательно, увеличение содержания термостабильных OR-белков в проростках озимой пшеницы при закалке лишь частично связано с индукцией синтеза новых полипептидов. Другие белки, накапливающиеся при закалке, синтезируются и при нормальной температуре. [c.15]
Содержание белков в клетках lorella и S enedesmus составляет около 55 % (в расчете на сухую массу), а в клетках Spirulina — 65 %. Белки водорослей хорошо сбалансированы по содержанию незаменимых аминокислот, за исключением метионина. В клетках водорослей, кроме того, синтезируется довольно много полинена-сыщенных жирных кислот и -каротина (до 150 мг %).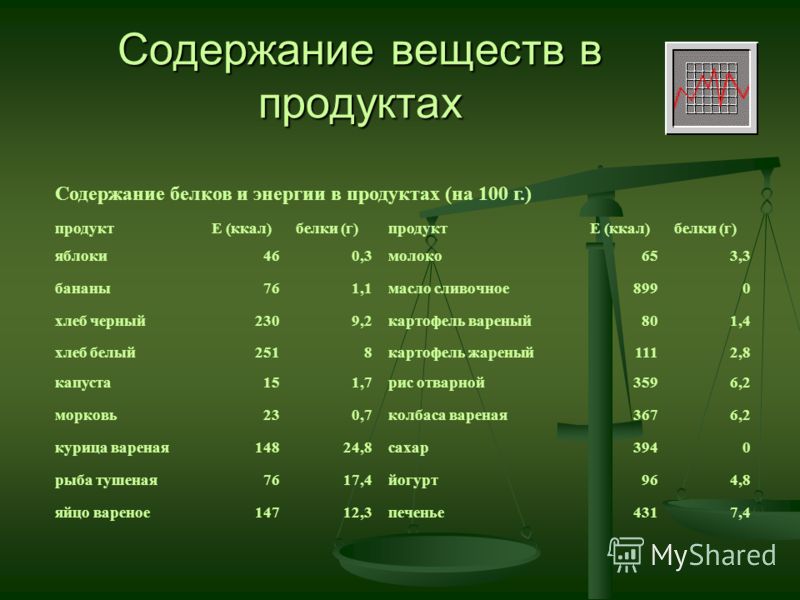 [c.14]
[c.14]
Биосинтез белков в клетках листьев зависит от экспрессии генетической информации трех различных геномов ядра, хлоропластов и митохондрий. Эта генетическая информация проявляется через три генетические системы, включающие ДНК, ДНК-полимеразу, РНК-полимеразу и аппарат белкового синтеза (рибосомы, транспортные РНК, ферментный набор…). Ядерные гены подчиняются закону двуродительского наследования, тогда как гены органелл имеют исключительно материнское наследование. Именно эти носители генетической информации с их собственными законами передачи определяют структуру и свойства белков листьев, а также содержание в них белков, липидов, волокон и т. п. Более подробные сведения о передаче и проявлении генетической информации в хлоропластах можно получить из литературных источников [25, 27, 1П , как и по тем же вопросам применительно к митохондриям [67]. [c.237]
В организме человека содержится около 4,5—5,0 г железа. На долю гемоглобина крови из этого количества (если принять за 100% все железо в организме) приходится 60—70%, миоглобина — 3—5%, ферритина—20% (от 17 до 23%), трансферрина—около 0,18%, функционального железа тканей — до 5%. Содержание железа в организме регулируется главным образом интенсивностью всасывания в кишечнике поступающего с Ш1щей железа. Избыток его не всасывается. Потребность в железе резко возрастает при анемиях различного происхождения. Железо всасывается в кишечнике в виде неорганического двухвалентного иона Ре после освобождения его из комплексов с белками. В клетках слизистой оболочки кишечника железо уже в трехвалентной форме Ре соединяется с белком апоферритином с образованием стабильного комплекса ферритина. Дальнейший транспорт железа к местам кроветворения осуществляется в комплексе с 3 -глобу- [c.503]
Содержание железа в организме регулируется главным образом интенсивностью всасывания в кишечнике поступающего с Ш1щей железа. Избыток его не всасывается. Потребность в железе резко возрастает при анемиях различного происхождения. Железо всасывается в кишечнике в виде неорганического двухвалентного иона Ре после освобождения его из комплексов с белками. В клетках слизистой оболочки кишечника железо уже в трехвалентной форме Ре соединяется с белком апоферритином с образованием стабильного комплекса ферритина. Дальнейший транспорт железа к местам кроветворения осуществляется в комплексе с 3 -глобу- [c.503]
Метилотрофы — обитатели водоемов и почв различного типа, где идут процессы с образованием одноуглеродных соединений. Их выделяют из сточных вод, с гниющих растительных остатков, из рубца жвачных животных. Интерес к изучению метилотрофов связан не только с особенностями их метаболизма, но и с перспективами их практического использования метилотрофы характеризуются активным ростом, высокими выходами биомассы, большим содержанием полноценного белка в клетке являются эффективными продуцентами различных веществ. [c.399]
[c.399]
Все типы существующих клеток делят на два основных класса прокариотические и эукариотические. Наиболее замечательная особенность последних заключается в наличии специальной внутриьслеточной структуры — ядра, которое содержит преобладающую часть ДНК и, следовательно, наследственную информацию. Ядро отдедено от внутреннего содержания клетки — цитоплазмы — ядерной мембраной. Кроме ДНК ядро содержит ряд белков, в первую очередь тех, которые участвуют в репликации и транскрипции, а также необходимы для деления клеток. В ядре эукариотических клеток ДНК существует в форме специальных органелл — хромосом. Эти органеллы можно увидеть в световом микроскопе на определенной стадии деления клетки. [c.23]
Содержание белков в клетках хлореллы и сценедесмус составляет 45—55 % в расчете на сухую массу, а в клетках спирулины достигает 60—65 %. Белки водорослей хорошо сбалансированы по содержанию незаменимых аминокислот, недостаточно содержится лишь метионина. Наряду с высоким содержанием белковых веществ в клетках водорослей довольно много синтезируется полиненасыщенных жирных кислот (являющихся, как и некоторые аминокислоты, незаменимыми) и провитамина А — каротина (до 150 мг%). Каротина в биомассе водорослей в 7—9 раз больше, чем в травяной муке из люцерны, отличающейся наиболее высоким содержанием этого провитамина среди кормовых трав. Содержание нуклеиновых кислот в одноклеточных водорослях значительно ниже (4—6 %), чем у бактерий, однако несколько выше по сравнению с растительными источниками белка (1—2%). [c.269]
Наряду с высоким содержанием белковых веществ в клетках водорослей довольно много синтезируется полиненасыщенных жирных кислот (являющихся, как и некоторые аминокислоты, незаменимыми) и провитамина А — каротина (до 150 мг%). Каротина в биомассе водорослей в 7—9 раз больше, чем в травяной муке из люцерны, отличающейся наиболее высоким содержанием этого провитамина среди кормовых трав. Содержание нуклеиновых кислот в одноклеточных водорослях значительно ниже (4—6 %), чем у бактерий, однако несколько выше по сравнению с растительными источниками белка (1—2%). [c.269]
Регуляция дыхания, вероятно, действует in vivo как механизм, приспосабливающий интенсивность дыхания к энергетическим потребностям клетки. В периоды быстрого распада АТФ (например, при синтезе белка) содержание АДФ и фосфата очень высоко и дыхание идет почти с максимальной интенсивностью. В то же время, когда потребность в АТФ мала (например, у покоящихся клеток), происходит накопление АТФ и убыль АДФ и фосфата, что приводит к снижению интенсивности дыхания. [c.245]
[c.245]
Кислый характер основной массы белков у галофильных бактерий. Оставался еще неясным вопрос, не является ли кислотность белковых компонентов мембран и рибосом специфической особенностью именно этих субк 1еточных стру ктур или же это фундаментальное свойство большинства белков галофильной клетки. По крайней мере частичный ответ на этот вопрос был получен в 1970 г. при сравнительном изучении основной массы белков у галофильных и близких к ним негалофильных бактерий. Выражение основная масса носит условный характер и означает белок, осаждаемый кислотой после удаления клеточных стенок и мембран. Эта белковая фракция составляет около 80% всего белка клетки и включает большую часть растворимых ферментов. Как и следовало ожидать, эти белки отличаются необычайно высоким содержанием кислых аминокислот. Молярное отношение кислых аминокислот к основным достигает здесь примерно 10 1, что даже выше соответствующих величин для белков рибосом и клеточных мембран. Таким образом, у крайне галофильных форм бактерий, по-видимому, большинство белков, если не все они, требуют высокой концентрации солей по той же причине необходимо нейтрализовать избыток отрицательных зарядов, который в отсутствие катионов ведет к появлению сил электрического отталкивания и к нарушению нормальной струк-туры и функции. Поэтому в заключение нужно будет рассмот-реть влияние катионов на функции галофильных белков. [c.130]
Поэтому в заключение нужно будет рассмот-реть влияние катионов на функции галофильных белков. [c.130]
При использовании в качестве субстратов для выращивания липидообразующих дрожжей гидролизных сред большое значение имеет подготовка гидролизата. Исследование различных способов нейтрализации гидролизатов (двухступенчатая нейтрализация, нейтрализация известковым молоком и 25%-ным раствором аммиака) показало зависимость скорости синтеза липидов от способа нейтрализации и связанного с ним соотношения углерода и азота в среде. Так, при соотношении N С, равном 1 6, в клетках микроорганизма накапливается до 31,1% белка, содержание липидов составляет 21,7%. При изменении соотношения М С до 1 40 происходит перераспределение направлений биосинтеза, в этом случае образуется до 35,7% липидов и только 15,0% белка. Таким образом, наиболее эффективным способом нейтрализации в данном случае является двухступенчатая нейтрализация, включающая на первой стадии нейтрализацию известковым молоком (до pH 4,0), на второй стадии — 25%-ным раствором аммиака (до pH 6,0). Экономический коэффициент в этих условиях составляет 60,6%, жировой — 15,6%. [c.351]
Экономический коэффициент в этих условиях составляет 60,6%, жировой — 15,6%. [c.351]
Как вы помните, во время лелсння клетки и ее ядра ядрышко исчезает и, наоборот, оно наблюдается в ядре в период между делениями, когда клетка растет. Кроме того, было замечено, что в клетка.х, быстро и активно растущих, ядрышко всегда увеличено в размерах. Отсюда невольно напрашивалось предположение, чго ядрышко как-то участвует в росте клетки, в процессах создания тела клетки, то есть в синтезе веществ, нз которых клетки строят себя. Как вы знаете, тело клетки состоит в основном из белков. Накопление нх в протоплазме происходит главным образом в период между клеточными делениями, в го время когда в ядре есть ядрышко. Значит, ядрышко участвует в синтезе белков Да, это действительно так. Но, точнее, не само ядрышко, а содержащаяся в нем рибонуклеиновая кислота. К этому же выводу пришел Касиерссон, высказывавший гипотезу об участии нуклеиновой кислоты в синтезе белка. Сейчас уже есть довольно много наблюдений и экспериментов, подтверждающих эту гипотезу.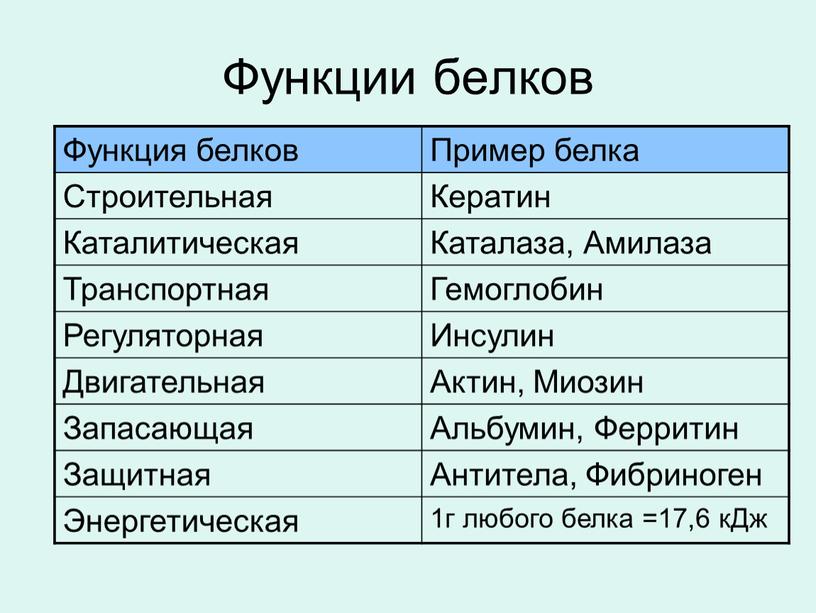 Например, если взять быстрорастущую культуру дрожжевых клеток и провести химический анализ, то в ней обнаружится довольно большое содержание РНК. И, наоборот, в голодающей культуре дрожжей, где обмен веществ замедлен и клетки едва растут, количество РНК незначительно. Было замечено и другое интересное явление синтез белков в клетках происходит параллельно синтезу нуклеиновых кислот. Если на клетку подействовать ядами, которые нарушают в ней образование нуклеиновых кислот, то может прекратиться и создание новых белков. [c.175]
Например, если взять быстрорастущую культуру дрожжевых клеток и провести химический анализ, то в ней обнаружится довольно большое содержание РНК. И, наоборот, в голодающей культуре дрожжей, где обмен веществ замедлен и клетки едва растут, количество РНК незначительно. Было замечено и другое интересное явление синтез белков в клетках происходит параллельно синтезу нуклеиновых кислот. Если на клетку подействовать ядами, которые нарушают в ней образование нуклеиновых кислот, то может прекратиться и создание новых белков. [c.175]
Колебания абсолютного содержания и концентрации гистоноподобных белков в клетках супраоптического и красного ядер при лишении ПФС и полной бессоннице пока еще трудно интерпретировать. Можно лишь заключить, что количество основных белков, особенно в глии, при естественном сне повышалось больше, чем общее содержание белков то же имело место и во время сна после периода с лишением ПФС или бессонницы, вызванной введением фенамина. Во время этих искусственных нарушений сна содержание основных белков снижалось меньше, чем суммарных белков, особенно в ГКС. По-видимому, гистоноподобные белки в исследованных нами ядрах играют какую-то особую роль в репа-ративных процессах при сне. [c.36]
По-видимому, гистоноподобные белки в исследованных нами ядрах играют какую-то особую роль в репа-ративных процессах при сне. [c.36]
Роль РНК в биосинтезе белков. Многолетние исследования в самых различных направлениях привели к установлению решающей роли рибонуклеиновых кислот в процессах биосинтеза белка. Еще В. И. Палладии установил, что имеется непосредственная связь между содержанием в ткани нуклеотидов и интенсивностью синтеза в ней белков. Эти наблюдения были подтверждены и развиты Т. Касперсоном, Ж. Браше, Э. Гейлом и рядом других исследователей, которые на самых различных объектах показали, что интенсивность синтеза белка в клетках и тканях теснейшим образом связана с содержанием в них рибонуклеиновой кислоты. [c.276]
Результаты опыта Динциса представлены на фиг. 202, из которой видно, что удельное содержание в остатках лейцина в обеих цепях гемоглобина постепенно возрастает с увеличением расстояния между лейциновым остатком и аминоконцом цепи. Кроме того, этот эффект тем более выражен, чем короче период метки. Сравнение этих результатов со схемой, представленной на фиг. 201, показывает, что полипептидная цепь действительно растет ступенчатым образом и что рост полипептидной цепи начинается с аминоконцевой аминокислоты. Этот результат вскоре был подтвержден для синтеза других белков в клетках как прокариотов, так и эукариотов. В частности, можно показать, что построение полипептидных цепей Е. соН начинается с аминоконцевой аминокислоты и завершается карбо-ксиконцевой аминокислотой. [c.408]
Главным компонентом актиновых нитей является актин. Актин был открыт в 1948 г. Б. Штраубом (Венгрия) и назван так из-за своей способности к активации гидролиза АТФ. Актин — один из самых распространенных белков в клетках растительных и животных организмов. Актин (содержание в миофибриллах достигает 25 %) представляет собой глобулярный белок с молекулярной массой около 46 ООО и диаметром глобулы [c.478]
Уменьшение содержания белка в клетках бактерий сопровождается накоплением в них безазотистых продуктов синтеза — липидных веЕчеств и углеводов. Очевидно, количество и активность ферментных систем, ответственных за синтез углеводов или липидов, увеличивается в различной степени в зависимости от условий культивирования и генотипических особенностей исследуемого штамма. При азотном голодании направленность биосинтеза у бактерий А. eutrophus Z-1 изменяется в сторону преимущественного накопления в клетках вещества липидной природы — поли-Р-оксимасляной кислоты. Как установлено, при отсутствии азота в среде через 12 ч содержание полимера в клетках возрастает от 0,6 до 11,3% (см. табл. 7). Синтез углеводов у водородных бактерий выражен в меньшей [c.69]
Помимо азота исследовано влияние нескольких основных минеральных элементов (серы, фосфора, калия, магния) на рост и биохимический состав водородных бактерий А. eutrophus Z-1. Опыты показали, что исключение любого минерального элемента из состава питательной среды не вызывает немедленного прекращения роста бактерий, но приводит к его замедлению (рис. 33). По степени влияния на скорость роста водородных бактерий минеральные элементы можно расположить в следующем порядке калий, фосфор, сера, магний. За время остаточ-ного роста биохимический состав биомассы бактерий трансформируется (см. табл. 7). Установлено, что в клетках Л. eutrophus Z-1 при исключении из питательной среды любого из исследуемых биогенных элементов ограничивается белковый синтез. Содержание белка в биомассе, полученной на среде без фосфора, уменьшается в 1,4 раза, без серы и магния — в 1,3 раза. При этом количество РНК также уменьшается. Концентрация белков в клетках сокращается в результате репрессии синтеза большинства аминокислот. Однако эти изменения носят количественный характер, так как весь набор аминокислот в белке сохраняется. Несмотря на отсутствие биогенных элементов в среде, при сохранении остальных параметров роста на, уровне оптимальных клетки некоторое время продолжают ассимилировать углерод. Однако из-за отсутствия условий для [c.72]
II адепозинтрифосфат (АТФ). Существенно подчеркнуть, что оба эти соединения клетка использует для многих целей и синтез гистидина — только одна из них. Первый фермент, участвующий в биосинтезе гистидина, связывает эти два промежуточных продукта, при этом образуется фосфорибозил-АТФ, которьш, претерпевая серию преобразований с участием восьми других ферментов, в 1 онце концов превращается в гистидип. Следовательно, для того чтобы синтезировать гистидин, S. typhimurium должна израсходовать значительную часть энергии и питательных веществ па синтез не менее девяти различных белков содержание этих белков может доходить до нескольких процентов от общего белка клетки, а для каких-либо других целей они пе используются. Если S. typhimurium будет получать из окружающей среды достаточное коли- [c.53]
На основании предлагаемого механизма нетрудно представить, что активность того или иного процесса в клетке опосредованно зависит от концентрации подходящего лиганда последний не только способствует при определенных концентрациях сближению рецептора и антирецептора в мембране, но и на конкурентных началах регулирует взаимодействие рецептора II антирецептора. В случае ауторегуляции биосинтеза белка, секретируемого клеткой во внешнюю среду, процесс его синтеза приобретет пульсирующий характер, причем колебания скорости процесса будут коррелировать с колебаниями в содержании поступившего во внешнюю среду белка и доступностью для пего соответствующих рецепторов. В пользу этого свидетельствуют данные экспериментов, результаты которых приведены па рис. 23. [c.95]
Белки имеют характерные спектры флуоресцешщи в ультрафиолетовой и видимой области. Пропорщюналь-ность интенсивности флуоресценции при определенных условиях содержанию белка в клетках является теоретической предпосылкой возможности количественной оценки. Однако практическому применению этого метода мешают трудности дифференцирования отдельных белков и разграничения бежов и ведущих себя сходным образом нуклеиновых кислот. Кроме того, такую же флуоресценцию дают связанные нуклеотиды (например, АТФ, АДФ). [c.316]
ЮТ конститутивными. Концентрация таких белков в клетке определяется полупериодом жизни мРНК, скоростью трансляции и стабильностью самих белков. Белки, содержание которых может регулироваться путем изменения активности генов, называют индуцибель-ными. [c.57]
Фенотипические признаки клеток разных типов, а также одной и той же клетки в различных условиях зависят от количества и свойств продуцируемых ими структурных, каталитических и регуляторных белков. Регулироваться может какой-то ОДИН или несколько отдельных этапов считывания генетической информации при синтезе белка. У бактерий, например у Е. соН, образование белков регулируется главным образом содержанием мРНК, доступной для трансляции. Дополнительный способ поддержания нужной концентрации клеточных белков состоит в регуляции различных этапов трансляции, а также скорости деградации белков. Эукариотические клетки обладают более сложными механизмами регуляции белкового состава. Содержание мРНК в цитоплазме регулируется не только на уровне инициации транскрипции в ядре, но и на уровне процессинга первичных транскриптов и транспорта зрелых РНК в цитоплазму. Подобно прокариотам, эукариотические клетки тоже могут регулировать как трансляцию, так и скорость транспорта и деградации белков. [c.172]
Белок — важная составляющая каждой клетки нашего организма.
Человек нуждается в наборе конкретных пищевых веществ – белков, жиров, углеводов, витаминов, минеральных веществ. Белки – это органические вещества животного и растительного происхождения, которые обеспечивают поддержку клеток человеческого организма. Их основным элементом являются многочисленные аминокислоты.
Белки называют пищей роста. Они представляют собой как бы каркас, который обеспечивает структурными элементами каждую клетку тела. Белки ответственны за рост, восстановление и замену тканей. Белки – единственный питательный элемент, который может сам себя дублировать. Ткани растут за счёт нагромождения друг на друга миллионов белковых молекул, пока каждый орган не достигнет своего полного развития, после чего, они заменяются новыми.
Белок можно сравнить с длинным жемчужным ожерельем, где каждая жемчужинка – это аминокислота, маленькая частичка белка.
Весьма популярна такая неправильная концепция питания: если питательное вещество полезно, то его должно быть много! Это заблуждение. Организму необходимо определённое количество каждого жизненно важного питательного вещества; если его мало – организм не может функционировать нормально, если слишком много – это дополнительная нагрузка для него. То же относится и к белкам. При избыточном поступлении белка организм начинает работать с нагрузкой, стараясь распределить калории. Человек расплачивается за это неправильным обменом веществ.
Белок также способствует более медленному подъему и падению уровня сахара и инсулина в крови, поэтому Вы можете избежать «скачков сахара» после того, как поели сладостей без соответствующего количества белка.
При недостаточном количестве белка в пище снижается работоспособность человека и сопротивляемость его организма к инфекционным заболеваниям. Наиболее выразительные признаки дефицита белка в организме — это потеря памяти и ослабле¬ние умственных возможностей, потеря сопротивляемости организма, образование целлюлита, исчезновение женского физиологического цикла или нарушение его нормального протекания.
Организму требуется 22 вида аминокислот, из них только 13 видов он может синтезировать сам. Остальные же 9 аминокислот, называемых незаменимыми, он должен получать с продуктами питания. Белки, содержащие все 9 незаменимых аминокислот, называются полноценными. Мясо, рыба, куры, яйца, молочные продукты, – вот главные источники полноценных белков. Овощи, крупы, злаковые и особенно бобовые (сухой горох, соя, чечевица, бобы) – отличные источники белков, называемых неполноценными, поскольку в них содержатся многие, но не все аминокислоты, в разных соотношениях.
Сбалансированное питание – это получение организмом всего набора незаменимых аминокислот вследствие сочетания овощей, злаковых, молочных и мясных продуктов.
Вот перечень продуктов – источников белка, в убывающей последовательности:
Список литературы
Версия для печати
|
|
На главную / Новости / Определение содержания остаточных протеинов клеток-хозяев в терапевтических препаратах на основе протеинов и антител 02.11.2019
Фильтр
Цена
|
|||||||||
Российские учёные открыли новый белок, спасающий клетки от гибели
Российские биохимики совершили открытие, которое поможет в борьбе с онкозаболеваниями и, возможно, приблизит создание новых омолаживающих средств.
Команда под руководством заведующей кафедрой химии природных соединений химического факультета МГУ академика Ольги Донцовой обнаружила новое свойство теломеразной РНК. Это один из ключевых компонентов клеточного фермента — теломеразы. Оказалось, теломеразная РНК кодирует белок, помогающий клеткам человека сопротивляться стрессу.
В последние годы всё больше внимания уделяется исследованию процессов старения и созданию новых методов омоложения человеческого организма. Специалисты, которые работают в этом направлении, стремятся как можно подробнее изучить механизмы клеточного деления и способности клеток противостоять стрессовым воздействиям. Последние могут быть вызваны различными видами излучения, токсичными веществами или недостаточным питанием клетки.
Большинство клеток, как известно, способно делиться только ограниченное количество раз, поскольку концевые участки ДНК, удваивающиеся при каждом акте деления, с каждым таким актом теряют повторяющиеся участки — теломеры. Как только их количество становится критически малым, дальнейшее деление уже невозможно, и клетка погибает.
Однако науке также известны клетки, способные к практически неограниченному делению. Такой «суперспособностью» обладают эмбриональные клетки, а также (в случае зрелого организма) стволовые и раковые клетки. Дело в том, что в их ядрах активен особый фермент — теломераза, которая достраивает теломеры на концах ДНК и таким способом увеличивает количество циклов деления.
До недавнего времени считалось, что теломеразная РНК является некодирующей, то есть не участвует в синтезе белка в клетке.
Однако в ходе новой работы российские исследователи выявили альтернативную роль теломеразной РНК в соматических клетках человека. Она присутствует в их цитоплазме в неактивной форме и не может участвовать в наращивании теломерной ДНК. Но при этом повышение содержания теломеразной РНК в клетках влияет на их стрессоустойчивость.
Эксперименты показали, что теломеразная РНК всё-таки является кодирующей, в частности, она кодирует синтез белка под названием hTERP. При помощи иммуноблоттинга (высокочувствительный метод выявления белков), иммунофлуоресцентной микроскопии и масс-спектрометрии исследователи доказали, что этот белок присутствует в клетках и состоит из 121 аминокислоты.
Биохимики искусственно повышали содержание этого белка в клетках, а затем обрабатывали их веществами, повреждающими ДНК. Оказалось, что белок hTERP защищает клетки от гибели в результате апоптоза (распада на отдельные тельца, ограниченные мембраной), который развивается в ответ на повреждения ДНК.
Дальнейшие исследования показали, что белок hTERP участвует в модуляции так называемой аутофагии. Это процесс, при котором клетка переваривает свою часть, «пришедшую в негодность», но выживает. (К слову, за изучение «самоедства» клеток японский учёный Ёсинори Осуми получил в 2016 году Нобелевскую премию по физиологии и медицине.)
Авторы работы уточняют, что изучение аутофагии имеет прикладное значение в исследовании механизмов омоложения организма при помощи радикальных диет. Считается, что клетки, ограниченные в питании, утилизируют собственные белки, в которых со временем накапливается всё больше дефектов.
Другой не менее важный аспект исследования механизмов аутофагии затрагивает её роль в опухолеобразовании. Учёные полагают, что на ранних этапах этого процесса аутофагия снижает риск возникновения опухоли, но по мере прогрессирования болезни тот же механизм способствует выживанию раковых клеток в различных стрессовых условиях.
«Открытие нового белка интересно тем, что он найден в РНК, которая раньше считалась некодирующей. Её очень активно при этом исследуют как компонент теломеразы. Мы открыли, что она может иметь и другую функцию, если находится не в ядре клетки, а в её цитоплазме. Изучение всех свойств теломеразы может приблизить учёных к созданию «эликсира молодости» и содействовать борьбе с раковыми заболеваниями», — заключает соавтор работы, доцент химического факультета МГУ Мария Рубцова.
Научная статья по итогам исследования опубликована в журнале Nucleic Acids Research.
Напомним, ранее авторы проекта «Вести.Наука» (nauka.vesti.ru) рассказывали о том, как удлинение теломер в клетках человека обратило процесс старения вспять.
Приложение — Коммерсантъ Наука (117996)
Рис. 1. Доказательство наличия белка hTERP в клетках, содержащих теломеразную РНК методами иммуноблоттинга и флуоресцентной микроскопии. Красным показан белок hTERP, синим — ядра клеток
Фото: Пресс-служба «Химический факультет МГУ»
Химики из Московского государственного университета обнаружили новое свойство теломеразной РНК. Это один из ключевых компонентов клеточного фермента — теломеразы. Оказалось, теломеразная РНК кодирует белок, помогающий клеткам человека сопротивляться стрессу. Открытие биохимиков поможет в борьбе с онкозаболеваниями и, возможно, приблизит создание эффективных омолаживающих средств.
Исследования, посвященные борьбе со старением человеческого организма, всегда привлекали ученых, но в последнее время в этой области случаются гигантские прорывы. Сейчас это направление тесно связано с изучением механизма клеточного деления и способности клеток противостоять стрессовым воздействиям. Например, противостоять воздействую различных видов излучения и токсинов или недостатку поступающих в нее питательных веществ.
Большинство клеток способно делиться только ограниченное количество раз. Ограничение возникает потому, что молекула ДНК при каждом акте деления клетки теряет расположенные на ее концах повторяющиеся участки — теломеры. Как только количество повторов на конце ДНК становится критически малым, дальнейшее деление становится невозможным, и клетка погибает.
Теломераза умеет кодировать
Однако науке давно известны клетки, способные к неограниченному делению. Прежде всего эмбриональные. А в случае зрелого организма такая способность есть у стволовых и раковых клеток. Как показали исследования, в ядрах перечисленных клеток активен особый фермент — теломераза, которая достраивает теломеры на концах ДНК и таким способом неограниченно увеличивает число циклов деления клетки.
До недавнего времени считалось, что входящая в состав теломеразы теломеразная РНК является некодирующей, то есть работает только как фермент при построении теломер, но никак не участвует в синтезе белков в клетке. Но группе ученых химического факультета МГУ под руководством доктора химических наук, профессора, академика РАН Ольги Донцовой удалось показать альтернативную роль теломеразной РНК в соматических клетках человека. В цитоплазме она действительно присутствует в неактивной форме и не может участвовать в наращивании теломерной ДНК, однако теломеразная РНК все-таки кодирует синтез белка (hTERP). Доказательства существования белка, кодируемого теломеразной РНК человека в клетках, получены благодаря сотрудничеству с академиком Вадимом Говоруном (ФГБУ ФНКЦ ФХМ ФМБА России), под чьим руководством были выполнены ключевые эксперименты по идентификации изучаемого белка методами масс-спектрометрии.
Биохимики искусственно повышали содержание этого белка в клетках, а затем обрабатывали их веществами, повреждающими ДНК. Оказалось, что hTERP защищает клетки от гибели в результате апоптоза (то есть распада на отдельные тельца, ограниченные мембраной), развивающегося в ответ на повреждения ДНК.
Дальнейшие исследования позволили обнаружить, что hTERP участвует в модуляции так называемой аутофагии — в этом случае клетка переваривает свою часть, «пришедшую в негодность», но выживает.
Изучение аутофагии имеет прикладное значение в исследовании механизмов омоложения организма при помощи радикальных диет: считается, что клетки, ограниченные в питании, утилизируют собственные белки, в которых со временем присутствует все больше дефектов. Другой, не менее важный аспект исследования механизмов аутофагии затрагивает ее роль в опухолеобразовании. Считается, что на ранних этапах этого процесса аутофагия снижает риск возникновения опухоли, но по мере прогрессии опухолеобразования тот же механизм способствует выживанию раковых клеток в различных стрессовых условиях.
Ученые надеются, что их открытие существенно изменит представление о роли теломеразной РНК в функционировании клеток.
«Белков, защищающих клетки от стрессовых воздействий, достаточно много,— пояснила один из авторов работы доцент химического факультета МГУ имени Ломоносова, кандидат химических наук Мария Рубцова.— Открытие нового белка интересно именно тем, что он найден в РНК, которая раньше считалась некодирующей. Ее очень активно исследуют как компонент теломеразы. Мы открыли, что она может иметь и другую функцию, если находится не в ядре клетки, а в ее цитоплазме. Изучение всех свойств теломеразы может приблизить ученых к созданию «эликсира молодости» и содействовать в борьбе с раковыми заболеваниями».
Как отмечают исследователи, альтернативную роль теломеразной РНК в соматических клетках человека удалось показать благодаря использованию оборудования, полученного в рамках программы развития МГУ. Применяя сортер клеток, биохимики получали необходимые клеточные линии (в частности, при помощи методов редактирования генома). А белок в клетках локализовывали, применяя современные флуоресцентные микроскопы.
Большую роль в проведении работы сыграло сотрудничество научной школы Ольги Донцовой с крупнейшими институтами РАН, где биохимикам помогали создавать клеточные линии, и Сколковским институтом науки и технологий, оказавшим бесценную помощь в разработке методов иммуноблоттинга. Отдельную благодарность ученые МГУ выражают грантовым агентствам — Российскому научному фонду и Российскому фонду фундаментальных исследований за финансовую поддержку.
Результаты исследования опубликованы в журнале Nucleic Acids Research.
Ольга Якубова, химический факультет МГУ им. М. В. Ломоносова
Перенос рекомбинантных нуклеиновых кислот в клетки (трансфекция) с помощью гистонов и других ядерных белков
В последнее время перспективным подходом в невирусном переносе генов стала доставка генов посредством белков (protein/peptide-mediated gene delivery). В предыдущих исследованиях было показано, что гистонные и другие ядерные белки могут служить эффективными векторами для переноса генов в клетки. Трансфекция эукариотических клеток комплексами нуклеиновых кислот с гистонами (гистонофекция) эффективно проходит с различными представителями семейства гистонных белков. Наличие ДНК-связывающих доменов и специфических сигнальных последовательностей ядерной локализации позволяет применять гистоны (Н1/Н5, Н2А, Н2В, Н3, Н4) и другие ядерные белки (такие, как белки семейства HMG и гистоноподобные прокариотические белки) для переноса рекомбинантных генов. Положительный заряд молекул гистонных белков способствует электростатическому взаимодействию с отрицательно заряженными молекулами нуклеиновых кислот и нейтрализации зарядов, что позволяет комплексам преодолевать отрицательно заряженную клеточную мембрану. Таким образом, гистонофекция является перспективным методом для невирусного переноса рекомбинантных нуклеиновых кислот при генной терапии.
Разработка эффективных систем доставки генов – одна из основных задач генной терапии. Технологии доставки генов значительно продвинулись в последние годы. Однако возникают проблемы доставки генов, связанные с низкой эффективностью, высокой стоимостью и трудоёмкостью подготовки векторов. Остаются нерешенными вопросы токсичности, иммуногенности, онкогенности векторов и кратковременности экспрессии трансгенов.
Системы доставки генов могут быть условно разделены на две группы: вирусные и невирусные. Вирусные системы основаны на применении рекомбинантных вирусов (ретровирусы, аденовирусы, адено-ассоциированные вирусы и др.), полученных с помощью генной инженерии и оптимизированных для переноса генов [1–2]. Основные преимущества вирусных систем – высокая эффективность генетической модификации и длительность экспрессии трансгенов. Однако клиническое применение вирусных векторов ограничено их иммуногенностью и онкогенностью. В последнее время большие усилия были сосредоточены на разработке систем невирусной доставки генов: физические (электропорация, соникация, генные пушки и т.д.), химические (липоплексы, полиплексы, катионные наночастицы и т.д.), «голые» генетические конструкции (плазмиды, олигонуклеотиды и т.д.) [3].
Одним из направлений развития полиплексных систем доставки нуклеиновых кислот (трансфекции) – применение катионных пептидов и белков в качестве генетических векторов [4–9]. К преимуществам использования пептидов и белков для доставки генов относят: простоту производства и использования рекомбинантных белков, высокую чистоту и однородность, способность направленного транспорта полиплексов (комплексы ДНК-белок) в определённые типы клеток за счёт специфичных лиганд-рецепторных взаимодействий, а также отсутствие ограничений на размер и тип доставляемой в клетки нуклеиновой кислоты.
Известно, что ядерные белки, такие как гистоны, конденсируют ДНК и могут быть использованы для трансфекции клеток [5, 10–11]. Гистоны – положительно заряженные белки, которые взаимодействуют с ДНК путём электростатических взаимодействий, являются основным компонентом хроматина. Существует два различных типа гистонов: линкерные (h2/Н5) и нуклеосомные (h3A, h3B, h4, h5) [12– 13]. Трансляция гистонов происходит в цитоплазме клеток, после чего гистонные белки транспортируются в ядро. У гистонов есть специфические сигнальные последовательности – сигналы ядерной локализации (NLS, от англ. nuclear localization signal), которые обеспечивают их проникновение в ядро [14]. Наличие NLS и значительный положительный заряд позволяет гистонам эффективно конденсировать и переносить рекомбинантные нуклеиновые кислоты.
Перенос рекомбинантных нуклеиновых кислот с помощью гистонов и других ядерных белков
Существуют различные методы невирусной доставки рекомбинантных генов для трансфекции культур клеток [2, 15]. Выбор системы доставки зависит от типа клетки и вида доставляемой биомолекулы (ДНК, РНК, белки). Некоторые типы клеток, в том числе широко используемые трансформированные «бессмертные» клеточные линии, могут быть трансфицированы многими коммерчески доступными трансфицирующими агентами, такими как Lipofectin® и Lipofectamine®. Другие типы клеток, например, первичные культуры клеток, трудно трансфицировать стандартными методами. Гистонные белки обладают естественной способностью связываться с ДНК, что делает их потенциальными векторами для биобезопасной и эффективной доставки биомолекул в клетки. Ещё в 1965 г. было показано, что гистоны и катионные полиамины, такие как поли-L-лизин, протамин и поли-L-орнитин, стимулируют поглощение альбумина опухолевыми клетками in vitro [16–18]. С развитием биомедицины способность гистонов переносить экзогенные белки и нуклеиновые кислоты в клетки стали рассматривать и в контексте использования в генной терапии.
Трансфекция с помощью линкерного гистона h2
Большинство невирусных методов доставки нуклеиновых кислот эффективны для трансформированных «бессмертных» культур клеток, однако недостаточно эффективны для трансфекции первичных культур. В связи с этим, остро встаёт вопрос поиска новых методов невирусной трансфекции различных культур клеток. Гистоны могут выступать доставщиками нуклеиновых кислот в первичные клеточные линии как самостоятельно, так и в комбинации с другими трансфекционными агентами.
Известно, что гистон h2 может использоваться для доставки ДНК во многие клеточные линии [19– 32]. Показана эффективная трансфекция гистоном h2 кардиомиоцитов, эндотелиальных клеток человека и первичных клеток крысы [21, 25, 27]. Гистон h2, выделенный из ядерного экстракта клеток тимуса телёнка, эффективен для трансфекции культур клеток in vitro, особенно в присутствии кальция хлорида и хлорохина [29]. Необходимость присутствия ионов кальция для доставки генов с помощью гистона h2 также показана и в других работах [19, 30]. Значительно повышало эффективность трансфекции использование гистона h2 в комбинации с DOSPER® (от англ. 1,3-Di-Oleoyloxy-2-(6-Carboxyspermyl)propylamid) – липосомным трансфекционным агентом для трансфекции первичных культур клеток [25]. V. Budker с соавт. (1997) показали, что гистон Н1 повышает эффективность трансфекции систем на основе амфифильных полиаминов [20]. Другие авторы показали, что гистон h2 может переносить ДНК, мРНК и малые интерферирующие РНК (миРНК) в трансформированные и первичные культуры клеток. Эффективность трансфекции была сопоставима или даже превосходила системы на основе липосом [31]. Для определения функциональных доменов гистона h2 человека, отвечающих за его основные функции, I. Puebla с соавт. (2003) с помощью методов генной инженерии создали различные усечённые варианты белка и исследовали их на способность конденсировать ДНК и трансфицировать трансформированные и первичные культуры клеток [31]. Фрагмент h2.4F, содержащий полный С-конец и фрагмент средней части гистона Н1 (387 нуклеотидов 3′-концевой последовательности кДНК гистона Н1 человека), показал наибольшую эффективность трансфекции. Это подтверждают другие исследования, в которых показано, что С-концевая часть гистона Н1 играет важную роль в конденсации ДНК [32]. Полипептид h2.4F способен доставлять как ДНК, так и РНК, что важно для создания векторной системы подавления экспрессии генов посредством механизма РНК-интерференции. Показано, что полипептид h2.4F менее токсичен для клеточных культур по сравнению с липосомными трансфекционными агентами [31].
H.J. Jung с соавт. (2008) показали, что рекомбинантный С-концевой пептид (h2C, 61 аминокислота) гистона h2 из золотой рыбки Carassius auratus способен конденсировать ДНК и защищать её от деградации. Полипептид h2C способен эффективно доставлять ДНК в клетки млекопитающих в отсутствии ионов кальция. При трансфекции клеточных линий (293Т человека и NIH/3T3 мыши) полипептидом h2C экспрессия репортерных генов lacz и egfp была в несколько раз выше, чем при трансфекции агентом Lipofectamine® [33].
Трансфекция с помощью нуклеосомных гистонов h3A, h3B, h4 и h5
D. Balicki с соавт. (1997) разработали метод генного переноса посредством гистона Н2А. Они показали, что в сравнении с другими гистонами h3A наиболее эффективен для трансфекции различных культур клеток [10]. N-концевой пептид гистона h3A, состоящий из 37 аминокислотных остатков, способен трансфицировать клетки in vitro. Авторы предположили, что Н2А конденсирует ДНК, образуя незаряженный комплекс, который проникает через плазматическую мембрану и доставляет ДНК в ядро [11]. Гистоны h2 и Н2А, видимо, трансфицируют клетки с помощью различных механизмов, так как удаление С-концевого фрагмента гистона Н2А незначительно сказывается на его трансфекцинной активности [11], а C-концевой фрагмент гистона h2 играет важную роль в h2-опосредованной трансфекции. Мутации или удаление N-концевой части гистона Н2А приводят к потере его трансфекционной активности [11].
H. Liu и I. Soderhall (2007) использовали гистон Н2А для доставки двуцепочечной РНК (дцРНК) в клетки кроветворной ткани американского сигнального рака, Pacifastacus leniusculus. Эффективность трансфекции гистона Н2А была выше, чем у трансфекционного агента Effectene® и липосомных систем доставки нуклеиновых кислот. Важно отметить, что высокая эффективность гистона Н2А сочетается с низкой токсичностью и специфичностью для трансфицированных клеток, выделенных из кроветворной ткани Pacifastacus leniusculus [34].
Было показано, что реконструированный хроматин в комплексе с гистонными белками h3B, оптимизированными для ядерной доставки, может использоваться в качестве эффективного средства доставки рекомбинантных нуклеиновых кислот в ядро клеток млекопитающих (клеточная линия MCF7), в результате чего повышается уровень экспрессии трансгена (более чем в 6 раз больше по сравнению с трансфекционным реагентом Lipofectamine®) [35].
K.M. Wagstaff с соавт. (2007) показали, что гистон h3B эффективно доставляет ДНК посредством гистон-опосредованной трансдукции (HMT, от англ. Histone-Mediated Transduction) в различные клеточные линии. Эффективность трансфекции гистона Н2В в 2,5 раза выше, чем у коммерческих липосомных агентов. Эффективность трансфекции увеличивалась при использовании димера гистонов Н2А и h3B, содержащего два домена белковой трансдукции (PTD, от англ. protein transduction domains) [36].
В работах I. Demirhan и O. Hasselmayer с соавт. (1998, 2001) исследована эффективность комбинирования гистонофекции и липофекции для доставки генов в клетки, найдены оптимальные соотношения ДНК-липидов-гистонов [28, 37]. Авторы показали, что наибольшая эффективность генной трансфекции наблюдается с гистонами Н3 и Н4, однако в отличие от результатов, полученных D. Balicki с соавт., гистон Н2А не способен к трансфекции клеток. Комплексообразование имеет решающее значение для трансфекции, и различие между результатами этих двух групп возможно из-за различных типов линий клеток-мишеней, условий трансфекции, источника и чистоты препаратов гистонных белков [10]. Интересно, что перенос гена, опосредованный гистонами h4 и h5 [28], не зависит от дополнительных кофакторов, таких как кальция хлорид и хлорохин, которые играли важную роль в экспериментах с гистоном Н2А [10–11].
Для экспрессии трансгена важна внутриядерная локализация плазмидной ДНК. В работе H. Kamiya с соавт. (2010) гистонные белки использовались для доставки плазмидной ДНК (pYK-CMV-luc) в клетки линии HeLa. Однако авторы показали, что комплексы гистона h4 с плазмидной ДНК обладали более низкой транскрипционной активностью. Это, по-видимому, связано с высокой стабильностью нуклеопротеинового комплекса, что предотвращало взаимодействие плазмидной ДНК с транскрипционным аппаратом клетки [38].
Трансфекция с помощью гистоноподобных белков и пептидов неэукариотического происхождения
Гистоноподобные белки и пептиды неэукариотического происхождения также могут служить векторами для трансфекции. Показано, что гистоноподобный белок архебактерий HPhA (от англ. archaeal histone-like protein-based) из Pyrococcus horikoshii штамма OT3 может образовывать стабильные нековалентные комплексы с нуклеиновыми кислотами и улучшает их доставку в различные типы клеточных культур [39]. Эффективность трансфекции при этом зависит от соотношения HPhA к ДНК, времени инкубации и добавления кальция хлорида. Важно, что цитотоксичность HPhA ниже, чем у липосомных трансфекционных агентов. В других исследованиях авторы использовали белок HPhA в качестве вектора для доставки гена p53 (опухолевый супрессор). Уровень экспрессии и активности гена p53 оценивали in vitro и in vivo. Было показано, что HPhA, по сравнению с трансфекционным агентом Lipofectamine®, повышает эффективность доставки гена р53 и его противоопухолевую активность [40]. Белок HPhA способен защищать нуклеиновые кислоты от действия нуклеаз, что важно для сохранения функциональной активности трансгенов [39].
Другие исследования показали, что гистоноподобный белок TmHU (от англ. heat unstable) из термофильных бактерий Thermotoga maritima может также выступать вектором для трансфекции ДНК в различные эукариотические клетки. Белок HU чрезвычайно стабилен, и его можно выделять из рекомбинантного штамма Escherichia coli. Белок TmHU может повышать эффективность других методов трансфекции, например липофекции, а также защищать ДНК от деградации и термической денатурации [41]. Как и гистоны, TmHU содержит NLS, которые обеспечивают его проникновение в ядро эукариотических клеток [41]. Также показано, что предварительная конденсация ДНК гистоноподобным белком HU из микоплазмы Acholeplasma laidlawii в 2–4 раза увеличивает эффективность трансфекции эукариотических клеток (клеточная линия HEK293) [42]. Эффективность трансфекции оценивали с помощью конфокальной флуоресцентной микроскопии по интенсивности флуоресценции маркерного белка GFP в клетках.
Трансфекция с помощью негистонных ядерных белков
Описано применение белков группы высокой подвижности HMGs (от англ. high-mobility group) в качестве невирусных генных векторов in vitro и in vivo [43–49]. HMGs – группа ядерных хромосомных белков, участвующих в «упаковке» хроматина и процессах транскрипции, репликации, рекомбинации и репарации [50]. Эти белки описаны в начале 1970-х годов [51] как группа негистоновых белков. HMGs подразделяются на 3 группы: HMGB (HMG-1/2), HMGN (HMG-14/-17) и HMGA (HMG-I/Y/ C). В 1988 г. M. Bottger с соавт. обнаружили способность белка HMG1 к конденсации ДНК и её доставке в L-клетки мыши [47]. Эффективность трансфекции была выше, чем при использовании кальций фосфатного метода. Y. Kaneda с соавт. (1989, 1991) разработали векторную систему на основе везикулярных комплексов, полученных инкубацией ДНК-содержащих липосом с вирусом HVJ (вирус Сендая) и мембраной эритроцитов, содержащей белок HMG1 [43, 44]. Авторы показали, что эффективность трансфекции комплексами, содержащими HMG1, в 10 раз выше, чем комплексами с бычьим сывороточным альбумином (БСА). S.V. Zaitsev с соавт. (1997) показали трансфекционную активность белка HMG17 в различных клеточных линиях [27]. Для эффективной трансфекции необходимо присутствие в среде ионов кальция в низкой концентрации. Эффективность трансфекции с помощью белка HMG17 была ниже, чем с использованием гистона Н1 и трансфекционного агента Lipofectamine®.
A.R. Mistry с соавт. (1997) показали способность белка HMG1 к доставке ДНК в клетки линии Caco-2 [49]. Эффективность трансфекции HMG1 была выше, чем у кальций фосфатного метода, однако ниже, чем у трансфекционного агента Lipofectin®. Важно, что комплексы белка HMG1-ДНК не токсичны для культивируемых клеток даже при высоких концентрациях.
Безопасность доставки рекомбинантных нуклеиновых кислот с помощью гистонных и других ядерных белков
Одно из основных препятствий использования невирусных систем доставки генов – их токсичность для клеток. Проводятся исследования токсичности невирусных трансфекционных агентов in vitro и in vivo [15, 52–53], однако точный механизм, лежащий в основе их токсичности, по-прежнему не найден. Было показано, что системы доставки ДНК, основанные на использовании катионных липидов, влияют на морфологию и жизнеспособность клеток. Микроскопическое исследование клеток, обработанных трансфекционными агентами на основе липосом, такими как Lipofectin® или Lipofectamine®, показало морфологические изменения, разрушения клеток и снижение их жизнеспособности [54–56].
Важная особенность гистонных белков – их низкая цитотоксичность. I. Puebla с соавт. показали, что гистон h2 менее токсичен, чем трансфекционные агенты на основе липосом [31]. Другие авторы также показали отсутствие токсичности гистона h2 и гистоноподобных белков [20, 27, 39].
Одним из недостатков использования гистонов в качестве векторов для генной терапии – способность вызывать иммунный ответ. Антитела к гистонам найдены при заболевании Либмана – Сакса (системная красная волчанка, СКВ) [57]. Показано, что гистоны h2 и h3B могут служить сильными иммуногенами при СКВ [58]. Также показано, что гистоны индуцируют иммунный ответ при введении их животным. Например, введение гистонов Н2А, h3B, h4 и h5 представителей рода Leishmania (паразитические протозоа, возбудители лейшманиоза) мышам вызывает специфический Th2 (клеточный) иммунный ответ и подавление Th3 (гуморального) иммунного ответа [59]. Таким образом, доставка генов с помощью гистонов должна применяться в четко определенных ситуациях, при которых возможно использование полезных свойств гистонов и ограничиваются их побочные эффекты.
Другой подход к минимизации иммуногенности гистонов – ограничение размера гистонных полипептидов, не затрагивающее их трансфекционного потенциала. D. Balicki с соавт. (2002) показали, что 37-мер N-концевой пептид гистона Н2А может эффективно трансфицировать клетки нейробластомы мыши NXS2, не вызывая токсического эффекта [11]. I. Puebla с соавт. для трансфекции использовали усечённые фрагменты гистона h2 различных размеров [31]. С-концевой фрагмент, составляющий одну треть от молекулы гистона h2, трансфицировал различные клетки млекопитающих с минимальной токсичностью. Предположительно, короткие пептиды имеют низкую токсичность и низкую иммуногенность. L. Collins с соавт. (2001, 2003) показали, что синтетический пептид полилизин-молоссин (от англ. polylysine-molossin), состоящий из 31 аминокислоты, является эффективным вектором для доставки генов [60, 61]. Исследования in vivo показали его низкую токсичность и иммуногенность.
Еще одно ограничение использования гистонов для доставки генов – быстрое выведение их из крови, что приводит к снижению их эффективности. Для повышения стабильности пептидов и белков их используют в сочетании с химическими полимерами и наночастицами. V.P. Torchilin и A.N. Lukyanov (2003) описали ряд таких полимеров и наночастиц, их характеристики и использование в доклинических и клинических исследованиях [62].
Гистоноподобные и негистонные ядерные белки практически не токсичны для различных клеточных линий [27, 39, 41, 43–44]. Было показано, что гистоноподобный белок HPhA из Pyrococcus horikoshii в 10 раз менее токсичен для клеток линий NIH 3T3 и HL-7702 по сравнению с трансфекционным агентом Lipofectamine®, который даже в низких концентрациях приводил к гибели клеток [39]. Белок TmHU также показал в 10 раз меньшую токсичность на клетках линии 293T по сравнению с трансфекционным агентом Lipofectamine® [41]. Везикулярные комплексы, содержащие белок HMG1, эффективно трансфицируют клетки линии LLC-MKz (клетки почки обезьяны) без токсического эффекта для них [43, 44]. Показано, что белок HMG17 менее токсичен для различных клеточных линий в отличие от липосомных агентов [27].
Обобщенные данные по применению гистонных, гистоноподобных и негистонных белков в качестве трансфекционных векторов представлены в таблице.
Механизм доставки рекомбинантных нуклеиновых кислот с помощью гистонов
Поры в ядерной мембране имеют размер 24 нм, что считается главным препятствием для внутриядерного проникновения комплексов плазмидной ДНК с катионными носителями [4]. Большие белки или комплексы пептида-ДНК транспортируются к ядру активным транспортом посредством «узнавания» последовательностей NLS. Один из подходов для генного переноса заключается в электростатическом связывании рекомбинантных нуклеиновых кислот с белками и полипептидами, содержащими последовательности NLS [63–65]. Кроме того, NLS-пептиды можно ковалентно конъюгировать с ДНК [66]. Инъекции плазмидной ДНК, ковалентно связанной с NLS-пептидом, в цитоплазму эмбриона Danio rerio (англ. zebrafish) приводит к ядерному транспорту в 50–100 раз выше по сравнению с немодифицированной «голой» плазмидной ДНК [67]. M.A. Zanta с соавт. (1999) показали, что NLSпептиды , ковалентно связанные с плазмидной ДНК, могут повышать эффективность трансфекции in vitro в 100 раз [66]. Четыре нуклеосомных гистона Н2А, h3B, h4 и h5 транспортируются из цитоплазмы в ядро по NLS-зависимому пути [68, 69]. У гистона Н1 нет канонических последовательностей NLS. Его ядерный транспорт, по-видимому, связан с положительно заряженным С-концевым доменом. Тем не менее, NLS последовательности остальных гистонов показывают некоторое сходство с NLS полиомавируса SV40 (от англ. Simian vacuolating virus 40) большого Т-антигена и расположены в N-концевой области [70]. Включение NLS последовательности SV40 большого Т-антигена в химерный гистон h2 повышало эффективность ядерного транспорта [21]. D. Balicki с соавт. создали несколько усечённых полипептидов, охватывающих все участки гистона Н2А, и оценили их способность к переносу чужеродной ДНК в клетки COS7 [11]. Высокую эффективность трансфекции показали N-концевые пептиды (первые 37 аминокислот гистона Н2А), содержащие NLS последовательности. Ядерная мембрана – барьер для прохождения ДНК к ядру, поэтому митотические стимулы повышают эффективность стандартных методов трансфекции [71]. При разработке трансфекционных реагентов для использования in vivo проблема ядерного транспорта встаёт особенно остро, так как большинство клеток-мишеней являются непролиферирующими. Существующие системы доставки генов полагаются на ковалентное или не ковалентное связывание NLS пептидов чужеродных белков, таких как SV40 большой Т-антиген. Гистоны могут стать естественным альтернативным подходом для преодоления барьера ядерной мембраны.
Анализ базы данных нуклеотидных последовательностей генов гистонов человека и мыши показывает, что каждый тип гистонных белков состоит из нескольких подтипов. Первоначальные эксперименты по применению гистонов в качестве трансфекционных агентов основывались на применении гетерогенных смесей гистонных белков из ядерных экстрактов, что затрудняло идентификацию наиболее эффективного белка для переноса нуклеиновых кислот. D. Balicki с соавт. предположили, что эффективность доставки ДНК гистоном Н2А объясняется 2 механизмами: электростатическим связыванием с ДНК (конденсацией) и ядерным транспортом комплексов гистонов Н2А-ДНК посредством NLS последовательностей белка [11]. Мутации положительно заряженных остатков N-концевого домена Н2А приводят к снижению трансфекционной активности, что подчеркивает важность сохранения целостности α-спиральной структуры N-концевой области гистонов Н2А.
Транспорт комплексов ДНК-гистоны через плазматическую мембрану клеток – не единственный фактор высокой трансфекционной активности гистонов. Перенос через плазматическую мембрану осуществляют и другие трансфекционные агенты, такие как поли-L-лизин, Lipofectamine® и полиэтиленимин [72, 73]. Однако преимущество гистонов заключается в том, что они остаются в комплексе с ДНК после проникновения в цитоплазму, участвуют в активном транспорте комплексов ДНК-гистон в ядро, где ДНК участвует в процессах транскрипции [11].
Понимание механизмов взаимодействия с клеточной поверхностью и проникновения внутрь клетки через плазматическую мембрану имеет большое значение для разработки эффективных систем переноса генов. Известно, что белки, пептиды, вирусы и ДНКбелковые комплексы проникают в клетки млекопитающих с помощью процесса рецептор-опосредованного эндоцитоза [74–77]. Кроме того, проникновение макромолекул в клетки может проходить по пути клатрин-независимого эндоцитоза, в том числе с помощью фагоцитоза, макропиноцитоза и кавеолярных везикул [78–80]. Ряд исследований показал, что некоторые пептиды способны пересекать мембрану клетки без участия эндоцитозного механизма [81]. Общее свойство всех гистонов, поли-L-лизина и поли-L-аргинина – высокое содержание положительно заряженных аминокислотных остатков (Arg и Lys). При физиологическом рН эти молекулы положительно заряжены и, следовательно, вряд ли могут пассивно диффундировать через липидный бислой. Существует распространённая гипотеза, что проникновение комплексов ДНК-переносчик происходит в клетках через эндоцитозный путь [82–83]. I. Kopatz с соавт. (2004) предложили новую модель для клеточного проникновения ДНК с участием протеогликанов как рецепторов ДНК-комплексов [84].
В литературе существуют противоречивые данные о механизмах проникновения комплексов нуклеиновых кислот с гистонами в клетки (рис.). E. HaritonGazal с соавт. (2003) экспериментально продемонстрировали, что гистоны h2, Н2А, h3B, h4 и h5 непосредственно проходят через плазматическую мембрану клеток HeLa and Colo-205 с помощью пассивной диффузии [85]. Было показано, что интернализация гистонов в этих клетках происходит при низкой температуре, недостатке АТФ (аденозинтрифосфат) и высокой молярности сахарозы, что блокирует процесс эндоцитоза. Кавеол-опосредованный эндоцитоз и фагоцитоз не могут участвовать в интернализации гистонов, так как применение специфических ингибиторов этих механизмов не влияет на скорость поглощения гистонов [85, 86]. Проникновение нуклеосомных гистонов h3A, h3B, h4 и h5, не связанное с эндоцитозом, показано на примере растительных клеток и протопластов [87, 88]. В этом случае поглощение гистонов проходило при 4 °С и не ингибировалось блокаторами эндоцитоза. Используя гистоны, меченые биотинилированием, и ИФА-системы, J. Rosenbluh с соавт. (2005) установили, что гистоны Н2А, Н3 и Н4 могут проходить через липидный бислой больших однослойных или многослойных липосом [89]. В отличие от Н2А, h4, h5, гистон h3B не мог проникать в липосомы.
Однако участие эндоцитоза в прохождении гистонов в комплексе с ДНК в клетку не может быть абсолютно исключено. Действительно, хлорохин повышает активность трансфекции гистона h2 [21, 27]. Хлорохин, как известно, нейтрализует кислую рН эндоцитозных пузырьков, что снижает деградацию макромолекул эндосомальных везикул. Также было установлено, что хлорохин повышает рецепторопосредованный перенос генов – процесс, происходящий с помощью эндоцитоза.
Для определения механизма доставки комплексов гистона h2-ДНК внутрь клетки, S.V. Zaitsev с соавт. (2002) использовали в экспериментах флуоресцентно меченые ДНК и гистон h2 [19]. С помощью флуоресцентной микроскопии и иммунофлуоресценции авторы показали локализацию комплексов гистона h2-ДНК в эндосомах/лизосомах, что свидетельствует о поглощении трансфекционных комплексов с помощью эндоцитоза. Авторами также установлено, что ионы кальция контролируют реорганизацию трансфекционных комплексов в эндосомах/лизосомах и их высвобождение в цитозоле, что важно для экспрессии трансгенов, тогда как поглощение трансфекционных комплексов клетками не зависит от присутствия ионов кальция.
Гистоны могут участвовать в ядерном транспорте не только нуклеиновых кислот, но и других биомолекул. Например, показано, что ковалентное присоединение гистонов к БСА приводило к проникновению комплексов в клетки [85]. В отличие от проникновения в клетку неконъюгированных гистонов, эффективность прохождения комплексов гистона-БСА в клетку снижалась при снижении уровня АТФ в клетке или понижении температуры, что свидетельствует о том, что часть комплексов гистона-БСА проникает в клетку с помощью эндоцитоза.
Для анализа механизма проникновения гистона Н2В в клеточное ядро K.M. Wagstaff с соавт. (2007) создали димер GFP и трех различных частей гистона h3B: N-концевой хвост, который содержал консервативный стандартный NLS; глобулярный домен (неконсервативный), который отвечает за формирование октамера и связывание с ДНК; С-концевой хвост, который играет роль в поддержании структуры нуклеосомы. Было показано, что трансдукция зависит от N-концевого хвоста и глобулярного домена. При добавлении еще одного сигнала ядерной локализации к гистону h3B увеличивалась скорость его проникновения в клеточное ядро. Было показано, что гистоны в комплексе с ДНК проникают в ядро посредством трансдукции белков, а не эндоцитоза [36].
Комбинированные системы доставки рекомбинантных нуклеиновых кислот в клетки
Трансфекционные агенты на основе катионных наночастиц и полимеров – перспективные векторы для генного переноса. Однако многие катионные полимеры в высоких концентрациях токсичны для клеток. Положительно заряженные белки, такие как гистоны, являются биологически безопасной альтернативой традиционным трансфекционным агентам, особенно in vivo. Одно из перспективных направлений – комбинирование различных катионных наночастиц с гистонными белками для повышения эффективности трансфекции. Так, было показано, что экстракт гистонов из тимуса телёнка и из куриных эритроцитов способен связывать ДНК и трансфицировать различные культуры клеток [90]. Однако исследователи наблюдали лишь незначительную экспрессию рекомбинантных репортерных генов. Эффективность трансфекции существенно возрастала при добавлении в комплексы катионного полимера полиэтиленимина (PEI, от англ. polyethylenimine). Ни PEI, ни одни гистоны по отдельности не могли достичь эффективности, сравнимой с комплексами PEI-гистон-ДНК. Эти результаты показывают, что смеси гистонов (рекомбинантных или из природных источников) в сочетании с минимальными концентрациями PEI могут использоваться в качестве низкотоксичных эффективных векторов для трансфекции клеток in vitro и in vivo.
J. Deng с соавт. (2011) синтезировали катионный сополимер низкомолекулярного полиэтиленимина и L-глутаминовой кислоты (PLGE, от англ. Poly (L-glutamic Acid) Grafted Polyethylenimine). Для улучшения эффективности доставки генов PLGE применяли в комплексе с гистонами, содержащими NLS, в качестве кофактора применяли хлорохин. В работе использовался линкерный гистон Н1 и нуклеосомные гистоны Н2А, Н2В, Н3 и Н4. Авторы показали успешное формирование комплексов ДНК-гистонPLGE размером около 200 нм в диаметре. Применение гистона значительно повышало эффективность трансфекции PLGE и экспрессию GFP in vitro (клетки линии HeLa) и in vivo (у плодовой мушки Drosophila melanogaster). Комплексы ДНК-гистон-PLGE низкотоксичны для клеток [91].
Было показано [92, 93], что концевые пептиды гистона Н3 в сочетании с полиэтиленгликолем (PEG, от англ. polyethylene glycol) являются высокоэффективными и нетоксичными средствами доставки генов. M.O. Sullivan с соавт. (2008) создали полиплексы PEG, содержащие триметилированные в четвертой позиции концевые пептиды гистона Н3 (h4K4me3). Наличие NLS-последовательностей позволяло h4K4me3 взаимодействовать с ядерными эффекторными комплексами, инициируя транскрипционную активность. При использовании полиплексов с h4K4me3 экспрессия репортерных генов начиналась в два раза быстрее, чем при использовании полиплексов PEG без пептида h4K4me3. Также авторы разрабатывают способ доставки нуклеиновых кислот с помощью комплексов, содержащих катионные наночастицы золота и h4K4me3 (HMGNs, от англ. histone-mimetic gold nanoparticles) [94]. Такие комплексы имеют сильный положительный заряд, что обеспечивает хорошую конденсацию ДНК и ее защиту от деградации нуклеазами. Было показано, что комплексы HMGN-плазмидная ДНК стабильны в присутствии нуклеаз сыворотки крови. Также эффективны для доставки нуклеиновых кислот комплексы PEI-h4K4me3 [94]. Эффективность трансфекции клеток линии СНО-К1 комплексами PEI-h4K4me3 была выше, чем при использовании PEI и h4K4me3 по отдельности.
Гистонные белки и пептиды успешно применяют в сочетании с другими системами доставки генов, что значительно повышает их эффективность. J.E. Hagstrom с соавт. (1996) для трансфекции клеточной линии NIh4T3 использовали тройные комплексы: плазмидная ДНК-гистон h2-DOPE (от англ. dioleoyl phosphatidylethanlamine) и плазмидная ДНКгистон h2-фосфатидилсерин [24]. Они показали, что тройные комплексы, содержащие гистон Н1 и DOPE, трансфицируют клетки с большей эффективностью, чем двойные комплексы, содержащие только плазмидную ДНК и DOPE. Гистон h2 способствует более плотной упаковке ДНК и стабилизирует её комплексы с липосомными трансфекционными агентами. Гистоны Н2А, h3B, h4 и h5 менее эффективны в сочетании с другими липосомными трансфекционными агентами [24]. Также показано, что в клетках, трансфицированных комплексами гистон h2-плазмидная ДНК-Lipofectin®, экспрессируется в 20 раз больше люциферазы, чем в клетках, трансфицированных комплексами плазмидная ДНК-Lipofectin® [21].
K.M. Wagstaff с соавт. (2008) показали, что реконструированный хроматин в комплексе с гистонными белками h3B, содержащими дополнительные NLS, повышает эффективность электропорации и липофекции [35]. Использование реконструированного хроматина с гистонными белками h3B при электропорации или липофекции (Lipofectamine®) значительно повышало эффективность доставки ДНК в клетки линии MCF7 и экспрессию репортерного гена GFP.
В настоящее время проводятся исследования по разработке адресных (тканеспецифичных) невирусных систем доставки рекомбинантных нуклеиновых кислот [63]. Эти системы основаны на доставке ДНК при помощи поликатионных носителей (например, поли-L-лизин) с синтетическими олигопептидными лигандами, которые специфичны к рецептору клетки-мишени. Основной недостаток липидной и полимерной систем адресной доставки – произвольное сшивание специфичных липидных и полимерных олигопептидов, что влияет на эффективность доставки, уменьшая её специфичность [64, 65]. Для повышения специфичности доставки были сконструированы генетические конструкции, содержащие последовательности ДНК, кодирующие гистоны и специфические лиганды. F.H. Dai с соавт. (2003) сконструировали серию векторов, содержащих последовательность кДНК, кодирующую гистон Н1, и рецептор эпидермального фактора роста [95]. Эти векторы эффективно и специфично трансфицировали клетки in vitro (клеточные линии: U2OS, клетки остеосаркомы человека, BEL-7402, клетки гепатомы человека, и SKOV3, клетки аденокарциномы яичника человека) и in vivo (мыши линии BALB/c после введения клеток BEL-7402 и SKOV3).
Заключение
Таким образом, применение гистонных и других ядерных белков для переноса рекомбинантных нуклеиновых кислот в клетки – перспективный метод невирусной трансфекции in vitro и in vivo. Гистонные белки могут быть использованы как в виде самостоятельных векторов для генного переноса, так и в виде компонентов более сложных трансфекционных систем, позволяя повысить стабильность нуклеиновых кислот и эффективность транспорта в ядро клетки.
Глава 7. Примеси ДНК и белков клетки-хозяина, стандартные испытания в сравнении с валидационными исследованиями
Содержимое (Table of Contents)
1. Область применения
Биотехнологические препараты, преимущественно рекомбинантные белки, получают с помощью сложной системы экспрессии (производства) с использованием генетически модифицированных клеток (клеток бактерий, дрожжей или млекопитающих). Среди примесей, подлежащих удалению в процессе очистки на конечном этапе производства, 2 компонентами, представляющими наибольший интерес с точки зрения безопасности и переносимости, являются остаточная ДНК клетки-продуцента и остаточные белки клетки-хозяина. С момента регистрации первых рекомбинантных белков применяются разные подходы, основанные преимущественно на разновидностях систем производства, для работы с данными примесями. В качестве стандартного испытания на белки клетки-хозяина независимо от типа получаемого препарата и используемой клеточной системы необходимо определять остаточные белки клетки-хозяина, в то время как исследования остаточной ДНК в качестве стандартного испытания проводят только для препаратов, полученных из перевиваемых клеточных линий млекопитающих.
Необходимо гарантировать, что содержание таких примесей в лекарственном препарате, предназначенном для пациента, снижено до допустимого уровня. Для достижения этой цели следует рассмотреть два подхода:
- валидационный подход: выполнить валидацию процесса производства для демонстрации того, что на заданных этапах процесса очистки эти примеси последовательно и воспроизводимо удаляются до тех пор, пока их уровень не станет приемлемым. Основываясь на коэффициентах снижения содержания примесей, можно предсказать и гарантировать остаточный уровень примеси в готовом препарате;
- стандартный подход: разработать аналитические методики, позволяющие максимально точно контролировать уровень этих примесей на разных этапах процесса, и установить фиксированное предельное содержание примесей, что позволит надлежащим образом контролировать содержание таких примесей в готовом препарате.
Можно комбинировать эти два подхода, т.е. проводить стандартное испытание на раннем этапе процесса очистки, а валидационное испытание, демонстрирующее уменьшение содержания примесей, проводить на готовом препарате для выявления максимального содержания примесей.
Учитывая возможность применения рекомбинантных белков в международном масштабе, необходимо гармонизировать критерии оценки на международном уровне, чтобы производители могли разрабатывать свои препараты на одних и тех же производственных линиях, независимо от предполагаемых регионов регистрации и вывода препарата на рынок.
2. Остаточная ДНК клетки-продуцента
В отношении препаратов, полученных с помощью бактерий и дрожжей нет необходимости проводить стандартные испытания при условии, что в готовом препарате не превышены допустимые уровни остаточной ДНК, а в досье представлены достаточные данные по валидации. ДНК из стабильной клеточной линии млекопитающих ранее считалась фактором риска из-за опасений, что остаточная ДНК клетки-хозяина может обладать туморогенным потенциалом. Однако полученная в дальнейшем информация показала, что ДНК из стабильной клеточной линии представляет риск в гораздо меньшей степени, чем предполагалось раньше, и, следовательно, должна относиться к категории общих примесей.
Валидационные испытания (например, эксперименты по внесению заданных количеств примеси с соответствующим распределением фрагментов ДНК по размерам) должны проводиться с целью выявления основных этапов, на которых возможно снижение содержания ДНК, а также для занесения в документацию данных о способности данных этапов снижать содержание остаточной клеточной ДНК в готовом препарате до приемлемого и заданного уровней. В настоящее время методика количественного анализа ДНК подробно описана и обладает воспроизводимостью.
В дополнение к данным валидационных испытаний необходимо представить результаты количественного анализа ДНК для минимального количества производственных серий (например, 5 последовательных серий) с целью демонстрации воспроизводимости процесса производства в отношении снижения содержания остаточной ДНК до уровня, который предполагается получить в ходе валидационных испытаний. Учитывая удовлетворительные данные по валидации и достоверные результаты по ограниченному числу производственных серий, проведение стандартных испытаний для определения содержания ДНК в стабильной клеточной линии на этапе очистки нерасфасованного препарата (на других соответствующих этапах) представляется нецелесообразным.
В некоторых случаях (например, ранее не утвержденные перевиваемые клеточные линии, трансформация последовательностей ДНК вирусными векторами и т.д.) может возникнуть необходимость в применении стандартного контроля удаления ДНК.
Допустимо прекращение проведения стандартных испытаний ДНК для препаратов, выделенных из стабильных клеточных линий и для которых уже получено регистрационное удостоверение. Однако в таком случае необходимо внести официальные изменения в регистрационное досье. Документация с изменениями должна содержать удовлетворительные результаты валидационного испытания наряду с ретроспективными данными, полученными заявителем с момента начала производственного процесса, что подтвердит стабильный уровень содержания остаточной ДНК в ходе процесса.
3. Остаточные белки клетки-хозяина
Вопрос об остаточных белках клетки-хозяина затрагивает все системы экспрессии (производства), а не только экспрессионную систему с использованием клеток млекопитающих. Наличие в любых рекомбинантных белках таких примесей требует изучения потенциальной иммуногенности препарата. По этой причине в настоящее время необходимо контролировать содержание остаточных белков клетки-хозяина на этапе очистки нерасфасованного препарата с помощью подходящих методов анализа. Результаты испытаний от серии к серии должны соответствовать друг другу и находиться в установленных спецификацией пределах.
При определении допустимых пределов необходимо помнить, что невозможно установить общее предельное содержание остаточных белков клетки-хозяина для всех биотехнологических препаратов. Действительно, белки клетки-хозяина — примеси, качественная и количественная характеристика которых изменяется от одного препарата к другому и даже от одной системы производства (очистки) к другой. Стандартизация аналитических методов затруднена, поскольку выбор реагентов, используемых в ходе испытаний, зависит от получаемого препарата и системы экспрессии. В отношении остаточных белков клетки-хозяина трудно подобрать материал, обладающий схожими с примесями характеристиками, для использования на определенных этапах процесса или при использовании валидационного подхода (искусственно контаминированный материал).
В большинстве случаев при удалении белков используют хроматографические колонки, для которых избирательность (селективность) и выход методик зависят не только от качества материала, но также и от способа первичного и повторного использования колонок, условий хранения, санитарной обработки и периода их эксплуатации. Валидационный подход не может охватить все эти критические параметры.
В отношении остаточных белков клетки-хозяина валидационный подход применяют только для каждого препарата индивидуально с учетом:
- качества аналитической методики, используемой для определения и количественного анализа примесей остаточных белков клетки хозяина;
- дизайна и качества валидационных испытаний;
- предполагаемого использования препарата (доза, показания, длительность лечения и т.д.).
4. Вывод
В большинстве случаев валидационный подход считается допустимым способом определения остаточного содержания ДНК клетки-хозяина.
Этот подход не так широко используется в отношении таких примесей, как белки клетки-хозяина, при анализе которых предпочтительно использовать индивидуальный подход для каждого препарата.
Необходимо отметить, что в любом случае нужно периодически проводить оценку процессов и методик анализа для подтверждения того, что при их использовании возможно достичь запланированных результатов.
Поделиться ссылкой:
»Сколько белков в клетке?
Сколько белков в клетке?
Reader Mode
Являясь доминирующими игроками в клетке с точки зрения как биомассы, так и функциональности, белки получают большую долю внимания в исследованиях молекулярной и клеточной биологии. Тем не менее, небольшое смещение акцента на проблемы более количественного характера, связанные с этими белками, поднимает всевозможные вопросы, на которые нет ответов. Например, сколько белков в клетке? То есть общее количество белковых молекул, а не количество различных типов.Перед просмотром опубликованных измерений мы можем попытаться оценить это значение на основе свойств ячейки, которые мы, возможно, уже знаем.
Содержание белка приблизительно линейно зависит от объема или массы клетки. Учитывая, что объем клетки может изменяться в несколько раз в зависимости от условий роста или от того, какой конкретный штамм использовался, мы сначала проанализируем количество белков на единицу объема клетки (то есть числовую плотность белка), а затем умножим его на объем клетки, чтобы найти фактическое количество белков. на ячейку для интересующей ячейки.
Рисунок 1: Обратная сторона конверта расчета количества белков на объем клетки. Также дается приложение для выбранных модельных организмов на основе их характерных объемов клеток. Оценка основана на общих значениях параметров, более точные значения для конкретных организмов см. В основном тексте.
Наш первый метод оценки показан как «обратная сторона конверта», разработанный на Рисунке 1 с использованием округленных «общих» значений параметров. Оценка основана на знании массы белка на единицу объема (обозначается c p ).Единицами c p являются [г белка] / [мл объема клетки], и этот параметр был зарегистрирован для различных типов клеток. Обозначим через l aa среднюю длину белка в аминокислотах и среднюю массу аминокислоты m aa . В свете этих определений количество белков в единице объема равно
.
Н / В = c p / (l aa * m aa ).
В E. coli и других бактериях мы используем среднюю длину белка l aa , равную 300 аминокислот на белок, а в почкующихся дрожжах, делящихся дрожжах и клетках человека мы используем большее значение 400 аминокислот на белок.Значения округлены до одной значащей цифры (с точностью около 10-20%) в соответствии с вариациями расчетных значений в литературе. Используемые средние значения длины были рассчитаны путем взвешивания длин белков по их содержанию в клетке. При этом учитываются такие проблемы, как белки с высоким содержанием, как правило, меньше, чем белки с низким содержанием.
Переходя к концентрации белка в клетках, сообщений на удивление мало, старые измеренные значения для c p равны 0.24 г / мл для E. coli и 0,28 г / мл для почкующихся дрожжей (BNID 105938, 108879, 108263, 108874). Ожидается, что значения будут аналогичными, если значения концентрации относятся либо к общему объему клеток и белкового комплемента, включая мембранно-ассоциированные белки, либо только к объему цитоплазмы и белкам). Предполагая, что средняя масса аминокислоты составляет 100 Да и с некоторыми преобразованиями единиц, мы получаем (также схематично показано с общими значениями параметров на рисунке 1)
и
Хотя это то, к чему мы стремились, читатель может задаться вопросом о том, какое значение cp мы использовали.Мы можем вывести его на основе других более известных свойств: плотности клеток, содержания воды и белковой доли сухой массы. Общая плотность клеток d составляет около 1,1 г / мл (BNID 103875, 102239, 106439). Содержание воды, которое мы обозначаем w, составляет в E. coli ≈70%, а в почкующихся дрожжах ≈60% по массе (BNID 105482, 103689). Доля белка в сухой массе p составляет ≈55% в E. coli и ≈40% в дрожжах. Связь между этими величинами: cp = d × (1-w) × p. Подставляя числа, которые мы находим,
Таблица 1: Диапазон оценок количества белков на клетку на основе различных работ.В некоторых случаях количество выводится из дополнительной информации и не указывается как таковая. Когда объем клеток не был указан в исследовании, использовались литературные значения при аналогичных условиях. * Значение общего количества белков на клетку не было явно указано и основано на суммировании значений содержания, как указано в дополнительном материале по протеому.
cp, coli = 1,1 г / мл × (1-0,7) × 0,55 = 0,19 г / мл
и
сП, дрожжи = 1,1 г / мл × (1-0,6) × 0,4 = 0,18 г / мл.
Полученные значения меньше приведенных выше на 20-40% и приводят к оценкам ≈3 × 10 6 белка / мкм 3 и ≈2 × 10 6 белка / мкм 3 в E. coli и почкующиеся дрожжи соответственно.
Теперь мы можем перейти к использованию характеристических объемов для определения количества белков на клетку, а не на единицу объема клетки. Для клетки E. coli объемом 1 мкм 3 сделать не так много, так как это наша единица объема клетки, и две оценки дают диапазон 2–4 миллионов белков на клетку.Для клеток почкующихся дрожжей размером 40 мкм 3 (гаплоид, BNID 100430, 100427) две оценки дают диапазон 90–140 миллионов белков на клетку. Экстраполируя эти плотности белков на клетки млекопитающих, прогнозируется значение примерно 10 10 белков на клетку для характерных клеточных линий, которые имеют средний объем 2000-4000 мкм 3 .
Как эти значения соотносятся с предыдущими сообщениями в литературе? Таблица 1 показывает компиляцию значений, основанных на опубликованных исследованиях протеома.Примечательно, что во многих случаях общая сумма по всем белкам не сообщалась и была выведена для наших целей путем суммирования всех измеренных количеств. Некоторые из общих сумм соответствуют приведенным выше общим оценкам, в основном по бактериям. Напротив, многие значения для эукариотических клеток, включая клетки дрожжей и млекопитающих, в 10 раз ниже, чем предполагалось. Остается выяснить, связано ли это кажущееся несоответствие с проблемами калибровки в масс-спектрометрических исследованиях, в которых они были измерены, или неточностями в значениях параметров, используемых в оценке (Р.Milo, Bioessays 35: 1050, 2013). Мы рассматриваем это как указание на то, что существует постоянная проблема для тщательного анализа, чтобы получить окончательные ответы для тех, кто заинтересован в количественном отображении содержимого ячейки.
76976 Всего просмотров 10 просмотров сегодня
Клетка содержит 42 миллиона белковых молекул, сообщают ученые — ScienceDaily
Официально — в простой клетке около 42 миллионов белковых молекул, сообщила группа исследователей во главе с Грантом Брауном. профессор биохимии Центра клеточных и биомолекулярных исследований Доннелли при Университете Торонто.Анализируя данные почти двух десятков крупных исследований содержания белка в дрожжевых клетках, команда смогла впервые получить надежные оценки количества молекул для каждого белка, как показало исследование, опубликованное на этой неделе в журнале Cell Systems. .
Работа была проведена в сотрудничестве с Анастасией Барышниковой, университетским учёным из Калифорнии, а ныне главным исследователем калифорнийской биотехнологической компании Calico, занимающейся проблемами старения.
Белки составляют наши клетки и делают в них большую часть работы.Таким образом они оживляют генетический код, потому что рецепты построения белков хранятся в коде ДНК генов.
Объясняя работу, Браун сказал, что, учитывая, что «клетка является функциональной единицей биологии, это просто естественное любопытство — захотеть узнать, что там находится и сколько каждого вида».
Несмотря на любопытство, есть еще одна причина, по которой ученые хотят подсчитывать белки. Многие заболевания вызваны недостатком или избытком определенного белка.Чем больше ученые знают о том, как контролируется изобилие белка, тем лучше они смогут исправить это, когда все пойдет не так.
Хотя исследователи годами изучали изобилие белка, результаты были представлены в произвольных единицах, что посеяло путаницу в полевых условиях и затруднило сравнение данных между различными лабораториями.
Многие группы, например, оценили уровни белка, наклеив флуоресцентную метку на молекулы белка и сделав вывод об их численности по яркости клеток.Но неизбежные различия в оборудовании означали, что разные лаборатории регистрировали разные уровни яркости, излучаемой ячейками. Другие лаборатории измеряли уровни белков, используя совершенно другие подходы.
«Было трудно представить себе, сколько белков содержится в клетке, потому что данные были представлены в совершенно разных масштабах», — сказал Брэндон Хо, аспирант лаборатории Брауна, который проделал большую часть работы над проектом.
Чтобы преобразовать произвольные меры в количество молекул на клетку, Хо обратился к пекарским дрожжам, простому для изучения одноклеточному микробу, который дает представление о том, как работает основная клетка.Дрожжи также являются единственным организмом, для которого было достаточно данных, чтобы рассчитать количество молекул для каждого из 6000 белков, кодируемых геномом дрожжей, благодаря 21 отдельному исследованию, в котором измерялось количество всех дрожжевых белков. Для клеток человека не существует таких наборов данных, где каждый тип клеток содержит только подмножество белков, кодируемых 20 000 генов человека.
Обилие существующих данных о дрожжах означало, что Хо мог собрать все воедино, провести сравнительный анализ и преобразовать расплывчатые измерения содержания белка в «что-то, что имеет смысл, другими словами, количество молекул на клетку», — сказал Браун.
Анализ
Хо впервые показывает, сколько молекул каждого белка находится в клетке, при этом общее количество молекул оценивается примерно в 42 миллиона. Большинство белков существует в узком диапазоне — от 1000 до 10 000 молекул. Некоторые из них чрезвычайно многочисленны — более полумиллиона копий, в то время как другие существуют менее чем в 10 молекулах в клетке.
Анализируя данные, исследователи смогли получить представление о механизмах, с помощью которых клетки контролируют обилие отдельных белков, открыв путь для аналогичных исследований на человеческих клетках, которые могут помочь выявить молекулярные корни болезни.Они также показали, что поступление белка коррелирует с его ролью в клетке, а это означает, что можно использовать данные о количестве, чтобы предсказать, что делают белки.
Наконец, в открытии, которое повсюду обрадует клеточных биологов, Хо показал, что обычная практика прикрепления светящихся меток к белкам мало влияет на их численность. Хотя этот подход произвел революцию в изучении биологии белков, обеспечив его первооткрывателей Осаму Шимомура, Мартина Чалфи и Роджера Циена Нобелевской премией по химии в 2008 году, он также вызвал опасения, что маркировка может повлиять на долговечность белка, что приведет к искажению данных.
«Это исследование будет иметь большое значение для всего дрожжевого сообщества и за его пределами», — сказал Роберт Нэш, старший биокуратор базы данных генома Saccharomyces, которая сделает данные доступными для исследователей всего мира. Он также добавил, что, представляя изобилие белка «в общем и интуитивно понятном формате, лаборатория Брауна предоставила другим исследователям возможность повторно изучить эти данные и тем самым облегчить сравнения между исследованиями и выработку гипотез».
Исследование финансировалось Исследовательским институтом Канадского онкологического общества.
История Источник:
Материалы предоставлены Университетом Торонто . Оригинал написан Йованой Дриньякович. Примечание. Содержимое можно редактировать по стилю и длине.
границ | Одноклеточный протеин — современное состояние, промышленный ландшафт и патенты 2001–2016 гг.
Введение
Люди и животные потребляют белок как источник азота и незаменимых аминокислот, из которых они строят новые структурные и функциональные (например,ж., ферменты и гормоны) белки, которые позволяют им выжить. В экстремальных условиях белки также могут использоваться в качестве источника энергии. Пищевая ценность белка определяется аминокислотным составом; В диетическом белке обычно содержится 20 аминокислот, некоторые из которых (например, фенилаланин, валин, треонин, триптофан, метионин, лейцин, изолейцин, лизин и гистидин, а также аргинин, цистеин, глицин, глутамин, пролин и тирозин). полезные) не могут синтезироваться людьми или животными, поэтому они необходимы и должны поступать с пищей (см. обзор Wu, 2009).
Boland et al. (2013) исследовали, как растущий спрос на мясной и молочный белок потребует улучшений в животноводстве, а также открытости для новых источников белка, как в качестве корма для животных, так и для непосредственного потребления человеком. Производство продукции животноводства и молочных продуктов неуклонно растет в течение последних десятилетий и теоретически может продолжать расти для удовлетворения ожидаемого спроса даже к 2050 году, когда спрос на мясо превысит 400 млн тонн, а спрос на молочные продукты — 800 млн тонн (Boland et al., 2013). Однако, поскольку растительный белок превращается в мясной белок довольно неэффективно (для производства 1 кг мясного белка требуется ~ 6 кг растительного белка), увеличение производства мяса для удовлетворения растущего спроса в конечном итоге не является устойчивым (ВОЗ, 2015). Западный мир также заинтересован в разработке более здоровой пищи с оптимальным аминокислотным составом и низким, но качественным содержанием жиров в сочетании с этически устойчивым производством. Как правило, это экологически безопасные процессы, не связанные с животными, но могут включать новые процессы, такие как производство «культивированного» мяса, в котором мясной белок более эффективно продуцируется in vitro , а не выращиванием целого животного (Kadim et al. ., 2015). Источники протеина растительного происхождения, такие как бобы, являются ценными в питательном отношении источниками протеина, но для этого требуются пахотная земля и вода, которые станут ограничивающими, поскольку мы будем стремиться удовлетворить глобальный спрос на протеин. Содержание белка в мясе обычно составляет около 45%, в молоке — около 25%, а в соевых бобах — около 35% (Ghasemi et al., 2011).
Белок также может быть получен путем культивирования различных микробов и водорослей, предпочтительно тех, которые содержат более 30% белка в своей биомассе и которые могут обеспечить здоровый баланс незаменимых аминокислот.Микробный белок обычно называют одноклеточным белком (SCP), хотя некоторые из продуцирующих микробы, такие как нитчатые грибы или нитчатые водоросли, могут быть многоклеточными. Помимо прямого использования в качестве SCP, микробы вносят свой вклад в потребность в белке, когда они используются для повышения содержания белка или повышения качества ферментированных продуктов (Bourdichon et al., 2012). Хотя микробный белок обеспечивает относительно небольшую часть современного питания человека, растущий глобальный спрос на белок, вероятно, сделает SCP все более важным (Boland et al., 2013). Высокие темпы роста или возможность использовать уникальные субстраты, такие как CO 2 или метан, приводят к процессам, которые обеспечивают гораздо более высокую эффективность и / или устойчивость, чем это возможно при традиционном сельском хозяйстве.
SCP в настоящее время производится из ограниченного числа видов микробов, особенно с учетом потребления человеком. Диапазон источников SCP, используемых в кормах для животных, шире, чем источники, одобренные для употребления в пищу людьми, и постоянно расширяется. Как рассматривается ниже, все продукты, полученные из водорослей, грибов (включая дрожжи) и бактерий, используются или находятся в стадии разработки.Этапы производства обычно включают (а) приготовление питательной среды, возможно, из отходов, (б) культивирование, включая ферментацию в твердом состоянии, (в) разделение и концентрацию SCP, в некоторых случаях сушку, и (г) окончательную переработку SCP в ингредиенты и продукты.
SCP для потребления человеком обычно производится из субстратов пищевого качества, но есть надежда, что будут разработаны процессы для производства SCP из недорогих отходов пищевой промышленности и производства напитков, а также непосредственно из лесных и сельскохозяйственных источников (Anbuselvi et al. ., 2014). Всегда необходимо учитывать нормативные вопросы. С введением водорослей поставщикам микробного белка стало возможным производство CO 2 , в то время как парниковый газ метан стал новым источником углерода для SCP из бактерий.
В следующем обзоре дается введение в производство SCP и организмы, используемые в качестве SCP, с акцентом на коммерчески реализуемые разработки в этой области. Более подробные обзоры исследований конкретных организмов, рассматриваемых для производства SCP, предоставлены Анупама и Равиндра (2000), Угальде и Кастрилло (2002), Рудраварам и др.(2009), Ghasemi et al. (2011) и Nasseri et al. (2011). Здесь мы предоставляем обновленную информацию о последних достижениях в патентном ландшафте (2001–2016 гг.) И текущих промышленных игроках на основе профилей компаний, найденных в Интернете, литературе и патентных базах данных.
Производственные системы SCP с различными субстратами и процессами
Водоросли, грибы (мицелиальные грибы и дрожжи) и бактерии могут быть использованы в качестве SCP (Анупама и Равиндра, 2000). В будущем диетический белок также может быть получен из белков, секретируемых сконструированными микробными клетками (например,g., белки молока или яичного белка) и полученные из культур клеток животных и растений, в которых клетки больше не являются микробами, но также не являются животными или растениями. Таким образом, различие между SCP и другими белками становится нечетким.
SCP из водорослей
Микроводоросли, которые производятся для употребления в пищу людьми или животными, обычно имеют высокое содержание белка (например, 60–70%; Таблица 1). Они также содержат жиры (особый интерес представляют ω-3 жирные кислоты и каротиноиды), витамины A, B, C и E, минеральные соли и хлорофилл (Gouveia et al., 2008). В них относительно низкое содержание нуклеиновых кислот (3–8%; Nasseri et al., 2011).
Таблица 1 . Недавние сообщения о содержании белка в некоторых водорослях, представляющих интерес как SCP *.
Микроводоросли в настоящее время используются в основном в форме добавок, доступных в таблетках, капсулах или жидкой форме, но они все чаще обрабатываются как ингредиенты, которые могут быть включены в пасту, выпечку, закуски и т. Д. (Gouveia et al., 2008; Зимберов, 2017). Наиболее доступные коммерческие продукты получены в основном из Arthrospira platensis и Arthrospira maxima (продается как спирулина, продается компанией e.g., Hainan Simai Pharmacy Co., Earthrise Nutritionals, Cyanotech Corp., FEBICO и Mayanmar Spriulina Factory) , Chlorella (продается, например, компанией Taiwan Chlorella Manufacturing Co., FEBICO и Roquette Klötze GmbH & Co), Dunaliella salina (продается, например, Qianqiu Biotechnology Co., Ltd., в основном для β-каротина) и Aphanizomenon flos-aquae (продается, например, Blue Green Foods, Klamath Valley Botanicals LLC и E3Live; Gouveia et al., 2008) . Эвглена Ко.Ltd. (Suzuki, 2017) и Algaeon (http://algaeon-inc.com/#products) оба продают продукты из Euglena , в основном для содержания β-глюкана, но включая продукты из цельных клеток. TerraVia не указывает водоросли, содержащиеся в их пищевом ингредиенте AlgaVia ® . Enzing et al. (2014) и Vigani et al. (2015) предоставляют полезные обзоры компаний и стран, занимающихся производством микроводорослей в качестве продуктов питания или кормов. Оба обзора посвящены Европейскому союзу, но при этом отмечается участие в этой отрасли множества компаний из Азии и Северной Америки.
Водоросли обычно питаются CO 2 и светом, хотя некоторые продукты, такие как AlgaVia ® , производятся путем традиционной ферментации, а не путем фотосинтеза. Производство водорослей на открытом воздухе в открытых прудах является обычным явлением, но оно подвержено загрязнению (не только биологическому, но и минеральному, влияющему на качество конечного продукта) и изменению погоды (Harun et al., 2010). Внутренние фотобиореакторы также используются, чтобы гарантировать поставку свежих водорослей в качестве корма для аквакультуры (моллюски, креветки, рыба; Henrikson, 2013; Mahmoud et al., 2016). Водоросли в основном используются в аквакультуре как источник омега-жирных кислот и каротиноидных пигментов, но их белок также способствует питанию животных (Muller-Feuga, 2000).
SCP от грибов
Согласно обзору Anupama and Ravindra (2000), Rudravaram et al., Для использования в качестве SCP рассматривается широкий спектр грибов. (2009) и Nasseri et al. (2011). В таблице 2 перечислены некоторые виды, которые были исследованы в последние годы, с указанием содержания белка в условиях, в которых они были выращены.Продукты из Saccharomyces, Fusarium и Torulopsis коммерчески доступны.
Таблица 2 . Недавние сообщения о содержании грибкового белка, произведенного из определенных субстратов для видов, исследованных как потенциальные источники SCP.
Грибы, выращенные как SCP, обычно содержат 30–50% белка (Anupama and Ravindra, 2000; Nasseri et al., 2011). Аминокислотный состав выгодно отличается от руководящих принципов ФАО; Содержание треонина и лизина обычно высокое, но содержание метионина относительно низкое, хотя все еще соответствует рекомендациям ФАО / ВОЗ (Anderson et al., 1975). Содержание метионина в некоторых грибковых продуктах, таких как Marmite ® , еще ниже. Сульфосодержащие аминокислоты были обогащены SCP из K. fragilis путем культивирования на сыворотке (Willetts and Ugalde, 1987).
Ожидается, что SCP, полученный из грибов, помимо белка, будет обеспечивать витамины в основном из группы B-комплекса (тиамин, рибофлавин, биотин, ниацин, пантотеновая кислота, пиридоксин, холин, стрептогенин, глутатион, фолиевая кислота и пара-аминобензойная кислота). кислота).Клеточные стенки грибов богаты глюканами, которые вносят клетчатку в рацион. Холестерин липопротеинов низкой плотности был снижен у добровольцев, которые потребляли микопротеин из Fusarium venenatum (Turnbull et al., 1992), и уровни глюкозы в крови и инсулина также могут быть положительно затронуты (Lang et al., 1999). Ожидается, что в грибах будет умеренное содержание нуклеиновых кислот (7–10%; Nasseri et al., 2011), которое, однако, слишком велико для потребления человеком и требует обработки для его снижения (Edelman et al., 1983).
Бренд Quorn ™ (http://www.quorn.com/) был запущен в 1985 году компанией Marlow Foods (Великобритания). Продукты Quorn ™ содержат микопротеин мицелиального гриба F. venenatum . Грибковая биомасса обеспечивает текстуру, напоминающую мясные продукты. Quorn ™ может быть единственным продуктом SCP, используемым исключительно для питания человека, и для этой цели широко используется бренд, продается и продается. Компания была недавно (2015 г.) приобретена филиппинским производителем лапши быстрого приготовления Monde Nissin Corp за 550 миллионов фунтов стерлингов (http: // www.reuters.com/article/quorn-ma-idUSL5N1204C720151001).
Отработанные пивные дрожжи ( Saccharomyces cerevisiae ) более века продавались в виде дрожжевых экстрактов, таких как Marmite ® (Unilever и Sanitarium Health Food), Vegemite ® (Bega Cheese Ltd.), Cenovis ® (Gustav Gerig AG) и Vitam-R ® (VITAM Hefe-Produkt GmbH). Дрожжевые экстракты являются хорошим источником пяти важных витаминов группы B, а также белка. Другой коммерчески доступные дрожжи, Torula ( Candida utilis , переименованный в Pichia jadinii ), широко используемый ароматизатор, также богаты белком. Torula использовался в Provesteen ® T, производимом Provesta Corporation в 1980-х годах, вместе с аналогичными продуктами с использованием дрожжей Pichia и Kluyveromyces (Hitzman, 1986). Торула богата аминокислотой глутаминовой кислотой, и по этой причине ее использовали для замены усилителя вкуса мононатрия глутамата (MSG).
Процесс под названием «Пекило» был разработан в Финляндии для производства SCP для кормов для животных из сахаров, присутствующих в сульфитном растворе сточных вод бумажных фабрик (обзор в Ugalde and Castrillo, 2002).Нитчатый гриб Paecilomyces varioti выращивали на сахарах, включая пентозы, в сульфитных отходах щелока или гидролизатах древесины. В течение 1982–1991 гг. В Финляндии действовали две фабрики в Мянття и Ямсянкоски, но после того, как целлюлозные фабрики прекратили свою деятельность, эти фабрики также были закрыты. Хотя продукт продавался как корм для животных, он также был исследован в качестве добавки к мясным продуктам, таким как колбасы и фрикадельки (Koivurinta et al., 1979). Технологический штамм Пекило можно приобрести в VTT Ltd.коллекция культур (www.culturecollection.vtt.fi/).
Quorn ™ и дрожжевые спреды, такие как Marmite ® , производятся из глюкозы, полученной из крахмала, в то время как в процессе Пекило использовались лигноцеллюлозные сахара. В дополнение к этим источникам углерода для производства SCP дрожжами и нитчатыми грибами использовались алканы и метанол. Метилотрофные дрожжи, например Komagataella pastoris (ранее Pichia pastoris ), производят биомассу и белок из метанола (Rashad et al., 1990). Производство в промышленных масштабах осуществляется, например, компанией Phillips Petroleum. Их дрожжи производили 130 г (DW) / л биомассы при продуктивности более 10 г / л -1 ч -1 (Johnson, 2013).
Компания «Бритиш Петролеум» первой начала производство Yarrowia lipolytica SCP для кормов для животных из восковидных н-парафинов на нефтеперерабатывающем заводе в 1970-х годах, построив пилотную установку мощностью до 100 тыс. Тонн в год (Groenewald et al., 2014). Хотя сам продукт считался безопасным, завод не получил необходимых разрешений на производство из-за экологических проблем (Bamberg, 2000).В сочетании с высокой ценой на субстрат в результате нефтяного кризиса 1973 года это привело к тому, что British Petroleum отказалась от интереса к SCP (Groenewald et al., 2014). Yarrowia SCP теперь доступен в меньшем масштабе как продукты Yarrowia Technology (продукты Yarrowia Equinox и Yarrowia GoodStart) от Skotan S.A. в Польше (http://www.yarrowiatechnology.com/?lang=3). Хотя масла и каротиноиды являются наиболее распространенными продуктами Yarrowia для использования человеком (Groenewald et al., 2014), американская компания Nucelis также предлагает богатую белком муку из тысячелистника обыкновенного (https: // www.nucelis.com/products.php?product=oils#circles).
Исследования и разработки SCP с различными видами грибов активны и продолжаются и могут привести к созданию новых продуктов или производственных процессов. Например, Zhao et al. (2013) описали процесс, в котором антибактериальные пептиды будут продуцироваться и секретироваться Y. lipolytica , образуя ценный продукт, в то время как отработанные дрожжи можно использовать в качестве SCP, поскольку в них высокое содержание белка. Большая часть текущих исследований сосредоточена на использовании отходов субстрата, таких как жмых сахарного тростника (например.g., Penicillium janthinellum с 46% белка, Rao et al., 2010), отработанное зерно пивоварни, гемицеллюлозный гидролизат (например, Debaryomyces hansenii , White et al., 2008; Kluyveromyces marxianus , Aggelopoulos, et al. , 2014), сыворотки (смешанные дрожжевые культуры, Yadav et al., 2014, 2016; K. marxianus , Aggelopoulos et al., 2014) и смеси других распространенных отходов пищевой промышленности, таких как остатки апельсина и картофеля, патока, и солодовые корешки ( К.marxianus , Aggelopoulos et al., 2014). Aggelopoulos et al. (2014) использовали твердофазную ферментацию (SSF), а не погруженное культивирование, а также отметили, что более ценные продукты могут быть извлечены до использования обогащенных белком остатков в качестве корма для животных.
SCP из бактерий
Бактерии также давно используются в качестве SCP, особенно в кормах. Некоторые из наиболее часто изучаемых видов были рассмотрены Анупама и Равиндра (2000), Рудраварам и др.(2009) и Nasseri et al. (2011), а в таблице 3 представлен список недавних исследований бактериальных SCP.
Таблица 3 . Недавние сообщения о содержании бактериального белка на определенных субстратах для видов, исследованных как потенциальные источники SCP.
Бактериальный SCP обычно содержит 50–80% белка в пересчете на сухой вес (Anupama and Ravindra, 2000), и ожидается, что содержание незаменимых аминокислот будет сравнимо с рекомендациями ФАО или выше (Erdman et al., 1977). Сообщалось о содержании метионина до 3,0% (Schulz and Oslage, 1976), что выше, чем обычно получают в SCP водорослей или грибов. Аналогичный аминокислотный состав наблюдается у бактерий, выращенных на метаноле или метане (Øverland et al., 2010). Как и в случае с грибами, бактериальный SCP имеет высокое содержание нуклеиновых кислот (8–12%), особенно РНК, и, следовательно, требует обработки перед использованием в качестве пищи / корма (Kihlberg, 1972; Nasseri et al., 2011; Strong et al., 2015 ). В дополнение к белку и нуклеиновой кислоте бактериальный SCP обеспечивает некоторые липиды и витамины из группы B.
Компания
Imperial Chemical Industries разработала SCP (Pruteen) для кормов для животных из метанола с использованием бактерии Methylophilus methylotrophus . Прутин содержал до 70% белка и использовался в кормах для свиней (Johnson, 2013). Однако Pruteen не могла конкурировать с более дешевыми кормами для животных, которые были доступны в конце 1970-х годов, и производство было прекращено. Прутин производился из метанола, но сейчас интерес к метану в качестве субстрата для SCP. UniBio A / S (с использованием знаний, полученных Dansk BioProtein A / S) и Calysta Inc.оба разработали технологию ферментации для преобразования природного газа в кормовой белок для животных с использованием метанотрофных бактерий. UniBio A / S использует ферментер с U-образной петлей для достижения производительности 4 кг м -3 ч -1 , производя UniProtein ® с ~ 70% белка, который был одобрен для использования в кормах для животных ( http://www.unibio.dk/company/subpage-1/). Ферментер с U-образным контуром разработан для увеличения скорости массопереноса метана из газа в жидкую фазу, что делает больше метана доступным для бактерий (Petersen et al., 2017). Calysta Inc. открыла производство для своего продукта FeedKind ® в Великобритании в 2016 году и в партнерстве с Cargill построит более крупное производственное предприятие в США (http://calysta.com/commercialization/). FeedKind ® , как и UniProtein ® , используется в кормах для животных. Метан — интересный субстрат, поскольку он является основным побочным продуктом животноводства и свиноводства (Philippe and Nicks, 2015), а также доступен при производстве биогаза (свалки, отходы).В настоящее время сжигается излишек метана. VTT Ltd. изучает конструкцию реактора и варианты сочетания производства метана на фермах с производством микробного масла и кормового белка (http://www.vttresearch.com/media/news/protein-feed-and-bioplastic-from-farm -biogas) из метанотрофных бактерий Methylococcus capsulatus (группа I), Methylosinus trichosporium (группа II) и Methylocystis parvus (группа II).
Как и в случае SCP из грибов, другие разработки в области производства бактериального SCP сосредоточены на улучшении различных субстратов для отходов или повышении ценности очистки сточных вод.Примеры включают обработку отходов переработки картофельного крахмала в двухступенчатом процессе с использованием Aspergillus niger для разложения волокон в картофельных остатках и Bacillus licheniformis для производства белка (Liu et al., 2014). Экономический анализ показал, что этот процесс может решить не только проблему загрязнения в крахмальной промышленности, но и проблему нехватки белка для кормов для животных в Китае (Liu et al., 2014). Другой пример одновременного управления сточными водами и производства SCP был описан Kornochalert et al.(2014) для заводских отходов резиновых листов. Они продемонстрировали, что химическая потребность в кислороде, взвешенных твердых частицах и общем количестве сульфидов в сточных водах была снижена пурпурной несерной бактерией, Rhodopseudomonas palustris , до уровней, соответствующих руководящим принципам для использования в качестве воды для орошения в Таиланде, и что произведенная биомасса была подходящей для SCP (Kornochalert et al., 2014).
Скорлупа сои ферментирована B. subtilis для повышения ее питательной ценности в качестве корма для животных с однокамерным желудком (Wongputtisin et al., 2014).
Kunasundari et al. (2013) описывают новый вторичный продукт, произведенный совместно с бактериальным SCP. Они культивировали Cupriavidus necator в больших масштабах для получения биомассы с высоким содержанием как белка, так и полигидроксиалканоата (PHA). Этой биомассой скармливали крыс. Корм был не только хорошо переносимым и безопасным для крыс, но крысы также производили фекальные гранулы, содержащие гранулы PHA, что позволяло очистить значительные количества PHA без использования сильных растворителей (Kunasundari et al., 2013).
Обработка SCP
В зависимости от материала субстрата и предполагаемого пищевого / кормового применения перед составлением конечного продукта SCP требуются различные этапы обработки. В следующем разделе мы рассмотрим наиболее важные потребности в обработке SCP.
Деградация клеточной стенки в белковых продуктах одиночной клетки
Некоторые SCP используются в виде препаратов целых клеток, в то время как у других клеточная стенка может быть разрушена, чтобы сделать белок более доступным.SCP, такие как Quorn ™, можно употреблять без разрушения клеточной стенки, и в этом случае хитин и глюкан из клеточных стенок грибов вносят клетчатку в рацион (Wiebe, 2004). SCP, полученный из эвглены , не требует усвоения, поскольку клетки имеют белковые пленки, а не клеточные стенки, что делает его более легко усваиваемым.
Для разрушения клеточной стенки использовались различные методы, в том числе механические силы (дробление, крошение, измельчение, гомогенизация под давлением или обработка ультразвуком), гидролитические ферменты (эндогенные или экзогенные), химическое разрушение с помощью детергентов или комбинации этих методов ( рассмотрено в Nasseri et al., 2011). Разрушение клеток может повлиять на качество и количество белка и других компонентов в SCP. Такие продукты, как Marmite ® и Vegemite ® , представляют собой клеточные экстракты, полученные путем нагревания клеток до 45–50 ° C, достаточного для того, чтобы внутриклеточные ферменты частично гидролизовали клеточную стенку; белки также восстанавливаются до более мелких пептидов (Trevelyan, 1976; Ugalde and Castrillo, 2002).
Удаление нуклеиновых кислот из белковых продуктов одиночных клеток
Хотя водоросли обычно имеют низкое содержание нуклеиновых кислот, быстро размножающиеся виды бактерий и грибов имеют высокое содержание нуклеиновых кислот (РНК).На содержание и деградацию РНК влияют условия роста, скорость роста и соотношение углерода и азота (Trevelyan, 1976). Когда SCP производят для потребления человеком, высокое содержание нуклеиновых кислот является проблемой, потому что прием пуриновых соединений, полученных в результате распада РНК, увеличивает концентрацию мочевой кислоты в плазме, что может вызвать подагру и камни в почках (Edelman et al., 1983). SCP с высоким содержанием нуклеиновых кислот, предназначенный в качестве корма для животных, рекомендуется только для кормления животных с короткой продолжительностью жизни (Strong et al., 2015). Гао и Сюй (2015) и Сюй (2015) недавно описали методы измерения содержания нуклеотидов в сложных продуктах SCP.
Были разработаны различные методы уменьшения содержания РНК в SCP (Sinskey and Tannenbaum, 1975), которые продолжают использоваться. Эндогенные ферменты, расщепляющие РНК (рибонуклеазы), могут быть использованы для деградации РНК после активации с помощью тепловой обработки (60–70 ° C), как это используется при производстве Quorn ™ (Anderson and Solomons, 1984). Рибонуклеазы также можно добавлять в процесс или использовать в качестве иммобилизованных ферментов (Martinez et al., 1990; Хамеш и Демир, 2015). Компоненты деградированной РНК диффундируют из клеток, но также происходит потеря биомассы (35–38%). Процесс был улучшен за счет использования более высоких температур (72–74 ° C) в течение 30–45 минут с меньшими потерями биомассы (потеря 30–33%; Ward, 1998). Повышение температуры требует ввода пара, что является фактором затрат, но тепло также необходимо для окончательной обработки биомассы при 90 ° C после активации РНКазы (Knight et al., 2001).
Также были изучены методы щелочного гидролиза и химической экстракции.Виикари и Линко (1977) использовали щелочную обработку для уменьшения РНК в биомассе P. varioti , используемой в процессе Пекило, до уровня менее 2%. Обработка при 65 ° C, pH 7,5–8,5 для активации эндогенной рибонуклеазы также снижала содержание РНК до <2%, в то время как содержание белка оставалось на уровне 50%.
Безопасность SCP
Как и любой продукт питания или корм, SCP должен быть безопасным для производства и использования. В большинстве регионов существуют правила, обеспечивающие безопасность пищевых продуктов или кормов для употребления (Bagchi, 2006).Обычно они различают не только пищу (для людей) и корм (для животных), но также и пищу (обеспечивающую питание и потенциально вкус и аромат) и пищевые добавки (консерванты, красители, модификаторы текстуры и т. Д.) Или корм и корм. добавки. Точные определения могут отличаться в зависимости от региона, но международные стандарты, регулируемые Объединенным комитетом экспертов ФАО / ВОЗ по пищевым добавкам, применяются к товарам, продаваемым на международном уровне (ВОЗ, 2017). Правила различаются в зависимости от предполагаемого назначения продукта, и хотя предполагается, что SCP будет либо пищевым продуктом, либо кормом (обеспечивающим питание), некоторые продукты могут поступать на рынок в качестве добавок (например,g., обеспечивающий цвет), а не как SCP, даже если в продукте присутствует белок, что ограничивает степень их добавления и их ценность как SCP. Coppens et al. (2006) обобщили европейские правила, касающиеся пищевых продуктов и пищевых добавок, сделав вывод, что «процесс подготовки« функциональных пищевых продуктов »к рынку, безусловно, является дорогостоящей и трудоемкой задачей», но также и что этот процесс может быть успешным.
Smedley (2013) дает полезные ссылки на конкретные правила, касающиеся кормов и кормовых добавок, в Бразилии, Канаде, Китае, Европейском союзе, Японии, Южной Африке и США, а также на различия между правилами в этих регионах.Следует отметить, что не все животные считаются одинаковыми во всех регионах, поэтому корм для домашних животных регулируется как корм в некоторых областях, но не в других. Перед продажей новых кормов или добавок требуется разрешение (Smedley, 2013).
Ключевыми проблемами являются содержание РНК, токсины, вырабатываемые микробами (производственными хозяевами или контаминантами), потенциальные симптомы аллергии и вредные вещества, полученные из исходного сырья, такие как тяжелые металлы. Были разработаны и используются в промышленности методы снижения содержания РНК до приемлемых уровней, как обсуждалось выше.
Проблема токсинов решается путем тщательного выбора производственного организма, условий процесса и рецептуры продукта. Некоторые грибы производят микотоксины, что делает их нежелательными источниками SCP (Анупама и Равиндра, 2000). Эффекты грибковых токсинов варьируются от аллергических реакций до канцерогенеза и смерти. Поражены как люди, так и животные, поэтому микотоксины недопустимы в SCP для употребления людьми или животными. Микопротеин Quorn ™ прошел обширное тестирование на наличие микотоксинов или других токсичных соединений, прежде чем был одобрен для употребления в пищу человеком (Wiebe, 2004).Конкретный штамм F. venenatum не продуцирует микотоксины в производственных условиях, но процесс все еще контролируется, чтобы гарантировать их отсутствие. Первоначальное тестирование безопасности микопротеина Quorn ™ длилось 16 лет, и еще много лет потребовалось для получения разрешения на продажу за пределами Великобритании (Solomons, 1986). Y. lipolytica — еще один гриб, безопасность которого была тщательно изучена, что свидетельствует о том, что его можно безопасно использовать в различных пищевых продуктах, в том числе в качестве SCP (Groenewald et al., 2014).
Бактерии также могут производить токсины, ограничивающие их использование в качестве SCP. Токсины могут быть внеклеточными (экзотоксины) или клеточно-связанными (эндотоксины). Например, как Pseudomonas spp. и Methylomonas methanica продуцируют высокий уровень белка и были оценены для использования в качестве SCP. Оба также производят эндотоксины, вызывающие лихорадочные реакции (Rudravaram et al., 2009). Их можно разрушить при нагревании. Кроме того, исследование иммуногенности SCP из M. capsulatus показало, что бесклеточный препарат (т.е.е., клеточная стенка удалена) не вызывали иммунных ответов у мышей, хотя препараты цельных клеток вызывали (Steinmann et al., 1990).
Использование различных видов отходов в качестве сырья для производства SCP привлекательно с точки зрения стоимости и устойчивости, но может быть проблематичным с точки зрения безопасности, и необходимо тщательно учитывать происхождение сырья. Например, Quorn ™ производится в среде определенного химического состава из глюкозы (гидролизованный крахмал) с помощью четко определенного процесса, который соответствует стандартам GLP (Wiebe, 2002, 2004).Любой продукт для потребления человеком, который будет производиться из гидролизатов биомассы или потоков отходов, должен будет предоставить эквивалентную запись о безопасности, прежде чем будет одобрен в Европе или Северной Америке. В дополнение к требованиям безопасности, связанным с использованием субстратов, полученных из отходов, для УПП, общественное восприятие и принятие пищевых продуктов, полученных из отходов, будет ключевым элементом, который следует учитывать при внедрении SCP в рационы питания человека.
Генетически модифицированные организмы в производстве SCP — будущие возможности
Использование генетически модифицированных организмов (ГМО) в продуктах питания и кормах еще не нашло общественного признания в Европе, хотя в других странах мира они получили большее признание.По мере накопления данных о потреблении ГМО они могут получить дальнейшее признание, поскольку источники протеина становятся все более дефицитными, особенно если развивается рынок здорового или индивидуального питания. ГМО дрожжи с заводов по производству биоэтанола уже могут использоваться в качестве корма для крупного рогатого скота в некоторых странах. Использование генетических элементов самого хозяина (самоклонирование) часто означает, что чужеродная ДНК не вводится.
Хотя Голдберг (1988) обсуждал перспективу использования генно-инженерных микробов в качестве SCP в 1980-х годах как средство улучшения экономики процесса за счет производства побочных продуктов (например,g., фермент, органическая кислота или антибиотик), эта концепция не получила развития и только в последние годы вызвала больший интерес и признание. Рассмотрен широкий спектр преимуществ продуктов SCP от генетической модификации. Например, компания DuPont с помощью генной инженерии создала дрожжи для производства длинноцепочечных жирных кислот омега-3, которые необходимы для здоровья человека (Xie et al., 2015). Секвенирование генома и генная инженерия также позволяют нарушить работу генов, участвующих в производстве токсинов, и, таким образом, повысить безопасность некоторых продуктов SCP.Нарушение генов может быть достигнуто с помощью традиционного мутагенеза и скрининга, но этот процесс может привести к нежелательным мутациям в продукте, тогда как генетическая модификация происходит быстрее и специфичнее. Этому будут способствовать новые технологии, такие как кластерные регулярные короткие палиндромные повторы (CRISPR), которые позволяют редактировать геном без введения новой ДНК. Штаммы, модифицированные с помощью CRISPR, не обязательно считаются ГМО. Методология CRISPR также может исключить введение в организм генов устойчивости к антибиотикам, избегая опасений по поводу распространения генов устойчивости к антибиотикам за счет использования ГМО.
Метаболизм источника углерода — еще одна цель для улучшения процессов производства SCP, поскольку источник углерода может быть основной статьей затрат при производстве SCP (Ugalde and Castrillo, 2002). Генная инженерия может расширить диапазон субстратов, используемых производственным организмом, или повысить эффективность их использования, позволяя использовать несколько источников сырья и обеспечивая использование всего потенциального углерода в сырье. Например, Ren et al. (2016) представили способность к ферментации ксилозы от Candida intermedia до S.cerevisiae путем расщепления генома, чтобы обеспечить производство этанола из глюкозы и производство SCP из ксилозы, в то время как Cui et al. (2011) представили инулазу Y. lipolytica . Точно так же экспрессия одного или нескольких гидролитических ферментов улучшила использование полимерных субстратов (Song et al., 2017). Целлюлоза, крахмал или сыворотка могут использоваться в консолидированных биопроцессах организмом, модифицированным для производства индивидуально подобранного ферментного коктейля, подходящего для конкретного сырья. Организмы также могут быть сконструированы так, чтобы иметь улучшенную устойчивость к кислотам, щелочам или другим соединениям, связанным с конкретными субстратами.
Генетические модификации могут также повысить нутрицевтическую ценность биомассы либо за счет оптимизации аминокислотного состава, либо за счет увеличения содержания определенных витаминов (например, витамина D, витамина B, биотина), жирных кислот, глутатиона и т. Д. с белком. Существуют значительные возможности для создания SCP с индивидуально подобранным питательным составом.
Генная инженерия может также предоставить новые способы сбора белков для включения в пищу или корм.Например, модификация для улучшения флокуляции могла бы снизить затраты на сбор клеток, или клетки можно было бы модифицировать, чтобы они имели набор ферментов, разрушающих клеточную стенку, которые активировались бы специфическими внеклеточными стимулами для обеспечения белков без клеточных стенок. Точно так же рибонуклеазы могут быть сконструированы для активации в определенное время в условиях, в которых протеазы не активируются. Морфологические характеристики также могут быть изменены для обеспечения определенных органолептических свойств.
Экономические аспекты
Развитие процессов SCP всегда определялось потребностью в белке, и это продолжает оставаться важным фактором развития как старых, так и новых процессов. Повышение ценности легкодоступных потоков субстрата и отходов также было и остается сильным фактором. УПП часто рассматривается как потенциальный побочный продукт, который может усилить экономический потенциал в противном случае убыточного процесса биопереработки, а также как средство снижения затрат на последующую переработку, необходимую для удаления технологических отходов.Продажа остаточной биомассы в качестве корма предпочтительнее продажи в качестве удобрения. Это видно из многочисленных публикаций и патентов (не рассматриваемых в этом обзоре), в которых конкретные отходы превращаются в SCP и оцениваются как пища для конкретных животных. Тем не менее, экологические проблемы теперь также играют важную роль в разработке новых продуктов SCP. Это особенно заметно в процессах, в которых используются парниковые газы: SCP водорослей из CO 2 и бактериальный SCP из метана.Такие процессы вряд ли будут экономически жизнеспособными в краткосрочной перспективе, поскольку при крупномасштабном выращивании еще предстоит преодолеть множество проблем, но они могут выжить там, где они могут получить выгоду от зеленой надбавки. Кроме того, экологические проблемы, а также экономические проблемы помогают стимулировать разработку продуктов из потоков отходов.
Помимо преимуществ для окружающей среды, ключевыми элементами при оценке экономической жизнеспособности производственного процесса SCP являются общая стоимость продукта, капитальные вложения и рентабельность.Угальде и Кастрилло (2002) подсчитали, что при производстве грибковых SCP 62% от общей стоимости продукта будет приходиться на сырье, а 19% — на производственный процесс. По данным Aggelopoulos et al. (2014), затраты на сырье варьируются от 35 до 55% производственных затрат, тогда как эксплуатационные расходы, включая рабочую силу, энергию и расходные материалы, составляют 45–55%. Использование побочных потоков и отходов биомассы иногда рассматривается как средство снижения стоимости субстрата в тех случаях, когда субстрат не ставит под угрозу удобство использования конечного продукта.
Масштаб также важен для экономической жизнеспособности производства SCP. Между стоимостью и масштабом производства существует эмпирическая зависимость. Было доказано, что непрерывные операции являются наиболее прибыльными, и большинство процессов SCP, которые были реализованы в промышленных масштабах, были адаптированы к непрерывному проектированию (Ugalde and Castrillo, 2002). С другой стороны, мелкомасштабное домашнее производство некоторых продуктов может стать возможным во многом так же, как производство домашнего йогурта или грибов, и как было предложено для питания растительных клеток без растений (Poutanen et al., 2017).
Обновленная информация о промышленном производстве SCP — Игроки и возможности
В таблице 4 перечислены компании, которые, как сообщается, производят УПП или проявляют к ней интерес, с указанием веб-сайта и патентной информации, если таковая имеется. Ниже приводится краткое описание некоторых действующих компаний.
Algaeon Inc . производит β-глюкан и цельноклеточные продукты из фотосинтетического протиста Euglena gracillis . Компания Algaeon была основана в 2011 году и базируется в США
.
BlueBioTech Int.GmbH , компания по биотехнологии микроводорослей, которая работает более 10 лет, производя большие количества спирулины и хлореллы .
Калиста Инк . была основана как частная компания в 2011 году. Она производит FeedKind ® из метана на пилотном предприятии в Великобритании и начала распространение коммерческих образцов в 2017 году. Она планирует открыть более крупный завод (производящий до 20 000 тонн в год) в США в 2019 году.
Cangzhou Tianyu Feed Additive Co., Ltd — производитель и торговая компания, расположенная в Хэбэе, Китай, с 2004 года. Их основными продуктами являются дрожжевой порошок, хлорид холина, бетаин и аллицин, имеющие рынки в Юго-Восточной Азии, Восточной Азии, Океании, Южной Азии и Южной Америке. В компании работает 50 человек, а их общий доход составляет 5–10 миллионов долларов США.
CBH Qingdao Co., Ltd была признанной компанией на протяжении десятилетий, поставляющей широкий спектр ингредиентов и добавок для кормовой и пищевой промышленности. Они могут поставлять продукцию, соответствующую стандартам FAMI-QS, ISO, GMP, KOSHER и HALAL.
Cyanotech Corporation — один из ведущих мировых производителей Spirulina с продажами в США и 30 других странах. Их оборот в 2016 году составил почти 32 миллиона долларов США. FDA присвоило статус GRAS продукту Cyanotech Spirulina в качестве пищевого ингредиента.
Компания Proteus Corporation, прародительница Earthrise , была основана в 1976 году. Они производят Spirulina со статусом GRAS. Они сертифицированы по GMP и имеют сертификат системы безопасности пищевых продуктов (FSSC) 22000: 2011.
E.I.D Parry Ltd., подразделение Parry Nutraceuticals является частью группы Murugappa с оборотом 4,4 млрд долларов США. Они используют технологию микроводорослей для производства нутрицевтиков, таких как Spirulina и Chlorella . Их продукция продается более чем в 40 странах, а их основные рынки находятся в Северной Америке, Европе, Юго-Восточной Азии и на Дальнем Востоке.
Эвглена Ко. Лтд. . была основана в Японии в 2005 году. Среди других продуктов, полученных из Euglena gracillis , Euglena Co.Ltd. разрабатывает обезжиренную эвглену как источник богатого белком корма для животных.
KnipBio была основана в 2013 году в США с целью предоставления доступных кормов для аквакультуры. Они производят KnipBio Meal из метанола с использованием метилотрофных бактерий и планируют начать коммерческое производство в 2018 году.
Lallemand Inc . канадская компания, специализирующаяся на разработке, производстве и продаже дрожжей и бактерий. Компания состоит из двух основных групп: Yeast Group (Монреаль, Канада) и Specialties Group (Тулуза, Франция).Они производят SCP для потребления человеком (LBI, Lake States ® , Engevita ™) из дрожжей S. cerevisiae и Torula .
LeSaffre производит дрожжи ( S. cerevisiae ) и продукты на основе дрожжей, включая SCP, такие как Lynside ® Nutri, Lynside ® ProteYn и родственные продукты (продукты Lesaffre Human Care), а также вкусовые ингредиенты на основе дрожжей. (Продукция Biospringer). В компании работают 7 700 сотрудников и более 80 дочерних компаний в более чем 40 странах мира.Их продукты и услуги продаются более чем в 180 странах, а их оборот в 2013 году составил ~ 1,6 миллиарда евро.
Marlow Foods Ltd производит микопротеин Quorn ™. Проект развития Quorn начался еще в 1960-х годах, когда они начали искать источник микробного белка, который понравился бы людям. Куорн классифицируется как безопасный, хорошо переносимый продукт регулирующими органами по всему миру, включая FDA и Агентство по пищевым стандартам Великобритании (FSA). Компания была приобретена Monde Nissin Corporation на Филиппинах за 831 миллион долларов США в 2015 году.
Nucelis Inc . была основана в 2010 году в США, но стала дочерней компанией Cibus Global в 2014 году. Наряду со скваленом, витамином D и пищевыми маслами Nucelis Inc. разрабатывает муку с высоким содержанием белка из дрожжей Yarrowia .
Nutrinsic базируется в США и имеет дочерние компании в Китае. Nutrinsic фокусируется на использовании сточных вод пищевой промышленности, производства напитков и биотоплива для производства кормов и удобрений. Они продают SCP для корма для животных под названием ProFloc ™, который, по описанию, содержит около 60% белка.Они открыли свое первое производство в США в 2015 году, используя сточные воды местной пивоварни.
Tangshan Top Bio-Technology Co., Ltd — производитель и торговая компания, расположенная в Хэбэе, Китай (материк). Их основные продукты: пивные дрожжи, автолизированные дрожжи, клеточная стенка дрожжей и дрожжевой экстракт, включая 100% натуральный, без ГМО, чистый дрожжевой порошок в качестве добавки к корму для животных по цене 1100–1250 долларов США за тонну и производственная мощность 15000 тонн. в год на производственную линию.Компания была основана в 2009 году и насчитывает около 200 сотрудников. Их основные рынки находятся в Китае, Восточной Азии, Западной Европе, Юго-Восточной Азии и Среднем Востоке, при этом 40–50% их продукции экспортируется.
ТерраВиа Холдингс, Инк . — публичная американская компания, специализирующаяся на поставках ингредиентов для продуктов питания и средств ухода из эукариотических водорослей. TerraVia появилась в 2016 году, но является производным от компании Solazyme Inc., основанной в 2003 году. TerraVia использует традиционные реакторы с мешалкой для выращивания своих водорослей.
UniBio A / S, Дания — это МСП, владеющее правами на уникальную технологию ферментации — технологию U-Loop, которая позволяет превращать природный газ в продукт с высоким содержанием белка — UniProtein ® . UniProtein ® имеет содержание белка ~ 71% и может использоваться в кормах для животных. UniBio A / S была основана в 2001 году.
Unilever производит дрожжевой экстракт Marmite ® из отработанного зерна пивоварни. Количество сотрудников составляет около 169 000 человек, а оборот компании составил 52 доллара США.7 миллиардов в 2016 году.
Vega Pharma Ltd расположена в Чжэцзяне, Китай. Группа компаний Vega разрабатывает, производит и продает фармацевтические препараты, пищевые ингредиенты, продукты для здоровья животных и пробиотики. Они предлагают SCP, содержащий до 65% белка и относительно высокий уровень треонина, в корм животным в качестве побочного продукта производства глутамата натрия.
Таблица 4 . Промышленные предприятия, занимающиеся производством SCP.
Последние патенты (2001–2016)
Последние патенты (2001–2016 гг.), Относящиеся к производству SCP с помощью водорослей, грибов, бактерий и смешанных микробных популяций, перечислены в таблицах 5–8.Некоторые патенты, принадлежащие промышленным операторам, также показаны в таблице 4. Количество патентов, связанных с использованием водорослей, бактерий, дрожжей или смешанных популяций, относительно равномерно разделено. Также было зарегистрировано множество патентов, в которых микробная биомасса образует компонент кормовой смеси, которая предназначена для обеспечения белком и другими питательными веществами рыб или сельскохозяйственных животных. Они не были включены в Таблицы 5–8, поскольку неясно, сколько протеина обеспечивается микробом, а сколько другими компонентами, такими как соя, фасоль или рыбная мука.
Таблица 5 . Патенты, связанные с получением SCP из водорослей в 2001–2016 гг. *.
Таблица 6 . Патенты, относящиеся к производству SCP из дрожжей или нитчатых грибов в 2001–2016 гг. *.
Таблица 7 . Патенты, относящиеся к производству SCP из бактерий в 2001–2016 гг. *.
Таблица 8 . Патенты, относящиеся к производству SCP из смешанных микробных популяций (бактерий и / или дрожжей и / или водорослей) или в которых микроорганизм не был указан в течение 2001–2016 годов *.
Отрасли промышленности и университеты в Китае были особенно активны в регистрации патентов, связанных с УПП, в последние годы, причем около 70% патентов, выданных с 2001 года, были зарегистрированы в Китае. В Китае большое внимание уделяется производству SCP путем ферментации сельскохозяйственных или пищевых остатков бактериями, дрожжами и смешанными популяциями. Таким образом, производство SCP часто сочетается с биоремедиацией и переработкой отходов.
Несколько важных патентов, связанных с использованием соединений C1, таких как метанол и метан, были зарегистрированы до 2001 г. и не были включены в этот обзор.Однако появилось два новых патента на производство SCP из метанола и шесть на производство SCP из метана (Таблица 7). SCP из водорослей также продолжает генерировать патенты, при этом внимание уделяется рецептурам продуктов, а также продолжаются разработки методов выращивания (таблица 5).
Заключительные замечания
Как видно из Таблицы 4, существует широкий спектр отраслей, вовлеченных в производство SCP, некоторые из которых производят SCP как побочный продукт других процессов, а другие сосредоточены в первую очередь на SCP.SCP из мицелиальных грибов и дрожжей продолжает доминировать на устоявшихся рынках, особенно если рассматривать SCP для потребления человеком. Дрожжевые SCP имеют долгую историю использования, что способствует их дальнейшему распространению на рынке. Однако SCP для человека из нитчатых грибов, вероятно, останется ограниченным F. venenatum (Quorn ™) и твердофазными ферментациями с другими пищевыми грибами из-за риска микотоксинов и долгого пути к нормативному признанию. Дрожжи также давно используются в качестве добавок к кормовой промышленности.Большая часть грибковых SCP, содержащихся в кормах для животных, является побочным продуктом производства продуктов питания и напитков, а также биоперерабатывающих заводов, на которых гриб сначала действует как биокатализатор для создания основного продукта, а затем обеспечивает обогащенные белком остатки, которые продаются в качестве корма. Грибковые SCP обладают такими преимуществами, как знакомство, хорошо зарекомендовавшие себя подходы к обработке и доступность. Основным препятствием является внедрение УПП новых видов, которые вызывают академический и патентный интерес, но которые трудно вывести на рынок.
Водоросли также имеют хорошо налаженные рынки как для пищевых продуктов, так и для кормов, хотя они традиционно ориентированы не на водоросли как SCP, а на пищевые добавки, содержащие омега-3 жирные кислоты, каротиноиды и витамины, с белком в качестве дополнительного преимущества. Поскольку с продуктами обращаются как с добавками или красителями, нормативные требования отличаются от требований для непосредственного использования в пищевых продуктах или кормах, что способствует появлению новых видов для потенциальных продуктов. Продукты из водорослей обычно имеют ароматизаторы, которые могут ограничивать количество, которое человек хотел бы съесть, уменьшая потребность в обширной переработке для уменьшения РНК, но также ограничивая количество белка, поступающего в рацион.Однако несколько молодых МСП, вышедших на рынок, разрабатывают процессы производства продуктов со слабым вкусом, которые могут увеличить вклад водорослевого белка в рацион человека. У водорослей SCP есть преимущества, заключающиеся в обеспечении здоровых липидов вместе с белком, при потенциальном потреблении CO 2 . Он считается экологически чистым и очень «зеленым». Основными препятствиями являются стоимость производства и необходимость в новой рецептуре, чтобы сделать ее приемлемой для людей.УПП из водорослей, вероятно, будет сильным в кормовой промышленности, если удастся снизить производственные затраты.
Бактериальный SCP в первую очередь ограничивается кормовой промышленностью, если не включает цианобактериальные продукты с нефотосинтезирующими бактериями. Некоторые бактериальные SCP в настоящее время являются побочным продуктом других отраслей промышленности, таких как производство глутамата натрия, и ожидается, что этот тип кормового продукта будет увеличиваться с расширением биоперерабатывающих заводов, как и в случае с дрожжами. Однако самые интересные современные разработки бактериальных SCP связаны с использованием метана в качестве источника углерода.Хотя использование метана для производства бактериальной биомассы не ново, движущие силы развития перешли от метана как дешевого источника углерода к бактериям как средству сокращения выбросов парниковых газов и потенциальной интеграции производства кормов с животноводством. . Низкая растворимость метана в сочетании с низкой скоростью роста бактерий является серьезным препятствием на пути к успеху в этой области. Однако молодые малые и средние предприятия, такие как UniBio и Calysta Inc., считают, что препятствия можно преодолеть.Бактериальные SCP, отличные от метана, обладают преимуществами в виде высоких скоростей продуцирования, но им не хватает из-за низкой степени узнаваемости и высокого содержания нуклеиновых кислот, что увеличивает затраты на обработку.
Первоначально SCP приобрели значение в питании людей во время войны, когда традиционных источников белка стало не хватать. Во второй половине двадцатого века он снова стал вызывать интерес из-за озабоченности по поводу удовлетворения потребностей в белке постоянно растущего населения мира. Эти опасения были глобальными, но когда мы рассматриваем текущий интерес к SCP, мы видим, что страны, которые сейчас проводят исследования и разработки новых SCP, как правило, являются странами с большим населением (например,г., Китай и Индия) и проблемы с недоеданием. Самые последние патенты, связанные с SCP, были поданы в Китае, что указывает на важность SCP для будущего производства продуктов питания и кормов. Быстрый рост продуктов SCP можно ожидать в Китае и, возможно, во всей Азии. Развитие SCP водорослей составляет исключение из этого наблюдения — поскольку в последние годы во всем мире было создано множество компаний для разработки продуктов, которые могут использовать текущую избыточную доступность CO 2 . Таким образом, движущие силы развития SCP водорослей несколько отличаются от движущих сил развития SCP бактериальных и грибковых.Производство SCP из метана разделяет эту экологическую озабоченность и возможность с развитием водорослей.
Расширение процессов биопереработки, как часть расширения концепций биоэкономики и экономики замкнутого цикла, также выступает в качестве движущей силы для разработки SCP для использования в качестве корма для животных, поскольку преобразование отходов в корм для животных обеспечивает лучшую рентабельность инвестиции, чем сжигание остаточной микробной биомассы или ее использование в качестве удобрения. Нормативное разрешение по-прежнему необходимо для использования новых продуктов в кормах для животных, но оно отличается от разрешения, необходимого для употребления в пищу человеком, и более широкий диапазон субстратов считается приемлемым, если продукт предназначен для использования в животных.Таким образом, можно ожидать большего расширения доступных SCP для кормов для животных, чем для продуктов питания для людей. Тем не менее, растет понимание неэффективности преобразования биомассы растений в SCP, который скармливают животным, а не непосредственно людям, что также подтолкнет разработку безопасных SCP в качестве пищи.
На западе интерес к здоровому питанию и новинкам в еде помогает пробудить новый интерес к SCP, а также размывает границы того, какие продукты могут быть включены в SCP. Культуры клеток как растений, так и животных могут внести свой вклад в обеспечение питания в будущем (Poutanen et al., 2017), но не соответствуют определению SCP как происходящего из микробных клеток. Кроме того, формы, в которых можно употреблять SCP, продолжают развиваться. SCP дрожжевых грибов употребляли в течение десятилетий в виде клеточного экстракта в форме паст, которые можно намазывать на хлеб, тогда как SCP грибов, который используется в Quorn ™, был намеренно разработан как продукт, который можно было бы разделить на кусочки и ломтики, которые больше очень напоминают мясо. Недавно разработанные продукты часто имеют форму сухих порошков или муки, которые предназначены для смешивания с другими ингредиентами для создания продуктов, в которых отдельные компоненты не воспринимаются.Такие продукты подходят для добавления в протеиновые батончики и напитки, такие как смузи, которые сейчас популярны. Кроме того, продолжают развиваться твердотельные ферментации, в которых используются микробы для улучшения качества белка и вкусовых качеств растительных продуктов или ингредиентов с низким содержанием питательных веществ. Строго говоря, это не SCP, поскольку и микроб, и исходный субстрат вносят свой вклад в конечный продукт, но они также будут вносить свой вклад в поставку белка в будущем. Наличие широкого ассортимента пищевых продуктов, содержащих SCP, должно стимулировать дальнейшее расширение рынка.
Авторские взносы
AR, SH и MT в равной степени внесли свой вклад в исследование и написание этой статьи. MW предоставил информацию о SCP водорослей и грибов, участвовал в написании статьи, а также просмотрел и отредактировал рукопись.
Финансирование
Авторы благодарят ООО «ВТТ» за финансовую поддержку.
Заявление о конфликте интересов
Авторы являются сотрудниками VTT Technical Research Center of Finland Ltd. и заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.MW получал финансовую поддержку от Marlow Foods в 1986–1989 годах и работал в проектах, поддерживаемых Marlow Foods с 1989 по 1994 год, но не имел постоянного сотрудничества с ними.
Другие авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы благодарят докторов наук. Йоханна Бухерт, Лаура Руохонен и Тийна Накари-Сетяля за запрос на обзор и поддержку его публикации.
Сокращения
DSP, нисходящая обработка; ГМО, генетически модифицированный организм; GRAS, признанный безопасным; SCP, одноклеточный белок; QPS, Квалифицированная презумпция безопасности микроорганизмов в пищевых продуктах и кормах.
Список литературы
Аггелопулос, Т., Кациерис, К., Бекатору, А., Панди, А., Банат, И. М., и Кутинас, А. А. (2014). Твердотельная ферментация смесей пищевых отходов для производства одноклеточного белка, летучих ароматических веществ и жира. Food Chem. 145, 710–716. DOI: 10.1016 / j.foodchem.2013.07.105
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ахмади, А. Р., Горчиан, Х., Хаджихосаини, Р., и Ханифар, Дж. (2010). Определение количества белка и аминокислот, экстрагированных из микробного белка (SCP) лигноцеллюлозных отходов. Пакистан J. Biol. Sci . 13, 355–361. DOI: 10.3923 / pjbs.2010.355.361
CrossRef Полный текст
Анбуселви, А., Махаланобис, С., Джа, М. (2014). Оптимизация одноклеточного белка с использованием зеленой лузги и бенгальской лузги с использованием дрожжей. Внутр. J. Pharm. Sci. Ред. Рез. . 28, 188–190.
Андерсон, К., Соломонс, Г. Л. (1984). «Первичный метаболизм и производство биомассы из Fusarium», в The Applied Mycology of Fusarium , ред. М. О. Мосс и Дж. Э. Смит (Кембридж: издательство Кембриджского университета), 231–250.
Андерсон, К., Лонгтон, Дж., Мэддикс, К., Скаммелл, Г.У. и Соломонов Г. Л. (1975). «Рост микрогрибов на углеводах», в Single-Cell Protein II , ред. С. Р. Танненбаум и Д. И. К. Ван (Кембридж, Массачусетс: MIT Press), 314–329.
Google Scholar
Апанди, Н. М., Мохамед, Р. М. С. Р., Латиффи, Н. А. А., Розлан, Н. Ф. М., и Аль-Гити, А. А. С. (2017). Содержание белков и липидов в микроводорослях Scenedesmus sp. биомасса, выращенная в сточных водах влажного рынка. Веб-конференция MATEC. 103: 06011. DOI: 10.1051 / matecconf / 201710306011
CrossRef Полный текст | Google Scholar
Багчи, Д. (2006). Нормативы в отношении нутрицевтиков и функциональных пищевых продуктов в США и во всем мире. Токсикология 221, 1–3. DOI: 10.1016 / j.tox.2006.01.001
PubMed Аннотация | CrossRef Полный текст
Baldensperger, J., Le Mer, J., Hannibal, L., and Quinto, P.J. (1985). Твердотельное брожение банановых отходов. Biotechnol. Lett . 7, 743–748. DOI: 10.1007 / BF01032289
CrossRef Полный текст | Google Scholar
Бамберг, Дж. (2000). Бритиш петролеум и глобальная нефть 1950-1975: вызов национализму . Кембридж: Издательство Кембриджского университета.
Google Scholar
Бхалла, Т. К., и Джоши, М. (1994). Обогащение белком яблочного жмыха путем совместного культивирования целлюлолитических плесневых грибов и дрожжей. World J. Microbiol. Биотехнология . 10, 116–117. DOI: 10.1007 / BF00357577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Боланд, М.J., Rae, A.N., Vereijken, J.M., Meuwissen, M.P.M., Fischer, A.R.H., van Boekel, M.A.J.S. и др. (2013). Будущие поставки белка животного происхождения для потребления человеком. Trends Food Sci. Технол . 29, 62–73. DOI: 10.1016 / j.tifs.2012.07.002
CrossRef Полный текст | Google Scholar
Бурдишон, Ф., Касарегола, С., Фаррох, К., Фрисвад, Дж. К., Гердс, М. Л., Хаммес, В. П. и др. (2012). Пищевые ферментации: микроорганизмы с технологическим полезным использованием. Внутр. J. Food Microbiol . 154, 87–97. DOI: 10.1016 / j.ijfoodmicro.2011.12.030
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Chiou, P. W. S., Chiu, S. W., and Chen, C. R. (2001). Ценность продукта ферментации Aspergillus niger в качестве диетического ингредиента для цыплят-бройлеров. Animal Feed Sci. Технол . 91, 171–182. DOI: 10.1016 / S0377-8401 (01) 00224-3
CrossRef Полный текст | Google Scholar
Коппенс, П., да Силва, М. Ф., и Петтман, С. (2006). Европейские правила в отношении нутрицевтиков, диетических добавок и функциональных пищевых продуктов: основа, основанная на безопасности. Токсикология 221, 59–74. DOI: 10.1016 / j.tox.2005.12.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цуй, В., Ван, К., Чжан, Ф., Чжан, С.-С., Чи, З.-М., и Мадзак, К. (2011). Прямое преобразование инулина в одноклеточный белок с помощью сконструированного Yarrowia lipolytica , несущего ген инулиназы. Процесс Биохим . 46, 1442–1448. DOI: 10.1016 / j.procbio.2011.03.017
CrossRef Полный текст | Google Scholar
Де Грегорио А., Мандалари Г., Арена Н., Нусита Ф., Триподо М. М. и Ло Курто Р. Б. (2002). Производство SCP и сырой пектиназы путем ферментации мякоти лимона в суспензионном состоянии. Биоресурсы. Технол . 83, 89–94. DOI: 10.1016 / S0960-8524 (01) 00209-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Де Оливейра, М.А.С.Л., Монтейро, М.П.С., Роббс, П.Г., и Лейте, С.Г.Ф. (1999). Рост и химический состав биомассы Spirulina maxima и Spirulina platensis при различных температурах. Aquacult. Инт . 7, 261–275. DOI: 10.1023 / A: 1009233230706
CrossRef Полный текст | Google Scholar
Дуарте, Л. К., Карвалейро, Ф., Лопес, С., Невес, И., и Гириу, Ф. М. (2008). Производство дрожжевой биомассы в гемицеллюлозном гидролизате отработанного зерна пивоварни. Заявл.Биохим. Биотехнология . 148, 119–129. DOI: 10.1007 / s12010-007-8046-6
CrossRef Полный текст | Google Scholar
Дуонг, В. Т., Ахмед, Ф., Томас-Холл, С. Р., Куигли, С., Новак, Э., и Шенк, П. М. (2015). Микроводоросли с высоким содержанием белка и высоким содержанием липидов из северной Австралии в качестве потенциального сырья для кормов для животных и биодизеля. Фронт. Bioeng. Biotechnol. 3:53. DOI: 10.3389 / fbioe.2015.00053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эдельман, Дж., Фьюэлл, А., Соломонс, Г. Л. (1983). Микопротеин — новая пища. Nutr. Abstr. Преподобный Clin. Нутр . 53, 471–480.
Энцинг, К., Плоег, М., Барбоза, М., и Сийтсма, Л. (2014). Продукты на основе микроводорослей для сектора пищевых продуктов и кормов: европейский прогноз . Научные и политические отчеты JRC (JRC85709), редакторы М. Вигани, К. Паризи и Э. Родригес-Сересо (Бюро публикаций Европейского Союза).
Google Scholar
Эрдман, М. Д., Берген, В.Г. и Редди К. А. (1977). Аминокислотные профили и предполагаемая оценка питания одноклеточного белка из некоторых лактобацилл. Заявл. Environ. Микробиол . 33, 901–905.
PubMed Аннотация | Google Scholar
Гао, Х., Сюй, Дж. Г. (2015). Метод измерения общего количества нуклеотидов в белковых продуктах . Патент № CN104316621A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Гао, Ю., Ки, Д., и Лю, Ю. (2012).Производство одноклеточного белка из соевой патоки с использованием Candida tropicalis. Ann. Микробиол . 62, 1165–1172. DOI: 10.1007 / s13213-011-0356-9
CrossRef Полный текст | Google Scholar
Гасеми Ю., Расул-Амини С. и Моровват М. Х. (2011). «Водоросли для производства SCP», в «Тенденции биохимических исследований ». Науки и технологии биопроцессов , изд. М.-Т. Liong (Нью-Йорк: Hauppage) 163–184.
Google Scholar
Гольдберг, И.(1988). Будущие перспективы генно-инженерного одноклеточного белка. Trends Biotechnol. 6, 32–34. DOI: 10.1016 / 0167-7799 (88) -3
CrossRef Полный текст | Google Scholar
Гувейя Л., Батиста А. Б., Соуза И., Раймундо А. и Бандарра Н. М. (2008). «Микроводоросли в новых пищевых продуктах», в Food Chemistry Research Developments , ed. К. Пападопулос (Нью-Йорк, Нью-Йорк: Nova Science Publishers), 75–111.
Google Scholar
Грюневальд, М., Бекхаут, Т., Невеглиз, К., Гайлардин, К., ван Дейк, П. В. М. и Висс, М. (2014). Yarrowia lipolytica : оценка безопасности маслянистых дрожжей с большим промышленным потенциалом. Crit. rev. Микробиол . 40, 187–206. DOI: 10.3109 / 1040841X.2013.770386
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хамеш Э. Э. и Демир Т. (2015). Микробные рибонуклеазы (РНКазы): производство и возможности применения. World J. Microbiol.Биотехнология . 31, 1853–1862. DOI: 10.1007 / s11274-015-1945-8
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Харун Р., Сингх М., Форд Г. М. и Данкуа М. К. (2010). Биотехнология микроводорослей для производства разнообразных потребительских товаров. Обновить. Sust. Энергия Ред. . 14, 1037–1047. DOI: 10.1016 / j.rser.2009.11.004
CrossRef Полный текст | Google Scholar
Хашем, М., Хешам, А. Э.-Л., Аламри, С. А., и Альрамман, С.А. (2014). Производство одноклеточного белка из потерянных плодов фиников Hanseniaspora uvarum KKUY-0084 и Zygosaccharomyces rouxii KKUY-0157. Ann. Микробиол . 64, 1505–1511. DOI: 10.1007 / s13213-013-0793-8
CrossRef Полный текст | Google Scholar
Хицман, Д. О. (1986). «Процесс Provesteen — ферментация сверхвысокой плотности» в Microbial Biomass Proteins , eds. М. Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 27–32.
Google Scholar
Джаласутрам В., Катарам С., Ганду Б. и Ануподжу Г. Р. (2013). Производство одноклеточного белка из переваренного и непереваренного помета птицы с помощью Candida utilis : оптимизация параметров процесса с использованием методологии поверхности отклика. Clean Technol. Environ. Политика 15, 265–273. DOI: 10.1007 / s10098-012-0504-3
CrossRef Полный текст | Google Scholar
Кадим, И. Т., Махгуб, О., Бакир, С., Фэй, Б., и Покупки, Р.(2015). Мясо из мышечных стволовых клеток: обзор проблем и перспектив. J. Integr. Сельское хозяйство . 14, 222–233. DOI: 10.1016 / S2095-3119 (14) 60881-9
CrossRef Полный текст | Google Scholar
Кам, С., Абедиан Кенари, А., Юнеси, Х. (2012). Продукция одноклеточного белка в липкой воде Lactobacillus acidophilus и Aspergillus niger . J. Aquat. Food Prod. Технол . 21, 403–417. DOI: 10.1080 / 10498850.2011.605539
CrossRef Полный текст | Google Scholar
Рыцарь, Н., Робертс, Дж., И Шелтон, Д. (2001). Термостойкость изделий QuornTM. Внутр. J. Food Sci. Технол . 36, 47–52. DOI: 10.1046 / j.1365-2621.2001.00424.x
CrossRef Полный текст | Google Scholar
Койвуринта Дж., Куркела Р. и Койвистойнен П. (1979). Использование Пекило, биомассы микрогриба из Paecilomyces varioti в колбасе и фрикадельках. Внутр. J Food Sci. Технол . 14, 561–570.
Google Scholar
Корночалерт, Н., Кантачоте, Д., Чайпрапат, С., и Теккарнярук, С. (2014). Использование Rhodopseudomonas palustris P1 стимулировало рост ферментированным экстрактом ананаса для обработки сточных вод латексных резиновых листов с целью получения одноклеточного белка. Ann. Микробиол . 64, 1021–1032. DOI: 10.1007 / s13213-013-0739-1
CrossRef Полный текст | Google Scholar
Кунасундари, Б., Муругайя, В., Каур, Г., Маурер, Ф. Х. Дж., И Кумар, С. (2013). Возвращаясь к применению одноклеточного белка Cupriavidus necator h26 и одновременному извлечению гранул биопласта. PLoS ONE 8: e78528. DOI: 10.1371 / journal.pone.0078528
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Курбаноглу, Э. Б., и Алгур, О. Ф. (2002). Производство одноклеточного белка из гидролизата бараньего рога бактериями. Биоресурсы. Технол . 85, 125–129. DOI: 10.1016 / S0960-8524 (02) 00094-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ланг, В., Беллисл, Ф., Аламович, К., Краплет, К., Борнет, Ф. Р. Дж., Slama, G., et al. (1999). Варьирование источника белка в смешанном питании изменяет кинетику глюкозы, инсулина и глюкагона у здоровых мужчин, оказывает слабое влияние на субъективное чувство сытости и не влияет на потребление пищи. Eur. J. Clin. Нутр . 53, 959–965. DOI: 10.1038 / sj.ejcn.1600881
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, Дж. З., Логан, А., Терри, С., и Спир, Дж. Р. (2015). Микробный ответ на производство одноклеточного белка и очистку пивоваренных сточных вод. Микробиологическая биотехнология . 8, 65–76. DOI: 10.1111 / 1751-7915.12128
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К., Ян, Х., Ли, Ю., Ченг, Л., Чжан, М., Чжан, Л. и др. (2013). Новые биоконверсии городских сточных вод и CO2 в богатую белком биомассу Chlorella vulgaris. Биоресурсы. Технол . 132, 171–177. DOI: 10.1016 / j.biortech.2012.12.017
CrossRef Полный текст | Google Scholar
Лю Б., Ли Ю., Сун Дж., Чжан, Л., Донг, Дж., И Ян, К. (2014). Производство одноклеточного белка с двухступенчатой ферментацией для обработки отходов переработки картофельного крахмала. Целлюлоза 21, 3637–3645. DOI: 10.1007 / s10570-014-0400-6
CrossRef Полный текст | Google Scholar
Лю Б., Сун Дж., Ли Ю., Ню Дж., Ван З. и Ян К. (2013). На пути к промышленно осуществимой переработке отходов переработки картофельного крахмала смешанными культурами. Заявл. Биохим. Биотехнология . 171, 1001–1010.DOI: 10.1007 / s12010-013-0401-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Махмуд Р., Ибрагим М. и Али Г. (2016). Закрытый фотобиореактор для производства биомассы микроводорослей в условиях выращивания в помещении. J. Algal Biomass Utln . 7, 86–92.
Google Scholar
Мартинес, М. К., Санчес-Монтеро, Дж. М., Синистерра, Дж. В., и Баллестерос, А. (1990). Новые нерастворимые производные рибонуклеазы и эндонуклеазы для удаления нуклеиновых кислот в концентратах одноклеточных белков. Biotechnol. Прил. Биохим . 12, 643–652.
PubMed Аннотация | Google Scholar
Мюллер-Феуга, А. (2000). Роль микроводорослей в аквакультуре: ситуация и тенденции. J. Appl. Phycol . 12, 527–534. DOI: 10.1023 / A: 1008106304417
CrossRef Полный текст | Google Scholar
Нассери А. Т., Расул-Амини С., Моровват М. Х. и Гасеми Ю. (2011). Одноклеточный белок: производство и процесс. Am. J. Food Technol . 6, 103–116.DOI: 10.3923 / ajft.2011.103.116
CrossRef Полный текст | Google Scholar
Эверланд М., Таусон А. Х., Ширер К. и Скреде А. (2010). Оценка продуктов, содержащих метан-утилизирующие бактерии, в качестве кормовых ингредиентов для животных с однокамерным желудком. Arch. Anim. Нутр . 64, 171–189. DOI: 10.1080 / 1745036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Параскевопулу, А., Атанасиадис, И., Канеллаки, М., Бекатуру, А., Блекас, Г., и Киоссеоглу, В.(2003). Функциональные свойства белка сигловых клеток, продуцируемого кефирной микрофлорой. Food Res. Инт . 36, 431–438. DOI: 10.1016 / S0963-9969 (02) 00176-X
CrossRef Полный текст | Google Scholar
Песоа А. младший, Мансила И. М. и Сато С. (1996). Выращивание Candida tropicalis в гемицеллюлозном гидролизате сахарного тростника для производства микробного белка. Дж. Биотехнология . 51, 83–88. DOI: 10.1016 / 0168-1656 (96) 01572-6
CrossRef Полный текст | Google Scholar
Петерсен, Л.А. Х., Вилладсен, Дж., Йоргенсен, С. Б., и Герней, К. В. (2017). Смешивание и массообмен в пилотном биореакторе с U-образной петлей. Biotechnol. Bioeng . 114, 344–354. DOI: 10.1002 / бит. 26084
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филипп, Ф.-Х., и Никс, Б. (2015). Обзор выбросов парниковых газов от свинарников: производство диоксида углерода, метана и закиси азота животными и навозом. Agric. Экосист. Окружающая среда . 199, 10–25.DOI: 10.1016 / j.agee.2014.08.015
CrossRef Полный текст
Поутанен, К., Нордлунд, Э., Пааси, Дж., Вехмас, К., и Окерман, М. (2017). Продовольственная экономика 4.0: видение VTT эры разумного производства продуктов питания, ориентированного на потребителя . Хельсинки: VTT Technical Research Center of Finland Ltd. Доступно на сайте: http://www.vtt.fi/inf/pdf/visions/2017/V10.pdf) VTT VISIONS 10
Рафикул И. М., Джалал К. К. А. и Алам М. З. (2005). Факторы окружающей среды для оптимизации биомассы спирулины в лабораторной культуре. Биотехнология 4, 19–22. DOI: 10.3923 / biotech.2005.19.22
CrossRef Полный текст
Рао, М., Варма, А. Дж., И Дешмук, С. С. (2010). Производство Penicillium janthinellum одноклеточного белка, незаменимых аминокислот и ксиланазы. BioResource 5, 2470–2477.
Google Scholar
Рашад, М. М., Мохариб, С. А., и Джванни, Э. У. (1990). Преобразование дрожжевыми отходами манго или метанола в одноклеточный белок и другие метаболиты. Biol. Отходы 32, 277–284. DOI: 10.1016 / 0269-7483 (90) -2
CrossRef Полный текст | Google Scholar
Равиндер Р., Венкатешвар Рао Л. и Равиндра П. (2003). Исследования мутантов Aspergillus oryzae для продукции одноклеточных белков из обезжиренных рисовых отрубей. Food Technol. Биотехнология . 41, 243–246.
Google Scholar
Ren, X., Wang, J., Yu, H., Peng, C., Hu, J., Ruan, Z., et al. (2016). Анаэробное и последовательное аэробное производство этанола с высоким титром и одноклеточного белка из кукурузной соломы, предварительно обработанной NaOH, штаммом Saccharomyces cerevisiae , модифицированным перетасовкой генома. Биоресурсы. Технол . 218, 623–630. DOI: 10.1016 / j.biortech.2016.06.118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ришипал Р. и Филип Р. (1998). Селекция морских дрожжей для получения одноклеточного белка из отходов панциря креветок. Биоресурсы Технол . 65, 255–256. DOI: 10.1016 / S0960-8524 (97) 00179-X
CrossRef Полный текст | Google Scholar
Родригес, Дж., Ферраз, А., Ногейра, Р. Ф. П., Феррер, И., Эспозито, Э., и Дюран, Н. (1997). Биодеградация лигнина аскомицетом Chrysondia sitophila. Заявл. Биохим. Биотехнология . 62, 233–242. DOI: 10.1007 / BF02787999
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родригес-Завала, Дж. С., Ортис-Крус, М. А., Мендоса-Эрнандес, Г., и Морено-Санчес, Р. (2010). Повышенный синтез a-токоферола, парамилона и тирозина Euglena gracilis в условиях высокой продукции биомассы. Дж.Прил. Микробиол . 109, 2160–2172. DOI: 10.1111 / j.1365-2672.2010.04848.x
CrossRef Полный текст | Google Scholar
Рудраварам, Р., Чандель, А. К., Рао, Л. В., Хуэй, Ю. З., и Равиндра, П. (2009). «Био (одноклеточный) белок: вопросы производства, токсины и статус коммерциализации», в Сельскохозяйственные отходы , ред. Г. С. Эшворт и П. Азеведо (Нью-Йорк, Нью-Йорк: Хауппейдж), 129–153.
Google Scholar
Safafar, H., Nørregaard, P.U., Ljubic, A., Мёллер, П., Холдт, С. Л., и Якобсен, К. (2016). Повышение содержания белка и пигментов у двух видов хлореллы, выращиваемых на промышленной технологической воде. J. Mar. Sci. Eng . 4:84. DOI: 10.3390 / jmse4040084
CrossRef Полный текст | Google Scholar
Шульц Э. и Ослаге Х. Дж. (1976). Состав и пищевая ценность одноклеточного белка (SCP). Anim. Feed Sci. Технол . 1, 9–24. DOI: 10.1016 / 0377-8401 (76)
-1
CrossRef Полный текст | Google Scholar
Сински, А.Дж. И Танненбаум С. Р. (1975). «Удаление нуклеиновых кислот в SCP» в Single-Cell Protein II , ред. С. Р. Танненбаум и Д. И. К. Ван (Кембридж, Массачусетс: MIT Press), 158–178.
Google Scholar
Сисман, Т., Озлем, Г., Доган, Н., Оздал, М., Алгур, Э. Ф. и Эргон Т. (2013). Одноклеточный белок как альтернативный корм для рыбок данио, Danio rerio : токсикологическая оценка. Toxicol. Ind. Health 29, 792–799. DOI: 10.1177 / 0748233712442711
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смедли, К.О. (2013). Сравнение нормативного регулирования разрешенных ингредиентов, процессов утверждения и процедур оценки рисков для кормовых ингредиентов . Охватываемая юрисдикция: Бразилия, Канада, Китай, Европейский Союз, Япония, Южная Африка и США. Международная федерация кормовой промышленности, 12 июля 2013 г.
Google Scholar
Соломонов Г. Л. (1986). «Микробные белки и регуляторный клиренс для микопротеина RHM», в Microbial Biomass Proteins , eds M.Му-Янг и К. Ф. Грегори (Лондон: Elsevier Applied Science), 19–26.
Google Scholar
Сонг, Х. Т., Ян, Ю. М., Лю, Д. К., Сюй, X. Q., Сяо, В. Дж., Лю, З. Л. и др. (2017). Конструирование рекомбинантного Yarrowia lipolytica и его применение в биотрансформации лигноцеллюлозы. Биоинженерия 17, 1–6. DOI: 10.1080 / 21655979.2017.1293219
CrossRef Полный текст | Google Scholar
Steinmann, J., Wottge, H.U., и Müller-Ruchholtz, W.(1990). Тестирование иммуногенности пищевых белков: in vitro, и in vivo, испытания на крысах. Внутр. Arch. Аллергия Иммунол . 91, 62–65. DOI: 10.1159 / 000235091
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Таран М., Асади Н. (2014). Новый подход к экологически безопасному производству одноклеточного белка из нефтехимических сточных вод с использованием галофильных микроорганизмов в различных условиях. Petroleum Sci. Технол .32, 625–630. DOI: 10.1080 / 106.2011.596888
CrossRef Полный текст | Google Scholar
Тревельян, В. Э. (1976). Химические методы снижения содержания пурина в пекарских дрожжах, форме одноклеточного белка. J. Sci. Продовольственное сельское хозяйство . 27, 225–230. DOI: 10.1002 / jsfa.2740270305
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Тернбулл У. Х., Лидс А. Р. и Эдвардс Г. Д. (1992). Микопротеин снижает уровень липидов в крови у свободноживущих людей. Am. J. Clin. Nutr. 55, 415–419.
PubMed Аннотация | Google Scholar
Ugalde, U., и Castrillo, J. I. (2002). «Белки отдельных клеток дрожжей и грибов», в Прикладная микология и биотехнология, Том II «Сельское хозяйство и производство пищевых продуктов» 2002 , ред. Г. Г. Хачатурянс и Д. К. Арора (Амстердам: Elsevier Science B.V.) 123–149.
Валентино, М. Дж. Г., Ганадо, Л. С., и Ундан, Дж. Р. (2016). Белковый потенциал отдельных клеток эндофитных грибов, связанных с бамбуком, с использованием рисовых отрубей в качестве субстрата. Adv. Прил. Sci. Res . 7, 68–72.
Вигани, М., Паризи, К., Родригес-Сересо, Э., Барбоса, М. Дж., Сийтсма, Л., Плоег, М., и Энцинг, К. (2015). Продукты питания и корма из микроводорослей: рыночные возможности и проблемы для ЕС. Trends Food Sci. Технол . 42, 81–92. DOI: 10.1016 / j.tifs.2014.12.004
CrossRef Полный текст | Google Scholar
Виикари, Л., и Линко, М. (1977). Снижение содержания нуклеиновых кислот в SCP. Процесс Биохим .12, 35.
Google Scholar
Вагмаре, А.Г., Сальве, М.К., ЛеБлан, Дж. Г., и Арья, С.С. (2016). Концентрация и характеристика белков микроводорослей из Chlorella pyrenoidosa . Биоресурсы. Биопроцесс . 3, 16. DOI: 10.1186 / s40643-016-0094-8
CrossRef Полный текст | Google Scholar
Ван, Дж. П., Ким, Дж. Д., Ким, Дж. Э. и Ким, И. Х. (2013). Аминокислотная перевариваемость одноклеточного белка из Corynebacterium ammmiagenes у растущих свиней. Anim. Feed Sci. Технол . 180, 111–114. DOI: 10.1016 / j.anifeedsci.2012.12.006
CrossRef Полный текст | Google Scholar
Уорд П. Н. (1998). Производство продуктов питания. Патент США № 5739030. Вашингтон, округ Колумбия: Бюро патентов и товарных знаков США.
Вибе, М. Г. (2002). Микопротеин из Fusarium venenatum : хорошо зарекомендовавший себя продукт для употребления в пищу людьми. Заявл. Microbiol. Биотехнология . 58, 421–427. DOI: 10.1007 / s00253-002-0931-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вибе, М.Г. (2004). QuornTM Myco-protein — Обзор успешного грибкового продукта. Миколог 18, 17–20. DOI: 10.1017 / S0269915X04001089
CrossRef Полный текст | Google Scholar
Willetts, A., и Ugalde, U. (1987). Производство одноклеточного белка из сыворотки. Biotechnol. Lett . 9, 795–800. DOI: 10.1007 / BF01028286
CrossRef Полный текст | Google Scholar
Wongputtisin, P., Khanongnuch, C., Khongbantad, W., Niamsup, P., and Lumyong, S.(2012). Скрининг и селекция Bacillus spp. для производства ферментированного кортикального соевого шрота. J. Appl. Микобиол . 113, 798–806. DOI: 10.1111 / j.1365-2672.2012.05395.x
CrossRef Полный текст | Google Scholar
Wongputtisin, P., Khanongnuch, C., Kongbuntad, W., Niamsup, P., Lumyong, S., and Sarkar, P.K (2014). Использование изолятов Bacillus subtilis из Туа-нао для улучшения питательных свойств оболочки соевых бобов при однокомпонентном кормлении. Lett. Прил. Микробиол . 59, 328–333. DOI: 10.1111 / lam.12279
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Се Д., Джексон Э. Н. и Чжу К. (2015). Устойчивый источник омега-3 эйкозапентаеновой кислоты из метаболически модифицированного Yarrowia lipolytica : от фундаментальных исследований до коммерческого производства. Заявл. Microbiol. Биотехнология . 99, 1599–1610. DOI: 10.1007 / s00253-014-6318-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сюй, Дж.Г. (2015). Метод оценки степени разрушения нуклеотидов. Метод определения и технология производства гидролизата свободных нуклеиновых кислот в белковом продукте. . Патент № CN104515817A. Государственное ведомство интеллектуальной собственности Китайской Народной Республики.
Ядав, Дж. С. С., Безавада, Дж., Аджила, К. М., Ян, С., Тьяги, Р. Д., и Сурампалли, Р. Ю. (2014). Смешанная культура Kluyveromyces marxianus и Candida krusei для производства одноклеточного белка и удаления органической нагрузки из сыворотки. Биоресурсы. Технол . 164, 119–127. DOI: 10.1016 / j.biortech.2014.04.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ядав, Дж. С. С., Ян, С., Аджила, К. М., Безавада, Дж., Тьяги, Р. Д., и Сурампалли, Р. Ю. (2016). Производство пищевых одноклеточных белков, определение характеристик и восстановление остаточных ферментированных сывороточных белков из сыворотки с помощью ультрафильтрации. Food Bioprod. Процесс 99, 156–165. DOI: 10.1016 / j.fbp.2016.04.012
CrossRef Полный текст | Google Scholar
Яздян, Ф., Гаджизаде, С., Шоджаосадати, С.А., Халилзаде, Р., Джаханшахи, М., и Носрати, М. (2005). Производство одноклеточного белка из природного газа: оптимизация параметров и оценка РНК. Иранский J. Biotech . 3, 235–242.
Google Scholar
Зепка, Л.К., Якоб-Лопес, Э., Голдбек, Р., Соуза-Соарес, Л.А., и Кейруш, М.И. (2010). Пищевая ценность одноклеточного белка, продуцируемого Aphanothece microscopica Nägeli. Биоресурсы. Технол .101, 7107–7111. DOI: 10.1016 / j.biortech.2010.04.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhang, H. Y., Piao, X. S., Li, P., Yi, J. Q., Zhang, Q., Li, Q. Y., et al. (2013). Влияние одноклеточного белка, заменяющего рыбную муку в рационе, на показатели роста, усвояемость питательных веществ и морфологию кишечника у свиней-отъемышей. Asian Australas J. Anim. Sci . 26, 1320–1328. DOI: 10.5713 / ajas.2013.13200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Г., Чжан В. и Чжан Г. (2010). Производство одноклеточного белка с использованием отработанного порошка стручкового перца, полученного при экстракции капсантина. Lett. Прил. Микробиол . 50, 187–191. DOI: 10.1111 / j.1472-765X.2009.02773.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, М.-Х., Чи, З., Чи, З.-М., и Мадзак, К. (2013). Одновременная продукция одноклеточного белка и рекомбинантного антибактериального пептида путем экспрессии гена антибактериального пептида в Yarrowia lipolytica . Процесс Биохим . 48, 212–217. DOI: 10.1016 / j.procbio.2013.01.003
CrossRef Полный текст | Google Scholar
Гомеостаз концентрации белка и мРНК в растущих клетках
Модель стохастической экспрессии генов
В моделях с постоянной скоростью скорость транскрипции на ген и скорость трансляции на мРНК постоянны 1,5,24 (рис. 1a). Модели с постоянной скоростью предсказывают постоянное количество мРНК, пропорциональное количеству копий гена и независимо от объема клетки.Однако экспериментальные наблюдения на клетках растений и млекопитающих выявили пропорциональность между количеством мРНК и объемом клеток для клеток с постоянным числом копий генома 18,19,20 . Более того, даже при сравнении клеток до и после репликации генома (S-фаза) коэффициент пропорциональности между мРНК и объемом клетки не обнаруживает каких-либо очевидных изменений. Напротив, постоянная скорость транскрипции на ген может предсказывать удвоение скорости транскрипции после репликации всего генома, что приводит к более высокой концентрации мРНК.В одном классе моделей с постоянной скоростью 26,27,34 явно рассматривается детерминированный экспоненциальный рост объема клетки. Возникающее в результате возмущение концентраций из-за репликации генома подавляется в пределе длительного времени жизни, но все еще значимо для молекул с коротким временем жизни, например, мРНК (см. Рис. 1 в ссылке 27 ).
Рис. 1
Модель стохастической экспрессии генов растущей клетки в сравнении с моделями постоянной скорости. a В модели постоянной скорости скорость транскрипции пропорциональна количеству копий гена, а скорость трансляции пропорциональна количеству мРНК.Эти предположения подразумевают, что количество гена и количество мРНК являются ограничивающими факторами в экспрессии генов. b На этапе 1 модели растущих клеток мы вводим в качестве ограничивающих факторов РНК-полимеразы (РНКП) и рибосомы. Гены разного цвета транскрибируются с разной скоростью. Здесь k 0 — константа, а регуляция генов грубо выражена во фракции распределения генов \ (\ phi _i = g_i {\ mathrm {/}} \ mathop {\ sum} \ nolimits_j {\ kern 1pt} g_j \). g i — эффективное количество копий гена i (также учитывающее силу промотора). n — общее количество RNAP. Скорость трансляции мРНК зависит от количества активных рибосом ( f a r ), скорости трансляции k t и доли мРНК i в общем пуле мРНК. В следующем разделе (Единая фазовая диаграмма экспрессии генов и клеточного роста) мы ослабим наши предположения и рассмотрим ситуации, в которых ограничивающими факторами экспрессии генов становятся номер гена и номер мРНК
С учетом трансляции различные эксперименты показали что количество рибосом является ограничивающим фактором, а не количество мРНК.Наиболее прямым доказательством является закон роста: скорость роста клеток пропорциональна доле рибосомных белков в общем протеоме (с постоянным коэффициентом, зависящим от условий роста) 35 для бактериальных клеток 30,31,36 и почкующиеся дрожжевые клетки 32 . Это означает, что постоянная часть рибосом активно транслирует мРНК. Эти результаты предполагают, что в целом клетки находятся ниже предела насыщения, при котором существует слишком много рибосом, которые мРНК могут связывать.Поэтому мы предположим биологическую ситуацию, в которой мРНК в клетке конкурируют за ограничивающий ресурс активной трансляции рибосом, поэтому скорость трансляции одного типа мРНК пропорциональна количеству активных рибосом, умноженному на ее долю в общем пуле мРНК.
Что касается транскрипции, эксперименты показали, что мутанты делящихся дрожжей с измененными размерами клеток регулируют глобальную транскрипцию для поддержания одинаковых скоростей транскрипции на объем клетки независимо от содержания клеточной ДНК.Изменения общей транскрипции коррелируют с согласованными изменениями в занятости генов РНК-полимеразами 37 . Эти результаты предполагают, что количество RNAPs может быть ограничивающим фактором транскрипции, а не количество генов, и аналогичные доказательства были показаны для бактериальных клеток 38 и клеток млекопитающих 39 . Однако в тех же экспериментах на делящихся дрожжах 37 было также обнаружено, что у мутантов с остановкой клеточного цикла общая скорость транскрипции перестала расти, когда объем клетки превышал определенное значение, что предполагало, что ДНК становится ограничивающей транскрипцию при низких значениях. Концентрация ДНК.Этот результат предполагает, что избыток RNAP может привести к тому, что количество генов станет ограничивающим фактором в определенных условиях. В этом разделе мы сосредоточимся на сценарии, при котором как РНКП, так и рибосома ограничивают экспрессию генов, которую мы обозначим как Фаза 1. На этой фазе мы покажем, что количество мРНК и количество белков пропорциональны объему клетки и растут в геометрической прогрессии. В следующем разделе (Единая фазовая диаграмма экспрессии генов и клеточного роста) мы рассмотрим более общую модель, в которой ограничивающая природа РНКП и рибосом может нарушиться, а динамика количества мРНК и белков отличается.
Чтобы устранить ограничивающий характер RNAP, мы определяем эффективное количество копий гена g i для каждого гена, чтобы учесть количество его копий и силу связывания его промотора, которая определяет его способность конкурировать за RNAP. . Скорость транскрипции для одного конкретного гена i пропорциональна доле RNAP, которые работают с его геном (ами), \ (\ phi _i = g_i {\ mathrm {/}} \ mathop {\ sum} \ nolimits_j { \ kern 1pt} g_j \), которую мы обозначаем как долю распределения генов.Генная регуляция, таким образом, является крупнозернистой во фракцию распределения гена ϕ i . Скорость транскрипции не зависит от числа копий генома, поскольку изменение числа генома оставляет неизменной фракцию распределения одного гена, что согласуется с рядом экспериментальных результатов на различных организмах 18,19,20,37 .
Фактически, явная регуляция генов также может быть включена в нашу модель (методы) с зависящим от времени g i .В таких сценариях g i может зависеть от концентрации белка (например, действие факторов транскрипции изменяет скорость транскрипции). Такие модели приведут к более сложной динамике концентраций мРНК и белка. Однако, поскольку нас интересует глобальное поведение экспрессии генов и роста клеточного объема, мы не сосредотачиваемся на этих сложных правилах в этой рукописи. Наши выводы относительно экспоненциального роста количества мРНК и белков для конститутивно экспрессируемых генов и экспоненциального роста клеточного объема на глобальном уровне не зависят от динамики экспрессии генов отдельных генов.
Далее, m , p , r , n представляет собой количество мРНК, белков, рибосом и РНК-полимераз, соответственно. Белки ( p ) также включают РНКП ( n ) и рибосомы ( r ) 30 . Мы рассматриваем деградацию мРНК со временем деградации τ для всех генов. Количество белков уменьшается только при делении клеток (хотя добавление конечной скорости разложения белков не влияет на наши результаты).{{k_t \ left ({m_i {\ mathrm {/}} \ mathop {\ sum} \ limits_j {\ kern 1pt} m_j} \ right) f_ar}} p_i + 1. $$
(3)
Здесь k 0 , k t — константы, характеризующие скорость транскрипции (трансляции) одиночной РНКП (рибосомы). f a — доля активных рибосом, которая, как мы предполагаем, является постоянной в данной питательной среде 30,32 .Мы отмечаем, что неспецифически связанные РНКП были зарегистрированы у бактерий 40,41 . Мы обсудим их эффект позже. Для простоты предположим, что значения ϕ i не меняются во времени. Формально это можно представить как соответствующую мгновенной репликации генома. В действительности конечная продолжительность репликации ДНК и различное время инициации репликации для разных генов приводят к ϕ i ’s, которые изменяются во время репликации ДНК.Позже мы проанализируем более полную версию модели, которая включает эти эффекты дозировки генов, но сначала рассмотрим упрощенный сценарий константы ϕ i , который уловит основные черты проблемы.
Мы предполагаем, что объем клетки приблизительно пропорционален общей массе белка, т. Е. \ (V \ propto M = \ mathop {\ sum} \ nolimits_j {\ kern 1pt} p_j \), что является хорошим приближением для бактерий 42,43 и клетки млекопитающих 17 .Чтобы упростить следующие формулы, мы считаем, что каждый белок имеет одинаковую массу, и устанавливаем плотность клеток равной 1.
Из-за быстрой деградации мРНК по сравнению с продолжительностью клеточного цикла 44,45 , количество мРНК может быть хорошо приближено. как находящийся в устойчивом состоянии. Мы можем выразить усредненное по ансамблю количество мРНК гена i как
$$ \ left \ langle {m_i (t)} \ right \ rangle = k_0 \ phi _i \ left \ langle {n (t)} \ правый \ rangle \ tau. $$
(4)
Уравнение (3) затем приводит к временной зависимости среднего числа рибосом, \ (d \ left \ langle r \ right \ rangle {\ mathrm {/}} dt = k_tf_a \ phi _r \ left \ langle r \ right \ rangle \), воспроизводя автокаталитическую природу образования рибосом и скорость роста
$$ \ mu = k_tf_a \ phi _r, $$
(5)
определяется относительным содержанием активных рибосом в протеоме 30,32 .
Точно так же количество белка i растет как \ (d \ left \ langle {p_i} \ right \ rangle {\ mathrm {/}} dt = k_tf_a \ phi _i \ left \ langle r \ right \ rangle \ ). По мере роста и деления клетки динамика становится нечувствительной к начальным условиям, поэтому количество белков также будет расти экспоненциально. 21 . Соотношение между средними значениями двух белков в установившемся состоянии определяется соотношением скорости их производства, поэтому \ (\ langle {p_i} \ rangle {\ mathrm {/}} \ langle {p_j} \ rangle = \ phi _i {\ mathrm {/}} \ phi _j \).Среднее количество мРНК отслеживает количество РНК-полимераз согласно формуле. (4), а значит, тоже растет экспоненциально. На протяжении клеточного цикла мы имеем
$$ \ left \ langle {m_i (t)} \ right \ rangle = m_b (i) {\ mathrm {exp}} \ left ({\ mu t} \ right), $$
(6а)
$$ \ left \ langle {p_i (t)} \ right \ rangle = p_b (i) {\ mathrm {exp}} \ left ({\ mu t} \ right), $$
(6b)
, где m b ( i ) ( p b ( i )) — количество мРНК (белка) гена i при рождении клетки.m_i} \ right \ rangle = k_0 \ tau \ phi _i \ phi _n \). Результаты не зависят от объема клетки и числа копий генома, что согласуется с экспериментальными данными для различных организмов 18,19,20,22 .
Мы явно принимаем во внимание деление клеток и для конкретности используем модель «сумматора» для деления клеток, рассматривая белок-инициатор I . Белок-инициатор накапливается с момента рождения клетки, запускает деление клетки, когда он достигает порога деления I c , а затем разрушается (или «сбрасывается», например.g., после инициации репликации ДНК в бактериях, АТФ-связанная DnaA дефосфорилируется до АДФ-связанной формы) 46,47,48 . Во время события деления мы предполагаем, что белки и мРНК делятся между двумя дочерними клетками в соответствии с биномиальным распределением 49 . Белок-инициатор устанавливает шкалу абсолютного количества белков, и среднее количество белков, продуцируемых в одном клеточном цикле, равно Δ ( i ) = I c ϕ i / ϕ I 47 .Поскольку количество белка увеличивается в два раза в течение одного клеточного цикла, среднее количество белка гена i при рождении клетки составляет p b ( i ) = I c ϕ i / ϕ I и соответствующее среднее количество мРНК при рождении клетки составляет m b ( i ) = k 0 I c τϕ i ϕ n / ϕ I .Отметим, что точный молекулярный механизм деления клеток не влияет на наши результаты.
Мы подтверждаем приведенные выше аналитические расчеты численным моделированием. Они также будут фиксировать стохастические колебания уровней экспрессии генов, которые не были включены в предыдущий анализ. Из-за короткого времени жизни мРНК производство белков можно приблизительно описать мгновенными всплесками 24 . Введем параметр размера пакета b 0 как среднее количество белков, произведенных за пакет, \ (b_0 \) = \ (k_tf_a \ langle {r (t)} \ rangle {\ mathrm {/}} \ langle {\ mathop {\ sum} \ nolimits_j {\ kern 1pt} m_j} \ rangle \ times \ tau \) ≈ \ (k_tf_a \ phi _r {\ mathrm {/}} \ left ({k_0 \ phi _n} \ right) \), независимо от объема ячейки. ϕ i для N = 200 белков равномерно отбираются в логарифмическом пространстве, при этом сумма более ϕ i (включая рибосому и RNAP) должна быть в точности равна единице. Мы выбираем параметры, которые являются биологически значимыми для бактерий: время удвоения T = ln (2) / μ = 150 мин, r b = 10 4 , n b = 10 3 , b 0 = 0.8, I c = 20, ϕ r = 0,2, f a = 0,7 и τ = 3,5 мин, другие числовые данные см. В разделе «Методы». Наши выводы не зависят от конкретного выбора параметров.
На рис. 2a мы показываем типичные траектории из нашего моделирования объема клетки, количества белка и количества мРНК для одного и того же гена в течение нескольких поколений. Чтобы проверить экспоненциальный рост белка и мРНК, мы усредняем количество белка и мРНК при фиксированной относительной фазе развития клеточного цикла, которая нормализуется по времени генерации и изменяется от 0 до 1.Усредненные значения количества белков и мРНК (кружки) хорошо предсказываются экспоненциальным ростом, уравнения. (6a) и (6b) (черные линии) без каких-либо подгоночных параметров, как показано на рис. 2b с 3 одиночными траекториями на заднем плане. Мы также моделируем регулируемый ген с помощью зависящего от времени числа копий гена и получаем качественно аналогичные результаты (методы, дополнительный рисунок 1).
Рис. 2
Экспоненциальный рост объема клетки, количества белков, количества мРНК; гомеостаз концентрации белка и мРНК на протяжении клеточного цикла. a Показаны численно смоделированные траектории объема клеток, количества белков и количества мРНК ( ϕ i = 0,018). b Усредненные значения количества белков и мРНК высокоэкспрессируемого гена ( ϕ i = 0,04) показаны (кружки) с тремя одиночными траекториями на заднем плане. Черные линии — это теоретические предсказания уравнений. (6а) и (6б). В среднем более 130 клеточных циклов. Цветная полоса представляет собой стандартное отклонение (то же самое для ( c )). c Показаны усредненные значения концентраций белка и мРНК того же гена, что и в ( b ) (кружки). Черные линии — это теоретические предсказания уравнений. (7а) и (7б). На заднем плане показаны три траектории. d Три траектории расходящихся концентраций в сценарии, когда количество белка и объем клеток растут независимо. См. Числовые данные в разделе «Методы». e Диаграмма разброса количества белков при делении клетки ( P d ) v.с. количество белков при рождении клеток ( P b ). Кружки — это данные с разбивкой по ячейкам. Черная линия представляет собой линейную аппроксимацию разделенных данных с наклоном 1,03, что соответствует корреляциям сумматора
. Соответствующие траектории концентраций белка и мРНК показаны на рис. 2c с ограниченными колебаниями вокруг предсказанных усредненных значений (черные линии). Напротив, если количество белка и объем клеток растут экспоненциально, но независимо, соотношение между ними будет расходиться по мере накопления эффектов шума, демонстрируя поведение случайного блуждания (рис.2г). Учитывая зависимость количества мРНК от клеточного цикла и гомеостаза концентрации белка на протяжении всего клеточного цикла, экспериментальное наблюдение на Escherichia coli , показывающее незначительную корреляцию между количеством мРНК и концентрацией белка 50 , согласуется с нашей моделью и не противоречит сильная корреляция концентрации мРНК и концентрации белка 51 .
В рамках нашей модели мы также можем изучить динамику количества белков: как количество белков при делении клеток коррелирует с числом белков при рождении клетки? Мы обнаруживаем, что корреляции следуют «сумматору» (т.е.е. количество добавленных новых белков не коррелирует с количеством при рождении), как показано на рис. 2e. Хотя это было количественно определено у различных организмов в отношении объема клеток 8,9,11,52,53,54 , проверке корреляций между содержанием белка при рождении и делении клеток уделялось значительно меньше внимания 55,56 . В связи с этим мы изучаем автокорреляционную функцию концентрации белка во времени. Мы обнаружили, что автокорреляционная функция является приблизительно экспоненциальной, а время корреляции ограничено снизу временем удвоения (дополнительный рис.2). Оба этих результата обеспечивают экспериментально проверяемые прогнозы.
Эффекты конечной продолжительности репликации гена
До сих пор мы рассматривали константу ϕ i на протяжении всего клеточного цикла, предполагая мгновенную репликацию генома. В этом разделе мы ослабим это условие и изучаем эффекты конечного времени репликации ДНК. Мы рассматриваем бактериальную модель репликации ДНК, в частности, E. coli , для которой механизм репликации ДНК хорошо охарактеризован 57 .Продолжительность репликации ДНК постоянна и определяется как период C . Соответствующее деление клеток следует после приблизительно постоянной продолжительности, известной как период D . Подробная информация о модели репликации ДНК находится в разделе «Методы». На рис. 3a мы показываем временные траектории фракции распределения генов, концентрации мРНК и концентрации белка одного гена для времени удвоения T = 30 мин с C + D = 70 мин. Репликация ДНК вводит зависимую от клеточного цикла модуляцию ϕ i .Резкое увеличение ϕ i соответствует репликации специфического гена i (рис. 3а) ϕ i → 2 ϕ i . Однако по мере репликации других генов относительная доля гена – в общем геноме уменьшается. Эта модуляция распространяется на концентрацию мРНК, которая по существу отслеживает динамику ϕ i из-за ее короткого времени жизни.Модуляция концентрации мРНК также влияет на концентрацию белка, но с гораздо меньшей амплитудой. Эти результаты можно проверить экспериментально, одновременно отслеживая процесс репликации ДНК и концентрацию мРНК.
Рис. 3
Эффекты конечной продолжительности репликации ДНК. a Временная траектория доли распределения генов (треугольники), концентрации мРНК (квадраты) и концентрации белка (кружки) белка с высоким числом копий ( μ p ≈ 10 4 , см. ( b )).Время удвоения составляет T = 30 мин, и мы используем значения периодов C и D из исх. 57 , а именно, C = 35 мин и D = 35 мин. В этой ситуации клетка подвергается репликации ДНК на протяжении всего клеточного цикла. Тем не менее, шум в ϕ i не распространяется на шум концентрации белка. Значение концентрации мРНК увеличено в 5 раз для наглядности. b Моделируется экспоненциально растущее население (см. Методы).Величина шума определяется как квадрат CV концентраций белка. Среднее количество белка ( мк p ) — это количество белка на средний объем клетки. Эффекты дозирования генов из-за репликации ДНК не создают значительного глобального внешнего шума. Рассматриваются два разных времени удвоения.
Шум в экспрессии генов можно классифицировать как внутренний и внешний шум 58 . В то время как собственный шум обусловлен стохастической природой химических реакций, участвующих в экспрессии генов, считается, что внешний шум возникает из-за колебаний внешних условий и является общим для подмножества белков.Эксперименты выявили глобальный внешний шум, который влияет на все концентрации белка в геноме 50,59,60 . Поскольку все гены подвергаются конечной продолжительности репликации ДНК, возникает соблазн считать конечную продолжительность репликации ДНК одним из основных источников глобального внешнего шума 34 . В нашей модели из предыдущего раздела (постоянные ϕ i на протяжении клеточного цикла) нет глобального внешнего шума (дополнительный рис.3). Глобальный внешний шум может появиться после того, как мы введем зависящие от времени ϕ i из-за репликации ДНК. Однако мы обнаружили, что коэффициент вариации (CV, отношение между стандартным отклонением и средним значением) наиболее высоко экспрессируемых белков составляет всего около 0,02 в рамках модели растущих клеток (рис. 3b), что намного меньше, чем в экспериментах 50 , 59 . Отметим, что небольшой внешний шум из-за репликации генов также наблюдается в моделях с постоянной скоростью 26,27 .Более того, недавние эксперименты и моделирование показали, что значительная часть внешнего шума уровня экспрессии мРНК может быть отнесена к колебаниям числа копий RNAP 28 . В рамках нашей модели колебания уровня РНКП приведут к внешнему шуму в концентрациях мРНК.
Единая фазовая диаграмма экспрессии генов и клеточного роста
Экспериментальные наблюдения на E. coli 30 и почкующихся дрожжах 32 подтверждают наше предположение, что рибосомы ограничивают трансляцию.Экспериментальные наблюдения на клетках растений и млекопитающих 18,19,20 и делящихся дрожжах 37 также согласуются с нашим предположением, что РНК-полимераза ограничивает транскрипцию. Однако, как мы обсуждали в первом разделе, в тех же экспериментах на делящихся дрожжах 37 ДНК становилась лимитирующей для транскрипции при низкой концентрации ДНК. Следовательно, мы не можем исключить возможность того, что в некоторых случаях из-за слишком большого количества RNAP, ДНК становится ограничивающим ресурсом для транскрипции, а не количество RNAP.Точно так же, когда рибосомы слишком многочисленны по сравнению с числом транскриптов, ограничивающим фактором для трансляции становится номер транскрипта, а не число рибосом.
В этом разделе мы обобщаем нашу модель, предполагая, что каждый ген имеет верхнюю границу количества RNAP ( n s ), которые могут одновременно работать с ним. Возможным крайним случаем является то, что ген полностью загружен RNAP, для которых RNAP ограничены только стерическими препятствиями.Такое же предположение сделано для мРНК с верхней границей рибосом ( r s ), которые могут работать с ней одновременно. Отметим, что точный механизм насыщения ДНК и мРНК выходит за рамки нашей грубой модели. Если количество РНКП (рибосом) превышает верхнюю границу, скорость транскрипции (трансляции) ограничивается количеством гена (мРНК) аналогично моделям с постоянной скоростью.
Мы определяем отношение белка к ДНК (отношение PTD) как сумму количества белков, деленную на сумму эффективных номеров генов,
$$ \ gamma = \ mathop {\ sum} \ limits_i {\ kern 1pt} p_i {\ mathrm {/}} \ mathop {\ sum} \ limits_i {\ kern 1pt} g_i.$
(8)
По мере того, как соотношение PTD становится больше, например, из-за достаточно большого объема клетки с фиксированным количеством генов, количество RNAP (рибосом) будет превышать максимальную нагрузку, которую могут выдерживать общие гены (мРНК). Мы подробно обсудили Фазу 1 (ни ДНК, ни мРНК не насыщены) ранее, и мы резюмируем наши прогнозы относительно перехода от Фазы 1 к другим фазам ниже.
Фаза 2: В фазе 2 ограничивающим фактором транскрипции становится количество копий гена, а скорость транскрипции пропорциональна количеству копий гена (рис.4б). Пороговое значение PTD для перехода от фазы 1 к фазе 2 составляет (Методы),
$$ \ gamma _1 = \ frac {{n_s}} {{\ phi _n}}. $$
(9)
Здесь n s — это верхняя граница количества RNAP, которые могут работать с одним геном, а ϕ n — доля распределения генов RNAP. Поскольку мРНК не насыщена, количество белка и объем клетки растут экспоненциально с той же скоростью роста, что и в фазе 1, уравнение.(5), и гомеостаз концентрации белка остается в силе. Однако, поскольку скорость продукции мРНК теперь пропорциональна количеству копий гена, концентрация мРНК больше не является постоянной по мере роста объема клетки (методы). На этапе 2, даже если скорость транскрипции удваивается после репликации генома, скорость трансляции пропорциональна относительной доле мРНК в общем пуле мРНК и, следовательно, все еще не зависит от числа копий генома. Средняя концентрация белка равна доле распределения генов (\ (\ left \ langle {c_i} \ right \ rangle = \ phi _i \)).Недавно предложенные теоретические модели экспрессии генов согласуются с этой фазой 61 . Что касается транскрипции, наша модель в фазе 2 эквивалентна моделям с постоянной скоростью, и мы подтвердили, что как для бактерий, так и для клеток млекопитающих, типичное время жизни мРНК достаточно короткое по сравнению со временем удвоения, чтобы различать фазу 1 и фазу 2 (дополнительные Рис.4).
Рис. 4
Фазы экспрессии генов и роста объема клеток. a Теоретическая фазовая диаграмма экспрессии генов и клеточного роста в рамках нашей модели.Ось x представляет собой отношение белка к ДНК ( γ ). Когда γ < γ 1 , ни ДНК, ни мРНК не являются насыщенными. Количество мРНК, количество белка и объем клетки растут экспоненциально со скоростью роста, заданной долей рибосомного гена в общем геноме ( ϕ r ). Когда γ 1 < γ < γ 2 , ДНК является насыщенной, а мРНК — нет. Количество белка и объем клетки по-прежнему растут экспоненциально, в то время как количество мРНК постоянно пропорционально количеству гена.Когда γ > γ 2 , и ДНК, и мРНК являются насыщенными. Количество белка и объем клеток растут линейно, а скорость роста объема клеток задается числом копий генома. b Динамика экспрессии гена в фазе 2. На этой фазе ДНК насыщается RNAP, поэтому скорость транскрипции пропорциональна эффективному количеству копий гена, g i . n s — это верхняя граница количества RNAP, которые могут работать с одним геном одновременно.Скорость трансляции такая же, как и в фазе 1. Для упрощения формулы мы предполагаем, что все рибосомы активны (чтобы учесть эффект неактивной фракции, r следует заменить на f a r ). c Динамика экспрессии гена в фазе 3, в которой и ДНК, и мРНК являются насыщенными. Скорость трансляции пропорциональна количеству мРНК. r s — это верхняя граница количества рибосом, которые могут работать с одной мРНК одновременно.
Фаза 3: по мере увеличения объема клетки мРНК также может насыщаться.Ограничивающим фактором для трансляции теперь является количество копий мРНК (рис. 4c). Пороговое значение PTD для перехода от фазы 2 к фазе 3 составляет (Методы)
$$ \ gamma _2 = \ frac {{k_0 \ tau r_sn_s}} {{\ phi _r}}. $$
(10)
Здесь r s — верхняя граница количества рибосом, которые могут работать на одной мРНК. На этой фазе скорость трансляции пропорциональна количеству мРНК, а количество белков линейно растет как \ (\ dot p_i = k_tk_0g_i \ tau n_sr_s \), с линейной скоростью роста, пропорциональной количеству гена.Следовательно, в предположении, что объем клетки определяется общим количеством белков, объем клетки также линейно растет с линейной скоростью роста, пропорциональной общему количеству гена,
$$ \ mu _l = k_tk_0 \ tau n_sr_s \ mathop {\ sum} \ limits_i {\ kern 1pt} g_i, $$
(11)
и, следовательно, пропорционально количеству копий генома. Как и на этапе 2, концентрация мРНК уменьшается по мере увеличения объема клетки, однако концентрация белка по-прежнему остается постоянной, а средняя концентрация белка равна доле распределения генов (\ (\ left \ langle {c_i} \ right \ rangle = \ phi _i \), Методы).В фазе 3, даже если объем клеток растет линейно, популяция все равно растет экспоненциально вместе со скоростью роста популяции. Однако не существует общей связи между фракцией рибосом в протеоме и скоростью роста популяции, в отличие от закона роста в фазах 1 и 2. Мы суммируем предсказанную фазовую диаграмму клеточного роста на рис. 4a.
Чтобы получить некоторое представление о параметрах, связанных с предлагаемой фазовой диаграммой, мы оцениваем коэффициент PTD в E.coli . Принимая во внимание типичный объем клетки E. coli как 1 мкм 3 , плотность белка как 3 × 10 6 белков / мкм 3 и общее количество кодирующих белок генов в E. coli как 4000 62 , мы оцениваем отношение белка к ДНК для E. coli как γ ~ 1000. Оценки двух пороговых значений отношений PTD (см. Методы) предполагают, что γ 1 ~ 1500 и γ 2 ~ 20,000.
Эти оценки предполагают, что клетки E. coli дикого типа обнаруживаются в фазе 1, но близки к фазе 2. Мы отмечаем, что на фактические пороговые значения отношения PTD для переходов между различными фазами роста могут влиять другие факторы. , , например, ., Гетерогенный размер генов, но мы предполагаем, что общий сценарий перехода от фазы 1 к фазе 3 по мере увеличения отношения белка к ДНК должен быть в целом применимым. По мере увеличения отношения PTD мы прогнозируем переход от экспоненциального роста к линейному росту количества белков и объема клеток (дополнительный рис.5). Мы предлагаем будущие эксперименты по изучению потенциального перехода от экспоненциального к линейному росту объема клетки, например, с использованием нитчатой E. coli , где деление клеток и репликация генов подавлены. Подобные эксперименты также могут быть проведены для более крупных клеток, например, клеток млекопитающих, в которых легче достичь перехода от экспоненциального роста к линейному увеличению объема клетки. Предварительные результаты экспериментов по измерению роста клеточной массы клеток млекопитающих 63 и дрожжевых клеток 64 действительно показывают переход от экспоненциального роста к линейному, когда клеточная масса превышает пороговое значение, что согласуется с нашим предсказанием.
На бактериях было показано, что существуют избыточные РНКП, неспецифически связанные с ДНК 40,41 . В Методиках мы рассматриваем модифицированную модель, учитывающую разделение RNAP на свободные RNAP, удлиняющиеся RNAP, связанные с промотором RNAP и неспецифически связанные RNAP. Скорость транскрипции определяется концентрацией свободных РНКП с помощью кинетики Михаэлиса-Ментен 40,65 . Мы обнаружили, что наши выводы остаются неизменными с приблизительно постоянной долей активно транскрибирующих RNAP в общем количестве RNAP для фазы 1 (дополнительный рис.6). Таким образом, эффект неспецифически связанных РНКП заключается в перенормировке константы транскрипции k 0 в Фазе 1 (уравнение (1)) на постоянный коэффициент. Переход от фазы 1 к фазе 2 качественно не затронут (дополнительный рисунок 7), а пороговое отношение PTD γ 1 (уравнение (9)) от фазы 1 к фазе 2 изменяется на постоянный коэффициент (методы) . Мы отмечаем, что альтернативные механизмы насыщения генов могут возникать при введении различных классов RNAP через насыщение свободных RNAP и кинетику Михаэлиса-Ментен (методы).
|
Белки — это молекулы-«рабочие лошадки» жизни, которые принимают участие практически во всех структурах и видах деятельности жизни. Это строительные материалы для живых клеток, которые появляются в структурах внутри клетки и внутри клеточной мембраны. Они переносят кислород, строят ткани, копируют ДНК для следующего поколения — они делают всю работу в любом организме. Хотя многие из белков являются структурными белками, многие из них являются регулирующими белками, называемыми ферментами. Они содержат углерод, водород и кислород, как углеводы и липиды, но они также содержат азот и часто серу и фосфор. Белковые молекулы часто очень большие и состоят из сотен и тысяч аминокислотных единиц. Несмотря на большие размеры, белок обычно имеет небольшую рабочую область, такую как карман, расположенный на трехмерной поверхности свернутой белковой цепи, который действует как сайт связывания. 20 аминокислот объединяются по-разному, образуя около 100 000 различных белков в организме человека.Некоторые из этих белков находятся в растворе в крови и других жидкостях организма, а некоторые находятся в твердой форме в виде каркаса тканей, костей и волос. Шипман и др. предполагает, что они составляют около 75% от сухой массы нашего тела. Белки можно охарактеризовать как полиамиды с очень длинной цепью. Амиды содержат азот, и азот составляет около 16% атомного содержания белка. Эти белки создаются в организме путем конденсации аминокислот под действием ферментных катализаторов с использованием структуры или направления нуклеиновых кислот в клетках. Аминокислотные единицы в молекуле белка удерживаются вместе пептидными связями и образуют цепи, называемые полипептидными цепями. Секвенирование 20 аминокислот формирует своего рода алфавит для выражения типа белка, что приводит к очень большому количеству типов белков. В клетке ДНК направляет или обеспечивает основную схему для создания белков, используя транскрипцию информации в мРНК, а затем трансляцию для фактического создания белков. Комментарий Миллера «В конце концов, живые существа созданы путем выполнения ряда генетических сообщений, закодированных в ДНК. Гены, функциональные единицы этой генетической программы, обычно кодируют белки, которые являются рабочими лошадками клетки. исследования геномов людей и других организмов расширяются, становится ясно, что эти белки могут делать практически все, что требуется для создания организма … » Wiki: структура белка |
Индекс
Биохимические концепции Химические концепции Ссылка Ссылка |
Что такое «одноклеточный белок»? А что насчет «Микопротеина»?
По мере увеличения численности населения растет и спрос на продукты питания.В связи с этим все больший интерес вызывают альтернативные источники белка. Одним из альтернативных источников белка является одноклеточный белок (SCP), который является общим термином для сырого или очищенного белка, происходящего из таких микроорганизмов, как бактерии, водоросли и грибы. То, что организм одноклеточный, означает, что он состоит, как следует из названия, из одной единственной клетки. В отличие от этого у нас есть многоклеточные организмы, такие как животные и растения, к которым мы привыкли, которые состоят из нескольких разных клеток, которые взаимодействуют друг с другом.
Одноклеточный белок по сравнению с животным и растительным белком
Итак, в чем разница между приготовлением белка с использованием
одноклеточный организм и животное или растение? Чтобы представить это на простом примере,
приготовление пищи из растения требует затрат энергии и ресурсов, чтобы вырастить полноценный
растение. Допустим, нас интересуют только соевые бобы. Для производства сои мы
нужно вырастить корни, листья, стебли и все другие части растения, которые мы
не хочу! Если, с другой стороны, мы хотим выращивать гриб, и каждый гриб только
имеет одну клетку, тогда все клетки, которые мы производим, будут грибами, которые мы хотим!
В практических вопросах, если мы хотим производить белок и знаем, что клетка грибов имеет высокое содержание белка, это означает, что мы можем производить намного больше белка из того же количества ресурсов по сравнению с выращиванием растений.Чтобы добавить к этому сравнению, мы также должны думать, что содержание стейка обычно составляет около 45%, молока — около 25% и сои — около 35%. Микроорганизмы, используемые для производства одноклеточного белка, могут достигать 75% содержания белка!
Каким образом SCP более экологичен?
Производство белка из отдельных клеток может быть более устойчивой альтернативой традиционным методам производства белка с использованием животных или растений (очень часто используется соя).Причин такого улучшения много:
1. Для производства SCP требуется меньше земли. Ферментеры — это большие вертикальные резервуары, поэтому они занимают намного меньше площади, чем поля для выращивания.
2. Он не зависит от сезона, погоды или местных условий.
3. Его можно постоянно возобновлять и производить с использованием различного сырья из возобновляемых источников.
Для сравнения: было заявлено, что одноклеточные ферментеры площадью около 8 квадратных километров теоретически могут поставлять весь белок, необходимый для питания населения мира.Еще одно преимущество производства SCP состоит в том, что микроорганизмы в большинстве случаев могут использовать потоки отходов и недорогое сырье для производства биомассы и белка. Сколько белка может быть произведено, будет зависеть от используемого сырья и типа используемого микроорганизма. Теперь давайте поговорим о некоторых примерах одноклеточного белка.
Бактерии Белки
Среди множества различных типов SCP бактерии, вероятно, являются наиболее промышленно исследуемой альтернативой и в настоящее время проходят испытания в качестве источника белка в кормах для животных многими основными компаниями.Основная привлекательность бактерий — это высокое содержание белка и высокая скорость роста. Бактерии обычно выращиваются в ферментерах и, в зависимости от вида, могут использовать различные источники углерода в качестве субстрата для роста, при этом метан является одним из наиболее часто используемых в промышленности. Большим недостатком использования бактерий в качестве источника белка является то, что они имеют высокое содержание нуклеиновых кислот, что увеличивает стоимость обработки. Сбор урожая также может быть затруднен, что усложняет последующую переработку с технической и экономической точек зрения.В конце концов, однако, самой большой проблемой использования бактериального белка в пищевых продуктах может стать признание общественностью того, что бактерии являются источником пищи.
Белок водорослей
Другой ключевой член семейства SCP, микроводоросли, использовались людьми на протяжении веков благодаря высокому содержанию белков и полезных жирных кислот. Например, ацтеки, мезоамериканская культура, процветавшая в центральной части Мексики, собрали сине-зеленые водоросли Arthrospira platensis, более известные как «Спирулина», из озера Тескоко в Мексике около 1300 г. до н.э.Точно так же население Чада давно собирает спирулину из озера Косором. Несколько десятилетий назад возник интерес к выращиванию водорослей в промышленных масштабах, и с тех пор интерес и развитие технологии на основе микроводорослей значительно выросли и стали применяться в дальнейшем.
Водоросли используют фотосинтез, что означает, что их основными субстратами являются углекислый газ и солнечный свет. Чтобы приспособиться к этому, водоросли можно выращивать на открытом воздухе в открытых водоемах или в комнатных фотобиореакторах.Однако трудности с промышленным использованием микроводорослей в основном объясняются двумя разными факторами. Во-первых, выращивание водорослей требует обширных площадей и капитальных затрат на создание прудов или освещаемых биореакторов. Во-вторых, водоросли имеют значительно более низкую скорость производства по сравнению с другими организмами. В настоящее время водоросли в основном используются в качестве добавок для употребления в пищу человеком, и очень мало попыток применения в качестве кормов для животных премиум-класса.
Белок грибов (или «микопротеин»)
Одно из самых недавних и интересных дополнений к семейству SCP — съедобные грибы, которые появились на рынке коммерческих продуктов питания всего несколько десятилетий назад.Но с тех пор он вызывает очень большой интерес из-за высокого содержания белка и пищевых волокон. Грибы не придирчивы в еде. Они могут расти на различных субстратах, таких как сахар, целлюлоза и даже липиды.
Самый распространенный способ выращивания грибов — в
ферментеры, где он может расти относительно быстро и с высокой плотностью. В
белок, полученный из грибов, обычно называемый «микопротеином», часто находит свой
применение в качестве ингредиента для кормов для водных животных или животных, а также в качестве ингредиента для человека
еда.
Являются ли грибы идеальным SCP для замены мяса?
Один из интересных моментов, связанных с грибами, заключается в том, что вы сами можете: действительно ли грибы являются SCP? Это может потребовать отдельного обсуждения, потому что грибы обычно растут как отдельные клетки, которые связаны друг с другом посредством нитей, образуя большую структуру, называемую «мицелием». Это означает, что грибы тоже можно рассматривать как многоклеточные, в зависимости от того, как на это смотреть. В практических приложениях это действительно отличная функция! Волокнистая текстура мицелия на самом деле очень желательна для использования грибов в пищу, поскольку она создает мясную консистенцию, которая не может быть воспроизведена с другими SCP, такими как бактерии.
Темпе производится из соевых бобов и ферментируется нитчатыми грибами.
В конце концов, микопротеины обычно более приемлемы в качестве пищи для человека. Фактически, нитчатые грибы использовались в традиционных азиатских продуктах питания, таких как tempeh и oncom , и на самом деле они являются основной причиной пользы этих продуктов для здоровья. Последние коммерческие тенденции также показывают, что использование мицелиальных грибов в качестве белкового ингредиента является неизученной областью. Это решение обладает огромным потенциалом для удовлетворения растущего глобального спроса на продукты питания с использованием экологически безопасного и безопасного для климата подхода.
Автор: Анника Флорен
Стажер по исследованиям и разработкам в Микорене
Определение содержания белка в сыворотке крови с помощью анализа изображений сотового телефона
В этой статье представлен простой, быстрый и недорогой способ измерения содержания белка в сыворотке (альбумин и общий белок) путем интеграции цветных изображений, полученных с помощью камеры мобильного телефона, и множественной линейной регрессии (MLR). Модели MLR были построены с использованием систем изображений RGB-HSV на основе изменений цвета, вызванных методами бромкрезолового зеленого и биурета на растворах, содержащих альбумин (0.От 24 до 5,03 г дл -1 ) и общих белков (от 0,25 до 8,20 г дл -1 ), соответственно, полученные с камеры сотового телефона. Эти методы были адаптированы для анализа на микроуровне с использованием 96-луночного планшета ELISA объемом 250 мкл в качестве реакционного контейнера, а затем были статистически подтверждены. Значения RMSEP, полученные для моделей альбумина и общего белка, были соответственно равны 0,28 и 0,12 г дл -1 , а их точность была соответственно равна 6.16 и 4,85%. Не наблюдалось статистической разницы при уровне достоверности 95% между концентрацией белка, рассчитанной с помощью предлагаемого метода, и концентрацией, обнаруженной с помощью эталонного метода, что доказывает надежность метода визуализации в качестве альтернативного подхода для этих анализов.
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент…
Что-то пошло не так.


