ИЗМЕНЧИВОСТЬ СОДЕРЖАНИЯ БЕЛКА В ЗЕРНЕ ГОРОХА В СТЕПНЫХ УСЛОВИЯХ ХАКАСИИ : научное издание
Перевод названия: VARIABILITY OF PROTEIN CONTENT IN PEA GRAIN IN THE STEPPE CONDITIONS OF KHAKASSIA
Тип публикации: статья из журнала
Год издания: 2018
Ключевые слова: горох, метеорологические условия, изменчивость, содержание белка, степная зона, дисперсионный анализ, вклад факторов, pea, meteorological conditions, variability, protein content, steppe zone, analysis of variance, share of factors
Аннотация: Установлено, что условия выращивания в 2015-2017 гг. в степной зоне Республики Хакасия на 84% определяли изменчивость белка в зерне 10 сортов гороха. Так, средний показатель содержания белка в 2015 году находился в пределах 27,48%, а в 2017 году — 24,45%. Прослеживается тенденция снижения содержания белка в зерне в более влажные годы, к которым можно отнести 2016-2017 гг. Сортовые различия только на 13 % влияли на формирование белка в семенах гороха. Следует учесть, что в сортоиспытании были представлены сорта, прошедшие селекционный отбор по комплексу хозяйственно полезных признаков, в том числе и по содержанию белка в семенах. Повышенное содержание белка по результатам трёх лет испытания было у сортов Омский 18 [7] и Руслан, которое, соответственно, составило 27,58 и 27,56%. По морфотипам растений чётких закономерностей не выявлено. Традиционный сорт Радомир (осыпающийся, листочковый) накапливал за три года исследования белка выше среднего значения по опыту, которое составило 25,77%. В группе безлисточковых форм отмечен размах изменчивости признака от 27,58 (Омский 18) до 24,40% (Шрек). Высокое содержание белка в зерне у безлисточковых форм позволяет заключить, что данный признак (безлисточковость) не является фактором, препятствующим накоплению белка в зерне.
Следует учесть, что в сортоиспытании были представлены сорта, прошедшие селекционный отбор по комплексу хозяйственно полезных признаков, в том числе и по содержанию белка в семенах. Повышенное содержание белка по результатам трёх лет испытания было у сортов Омский 18 [7] и Руслан, которое, соответственно, составило 27,58 и 27,56%. По морфотипам растений чётких закономерностей не выявлено. Традиционный сорт Радомир (осыпающийся, листочковый) накапливал за три года исследования белка выше среднего значения по опыту, которое составило 25,77%. В группе безлисточковых форм отмечен размах изменчивости признака от 27,58 (Омский 18) до 24,40% (Шрек). Высокое содержание белка в зерне у безлисточковых форм позволяет заключить, что данный признак (безлисточковость) не является фактором, препятствующим накоплению белка в зерне.
It was stated that the conditions of cultivation in 2015-2017 in the steppe zone of the Khakas Republic identified protein content variability in grain of 10 pea varieties by 84 %. Thuswise the aggregate figure of protein content in 2015 was at the level of 27,48 %, and in 2017 — 24,45 %. There is the tendency of grain protein content reduction in wetter years such as 2016-2017. The varietal differences influenced protein formation in pea grain only by 13 %. It should be appreciated that the variety trial included the varieties selected by the complex of economic traits including by protein content in grain.In the result of three years of trial higher protein content was in varieties Omskiy 18 and Ruslan which was correspondingly 27,58 and 27,56 %. Varieties Yakhont and Radomir had aggregate figure of more than 26 %. While comparing varieties by plants morphotypes clear regularities were not determined. In average during three years of trial traditional variety Radomir (shattering, laminar) collected protein more than average from experience that was 25,77 % (table). In the group of leafless forms it was noticed the scope of variability characteristic from 27,58 % (Omskiy 18) to 24,40 % (Shrek).
Thuswise the aggregate figure of protein content in 2015 was at the level of 27,48 %, and in 2017 — 24,45 %. There is the tendency of grain protein content reduction in wetter years such as 2016-2017. The varietal differences influenced protein formation in pea grain only by 13 %. It should be appreciated that the variety trial included the varieties selected by the complex of economic traits including by protein content in grain.In the result of three years of trial higher protein content was in varieties Omskiy 18 and Ruslan which was correspondingly 27,58 and 27,56 %. Varieties Yakhont and Radomir had aggregate figure of more than 26 %. While comparing varieties by plants morphotypes clear regularities were not determined. In average during three years of trial traditional variety Radomir (shattering, laminar) collected protein more than average from experience that was 25,77 % (table). In the group of leafless forms it was noticed the scope of variability characteristic from 27,58 % (Omskiy 18) to 24,40 % (Shrek). High protein content in grain of leafless forms allows to conclude that this characteristic (leaflessness) does not prevent protein accumulation in grain.
High protein content in grain of leafless forms allows to conclude that this characteristic (leaflessness) does not prevent protein accumulation in grain.
Ссылки на полный текст
ОФС.1.2.3.0012.15 Определение белка | Фармакопея.рф
Содержимое (Table of Contents)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ст. ГФ XII, ч.1, ОФС 42-0053-07
Определение содержания белка проводят в лекарственных средствах, выделенных из природных источников или полученных биотехнологическими методами.
Для таких лекарственных средств могут использоваться модифицированные методики определения белка, указанные в фармакопейных статьях, в которых могут быть изменены рекомендуемые области концентраций белка и/или объемы испытуемого раствора и реактивов и некоторые другие условия в соответствии с индивидуальными свойствами определяемого компонента.
Колориметрические и некоторые спектрофотометрические методы требуют использования стандартного образца. В качестве стандартного образца белка используют: стандартный образец присутствующего в препарате белка, или бычий сывороточный альбумин, или сывороточный альбумин человека, высушенные перед испытанием до постоянной массы (стандартный образец и условия высушивания указывают в фармакопейной статье).
Для количественного определения белка используют спектрофотометрические, колориметрические и спектрофлуориметрические методы.
Метод 1 (Спектрофотометрический)
Метод основан на способности ароматических аминокислот (тирозина, триптофана и, в меньшей степени, фенилаланина), входящих в последовательность молекулы белка, поглощать ультрафиолетовый свет при длине волны около 280 нм.
Для растворения молекул белка используют различные растворители: воду, натрия хлорид раствор 0,9 %, различные буферные растворы и др.
При использовании буферного раствора для растворения молекул белка, имеющего высокое значение оптической плотности по отношению к воде, свидетельствует о присутствии в белковой молекуле интерферирующего вещества. Для устранения влияния интерферирующего вещества на результаты анализа следует использовать в качестве раствора сравнения вместо воды буферный раствор. Если интерферирующие вещества имеют высокую оптическую плотность, результаты анализа могут быть подвергнуты сомнению.
При низких концентрациях белок адсорбируется на стенках кюветы, что может приводить к заниженным результатам содержания белка в растворе. В этом случае испытуемый раствор препарата предварительно концентрируют или используют при приготовлении испытуемого раствора неионные детергенты.
Испытуемый раствор. Готовят раствор испытуемого вещества в буферном растворе, указанном в фармакопейной статье, с концентрацией белка от 0,2 мг/мл до 2,0 мг/мл.
Стандартный раствор. Готовят раствор соответствующего стандартного образца в том же буферном растворе и с той же концентрацией белка, что и в испытуемом растворе.
Методика. Испытуемый раствор, стандартный раствор и раствор сравнения выдерживают при одинаковой температуре. Температуру и время инкубации указывают в фармакопейной статье. Определяют оптические плотности испытуемого и стандартного растворов в кварцевых кюветах при длине волны 280 нм, используя тот же буферный раствор в качестве раствора сравнения.
Для получения достоверных и точных результатов значения оптической плотности растворов должны удовлетворять требованиям линейности в интервале определяемых концентраций белка.
Для высокоочищенных белков концентрацию белка в растворе вычисляют с использованием удельного показателя поглощения.
Рассеяние света. Точность определения содержания белка в ультрафиолетовой области снижается, если белки в растворе существуют в виде частиц, сравнимых по размеру с длиной волны измеряемого света (250 – 300 нм). Рассеяние светового потока приводит к увеличению оптической плотности испытуемого раствора. При расчете оптической плотности испытуемого раствора при длине волны 280 нм, обусловленной рассеянием света, определение проводят при длинах волн 320 нм, 325 нм, 330 нм, 335 нм, 340 нм и 350 нм. Строят график зависимости десятичного логарифма (lg) оптической плотности от lg соответствующей длины волны. Экстраполируют кривую методом линейной регрессии для определения логарифма оптической плотности при длине волны 280 нм. Антилогарифм этого значения соответствует оптической плотности за счет рассеяния света. Для расчета истинного содержания белка в испытуемом растворе оптическую плотность раствора, полученную при 280 нм, корректируют, вычитая оптическую плотность, относящуюся к рассеянному свету.
Антилогарифм этого значения соответствует оптической плотности за счет рассеяния света. Для расчета истинного содержания белка в испытуемом растворе оптическую плотность раствора, полученную при 280 нм, корректируют, вычитая оптическую плотность, относящуюся к рассеянному свету.
Снизить эффект рассеянного света в опалесцирующих растворах можно фильтрованием через фильтр с размером пор 0,2 мкм, не адсорбирующим белок, или центрифугированием. Условия фильтрования и центрифугирования указывают в фармакопейной статье.
Расчеты. Концентрацию белка в испытуемом растворе (С) в мг/мл вычисляют по формуле:
С = С0 ∙ А/А0,
где
С0 — концентрация белка в растворе стандартного образца, в мг/мл;
А и А0 – скорректированные значения оптической плотности испытуемого раствора и раствора стандартного образца соответственно.
Метод 2 (Метод Лоури, колориметрический)
Метод основан на реакции белков с солями меди (II) в щелочном растворе и восстановлении фосфорномолибдено-вольфрамового реактива (реактив Фолина) с образованием окрашенных продуктов, интенсивность окраски которых определяют по оптической плотности при длине волны 750 нм. Реактив Фолина взаимодействует с остатками ароматических аминокислот белка, главным образом тирозина, а также триптофана и фенилаланина и, в меньшей степени, цистеина. Развитие окраски достигает максимума через 20 – 30 мин при комнатной температуре, в дальнейшем идет уменьшение ее интенсивности. Степень окрашивания зависит от природы белка. Поскольку различные виды белков могут давать цветные реакции различной интенсивности, испытуемый белок должен соответствовать стандартному образцу.
Реактив Фолина взаимодействует с остатками ароматических аминокислот белка, главным образом тирозина, а также триптофана и фенилаланина и, в меньшей степени, цистеина. Развитие окраски достигает максимума через 20 – 30 мин при комнатной температуре, в дальнейшем идет уменьшение ее интенсивности. Степень окрашивания зависит от природы белка. Поскольку различные виды белков могут давать цветные реакции различной интенсивности, испытуемый белок должен соответствовать стандартному образцу.
Определению мешают некоторые соли, тиоловые соединения, углеводы, липиды, неионные детергенты, органические растворители, комплексоны и некоторые другие соединения. Большинство мешающих веществ дает слабое окрашивание, однако применение некоторых детергентов приводит к значительному увеличению окраски. Высокая концентрация соли может являться причиной образования осадка. Для уменьшения влияния веществ, мешающих определению, проводят дополнительное разведение раствора, обеспечивающее концентрацию испытуемого белка на уровне, достаточном для проведения точных измерений, или осаждение белков растворами натрия дезоксихолата и трихлоруксусной кислоты.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 5 мкг/мл и 100 мкг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Метод А (без предварительного осаждения белка).
К 1,0 мл каждого из стандартных растворов, испытуемого раствора и к 1,0 мл контрольного раствора, прибавляют по 5,0 мл реактива В. Содержимое пробирок перемешивают и оставляют на 10 — 30 мин при комнатной температуре. Затем в каждую пробирку прибавляют 0,5 мл реактива Фолина, разбавленного перед употреблением водой в 2 раза, быстро и тщательно перемешивают и оставляют на 30 мин при комнатной температуре. Измеряют оптическую плотность испытуемого и стандартных растворов на спектрофотометре при длине волны 750 нм (или указанной в фармакопейной статье), используя контрольный раствор в качестве раствора сравнения. Окраска остается стабильной в течение 2 часов. Допускается использование коммерческого реактива Фолина-Чокалтеу.
Затем в каждую пробирку прибавляют 0,5 мл реактива Фолина, разбавленного перед употреблением водой в 2 раза, быстро и тщательно перемешивают и оставляют на 30 мин при комнатной температуре. Измеряют оптическую плотность испытуемого и стандартных растворов на спектрофотометре при длине волны 750 нм (или указанной в фармакопейной статье), используя контрольный раствор в качестве раствора сравнения. Окраска остается стабильной в течение 2 часов. Допускается использование коммерческого реактива Фолина-Чокалтеу.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечания:
- Приготовление реактива А. В мерную колбу вместимостью 100 мл помещают 2 г натрия карбоната, растворяют в 0,1 М растворе натрия гидроксида и доводят объем до метки этим же раствором, перемешивают.
Срок годности раствора 1 мес.
- Приготовление реактива Б. В мерную колбу вместимостью 100 мл помещают 0,5 г меди сульфата, 1 г калия-натрия тартрата, растворяют в воде и доводят до метки.
Срок годности раствора: 2 мес.
- Приготовление реактива В. Перед анализом смешивают 50,0 мл реактива А и 1,0 мл реактива Б.
Метод Б (с натрия додецилсульфатом).
Определение проводят, как описано в методе А, но вместо 5 мл реактива В к растворам прибавляют по 1 мл щелочного реактива меди и по 0,5 мл разведенного реактива Фолина.
Примечания:
- Приготовление сульфатного реактива меди. В мерной колбе вместимостью 100 мл растворяют в воде 0,2 г меди сульфата и 0,4 г натрия тартрата, доводят объем раствора водой до метки и перемешивают. В мерной колбе вместимостью 100 мл растворяют в воде 10 г натрия карбоната, доводят объем раствора водой до метки и перемешивают. Медленно приливают раствор натрия карбоната к раствору меди сульфата при перемешивании. Раствор используют в течение 24 часов.
- Приготовление щелочного реактива меди. 1 объем полученного раствора сульфатного реактива меди смешивают с 2 объемами 5 % раствора натрия додецилсульфата (50 г/л) и 1 объемом 3,2 % раствора натрия гидроксида
(32 г/л).
Срок годности раствора: 2 недели при комнатной температуре.
- Приготовление разведенного реактива Фолина. Смешивают 5 мл реактива Фолина с 55 мл воды.
Раствор хранят в банках темного стекла при комнатной температуре.
Метод В (с предварительным осаждением белка).
Методика. К 1,0 мл испытуемого раствора прибавляют 0,1 мл раствора натрия дезоксихолата. Раствор перемешивают на вихревой мешалке и выдерживают при комнатной температуре в течение 10 мин. Прибавляют 0,1 мл 72 % раствора трихлоруксусной кислоты и перемешивают на вихревой мешалке. Осадок отделяют центрифугированием в течение 30 мин при 3000 g. Осторожно удаляют надосадочную жидкость, оставшийся осадок растворяют в 1 мл щелочного реактива меди. Далее поступают, как описано выше в методе Б.
При построении калибровочного графика стандартные растворы белка следует обрабатывать аналогичным способом.
В качестве раствора сравнения используют пробу, содержащую 0,1 мл 0,1 М раствора натрия гидроксида, 0,9 мл воды, 5,0 мл реактива В и 0,5 мл разбавленного в 2 раза реактива Фолина.
Примечания:
- Приготовление 0,15 % раствора натрия дезоксихолата.
 В мерную колбу вместимостью 100 мл помещают 0,15 г натрия дезоксихолата и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
В мерную колбу вместимостью 100 мл помещают 0,15 г натрия дезоксихолата и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают. - Приготовление 72 % раствора трихлоруксусной кислоты. В мерную колбу вместимостью 500 мл помещают 360 г трихлоруксусной кислоты и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
Срок годности 72 % раствора трихлоруксусной кислоты 1 мес.
Метод 3 (Метод Бредфорд, колориметрический)
Данный метод основан на смещении максимума поглощения оптической плотности красителя кислотного синего 90 (Кумасси бриллиантовый синий R-250) от 470 нм до 595 нм, наблюдаемой вследствие связывания белка с красителем. Краситель наиболее активно связывается с остатками аргинина и лизина белка, что может приводить к погрешности при количественном определении различных видов белков. Белок, используемый в качестве стандартного образца, должен быть таким же, как испытуемый белок.
Существует относительно небольшое влияние интерферирующих веществ, которого можно избежать, не используя детергенты и амфолиты в испытуемом образце. Сильнощелочные образцы могут взаимодействовать с кислотным реактивом.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 0,1 мг/мл и 1 мг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Методика. Прибавляют 5 мл реактива Бредфорд к 0,1 мл каждого стандартного раствора, испытуемого раствора и контрольного раствора. Тщательно перемешивают, переворачивая. Избегают образование пены, приводящей к плохой воспроизводимости. Выдерживают при комнатной температуре в течение 10 мин и измеряют оптические плотности стандартных растворов и испытуемого раствором на спектрофотометре при длине волны 595 нм, используя контрольный раствор в качестве раствора сравнения, содержащего растворитель и реактив Бредфорд. При определении не следует использовать кварцевые спектрофотометрические кюветы, поскольку краситель связывается с этими материалами. Окраска остается стабильной в течение 1 ч.
Тщательно перемешивают, переворачивая. Избегают образование пены, приводящей к плохой воспроизводимости. Выдерживают при комнатной температуре в течение 10 мин и измеряют оптические плотности стандартных растворов и испытуемого раствором на спектрофотометре при длине волны 595 нм, используя контрольный раствор в качестве раствора сравнения, содержащего растворитель и реактив Бредфорд. При определении не следует использовать кварцевые спектрофотометрические кюветы, поскольку краситель связывается с этими материалами. Окраска остается стабильной в течение 1 ч.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
В нормативных документах допускается изменение объемов испытуемого раствора и реактива Бредфорд при соблюдении линейной зависимости оптической плотности от концентрации белка при построении калибровочного графика.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечание:
Приготовление реактива Бредфорд. В мерную колбу вместимостью 500 мл помещают 0,05 г кислотного синего 90 (Кумасси бриллиантовый синий R-250), растворяют в 25 мл спирта 96%, прибавляют 50 мл фосфорной кислоты концентрированной, доводят объем раствора водой до метки и тщательно перемешивают. Фильтруют и хранят в банках темного стекла при комнатной температуре. Если при хранении выпадает осадок красителя, перед использованием реактив необходимо профильтровать.
Срок годности 2 недели.
Метод 4 (Метод с бицинхониновой кислотой, колориметрический)
Метод основан на восстановлении ионов меди Cu2+ до ионов меди Cu1+ при взаимодействии с остатками цистеина, цистина, триптофана, тирозина, пептидной связью белка и образовании окрашенного комплекса Cu+ с бицинхониновой кислотой (2,2’-бихинолин-4,4’-дикарбоновая кислота). Определению мешают восстанавливающие вещества: сахара, аскорбиновая кислота, тиоловые соединения, этилендиаминтетраацетат. Влияние мешающих веществ может быть минимизировано путем разведения, обеспечивающего концентрацию белка на уровне, достаточном для проведения точных измерений. В качестве альтернативы можно использовать методику осаждения белка, описанную в определении белка по методу Лоури. Поскольку интенсивность окраски образующегося комплекса зависит от природы белка, белок стандартного образца должен быть тот же, что и в испытуемом образце.
Определению мешают восстанавливающие вещества: сахара, аскорбиновая кислота, тиоловые соединения, этилендиаминтетраацетат. Влияние мешающих веществ может быть минимизировано путем разведения, обеспечивающего концентрацию белка на уровне, достаточном для проведения точных измерений. В качестве альтернативы можно использовать методику осаждения белка, описанную в определении белка по методу Лоури. Поскольку интенсивность окраски образующегося комплекса зависит от природы белка, белок стандартного образца должен быть тот же, что и в испытуемом образце.
Стандартные растворы. Соответствующий стандартный образец белка растворяют в буферном растворе, указанном в фармакопейной статье. Части полученного раствора разводят в том же буферном растворе для получения не менее чем пяти стандартных растворов, имеющих концентрации белка, равномерно распределенные в интервале между 10 мкг/мл и 1200 мкг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в буферном растворе, указанном в фармакопейной статье, с концентрацией белка, находящейся в пределах интервала концентраций калибровочного графика.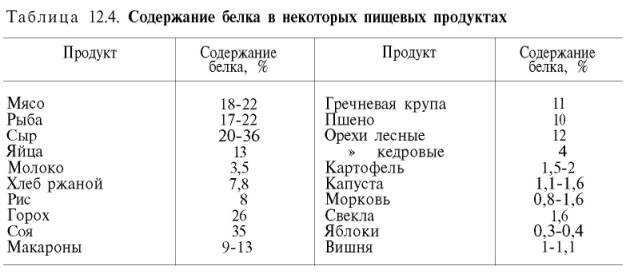
Контрольный раствор. Используют буферный раствор, применяемый для приготовления стандартных и испытуемого растворов.
Методика. Прибавляют к 0,1 мл каждого стандартного раствора, испытуемого раствора и контрольного раствора 2,0 мл реактива медно- бицинхониновой кислоты. Растворы выдерживают при температуре 37 ºС в течение 30 мин, засекают время и охлаждают смесь до комнатной температуры. Через 60 мин после окончания инкубации при 37 ºС измеряют оптические плотности стандартных растворов и испытуемого раствора на спектрофотометре при длине волны 562 нм в кварцевых кюветах, используя контрольный раствор в качестве раствора сравнения.
Зависимость оптической плотности от концентрации белка носит нелинейный характер, тем не менее, если интервал концентраций, используемых для построения калибровочного графика, небольшой, то она приближается к линейной. Строят зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Примечания:
- Приготовление реактива бицинхониновой кислоты. В мерную колбу вместимостью 1 л помещают 10 г динатриевой соли бицинхониновой кислоты, 20 г натрия карбоната моногидрата, 1,6 г натрия тартрата, 4 г натрия гидроксида, 9,5 г натрия гидрокарбоната, растворяют в воде. При необходимости значение рН полученного раствора доводят до 11,25 раствором натрия гидроксида 10 % или натрия гидрокарбоната 5 %. Доводят объем раствора водой до метки и перемешивают.
- Приготовление реактива медно- бицинхониновой кислоты. Смешивают 1,0 мл 4 % раствора меди сульфата (40 г/л) и 50,0 мл реактива бицинхониновой кислоты.
Метод 5 (Колориметрический метод с биуретовым реактивом)
Метод основан на взаимодействии ионов двухвалентной меди с пептидными связями молекулы белка в щелочной среде с образованием окрашенного комплекса, оптическая плотность которого измеряется при длине волны 540 нм. Этот метод показывает минимальные различия между равными количествами иммуноглобулиновых и альбуминовых белков.
Этот метод показывает минимальные различия между равными количествами иммуноглобулиновых и альбуминовых белков.
Метод не рекомендован для проведения реакции в растворах, содержащих соли аммония, а также для мутных или образующих осадок растворов. Для устранения влияния мешающих веществ проводят осаждение белка из раствора испытуемого образца следующим образом: к 1 объему раствора испытуемого образца прибавляют 0,1 объем 50 % раствора трихлоруксусной кислоты, перемешивают на вихревой мешалке и выдерживают при комнатной температуре в течение 10 мин, центрифугируют при 3000 g в течение 30 мин. Удаляют надосадочную жидкость и растворяют осадок в небольшом объеме 0,5 М раствора натрия гидроксида. Полученный раствор используют для приготовления испытуемого раствора.
При построении калибровочного графика стандартные растворы белка следует обрабатывать аналогичным способом.
Стандартные растворы. Если иное не указано в фармакопейной статье, растворяют соответствующий стандартный образец белка в 0,9 % растворе натрия хлорида. Части полученного раствора разводят 0,9 % раствором натрия хлорида для получения не менее трех стандартных растворов с концентрациями в интервале от 2 мг/мл до 10 мг/мл.
Части полученного раствора разводят 0,9 % раствором натрия хлорида для получения не менее трех стандартных растворов с концентрациями в интервале от 2 мг/мл до 10 мг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в 0,9 % растворе натрия хлорида с концентрацией белка, находящейся в пределах интервала концентраций стандартных растворов.
Контрольный раствор. Используют 0,9 % раствор натрия хлорида.
Методика. К 1,0 мл испытуемого раствора, каждого из стандартных растворов и контрольного раствора прибавляют 4,0 мл биуретового реактива, перемешивают и оставляют при комнатной температуре на 30 мин. Измеряют оптическую плотность испытуемого и стандартных растворов при длине волны 540 нм, используя контрольный раствор в качестве раствора сравнения (или указанной в фармакопейной статье, в пределах 540 — 650 нм).
Зависимость оптической плотности от концентрации белка носит нелинейный характер. Однако в небольшом интервале концентраций, используемых для построения калибровочного графика, она приближается к линейной. Строят график зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Строят график зависимости оптических плотностей стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и оптической плотности испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофотометра, но не реже 1 раза в 3 мес.
Примечание:
Приготовление 50 % раствора трихлоруксусной кислоты. В мерную колбу вместимостью 500 мл помещают 250 г трихлоруксусной кислоты и растворяют в воде. Объем раствора доводят до метки водой и тщательно перемешивают.
Срок годности 50 % раствора трихлоруксусной кислоты 1 мес.
Метод 6 (Флуорометрический метод с о-фталальдегидом)
Метод основан на дериватизации белка о-фталальдегидом, который реагирует с первичными аминогруппами белка (N-концевая аминокислота и
ε-аминогруппа остатков лизина) с последующим измерением флуоресценции полученного комплекса. Чувствительность количественного определения может быть увеличена гидролизом белка перед добавлением о-фталальдегида. Гидролиз делает α-аминогруппу, входящую в структуру аминокислот, доступной для взаимодействия с фталальдегидным реактивом. Метод является высокочувствительным и требует небольшого количества белка.
Чувствительность количественного определения может быть увеличена гидролизом белка перед добавлением о-фталальдегида. Гидролиз делает α-аминогруппу, входящую в структуру аминокислот, доступной для взаимодействия с фталальдегидным реактивом. Метод является высокочувствительным и требует небольшого количества белка.
Определению мешают буферные растворы, содержащие первичные амины, такие как трис(гидроксиметил)аминометан, и аминокислоты, которые взаимодействуют с о-фталальдегидом. Аммиак в больших концентрациях также взаимодействует с о-фталальдегидом. Флуоресценция, полученная при взаимодействии аминов с о-фталальдегидом, может быть нестабильной. Использование автоматизированных методик для стандартизации данного метода позволяет повысить точность и воспроизводимость определения.
Стандартные растворы. Растворяют соответствующий стандартный образец белка в 0,9 % растворе натрия хлорида. Части полученного раствора разводят 0,9 % раствором натрия хлорида для получения не менее пяти стандартных растворов с концентрациями в интервале от 10 мкг/мл до 200 мкг/мл.
Испытуемый раствор. Готовят раствор испытуемого лекарственного средства в 0,9 % растворе натрия хлорида с концентрацией белка, находящейся в пределах интервала концентраций стандартных растворов. Доводят значение рН раствора до 8,0-10,5 перед добавлением фталальдегидного реактива.
Контрольный раствор. Используют 0,9 % раствор натрия хлорида.
Методика. Смешивают 10 мкл испытуемого раствора, каждого из стандартных растворов и контрольного раствора с 0,1 мл фталальдегидного реактива и выдерживают при комнатной температуре в течении 15 мин. Прибавляют 3 мл 0,5 М раствора натрия гидроксида и перемешивают. Определяют интенсивность флуоресценции испытуемого раствора и каждого из стандартных растворов при длине волны возбуждения 340 нм и длине волны испускания между 440 нм и 455 нм, используя контрольный раствор в качестве раствора сравнения. Измеряют интенсивность флуоресценции указанных растворов только один раз, поскольку излучение снижает интенсивность флуоресценции.
Зависимость интенсивности флуоресценции от концентрации белка носит линейный характер. Строят график зависимости интенсивностей флуоресценции стандартных растворов от концентраций белка и используют линейную регрессию для построения калибровочной кривой. На основании калибровочной кривой и интенсивности флуоресценции испытуемого раствора определяют концентрацию белка в испытуемом растворе.
Калибровочный график строят каждый раз при приготовлении новых реактивов или использовании другого спектрофлуориметра, но не реже 1 раза в 3 мес.
Примечания:
Приготовление боратного буферного раствора. В мерную колбу вместимостью 1000 мл помещают 61,83 г борной кислоты и растворяют в воде и доводят рН до значения 10,4 при помощи раствора калия гидроксида. Объем раствора доводят до метки водой и тщательно перемешивают.
Приготовление исходного раствора фталальдегида. 1,20 г фталальдегида растворяют в 1,5 мл метанола, прибавляют 100 мл боратного буферного раствора и перемешивают. Прибавляют 0,6 мл 30 % раствора макрогол 23 лаурилового эфира (300 г/л) и перемешивают.
Прибавляют 0,6 мл 30 % раствора макрогол 23 лаурилового эфира (300 г/л) и перемешивают.
Хранят при комнатной температуре и используют в течение 3 недель.
Приготовление фталальдегидного реактива. К 5 мл исходного раствора фталальдегида прибавляют 15 мкл 2-меркаптоэтанола. Раствор следует готовить не менее чем за 30 мин перед использованием.
Используют в течение 24 часов.
Метод 7 (Определение белка по содержанию азота)
Определение белка по содержанию азота основано на том, что содержание азота в большинстве белков практически одинаково и может быть принято равным 16 %. По количеству найденного азота во взятой пробе рассчитывают содержание белка в лекарственном средстве, используя коэффициент пересчета азота на белок, равный 6,25.
На результаты определения будут оказывать влияние другие азотсодержащие вещества, присутствующие в испытуемом образце.
Методика определение белка по содержанию азота основана на разложении испытуемого образца в ходе проведения анализа, но не лимитирована содержанием белка в водной среде. При нагревании азотсодержащего органического соединения с серной кислотой концентрированной, азот превращается в аммония сульфат, который можно определить количественно.
При нагревании азотсодержащего органического соединения с серной кислотой концентрированной, азот превращается в аммония сульфат, который можно определить количественно.
Метод А (Метод Къельдаля)
Определение проводят в соответствии с требованиями, указанными в ОФС «Определение азота в органических соединениях» (метод 2 – микрометод Къельдаля) из точной навески препарата, содержащей 10 – 20 мг белка. После минерализации азотсодержащего органического соединения с серной кислотой концентрированной азот превращается в аммония сульфат, который можно определить количественно.
Метод Б
Большинство приборов для определения азота используют пиролиз, то есть сжигание образца в кислороде при температуре приблизительно 1000 °С, в ходе которого выделяется азота монооксид (NO) и другие оксиды азота (NOx), из азота присутствующего в испытуемом веществе. Некоторые приборы преобразуют оксиды азота в азот, который количественно определяется с помощью детектора по теплопроводности. В других приборах азота монооксид (NO) смешивается с озоном (О3) для получения азота диоксида (NO2 *) в возбужденном состоянии, испускающего свет при распаде, который может быть количественно определен с помощью хемилюминесцентного детектора. Для оптимизации навески и параметров пиролиза и обеспечения стабильности показателей при проведении анализа используется стандартный образец соответствующей чистоты и подходящий по составу с исследуемому белку.
В других приборах азота монооксид (NO) смешивается с озоном (О3) для получения азота диоксида (NO2 *) в возбужденном состоянии, испускающего свет при распаде, который может быть количественно определен с помощью хемилюминесцентного детектора. Для оптимизации навески и параметров пиролиза и обеспечения стабильности показателей при проведении анализа используется стандартный образец соответствующей чистоты и подходящий по составу с исследуемому белку.
Расчеты. Концентрацию белка рассчитывают путем деления содержания азота в испытуемом образце на известное содержание азота в исследуемом белке. Известное содержание азота в белке можно определить исходя из химического состава белка или путем сравнения с подходящим стандартным образцом.
Скачать в PDF ОФС.1.2.3.0012.15 Определение белка
Поделиться ссылкой:
Батончик с высоким содержанием белка со вкусом клубники в молочном шоколаде 50 г DOMYOS
Состав вкус Ваниль
Олигофруктоза, концентрат молочного белка, изомальтоолигосахарид, концентрат сывороточного белка, молочный шоколад (сахар, масло какао, сухое цельное молоко, какао тертое, сухая молочная сыворотка, молочный жир, эмульгаторы: соевый лецитин и Е476, ароматизатор натуральный «Ваниль»), подсолнечное масло, кокосовая стружка, влагоудерживающий агент глицерин, инулин, эмульгатор лецитин соевый, ароматизатор, D-альфа-токоферола ацетат (витамин Е).
Состав вкус Орех
Олигофруктоза, изомальтоолигосахарид, концентрат молочного белка, концентрат сывороточного белка, молочный шоколад (сахар, масло какао, сухое цельное молоко, какао тертое, сухая молочная сыворотка, молочный жир, эмульгаторы: соевый лецитин и Е476, ароматизатор натуральный «Ваниль»), арахис жареный, миндаль жареный, подсолнечное масло, ароматизатор, влагоудерживающий агент глицерин, эмульгатор лецитин соевый, инулин, D-альфа-токоферола ацетат (витамин Е).
Состав вкус Клубника
Концентрат молочного белка, олигофруктоза, концентрат сывороточного белка, изомальтоолигосахарид, молочный шоколад, фруктовые кусочки Клубника (концентр. яблочное пюре, клубничное пюре), фруктозо-глюкозный сироп, патока, сахар, пшеничное волокно, агент желирующий: пектин, регулятор кислотности: яблочная кислота, красители (концент. сок моркови, тыквы, черники), свекольный порошок, подсолнечное масло, инулин, влагоудерживающий агент глицерин, эмульгатор лецитин соевый, ароматизатор, витамин — Е
Масса нетто
50 г
Пищевая ценность
В 100 г продукта: белки – 33 г (44% от величины суточной нормы потребностей в белке в соответствии с ТР ТС 022/2011), жиры – 6 г, углеводы – 13,7 г, клетчатка – 27,3 г. , витамин Е – 10 мг (100% от рекомендуемой средней суточной потребности в витаминах и минералах). Энергетическая ценность в 100 г продукта: 295 ккал / 1235 кДж.
, витамин Е – 10 мг (100% от рекомендуемой средней суточной потребности в витаминах и минералах). Энергетическая ценность в 100 г продукта: 295 ккал / 1235 кДж.
ГОСТ на содержание белка в кормах, определение качества
Каково оптимальное количество белка в корме?
Как правило, производители готовых промышленных рационов, разрабатывая конкретный продукт, определяют содержание в нём отдельных нутриентов, ориентируясь на рекомендации FEDIAF и AAFCO. В отношении белка в сухом корме они одинаковы: в период роста, а также беременности и лактации кошкам необходимо минимум 30% протеина в пересчёте на сухое вещество, взрослым животным — минимум 26%. Для собак эти цифры составляют 22% и 18% соответственно.
Российский ГОСТ на белок в корме даёт такие же рекомендации. Обращаем ваше внимание, что это именно минимальные значения, снижение которых грозит серьёзными нарушениями в работе организма.
Сколько именно белка будет в каждом конкретном корме, зависит от производителя, который сам решает этот вопрос в зависимости от доступных ему технологий, позиционирования продукта на рынке, стоимости сырья и экономической целесообразности. Поэтому и разброс по содержанию белка в сухих кормах столь высок: в магазинах можно встретить рационы с уровнем протеина в гарантированном анализе и 12%, и 50%. Владельцам важно понимать, что производитель, сообщая информацию о белке на этикетке, гарантирует потребителям, что этого нутриента в корме будет не менее указанного процента, но может быть и больше.
Поэтому и разброс по содержанию белка в сухих кормах столь высок: в магазинах можно встретить рационы с уровнем протеина в гарантированном анализе и 12%, и 50%. Владельцам важно понимать, что производитель, сообщая информацию о белке на этикетке, гарантирует потребителям, что этого нутриента в корме будет не менее указанного процента, но может быть и больше.
В то же время существуют и физиологические потребности в белке у кошек и собак — это то оптимальное количество, которое необходимо для поддержания здоровой жизнедеятельности организма.
Сравним минимальные нормы отрасли с физиологическими потребностями: для кошки весом около 4 кг в сутки требуется приблизительно 60 г сухого корма. Представим, что у него средняя влажность 10% и он содержит 26% белка. При таком кормлении животное получит всего лишь 3,5 г белка в чистом виде на килограмм собственного веса. Суточная порция собаки, которая весит 10 кг, составляет примерно 150 г, и на рационе с 18% белка и 10% влажности она получит лишь 2,4 г белка на килограмм веса в сутки.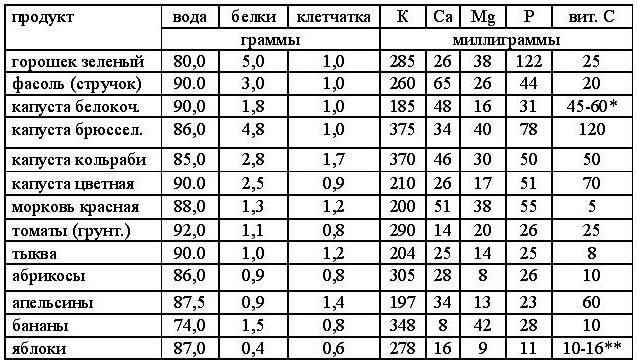 Как мы видим, до физиологической нормы корма с таким уровнем протеина явно не дотягивают.
Как мы видим, до физиологической нормы корма с таким уровнем протеина явно не дотягивают.
Определение ценности белка в кормах
Наиболее часто встречающиеся ингредиенты кормов для домашних животных — птица, мясо, рыба, субпродукты, зерно, бобовые и их производные — содержат белок, но их биологическая ценность для плотоядных неодинакова и складывается из двух составляющих:
- полноценности аминокислотного состава для данного вида животных;
- усвояемости (полноты расщепления белков ферментами пищеварительного тракта).
Для кошек и собак, как хищников, наиболее полный аминокислотный профиль содержат животные белки. Для наглядности приводим таблицу* содержания незаменимых аминокислот в двух самых популярных компонентах для собак и кошек.
На примере кукурузы понятно, что растительные компоненты обладают низкой биологической ценностью для кошек и собак, а значит, не могут служить сколько-нибудь адекватной заменой источникам животного белка, однако в составе многих готовых промышленных рационов этот факт попросту игнорируется. Таким образом, мы видим, что, используя кукурузу как основной источник белка, производителю придётся добавить её в корм в разы больше, чем курицы, чтобы добиться необходимого показателя. Но даже в этом случае в корме будет не хватать многих незаменимых аминокислот, поэтому в такие продукты приходится добавлять выделенные аминокислоты.
Таким образом, мы видим, что, используя кукурузу как основной источник белка, производителю придётся добавить её в корм в разы больше, чем курицы, чтобы добиться необходимого показателя. Но даже в этом случае в корме будет не хватать многих незаменимых аминокислот, поэтому в такие продукты приходится добавлять выделенные аминокислоты.
Важно понимать и такую простую вещь: зерновые являются источником не только белка, но и углеводов, причём в большей степени. Таким образом, чем больше зерна в корме, тем выше в нём уровень углеводов.
И напоследок — о качестве
Источники животного белка тоже могут быть разными. Наиболее качественными в плане сохранения всех ценных компонентов являются свежие мясо, рыба, яйца, ценные субпродукты (печень, почки, сердце, рубец), отличающиеся высоким содержанием витаминов и микроэлементов. Когда животные компоненты добавляются в корм в свежем виде, то несмотря на однократную тепловую обработку, они сохраняют значительную часть полезных веществ.
На втором месте находятся дегидратированные мясные продукты, которые перед приготовлением обезвоживаются. Добавляются такие компоненты для достижения необходимого уровня белка в корме. Важно понимать, что ценность этих компонентов ниже, так как прежде, чем попасть в корм высушенные компоненты однажды уже подвергались высокотемпературному воздействию, в результате чего многие витамины погибают, а аминокислоты разрушаются.
Очень часто в рецептах кормов используется мясная мука, на производство которой редко идёт отборное мясо — чаще всего это отходы мясной промышленности, изначально бедные по содержанию как аминокислот, так и других нутриентов. Ингредиенты такого типа, по сути являющиеся продуктом рендеринга, мы относим к третьему уровню качества ингредиентов.
Очень многое о качестве белка нам скажет и то, как ингредиенты названы в составе корма. Идеально, если на упаковке дано чёткое и полное описание каждого ингредиента, чтобы покупатель ясно понимал, из какого сырья произведён продукт.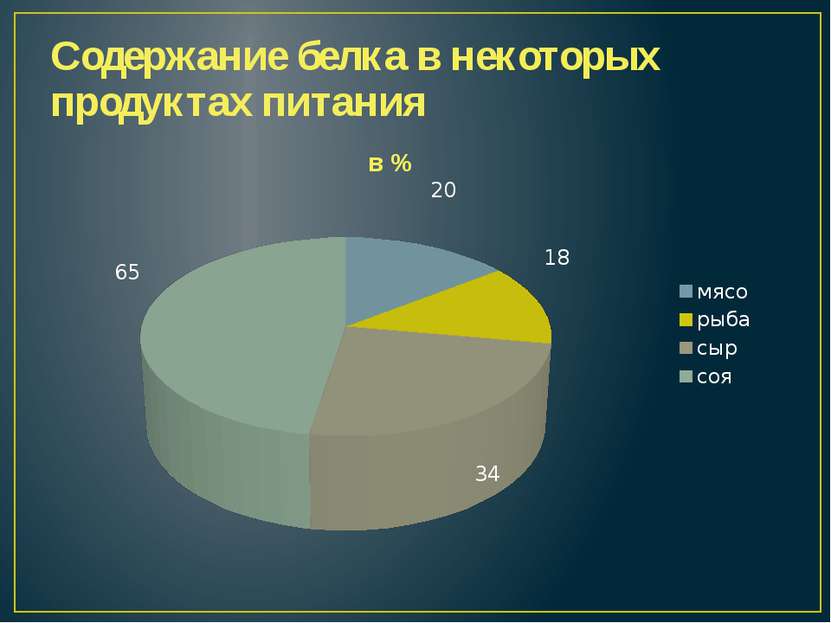 Также желательно, чтобы было указано процентное содержание компонента. Вот пример состава, не вызывающего сомнений, что именно ест питомец:
Также желательно, чтобы было указано процентное содержание компонента. Вот пример состава, не вызывающего сомнений, что именно ест питомец:
Может производитель пойти и по другому пути, завуалировав источник животного белка общими формулировками, из которых совершенно невозможно уяснить, из чего, собственно, корм состоит. Посмотрите на этот состав и попробуйте определить, какой вид мяса в нём использован?
Уверены, вам это не удалось ввиду того, что здесь эта информация попросту отсутствует. Единственное, что можно уяснить, — дегидратированные белки животного происхождения получены из птицы, но какой — опять же неясно. Покупая такой корм, владелец получает «кота в мешке» и попросту не знает, чем он кормит своего питомца на самом деле. И это может доставить множество проблем, если, например, у кошки или собаки есть непереносимость какого-то конкретного вида животного белка или другого ингредиента.
Выбирая корм, проверьте:
- Достаточно ли белка в корме в целом.

- Питомцам нужен корм, соответствующий их физиологическим потребностям, поэтому на этот показатель, указанный в гарантированном анализе, следует обращать особое внимание. Советуем посчитать минимальное количество белка, которое может получить питомец с конкретным кормом.
- Какого качества белок в корме.
Попробуйте разделить все источники белка в корме на животные и растительные. Желательно, чтобы доля качественных животных ингредиентов составляла не менее 65%. Важно также понять, насколько много в корме продуктов рендеринга (муки, гидролизатов и изолятов). Их преобладание в составе сразу должно вас насторожить.
*Источник: intelmeal.ru
RESOURCE PROTEIN СМЕСЬ С ВЫСОКИМ СОДЕРЖАНИЕМ БЕЛКА 200МЛ/ШОКОЛАД/

 Ввиду сбалансированного состава не имеет ограничений по длительности приема
Ввиду сбалансированного состава не имеет ограничений по длительности приемаВажная роль корма с высоким содержанием белка в питании кошек и собак
Необязательно постоянно быть в режиме искателя приключений, чтобы сохранить здоровье и активность вашего питомца. Каждый владелец домашнего животного под активным образом жизни подразумевает что-то свое. Тем не менее, есть некоторые вещи, с которыми согласятся все – например, сколько нюансов нужно учитывать при подборе рациона для вашего питомца, чтобы быть уверенным, что он получает полноценное питание.
Какие ингредиенты должны быть в составе корма для вашего питомца? Какой вкус выбрать? Также необходимо учитывать возраст вашего любимца, размер породы и даже индивидуальные ограничения в питании, такие как аллергия или медицинские показания. Все это выглядит достаточно сложной задачей. Начать подбор стоит с такого параметра, как количество протеина в составе, и рассмотреть варианты кормов для кошек и собак с высоким содержанием белка.
Почему так важно обращать внимание на содержание белка?
Белок – это незаменимый макронутриент, питательное вещество, жизненно важное для крепкого здоровья и хорошего самочувствия собак и кошек. Белок важен для роста и поддержания в хорошем состоянии всех тканей организма, он легко усваивается и служит природным источником незаменимых аминокислот, необходимых собакам и кошкам в качестве «строительного материала» для шерсти, кожи, мышц, хрящей, сухожилий и связок. На молекулярном уровне белок играет ключевую роль в выработке ферментов, запускающих жизненно важные метаболические реакции, гормонов, которые действуют в организме как химические посредники, и антител, которые формируют иммунную систему. Очень важно, чтобы в рационе ваших питомцев присутствовало достаточное количество высококачественного белка: так они получают необходимые элементы для здоровой жизни.
Как определить количество белка в корме вашего питомца
Существует несколько способов определить, достаточно ли белка в рационе вашего питомца:
1. Посмотрите на состав и найдите указанный в нем животный белок, например, индейка, курица или лосось.
2. Посмотрите на общее содержание белка, указанное в гарантированном составе на обратной стороне упаковки(%).
3. Ориентируйтесь на то, что содержание белка должно быть выше 30 для собак и выше 40 для кошек.
Чего ожидать при переходе на корм с более высоким содержанием белка для кошек и собак.
Прежде чем переводить питомца на корм с повышенным содержанием белка, помните: важно делать это постепенно, на протяжении не менее 7-10 дней, чтобы избежать расстройства пищеварения. Если у животного есть какие-либо заболевания, вам необходимо проконсультироваться с ветеринаром по поводу выбранного рациона.
Обеспечьте своему питомцу рацион с необходимым количеством белка, и вскоре вы будете приятно удивлены, заметив улучшение состояния их здоровья и самочувствия:
- Шерсть и кожа станет более гладкой и шелковистой уже через несколько недель,
-
Улучшится структура мышц, -
Повысится уровень энергии и игривости, -
Здоровое пищеварение, -
Стул уменьшится в объеме – чем меньше наполнителей, тем меньше отходов.
Конечно же, высокое содержание белка — не единственное, что должно быть в составе корма. Во всех рецептурах CORE этот важный питательный элемент идеально сбалансирован умеренным содержанием жиров и сниженным содержанием углеводов для оптимизации уровня энергии вашего питомца. Кроме того, мы добавляем свежие фрукты и овощи в качестве натуральных источников витаминов, минералов и антиоксидантов.
Почему CORE постоянно стремится к идеально сбалансированному рациону, богатому белком? Домашние животные – это члены нашей семьи, и мы хотим дать им все возможное для долгой, здоровой и счастливой жизни. А это значит еще больше игр во дворе, прогулок по окрестностям, поцелуев и объятий в конце каждого дня.
Как вы заметите то, что ваш питомец стал более здоровым и жизнерадостным?
Может, вы вдохновитесь и сами станете более активными.
Возможности безграничны.
Содержание белка в пшенице
В пшенице содержится приблизительно от 6 до 20% белка, в зависимости от типа и разновидности пшеницы, но главным образом в зависимости от условий внешней среды в период созревания пшеницы.
Обильные дожди в период развития зерна обусловливают низкое содержание белка, а сухая погода в это же время благоприятствует его высокому содержанию. На содержание белка значительно влияет также наличие в почве азота. Усиленные дозы азотных удобрений увеличивают содержание белка в пшенице. Финни и др. установили, что можно достигнуть значительного увеличения белка в пшенице путем подкормки ее в поле в соответствующее время, в период развития зерна, раствором мочевины.
Для выпечки дрожжевого хлеба обычно предпочитается мука с содержанием белка не менее 11 %, а чтобы мука получилась с таким количеством белка, содержание его в пшенице должно быть не менее 12%. Климатические условия во многих странах не позволяют производить пшеницу с таким процентом белка, в связи, с чем эти страны вынуждены, как правило, импортировать высокобелковую пшеницу, чтобы в дальнейшем смешивать ее с местной. В США обычно выплачивается премия за твердозерную пшеницу с высоким содержанием белка, поскольку на такую пшеницу предъявляют усиленный спрос для смешивания с низкобелковой пшеницей при выработке хлебопекарной муки. Твердозерная пшеница в США обычно продается не только с учетом типа, но и содержания белка.
Мука для разных других целей (за исключением выпечки дрожжевого хлеба) вырабатывается в общем из низкобелковых пшениц, в некоторых случаях с совершенно ничтожным процентом содержания белка. В приведенном ниже перечне приблизительно указывается необходимое количество белка в муке в зависимости от ее назначения.
Содержание белка определяется обычно с помощью весьма распространенного метода Кьельдаля или одной из его модификаций. При условии тщательного соблюдения всех деталей это совершенно точный и довольно несложный метод. Крупные лаборатории, выполняющие анализы на содержание белка, часто производят до тысячи определений в день.
Кроме упомянутого метода, имеются и другие, более простые и быстрые методы определения процентного содержания белка в пшенице, как, например, фотометрический метод, предложенный 3елени и др., биуретовый метод Пинкни, метод связывания красок Юди и сульфсалициловый метод Файнштейна и Xарта.
Указанные методы носят эмпирический характер, поэтому результаты; полученные с их помощью, всегда сверяются с результатами по методу Кьельдаля, хотя они обычно хорошо совпадают. Тем не менее ни один из указанных быстрых и простых методов не может быть рекомендован для применения вместо метода Кьельдаля во всех тех случаях, когда даже нессколько десятых долей процента белка имеют значение, поскольку в каждом отдельном случае расхождения между результатами этих методов и результатами определения белка по Кьельдалю составляют около 0,7% белка и даже больше. Правда, до сих пор еще окончательно не установлено, какой метод дает ошибку в этих случаях. Следует подчеркнуть все же, что в действительности методом Кьельдаля определяется только содержание азота, причем подсчет содержания белка производится путем использования произвольного множителя. Поскольку содержание небелкового азота в пшенице разных типов и разного происхождения может быть несколько неодинаковым, метод Кьельдаля, несмотря на его сравнительно высокую степень точности, может фактически оказаться менее точным для определения действительного содержания, белка, чем это вообще принято считать.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
Содержание белка в рационе для оптимальной диеты: клинический взгляд
Abstract
Роль диетического белка в различных клинических условиях питания и некоторых физиопатологических перспективах является актуальной и горячей темой для обсуждения. Недавние материалы Protein Summit 2, в которых приняли участие более 60 ученых-диетологов, экспертов в области здравоохранения и преподавателей питания, предлагают увеличить потребление растительного, но, в частности, животного белка, поскольку оно более богато лейцином и, следовательно, более эффективно влияет на метаболизм анаболического белка.Выводы Группы явно противоречат заявлениям об экологии питания, которые решительно поддерживают сокращение количества продуктов животного происхождения в рационе человека и в настоящее время обеспокоены чрезмерным потреблением, в основном животного белка, в западных и западных странах. В заключение, пришло время тщательно оценить потребление белка и аминокислот с учетом качества, усвояемости, суточного распределения и индивидуальных характеристик.
Ключевые слова: диетический белок, животные белки, незаменимые аминокислоты, лейцин
Американский журнал клинического питания (AJCN) недавно опубликовал в качестве дополнения 1, 2, 3, 4, 5, 6 Proceedings of the Protein Summit 2 для оценки роли диетического белка в различных клинических условиях питания и некоторых физиопатологических перспективах, таких как контроль веса, метаболическая активность, здоровое старение и более здоровое питание в рамках энергетического баланса.Саммит, а также добавка AJCN, в которой приняли участие более 60 ученых-диетологов, экспертов в области здравоохранения и преподавателей питания, также были поддержаны несколькими «мясными компаниями» 1.
Подводя итог заключениям, начиная с контроля веса (оптимальной потери веса) у пациентов с ожирением, панель 1 показала большую потерю веса, потерю жировой массы, лучшее сохранение безжировой массы тела, более значительное снижение артериального давления, триглицериды в сыворотке крови. , и окружность талии после более высокого содержания белка по сравнению сдиеты с низким содержанием белка, как в краткосрочной, так и в долгосрочной перспективе. Также было обнаружено легкое влияние на чувство сытости, но не на насыщение. Общие данные показывают, что содержание белка в ограничительных диетах должно находиться в диапазоне 1,2–1,6 г белка на кг / вес тела (МТ) в день с общим показанием принимать 20–30 г белка при каждом основном приеме пищи (завтрак, обед и обед). Эти результаты были подтверждены в недавней статье Wejis и Wolfe7 на выборке пожилых людей с ожирением (старше 55 лет), показывающей, что потребность в белке во время потери веса должна составлять не менее 1.2 г / кг массы тела и 1,9 г / кг массы без жира для получения удовлетворительного прироста мышечной массы.
Что касается метаболической роли белков, комиссия утверждает, что рекомендуемые диетические нормы основаны на исследованиях азотного баланса (NB), которые просто отражают общее удержание азота в условиях энергетического баланса у здоровых молодых людей.8 Кроме того, потребление белка с пищей рассчитывается на основе минимального количества, необходимого для достижения NB, и минимальных требований к аминокислотам (AA). С другой стороны, более точный и реалистичный подход к белковому балансу заключается в оценке основных или необходимых требований к АА для получения метаболических преимуществ, а не только для поддержания, таких как улучшение гликемической регуляции, восстановление после травмы, улучшение функции безжировой массы тела и т. Д.Группа экспертов предлагает метод индикаторного окисления аминокислот (IAAO) в качестве альтернативного подхода к NB.Метод IAAO подчеркивает, что при дефиците незаменимых АК в рационе все остальные АК будут окисляться в соответствии с различными физиопатологическими состояниями. 9, 10 Фактически, метод IAAO снова предлагает потребность в белке 1,2 г кг / МТ / день, что намного выше, чем текущие рекомендации диетических рекомендаций8.
Другие исследования3, 11, 12 идентифицируют сами АК как потенциальные сигналы для активации синтеза белка, а не только как субстраты для метаболизма белка.Среди различных сигнальных систем основную роль играет лейцин-индуцированная активация млекопитающих — мишень комплекса рапамицина 1 (mTORC-1), в частности, в синтезе мышечного белка: индуцированная лейцином активация mTORC1 приводит к стимуляции синтеза скелетных мышц. предпочтительно в течение 2 часов после приема пищи, содержащей не менее 20–30 г белков, богатых лейцином.13, 14, 15 Этот ответ, называемый «порог приема пищи», подкрепленный регулярными физическими упражнениями, уменьшается с возрастом, что предполагает небольшое увеличение потребление белка пожилыми людьми — это совершенно новое предложение по просвещению в области питания, помимо традиционного показания к регулярным физическим упражнениям для предотвращения саркопении16 за счет положительного влияния на путь mTORC1.17 Хотя предполагается увеличение потребления как растительного, так и животного белка, 18 Группа отмечает, что животные белки богаче лейцином и, следовательно, более эффективны для влияния на метаболизм анаболических белков. Предупреждение также выдвигается в связи с текущей диетической рекомендацией резко сократить потребление насыщенных и твердых жиров, что в диетической практике означает сокращение количества животных белков и связанных с ними групп пищевых продуктов. Хроническое сокращение потребления пищевых продуктов животного происхождения19 может иметь в качестве вторичного эффекта снижение потребления некоторых «питательных веществ, вызывающих озабоченность» (т.е. питательных веществ с ежедневным потреблением, как правило, ниже рекомендованного), таких как кальций, витамин D, калий, железо, фолиевая кислота для белковых продуктов животного происхождения18, 19 и диетическая клетчатка, витамин E и магний для белковых продуктов растительного происхождения18, 20
В конце концов, Комиссия предлагает тему перевода современных научных данных в клиническую практику; Другими словами, нужно ли нам пересматривать текущие диетические рекомендации?
Panel1 предполагает, что текущая рекомендуемая диета составляет 0.8 г белков / кг МТ / день основаны на расчетной средней потребности 0,66 г / кг МТ / день, «среднесуточный уровень потребления питательных веществ, рассчитанный для удовлетворения потребности половины здоровых людей на определенном этапе жизни и в определенной гендерной группе». 20, 21 В заключение, 0,8 г белков / кг МТ / день кажется слишком низким, по крайней мере, в некоторых клинических условиях, а метод NB неточен для надлежащего мониторинга индивидуальных потребностей в белке. Следовательно, Группа предлагает «гибкость» также в отношении потребления белка, чтобы создать множество планов питания для отдельных лиц.
С точки зрения питания Группа поддерживает рекомендацию о приемлемых диапазонах распределения макронутриентов (AMDR), которая направлена на поддержание адекватного потребления макронутриентов (и микронутриентов) на фоне адекватного потребления энергии. По данным Института медицины 21 AMDR для углеводов составляет от 45% до 65%, жиров от 20% до 35% и белков от 10% до 35% от общего количества потребляемой энергии.
Убедительное заявление Группы, по крайней мере, на наш взгляд, заключается в том, что время потребления белка должно быть равномерно распределено при минимальном количестве 20–30 г / прием пищи в течение трех основных блюд.
Особое внимание уделяется составу АК белков; Наконец, дается настоятельная рекомендация увеличить рекомендуемое потребление белка с 0,8 до 1,0–1,2 г / кг / день, по крайней мере, для пожилых людей и при некоторых других физиопатологических состояниях.
Эти выводы, сделанные после прочтения дополнения AJCN, явно противоречат заявлениям о пищевой экологии, которые (фактически уже более 10 лет) решительно поддерживают сокращение количества продуктов животного происхождения в рационе человека и в настоящее время обеспокоены чрезмерным (в основном животных) потребление белка в западных и западных странах.22, 23 Недавние наблюдения подтверждают подозрение, что высокое потребление белка с пищей (когда белок заменяет углеводы) связано для населения в целом с повышенным риском набора веса24.
Количество (и качество) потребляемого белка по-прежнему является «горячей» диетической темой, требующей широкого обсуждения и уточнения.
В данной статье не рассматривается вопрос о качестве пищевого белка; тем не менее, Продовольственная и сельскохозяйственная организация (ФАО) недавно пересмотрела использование новой шкалы для количественной оценки качества диетического белка: шкалы усвояемых, незаменимых (или незаменимых) аминокислот и DIAAS.25
Эта оценка подчеркивает содержание ИУК и усвояемость белка как показатель биологической ценности белка, фактор, представляющий ценный клинический и физиологический интерес.26, 27
Как предварительное наблюдение, необходимо прийти к общему мнению о том, что означает «г протеина / кг массы тела / день». Что мы хотим для BW: актуальное, идеальное BW или что-то еще? Как лечить людей с недостаточным или избыточным весом, молодых или пожилых людей, людей с саркопенией или культуристов? Предположение о 0,8 или 1,2 или других количествах диетического белка / кг массы тела имеет заметную систематическую ошибку из-за вариабельности состава тела, явно не определяемой простым измерением массы тела и индекса массы тела! Мы бы предложили, и на самом деле мы, по крайней мере, в текущей клинической практике, но не у критически больных пациентов, принять в качестве эталона BW, «желаемый BW», рассчитанный на основе среднего значения индекса массы тела между 18.5 и 25 кг / м 2 . Тем не менее, мы задаем дискуссию по этому вопросу. Кроме того, адекватное потребление белка требует специальной оценки для пациентов в критическом состоянии, особенно при искусственном питании. Мы также считаем, что, по-прежнему подтверждая для населения текущие диетические рекомендации 0,8 г белка / кг «желательной» массы тела в день, AMDR может быть разумным диетическим подходом в клинической практике, но также является обоснованием для диетических рекомендаций. Это допускает некоторую гибкость в диетических рецептах, учитывая крайнюю неоднородность групп населения с большими этническими, культурными, социальными, экономическими межиндивидуальными различиями и особенностями, более широкий возрастной диапазон с заметным увеличением числа пожилых людей, людей старше 65 лет, значительным сокращением при физической активности в любом возрасте и т. д.Общие рекомендации придерживаться более вегетарианской, экологически безопасной диеты в средиземноморском стиле должны сохраняться при условии, что будет обеспечено разнообразие в потреблении продуктов растительного и животного происхождения с высокой питательной ценностью. Более точное распределение богатой белком пищи при трех основных приемах пищи (в частности, за счет увеличения потребления белка за завтраком, по крайней мере, в странах Средиземноморья с одновременным сокращением во время обеда) может улучшить белковый баланс и, следовательно, снизить потребление белка.Эффект экономии белка будет также получен при регулярных физических упражнениях. Можно предложить более высокое потребление смешанных растительных и животных белков, чем нынешние 0,8 г / кг МТ / день, связанное с регулярными физическими упражнениями, в ограничительных диетах для пациентов с ожирением и у (в остальном здоровых) пожилых людей с саркопенией.
По нашему мнению, тема рекомендаций по потреблению белка до сих пор не была исчерпывающе исследована, по крайней мере, в клинической практике питания: теперь пора тщательно оценить потребление белка и АК, как это обычно делается для потребления жиров и СНО, с точным учетом количества. но также качество, усвояемость, время ежедневного распределения, состав еды, индивидуальные характеристики обезжиренной массы, общее дневное потребление энергии, сопутствующие заболевания и т. д.
Особое внимание также следует уделять «питательным веществам, вызывающим озабоченность», на предположение о которых может легко повлиять состав предписанного рациона, включая продукты, богатые белком.
Работа с мукой с низким содержанием белка
Q: Наша обычная мука с высоким содержанием глютена пережила крышу с точки зрения затрат. У меня есть возможность купить муку с низким содержанием белка по гораздо более низкой цене. Что мне нужно сделать, чтобы использовать муку с низким содержанием белка?
A: Мне задавали этот вопрос много раз, и мой стандартный ответ состоит в том, что это зависит от количества протеина в вашей муке и содержания протеина в муке.Мы даже не будем вдаваться в подробности, как вы управляете тестом, поскольку это могло бы стать значительной главой в моей книге; Вместо этого давайте рассмотрим основные изменения, необходимые для эффективного использования муки с низким содержанием белка при приготовлении качественной пиццы.
Предположим, вы используете муку с высоким содержанием глютена и содержанием белка около 13 процентов. Вы хотите иметь возможность использовать новую муку, такую как мука для хлеба с содержанием белка всего 11 процентов. Вы сможете сохранить рецептуру теста в том же виде.После замеса теста перенесите его прямо на стол для масштабирования и формования в шарики, затем поместите шарики из теста в коробки для теста или другие подходящие контейнеры и как можно быстрее поместите их в холодильник. Не позволяйте тесту выходить из холодильника дольше, чем это абсолютно необходимо после замеса. Убедитесь, что ящики с тестом сложены крест-накрест в холодильнике, по крайней мере, на два часа, затем опустите их и сложите ящики.
После того, как вы поместите тестовые коробки в холодильник, не пытайтесь хранить тесто более двух дней.Эта мука с низким содержанием белка не выдержит трех дней хранения в холодильнике почти так же хорошо, как обычная мука с высоким содержанием белка. Чтобы использовать тесто, вытащите из холодильника примерно трехчасовой запас за 90 минут до того, как вы собираетесь его использовать.
До тех пор, пока вы не выполняете никаких демонстрационных подбрасываний / раскручивания теста, вы не должны видеть слишком большой разницы в способе обработки теста, но если вы действительно чувствуете, что тесто обрабатывается немного мягче, чем вам хотелось бы, вы может потребоваться уменьшить общее поглощение теста на 2 или 3 процента от веса муки, чтобы придать тесту что-то более близкое к вашим «нормальным» характеристикам обработки теста.
Что касается качественных характеристик готовой пиццы, вы можете немного потерять хрусткость, но многое из этого можно восстановить, изменив время и температуру выпекания. Выпекая пиццу немного дольше и при немного более низкой температуре, можно вернуть большую часть хрустящей корочки.
Другой подход — рассмотреть возможность добавления витальной пшеничной клейковины (VWG) в рецептуру теста, приготовленного из муки с низким содержанием белка. Жизненно важный пшеничный глютен — это не что иное, как концентрированный глютен, который обычно содержится в муке, которую мы используем каждый день.Правило, которому нужно следовать для увеличения содержания белка в муке с жизненно важным пшеничным глютеном, выглядит следующим образом:
1) Решите, насколько вы хотите увеличить содержание белка.
2) Разделите это число на 0,60; это даст вам процент жизненно важного пшеничного глютена (VWG), который нужно добавить для достижения желаемого содержания белка.
3) На каждый 1 процент добавленного VWG увеличивайте водопоглощение на 1 процент. (Добавьте в тесто воды в количестве, равном количеству добавленного VWG)
Добавьте VWG в тесто, добавив его непосредственно в сухую муку и взбивая в течение нескольких секунд, чтобы он растворился в муке.
Если мы заменяем типичную муку с высоким содержанием глютена с содержанием белка примерно 13 процентов на хлебную муку с содержанием белка примерно 11 процентов, разница в содержании белка, которую будет вносить VWG, составит 2 процента. Если мы разделим это на 0,60, нам нужно будет добавить 3,33 процента VWG в зависимости от веса муки, поэтому, если мы используем 50 фунтов муки, нам нужно будет добавить 1,665 фунтов (1 фунт 10,64 унции) VWG. Затем мы добавляли равное количество воды в рецептуру теста.Это даст нам готовое тесто с тем же общим содержанием белка, которое мы использовали ранее, и мы могли бы использовать это тесто точно так же. Единственным недостатком использования VWG является его стоимость. Его добывают из муки, поэтому его стоимость привязана к стоимости муки. Но для некоторых операторов использование более дешевой муки в сочетании с VWG может иметь преимущество в стоимости или производительности для производства муки, пригодной для использования в их конкретном применении.
Q: Есть ли какой-нибудь «волшебный» ингредиент, который мы можем добавить в более дешевую муку, чтобы она работала так же, как наша обычная мука, цена на которую сейчас практически недоступна?
A: Под более низкой стоимостью, я предполагаю, что вы имеете в виду муку с более низким содержанием белка, такую как хлеб или мука типа H&R.Единственное, что вы можете добавить в любую из этих видов муки, чтобы придать им те же характеристики, что и мука с высоким содержанием белка / глютена, — это жизненно важный пшеничный глютен. Существуют дополнительные ингредиенты, называемые усилителями теста, которые можно добавлять в тесто, чтобы усилить его, но не в такой степени, в какой их нужно было бы усиливать при применении для пиццы, поэтому в конечном итоге ответ отрицательный. Однако имейте в виду, что если нынешняя ситуация с мукой когда-либо ухудшится до такой степени, что мы будем вынуждены принимать любую поставляемую нам муку или вообще не будем иметь никакой муки, с которой можно будет работать, лучший курс действий по-прежнему будет заключаться в том, чтобы принять ее. мука.Нет, из него не получится лучшая пицца в городе, но свет будет включен, а дверь будет открыта. Как бы вы использовали такую муку?
Вот некоторые основные сведения о том, что может потребоваться для использования такой муки:
1) Уменьшите абсорбцию теста примерно до 50 процентов или чуть меньше, исходя из общего веса муки в вашем тесте.
2) Замешивайте тесто до тех пор, пока оно не станет гладким, не более того.
3) Отрегулируйте температуру воды, которую вы добавляете в тесто, чтобы обеспечить готовую температуру теста в диапазоне от 70 до 75 F.
4) Сразу после замеса масштабируйте тесто, сформируйте из него шарики и как можно быстрее поместите его в коробку и поместите в холодильник.
5) Обязательно протрите шарики теста небольшим количеством масла и убедитесь, что они сложены крест-накрест в холодильнике не менее чем на 2 часа, прежде чем складывать и складывать коробки.
6) Постарайтесь приготовить ровно столько теста, чтобы его можно было полностью использовать на следующий день, помня, что тесто, вероятно, все еще будет показывать некоторое обещание для использования на второй день (но не испытывайте удачу, оно может не выдержать три дня).
7) Во многих случаях вы можете улучшить высоту / толщину корочки, снизив температуру выпекания примерно на 25 F и увеличив время выпекания для достижения желаемого цвета и характеристик готовой корочки.
Помните, в Италии готовили отличную пиццу задолго до того, как у нас появилась мука с высоким содержанием белка.
Содержание белка в 230 общих продуктах питания
Последнее обновление 4 ноября 2021 г., Майкл Джозеф
У всех нас разные потребности в белке, но бывает сложно точно определить, сколько белка содержится в обычных продуктах питания.
По этой причине в этом руководстве представлен простой обзор содержания белка в 230 распространенных продуктах питания.
Источником данных является сводная база данных пищевых продуктов Министерства сельского хозяйства США, и все продукты указаны из расчета на 100 граммов сырых (1).
Зерновые
Зерна злаков умеренно богаты белком.
| Продукты питания | Содержание белка (на 100 г) |
| Амарант | 13,6 г |
| Ячмень | 12 г |
| Хлеб (коричневый) | 11 г |
| Хлеб (белый) | 9 г |
| Гречка | 13.3 г |
| Кукурузная мука | 8,8 г |
| Зерна кукурузы | 9,4 г |
| Кускус | 12,7 г |
| Овес | 16,9 г |
| Макаронные изделия (сухие) | 13 г |
| Киноа | 14,1 г |
| Рис (коричневый) | 7,5 г |
| Рис (белый) | 7,5 г |
| Ржаная мука | 10.9 г |
| Манная крупа | 12,7 г |
| пишется | 14,6 г |
| Мука пшеничная | 12,0 г |
| Пшеница (цельное зерно) | 13,2 г |
| Дикий рис | 14,7 г |
Молочные продукты и яйца
Молочные продукты являются богатыми источниками полноценного белка, и сыр может быть особенно богат белком в зависимости от конкретного типа сыра.
| Продукты питания | Содержание белка (на 100 г) |
| Сыр Бри | 20,7 г |
| пахта | 3,2 г |
| Сыр камамбер | 19,8 г |
| Сыр Чеддер | 24,9 г |
| Сгущенное молоко | 7,9 г |
| Сыр Бри | 20,7 г |
| пахта | 3.2 г |
| Сыр камамбер | 19,8 г |
| Сыр Чеддер | 24,9 г |
| Сгущенное молоко | 7,9 г |
| Творог | 11 г |
| Творог (нежирный) | 12,4 г |
| Крем | 2,1 г |
| Сливочный сыр | 6,2 г |
| Сыр Эдам | 25 г |
| Яйца | 12.6 г |
| Сыр фета | 14,2 г |
| Сыр Гауда | 24,9 г |
| Сыр Грюйер | 29,8 г |
| Молоко (1% жирности) | 3,3 г |
| Молоко (цельное) | 3,3 г |
| Сыр Моцарелла | 22,2 г |
| Сыр пармезан | 35,7 г |
| Сыр Проволоне | 25.6 г |
| Яйца перепелиные | 13,1 г |
| творог | 12 г |
| Сыр Романо | 31,8 г |
| Сметана | 2,4 г |
| Швейцарский сыр | 27 г |
| Концентрат сывороточного протеина (Now Foods) | 72,7 г |
| Изолят сывороточного протеина (Now Foods) | 89,3 г |
| Йогурт | 3.5 г |
Фрукты
Вообще говоря, фрукты — плохой источник белка.
Тем не менее, некоторые фрукты все еще содержат небольшое количество, из которых наиболее заметны сушеные ягоды годжи.
| Продукты питания | Содержание белка (на 100 г) |
| Яблоко | 0,3 г |
| Абрикос | 1,4 г |
| Абрикос (сушеный) | 3.4 г |
| Авокадо | 2 г |
| Банан | 1,1 г |
| ежевика | 1,4 г |
| Черника | 0,7 г |
| Вишня | 1,1 г |
| Даты | 2,5 г |
| дуриан | 1,3 г |
| Ягоды годжи (сушеные) | 14,3 г |
| Виноград | 0.8 г |
| Грейпфрут | 0,8 г |
| Гуава | 2,6 г |
| Киви | 1,1 г |
| Кумкват | 1,9 г |
| Лимон | 1,1 г |
| Лайм | 0,7 г |
| Логанберри | 1,5 г |
| Манго | 0,8 г |
| Оливки | 1,0 г |
| Оранжевый | 1.0 г |
| Маракуйя | 2,2 г |
| Персик | 0,9 г |
| Хурма | 0,8 г |
| Ананас | 0,6 г |
| Гранат | 1,7 г |
| Чернослив | 3,7 г |
| Изюм | 2,3 г |
| Малина | 1,2 г |
| Звездчатые фрукты | 1.0 г |
| Клубника | 0,7 г |
| Тамаринд | 2,8 г |
| Мандарин | 0,8 г |
Бобовые
Бобовые — это, как правило, лучший растительный источник белка. Бобовые продукты, такие как твердый тофу, также очень богаты белком.
| Продукты питания | Содержание белка (на 100 г) |
| Черная фасоль | 21.6 г |
| Нут | 20,3 г |
| Горох колотый зеленый | 23,1 г |
| Фасоль | 22,5 г |
| Чечевица | 24,6 г |
| Лимская фасоль | 21,5 г |
| Мисо | 12,8 г |
| Бобы мунг | 23,9 г |
| Натто | 19,4 г |
| Арахис | 25.8 г |
| Фасоль пинто | 21,4 г |
| Соевые бобы | 28,6 г |
| Темпе | 20,3 г |
| Тофу | 17,3 г |
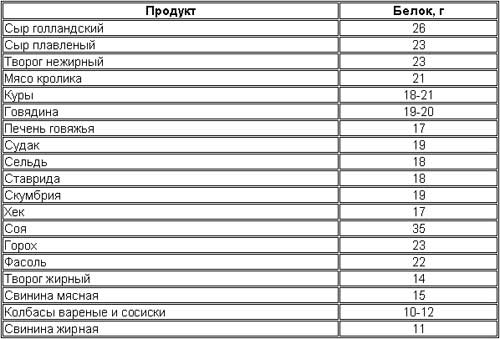
Мясо
Для мяса это приблизительное количество белка, основанное на данных Министерства сельского хозяйства США.
Мясные продукты являются полноценным источником белка, но стоит отметить, что плотность белка в разных видах мяса может значительно различаться.Например, куриная грудка без кожи будет содержать гораздо больше белка, чем жирный стейк или свиная грудинка.
Для тех, кто хочет максимально увеличить содержание протеина, постное мясо предлагает лучшее соотношение протеина и калорий.
| Продукты питания | Содержание белка (на 100 г) |
| Бекон | 13 г |
| Почка говяжья | 17,4 г |
| Печень говяжья | 20.4 г |
| Селезенка говяжья | 18,3 г |
| Филей нижний | 20,6 г |
| Сервелат | 17,5 г |
| Куриная грудка | 23,1 г |
| Куриная печень | 16,9 г |
| Чоризо | 24,1 г |
| Стейк из куриного глаза | 19 г |
| Утиное мясо | 18,3 г |
| Фланк-стейк | 21.2 г |
| Говяжий фарш | 17,2 г |
| Куриный фарш | 17,4 г |
| Фарш из баранины | 16,6 г |
| Свиной фарш | 16,9 г |
| Фарш из индейки | 17,5 г |
| Баранья отбивная | 18,3 г |
| Сердце ягненка | 16,5 г |
| Почка ягненка | 15,7 г |
| Печень ягненка | 20.4 г |
| Ливервурст | 14,1 г |
| Панчетта | 9,3 г |
| Пепперони | 23 г |
| Свиная отбивная | 20,7 г |
| Почка свиная | 16,5 г |
| Прошутто | 24,1 г |
| Стейк Рибай | 17,3 г |
| Стейк раунд | 22,2 г |
| Юбка стейк | 23.1 г |
| Soppressata | 25 г |
| Стейк из стрипов | 23,1 г |
| Сладкое печенье | 20,4 г |
| Стейк из вырезки | 20 г |
| Верхний стейк из вырезки | 20 г |
| Стейк на косточке | 20,3 г |
Орехи и семечки
Орехи — еще один растительный источник белка, и количество белка существенно варьируется от ореха к ореху.
| Продукты питания | Содержание белка (на 100 г) |
| Желудь | 8,1 г |
| Миндаль | 21,2 г |
| Бразильские орехи | 14,3 г |
| Орехи кешью | 18,2 г |
| Каштаны | 5 г |
| Семена чиа | 15,6 г |
| Кокосовое мясо | 3.7 г |
| Семена льна | 18,3 г |
| Орехи гинкго | 10,4 г |
| Фундук | 15 г |
| Хумус | 8 г |
| Орехи макадамия | 7,9 г |
| Пеканы | 9,5 г |
| Кедровые орехи | 13,7 г |
| Фисташковые орехи | 21,1 г |
| Тыквенные семечки | 18.6 г |
| Семена кунжута | 17 г |
| Семечки подсолнечника | 20,8 г |
| Тахини | 17 г |
| Грецкие орехи | 18 г |
Морепродукты
Помимо большого количества омега-3, витаминов и минералов, морепродукты также являются отличным источником белка.
| Продукты питания | Содержание белка (на 100 г) |
| Морское ушко | 17.1 г |
| Анчоусы | 20 г |
| Бас | 18,4 г |
| Лещ | 24 г |
| Сом | 16,4 г |
| Икра | 25 г |
| Краб | 19 г |
| Треска | 19 г |
| Каракатица | 16,2 г |
| Угорь | 18,4 г |
| Камбала | 12 г |
| Палтус | 20.8 г |
| Селедка | 18 г |
| Лобстер | 18,8 г |
| Скумбрия | 19 г |
| Морской черт | 14,5 г |
| Мидии | 11,9 г |
| Осьминог | 15 г |
| Устрицы | 9 г |
| Лосось | 20 г |
| Икра лосося | 21 г |
| Сардина | 25 г |
| Акула | 21 г |
| Кальмар | 16 г |
| Рыба-меч | 17 г |
Овощи
Овощи, как правило, содержат мало белка, и они не являются полноценным его источником.Тем не менее, их аминокислоты (содержание белка) по-прежнему увеличивают количество, потребляемое с пищей.
| Продукты питания | Содержание белка (на 100 г) |
| Артишок | 3,3 г |
| Руккола | 2,6 г |
| Спаржа | 2,2 г |
| Болгарский перец | 1,0 г |
| Зелень свеклы | 2,2 г |
| Бок Чой | 1.5 г |
| Брокколи | 2,8 г |
| Брюссельская капуста | 3,4 г |
| Мускатная тыква | 0,9 г |
| Капуста (зеленая) | 1,3 г |
| Капуста (красная) | 1,4 г |
| Морковь | 0,9 г |
| Цветная капуста | 2,0 г |
| Сельдерей | 0,7 г |
| Зеленый лук | 3.3 г |
| Зеленая капуста | 2,5 г |
| Зелень одуванчика | 2,7 г |
| Баклажан | 1,0 г |
| Эндив | 1,3 г |
| Чеснок | 6,4 г |
| Лук зеленый | 1,8 г |
| Jicama | 0,7 г |
| Кале | 3,3 г |
| Кольраби | 1.7 г |
| Лук-порей | 1,5 г |
| Салат | 1,4 г |
| Грибы | 2,5 г |
| Горчица зелень | 2,7 г |
| Окра | 2,0 г |
| Репчатый лук | 1,1 г |
| Пастернак | 1,2 г |
| Картофель | 2,0 г |
| Тыква | 1.0 г |
| Пурпурный сладкий картофель | 1,3 г |
| Radicchio | 1,4 г |
| Редис | 0,7 г |
| Брюква (Швеция) | 1,2 г |
| Морские водоросли | 3,0 г |
| Лук-шалот | 2,5 г |
| Спагетти с кабачком | 0,6 г |
| Шпинат | 2,9 г |
| Сладкий картофель | 1.6 г |
| Швейцарский мангольд | 1,8 г |
| Tomatillo | 1,0 г |
| Помидоры | 0,9 г |
| Репа | 0,9 г |
| Кресс-салат | 2,3 г |
| Водяной каштан | 1,4 г |
| Кабачки | 1,2 г |
Последние мысли
Почти каждая пища содержит диетический белок, но некоторые варианты предлагают намного больше, чем другие.Кроме того, уровни биодоступности различаются между животными и растительными источниками белка.
В целом, молочные продукты, мясо, морепродукты и бобовые / бобовые продукты, как правило, являются самыми высокими источниками белка. Однако другие продукты также могут внести свой вклад.
Сосредоточение внимания на выборе белков с более высоким содержанием в этом списке может помочь любому, кто хочет увеличить свое потребление
Для получения дополнительной информации о важности белка см. Это руководство по потенциальным последствиям недостаточного потребления белка.
Влияние снижения содержания белка в кормах для бройлеров
В исследовании, опубликованном в октябрьском выпуске Poultry Science , приняли участие исследователи Ян ван Харн и Маринус Ван Кримпен, компания Wageningen Livestock Исследования, вместе с Альбертом Дийкслагом из ForFarmers.
Авторы обнаружили, что снижение ЦП снижает содержание азота и влаги в подстилке, а также частоту и тяжесть повреждений подушечек стопы.
«Снижение ХП в рационе кажется многообещающим подходом для уменьшения выделения азота из птичников и уменьшения количества растительного белка в рационах бройлеров, одновременно улучшая благополучие бройлеров», — прокомментировали они .
Цели
Уменьшение содержания белка в рационе домашней птицы имеет несколько потенциальных преимуществ для белковой самообеспеченности ЕС, загрязнения окружающей среды, здоровья и благополучия бройлеров, при условии, что показатели роста и убойный выход не будут снижены, заявили в команде. .
Целью их исследования было оценить эффекты снижения содержания ЦП в рационе на 1, 2 или 3% у гровера (11–28 дней) и фазы откорма (28–35 дней) с частичной заменой соевого шрота на свободные АК, включая глицин, на показатели роста, убойные урожаи, качество подстилки и поражение ступней бройлеров.
Методология
Группа провела исследование на 884 самцах бройлеров Ross 308, содержащихся в 68 напольных загонах (0,75 м2) в возрасте от 0 до 35 дней.
Экспериментальные рационы были разработаны и произведены ForFarmers.
Применялась трехфазная программа кормления. Диеты для стартера, гровера и откорма были предоставлены в возрасте от 0 до 11, от 11 до 28 и от 28 до 35 дней соответственно.
Команда сообщила, что на начальном этапе все животные получали одинаковый контрольный рацион с содержанием ЦП 216 г / кг и 11,5 г / кг перевариваемого лизина. После этого были предложены четыре экспериментальные программы кормления, различающиеся уровнями CP (контроль и с 1% (CP-1%), 2% (CP-2%) и 3% (CP-3%) более низким содержанием ХП в рационе в каждой фазе). .По их словам, в контрольных рационах содержание CP в фазах выращивания и откорма составляло 208 и 198 г / кг соответственно.
Рационы каждой фазы готовились из одной и той же партии ингредиентов. Содержание диетического соевого шрота в рационах производителей было снижено с 27,3% (контроль) до 17,3% (CP-3%), в то время как содержание соевого шрота в рационах финишера было снижено с 25,0% (контроль) до 14,6% (CP-3%). ).
Они были составлены таким образом, чтобы соответствовать или превосходить рекомендации по кажущейся усвояемой в кале АК (лизин, метионин, треонин, триптофан, изолейцин, валин и аргинин) в соответствии с рекомендациями CVB (CVB, 2012) и быть изоэнергетическими в каждом из них. фаза.
Команда заявила, что они добавили свободный глицин в рационы с низким содержанием белка к очевидному усвояемому фекалию глицину + серину в контрольном рационе, чтобы сохранить продуктивные результаты бройлеров.
Свободный глицин не был одобрен для использования в качестве кормовой добавки в Нидерландах, поэтому исследователи сообщили, что им пришлось запросить разрешение от Отдела ветеринарных лекарственных средств для проведения исследования.
Результаты
Ни одна из программ кормления с низким КП не повлияла на прибавку массы тела (BWG), потребление корма или смертность с 0 по 35 день, как выяснили исследователи.
Однако, по их словам, конверсия CP улучшилась с уменьшением содержания CP в рационе. Бройлеры, получавшие программу кормления CP-2% или CP-3%, имели улучшенный коэффициент конверсии корма (FCR).
Бройлеры, получавшие программы кормления с низким содержанием протеина, имели лучшее качество подстилки и меньшее количество повреждений подушечек лап по сравнению с бройлерами, получавшими контрольную программу кормления, а бройлеры, получавшие программу кормления CP-3%, имели более низкий выход грудного мяса, чем бройлеры, получавшие контрольную пищу. программа кормления.
Убойные надои бройлеров, получавших программу кормления CP-1% или CP-2%, не отличались от контрольной программы кормления, сказали они.
Качество помета
«Возможно, снижение показателей роста бройлеров, получавших контрольный рацион, можно объяснить ухудшением качества помета (Greene et al., 1985; Martland, 1985)», прокомментировали авторы.
Ухудшение качества подстилки в контрольной группе могло также привести к некоторому тепловому дискомфорту для птиц, что также могло отрицательно повлиять на результаты их роста, особенно на FCR (De Jong et al., 2014), — отметили эксперты по питанию птицы.
«Другой причиной ухудшения КК у птиц, получавших контрольную пищу, могло быть плохое состояние кишечника. Хорошо известно, что диета с высоким содержанием белка может отрицательно влиять на здоровье и работоспособность кишечника (Qaisrani et al., 2015; Apajalahti and Vienola, 2016).
«Белок, который не был переварен до конца тонкой кишки, потенциально может ферментироваться гнилостными бактериями в слепой кишке. В результате гниения образуется множество вредных и токсичных соединений, таких как амины, индолы, фенолы, крезол и аммиак, которые в высоких концентрациях могут оказывать неблагоприятное воздействие на рост и продуктивность цыплят (Apajalahti and Vienola, 2016) », — написали они .
Уменьшение количества белка, попадающего в тонкий кишечник, за счет снижения содержания ХП в рационе может снизить выработку токсичных метаболитов ферментации белка в слепой кишке, добавили исследователи.
Более того, включение свободного глицина в диеты с низким содержанием CP в исследовании, в соответствии с которыми учитываются рекомендации по глицину и серину (CVB, 2018) животного, может быть причиной аналогичных (CP-1% и CP- Они сообщили, что результаты роста в группах с низким содержанием белка достигаются при 3% программе кормления) или даже лучше (программа кормления CP-2%).
Дополнительный глицин может быть необходим для поддержания максимальной продуктивности цыплят-бройлеров, когда их кормят рационами, основанными на растительных ингредиентах и с низким содержанием белка, согласно Ospina-Rojas et al. (2013).
Уменьшение поражений подушечек стопы
Частота поражений подушечек стопы в настоящем исследовании линейно снижалась с уменьшением содержания ХП в рационе, заключила команда.
«Хорошо известно, что наиболее важным фактором, вызывающим поражение подушечек стопы, считается мокрый подстилка (Shepherd and Fairchild, 2010).В настоящем исследовании наблюдаемые различия в качестве помета хорошо согласуются с определенными оценками подушечек лап. Бройлеры, получавшие контрольную программу кормления, имели самые низкие оценки по качеству подстилки и самые высокие оценки по подушечкам лап ».
Доля соевого шрота уменьшалась с уменьшением содержания белка в рационах. По их словам, в результате содержание калия и электролитный баланс (dEB) также снизились с увеличением содержания белка в рационе.
«Хорошо известно, что потребление воды увеличивается с увеличением как dEB, так и калия (Mushtaq et al., 2013) и что это наиболее вероятная причина ухудшения качества подстилки и более высокого балла по ступням у бройлеров, получавших контрольный рацион. Помимо калия, соевый шрот содержит также другие компоненты, которые могут быть ответственны за более высокое выведение воды, такие как клетчатка с высокой водоудерживающей способностью и ферментируемые сахара (Francesch and Brufau, 2004) ».
Снижение диетической ХП привело к снижению влажности подстилки и содержания азота, отметили ученые.
«Эти результаты согласуются с выводами Ferguson et al. (1998a), Kamran et al. (2010) и Belloir et al. (2017), но не полностью соответствуют данным Moran et al. (1992). , Elwinger и Svensson (1996), Ferguson et al. (1998b), Khajali and Moghaddam (2006) и Ospina-Rojas et al. (2012), которые также сообщили об уменьшении содержания азота, но без изменения содержания влаги. помета «.
Источник: Poultry Science Volume 98, Issue 10, October 2019
DOI: https: // doi.org / 10.3382 / ps / pez229
Название: Влияние низкобелковых рационов с добавлением свободных аминокислот на показатели роста, убойный выход, качество подстилки и поражение подушечек ног самцов бройлеров
Авторы: J van Harn , MA Dijkslag, MM van Krimpen
Естественная вариация OsGluA2 участвует в регулировании содержания белка в зерне в рисе
Содержание глутелина в значительной степени влияет на вариацию GPC
Мы сначала исследовали GPC в основной коллекции из 402 образцов риса, включая 205 индики. Сорта и 197 japonica в двух условиях окружающей среды 36,37 .Результаты показали, что GPC сильно различается между сортами риса, от 5,33% до 14,83%, 81,5% сортов сконцентрированы в диапазоне 7,5–11,5% (рис. 1a). Более того, как и ожидалось, фактор окружающей среды оказывает значительное влияние на GPC, поскольку среднее значение GPC в 2013 году (10,56 ± 0,07%) значительно выше, чем в 2012 году (8,66 ± 0,06%) (дополнительная таблица 1).
Рис. 1
Сорта Indica показывают более высокое содержание GPC и глютелина, чем сорта japonica . a Распределение GPC среди 402 образцов в 2012 и 2013 годах, а также распределение GPC внутри подвидов indica и japonica в 2013 году. разновидностей и 60 японских разновидностей. Планки погрешностей, s.d. P -значения были рассчитаны с помощью независимых выборок t -теста. c Попарный корреляционный анализ между четырьмя общими видами содержания белка.Верхняя диагональ: коэффициенты корреляции Пирсона между каждыми двумя признаками; нижняя диагональ: графики разброса корреляций между каждыми двумя признаками. Двойные звездочки (**) обозначают уровень значимости при P <0,01
Вариация GPC была дополнительно проанализирована в подвидах indica и japonica соответственно. Результаты показали, что между двумя видами существует значительная разница в обоих двух условиях окружающей среды. GPC сорта Indica — 9.29 ± 0,09%, а в 2012 г. — 7,99 ± 0,07% в japonica . Такая же тенденция наблюдалась и в 2013 г .; GPC составляют 11,19 ± 0,08% и 9,91 ± 0,08% для indica и japonica соответственно (дополнительная таблица 1). Используя значения \ (\ bar x \) ± s.d. В качестве квантиля все образцы риса были разделены на три типа: высокий, средний и низкий. Мы заметили, что частотные распределения в двух подвидах несбалансированы по трем типам ( χ 2 = 6.474, P = 0,039). Для подвида indica он обладает более высокой долей сортов с высоким GPC; наоборот, более высокая доля образцов с низким GPC встречается у подвида japonica (дополнительная таблица 2). Таким образом, был сделан вывод, что сорта Indica показали более высокий GPC, чем japonica , что согласуется с предыдущими данными 14,15 .
Чтобы выяснить, почему GPC у подвида indica обычно выше, чем у подвида japonica , были выбраны 43 традиционных сорта indica и 60 japonica сортов из 402 образцов с аналогичной датой заголовка и высотой растений для определения субпопуляции объекта. для дальнейшего анализа четырех фракций SSP по методу Кьельдаля 28 .Статистический анализ показал, что содержание глютелина и альбумина + глобулина показывает значительную разницу между двумя подвидами, что объясняет 73,9% и 15,8% общей дисперсии GPC, в то время как не было обнаружено значительных различий по содержанию проламина в исследуемой популяции (рис. 1b, c). ). Таким образом, совершенно очевидно, что вариация содержания глютелина играет важную роль в вариации GPC между подвидами indica и japonica , что позволяет предположить, что содержание глютелина может быть непосредственно использовано в качестве цели для улучшения качества питания риса.
Идентификация двух основных QTL для вариации GPC
Чтобы понять генетические механизмы GPC у риса, была использована популяция линии замещения хромосомных сегментов (CSSL), полученная от скрещивания сорта indica Habataki и сорта japonica Sasanishiki. используется для отображения QTL (дополнительная таблица 3). В этой популяции в общей сложности было идентифицировано 18 QTL для GPC в трех условиях окружающей среды с порогом LOD ≥ 2,5. Среди них qGPC-1 и qGPC-10 были повторно идентифицированы во всех трех условиях окружающей среды, в то время как qGPC-3, qGPC-8 и qGPC-12 были обнаружены в двух условиях окружающей среды, а другие могут могут быть идентифицированы только при одном условии окружающей среды, что позволяет предположить, что они могут быть чувствительны к факторам окружающей среды (рис.2а и дополнительная таблица 4). Аллели из Хабатаки на qGPC-3, qGPC-8, qGPC-10 и qGPC-12 могут увеличивать GPC, в то время как аллель qGPC-1 снижает GPC.
Рис.2
Клонирование qGPC-10 на основе карты. a График результатов картирования QTL GPC с популяцией CSSL в трех различных средах. b Расположение qGPC-10 на 10-й хромосоме и qGPC-10 было ограничено регионом, управляемым RM5758 и RM467, с использованием популяции F 2 . c Точное отображение qGPC-10 . Слева: отображение высокого разрешения. Верно, фенотипы рекомбинантов. Прямоугольники представляют собой медианные значения и первый и третий квартили; усы представляют собой минимальное и максимальное значения. Наличие одинаковых строчных букв означает несущественную разницу между ними ( P > 0,05). P -значения были рассчитаны с помощью однофакторного дисперсионного анализа. d Четыре предсказанных ORF. e Паттерны экспрессии четырех предсказанных ORF с помощью анализа qRT-PCR.Ткани: RO, ST и FL: корень, стебель и флаговый лист на стадии колошения с выходом метелки на 1 см из оболочки листа; 15E: эндосперм при 15 DAF. Планки погрешностей, s.d., n = 3. P -значения были рассчитаны с помощью независимых выборок t -test. f Схема векторов для трансгенного анализа. HpHc, вектор комплементации; KO, вектор нокаута, целевой сайт подчеркнут, а PAM выделен красным. Удаленные последовательности показаны красными дефисами. г , ч GPC трансгенных растений в T 1 .(-) и (+) указывают на трансген-отрицательные и трансген-положительные растения. Планки погрешностей, стандартное отклонение: n = 15 дюймов HpHc (-) и HpHc (+) и n = 8 единиц KO (-) и KO (+). P -значения были рассчитаны с помощью независимых выборок t -теста. Исходные данные рис. 2a – c и 2e – h представлены в виде файла исходных данных
Разграничение
qGPC-10 на область длиной 35 кб
Поскольку qGPC-10 является стабильно унаследованным QTL с большим эффектом для GPC, map- клонирование на основе было выполнено для qGPC-10 .Согласно предварительным результатам картирования, линия CSSL SL431, несущая qGPC-10 , была выбрана в качестве родительской для скрещивания с Sasanishiki с целью создания популяции F 2 для точного картирования (дополнительный рис. 1a, b). Профили белков зерна двух родителей анализировали с помощью анализа SDS-PAGE. Денситометрический анализ показывает, что SL431 имеет более высокое накопление проглутелинов, кислотных и основных субъединиц, а также проламинов, чем в Sasanishiki (дополнительный рис. 1c).Это наблюдение было дополнительно подтверждено результатами анализа белковой фракции (дополнительный рис. 1d). Неожиданно наблюдалась резкая сегрегация GPC в популяции F 2 , содержащей 2085 растений, в диапазоне от 8,4% до 13,4% при нормальном распределении ( P = 0,113> 0,05, тест K – S), даже несмотря на генетический фон SL431 похож на Sasanishiki (дополнительный рис. 2a – c). Чтобы исключить влияние окружающей среды, всего 790 растений с экстремальными фенотипами, а именно, GPC в диапазоне от 8.От 4% до 9,5% и от 11,5% до 13,4%, соответственно, были выбраны для создания субпопуляции для точного картирования. В результате, qGPC-10 было успешно отграничено до интервала между маркерами RM5758 и RM467, генетическая дистанция составила около 3,83 сМ (рис. 2b).
Чтобы еще больше сузить интервал привязки qGPC-10 , мы выбрали индивидов F 2 с гетерозиготными генотипами на RM467 и RM5758 для создания популяции F 3 . 1085 F 3 особей с экстремальными фенотипами (GPC в диапазоне от 8.От 8% до 10% и от 10,5% до 11,4%) были выбраны для точного картирования. Всего было обнаружено 97 рекомбинантов в интервале между RM467 и RM5758 на основе их генотипов, которые были разделены на восемь типов. Множественный сравнительный анализ показал, что восемь типов можно разделить на три группы на основе их GPC (рис. 2c и дополнительная таблица 5). Этот результат четко указывает на то, что qGPC-10 совмещает с маркером YYH-1, находящимся между маркером Y1 и Y3, и физическое расстояние между ними составляло около 35 т.п.н.Интересно, что тот факт, что GPC у гетерозиготных растений значительно выше, чем у гомозигот Sasanishiki, но ниже, чем у гомозигот Habataki, указывает на то, что аллель qGPC-10 H (аллель из Habataki) является частично доминантным.
Согласно информации из проекта аннотации генома риса, в этой области присутствуют четыре предсказанных гена (рис. 2d и дополнительная таблица 6), а именно: LOC_Os10g26050 , LOC_Os10g26060 , LOC_Os10g2601774g.Мы измерили уровни экспрессии этих генов в различных органах с помощью количественной ПЦР с обратной транскрипцией (qRT-PCR) (рис. 2e). Только LOC_Os10g26060 , предположительно кодирующий предшественник глутелина, по-разному экспрессируется в эндоспермах между NIL, примерно в 1,3 раза выше в NIL- qGPC-10 H (высокий GPC), чем в NIL- qGPC-10 S (низкий GPC) ( P = 3,0 × 10 –4 , независимые образцы t -тест).Таким образом, мы пришли к выводу, что ген LOC_Os10g26060 , кодирующий предшественник глутелина типа A2 (далее обозначаемый как OsGluA2 ), отвечает за qGPC-10 .
OsGluA2 — ген-кандидат, лежащий в основе qGPC-10
Для подтверждения того, что ген OsGluA2 отвечает за qGPC-10 , были созданы две конструкции, которые трансформировали в соответствующие генотипы посредством трансформации, опосредованной agrobacterium (рис.2е). Во-первых, была создана комплементарная конструкция (HpHc), содержащая фрагмент промотора размером ~ 2 т.п.н. с полной длиной OsGluA2 из SL431 и введенная в родительский Sasanishiki. По сравнению с трансген-отрицательными растениями, трансген-положительные растения в потомстве T 1 для HpHc (+) показали значительное ( P = 2,5 × 10 -3 , независимые образцы t -тест) увеличение ГПХ (рис. 2ж). Во-вторых, была разработана одна системная конструкция CRISPR-Cas9, экспрессирующая направляющие РНК, нацеленные на второй экзон OsGluA2 , которые использовали для трансформации в SL431.Мы провели скрининг на KO- OsGluA2 с двухосновной делецией во втором экзоне, по прогнозам, продуцирующий укороченные полипептиды с 187 аминокислотами (дополнительный рис. 3b-d). Как и ожидалось, зерна, полученные из гомозиготных растений KO- OsGluA2 , показали более низкий фенотип GPC (фиг. 2h). Между тем, не было значительных различий между НИЛ и трансгенными растениями по другим агрономическим признакам и компонентам урожая (дополнительный рисунок 3а и дополнительная таблица 7). Все эти свидетельства подтверждают, что OsGluA2 отвечает за qGPC-10 .
Более высокий уровень экспрессии
OsGluA2 способствует GPC
Чтобы проиллюстрировать, как OsGluA2 регулирует GPC, с помощью qRT-PCR исследовали паттерны экспрессии OsGluA2 между NIL (NIL- H и NIL- qGPC-10 S ) (рис. 3a). OsGluA2 транскриптов были в изобилии в эндоспермах через 15-25 дней после цветения (DAF), аналогично предыдущим результатам 28 .Кроме того, значительные различия в уровне экспрессии наблюдались при 15 DAF, выше в NIL- qGPC-10 H , чем в NIL- qGPC-10 S во время развития эндосперма. Различный уровень экспрессии OsGluA2 в NIL означает, что вариации последовательности в промоторной области могут влиять на уровень экспрессии OsGluA2 и, таким образом, приводить к различным GPC.
Рис. 3
Паттерны экспрессии OsGluA2 и генов, участвующих в запасных материалах. a Характер экспрессии OsGluA2 определяли с помощью qRT-PCR. 5E, 10E, 15E, 20E и 25E: эндосперм в 5, 10, 15, 20 и 25 DAF. n = 3. b Анализы GUS в трансгенном рисе, несущем qGPC-10 S :: GUS и qGPC-10 H :: GUS в 15, 20 и 25 DAF . Масштабная линейка = 1 мм. c Активность GUS в созревающих семенах при 15, 20 и 25 DAF. Активность GUS выражается в пмоль 4MU мин -1 мкг -1 белка. n = 10. d Уровни экспрессии ключевых генов, участвующих в синтезе и хранении компонентов эндосперма в T 2 трансгенных растениях и NIL. Трансген-положительные растения OsGluA2 и NIL- qGPC-10 H показаны относительно трансген-отрицательных растений и NIL- qGPC-10 S , соответственно, установленной как 1. Ошибка bars, sd, n = 3. e Ультраструктура клеток в развивающемся эндосперме NIL и трансгенных растений в 15 DAF.Белковые тела I и II PB I и PB II, гранула крахмала SG, внеклеточное пространство ECS, клеточная стенка CW. Масштабные линейки = 2 мкм. f Количественное сравнение площади PB II в NIL и трансгенных растениях. P -значения были рассчитаны с помощью независимых выборок t -теста. Планки погрешностей, s.d., n = 3. Исходные данные рис. 3a, 3c, 3d и 3f представлены в виде файла исходных данных
. Характер экспрессии OsGluA2 был дополнительно проанализирован с использованием трансгенных растений, несущих qGPC-10 S :: GUS (промотор OsGluA2 из Sasanishiki) и qGPC-10 H :: GUS (промотор OsGluA2 из SL431) соответственно.Окрашивание GUS в эндосперме постепенно становилось темнее вместе с заполнением зерна, и активность GUS qGPC-10 H :: GUS была выше, чем у qGPC-10 S :: GUS при 15, 20 и 25 DAF соответственно, что соответствует результату, полученному с помощью qRT-PCR (рис. 3b, c).
OsGluA2 оказывает плейотропное действие на качество рисового зерна
Чтобы изучить генетическое влияние OsGluA2 на качество рисового зерна, НИЛ и трансгенные растения были исследованы на GPC, фракции SSP, а также на содержание крахмала и физико-химические свойства ( Таблица 1).Содержание GPC, а также глютелина, альбумина и проламина в NIL- qGPC-10 H значительно выше, чем в NIL- qGPC-10 S , за исключением содержания глобулинов. Аналогичные результаты наблюдались также для трансгенных потомков с комплементацией (HpHc) и нокаутом (KO- OsGluA2 ). Эти результаты ясно показывают, что OsGluA2 оказывает заметное влияние на GPC и большинство фракций SSP, с наибольшим эффектом на вариации глутелина ( P = 2.5–8,4 × 10 –4 , независимые образцы t -тест). Следовательно, считается, что изменение количества глютелина является основным фактором, влияющим на общие вариации GPC в NIL и трансгенных растениях. Кроме того, содержание крахмала и содержание амилозы (AC) были немного изменены в зависимости от генетического фона. Однако консистенция геля (ГХ) значительно изменилась. Когда GPC увеличивается, GC резко уменьшается в NIL ( P = 3,7 × 10 –4 , независимых выборок t -тест) и тесте комплементации ( P = 4.8 × 10 –3 , независимые образцы t -тест). Точно так же, когда GPC в KO (+) растениях уменьшается, GC увеличивается ( P = 7,2 × 10 –3 , независимые образцы t -тест). Тот факт, что GPC отрицательно коррелирует с GC, означает, что GPC также может влиять на поедание риса и качество приготовления.
Таблица 1 Признаки качества зерна в NIL и трансгенных растениях
Чтобы определить, связано ли изменение накопления SSP и крахмала с транскрипционными изменениями других генов, связанных с материалами для хранения зерна, мы исследовали уровни транскрипции 32 генов, включая 16 генов-признаков, участвующих в синтезе SSP, и 16 генов, связанных с метаболизмом крахмала, при 15 DAF (рис.3d). В целом, экспрессия генов, кодирующих глютелины ( GluA1, GluA2, GluB1, GluC и RAG2 ) и проламинов ( 17-кДа проламинов ), повышается в различной степени в NIL- qGPC-10 . H по сравнению с NIL- qGPC-10 S . Точно так же эти гены заметно подавляются в растениях KO- OsGluA2 . В то же время уровень транскрипции генов, связанных с метаболизмом крахмала, также в разной степени изменился.Эти результаты убедительно свидетельствуют о том, что OsGluA2 оказывает значительный ассоциированный эффект на экспрессию большой части других генов, участвующих в метаболизме материалов для хранения зерна в развивающихся зернах риса.
Кроме того, общее содержание аминокислот в зернах также измеряли как в NIL, так и в трансгенных растениях (дополнительный рис. 4). По сравнению с соответствующими уровнями в NIL- qGPC-10 S и трансген-отрицательных HpHc (-) растениях, количества аспарагиновой кислоты, треонина, глутаминовой кислоты + глутамина, изолейцина, лизина, аргинина и аминокислот пролина и общее содержание аминокислот было значительно увеличено в NIL- qGPC-10 H и трансген-положительных HpHc (+) растениях, соответственно, тогда как обратное было верно для KO- OsGluA2 .Эти результаты предполагают, что OsGluA2 усиливает GPC за счет увеличения содержания белка в зерне и общего количества аминокислот и, таким образом, улучшает качество питания.
Зерна, обогащенные GPC, имеют все больше и больше белкового тела II
Мы анатомически определили эффект OsGluA2 на образование белкового тела (PB) с помощью просвечивающего электронного микроскопа (рис. 3e). В развивающихся эндоспермах при 15 DAF на ультратонких срезах можно хорошо различить два типа PB, включая PB I, содержащий проламин, и PB II, содержащий глютелин / глобулин.В развивающихся эндоспермах NIL- qGPC-10 H и HpHc (+) размер (площади сечения) PB II был больше увеличен, тогда как для KO (+) было наоборот, по сравнению с контрольные растения (рис. 3е). Эти результаты показывают, что OsGluA2 увеличил общее количество содержания глютелина, что привело к увеличению размера и увеличению количества PB II.
Один SNP связан с уровнем транскрипции и GPC
Чтобы идентифицировать естественную вариацию OsGluA2 , мы сначала секвенировали геномную область OsGluA2 от Sasanishiki и SL431.Мы не обнаружили нуклеотидных различий между двумя сортами в кодирующих областях OsGluA2 . Вместо этого были выявлены шесть полиморфизмов в промоторной области (2 т.п.н.) и один полиморфизм в 3′-нетранслируемой области (3’НТО) (рис. 4a).
Рис.4
Анализ гаплотипов OsGluA2 . a Схема структуры гена и аллельной вариации OsGluA2 между Sasanishiki и SL431, обозначенная вертикальными линиями внизу. b Анализ гаплотипа области гена OsGluA2 из 100 сортов риса.IND indica популяция, TEJ умеренный japonica популяция, TRJ тропический japonica популяция, ARO ароматическая популяция. c Филогенетическое древо пяти гаплотипов. d Анализ содержания глютелина в репрезентативных сортах с пятью различными гаплотипами. n = 8 в типе 1, n = 7 в типе 2 и типе 3, n = 6 в типе 5 и n = 2 в типе 5. e Относительный уровень экспрессии пяти гаплотипы.Номер сорта гаплотипа типа 1, типа 2, типа 3, типа 4 и типа 5 составлял 8, 7, 7, 6 и 2 соответственно. Для анализа использовали три повтора каждого сорта. f Анализ временной экспрессии промоторной активности в протопластах риса. n = 10. Слева — конструкции с сайт-направленными мутациями в четырех SNP в промоторной области. Справа, относительные значения Люк / Рен. Планки погрешностей, s.d. Наличие одной и той же заглавной буквы означает несущественную разницу между ними ( P > 0.01). P -значения были рассчитаны с помощью однофакторного дисперсионного анализа. Исходные данные на рис. 4d – f представлены в виде файла исходных данных
Для того, чтобы проследить характер распределения OsGluA2 , мы затем секвенировали полноразмерные гены OsGluA2 100 образцов из разных стран, включая 31 образец из разных стран. japonica , 24 тропических japonica , 22 aus , 21 indica, и 2 ароматических образца (рис. 4b). Филогенетический анализ показал, что OsGluA2 разделяется на пять типов (гаплотипов) (рис.4в). Чтобы проверить влияние этих семи мутаций на экспрессию генов, мы измерили содержание транскриптов OsGluA2 в этих пяти типах в эндоспермах при 15 DAF и их соответствующее содержание глютелина в зрелых семенах. Результат показывает, что сорта, обладающие типом 1, имеют тенденцию демонстрировать значительно более низкие уровни экспрессии и более низкое содержание глютелина, чем другие типы (рис. 4d, e). Эти результаты предполагают, что четыре нуклеотидные мутации (SNP-1191, SNP-1100, InDel-229 до -230 и SNP-137) в промоторной области, по-видимому, связаны с разнообразием GPC.Кроме того, мы провели тесты временной экспрессии сайт-направленных мутантных фрагментов промотора OsGluA2 в протопластах риса, чтобы проверить эффекты четырех SNP в промоторной области. По сравнению с активностью промотора Sasanishiki, относительная активность фрагмента промотора с одной мутацией (M3, положение -1100) была значительно увеличена ( P <0,01, односторонний ANOVA), аналогично промотору SL431, тогда как M1, M2 и M4 показали относительно низкую активность, как и Сасанишики (рис.4е). Так совпало, что согласно анализу PLACE (растения cis — действующие регуляторные элементы ДНК), SNP-1100 был обнаружен как остаток в регулирующем элементе cis (BIHD1OS) 38 . Эти результаты показывают, что SNP-1100 может быть функциональным SNP (FNP), что объясняет различия в уровне экспрессии между аллелями OsGluA2 . Таким образом, этот FNP был использован для определения гаплотипов OsGluA2 как двух типов, один из которых является типом с низкой экспрессией ( OsGluA2 LET ), а все остальные — с типом высокой экспрессии ( OsGluA2 HET ).
OsGluA2 способствует расхождению индика и японской
Чтобы исследовать естественную изменчивость OsGluA2 в зародышевой плазме риса, мы дополнительно проанализировали геномные последовательности этого гена в 3005 культивируемых образцах, составляющих сорта из семи групп 37,39 . Мы заметили, что распределение двух функциональных типов OsGluA2 несбалансировано в семи группах культивируемого риса (дополнительная таблица 8, × 2 = 1025.774, P <0,0001). У сортов умеренного пояса japonica самая высокая доля OsGluA2 LET (213 из 317, 67,19%), а у сорта индика самый низкий уровень (70 из 1755, 3,99%). Кроме того, доли OsGluA2 LET в несекретной японской (74 из 131, 56,49%) и тропической японской (141 из 387, 36,43%) также намного выше, чем у Индика .Эти результаты показывают, что сорта japonica обычно имеют более высокую долю OsGluA2 LET , чем сорта indica . Более того, мы заметили, что доля OsGluA2 LET имеет тенденцию к увеличению вместе с увеличением широты, предполагая региональную дифференциацию в OsGluA2 (рис. 5a), особенно для japonica . Мы дополнительно исследовали параметры генетической дивергенции для OsGluA2 и его фланкирующих областей между подвидами indica и japonica , включая оценки гаплотипа и нуклеотида F ST , ST G по Nei. и Hudson G ST и H ST (рис.5б). Все оценки этих пяти параметров в локусе OsGluA2 намного выше, чем его фланкирующие области генома. Эти результаты предполагают, что существует генетическая дифференциация в OsGluA2 между двумя подвидами, что может способствовать расхождению indica и japonica .
Рис. 5
Географическое распространение, филогенетические отношения и генетические различия OsGluA2 . a Географическое распределение среди 3005 сортов возделываемого риса.Типы OsGluA2 LET и OsGluA2 HET обозначены зелеными и красными кружками соответственно. b Параметры генетического различия между экотипами indica и japonica для OsGluA2 и его фланкирующих геномных областей. c Анализ нуклеотидного разнообразия и отбора в OsGluA2 и фланкирующих областях (~ 80 т.п.н.). Геномные последовательности 3005 культивируемых и 27 диких образцов были приобретены в RFGB (http: // www.rmbreeding.cn/Snp3k) и OryzaGenome (http://viewer.shigen.info/oryzagenome/) соответственно. ADM смешанный, ароматический ARO, IND индика, JAP неклассифицированный japonica , TEJ умеренный japonica, TRJ тропический japonica . d Филогенетическое родство OsGluA2 , полученного из 3005 культурных и 27 образцов дикого риса. e Сеть гаплотипов OsGluA2 . Размер круга пропорционален количеству образцов для данного гаплотипа.Черные точки на линиях указывают на мутационные стадии между гаплотипами
.
OsGluA2
LET получено из дикого риса
Чтобы выявить, внес ли искусственный отбор вклад в одомашнивание OsGluA2 , геномная информация 3005 культивируемого риса и 27 образцов O. rufipogon была использована для анализа генетических данных. разнообразие этого гена и его фланкирующих участков (рис.5в и таблица 2). Значение нуклеотидного разнообразия ( π ) для этого гена намного ниже, чем его фланкирующие области как в культурных, так и в диких популяциях ( O. rufipogon ), предполагая, что низкое нуклеотидное разнообразие в локусе OsGluA2 может быть результатом естественный отбор, а не искусственный. Более того, все оценочные значения Tajima’s D для культурных и диких популяций отрицательны, что указывает на низкочастотный полиморфизм в этих регионах.Однако ни одно из этих значений не является статистически значимым, за исключением дикой популяции, что позволяет предположить, что локус OsGluA2 не избежал нейтральной эволюции во время одомашнивания.
Таблица 2 Расчетные параметры нуклеотидного разнообразия и D Tajima OsGluA2 и его фланкирующих областей
Филогенетический анализ OsGluA2 предполагает, что OsGluA2 LET происходил из LET rufipogon (рис. 5г). Кроме того, была построена сеть гаплотипов для описания эволюционных взаимоотношений и мутационных этапов с использованием всех 87 OsGluA2 гаплотипов (рис. 5e). Среди них 39 и 48 гаплотипов относятся к типам OsGluA2 LET и OsGluA2 HET соответственно. Все дикие образцы содержат тип OsGluA2 LET , и гаплотипы, представленные в основном в образцах japonica , имеют наиболее близкое родство с гаплотипами дикого риса.Эти результаты предполагают, что OsGluA2 LET произошел от O. rufipogon , а также что по меньшей мере одно мутационное событие способствовало происхождению OsGluA2 LET в образцах japonica . Тип OsGluA2 HET , который доминирует в образцах indica , является результатом мутации из OsGluA2 LET . Кроме того, мы также заметили, что 15 гаплотипов (включая 27 образцов) с типом OsGluA2 LET являются результатами обратной мутации OsGluA2 HET .
Рыба с самым высоким содержанием белка
В тунце самое высокое содержание белка по сравнению с другими видами рыб.
Кредит изображения: fcafotodigital / iStock / GettyImages
Уровень белка в рыбе высок, что делает ее хорошим источником этого макроэлемента, а также снабжает ее необходимыми минералами и полезными для сердца жирными кислотами омега-3. Однако важно ограничить потребление более крупной рыбы, такой как акула и рыба-меч, поскольку они могут содержать высокий уровень ртути.
По данным Национальной академии наук, рекомендуемая суточная норма (RDA) белка для взрослых женщин составляет 46 граммов, а RDA для взрослых мужчин — 56 граммов. Помимо рыбы, другие продукты, которые представляют собой отличные источники диетического белка, включают сыр, бобы, нежирное красное мясо, семена, птицу, дрожжевой экстракт и бобовые.
Подробнее: 7 рыбных рецептов, которые полезны для сердца
Ешьте тунец, чтобы получить белок
В тунце самое высокое содержание белка по сравнению с другими видами рыбы.По данным Министерства сельского хозяйства США, голубые и желтоперые тунцы особенно богаты белком: голубой тунец содержит 29,91 грамма белка на 100 граммов сушеной рыбы, а желтоперый — 29,15 грамма. Консервированный светлый тунец, обычно приготовленный из смеси желтоперого и полосатого тунца, также является отличным источником белка: по данным Министерства сельского хозяйства США, он содержит 29,13 грамма белка на 100 граммов.
Белок в других рыбах
Помимо тунца, другая рыба с высоким содержанием белка, от 26 до 29 граммов на 100 граммов порции, согласно USDA, включает анчоусы, лосось, палтус, окунь и тилапию.Меч-рыба и треска также содержат большое количество диетического белка, каждый из которых обеспечивает около 23 граммов на 100 граммов рыбы.
Омары и другие моллюски также являются хорошими источниками протеина, из них 26,41 грамма на 100 граммов. Креветки и крабовое мясо — это другие морские ракообразные с высоким содержанием белка. Икра рыбы, как правило, потребляется в меньших количествах, чем рыбное мясо, но при этом очень богата белком, предлагая около 29 граммов белка на 100 граммов.
Подробнее: 13 видов рыб, которых следует избегать
Помните об уровнях ртути
При выборе рыбы с высоким содержанием белка важно делать правильный выбор, чтобы снизить риск воздействия ртути.Голубой тунец обеспечивает самое высокое содержание белка в рыбе, но, в основном, его употребляют в суши, но при этом связан с высоким содержанием ртути. С другой стороны, светлый консервированный тунец, по данным Американской кардиологической ассоциации (AHA), содержит лишь немного меньше белка, чем голубой тунец, но имеет относительно низкий уровень ртути. Креветки, лосось, треска и крабы также содержат мало ртути, в то время как рыба-меч и окунь содержат большее количество ртути.
Следуйте этим рекомендациям
AHA рекомендует есть не менее двух порций рыбы в неделю, выбирая в основном рыбу с высоким содержанием омега-3 и низким содержанием ртути, такую как лосось и тунец, обе из которых также богаты белком.В качестве дополнительной пользы для здоровья жирные кислоты омега-3 в рыбе также снижают риск сердечных заболеваний.
Беременным женщинам и детям следует быть особенно осторожными, чтобы ограничить потребление рыбы рыбой с низким содержанием ртути и не должно превышать двух порций рыбы по 6 унций в неделю. Помимо рыбы, система здравоохранения клиники Майо также рекомендует есть другие продукты с высоким содержанием белка, такие как тофу, соевые бобы, грецкие орехи и льняное семя.
протеина в муке | Процессы выпечки
Содержание белка в пшеничной муке широко варьируется от 6 до 18% в зависимости от типа или класса помола пшеницы, условий выращивания и внесения удобрений, особенно азота. 2 Качество белков муки определяется уровнем и распределением отдельных белковых фракций, в основном глютена, глиадина и глютенина, которые различаются в зависимости от типа пшеницы и условий их выращивания, а также от методов обработки, в основном от помола.
Как это работает?
В сфере переработки зерна существуют официальные методы определения содержания белка в муке. Методы включают:
- Международный метод AACC 46–10 — Сырой белок.Процедура Кьельдаля
- Международный метод AACC 46–30 — Анализ азота при сжигании сырого протеина (CNA)
Процедура Кьельдаля была заменена на CNA в большинстве лабораторий, поскольку CNA обеспечивает большую точность, а также отсутствие коррозионных химикатов, необходимых для анализа Кьельдаля. Кроме того, метод CNA более эффективен при извлечении азота, что дает значения, которые постоянно превышают значения Кьельдаля. 2
Метод CNA основан на высокотемпературном сжигании в полностью автоматизированном анализаторе белка.Предполагается, что белок является основным компонентом муки, содержащим азот. Таким образом, количество азота, выделяющегося при сгорании, преобразуется в содержание белка. 3
Результаты по содержанию белка выражаются в% от общей массы образца с учетом его влажности. Последнее может варьироваться от одной муки к другой. Следующее уравнение можно использовать для преобразования любого анализа белка в любую основу влажности: 4
- A = Процент анализа (содержание белка) при требуемой влажности
- B = первоначально определенный процент анализа (содержание белка)
- C = Желаемая влажность (обычно 14% для отчетов о лабораторных результатах)
- D = первоначально проанализированный процент влажности (фактическое значение)
Метод AACCI 46–30 состоит из следующих шагов: 3
- Отвешивание образца муки или молотой пшеницы (0.От 15 до 0,20 г) и поместив его в анализатор белка CNA.
- Образец автоматически опускается в горячую печь, где он обжигается при 952 ° C (1746 ° F)
- Содержание белка в образце определяется на основании количества газообразного азота, выделяющегося при сгорании. Вышеприведенная формула применяется для преобразования этого измерения в содержание белка.
Для измерения влажности муки можно использовать различные методы. Недавно во многих лабораториях был внедрен анализ отражения в ближней инфракрасной области (NIR) благодаря простоте работы, возможности адаптации для оперативного и быстрого определения влажности, а также белка и золы.Для обеспечения точности результаты NIR должны быть правильно откалиброваны относительно результатов Кьельдаля или CNA. 5,2
Выбор метода определения содержания белка в протеиновой муке зависит от стоимости, времени и наличия оборудования и квалифицированных операторов.
Приложение
Белок в муке очень важен для пекарей и мукомолов. Вот несколько причин:
- Функциональные характеристики: Содержание белка может влиять на многие функциональные свойства муки и теста / жидкого теста, такие как водопоглощение, когезионность, вязкоупругость, прочность теста, текстура, объем буханки и размер крошки. 2,6
- Экономика: Чем выше содержание протеина, тем выше стоимость (цена) муки.
- Переработка и обращение: Тесто из муки с высоким содержанием белка физически прочнее и стабильнее, чем тесто с меньшим содержанием белка, что делает его более устойчивым к повреждениям на высокоскоростных линиях. Мука с высоким содержанием белка также требует большего количества воды и более длительного времени замеса для достижения оптимального развития и консистенции теста.
Список литературы
- Делькур, Дж.А., Хосни Р. «Структура злаков». Принципы науки и технологии зерновых, 3-е издание, AACC International, Inc.


