Вещества простые и сложные. Химические элементы » HimEge.ru
Три агрегатных состояния воды
Окружающий мир материален. Материя бывает двух видов: вещество и поле. Объект химии – вещество (в том числе и влияние на вещество различных полей – звуковых, магнитных, электромагнитных и др.)
Вещество — все, что имеет массу покоя (т.е. характеризуется наличием массы тогда, когда не движется). Так, хотя масса покоя одного электрона (масса не движущегося электрона) очень мала – около 10-27 г, но даже один электрон – это вещество.
Вещество бывает в трех агрегатных состояниях – газообразном, жидком и твердом. Есть еще одно состояние вещества – плазма (например, плазма есть в грозовой и шаровой молнии), но в школьном курсе химию плазмы почти не рассматривают.
Вещества могут быть чистыми, очень чистыми (нужными, например, для создания волоконной оптики), могут содержать заметные количества примесей, могут быть смесями.
Все вещества состоят из мельчайших частиц – атомов. Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Вещества, состоящие из атомов одного вида (из атомов одного элемента), называют простыми (например, древесный уголь, кислород, азот, серебро и др.). Вещества, которые содержат связанные между собой атомы разных элементов, называют сложными.
Если в веществе (например, в воздухе) присутствуют два или большее число простых веществ, и их атомы не связаны между собой, то его называют не сложным, а смесью простых веществ. Число простых веществ сравнительно невелико (около пятисот), а число сложных веществ огромно. К настоящему времени известны десятки миллионов разных сложных веществ.
Вещества способны вступать между собой во взаимодействие, причем возникают новые вещества. Такие превращения называют химическими. Например, простое вещество уголь взаимодействует (химики говорят – реагирует) с другим простым веществом – кислородом, в результате образуется сложное вещество – углекислый газ, в котором атомы углерода и кислорода связаны между собой. Такие превращения одних веществ в другие называют химическими. Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химические превращения – это химические реакции. Так, при нагревании сахара на воздухе сложное сладкое вещество – сахароза (из которого состоит сахар) – превращается в простое вещество – уголь и сложное вещество – воду.
Химия изучает превращения одних веществ в другие. Задача химии – выяснить, с какими именно веществами может при данных условиях взаимодействовать (реагировать) то или иное вещество, что при этом образуется. Кроме того, важно выяснить, при каких именно условиях может протекать то или иное превращение и можно получить нужное вещество.
Каждое вещество характеризуется совокупностью физических и химических свойств. Физические свойства – это свойства, которые можно охарактеризовать с помощью физических приборов. Например, с помощью термометра можно определить температуру плавления и кипения воды. Физическими методами можно охарактеризовать способность вещества проводить электрический ток, определить плотность вещества, его твердость и т.д. При физических процессах вещества остаются неизменными по составу.
Физические свойства веществ подразделяют на счислимые (те, которые можно охарактеризовать с помощью тех или иных физических приборов числом, например, указанием плотности, температур плавления и кипения, растворимости в воде и др.) и несчислимые (те, которые охарактеризовать числом нельзя или очень трудно – такие, как цвет, запах, вкус и др.).
Химические свойства вещества – это совокупность сведений о том, с какими другими веществами и при каких условиях вступает в химические взаимодействия данное вещество. Важнейшая задача химии – выявление химических свойств веществ.
В химических превращениях участвуют мельчайшие частицы веществ – атомы. При химических превращениях из одних веществ образуются другие вещества, и исходные вещества исчезают, а вместо них образуются новые вещества (продукты реакции). А атомы при всех химических превращениях сохраняются. Происходит их перегруппировка, при химических превращениях старые связи между атомами разрушаются и возникают новые связи.
Число различных веществ огромно (и у каждого из них своя совокупность физических и химических свойств). Атомов, отличающихся друг от друга по важнейшим характеристикам, в окружающем нас материальном мире сравнительно невелико – около ста. Каждому виду атомов отвечает свой химический элемент. Химический элемент – это совокупность атомов с одинаковыми или близкими характеристиками. В природе встречается около 90 различных химических элементов. К настоящему времени физики научились создавать новые, отсутствующие на Земле виды атомов. Такие атомы (и, соответственно, такие химические элементы) называют искусственными (по-английски – man-made elements). Искусственно полученных элементов к настоящему времени синтезировано более двух десятков.
Каждый элемент имеет латинское название и одно- или двух-буквенный символ. В русскоязычной химической литературе нет четких правил произношения символов химических элементов. Одни произносят так: называют элемент по-русски (символы натрия, магния и др. ), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
), другие – по латинским буквам (символы углерода, фосфора, серы), третьи – как звучит название элемента по-латыни (железо, серебро, золото, ртуть). Символ элемента водорода Н у нас принято произносить так, как эту букву произносят по-французски.
Сравнение важнейших характеристик химических элементов и простых веществ приведено в таблице ниже. Одному элементу может отвечать несколько простых веществ (явление аллотропии: углерод, кислород и др.), а может – и одно (аргон и др. инертные газы).
| Х и м и ч е с к и й э л е м е н т | П р о с т о е в е щ е с т в о |
| 1. Заряд ядра | 1. Совокупность физических свойств(цвет, запах, растворимость в воде, температуры плавления, кипения, разложения, тип кристаллической решетки и др.) 2. Совокупность химических свойств (с чем реагирует и при каких условиях) |
2. Значение электроотрицательности Значение электроотрицательности |
|
| 3. Совокупность степеней окисления | |
| 4. Для элементов, встречающихся в природе: постоянство изотопного состава,и как следствие, постоянство атомной массы |
05. Простые и сложные вещества
Модели молекул и названия веществ, входящих в состав лесного воздуха:
1 — азот, 2 — кислород, 3 — аргон, 4 — углекислый газ, 5 — вода, 6 — озон (образуется из кислорода при грозовых разрядах), 7 — терпинеол (выделяется хвойными деревьями).
Простое вещество состоит из атомов только одного вида или из молекул, построенных из атомов одного вида.
Примеры: азот, кислород, аргон, озон.
Сложное вещество состоит из молекул, построенных из атомов разных видов.
Примеры: углекислый газ, вода, терпинеол.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух — смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекл только одного вида, смесью не является.
Сравнение смесей и сложных веществ
|
Смесь |
Сложное вещество |
|
1. |
1. Свойства исходных веществ не сохраняются. |
|
2. Вещества можно разделить физическими методами. |
2. Сложное вещество нельзя разделить физическими методами. |
|
3. Количественный состав может быть произвольным. |
3. Количественный состав химического соединения всегда одинаков независимо от места нахождения и способа получения. |
Задачи
1. Представьте, что у вас в руках волшебная палочка и вы превращаете: а) камень в песок; б) кислород в озон; в) лед в пар. В каком случае вы проводите химические превращения?
2. Найдите простые вещества среди перечисленных веществ: воздух, вода, озон, мед, морская вода, кислород, азот.
3. Из перечисленных веществ два являются смесями. Найдите их: а) кислород, б) озон, в) вода в реке, г) вода в облаке, д) поваренная соль, е) воздух, ж) сахар.
Итоговая работа по химии. 8-й класс
Инструкция для учителя
Проверка ответов обучающихся на задания части
выполняется учителем или с помощью
компьютера.
Верное выполнение каждого задания части 1
(1-15) оценивается 1 баллом.
Каждое верно выполненное задание 16–19
максимально оценивается 2 баллами.
Задания 16–17 считаются выполненными верно, если
в каждом из них правильно выбраны два варианта
ответа. За неполный ответ – правильно назван 1 из
2-х ответов, выставляется 1 балл. Остальные
варианты ответов считаются неверными и
оцениваются 0 баллов.
Задания 18–19 считаются выполненными верно, если
правильно установлены 4 соответствия. Частично
верным считается ответ, в котором установлены 2
или 3 соответствия из 4-х; он оценивается 1 баллом.
Остальные варианты считаются неверным ответом и
оцениваются 0 баллов.
Проверка заданий части 2 (20, 21)
осуществляется экспертной комиссией. При
оценивании каждого из 2-х заданий эксперт на
основе сравнения ответа обучающегося с образцом
ответа, приведенным в критериях оценивания,
выявляет в ответе обучающегося элементы,
каждый из которых оценивается 1 баллом.
Максимальная оценка за верно выполненное
задание 20 составляет 4 балла, а за задание 21 — 3
балла.
Задания с развернутым ответом могут быть
выполнены обучающимися разными способами.
Поэтому приведенные в критериях оценивания
образцы решений следует рассматривать лишь как
один из возможных вариантов ответа. Это
относится, прежде всего, к способам решения
расчетных задач.
Полученные обучающимися баллы за выполнение
всех заданий суммируются. В аудитории во время
итоговой работы у каждого обучающегося должны
быть следующие материалы и оборудование:
— Периодическая система химических элементов
Д.И. Менделеева;
— таблица растворимости солей, кислот и
оснований в воде;
— электрохимический ряд напряжений металлов;
— непрограммируемый калькулятор.
Итоговая оценка обучающегося определяется по
5-балльной шкале.
- от 1 до 10 баллов – отметка “2”,
- от 11 до 17 баллов – отметка “3”,
- от 18 до 25 баллов – отметка “4”,
- от 26 до 30 баллов – отметка “5”
При разработке КИМОВ использована литература:
1. Готовимся к ГИА. Химия. 8 класс. Итоговое
Готовимся к ГИА. Химия. 8 класс. Итоговое
тестирование в формате экзамена./ авт. Сост. Д.Ю.
Добротин. – Ярославль: Академия развития, 2010. – 64
с.: ил. – (Экзамен в новой форме) ISBN 978-5-7797-1398-6
Вариант 1
Часть 1
К каждому из заданий 1–15 даны 4 варианта
ответа, из которых только один правильный. Номер
этого ответа обведите кружком.
1. К простым веществам относится
1) сахар
2) мел
3) вода
4) железо
2. Число электронов на внешнем электронном слое
атома алюминия равно
1) 1
2) 3
3) 5
4) 7
3. Тип химической связи в молекуле азота
1) ионная
2) ковалентная полярная
3) ковалентная неполярная
4) металлическая
4. Соединение, в котором степень
окисления серы равна +6
1) H2SO4
2) SO2
3) H2S
4) H2SO3
5. Кристаллическая решетка натрия
1) ионная
2) металлическая
3) молекулярная
4) атомная
6. Химическое явление
Химическое явление
1) испарение воды
2) растворение соли в воде
3) возгонка йода
4) горение древесины
7. Масса 0,7 моль железа равна
1) 37,2г
2) 38,8г
3) 39,2г
4) 42,4г
8. Кислород применяется
1) в авиации
2) в металлургии
3) в медицине
4) во всех перечисленных областях
9. Водород не реагирует с
1) хлором
2) аммиаком
3) азотом
4) кислородом
10. Формула оксида цинка
1) ZnO
2) Zn2O
3) ZnO2
4) Zn2O3
11. В реакцию с серной кислотой вступает
1) серебро
2) медь
3) азотная кислота
4) оксид меди (II)
12. Карбонат натрия реагирует с
1) оксидом магния
2) соляной кислотой
3) оксидом натрия
4) медью
13. Верны ли суждения о правилах техники
безопасности?
А. Запрещается переливать излишки взятого
вещества обратно в склянку.
Б. В химической лаборатории разрешается
принимать пищу.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14. На изображённом рисунке получают
1) водород
2) аммиак
3) кислород
4) хлор
15. Массовая доля серы в сульфате калия
равна
1) 9,7%
2) 17,2%
3) 18,4%
4) 24,9%
При выполнении заданий 16–17 из
предложенного перечня ответов выберите два
правильных и обведите их номера. Цифры выбранных
ответов запишите в указанном месте без
дополнительных символов.
16. В ряду химических элементов Li —> Na —>
K
1) уменьшается электроотрицательность;
2) возрастает число электронов во внешнем
электронном слое атомов;
3) уменьшается число протонов в ядре атома;
4) усиливаются металлические свойства
соответствующих им простых веществ;
5) уменьшаются радиусы атомов.
17. Для водорода верны следующие
утверждения:
1) вступает в реакцию с кислородом при обычных
условиях
2) атомы водорода в молекуле образованы
ковалентной неполярной связью
3) самый легкий газ
4) в состав молекулы входит один атом водорода
5) хорошо растворим в воде
При выполнении заданий 18–19 к каждому
элементу первого столбца подберите
соответствующий элемент из второго столбца.
Выбранные цифры запишите под соответствующими
буквами таблицы. Цифры в ответе могут
повторяться.
18. Установите соответствие между
уравнением химической реакции и её типом.
| УРАВНЕНИЕ РЕАКЦИИ | ТИП РЕАКЦИИ | |
| А) 2HCl + MgO = MgCl2 + H2O
Б) CaO + H2O В) 2HCl + 2Na = 2NaCl + H2 Г) 2H2O = 2H2 + O2 |
1) соединения
2) разложения 3) замещения 4) обмена |
| Ответ: | А | Б | В | Г |
19. Установите соответствие между
Установите соответствие между
формулой и названием вещества.
| ФОРМУЛА | НАЗВАНИЕ | |
| А) H2O
Б) Вa(OH)2 В) HCl Г) СаСО3 |
1) соляная кислота
2) карбонат кальция 3) оксид водорода 4) оксид бария 5) гидроксид бария |
| Ответ: | А | Б | В | Г |
Часть 2
Для ответов на задания 20, 21 используйте
отдельный лист. Запишите сначала номер задания
Запишите сначала номер задания
(20, 21), а затем развёрнутый ответ к нему.
20. Напишите 3 уравнения реакций,
соответствующие схеме превращений:
Ca —> СаО —> Ca(OН)2 —> CаSO4
Определите окислитель и восстановитель в
первой реакции.
21. Какой объём водорода (н.у.) выделится
при взаимодействии натрия с 24,5 г 20% -ного раствора
серной кислоты?
Вариант 2
Часть 1
К каждому из заданий 1–15 даны 4 варианта
ответа, из которых только один правильный. Номер
этого ответа обведите кружком.
1. К сложным веществам относится
1)мел
2) водород
3) серебро
4) железо
2. Распределение электронов по
электронным слоям в атоме алюминия
соответствует ряд чисел
1) 2, 8, 1
2) 2, 5
3) 2, 8, 3
4) 2, 3
3. Соединение с ионным типом химической
связи
1) SO2
2) NaCI
3) CI2
4) NH3
4. Определите степень окисления азота в
Определите степень окисления азота в
нитрате калия KNO3
1) -7
2) +7
3) +5
4) -5
5. Ионную кристаллическую решетку имеет
1) лёд
2) графит
3) хлороводород
4) хлорид цинка
6. Физическое явление
1) горение спички
2) плавление металла
3) появление ржавчины
4) брожение сока
7. Количество вещества 72 г магния равно
1) 6 моль
2) 3 моль
3) 4 моль
4) 5 моль
8. Кислород выделяется в ходе
1) дыхания
2) гниения
3) горения
4) фотосинтеза
9. Водород не реагирует с
1) хлоридом натрия
2) кальцием
3) оксидом меди (II)
4) азотом
10. Какая формула соответствует оксиду
алюминия
1) AIO
2) AI2O3
3) AIO2
4) AI2O
11. В реакцию с соляной кислотой вступает
1) медь
2) хлорид магния
3) магний
4) оксид серы (IV)
12. Хлорид калия реагирует с
Хлорид калия реагирует с
1) нитритом серебра
2) серебром
3) водородом
4) гидроксидом калия
13. Верны ли суждения о правилах техники
безопасности?
А. Чтобы погасить пламя спиртовки, следует
накрыть его специальным колпачком.
Б. В лаборатории запрещается использовать
склянки с неподписанными реактивами.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
14. Для получения мыльных пузырей
применяют газ
1) водород
2) углекислый газ
3) кислород
4) аммиак
15. Массовая доля азота в нитрате кальция
равна
1) 17,1%
2) 27,2%
3) 36,8%
4) 54,9%
При выполнении заданий 16–17 из
предложенного перечня ответов выберите два
правильных и обведите их номера. Цифры выбранных
ответов запишите в указанном месте без
дополнительных символов.
16. В ряду химических элементов С —> N —>
О
1) уменьшается электроотрицательность;
2) возрастает число электронов во внешнем
электронном слое атомов;
3) уменьшается число протонов в ядре атома;
4) усиливаются неметаллические свойства
соответствующих им простых веществ;
5) увеличиваются радиусы атомов.
17. Для кислорода верны следующие
утверждения:
1) окисляет щелочные металлы при обычных
условиях
2) атомы кислорода в молекуле образованы
ковалентной полярной связью
3) является жидкостью (н.у.)
4) в состав молекулы входит один атом кислорода
5) плохо растворим в воде
При выполнении заданий 18–19 к каждому
элементу первого столбца подберите
соответствующий элемент из второго столбца.
Выбранные цифры запишите под соответствующими
буквами таблицы. Цифры в ответе могут
повторяться.
18. Установите соответствие между
уравнением химической реакции и её типом.
| УРАВНЕНИЕ РЕАКЦИИ | ТИП РЕАКЦИИ | |
| А) 2HCl + Mg = MgCl2 + H2
Б) ВaO + H2O В) 2HCl + СаО = СaCl2 + H2О Г) 2KNO3 = 2KNO2 + O2 |
1) соединения
2) разложения 3) замещения 4) обмена |
| Ответ: | А | Б | В | Г |
19. Установите соответствие между
Установите соответствие между
формулой и названием вещества.
| ФОРМУЛА | НАЗВАНИЕ | |
| А) H2
Б) Вa(OH)2 В) HNO3 Г) ВаСО3 |
1) гидроксид бария
2) азотная кислота 3) оксид водорода 4) карбонат бария 5) водород |
| Ответ: | А | Б | В | Г |
Часть 2
Для ответов на задания 20, 21 используйте
отдельный лист. Запишите сначала номер задания
(20, 21), а затем развёрнутый ответ к нему.
20. Напишите 3 уравнения реакций,
соответствующие схеме превращений:
Вa —> ВаО —> Вa(OН)2 —> ВаSO4
Определите окислитель и восстановитель в
первой реакции.
21. Какой объём водорода (н.у.) выделится
при взаимодействии магния с 73 г 10% -ного раствора
соляной кислоты?
Система оценивания итоговой работы по химии
Часть 1
Верное выполнение каждого задания части 1
(1–15) оценивается 1 баллом. За выполнение
задания с выбором ответа выставляется 1 балл при
условии, что указан только один номер
правильного ответа. Если отмечены два и более
ответов, в том числе правильный, то ответ не
засчитывается.
Задание с кратким ответом считается
выполненным верно, если в заданиях 16–19 правильно
указана последовательность цифр. За полный
правильный ответ на задания 16–19 ставится 2 балла;
если допущена одна ошибка, то ответ оценивается в
1 балл. Если допущены две и более ошибки или
ответа нет, то выставляется 0 баллов.
Вариант 1
| № задания | Ответ | № задания | Ответ |
| 1 | 4 | 11 | 4 |
| 2 | 2 | 12 | 2 |
| 3 | 3 | 13 | 1 |
| 4 | 1 | 14 | 1 |
| 5 | 2 | 15 | 3 |
| 6 | 4 | 16 | 14 |
| 7 | 3 | 17 | 23 |
| 8 | 4 | 18 | 4132 |
| 9 | 2 | 19 | 3512 |
| 10 | 1 |
Часть 2
Критерии оценивания заданий с развёрнутым
ответом
20. Напишите 3 уравнения реакций,
Напишите 3 уравнения реакций,
соответствующие схеме превращений: Ca —> СаО
—> Ca(OН)2 —> CаSO4
Определите окислитель и восстановитель в
первой реакции.
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) |
|
| Написаны уравнения реакций, соответствующие схеме превращений: 1) 2Ca + O2 2) CaO + H2O = Ca(OH)2 3) Ca(OH)2 + H2SO4 = CaSO4 + 2H2O Определены окислитель и восстановитель в 4) Ca0 — восстановитель, О20 — |
|
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы |
4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции |
1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
21. Какой объём водорода (н.у.) выделится
Какой объём водорода (н.у.) выделится
при взаимодействии натрия с 24,5 г 20% -ного раствора
серной кислоты?
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) |
|
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы |
3 |
| Правильно записаны два первых элемента из названных выше |
2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) |
1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Вариант 2
| № задания | Ответ | № задания | Ответ |
| 1 | 1 | 11 | 3 |
| 2 | 3 | 12 | 1 |
| 3 | 2 | 13 | 3 |
| 4 | 3 | 14 | 1 |
| 5 | 4 | 15 | 1 |
| 6 | 2 | 16 | 24 |
| 7 | 2 | 17 | 15 |
| 8 | 4 | 18 | 3142 |
| 9 | 1 | 19 | 5124 |
| 10 | 2 |
Часть 2
Критерии оценивания заданий с развёрнутым
ответом
20. Напишите 3 уравнения реакций,
Напишите 3 уравнения реакций,
соответствующие схеме превращений:
Вa —> ВаО —> Вa(OН)2 —> Ва(NO3)2
Определите окислитель и восстановитель в
первой реакции.
| Элементы ответа (допускаются иные формулировки ответа, не искажающие его смысла) |
|
| Написаны уравнения реакций, соответствующие схеме превращений: 1) 2Ba + O2 2) BaO + H2O = Ba(OH)2 3) Ba(OH)2 + 2HNO3 = Ba(NO3)2 + 2H2O Определены окислитель и восстановитель в 4) Ba0 — восстановитель, О20 — |
|
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы |
4 |
| Правильно записаны 3 уравнения реакций | 3 |
| Правильно записаны 2 уравнения реакций | 2 |
| Правильно записано 1 уравнение реакции |
1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 4 |
21. Какой объём водорода (н.у.) выделится
Какой объём водорода (н.у.) выделится
при взаимодействии магния с 73 г 10% -ного раствора
соляной кислоты?
|
Элементы ответа |
|
| Критерии оценивания | Баллы |
| Ответ правильный и полный, включает все названные элементы |
3 |
| Правильно записаны два первых элемента из названных выше |
2 |
| Правильно записан один из названных выше элементов (1-й или 2-й) |
1 |
| Все элементы ответа записаны неверно | 0 |
| Максимальный балл | 3 |
Урок 4.
 Сложные вещества – HIMI4KA
Сложные вещества – HIMI4KA
У нас вышел новый курс, где всё объясняется ещё проще. Подробннее по ссылке
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Подавляющее большинство химических веществ — это сложные вещества. Вы уже знаете некоторые из них. Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Вода, метан, сахар, поваренная соль — сложные вещества. Сложные вещества делятся на две группы — неорганические и органические.
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Простейшим органическим веществом является природный газ метан. Но вам, наверное, знакомы и такие органические вещества, как сахар (сахароза), уксусная и лимонная кислоты, спирт, крахмал, белки, жиры, пластмассы и т. д. Органических веществ миллионы. Они содержатся во всех животных и растительных организмах (откуда и произошло их название), входят в состав пищи, топлива, лекарств, красителей, самых разнообразных материалов.
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Сложные вещества, как и простые, имеют либо молекулярное, либо немолекулярное строение. При этом вещества молекулярного строения могут существовать при обычных условиях в различных агрегатных состояниях. Например, метан — газ, вода — жидкость, сахар — твердое вещество.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
- Сложными называются вещества, состоящие из атомов разных химических элементов.

- Каждое чистое вещество имеет определенный качественный и количественный состав.
- Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено.
- Сложные вещества имеют молекулярное или немолекулярное строение.
- Все сложные вещества делятся на органические и неорганические.
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Хотите ещё проще? Мы создали новый курс, где максимум за 7 дней вы овладете химией с нуля. Подробннее по ссылке
Химический состав и потребительские свойства молока
Молоко — это продукт нормальной секреции молочной железы коровы. С физико-химических позиций молоко представляет собой сложную полидисперсную систему, в которой дисперсионной средой является вода, а дисперсной фазой — вещества, находящиеся в молекулярном, коллоидном и эмульсионном состоянии. Молочный сахар и минеральные соли образуют молекулярные и ионные растворы. Белки находятся в растворенном (альбумин и глобулин) и коллоидном (казеин) состоянии, молочный жир — в виде эмульсии.
Молочный сахар и минеральные соли образуют молекулярные и ионные растворы. Белки находятся в растворенном (альбумин и глобулин) и коллоидном (казеин) состоянии, молочный жир — в виде эмульсии.
Состав молока непостоянен и зависит от породы и возраста коровы, условий кормления и содержания, уровня продуктивности и способа доения, периода лактации и других факторов. Период лактации у коров длится 10-11 мес, в течение этого времени от коров получают доброкачественное молоко.
Химизация сельского хозяйства, лечение заболеваний крупного рогатого скота, загрязнение окружающей среды предприятиями и транспортом привели к увеличению содержания в молоке посторонних веществ.
Компоненты молока делят на истинные и посторонние, а истинные — на основные и второстепенные исходя из их содержания в молоке (рис. 5.1).
Такие основные компоненты, как молочный жир, лактоза, казенны, лактоальбунин, лактоглобулин, являются соединениями, которые синтезируются в молочной железе и встречаются только в молоке.
При производстве, оценке состава и качества молока принято выделять содержание жировой фазы и молочной плазмы (все остальные компоненты, кроме жира).
С технологической и экономической точек зрения молоко можно разделить на воду и сухое вещество, в которое входит молочный жир и сухой обезжиренный молочный остаток (СОМО) (рис. 5.2).
Наибольшие колебания в химическом составе молока происходят за счет изменения воды и жира, содержание лактозы, минеральных веществ и белков постоянно. Поэтому по содержанию СОМО можно судить о натуральности молока.
Белки молока. За последние годы сформировалось устойчивое мнение, что белки являются самой ценной составной частью молока. Белки молока — это высокомолекулярные соединения, состоящие из ос-аминокислот, связанных между собой характерной для белков пептидной связью.
Белки молока делят на две основные группы — казенны и сывороточные белки.
Казеин относится к сложным белкам и находится в молоке в виде мицелл. Эти мицеллы формируются при участии ионов кальция, фосфора и др. Казеиновые мицеллы имеют округлую форму и величина их зависит от содержания ионов кальция. С уменьшением содержания в молоке кальция эти молекулы распадаются на более простые казеиновые комплексы.
Эти мицеллы формируются при участии ионов кальция, фосфора и др. Казеиновые мицеллы имеют округлую форму и величина их зависит от содержания ионов кальция. С уменьшением содержания в молоке кальция эти молекулы распадаются на более простые казеиновые комплексы.
По современным представлениям рассматривают as-, В-, х-казеины коровьего молока.
аs-казеин — основная часть казеинов молока (60%), состоит из трех фракций: asl as2 as3.
В-казеины являются фосфопротеинами, более чувствительны, чем аз-казеин, к температуре при осаждении ионами кальция.
х-казеин является единственным углеводсодержащим казеином.
Казеин в сухом виде — белый порошок, без вкуса и запаха. В молоке казеин находится в коллоидном растворе в виде растворимой кальциевой соли. Под действием кислот, кислых солей и ферментов казеин свертывается (коагулирует) и выпадает в осадок. Эти свойства позволяют выделять общий казеин из молока. После удаления казеина в молоке остаются сывороточные белки (0,6%).
После удаления казеина в молоке остаются сывороточные белки (0,6%).
Основные сывороточные белки — альбумин и глобулин. Альбумин относится к простым белкам, хорошо растворим в воде. Под действием сычужного фермента и кислот альбумин не свертывается, а при нагревании до 70 °С выпадает в осадок.
Самая большая часть в альбуминовой фракции приходится на (3-ла-ктоальбумин, а а-лактоальбумин — самый термостабильный сывороточный белок. Альбумин содержит ценную незаменимую аминокислоту триптофан (до 7%), которую не содержат ни один белок.
Глобулин присутствует в молоке в растворенном состоянии. Он также относится к простым белкам, свертывается при нагревании в слабокислой среде до температуры 72 °С. Альбумин и глобулин относятся к белкам плазмы крови. Глобулин является носителем иммунных тел. Количество сывороточных белков увеличивается в молозиве до 15%.
Из других белков наибольшее значение имеет белок жировых шариков, который относится к сложным белкам. Оболочки жировых шариков состоят из соединений фосфолипидов и белков (липопротеиды) и представляют собой лецитино-белковый комплекс.
Оболочки жировых шариков состоят из соединений фосфолипидов и белков (липопротеиды) и представляют собой лецитино-белковый комплекс.
Сывороточные белки все шире используют в качестве добавок при производстве молочных и других продуктов. Сывороточные белки с точки зрения физиологии питания более полноценные, чем казеин, так как содержат больше незаменимых кислот и серы. Степень усвоения белков молока — 96-98%.
Молочный жир в чистом виде представляет собой сложный эфир трехатомного спирта глицерина, предельных и непредельных жирных кислот. Молочный жир состоит из триглицеридов насыщенных и ненасыщенных кислот, свободных жирных кислот и неомыляемых веществ (витаминов, фосфатидов).
Молочный жир находится в молоке в виде жирных шариков размером 0,5—10 мкм, окруженных лецитино-белковой оболочкой. Оболочка жирового шарика имеет сложную структуру и химический состав, обладает поверхностной активностью и стабилизирует эмульсию жировых шариков.
В молочном жире преобладает олеиновая и пальмитиновая кислоты. Молочный жир в отличие от других жиров содержит повышенное (около 8%) количество низкомолекулярных (летучих) жирных кислот (масляной, капроновой, каприловой, каприновой).
Молочный жир в отличие от других жиров содержит повышенное (около 8%) количество низкомолекулярных (летучих) жирных кислот (масляной, капроновой, каприловой, каприновой).
Для характеристики жирно-кислотного состава молочного жира используют важнейшие химические числа: омыления, йодное, Рейхерта-Мейсля, Поленске. Молочный жир способен подвергаться фазовым изменениям. Он может находиться в отвердевшем (кристаллическом) и расплавленном состоянии, температура застывания — 18-23 °С, температура плавления 27-34 9С. Плотность молочного жира при температуре 20 °С составляет 0,930-0,938 г/см3.
В зависимости от температурных условий среды глицериды молочного жира могут образовывать кристаллические формы, отличающиеся построением кристаллической решетки, формой кристаллов, температурой плавления.
Молочный жир малоустойчив к воздействию высоких температур, световых лучей, водяных паров, кислорода воздуха, растворов щелочей и кислот. Под влиянием этих факторов он гидролизуется, осаливается, окисляется и прогоркает.
Кроме нейтральных жиров в молоке содержатся жироподобные вещества: фосфатиды (фосфолипиды) и стерины. Основные фосфа-тиды — лецитин и кефалин, а стерины — холестерин и эргостерин. Энергетическая ценность молочного жира составляет 37,7 кДж, усвояемость — 95%.
Молочный сахар (лактоза) по современной номенклатуре углеводов относится к классу олигосахаридов (дисахарид). Из общего содержания сухих веществ на лактозу приходится около 40% и 26% калорийности молока.
Лактоза играет важную роль в физиологии развития, так как является практически единственным углеводом, получаемым новорожденными млекопитающими с пищей. Химическая формула лактозы Этот дисахарид расщепляется ферментом лактазой, является источником энергии и регулирует кальциевый обмен.
В желудке человека фермент лактазу обнаруживают уже на третьем месяце развития плода, и содержания ее достаточно на протяжении всей жизни, если молоко постоянно входит в рацион питания.
Лактоза существует в двух изомерных формах, которые обладают разными физическими свойствами.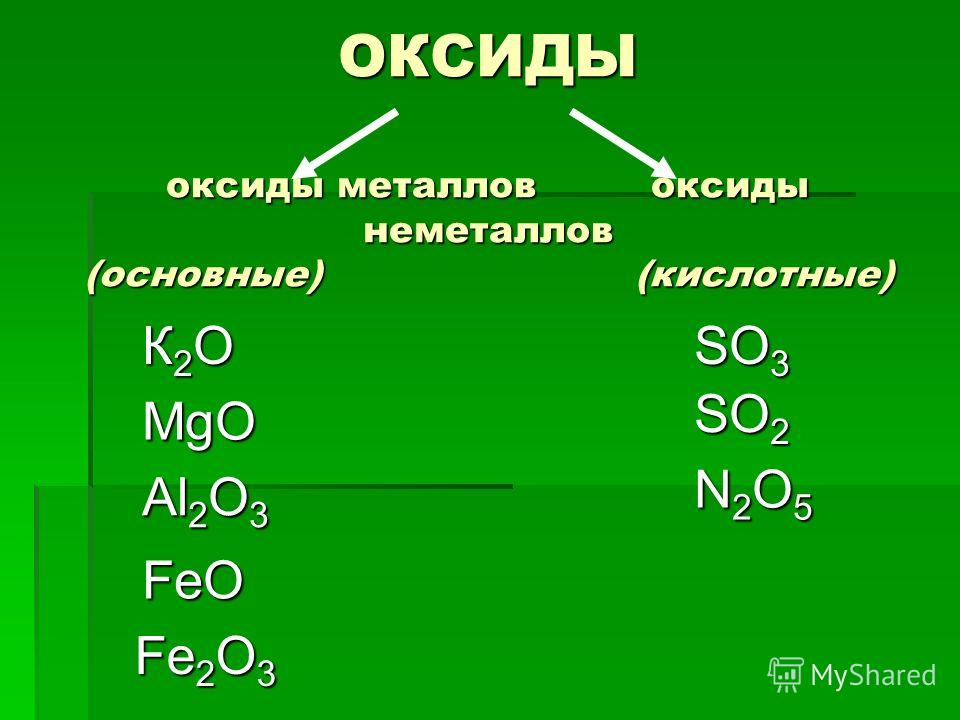 Это а- и В-формы лактозы, каждая из которых может быть гидратной и ангидридной (безводной).
Это а- и В-формы лактозы, каждая из которых может быть гидратной и ангидридной (безводной).
Взаимный переход лактозы может происходить по следующей схеме:
Взаимный переход а- и В-форм лактозы зависит от температуры и концентрации раствора.
Лактоза по сравнению с сахарозой менее сладкая и хуже растворяется в воде. Если принять сладость сахарозы за 100 ед., то сладость фруктозы будет 125 ед., глюкозы — 72 ед., лактозы — 38 ед. При температуре 20 °С растворимость лактозы 16,1%, при 50 °С — 30,4%, при 100 °С — 61,2%, в то время как растворимость сахарозы при этих температурах составляет 67,1; 74,2 и 83%. Лактоза является главным источником энергии для молочнокислых бактерий, которые сбраживают ее на глюкозу и галактозу и далее до молочной кислоты. Под влиянием молочных дрожжей конечные продукты распада лактозы — главным образом спирт и углекислый газ.
Особенность лактозы — медленное всасывание (усвоение) стенками желудка и кишечника. Достигая толстого кишечника она стимулирует жизнедеятельность бактерий, продуцирующих молочную кислоту, которая подавляет развитие гнилостной микрофлоры.
В молоке преобладает а-форма лактозы, которая придает молоку сладковатый привкус, легко усваивается организмом, но не проявляет выраженных бифидогенных свойств (не является регулятором микробиологических процессов).
Кроме лактозы в молоке содержатся в небольших количествах другие сахара — это прежде всего аминосахара, которые связаны с белками и действуют как стимуляторы роста микроорганизмов.
Усвояемость молочного сахара составляет 99%. Энергетическая ценность лактозы 15,7 кДж.
Минеральные вещества (соли молока). Под понятием минеральные вещества подразумеваются ионы металлов, а также неорганические и органические кислоты молока. В молоке содержится 0,7-0,8% минеральных веществ. Большую часть составляют средние и кислые соли фосфорной кислоты. Из солей органических кислот присутствуют главным образом соли казеиновой и лимонной кислот.
Минеральные вещества содержатся во всех тканях организма, участвуют в формировании костей, поддерживают осмотическое давление крови, являются составной частью ферментов, гормонов.
Соли молока и микроэлементы наряду с другими основными компонентами обусловливают высокую пищевую и биологическую ценность молока. Недостаток или избыток солей влечет за собой нарушение коллоидной системы белков, в результате чего они выпадают в осадок. Это свойство молока используется для коагуляции белка в производстве кисломолочных продуктов и сыров.
В зависимости от концентрации в молоке ионы делятся на микро- и макроэлементы.
Содержание макроэлементов в молоке зависит от породы коров, стадии лактации, средние их значения приведены в табл. 5.1.
Наряду с макроэлементами в молоке присутствуют в виде ионов и микроэлементы (мг/1000 см3). Микроэлементы являются жизненно необходимыми веществами. Они входят в состав многих ферментов, активизируют или ингибируют их действие, могут быть катализаторами химических превращений веществ, вызывающих различные пороки. Поэтому концентрация микроэлементов не должна превышать допустимых значений.
Высокую потребность организм человека испытывает в таких микроэлементах, как Fe, Си, Со, Zn, J. Растущий детский организм особенно нуждается в таких минеральных веществах, как кальций, фосфор, железо, магний.
Растущий детский организм особенно нуждается в таких минеральных веществах, как кальций, фосфор, железо, магний.
Витамины. Витамины относятся к низкомолекулярным органическим соединениям, не синтезирующимся в организме человека. Они поступают в организм с пищей, не обладают энергетическими и пластическими свойствами, проявляют биологическое действие в малых дозах.
По Международной химической номенклатуре витамины делят на растворимые в воде, растворимые в жирах и витаминоподобные вещества.
В молоке содержатся все жизненно необходимые витамины, некоторые в недостаточных количествах. Содержание витаминов зависит от сезона года, породы животных, качества кормов, условий хранения и обработки молока.
Усредненный витаминный состав молока приведен в табл. 5.2.
Жирорастворимые витамины устойчивы к нагреванию и начинают разрушаться при температуре свыше 120 °С (витамин А), но не устойчивы к действию воздуха, ультрафиолетовых лучей, кислот. Витамин А придает желтый цвет сливочному маслу. Витамин Е является антиокислителем жиров и защищает витамин А от окислительного разрушения.
Витамин Е является антиокислителем жиров и защищает витамин А от окислительного разрушения.
Водорастворимые витамины, за исключением витаминов С и В12, устойчивы к нагреванию. Они хуже выдерживают нагревание в щелочной среде. Витамин РР практически полностью сохраняется после тепловой обработки и хранения молока. Наиболее разрушается при пастеризации и хранении витамин С.
Ферменты катализируют многие биохимические процессы, протекающие в молоке, и при производстве молочных продуктов. Они образуются из молочной железы животного (нативные ферменты) или выделяются микроорганизмами. Важную роль играют такие ферменты молока, как лактаза, фосфатаза, редуктаза, пероксидаза, липаза, протеаза, амилаза.
Лактаза (галактозидаза) расщепляет молочный сахар на глюкозу и галактозу, выделяется микроорганизмами.
Фосфатаза (фосфомоноэстераза) бывает животного (нативного) и микробиологического происхождения. По наличию фосфатазы судят о пастеризации молока.
Редуктаза образуется за счет развития посторонних микроорганизмов. Редуктазная проба свидетельствует о классе чистоты молока по бактериальной обсемененности.
Пероксидаза — фермент животного происхождения, разрушается при кратковременном нагревании до 75-80 °С. По наличию в молоке фермента пероксидазы судят от эффективности пастеризации молока.
Липаза (гидролаза эфиров глицерина) может быть нативного и микробиологического происхождения. Ее присутствие в молочных продуктах с повышенным содержанием жира нежелательно, так как она расщепляет молочный жир на глицерин и жирные кислоты, что приводит к появлению прогорклого вкуса. Разрушается липаза при температурах 80-85 °С.
Таким образом, ферменты молока играют положительную или отрицательную роль, их активность зависит от температуры, величины рН, концентрации сухих веществ молока, количества самого фермента и др.
Иммунные тела {антитела), гормоны обладают бактерицидными свойствами. Они образуются в организме животного, на непродолжительное время подавляют развитие микроорганизмов. Время, в течение которого проявляются бактерицидные свойства молока, называется бактерицидной фазой. Продолжительность ее зависит от температуры молока и составляет при 30 °С 3 ч, при 5 °С — более суток.
Красящие вещества (пигменты) имеют двоякую природу (животного и растительного происхождения). Пигменты растительного происхождения попадают в молоко из кормов (каротин, хлорофилл). Наличие в молоке пигмента рибофлавина придает желтый цвет молоку и зеленовато-желтый — сыворотке.
Газы содержатся в молоке в небольшом количестве (50-80 см3 в 1000 см3), в том числе 50-70% углекислоты, 10% кислорода и 30% азота. При тепловой обработке часть газов улетучивается.
Вода — основная составная часть молока. Количество воды определяет физическое состояние продукта, физико-химические и биохимические процессы. От активности воды, ее энергии связи зависит интенсивность биохимических и микробиологических процессов, а также сохраняемость молочных продуктов.
Вещество — Электронный учебник K-tree
Вещество — это одна из форм материи состоящая из частиц имеющих собственную массу. Такими частицами могут
быть, например, атомы или молекулы.
Чистые вещества состоят из одинаковых молекул, например: кислород или оксид железа. Чистые вещества получают в
лаборатории, а в жизни приходится иметь дело со смесями из которых можно выделить чистые вещества.
Смеси, как и всё в природе, могут быть гомогенными (греч. гомос — одинаковый) или гетерогенными (греч. гетерос — разный).
Гомогенные смеси непрерывны, то есть в такой смеси присутствуют только указанные молекулы, например, заваренный чай с
растворённым сахаром — гомогенная смесь, а сухой чай перемешанный с сахаром — это гетерогенная смесь, здесь
между молекулами веществ (сахар и чай) присутствует раздел фаз — воздух.
Простые и сложные вещества
Простые вещества
состоят из атома одного элемента, а сложные вещества — из двух и более. Например O2 — кислород —
простое вещество, а вода, H2O — сложное.
Химия — наука о веществах
Химия — это наука о веществах и их свойствах. Любое тело состоит из вещества: гвоздь из железа, порох из серы
и т.д. Также тело может состоять из нескольких веществ, например, компьютер состоит из железа, золота, меди и других
веществ.
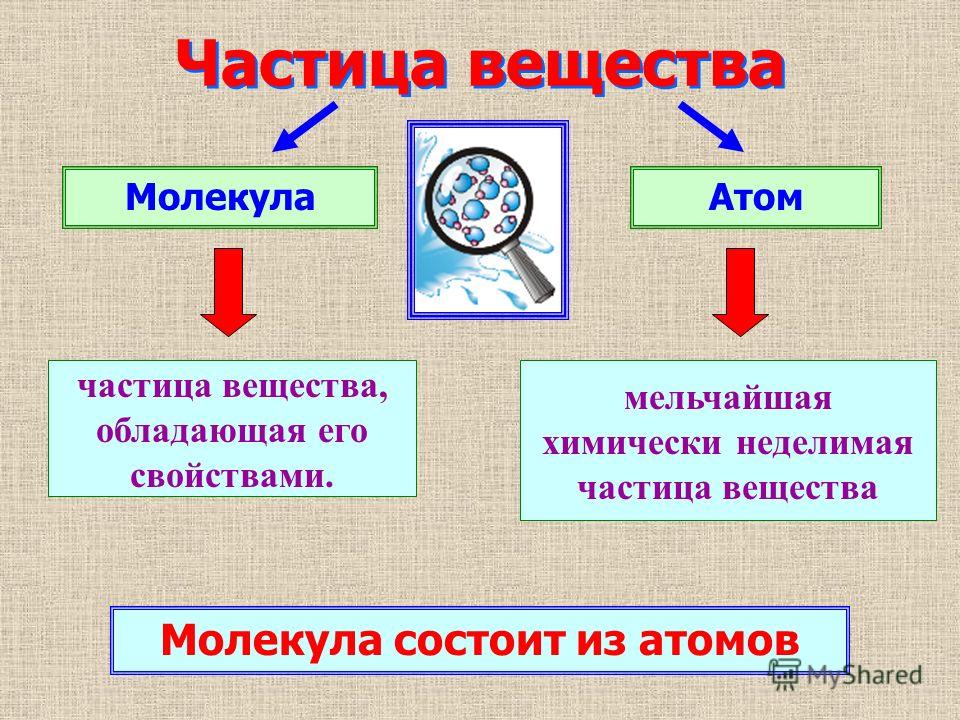
Молекула
Молекула — это наименьшая частица вещества обладающая всеми его химическими свойствами. Молекулы состоят
из атомов — более мелких элементов, молекула может состоять из одного и более атомов.
Предположения о наличии атомов возникли ещё у древнегреческих философов, но самую близкую к реальности модель
предложил только в 1911 году Резерфорд. Такая модель была названа «Планетарная модель», в центре атома
распологалось ядро, вокруг которого вращались электроны. Всё бы ничего, но если представить, что заряд электрона
позволяет ему (электрону) вращаться вокруг атома, то со временем этот заряд должен истощаться (выделение энергии)
и все электроны должны «упасть» на ядро.
Планетарная модель Бора
Чтобы объяснить этот эффект, Нильс Бор в 1913 году ввёл допущение, что электрон движется только по стационарной
орбите и выделяет энергию только тогда, когда переходит с одной орбиты на другую. Такое предположение
позволило получить радиусы орбит электронов и количество энергии, которой обладает электрон на каждой орбите.
Строение атома
Атом состоит из ядра и электронов, при этом ядро заряжено положительно, а электроны (e—) — отрицательно.
Так, атом не имеет заряда, поскольку положительный заряд ядра компенсируется отрицательным зарядом
электронов. Впоследствии учёные обнаружили, что существуют различные элементы, имеющие одинаковое количество
электронов, но разную массу — это натолкнуло на мысль, что ядро тоже из чего-то состоит.
Ядро состоит из протонов и нейтронов, протоны имеют положительный заряд, а нейтроны нулевой. Так, например,
Хлор (Cl — 17й элемент периодической системы элементов) содержит 17 протонов и 17 электронов. Для каждого
химического элемента число протонов фиксировано, а количество нейтронов может варьироваться, элементы
с одинаковым количеством протонов и разным количеством нейтронов называются изотопами.
Электронное облако
Вообще, положение электрона пока зафиксировать не удалось, поэтому говорят о вероятности нахождения электрона в
некой области, такую область называют электронным облаком. Математически, электронное облако описывается
сложными дифференциальными уравнениями и для нас пока не имеет особого смысла.
Образно выражаясь, электрон может находиться и в метре и в километре от своего ядра, но вероятнее всего он будет
находиться в некоем пространстве около ядра, как выглядет электронное облако и как распределяются электроны вокруг
ядра читайте в следующей статье «Электронная конфигруация атома».
Тест:
что происходит в растении в процессе фотосинтеза, что выделяется в световую и темновую фазу фотосинтеза
Что такое фотосинтез
Фотосинтез — процесс, при котором в клетках, содержащих хлорофилл, под действием энергии света образуются органические вещества из неорганических. При фотосинтезе растение поглощает углекислый газ и воду, синтезирует органические вещества и выделяет кислород, как побочный продукт фотосинтеза.
Процессы фотосинтеза идут в тканях, содержащих хлоропласты, — преимущественно, в листе, на который приходится большая часть процессов фотосинтеза. Такая ткань называется хлоренхима, или мезофилл.
Строение хлоропластов
Чтобы понять, что происходит в растении при фотосинтезе, изучим подробнее хлоропласты. Хлоропласты — это особые пластиды растительных клеток, в которых происходит фотосинтез. Основные элементы структурной организации хлоропластов высших растений представлены на рис.1.
Рис.1. Строение хлоропласта высших растений.
Хлоропласт — это двумембранный органоид. Внешняя мембрана проницаема для большинства органических и неорганических соединений. Она содержит специальные транспортные белки, благодаря которым нужные для работы хлоропласта пептиды и другие вещества попадают в него из цитоплазмы. Внутренняя мембрана обладает избирательной проницаемостью и способна контролировать, какие именно вещества попадут во внутреннее пространство хлоропласта.
Для хлоропластов характерна сложная система внутренних мембран, позволяющая пространственно организовать фотосинтетический аппарат, упорядочить и разделить реакции фотосинтеза, несовместимые между собой, и их продукты. Мембраны образуют тилакоиды, которые, в свою очередь, собираются в «стопки» — граны. Пространство внутри тилакоидов называется внутритилакоидным пространством, или люменом.
Внутреннее пространство хлоропласта между гранами заполняет строма — гидрофильный слабоструктурированный матрикс. В строме содержатся необходимые для реакций синтеза сахаров ферменты, а также рибосомы, кольцевая молекула ДНК, крахмальные зёрна.
Пигменты хлоропластов
Что происходит во время фотосинтеза? На молекулярном уровне фотосинтез обеспечивают особые вещества — пигменты, благодаря которым энергия солнечного света становится доступной для биологических систем. У фотосинтезирующих организмов можно выделить три основные группы пигментов:
- хлорофилл а — у большинства фотосинтезирующих организмов,
- хлорофилл b — у высших растений и зелёных водорослей,
- хлорофилл c — у бурых водорослей,
- хлорофилл d — у некоторых красных водорослей.
- каротины — у всех фотосинтезирующих организмов, кроме прокариот;
- ксантофиллы — у всех фотосинтезирующих организмов, кроме прокариот
- Фикобилины — красные и синие пигменты красных водорослей.
В хлоропластах пигменты ассоциированы с белками с помощью ионных, водородных и других типов связей. Не стоит забывать, что у растений есть множество других пигментов, находящихся не в хлоропластах и не принимающих участие в фотосинтезе — например, антоцианы.
Хлорофилл
Хлорофиллы выполняют функции поглощения, преобразования и транспорта энергии света. Лучше всего хлорофиллы поглощают свет в синей (430—460 нм) и красной (650—700 нм) областях спектра. Зелёную область спектра хлорофиллы эффективно отражают, что придаёт растению зелёный цвет.
Интересно, что строение молекулы хлорофилла схоже со строением гемоглобина, но центром молекулы хлорофилла является ион магния, а не железа.
Основными хлорофиллами высших растений являются хлорофилл a и хлорофилл b, они входят в состав реакционных центров фотосистем и светособирающих комплексов мембран тилакоидов хлоропластов. Светособирающие комплексы улавливают кванты света и передают энергию к фотосистемам I и II. Фотосистемы — это пигмент-белковые комплексы, играющие ключевую роль в световой фазе фотосинтеза.
Каротиноиды
Каротиноиды — это жёлтые, оранжевые или красные пигменты. В зелёных листьях каротиноиды обычно незаметны из-за наличия в листьях хлорофилла. При разрушении хлорофилла осенью именно каротиноиды придают листьям характерную жёлто-оранжевую окраску.
Функции каротиноидов:
- Антенная — входят в состав светособирающих комплексов, улавливают энергию света и передают её на хлорофиллы. Каротиноиды играют роль дополнительных светособирающих пигментов в той части солнечного спектра (450—570 нм), где хлорофиллы малоэффективны. Особенно это важно для водных экосистем, в которых волны оптимальной для хлорофиллов длины быстро исчезают с глубиной.
- Защитная функция (антиоксидантная) — обезвреживание агрессивных кислородных соединений (активных форм кислорода) и избытка хлорофилла в возбуждённом состоянии при слишком ярком освещении.
Каротиноиды химически представляют собой 40-углеродную цепь с двумя углеродными кольцами по краям цепи. В строении ксантофиллов, в отличие от каротинов, присутствуют спиртовые, эфирные или альдегидные группы.
Учите биологию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду
BIO72020 вы получите бесплатный доступ к курсу биологии 7 класса, в котором изучается тема фотосинтеза.
Что происходит в процессе фотосинтеза
Как уже было сказано ранее, в ходе фотосинтеза в хлоропластах под действием солнечного света образуются органические вещества.
Процесс фотосинтеза можно разделить на две фазы:
1. Световая.
2. Темновая.
В ходе световой фазы фотосинтеза образуется энергия в виде АТФ и универсальный донор атома водорода — восстановитель НАДФН (НАДФ·Н2). Эти вещества необходимы для протекания темновой фазы. Также образуется побочный продукт — кислород. Световая фаза может проходить только на мембранах тилакоидов и на свету.
Благодаря сложному биохимическому процессу — циклу Кальвина — в темновую фазу фотосинтеза образуются органические вещества (сахара). Темновая фаза проходит в строме хлоропластов и на свету, и в темноте. Темновые ферментативные процессы протекают медленнее, чем световые, поэтому при очень ярком освещении скорость протекания фотосинтеза будет полностью определяться скоростью темновой фазы. Схемы процессов фотосинтеза представлены на рис.2. Подробное описание процессов смотри далее.
Рис.2. Схема процессов фотосинтеза и суммарное уравнение фотосинтеза.
Световая фаза фотосинтеза
Чтобы лучше понять, что происходит во время фотосинтеза, разберём фазы фотосинтеза. Световая фаза фотосинтеза включает в себя фотохимические и фотофизические процессы, и может быть поделена на три этапа:
- Фаза поглощения — энергия света улавливается при помощи светособирающих комплексов, переходит в энергию электронного возбуждения пигментов, передаётся в реакционный центр фотосистем I и II.
- Фаза реакционных центров — энергия электронного возбуждения пигментов светособирающих комплексов используется для активации реакционных центров фотосистем. В реакционном центре электрон от возбуждённого хлорофилла передаётся другим компонентам электрон-транспортной цепи, пигмент после отдачи электрона переходит в окисленное состояние и становится способным, в свою очередь, отнимать электроны у других веществ. Именно в этом процессе происходит преобразование физической формы энергии в химическую.
- Фаза электрон-транспортной цепи — электроны переносятся по цепи переносчиков, образуются АТФ, НАДФН, O2. Необходимо, чтобы каждый переносчик электрон-транспортной цепи поочерёдно восстанавливался и окислялся, обеспечивая таким образом перенос энергии электронов. Любой этап переноса электрона сопровождается высвобождением или поглощением энергии. Часть энергии теряется. На некоторых участках электрон-транспортной цепи перенос электрона сопряжён с переносом протона.
Для того чтобы понять, что происходит во время фазы фотосинтеза, рассмотрим эти процессы подробнее. Кванты света улавливаются светособирающими комплексами фотосистемы I — молекула хлорофилла в составе светособирающего комплекса переходит в возбуждённое состояние, и энергия передаётся в реакционный центр фотосистемы I. Происходит возбуждение молекул хлорофилла фотосистемы I, отщепляется электрон. Пройдя по цепочке внутренних компонентов фотосистемы I и внешних переносчиков, электрон в конце концов попадает к НАДФ+ — образуется восстановитель НАДФН. Получается, что хлорофилл фотосистемы I отдал электрон и приобрёл положительный заряд, и для дальнейшего функционирования необходимо восстановить нейтральность молекулы, получить электрон, чтобы закрыть «дырку». Этот электрон приходит от фотосистемы II.
На светособирающие комплексы фотосистемы II попадают кванты света — происходит возбуждение молекулы хлорофилла фотосистемы II, молекула хлорофилла отдаёт электрон и переходит в окисленное состояние. Нехватку электрона хлорофилл восполняет благодаря фотолизу воды, при этом образуется протоны H+, а также важный побочный продукт фотосинтеза — кислород. По цепи переносчиков электрон от хлорофилла фотосистемы II попадает к хлорофиллу реакционного центра фотосистемы I и восстанавливает его. Теперь этот хлорофилл может снова поглощать энергию кванта света и отдавать электрон в электрон-транспортную цепь.
Протоны, попадающие во внутритилакоидное пространство, используются для синтеза АТФ. С помощью фермента АТФ-синтазы за счёт градиента протонов образуется АТФ из АДФ и фосфата. Под градиентом понимают неравномерное распределение: во внутритилакоидном пространстве H+ больше, в строме — меньше. Поэтому частицы стремятся проникнуть в строму, переходят в неё через АТФ-синтазу, а в процессе пути сквозь белковый комплекс отдают ему часть энергии, которая и используется для синтеза АТФ.
Темновая фаза фотосинтеза
Что образуется при фотосинтезе в темновую фазу? В строме хлоропластов с помощью энергии АТФ и восстановителя НАДФН, полученных в световую фазу, образуются простые сахара, из которых в ходе других процессов образуется крахмал. Ферментативные процессы не нуждаются в наличии света. Важнейший процесс, происходящий в темновую фазу фотосинтеза, — фиксация углекислого газа воздуха. Синтез и превращения сахаров в хлоропластах имеют циклический характер и носят название цикл Кальвина.
В нём можно выделить три этапа:
- Фаза карбоксилирования (введение CO2 в цикл).
- Фаза восстановления (используются АТФ и НАДФН, полученные в световую фазу).
- Фаза регенерации (превращения сахаров).
В строме хлоропластов находится производное простого пятиуглеродного сахара рибозы. С помощью особого фермента (Рубиско) к производному рибозы присоединяется CO2 (реакция карбоксилирования) — образуется неустойчивое шестиуглеродное соединение, которое быстро распадается на две трехуглеродные молекулы. Дальше, с затратой АТФ и НАДФН, полученных в ходе световых процессов, трехуглеродное соединение модифицируется — образуется восстановленное соединение с атомом фосфора и альдегидной группой в составе. Теперь перед клеткой стоит проблема: необходимо получить шестиуглеродное соединение — глюкозу для синтеза крахмала, а также пятиуглеродное — производное рибозы для того, чтобы эти процессы могли начаться заново. Для решения этих проблем в фазу регенерации из полученных ранее трехуглеродных соединений под действием ферментов образуются четырёх-, пяти-, шести- и семиуглеродные сахара. Из шестиуглеродной молекулы образуется глюкоза, из которой синтезируется крахмал. Из пятиуглеродной молекулы образуется производное рибозы и цикл замыкается. Остальные сахара также используются клеткой в других биохимических процессах.
Отдельно стоит сказать про крайне важный фермент первой фазы цикла Кальвина — рибулозо-1,5-дифосфаткарбоксилазу (Рубиско). Это сложный фермент, состоящий из 16 субъединиц, с молекулярной массой в 8 раз больше, чем у гемоглобина. Является одним из важнейших ферментов в природе, поскольку играет центральную роль в основном механизме поступления неорганического углерода (из CO2) в биологический круговорот. Содержание Рубиско в листьях растений очень велико, он считается самым распространённым ферментом на Земле.
Рис.3. Суммарные уравнения и частные реакции фотосинтеза.
Значение фотосинтеза
В процессе фотосинтеза энергия света заключается в энергию химических связей органических веществ. Поэтому фотосинтез служит первичным источником почти всей энергии, используемой живыми организмами в процессе жизнедеятельности. Практически все живые организмы, за исключением хемосинтетиков, так или иначе пользуются теми продуктами, что выделяются при фотосинтезе.
За счёт фотосинтеза сформировалась и поддерживается пригодная для дыхания атмосфера с высоким содержанием кислорода.
Фиксация углекислого газа в ходе фотосинтеза служит главным местом входа неорганического углерода в биогеохимический цикл. Также ассимиляция CO2 препятствует перегреву Земли, предотвращая парниковый эффект.
Заключение
Каждый год на нашей планете благодаря фотосинтезу производится около 200 миллиардов тонн кислорода, из которого образуется озоновый слой, защищающий от ультрафиолетовой радиации. Фотосинтез помогает поддерживать состав атмосферы и препятствует увеличению количества углекислого газа. Без растений и кислорода, который они выделяют в процессе фотосинтеза, жизнь на нашей планете была бы просто невозможна.
Простых углеводов — маленькие сахара
Углеводы могут немного сбивать с толку. Иногда люди называют сложные углеводы «хорошими», а простые — «плохими». Но нельзя сказать, что все простые углеводы вредны. Некоторые хороши. Чтобы понять почему, полезно узнать о биохимии простых углеводов.
Что такое простые углеводы?
Что касается химической структуры, простые углеводы представляют собой небольшие молекулы, состоящие из моносахарида или двух моносахаридов, связанных вместе.Все, что больше, называется сложным углеводом.
Хорошо, а что такое моносахарид? Это просто модное слово для обозначения одного сахара. Глюкоза — это моносахарид, и это хороший сахар, потому что это тот сахар, который ваше тело и мозг используют в качестве топлива каждый день. Другие моносахариды включают фруктозу, которая содержится во фруктах и овощах, и галактозу, которая содержится в молоке. Все это не вредно для вас.
Отдельные сахара могут быть объединены с образованием дисахаридов , термин, означающий «два сахара».«Эти сахара включают:
- Лактоза (молочный сахар) состоит из молекул глюкозы и галактозы. Люди с непереносимостью лактозы не могут правильно переваривать этот сахар.
- Сахароза (столовый сахар) состоит из молекул глюкозы и фруктозы. Это белое порошкообразное или гранулированное вещество, которое мы обычно называем «сахаром», когда готовим или запекаем.
- Мальтоза (солодовый сахар) образуется при соложении злаков, таких как ячмень.
Простые углеводы довольно легко усваиваются вашим телом.Немногое происходит во рту или желудке — большинство простых углеводов перевариваются в тонком кишечнике. Ферменты расщепляют простые сахара на отдельные компоненты, которые могут проникать через стенки кишечника и попадать в кровоток.
Любой сахар, который ваше тело не использует в качестве топлива, превращается в жир и откладывается в жировой ткани.
Обозначение простых углеводов на этикетках
Простые углеводы часто используются в обработанных пищевых продуктах. Часто это продукты с высоким содержанием калорий, но не очень питательные, поэтому простые углеводы могут быть помечены как «плохие».«Если вы очистите свой рацион, это может помочь сократить количество продуктов, содержащих следующие ингредиенты:
- Сахароза
- Коричневый сахар
- Сахар-сырец
- Кукурузный сироп с высоким содержанием фруктозы
- Кукурузный сироп
- Декстроза
- Глюкоза
- Фруктоза
- Мальтоза
- Солодовый сахар
- Сироп
- Мед
Все ли простые углеводы вредны для вас?
Простые углеводы — неплохие молекулы — они нравятся вашему организму в нужном количестве.Как и во многих других вещах, яд создает доза. Проблема в том, что продукты с высоким содержанием простых сахаров содержат много калорий, а потребление слишком большого количества сахара и калорий вредно для вас.
Фрукты и овощи от природы содержат фруктозу, но они также полезны для вас, потому что они богаты питательными веществами и содержат клетчатку, замедляющую переваривание и всасывание сахара. Фруктовые соки, не содержащие клетчатки, могут быть очень питательными, но простые углеводы усваиваются гораздо быстрее, а клетчатка не замедляет пищеварение.Вот почему лучше есть фрукты целиком, чем пить фруктовый сок.
Молоко содержит лактозу, что является проблемой для людей с непереносимостью лактозы. Люди с этим заболеванием должны избегать молока и многих других молочных продуктов или использовать дополнительные ферменты, называемые лактазой, которые помогают им переваривать молочный сахар.
Сахарохимия — понимание ингредиентов для канадского пекаря
С химической точки зрения сахар состоит из атомов углерода (C), кислорода (O) и водорода (H) и классифицируется как углевод .Есть три основные группы сахаров, классифицируемые в зависимости от того, как атомы расположены вместе в молекулярной структуре. Эти группы следующие:
- Моносахариды или простые сахара. Декстроза ( глюкоза ) является основным моносахаридом. Другие — это левулоза, или , фруктоза, (содержится в меде , и многих фруктах) и галактоза, которая является молочным сахаром. Такие сахара плохо кристаллизуются. ( Mono означает one , что означает, что сахар состоит только из одной молекулы.)
- Дисахариды или сложные сахара. Сахароза (обычный сахар) является основным примером дисахарида. Мальтоза, содержащаяся в злаках, и лактоза , содержащаяся в молоке, являются другими.
- Полисахариды . Примерами являются крахмалы, декстрины и целлюлоза.
Пекарей интересуют не полисахариды, а моносахариды и дисахариды. Последние два подслащивают, но их нельзя использовать взаимозаменяемо, поскольку они по-разному влияют на конечный продукт.Эти различия будут затронуты позже в книге.
Полезно понять некоторые условные обозначения различных сахаров. Обратите внимание, что названия сахаров часто заканчиваются на «осе»: сахароза, декстроза, мальтоза, лактоза и т. Д. Сахароза — это химическое название сахара, производимого на заводах по производству тростникового и свекловичного сахара.
Обратите внимание, что глюкоза — это химическое название определенного типа сахара. Иногда сбивает с толку то, что глюкоза естественным образом встречается в виде молекулы сахара в таких веществах, как мед, но ее также производят промышленным способом из кукурузы (кукурузы).
Правила Канады по пищевым продуктам и лекарствам (FDR) регулируют следующие определения:
- Сахара: все моносахариды и дисахариды. Используется для маркировки пищевых продуктов.
- Подслащивающий агент: Любой пищевой продукт, для которого предусмотрен стандарт в Разделе 18 Регламента по пищевым продуктам и лекарствам, или любая их комбинация. Включает сахар (сахарозу), сахарные сиропы и патоку, полученную из сахарного тростника или сахарной свеклы, декстрозу, глюкозу и сиропы, мед и лактозу. Не включает подсластители, которые считаются пищевыми добавками.
- Подслащивающий ингредиент: любой сахар, инвертный сахар , мед, декстроза, глюкоза или твердые вещества глюкозы, или любая их комбинация в сухой или жидкой форме. Предназначен для подслащивания фруктов, овощей, их продуктов и заменителей.
- Кленовый сироп: сироп, полученный концентрированием кленового сока или разбавлением или растворением кленового сока, кроме кленового сока, в питьевой воде.
- Подсластитель: Любая пищевая добавка, указанная как подсластитель. Включает как сахарные спирты, так и подсластители высокой интенсивности, такие как ацесульфам-калий, аспартам и сукралоза.
- Сахарные спирты: пищевые добавки, которые могут использоваться в качестве подсластителей. Включает изомальт, лактит, мальтит, сироп мальтита, маннит, сорбит, сироп сорбита, ксилит и эритрит.
Природа растительных веществ и обсуждение
СКЕЛЕТ ЗАВОДА
В 1952 г. А. Ф. Хилл из Гарварда
Университет выделил различные части растений, которые необходимы для
понимание их природы и использования для людей и животных.Было отмечено, что ограждение закрывает
подавляющее большинство растительных клеток и ограничивающий состав под названием Cell
Стенка . Стена придает прочность и жесткость
растение и служит своеобразным скелетом.
Эти стены всегда состоят из целлюлозы, которая встречается в одиночку.
или с другими веществами. Целлюлоза
это неживое вещество, которое растение вырабатывает из виноградного сахара. Это
химически очень сложный углевод с формулой (C 6 H 10 O 5 ) n Стенки клеток различаются по размеру и
внешний вид.У некоторых стены
сильно утолщенные, которые называются склеренхима
Ячейки. Они предназначены для
поддержать растение. Как тело растения
увеличивается в размерах, требуется больше поддержки и различные ткани склеренхимы
сформированы, которые почти полностью состоят из волокон. Волокна представляют собой длинные заостренные клетки с очень
толстые стенки и небольшие полости. Они
имеют тенденцию к переплетению и могут растягиваться и сжиматься. Некоторые волокна имеют клеточные стенки, которые
почти чистая целлюлоза, например хлопок.В других также присутствует некоторое количество лигнина, как в лубяных волокнах, содержащихся в
кора растений. Лигнин сильно увеличивает
прочность стены без уменьшения ее способности проводить воду. Когда необходимо защитное покрытие,
целлюлозные стены могут быть пропитаны произведенными гидроизоляционными материалами
такие как суберин, кутин или слизь.
В некоторых случаях неорганические материалы, такие как диоксид кремния, могут присутствовать в
клеточные стенки.
Свойства, придающие клеточные стенки
полезные для растения часто несут ответственность за экономическую ценность
люди.Одревесневшие стены из дерева
имеет множество применений, когда требуется жесткий, но легко обрабатываемый материал. Чем больше эластичных волокон — это основа
текстильной промышленности и наряду с древесиной составляют основное сырье
материал бумажной промышленности. Клетка
стены с суберином обеспечивают пробку.
Стены из почти чистой целлюлозы используются для изготовления синтетических материалов.
волокна, целлофан, взрывчатые вещества и другие промышленные товары. Поскольку целлюлоза и ее производные
горючие, в качестве топлива можно использовать все типы стенок ячеек.Уголь — это ведь стены растений, которые
процветали в каменноугольный период и постепенно утратили
их газообразные элементы. Постепенное
чередование видов топлива, которые показывают прогрессирующую потерю водорода и кислорода, может
можно отслеживать от целлюлозы до лигнина, торфа, мягких и каменных углей.
ПРОТОПЛАЗМ
Большое количество сахара, производимого во время фотосинтеза.
используется при образовании новой протоплазмы, чтобы заменить сломавшуюся
вниз и обеспечить рост растения.Протоплазма растений — очень сложное вещество, и его химическая природа
не совсем понятен, хотя общие элементы включены в его состав. он содержит простые сахара и более высоко
промышленные углеводы; жиры на разных стадиях синтеза; большой
количество белкового материала, полученного частично из виноградного сахара и частично
из нитратов, абсорбированных из почвы; соли разных неорганических элементов,
такие как фосфор, железо, магний, сера, калий и кальций; а также
витамины, ферменты и другие выделения.Когда пища готовится, она сильно меняет изначальную природу растения.
протоплазма. Все согласны
что свежая, сырая растительная пища может иметь большую пользу для здоровья из-за
наличие витаминов и других компонентов протоплазмы в здоровом
условие.
РЕЗЕРВ ЕДА
В большинстве случаев растения
гораздо больше пищи, чем можно сразу использовать для роста растений или в качестве источника
энергии.Излишки хранятся в
сильно модифицированные ячейки в разных местах в качестве резервного источника для использования
для роста и других занятий в более позднее время. Подземные стебли, корни, почки и семена являются основным хранилищем
органы растений. Три основных
виды пищевых материалов, которые производятся растениями, — это углеводы,
жиры и белки.
Углеводы
Это самые простые растения
продукты.Они состоят из углерода,
водород и кислород в соотношении двух частей водорода к одной из
кислород. Основные углеводы:
сахар, крахмал и целлюлоза.
Сахар . — Виноградный сахар,
производимые растением в процессе фотосинтеза, чаще всего присутствуют в растении
клетки. Это основной материал обмена веществ,
известная как глюкоза, имеет формулу C 6 H 12 O 6. Иногда хранится в больших
такое количество, которое содержится в стеблях кукурузы. Фруктовый сахар или фруктоза, другой продукт
фотосинтеза, имеет ту же формулу, но обладает немного другой
характеристики. Чаще всего встречается
только во фруктах.
Высшие и более сложные сахара
сформированы из этих простых сахаров.
Наиболее важным из высших сахаров является тростниковый сахар или сахароза с формулой C 12 H 22 O 11 .Накапливается в больших количествах в
сахарная свекла и сахарный тростник и, в меньшей степени, многие другие растения. Все сахара растворимы в воде и
таким образом, они легко доступны для использования растением. Они очень питательны и служат ценным кормом для
животные и люди. Мы используем эти
сахара не только в том виде, в каком они присутствуют в тканях растений, но и путем извлечения и
очищая их.
Крахмал . .— Крахмалы
нерастворимые соединения сложной природы и формулы (C 6 H 10 O 6 ) n . Их получают из виноградного сахара и
составляют первый видимый продукт фотосинтеза. Крахмал — самый распространенный вид резерва.
пища зеленых растений и имеет важнейшее значение в их метаболизме. Однако из-за его нерастворимости
крахмал должен быть переварен, то есть сделать растворимым, прежде чем его можно будет использовать.Это делается с помощью ферментов.
которые присутствуют в клетках. Крахмал
хранится в крупных тонкостенных ячейках в виде характерных зерен. Люди очень зависят от крахмала, который
представляет собой важнейшую растительную пищу и жизненно важен в промышленном мире.
также.
Целлюлоза . — Это высший вид
углевод. Помимо его присутствия в
стенки клеток, у него мало, если вообще есть, функции резервного питания, хотя
есть свидетельства того, что его используют некоторые бактерии.
Резервная целлюлоза .— Они напоминают
целлюлоза физически, но они различаются по своим химическим свойствам. К ним относятся гемицеллюлозы, пектины,
десны и слизи. Что-нибудь из этого
соединения играют двоякую роль. Они помогают
поддерживают стенки клеток и служат резервной пищей. Гемицеллюлозы могут постепенно превращаться в
пектины, а затем в десны.
Гемицеллюлоза .- Они часто встречаются как дополнительные слои
стенки клеток, особенно в семенах тропических растений, таких как финик и
пальма цвета слоновой кости. Они легко
усваиваются растениями, но лишь в незначительной степени усваиваются людьми, и поэтому не подходят
для питания человека. Однако у них есть
применение в некоторых отраслях.
Пектины .— Это фруктовые желе, встречающиеся в большинстве растений.
клетки, особенно во фруктах и овощах.Они хорошо растворяются в воде и могут использоваться в пищу обоими растениями.
и животные. Пектины также увеличивают
задержка воды в клетках. Середина
пластинка, цементирующий материал, скрепляющий стенки ячеек, состоит из
пектиновые соединения. Пектины затвердевают
после того, как они были удалены с растения, и люди воспользуются этим
при приготовлении джемов и желе.
Камеди .- расщепление целлюлозы или других углеводов
соединений является производным этих. Они состоят
органической кислоты в сочетании с неорганическими солями. Они могут секретироваться естественным путем в
тканей или может возникнуть в результате ранения. Десны помогают удерживать воду в растении, а также служат
резервная еда. Они используются в
промышленность, медицина и продукты питания.
слизи .- Они тесно связаны с деснами. При намокании водой не растворяются
но образуют слизистые массы. Они есть
секретируется в мешочки, каналы или волосы.
Они выполняют разнообразную функцию и могут служить в качестве резервной пищи, в качестве вспомогательного средства.
в контроле потери воды или слишком быстрой диффузии, как механизма для
хранение воды и как средство для облегчения рассеивания семян. Слизистость часто встречается в ассоциации
с целлюлозой в клеточных стенках. Они
успешно применяются в медицине.
Жиры
Жиры представляют собой соединения углерода,
водород и кислород похожи на углеводы, но в них намного меньше кислорода. Из-за этого их часто называют
углеводороды. Формула для
типичный жир Триолеин показывает их химическую природу: C 57 H 104 O 4 .. Жиры производятся из углеводов двумя
процессы, (1) производство жирных кислот и (2) образование
глицерин.Эти два продукта объединяются в
образуют жидкие или твердые жиры. В жидком состоянии жиры называются маслами или жирными маслами, и
бывают в виде небольших шариков.
Жиры в небольших количествах присутствуют во всей живой протоплазме, но
хранится как резервный корм в основном в семенах и плодах. Они нерастворимы и должны перевариваться.
перед использованием. У них высокая энергия
содержания и являются ценным кормом как для растений, так и для животных. Жиры играют важную роль в медицине
и промышленность.
Белки
Белки
также частично получен из углеводов путем образования амино
кислоты. Эти последние простые соединения
затем соединяются с нитратами из почвы и другими веществами с образованием
очень сложная молекула белка.
Основная характеристика белков — высокое содержание азота.Также присутствует сера, и часто
фосфор. Глиадин — типичный
белок, который встречается в пшенице и имеет формулу: C 736 H 1161 N 184 O 208 S 3 . Несмотря на то, что белки являются основным
составляющие протоплазмы, они хранятся в основном только в семенах, где они
происходят в виде твердых гранул, называемых зернами алеурона. Известно, что сотни белков встречаются в
ткани растений. Как только белки
переведены в растворимую форму, они представляют собой важную пищу для обоих
растения и животные.Они есть
особенно ценно как строители мышц и нервов, а не как источник
энергии и являются неотъемлемой частью рациона животных. Белки редко извлекаются из растений
ткани для пищевых целей, за исключением соевых бобов. У белков очень мало промышленного применения.
СЕКРЕЦИИ И ИСКЛЮЧЕНИЯ
Растения производят различные типы веществ в виде
выделения и выделения.Эти
разнообразны по химическому составу и функциям. Некоторые из них секретируются в специальные клетки или ткани для определенного
цель, в то время как другие не имеют очевидного использования и считаются побочными продуктами
метаболизма. Иногда эти
материалы, имеющие большую коммерческую ценность и включают эфирные масла, пигменты,
смолы, дубильные вещества, латекс, воски, алкалоиды, глюкозиды, органические кислоты, ферменты,
витамины и гормоны.
Эфирные масла
Эти масла часто называют эфирными маслами.
отличаются от жирных масел своей высокой ароматичностью и летучестью.Они образуются в железах или специальных
клетки. Их функция кажется
в первую очередь для привлечения насекомых, участвующих в опылении, или для отражения враждебных
насекомые и животные своим едким вкусом.
Они могут оказывать антисептическое и бактерицидное действие в
растения. Эти ароматические масла используются
в производстве парфюмерии и мыла и в других отраслях промышленности, а также
в медицине и как пищевые ароматизаторы.
Пигменты
Завод производит все красящие материалы, которые входят в его состав.
основной корпус.Это химически и
функционально разнообразны. Большинство
важен хлорофилл, особенно сложное вещество. Он содержит пигменты ксантофилл и
каротин и является одним из важнейших факторов фотосинтеза. Другие цвета имеют ценность только как средство
привлечения насекомых и других животных для опыления и распространения, в то время как
некоторые из них являются лишь побочными продуктами деятельности растений. Когда пигменты стабильны, их можно
извлекаются и используются как красители.
Танины
Горькие, вяжущие
материалы, выделяемые в коре, древесине или других частях многих растений. Их функция может заключаться в помощи в
заживление ран и предотвращение кариеса, а также может играть роль в
образование пробки и пигментов.
Они также служат защитой от естественных врагов.Танины обладают особыми свойствами, которые делают
они неоценимы в определенных отраслях.
Они могут реагировать с белками, такими как желатин в шкурах животных, чтобы
производить твердое, твердое вещество. Таким образом
они используются при дублении кожи.
Они также могут реагировать с солями железа с образованием черного.
цвет. Это делает их ценными в
красильная промышленность и производство красок. Танины находят применение в медицине благодаря их вяжущим свойствам.
характеристики.
Смолы
Это сложные материалы, которые
вероятно, получены из углеводов.
Они секретируются железами или каналами и часто встречаются в сочетании.
с эфирными маслами и камедью. Они
образуются либо естественным путем, либо в результате повреждения тканей. Смолы нерастворимы в воде и поэтому
любая поверхность, непроницаемая для влаги.Таким образом, они важны при производстве красок и
лаки. Для растения могут служить смолы.
удерживать влагу или сопротивляться гниению благодаря своему антисептическому действию. Некоторые смолы использовались в медицине.
Латекс
Растения часто выделяют молочный или
цветная жидкость, которая называется латексом.
Это смесь смол, камедей, углеводородов, пищевых продуктов и др.
вещества, образующиеся в специальных сосудах, обычно в коре или
листья.Его использование растением не
ясно, но может быть задействован в защите.
Производятся ценные промышленные товары, такие как резина и жевательная резинка.
из латекса.
Воски
Часто бывает покрытие
листья и плоды, которые выделяет растение, чтобы защитить его от
чрезмерная потеря воды. Этот воск
похож на жир по составу.Воски
были собраны и в некоторой степени использовались в торговле, например, автомобильные воски.
Алкалоиды
Это растительные основания, которые содержат азот и считаются
продукты разложения белков.
Они секретируются в специальные клетки или пробирки. Они могут обеспечить защиту от естественных врагов из-за
их горький вкус.Алкалоиды
соединения без запаха, которые оказывают выраженное физиологическое действие на животных. Таким образом, они имеют важное значение в медицине.
и являются одними из самых ценных лекарств. В их состав также входят сильнодействующие растительные яды.
и наркотики. Такие вещества, как
кофеин и теобромин, которые действительно являются тесно связанными пуриновыми основаниями, являются
часто классифицируется как алкалоиды.
Глюкозиды
Хотя похож на алкалоиды в
их свойства, глюкозиды получены из углеводов, а не
белки.Считается, что они дают
функции защиты, как они обычно происходят в коре. Однако они могут служить для регулирования
кислотность и щелочность растительных клеток.
Эти вещества были полезны в качестве лекарств.
Органические кислоты
Они широко распространены среди
растения, особенно фрукты и овощи.Они могут находиться в свободном состоянии в виде кальция, калия или натрия.
соли или в сочетании со спиртами.
Считается, что фруктовые кислоты проявляют влечение к животным и, таким образом, помогают в
распространение фруктов и семян. Они
также участвуют в метаболизме и росте.
Ферменты
Ферменты присутствуют во всех живых
организмы.Есть много разных
видов, но обычно они присутствуют в очень небольших количествах. Они действуют как катализаторы в химической
реакции. Они вызывают все
химические изменения, которые происходят в живом веществе, фактически не вступая в
сами реакции. Один из их
наиболее важными функциями являются пищеварение, процесс, посредством которого нерастворимые
материалы расщепляются на растворимые и тем самым становятся доступными
для транспортировки ко всем частям организма для конечного использования.Ферменты бывают коллоидными и белковыми в
природа. Они специфичны в своих
действия. Их беспокоит не только
с окислением и другими деструктивными фазами метаболизма, но с
конструктивные фазы также. Они
участвуют в фотосинтезе и в образовании белков и жиров и
присутствуют в каждой живой клетке растения.
Витамины
Это вещества, которые кажутся необходимыми для благополучия
как растения, так и животные.Они есть
образованы растениями, и хотя животные могут их хранить, они неспособны
производя их. Витамины присутствуют в
чрезвычайно незначительные количества и поэтому их трудно изучать. Они необходимы для нормального обмена веществ,
рост, развитие и размножение.
Похоже, что они контролируют большинство конструктивных фаз метаболизма. Витамины также незаменимы для
профилактика некоторых заболеваний человека, например цинга. Зеленые овощи, фрукты и семена — важные источники
витамины.Водоросли особенно
ценны тем, что содержат много разных видов витаминов.
Гормоны
Гормоны производятся в одной части
организма, а затем переносятся в другие части, где они могут влиять
какой-то специфический физиологический процесс.
Гормоны растений регулируют различные явления роста, такие как:
тропизмы, увеличение клеток и удлинение клеток.Они также играют роль в производстве корней и цветов.
и в формировании плодов.
Простые и сложные углеводы: диетические потребности — стенограмма видео и урока
Питательные вещества и калории
Питательные вещества — это вещества в пище, которые важны для производства энергии, восстановления и роста.
Различные питательные вещества для вашего тела подобны различным видам масла для автомобиля.Есть масло, которое помогает автомобилю нормально функционировать, известное как моторное масло. Есть сырая нефть, которая превращается в бензин, чтобы дать автомобилю энергию. Также существуют всевозможные продукты из сырой нефти, которые используются для ремонта автомобиля, если он сломался из-за чего-то вроде ржавчины.
Подобно тому, как бензин дает нашему автомобилю энергию для вождения, некоторые питательные вещества обеспечивают наше тело энергией за счет калорий. калорий , это количество тепла, необходимое для повышения температуры 1 грамма воды на 1 градус C.На обычном языке и на этикетках пищевых продуктов калория (иногда называемая большой калорийностью) эквивалентна термину килокалория или ккал, который на самом деле равен 1000 меньших калорий.
Итак, если вы видите на этикетке продуктов питания, особенно в стране за пределами США, 500 ккал на вкусное лакомство, на самом деле это эквивалент 500 калорий на американском языке.
Различные типы углеводов
Три важных питательных вещества, обеспечивающих калории, известны как , углеводы, , белки и жиры.
Углеводы являются основным источником легкодоступной энергии для организма, состоящей из единиц молекул сахара, которые иногда называют сахаридами. Да, углеводы состоят из молекул сахара. Но есть разные виды углеводов.
Некоторые из них представляют собой простые сахара, называемые моносахаридами, такие как глюкоза, фруктоза, галактоза. Это означает, что в простом сахаре всего одна единица сахара, потому что «моно», как и «монорельс», означает слово «один».
Другой тип простых углеводов известен как дисахарид, что означает наличие «ди-» или «двух» сахарных (или сахаридных) звеньев в цепи.Столовый сахар, также называемый сахарозой, является разновидностью дисахарида.
Другой тип углеводов — полисахариды, где «поли-» означает «многие». Итак, если у нас есть цепочка из примерно двадцати единиц сахара, мы имеем дело с полисахаридом. Полисахарид обычно называют сложным углеводом. Этот продукт включает крахмалы и пищевые волокна, такие как те, что содержатся в овощах, хлебе и хлопьях.
За исключением клетчатки, почти все другие типы углеводов в конечном итоге перевариваются или превращаются в нашем организме в глюкозу.Однако, поскольку простые сахара, естественно, намного меньше по размеру, они либо уже состоят из глюкозы, либо быстро расщепляются на нее. Вот почему простой сахар, содержащийся в столовом сахаре или меде, так вкусен для нашего языка. Это потому, что они являются очень готовым источником энергии, и наше тело научилось распознавать и жаждать этого. Это не похоже на сложные углеводы, содержащиеся в овсянке, которая на вкус не так хороша.
Сложные углеводы
Продукты, богатые сложными углеводами, особенно когда в них много клетчатки, более полезны для здоровья, в основном, в три раза.Во-первых, клетчатка замедляет переваривание и всасывание углеводов. Это уменьшает серьезность пиков нездорового сахара в вашем теле. Во-вторых, клетчатка заставляет вас чувствовать себя сытым, сводя к минимуму потребление слишком большого количества углеводов.
Другая причина, по которой сложные углеводы более полезны, заключается в том, что они часто содержат другие питательные вещества, такие как витамины и минералы. Простых углеводов, содержащихся в столовом сахаре, газированных напитках, пончиках и т. Д., Нет. Вот почему их называют пустыми калориями. Это потому, что они содержат мало истинных питательных веществ, кроме чистой энергии.Избыточная энергия из-за слишком большого количества углеводов откладывается в вашем теле в виде жира. Слишком много жира приводит к ожирению, которое приводит ко всему, от артрита до сердечных заболеваний.
Это похоже на машину, двигатель которой залит топливом, обеспечивающим энергию. Автомобиль получит травму и заглохнет.
Вот почему получение энергетической ценности из сложных углеводов с клетчаткой, витаминами и минералами намного лучше для вас. Вы потребляете меньшее количество калорий, но при этом чувствуете себя сытым.Вы также получаете добавленные питательные вещества без огромных скачков сахара, которые могут предрасполагать вас к диабету и вызывать чувство усталости после того, как сахарный прилив закончился. Это означает, что волокно похоже на регулятор в автомобиле, который гарантирует, что только постоянный поток бензина поступает в двигатель и не перегружает систему.
Конечно, даже сложные углеводы нужно употреблять в умеренных количествах, иначе их чрезмерное потребление так же легко приведет к накоплению жира в организме в течение более длительного периода времени.
Сколько углеводов мне тогда съесть?
Вот почему количество углеводов, которое вы действительно должны потреблять, лучше всего проконсультироваться с врачом и диетологом. Каждый человек поистине уникален, и делать общие заявления иногда неуместно. Однако, как правило, человек, который ежедневно потребляет 2000 калорий, должен удовлетворять около 45-65 процентов своей потребности в калориях за счет углеводов.
Опять же, помните, что все, от возраста и пола до уровня активности и болезненных состояний, изменяет это количество.
Употребление сложных углеводов, таких как цельнозерновые, очень важно для вашего здоровья. Исследования показали, что это снижает риск сердечных заболеваний, диабета, инсульта, высокого кровяного давления и даже некоторых видов рака.
Резюме урока
Что ж, теперь вы знаете, что углеводы, хотя технически питательные вещества, не все одинаково питательны.
Питательные вещества — это вещества в пище, которые важны для производства энергии, восстановления и роста, а углеводов являются основным источником легкодоступной энергии для организма, состоящей из единиц молекул сахара, которые иногда называют сахаридами.
Углеводы обеспечивают человека калориями. калорий — это количество тепла, необходимое для повышения температуры 1 грамма воды на 1 градус C.
Есть много разных типов углеводов. Простые сахара или простые углеводы, которые часто содержатся в продуктах, которые мы считаем полными пустых калорий, известны как моносахариды и дисахариды. Первые включают глюкозу, фруктозу и галактозу, а вторые — сахарозу или столовый сахар.
Наконец, у нас есть полисахариды или сложные углеводы, в том числе крахмалы и клетчатка.
Результаты обучения
Просмотр этого урока может помочь вам:
- Различать питательные вещества и калории
- Определить и описать различные типы углеводов, содержащихся в продуктах питания
- Обсудите пользу для здоровья сложных углеводов
- См. Общие рекомендации по суточному потреблению углеводов
Разъяснение углеводов, часть I | КПП
Лошади используют три различных типа углеводов: простые сахара и крахмалы, быстро ферментируемые углеводы и структурные углеводы.В этой части нашей серии статей речь пойдет о простых сахарах и крахмале.
Что такое углеводы и почему они важны?
Углеводы — это вещества, состоящие из элементов углерода (C), водорода (H) и кислорода (O). Различные формы углеводов образуются за счет различных физических комбинаций (молекулярной структуры) компонентов C, H и O. Самыми простыми и основными единицами углеводов являются моносахариды или отдельные сахара (например, глюкоза и фруктоза). Моносахариды — это строительные блоки, используемые для производства более сложных углеводов.Различная структура углеводов играет важную роль в том, как и где в пищеварительном тракте лошади они перерабатываются и усваиваются.
Углеводы должны быть расщеплены на глюкозу, прежде чем они могут быть использованы в качестве энергии в клетках лошади. После расщепления глюкоза циркулирует по кровотоку, снабжая клетки энергией. Избыточная глюкоза хранится в виде гликогена в мышечной ткани и печени для дальнейшего использования. Лошади способны удовлетворить примерно 30% -70% своих энергетических потребностей за счет углеводов, что делает углеводы важной частью их рациона.
Сахар простой и крахмал
Сахар — самые простые углеводы. Сахара представляют собой моносахариды или дисахариды (молекула из 2 моносахаридов). Различия в физическом расположении моносахаридов приводят к различным типам сахаров. Простые сахара, обычно содержащиеся в кормах, включают сахарозу, фруктозу и мальтозу. С другой стороны, крахмалы немного сложнее. Крахмалы — это молекулы, содержащие множество моносахаридов, называемых полисахаридами. Крахмал можно разделить на два компонента: амилозу и амилопектин.
Простые сахара и крахмалы перевариваются в передней кишке (во рту, пищеводе, желудке и тонком кишечнике). Желудочные кислоты и ферменты способствуют расщеплению сахаров и крахмалов. Образовавшаяся глюкоза всасывается в тонком кишечнике. Эта глюкоза немедленно становится доступной через кровоток в качестве источника энергии. Из-за ограниченной доступности ферментов и производства кислоты важно отметить, что передняя кишка имеет ограниченную способность переваривать сахар и крахмал. При кормлении в больших количествах избыточный сахар и крахмал попадают в заднюю кишку (слепую кишку и толстую кишку), где они могут вызвать расстройство пищеварения или ламинит.Тщательный контроль количества простых сахаров и крахмала, скармливаемых лошадям, является ключевым аспектом управления.
Где можно найти простой сахар и крахмал?
Растения производят сахар и крахмал для удовлетворения собственных потребностей в энергии. Растения накапливают излишки сахара и крахмала в семенах и других тканях растений. Зерновые, которые являются семенами растений, богаты этими типами углеводов. Овес, кукуруза и ячмень обычно используются в кормах для лошадей и содержат относительно высокие уровни крахмала и сахара.
Трава и сено также содержат эти простые углеводы, но не в такой степени, как простые зерна и зерновые концентраты. Содержание простых сахаров и крахмала в травах может варьироваться в зависимости от стадии роста и сезонных температур. Сено в тюках содержит на 4-5% меньше крахмала и сахара, чем свежая трава.
Основы углеводов | HowStuffWorks
Углеводы — это один из трех макроэлементов (два других — белок и жир), в которых нуждается наш организм, и он составляет основную часть потребляемых нами калорий.Фактически, от 45 до 60 процентов типичной американской диеты состоит из источников углеводов. В некоторых частях мира, особенно в развивающихся странах, потребление углеводов может приближаться к 80 процентам.
Растения богаты углеводами, так как это их форма хранения энергии. Когда мы едим растительную пищу, мы поглощаем эту накопленную энергию и используем ее в организме. Хотя мы можем использовать белок и жир для производства энергии, углеводы являются источником топлива, которое легче всего использовать для организма, и поэтому они предпочтительнее.Это связано в первую очередь с основной химической структурой углеводов — углеродными, водородными и кислородными единицами. Моносахариды, простые углеводы, всасываются непосредственно в кровоток. Но сложные углеводы также относительно легко разбираются организмом, создавая глюкозу, которая может быть отправлена клеткам для получения энергии. Фактически, организм начинает расщеплять углеводы во рту с помощью фермента, который содержится в слюне.
| Прерывание поста Если вы упорный шкипер завтрака, это может изменить ваше мнение.Вы знаете, что организм хранит углеводы (гликоген) в печени и мышцах, поэтому он может функционировать даже при слишком низком уровне углеводов. Но как долго ты сможешь заправиться? После 12-18 часов голодания запасы в печени истощаются. Так что, если вы обычно не находите время для завтрака, но чувствуете, что к обеду налегаетесь на дым, то это потому, что это действительно так! |
Обилие углеводов очень важно, потому что они обеспечивают стабильный и легко доступный источник энергии для организма.Фактически, это основной источник энергии для мозга и центральной нервной системы. Постоянное поступление глюкозы необходимо для нормального функционирования мозга и нервных тканей. Если вы не едите достаточно углеводов, организм будет обращаться к другим источникам, таким как жир, для удовлетворения своих энергетических потребностей. Хотя наш организм может использовать альтернативные источники (включая белок) в качестве топлива, не рекомендуется снижать потребление углеводов настолько, чтобы заставить организм перейти в это состояние. Вот почему стратегия, лежащая в основе некоторых низкоуглеводных диет — побудить организм сжигать жир в качестве топлива — может показаться хорошей идеей, но на самом деле это не так.
Жир нужен нам не только в питании, но и в нашем теле — конечно, в определенных пределах. Пищевой жир является концентрированным источником энергии (9 калорий на грамм). Он заставляет нас дольше чувствовать сытость, поскольку имеет тенденцию медленно покидать желудок, а также транспортирует и поддерживает абсорбцию жирорастворимых витаминов A, D, E и K. В организме жир является основной формой, в которой люди хранят избыточная длительная энергия. Жир не является легкодоступным источником энергии, как углеводы; скорее, он предназначен для того, чтобы поддерживать нас во времена голода, добровольного или иного.Это одна из причин, почему так трудно сбросить жир, особенно если вы слишком мало калорий. Наше тело рассматривает жир как источник защиты и не хочет легко отказываться от него. Во всем теле жир является компонентом клеточных мембран, который помогает регулировать поток материалов в клетки и из них, служит предшественником различных гормоноподобных веществ, которые регулируют многие физиологические процессы, действует как изолятор от потери тепла и защищает жизненно важные органы, такие как почки и сердце.
Силу протеина часто недооценивают. Несомненно, белок состоит из аминокислот, которые организм использует для создания новых и восстановления старых тканей и мышц. Но белок — это рабочая лошадка: он является частью каждой клетки и ткани организма (включая органы, кожу, кости и мышцы), поддерживает иммунные функции организма, помогает транспортировать питательные вещества, служит буфером для поддержания стабильного уровня pH в крови. , а также как ферменты и гормоны, регулирует процессы в организме.
Когда не хватает доступной глюкозы в результате расщепления углеводов, организм сначала обращается к запасам углеводов (гликогену).Если нового приема углеводов по-прежнему нет, а запасы истощены, организм вынужден использовать альтернативные источники (жир и белок) для получения энергии. Когда это происходит, белок отвлекается от намеченной работы, и для восстановления мышц остается не так много, поэтому мышцы могут становиться меньше и слабее.
В крайних случаях, например, когда человек сидит на диете с нулевым содержанием углеводов, организм может разрушить мышцы, чтобы преобразовать их в глюкозу. Однако ваше сердце — основная мышца тела — обычно защищено.Энергетические потребности мозга и сердца являются первоочередной задачей организма, и он прилагает все усилия, чтобы предотвратить повреждение этих и других основных органов.
Топим наши двигатели
| © 2006 Publications International, Ltd. Сложные углеводы, такие как фрукты, вызывают медленное повышение уровня сахара в крови на и сохранение на постоянном уровне . |
Даже если мы потребляем достаточное количество углеводов каждый день для удовлетворения наших энергетических потребностей, мы не едим постоянно.Тем не менее, наш организм нуждается в глюкозе постоянно, а не только во время еды или когда нам хочется перекусить. Так как же организму удается поддерживать постоянный приток глюкозы к клеткам?
Наш организм обладает удивительной способностью как использовать глюкозу, так и сохранять ее для будущих нужд. Существует тонкая система регулирования, которая строго контролирует уровень глюкозы в крови.
Регулирующая система работает следующим образом: когда вы едите пищу или прием пищи, содержащие углеводы, они всасываются из пищеварительного тракта, вызывая повышение уровня сахара (глюкозы) в крови.Инсулин, гормон, выделяемый вашей поджелудочной железой, помогает глюкозе проникать в ваши клетки, где она используется для производства энергии. Ваше тело не превращает весь сахар в крови в энергию одновременно. Инсулин работает как для очистки крови от глюкозы для использования клетками, так и для накопления излишков глюкозы в печени и мышцах. Эта форма хранения глюкозы называется гликогеном. Некоторая часть глюкозы также может превращаться в жировые отложения, если вы потребляете больше калорий, чем нужно вашему организму.
Если уровень сахара в крови падает слишком низко, другой гормон, называемый глюкагоном, запускает преобразование гликогена из печени обратно в глюкозу посредством процесса, называемого гликогенолизом (распад гликогена).Это взаимодействие между инсулином и глюкагоном в сочетании с несколькими другими физиологическими системами контроля позволяет постоянно поддерживать уровень сахара в крови в пределах нормы. Ваше тело круглосуточно нуждается в стабильном поступлении глюкозы, потому что ваши органы никогда не перестают работать. На самом деле, постоянный запас глюкозы настолько важен, что мы можем производить глюкозу альтернативным методом в периоды, когда у нас низкие запасы гликогена или недостаточное потребление углеводов. Посредством процесса, называемого глюконеогенезом, белок и, в меньшей степени, жир могут быть задействованы для доставки глюкозы в организм, хотя это гораздо более сложный, «дорогой топливный» и неэффективный процесс, а не предпочтительный метод получения глюкозы. .
Формула сахара: химическая формула сахара
Формула сахара: сахароза
Для большинства людей слово сахар относится к белому кристаллическому веществу, которое вы используете для подслащивания чая и кофе. Но когда ваш учитель химии говорит «сахар», он, скорее всего, имеет в виду
одна из широкого диапазона молекул, начиная от глюкозы, сахарозы, фруктозы или любой другой молекулы, которая заканчивается на -озу. Фактически, «сахар» — это свободный термин, используемый для обозначения широкого спектра веществ.
в классе соединений, известных как углеводы.Углеводы можно удобно разделить на два класса: простые сахара и сложные сахара. В этой статье речь пойдет о сахарах гексозы — сахарах.
с шестью атомами углерода на молекулу мономера.
Диаграмма углеводного дерева
| Класс | Сахарные мономеры гексозы | Химическая / молекулярная формула |
| Моносахариды |
|
C6h22O6 |
| Дисахариды | C12h32O11 |
Простые сахара представляют собой моносахариды (моно- означает «один») или дисахариды (ди- означает «два»).Дисахариды состоят из двух молекул моносахаридов, связанных между собой химической связью, называемой
гликозидная связь (связь, которая связывает мономеры в углеводах). Моносахариды — это основные строительные блоки углеводов.
Простой сахар — быстрый источник энергии для млекопитающих. Они намного быстрее всасываются в кровоток, чем сложные сахара, поскольку имеют гораздо более простую структуру. Встречаются простые сахара
естественно, в таких продуктах, как фрукты, овощи и молочные продукты.Обработанные или рафинированные продукты, такие как конфеты, пирожные, безалкогольные напитки, газированные напитки, сироп, желе, содержат большое количество простых сахаров.
Дополнительные сведения о формулах и химической структуре сахаров, начиная с хорошо известных простых сахаров: сахарозы, мальтозы и лактозы.
Химическая формула сахарозы — C12h32O11. Сахароза — это дисахарид, состоящий из молекулы глюкозы и фруктозы — подробности о глюкозе и фруктозе показаны ниже. Сахароза имеет 12 атомов углерода,
22 атома водорода и 11 атомов кислорода.Сахароза — это то, что обычно называют «столовым сахаром». Это сахарный песок, который мы все используем, чтобы подсластить пищу. Сахароза встречается в природе в качестве основного
сахар — это фрукты, например, ананас. Когда эксперты советуют вам держаться подальше от продуктов с высоким содержанием сахара, в том числе продуктов, богатых сахарозой, таких как мороженое, леденцы, лимонад, печенье и т. Д.
пудинг и др.
Химическая формула мальтозы также C12h32O11. Мальтоза — это дисахарид, состоящий из двух молекул глюкозы.Он имеет ту же химическую формулу, что и сахароза. Это означает, что в мальтозе также содержится 12
атомов углерода, 22 атома водорода и 11 атомов кислорода. Однако все они имеют разную химическую структуру, как показано на рисунке ниже.
Продукты, богатые мальтозой, включают картофель, хлеб, хлопья, пиццу, мед и т. Д. Солод, продукт, используемый для варки пива, наполнен мальтозой. Фактически, название «мальтоза» произошло от слова «солод».
Когда мы едим, крахмал расщепляется на молекулы мальтозы пищеварительным ферментом амилазой.Мальтоза расщепляется на молекулы глюкозы специальным пищеварительным ферментом, который называется
мальтаза.
Так же, как сахароза и мальтоза, химическая формула лактозы — C12h32O11. Сахароза, мальтоза и лактоза — все дисахариды, имеющие одну и ту же химическую формулу. У них одинаковое количество
молекулы углерода, водорода и кислорода (12, 22 и 11 соответственно). Как уже упоминалось выше, все три сахара имеют разные химические структуры (представлены на диаграмме ниже).Лактоза — это
состоит из одной молекулы галактозы и одной молекулы глюкозы.
Это сахар, который в основном содержится в молоке и молочных продуктах, включая масло, сыр, йогурт, пудинг и мороженое. Лактоза — важный источник энергии для младенцев; грудное молоко и большинство детей
обе формулы богаты лактозой.
Химическая структура сахарозы, лактозы и мальтозы
Химическая формула глюкозы — C6h22O6.
Глюкоза — это моносахарид с 6 атомами углерода, 12 атомами водорода и 6 атомами кислорода.Это ключевой источник энергии для клеток нашего тела. У животных пищеварительная система расщепляет углеводы
и высвобождает глюкозу в кровоток животных. Такие продукты, как конфеты, фруктовый сок и пирожные, наполнены простыми сахарами (например, сахарозой), которые можно переваривать и высвобождать.
много молекул глюкозы попадает в кровоток. С другой стороны, у растений есть более впечатляющий способ получения глюкозы. Они производят глюкозу с нуля в присутствии солнечного света, используя углерод.
диоксид и вода; в процессе, называемом фотосинтезом.
Химическая формула галактозы также C6h22O6.
Галактоза — это моносахарид с той же химической формулой, что и глюкоза и фруктоза. Следовательно, он имеет такое же количество атомов углерода, водорода и кислорода, что и молекула глюкозы и фруктозы (6, 12
и 6 соответственно). В отличие от сахарозы и глюкозы, она не содержится в больших количествах во многих наших продуктах. Он соединяется с глюкозой с образованием лактозы.
Так же, как глюкоза и галактоза, химическая формула фруктозы — C6h22O6.
Фруктоза — это моносахарид с той же химической формулой, что и глюкоза и галактоза. Он также имеет 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Обычно он содержится во фруктах, где иногда встречается.
связаны с глюкозой — как сахароза. Фруктозу обычно добавляют в пищу в качестве дешевой альтернативы другим простым сахарам.
Химическая структура глюкозы, галактозы и фруктозы
Как следует из названия, они имеют более сложную структуру, чем простые сахара. Это длинные цепочки молекул моносахаридов, связанных друг с другом, как ожерелье.Их можно разделить на два
классы: олигосахариды и полисахариды. Полисахариды сложнее олигосахаридов; олиго — означает «немногие», а поли — «много». Следовательно, олигосахариды состоят из трех-десяти
единиц мономера, в то время как полисахариды состоят из намного большего. Следующие разделы будут ограничены полисахаридами.
Живые существа в основном используют сложные сахара либо для хранения энергии, либо для структурной поддержки и защиты.Сложные углеводы можно найти в цельных растительных продуктах, таких как хлеб, рис, макаронные изделия и
картошка.
После того, как вы съели кусок хлеба или что-нибудь еще, что содержит крахмал, пищеварительные соки во рту и желудке расщепляют сложные сахара на простые. Затем простые сахара выделяются в
кровь и транспортируются к клеткам, где они используются в качестве энергии для выполнения функций организма. Избыточные простые сахара превращаются в форму хранения, называемую гликогеном, и сохраняются в качестве запаса энергии.
Некоторые из наиболее распространенных сложных сахаров обсуждаются ниже, в том числе их сахарные формулы.
Гликоген используется животными как запас энергии. Это длинная цепь молекул глюкозы, связанных между собой гликозидной связью (альфа-1,4-гликозидной связью), с разветвлением примерно через каждые 10
молекулы через гликозидную связь (альфа-1,6-гликозидная связь). Полимер гликогена содержит около 30000 единиц глюкозы. Когда организму нужно задействовать свои резервы, молекулы гликогена разрушаются.
вниз, чтобы высвободить большое количество отдельных компонентов глюкозы, которые будут использоваться для производства энергии.
Благодаря альфа-1,4-гликозидной связи гликоген и крахмал имеют спиральную структуру, удобную для хранения энергии.
Точно так же, как гликоген — это запас энергии у животных, крахмал — это запас энергии у растений. В отличие от гликогена, который представлен в одной форме, существует две разные формы крахмала: амилоза и
амилопектин. Считается, что 80% крахмала состоит из амилопектина, а оставшиеся 20% — это амилоза.
Амилоза — неразветвленный полисахарид молекул глюкозы.Следовательно, единственное различие между гликогеном и амилозой — это отсутствие разветвления в амилозе.
Амилопектин : Как и гликоген, амилопектин представляет собой разветвленный полисахарид глюкозы. Единственное различие между гликогеном и амилопектином — его менее частое разветвление. В
амилопектин, разветвление происходит примерно через каждые 30 молекул глюкозы. Амилопектин состоит из тысяч и сотен тысяч мономеров глюкозы.
Когда мы едим крахмалистую пищу, слюнная железа и поджелудочная железа выделяют ферменты, называемые альфа-амилазами (амилазы слюны и поджелудочной железы соответственно), в месяц и желудок соответственно.Эти ферменты расщепляют гликозидные связи, чтобы расщепить крахмал на молекулы мальтозы. Другой фермент, называемый мальтазой, вырабатываемый тонкой кишкой, далее расщепляет мальтозу на индивидуальную глюкозу.
молекулы.
Целлюлоза — одно из наиболее распространенных органических соединений на Земле. Это важный структурный компонент растительных клеток. В отличие от вышеуказанных полисахаридов, целлюлоза состоит из
отдельные молекулы глюкозы, связанные бета-1,4-гликозидными связями. Эта связь придает целлюлозе ее линейную структуру.



 Вещества сохраняют свои свойства.
Вещества сохраняют свои свойства.