Белки основные — Справочник химика 21
Не следует забывать, что среди аминокислот, входящих в состав природных белков, имеются также моноаминодикарбоновые кислоты и диаминомонокарбоновые кислоты. Избыток первых в данном белке увеличивает его кислотный характер. В белках основного характера содержится некоторый избыток диаминокислот. [c.395]
Гистоны—белки основного характера, так как содержат значительное количество диаминокислот со свободными аминогруппами они растворимы в воде и в разбавленных кислотах, но не растворимы в разбавленных щелочах. Обычно представляют собой собственно белковые части сложных белков. Представитель глобин — белок, входящий в состав сложного белка крови — гемоглобина. [c.297]
Обе стадии невозможно отделить одну от другой. Сущность тепловой денатурации можно рассмотреть на примере глобулярных белков. Основная молекула глобулярного белка, как известно, состоит из одной или нескольких полипептидных цепей, сложенных складками и образующих клубки. Такая структура стабилизируется непрочными связями, среди которых большую роль играют водородные связи, образующие поперечные мостики между параллельными пептидными цепями или их складками. При нагревании белков происходит усиленное движение полипептидных цепей или их складок, что вызывает разрыв непрочных связей между ними. В результате этого наблюдается развертывание и перегруппировка складок, сопровождаемые перераспределением полярных и неполярных радикалов, причем неполярные радикалы концентрируются на поверхности глобул, понижая их гидрофильность, а следовательно, и растворимость. [c.370]
Такая структура стабилизируется непрочными связями, среди которых большую роль играют водородные связи, образующие поперечные мостики между параллельными пептидными цепями или их складками. При нагревании белков происходит усиленное движение полипептидных цепей или их складок, что вызывает разрыв непрочных связей между ними. В результате этого наблюдается развертывание и перегруппировка складок, сопровождаемые перераспределением полярных и неполярных радикалов, причем неполярные радикалы концентрируются на поверхности глобул, понижая их гидрофильность, а следовательно, и растворимость. [c.370]
Последние годы отмечены повышенным интересом к ферментам, взаимодействующим с ДНК. Большинство из них — белки основного характера, и их удобнее очищать на катионообменниках чаще всего для этой цели используют фосфоцеллюлозу. [c.304]
Подобно аминокислотам, белки сочетают в себе как кислотные, так и основные свойства. Являясь амфотерными полиэлектролитами, белки тем не менее существенно отличаются от свободных аминокислот, кислотно-основные свойства которых обусловлены а-амино- и а-карбоксильными группами. В белках основной вклад в формирование кислотно-основных свойств вносят заряженные радикалы аминокислотных остатков, расположенные на поверхности белковой глобулы. Основные свойства белков связаны с такими аминокислотами, как аргинин, лизин или гистидин, а кислые — с аспарагиновой и глутаминовой аминокислотами. Что касается а-аминных и а-кар-боксильных групп аминокислот, то их ионизация не имеет существенного значения, так как подавляющее их число участвует в образовании пептидных связей. Кривые титрования белков достаточно сложны для интерпретации. Это связано, во-первых, с наличием большого числа титруемых групп, а также с тем, что рА для каждой титруемой группы в белке может существенно отличаться от таковой в аминокислоте. Это связано с электростатическими взаимодействиями между ионизированными группами белка, наличием близко расположенных гидрофобных остатков, а также влиянием водородных связей. [c.52]
В белках основной вклад в формирование кислотно-основных свойств вносят заряженные радикалы аминокислотных остатков, расположенные на поверхности белковой глобулы. Основные свойства белков связаны с такими аминокислотами, как аргинин, лизин или гистидин, а кислые — с аспарагиновой и глутаминовой аминокислотами. Что касается а-аминных и а-кар-боксильных групп аминокислот, то их ионизация не имеет существенного значения, так как подавляющее их число участвует в образовании пептидных связей. Кривые титрования белков достаточно сложны для интерпретации. Это связано, во-первых, с наличием большого числа титруемых групп, а также с тем, что рА для каждой титруемой группы в белке может существенно отличаться от таковой в аминокислоте. Это связано с электростатическими взаимодействиями между ионизированными группами белка, наличием близко расположенных гидрофобных остатков, а также влиянием водородных связей. [c.52]
Гистоны. Белки основного характера. Находятся в виде нуклеопротеидов (см. стр. 392) в лейкоцитах и красных кровяных шариках. [c.390]
стр. 392) в лейкоцитах и красных кровяных шариках. [c.390]
Белки — это важнейшие для жизни вещества. Белки — основной структурный компонент живых тканей. Посмотрите на своего соседа. Все, что вы видите кожа, волосы, глаза, ногти, — это белки. Костные ткани, кровь, мозг — все содержит белки. Кроме того, все ферменты, контролирующие химические процессы в организме, представляют собой белки. В каждом чело- [c.258]
Физиологическое значение белков трудно переоценить не случайно их называют носителями жизни . Белки-основной материал, из которого построен живой организм, т.е. протоплазма каждой живой клетки. [c.230]
Огромное разнообразие белков есть следствие их эволюции. Эволюция явилась результатом многочисленных природных экспериментов (мутации и последующий отбор), которые могут быть использованы для изучения принципов строения белков. Основной мутационной ступенью эволюции белков является замена аминокислотного остатка на следующих по значимости этапах происходят вставки и делеции одного или большего числа остатков очень большие изменения являются результатом мультипликации и слияния генов. [c.241]
Японскую ассоциацию по пищевому растительному белку. Основные фирмы, фигурирующие в голубой книге Американской ассоциации по сое, представлены ниже. [c.660]
Исследования механизма свертывания, отвечающие второму подходу к установлению структурной организации белка, базируются на многочисленных физических, химических и биологических методах исследования, которые дают прямую или косвенную информацию о геометрических, термодинамических и кинетических аспектах процессов денатурации и ренатурации, механизме клеточного синтеза аминокислотной последовательности и взаимодействия белковых цепей с шаперона-ми. В исследованиях этого плана, как и предшествующего, надежда возлагается на то, что в результате анализа экспериментальных данных в конечном счете удастся разработать эмпирические правила, позволяющие предсказывать по известному химическому строению белка основные этапы свертывания, в первом случае, и нативную пространственную структуру, во втором. Далее, предполагается, если эти цели будут достигнуты, то станет ясно не только как возникает физиологически активная конформация, но и почему она возникает, т.е. бу- [c.77]
Далее, предполагается, если эти цели будут достигнуты, то станет ясно не только как возникает физиологически активная конформация, но и почему она возникает, т.е. бу- [c.77]
Представление о пространственной структуре пептидов и белков, якобы «предопределенной конформацией остова», не следует ни из экспериментальных фактов, ни из результатов расчета. Оно родственно а-спиральной концепции и является следствием стереотипности мышления, а также, по-видимому, магии слов. Появление таких терминов, как «остов», «основа», «скелет», обычно связано с необходимостью подчеркнуть фундаментальные, самые существенные свойства структуры или ее частей, В лексикон исследователей пространственного строения пептидов и белков слова «пептидный остов» и «пептидный скелет» пришли от исследователей химического строения этих соединений. Там они совершенно точно передавали суть химической структуры изучаемых объектов. Но эти слова потеряли свой первозданный смысл и приобрели ложный, иллюзорный, как только стали употребляться в описаниях пространственного строения пептидов и белков. Основные цепи пептидных и белковых молекул обретают лишь видимость остова или скелета в нативных конформациях, т.е. в состоянии, когда реализована полная схема межостаточных невалентных взаимодействий, прежде всего, взаимодействий типа «боковая цепь — боковая цепь» и «боковая цепь — основная цепь». Вне этих взаимодействий, т,е, в условиях денатурации, видимость пропадает, иллюзия рассеивается и химическая основа пептидов и белков превращается в гибкую цепь, которая не может самостоятельно удерживать свою форму, В предположении об особой конформационной роли пептидного остова авторы [22] делают одно исключение, В связи с этим они замечают «Сказанное не относится к ситуации, когда следует учитывать дающие весьма существенный вклад в конформационную энергию электростатические взаимодействия ионогенных групп в этом случае конформация боковой цепи, несущей ионогенную группу, должна быть «приравнена» к конформации пептидного остова» [22, С, 36], Таким образом, в структурной организации пептидов особая роль отводится также электростатическим взаимодействиям и, прежде всего, взаимодействиям между заряженными группами.
Основные цепи пептидных и белковых молекул обретают лишь видимость остова или скелета в нативных конформациях, т.е. в состоянии, когда реализована полная схема межостаточных невалентных взаимодействий, прежде всего, взаимодействий типа «боковая цепь — боковая цепь» и «боковая цепь — основная цепь». Вне этих взаимодействий, т,е, в условиях денатурации, видимость пропадает, иллюзия рассеивается и химическая основа пептидов и белков превращается в гибкую цепь, которая не может самостоятельно удерживать свою форму, В предположении об особой конформационной роли пептидного остова авторы [22] делают одно исключение, В связи с этим они замечают «Сказанное не относится к ситуации, когда следует учитывать дающие весьма существенный вклад в конформационную энергию электростатические взаимодействия ионогенных групп в этом случае конформация боковой цепи, несущей ионогенную группу, должна быть «приравнена» к конформации пептидного остова» [22, С, 36], Таким образом, в структурной организации пептидов особая роль отводится также электростатическим взаимодействиям и, прежде всего, взаимодействиям между заряженными группами. [c.399]
[c.399]
В процессе эволюции белков происходят замены отдельных остатков, вставки и делеции нескольких остатков, удвоение и слияние генов. Для белков основные этапы исторического процесса знаменуются заменами аминокислотных остатков в полипептидной цепи. С течением времени эти замены накапливаются, так что в конечном счете какое-либо сходство между исходной и окончательной аминокислотными последовательностями может исчезнуть. Однако, как правило, даже после того как исчезнет сходство аминокислотных последовательностей двух гомологичных белков, сохраняется соответствие в укладке их цепей. Тенденции к замещениям заметно отличаются у остатков в разных положениях в цепи (рис. 7.1, б). Различия гомологичных белков не исчерпываются за- [c.197]
Мембраны эритроцитов содержат около восьми основных полипептидов [6]. Пять из них являются внешними и составляют 40 % общего содержания белка. Основным внутренним белком является гликофорин, один из немногих внутренних белков с установленной аминокислотной последовательностью (рис. 25.3.7) . В его молекуле несколько аминокислотных остатков связано с олигосахаридными фрагментами, которые в основном определяют антигенные и рецепторные свойства эритроцитов эти олигосахариды локализованы исключительно в Л -концевой части аминокислотной последовательности и находятся на внешней поверхности мембраны. Примечательна также высокая концентрация остатков дикарбоновых аминокислот в С-концевой последовательности. Однако наибольший интерес представляет участок между М- и концевыми последовательностями, содержащий около двадцати [c.121]
25.3.7) . В его молекуле несколько аминокислотных остатков связано с олигосахаридными фрагментами, которые в основном определяют антигенные и рецепторные свойства эритроцитов эти олигосахариды локализованы исключительно в Л -концевой части аминокислотной последовательности и находятся на внешней поверхности мембраны. Примечательна также высокая концентрация остатков дикарбоновых аминокислот в С-концевой последовательности. Однако наибольший интерес представляет участок между М- и концевыми последовательностями, содержащий около двадцати [c.121]
При помощи метода фракционирования гомогенатов органов и тканей в центрифугах было показано, что ядерная фракция печени и почек содержит незначительное число ферментов, хотя известно, что в ядрах осуществляется синтез некоторых белков. Основное место синтеза белка, как теперь установлено,— фракция рибосом цитоплазмы. Показано, кроме [c.158]
Гистоны — белки основного характера, растворимые в разбавленных растворах кислот и щелочей осаждаются этанолом. [c.80]
[c.80]
Активацию рассматривают как суммарный результат физико-химических процессов реорганизации структуры и снижения стабильности макромолекул и мембран. Их термодинамические и кинетические характеристики сходны с показателями тепловой денатурации белков и плавления нуклеиновых кислот. Все химические реагенты и воздействия, вызывающие активацию, влияют на структурную организацию клеточных биополимеров и мембран. Активация спор при низких значениях pH происходит в той же зоне, где и денатурация белков. Основной итог активации — подготовка клетки к следующему этапу прорастания — инициации. [c.107]
Молекула ДНК состоит из 2 сплетенных комплементарных цепей нуклеотидов, которые удерживаются вместе за счет так называемого спаривания оснований. Особенности синтеза ДНК приводят к антипараллельности комплементарной цепи, 3 -конец одной цепи находится рядом с 5 -концом другой. Структурно цепи образуют двойную спираль, представляющую как бы винтовую лестницу, закрученную вправо вокруг воображаемой центральной оси. В свою очередь ДНК и РНК отвечают за синтез белка — основной структурной единицы любого организма. [c.440]
В свою очередь ДНК и РНК отвечают за синтез белка — основной структурной единицы любого организма. [c.440]
В процессе высушивания зерна не должны быть денатурированы белки, основное количество которых находится в его зародыше. Эти белки чрезвычайно термолабильны, и при неправильном режиме сушки зерно теряет свою всхожесть. Поэтому максимально допустимая температура нагрева зерна в основном определяется термоустойчивостью его белкового комплекса. С повышением влажности зерна его термоустойчивость падает. Сохранение семенных и продовольственных качеств зерна зависит не только от температуры, но и от скорости нагревания и времени выдержки при максимальной температуре [50]. Поэтому для сушки зерна применяют многокамерные сушилки с различным режимом по зонам и с охлаждением. По-видимому, целесообразно также применение цилиндро-конических аппаратов, в которых создается организованное движение материала. [c.212]
Физиологическое значение белков трудно переоценить не случайно их называют носителями жизни . Белки — основной материал, из которого построен живой организм, т. е. протоплазма каждой живой клетки. Особый класс белков образуют биологические катализаторы— ферменты (см. 40.5) белковую природу имеет также часть гормонов (см. 40.4). Склеропротеины служат живым организмам для создания органов защиты (рога) или теплоизоляции (перьевой или волосяной покров). [c.547]
Белки — основной материал, из которого построен живой организм, т. е. протоплазма каждой живой клетки. Особый класс белков образуют биологические катализаторы— ферменты (см. 40.5) белковую природу имеет также часть гормонов (см. 40.4). Склеропротеины служат живым организмам для создания органов защиты (рога) или теплоизоляции (перьевой или волосяной покров). [c.547]
Гистоны — белки основного характера, растворимые в разбавленных растворах кислот и щелочей осаждаются этанолом. Содержатся в клеточных ядрах, где они слабо связаны с нуклеиновыми кислотами. [c.550]
Мы не пытались углубляться во многие интересные применения систем с водородными связями. В гл. 11 дается лишь краткий обзор некоторых применений, главным образом для характеристики разнообразных возможностей. Даже в гл. 10 (где рассматриваются белки) основное внимание сосредоточено только на одном вопросе — роли водородной связи в структуре белков. [c.7]
Несмотря на всю сложность молекулы белка, основные принципы ее структуры делаются все яснее, и все более очевидной становится важная роль Н-связи в этой структуре. [c.254]
[c.254]
Гистоны, также обладающие основным характером, имеют более сложный состав и больший молекулярный вес, чем протамины, приближаясь тем самым к обычным белкам. И у этих белков основность обусловлена высоким содержанием аргинина. Они растворимы в воде и осаждаются аммиаком при нагревании они свертываются только в присутствии электролитов и то частично. Гистоны гидролизуются пепсином. Они находятся в ядрах клеток, связанные, как и протамины, с нуклеиновыми кислотами в виде нуклеопротеидов (они получаются легче всего из богатых ядрами органов, например щитовидной железы), [c.446]
Первыми генной инженерией всерьез заинтересовались фармацевтические фирмы. Для них возможность сравнительно дешево производить практически любые белки в больших количествах открывает совершенно новые горизонты. Ведь, помимо того, что белки — основные рабочие молекулы в клетке, они играют ещё ключевую [c.122]
Глинистые материалы, адсорбируя микробные клетки, образуют с ними крупные агрегаты размером 50—200 мкм. Подобные агрегаты образуются со всеми испытанными дрожжами и бактериями, а также при внесении белков, основных аминокислот и других веществ, подвергающихся адсорбции на частицах глин. Если адсорбция клеток не происходит или происходит очень слабо, то подобных агрегатов не образуется. Размеры агрегатов в определенной степени зависят от числа микробных клеток, адсорбированных минералом. [c.70]
Подобные агрегаты образуются со всеми испытанными дрожжами и бактериями, а также при внесении белков, основных аминокислот и других веществ, подвергающихся адсорбции на частицах глин. Если адсорбция клеток не происходит или происходит очень слабо, то подобных агрегатов не образуется. Размеры агрегатов в определенной степени зависят от числа микробных клеток, адсорбированных минералом. [c.70]
В водных растворах белки обладают свойствами слабых кислот или слабых оснований, в зависимости от преобладания в молекуле белка дикарбоновых кислот (глютаминовая, аспарагиновая) или диаминокислот (лизин, аргинин). Белки кислого характера (альбумины, глобулины) в водном растворе несут отрицательный заряд, белки основного характера (протамины, гистоны) — положительный. [c.25]
Заряд белковой молекулы в нейтральней среде определяется соотношением количества свободных групп —СООН и —ЫНд и степенью их диссоциации. Чем больше карбоксильных групп —СООН, тем выше окажется отрицательный заряд, и белок будет проявлять свойства слабой кислоты.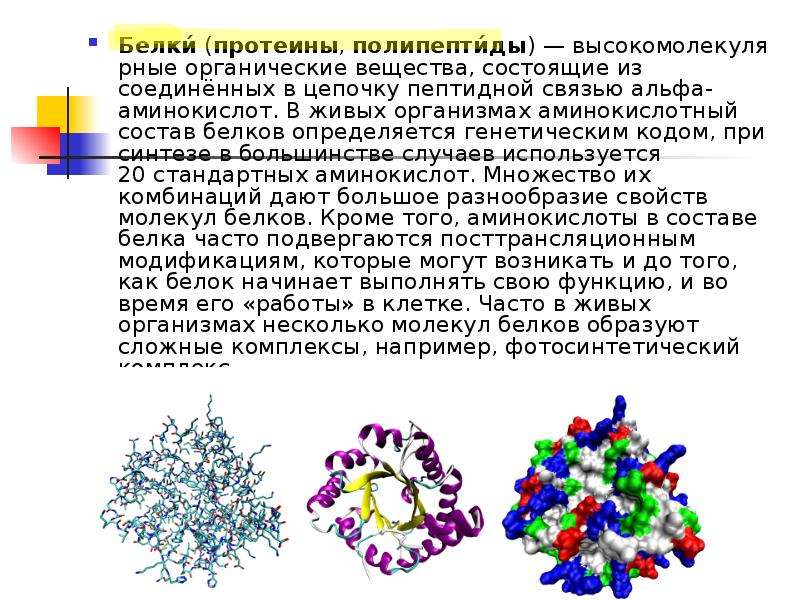 Преобладание аминных 1 рупп —Nh3 сообшает белку основные свойства и положительный заряд. [c.188]
Преобладание аминных 1 рупп —Nh3 сообшает белку основные свойства и положительный заряд. [c.188]
Белки—основной материал, из ]соторою строится структура живой клетки, [c.3]
Наиболее интересной и важной группой из числа сложных белков являются нуклеопротеиды, в них белок соединен с нуклеиновой кислотой. В отличие от других сложных белков нуклеопротеиды состоят из сравнительно простого и низкомолекулярного белка основного характера — протамина или гистона, и высокомолекулярной простетической группы — нуклеиновой кислоты. Нуклеопротеиды входят в состав всех клеток живого организма, являются важной частью хромозом и т. д. К этому классу соединений относятся и молекулы ]-иганты — вирусы, инициаторы многих инфекционных заболеваний, например, полиомиелита. [c.533]
Все нуклеопротеиды можно разделить по меньшей мере на два типа. К первому типу относятся нуклеопротеиды, в которых нуклеиновая кислота связана солевой связью с простыми белками основного характера и низкого молекулярного веса. Такими белками могут быть протамины (сальмин, клупеин, сту-рин), встречающиеся в сперме рыб. К этому же типу относятся нуклеопротеиды, в которых нуклеиновая кислота связана с основными белками более высокого молекулярного веса — гистолами. Примером могут служить нуклеопротеиды, встречающиеся в тканях зобной и поджелудочной желез. Ко второму типу мы относим более сложные структуры — вирусы растений (например, вирус табачной мозаики) и бактериофаги. Содержание нуклеиновых кислот в вирусах колеблется от 5 до 50%. Природа связи между белками и нуклеиновыми кислотами в вирусных нуклеопротеидах изучена слабее, чем в нуклеопро-теидах первого типа. Известно, что в вирусном нуклеопротеиде связи между белком и нуклеиновыми кислотами более лабильны и что для белков вирусов характерно высокое содержание основных аминокислот. Даже сравнительно простые вирусы имеют весьма сложное строение. Еще более сложное строение у таких вирз сов, как вирусы гриппа и пситтакоза. Последние могут даже быть отнесены к микроорганизмам.
Такими белками могут быть протамины (сальмин, клупеин, сту-рин), встречающиеся в сперме рыб. К этому же типу относятся нуклеопротеиды, в которых нуклеиновая кислота связана с основными белками более высокого молекулярного веса — гистолами. Примером могут служить нуклеопротеиды, встречающиеся в тканях зобной и поджелудочной желез. Ко второму типу мы относим более сложные структуры — вирусы растений (например, вирус табачной мозаики) и бактериофаги. Содержание нуклеиновых кислот в вирусах колеблется от 5 до 50%. Природа связи между белками и нуклеиновыми кислотами в вирусных нуклеопротеидах изучена слабее, чем в нуклеопро-теидах первого типа. Известно, что в вирусном нуклеопротеиде связи между белком и нуклеиновыми кислотами более лабильны и что для белков вирусов характерно высокое содержание основных аминокислот. Даже сравнительно простые вирусы имеют весьма сложное строение. Еще более сложное строение у таких вирз сов, как вирусы гриппа и пситтакоза. Последние могут даже быть отнесены к микроорганизмам. Подробное строение вирусов этой группы здесь не рассматривается. [c.246]
Подробное строение вирусов этой группы здесь не рассматривается. [c.246]
Наряду с жирами и углеводами белки — основная составная часть пищи человека. В индустриальных странах главным источником пищевых белков являются продукты животного пронсхождення, в то время как в развивающихся странах в пище преобладают биологически неполноценные растительные белки. Для удовлетворения потребности постоянно растущего населения помимо увеличения производства животных и растительных продуктов, выведения сортов зерновых с повышенным содержанием недостающих аминокислот и повышения ценности биологически неполноценных растительных белков добавлением синтетических аминокислот все большее значение приобретает дальнейшее развитие микробиологических щюцессов получения белков одноклеточных микроорганизмов [10 — 15]. Микробиологические процессы основаны на способности определенных микроорганизмов использовать в обмене веществ в качестве источника углерода такие вешества, как углеводороды нефти, спирты или сырье, содержащее углеводы (крахмал, меласса, целлюлоза). Обзор важнейших процессов дан в табл. 3-1. [c.341]
Обзор важнейших процессов дан в табл. 3-1. [c.341]
Белки — основные вещества живой материи, их физиологическая и структурная роль чрезвычайно важна. В самом деле, в форме голопротеинов или гетеропротеинов, т. е. белков, связанных с другими молекулами, они содержатся во всех ком-партментах того биологического единства, которым является клетка. [c.125]
При филировании белков основным критерием служит молекулярная масса. Общепризнано, что в диапазоне 10—50 тыс. Да белки проявляют высокую склонность к филированию. Молекулы с очень малой массой дают прядильные растворы с чрезвычайно низкой вязкостью, образующие нестойкие белковые нити, которые быстро диспергируются в коагулирующем растворе. Наоборот, из белков с очень высокой молекулярной массой на этапе денатурации получаются прядильные растворы с очень сильной вязкостью, что делает невозможным прядение волокон. Некоторые белки также образуют очень густые гели в щелочной среде за счет появления межцепочечных ковалентных связей типа дисульфидный мостик , что вызывает необходимость подгонять, приспосабливать параметры филирования [97]. [c.537]
[c.537]
Исследование структурных и конформационных свойств индивидуальной полипептидной субъединицы обычно ведется по трем аспектам рассматриваются первичная, вторичная и третичная структуры, как это было предложено Линдерстрем-Лангом [И]. Организмы используют для синтеза белков основной набор из 20 аминокислот (см. гл. 23.2). Необычные аминокислоты, которые эпизодически встречаются в белковых структурах, часто являются результатом химической модификации простетической группы гема (остатки 70—80) они остались неизменными в процессе эволюции, тогда как другие части молекулы играют, по-видимому, меньшую роль для спецификаций, особенно остатки, не участвующие в агре- [c.222]
Гистоны также являются белками основного характера. В их состав входят лизин и аргинин, содержание которых, однако, не превышает 20—30%. Молекулярная масса гистонов намного больше нижнего предела молекулярной массы белков. Эти белки сосредоточены в основном в ядрах клеток в составе дезоксирибонуклеопротеинов и играют важную роль в регуляции экспрессии генов (см. главы 2 и 3). [c.73]
главы 2 и 3). [c.73]
В 1916 г. в опытах на животных было показано токсичное действие сырого яичного белка употребление печени или дрожжей снимало этот эффект. Фактор, предотвращающий развитие токсикоза, был назван витамином Н. Позже было установлено, что в дрожжевом экстракте печени и желтке куриного яйца содержится пищевой фактор, отличный от всех других известных к этому времени витаминов. Этот фактор стимулирует рост дрожжей и азотфиксирующих бактерий Rhizobium, в связи с чем он и получил название биотин (от греч. bios—жизнь), или коэнзим R. В 1940 г. было установлено, что все три названия (биотин, витамин Н и коэнзим R) относятся к одному и тому же химически индивидуальному соединению. Выделенное из сырого яичного белка вещество оказалось гликопротеином—белком основного характера, названным авидином этот белок обладает высоким сродством связывания с биотином с образованием нерастворимого в воде комплекса. Комплекс не подвергается расщеплению в пищеварительном тракте, поэтому биотин не всасывается, хотя и содержится в пищевых продуктах. [c.228]
[c.228]
От чего зависит заряд белка в водном растворе Назовите белкй основного и кислого характера. [c.44]
Свободные аминокислоты и входящие в состав белков основные и кислотные остатки являются электролитами. Функционируя в водной среде, они диссоциируют на ионы. Рационально пользоваться следующим определением Бренстеда кислота — молекула, от которой отщепляется протон основание — иолеку-ла, присоединяющая протон. Сам растворитель — вода — выступает как кислота в реакции НаО ОН и как основание в реакции НаО 4-Н+Н3О+ (ион оксония). [c.61]
Гистоны. Белки основного характера. Содержатся в нук-леопрртеидах лейкоцитов и красных кровяных шариков. [c.501]
Препарат на основе белка плазмы крови сделал МРТ безопаснее и точнее
Стандартный метод магнитно-резонансной томографии (МРТ) основан на явлении ядерного магнитного резонанса атомов водорода. Метод основан на явлении ядерного магнитного резонанса, связанного с особенностями магнитных свойств некоторых ядер, в первую очередь водорода. Сперва мощное постоянное магнитное поле выстраивает направление магнитных моментов ядер – спинов. Затем под воздействием переменного магнитного поля они начинают двигаться, что создает электромагнитный сигнал, который фиксирует томограф и на его основе создает изображение изучаемого объекта. Ткани по-разному насыщены водородом, а потому при измерении электромагнитного отклика области организма будут отличаться. Лучше всего МРТ подходит для анализа органов, в которых содержится больше всего воды, например мозга или кровеносных сосудов. Но иногда этот способ приходится применять и для других частей тела, и пациенту прописывают курс специальных препаратов, улучшающих «видимость» для аппарата МРТ. В частности, такой подход используется при поиске мелких метастазов. Однако подобные препараты содержат в своем составе токсичный металл гадолиний, поэтому Европейское агентство лекарственных средств ограничило для врачей доступ к этим веществам — теперь введение контрастных препаратов возможно только в маленьких дозах и в случаях, когда контрастная томография необходима.
Сперва мощное постоянное магнитное поле выстраивает направление магнитных моментов ядер – спинов. Затем под воздействием переменного магнитного поля они начинают двигаться, что создает электромагнитный сигнал, который фиксирует томограф и на его основе создает изображение изучаемого объекта. Ткани по-разному насыщены водородом, а потому при измерении электромагнитного отклика области организма будут отличаться. Лучше всего МРТ подходит для анализа органов, в которых содержится больше всего воды, например мозга или кровеносных сосудов. Но иногда этот способ приходится применять и для других частей тела, и пациенту прописывают курс специальных препаратов, улучшающих «видимость» для аппарата МРТ. В частности, такой подход используется при поиске мелких метастазов. Однако подобные препараты содержат в своем составе токсичный металл гадолиний, поэтому Европейское агентство лекарственных средств ограничило для врачей доступ к этим веществам — теперь введение контрастных препаратов возможно только в маленьких дозах и в случаях, когда контрастная томография необходима.
«Химики давно заметили потенциал органических препаратов для проведения контрастной МРТ. Наша научная группа поставила себе задачу — найти органическое вещество, соответствующее четырем параметрам: оно должно присутствовать в норме в организме пациента, у него должна быть маленькая действующая концентрация, высокая растворимость и совместимость с организмом. В результате мы выбрали сывороточный альбумин человека — белок, содержащийся в крови и спинномозговой жидкости. Препараты на основе альбумина использовались для МРТ и раньше, но в своем исследовании мы решили развить потенциал этого белка. Совместив пространственно затрудненные для влияния посторонних факторов нитроксильные радикалы и сывороточный альбумин, мы получили четыре разновидности нашего препарата HSA-NIT», — рассказывает руководитель проекта по гранту РНФ Игорь Григорьев, доктор химических наук, главный научный сотрудник Новосибирского института органической химии имени Н. Н. Ворожцова.
В ходе испытаний ученые проверяли устойчивость препарата и показали его низкую токсичность на уровне природного белка. Известно, что нитроксильный радикал восстанавливается в организме постепенно при помощи природных восстановителей — по этому параметру HSA-NIT превосходит своих предшественников в разы. Также ученые отметили, что белок в составе препарата выводится из крови человека в течение 25 дней — в случае металлосодержащих контрастных веществ за такое время у пациента могло бы ухудшиться здоровье из-за их токсичности, но при использовании HSA-NIT такого риска нет, и окно для съемки МРТ увеличивается.
Исследование российских химиков показало, что использование сывороточного альбумина при создании контрастных препаратов поможет улучшить продуктивность и точность процесса МРТ. Ученые считают, что в будущем возможно сильно увеличить количество нитроксильных радикалов в препарате, чтобы продолжить усовершенствование МРТ с применением контрастных веществ, ведь даже нынешней точности томографии может не хватать для диагностирования некоторых заболеваний. Следующей целью исследователей станет разработка новых конъюгантов, для большего контрастирования тканей пациента.
В исследовании принимала участие лаборатория биомедицинской химии ИХБФМ СО РАН.
Белки острой фазы и маркеры воспаления
Воспаление – это основная защитная реакция организма на внедрение чужеродного агента, введение антигена или физическое повреждение тканей.
Острофазные белки – это белки коагуляции, транспортные белки, которые также выполняют функции медиаторов иммунной системы. Они синтезируются в печени, их концентрация существенно изменяется и зависит от стадии, течения заболевания и массивности повреждения, что и определяет ценность этих тестов для клинической лабораторной диагностики.
В Клинико-диагностической лаборатории производится определение следующих острофазных белков и маркеров воспаления:
- С-реактивный белок (СРБ) – один из самых чувствительных и ранних индикаторов воспаления. Часто используется для диагностики и мониторинга различных воспалительных процессов, дифференциальной диагностики между бактериальной и вирусной инфекциями, обнаружения послеоперационных осложнений, мониторинга эффективности лечебных мероприятий.
- Гаптоглобин – увеличение содержания его в крови отмечается при острых воспалительных процессах, опухолях, нефротическом синдроме.
- Церрулоплазмин – возрастание его уровня наблюдается при острых и хронических инфекциях, циррозе печени, гепатитах, инфаркте миокарда, системных заболеваниях, злокачественных новообразованиях (в 1,5-2 раза).
- Определяются иммуноглобулины классов А, М и G (Ig A, Ig M, Ig G).
Диагностика ревматизма
ASO (антистрептолизин) – является лабораторным критерием ревматизма.Повышение свидетельствует о сенсибилизации организма к стрептококковым антигенам. В период реконвалесценции показатель снижается по сравнению с острым периодом, поэтому может использоваться для наблюдения за динамикой течения, оценки степени активности ревматического процесса.
Ревматоидный фактор – определяется у больных ревматоидным артритом. Также обнаруживается у людей с иными видами аутоиммунной и хронической воспалительной патологией.
Рекомбинантный укороченный белок TNF-BD
вируса натуральной оспы проявляет
специфическую фармакологическую активность
в экспериментальной модели септического шока
Vavilovskii Zhurnal Genet Selektsii. 2020 May; 24(3): 239–243.
Language: Russian | English
И.П. Гилева
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
С.Н. Якубицкий
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
И.В. Колосова
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
С.Н. Щелкунов
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия,
И.П. Гилева,
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
Received 2019 Dec 6; Revised 2020 Jan 27; Accepted 2020 Jan 30.
This work is licensed under a Creative Commons Attribution 4.0 License
Abstract
Фактор некроза опухолей (TNF) – один из основных цитокинов, медиаторов иммунной системы,
обеспечивающих защиту организма человека от вирусных инфекций. В процессе эволюции антропогенный
вирус натуральной оспы (Variola virus, VARV) освоил эффективные механизмы преодоления иммунологических
барьеров человека, кодируя в своем геноме белки, способные взаимодействовать с рецепторами цитокинов
организма-хозяина, блокируя таким образом их активность. В частности, ген G2R этого вируса кодирует белок
CrmB, который эффективно связывает TNF человека и мышей. При этом данный белок является двухдоменным
и наряду с TNF-связывающим N-концевым доменом содержит С-концевой хемокин-связывающий домен. При
использовании методологии молекулярного клонирования нами ранее получен рекомбинантный бакуловирус, продуцирующий в клетках насекомых рекомбинантный белок CrmB вируса натуральной оспы (VARV-CrmB),
и показан его TNF-нейтрализующий потенциал в различных тестах in vitro и in vivo. С целью снижения иммуногенности этого вирусного белка при его многократном введении для терапии хронических воспалительных заболеваний получена рекомбинантная плазмида, направляющая в клетках Escherichia coli биосинтез укороченного
однодоменного TNF-связывающего (TNF-BD) белка VARV. Методом металл-хелатной аффинной хроматографии
из клеток выделен рекомбинантный белок TNF-BD. Терапевтический потенциал белка TNF-BD изучен в экспериментальной модели септического шока, индуцированного в организме мышей введением бактериального
липополисахарида (ЛПС). После индукции септического шока животным вводили разные дозы рекомбинантного белка TNF-BD и регистрировали их гибель в течение 7 сут. Все мыши, не получавшие препарат белка TNF-BD
после
инъекции ЛПС, погибли через 3 сут, а в группах животных, которым вводили TNF-BD, в зависимости от
дозы этого белка выжили 30, 40 или 60 % мышей. Результаты исследования демонстрируют наличие специфической фармакологической активности у рекомбинантного белка TNF-BD, синтезированного в бактериальных
клетках, в мышиной модели ЛПС-индуцированного септического шока.
Keywords: белок VARV-CrmB, вирус натуральной оспы, ЛПС, септический шок, TNF-связывающий домен
Abstract
Tumor necrosis factor (TNF) is one among the key cytokines that mediate the immune system to protect
humans against viral infections. Throughout evolution, anthropogenic Variola virus (VARV) has developed effective
mechanisms to overcome human defense reactions. The viral genome encodes soluble proteins imitating the structure
of cellular cytokine receptors. These proteins compete with cellular receptors for cytokine binding, thus blocking
the antiviral immune response. In particular, the G2R gene of VARV encodes the TNF decoy receptor, VARV-CrmB
protein. This protein consists of N-ended TNF-biding (TNF-BD) and C-ended chemokine binding (Ch-BD) domains.
Recombinant VARV-CrmB protein has been produced in insect cells using molecular cloning methods and its TNF neutralizing
activity has been shown in vitro and in vivo. To decrease the immunogenicity of this protein, a recombinant
plasmid coding for shortened TNF-BD protein of VARV in Escherichia coli cells has been constructed. Using the method
of immobilized metal affinity chromatography, recombinant TNF-BD protein corresponding to the TNF-biding domain of VARV-CrmB protein was purified from E. coli cells. The therapeutic potential of TNF-BD was studied using an experimental
model of LPS-induced septic shock. After septic shock induction, several doses of recombinant TNF-BD were
injected and the mortality of experimental animals was observed during 7 days. All mice not injected with TNF-BD
had been dead by day 3 of the experiment, but 30, 40 and 60 % of the experimental animals, who received different
TNF-BD doses, survived in a dose-dependent manner. Data obtained demonstrate that recombinant TNF-BD protein is
pharmacologically active in the experimental model of LPS-induced septic shock.
Keywords: VARV-CrmB protein, variola virus, LPS, septic shock, TNF-biding domain
Введение
В процессе коэволюции у вируса натуральной оспы (ВНО)
появились многочисленные эффективные механизмы
преодоления иммунологических барьеров человека.
В частности, вирусный геном детерминирует синтез
секретируемых белков, имеющих структурное сходство
с клеточными рецепторами цитокинов. Вирусные белки
функционируют как связывающие цитокины рецепторы,
блокируя таким образом их активность (Shchelkunova,
Shchelkunov, 2016). Способность вирусных белков эффективно взаимодействовать с иммунной системой человека
открывает перспективу их использования для разработки
иммуномодулирующих терапевтических средств нового
поколения.
Некоторые TNF-блокаторы – Remicade® (Centocor, Inc.,
Malvern, PA, США), Enbrel® (Immunex Corp, Seattle, WA,
США), Humira™ (Abbott Laboratories, Abbott Park, IL,
США), действующим началом которых являются моно-
клональные антитела или химерные белки, состоящие
из TNF-рецепторных и иммуноглобулиновых доменов,
прошли клинические испытания и разрешены для применения в медицинской практике, но не один из перечисленных препаратов не оказался эффективным против
септического шока (Monaco et al., 2015). Продемонстрированная in vivo и in vitro высокая TNF-нейтрализующая
активность белка VARV-CrmB вируса натуральной оспы
(Gileva et al., 2006; Shchelkunova, Shchelkunov, 2016)
позволяет надеяться, что основой терапевтических пре-
паратов нового поколения может стать этот белок.
Эндотоксический шок, индуцированный липополисахаридом (ЛПС) грамотрицательных бактерий (реакция
Шварцмана), – широко используемая экспериментальная
модель септического шока (Leturcq et al., 1995; Lamping
et al., 1998; Fei et al., 2011). Введение рекомбинантного
белка VARV-CrmB мышам с ЛПС-индуцированным септическим шоком приводило к достоверному увеличению
выживаемости мышей и отчетливому снижению гистопатологических изменений внутренних органов по срав-
нению с контрольными животными (Gileva et al., 2006).
Полноразмерный рекомбинантный белок VARV-CrmB
имеет молекулярную массу 47 кДа, и в его структуре выделяют
N-концевой TNF- (TNF-BD) и С-концевой хемокин-связывающий (Сh-BD) домены (Alejo et al., 2006).
С целью уменьшения иммуногенности рекомбинантного
белка VARV-CrmB ранее нами получен его укороченный
однодоменный вариант TNF-BD. Показаны биологическая
активность белка TNF-BD in vitro (ингибирование как
цитотоксичности TNF для культуры клеток фибробластов мыши L929, так и TNF-индуцированной окислительно-
метаболической активности лейкоцитов крови мышей)
(Цырендоржиев и др., 2014; Трегубчак и др., 2015), а также
пониженная иммуногенность относительно полнораз-
мерного белка (Непомнящих и др., 2017).
Цель настоящего исследования – изучение специфи-
ческой фармакологической активности укороченного
однодоменного рекомбинантного белка TNF-BD вируса
натуральной оспы in vivo, а именно – в экспериментальной
модели ЛПС-индуцированного септического шока.
Материалы и методы
Реагенты. Для приготовления жидких и твердых пита-
тельных средств использовали бактопептон, дрожжевой
экстракт и бактоагар (Difco, США), антибиотики ампициллин,
тетрациклин и канамицин (Sigma, США). Ре-
комбинантную плазмидную ДНК выделяли с помощью
набора Qiagen Plasmid Midi Kit (QIAGEN, Германия).
В работе были применены также реактивы фирмы Sigma
(США): имидазол, ЛПС Escherichia coli 055:B5, мочевина,
фенилметилсульфонилфторид (PMSF), IPTG.
Рекомбинантные плазмиды и бактериальные штаммы.
Рекомбинантная плазмида pQE60-TNF-BD любезно
предоставлена Т.В. Трегубчак (Трегубчак и др., 2015).
Для амплификации этой плазмиды использовали штамм
E. coli XL10-Gold (QIAGEN, Германия), а для нара-
ботки рекомбинантного белка TNF-BD – штамм E. coli
SG13009[pRep4] (QIAGEN, Германия). Компетентные
клетки E. coli XL10-Gold и E. coli SG13009 получали по
методу (Mandel, Higa, 1970).
Бактериальные среды. Для культивирования штамма
E. coli SG13009[pRep4], содержащего pQE60-TNF-BD, ис-
пользовали стандартную LB-среду (Sambrook et al., 1985).
Электрофорез, хроматография. Фракционирование
белков проводили в SDS-ПААГ по стандартной методике
(Laemmli, 1970), с помощью маркеров молекулярных масс
белков PageRuler™ Plus Prestained Protein Ladder (Thermo
Scientific, США) (11, 17, 28, 36, 55, 72, 95, 130, 250 кДа).
Металл-хелатную афинную хроматографию проводили,
используя Ni-NTA агарозу (QIAGEN, Германия), на ко-
лонке объемом 1 мл. Концентрацию белка определяли по
методу (Bradford, 1976).
Животные. В эксперименты брали самок мышей
линии BALB/c с массой тела 19–21 г (возраст 8–9 нед),
полученных из вивария Государственного научного
центра вирусологии и биотехнологии «Вектор» Роспо-
требнадзора (Кольцово, Новосибирская область, Россия).
Мышей содержали при естественном световом режиме и постоянном доступе к воде и пище. Животных выводили
из эксперимента в соответствии с правилами, принятыми
Европейской конвенцией по защите животных, используемых
для экспериментальных целей.
Результаты
Наработка рекомбинантного белка TNF-BD. Для полу-
чения инокулятов были взяты индивидуальные колонии
Apr-, Kmr-, TcMr-трансформантов E. coli SG13009[pRep4].
Инокулят разводили свежим L-бульоном (1:50), содержа-
щим 100 мкг/мл ампициллина и по 30 мкг/мл канамицина
и тетрациклина. Бактериальную культуру инкубировали
при 37 °С и интенсивной аэрации до достижения оптической плотности культуры А550 = 0.3–0.5, затем добавляли
индуктор IPTG до концентрации 1 мМ (продолжительность индукции 4 ч). Клетки собирали низкоскоростным
центрифугированием и ресуспендировали в 5 мл буфера
следующего состава: 10 % сахароза, 100 мМ Трис-HCl,
pH 7.3, 5 мМ ЕДТА, 20 мкг/мл PMSF. Затем бактериальные
клетки разрушали ультразвуком на установке Soniprep
(MSE, США; 10 циклов по 1 мин с интервалами между
циклами в 30 с). Как было показано ранее (Трегубчак и
др., 2015), рекомбинантный белок TNF-BD синтезируется
в клетках E. coli в виде «телец включения». Для выделения
целевого продукта тельца включения солюбилизовали в
буфере А (100 мМ NaH2PO4, 10 мМ Трис-НCl, pH 8.0,
300 мМ NaCl, 10 мМ имидазол, 6 М мочевина) и суперна-
тант наносили на колонку с Ni-NTA агарозой (V = 1 мл),
уравновешенную 5 мл этого же буфера. Колонку про-
мывали (2 мл × 3) буфером В (100 мМ Nah3PO4, 10 мМ
Трис-НCl, pH 6.3, 300 мМ NaCl, 20 мМ имидазол, 6 М
мочевина) и элюировали целевой продукт буфером С
(100 мМ NaH2PO4, 10 мМ Трис-НCl, pH 8.0, 300 мМ
NaCl, 250 мМ имидазол) (0.3 мл × 5). Фракции выделения анализировали
в 10 % ПААГ. Результаты выделения
представлены на рис. 1. Фракции, содержащие целевой
продукт, объединяли. Таким образом, был выделен пре-
парат рекомбинантного белка TNF-BD, чистота которого,
по данным электрофореза, составляла около 90 %.
Исследование токсичности рекомбинантного белка
TNF-BD. Для того чтобы определить способность пре-
парата укороченного однодоменного белка TNF-BD предотвращать
взаимодействие мышиного TNF со специфи-
ческими рецепторами
эукариотических клеток, изучали
его активность в тесте нейтрализации цитотоксического
действия mTNF на культуре клеток мышиных фибробластов L929, как описано в работе (Трегубчак и др., 2015).
Для определения токсичности рекомбинантного белка
взяли две группы мышей линии BALB/c (каждая группа
содержала пять животных). Одной группе вводили внутрибрюшинно физиологический
раствор, другой – ре-
комбинантный белок в дозе 50 мкг/мышь. Наблюдение
вели в течение 7 сут, за этот период не было обнаружено
проявлений токсичности рекомбинантного белка.
Исследование специфической фармакологической
активности белка TNF-BD в экспериментальной модели
септического шока. Предварительно для мышей
линии BALB/c была определена доза ЛПС E. coli 055:B5,
вызывающая гибель 100 % животных (ЛД100 ), равная
20 мг/ кг веса. Животные были объединены в пять групп (по 10 особей в группе). Мышам в группах 1–3 внутрибрюшинно
вводили рекомбинантный белок TNF-BD в
дозах 0.2, 2 или 20 мкг/мышь. Через 30 мин этим живот-
ным внутрибрюшинно инъецировали раствор ЛПС E. coli
(O55:B5) в дозе 1 ЛД100. Группе сравнения (группа 4)
вводили только ЛПС, а группе отрицательного контроля
(группа 5) – натрий-фосфатный буфер. После введения
препаратов мышам регистрировали их гибель в течение
7 сут. Результаты эксперимента показаны на рис. 2: на
конец эксперимента выживаемость животных в группе 5
составила 100 %, в группе 4 – 0 %, а в группах 1–3 – 30,
40 и 60 % соответственно.
Electrophoretic resolution of proteins.
(a) PAGE resolution of E. coli cell lysates with 10 % SDS. Lanes: 1, protein ladder;
2–4, SG13009[pRep4, pQE60-TNF-BD]; 5, SG13009[pRep4]. (b) PAGE resolution
of recombinant TNF-BD protein fractions with 12 % SDS. Lanes: 1, fraction of
insoluble cell proteins of E. coli SG13009[pRep4, pQE60-TNF-BD] solubilized in
buffer A; 2, 3, loading onto a column with Ni-NTA agarose equilibrated with
buffer A; 4, 5, washing the column with buffer B; 6–10, elution of the target
product with buffer C; 11, protein ladder.
Survival of experimental animals with LPS-induced endotoxic
shock after administration of the recombinant TNF-BD protein.
Обсуждение
Cигнальная система, активируемая TNF, – один из основных факторов, обусловливающих развитие воспалительного процесса. Гиперпродукция TNF может приводить к
гибели организма в результате развития системной воспалительной
реакции или септического шока. Сепсис и
септический шок до настоящего времени представляют
одну из основных проблем здравоохранения. Ежегодно
они являются причиной смерти более миллиона человек
(Seymour, Rosengart, 2015). TNF-антагонисты, действующим
началом которых были моноклональные антитела
(Infliximab, Adalimumab) или аналог клеточных рецепторов (Etanercept), прошли клинические испытания и разрешены для применения в медицинской практике, но не
один из этих препаратов не проявил терапевтической активности
против септического шока (Monaco et al., 2015).
Поэтому поиск новых классов соединений, обладающих
TNF-нейтрализующей активностью, остается актуальной
проблемой.
Существование вирусных белков, способных связывать
цитокины и, в частности TNF, блокируя таким образом его
активность (Shchelkunova, Shchelkunov, 2016), позволяет
предположить возможность разработки нового поколения
TNF-антагонистов на основе TNF-связывающего белка
вируса натуральной оспы (VARV-CrmB). Ранее нами по-
лучен рекомбинантный бакуловирус BVi67, несущий ген
белка VARV-CrmB, а из инфицированных им клеток насекомых линии Sf21 выделен рекомбинантный вирусный
белок. Рекомбинантный белок VARV-CrmB эффективно
нейтрализует эффекты TNF в экспериментальных системах in vitro и in vivo (Gileva et al., 2006). Особенно следует
подчеркнуть его выраженный терапевтический эффект на
проявление ЛПС-индуцированного септического шока у
мышей, что отчетливо снижает гистопатологические из-
менения внутренних органов и достоверно увеличивает
выживаемость животных (Gileva et al., 2006). Новый
TNF-антагонист, кроме TNF-нейтрализующего потенциала,
должен обладать низкой иммуногенностью, так как
эффективность
применения препарата может быть снижена
из-за развития иммунного ответа на терапевтический
белок (Chen et al., 2015; Eng et al., 2015).
Полноразмерный рекомбинантный белок VARV-CrmB
(47 кДа) обладает способностью к олигомеризации, это
может снизить его терапевтический потенциал при по-
вторном или многократном применении. Белок VARVCrmB
состоит из TNF- и хемокин-связывающего доменов
(Alejo et al., 2006). Нами сделано предположение, что однодоменный укороченный TNF-связывающий белок
сохранит свою терапевтическую активность и будет обладать существенно меньшей иммуногенностью. Был
получен бактериальный продуцент укороченного белка
TNF-BD, соответствующего TNF-связывающему домену
белка VARV-CrmB, и экспериментально доказана его способность ингибировать цитотоксичность TNF на клетках
мышиных фибробластов L929 и TNF-индуцированную
окислительно-метаболическую активность лейкоцитов
крови мышей (Цырендоржиев и др., 2014; Трегубчак и
др., 2015). При этом рекомбинантный TNF-BD проявлял
сниженную иммуногенность относительно белка VARVCrmB
при многократном введении экспериментальным
животным (Непомнящих и др., 2017).
В настоящем исследовании изучен терапевтический потенциал короткого рекомбинантного однодоменного белка
TNF-BD в экспериментальной модели септического шока.
С этой целью белок TNF-BD выделили из клеток E. coli
методом металл-хелатной аффинной хроматографии, как
это показано на рис. 1, а и б. При его внутрибрюшинном
введении мышам линии BALB/c установлено отсутствие
токсичности. Для мышей этой линии экспериментально
определена доза ЛПС E. coli (O55:B5), вызывающая 100 %
гибель животных (ЛД100 ). При внутрибрюшинном введении ЛПС и белка TNF-BD в нашей работе впервые
продемонстрирована дозозависимая специфическая фармакологическая
активность низкоиммуногенного укороченного
рекомбинантного белка TNF-BD в модели ЛПС-
индуцированного
септического шока (см. рис. 2).
Следует отметить, что вопрос правомерности использования
мышиной модели эндотоксимии (реакции Щварцмана)
для выявления новых препаратов для терапии
септического шока у людей остается дискуссионным.
Основанием для скептического отношения к мышиной
модели служат отличия результатов транскриптомных
анализов, механизмов развития врожденного и приобретенного иммунных ответов, гетерогенность человеческой
популяции versus гомогенности инбредных линий мышей
(Efron et al., 2015; Stortz et al., 2017). Не исключено, что
препараты, проявившие высокую эффективность в мыши-
ной модели сепсиса, не будут эффективными для человека,
как это случилось с препаратом Centocor (Thayer, 1993).
Однако простота проведения эксперимента и воспроизводимость результатов делают эту модель незаменимой
для первичного скрининга TNF-связывающих терапевтических препаратов.
Заключение
На основании проведенного исследования можно сделать
вывод, что рекомбинантный белок TNF-BD вируса нату-
ральной оспы является перспективным для разработки
нового поколения TNF-антагонистов. Этот белок может
служить модельным объектом для изучения взаимо-
действия вирусных белков с компонентами иммунной
системы
организма человека. Методами делеционного
анализа
и мутагенеза, рентгеноструктурного анализа,
компьютерного моделирования возможно идентифициро-
вать в структуре белка TNF-BD аминокислотные остатки,
осуществляющие взаимодействие с TNF и составляющие
конкуренцию клеточным рецепторам.
Conflict of interest
The authors declare no conflict of interest.
References
Непомнящих Т.С., Трегубчак Т.В., Якубицкий С.Н., Таранов О.С.,
Максютов Р.А., Щелкунов С.Н. Кандидатные антиревматиче-
ские плазмидные конструкции обладают низкой иммуноген-
ностью. Вавиловский журнал генетики и селекции. 2017;21(3):
317-322. DOI 10.18699/VJ17.249.
[Nepomnyashchikh T.S., Tregubchak T.V., Yakubitskiy S.N., Taranov
О.S., Maksyutov R.A., Shchelkunov S.N. Candidate antirheumatic
genotherapeutic plasmid constructions have low immunogenicity.
Vavilovskii Zhurnal Genetiki i Selektsii = Vavilov Journal
of Genetics and Breeding. 2017;21(3):317-322. DOI 10.18699/
VJ17.249. (in Russian)]
Трегубчак Т.В., Шеховцов С.В., Непомнящих Т.С., Пельтек С.Е.,
Колчанов Н.А., Щелкунов С.Н. TNF-связывающий домен белка
VARV-CrmB, синтезированный в клетках Escherichia coli, эф-
фективно взаимодействует с TNF человека. Докл. Акад. наук.
2015;462(4):488-492. DOI 10.7868/S0869565215160276.
[Tregubchak T.V., Shekhovtsov S.V., Nepomnyashchikh T.S., Peltek
S.E., Kolchanov N.A., Shchelkunov S.N. TNF-binding domain
of the variola virus CrmB protein synthesized in Escherichia coli
cells effectively interacts with human TNF. Dokl. Biochem. Biophys.
2015;462(1):176-180. DOI 10.1134/S1607672915030102.]
Цырендоржиев Д.Д., Орловская И.А., Сенников С.В., Трегуб-
чак Т.В., Гилева И.П., Цырендоржиева М.Д., Щелкунов С.Н.
Биологические эффекты индивидуально синтезированного
TNF-связывающего домена CrmB вируса натуральной оспы.
Бюл. эксп. биол. мед. 2014;157(2):214-217.
[Tsyrendorzhiev D.D., Orlovskaya I.A., Sennikov S.V., Tregubchak
T.V., Gileva I.P., Tsyrendorzhieva M.D., Shchelkunov S.N. Biological
effects of individually synthesized TNF-binding domain of variola
virus CrmB protein. Bulletin of Experimental Biology and Medicine.
2014;157(2):249-252. DOI 10.1007/s10517-014-2537-6.]
Alejo A., Ruiz-Arguello M.B., Ho Y., Smith V.P., Saraiva M., Alcami
A. A chemokine-binding domain in the tumor necrosis factor
receptor from variola (smallpox) virus. Proc. Natl. Acad. Sci. USA.
2006;103:5995-6000.
Bradford M.M. A rapid and sensitive method for the quantitation of
microgram quantities of protein utilizing the principle of protein-dye
binding. Anal. Biochem. 1976;72:248-254.
Chen D.Y., Chen Y.M., Tsai W.C., Tseng J.C., Chen Y.H., Hsieh C.W.,
Hung W.T., Lan J.L. Significant associations of antidrug antibody
levels with serum drug trough levels and therapeutic response
of adalimumab and etanercept treatment in rheumatoid arthritis.
Ann. Rheum. Dis. 2015;74(3):e16. DOI 10.1136/annrheumdis-
2013-203893.
Efron P.A., Mohr A.M., Moore F.F., Moldawer L.L. The future of
murine sepsis and trauma research models. J. Leukoc. Biol. 2015;
98(6):945-952. DOI 10.1189/jlb.5MR0315-127R.
Eng G.P., Bendtzen K., Bliddal H., Stoltenberg M., Szkudlarek M.,
Fana V., Lindegaard H.M., Omerovic E., Hojgaard P., Jensen E.K.,
Bouchelouche P.N. Antibodies to infliximab and adalimumab in
patients with rheumatoid arthritis in clinical remission: a cross-sectional
study. Arthritis. 2015;784825. DOI 10.1155/2015/784825.
Fei Y., Wang W., Kwiecinski J., Josefsson E., Pullerits R., Jonsson I.- M.,
Magnusson M., Jin T. The combination of a tumor necrosis factor
inhibitor and antibiotic alleviates staphylococcal arthritis and sepsis
in mice. J. Infeсt. Dis. 2011;204(3):348-357. DOI 10.1093/infdis/
jir266.
Gileva I.P., Nepomnyashikh T.S., Antonets D.V., Lebedev L.R., Kochneva
G.V., Grazhdantseva A.V., Shchelkunov S.N. Properties of the
recombinant TNF binding proteins from variola, monkepox and
cowpox viruses are different. Biochem. Biophphys. Acta. 2006;
1764:1710-1718.
Laemmli U.K. Cleavage of structural proteins during the assembly of
the head of bacteriofage T4. Nature. 1970;227:680-685.
Lamping N., Detter R., Schroder N.W., Pfeil D., Hallatschek W., Burger
R., Schumann R.R. LPS-binding protein protects mice from septic
shock caused by LPS or sram-negative bacteria. J. Clin. Invest.
1998;101(10):2065-2071.
Leturcq D.J., Moriarty A.M., Talbott G., Winn R.K., Martin T.R., Ulevitch
R.J. Therapeutic strategies to block LPS interactions with its
receptor. Prog. Clin. Biol. Res. 1995;392:473-477.
Mandel M., Higa A. Calcium-dependent bacteriophage DNA infection.
J. Mol. Biol. 1970;53:159-162.
Monaco C., Nanchahal J., Taylor P., Feldmann M. Anty-TNF therapy:
past, present and future. Int. Immunol. 2015;27(1):55-62. DOI
10.1093/intimm/dxu107.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory
Manual. 2nd. edn. Cold Spring Harbor, New York: Cold Spring
Harbor Laboratory Press, 1989.
Seymour C.W., Rosengart M.R. Septic shock: advances in diagnoses
and treatment. JAMA. 2015;314(7):708-717. DOI 10.1001/jama.
2015.7885.
Shchelkunova G.A., Shchelkunov S.N. Immunomodulating drugs based
on poxviral proteins. BioDrugs. 2016;30(1):9-16. DOI 10.1007/
s40259-016-0158-5.
Stortz J.A., Raymond S.L., Mira J.C., Moldawer L.L., Mohr A.M.,
Efron P.A. Murine models of sepsis and trauma: Can we bridge the
gap? ILAR J. 2017;58(1):90-105. DOI 10.1093./ilar/ilx007.
Thayer A. Centocor stops sales, trails or flagship drug. Chem. Eng.
News. 1993;71(4):6. DOI 10.1021/cen-v71n004.p006.
Acknowledgments
This work was supported by State Budgeted Project 0324-2019-0041 for ICG and the Russian Foundation for Basic Research, project
18-04-00022A. The authors are grateful to T.B. Tregubchak for providing plasmid pQE60-TNF-BD.
Contributor Information
И.П. Гилева,
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
С.Н. Якубицкий,
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
И.В. Колосова,
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
С.Н. Щелкунов,
Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, р. п. Кольцово, Новосибирская область, Россия,
Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия,
Белки — ООО Аналитек
Технология разделения белков UPLC и HPLC колонки
Разработка и успех коммерциализации биопрепаратов и диагностических реагентов на основе белков часто зависит от способности адекватно характеризовать эти сложные биомолекулы. Waters ACQUITY®XBridge™ BEh400 C4 колонки для обращеннофазной хроматографии и методы, разработанные для них, могут помочь вам улучшить ваше разделение белков и охарактеризовать сложности.
XBridge BEh400 C4 обращеннофазные HPLC колонки.
Широкие поры Ethyl Bridged Hybrid (ВЕН) на основе 3,5 мкм частиц с С4 лиганд хорошо подходят для HPLC на основе белковых и полипептидных характеристик.
Колонки XBridge Protein BEH SEC 3,5 мкм
SEC-колонки для ВЭЖХ содержат в своей основе такую же технологию гибридных частиц с этиленовым мостиком (BEH) и стабильной связью с диолом от компании Waters, что позволяет получать результаты исключительного качества по сравнению с традиционными предложениями для SEC на основе 100%-го силикагеля.
Особенности:
— Гель-фильтрационное разделение белков с молекулярной массой от 10 до 1500 кДа с повышенной пропускной способностью.
— Непревзойденный срок службы SEC-колонок для снижения затрат на анализ одного образца.
— Комплексный контроль для обеспечения беспрецедентной идентичности колонок и повышенной уверенности при использовании утвержденных методов.
— Дополнительные колонки ACQUITY для SEC на основе СВЭЖХ, служащие для беспроблемного переноса методов в зависимости от нужд сферы применения.
Колонки Protein-Pak для HPLC и UHPLS
Анализ и выделение белков или полипептидов в лабораторных масштабах. ЖХ-колонки Protein-Pak содержат качественные химические среды для колонок на основе оксида кремния или метакрилата, а также среды ионного обмена, гель-фильтрационной хроматографии гидрофобного взаимодействия и аффинной хроматографии для разделения, очистки в лабораторных масштабах и определения белков и других молекул биологического происхождения.
Линейка колонок Protein-Pak для ВЭЖХ и СВЭЖХ включает:
— Колонки для HIC высокого разрешения.
— Колонки для ионного обмена (IEX) высокого разрешения.
— Стеклянные колонки для ионного обмена.
— Колонки для аффинной хроматографии с эпоксиактивированным адсорбентом.
Лаборатория терапевтических белков и антител
Работы по конструированию потенциально терапевтических рекомбинантных белков и антител, включая противораковые белки, противовирусные и антицитокиновые антитела.
Лаборатория работает над разработкой пептидных и белковых противораковых препаратов нового поколения. По оценкам Всемирной организации здравоохранения онкологические заболевания к 2020 г. выйдут на первое место в мире по смертности в структуре всех заболеваний, обогнав при этом «традиционного лидера» – сердечно-сосудистые заболевания. В настоящее время схемы лечения злокачественных опухолей в основном используют хирургические методы и химиотерапию по отдельности или в комбинации. К сожалению, ряд опухолей не поддается хирургическому устранения, а имеющиеся препараты для химиотерапии при их высокой токсичности эффективны не во всех случаях. Кроме того, при развитии синдрома множественной лекарственной устойчивости рецидив заболевания протекает в более тяжелой и зачастую неизлечимой форме. Поэтому актуальным является поиск новых малотоксичных противоопухолевых препаратов, обеспечивающих высокую избирательность и эффективность лечения. Следует отметить, что любой новый препарат, отвечающим этим требованиям, дает неоспоримые конкурентные преимущества его разработчикам. Этим требованиям – специфичности действия и отличающимся от традиционных противоопухолевых препаратов механизмам действия – удовлетворяют терапевтические антитела и пептиды, изучение которых лежат в основе деятельности Лаборатории терапевтических белков и антител.
В настоящее время одним из активно развивающихся направлений противораковой терапии является создание противоопухолевых препаратов на основе природных белков и пептидов, способных вызывать апоптотическую гибель раковых клеток и селективно подавлять рост опухоли. Такие проапоптотические белки и пептиды, как цитокины семейства фактора некроза опухолей (Mahalingam et al., 2011; Dimberg et al., 2013; Prasad et al., 2014), интерфероны (George et al., 2012), интерлейкин-24 (Tian et al., 2012), некоторые вирусные белки (апоптин – неструктурный белок вируса анемии цыплят, белок NS1 парвовируса грызунов, белок E4orf4 человека) (Argiris et al., 2011; Backendorf & Noteborn, 2014), рибонуклеазы (онконаза – рибонуклеаза из лягушки леопардовой Rana pipiens, бактериальные рибонуклеазы биназа и барназа) (Fang & Ng, 2011; Smolewski et al., 2014), кротамин – пептид из яда каскавеллы Crotalus durissus (Hayashi et al., 2012), белки и пептиды молока (Barbana et al., 2011; Gibbons et al., 2011; Koval et al., 2014) являются основой противоопухолевых лекарственных средств, которые внедряются в клиническую практику или проходят различные этапы доклинических и клинических испытаний. Препараты на основе антител, такие, как Мабтера, Герцептин, Авастин, обладающие высокой специфичностью к клеточным мишеням, активно применяются в клинике и открывают перспективы создания персонализированных противораковых препаратов.
Ранее в Институте химической биологии и фундаментальной медицины СО РАН (ИХБФМ СО РАН) из молока человека был выделен и охарактеризован белок лактаптин – протеолитический фрагмент каппа-казеина, способный индуцировать апоптотическую гибель раковых клеток (Некипелая и др., 2008; Власов и др., 2008). Был получен штамм-продуцент E. coli, синтезирующий рекомбинантный аналог природного пептида, также обладающий способностью индуцировать апоптоз раковых клеток человека в культуре и тормозить рост и метастазирование опухолей животных и человека в модели ксенографтов (Тикунова и др., 2010; Semenov et al., 2010; Koval et al., 2012; Коваль и др., 2012; Koval et al., 2014). На основе полученного рекомбинантного пептида создан новый противоопухолевый препарат «Лактаптин» и проведены его доклинические исследования. Однако, лактаптин, как и другие белковые терапевтические препараты, имеет существенный недостаток – он равномерно распределяется по органам и тканям, что уменьшает его концентрацию в опухоли-мишени и, соответственно, снижает эффективность противоопухолевого действия.
Повысить противоопухолевую эффективность терапевтических белков можно за счет адресной доставки препарата к клеткам опухоли. Адресный подход реализуется, например, при разработке противораковых препаратов на основе моноклональных антител или их фрагментов, имеющих специфичность к антигенам раковых клеток, а также лигандов опухолеспецифических рецепторов. Кроме того, сотрудники ИХБФМ СО РАН имеют большой опыт в разработке полноразмерных рекомбинантных антител. В частности, сконструированы полноразмерные антитела против цитокинов человека, разработаны противовирусные антитела (Levanov et al., 2010; Tikunova et al., 2012; Baykov et al, 2014; Леванов и др., 2010; Хлусевич и др., 2014). В настоящее время завершаются доклинические испытания гуманизированного антитела против вируса клещевого энцефалита.
НИК «НаноБио» — Лаборатория молекулярной биологии нуклеотид-связывающих белков
Лаборатория молекулярной биологии нуклеотид-связывающих белков была создана в 2014 году в рамках выполнения работ по соглашению № 14-34-00023 от 11.09.2014 между Российским научным фондом, Санкт-Петербургским государственным политехническим университетом и Ходорковским Михаилом Алексеевичем, руководителем поддержанного проекта «Исследование механизмов и динамики нуклеотид-связывающих белков: от бактерий до человека».
Заведующий лабораторией — Михаил Алексеевич Ходорковский.
Проект «Исследование механизмов и динамики нуклеотид-связывающих белков: от бактерий до человека» направлен на решение одной из актуальных проблем биологии: исследование механизмов и динамики взаимодействия различных белков с ДНК, РНК, АТФ и другими нуклеотидами, как с помощью современных экспериментальных биохимических и биофизических методов (малоуглового рассеяния нейтронов, масс- и КД-спектроскопии, оптического захвата, субдифракционной флуоресцентной микроскопии, спектрофотометрии, спектрофлюоромметрии и др.) так и с помощью теоретических методов молекулярного моделирования и молекулярной динамики. Исследуемые нами белки (RecA, RecX, DinI, FtsZ, TIP49A/B, белки рибосом участвующие в процессе транслокации мРНК) вовлечены во многие важнейшие процессы жизнедеятельности живых клеток про- и эукариот, такие как структурные перестройки хроматина во время репарации ДНК, регуляция транскрипции, поддержание стабильности генома, биогенез белков, формирование и поддержание теломер, делении клеток, трансляции и многих других. Несмотря на свое большое разнообразие белки исследуемого нами набора обладают одним общим свойством – свойством взаимодейстия с ДНК, РНК, АТФ и другими нуклеотидами.
Исследование механизмов и динамики взаимодействия белка RecA E. coli и D. radiodurans с ДНК, а также регуляции этого процесса вспомогательными белками RecX, SSB и DinI биохимическими, оптическими и одномолекулярными биофизическими методами;
Исследование динамики и механизмов регуляции структур, формируемых белком FtsZ в клетках бактерий при помощи генноинженерных методов и субдифракционной микроскопии;
Изучение взаимодействий между компонентами макромолекулярного рибонуклеопротеинового рибосомного комплекса в процессе трансляции с использованием биохимических и одномолекулярных биофизических методов;
Установление связи между структурой и функцией жизненно важных белков семейства TIP49 и исследовании молекулярных механизмов их действия.
Петухов Михаил Геннадьевич
Коневега Андрей Леонидович
Байтин Дмитрий Михайлович
Побегалов Георгий Евгеньевич
За время проекта был достигнут значительный прогресс в понимании механизмов работы изучаемых белков, а часть из этих результатов смо-гут конвертироваться в потенциально перспективные терапевтические агенты.
Одной из таких мишеней, по которой получены многообещающие результаты, является белок RecA, центральный фермент рекомбинационной репарации, функционально задействованный в общей резистентно-сти патогенных для человека бактерий.
Многообещающим результатом проекта является разработка и создание пептида-ингибитора активности этого белка, блокирующего SOS-ответ у бактерий. Исследования взаимодействия RecA с другими бактериальными белками и ДНК ингибирующие свойства этого пептида были изучены с помощью широкого набора биохимических методов, методов оптической флюоресцентной микроскопии, оптической спектроскопии поглощения и флюоресценции, спектроскопии кругового дихроизма и одномолекулярных методов с использованием оптической ловушки. Исходя из результатов исследования и модели формирования пептида ингибитора, на основе фрагмента белка RecX в 2016 году была подготовлена и подана заявка на изобретение на семейство пептидов – ингибиторов (около 17 000 соединений) активности белка RecA, блокирующих SOS-ответ у бактерий. Поскольку система бактериального SOS-ответа является основным механизмом адаптации бактерий к антибиотикам, этот результат открывает возможность решения одной из мировых проблем в современной медицине – создания нового поколения антибиотиков, к которым бактерии не смогут вырабатывать резистентность.
Важный результат также получен относительно свойств RecA бактерии Deinococcus radiodurans, проявляющей чрезвычайную эффективность системы репарации, что может быть использовано для создания эффективных биотехнологических штаммов микроорганизмов для обезвреживания радиоактивных отходов и, соответственно, улучшению среды обитания человека. Методом оптического захвата показано, что это свойство обеспечено существенно более быстрым построением филамента RecADr на двунитевой ДНК по сравнению с RecAEc.
Еще одной важной мишенью является белок TIP49. В рамках проекта проведено всесторонне исследование этого белка, используя биохимиче-ские и одномолекулярные методы, и методы молекулярного моделирования и молекулярной динамики.
Для выполнения этих исследований была разработана специализированная обновленная и ускоренная версия алгоритма SEQOPT предназначенного для глобальной оптимизации аминокислотных последовательностей альфа-спиралей белков. С помощью этой версии была восстановлена полноатомная модель смешанного додекамерного комплекса TIP49a/b и проанализированы интерфейсы додекамеризации. Был также разработан AquaBridge новый метод поиска всех возможных конформаций тесно-связанной (структурной) воды в АЦ репрезентативного набора АТФаз для использования в коммерчески доступном программном пакете моле-кулярного моделирования ICM-Pro. С помощью этого метода получены новые данные об ориентации литической воды в атакующей позиции, необходимой для протекания гидролиза АТФ в белковых комплексах TIP49.
Предложен новый молекулярный механизм аллостерического влияния ДНК на АТФазную активность TIP49 и получен первый практически важный результат. В совместной работе с нашими коллегами из Гарвардского университета (США) и Университета Поля Сабатье (Франция) бы-ли разработаны и экспериментально протестированы несколько новых низкомолекулярных ингибиторов белков семейства TIP49, обладающих антираковой активностью на нескольких раковых клеточных линиях. Продолжение этой работы позволит не только разработать новые эффективные методы конструирования высокоэффективных лигандов белков, но и создать новые лекарственные средства для онкологических заболеваний.
Другой перспективной мишенью для новых антибактериальных препаратов является белок FtsZ, ключевой элемент аппарата деления прокариот. За период выполнения проекта нам удалось значительно продвинуться в понимании механизмов функционирования и регуляции этого важного элемента бактериальной клетки. Так, использование флуоресцентной микроскопии сверхвысокого разрешения позволило разрешить Z-кольцо – центральную структуру, формируемую белком FtsZ – с недостижимым прежде разрешением (около 20 нм), в результате был сделан вывод о меньшей толщине Z-кольца, чем считалось прежде. Более того, впервые было показано, что Z-кольцо утолщается в процессе сокращения.
Наряду с изучением структур FtsZ в нормально делящихся бактериях, в данной работе исследовалось влияние на FtsZ факторов, блокирующих деление бактериальной клетки, например, состояния SOS-ответа. Как отмечено выше, SOS-ответ является одним из главных механизмов формирования устойчивости бактерий к антибиотикам. Как активация SOS-ответа, так и выживание клеток после него сопряжены с регуляцией FtsZ: при активации SOS-ответа происходит блокирование FtsZ, по окончании данного состояния FtsZ восстанавливает свою активность, которая критически необходима для выживания клетки. Таким образом, создание ингибиторов FtsZ позволит блокировать как само состояние SOS-ответа, так и процесс выхода из него. В ходе выполнения проекта нам удалось получить важные сведения о механизмах, отвечающих за блокирование FtsZ при наступлении SOS-ответа, а также обеспечивающих правильное позиционирование Z-колец при восстановлении деления. Однако для лучшего понимания о месте и роли FtsZ в данном состоянии требуются дальнейшие исследования.
Кроме изучения механизмов работы белка FtsZ E.coli, в настоящем проекте был дан старт исследованиям FtsZ некоторых видов микоплазм, серьёзных патогенов человека, животных и растений, о механизмах деления которых пока практически ничего неизвестно. Предварительные данные об активности этих белков выглядят многообещающими, продолжение этого направления исследований может привести к прорыву в данной области знаний. В целом стоит отметить, что новые данные о механизмах деления бактерий, в особенности о белке FtsZ, полученные в ходе выполнения проекта, позволяют лучше понять динамические процессы, происходящие в ходе деления бактерий, и должны помочь в создании новых препаратов, на-прямую блокирующих ключевой белок FtsZ. Дальнейшие работы должны помочь существенно продвинуться в этом направлении.
Были разработаны методики получения отдельных компонентов трансляционной системы из термофильных бактерий Thermus thermophilus. Поставлены и оптимизированы методики, позволяющие собирать как гомогенные, так и гетерогенные системы для изучения отдельных реакций цикла элонгации in vitro, состоящие из термофильных (T. thermophilus) и мезофильных (E. coli) компонентов трансляционной ма-шины. Были разработаны методики, позволяющие сайт-специфично вводить одну или две флуоресцентные метки в молекулы нативных тРНК и транскриптов тРНК, модифицированных по определенным положениям.
Впервые в мире с использованием флуоресцентных меток при помощи спектрофлуориметра остановленного потока были получены данные о престационарной кинетике отдельных реакций цикла элонгации (А-сайтовое взаимодействие аминоацил-тРНК с рибосомами, транслокация, катализируемая элонгационным фактором EF-G, взаимодействие деацилированной тРНК с выходным (Е) сайтом 70S рибосом) с использованием компонентов термофильной системы (рибосомы, EF-Tu, EF-G). Для отдельных реакций были проанализированы концентрационные и температурные зависимости, а также оценено влияние ряда антибиотиков. В частности, добавление антибиотика тетрациклина приводило к кинетическому ингибированию реакции связывания в А сайте, а среди характерных механизмов ингибирования транслокации следует отметить рассинхронизацию движения тРНК (физического перемещения акцепторного конца и угла L-образной структуры тРНК). Дополнительно было показано, что виомицин и паромомицин модифицируют термодинамический профиль реакции транслокации на рибосоме и смещают равновесие в сторону претранслокационного состояния при отсутствии элонгационного фактора EF-G и гидролиза GTP.
Для измерения силы взаимодействия мРНК-рибосома использовались одномолекулярные методы на основе оптической ловушки и акустической cиловой спектроскопии. Измеренная сила, необходимая для разрыва взаимодействия мРНК-рибосома составила 14pN для рибосомного комплекса, содержащего инициаторную fMet-тРНКfMet в Р сайте.
Была определена специфичность бактериальной дигидроуридинсинтазы DusC и построены полноатомные модели комплексов белка DusC с триптофановой тРНК. Методами молекулярного моделирования были найдены разные конформации, при которых уридины в определенных положениях оказывались в активном центре белка DusC, и при этом имелось достаточное количество контактов для образования комплекса. При помощи моделирования молекулярной динамики были построены траекто-рии для ряда комплексов и произведена оценка их стабильности.
Байтин Д.М., Бахланова И.В., Петухов М.Г., Побегалов Г.Е., Ходорковский М.А., Якимов А.П., Семейство пептидов — ингибиторов активностей белка RecA, блокирующих SOS-ответ у бактерий, уведомление о поступлении заявки о выдаче патента РФ № 2016127595 от 08.07.2016
Basic Protein — обзор
I СТРУКТУРА ОСНОВНОГО БЕЛКА
Основные белки бычьего (Eylar et al ., 1971; Brostoff et al ., 1974b) и человеческого (Carnegie, 1971) миелина ЦНС имеют был полностью упорядочен. Определение частичной последовательности и аминокислотный анализ триптических пептидов других основных белков млекопитающих (Shapira et al ., 1971; Martenson et al ., 1971a; Kornguth et al ., 1972; Brostoff & Eylar, 1972; Martenson и др. ., 1972) показали, что, за одним заметным исключением (см. Ниже), первичных структур этих белков очень похожи на структуру бычьего или человеческого белка. На рис. 1 последовательность бычьего основного белка проиллюстрирована с точки зрения положений (1) остатков, заряженных при нейтральном pH, (2) остатков, которые являются гидрофобными или слабо гидрофильными (отрицательно гидрофобными), (3) гистидиловых остатков, и (4) пролильных остатков. Все заряженные остатки сильно гидрофильны и неизменно находятся на поверхности белка.Шкала гидрофобности показывает относительную тенденцию каждого остатка избегать водной среды и располагаться в неполярной области (внутренней части) белка. Слабогидрофильные остатки (Gln, Asn, Ser), слабогидрофобные остатки Thr и His и сильно гидрофобные остатки Tyr и Trp могут участвовать в водородном связывании. Гистидиловые остатки могут быть либо сильно гидрофильными (заряженными), либо слабогидрофобными (незаряженными) в зависимости от их точного расположения в белке и, как следствие, значений имидазолила pK a . Пролиловые остатки завершают α-спиральные сегменты полипептидной цепи (если такие сегменты присутствуют) и меняют ее направление. Четыре остатка в основном белке подвергаются модификации in vivo : Ala-1 ацетилирован, Arg-106 частично метилирован, а Thr-97 и Ser-164 частично фосфорилированы. Особый интерес представляет последовательность трипролина (остатки 98–100), которая может вызвать разворот пептидной цепи (Hagopian et al ., 1971), частое появление заряженных остатков, а также высокогидрофобных остатков. в тандеме низкая гидрофобность области между остатками 43 и 85 и высокая концентрация лизила и низкая концентрация аргинильных остатков в C-концевой области между Trp-115 и Gly-156.В меньшем из двух основных белков крысы ( S-белок крысы) область между Trp-115 и Gly-156 отсутствует. Ряд отличительных особенностей этой последовательности будет подробно рассмотрен ниже.
Рис. 1. Аминокислотная последовательность основного белка бычьего миелина, иллюстрирующая распределение остатков в соответствии с их гидрофобным (положительное направление) или гидрофильным (отрицательное направление) характером. Незаштрихованные полосы обозначают гистидильные остатки, которые могут быть либо слабо гидрофобными (незаряженными), либо сильно гидрофильными (заряженными).Заряженным остаткам даются стандартные однобуквенные обозначения: Arg, R; Lys, К; Клей; Asp, D. Пролильные остатки показаны сплошными кружками; остатки глицила, не имеющие боковой цепи, выглядят как пробелы. Показаны положения метильной (Me) и фосфатной (P) групп, а также области, удаленной в S-белке крысы. Относительная гидрофобность согласно Nozaki & amp; Танфорд (1971) следующие: Джин и Сер, −3; Asn, −2; Его (незаряженный) и Ала, +5; Met, +13; Вал, +15; Лей и Иль, +18; Тюр, +23; Phe, +25; Трп, +34.В соответствии с этим представлением можно идентифицировать все остатки, за исключением пар Ser, Gin и Leu, Ile.
За исключением относительно коротких последовательностей, кажется, нет очевидной регулярности в расположении остатков какого-либо конкретного типа. Фактически, нерегулярная, но явно специфическая линейная последовательность аминокислот сама по себе, по-видимому, не имеет никакого смысла с точки зрения функции белка in vivo , если линейная последовательность не была преобразована в какую-то трехмерную структуру. .Ряд исследований показал, что изолированный основной белок в водном растворе при нейтральном или близком к нейтральному pH имеет небольшую, если вообще имеет, уникальную вторичную или третичную структуру и, по-видимому, сильно разупорядочен и расширен (Palmer & Dawson, 1969; Eylar & Томпсон, 1969; Оширо и Эйлар, 1970; Чао и Эйнштейн, 1970; Энтони и Москарелло, 1971; Кригбаум и Хсу, 1975; Либес и др. ., 1975; Джонс и Рамсби, 1975). В этом отношении выделенный основной белок миелина очень похож на другой основной белок, цитохром с, после того, как его гемовая группа была химически удалена.Апо-цитохром c имеет сильно дезорганизованную конформацию «случайной спирали» (Stellwagen et al. ., 1972; Fisher et al. ., 1973). Нативный цитохром c, напротив, представляет собой компактный глобулярный белок с очень высокой степенью вторичной и третичной структуры (Dickerson et al ., 1971). Какие бы конформационные детерминанты ни существовали в коротких отрезках полипептидной цепи апо-цитохрома c, их потенциал, по-видимому, не может быть выражен до тех пор, пока дальнодействующие взаимодействия между различными последовательностями в белке не будут индуцированы специфическим ковалентным связыванием гема (Fisher et al ., 1973). По аналогии, похоже, не было бы оснований для a priori предполагать, что конформация основного белка после специфического взаимодействия с другими составляющими миелина in vivo не будет компактной и высокоструктурированной, хотя и не обязательно спиральной. Фактически, некоторая структура, очевидно спиральная, вводится в основной белок, когда он связывается с додецилсульфатом натрия (SDS) или липидами, которые являются кислотными или цвиттерионными (Palmer & Dawson, 1969; Anthony & Moscarello, 1971; Liebes et al. ., 1976; Moore и др. ., 1976). Epand et al. (1974) исследовали основные белковые молекулы с помощью электронной микроскопии. Образцы, которые были растворены в водном растворе при pH 7,4 перед подготовкой к микроскопии, выглядели как компактные скрученные частицы в форме стержня с размерами примерно 13 × 130 Å.
Границы | Создание основного белка миелина — из транспорта мРНК в локализованную трансляцию
Основной миелиновый белок
В центральной нервной системе (ЦНС) олигодендроциты производят и поддерживают миелин.Изолирующая многослойная миелиновая оболочка улучшает нейронную коммуникацию за счет увеличения скорости распространения импульсов в аксонах нейронов при одновременном ограничении потребности в энергии. Также становится все более очевидным, что олигодендроциты обеспечивают трофическую поддержку аксонов нейронов, что важно для выживания и целостности аксонов (Funfschilling et al., 2012; Lee et al., 2012). Недостаток или нарушение целостного миелина связано с несколькими неврологическими расстройствами, включая рассеянный склероз и наследственные лейкодистрофии.
Одним из основных компонентов миелина ЦНС является основной белок миелина (MBP; Jahn et al., 2009), который называют «исполнительной молекулой миелина» (Boggs, 2006). Мыши Shiverer ( shi ), а также крысы long evans shaker ( les ) лишены функционального MBP и характеризуются тяжелой гипомиелинизацией ЦНС, симптомами дрожи и преждевременной смертью (Readhead and Hood, 1990; Kwiecien et al. , 1998). Интересно, что компактный миелин может образовываться в периферической нервной системе обоих мутантных грызунов, что, по-видимому, зависит от компенсаторной функции белка P0, который не экспрессируется в ЦНС (Martini et al., 1995). Дефицит других белков миелина, таких как протеолипидный белок (PLP) и 2 ‘, 3′-циклический нуклеотид-3’-фосфодиэстераза (CNP), по-видимому, вызывает вторичные нейрональные эффекты, а не влияет на миелинизацию ЦНС как таковую (Klugmann et al., 1997; Griffiths et al., 1998; Lappe-Siefke et al., 2003).
Многофункциональные классические белки MBP возникают из генного комплекса под названием Golli (гены линии олигодендроцитов), который также дает начало семейству белков Golli (-MBP) (Campagnoni et al., 1993). Ген Golli имеет три разных сайта начала транскрипции, позволяющих экспрессировать два разных подсемейства белков, которые регулируются локально и во времени. В то время как присутствие классических белков MBP в основном ограничивается миелинизирующими клетками, белки Golli (-MBP) были описаны в других нервных и ненейральных клетках (Fulton et al., 2010). Различные изоформы MBP у мышей (14, 17,22, 17,24, 18,5, 20,2 и 21,5 кДа) в основном происходят из сайта старта транскрипции 3 и образуются путем дифференциального сплайсинга (Harauz and Boggs, 2013).Все классические изоформы MBP кодируются экзонами I, III, IV и VII, тогда как экзоны II, V и VI встречаются только в определенных вариантах сплайсинга.
Интересно, что разные изоформы регулируются в процессе развития и имеют разное клеточное распределение. Изоформы, содержащие экзон II (17,22, 20,2 и 21,5 кДа), экспрессируются на высоких уровнях в раннем развитии, распространяются по цитоплазме, а также накапливаются в ядре (Allinquant et al., 1991; Smith et al., 2013). Ядерный MBP 21,5 кДа, по-видимому, влияет на пролиферацию иммортализованных олигодендроглиальных клеток N19 и стимулирует морфологические изменения в совместно культивируемых нейрональных клетках N2a (Smith et al., 2013). MBP, содержащие экзон II, также были обнаружены в компактном миелине, но, по-видимому, они обогащены радиальным компонентом миелина (Karthigasan et al., 1996).
Изоформы MBP, лишенные экзона II, локализуются на плазматической мембране (Allinquant et al., 1991). Из-за своего положительного заряда MBP связывается с отрицательно заряженными олигодендроглиальными фосфолипидами и традиционно считается, что он действует в первую очередь в уплотнении миелиновых мембран. На мышах и рыбках данио было показано, что фосфатидилинозитол-4,5-бисфосфат (PIP2) рекрутирует МВР на плазматическую мембрану и что этому взаимодействию можно противодействовать повышенными уровнями кальция (Nawaz et al., 2009, 2013). Функция MBPs в уплотнении миелина за счет мембранной ассоциации, очевидно, очень важна, но этой молекуле были приписаны дополнительные функции, которые могут объяснять радикальные фенотипы, наблюдаемые в ее отсутствие.
Недавно было показано, что белок MBP участвует в регуляции соотношения белков и липидов миелиновых мембран, действуя как молекулярное сито и ингибируя диффузию мембранных белков с большими цитозольными доменами в листы миелиновых мембран (Aggarwal et al., 2011). В этих развивающихся мембранных листах MBP, по-видимому, олигомеризуется в связную белковую сеть, которая вытесняет другие миелиновые белки, такие как миелин-ассоциированный гликопротеин (MAG) или CNP, из слоя с образованием богатой липидами изолирующей миелиновой мембраны с небольшим количеством оставшихся белков, в основном PLP и MBP (Aggarwal et al., 2013).
Также было продемонстрировано, что MBP взаимодействует с белками цитоскелета и влияет на их связывание и полимеризацию (Dyer et al., 1994; Hill and Harauz, 2005; Hill et al., 2005).
В дополнение к этим структурным задачам, MBP был связан с сигнальными путями. MBP обладает способностью связывать сигнальные молекулы, такие как киназа Fyn, которая важна для морфологической дифференцировки и миелинизации (Kramer-Albers and White, 2011; Smith et al., 2012). Более того, связывание MBP с плазматической мембраной модулирует управляемые напряжением каналы Ca 2 + (VOCC) и тем самым влияет на ответы Ca 2 + в клетке (Smith et al., 2011).
Отдельные функции, а также их регуляция посттрансляционными модификациями подробно рассмотрены в других источниках (Boggs, 2006; Harauz et al., 2009; Harauz and Boggs, 2013) и подчеркивается, что MBP является важным белком для многих аспектов олигодендроцитов. гомеостаз и образование миелина. Здесь мы рассмотрим синтез MBP и сосредоточимся на посттранскрипционных событиях, включая транспорт мРНК и локализованную трансляцию.
Mbp мРНК локализована в транспортных гранулах РНК
Поскольку тридцать лет назад было обнаружено, что мРНК Mbp и рибосомы присутствуют во фракциях биохимически очищенного миелина, было высказано предположение, что мРНК Mbp и транспортируется в миелиновый компартмент, где трансляция происходит локально (Colman et al., 1982). Это исследование также продемонстрировало эффективность данной системы локализации. Было показано, что вновь синтезированный белок MBP может быть обнаружен во фракциях миелина уже через 2 мин после трансляции в активно миелинизирующем стволе мозга молодых крыс. После этого эксперименты по микроинъекции с меченой мРНК Mbp и выявили образование гранул для транспорта РНК, которые перемещаются по микротрубочкам по всей цитоплазме к дистальным частям отростков олигодендроцитов (Ainger et al., 1993; Carson et al., 1997).
Цитоплазматическая локализация мРНК была описана для многих мРНК и типов клеток (Shahbabian and Chartrand, 2012). Обычно различные связывающие РНК белки, называемые trans, -действующие факторы, связываются со специфическими нуклеотидными последовательностями в 3′-нетранслируемой области (UTR) мРНК, называемой цис--действующими факторами или элементами. Локализация мРНК может расширять контроль экспрессии клеточных генов в пространственно-временном режиме за счет ингибирования трансляции мРНК до тех пор, пока не будет достигнуто конкретное место в определенный момент времени.
Формирование гранул РНК, включая особый отбор транспортируемого груза, необходимо строго контролировать. Сообщалось, что члены семейства белков QKI влияют на ядерно-цитоплазматический транспорт, а также на стабилизацию мРНК Mbp и (Li et al., 2000; Larocque et al., 2002; Bockbrader and Feng, 2008; Wang et al. , 2010).
Цитоплазматический транспорт мРНК Mbp в значительной степени зависит от связывающего РНК белка, называемого гетерогенным ядерным рибонуклеопротеином (hnRNP) A2, который связывается со специфической последовательностью в 3’UTR (Hoek et al., 1998). Эта последовательность первоначально была названа сигналом транспорта РНК (RTS), состоящим из 21 нуклеотида (Ainger et al., 1997), и впоследствии было показано, что для связывания hnRNP A2 требуется только 11 нуклеотидов (GCCAAGGAGCC), которые называются ответным элементом A2 ( A2RE; Munro et al., 1999). Этот цис -действующий A2RE был идентифицирован в нескольких других мРНК, включая глиальный миелин-ассоциированный олигодендроцитарный основной белок ( Mobp ), Tau , карбоангидразу II ( CaII ), белок-предшественник амилоида ( App ), а также нейрональная кальций / кальмодулин-зависимая протеинкиназа IIα ( CamKIIα ), Neurogranin и регулируемый активностью белок, связанный с цитоскелетом ( Arc ; Barbarese et al., 1999; Гао и др., 2008).
Альтернативный сплайсинг пре-мРНК, кодируемой геном HnRNP A2 / B1 / B0 , приводит к синтезу четырех изоформ hnRNP B1, A2, B1b и A2b (Hatfield et al., 2002). В большинстве исследований, посвященных hnRNP A2 и мРНК Mbp , использовали антитела, которые не различают четыре изоформы в иммуноцитохимических экспериментах. Следовательно, сделанные выводы сосредоточены на наиболее распространенном белке hnRNP A2. Недавно было высказано предположение, что hnRNP A2b является преобладающей изоформой в цитоплазме нервных клеток и что образование гранул мРНК Mbp и , по-видимому, зависит от hnRNP A2b (Han et al., 2010). Возможно, описанные цитоплазматические функции hnRNP A2 в контексте локализации мРНК Mbp и , которую мы рассматриваем здесь, следует (в основном) отнести к hnRNP A2b и принять во внимание, когда мы говорим о hnRNP A2.
A2RE кодируется как часть экзона VII и, следовательно, присутствует в каждом варианте сплайсинга Мбит / с и . Следовательно, все мРНК Mbp и потенциально могут взаимодействовать с hnRNP A2 и гранулами РНК. Интересно, что было высказано предположение, что аналогично белку мРНК, содержащие экзон II, по-разному локализованы в олигодендроцитах.Кажется, что мРНК Mbp, содержащие экзон II и локализуются в теле клетки, тогда как мРНК без экзона II транспортируются в дистальные клеточные отростки (de Vries et al., 1997). Остается неясным, как последовательность экзона II влияет на субклеточное распределение мРНК Mbp и , кодирующих эти изоформы 17,22, 20,2 и 21,5 кДа.
В дополнение к A2RE мРНК Mbp содержит дополнительную цис -действующую последовательность в ее 3’UTR, называемую областью локализации РНК (RLR) (Ainger et al., 1997) или сигнала локализации РНК (RLS; Barbarese et al., 1999). Было высказано предположение, что вторичная структура этой последовательности необходима для специфической локализации мРНК Mbp и в миелиновом компартменте.
Недавно дополнительные РНК-связывающие белки были идентифицированы в гранулах мРНК размером Mbp (Raju et al., 2008; Laursen et al., 2011; White et al., 2012). И HnRNP K, и hnRNP F связаны с мРНК Mbp, и hnRNP A2 и влияют на синтез белка MBP (Laursen et al., 2011; White et al., 2012). Коиммунопреципитация hnRNP F с hnRNP A2 является устойчивой к РНКазе, тогда как совместная очистка hnRNP A2 с hnRNP K, по-видимому, зависит от РНК. Таким образом, hnRNP F, возможно, рекрутируется в гранулу РНК с помощью hnRNP A2, в то время как hnRNP K связывается с мРНК Mbp и непосредственно с еще неопределенной областью. Нокдаун hnRNP K, по-видимому, отменяет транспорт мРНК Mbp и от точек ветвления отростков к наиболее дистальным частям отростков олигодендроцитов и предполагает роль hnRNP K на этом этапе транспортного пути (Laursen et al., 2011). Более ранние исследования уже наблюдали олигодендроглиальные hnRNP K в гранулярных структурах в более проксимальных, а не дистальных частях отростков (Kosturko et al., 2005), но кажется, что клеточное распределение hnRNP K зависит от статуса дифференцировки олигодендроцитов. (Лаурсен и др., 2011).
В дополнение к hnRNP K и hnRNP F, hnRNP CBF-A типа A / B был идентифицирован в гранулах мРНК размером Mbp и . CBF-A связывается с RTS мРНК Mbp , коиммунопреципитирует с hnRNP A2, A3, а также U и нокдаун CBF-A в иммортализованной линии клеток-предшественников олигодендроцитов (OPC) Oli- neu ингибирует транспорт МРНК Mbp в отростки (Raju et al., 2008). Оказывается, что hnRNP K и CBF-A важны для разных частей пути транспорта от цитозоля к наиболее дистальным регионам процессов, но это нуждается в более детальном рассмотрении в будущем.
HnRNP F фосфорилируется по тирозину с помощью киназы Fyn (White et al., 2012), а hnRNP K, по-видимому, фосфорилируется по тирозину в олигодендроцитах, культивируемых на ламинине в течение 4 дней (Laursen et al., 2011). Хотя было показано, что ламинин стимулирует активность олигодендроглии Fyn и что Fyn взаимодействует с hnRNP K в ЦНС (Kai et al., 1997), остается показать, является ли hnRNP K целью Fyn. Влияние активации Fyn на трансляцию MBP обсуждается ниже.
Было высказано предположение, что мРНК Mbp и транспортируется по микротрубочкам в миелиновый компартмент и что для этого транспорта требуется кинезин, поскольку транслокация микроинъектированной мРНК Mbp в миелиновые листы культивируемых олигодендроцитов нарушается лекарствами, влияющими на динамику микротрубочек, или антисмысловыми действиями кинезина. Обработка РНК (Carson et al., 1997). Более того, олигодендроциты, происходящие от гипомиелинизированного мутанта крысы taiep , имеют аномально накопленные микротрубочки и обнаруживают ограниченный транспорт гранул мРНК Mbp (Song et al., 2003). Как показано на рыбках данио, кинезиновый моторный протеин Kif1b необходим для транспорта мРНК мРНК к процессам миелинизации олигодендроцитов, а мутанты Kif1b демонстрируют эктопическую локализацию белка MBP, а также смещенные миелиноподобные мембраны (Lyons et al., 2009). Ген сверхэкспрессии опухоли, ассоциированный с микротрубочками (TOG), колокализуется с мРНК Mbp и hnRNP A2 в гранулах и может участвовать в регуляции активности кинезина, тем самым направляя транспорт гранул к положительному концу микротрубочки (Kosturko et al., 2005 ).
Репрессия трансляции во время транспорта мРНК
Mbp
Было высказано предположение, что гранулы РНК содержат все необходимые молекулы для трансляции мРНК, и действительно, ряд соответствующих молекул был идентифицирован в гранулах мРНК размером Mbp и .К ним относятся аргинил-тРНК синтетаза (ATS), фактор элонгации 1a (EF1a) и рибосомная РНК (Barbarese et al., 1995). Если гранулы мРНК более или менее готовы к трансляции транспортируемых мРНК, то следует избегать преждевременной или эктопической трансляции до тех пор, пока определенные сигналы не приведут в действие механизм синтеза белка. Что касается мРНК Mbp, hnRNP E1 и малая некодирующая РНК 715 (sncRNA715) были напрямую связаны с ингибированием трансляции во время транспорта (Kosturko et al., 2006; Bauer et al., 2012), в то время как функция других молекул гранул, таких как hnRNP F, TOG и hnRNP K, в отношении контроля трансляции может иметь более косвенное влияние на путь синтеза MBP (Francone et al., 2007; Laursen et al., 2011; White et al., 2012).
HnRNP E1 частично колокализуется с hnRNP A2 и микроинъектированной A2RE-содержащей мРНК в олигодендроцитах (Kosturko et al., 2006). Кроме того, hnRNP E1 ингибирует трансляцию A2RE-содержащей Green флуоресцентного белка репортерной мРНК в микроинъектированных клетках нейробластомы B104 и в анализе in vitro на основе лизата ретикулоцитов кролика (Kosturko et al., 2006). Дополнительные эксперименты приводят к заключению, что hnRNP E1 рекрутируется в гранулы РНК с помощью hnRNP A2 и ингибирует трансляцию A2RE-содержащих мРНК во время транспорта (Kosturko et al., 2006).
В свете возрастающей важности посттранскрипционной регуляции генов небольшими молекулами РНК, такими как микроРНК или эндогенные миРНК, трансляционное ингибирование локализованных мРНК с помощью этих типов молекул, по-видимому, является подходящим механизмом, о котором сообщалось в нейронах (McNeill и Ван Вактор, 2012).Недавно было обнаружено, что sncRNA715 ингибирует синтез эндогенного MBP в первичных олигодендроцитах посредством связывания со специфическим сайтом узнавания в 3’UTR мРНК Mbp (Bauer et al., 2012). SncRNA715 коурифицируется с hnRNP A2 и мРНК биохимически и располагается в гранулярных структурах в цитоплазме и отростках культивируемых олигодендроцитов. Интересно, что анализ очагов хронического рассеянного склероза, содержащих OPCs и Mbp мРНК, но без белка MBP, выявил аномально высокие уровни sncRNA715 по сравнению с нормальным внешним видом белого вещества (NAWM; Bauer et al., 2012). Эти данные не только указывают на эволюционно консервативный механизм регуляции трансляции MBP, но также могут способствовать лучшему пониманию того, почему OPCs неспособны дифференцироваться надлежащим образом, чтобы ремиелинизировать аксоны на поздних стадиях MS.
Хотя еще неясно для hnRNP E1, sncRNA715, по-видимому, регулирует все изоформы MBP, поскольку связывающая последовательность присутствует во всех 3’UTR мРНК Mbp , и вестерн-блот-анализ выявил репрессию трансляции каждой изоформы (Bauer et al., 2012). Пока неизвестно, влияют ли hnRNP E1 и sncRNA715 синергетически на трансляцию MBP в олигодендроцитах, или действуют ли они в разные моменты времени или в разных клеточных местоположениях.
Концептуально можно выделить два аспекта репрессии трансляции мРНК Mbp. Поскольку мРНК Mbp может быть обнаружена в OPC, которые еще не синтезируют белок MBP, трансляция MBP обычно может репрессироваться в OPC до тех пор, пока не будет достигнута определенная степень дифференцировки, при которой определенные (аксональные) сигналы инициируют синтез белка MBP.В миелинизирующих олигодендроцитах синтез белка MBP может подавляться во время внутриклеточного транспорта, чтобы предотвратить эктопическую локализацию MBP, которая может иметь пагубные последствия из-за уплотнения внутриклеточных мембран (Staugaitis et al., 1990). Последнее также, по-видимому, очень важно для специфического аппарата синтеза, способного производить определенные количества миелина в ответ на аксональные детерминанты, такие как диаметр или активность аксона.
Ряд молекул участвует в транспорте мРНК Mbp и в олигодендроцитах, и предполагается, что они действуют в образовании гранул РНК, транспорте и ингибировании трансляции (суммировано в Таблице 1 и на Рисунке 1).Глубокое секвенирование РНК и продвинутая протеомика, скорее всего, в будущем определят дополнительные регуляторные молекулы.
ТАБЛИЦА 1. Молекулы, связанные с мРНК MBP во время цитоплазматической локализации, как указано в тексте.
РИСУНОК 1. Транспорт и локализованный перевод MBP. Mbp мРНК транспортируется по микротрубочкам к олигодендроглиальной плазматической мембране в гранулах РНК, содержащих РНК-связывающие белки, моторные белки и части (если не весь) аппарат синтеза белков.На плазматической мембране киназа Fyn является важной сигнальной молекулой и преобразует аксональные сигналы в локализованную трансляцию MBP. Подробности см. В тексте. MBP, основной белок миелина; A2, F, E1, K, гетерогенные ядерные рибонуклеопротеины A2, F, E1 и K; CBF-A, фактор связывания CArG-бокса A; TOG, ген сверхэкспрессии опухоли; mGluR, метаболический рецептор глутамата; NMDAR, рецептор NMDA; EF1a, коэффициент удлинения 1a; САР, аргинил-тРНК синтетаза; 60S / 40S, большая / малая рибосомная субъединица; 5’CAP, 5’7-метилгуанилат CAP; UTR, непереведенный регион; ААААА, Поли Хвост.
Трансляционная де-репрессия и локальный синтез MBP
Трансляционно ингибированные мРНК в гранулах РНК, как было показано, депрессируются, чтобы инициировать синтез белка в определенный момент времени или локализацию в клетках (Ostareck-Lederer et al., 2002; Huttelmaier et al., 2005).
Как упоминалось выше, олигодендроциты должны регулировать количество миелина, продуцируемого в определенных сегментах аксонов, и, поскольку эти количества могут варьироваться, по-видимому, дело в том, что по крайней мере части аппарата синтеза миелина децентрализованы, чтобы отвечать на требования аксонов локально.Нерецепторные тирозинкиназы семейства Src участвуют в инициации локальной трансляции транспортируемых мРНК за счет фосфорилирования trans -действующих факторов (Ostareck-Lederer et al., 2002; Huttelmaier et al., 2005).
В олигодендроцитах киназа Fyn является преобладающей киназой семейства Src и важным регулятором миелинизации (Kramer-Albers and White, 2011). При скрининге субстратов Fyn в олигодендроглиальных клетках был идентифицирован hnRNP A2, и был предложен аксонально-глиальный сигнальный путь, контролирующий активацию Fyn, чтобы запустить трансляцию MBP в сайте аксон-глиального контакта (White et al., 2008). Было показано, что связывание молекулы адгезии аксональных клеток L1 с олигодендроглием F3 / контактином активирует киназу Fyn, которая фосфорилирует hnRNP A2 и способствует трансляции мРНК, содержащих A2RE (White et al., 2008).
Позже выяснилось, что F3 / контактин образует комплекс с интегринами α6β1 и что связывание L1 усиливает миелинизацию в системе совместного культивирования, которая может быть заблокирована добавлением антител, направленных против интегринов β1 (Laursen et al., 2009), предполагая скоординированная регуляция активации Fyn и миелинизации внеклеточным матриксом и поверхностью аксонов.
Стимуляция интегринов α6β1 связыванием ламинина увеличивает активность Fyn (Laursen et al., 2009), а присутствие конститутивно активного мутанта интегрина β1 способствует трансляции MBP (Laursen et al., 2011). Как описано выше, белок гранул hnRNP F фосфорилируется Fyn. Active Fyn высвобождает hnRNP F из гранул и снижает количество мРНК Mbp, связанных с hnRNP F (White et al., 2012). Поскольку hnRNP A2 и hnRNP E1 также, по-видимому, высвобождаются из гранул в этих условиях (White et al., 2008) кажется, что активация Fyn приводит к разрушению гранулы за счет фосфорилирования белков гранул, высвобождая Mbp мРНК из ее ингибиторов в сайте аксон-глиального контакта и позволяя происходить локализованному синтезу белка MBP. Возможно, что sncRNA715 также отделяется от мРНК Mbp и в ответ на активность Fyn по еще неизвестному механизму.
Интересно, что недавно было показано, что электрическая стимуляция увеличивает экспрессию L1 на поверхности аксонов, а также активацию Fyn, локальный синтез MBP и миелинизацию, которые, по-видимому, регулируются высвобождением везикулярного глутамата аксонов (Wake et al., 2011).
Все вышеупомянутые исследования подчеркивают центральную роль киназы Fyn в регуляции трансляции MBP. Это имеет сильные последствия для процесса миелинизации, как показано in vivo , поскольку мыши гипомиелинизируются в ЦНС в отсутствие Fyn или в присутствии мутировавших неактивных Fyn (Sperber et al., 2001). Более того, уровни MBP снижены у мышей с нокаутом Fyn, и Fyn фосфорилирует белки QKI, модулируя связывание и стабилизацию мРНК Mbp и (Zhang et al., 2003; Лу и др., 2005). В элегантном недавнем исследовании in vivo миелинизации на рыбках данио было показано, что Fyn регулирует количество миелиновых оболочек на олигодендроциты (Czopka et al., 2013).
Интересно, что активный Fyn связывается с α-Tubulin, а также с ассоциированным с микротрубочками белком Tau в олигодендроцитах, и было предположено, что активированный Fyn рекрутирует цитоскелет к сайту аксон-глиального контакта (Klein et al., 2002). Как упоминалось выше, гранулы мРНК Mbp и транспортируются по микротрубочкам к периферии клетки, так что активация Fyn может рекрутировать мРНК Mbp в сайт аксон-глиального контакта, чтобы инициировать процесс миелинизации путем синтеза MBP.Однако вполне вероятно, что также Fyn-независимые пути регулируют трансляцию мРНК Mbp и . Интересно, что была предложена функция TOG в синтезе MBP, которая, по-видимому, не зависит от транспорта гранул (Francone et al., 2007). Тем не менее, множество данных свидетельствует о межклеточном сигнальном пути, происходящем от активных аксонов нейронов, который рекрутирует мРНК Mbp и и индуцирует локальный синтез и миелинизацию MBP.
Заключение
Общий синтез MBP — сложный и строго регулируемый механизм, и здесь мы обсудили только его элементы.Как показано на рисунке 1, мРНК Mbp и транспортируется в больших рибонуклеопротеиновых комплексах на микротрубочках к олигодендроглиальной плазматической мембране. Некоторые белки и РНК образуют эти гранулы, и трансляция MBP подавляется во время транспорта. Похоже, что аксон-глиальные сигнальные события рекрутируют гранулы и стимулируют локализованную трансляцию MBP, позволяя происходить адаптированной к аксонам миелинизации. Вероятно, что гранулы транспорта РНК очень динамичны и потенциально изменяют свой состав во время внутриклеточного транспорта, так что критическая функция отдельных молекул ограничивается отдельными частями события локализации.Будущие исследования помогут улучшить наше понимание регуляции и состава гетерогенных гранул, которые будут иметь важное значение для процедуры миелинизации.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа поддержана стипендиями Focus Program Translational Neuroscience Mainz (Кристина Мюллер) и Stipendienstiftung Rheinland-Pfalz (Нина М.Bauer) и грантами программы MAIFOR (Майнц) и Deutsche Forschungsgemeinschaft (DFG Wh268 / 1-1) (Робину Уайту). Мы благодарим Heiko Luhmann за постоянную поддержку и Jacqueline Trotter за критические комментарии к рукописи. Мы искренне приносим свои извинения за то, что не смогли упомянуть и процитировать всю прекрасную работу, которая способствовала этой захватывающей области исследований.
Список литературы
Аггарвал С., Снайдеро Н., Палер Г., Фрей С., Санчес П., Цвекштеттер М. и др.(2013). Сборка миелиновой мембраны осуществляется за счет фазового перехода основных белков миелина в сплоченную белковую сеть. PLoS Biol. 11: e1001577. DOI: 10.1371 / journal.pbio.1001577
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Аггарвал С., Юрлова Л., Снайдеро Н., Ритц К., Фрей С., Циммерманн Дж. И др. (2011). Размерный барьер ограничивает диффузию белка на клеточной поверхности для образования слоев миелиновой мембраны, богатых липидами. Dev. Cell 21, 445–456.DOI: 10.1016 / j.devcel.2011.08.001
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Эйнгер, К., Авосса, Д., Дайана, А.С., Барри, К., Барбарезе, Э., и Карсон, Дж. Х. (1997). Элементы транспорта и локализации в мРНК основного белка миелина. J. Cell Biol. 138, 1077–1087. DOI: 10.1083 / jcb.138.5.1077
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Эйнгер, К., Авосса, Д., Морган, Ф., Хилл, С. Дж., Барри, К., Барбарезе, Э., и другие. (1993). Транспорт и локализация мРНК экзогенного основного белка миелина, микроинъектированная в олигодендроциты. J. Cell Biol. 123, 431–441. DOI: 10.1083 / jcb.123.2.431
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Аллинкуант Б., Стаугайтис С. М., Д’юрсо Д. и Колман Д. Р. (1991). Эктопическая экспрессия изоформ основного белка миелина в олигодендроцитах Шиверера: значение для миелиногенеза. J. Cell Biol. 113, 393–403.DOI: 10.1083 / jcb.113.2.393
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Барбарезе, Э., Брамвелл, К., Квон, С., Цуй, Х. и Карсон, Дж. Х. (1999). РНК на пути к миелину. J. Neurocytol. 28, 263–270. DOI: 10.1023 / A: 1007097226688
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Barbarese, E., Koppel, D. E., Deutscher, M. P., Smith, C. L., Ainger, K., Morgan, F., et al. (1995). Компоненты трансляции белков совместно локализованы в гранулах в олигодендроцитах. J. Cell Sci. 108 (Pt 8), 2781–2790.
Pubmed Аннотация | Pubmed Полный текст
Бауэр, Н. М., Моос, К., Ван Хорссен, Дж., Витте, М., Ван дер Валк, П., Альтенхайн, Б. и др. (2012). Синтез основного белка миелина регулируется небольшой некодирующей РНК 715. EMBO Rep. 13, 827–834. DOI: 10.1038 / embor.2012.97
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Бокбрейдер, К., Фенг, Ю. (2008). Существенная функция, сложная регуляция и патологическое влияние селективного РНК-связывающего белка QKI на развитие миелина ЦНС. Future Neurol. 3, 655–668. DOI: 10.2217 / 14796708.3.6.655
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Campagnoni, A. T., Pribyl, T. M., Campagnoni, C. W., Kampf, K., Amur-Umarjee, S., Landry, C. F., et al. (1993). Структура и регуляция развития Golli-mbp, гена длиной 105 килобаз, который включает ген основного белка миелина и экспрессируется в клетках линии олигодендроцитов в головном мозге. J. Biol. Chem. 268, 4930–4938.
Pubmed Аннотация | Pubmed Полный текст
Карсон, Дж. Х., Уорбойз, К., Эйнджер, К., и Барбарез, Э. (1997). Для транслокации мРНК основного белка миелина в олигодендроциты необходимы микротрубочки и кинезин. Cell Motil. Цитоскелет 38, 318–328. DOI: 10.1002 / (SICI) 1097-0169 (1997) 38: 4 <318 :: AID-CM2> 3.0.CO; 2- #
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Колман Д. Р., Крейбич Г., Фрей А. Б. и Сабатини Д. Д. (1982).Синтез и включение полипептидов миелина в миелин ЦНС. J. Cell Biol. 95, 598–608. DOI: 10.1083 / jcb.95.2.598
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Чопка Т., Френч-Констант К. и Лайонс Д. А. (2013). У отдельных олигодендроцитов есть всего несколько часов, чтобы создать новые миелиновые оболочки in vivo. Dev. Ячейка 25, 599–609. DOI: 10.1016 / j.devcel.2013.05.013
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
де Фрис, Х., Де Йонге, Дж. К., Шраге, К., Ван дер Хаар, М. Э. и Хокстра, Д. (1997). Дифференциальная и зависимая от клеточного развития локализация мРНК миелина в олигодендроцитах. J. Neurosci. Res. 47, 479–488. DOI: 10.1002 / (SICI) 1097-4547 (19970301) 47: 5 <479 :: AID-JNR3> 3.0.CO; 2-E
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Дайер, К. А., Филиботт, Т. М., Вольф, М. К., и Биллингс-Гальярди, С. (1994). Основной белок миелина опосредует внеклеточные сигналы, которые регулируют стабильность микротрубочек в мембранных листах олигодендроцитов. J. Neurosci. Res. 39, 97–107. DOI: 10.1002 / jnr.4903
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Франсоне, В. П., Маджипинто, М. Дж., Костурко, Л. Д., и Барбарезе, Э. (2007). Связанный с микротрубочками белок, сверхэкспрессированный геном опухоли / связанный с цитоскелетом белок 5, необходим для экспрессии основного белка миелина в олигодендроцитах. J. Neurosci. 27, 7654–7662. DOI: 10.1523 / JNEUROSCI.0203-07.2007
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Фултон, Д., Паез, П. М., Кампанони, А. Т. (2010). Множественные роли генов миелинового белка во время развития олигодендроцитов. ASN Neuro 2, e00027. DOI: 10.1042 / AN200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Funfschilling, U., Supplie, L.M, Mahad, D., Boretius, S., Saab, A.S., Edgar, J., et al. (2012). Гликолитические олигодендроциты поддерживают миелин и долговременную целостность аксонов. Природа 485, 517–521. DOI: 10.1038 / природа11007
Pubmed Аннотация | Pubmed Полный текст
Гао, Ю., Татаварти, В., Корза, Г., Левин, М. К., и Карсон, Дж. Х. (2008). Мультиплексное дендритное нацеливание на альфа-кальций-кальмодулин-зависимую протеинкиназу II, нейрогранин и белковые РНК, связанные с регулируемым цитоскелетом, посредством пути A2. Мол. Биол. Cell 19, 2311–2327. DOI: 10.1091 / mbc.E07-09-0914
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Griffiths, I., Klugmann, M., Anderson, T., Yool, D., Thomson, C., Schwab, M.H., et al. (1998).Набухание аксонов и дегенерация у мышей, лишенных основного протеолипида миелина. Наука 280, 1610–1613. DOI: 10.1126 / science.280.5369.1610
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хан, С. П., Френд, Л. Р., Карсон, Дж. Х., Корза, Г., Барбарезе, Э., Маджипинто, М. и др. (2010). Дифференциальное субклеточное распределение и функции переноса сплайсоформ hnRNP A2 / B1. Трафик 11, 886–898. DOI: 10.1111 / j.1600-0854.2010.01072.х
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Hatfield, J. T., Rothnagel, J. A., and Smith, R. (2002). Характеристика гена hnRNP A2 / B1 / B0 мыши и идентификация процессированных псевдогенов. Ген 295, 33–42. DOI: 10.1016 / S0378-1119 (02) 00800-4
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хилл, К. М., и Харауз, Г. (2005). Эффекты заряда модулируют сборку актина классическими изоформами основного белка миелина. Biochem. Биофиз. Res. Commun. 329, 362–369. DOI: 10.1016 / j.bbrc.2005.01.151
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хилл, К. М., Либич, Д. С., и Харауз, Г. (2005). Сборка тубулина классическими изоформами белка миелина и регуляция посттрансляционной модификацией. Биохимия 44, 16672–16683. DOI: 10.1021 / bi050646 +
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Хук, К. С., Кидд, Дж. Дж., Карсон, Дж. Х. и Смит, Р. (1998). hnRNP A2 избирательно связывает цитоплазматическую транспортную последовательность мРНК основного белка миелина. Биохимия 37, 7021–7029. DOI: 10.1021 / bi9800247
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Huttelmaier, S., Zenklusen, D., Lederer, M., Dictenberg, J., Lorenz, M., Meng, X., et al. (2005). Пространственная регуляция трансляции бета-актина посредством Src-зависимого фосфорилирования ZBP1. Природа 438, 512–515.DOI: 10.1038 / nature04115
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кай Н., Мишина М. и Яги Т. (1997). Молекулярное клонирование Fyn-ассоциированных молекул в центральной нервной системе мышей. J. Neurosci. Res. 48, 407–424. DOI: 10.1002 / (SICI) 1097-4547 (19970601) 48: 5 <407 :: AID-JNR3> 3.0.CO; 2-I
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Картигасан Дж., Гарви Дж. С., Рамамурти Г. В. и Киршнер Д.А. (1996). Иммунолокализация изоформ MBP 17 и 21,5 кДа в компактном миелине и радиальном компоненте. J. Neurocytol. 25, 1–7. DOI: 10.1007 / BF02284781
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Кляйн, К., Крамер, Э. М., Кардин, А. М., Шравен, Б., Брандт, Р., и Троттер, Дж. (2002). Процесс разрастания олигодендроцитов стимулируется взаимодействием фин киназы с цитоскелетным белком тау. J. Neurosci. 22, 698–707.
Pubmed Аннотация | Pubmed Полный текст
Клугманн, М., Schwab, M.H., Puhlhofer, A., Schneider, A., Zimmermann, F., Griffiths, I.R., et al. (1997). Сборка миелина ЦНС в отсутствие протеолипидного белка. Нейрон 18, 59–70. DOI: 10.1016 / S0896-6273 (01) 80046-5
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Костурко, Л. Д., Маггипинто, М. Дж., Д’са, К., Карсон, Дж. Х., и Барбарезе, Э. (2005). Связанный с микротрубочками белок, сверхэкспрессируемый опухолью, связывается с гетерогенным ядерным рибонуклеопротеином А2 РНК-транспортным белком. Мол. Биол. Cell 16, 1938–1947. DOI: 10.1091 / mbc.E04-08-0709
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Костурко, Л. Д., Маггипинто, М. Дж., Корза, Г., Ли, Дж. У., Карсон, Дж. Х., и Барбарезе, Э. (2006). Гетерогенный ядерный рибонуклеопротеин (hnRNP) E1 связывается с hnRNP A2 и ингибирует трансляцию мРНК ответного элемента A2. Мол. Биол. Cell 17, 3521–3533. DOI: 10.1091 / mbc.E05-10-0946
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Крамер-Альберс, Э.М., и Уайт Р. (2011). От аксон-глиальной передачи сигналов до миелинизации: интегрирующая роль олигодендроглиальной киназы Fyn. Cell. Мол. Жизнь. Sci. 68, 2003–2012 гг. DOI: 10.1007 / s00018-010-0616-z
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Квесиен, Дж. М., О’Коннор, Л. Т., Гетц, Б. Д., Делани, К. Х., Флетч, А. Л., и Дункан, И. Д. (1998). Морфологические и морфометрические исследования дисмиелинизирующего мутанта крысы-шейкер Long Evans. J. Neurocytol. 27, 581–591. DOI: 10.1023 / A: 1006922227791
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Lappe-Siefke, C., Goebbels, S., Gravel, M., Nicksch, E., Lee, J., Braun, P.E., et al. (2003). Нарушение Cnp1 разъединяет функции олигодендроглии в поддержке аксонов и миелинизации. Nat. Genet. 33, 366–374. DOI: 10.1038 / ng1095
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ларок Д., Пилотт Дж., Чен Т., Клотье Ф., Massie, B., Pedraza, L., et al. (2002). Ядерное удержание мРНК MBP у дрожащих жизнеспособных мышей. Нейрон 36, 815–829. DOI: 10.1016 / S0896-6273 (02) 01055-3
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лаурсен, Л. С., Чан, К. В., и Френч-Констан, К. (2009). Комплекс интегрин-контактин регулирует миелинизацию ЦНС посредством дифференциального фосфорилирования Fyn. J. Neurosci. 29, 9174–9185. DOI: 10.1523 / JNEUROSCI.5942-08.2009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лаурсен, Л.С., Чан, К. У., и Френч-Констан, К. (2011). Трансляция мРНК основного белка миелина в олигодендроцитах регулируется активацией интегрина и hnRNP-K. J. Cell Biol. 192, 797–811. DOI: 10.1083 / jcb.201007014
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли Ю., Моррисон Б. М., Ли Ю., Ленгахер С., Фарах М. Х., Хоффман П. Н. и др. (2012). Олигодендроглии метаболически поддерживают аксоны и способствуют нейродегенерации. Природа 487, 443–448.DOI: 10.1038 / природа11314
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ли, З., Чжан, Ю., Ли, Д., и Фэн, Ю. (2000). Дестабилизация и неправильная локализация мРНК основного белка миелина при дрожащей дисмиелинизации, в которой отсутствуют РНК-связывающие белки QKI. J. Neurosci. 20, 4944–4953.
Pubmed Аннотация | Pubmed Полный текст
Лу, З., Ку, Л., Чен, Ю., и Фэн, Ю. (2005). Аномалии развития экспрессии основного белка миелина в головном мозге с нокаутом fyn выявляют роль Fyn в посттранскрипционной регуляции. J. Biol. Chem. 280, 389–395. DOI: 10.1074 / jbc.M405973200
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Лайонс, Д. А., Нейлор, С. Г., Шольце, А., и Талбот, В. С. (2009). Kif1b необходим для локализации мРНК в олигодендроцитах и развития миелинизированных аксонов. Nat. Genet. 41, 854–858. DOI: 10,1038 / нг.376
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Мартини, Р., Мохаджери, М. Х., Каспер, С., Гизе, К. П., и Шахнер, М. (1995). У мышей с двойным дефицитом генов P0 и основного белка миелина показано, что оба белка вносят вклад в формирование основной плотной линии миелина периферических нервов. J. Neurosci. 15, 4488–4495.
Pubmed Аннотация | Pubmed Полный текст
Манро, Т. П., Маги, Р. Дж., Кидд, Г. Дж., Карсон, Дж. Х., Барбарезе, Э., Смит, Л. М. и др. (1999). Мутационный анализ элемента ответа гетерогенного ядерного рибонуклеопротеина А2 на трафик РНК. J. Biol. Chem. 274, 34389–34395. DOI: 10.1074 / jbc.274.48.34389
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Наваз, С., Кипперт, А., Сааб, А.С., Вернер, Х. Б., Ланг, Т., Нейв, К. А. и др. (2009). Фосфатидилинозитол-4,5-бисфосфат-зависимое взаимодействие основного белка миелина с плазматической мембраной в олигодендроглиальных клетках и его быстрое нарушение повышенным содержанием кальция. J. Neurosci. 29, 4794–4807. DOI: 10.1523 / JNEUROSCI.3955-08.2009
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Наваз, С., Швейцер, Дж., Ян, О., и Вернер, Х. Б. (2013). Молекулярная эволюция основного белка миелина, большого структурного компонента миелина. Glia 61, 1364–1377. DOI: 10.1002 / glia.22520
CrossRef Полный текст
Ostareck-Lederer, A., Ostareck, D.H., Cans, C., Neubauer, G., Bomsztyk, K., Superti-Furga, G., et al. (2002). c-Src-опосредованное фосфорилирование hnRNP K управляет активацией трансляции специфически подавленных мРНК. Мол. Клетка. Биол. 22, 4535–4543. DOI: 10.1128 / MCB.22.13.4535-4543.2002
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Раджу, К. С., Гориц, К., Норд, Ю., Хермансон, О., Лопес-Иглесиас, К., Виза, Н., и др. (2008). В культивируемых олигодендроцитах hnRNP CBF-A A / B-типа сопровождает мРНК MBP, связанную с последовательностями доставки мРНК. Мол. Биол. Ячейка 19, 3008–3019. DOI: 10.1091 / mbc.E07-10-1083
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Смит, Г.С., Де Авила, М., Паес, П. М., Спреер, В., Уиллс, М. К., Джонс, Н. и др. (2012). Замены пролина и псевдофосфорилирование треонина лиганда Sh4 основного белка миелина 18,5 – кДа снижают его сродство к домену Fyn-Sh4 и изменяют развитие процесса и локализацию белка в олигодендроцитах. J. Neurosci. Res. 90, 28–47. DOI: 10.1002 / jnr.22733
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Смит, Г. С., Паес, П.M., Spreuer, V., Campagnoni, C.W., Boggs, J.M., Campagnoni, A.T. и др. (2011). Классические изоформы основного белка миелина массой 18,5 и 21,5 кДа подавляют приток кальция в олигодендроглиальные клетки, в отличие от изоформ голли. J. Neurosci. Res. 89, 467–480. DOI: 10.1002 / jnr.22570
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Смит, Г. С., Самборска, Б., Хоули, С. П., Клайман, Дж. М., Гиллис, Т. Е., Джонс, Н., и др. (2013). Локализовано в ядре 21.Основной белок миелина 5 кДа способствует пролиферации олигодендроцитов и усиливает разрастание нейритов в сокультуре, в отличие от изоформы 18,5 кДа, связанной с плазматической мембраной. J. Neurosci. Res. 91, 349–362. DOI: 10.1002 / jnr.23166
CrossRef Полный текст
Сонг, Дж., Карсон, Дж. Х., Барбарезе, Э., Ли, Ф. Ю. и Дункан, И. Д. (2003). Транспорт РНК в олигодендроцитах мутантной крысы по taiep. Мол. Клетка. Neurosci. 24, 926–938. DOI: 10.1016 / S1044-7431 (03) 00254-9
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Спербер, Б.R., Boyle-Walsh, E.A., Engleka, M.J., Gadue, P., Peterson, A.C., Stein, P.L. и др. (2001). Уникальная роль Fyn в миелинизации ЦНС. J. Neurosci. 21, 2039–2047.
Pubmed Аннотация | Pubmed Полный текст
Стаугайтис, С. М., Смит, П. Р. и Колман, Д. Р. (1990). Экспрессия изоформ основного белка миелина в неглиальных клетках. J. Cell Biol. 110, 1719–1727. DOI: 10.1083 / jcb.110.5.1719
CrossRef Полный текст
Уэйк, Х., Ли, П.Р., и Филдс, Р. Д. (2011). Контроль локального синтеза белка и начальных событий миелинизации с помощью потенциалов действия. Наука 333, 1647–1651. DOI: 10.1126 / science.1206998
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Ван, Ю., Лакруа, Г., Хейнс, Дж., Дукханин, Э., Алмазан, Г., и Ричард, С. (2010). РНК-связывающий белок QKI-6 локализуется с мРНК MBP в стрессовых гранулах глиальных клеток. PLoS ONE 5: e12824. DOI: 10,1371 / журнал.pone.0012824
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Уайт, Р., Гонсиор, К., Бауэр, Н. М., Крамер-Альберс, Э. М., Луман, Х. Дж. И Троттер, Дж. (2012). Гетерогенный ядерный рибонуклеопротеин (hnRNP) F является новым компонентом олигодендроглиальных транспортных гранул РНК, участвующих в регуляции синтеза основного белка миелина (MBP). J. Biol. Chem. 287, 1742–1754. DOI: 10.1074 / jbc.M111.235010
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Белый, Р., Гонсиор, К., Крамер-Альберс, Э. М., Стор, Н., Хуттельмайер, С., и Троттер, Дж. (2008). Активация олигодендроглиальной киназы Fyn усиливает трансляцию мРНК, транспортируемых в гранулах hnRNP A2-зависимой РНК. J. Cell Biol. 181, 579–586. DOI: 10.1083 / jcb.200706164
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Zhang, Y., Lu, Z., Ku, L., Chen, Y., Wang, H., and Feng, Y. (2003). Фосфорилирование тирозина QKI опосредует онтогенетические сигналы для регулирования метаболизма мРНК. EMBO J . 22, 1801–1810. DOI: 10.1093 / emboj / cdg171
Pubmed Аннотация | Pubmed Полный текст | CrossRef Полный текст
Взаимосвязь между изоэлектрической точкой и: длиной белков, таксономией и экологией организмов | BMC Genomics
Общие свойства распределений изоэлектрических точек в протеомах
Некоторые примеры распределений изоэлектрических точек белков, кодируемых выбранными протеомами, показаны на рис. 1 (дополнительные протеомы см. В дополнительных файлах данных 2, 3 и 4).Все проанализированные протеомы обычно показывают бимодальное распределение с меньшим третьим пиком между двумя основными пиками, что согласуется с результатами других авторов [7, 8] и предположениями о том, что мультимодальное распределение pI соответствует значениям pK аминокислотных фрагментов [ 8, 14].
Рисунок 1
Гистограммы значений pI с интервалом 0,1 единицы (левая панель) и отношения между длиной белков (log L) и их pI (правая панель) для выбранных прокариотических протеомов с различным смещением pI (b): (A ) Natronomonas pharaonis DSM 2160, b = -87%.(B) Silicibacter pomeroyi DSS-3, b = -44%; (C) Ehrlichia ruminantium str. Гардель, b = 0%; (D) Mycoplasma pneumoniae M129, b = 43%; (E) Wigglesworthia glossinidia , b = 86%. Черные точки представляют собой набор кислых белков, а серые — набор основных белков. Диаграммы для всех проанализированных протеомов доступны в дополнительных файлах данных 2, 3 и 4.
Чтобы упростить сравнительный анализ распределения pI различных протеомов, мы разделили все наборы белков на два набора, названные позже кислотным и основным наборами.Точка деления соответствует значению pI, для которого распределение pI достигает минимума между кислотным и основным наборами (подробности см. В разделе «Методы»). Для большинства протеомов точка деления находилась между 7,4 и 7,5. Распределение значений пунктов деления очень узкое — диапазон 7,22–7,54 при среднем и медиане 7,41. Мы не обнаружили никакой корреляции между pH в этих точках и таксономической или экологической классификацией организмов и размерами генома.Универсальность значения pH минимума в распределении pI подтверждает вывод других авторов о том, что бимодальное распределение pI является результатом внутренних химических свойств аминокислот [8].
Для каждого протеома мы рассчитали средний pI отдельно для основного и кислого наборов белков, среднюю длину белков и смещение pI (см. Раздел «Методы»). Смещение pI просто описывает асимметрию бимодального распределения pI (рис. 1). Диапазон составляет от -100% до 100%.Эти два крайних значения указывают на то, что все белки в данном протеоме являются кислотными или основными, соответственно. Значение, близкое к нулю, означает, что данный протеом имеет одинаковую долю кислотных и основных белков. Мы обнаружили, что, если протеом имеет более кислые белки, средний pI белков кислотного набора ниже и взаимосвязь статистически значима (коэффициент корреляции, r = 0,76, p <0,001) - дополнительный файл данных 5A. С другой стороны, если в протеоме преобладают основные белки, это не связано со сдвигом среднего значения pI основных белков, за исключением некоторых внутриклеточных микроорганизмов (дополнительный файл данных 5B).Мы также обнаружили, что базовые наборы имеют большую дисперсию их pI, чем кислые наборы, что указывает на большее разнообразие основных белков.
Взаимосвязь между значением pI и размером белков
Виртуальное двумерное распределение белков показывает характерный образец, который может напоминать «бабочку» [7] или «легкие», и никакой корреляции между pI и молекулярной массой не наблюдалось. белки. Nandi et al. [15] обнаружили, что молекулярная масса белков является гораздо более консервативной характеристикой, чем их pI, что дополнительно предполагает отсутствие корреляции между pI и молекулярной массой.Однако после разделения протеомов на кислотные и основные наборы можно увидеть корреляцию между pI и размером белков для многих протеомов — положительную для кислых белков и отрицательную для основных белков (рис. 1). Хотя коэффициент корреляции не очень высок, для более чем 92% кислотных наборов и почти 99% основных наборов кодируемых хромосомами протеомов архей, бактерий и эукариот он является статистически значимым с поправкой Бенджамини-Хохберга на p <0,05. Кроме того, корреляция между размером и pI белков является общей чертой с очень узким распределением коэффициентов корреляции (показано на рис.2 отдельно для кислых и основных белков).
Рисунок 2
Распределение коэффициентов корреляции между значением pI и длиной белков, рассчитанных отдельно для кислотного и основного наборов протеомов.
Чтобы показать, что эти корреляции являются внутренними свойствами протеомов, мы создали три искусственных протеома, состоящих из случайно сгенерированных белков, характеризующихся: (i) средним аминокислотным составом белков E. coli и длиной настоящего белка E. .белки coli ; (ii) равные частоты аминокислот и длина реальных белков E. coli ; (iii) средний аминокислотный состав белков E. coli и равномерное распределение длины в диапазоне белков E. coli . (См. Дополнительный файл данных 6 для распределения pI и отношений между длиной белков и их pI для этих протеомов.) Создание искусственных протеомов повторяли 100 раз для каждого набора. В каждом случае мы получили значительную корреляцию между длиной и значениями pI (табл.1). Каждая версия искусственных протеомов давала бимодальное распределение pI и более сильные корреляции между pI и длиной белков, чем в реальном протеоме E. coli . Смещение pI реального протеома не попадает в диапазон значений pI сгенерированных протеомов и является ближайшим к сгенерированным протеомам, исходя из среднего аминокислотного состава и длины реальных белков E. coli . Смещение pI было более сбалансированным, когда белки были получены из однородного распределения аминокислот, но все еще без белков с pI, близким к 7.4. Кроме того, протеом становился более кислым, когда длина белков соответствовала равномерному распределению. Это предполагает, что отбор по длине белков может до некоторой степени влиять на распределение pI.
Таблица 1. Свойства искусственных и реальных протеомов E. coli .
Результаты означают, что более длинные белки могут поддерживать нейтральный или почти нейтральный pI, тогда как самые экстремальные значения pI специфичны для более коротких белков. Вероятно, это связано с чисто статистическими причинами.Более короткие белки демонстрируют более высокие колебания аминокислотного состава, что сильно влияет на их pI — включение даже одного заряженного остатка значительно сдвигает pI белка в сторону более низкого или более высокого значения. С другой стороны, длинные белки, обычно состоящие из более заряженных аминокислот, намного лучше амортизируют эффект колебаний в их составе и могут поддерживать свой pI даже близким к 7,4. Это «статистическое» объяснение взаимосвязи между размером белков и pI не исключает возможности того, что эта взаимосвязь может иметь некоторые биологические последствия в диверсификации структуры и функции белков.Например, если существует ограничение выбора для получения очень кислого или очень основного белка, самый простой способ добиться этого — «сделать» его коротким. На самом деле, очень простые белки, взаимодействующие с нуклеиновыми кислотами — рибосомные белки — обычно очень короткие. Мы думаем, что необходимо найти больше белков, подвергнутых такому отбору. Эти белки могут принадлежать к определенным регуляторным белкам, факторам транскрипции, модуляторам, сигнальным белкам, небольшим белкам, взаимодействующим с другими белками и т. Д.
Мы также заметили разницу в длине кислых и основных белков. Сравнительный анализ показал, что кислотные белки значительно длиннее основных (t-критерий Стьюдента, скорректированный по Бенджамини-Хохбергу p <0,05) более чем в 95% протеомов архей, бактерий и эукариот. Кислые белки в среднем на 73 и 107 аминокислотных остатков длиннее основных у Prokaryota и Eukaryota соответственно. Вероятно, это связано с наличием очень коротких рибосомных белков в основном наборе и длинных аминоацил-тРНК-синтетаз в кислотном [15].
Nandi et al. [15] наблюдали, что размер ортологичных белков, обнаруженных у близкородственных организмов, намного более консервативен, чем их pI. Мы сравнили длину ортологичных белков многих протеомов, значения pI которых были изменены с кислых на основные или наоборот, но мы также не наблюдали каких-либо статистически значимых различий в длине этих белков. Мы обнаружили, что изменение pI не зависело от длины сравниваемых ортологов.
Связь между значениями pI протеомов и таксономией
При анализе потенциальных отношений между pI протеомов и таксономией мы использовали смещение pI, которое является довольно кратким, но очень информативным параметром, подчеркивающим наиболее четкие и основные различия в распределениях pI. .На рис. 3 показан результат статистического анализа смещения pI различных групп протеомов и дендрограмма UPGMA, на которой различные группы протеомов классифицируются в соответствии с медианным смещением pI. Анализ позволяет разделить протеомы как минимум на две группы: (1) более основные протеомы, кодируемые пластидами, вирусами и плазмидами, и (2) более кислые протеомы архей, бактерий, эукариот, митохондрий и фагов. Это разделение поддерживается 95% (метод подвыборки), WLS-LRT и F-тестом (оба p <0.001). Более того, каждое сравнение между членами, отнесенными к этим различным группам, проведенное с помощью теста Краскела-Уоллиса, является статистически значимым (p <0,002). В кислой группе можно выделить некоторые подгруппы в соответствии с высоким процентом поддержки: эукариоты с митохондриями и бактерии с фагами. Клады, содержащие прокариот и фаги, довольно слабо подтверждены анализом подвыборки, но очень значимы согласно WLS-LRT и F-тесту (для обоих p <0,001). Наблюдаемая основность протеомов пластид, вирусов и плазмид, вероятно, связана с преобладанием основных белков (напр.грамм. рибосомный в случае пластид и основных белков, взаимодействующих с нуклеиновыми кислотами в случае вирусов), а также может быть результатом более высокой скорости накопления мутаций, особенно в вирусах и плазмидах (см. раздел «Связь между значением pI протеомов, их размеры и содержание GC в геномах »для аналогичного объяснения внутриклеточных бактерий).
Рисунок 3
Статистический анализ смещения pI различных групп протеомов и их кластеризации на основе UPGMA согласно медиане смещения pI.Числа в узлах означают процентную поддержку, основанную на методе подвыборки, а звездочки обозначают результаты тестов WLS-LRT / F (оба с p <0,001).
Наш анализ протеомов прокариот, выполненный на нижнем таксономическом уровне, не выявил какой-либо связи между смещением pI и филогенезом, что согласуется с результатами Knight et al. [7]. Многие монофилетические или близкородственные группы (например, таксоны архей или протеобактерий) не были сгруппированы, когда смещение pI использовалось в качестве критерия.Это указывает на то, что распределение pI не сохранилось во время эволюции прокариот. Мы не наблюдали такой взаимосвязи и для протеомов эукариот.
С другой стороны, мы обнаружили интересную группировку, связанную с филогенетическим сигналом, при анализе митохондриальных протеомов, которые намного меньше и более консервативны в соответствии с их содержанием белка, чем большие протеомы, кодируемые хромосомами (рис.4, см. Также Табл. 2). Анализируемые группы протеомов четко делятся на две подгруппы: Viridiplantae + Protista и Fungi + Metazoa.Это деление строго поддерживается в 100%, WLS-LRT и F-тесте (для обоих p <0,001). Это согласуется с мнением о том, что клады Fungi + Metazoa, называемые Opisthokonta, являются хорошо известной группой, что подтверждается многими анализами молекулярных данных [16, 17]. Кроме того, две подгруппы Metazoa: Chordata и non-Chordata (включая большинство типов беспозвоночных) образуют хорошо поддерживаемую кладу (97%; WLS-LRT и F-тест: для обоих p <0,001). Группа Viridiplantae + Protista в среднем имеет гораздо больше основных протеомов, чем Fungi + Metazoa.В группе Opisthokonta у грибов есть умеренно основные протеомы, в то время как у Metazoa есть нейтральные (нехордовые) или слабокислые (хордовые).
Рисунок 4
Статистический анализ смещения pI митохондриальных протеомов и их кластеризации на основе UPGMA согласно медиане смещения pI. Числа в узлах означают процентную поддержку, основанную на методе подвыборки, а звездочки обозначают результаты тестов WLS-LRT / F (оба с p <0,001).
Таблица 2 Сравнение смещения pI для подмножеств органеллярных протеомов.
Наблюдаемый филогенетический сигнал в смещении pI, вероятно, является результатом различного состава протеомов. Митохондриальные протеомы Viridiplantae, Protista и Fungi обычно в несколько раз больше, чем протеомы Metazoa, которые обычно содержат 12–13 белков. Фактически, большинство белков (например, рибосомных белков), которые отсутствуют у Metazoa, но присутствуют в Viridiplantae, Protista и Fungi, являются очень простыми (дополнительный файл данных 7). Поэтому, когда мы провели такой же анализ на основе протеомов, состоящих только из 12 белков, присутствующих в большинстве митохондриальных протеомов, филогенетический сигнал исчез, а смещение pI основных протеомов стало нейтральным или даже кислым (для грибов).Мы не обнаружили никакой связи между смещением pI и филогенезом на более низких таксономических уровнях: между типами многоклеточных и подгруппами Craniata при анализе как полных протеомов, так и протеомов, содержащих только 12 общих белков.
Аналогично Knight et al. [7], но анализируя более широкий набор протеомов, мы обнаружили значительную корреляцию между смещением pI протеомов, кодируемых прокариотическими геномами и их плазмидами (N = 63, r = 0,74, p <0,001). Такой корреляции между смещением pI протеомов с ядерным кодированием эукариот и протеомами их органелл нет (N = 36, r = 0.04, p = 0,81). Мы получили аналогичные результаты при анализе средних значений pI для кислотных и основных наборов по отдельности, и никакой корреляции не было обнаружено в этих двух случаях, когда изучалась средняя длина белков в этих двух наборах. Кажется, что геномы органелл более независимы, чем плазмиды, чтобы следовать геномным тенденциям в pI, что, по-видимому, не верно для плазмид. Например, органеллы разделены двумя мембранами и обладают собственными репликационными, транскрипционными и трансляционными механизмами.Плазмиды обычно кодируют больше основных белков, чем хромосомы, но мутационное давление или некоторые ограничения отбора влияют на эти два протеома одновременно, и перенос генов между плазмидами и хромосомами происходит, вероятно, чаще, чем между органеллярным и ядерным геномами. Если будет доступно больше данных, было бы интересно проанализировать такие отношения между вирусными или фагальными протеомами и протеомами инфицированных организмов.
Взаимосвязь между значениями pI и субклеточной локализацией белков
Анализируемые митохондриальные и пластидные протеомы включают только белки, кодируемые органеллярными геномами.Однако существует множество белков, кодируемых ядерными генами, которые нацелены на органеллы. Кодируемые ядром органеллярные белки обычно снабжены N-концевыми сигналами нацеливания (транзитными пептидами), ответственными за их импорт в органеллы. Эти пептиды отщепляются органеллярными пептидазами после транспортировки белков. Поскольку эти пре-последовательности богаты основными аминокислотными остатками, pI преждевременных необработанных белков (то есть целых последовательностей) должна быть более основной, чем pI зрелых белков (т.е.е. без транзитного пептида). В закладке. 2 мы сравнили смещение pI преждевременных и зрелых белков с протеомами, кодируемыми органеллярными геномами. Поскольку митохондриальные протеомы различаются в разных таксономических группах, мы проанализировали их отдельно. (См. Дополнительный файл данных 8 для распределения pI и взаимосвязей между длиной белков и их pI для этих протеомов.) Как и ожидалось, присутствие очень основных транзитных пептидов (pI смещение 93 — 100%) в преждевременных белках сдвигает pI распределение этих белков по основности (т. е.е. более высокие значения pI bias), тогда как большинство зрелых белков являются кислыми. Интересно, что только в пластидных и митохондриальных протеомах растений все еще существует слабый избыток кислых преждевременных белков. Кодируемые ядром органелларные протеомы обычно отличаются от протеомов, кодируемых органеллами. Значения смещения pI только митохондриальных белков преждевременного созревания Viridiplantae и Fungi и митохондриальных зрелых белков Chordata попадают в пределы квартильного диапазона смещения pI соответствующих протеомов, кодируемых органеллами.
Schwartz et al. [6] проанализировали три субклеточных локализации белков и обнаружили, что цитоплазматические и интегральные мембранные протеомы содержат больше кислых и основных белков, соответственно, тогда как ядерный протеом имеет довольно равные пропорции кислотных и основных белков. В этой статье мы рассмотрели 12 субклеточных локализаций в анализах (табл. 3). (См. Также дополнительный файл данных 9 для распределения pI и отношений между длиной белков и их pI для этих протеомов.Результаты показали, что наиболее кислые протеомы присутствуют не только в цитозоле, но также в вакуолях и лизосомах, а многие кислые белки строят цитоскелет. Самым основным из них является митохондриальный протеом, и распределение pI белков, интегрированных в мембрану, немного смещено в сторону основности. Остальные субклеточные локализации содержат более сбалансированные пропорции кислых и основных белков. Основной характер интегральных мембранных белков можно объяснить присутствием основных остатков по обе стороны от области, охватывающей мембрану, которые играют роль в стабилизации белков в мембране [6].Основность митохондриальных белков обусловлена наличием положительно заряженных транзитных пептидов. Другие взаимосвязи между pI и субклеточной локализацией, вероятно, связаны с присутствием некоторых специфических групп белков в определенных локализациях (например, кислотных гидролаз в лизосомах, деградирующих ферментов в вакуолях и кислых белков, таких как актины, динеины, кератины, кинезины и т. ламины, миозины, тубулины в цитоскелете). Интересно сопоставить распределение pI конкретных протеомов с pH компартментов, в которых эти протеомы расположены.Однако мы не наблюдали какой-либо статистически значимой корреляции (r = 0,38, p = 0,27, n = 10).
Таблица 3 Сравнение смещения pI для протеомов различной субклеточной локализации.
Взаимосвязь между значениями pI протеомов и экологией их организмов
Для детального анализа взаимосвязей между pI протеомов и экологией организмов все проанализированные прокариотические протеомы были отнесены к различным экологическим подгруппам (подробности см. В разделе «Методы») и затем сравнивают в отношении смещения pI (Табл.4). Тесты Краскела-Уоллиса показали, что различия не были статистически значимыми, когда организмы были сгруппированы в соответствии с их потребностями в кислороде и температуре (p> 0,1), но они были очень значимыми при классификации в соответствии с их средой обитания, связью с клетками-хозяевами и требованиями к солености (p <0,001). К такому же выводу мы пришли (на том же уровне значимости) при выполнении теста χ 2 . На рис. 5 представлены отношения наблюдаемого к ожидаемому количеству протеомов в данном классе смещения pI для различных экологических классификаций.
Таблица 4 Статистический анализ смещения pI для различных экологических групп. Рисунок 5
Отношения наблюдаемого и ожидаемого количества протеомов в данном классе смещения pI для различных экологических классификаций: (A) кислород, (B) температура, (C) соленость, (D) среда обитания и (E) отношение к клетке-хозяину.
Анализы показали, что соленость положительно коррелирует с кислотностью протеомов — чем более галофильные организмы имеют более кислые протеомы. Это согласуется с результатами других авторов, наблюдавших у галофилов преобладание кислотных остатков над основными [18–22] и низкую изоэлектрическую точку их белков [10–12].Чрезвычайно галофильные и умеренно галофильные бактерии присутствуют только в «кислом» классе, а мезогалофилы исчезают в «основном» классе (рис. 5C). Эта связь обычно объясняется более высокой стабильностью и растворимостью белков, богатых кислотными остатками, в гиперсоленой среде [19, 23–28].
Учитывая предпочтения среды обитания, организмы, ассоциированные с хозяином, имеют наименее кислые протеомы по сравнению с другими группами, а водные бактерии обладают наиболее кислыми. В « кислом » классе водные бактерии представляют собой наиболее представленную группу, а виды, связанные с хозяевами, — наиболее недопредставленную (рис.5D). С другой стороны, «базовый» класс содержит только микроорганизмы, ассоциированные с хозяином. Хотя протеомы видов, ассоциированных с хозяином, сдвинуты в сторону более основных протеомов, в среднем они все еще являются кислыми (Табл. 4). Однако более подробная классификация организмов с учетом их отношения к клетке-хозяину показала, что протеомы внутриклеточных бактерий в среднем являются основными, а внеклеточные и свободноживущие / внутриклеточные виды имеют слегка кислые протеомы (рис. 5E). Более кислые протеомы характерны для свободноживущих / внеклеточных и свободноживущих видов.Фактически, эти две группы чрезмерно представлены в «кислотном» классе, тогда как внутриклеточные бактерии сильно представлены в «основном» классе. Результаты показывают, что чем больше организм связан с клеткой-хозяином, тем больше у него основного протеома. Объяснение этого результата будет обсуждаться в следующем разделе, где рассматривается взаимосвязь между смещением pI, размером протеома и содержанием GC в геноме. Мы также заметили, что все внутриклеточные организмы, которые имеют слабокислые протеомы (Anaplasma, Brucella, Chlamydiae, Ehrlichia) и большинство из них (за одним исключением), имеют слабоосновные протеомы со смещением pI ≤ 20% (Bartonella, Coxiella, Parachlamydia, Rickettsia conorii , Tropheryma, Wolbachia) находятся и обычно размножаются в вакуолях или фагосомах.Интересно, что R. conorii имеет наименее основной протеом в пределах рода Rickettsia и как единственный представитель этого рода наблюдается в вакуоли [29]. Это означало бы, что среда вакуолей изменяет протеомы внутриклеточных организмов в сторону кислотности.
Экологические изменения довольно сильно и быстро влияют на смещение pI в процессе эволюции протеомов, поскольку изменения смещения pI наблюдаются даже среди близкородственных организмов. Мы собрали все проанализированные виды, принадлежащие к одному роду и имеющие разное экологическое назначение (см. Дополнительный файл данных 10).В каждом случае смещение pI видов, ассоциированных с хозяином, больше смещено в сторону более высоких значений (то есть основности), чем смещение видов, живущих в нескольких средах. Наиболее яркими примерами являются два вида Burkholderia, из которых один живет в наземной среде обитания и обладает кислотным протеомом, а другой связан с хозяином и имеет основной протеом. Протеомы других видов, ассоциированных с хозяином, хотя и смещены в сторону основности, все же остаются кислыми, вероятно, потому, что эти виды все еще являются факультативными и внеклеточными паразитами.Более того, явный сдвиг смещения pI виден при сравнении видов, живущих с разными требованиями к солености. Протеомы галофильных и мезогалофильных видов содержат более кислые белки, чем негалофильные.
Взаимосвязь между значениями pI протеомов, их размерами и GC-содержанием геномов
Взаимосвязь между pI-значением протеомов, их размерами и GC-содержанием геномов была проанализирована Knight et al. [7]. Они пришли к выводу, что нет корреляции между медианной pI и содержанием GC в небольших базовых протеомах, и открыли дискуссию о причинах основности крошечных протеомов, дав два непроверенных возможных объяснения: отбор белков в протеоме и отбор внутри определенных белков.Чтобы увидеть, насколько общими являются эти отношения, мы выполнили анализ более широкого набора протеомов с использованием смещения pI и более подробно рассмотрели связь организмов с клеткой-хозяином.
Фиг. 6A представляет взаимосвязь между смещением pI и размером протеома (выраженным как логарифм количества белков) для прокариотических организмов. График в дополнительном файле данных 11 включает также эукариотические организмы. Для прокариотических протеомов видна четкая тенденция — меньшие протеомы содержат больше основных белков, тогда как большинство протеомов Eukaryota смещены в сторону больших значений размера протеома.Коэффициент корреляции для набора, содержащего прокариотические протеомы, составляет r = -0,64 (p <0,001). Отрицательная корреляция была обнаружена также для смещения pI и содержания GC геномов (для всего набора: r = -0,49, для прокариотических протеомов r = -0,50; для обоих p <0,001). Как правило, геномы с более низким содержанием GC кодируют более простые протеомы. Детальный анализ прокариотических протеомов с учетом взаимосвязи между организмами и клеткой-хозяином показал, что чем больше штамм бактерий полагается на своего хозяина, тем выше фракция AT в его геноме и тем меньше и более базовый протеом он имеет (рис.6). Большинство этих организмов являются внутриклеточными паразитами или эндосимбионтами, или, по крайней мере, они каким-то образом связаны со своим хозяином (внеклеточными). Кажется, что правила являются общими, потому что протеом, кодируемый нуклеоморфом эукариота Guillardia theta [30], также является AT-богатым, редуцированным и самым основным во всем наборе. G. theta — одноклеточная водоросль-криптофит, которая является хозяином для другой клетки с уменьшенным остаточным ядром, называемой нуклеоморфом. Клетка также может считаться эндосимбионтом.
Рис. 6
Связь между смещением pI и: (A) логарифмом размера протеома и (B) содержанием геномных GC для различных экологических групп прокариот.
Наблюдаемые корреляции становятся более ясными, если рассматривать только виды с протеомами менее 1000 белков. Коэффициенты корреляции изменяются от -0,64 до -0,82 для взаимосвязи между смещением pI и размером протеома и от -0,49 до -0,58 для взаимосвязи между смещением pI и содержанием GC и являются статистически значимыми.Таким образом, нельзя полностью исключить гипотезу о том, что неэффективность механизмов репарации ДНК у внутриклеточных микроорганизмов вызывает большое смещение AT их малых геномов и, как следствие, большее содержание основного лизина [31]. Возможно, что существуют и другие причины наблюдаемой взаимосвязи между основностью протеома и уменьшением его размера, например: увеличение или потеря некоторых групп белков, вызывающих сдвиг pI всего протеома или отбор на изменение pI протеома. определенные белки, напримерграмм. участвует в адаптации к новой среде или хозяину [7]. Первая гипотеза объясняет, по крайней мере, различия между митохондриальными протеомами (см. Выше).
Мы рассмотрели, объясняет ли эта гипотеза основность малых прокариотических протеомов. Мы можем исключить приобретение основных белков как объяснение, потому что трудно найти какие-либо новые гены, полученные внутриклеточными бактериями, которые отсутствовали бы у близкородственных свободноживущих родственников [32–34]. Обычно у внутриклеточных бактерий многие гены разрушаются или, скорее, уничтожаются, оставляя консервативный набор генов (например,грамм. кодирующие основные рибосомальные белки). Утрата незаменимых генов, кодирующих кислые белки, может привести к сдвигу всего протеома в сторону основности. Можно предположить, что консервативные ортологичные белки, присутствующие как во внутриклеточных бактериях, так и в их свободноживущих аналогах, не изменили своих функций в ходе эволюции, и эти наборы имеют одинаковые пропорции различных классов белков. Тогда мы должны ожидать, что эти протеомы имеют схожее распределение pI и являются более основными, чем белки, которые все еще присутствуют в свободноживущих бактериях, но были потеряны во внутриклеточном организме.Чтобы проверить это, мы проанализировали распределение pI для трех наборов белков: присутствующих только в свободноживущих бактериях, но не во внутриклеточных, и ортологичные белки, общие для внутриклеточных бактерий и их свободноживущие аналоги, проанализированные отдельно для этих двух групп. бактерий. Результаты сравнения Escherichia coli K12 с: Buchnera aphidicola str. Bp, Candidatus Blochmannia floridanus и Wigglesworthia glossinidia представлены на рис.7. Набор ортологичных белков этих эндосимбионтов очень прост. Однако ортологичные белки E. coli даже более кислые, чем набор белков, присутствующих только в E. coli и потерянных у эндосимбионтов. Мы получили аналогичные результаты для семи других пар бактерий. Предполагая, что протеом E. coli похож на свободно живущего предка эндосимбионтов, мы можем оценить, что от 300 до 400 его белков (то есть 55-65 процентов общей части протеомов) изменили свою pI с кислой на основную во время переход к внутриклеточному образу жизни.Следовательно, в отличие от митохондриальных протеомов, наблюдаемый сдвиг малых бактериальных протеомов в сторону основности не может быть объяснен увеличением или потерей некоторых белков в протеоме, а сдвигом pI многих белков.
Рисунок 7
Распределение pI для трех наборов белков: присутствует в E . coli только K12, а не во внутриклеточном эндосимбионте (только в Ec), E. coli белки, ортологичные внутриклеточным бактериям [(common (Ec)], и эндосимбионтные белки, ортологичные E.coli [(общий (инициалы эндосимбионта)]. Сравнения сделаны для E . (C).
Чтобы найти объяснение этому сдвигу, мы сгенерировали для каждого организма протеом с таким же распределением белков по длине, что и в его реальном протеоме, но с аминокислотным составом, рассчитанным для базового состава, характерного для данного генома. это отражает, в некоторой степени, состав, порожденный мутационным давлением [35].Мы создали 100 таких протеомов для каждого организма и усреднили их смещение pI. Эти протеомы демонстрируют равновесное устойчивое состояние протеомов, развивающихся только под давлением мутаций без каких-либо ограничений отбора. Все сгенерированные протеомы показали чрезвычайно высокое (более 85%) смещение pI со средним значением = 94% (фиг. 8A, см. Дополнительный файл данных 6 для примера E. coli ). На самом деле, согласно таблице генетического кода, при равных частотах кодонов представительство кислотных остатков ниже, чем основных.Отношение между долей основной или кислой аминокислоты и содержанием GC является нелинейным, но любой нуклеотидный состав благоприятствует основным остаткам, особенно для экстремального содержания GC (рис. 8B). Наименьшая разница между долей кодируемой основной и кислой аминокислот составляет 37% ГХ. Это согласуется с соотношением, полученным для сгенерированных протеомов. Наименьшее смещение pI находится между 30% и 40% от содержания GC. Кроме того, точки раздваиваются в сторону более высокого смещения pI для крайних значений содержания GC, показывая отрицательную корреляцию ниже и положительную корреляцию выше 40% содержания GC.Отрицательная связь, вероятно, связана с увеличением основного лизина, кодируемого кодонами, богатыми AT, а положительная — с ростом основного аргинина, кодируемого кодонами, богатыми GC. Поскольку любая композиция ДНК (особенно та, которая находится в равновесии с мутационным давлением) сдвигает протеомы в сторону основности, мы можем предположить, что кислые протеомы подвергаются сильному давлению отбора, противоположному мутационному давлению. Чем более кислый протеом, тем более сильный отбор должен производиться на него.На данный момент наиболее кислые протеомы принадлежат к экстремальным галофилам, поэтому следует ожидать очень сильных ограничений отбора на эту группу со стороны гиперсоленой среды, в которой они живут.
Рисунок 8
Изоэлектрическая точка и содержание ГХ. (A) Связь между сгенерированным компьютером смещением pI и геномным содержанием GC прокариотических организмов. Сгенерированное смещение pI представляет собой среднее значение, рассчитанное для 100 виртуальных протеомов, сгенерированных для каждого организма, при том же распределении белков по длине, что и в реальных протеомах, и аминокислотном составе, рассчитанном на основе базового состава, характерного для данного генома.(B) Соотношение между долей основных и кислых аминокислот и содержанием GC.
Результаты показывают, что смещение AT само по себе не может объяснить наблюдаемую основность крошечных протеомов. Мы не наблюдали никакой корреляции для этих виртуальных протеомов между смещением pI и размером протеома. Похоже, что ускорение накопления мутаций само по себе может быть ответственно за основность крошечных протеомов. Это согласуется с хорошо задокументированными более высокими темпами эволюции внутриклеточных бактерий, чем их свободноживущие родственники.Было высказано предположение, что более высокая скорость эволюции является результатом повышенной скорости мутаций [36] и / или эффекта храповика Мюллера или более легкой фиксации мутаций за счет генетического дрейфа в небольших бесполых популяциях [37–46]. Соответственно, увеличение основности протеомов и увеличение смещения мутаций AT будут параллельными явлениями, возникающими в результате более высокой скорости эволюции геномов внутриклеточных бактерий. Повышенное смещение AT, вероятно, является результатом устранения генов, кодирующих ферменты, связанные с репарацией ДНК и рекомбинацией, или, по крайней мере, из-за снижения их эффективности во внутриклеточных организмах [31, 32, 37, 47–49].Эти ферменты обычно корректируют связанную с ошибкой тенденцию к обогащению AT, например дезаминирование цитозина до урацила, который затем заменяется тимином.
Чтобы подтвердить наше объяснение, мы проанализировали 39 наборов консервативных ортологичных белков, присутствующих в каждом из 100 отобранных прокариотических организмов, что довольно равномерно представляет значения смещения pI. Мы предположили, что если увеличение скорости замены влияет на распределение pI, мы должны наблюдать положительную корреляцию между pI этих белков и смещением pI всех протеомов.Собственно, для 36 из них мы обнаружили такую статистически значимую корреляцию (см. Дополнительный файл данных 12). Три набора, для которых корреляция не была значимой, представляют самые основные рибосомные белки, и, возможно, их дальнейшее изменение было маловероятным. Результаты показывают, что даже очень консервативные белки, подвергающиеся строгим ограничениям отбора, следуют глобальной тенденции в распределении pI. Такая взаимосвязь, вероятно, касается многих других белков, потому что анализ pI кластеров ортологичных групп (COG) показал, что белки только нескольких кластеров консервативны и остаются в том же кислотном или основном наборе, в то время как большинство из них прыгают между двумя наборами [15 ].Многие из этих беспорядочных белков являются мембранными белками, которые имеют прямой контакт с внешней средой и могут считаться адаптивными белками. Следовательно, это будет способствовать гипотезе о выборе для изменения pI конкретных белков. Однако это не полностью объясняет основность небольших прокариотических протеомов, потому что изменения pI затрагивают также многие немембранные и очень консервативные белки. (Связь между pI и другими явлениями, которые мы обсуждали в дополнительном файле данных 13.)
Было бы интересно исследовать взаимосвязь между изменением распределения pI протеомов и переходом организмов от свободного к внутриклеточному образу жизни на разных стадиях редукции генома. Очень проницательные результаты, касающиеся этого предмета, дадут секвенирование и анализ сокращенных геномов бактериальных эндосимбионтов, идентифицированных в эукариотических хозяевах, например цианобактерия в амебе Paulinella chromatophora , цианобактерия Cyanothece в диатоме Rhopalodia gibba , грамотрицательная бактерия в диатоме Pinnularia nobilis и множество различных бактериальных эндосимбионтов, обнаруженных у различных видов насекомых.Дополнительные интересные результаты могут быть получены при анализе нуклеоморфов — небольших редуцированных эукариотических ядер, обнаруженных в определенных пластидах, присутствующих в некоторых группах водорослей, таких как криптомонады и хлорарахниофиты. Более того, интересно оценить, сколько мутаций требуется или должно быть принято для ремоделирования одного протеома в другой в аспекте их pI. Однако следует принимать во внимание многие факторы, такие как длина, аминокислотный состав, pI исходных белков, скорость мутаций и паттерны нуклеотидных замен и результирующие паттерны аминокислотных замен.
Идентификация основных белков предварительного и малого размера в миелине мыши и их структурная связь с большими и малыми основными белками в JSTOR
Абстрактный
Описан новый метод идентификации антигенно родственных белков с помощью радиоиммуноанализа после фракционирования в геле додецилсульфата натрия / полиакриламида. При исследовании миелина взрослой мыши этим методом были идентифицированы четыре белка, которые антигенно связаны с малым основным белком миелина.Они были обозначены: предбольшие (молекулярная масса 21 500), большие (18 500), малые (17 000) и мелкие (14 000). Четыре белка были выделены элюированием из полиакриламидных гелей, и каждый белок мигрировал в виде единой полосы при анализе либо с помощью электрофореза додецилсульфата натрия, либо с помощью электрофореза в кислотном полиакриламидном геле. Серийные разведения очищенных белков измеряли радиоиммуноанализом. И наклон кривой ингибирования, и уровень максимального ингибирования для каждого белка были такими же, как и для основного белка малого миелина, что указывает на то, что каждый из четырех белков содержит все антигенные сайты, присутствующие в небольшом основном белке.Структурные отношения между четырьмя белками были исследованы с помощью двумерного анализа триптических перевариваемых веществ. Результаты показали, что: large был сходен по аминокислотной последовательности с основным основным белком миелина других видов; small был идентичен по последовательности большой, за исключением внутренней делеции примерно 40 аминокислотных остатков; prelarge содержала последовательность больших плюс дополнительную последовательность из 25-35 аминокислотных остатков; а предварительный малый содержит последовательность малых плюс такую же дополнительную последовательность, что и предварительный большой.Четыре белка также обрабатывали 2- (2-нитрофенилсульфенил) -3-метил-3′-бромоиндолинином (BNPS-skatole), который расщепляет белки специфически по остаткам триптофана. Анализ продуктов расщепления показал, что дополнительная аминокислотная последовательность как в предварительном, так и в малом размере простирается от аминоконца молекулы. Обсуждаются некоторые последствия этих результатов.
Информация о журнале
PNAS — это самый цитируемый в мире междисциплинарный научный сериал.Он публикует высокоэффективные исследовательские отчеты, комментарии, мнения, обзоры и т. Д.
доклады коллоквиума и акции Академии. В соответствии с руководящими
принципы, установленные Джорджем Эллери Хейлом в 1914 году, PNAS издает
краткие первые объявления членов Академии и иностранных партнеров подробнее
важный вклад в исследования и работу, которая, по мнению Участника,
иметь особое значение.
Информация об издателе
Национальная академия наук (НАН) — это частная некоммерческая организация ведущих исследователей страны.НАН признает и продвигает выдающуюся науку путем избрания в члены; публикация в своем журнале PNAS; и его награды, программы и специальные мероприятия. Через Национальные академии наук, инженерии и медицины NAS предоставляет объективные, научно обоснованные рекомендации по важнейшим вопросам, затрагивающим нацию.
Основные миелиновые белки млекопитающих и субмлекопитающих позвоночных: энцефалитогенная активность у морских свинок и крыс
Реферат
Основные белки миелина центральной нервной системы различных позвоночных, млекопитающих и субмлекопитающих, были исследованы на энцефалитогенную активность на морских свинках и крысах Льюиса.Основные белки миелина млекопитающих, птиц (курица), рептилий (черепаха) и земноводных (лягушки) были энцефалитогенными у крыс на уровне 50 мкг; у рыб (карп, акула) полностью бездействовали. Ни один из основных белков миелина от видов суб млекопитающих не был энцефалитогеном у морских свинок при таких высоких уровнях, как 250 мкг. Морские свинки одинаково хорошо реагировали на 5 мкг всех протестированных основных белков миелина млекопитающих, за исключением меньшего из двух белков крысы, который был полностью неактивным на этом уровне.Напротив, крысы хорошо реагировали на белки морской свинки и как на , так и на более мелкие крысиные белки, но не так хорошо на белки других млекопитающих (бык, кролик и человек) на уровне 10 мкг. Различные паттерны реактивности морских свинок и крыс по отношению к основным белкам миелина млекопитающих и субмлекопитающих позволяют предположить, что эти два вида распознают разные аминокислотные последовательности в молекуле основного белка как энцефалитогенные детерминанты. Дополнительные исследования, проведенные на высокочувствительных линиях крыс, показали, что вся ткань спинного мозга саламандр, а также лягушки является энцефалитогеном, а спинной мозг карпа — нет.Свидетельства быстрых автолитических изменений в ткани спинного мозга хладнокровных животных вместе с наблюдаемой гетерогенностью основных белков рыб указывают на необходимость осторожности при интерпретации отрицательных результатов с белками карпа и акулы.
Сноски
-
↵ 1 Секция химии миелина, Лаборатория церебрального метаболизма, Национальный институт психического здоровья, Бетесда, Мэриленд, 20014.
-
↵ 2 Отделение патологии, Центр хронических болезней Нью-Йоркского медицинского колледжа, Берд С.Больница Колера, Остров Благосостояния, Нью-Йорк, штат Нью-Йорк, 10017; при частичной поддержке грантом 536C12 Национального общества рассеянного склероза.
-
↵ 3 Отделение патологии, Медицинский факультет Вашингтонского университета, Сиэтл, Вашингтон 98195; при частичной поддержке Службы общественного здравоохранения США, Национальных институтов здравоохранения, грант NS-03147-12 и Национального общества рассеянного склероза, грант 427E12.
- Поступила 28 января 1972 г.
- Авторские права © 1972 г., Американская ассоциация иммунологов, Inc.
PAGE-SDS Протокол Лэммли
PAGE-SDS Протокол Лэммли
Стандартные решения
1) 1,5 М ацетат-КОН, pH 4,3 (48 мл 1 МКО
+ 17,2 мл AcH + h3O до 200 мл) — Сохранить
RT.
2) 30% акриламида 0,8% метилен-бис
Акриламид. Держать 4 ° C.
3) 0,25 М ацетат-КОН, pH 6,8 (48 мл 1 МКО
+ 2,9 мл AcH + h3O до 200 мл) — Держите при комнатной температуре.
4) 10% персульфат аммония (APS).Хранить
4 ° C менее 1 месяца.
Рабочий буфер
х1
|
бета-аланин |
0,35 млн |
18,7гр |
|
AcH |
0.14 млн |
4,8 мл |
|
h3O до |
600 мл |
|
|
Отрегулируйте pH до |
4.3 |
Держать при RT
Буфер для образцов x5
|
Глицерин 50% |
1,45 мл |
|
0.25 М ацетат-КОН, pH 6,8 |
0,5 мл |
|
Метиловый зеленый |
следы |
Хранить аликвотами по 1 мл при -20 ° C.
Разделительный гель
|
% Акриламид |
10% |
15% |
7% |
Градиент 7.5% |
Градиент 20% |
||
|
1,5 М ацетат-КОН, pH 4,3 |
6,7 мл |
6,7 мл |
6.7 мл |
5,25 мл |
5,25 мл |
||
|
50% глицерин |
6,0 мл | 6.0 мл | 6,0 мл |
0 мл |
4,20 мл |
||
|
30% акриламида 0,8% метилен-бис-акриламида |
8.8 мл |
13,3 мл |
6,4 мл |
5,25 мл |
14.0 мл |
||
|
H 2 O |
4,2 мл |
0 мл |
6,6 мл |
2.9 мл |
0 мл |
||
|
10% APS |
320 ул |
320 ул |
320 ул |
160 ул |
80 ул |
||
|
ТЕМЕД |
40 ул |
40 ул |
40 ул |
50 ул |
50 ул |
Добавьте TEMED и APS в
конец.Осторожно покрутите колбу, чтобы не образовались пузырьки.
Пипетируйте раствор до уровня 4 см от верха. Добавьте 0,3 мл н-бутанола.
Очень резкая граница раздела жидкости будет видна в течение 10-20 минут. Пусть полимеризуется
гель еще не менее часа. Промойте поверхность геля с помощью h3O.
перед заливкой геля для укладки.
Укладка
Гель
|
Количество минигелей |
2 |
5 |
8 |
|
0.25 М ацетат-КОН, pH 6,8 |
2,5 мл |
4,0 мл |
5,0 мл |
|
30% акриламида 0,8% метилен-бис-акриламида |
1.0 мл |
1,5 мл |
2,0 мл |
|
H 2 O |
6,4 мл |
9.6 мл |
12,8 мл |
|
10% APS |
100 ул |
150 ул |
200 ул |
|
ТЕМЕД |
10 ул |
15 ул |
20 ул |
Заполните каждый бутерброд стопкой
гелевый раствор и вставьте гребешок в каждое место, стараясь не задерживать
пузыри ревет зубы.Гель должен полностью полимеризоваться через 1 час. Хранить
гель при 4С не более 2 суток; использовать только свежие
гели . ОБРАТНЫЙ
ПОЛЯРНОСТЬ СВИНЦОВ К ГЕЛЮ (При кислом pH
белки будут заряжены положительно и, следовательно, устремятся к катоду,
так что если мы не изменим полярность, образец будет потерян!). Условия работы: 40 мА / 250 В макс.
Подготовка проб
Перед добавлением буфера для образцов выдержите образцы при 0 ° C.Добавьте буфер для образца (RT) к образцу (все еще находящемуся на льду) и немедленно загрузите.
Для геля толщиной 0,75 мм и 15 лунок, нанесенных на 0,5 мм.
5 мкг для окрашивания Coomasie Blue и в 10-100 раз меньше белка для окрашивания серебром.
Если вы не знаете электрофоретический рисунок своего белка,
загрузите один и тот же образец в параллельные лунки в разное время во время цикла.
Использовать только очищенную или частично
очищенный материал.
Окрашивание
Решение
|
Метанол CP |
500 мл |
50% |
|
Уксусная кислота CP |
100 мл |
10% |
|
H 2 O |
400 мл | |
|
Кумаси бриллиантовый синий R |
2.5гр |
0,25% |
Колбу хранить в темноте при комнатной температуре.
Раствор для разрушения
|
Метанол CP |
150 мл |
15% |
|
Уксусная кислота CP |
100 мл |
10% |
|
H 2 O |
750 мл |
Колбу хранить в темноте при комнатной температуре.
Окрашивать в течение ночи при комнатной температуре или
поместите гель с красящим раствором на несколько секунд в микроволновую печь на высокое положение,
а затем встряхивать еще 15 минут при комнатной температуре.Промыть водой 2-3 раза и обесцветить.
с несколькими сменами обесцвечивающего раствора в присутствии губки.
Доктор Марио Лебендикер Центр очистки белков
Центр Вольфсона для
Прикладная структурная биология , Еврейский университет Иерусалима
марио[email protected]
Телефон: 972-2-6586920
Авторские права
©, 2002, Еврейский университет Иерусалима. Все права защищены.
Фосфорилирование in vivo четырех основных белков миелина головного мозга крысы | Biochemical Journal
При исследовании миелина головного мозга крысы с помощью электрофореза додецилсульфат натрия / полиакриламидослаб-гель с последующей флюорографией окрашенного геля было обнаружено, что множество белков миелина головного мозга крысы были помечены через 2, 4 и 24 часа после внутримозгового введения. из H 3 32 PO 4 .Среди помеченных белков были белки, мигрирующие на позиции миелин-ассоциированного гликопротеина, белки Wolfgram, протеолипидный белок, DM-20 и основные белки. Четыре основных белка с мол. Масс. Было показано, что 21000, 18000 (большой основной белок), 17000 и 14000 (малый основной белок) фосфорилируются после электрофореза в гелевых системах, содержащих как кислота-мочевина, так и додецилсульфат натрия, с последующей флюорографией. Четыре основных белка после окрашивания амидо-черным приобрели голубовато-зеленый цвет, характерный для основных белков миелина.Четыре основных белка очищали до гомогенности. Флюорография очищенных основных белков после повторного электрофореза выявила присутствие фосфорилированных высокомолекулярных «полимеров», связанных с каждым основным белком. Аминокислотные составы фосфорилированного большого основного белка и малых основных белков совместимы с аминокислотными последовательностями. Белки с мол. Масс.


