Омега 3 омега 6 что это: Комплексный анализ крови на ненасыщенные жирные кислоты семейства омега-3 и омега-6
Здоровое питание: как получить жирные кислоты Омега-3 и Омега-6
В мире модниц курс на здоровое питание — причем основная идея именно в балансе ежедневного рациона, а не в поедании различных БАДов. Если вы правильно подберете диету, то выверенное равновесие между углеводами, белками и жирами быстро даст свои плоды и вы будете чувствовать себя гораздо лучше.
Еще один важный аспект, за которым стоит следить, если вы хотите быть здоровой и выглядеть привлекательно — нужно контролировать количество витаминов и полезных веществ в продуктах, которые вы едите. Особенно заострите внимание на том, чтобы в вашей пище было достаточно жирных кислот Омега-3 и Омега-6.
Эти липиды предотвращают появление сердечно-сосудистых заболеваний, обеспечивают нормальное функционирование нервной системы, помогают в борьбе с заболеваниями суставов, укрепляют иммунитет — в общем незаменимы. Самое приятное, что точно оценят девушки — благодаря этим элементам улучшается состояние кожи, волос и ногтей. Ничего кроме пользы.
Ничего кроме пользы.
Большое количество Омега-3 и Омега-6 ищите в рыбе жирных сортов — причем лучше всего, если это будет продукт, выросший в диких условиях. В отличие от фермерской, такая рыба менее жирная и содержит больше полезных микроэлементов — кормление комбикормом и содержание в садках снижает эти показатели. И не бойтесь, что ваша диета станет однообразной — обратите внимание на менее популярные сорта лососевых: чавычу, кету, горбушу, нерку и кижуча. Как правило, эта рыба вылавливается в естественной среде обитания и продается в замороженном виде — но это никак не ухудшает ее свойств.
Блюда, которые можно приготовить с этими видами рыб тоже огромное множество — тут уже как ваша фантазия позволит. Например, в меню может войти суп, стейк из рыбы, салат. Для тех, кто любит экспериментировать с готовкой, есть более креативные варианты — самодельные бургеры с неркой или домашние японские роллы.
Ехать на другой конец страны за дикой рыбой не нужно — все уже давно есть в магазинах. Например, продукты «Дальний Восторг» производства компании «Устькамчатрыба» можно найти в «Азбуках Вкуса», «Рыбторге» на Патриарших и в сети «У Палыча». До здорового образа жизни всего пару шагов.
Например, продукты «Дальний Восторг» производства компании «Устькамчатрыба» можно найти в «Азбуках Вкуса», «Рыбторге» на Патриарших и в сети «У Палыча». До здорового образа жизни всего пару шагов.
Подпишитесь и станьте на шаг ближе к профессионалам мира моды.
Омега-3-6-7-9 — 60 or 140 capsules
Знаете ли вы, что не всегда достаточно приема только омега-3?
Знаете ли вы, что для поддержания организма, не всегда достаточно получать только такие кислоты рыбьего жира, как ЭПК и ДГК? В комплексе вы должны каждый день получать и другие насыщенные жиры. Именно поэтому Омега-3-6-7-9 содержит рыбий жир и четыре различных вида растительных масел. С этим продуктом вы получите как жирные кислоты рыбьего жира ЭПК и ДГК, так другие жирные кислоты, такие как гамма-линоленовая кислота и пальмитолеиновая кислота, которые организм не в состоянии производить самостоятельно. Их вы должны получать из продуктов питания или из вспомогательных препаратов.
Принимая данный препарат, вы обеспечиваете себя достаточным количеством полиненасыщенных жирных кислот столь необходимых для поддержания здоровья. Замена тяжелых животных жиров полиненасыщенными, нормализует работу сердца и кровяных сосудов, способствует понижению уровня холестерина в крови и предотвращает образование тромбов. Данный препарат влияет на состояние кожи, предотвращая аллергический дерматит и сухость, а также на внешний вид и здоровье волос.
Если в вашем рационе не содержится достаточного количество рыбы, орехов или семян, то уровень жировых кислот и рыбьего жира может быть восполнен ежедневным приемом Омега-3-6-7-9.
Качество масел
Мы очень требовательны в отношении качества масел, используемых для производства нашей продукции: оно проходит тщательный контроль и отвечает всем требованиям ЕС Рыбий жир для Омега-3-6-7-9 получают из неотносящейся к исчезающим видам рыбы, обитающих в холодных водах Тихого океана у побережья Перу. Технология производства включает в себя несколько этапов, которые в конечном итоге обеспечивают высокое качество продукта. Вся продукция, а в особенности масло, проходит тестирование на наличие тяжёлых металлов, таких как ртуть, мышьяк, свинец и кадмий. Каждая партия товара соответствует всем требованиям ЕС и проходит контроль на наличие в продукции диоксина, ПХФ, и других вредных химических добавок. Капсулы изготовлены в ЕС по собственному разработанному Via Naturale рецепту.
Технология производства включает в себя несколько этапов, которые в конечном итоге обеспечивают высокое качество продукта. Вся продукция, а в особенности масло, проходит тестирование на наличие тяжёлых металлов, таких как ртуть, мышьяк, свинец и кадмий. Каждая партия товара соответствует всем требованиям ЕС и проходит контроль на наличие в продукции диоксина, ПХФ, и других вредных химических добавок. Капсулы изготовлены в ЕС по собственному разработанному Via Naturale рецепту.
Омега-3-6-7-9 для всей семьи!
Ненасыщенные жирные кислоты предназначены для всей семьи, поскольку недостаток в кислотах возникает уже с самого детства и сохраняется на протяжении всей жизни. Для детей, а иногда и для взрослых, представляется трудным проглотить капсулу целиком, поэтому ее можно разрезать и смешать содержимое с пищей.. Прием Омега 3-6-7-9 не вызовет у вас неприятных вкусовых ощущений: капсулы не имеют вкуса и не вызывают изжогу.
Роль омега-6 и омега-3 жирных для организма больного человека
Почему «омега»?
Эти почти космические слова «омега-3» и «омега-6» каждый если не слышал, то видел на упаковках продуктов. Как и читал о том, что это уникально полезные компоненты пищи. Что же обозначает этот «шифр» из греческой буквы и цифры? Это часть полного химического названия органических соединений – полиненасыщенных жирных кислот (ПНЖК). Они присутствуют в организме человека, животных и растений. Комбинация буквы и цифры обозначает номер атома углерода (отсчет с конца), где молекула такой кислоты изгибается определенным образом – за счет двойной связи. Дальше такие изгибы молекулы повторяются. Как выглядят эти кислоты?
Как и читал о том, что это уникально полезные компоненты пищи. Что же обозначает этот «шифр» из греческой буквы и цифры? Это часть полного химического названия органических соединений – полиненасыщенных жирных кислот (ПНЖК). Они присутствуют в организме человека, животных и растений. Комбинация буквы и цифры обозначает номер атома углерода (отсчет с конца), где молекула такой кислоты изгибается определенным образом – за счет двойной связи. Дальше такие изгибы молекулы повторяются. Как выглядят эти кислоты?
Форма молекулы и количество двойных связей между атомами углерода влияют на ее свойства.
«Омега-3» и «омега-6» кислоты относятся к незаменимым веществам. Линолевая кислота и альфа-линоленовая кислота никаким образом не могут получаться в организме человека. Другие омега-6 и омега-3 – тоже очень нужные вещества — могут получаться в процессе обмена веществ из линолевой и альфа-линоленовой кислоты соответственно.
Но активность ферментов, которые превращают одни омега-кислоты в другие у разных людей сильно отличается. Чтобы не возник дефицит каких-либо из этих кислот – особенно омега-3 – все они должны присутствовать в пище.
Какую роль ПНЖК играют в организме?
-
Превращаются в компоненты мембран клеток. Изогнутая определенным образом молекула – за счет двойных связей — позволяет мембранам быть достаточно плотными, чтобы содержимое клетки не вытекло из нее. В то же время остается пространство для других молекул, помогающих разным веществам проникать внутрь клетки и выходить из нее. -
Являются предшественниками сигнальных веществ, которые регулируют процесс воспаления и работу гладких мышц организма, влияют на иммунитет и жировой обмен. -
Служат источником энергии.
Чем отличается действие омега-3 и омега-6?
1. Что такое омега-6, какое действие оказывают на организм
В организме из линолевой кислоты получается арахидоновая кислота. Она может и поступать с едой.
Эта кислота – предшественник биологически активных веществ организма — эйкозаноидов, которые отвечают за развитие воспалительной реакции, сужение кровеносных сосудов, свертывание крови.
2. Что такое омега-3, какое действие оказывают на организм
Кроме альфа-линоленовой кислоты к омега-3 относятся еще две ненасыщенные кислоты, важные для нормальной работы организма:
В чем особенность их роли в организме?
-
Докозагексаеновая кислота преимущественно встречается в мембранах клеток сетчатки глаза и участках мембран нервных клеток, которые отвечают за восприятие нервного импульса. Поэтому омега-3 важны для нормального зрения и работы нервной системы. -
Из эйкозапентаеновой кислоты тоже получаются эйкозаноиды, как и из омега-6. Но их строение и функции немного отличаются от последних. Они регулируют скорее конечную стадию воспалительного процесса, «выключая» его. Поэтому считается, что омега-3 кислоты проявляют противовоспалительное действие.
Они регулируют скорее конечную стадию воспалительного процесса, «выключая» его. Поэтому считается, что омега-3 кислоты проявляют противовоспалительное действие.
3. Какое соотношение омега-6 и омега-3 жирных кислот должно быть в питании больного человека, и почему это важно?
Чтобы еда способствовала нормальному самочувствию, она должна быть в целом сбалансированной. То же самое работает и для частного случая: соотношение незаменимых жирных кислот в пище.
Приемлемая пропорция омега-3 : омега-6 может колебаться: от 1:10 до 1:1. Оптимальным соотношением для среднестатистическог взрослого человека соотношение омега-3 : омега-6 считается 1:4. Почему это важно? Это дает баланс эйкозаноидов, которые обеспечивают развитие воспалительного ответа, с теми, которые «гасят» его. Во время болезни – например, при раке — в организме больного протекает воспалительный процесс.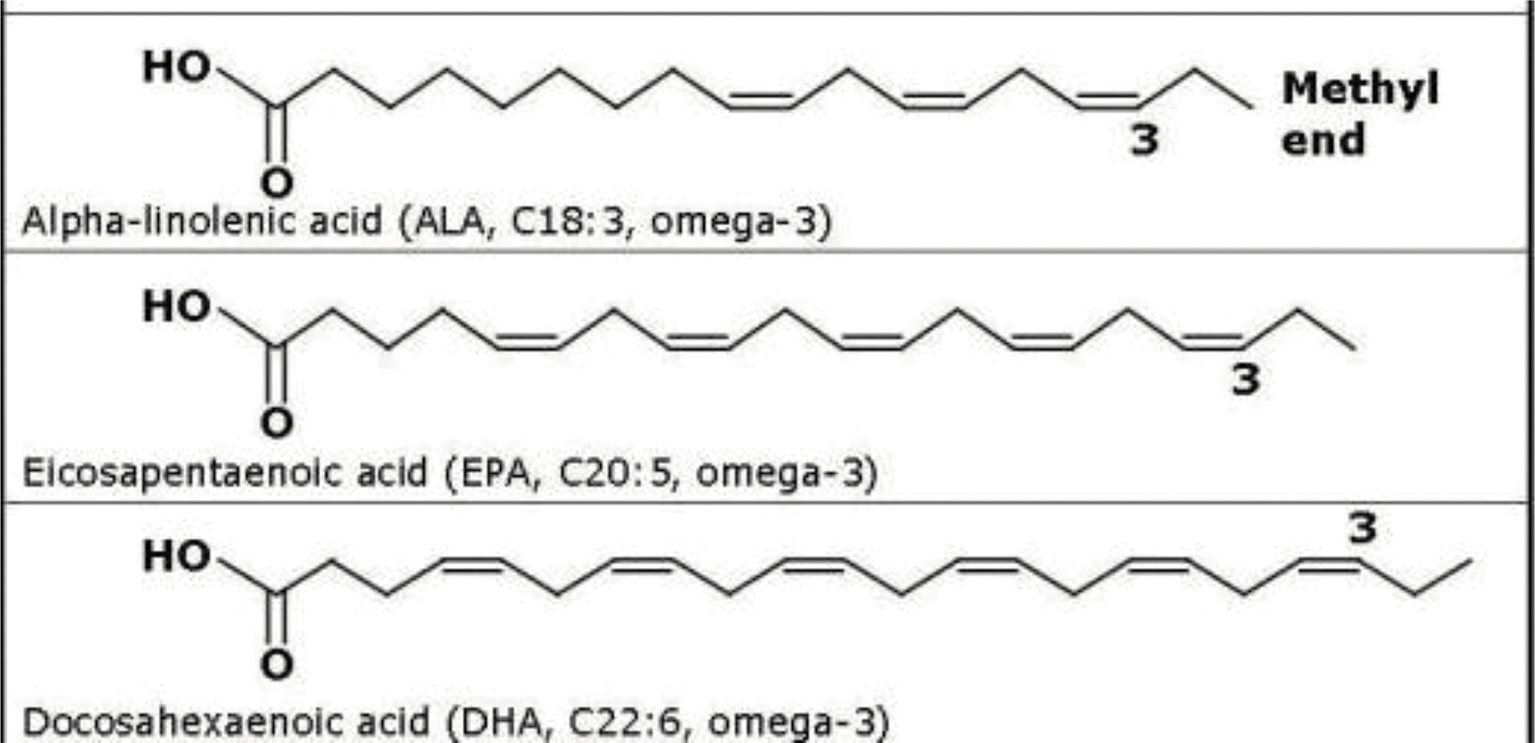 Если он идет слишком бурно, это истощает человека. В связи с этим в специализированных продуктах лечебного питания для онкопациентов, например, Нутриэн Форт (Nutrien Fort), соотношение омега жирных кислот смещается в сторону увеличения противовоспалительных омега-3. Правильное соотношение веществ, которые влияют на воспалительную реакцию и иммунитет, может помочь организму удерживать иммунный ответ на достаточном уровне.
Если он идет слишком бурно, это истощает человека. В связи с этим в специализированных продуктах лечебного питания для онкопациентов, например, Нутриэн Форт (Nutrien Fort), соотношение омега жирных кислот смещается в сторону увеличения противовоспалительных омега-3. Правильное соотношение веществ, которые влияют на воспалительную реакцию и иммунитет, может помочь организму удерживать иммунный ответ на достаточном уровне.
Считается, что потребности в омега-кислотах удовлетворяются, когда в рационе достаточно жирной океанической рыбы и растительных масел (нерафинированных, холодного отжима).
Но бывает ситуация, когда человек не может есть «правильные» продукты. Например, онкологическим больным трудно питаться полноценно. Из-за лучевой и химиотерапии у них воспаляются слизистые рта и глотки, меняются вкусовые ощущения. Полезная еда может показаться несъедобной. Чтобы они могли питаться полноценно, есть лечебные продукты питания с нейтральным вкусом.
4. Соотношение омега-6 к омега-3 в продукте Нутриэн Форт очень хорошее и подходит для онкологических больных
Гиперкалорийная смесь Нутриэн Форт (Nutrien Fort) разработана для поддержки онкологических больных. Ее можно пить как напиток или использовать как энтеральное питание.
Она содержит незаменимые кислоты, причем в ней много более дефицитных омега-3. Это может помочь в сдерживании воспалительного процесса, который всегда есть во время борьбы организма с опухолью.
Смесь Нутриэн Форт (Nutrien Fort) – сама по себе полноценный продукт питания. Ее состав и питательную ценность посмотрите здесь https://nutrien-medical.com/products/nutrien-fort-sukhaya-smes/.
БАЛАНС ОМЕГА-3
Омега-3, Омега-6, Омега-9. Популярность ненасыщенных жиров растет год от года. Но давайте постараемся разобраться, так ли необходимо дополнительно принимать те или иные группы ненасыщенных жиров. Что это? – Мода или необходимость?
Что это? – Мода или необходимость?
Омега-9 жирные кислоты организм человека способен синтезировать самостоятельно и эта группа жиров не относится к незаменимым. То есть, в случае необходимости наш организм самостоятельно запускает процесс образования этого нутриента из подручных материалов. Нужен ли дополнительный прием Омега-9 жирных кислот? – Нет! Не нужен. Используйте в рационе продукты, которые богаты Омега-9 жирными кислотами: оливковое масло, орехи, семя кунжута или авокадо.
Омега-3 и Омега-6 жирные кислоты относятся к незаменимым, эссенциальным. Омега-3 и Омега-6 называются полиненасыщенными , потому что они имеют много двойных связей (поли = много). Человек не обладает ферментами, которые необходыми для их производства и, следовательно, мы должны получить их из рациона.
На протяжении последних десятилетий произошло существенное изменение в потреблении жиров. Мы употребляем слишком много жиров Омега-6 (подсолнечного, кукурузного и сафлорового масел), но при этом из рациона практически исчезли жиры Омега-3 (льняное масло, холодноводная морская рыба). Пищевая промышленность активно использует масла с высоким содержанием Омега-6 ПНЖК для производства соусов, кондитерских изделий, бакалейной продукции. Поступление Омега-6 жирных кислот у взрослого человека увеличилось многократно и значительно превосходит рекомендованные нормы потребления данных нутриентов. Если Вы любитель типичной американской диеты, то поступление Омга-6 жирных кислот превышает рекомендованные нормы примерно в 25 раз.
Пищевая промышленность активно использует масла с высоким содержанием Омега-6 ПНЖК для производства соусов, кондитерских изделий, бакалейной продукции. Поступление Омега-6 жирных кислот у взрослого человека увеличилось многократно и значительно превосходит рекомендованные нормы потребления данных нутриентов. Если Вы любитель типичной американской диеты, то поступление Омга-6 жирных кислот превышает рекомендованные нормы примерно в 25 раз.
Дефицит Омега-6 жирных кислот может отмечаться только у маленьких детей, в питание которых используются неадаптированные молочные смеси, либо вводится неправильно прикорм. Либо может отмечаться у взрослых, страдающих тяжелыми гастроэнтерологическими заболеваниями, при которых страдает переваривание и всасывание жиров.
Истинный секрет хорошего здоровья — в под. держании баланса жиров омега-3 и омега-6 в рационе.
Избыток Омега-6 жиров может привести к повышению уровня эйкозаноидов, ответственных за воспалительные процессы. Помимо прочих нежелательных вещей, эти эйкозаноиды могут сужать просвет кровеносных сосудов и бронхов, повышать кровяное давление. Избыток жиров омена-6 в рационе тесно связан с подавлением иммунитета, раком и воспалительными заболеваниями, такими как астма и артрит.
Избыток жиров омена-6 в рационе тесно связан с подавлением иммунитета, раком и воспалительными заболеваниями, такими как астма и артрит.
Однако нельзя утверждать, что омега-3 полезны, а омена-6 вредны. Такое упрощение не приведет ни к чему хорошему. Необходимо сбалансировать свой рацион по полиненасыщенным кислотам: контролировать избточное поступление Омега-6 и увеличить поступление Омега-3 ПНЖК.
Жирные кислоты омега-9. Это наиболее узнаваемая подгруппа жиров: по сути, сюда относятся мононенасыщенные жиры, содержащиеся в оливках, миндале, орехах макадамия, фундуке, арахисе, кунжутном семени и авокадо. Из этих продуктов отжимают масла, идеально подходящие для готовки. Средиземноморская кухня считается наиболее полезной для здоровья именно благодаря широкому использованию продуктов, богатых жирами омега-9, в первую очередь оливкового масла. Эти жиры, отличающиеся высокой химической стабильностью, препятствуют оседанию холестериновых бляшек на стенках артерий. Ученые неоднократно убеждались, что «средиземноморская диета» — рацион с большим содержанием жиров омега-9 — обладает несравненно лучшими защитными свойствами, чем широко рекламируемая низкожировая высокоуглеводная диета.
Ученые неоднократно убеждались, что «средиземноморская диета» — рацион с большим содержанием жиров омега-9 — обладает несравненно лучшими защитными свойствами, чем широко рекламируемая низкожировая высокоуглеводная диета.
Однако продукты, богатые жирами омега-9, при всей своей пользе для здоровья содержат довольно мало эссенциальных жирных кислот. Жирные кислоты омега-9 не относятся к числу эссен-Диальных, то есть незаменимых, наш организм способен сам вырабатывать их. Полезные качества жиров омега-9 бледнеют на фоне терапевтических свойств жирных кислот омега-3 и омега-6. в рационе, богатом эсенциальными жирными кислотами, жиры группы омега-9 играют лишь вспомогательную роль. Рацион с большим содержанием мононенасыщенных жиров полезнее для здоровья, чем низкожировые диеты; логично ожидать, что еще полезнее будет рацион, бога-тый эссенциальными жирными кислотами.
питание и сохранение молодости кожи
Натуральные масла таят в себе колоссальную пользу для здоровья и красоты кожи. Поэтому их активно используют в косметологии. Косметические средства с добавлением натуральных масел помогают сохранить молодость и красоту кожи
Поэтому их активно используют в косметологии. Косметические средства с добавлением натуральных масел помогают сохранить молодость и красоту кожи
Натуральные масла: смягчение, питание и сохранение молодости кожи
Натуральные масла таят в себе колоссальную пользу для здоровья и красоты кожи. Поэтому их активно используют в косметологии. Косметические средства с добавлением натуральных масел помогают сохранить молодость и красоту кожи.
Масла по-разному воздействуют на кожу, в зависимости от состава и свойств. Существует ряд масел, в состав которых входят полиненасыщенные жирные кислоты Омега-3 (альфа-линоленовая кислота) и Омега-6 (линолевая кислота). Это льняное, миндальное, соевое масло, масло карите, оливы, авокадо и другие. В косметологии активно применяются масла карите, оливы, льна. Они прекрасно воспринимаются кожей в составе косметических средств — кремов и масок.
Кислоты Омега-3 и Омега-6 чрезвычайно необходимы организму человека. Они не синтезируются в нашем организме, а потому должны доставляться извне. Учёными доказана их польза не только для кожи, но и мозга, сердечно-сосудистой системы, других органов и клеток. На кожу они воздействуют тонизирующее, делают её мягкой и упругой, выравнивают морщины. Проникая в глубокие слои кожи, кислоты Омега-3 и Омега-6 снабжают клетки кожи энергией, которая способствует быстрому клеточному обмену. Тем самым кожа насыщается и обновляется на клеточном уровне.
Именно масла способны доставлять эти незаменимые кислоты в глубокие слои кожи. Самая большая их концентрация — в льняном масле. Цену льна знали ещё в Древнем Египте и Индии, а на Руси его он и кормил, и одевал, и грел, и лечил. Не удивительно, что свойства льняного масла высоко ценится и в косметологии. Не менее ценны — масла оливы и карите, которые активно используются при изготовлении кремов и масок, а также используются самостоятельно как дополнительное питание для кожи.
Состав льняного масла
Льняное масло, кроме полиненасыщенных жирных кислот Омега-3 и Омега-6, содержит ряд витаминов: A, E, B, K. Причём, самое большое содержание Омега-3 — именно в льняном масле. Поэтому оно используется как основной источник витаминов и линоленовой кислоты к клеткам кожи.
Состав масла карите
Масло карите (ши) содержит триглицериды, которые образуются жирными кислотами: олеиновой, стеариновой, пальмитиновой. В состав этого масла входят неомыляемые жиры, миристиновая, линолевая, линоленовая кислоты, а также углеводы и протеины.
Полезные свойства масла ши были открыты более 70 лет назад. Тогда учёные обнаружили, что африканские народы применяют масло плодов ши для смазывания кожи. И они не знали ни о каких кожных заболеваниях, а кожа их многие годы остаётся гладкой и упругой. Такой эффект достигается за счёт объединения в продукте жирных кислот и неомыляемых жиров.
Состав оливкового масла
Масло оливы богато содержанием полезных для кожи веществ:
• олеиновая кислота,
• линолевая и линоленовая кислоты (Омега-3 и Омега-6),
• флавоноиды,
• каротин,
• токоферолы,
• фосфолипиды,
• хлорофилл,
• витамины A, C, D, E, K,
• витамины группы B.
Сочетание этих веществ делает масло оливы очень ценным для применения в косметологии.
Натуральные масла карите, оливы, льна в комплексе оказывают неоценимое влияние на кожу:
• смягчают, доставляя в глубокие слои увлажняющие компоненты;
• тонизируют кожу и повышают её эластичность;
• нейтрализуют действие свободных радикалов;
• разглаживают морщины и предупреждают появление новых;
• стимулируют кислородный обмен;
• питают кожу необходимыми для сохранения свежести, упругости и молодости компонентами.
Применение косметических продуктов с содержанием натуральных масел
позволяет обеспечивать кожу необходимым питанием и увлажнением,
препятствует её увяданию. В сохранении молодости кожи помогает активная
косметика Dr. Stern, в составе которой присутствуют натуральные масла.
Вся правда об омега-3 | Здоровье
Если вы еще не в курсе, в море противоречивых знаний о ЗОЖ опять шторм. Десятилетиями врачи и их пациенты верили в пользу омега-3 жирных кислот, но внезапно выяснилось, что рыбий жир не так уж полезен для сердца и сосудов и не тянет на звание эликсира долголетия.
С одной стороны, подобные потрясения мы уже переживали: вспомнить хотя бы историю с красным мясом, которое сначала назвали канцерогенным, а потом реабилитировали. С другой, сейчас речь идет не только о поруганной вере человечества в пользу омега-3 жирных кислот, но и о больших деньгах. Неужели мы напрасно тратились на БАД и лекарства с полиненасыщенными жирными кислотами, рынок которых во всем мире, между прочим, тянет на сотни миллионов долларов? Разобраться в вопросе нам помогла Ирина Десятская, врач-диетолог клуба World Class Павлово.
Судя по реакции профессионального сообщества, ученые сами немного в шоке от результатов последних расследований. Авторитетная научная организация Cochrane, изучив 79 рандомизированных контролируемых исследований, в которых суммарно поучаствовали 112 059 человек, пришла к выводам, что польза омега-3 жирных кислот для профилактики и лечения заболеваний сердца и сосудов и продления жизни, мягко скажем, преувеличена. Как такое возможно, если множество качественных научных исследований ранее доказывали обратное? Эксперты говорят, что позитивные результаты от добавок и лекарств с омега-3 были заметны в группах добровольцев с заболеваниями сердца и сосудов. Если же речь шла о здоровых людях, препараты не оказывали существенного влияния на шансы заболеть или, наоборот, остаться здоровым — но на эту дьявольскую деталь раньше никто не обратил внимания. Так что в 2020 году придется забыть старые рекламные слоганы и поверить в новую реальность: увы, сами по себе полиненасыщенные жирные кислоты омега-3 не защищают нас от проблем с сердцем, сосудами или другими органами. Но это не значит, что они бесполезны. Огромной важности полиненасыщенных кислот для здоровья человека пока никто не отменял.
Важные сведения об омега-3
Жирные кислоты омега-3 нужны для массы важных процессов: без них не бывает нормального жирового обмена, невозможен синтез гормонов, сбоит деятельность мозга и нервной системы. При этом омега-3 (кстати, это группа кислот, наиболее важными и известными являются альфа-линоленовая (АЛК), эйкозапентаеновая (ЭПК) и докозагексаеновая (ДГК), не синтезируются в организме самостоятельно и могут поступать только вместе с пищей. Чтобы ваша внутренняя химическая лаборатория получала ровно то и сколько ей нужно, стоит помнить о важных особенностях омега-3 кислот.
Омега-3 из растительных источников не покрывают всех нужд организма.
«Альфа-линоленовая ЖК имеет растительное происхождение (это семя льна, кунжутное масло, оливковое масло, орехи и т.д.), в организме человека она превращается в другие незаменимые жирные кислоты — ЭПК и ДГК, — объясняет наш эксперт. — И именно эти две — ЭПК и ДГК — играют важную роль в регуляции жирового обмена. Однако в ходе многочисленных исследований стало известно, что альфа-линоленовая кислота способна трансформироваться в ЭПК и ДПК в очень небольших количествах. Эффективность составляет около 5% у мужчин и 7–8% у женщин. И это при том, что процесс трансформации запускается только в случае, если человек здоров, у него работает ген, отвечающий за этот процесс, а в рационе нет избытка омега-6 кислот (к слову, он есть у большинства из нас)».
Условий столько, что специалисты прямо говорят: получать ЭПК и ДПК надежнее напрямую из животных источников: жирной морской рыбы, например трески, скумбрии и морепродуктов. Теоретически достаточно двух-трех порций в неделю, но рыба должна быть мелкой, жирной, с коротким сроком жизни и питающаяся в основном планктоном, а не искусственно выведенная на кормах. Звучит как настоящий квест, особенно для тех, кто не живет на берегу океана и не промышляет рыболовством. Как ни крути, городским жителям могут быть полезны дополнительные источники омега-3 в виде капсул.
Добавки омега-3 не исключают нормального питания.
Внутренняя химическая лаборатория человека настроена получать необходимое для работы топливо из еды — так задумано природой. Поэтому ни один врач не посоветует перейти на капсулы, если можно выстроить нормальный рацион. Палки в эту схему вставляют только современные реалии жизни. «К сожалению, как бы правильно мы ни питались, восполнить дефицит омега-3 жирных кислот очень сложно, — уверена Ирина Десятская. — Мало кто съедает столько рыбы, чтобы удовлетворить эти потребности. Да и качество еды тех же морепродуктов, яиц, овощей, богатых омега-3, далеко от идеала. В своей практике я рекомендую несколько раз в неделю употреблять дикую, не фермерскую рыбу, такие же морепродукты, 1–2 ст. л. качественных нерафинированных растительных масел в день. Но омега-3 (ЭПК и ДГК) в виде биологически активных добавок от надежных производителей и в необходимой для вас дозировке, скорее всего, будут полезны организму. Только не забудьте обсудить это с врачом, прежде чем бежать в аптеку”.
Необходимо соблюдать баланс омега-3, 6 и 9.
Класс полиненасыщенных жирных кислот — это не только омега-3, но и омеги с порядковыми номерами 6 и 9. Каждая из них по-своему нужна и полезна, но это не значит, что правило “чем больше съем, тем лучше будет” здесь уместно. Во-первых, избыток жирных продуктов в целом может сказаться на внешнем виде и самочувствии. Во-вторых, структура питания среднестатистического городского жителя, как правило, включает слишком много омега-6 и 9 (их легко получить из растительных масел, орехов, продуктов промышленного производства) и слишком мало омега-3. Чем это грозит? Главное — омега-6 обладают провоспалительным эффектом, который способны подавить только кислоты омега-3. “Кроме того, эти жирные кислоты конкурируют за одни и те же ферменты: если в рационе намного больше омега-6, начнется угнетение омега-3, — объясняет эксперт. — Дополнительный прием омеги 6 и 9 можно порекомендовать только строгим вегетарианцам, а широким массам более актуально увеличить количество омега-3 из любых источников”. Хорошим выбором тут может стать фермерская продукция. По данным американской FDA, авторитетного регулятора качества пищевых продуктов в США, в мясе и яйцах животных свободного выгула (коров, кур, индейки), которые ели траву, жучков и червячков, преобладают кислоты омега-3. У их собратьев, выросших на комбикорме или кукурузе в тесноте загонов, наоборот, в избытке омега-6.
питательных веществ | Бесплатный полнотекстовый | Увеличение соотношения омега-6 / омега-3 жирных кислот увеличивает риск ожирения
1. Введение
Ожирение — это сложное состояние, включающее нарушение регуляции нескольких систем органов и молекулярных путей, включая жировую ткань, печень, поджелудочную железу, желудочно-кишечный тракт, микробиом, центральная нервная система (ЦНС) и генетика. Роль ЦНС в ожирении привлекает все больше внимания, поскольку показатели ожирения растут, а лечение продолжает неэффективно.Хотя роль гипоталамуса в регуляции аппетита и приема пищи уже давно признана, роль систем вознаграждения ЦНС начинает изучаться по мере изучения роли влияния окружающей среды на энергетический баланс. Кроме того, жирные кислоты омега-3 имеют большие перспективы в профилактике и лечении ожирения.
Полиненасыщенные жирные кислоты омега-6 и омега-3 (ПНЖК) являются незаменимыми жирными кислотами, которые должны быть получены с пищей, не могут производиться людьми и другими млекопитающими из-за отсутствия эндогенных ферментов для десатурации омега-3 [1, 2].Из-за агробизнеса и современного сельского хозяйства западные диеты содержат чрезмерные уровни ПНЖК омега-6, но очень низкие уровни ПНЖК омега-3, что приводит к нездоровому соотношению омега-6 / омега-3 20: 1 вместо 1: 1, как было раньше. во время эволюции у людей (рис. 1) [1,3]. Эйкозаноидные продукты, полученные из омега-6 ПНЖК (такие как простагландин (PG) E2 и лейкотриен (LT) B4, синтезируемый из арахидоновой кислоты (AA)), являются более мощными медиаторами тромбоза. и воспаление, чем аналогичные продукты, полученные из омега-3 ПНЖК (PGE3 и LTB5, синтезированные из эйкозапентаеновой кислоты (EPA)) (Рисунок 2) (Таблица 1) [1,2,3].Таким образом, несбалансированное соотношение омега-6 / омега-3 в пользу омега-6 ПНЖК является сильно протромботическим и провоспалительным, что способствует распространенности атеросклероза, ожирения и диабета [1,2,3,4,5,6] . Фактически, регулярное употребление диет, богатых омега-3 ПНЖК, было связано с низкой заболеваемостью этими заболеваниями, особенно среди исландского населения, коренных народов инуитов и коренных американцев на Аляске [7,8,9]. Однако использование рыбьего жира в качестве основного источника омега-3 ПНЖК для лечения диабета 2 типа не всегда приводило к успеху [6,10,11].Хотя исследования питания показывают, что высокое соотношение омега-6 / омега-3 в значительной степени способствовало «эпидемии ожирения» [12,13], клинические испытания с использованием омега-3 ПНЖК в качестве средств для снижения веса дали противоречивые результаты, оба положительные [14 , 15,16] и отрицательные эффекты [17,18,19] из-за многих факторов (Таблица 2).
В этой статье основное внимание уделяется различным аспектам жирных кислот омега-6 и омега-3 и их соотношению в энергетическом балансе, а также в профилактике и лечении ожирения.
2.Важность соотношения жирных кислот омега-6 / омега-3: метаболические, физиологические и эволюционные аспекты
Существует два класса незаменимых жирных кислот (НЖК): омега-6 и омега-3. Различие между жирными кислотами омега-6 и омега-3 основано на расположении первой двойной связи, считая от метильного конца молекулы жирной кислоты. Жирные кислоты омега-6 представлены линолевой кислотой (LA) (18: 2ω-6), а жирные кислоты омега-3 — альфа-линоленовой кислотой (ALA) (18: 3ω-3). LA в изобилии в природе и содержится в семенах большинства растений, за исключением кокоса, какао и пальмы.АЛК, с другой стороны, содержится в хлоропластах зеленолистных овощей, а также в семенах льна, рапса, чиа, периллы и грецких орехов. Обе незаменимые жирные кислоты метаболизируются до длинноцепочечных жирных кислот из 20 и 22 атомов углерода. LA метаболизируется до арахидоновой кислоты (AA) (20: 4ω6), в то время как ALA метаболизируется до эйкозапентаеновой кислоты (EPA) (20: 5ω3) и докозагексаеновой кислоты (DHA) (22: 6ω3). Это достигается за счет увеличения длины цепи и степени ненасыщенности путем добавления дополнительных двойных связей к карбоксильному концу молекулы жирной кислоты [20] (рис. 3).АК содержится преимущественно в фосфолипидах животных зернового откорма, молочных продуктов и яиц. ЭПК и ДГК содержатся в жирах рыб, особенно жирных рыб. У млекопитающих, в том числе людей, кора головного мозга, сетчатка, семенники и сперма особенно богаты ДГК. DHA — один из самых распространенных компонентов структурных липидов мозга. DHA, как и EPA, может быть получена только путем прямого приема внутрь или путем синтеза из пищевых EPA или ALA: люди и другие млекопитающие, за исключением некоторых плотоядных животных, таких как львы, могут преобразовывать LA в AA и ALA в EPA и DHA, хотя процесс медленный [21,22].Существует конкуренция между жирными кислотами омега-6 и омега-3 за ферменты десатурации. И десатураза жирных кислот 1 (FADS1), и десатураза жирных кислот 2 (FADS2) предпочитают ALA, а не LA [21,23,24]. Однако высокое потребление ЛА, характерное для западных диет, препятствует десатурации и удлинению АЛК [22,23,24,25]. Точно так же трансжирные кислоты мешают десатурации и удлинению как LA, так и ALA. Существуют важные генетические переменные в биосинтезе жирных кислот с участием FADS1 и FADS2, которые кодируют ограничивающие скорость ферменты для метаболизма жирных кислот (Рисунок 3).Ameur et al. [26] выполнили полногеномное генотипирование (n = 5652 человека) области FADS в пяти европейских популяционных когортах и проанализировали имеющиеся геномные данные по человеческим популяциям, архаичным гомининам и более отдаленным приматам. Их результаты показывают, что у современных людей есть два общих гаплотипа FADS A и D, которые резко различаются по своей способности генерировать длинноцепочечные полиненасыщенные жирные кислоты (LC-PUFA). Наиболее распространенный гаплотип, обозначенный гаплотипом D, был связан с высоким уровнем липидов в крови (p = 1 × 10 −65 ), тогда как менее распространенный гаплотип (гаплотип A) был связан с низким уровнем липидов в крови (p = 1 × 10 −52 ).Гаплотип D, связанный с повышенной способностью продуцировать AA и EPA из их предшественников, LA и ALA, соответственно, специфичен для людей и появился после разделения общего предка людей и неандертальцев. Этот гаплотип свидетельствует о положительном отборе в африканских популяциях, в котором он в настоящее время почти закреплен, а за пределами Африки он встречается реже. Гаплотип D обеспечивает более эффективный синтез LC-PUFA, и при сегодняшнем потреблении с пищей большого количества LA омега-6 из растительных масел он приводит к усиленному синтезу AA из LA.В результате гаплотип D представляет собой фактор риска ишемической болезни сердца (ИБС), рака, ожирения, диабета и метаболического синдрома, усугубляя неравенство в состоянии здоровья среди населения африканского происхождения, живущего на Западе, в дополнение к более низкому социально-экономическому статусу [27 , 28]. Более того, FADS2 является лимитирующим ферментом, и есть некоторые свидетельства того, что он уменьшается с возрастом [21]. Недоношенные дети [29], люди с гипертонией [30] и некоторые диабетики [31] ограничены в своей способности вырабатывать EPA и DHA из ALA.Эти данные важны, и их необходимо учитывать при составлении рекомендаций по питанию. Генетические варианты в кластере FADS являются детерминантами уровней длинноцепочечных ПНЖК в кровообращении, клетках и тканях. Эти генетические варианты были изучены с точки зрения происхождения, и доказательства надежны относительно этнической принадлежности. Таким образом, 80% афроамериканцев и около 45% американцев европейского происхождения несут две копии аллелей, связанных с повышенным уровнем АА. Вполне вероятно, что взаимодействия генов ПНЖК, вызванные современной западной диетой, по-разному влияют на риск воспалительных заболеваний (ожирение, диабет, атеросклероз и рак) в различных популяциях.Как упоминалось ранее, клетки млекопитающих не могут преобразовывать омега-6 в жирные кислоты омега-3, потому что в них отсутствует конвертирующий фермент, омега-3 десатураза. Жирные кислоты омега-6 и омега-3 не являются взаимопревращаемыми, метаболически и функционально различны и часто имеют важные противоположные физиологические эффекты, поэтому важен их баланс в диете. Когда люди потребляют рыбу или рыбий жир, ЭПК и ДГК из рациона частично заменяют омега-6 жирные кислоты, особенно АК, в мембранах, вероятно, всех клеток, но особенно в мембранах тромбоцитов, эритроцитов, нейтрофилов, моноцитов и т. Д. клетки печени (см. обзор [3,32]).AA и EPA являются исходными соединениями для производства эйкозаноидов. Из-за повышенного количества омега-6 в западной диете продукты метаболизма эйкозаноидов из АК, в частности простагландины, тромбоксаны, лейкотриены, гидроксижирные кислоты и липоксины, образуются в больших количествах, чем продукты, полученные из жирных кислот омега-3. в частности EPA [3]. Эйкозаноиды из АК являются биологически активными в очень малых количествах и, если они образуются в больших количествах, они способствуют образованию тромбов и атером; аллергическим и воспалительным заболеваниям, особенно у восприимчивых людей; и к пролиферации клеток [33].Таким образом, диета, богатая жирными кислотами омега-6, изменяет физиологическое состояние на провоспалительное, протромботическое и прогрегационное, с увеличением вязкости крови, спазмом сосудов, сужением сосудов и пролиферацией клеток. Между омега-6 и омега-3 существует баланс. жирные кислоты на протяжении долгой эволюционной истории рода Homo [34]. В ходе эволюции омега-3 жирные кислоты были обнаружены во всех потребляемых продуктах: особенно в мясе, рыбе, дикорастущих растениях, орехах и ягодах [34,35,36,37,38,39,40,41,42,43,44,45 , 46,47,48,49,50].Недавние исследования Cordain et al. [51] о составе мяса диких животных подтверждают оригинальные наблюдения Crawford и Sinclair et al. [36,52]. Однако быстрые изменения в питании за короткие периоды времени, которые произошли за последние 100–150 лет, — это совершенно новое явление в эволюции человека (рис. 1). Баланс между омега-6 и омега-3 жирными кислотами — это физиологическое состояние, которое менее воспалительно с точки зрения экспрессии генов [53], метаболизма простагландинов и лейкотриенов и выработки интерлейкина-1 (ИЛ-1) [3].Современное сельское хозяйство, изменив корма для животных в результате его упора на производство, снизило содержание омега-3 жирных кислот во многих пищевых продуктах: мясе животных, яйцах и даже рыбе [39,40,41,42]. Продукты из съедобных дикорастущих растений содержат хороший баланс жирных кислот омега-6 и омега-3. Портулак, дикорастущее растение, по сравнению со шпинатом, красным листом салата, салатом-латуком и зеленью горчицы, содержит в восемь раз больше АЛК, чем культурные растения [46]. Современная аквакультура производит рыбу, которая содержит меньше омега-3 жирных кислот, чем рыба, выращиваемая естественным образом в океане, реках и озерах [41].В составе жирных кислот яичного желтка кур на свободном выгуле соотношение омега-6: омега-3 составляет 1,3, тогда как в яйцах Министерства сельского хозяйства США (USDA) соотношение составляет 19,9 [42]. За счет обогащения корма для кур рыбной мукой или льняным семеном соотношение омега-6: омега-3 снизилось до 6,6 и 1,6 соответственно. Хотя диеты различаются в разных географических регионах [54], ряд исследователей, включая Кроуфорда [36], Кордейна [51], Eaton [55] и Kupiers [56] показали, что в период палеолита в рацион человека входили равные количества жирных кислот омега-6 и омега-3 как из растений (LA + ALA), так и из жиров. диких животных и рыб (AA + EPA + DHA).Недавние исследования Kuipers et al. [56] оценили потребление макроэлементов и жирных кислот из рациона палеолита Восточной Африки, чтобы реконструировать несколько рационов палеолита и, таким образом, оценить диапазоны потребления питательных веществ, в которых эволюционировал человек. Они обнаружили (диапазон медианы в% энергии) потребление белков от умеренного до высокого (25–29%), от умеренного до высокого (30–39%) и умеренных углеводов (39–40%). Так же, как другие пришли к выводу ранее, Kuipers et al. [56] утверждали, что «по сравнению с западными диетами палеолитические диеты содержали неизменно высокое содержание белка и длинноцепочечных ПНЖК и более низкое содержание LA».Guil-Guerrero J et al. [57] определили жировой состав замороженных мамонтов (от 41000 до 34000 лет назад), бизонов из раннего голоцена (8200–9300 лет назад) и лошадей из среднего голоцена (4600–4400 лет назад), часто потребляемых охотниками эпохи палеолита / неолита. собирателей и пришли к выводу, что «животный жир содержал подходящие количества омега-3 и омега-6 жирных кислот, возможно, в количествах, достаточных для удовлетворения сегодняшних диетических требований для хорошего здоровья». Выяснение источников омега-3 жирных кислот, доступных для людей, живших в палеолите и неолите, очень важно для определения доступности питательных веществ в то время и для заключения о здоровых пищевых привычках для современных людей.Как и в предыдущих исследованиях, количество ALA было выше, чем количество LA в жире замороженных образцов [58,59] (Таблица 3 и Таблица 4).
3. Влияние жирных кислот омега-6 и омега-3 и их соотношение на ожирение
Экспериментальные исследования показали, что жирные кислоты омега-3 и омега-6 могут вызывать различные эффекты на увеличение жировых отложений за счет механизмов адипогенеза [60], липидный гомеостаз [61,62], ось мозг-кишечник-жировая ткань [63] и системное воспаление [64]. Метаболиты АК (20: 4ω-6) играют важную роль в терминальной дифференцировке преадипоцитов в зрелые адипоциты [65].Этот эффект может подавляться омега-3 жирными кислотами на нескольких этапах [66,67,68,69]. Жирные кислоты омега-6 увеличивают содержание триглицеридов в клетках за счет увеличения проницаемости мембран [70], тогда как жирные кислоты омега-3 уменьшают отложение жира в жировых тканях, подавляя липогенные ферменты и увеличивая β-окисление [71]. Кроме того, омега-6 и омега-3 жирные кислоты по-разному модулируют ось мозг-кишечник-жировая ткань [63] и воспалительные свойства последующих эйкозаноидов, которые в конечном итоге влияют на дифференцировку преадипоцитов и рост жировой массы [72].Белые адипоциты накапливают энергию в форме триглицеридов, тогда как коричневые адипоциты рассеивают энергию триглицеридов, выделяя тепло (таблица 5). У грызунов и, возможно, у людей оба типа жировых клеток участвуют в общем энергетическом балансе. Изменяя скорость дифференцировки и пролиферации адипоцитов, различия в составе жирных кислот пищевых жиров могут также способствовать развитию жировой ткани, в частности, в отношении относительного потребления жирных кислот омега-6 и омега-3.Отношение омега-6 / омега-3 определяет доступность омега-6-АК в жировой ткани и, таким образом, уровень различных простагландинов, происходящих из опосредованных циклооксигеназой путей, которые могут блокироваться жирными кислотами омега-3 (рис. 2). . Недавние исследования показали, что воздействие на мышей диеты с высоким содержанием омега-6 жирных кислот (аналогично западной диете) в перинатальном периоде приводит к прогрессивному накоплению жира в организме от поколения к поколению, что согласуется с тем фактом, что у людей постоянно наблюдается избыточный вес и ожирение. увеличились в последние десятилетия и возникают раньше в жизни [12,73].Кроме того, метаболиты АК, простагландины E2 и F2α играют ингибирующую роль в процессе потемнения белых жировых клеток, превращающихся в рассеивающие энергию коричневые жировые клетки, которые, как полагают, играют роль в контроле энергетического баланса за счет снижения массы тела [74,75,76, 77,78,79,80,81,82] (Таблица 5). Высокое потребление омега-6 жирных кислот в перинатальный период связано с повышенным ожирением у потомства. В исследованиях на людях уровень АК в жировой ткани связан с ИМТ и избыточным весом детей.Высокое содержание омега-6 / омега-3 жирных кислот в фосфолипидах мембран эритроцитов пуповины (эритроцитов) было связано с высокой толщиной подлопаточной кожной складки в возрасте 3 лет [5]. Исследования на животных и людях показали, что добавление EPA и DHA может защищать от ожирения и снижать прибавку в весе у уже страдающих ожирением животных и людей [83]. В частности, исследования продемонстрировали снижение висцерального (эпидидимального и / или забрюшинного) жира у крыс, получавших диету с высоким содержанием липидов, включающую ПНЖК омега-3 [75,78,79,84,85,86,87], и эффект был дозовым. зависимый [85].Уменьшение висцерального жира было связано с уменьшением размера [85,86] и количества адипоцитов [87]. Было показано, что диета с высоким содержанием жиров, богатая омега-6 жирными кислотами, увеличивает риск резистентности к лептину, диабета и ожирения у людей и грызунов [76,88]. АК нарушает передачу сигналов лептина в гипоталамусе и энергетический гомеостаз у мышей [77]. Предполагается, что ингибирующая роль АК действует как в базальной, так и в стимулированной инсулином экспрессии и продукции лептина [88].
3.1. Модель
трансгенных мышей Fat-1. Многие проблемы, связанные с исследованиями диетических животных, могут быть преодолены с помощью модели трансгенных мышей Fat-1, несущих ген Fat-1 Caenorhabditis elegans, кодирующий десатуразу жирных кислот омега-3.Этот фермент может преобразовывать омега-6 в жирные кислоты омега-3 путем добавления двойной связи в положение омега-3 [89]. Следовательно, жир-1 не только увеличивает уровень жирных кислот омега-3, но и одновременно снижает уровень жирных кислот омега-6, а также соотношение омега-6 / омега-3 — цель, которую трудно достичь только с помощью диетических средств, но она важна. для пользы для здоровья. Хотя трансгенная модель не полностью соответствует диетическому подходу, она производит те же типы жирных кислот омега-3, что и получаемые с пищей [89].Кроме того, модель жира-1 предлагает многочисленные преимущества в исследованиях пользы для здоровья жирных кислот омега-3, поскольку трансгенная модель позволяет выяснить механизмы действия жирных кислот омега-3 без затрудняющих факторов, связанных с диетическими подходами. такие как доза, состав и продолжительность лечения, применявшиеся в различных исследованиях [16,90,91] (Таблица 2). Использование мышиной модели с жиром-1 позволяет избежать этих проблем, скармливая точно такой же рацион трансгенным мышам и мышам дикого типа (WT).Поскольку FAT-1 является ферментом, производство жирных кислот омега-3 у мышей ограничено количеством доступного субстрата: жирных кислот омега-6. Было показано, что степень увеличения жирных кислот омега-3 (в 3-4 раза), необходимая для улучшения параметров метаболизма у трансгенных мышей, содержащих жир-1, достижима с помощью диетических средств у животных и людей [92]. Недавно Ли и др. [93] провели всестороннее исследование с использованием модели жира-1, чтобы лучше определить, как изменения уровней омега-6 и омега-3 жирных кислот в тканях влияют на энергетический баланс, метаболизм липидов и глюкозы, хроническое воспаление и лежащие в основе молекулярные явления. (или механизмы).Их результаты показывают, что при использовании диеты с высоким содержанием жиров мыши с жиром 1 сильно сопротивлялись ожирению, диабету, гиперхолестеринемии и стеатозу печени. Эндогенное повышение ПНЖК омега-3 и снижение ПНЖК омега-6 не повлияло на количество потребляемой пищи, но привело к увеличению расхода энергии у мышей с жиром-1. Эти метаболические фенотипы сопровождались ослаблением воспалительного состояния, поскольку уровни в тканях простагландина E2, лейкотриена B4, хемоаттрактантного протеина-1 моноцитов и TNF-α были значительно снижены.TNF-α-индуцированная передача сигналов NF-κB была почти полностью отменена. В соответствии с уменьшением хронического воспаления и значительным увеличением активности рецептора-γ, активируемого пролифератором пероксисом, в ткани печени с жиром-1, передача сигналов инсулина в печени резко повышалась. Активность пролипогенных регуляторов, таких как Х-рецептор печени, стеароилСоА-десатураза-1 и белок-1, связывающий регуляторный элемент стерола, резко снизилась, тогда как активность рецептора-α, активируемого пролифератором пероксисом, ядерного рецептора, который способствует β-окислению липидов. , был заметно увеличен [93].Таким образом, эндогенное превращение омега-6 в омега-3 ПНЖК через жир-1 сильно защищает от ожирения, диабета, воспаления и дислипидемии и может представлять собой новый терапевтический метод лечения этих распространенных заболеваний.
3.2. Исследования на людях
Рандомизированные контролируемые испытания на людях, изучающие взаимосвязь между добавками омега-3 и составом тела, дали противоречивые результаты из-за многих факторов, обобщенных в Таблице 2 [19,83]. Это может быть связано с различиями в дизайне исследований, дозировках, без учета соотношения омега-6 / омега-3 в фоновой диете, времени и продолжительности приема омега-3 ПНЖК, использовании других добавок помимо омега-3. 3 ПНЖК и демографические данные исследуемой популяции.Кроме того, во многих исследованиях определение жирных кислот омега-6 / омега-3 было основано на опросниках частоты приема пищи, которые не так точны, как прямые измерения жирных кислот в фосфолипидах мембран эритроцитов. Несколько исследований предоставили подтверждающие доказательства роли омега-3 ПНЖК в составе тела [94], снижении веса [95], уменьшении чувства голода и большей сытости [96]. Эти данные подтверждают потенциальную роль омега-3 в регуляции аппетита у людей. Некоторые интервенционные исследования показали, что добавление омега-3 жирных кислот снижает массу тела и ожирение у худых [14], страдающих избыточным весом [95,97] и ожирения [98].Couet et al. [14] отметили увеличение базального окисления липидов на 22% при приеме 6 граммов рыбьего жира в течение 3 недель. Жирные кислоты омега-3 являются долгосрочными распределителями топлива для метаболизма с большим распределением в сторону β-окисления у мужчин, чем у женщин. Определение фосфолипидов мембран красных кровяных телец омега-6 и омега-3 представляет собой биомаркеры пищевого потребления и эндогенного метаболизма и представляет собой наиболее точную информацию. способ проведения профилактических исследований и клинических интервенционных исследований для оценки их роли в увеличении веса и ожирении [99].Wang et al. [100] провели проспективный анализ для изучения связи базовых уровней фосфолипидов мембран эритроцитов, жирных кислот омега-3, жирных кислот омега-6, соотношения омега-6 / омега-3 и трансжирных кислот с продольными изменениями массы тела. и риск получить избыточный вес или ожирение в среднем в течение 10,4 лет наблюдения в исследовании NIH Women’s Health Initiative Study. Результаты этого проспективного исследования показали, что базовые уровни фосфолипидов мембран эритроцитов цис-омега-3 жирных кислот обратно пропорциональны, а цис-омега-6 жирные кислоты положительно связаны с продольным увеличением веса у здоровых женщин с изначально нормальным весом.Это первое исследование, в котором проспективно изучаются жирные кислоты омега-3 и омега-6 в фосфолипидах мембран эритроцитов в зависимости от увеличения веса и риска ожирения. После многопараметрической корректировки значимые положительные ассоциации с увеличением веса были обнаружены только для дигомо-γ-линоленовой кислоты (DGLA), LA и гамма-линоленовой кислоты (GLA) среди жирных кислот омега-6 и транс-18: 1 среди трансжирных кислот; в то время как между жирными кислотами омега-3 была обнаружена обратная связь с EPA.Авторы заявляют, что «вариации по отдельным жирным кислотам могут быть связаны с неизвестными и неконтролируемыми факторами, участвующими в превращении и метаболизме каждой жирной кислоты, и их следует интерпретировать с осторожностью, учитывая множественные сравнения. Это исследование включало только женщин с нормальным ИМТ на исходном уровне, чтобы свести к минимуму возможные искажения и снизить риск избыточного веса или ожирения ». Чтобы дополнительно оценить влияние исходного ИМТ на результаты, Wang et al. [100] стратифицированный анализ по исходным уровням ИМТ (18.5 – ≤23, 23 – ≤25 кг / м 2 ), а также включили женщин с избыточным весом или ожирением на исходном уровне (исходный ИМТ ≥ 25 кг / м 2 ) в анализ чувствительности. Подобные модели ассоциаций были обнаружены в этих дополнительных анализах. В заключение, это проспективное исследование предоставило убедительные доказательства того, что жирные кислоты омега-3 в фосфолипидах мембран эритроцитов обратно связаны, в то время как цис-омега-6 жирные кислоты, соотношение омега-6 / омега-3 и трансжирные кислоты положительно связаны с продольная прибавка в весе.
5. Соотношение жирных кислот омега-6 / омега-3: эндоканнабиноидная система
Диета с высоким содержанием соотношения омега-6 / омега-3 вызывает усиление передачи сигналов эндоканнабиноидов и связанных с ними медиаторов, что приводит к усилению воспалительного состояния. энергетический гомеостаз и настроение. В экспериментах на животных высокое потребление омега-6 кислот приводит к снижению чувствительности к инсулину в мышцах и способствует накоплению жира в жировой ткани. Подходы к питанию с диетическими жирными кислотами омега-3 устраняют нарушение регуляции этой системы, улучшают чувствительность к инсулину и контролируют жировые отложения.
Эндоканнабиноиды — это липиды, полученные из жирных кислот омега-6. Их концентрации регулируются (1) потреблением с пищей омега-6 и омега-3 жирных кислот; и (2) активностью биосинтетических и катаболических ферментов, участвующих в эндоканнабиноидном пути, который играет важную роль в регуляции аппетита и метаболизма [81,104]. Эндоканнабиноидная система участвует в регуляции энергетического баланса, а устойчивая гиперактивность эндоканнабиноидной системы способствует ожирению [81,82].AA является предшественником 2-арахидоноилглицерина (2-AG) и анандамида (AEA). Увеличение пула предшественников АК вызывает чрезмерную передачу сигналов эндоканнабиноидов, приводящую к увеличению веса и метаболическому профилю, связанному с ожирением. Эндоканнабиноиды активируют эндогенные каннабиноидные рецепторы CB1 и CB2 в головном мозге, печени, жировой ткани и желудочно-кишечном тракте [105]. Активация рецепторов CB1 в гипоталамусе приводит к повышению аппетита и приема пищи [82]. В экспериментах на мышах эндоканнабиноиды избирательно усиливают сладкий вкус, который в нынешних высококалорийных пищевых продуктах стимулирует прием пищи [106].Эндоканнабиноидная система функционирует совместно с другими системами, регулирующими потребление пищи и энергетический баланс, и регулируется лептином, инсулином, грелином, холецистокинином и другими сигналами. Нацеливание на эндоканнабиноидную систему было стратегией снижения веса. Рандомизированные контролируемые клинические испытания на людях с избыточной массой тела или ожирением показали, что антагонисты рецепторов CB1, такие как римонабант, приводят к значительной потере веса после одного года лечения [107]. Однако препарат был снят с продажи из-за серьезных побочных эффектов, которые привели к повышенному риску тревоги, депрессии и суицида [108].Alvheim et al. [80] провели эксперимент на мышах в возрасте шести недель, в котором увеличение содержания линолевой кислоты в рационе приводило к увеличению содержания АК в фосфолипидах мембран эритроцитов, повышению уровня 2-AG и AEA в печени, повышению уровня лептина в плазме и привело к увеличению размера адипоцитов и увеличению инфильтрации макрофагов в жировой ткани. Также было отмечено, что более высокое содержание линолевой кислоты увеличивало эффективность корма и вызывало больший набор веса, чем изокалорийные рационы, содержащие меньше LA. Повышение диетической LA с 1% до 8% энергии увеличивало уровень эндоканнабиноидов в печени, что увеличивало риск развития ожирения даже при диете с низким содержанием жиров.Мыши с хроническим дефицитом омега-3 ПНЖК имеют значительно более низкие концентрации DHA в фосфолипидах мозга и более высокие 2-AG (производные от АК) по сравнению с мышами с достаточным количеством омега-3 ПНЖК в своем рационе [82]. Кроме того, добавление омега-3 ПНЖК мышам с 10% -ным содержанием ДГК-богатого рыбьего жира в течение 4 недель привело к более высоким уровням ДГК в мозге по сравнению с мышами, соблюдающими диету с низким содержанием омега-3 ПНЖК, и привело к значительному снижению 2-АГ в мозге и мозг AA. Такой подход к питанию с диетическими ПНЖК омега-3 обратил вспять нарушение регуляции каннабиноидной системы, улучшил чувствительность к инсулину и уменьшил центральный жир тела.
3 мифа об омега-3 и омега-6, развенчаны
Омега-3 и омега-6 — оба типа диетических жиров, каждый из которых имеет свою пользу для здоровья. Омега-3 — это тип полиненасыщенных жиров, которые ваше тело не может вырабатывать самостоятельно, а это означает, что вам нужно получать их из своего рациона или из добавок. Рыба — это, вероятно, то, что большинство людей представляют себе, когда думают об омега-3, из-за чего может показаться, что невозможно обеспечить референсную суточную норму потребления (RDI) на веганской диете. Вот правда: вы можете получать достаточно здоровых жиров, таких как омега-3 и омега-6, на веганской диете.Читайте дальше, чтобы развеять самые популярные мифы об омегах.
Что такое омега-3 и омега-6?
Существует несколько различных типов омега-3. Организм использует альфа-линолевую кислоту, тип жирных кислот омега-3, содержащихся в растительных источниках, в основном для получения энергии. Два других типа — это эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA).
«Две незаменимые жирные кислоты, которые должны быть получены с пищей, — это линолевая кислота и альфа-линоленовая кислота», — рассказывает LIVEKINDLY Джоди Бержерон, медперсонал в Cape Cod Healthcare. «Типичная западная диета содержит больше омега-6 жирных кислот по сравнению с омега-3 жирными кислотами. Как омега-6, так и омега-3 жирные кислоты необходимы для нормального роста и развития, а также для неврологической функции ».
Омега-3 жирные кислоты полезны для здоровья сердца. Они могут помочь повысить уровень «хорошего» холестерина липопротеинов высокой плотности (ЛПВП), снизить кровяное давление и уменьшить артериальный налет. Исследования также показали, что EPA может улучшить психическое здоровье за счет уменьшения симптомов депрессии; он также помогает уменьшить воспаление, которое может усугубить симптомы ряда хронических заболеваний.
DHA поддерживает здоровое развитие мозга у младенцев, может помочь улучшить память с возрастом и помочь в правильном контроле веса.
Омега-6, еще один тип полиненасыщенных жирных кислот, также необходимы. Организм использует их в первую очередь для получения энергии; самый распространенный вид — линолевая кислота.
А теперь давайте разберемся с мифами.
Семена чиа, конопли, льняное семя и грецкие орехи содержат омега-3 | Милада Вигерова через Unsplash
МИФ №1: Омега-3 можно получить только из рыбы
Жирная рыба, такая как лосось и тунец, являются хорошо известными источниками омега-3, что может показаться плохой новостью для веганов и людей, не любящих рыбу.Но можно получить достаточное количество омега-3 на растительной диете; Американская кардиологическая ассоциация рекомендует получать от 1,5 до трех граммов ALA omega 3 в день. Потребление EPA и DHA колеблется от 0,5 до 1,8 в день.
Растительные источники омега-3
Семена чиа: Одна унция чиа содержит 4915 мг АЛК, что составляет до 447 процентов от рекомендуемой суточной нормы потребления (РСНП).
Семена конопли: Одна унция обеспечивает 6000 мг ALA, что составляет от 375 до 545 процентов от РСНП.
Семена льна: Унция семян льна содержит 6 388 мг ALA, что составляет впечатляющие 400–580 процентов от РСНП.
Грецкие орехи: Одна порция (одна унция) обеспечивает 2 542 мг АЛК, примерно 159–231 процент от того, что вам нужно в день.
Однако некоторым может быть сложно удовлетворить свои ежедневные потребности только за счет цельных источников пищи. Кроме того, в этих источниках отсутствуют EPA и DHA. По данным Академии питания и диетологии, мужчинам и женщинам в возрасте от 19 до 50 необходимо 12 граммов и 17 граммов жирных кислот омега-6 в день.
Веганская добавка с омега-3, содержащая водорослевое масло, может быть источником EPA и DHA (а некоторые добавки содержат как омега-3, так и омега-6), но вы всегда должны проконсультироваться с врачом, прежде чем добавлять добавку в свой рацион.
Растительные источники омега-6
Грецкие орехи: Одна унция содержит 10 800 мг, что составляет 64 процента от РСНП.
Тофу: 3,5 унции дадут вам 4970 мг, что составляет 29 процентов от РСНП.
Семена конопли: Три столовые ложки добавят к вашему рациону 8 240 мг, что составляет 47 процентов от РСНП.
Семена подсолнечника: В унции содержится 10 600 мг, что составляет 62 процента от РСНП.
Арахисовое масло: Одна столовая ложка арахисового масла содержит 1960 мг, что составляет около 11 процентов от РСНП.
Миндаль: В одной унции 3490 мг, что составляет 20 процентов от РСНП.
Кешью: Унция содержит 2210 мг, что составляет 13 процентов от РСНП.
Некоторые растительные масла, такие как авокадо и сафлор, также содержат омега-6.
Средиземноморская диета имеет более высокое соотношение жирных кислот омега-3 к омега-6.| Калум Льюис через Unsplash
МИФ № 2: Омега 6 вызывает воспаление
Распространенное заблуждение состоит в том, что омега-6 вызывает воспаление. В частности, диета, при которой вы получаете больше омега-6, чем омега-3.
«Линолевая кислота (LA) является основной жирной кислотой омега-6 в рационе и превращается в арахидоновую кислоту (AA), которая может быть связана с воспалением», — объясняет Bergeron. Но не беспокойтесь: организм очень мало конвертирует ЛА в АА. Бержерон добавляет, что полиненасыщенные жиры омега-6 на самом деле обладают противовоспалительными свойствами, поэтому употребление большего количества пищи может помочь уменьшить воспаление.Омега-6 может даже помочь снизить риск сердечных заболеваний.
«Хорошо известно, что хроническое воспаление средней степени тяжести и окислительный стресс связаны с сердечно-сосудистыми заболеваниями, раком и другими хроническими состояниями», — добавляет она. Все сводится к диете. Средиземноморская диета, которая обычно включает рыбу, но также может быть основана на растениях, фокусируется на большом количестве «противовоспалительных и богатых питательными веществами продуктов» , таких как овощи, фрукты, цельнозерновые, орехи и семена.
«В нем более высокое соотношение жирных кислот омега-3 и омега-6, что приводит к уменьшению воспаления», — добавляет она. «Высокое количество фитонутриентов и клетчатки в рационе, наряду с низким гликемическим индексом и низким содержанием насыщенных жиров, способствует уменьшению воспалительных процессов в организме».
Настоящие жиры, которые вам следует минимизировать, — это насыщенные, трансжирные кислоты и частично гидрогенизированные масла.
Трансжирные кислоты и частично гидрогенизированные масла обычно используются для жареной пищи. К ним относятся жареный цыпленок, картофель фри, упакованные торты и печенье, корки для пирогов, пончики и жареные закуски.Оба эти фактора могут нанести вред здоровью сердца, и их следует сводить к минимуму.
Американская кардиологическая ассоциация рекомендует растительную диету для снижения уровня холестерина. | Мариана Медведева через Unsplash
МИФ № 3: Омега-3 добавки понижают уровень холестерина
Вопреки тому, что многие из нас читали, существует мало доказательств того, что добавки омега-3 снижают уровень холестерина. Однако мыслительный процесс, лежащий в основе приема добавок омега-3 для здоровья сердца, не является неправильным.
Исследования показали, что омега-3 может значительно снизить уровень триглицеридов — жира, который увеличивает риск сердечных заболеваний.Более эффективный способ снизить уровень холестерина — заменить насыщенные жиры полиненасыщенными, например омега-3.
Такие продукты, как говядина, баранина, свинина, птица в кожуре, сало, сыр и жирные молочные продукты, содержат насыщенные жиры. Растительная диета может снизить уровень холестерина — Американская кардиологическая ассоциация даже рекомендует это.
Несмотря на миф о том, что омега-3 получают из рыбы, получить достаточное количество его (и омега-6) на веганской диете легко, если вы регулярно едите перечисленные выше продукты.
LIVEKINDLY здесь, чтобы помочь вам ориентироваться на растущем рынке экологически чистых продуктов, которые продвигают добрую планету. Все наши подборки курируются редакционной группой. Если вы покупаете что-то, на что мы ссылаемся на нашем сайте, LIVEKINDLY может получать комиссию.
Значение полиненасыщенных жирных кислот с высоким содержанием омега-6 для здоровья
Полиненасыщенные жирные кислоты омега-6 (n-6) (например, арахидоновая кислота (AA)) и омега-3 (n-3) PUFA (напр.например, эйкозапентаеновая кислота (EPA)) являются предшественниками мощных сигнальных молекул липидного медиатора, называемых «эйкозаноидами», которые играют важную роль в регуляции воспаления. В целом, эйкозаноиды, полученные из n-6 PUFA, обладают провоспалительным действием, в то время как эйкозаноиды, полученные из n-3 PUFA, обладают противовоспалительным действием. Изменения в рационе питания за последние несколько десятилетий в потреблении n-6 и n-3 ПНЖК показывают резкое увеличение соотношения (n-6) к (n-3) (~ 15: 1), что связано с усилением метаболизма n-6 PUFA по сравнению с n-3 PUFA.С увеличением соотношения (n-6): (n-3) ПНЖК наблюдается увеличение хронических воспалительных заболеваний, таких как неалкогольная жировая болезнь печени (НАЖБП), сердечно-сосудистые заболевания, ожирение, воспалительное заболевание кишечника (ВЗК), ревматоидный артрит. и болезнь Альцгеймера (БА). Увеличивая соотношение (n-3): (n-6) ПНЖК в западной диете, можно добиться снижения частоты этих хронических воспалительных заболеваний.
1. Введение
Жирные кислоты — это углеводородные цепи с карбоксильной группой на одном конце и метильной группой на другом.Биологическая реакционная способность жирных кислот определяется длиной углеродной цепи, а также количеством и положением любых присутствующих двойных связей. В то время как насыщенные жирные кислоты не содержат двойных связей в ацильной цепи, ненасыщенные жирные кислоты содержат по крайней мере одну двойную связь. Когда присутствуют две или более двойных связей, ненасыщенные жирные кислоты называют ПНЖК [1]. Существует два семейства ПНЖК, и они классифицируются как омега-3 (n-3) и омега-6 (n-6) в зависимости от расположения последней двойной связи относительно концевого метильного конца молекулы [2] .Человеческий организм может производить все необходимые ему жирные кислоты, кроме двух. Линолевая кислота (LA, C18: 2n-6) (предшественник ряда жирных кислот n-6) и α -линоленовая кислота (ALA, C18: 3n-3) (предшественник ряда жирных кислот n-3 ) являются простейшими членами каждого семейства ПНЖК и называются незаменимыми жирными кислотами, поскольку организм не может их синтезировать. ПНЖК регулируют широкий спектр биологических функций в зависимости от расположения последней двойной связи, которые варьируются от артериального давления и свертывания крови до правильного развития и функционирования мозга и нервной системы [2].Кроме того, липидные медиаторы, полученные из длинноцепочечных (LC-) PUFA (арахидоновая кислота (AA) в серии n-6 и эйкозапентаеновая кислота (EPA) и докозагексаеновая кислота (DHA) в серии n-3), играют важную роль в иммунная регуляция и воспаление [3]. Основные пищевые источники LA включают растительные масла, такие как подсолнечное, сафлоровое и кукурузное масла (Таблица 1), но они также присутствуют в злаках, животном жире и цельнозерновом хлебе. Богатые диетические источники ALA включают зеленые листовые овощи, льняное семя и рапсовое масло [2] (таблица 1).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные выражены в мг / 100 г съедобной части.Данные получены из [13, 14, 18]. Содержание жирных кислот может незначительно отличаться в зависимости от вида, источника и аналитических факторов. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
За последние несколько десятилетий произошли резкие качественные изменения в питании с повышенным уровнем потребления жирных кислот [4]. Сегодня промышленно развитые общества характеризуются увеличением потребления насыщенных жиров, омега-6 ПНЖК и трансжирных кислот, а также общим снижением потребления омега-3 ПНЖК [5]. Жирные кислоты в настоящее время составляют 28–42% от общего количества энергии, потребляемой европейским населением [4, 6], тогда как при древнем питании потребление жирных кислот составляло лишь примерно 20–30% от общей энергии [4, 7, 8].В результате увеличения потребления богатых LA растительных масел, связанных с западной диетой, потребление n-6 ПНЖК стало значительно выше, чем потребление n-3 ПНЖК [9]. Оптимальное диетическое соотношение n-6: n-3 должно составлять примерно 1–4: 1. Однако, в соответствии с изменениями в питании, описанными выше в западной диете, это соотношение теперь увеличилось и находится в диапазоне 10: 1. до 20: 1 [4]. Параллельно с этим наблюдается рост числа заболеваний, связанных с воспалительными процессами, таких как сердечно-сосудистые заболевания, ожирение, ВЗК, ревматоидный артрит и рак.Другими примерами являются нейродегенеративные и психические заболевания, такие как AD и депрессия [10]. Исследование, проведенное Хасаном и Ханачи с участием 984 иранских женщин, показало, что правильная диета, богатая фруктами, бобовыми, овощами, злаками и рыбой, богатой n-3 ПНЖК, может снизить вероятность развития метаболического синдрома [ 11]. Другое исследование, проведенное во Франции с участием 912 мужчин, показало, что низкое потребление рыбы, богатой n-3 ПНЖК, связано с более высокой вероятностью развития метаболического синдрома [12].Таким образом, высокое потребление n-6 PUFA, наряду с низким потреблением n-3 PUFA, смещает физиологическое состояние к провоспалительному и протромботическому с увеличением вазоспазма, сужения сосудов и вязкости крови, а также с развитием заболеваний, связанных с этими состояниями. .
ПНЖК играют важную роль в составе всех клеточных мембран, где они поддерживают гомеостаз для правильной функции мембранных белков и влияют на текучесть мембран, таким образом регулируя клеточные сигнальные процессы, клеточные функции и экспрессию генов [13].Другие функции ПНЖК требуют их метаболизма для более ненасыщенных членов их семьи. Например, LA превращается в AA (20: 4n-6) через γ -линоленовую кислоту (GLA, 18: 3n-6) и дигомо- γ -линоленовую кислоту (DGLA, 20: 3n-6). С помощью того же набора ферментов ALA может быть преобразована в EPA (20: 5n-3) и DHA (22: 6n-3). Основным местом метаболизма ПНЖК является печень; однако он также может иметь место в различных других тканях [14]. Именно эти длинноцепочечные метаболиты LA и ALA имеют большое клиническое значение в различных органах, таких как мозг, почки и печень [15–17].Циклооксигеназы (COX) и липоксигеназы (LOX) могут преобразовывать АК в 2-й ряд простагландинов, 2-й ряд тромбоксанов и 4-й ряд лейкотриенов. Это очень важные, активные и недолговечные гормоны, называемые «эйкозаноидами», которые участвуют в различных патологических процессах, включающих воспалительные состояния, такие как атеросклероз, ожирение и ВЗК [13].
Поскольку ПНЖК дают начало разнообразным биологически активным соединениям, которые все играют важную роль в патологических и физиологических процессах, необходимо правильное понимание вклада этих активных соединений в совпадающий рост воспалительных заболеваний, наблюдаемых с нарушением баланса в соотношении n-6: n-3, связанное с западной диетой.
2. Метаболизм жирных кислот n-6 и биосинтез эйкозаноидов
Линолевая кислота может метаболизироваться до других, более ненасыщенных, длинноцепочечных членов семейства n-6 путем вставки дополнительных двойных связей во время последовательных механизмов удлинения и десатурации. (Фигура 1). Ограничение начальной скорости десатурации LA до GLA катализируется ферментом дельта-6-десатуразой (FADS2) [19]. Затем происходит удлинение для преобразования GLA в DGLA за счет удлинения очень длинноцепочечных жирных кислот (ELOVL) 5, и, наконец, цикл удлинения и десатурации за счет дельта-5-десатуразы (FADS1) генерирует AA [20].
Важность гена FADS2 в синтезе LC-PUFA недавно была продемонстрирована на мышах [19, 22]. Первое исследование Stoffel et al. демонстрирует, что потеря гена FADS2 отменяет синтез LC-PUFA с дальнейшим воздействием на пути COX и LOX, что в конечном итоге приводит к гипогонадизму и бесплодию самцов и самок мышей [19]. Далее с помощью этой нулевой модели FADS2 была продемонстрирована ключевая роль, которую PUFA-замещенные фосфолипиды играют в установлении клеточной полярности, что показано здесь для плотных соединений клеток Сертоли в семенниках и сети щелевых соединений между клетками фолликулов яичников [19].Страуд и др. продемонстрировали нарушение репродуктивной функции самцов, а также кожные и кишечные язвы у мышей, нулевых по FADS2 [22].
Элонгация очень длинноцепочечных жирных кислот (ELOVL) 5 — один из семи ферментов, конденсирующих жирные кислоты млекопитающих, участвующих в микросомальном удлинении жирных кислот [20]. ELOVL5 необходим для удлинения GLA до DGLA. Исследования с использованием микросомального белка печени мышей ELOVL5 с нулевым уровнем показали, что в тканях больше накапливается GLA и снижается уровень продуктов метаболизма нижестоящих, таких как AA для метаболизма n-6 и DHA для метаболизма n-3.Метаболическим следствием этого снижения AA и DHA была активация (или дерепрессия) белка, связывающего регуляторный элемент стерола (SREBP) -1c. Активация этого фактора транскрипции (как будет более подробно обсуждаться позже) у ELOVL5 нулевых мышей приводила к активации дополнительных генов, участвующих в синтезе жирных кислот и триглицеридов, что привело к развитию стеатоза печени [20].
Есть много других факторов, участвующих в регуляции активности ферментов дельта-5-десатуразы и дельта-6-десатуразы.Например, снижение активности как дельта-5, так и дельта-6 десатуразы было продемонстрировано в печени пациентов с НАЖБП с ожирением [23]. Глюкагон, адреналин, глюкокортикоиды и трироксин подавляют активность дельта-5-десатуразы и дельта-6-десатуразы [24]. Сообщалось о низкой активности фермента дельта-6-десатуразы у крыс с диабетом, у которых инсулин действует как хорошо известный стимулятор дельта-6-десатуразы [25]. Поскольку LA и ALA метаболизируются одним и тем же набором ферментов, между этими двумя жирными кислотами существует естественная конкуренция, в результате чего дельта-5-десатураза и дельта-6-десатураза будут проявлять сродство к метаболизму n-3 по сравнению с n-6 PUFA, при условии, что что они существуют в соотношении 1: 1–4.Тем не менее, более высокое потребление LA, которое сейчас наблюдается в западной диете, показывает увеличение предпочтения этих ферментов метаболизму n-6 ПНЖК, что приводит к синтезу AA, несмотря на то, что эти ферменты проявляют более высокое сродство к n-3. ПНЖК [26]. Было показано, что добавление к диете EPA и DHA исправляет этот дисбаланс путем частичного замещения АК из клеточных мембран тромбоцитов, эритроцитов, нейтрофилов, моноцитов и гепатоцитов, где АК обычно содержится в больших количествах [27].
Промежуточные продукты метаболизма ПНЖК могут либо включаться в фосфолипиды, либо подвергаться дальнейшим стадиям удлинения / десатурации. В пути n-6 АК, синтезируемая в результате десатурации DGLA с помощью дельта-5-десатуразы (FADS1), может быть дополнительно удлинена с помощью ELOVL2 до докозатетраеновой кислоты (C22: 4n-6) или до соответствующего набора эйкозаноидов через COX. и ферменты LOX. Важность PUFA, производных ELOVL2, для млекопитающих недавно была продемонстрирована на мышах, подвергшихся абляции ELOVL2, что демонстрирует важность этого фермента элонгазы [28].Это исследование показало роль ELOVL2 в удлинении ПНЖК C20 и C22, чтобы продуцировать ПНЖК от C24: 4n-6 до C30: 5n-6 в яичках, где они необходимы для нормального сперматогенеза и фертильности [28]. Связывание факторов роста и гормонов с мембранными рецепторами приводит к активации фосфолипазы A 2 , которая высвобождает АК из клеточной мембраны, где свободная кислота может стать субстратом для биосинтеза эйкозаноидов за счет активности COX и LOX [29]. Эйкозаноиды, полученные из АК, синтезируются в больших количествах, чем когда-либо прежде, из-за увеличения их потребления с пищей [4].
Эйкозаноиды являются биологически активными липидами и включают простагландины (PG), тромбоксаны (TX), лейкотриены (LT) и гидроксиэйкозатетраеновые кислоты (HETE), которые все участвуют в различных патологических процессах, таких как воспаление и рак (Таблица 2) [30 ]. Когда они присутствуют в больших количествах, они влияют на различные метаболические процессы, помимо воспаления, такие как агрегация тромбоцитов, кровотечение, сужение сосудов и расширение сосудов [18]. В целом эйкозаноиды, происходящие из АК, обладают провоспалительным действием, но они выполняют важные гомеостатические функции в регулировании как стимулирования, так и разрешения воспаления в иммунном ответе [31].Напротив, известно, что n-3 PUFA и их производные LC в основном способствуют противовоспалительной активности [32]. В недавнем исследовании с участием 250 клинически стабильных пациентов с хронической обструктивной болезнью легких (ХОБЛ) более высокое потребление n-3 ПНЖК было связано с более низкими концентрациями провоспалительных цитокинов (например, фактора некроза опухоли альфа (TNF α )) при более высоком уровне n- 6 Потребление ПНЖК было связано с более высокими концентрациями провоспалительного интерлейкина-6 (ИЛ-6) и С-реактивного белка (СРБ) в болезненном состоянии [33].Хотя ХОБЛ является сложным хроническим воспалительным заболеванием, интересно проследить связь между потреблением n-6 и n-3 ПНЖК с пищей на воспалительных маркерах сыворотки, связанных с заболеванием [33]. Несмотря на многочисленные доказательства того, что повышенное потребление n-6 ПНЖК с пищей вызывает провоспалительную реакцию у хозяина, следует отметить, что недавние исследования также показали обратное [34, 35]. Недавний обзор показал, что n-6 PUFA обладают некоторым противовоспалительным действием, таким как n-3 PUFA [36].Например, средние сывороточные концентрации CRP имели тенденцию к снижению с увеличением потребления n-6 ПНЖК как у японских мужчин [34], так и у женщин [35]. Тем не менее доказательства этих ассоциаций ограничены.


