Меланома форум свежие вопросы и ответы: Врач-онколог рассказал о новейших способах лечения меланомы — Российская газета
Меланома: лечение, симптомы, диагностика, удаление
Использование генных технологий – настоящий прорыв в борьбе со столь опасной опухолью. Сегодня учеными открыты моноклональные антитела, блокирующие антиген на поверхности клетки. Именно мутации определенного гена приводят к развитию опухолевого процесса. Воздействие на уровне генома подавляет образование опухоли путем ограничения роста клеток. Это открывает новые перспективы – путь к спасению и продлению жизни больным, у которых вчера еще не было надежды.
Читать полностью
В настоящее время уже изложена учеными рабочая гипотеза о взаимодействии вируса и опухолевой клетки. Суть возможного метода в следующем: опухолевая клетка не способна в полной мере противостоять атаке вируса; применяя быстродействующий вирус, можно добиться гибели раковой клетки еще до того момента, когда иммунная система атакует вирус.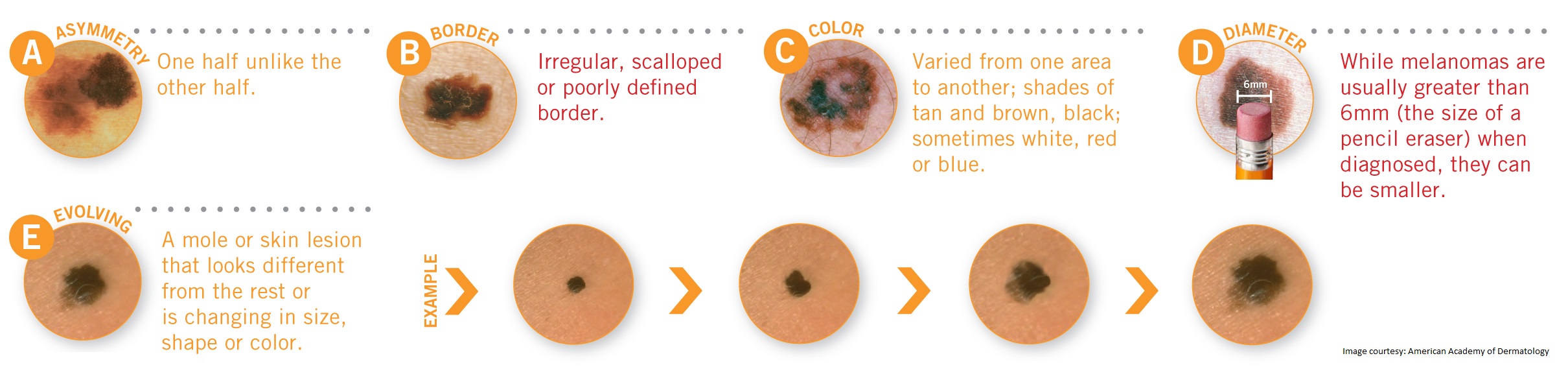
Скрыть
Меланома – злокачественная опухоль, развивающаяся из пигментобразующих клеток (меланоцитов), отличающихся интенсивной окраской и способных вырабатывать пигмент меланин. Меланома чаще встречается на открытых участках тела, подверженных воздействию солнечных лучей. При этом у женщин чаще располагается на коже нижних конечностей, у мужчин – на туловище. Иногда меланома может образовываться и на других участках тела: сетчатке глаза, слизистых оболочках, анусе и влагалище. Также на коже нижних конечностей, туловища и лица проявляет меланома симптомы. Лечение опухоли зависит от стадии болезни. Следует отметить, что не каждый вид невусов одинаково склонен к злокачественности. Меланома может также возникнуть и на чистом участке кожи. Ранняя диагностика меланомы имеет важнейшее значение и существенно увеличивает шансы больного на выздоровление.
Меланома может возникать у людей любого возраста, в том числе и у подростков. Это опасное заболевание, требующее незамедлительного лечения. В большинстве случаев злокачественное образование локализовано на коже, его нетрудно выявить в начальной стадии, когда возможно излечение.
Это опасное заболевание, требующее незамедлительного лечения. В большинстве случаев злокачественное образование локализовано на коже, его нетрудно выявить в начальной стадии, когда возможно излечение.
Диагностика
Первым этапом диагностики является осмотр онколога или дерматолога. При постановке диагноза используют такие методы, как дерматоскопия, биопсия и гистологическое исследования. Для изучения распространенности процесса проводят исследования «сторожевого» лимфоузла, а также дополнительные исследования (компьютерная томография, ультразвуковое исследования и т.д.).
Эти методики широко используют специалисты LISOD, что дает возможность точно диагностировать степень распространения заболевания с последующим объемом терапии.
Лечение
Полную информацию о диагностике и лечении этого вида рака Вам предоставят консультанты Информационной службы LISOD:
- 0-800-500-110 (бесплатно для звонков
со стационарных телефонов по Украине) - или +38 044 520 94 00 – ежедневно
с 08:00 до 20:00.
Лечение меланомы зависит от стадии развития болезни. При наличии первичного очага без метастазов применяют оперативное лечение с широким иссечением первичного очага. Иногда после такого иссечения образуются довольно большие дефекты, требующие закрытия сложными лоскутами кожи из других участков тела. Особенно это касается функционально активных зон – конечностей и лица. В LISOD этот этап выполняет опытный пластический хирург.
При наличии метастазов меланомы в регионарные лимфатические узлы, дополнительно проводят иссечение регионарных лимфоузлов, лечение противоопухолевыми средствами сочетают с иммунотерапией. Чтобы определить, поражены ли лимфатические узлы, если на то нет явных указаний, возможно проведение процедуры выявления «сторожевого» лимфоузла. Этот лимфоузел первым получает лимфу из зоны опухоли и является первым, в котором развиваются метастазы. Если же в «сторожевом» узле метастазов не выявлено, то вероятность их распространения в другие лимфоузлы не превышает 2-3%. Таким образом, исследуя состояние «сторожевого» лимфоузла, мы с очень высокой степенью достоверности можем судить о состоянии всех других лимфоузлов и избавить многих пациентов от травматичных операций и связанных с ними возможных осложнений.
Таким образом, исследуя состояние «сторожевого» лимфоузла, мы с очень высокой степенью достоверности можем судить о состоянии всех других лимфоузлов и избавить многих пациентов от травматичных операций и связанных с ними возможных осложнений.
При невозможности проведения хирургического лечения альтернативой выступают современные методы химиотерапии, которые широко используются в LISOD. Схему химиотерапии для пациентов подбирают сугубо индивидуально, учитывая все критерии. Количество курсов химиотерапии зависит от течения заболевания и переносимости больным терапии. После минимального количества циклов пациенту проводят контрольное обследование, например компьютерную томографию или ПЭТ-КТ, по результатам которых оценивают эффективность терапии.
В лечении меланом также используется лучевая терапия. Применение линейных ускорителей с привлечением компьютерной томографии и сложных компьютерных программ дает возможность получить трехмерное изображение опухоли и здоровых органов. При этом к опухоли подводится необходимая доза облучения, тогда как на окружающие органы и ткани излучение практически не распространяется. Это позволяет существенно снизить частоту побочных явлений и осложнений лучевой терапии.
При этом к опухоли подводится необходимая доза облучения, тогда как на окружающие органы и ткани излучение практически не распространяется. Это позволяет существенно снизить частоту побочных явлений и осложнений лучевой терапии.
Симптомы
Клинически переход доброкачественного пигментного пятна в злокачественную меланому характеризуется следующими симптомами:
- ростом пятна и затвердением;
- усилением пигментации или, наоборот, ослаблением ее;
- появлением красноты и застойных явлений вокруг основания пятна;
- развитием пигментных или непигментных лучистых разрастаний, идущих от пигментного пятна в разные стороны.
Иногда первым симптомом растущей меланомы является увеличение регионарных лимфатических узлов, тогда как давно существующее пигментное пятно или папиллома не имеет признаков видимого увеличения или иногда даже несколько уменьшается в своих размерах и в интенсивности пигментации. Увеличение пигментного пятна (папилломы) и уплотнение его являются первыми и наиболее постоянными признаками злокачественного превращения родимых пятен.
Увеличение пигментного пятна (папилломы) и уплотнение его являются первыми и наиболее постоянными признаками злокачественного превращения родимых пятен.
Нередко рядом с увеличивающимся пигментным пятном появляются другие мелкие узелки, чаще пигментированные, реже не пигментированные.
Другим начальным признаком, иногда совпадающим с первыми или появляющимся независимо от них, является увеличение или уменьшение пигментации. Особое значение придается пигментным или непигментным радиальным разрастаниям, расходящимся от первичной опухоли в разные стороны и несущим с собою распространение процесса в окружающую нормальную кожу и соседние ткани.
Наконец, довольно значительная группа опухолей появляется без видимых причин – сначала в виде доброкачественного уплотнения, папилломы, пигментированного образования, иногда долгое время остающегося без видимого роста.
Факторы риска
Наиболее значимыми факторами, влияющими на возникновение меланомы, являются:
- повышенная солнечная радиация;
- солнечные ожоги.

Большинство раковых заболеваний кожи, в том числе и меланома, вызваны чрезмерным ультрафиолетовым излучением. Под воздействием УФ излучения повышается вероятность генетических нарушений в клетках, что может привести к образованию опухоли. Помочь больному может только своевременное лечение меланомы кожи.
Группы риска
- Значительно увеличивается риск заболевания меланомой, если ранее уже был поставлен аналогичный диагноз либо выявлен любой другой рак кожи.
- Семейная история. Если ближайшие родственники (особенно 2 и более) уже сталкивались с этим заболеванием, то риск возникновения меланомы значительно увеличивается.
- Пожилой возраст. У людей в пожилом возрасте значительно чаще встречается заболевание меланомой.
- Травматизация. Травма невуса (как однократная, так и многократная).
Профилактика
Основной профилактикой является предотвращение избыточного ультрафиолетового облучения.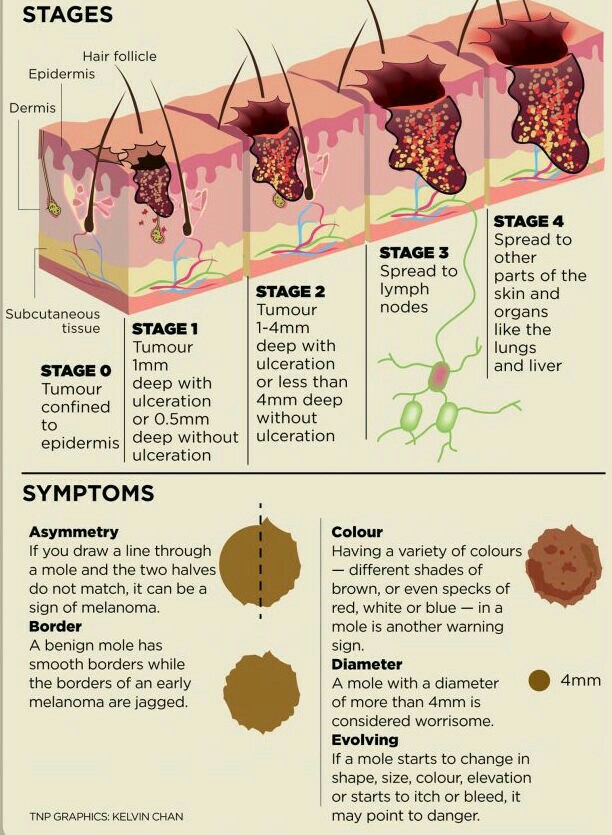
Вопросы и ответы
В разделе публикуются вопросы пациентов и ответы наших специалистов. Вопрос каждого человека касается конкретной проблемы, связанной с его заболеванием. Пациентам отвечают израильские клинические онкологи и главный врач LISOD, д.м.н., профессор Алла Винницкая.
Ответы специалистов основаны на знаниях принципов доказательной медицины и профессиональном опыте. Ответы соответствуют исключительно предоставленным сведениям, имеют ознакомительный характер и не являются врачебной рекомендацией.
Основная цель раздела – дать информацию пациенту и его семье, чтобы вместе с лечащим врачом принять решение о виде лечения. Предложенная Вам тактика лечения может отличаться от принципов, изложенных в ответах наших специалистов. Не стесняйтесь задать лечащему врачу вопрос о причинах отличий. Вы должны быть уверены, что получаете правильное лечение.
Вы должны быть уверены, что получаете правильное лечение.
Доброго дня, в моєї матері меланома, провели дві операції, що порадите,
Клінічний діагноз: меланома шкіри періанальної ділянки ІА ст рТіаіМоМо. Рго1оп§аїіо шогЬі. Мі$ меланоми в пахові лімфовузли справа.
22.03. Іб.операція: висічення тумора періанальної ділянки. Гістологічне дослідження № 13823-32 (01.04.16.)- пігментна меланома з перевагою горизонтального росту, за Кларком III, з виразкуванням, помірним лімфоїдним інфільтратом по переферії утвору. КТ (голови, ОГК, о.ч.п. і тазу 25.04.16.)-ознак вторинного ураження на рівні обстеження не виявлено, киста правої нирки (протокол обстеження на руки). Загальний аналіз крові: Ег- 4,0 -1012\л, НЬ-122 г/л, КП-0,9 , Ь-83’109\л (е-1%, п-5%, с-71%, л-17%, м-6%), ШОЕ- 11 мм/год. Біохімічний аналіз крові: заг.білірубін-11,9 мкмоль\л, заг.білок- 79,5 г\л, глюкоза-6,0 ммоль\л, креатинін-48 мкхоль\л, АСТ-21од\л (ТЧ<37од\л), АЛТ-20од\л (14.<41 од’л), амілаза-98од\л (ТЧ< 100 од’л). Коагулограма: протромбіновий час-13,4″, протромбіновий індекс-97%, заг.фібриноген -3,7 г\л, фібриноген „Б”-1+, етаноловий тест-слабо позитивний, ІТЧК-0,79. Гр.крові В(ІІІ)Ші+. ЕКГ-без патології. УЗД: в правій паховій ділянці визначаються скупчення гіпоехогенних неоднорідних овальної форми чіткоконтурованих включень сі~1,0; 2,5; 2,65; 4,5см-збільшені лімфовузли. 14.07.16. операція Дюкена справа. Гістологічне дослідження № 30563-74 (20.07.16.)- у лімфовузлах метастази пігментної меланоми із вторинними змінами. Післяопераційний період-без особливостей.
КТ (голови, ОГК, о.ч.п. і тазу 25.04.16.)-ознак вторинного ураження на рівні обстеження не виявлено, киста правої нирки (протокол обстеження на руки). Загальний аналіз крові: Ег- 4,0 -1012\л, НЬ-122 г/л, КП-0,9 , Ь-83’109\л (е-1%, п-5%, с-71%, л-17%, м-6%), ШОЕ- 11 мм/год. Біохімічний аналіз крові: заг.білірубін-11,9 мкмоль\л, заг.білок- 79,5 г\л, глюкоза-6,0 ммоль\л, креатинін-48 мкхоль\л, АСТ-21од\л (ТЧ<37од\л), АЛТ-20од\л (14.<41 од’л), амілаза-98од\л (ТЧ< 100 од’л). Коагулограма: протромбіновий час-13,4″, протромбіновий індекс-97%, заг.фібриноген -3,7 г\л, фібриноген „Б”-1+, етаноловий тест-слабо позитивний, ІТЧК-0,79. Гр.крові В(ІІІ)Ші+. ЕКГ-без патології. УЗД: в правій паховій ділянці визначаються скупчення гіпоехогенних неоднорідних овальної форми чіткоконтурованих включень сі~1,0; 2,5; 2,65; 4,5см-збільшені лімфовузли. 14.07.16. операція Дюкена справа. Гістологічне дослідження № 30563-74 (20.07.16.)- у лімфовузлах метастази пігментної меланоми із вторинними змінами. Післяопераційний період-без особливостей. Виписується в задовільному стані під амбулаторне спостереження проктолога.
Виписується в задовільному стані під амбулаторне спостереження проктолога.
Здравствуйте. Пациентка нуждается в более детальном обследовании для уточнения масштаба распространения болезни. Необходим визит к клиническом у онкологу.
12. 11.2015 року моїй сестрі зроблена операція -Радикальне висічення пухлини шкіри спини та Аксілярна лімфаденектомія зліва. Поставлено діагноз: Меланома шкіри спини рТ2в рN2 М1. Сr лівої грудної залози Т2 рN1 кл.гр.II. Мts в ліву легеню ER(+++) PR(+++)HER 2neu(2-) 11.12.2015 Висновок з відділення ПЕТ-КТ-картина метастатичної лівобічної аксілярної лімфаденопатії,дифузного метастатичного ураження паренхіми легень,неопластичній тканині верхнього латерального квадранту лівої молочної залози,вогнища відсіву меланоми в шкіру тулуба зліва. Нам порадили хіміотерапію за \»дортмунською схемою\»з препаратами Дакарбазин,Цисплатин,Кармустин,Тамоксифен. Напишіть,будь ласка,як ви рахуєте- чи максимально правильно назначено лікування і що це за схема?
11.2015 року моїй сестрі зроблена операція -Радикальне висічення пухлини шкіри спини та Аксілярна лімфаденектомія зліва. Поставлено діагноз: Меланома шкіри спини рТ2в рN2 М1. Сr лівої грудної залози Т2 рN1 кл.гр.II. Мts в ліву легеню ER(+++) PR(+++)HER 2neu(2-) 11.12.2015 Висновок з відділення ПЕТ-КТ-картина метастатичної лівобічної аксілярної лімфаденопатії,дифузного метастатичного ураження паренхіми легень,неопластичній тканині верхнього латерального квадранту лівої молочної залози,вогнища відсіву меланоми в шкіру тулуба зліва. Нам порадили хіміотерапію за \»дортмунською схемою\»з препаратами Дакарбазин,Цисплатин,Кармустин,Тамоксифен. Напишіть,будь ласка,як ви рахуєте- чи максимально правильно назначено лікування і що це за схема?
Добрый день!
На Ваш вопрос отвечал Реут Игорь Анатольевич, клинический онколог больницы израильской онкологии LISOD:
«Необходимо сделать исследование ткани опухоли на наличие мутации гена BRAF, для решения вопроса о возможности таргетной терапии Вемурафенибом.
Если начинать химиотерапию, то достаточно одного Дакарбазина.»
С уважением, LISOD
Уважаемый доктор. Моему мужу удалили на левой половине шеи родимое пятно хирургическим методом. Диагноз: поверхностно-распространяющая меланома , узловая форма, фаза вертикального роста. Результаты гистологии показали: стадия 1А, КГ — II, рТ-1, N0, М0. Лечение не назначено, при желании можно принимать эхинацею. Что бы Вы посоветовали?
Если стадирование проведено правильно и операция проведена адекватно, то дополнительного лечения не требуется.
Здравствуйте. В мае 2012 перенес операцию на левой голени по удалению меланомы. Стадия 1А, 3-й уровень инвазии по Кларку, по Бреслоу глубина проникновения 1мм, без поражения лимфоузлов. Назначено лечение — «Интерферон 2B», принимал 1 месяц. В настоящее время у меня воспалился лимфоузел в левой подмышечной области. Регионарные лимфоузлы при проверке на УЗИ не увеличены.
Вопрос: может ли увеличение подмышечного лимфоузла быть проявлением меланомы? как проверить организм?
Вероятность поражения лимфоузла существует. Рекомендуется проведение ПЭТ-КТ для верификации возможного распространения болезни и консультация онколога по результатам исследования.
Рекомендуется проведение ПЭТ-КТ для верификации возможного распространения болезни и консультация онколога по результатам исследования.
Здравствуйте! В январе 2013 удалена родинка, по гистологии-меланома. Проведено широкое иссечение. При выписке диагноз: меланомы кожи спины,T2N0M0 Назначен лайферон. В мае на осмотре пункция из подмышечного лимфоузла — найдены клетки меланомы. Назначили удаление лимфоузла. Все остальные УЗИ и анализы в пределах нормы. Обязательно ли вырезать лимфоузел или есть другие методы лечения? Что обследовать еще, чтобы избежать рецидива?
В таком случае необходимо проведение ПЭТ-КТ исследования, если нет возможности, то КТ всего тела, включая голову. Если нет других находок, то показана диссекция подмышечных лимфоузлов.
Добрый день! Мне 33 года, через 1,5 года после рождения второго ребенка заметила, что на голени увеличилась родинка (из обычной превратилась в непонятно что, больше похожее на «гуску»). Обратилась к врачу, рекомендовал удаление, анализ показал меланому. Иммуногистохимическое исследование с АТ к: Myogenin(F5D), СD177, S-100 protein, HMB45, Ki 67 (MIB-1). Tyrosinase (T311), Desmin (D33). Опухоль кожи характерного альвеолярного строения из атипичных меланцитов с характерной экспрессией S-протеина, HMB45, вертикальным распространиением в верхние слои эпидермиса и ретикулярный слой дермы, достигая потовых желез, наличием атипических митозов в ядрах и ядерной экспрессией Ki 67 в около 10% опухлевых клеток. Отмечается минимальное внутри и внеклекточное содержание пигмента и скудный перифокальный реактивный лимфоидный инфильтрат. Итого: меланома, узловая форма, 4 уровень инвазии, толщина 2,2 мм. Сделали операцию иссечения кожи вокруг родинки, в результатах опухлевого роста не выявлено. Назначено лечение в течении года лаферобионом или иммунофаном. Подскажите, этого достаточно?
Сделали операцию иссечения кожи вокруг родинки, в результатах опухлевого роста не выявлено. Назначено лечение в течении года лаферобионом или иммунофаном. Подскажите, этого достаточно?
При меланоме, с указанными Вами характеристиками ((Т3) и отсутствии отдаленных метастазов)) рекомендуется проведение широкого иссечения опухоли (2 см края разреза) и исследование «сигнального» лимфатического узла (как правило, пахового, в Вашем случае). Если метастазов в этом узле нет, то хирургическое лечение на этом ограничивается, если есть – выполняется удаление всей группы паховых лимфоузлов. Учитывая группу высокого риска рецидива, метастазирования и молодой возраст – принято рекомендовать профилактическую терапию интерфероном .
Здравствуйте! Мне 35 лет.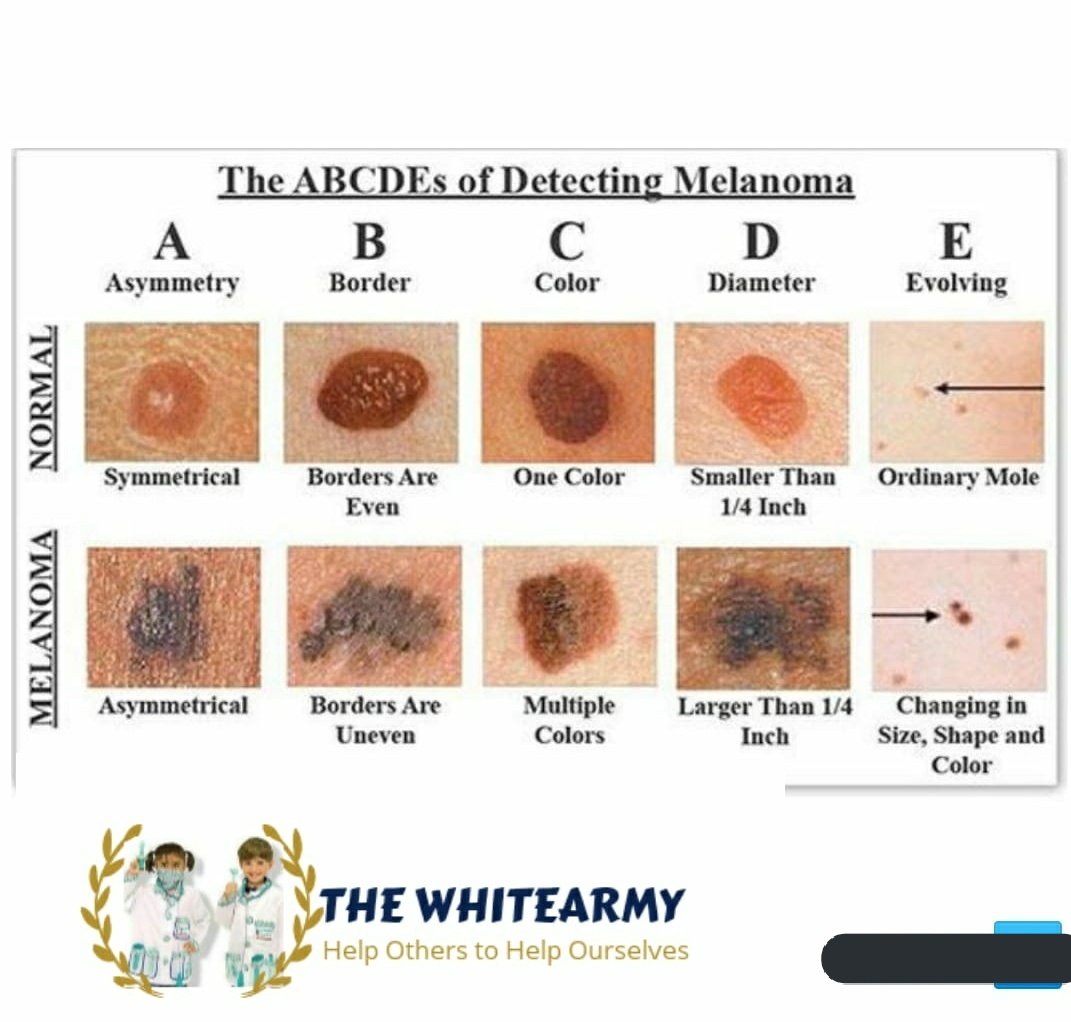 В апреле месяце 2012 мне поставили диагноз: меланома кожи правого бедра по гистологии, родинка была удалена по принципу обширной биопсии без какого либо предварительного обследования. Далее выяснилось, что есть mts в паховобедренные лимфоузлы. Произведена операция Дюкена 3 июля, после назначили курс интерферонов по 40 млн в/в по схеме 5-2 в течении 2-х месяцев. Как только доза снизилась до 6-ти при повторном КТ обнаружили лимфоузлы в правом паху и подвздошной области. 30 ноября проведена внутритазовая подвздошно-обтураторная правостороння лимфодиссекция, правосторонняя паховая лимфодиссекция Т3N1MO ст.3 гр 2. После операции назначили химию, но только с 21 января 2013 (пока всё заживало). На повторном КТ от января 2013 обнаружены новые узлы вдоль правых подвздошных сосудов и паховые узлы слева. Сейчас прохожу курс химиотерапии по протоколу Винбластин + Цисплатин. МРТ головы структурных изменений головного мозга не выявлено, КТ брюшной полости — без патологии. Предлагают после курса химиотерапии, если узлы не уйдут, опять оперироваться.
В апреле месяце 2012 мне поставили диагноз: меланома кожи правого бедра по гистологии, родинка была удалена по принципу обширной биопсии без какого либо предварительного обследования. Далее выяснилось, что есть mts в паховобедренные лимфоузлы. Произведена операция Дюкена 3 июля, после назначили курс интерферонов по 40 млн в/в по схеме 5-2 в течении 2-х месяцев. Как только доза снизилась до 6-ти при повторном КТ обнаружили лимфоузлы в правом паху и подвздошной области. 30 ноября проведена внутритазовая подвздошно-обтураторная правостороння лимфодиссекция, правосторонняя паховая лимфодиссекция Т3N1MO ст.3 гр 2. После операции назначили химию, но только с 21 января 2013 (пока всё заживало). На повторном КТ от января 2013 обнаружены новые узлы вдоль правых подвздошных сосудов и паховые узлы слева. Сейчас прохожу курс химиотерапии по протоколу Винбластин + Цисплатин. МРТ головы структурных изменений головного мозга не выявлено, КТ брюшной полости — без патологии. Предлагают после курса химиотерапии, если узлы не уйдут, опять оперироваться.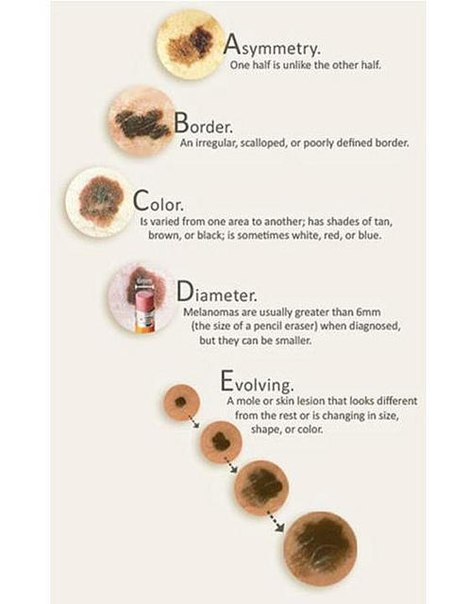 Есть ли в этом смысл?
Есть ли в этом смысл?
После окончания проводимой химиотерапии следует сделать повторную оценку состояния, исключить отдаленное метастазирование (ПЭТ-КТ) и если находки будут только в лимфоузлах, то оперативное их удаление может дать эффект.
Здравствуйте! 21.11.2009 в лазерном центре удалили плоскую бородавку на пятке. 12.08.2011 было широкое иссечение с замещением дефекта свободным кожным лоскутом: заболевание пигментой кожи правой пяточной области. Гистология: меланома, 3-й уровень инвазии по Кларку. 23.07.2012 операция Дюкена справа. Гистология: вторичные изменения меланомы в 4-х из 8 лимфоузлах. КТ от 26.11.2012: КТ-картина множественного mts-поражения легких. 14.12.2012 назначили паллиативную химию.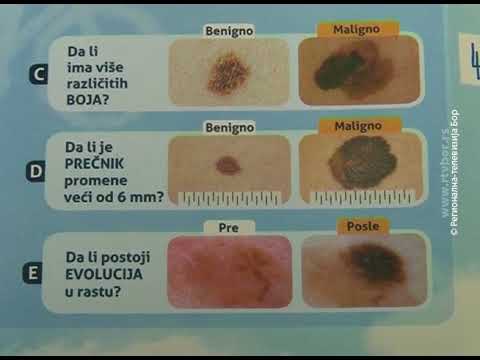 Что посоветуете?
Что посоветуете?
В данном случае назначение химиотерапии абсолютно правильное решение.
Добрый день, доктор! Мужу 41 год. Месяц назад установлен диагноз: атипическая лентигиозная меланоцитарная дисплазия фокусом перехода в меланому, преимущественно эпителиоидноклеточного строения с глубиной инвазии 2 по кларку и толщиной 0,8 по Бреслоу. Некрозонизъязвления нет. Удалена в пределах нормальных тканей. Выписали домой и сказали приехать через 3 месяца. Провели УЗИ лимфоузлов паховой области — всё в норме. Что посоветуете дальше?
Если стадия соответствует действительности, необходимо проведение компьютерной томографии всего тела, включая головной мозг.
Если все в порядке, то рекомендуется только наблюдение.
Меланома не болит, она растет
В Петербурге среди онкозаболеваний меланома кожи составляет 1,9% у мужчин и 2,43% у женщин. Однако по скорости роста заболеваемости меланома занимает лидирующие позиции, поскольку развивается стремительно.
Меланома кожи — одна из самых агрессивных злокачественных опухолей. Так, по данным статистики, из каждых 100 человек, погибших от онкологических заболеваний, 44 умирают именно от меланомы кожи.
Впервые День диагностики меланомы кожи был проведен в 1999 году по инициативе Европейской академии дерматологии и венерологии (EADV)./skin-cancer-symptoms-5b0d84a7119fa8003747e2cb.png) С 2007 года День диагностики проводится и в России. За 5 лет были обследованы более 25 тысяч пациентов, у 838 из них было выявлено подозрение на меланому. В Петербурге за один только день диагностики меланомы в 2012 году были обследованы 695 человек, 234 из них были направлены в Городской онкодиспансер для дальнейшего обследования и лечения. У троих выявлена меланома.
С 2007 года День диагностики проводится и в России. За 5 лет были обследованы более 25 тысяч пациентов, у 838 из них было выявлено подозрение на меланому. В Петербурге за один только день диагностики меланомы в 2012 году были обследованы 695 человек, 234 из них были направлены в Городской онкодиспансер для дальнейшего обследования и лечения. У троих выявлена меланома.
Около 70% меланом появляются на месте поврежденной родинки, 30% возникают на внешне не изменённой коже. Основная причина, которая приводит к перерождению родинок — их механическая травма, как постоянная (трение украшений или одежды о родинку), так и однократная (порез при бритье). На втором месте стоит злоупотребление ультрафиолетовым излучением (солнце, солярий).
Как и со многими другими формами рака, одним из важнейших факторов успеха в лечении меланомы кожи является ранняя диагностика заболевания. По данным Европейского общества медицинской онкологии (ESMO), 10-летняя выживаемость страдающих меланомой, выявленной на первой стадии, составляет 79,2–87,9%, в то время как при второй стадии этот показатель составляет уже от 32,3 до 64,4%, при четвертой стадии заболевания десять лет проживают не более 4% пациентов.
Все факторы риска развития меланомы кожи можно разделить на две основные группы:
1. Наследственные или врожденные. Опасности подвергаются люди со светлой кожей, волосами и глазами, с большим количеством родинок на коже (при наличии более 100 родинок риск развития меланомы возрастает на 50%), а также те, у кого в семье были случаи заболевания опухолями кожи. Такие факторы риска можно выявить лишь у 15% входящих в группы риска по развитию меланомы кожи.
2. Внешние или поведенческие факторы имеют 75% людей, входящих в группы повышенного риска. В нее попадают люди, которые три и более раза сильно обгорали на солнце (с образованием волдырей) в возрасте до 20 лет, долго работают на открытом воздухе, живут в северных широтах и часто ездят в южные страны, используют искусственные источники ультрафиолетового излучения (солярий).
Всем, кто входит в группы риска, нужно проходить профилактический осмотр у дерматолога или онколога минимум один раз в год.
Любые изменения со стороны родинок должны заставить вас обратиться к врачу. Особенно внимательным нужно быть, если родинка растет, меняет цвет, форму, структуру или начинает кровоточить. Наиболее опасны родинки неправильной формы, неравномерной окраски, крупных размеров (более 0.5 см).
Особенно внимательным нужно быть, если родинка растет, меняет цвет, форму, структуру или начинает кровоточить. Наиболее опасны родинки неправильной формы, неравномерной окраски, крупных размеров (более 0.5 см).
Родинку важно удалить целиком, в пределах здоровых тканей. Все, что удалит врач, должно быть отправлено на гистологическое исследование, которое покажет, есть ли изменения в тканях родинки или нет. Только при соблюдении этих правил удаление родинки безопасно и не повлечет нежелательных последствий.
Ни в коем случае нельзя прижигать родинки чистотелом и другой химией. Не рекомендуется удалять их лазером и жидким азотом, потому что в этом случае не остается материала для гистологического исследования.
© Доктор Питер
Диагностика и лечение меланомы кожи в Институте онкологии ЕМС в Москве
Меланома — злокачественная опухоль из меланоцитов, клеток, производящих меланины (белки, защищающие кожу от ультрафиолетового излучения, придающие ей бронзовый цвет при загаре).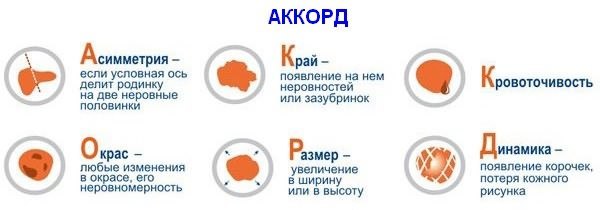 Локализуется меланома в основном в коже, в более редких случаях может возникнуть в радужной оболочке глаза, слизистых оболочках и очень редко во внутренних органах.
Локализуется меланома в основном в коже, в более редких случаях может возникнуть в радужной оболочке глаза, слизистых оболочках и очень редко во внутренних органах.
Факторы риска
-
Ультрафиолетовое повреждение кожи. Полученные в течение жизни солнечные ожоги значительно повышают риск образования меланомы.
-
Использование солярия.
-
Светлый фототип кожи — светлый цвет глаз и волос.
-
Большое количество родинок.
-
Более 5 атипичных родинок.
-
Наличие в личном или семейном анамнезе случаев рака кожи.
Клинически можно выделить 4 основных типа меланом:
Поверхностно-распространенная меланома — один из наиболее распространенных видов меланом, порядка 70% вновь выявленных случаев меланомы. При раннем обнаружении отличается в целом благоприятным прогнозом по сравнению с другими типами.
Узловая меланома – для нее характерен менее благоприятный прогноз, она быстрее растет и чаще метастазирует. В структуре заболеваемости занимает второе место — около 15% всех случаев выявленных меланом.
В структуре заболеваемости занимает второе место — около 15% всех случаев выявленных меланом.
Акролентигиозная меланома — медленно растущая меланома, поражает чаще всего ладони, подошвы, ногтевые ложа. Порядка 10% среди всех меланом.
Лентигиозная меланома — злокачественный вариант лентиго (описать что такое лентиго), поражает чаще всего пожилых людей, обычно локализуется в области лица, в участках наиболее сильно подверженных инсоляции (воздействию солнца). Растет очень медленно. Прогноз в целом благоприятный, около 5% среди всех случаев меланом.
И наиболее редкая и агрессивная меланома — беспигментная, встречается очень редко, быстро метастазирует, плохо отвечает на терапию, прогноз крайне неблагоприятный, средняя продолжительность жизни у пациентов с беспигментной меланомой — 1-2 месяца.
В целом меланома отличается достаточно агрессивным течением, ранним метастазированием, частым рецидивированием. При этом заподозрить меланому на ранних стадиях во многих случаях достаточно просто, нужно лишь знать, как она проявляется.
Самодиагностика
По всему миру широко применяется ABCDE-система, позволяющая заподозрить наличие меланомы, проанализировав некоторые параметры у подозрительного невуса (родинки). Институт меланомы Австралии, региона, лидирующего в мире по заболеваемости меланомой, разработал специальную учебную программу по профилактике меланомы кожи для учащихся средних школ, программа включает в себя и изучения ABCDE-системы, что подчеркивает важность метода в диагностике и самодиагностике меланомы кожи.
ABCDE – аббревиатура, в которой зашифрованы 5 параметров которые мы должны проанализировать:
A – assymetry, ассиметрия. Мысленно разделите родинку воображаемой линией ровно по середине, если левая и правая половина идентичны — все в норме.
B – borders, границы. У доброкачественного невуса границы края четкие, он четко отграничен от окружающей кожи. У меланомы, напротив, они размыты и могут как бы «врастать» в окружающую кожу.
У меланомы, напротив, они размыты и могут как бы «врастать» в окружающую кожу.
C – color, цвет. Чаще всего, доброкачественные родинки — одного цвета или оттенка, светлые или темные. В меланоме же могут быть вкрапления синего, красного, желтого и даже зеленого цветов, резко отличающихся от основного цвета родинки.
D – diameter, диаметр. Исследования показывают, что чаще всего, доброкачественный невус характеризуется размерами не более 6 мм, это приблизительно равно размеру круглого ластика на конце простого карандаша.
E – evolution, развитие. Любые изменения происходящие в невусе: изменения размера, цвета, появление сателлитов (небольшие образования схожие по структуре с невусом, появляющиеся вокруг него), появление клинических симптомов — зуд, кровоточивость, покалывание и т. д., все это состояния подозрительные на перерождение доброкачественного невуса в меланому.
д., все это состояния подозрительные на перерождение доброкачественного невуса в меланому.
Обладая этими знаниями, важно помнить, что окончательный диагноз может поставить только опытный онколог на основании патоморфологического исследования опухоли и полноценного обследования в специализированном центре.
Диагностика меланомы
Ключевым этапом диагностики меланомы является патоморфологическое исследование. Для получения материала опухоль нужно удалить, заранее предполагая, что это может быть меланома, поэтому иссечение должно быть выполнено широко, с захватом окружающих здоровых тканей. В последующем материал отправляется в Гистологическую лабораторию ЕМС, где ведущие российские патоморфологи смогут быстро и точно поставить диагноз. При необходимости, для получения «второго мнения», материал может быть отправлен коллегам из стран Западной Европы и США, эта услуга уже включена в стоимость исследования и дополнительно не оплачивается.
Патоморфологическое и иммуногистохимическое исследования позволяют не только определиться с диагнозом, но и позволят узнать глубину поражения кожи, и наличие у опухоли определенных мутаций, которые окажут ключевое влияние на выбор тактики лечения пациента.
Вторым важным этапом диагностики являются инструментальные и лабораторные исследования, которые нужны для поиска отдаленных метастазов в организме и постановки окончательного диагноза и определения стадии.
Согласно европейским и американским алгоритмам, обследование включает :
-
КТ органов грудной и брюшной полости, органов таза с внутривенным контрастированием, либо выполнение более совершенного метода обследования — ПЭТ/КТ всего тела, доступного в Институте онкологии ЕМС. ПЭТ/КТ — это современный и точный метод обследования позволяющий за один раз «просканировать» все тело пациента и выявить даже самые небольшие изменения, которые могут быть не видны на КТ.
-
МРТ головного мозга с контрастированием
При наличии специфических жалоб могут понадобиться дополнительные инструментальные и лабораторные исследования.
Стадирование
Установка стадии меланомы напрямую зависит от глубины поражения кожи опухолью и наличия метастазов. Цель всех диагностических мероприятий —определить стадию, от этого будет зависеть план дальнейшего лечения.
Стадия 0 — меланома in situ, опухоль не выходит за пределы эпидермиса.
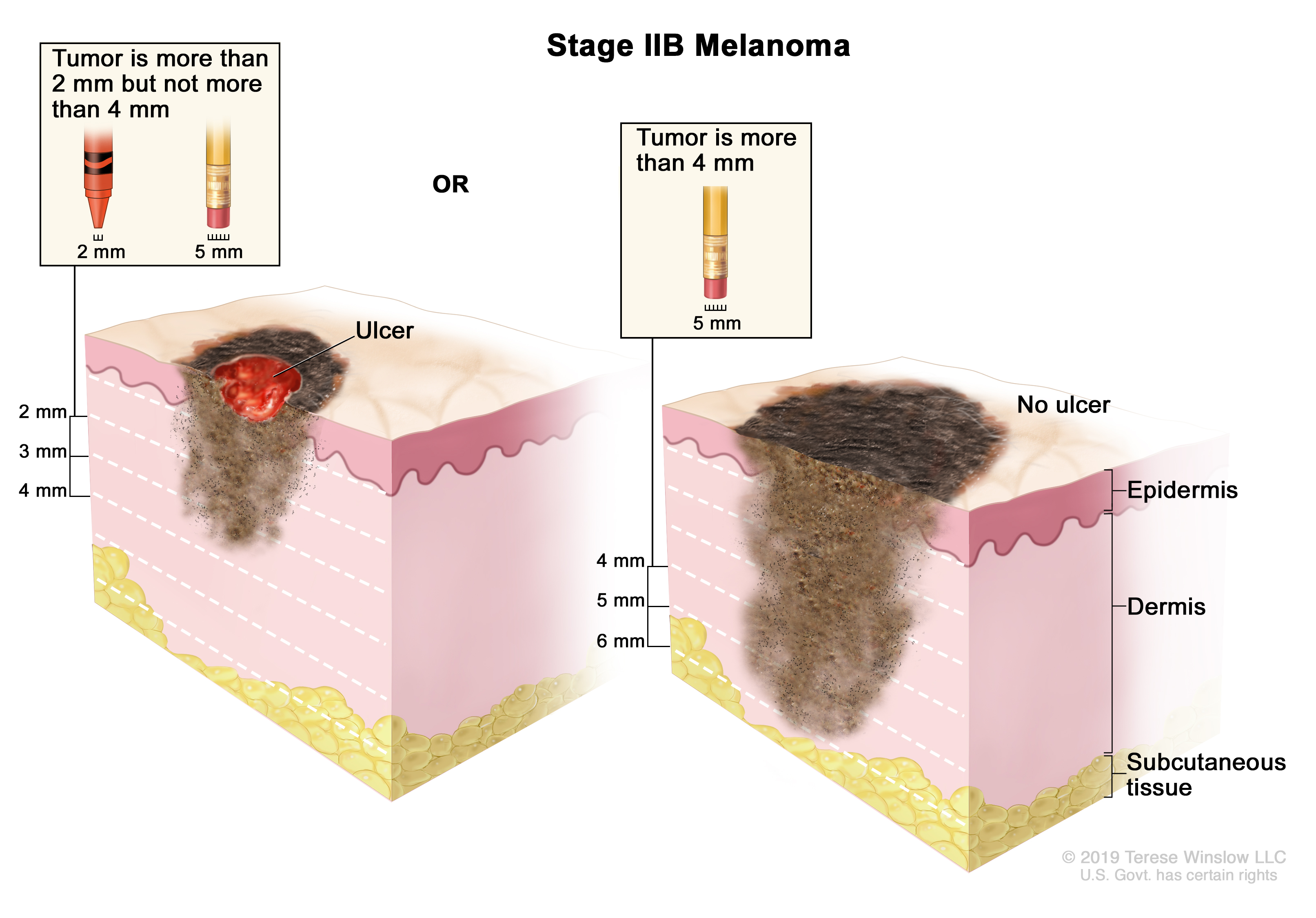
Стадия I — опухоль толщиной не более 2 мм, нет признаков изъязвления.
Стадия II — опухоль толщиной 1-2 мм с признаками изъязвления, либо опухоль более 2 мм.
Стадия III — опухоль поражает соседние лимфатические сосуды, узлы и/или кожу вокруг себя (появление сателлитов).
Стадия IV — опухоль поражает отдаленные участки организма: печень, легкие, головной мозг и т. д.
Лечение меланомы
Хирургическое лечение меланомы
Выбор тактики лечения меланомы кожи напрямую зависит от стадии заболевания. Когда опухоль локализована только в области первичного поражения (на коже), когда нет сателлитов и отдаленных метастазов (стадии 0, I, II) используются хирургические методы лечения — широкое иссечение + биопсия сторожевого лимфатического узла с последующим патоморфологическим исследованием.
Биопсия сторожевого лимфатического узла — удаление топографически наиболее близкого лимфатического узла к первичному очагу поражения, именно в него сначала устремятся клетки опухоли для метастазирования, и если в узле отсутствуют клетки меланомы — значит опухоль не начала распространение по организму, что дает лучший прогноз для пациента.
У пациентов с меланомой, распространившейся локально, с изменениями в окружающей коже (наличием сателлитов), с пораженными регионарными лимфатическими узлами и сосудами — стадия III — хирургическое лечение дополняется системной терапией (иммунотерапией или химиотерапией).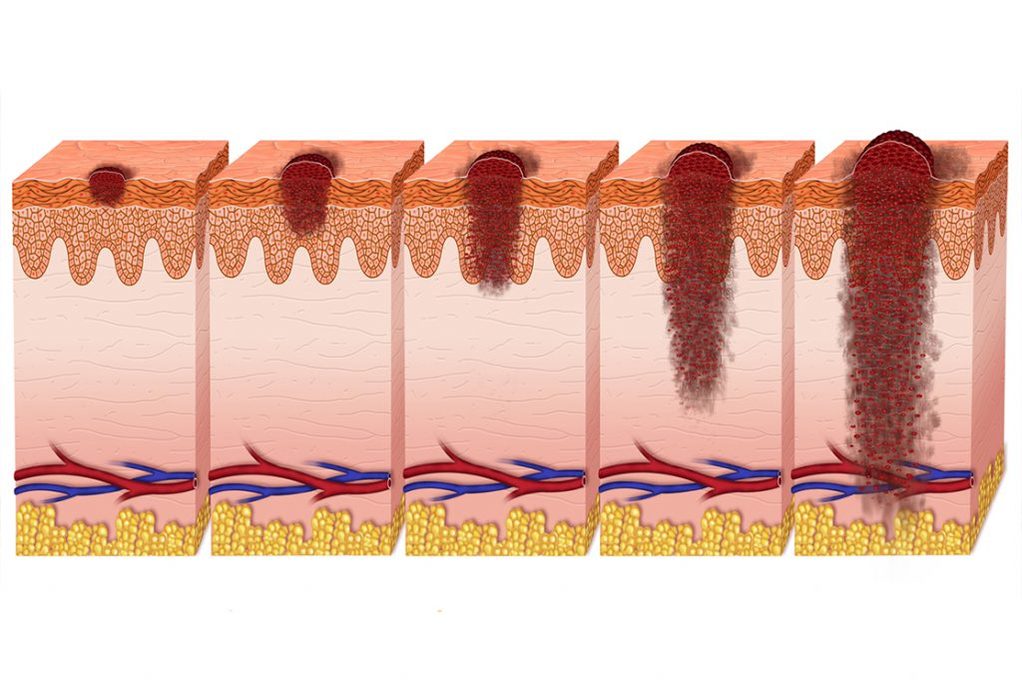 У пациентов с распространенной меланомой — метастазами в отдаленных областях организма — основу лечения составляет системная терапия. Решение о хирургическом вмешательстве принимается в каждом случае индивидуально в зависимости от возможности выполнения операции — состояния пациента и резектабельности метастазов.
У пациентов с распространенной меланомой — метастазами в отдаленных областях организма — основу лечения составляет системная терапия. Решение о хирургическом вмешательстве принимается в каждом случае индивидуально в зависимости от возможности выполнения операции — состояния пациента и резектабельности метастазов.
Лучевая терапия меланомы
Лучевая терапия — метод лечения меланомы, при котором для уничтожения клеток опухоли применяется излучение с высокой энергией. При лечении меланомы лучевая терапия обычно применяется с паллиативной целью или как метод лечения метастазов в головном мозге, при ограниченных возможностях хирургического лечения, чаще всего для лечения пациентов с меланомой III и IV стадий.
Иммунотерапия меланомы
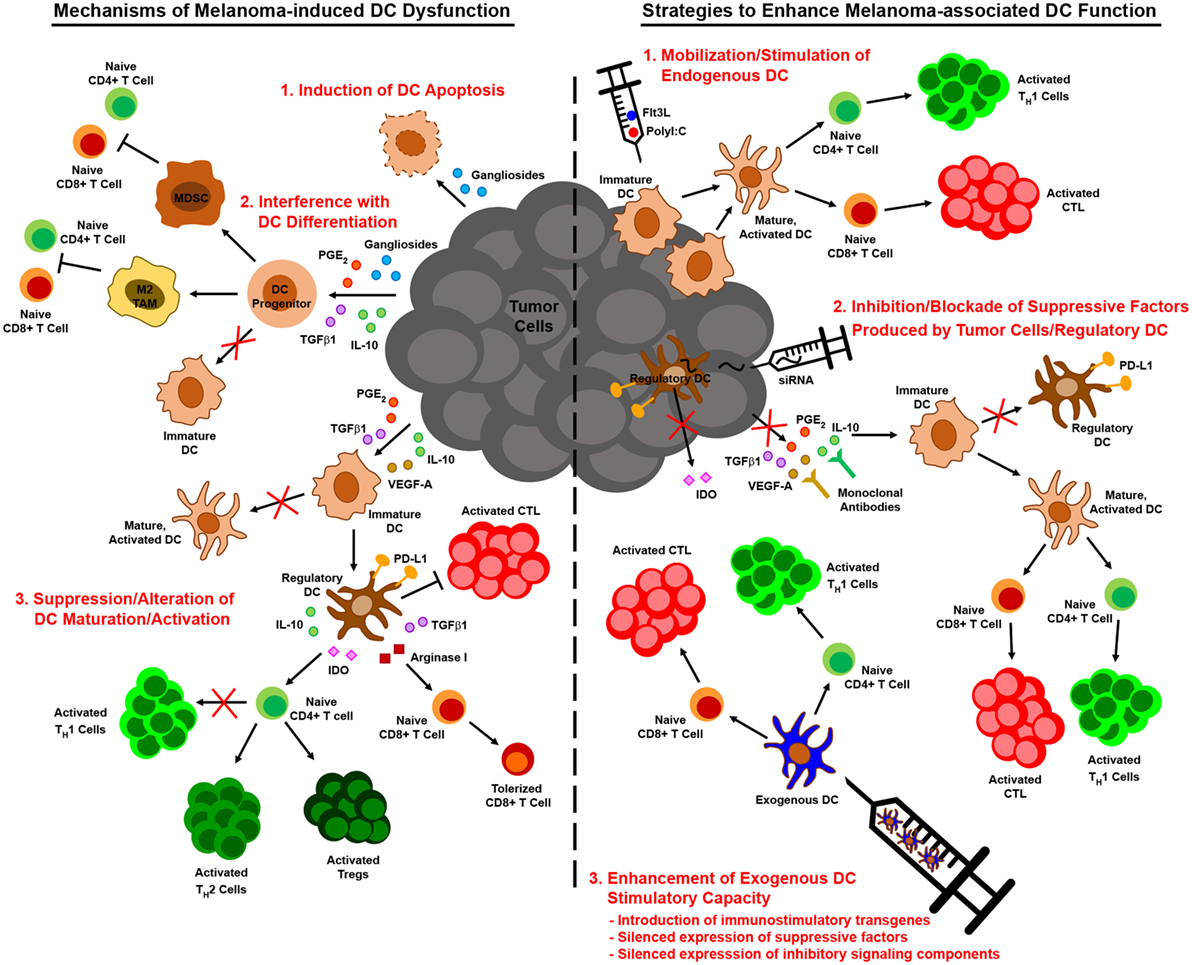
Иммунная система — система органов, тканей и специальных клеток организма, основной задачей которых является поиск и уничтожение чужеродных агентов, патогенов, вирусов, паразитов и также опухолевых клеток.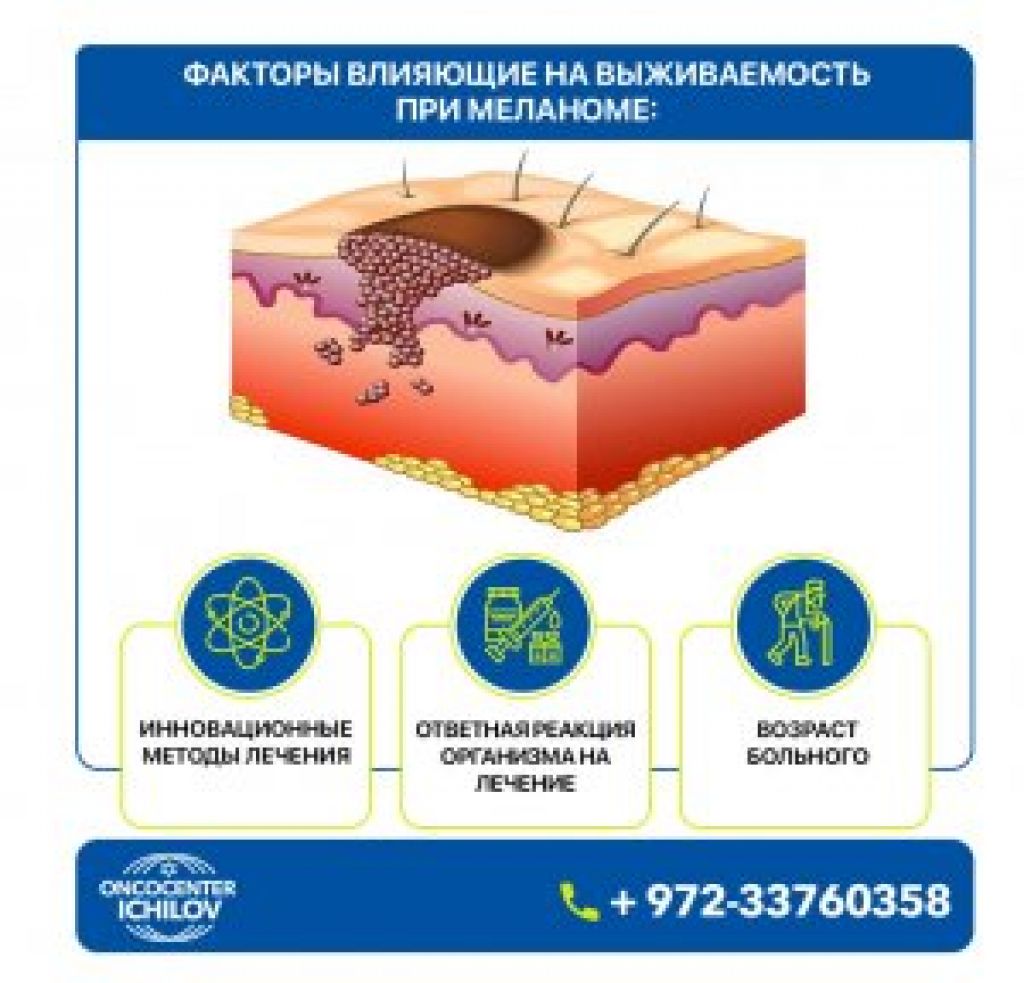 Иммунотерапия в онкологии — это вариант системной медикаментозной терапии, направленной на активацию собственной иммунной системы для борьбы с опухолью. Происходит это за счет либо усиления иммунной системы в целом, либо за счет «тренировки» иммунных клеток для лучшего специфического ответа именно против опухолевых клеток.
Иммунотерапия в онкологии — это вариант системной медикаментозной терапии, направленной на активацию собственной иммунной системы для борьбы с опухолью. Происходит это за счет либо усиления иммунной системы в целом, либо за счет «тренировки» иммунных клеток для лучшего специфического ответа именно против опухолевых клеток.
Этот вид терапии на сегодняшний день — один из самых современных и быстроразвивающихся, иммунотерапия становится все более важной частью противоопухолевого лечения. Развитие обусловлено высокой эффективностью таких препаратов, а так же меньшим числом побочных эффектов по сравнению с традиционной химиотерапией. В Институте онкологии ЕМС для иммунотерапии доступны самые новые и качественные препараты, лечение в клинике проводится согласно последним европейским и американским протоколам.
Меланома – иммуногенная опухоль, которая активно борется против иммунной системы организма, ее клетки выделяют специальные вещества, которые позволяют ей либо ускользнуть от иммунных клеток организма, либо за их счет стимулировать собственные рост и развитие.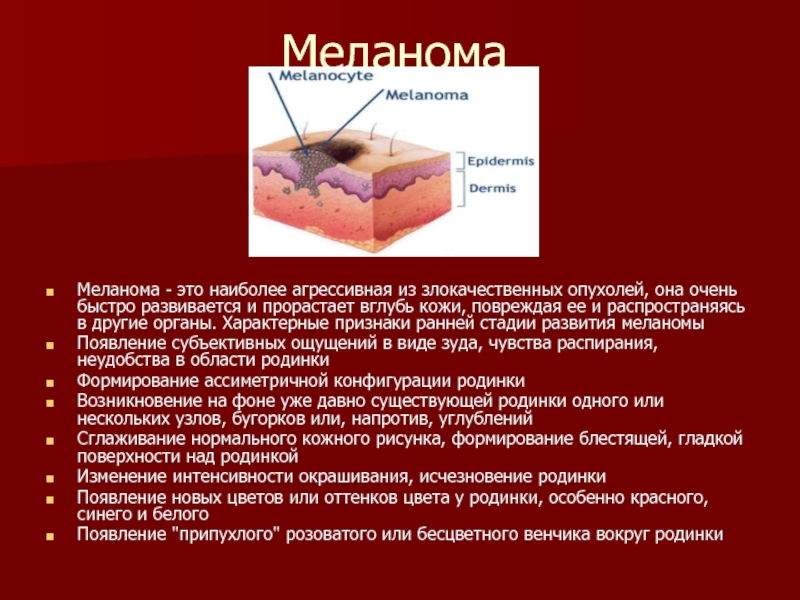
В иммунотерапии меланомы есть несколько ключевых подходов:
-
Использование ингибиторов контрольных точек иммунного ответа
-
Использование цитокинов
-
Использование таргетной терапии
Использование ингибиторов контрольных точек иммунного ответа
Важной способностью иммунной системы является возможность отличать нормальные здоровые клетки организма от клеток опухоли, происходит это в том числе за счет контрольных точек иммунного ответа – специальных молекул на поверхности Т-лимфоцитов (клеток иммунной системы), которые должны быть активированы или инактивированы для начала иммунного ответа. В терапии меланомы используются блокаторы молекулы PD-1: пембролизумаб (Keytruda) и ниволумаб (Oppo). Эффективность этих препаратов доказана множеством клинических исследований, при местататической меланоме, более 50% пациентов, получавших эти препараты, переживали 10 лет. Второй группой препаратов в группе ингибиторов иммунных переключателей являются блокаторы CTLA-4 – молекулы, действие которой схоже с PD-1, она также позволяет клеткам опухоли избегать иммунного ответа организма. Основной препарат в группе блокаторов CTLA-4 — ипилимумаб (Yervoy), вещество, также доказавшее свою эффективность в множестве клинических исследований.
Основной препарат в группе блокаторов CTLA-4 — ипилимумаб (Yervoy), вещество, также доказавшее свою эффективность в множестве клинических исследований.
Использование цитокинов
Цитокины – химические вещества, которые синтезируются некоторыми клетками иммунной системы. Цитокины играют ключевую роль в регуляции роста и активности иммунных клеток. Для лечения меланомы используют две основные группы цитокинов – интерлейкины и интерфероны.
Интерлейкины – группы цитокинов, которая передает сигналы между иммунными клетками в организме.
Препарат интерлейкин-2 (IL-2) помогает клеткам иммунной системы расти и делиться значительно быстрее. Препарат показал свою эффективность в лечении рака почки и метастатической меланомы. IL-2 может использоваться и в виде монотерапии, и в комбинации с другими препаратами химиотерапевтическими или иммунотерапевтическими. Интерфероны – химические вещества помогающие организму бороться с вирусными инфекциями и опухолевыми клетками. Существует три типа интерферонов: альфа, бета и гамма. Для лечения онкологических заболеваний используется только интерферон-альфа. Он стимулирует активность иммунных клеток и позволяет им эффективнее бороться с клетками опухоли, замедляя их рост и уничтожая их.
Существует три типа интерферонов: альфа, бета и гамма. Для лечения онкологических заболеваний используется только интерферон-альфа. Он стимулирует активность иммунных клеток и позволяет им эффективнее бороться с клетками опухоли, замедляя их рост и уничтожая их.
Использование таргетной терапии
Терапия моноклональными антителами (таргетная терапия, биотерапия) — вариант системной терапии онкологических заболеваний, при котором используются специально выращенные моноклональные антитела (специальные белки, выделяемые иммунными клетками), тропные именно к клеткам опухоли. Такая терапия подходит не в каждом случае, сначала нужно выяснить гисто-генетический портрет опухоли с помощью иммуногистохимического исследования, которое позволит понять, есть ли в исследуемой опухоли мутации, которые позволят применять таргетные препараты или нет. При выборе тактики лечения меланомы нужно оценить наличие мутаций BRAF, C-kit и MEK, для каждой из них есть свои препараты:
BRAF — вемурафениб (zelboraf), дабрафениб (tafinlar), траметиниб (mekinist) , кобиметиниб (cotellic) — последние два так же активны при наличии мутации MEK
C-kit – иматиниб (gleevec)
К препаратам группы таргетной терапии так же относятся описанные выше блокаторы PD-1. Преимущество моноклональных антител в сравнении с классической химиотерапией в меньшем числе побочных эффектов, достигается это за счет избирательности их действия исключительно на клетки опухоли и в гораздо меньшей степени на остальные клетки организма.
Преимущество моноклональных антител в сравнении с классической химиотерапией в меньшем числе побочных эффектов, достигается это за счет избирательности их действия исключительно на клетки опухоли и в гораздо меньшей степени на остальные клетки организма.
Химиотерапия
Классическая химиотерапия также может применяться при лечении меланом. Обычно это происходит в случаях, когда иммунотерапия оказалась неэффективной, либо если на фоне ее применения развились нежелательные побочные реакции, угрожающие жизни пациента. В лечении меланомы используются химиопрепараты:
и их комбинации.
Дальнейшее наблюдение
Частота и методы контрольных обследований зависят от стадии заболевания и проведенного лечения. Пациентам с заболеваниями на ранних стадиях (0, I, IIА) показан ежегодный полный осмотр кожных покровов, регулярный самоосмотр кожи и лимфатических узлов. Методы визуализации (КТ, МРТ, ПЭТ/КТ, УЗИ и т. д.) показаны при наличии специфических симптомов.
Пациентам с IIB — IV стадиями заболевания контрольные обследования показаны каждые 3-6 месяцев на протяжении 2 лет после лечения, в последующем — каждые 3-12 месяцев на протяжении 3 лет, и затем каждый год на протяжении всей жизни, регулярные ультразвуковые исследования лимфатических узлов. Обследование включает в себя:
-
тщательный осмотр кожных покровов и оценку состояния лимфатических узлов
-
КТ органов грудной и брюшной полости, органов таза с внутривенным контрастированием, либо ПЭТ/КТ всего тела
-
КТ или МРТ головного мозга с в/в контрастированием
Крупный успех в лечении меланомы на поздней стадии — выживает более половины пациентов
Автор фото, Getty Images
В лечении одной из самых страшных раковых опухолей — меланомы — достигнут большой успех.
Десять лет назад всего один из 20 пациентов, которому диагностировали меланому на поздней стадии, выживал в течение пяти лет. Большинство умирали в течение нескольких месяцев после постановки диагноза.
Большинство умирали в течение нескольких месяцев после постановки диагноза.
Теперь, по данным британских врачей, 52% пациентов с таким диагнозом имеют шанс прожить по крайней мере пять лет, благодаря иммунотерапии.
Насколько опасна меланома?
Меланома — пятый по распространенности вид рака в Британии. От неё гибнет около 2300 человек в год.
Если диагноз ставится на раннем этапе заболевания, шансы на выживание высоки. Однако если к моменту обнаружения рак начал агрессивно распространяться в организме пациента и образовывать метастазы, смерть наступала в течение в течение 6-9 месяцев после постановки диагноза.
«В прошлом метастазирующая меланома считалась неизлечимым заболеванием, — говорит профессор Джеймс Ларкин, консультант медицинского управления Ройял Марсден. — Онкологи считали меланому особым видом рака, который было невозможно лечить на стадии образования метастаз».
Что показали клинические испытания?
В клинических испытаниях, которые проходили в течение пяти лет в британских больницах, приняли участие 945 пациентов с меланомой четвертой стадии.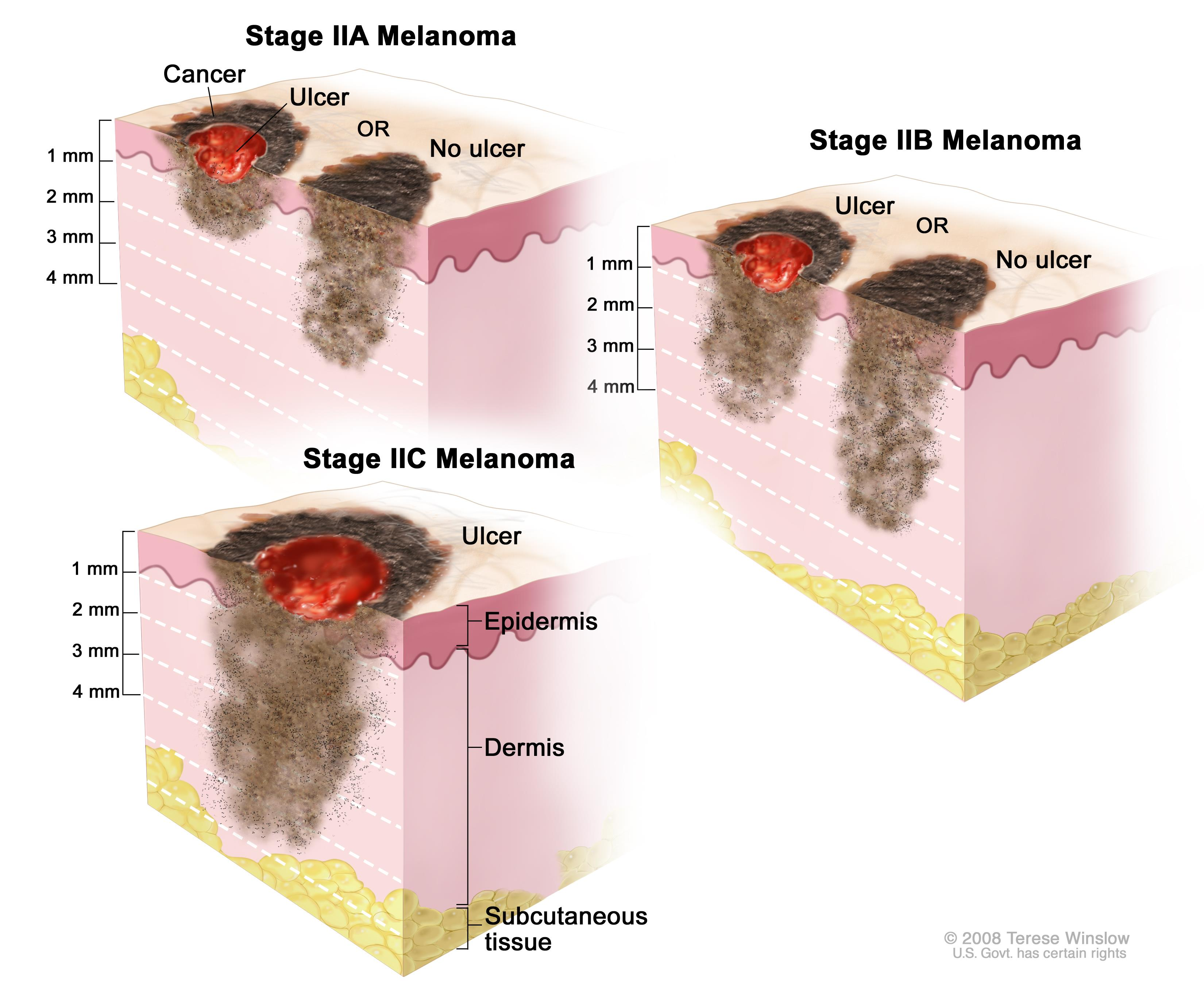
Треть из них получала ниволумаб, треть — ипилимумаб, а еще трети вводились оба лекарства.
Спустя пять лет врачи проанализировали выживаемость пациентов.
Оказалось, что выжили:
- 26% больных, получавших ипилимумаб
- 44% больных, получавших ниволумаб
- 52% больных, получавших и тот и другой препарат
«Мы были поражены столь быстрым прогрессом в течение такого короткого времени, — рассказывает профессор Ларкин. — Речь идет о самой необычной трансформации в лечении вида рака, который до этого считался самым трудно излечимым онкологическим заболеванием».
Результаты клинических испытания были доложены на заседании Европейского общества медицинской онкологии и опубликованы в журнале New England Journal of Medicine.
Свидетельства пациентов
Автор фото, Pam Smith
Подпись к фото,
Пам Смит: я могла никогда не увидеть своих внуков
67 летняя Пам Смит, проходившая лечение в больнице города Танбридж-Уэллс, была включена в программу испытаний в январе 2014 года.
Она была в отчаянии, узнав, что ее рак является неизлечимым. У нее не было никаких шансов выжить, если бы не новые методы лечения, говорит Пам.
В течение четырех месяцев каждые две недели ей вводили препараты, но лекарства вызвали у нее такие сильные побочные эффекты в форме диареи, что лечение пришлось прекратить.
Однако ее опухоль сократилась вдвое и перестала расти. По словам Пам, она прекрасно себя чувствует.
«Я могла никогда не увидеть своих внуков, — говорит она. — Прошло уже больше пяти лет с момента диагноза, и моему внуку исполнилось шесть лет».
Можно ли считать результат полным излечением?
В случае рака всегда трудно говорить о полном излечении, но ремиссия в течение пяти лет является крупным достижением.
Некоторые из пациентов, которые принимают эти препараты, находятся в полной ремиссии и сканирование не выявляет у них патологий.
Другие, подобно Пам, имеют опухоли, но те не проявляют признаков роста.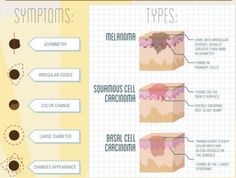
Из всех выживших пациентов три четверти больше не нуждаются в приеме антираковых препаратов.
Иммунотерапия доказывает свою эффективность
Обычно наша иммунная система самостоятельно ищет в организме мутировавшие клетки и разрушает их, не давая им размножаться. Однако раковые клетки нашли способ обходить эту естественную защиту, что позволяет опухоли быстро расти.
Лауреаты Нобелевской премии по медицине 2018 года американец Джеймс Аллисон и японец Тасуку Хондзё научились обманывать раковые клетки и не давать им блокировать иммунную реакцию. Это произвело настоящую революцию в терапии и легло в основу нового класса лекарственных препаратов.
Пока что у этих лекарств немало побочных эффектов, однако они доказали свою эффективность в борьбе с онкологией. Иногда удается вылечить даже пациентов на поздней стадии рака, которых ранее считали неизлечимыми.
Как насчет побочных симптомов?
Да, новые препараты воздействуют на всю иммунную систему человека и могут вызывать такие побочные эффекты как усталость, воспаления кожи и диарею.
Иногда побочные эффекты оказываются настолько серьезными, что пациент, подобно Пам Смит, не может пройти полный курс лечения.
Однако даже кратковременное лечение, как оказалось, оказывает длительное благотворное воздействие на иммунную систему и на общее состояние больных.
Это сильно отличает иммунотерапию от других методов лечения, например, химиотерапии, которая перестает действовать при прекращении приема препаратов.
В то же время следует учитывать, что воздействие на иммунную систему может приводить к тому, что побочные эффекты могут проявляться и в дальнейшем.
Насколько доступны новые лекарства?
Результаты этого клинического испытания привели к тому, что новые иммунопрепараты начинают применяться по всему миру.
Государственная служба здравоохранения Британии необычно быстро одобрила применение новых препаратов. Теперь ими лечат и другие виды рака — легких и почек.
Осторожно! Меланома! — БУЗ ВО Великоустюгская ЦРБ
Меланома — одна из разновидностей кожных злокачественных новообразований, которая развивается из пигментных клеток-меланоцитов, продуцирующих меланины, и характеризующаяся агрессивным, часто непредсказуемым и вариабельным характером клинического течения.
Наиболее частая ее локализация — кожные покровы, значительно реже — слизистая оболочка глаз, полости носа, рта, гортани, кожа наружного слухового прохода, заднепроходного отверстия, женских наружных половых органов. Эта опухоль является одной из наиболее тяжелых форм рака, непропорционально часто поражающей людей молодого (15-40 лет) возраста, и занимающей 6-е место в числе всех злокачественных опухолей у мужчин и 2-е место — у женщин (после рака шейки матки).
Еще около 40 лет назад меланома кожи была относительно редким заболеванием. Однако в последние десятилетия частота ее значительно увеличилась, и годовые темпы роста составляют до 5%. Чем опасна меланома?
Как отличить родинку от меланомы?
Доброкачественному родимому пятну характерны:
- Симметричной формой.

- Плавными ровными очертаниями.
- Равномерной пигментацией, придающей образованию окраску от желтой до коричневой и даже иногда черной.
- Плоской поверхностью, находящейся на одном уровне с поверхностью окружающей кожи или незначительно равномерно над ней возвышающейся.
- Отсутствием увеличения в размерах или незначительным ростом в течение длительного времени.
Как выглядит меланома?
Она может иметь вид плоского пигментного или непигментированного пятна с небольшим возвышением, округлой, полигональной, овальной или неправильной формы с размером в диаметре более 6 мм. Она длительное время может сохранять гладкую блестящую поверхность, на которой в дальнейшем возникают небольшие изъязвления, неровности, кровоточивость при незначительной травме. Пигментация чаще носит неравномерный характер, но более интенсивная в центральной части, иногда с характерным ободком черной окраски вокруг основания. Окраска всего новообразования может быть коричневой, черной с синеватым оттенком, багровой, пестрой в виде отдельных неравномерно распределенных пятнышек.
В ряде случаев оно приобретает вид разросшихся папиллом, напоминая «цветную капусту», или форму гриба на широком основании или на ножке. Рядом с меланомой иногда возникают дополнительные отдельные или сливающиеся с основной опухолью очаги («сателлиты»). Изредка опухоль проявляется ограниченным покраснением, превращающимся в постоянную язву, дно которой заполняется разрастаниями. При развитии на фоне родимого пятна злокачественная опухоль может развиваться на его периферии, формируя асимметричное образование.
Большое значение имеет знание достоверных и значимых симптомов перехода доброкачественных образований в активное состояние. Как распознать злокачественное образование и момент трансформации в него родимого пятна? Ранние признаки следующие:
- Увеличение плоскостных размеров до того неизменной или очень медленно увеличивающейся родинки, или быстрый рост вновь возникшего невуса.
- Изменение формы или очертаний уже существовавшего образования. Возникновение на каком-либо его участке уплотнений или асимметрии контуров.
- Изменение цвета или исчезновение равномерности окраски существовавшего или приобретенного «родимого» пятна.
- Изменение интенсивности (увеличение или уменьшение) пигментации.
- Появление необычных ощущений — зуд, покалывание, жжение, «распирание».
- Возникновение покраснения вокруг родимого пятна в виде венчика.
- Исчезновение волос с поверхности образования, если они были, исчезновение кожного рисунка.
- Появление трещин, шелушения и кровоточивости при незначительных травмах (легкое трение одеждой) или даже без них, а также разрастаний по типупапилломы.
Наличие одного из этих симптомов, а тем более их сочетание — повод для обращения пациента на прием к врачу, для дальнейшего направления в специализированное лечебно-профилактическое учреждение онкологической направленности для обследования и лечения
Лечение меланомы кожи
Главный метод — это хирургическое ножевое, лазерное или радиоволновое иссечение опухоли. При наличии метастатических очагов применяется сочетание хирургического метода с химио- и иммунотерапией.
При наличии метастатических очагов применяется сочетание хирургического метода с химио- и иммунотерапией.
Профилактика меланомы
Основным методом предотвращения развития злокачественных опухолей на коже является своевременное удаление тех родинок, пигментных пятен, невусов, которые были травмированы. А также тех участков тела, которые в силу своего месторасположения подвергаются огромному риску травмирования и, значит, дальнейшей возможности развития меланомы. Немаловажное значение имеет ограничение пребывания на солнце тем людям, которые относятся к группам риска (светлокожие, рыжие, с большим количество родинок, а также те, у кого в роду были случаи развития меланом). Для этих людей очень важно защищать свою кожу от прямого воздействия солнечных лучей, таккак это может быть для них именно тем фактором, который спровоцирует развитие опухоли.
10 методов профилактики меланомы
- Избегать УФ излучения. Один из лучших методов, снижающий риск развития.

- Носить головные уборы. Бейсболки, кепки и соломенные шляпки защищают кожу человека значительно хуже, нежели шляпа с широкими полями, сшитая из плотного материала, ведь защищает кожу на лбу, ушах, носу и частично шее.
- Носить солнцезащитные очки. Солнцезащитные очки с высокой степенью защиты от солнечных лучей защищают глаза и кожу вокруг, то есть веки.
- Носить одежду, закрывающую большие участки кожи. Естественно лучшим вариантом будет ношение рубашек с длинными рукавами и брюк. Цвет одежды, чем темнее, тем больше защищает. Благодаря инновационным технологиям сейчас создали такой материал, который очень хорошо защищает от солнечных лучей.
- Наносить на кожу защитные косметические средства. Средства от солнечной защиты и бальзамы для губ рекомендуют использовать даже специалисты высококвалифицированных медицинских учреждений.
- Находиться в тени. Во время наивысшей солнечной активности лучше оставаться в тени. Помните, что солнечные лучи проходят через легкие облачка.
- Не посещать солярии. Не зря дерматологи всего мира категорически не рекомендуют находиться под лампами соляриев.
- Получать витамин Д из пищи. Этот незаменимый витамин лучше потреблять с пищей и пищевых добавок, а также поливитаминов.
- Удалять родинки и наблюдать за невусами. Люди с большим количеством родинок на теле должны с завидной регулярностью посещать дерматологический кабинет, а если понадобится, то и удалять образования.
- Пройти генетическое тестирование. Наследственная предрасположенность может стать причиной развития меланомы. Поэтому пройти тестирование и выявить свою предрасположенность.
Ультрафиолетовое (УФ) излучение и рак кожи
Немеланомные раковые заболевания кожи
К немеланомным раковым заболеваниям кожи относятся такие, как базальноклеточная и плоскоклеточная карцинома. Эти два вида рака редко приводят к летальному исходу, но их хирургическое лечение болезненно и часто оставляет серьезные уродующие шрамы. Временные тенденции заболеваемости немеланомным раком кожи определить сложно, поскольку не удалось добиться надежной регистрации этих случаев раковых заболеваний. Однако, специальные научные исследования, проведенные в Австралии, Канаде и Соединенных Штатах, указывают на то, что в период с 60-х по 80-е годы прошлого столетия уровень распространенности немеланомных раковых заболеваний кожи увеличился более чем в два раза.
Временные тенденции заболеваемости немеланомным раком кожи определить сложно, поскольку не удалось добиться надежной регистрации этих случаев раковых заболеваний. Однако, специальные научные исследования, проведенные в Австралии, Канаде и Соединенных Штатах, указывают на то, что в период с 60-х по 80-е годы прошлого столетия уровень распространенности немеланомных раковых заболеваний кожи увеличился более чем в два раза.
Риск развития немеланомных раковых заболеваний кожи рассматривался в контексте индивидуального воздействия УФ-излучения, в результате чего можно сделать следующие выводы:
- Чаще всего немеланомные раковые заболевания кожи развиваются на тех участках тела, которые обычно открыты солнцу, т.е. на ушах, шее и предплечье. Это означает, что длительное, повторяющееся воздействие УФ-излучения является основной причиной возникновения таких заболеваний.
- В некоторых странах установлена четкая взаимосвязь между ростом заболеваемости немеланомными видами рака кожи и меньшими значениями географической широты, поскольку чем меньше расстояние от экватора, тем выше уровни УФ-излучения.

Злокачественная меланома
Распространенность злокачественной меланомы гораздо ниже, чем немеланомных раковых заболеваний кожи, но именно меланома является основной причиной смерти от рака кожи. При этом вероятность регистрации и правильного диагностирования меланомы выше, чем немеланомных раковых заболеваний. С начала 70-х годов прошлого века заболеваемость злокачественной меланомой значительно выросла (например, в Соединенных Штатах она растет в среднем на 4% в год). Результаты многочисленных научных исследований указывают на то, что риск злокачественной меланомы находится в определенной зависимости от генетической предрасположенности и индивидуальных свойств организма, а также от поведения человека в отношении возможного воздействия на него УФ-излучения. Ниже дается краткое описание основных факторов риска заболевания злокачественной меланомой.
- Большое количество атипичных родимых пятен (родинок) — это самый значительный фактор риска заболевания злокачественной меланомой людей со светлым типом кожи.

- Злокачественная меланома чаще встречается у людей с бледным цветом лица, голубыми глазами, рыжими или светлыми волосами. Экспериментальные исследования показали, что при сравнении больных меланомой и контрольной группы людей первым потребовалась меньшая минимальная доза УФ-облучения, вызвавшая у них эритему, причем более долго заживавшую эритему.
- Сильное прерывистое воздействие солнечного УФ-излучения может быть серьезным фактором риска развития злокачественной меланомы.
- Заболеваемость злокачественной меланомой среди представителей белой расы обычно тем выше, чем ближе к экватору расположено место их обитания, а самая высокая заболеваемость среди них была зарегистрирована в Австралии, где ежегодные уровни заболеваемости в 10 раз (для женщин) и более, чем в 20 раз (для мужчин) превышают уровни, зарегистрированные в Европе.
- Ряд эпидемиологических исследований подтверждает наличие прямой связи заболевания меланомой с солнечным ожогом, имевшим место когда-то в прошлом, особенно в раннем возрасте.

- Роль кумулятивного воздействия солнца в развитии злокачественной меланомы неоднозначна. Однако риск злокачественной меланомы выше для тех людей, у которых в прошлом диагностировался немеланомный рак кожи или актинический (солнечный) кератоз. В обоих случаях это указывает на кумулятивное воздействие УФ-излучения.
Лучевая терапия при меланоме: что обеспечит благоприятное будущее?
Результаты исследования указывают на возможный синергетический эффект облучения и ингибиторов контрольных точек в терапии меланомы. Однако еще остались вопросы, ответы на которые пока не получены, например, вопрос о последовательности лечения.
По мнению профессора Жана Жака Гроба из университета Экс-Марселя, Марсель, которое он высказал во время 7-й конференции European Post-Chicago Melanoma/ Skin Cancer Meeting, проходившей в Мюнхене, объяснить, каким станет будущее лучевой терапии (ЛТ) при лечении меланомы, непросто. В настоящее время ЛT используется непосредственно для спасения жизни пациента, например, при наличии метастазов в головной мозг. Кроме того, симптоматическая ЛT применяется для поддержания качества жизни пациентов. По словам Гроба, классическое адъювантное применение ЛТ в значительной степени ушло на второй план.
В настоящее время ЛT используется непосредственно для спасения жизни пациента, например, при наличии метастазов в головной мозг. Кроме того, симптоматическая ЛT применяется для поддержания качества жизни пациентов. По словам Гроба, классическое адъювантное применение ЛТ в значительной степени ушло на второй план.
За последние годы технологии ЛТ были некоторым образом усовершенствованы. К таким положительным изменениям относятся, помимо всего прочего, графическая ЛТ («image guided radiotherapy») и стереотаксическая лучевая терапия. Возможной отправной точкой для возможных дальнейших разработок Гроб назвал «абскопальный эффект», который наблюдался в различных опухолевых единицах, а также в меланоме. Этот эффект описывает уменьшение опухолевой массы — как правило, метастазов, который возникает при ЛT отдаленных частей опухоли. Предполагается, что этот процесс основан на системной иммунологической реакции, точный механизм действия которой неизвестен.
«Вопрос состоит в том, возможно ли трансформировать этот редкий эффект в ЛT следующего поколения, используя синергию с целенаправленной терапией или иммунотерапией?», — размышляет Гроб.
Использование синергетического эффекта
ЛТ прямо и косвенно воздействует на опухоль, поскольку она вызывает гибель иммуногенных опухолевых клеток. При этом происходит высвобождение факторов, которые стимулируют созревание антигенпредставляющих клеток (APC) или поглощение антигена APC. Однако в дополнение к желаемым эффектам она также оказывает благоприятное воздействие на рост опухоли, такое как, например, усиление экспрессии PD-L1 («первый лиганд программируемой смерти клеток») или повышение параметров TGF-β, которое приводит к повышению числа регуляторных Т-клеток.
Различные доклинические исследования указывают на синергический эффект комбинации ингибиторов контрольных точек и ЛT. Таким образом, комбинация ингибитора PD-L1 при помощи высодозированной ЛT усиливала иммунный ответ в модели аллотрансплантата с протоковой аденокарциномой поджелудочной железы.
Открытые вопросы
Тем не менее, Гроб заявил в Мюнхене о том, что, несмотря на многообещающие результаты доклинических исследований, еще предстоит решить многочисленные вопросы.
К ним, наряду с вопросом о переносимости у человека, относится например, вопрос о том, каким образом общую дозу следует фракционировать до меньших индивидуальных доз. Кроме того, все еще неясными остаются доза и объем облучения (размеры области облучения), а также временная последовательность методов терапии.
Гроб процитировал результаты исследований, согласно которым при наличии ингибиторов CTLA-4 (антиген-4, ассоциированный с цитотоксическими T-лимфоцитами) было бы эффективнее начать, а затем продолжить одновременное проведение иммунотерапии и стереотаксической ЛT. В сочетании с ингибитором PD-L1 было бы лучше начать иммунотерапию незадолго до фракционированной ЛT и продолжить ее после ЛT.
Клиническое применение
В настоящее время в рамках многочисленных клинических исследованиях рассматривается комбинация иммунотерапии и ЛT.
Недавно был опубликован анализ исследования KEYNOTE-001, в котором рассматривалась эффективность ингибитора контрольных точек вместе с ЛT.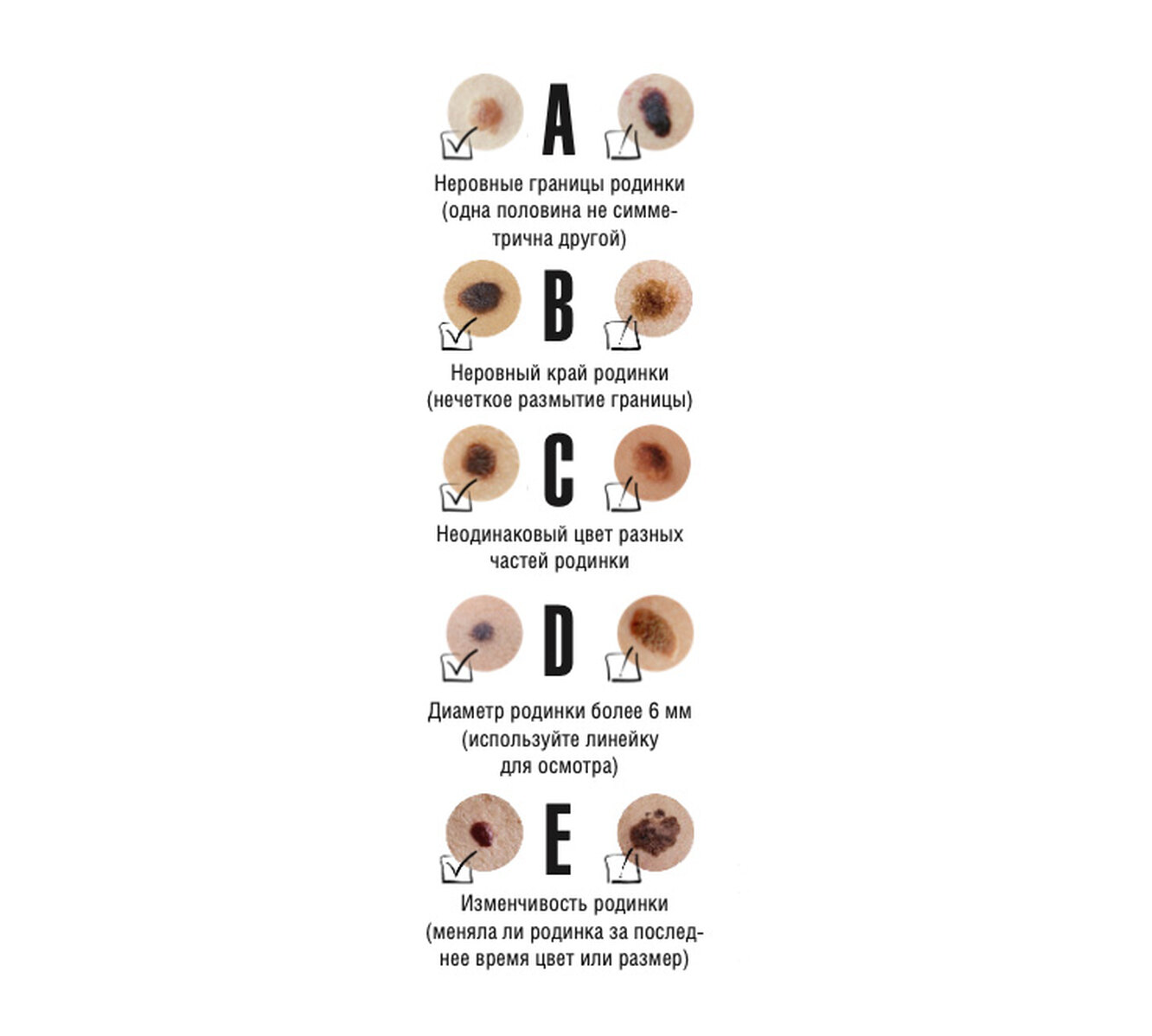 При этом у пациентов, которым дополнительно проводилась ЛТ, было обнаружено значительное преимущество в отношении выживаемости без прогрессирования и общей выживаемости. Предварительное проведение ЛТ было самым важным прогнозирующим фактором для выживаемости.
При этом у пациентов, которым дополнительно проводилась ЛТ, было обнаружено значительное преимущество в отношении выживаемости без прогрессирования и общей выживаемости. Предварительное проведение ЛТ было самым важным прогнозирующим фактором для выживаемости.
Тем не менее, Гроб отметил, что часто неясно, основаны ли эффекты на сочетании с ЛТ или только на иммунотерапии. «У иммунотерапии есть много партнеров, и ЛT — не самый простой из них. Поэтому я бы с большой осторожностью заявлял о том, что мы могли бы таким образом создать ЛТ следующего поколения», — сказал Гроб.
Так что очень волнуюсь — зловещий крот
Привет всем, впервые публикую здесь, но действительно нужно разгрузить, и решил, что это то место, где люди поймут.
Итак, у меня есть довольно сомнительно выглядящая родинка на правой стороне лица, между концом моей брови и линией роста волос. Это не то место, где вы легко могли бы увидеть лицо в зеркале, поэтому моя проблема в том, что я, честно говоря, не знаю, как долго оно выглядело так, как сейчас.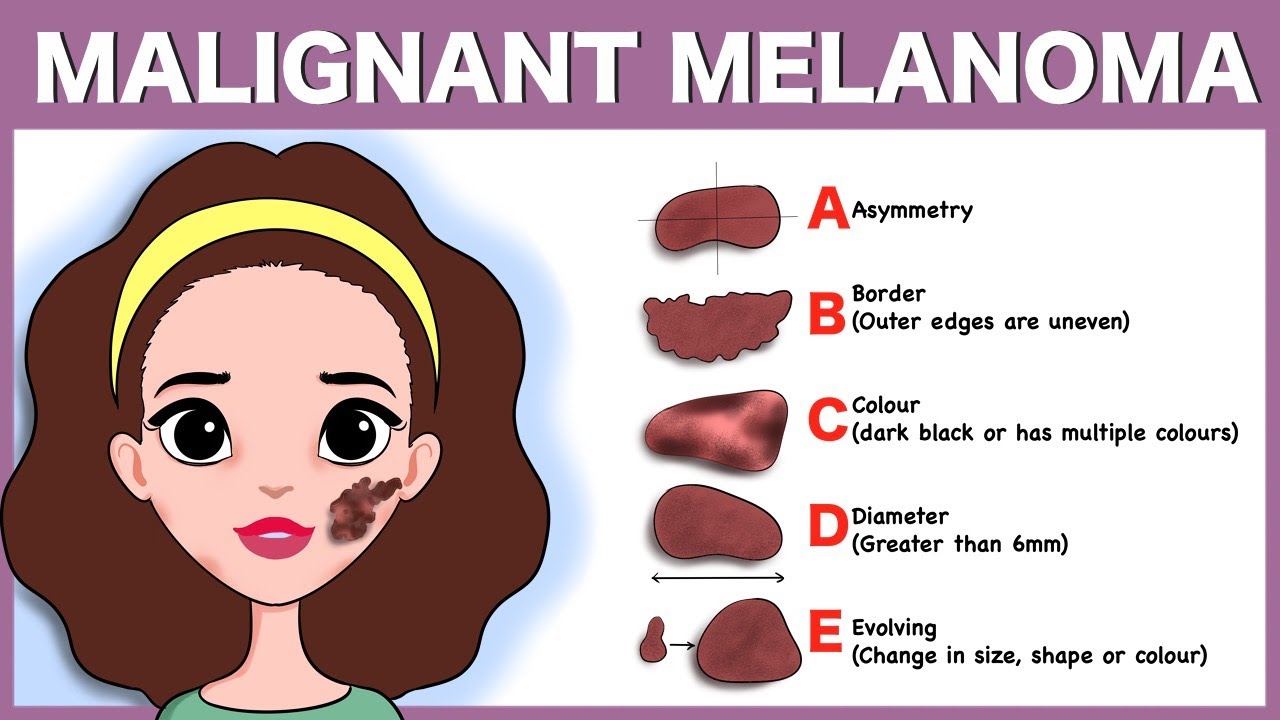
На прошлой неделе у меня там чесался, и когда я пошел чесать, я заметил, что он приподнялся, я присмотрелся и сразу почувствовал страх…это 2-3 разных оттенка коричневого, от светлого до темного. У него также была небольшая струпья / чешуйчатая область, но ее больше нет. Это не симметрично, но я не думаю, что это когда-либо было с самого начала? Я действительно не знаю
Обеспокоенный, что записался на прием к своему терапевту. Я видел ее вчера, и она обратилась с тревогой в клинику для родинок в больнице (чтобы ее осмотрели в течение 10 дней, — сказала она). В любом случае, теперь мне стало еще хуже! Я думаю, что часть меня надеялась, что я увижу терапевта, и она скажет мне, что это ничего, но я знаю, что она не может этого сделать, и это глупо с моей стороны.
Я сама медсестра скорой помощи, я провожу свои дни, успокаивая людей и говорю им, чтобы они не волновались и делали вещи шаг за шагом, но логическое обоснование улетучивается, когда это вы, не так ли?
Итак, теперь я паникую, паникую, потому что не знаю, сколько времени это было, паникую, что я оставил это слишком поздно, паникую, что мне 30, с четырьмя маленькими детьми, и в основном мой разум перегружен Несколько лет назад моему отцу удалили раковую опухоль со лба, так что это не помогает.
Мой вопрос: была ли у кого-нибудь родинка, соответствующая всем критериям меланомы, но все в порядке? Я знаю, что забегаю вперед, и здесь есть люди, которые сталкиваются с гораздо более серьезными проблемами, но я так напуган, что даже не могу думать прямо. Мой мозг только что перешел к худшему сценарию.
извините, это так долго, и спасибо, если вы нашли время прочитать xxx
Меланома, стадия 1a | Рак чат
Привет, Джейми,
Спасибо Sunscared за ваше упоминание о моей помощи с информацией о меланоме.Sunscared верен примерно у 95% пациентов со стадией 1, никогда больше не имеющих проблем с меланомой. К сожалению, эти форумы обычно заполняются пациентами, у которых в настоящее время есть проблемы, в то время как те, кто избавился от болезни в течение нескольких лет, не возвращаются, чтобы поделиться своими историями, что понятно, потому что они продолжают жить своей жизнью.
Sunscared также объяснил, почему они не показывают статистику выживания после 10-летней отметки. Учтите это — пациенты на стадиях 1 и 2 наблюдаются в течение 1-3 лет перед выпиской, на стадии 3 в течение 5 лет (раньше было 10 лет) и на стадии 4 на неопределенный срок, поскольку на стадии 4 не принято дожить более 10 лет ( хотя с новым лекарственным средством для лечения меланомы я знаю немало тех, кто все еще свободен от болезни до 15 лет спустя и продолжает подсчет)! Таким образом, трудно изучить, сколько пациентов на стадии 1 выжили после 10-летней отметки — единственный способ — посмотреть, достигли ли они стадии 3 или 4 за это время, и затем подсчет начинается снова с этого прогрессирования. Дата.Таким образом, в моем случае я прожил 13 лет на стадии 1, прежде чем перешел в стадию 3, и я прожил 11 лет (и все еще не болен) с момента постановки диагноза стадии 3 — так что я прожил уже 24 года. Я был среди 5% неудачливых пациентов, которые перешли на стадию 1, и я знаю нескольких других пациентов в таком же положении. Тем не менее, я знаю только двух пациентов со стадией 1, которые все еще свободны от болезни между 14 и 25 годами спустя — и это только потому, что они все еще предпочитают посещать форумы и помогать новым диагностированным, как и вы, знайте, что все еще есть очень и очень хороший шанс, что вы доживете до глубокой старости!
Учтите это — пациенты на стадиях 1 и 2 наблюдаются в течение 1-3 лет перед выпиской, на стадии 3 в течение 5 лет (раньше было 10 лет) и на стадии 4 на неопределенный срок, поскольку на стадии 4 не принято дожить более 10 лет ( хотя с новым лекарственным средством для лечения меланомы я знаю немало тех, кто все еще свободен от болезни до 15 лет спустя и продолжает подсчет)! Таким образом, трудно изучить, сколько пациентов на стадии 1 выжили после 10-летней отметки — единственный способ — посмотреть, достигли ли они стадии 3 или 4 за это время, и затем подсчет начинается снова с этого прогрессирования. Дата.Таким образом, в моем случае я прожил 13 лет на стадии 1, прежде чем перешел в стадию 3, и я прожил 11 лет (и все еще не болен) с момента постановки диагноза стадии 3 — так что я прожил уже 24 года. Я был среди 5% неудачливых пациентов, которые перешли на стадию 1, и я знаю нескольких других пациентов в таком же положении. Тем не менее, я знаю только двух пациентов со стадией 1, которые все еще свободны от болезни между 14 и 25 годами спустя — и это только потому, что они все еще предпочитают посещать форумы и помогать новым диагностированным, как и вы, знайте, что все еще есть очень и очень хороший шанс, что вы доживете до глубокой старости!
Так что не зацикливайтесь на 10-летнем отсечении статистики.Ваши шансы увидеть своих внуков составляют 95%, и, если, к сожалению, меланома вернется и начнет прогрессировать, все еще есть хороший шанс, что вы все еще увидите своих внуков, потому что медикаментозное лечение пациентов на поздней стадии показывает отличные результаты.
Если вам действительно трудно справиться со своим диагнозом, обратитесь в местный центр Macmillan или Maggies, где вам проконсультируют. Я знаю многих пациентов, которым это очень помогло. Между тем, я отправлю вам запрос на добавление в друзья, и, если вы его примете, мы сможем поговорить в личном сообщении, если вы когда-нибудь почувствуете в этом необходимость.Береги себя, все будет в порядке,
Энджи
Меланома: вопросы, которые следует задать группе здравоохранения
НА ЭТОЙ СТРАНИЦЕ: Вы найдете несколько вопросов, которые можно задать своему врачу или другим членам медицинской группы, чтобы помочь вам лучше понять свой диагноз, план лечения и общий уход. Используйте меню для просмотра других страниц.
Часто разговаривать с медперсоналом важно для принятия информированных решений о вашем медицинском обслуживании. Эти предлагаемые вопросы являются отправной точкой, чтобы помочь вам узнать больше о лечении и лечении рака.Вам также предлагается задать дополнительные вопросы, которые важны для вас. Вы можете распечатать этот список и принести его на следующий прием или загрузить бесплатное мобильное приложение Cancer.Net для цифрового списка и других интерактивных инструментов для управления вашим лечением. Также может быть полезно попросить члена семьи или друга пойти с вами на прием, чтобы помочь делать заметки.
Вопросы, которые следует задать после диагностики
-
Какой у меня тип или подтип меланомы?
-
Вы можете объяснить мне мой отчет о патологии?
-
На какой стадии меланома? Что это значит?
-
Какова глубина меланомы в миллиметрах?
-
Есть ли язвы на меланоме?
-
Обладает ли меланома митотической активностью?
-
Вероятно ли, что меланома распространилась? Почему или почему нет?
Вопросы по выбору лечения и устранению побочных эффектов
-
Какие у меня варианты лечения?
-
Какие клинические испытания доступны для меня? Где они расположены и как узнать о них больше?
-
Какой план лечения вы порекомендуете? Почему?
-
Какова цель каждого лечения? Чтобы избавиться от рака, помочь мне почувствовать себя лучше или и то, и другое?
-
Каковы возможные побочные эффекты каждого варианта лечения как в краткосрочной, так и в долгосрочной перспективе? Что мы можем сделать, чтобы их предотвратить?
-
Кто будет частью моей медицинской бригады и чем будет заниматься каждый из них?
-
Кто будет руководить моим общим лечением?
-
Как каждое лечение повлияет на мою повседневную жизнь? Смогу ли я работать, заниматься спортом и заниматься своими обычными делами?
-
Может ли это лечение повлиять на мою сексуальную жизнь? Если да, то как и как долго?
-
Может ли это лечение повлиять на мою способность забеременеть или иметь детей? Если да, следует ли мне поговорить со специалистом по фертильности до начала лечения рака?
-
Если меня беспокоят расходы на лечение рака, кто мне может помочь?
-
Какие услуги поддержки мне доступны? Моей семье?
-
Кому мне позвонить, если у меня возникнут вопросы или проблемы?
Вопросы об операции
-
Какой вид операции вы рекомендуете?
-
Следует ли мне сделать биопсию сторожевого лимфатического узла, чтобы выяснить, не распространился ли он на лимфатические узлы?
-
Удастся ли хирургическим путем удалить весь рак? Мне понадобится дополнительная операция?
-
Сколько времени займет операция?
-
Как долго я буду в больнице?
-
Нужен ли мне кожный трансплантат после хирургического удаления меланомы?
-
Вы можете описать, каким будет мое выздоровление после операции?
-
К кому мне следует обращаться по поводу любых побочных эффектов, которые у меня возникают? И как скоро?
-
Каковы возможные отдаленные последствия этой операции?
-
Потребуется ли мне дополнительное лечение после операции?
Вопросы об адъювантном или системном лечении
-
Какой вид лечения рекомендуется?
-
Имеется ли в моей меланоме генетическая мутация BRAF или другая известная мутация? Возможна ли таргетная терапия или иммунотерапия?
-
Какова цель этого лечения?
-
Сколько времени займет это лечение?
-
Получу ли я это лечение в больнице или клинике? Или возьму дома?
-
Какие побочные эффекты можно ожидать во время лечения?
-
К кому мне следует обращаться по поводу любых побочных эффектов, которые у меня возникают? И как скоро?
-
Каковы возможные отдаленные последствия этого лечения?
-
Что можно сделать, чтобы предотвратить или контролировать эти побочные эффекты?
Вопросы о меланоме III стадии
-
Сколько лимфатических узлов поражено меланомой?
-
Будут ли удалены остальные лимфатические узлы? Если да, каковы возможные осложнения операции на лимфатических узлах?
-
Меланома вышла из лимфатического узла? Это называется экстранодальным распространением меланомы.Что это означает для моего лечения?
-
Рекомендуется ли лучевая терапия или другое лечение после операции?
-
Каковы цели каждого лечения? Каков мой прогноз?
Вопросы о меланоме IV стадии
-
Где распространилась меланома? Мне нужно сканирование мозга или ПЭТ-КТ, чтобы определить, где он распространился?
-
Возможно ли хирургическое удаление метастазов, особенно при наличии 1 или 2 опухолей? Если да, то каковы преимущества и риски?
-
Каковы цели каждого лечения? Каков мой прогноз?
-
Как можно предотвратить побочные эффекты и симптомы, чтобы уменьшить мой дискомфорт и повысить качество жизни?
Вопросы о планировании последующего лечения
-
Каков шанс, что рак вернется? Следует ли мне следить за конкретными признаками или симптомами?
-
Какие шаги я могу предпринять, чтобы снизить риск развития новой меланомы или другого типа рака кожи?
-
Какие долгосрочные или поздние побочные эффекты возможны в зависимости от полученного мной лечения рака?
-
Какие дополнительные тесты мне понадобятся и как часто они будут нужны?
-
Как мне получить краткое изложение лечения и план ухода за выжившими для хранения в моем личном деле?
-
Кто будет руководить моим последующим наблюдением?
-
Какие услуги поддержки по случаю потери кормильца мне доступны? Моей семье?
-
Подвержены ли члены моей семьи более высокому риску развития меланомы?
Следующий раздел в этом руководстве — Дополнительные ресурсы .Он предлагает еще несколько ресурсов на этом веб-сайте, которые могут быть вам полезны. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Вопросы и ответы
Лечение меланомы (PDQ®) — версия для профессионального здравоохранения. Национальный институт рака. Доступно по адресу https://www.cancer.gov/types/skin/hp/melanoma-treatment-pdq#link/_25_toc. 11 апреля 2019 г .; Доступ: 31 января 2020 г.
Эггермонт AM, Suciu S, Santinami M, Testori A, Kruit WH, Marsden J, et al.Адъювантная терапия пегилированным интерфероном альфа-2b по сравнению с только наблюдением при резецированной меланоме III стадии: окончательные результаты рандомизированного исследования III фазы EORTC 18991. Ланцет . 2008, 12 июля. 372 (9633): 117-26. [Медлайн].
Роберт С., Рибас А., Вулчок Дж. Д., Ходи Ф. С., Хамид О., Кеффорд Р. и др. Лечение пембролизумабом против рецептора запрограммированной смерти-1 при распространенной меланоме, резистентной к ипилимумабу: рандомизированная группа сравнения доз в исследовании фазы 1. Ланцет .2014 14 июля. [Medline].
Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B, et al. Сравнение ниволумаба и химиотерапии у пациентов с меланомой на поздней стадии, у которых развилось прогрессирование после лечения анти-CTLA-4 (CheckMate 037): рандомизированное контролируемое открытое исследование фазы 3. Ланцет Онкол . 2015 16 апреля (4): 375-84. [Медлайн].
Carvajal RD, Antonescu CR, Wolchok JD, et al. KIT как терапевтическая мишень при метастатической меланоме. ДЖАМА . 2011 г. 8 июня. 305 (22): 2327-34. [Медлайн]. [Полный текст].
Далвин Л.А., Даменто Дж. М., Зев Б. П., Эбботт Б. А., Ходж Д. О., Пулидо Дж. С.. Болезнь Паркинсона и меланома: подтверждение и пересмотр ассоциации. Mayo Clin Proc . 2017 июл.92 (7): 1070-1079. [Медлайн]. [Полный текст].
Малкахи Н. Меланома, болезнь Паркинсона: видеть одного, осознавать другого. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/883195.19 июля 2017 г .; Доступ: 6 февраля 2019 г.
Американское онкологическое общество. Онкологические факты и цифры, 2020. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/annual-cancer-facts-and-figures/2020/cancer-facts-and-figures- 2020.pdf. Доступ: 31 января 2020 г.
Статистика рака: меланома кожи. Национальный институт рака. Доступно по адресу https://seer.cancer.gov/statfacts/html/melan.html. Доступ: 31 января 2020 г.
Shaikh WR, Xiong M, Weinstock MA. Вклад узлового подтипа в смертность от меланомы в США, 1978–2007 гг. Arch Dermatol . 2012 Январь 148 (1): 30-6. [Медлайн].
Mocellin S, Pasquali S, Riccardo Rossi C, Nitti D. Подтверждение прогностической ценности соотношения лимфатических узлов у пациентов с кожной меланомой: популяционное исследование 8 177 случаев. Хирургия .2011 Июль 150 (1): 83-90. [Медлайн].
Показатели выживаемости при меланомном раке кожи по стадиям. Американское онкологическое общество. Доступно по адресу https://www.cancer.org/cancer/melanoma-skin-cancer/detection-diagnosis-staging/survival-rates-for-melanoma-skin-cancer-by-stage.html. 1 февраля 2019 г .; Доступ: 6 февраля 2019 г.
Брюэр Дж. Д., Кристенсон Л. Дж., Уивер А. Л. и др. Злокачественная меланома у реципиентов солидных трансплантатов: сбор данных о случаях в базе данных и сравнение с данными эпиднадзора, эпидемиологии и конечных результатов для анализа исходов. Дерматол Арки . 2011 Июль 147 (7): 790-6. [Медлайн].
Jethanamest D, Vila PM, Sikora AG, Morris LG. Предикторы выживаемости при меланоме слизистой оболочки головы и шеи. Энн Сург Онкол . 2011 Октябрь 18 (10): 2748-56. [Медлайн]. [Полный текст].
Sandru A, Voinea S, Panaitescu E, Blidaru A. Показатели выживаемости пациентов с метастатической злокачественной меланомой. Дж. Мед Жизнь . 2014 окт-дек. 7 (4): 572-6. [Медлайн]. [Полный текст].
Kantor J, Kantor DE. Регулярное обследование кожи всего тела под руководством дерматолога и раннее выявление меланомы. Дерматол Арки . 2009 август 145 (8): 873-6. [Медлайн].
Сабель М.С., Вонг С.Л. Обзор доказательной поддержки визуализации меланомы перед лечением. J Natl Compr Canc Netw . 2009 7 (3): 281-9. [Медлайн].
Xing Y, Bronstein Y, Ross MI, Askew RL, Lee JE, Gershenwald JE, et al.Современные методы диагностической визуализации для определения стадии и наблюдения за пациентами с меланомой: метаанализ. Национальный институт рака . 2011 19 января. 103 (2): 129-42. [Медлайн]. [Полный текст].
Бронштейн Y, Ng CS, Rohren E, Ross MI, Lee JE, Cormier J, et al. ПЭТ / КТ в ведении пациентов с метастатической меланомой стадии IIIC и IV, рассматриваемых в качестве кандидатов на операцию: оценка дополнительной ценности после традиционной визуализации. AJR Am J Roentgenol .2012 Апрель 198 (4): 902-8. [Медлайн].
Гротц Т.Э., Маркович С.Н., Эриксон Л.А. и др. Консенсусные рекомендации Mayo Clinic по глубине иссечения при первичной кожной меланоме. Mayo Clin Proc . 2011 июн. 86 (6): 522-8. [Медлайн]. [Полный текст].
[Рекомендации] Национальная комплексная онкологическая сеть. Руководство NCCN по клинической практике в онкологии: меланома. NCCN. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/melanoma.pdf. Версия 1.2020 — 19 декабря 2019 г .; Доступ: 31 января 2020 г.
Gillgren P, Drzewiecki KT, Niin M, et al. Размер поля хирургического иссечения 2 см по сравнению с 4 см при первичной меланоме кожи толщиной более 2 мм: рандомизированное многоцентровое исследование. Ланцет . 2011, 5 ноября. 378 (9803): 1635-42. [Медлайн].
Bachter D, Michl C, Buchels H, Vogt H, Balda BR. Прогностическая ценность сторожевого лимфатического узла при злокачественных меланомах. Последние результаты Cancer Res .2001. 158: 129-36. [Медлайн].
Кадили А., Маккиннон Г., Райт Ф., Ханна В., Макинтош Е., Абхари З. и др. Валидация системы баллов для прогнозирования метастазов в недозорные лимфатические узлы при меланоме. J Surg Oncol . 2010 г. 1. 101 (3): 191-4. [Медлайн].
Американский объединенный комитет по раку. Меланома кожи. Amin MB, Edge S, Greene F, Byrd DR, Brookland RK и др., Под ред. Руководство по организации стадий AJCC . 8-е издание. Нью-Йорк: Спрингер; 2016 г.
McWilliams RR, Rao RD, Buckner JC, Link MJ, Markovic S, Brown PD. Метастазы в мозг, вызванные меланомой. Expert Rev Anticancer Ther . 2008 май. 8 (5): 743-55. [Медлайн].
[Рекомендации] Вонг С.Л., Фарис М.Б., Кеннеди Э.Б., Агарвала С.С., Ахурст Т.Дж., Ариян С.и др. Биопсия сторожевого лимфатического узла и лечение региональных лимфатических узлов при меланоме: Обновление клинических рекомендаций Американского общества клинической онкологии и Общества хирургической онкологии. Энн Сург Онкол . 2018 25 февраля (2): 356-377. [Медлайн].
Фариес М.Б., Томпсон Дж. Ф., Кокран А. Дж., Андтбака Р. Х., Моззилло Н. и др. Завершающее рассечение или наблюдение метастазов в сторожевые узлы при меланоме. N Engl J Med . 2017 июн 8. 376 (23): 2211-2222. [Медлайн].
Mulcahy N. Практическое исследование хирургии меланомы. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/881465. 12 июня 2017 г .; Доступ: 14 июня 2017 г.
Leiter U, Stadler R, Mauch C, et al. Выживаемость SLNB-положительных пациентов с меланомой с и без полной лимфодиссекции: многоцентровое рандомизированное исследование DECOG. Журнал клинической онкологии . 2015. 33 (доп.): Реферат LBA9002. [Полный текст].
Gould Rothberg BE, Berger AJ, Molinaro AM, Subtil A, Krauthammer MO, Camp RL, et al. Прогностическая модель меланомы с использованием тканевых микрочипов и генетических алгоритмов. Дж. Клин Онкол .2009 г. 1. 27 (34): 5772-80. [Медлайн]. [Полный текст].
Long GV, Хаушильд А., Сантинами М., Аткинсон В., Мандала М., Кьярион-Силени В. и др. Адъювант дабрафениб плюс траметиниб при меланоме с мутацией BRAF стадии III. N Engl J Med . 2017 9 ноября. 377 (19): 1813-1823. [Медлайн]. [Полный текст].
Хаушильд А., Даммер Р., Сантинами М. и др. Долгосрочная польза адъюванта дабрафениб + траметиниб (D + T) у пациентов (пациентов) с резецированной стадией III мутантной меланомы BRAF V600: пятилетний анализ COMBI-AD. Дж. Клин Онкол . 2020. 38:15 Suppl: [Полный текст].
Eggermont AMM, Blank CU, Mandala M, Long GV, Atkinson V, Dalle S, et al. Адъювант пембролизумаб по сравнению с плацебо при резекции меланомы III стадии. N Engl J Med . 2018 10 мая. 378 (19): 1789-1801. [Медлайн]. [Полный текст].
Eggermont AM, Blank CU, Mandalà M, et al. Сравнение пембролизумаба и плацебо после полной резекции меланомы III стадии высокого риска: новые результаты безрецидивной выживаемости в двойном слепом исследовании III фазы EORTC 1325-MG / Keynote 054 при медиане наблюдения в течение трех лет. Дж. Клин Онкол . 2020. 38:15 Suppl: [Полный текст].
Weber J, et al; CheckMate 238 соавторов. Адъювант ниволумаб по сравнению с ипилимумабом при резекции меланомы III или IV стадии. N Engl J Med . 2017 9 ноября. 377 (19): 1824-1835. [Медлайн].
Eggermont AM, Chiarion-Sileni V, Grob JJ, et al. Длительное выживание при меланоме III стадии при адъювантной терапии ипилимумабом. N Engl J Med . 2016 10 ноября. 375 (19): 1845-1855.[Медлайн]. [Полный текст].
Nelson, R. FDA одобрило Imlygic, первую онколитическую вирусную терапию в США. Медицинские новости Медскапа . 27 октября 2015 г. Доступно по адресу http://www.medscape.com/viewarticle/853345.
Andtbacka RH, Kaufman HL, Collichio F, Amatruda T, Senzer N, Chesney J, et al. Talimogen Laherparepvec повышает частоту стойкого ответа у пациентов с запущенной меланомой. Дж. Клин Онкол . 2015 г. 1. 33 (25): 2780-8.[Медлайн].
Dummer R, Hoeller C, Gruter IP, Michielin O. Сочетание талимогена лахерпарепвека с иммунотерапией при меланоме и других солидных опухолях. Cancer Immunol Immunother . 2017 июн.66 (6): 683-695. [Медлайн]. [Полный текст].
Кирквуд JM, Strawderman MH, Ernstoff MS, Smith TJ, Borden EC, Blum RH. Адъювантная терапия интерфероном альфа-2b резецированной меланомы кожи высокого риска: исследование Восточной совместной онкологической группы EST 1684. Дж. Клин Онкол . 1996 14 января (1): 7-17. [Медлайн].
Кирквуд Дж. М., Манола Дж., Ибрагим Дж., Сондак В., Эрнстофф М. С., Рао Ю. Восточная кооперативная онкологическая группа. Объединенный анализ Восточной совместной онкологической группы и межгрупповых исследований адъювантного альфа-интерферона в высоких дозах для лечения меланомы. Clin Cancer Res . 2004. 10: 1670-77.
Pectasides D, Dafni U, Bafaloukos D, Skarlos D, Polyzos A, Tsoutsos D, et al. Рандомизированное исследование III фазы: 1 месяц по сравнению с 1 годом адъювантного лечения высокими дозами интерферона альфа-2b у пациентов с резецированной меланомой высокого риска. Дж. Клин Онкол . 2009 20 февраля. 27 (6): 939-44. [Медлайн].
Хаушильд А., Вейхенталь М., Расс К., Линсе Р., Ульрих Дж., Штадлер Р. и др. Проспективное рандомизированное многоцентровое адъювантное совместное дерматологическое исследование онкологической группы низких доз интерферона альфа-2b с модифицированной фазой индукции высоких доз интерферона альфа-2b или без нее у пациентов с меланомой без лимфоузлов. Дж. Клин Онкол . 20 июля 2009 г. 27 (21): 3496-502. [Медлайн].
Hauschild A, Weichenthal M, Rass K, Linse R, Berking C, Böttjer J, et al.Эффективность низких доз интерферона (альфа) 2a 18 по сравнению с 60 месяцами лечения у пациентов с первичной меланомой с толщиной опухоли> = 1,5 мм: результаты рандомизированного исследования III фазы DeCOG. Дж. Клин Онкол . 2010 10 февраля. 28 (5): 841-6. [Медлайн].
Эггермонт AM, Suciu S, Testori A, et al. Изъязвление и стадия являются предикторами эффективности интерферона при меланоме: результаты испытаний адъювантов фазы III EORTC 18952 и EORTC 18991. Eur J Cancer .2012 января. 48 (2): 218-25. [Медлайн].
Spitler LE, Grossbard ML, Ernstoff MS, Silver G, Jacobs M, Hayes FA и др. Адъювантная терапия злокачественной меланомы III и IV стадии с использованием гранулоцитарно-макрофагального колониестимулирующего фактора. Дж. Клин Онкол . 2000 апр. 18 (8): 1614-21. [Медлайн].
Лоусон Д.Х., Ли С., Чжао Ф., Тархини А.А., Марголин К.А., Эрнстофф М.С. и др. Рандомизированное плацебо-контролируемое исследование фазы III дрожжевого гранулоцитарно-макрофагального колониестимулирующего фактора (GM-CSF) по сравнению с вакцинацией пептидом по сравнению с вакцинацией GM-CSF плюс пептид по сравнению с плацебо у пациентов без признаков заболевания после полной хирургической резекции локально Меланома продвинутой стадии и / или стадии IV: исследование Восточной совместной онкологической группы Американского колледжа радиологической сети по исследованию рака (E4697). Дж. Клин Онкол . 2015 г. 1. 33 (34): 4066-76. [Медлайн].
Фехер Л.А., Флаэрти КТ. Где мы находимся с адъювантной терапией меланомы III и IV стадии в 2009 году ?. J Natl Compr Canc Netw . 2009 7 (3): 295-304. [Медлайн].
Линза МБ, Рейман Т, Хусейн А.Ф. Использование тамоксифена при лечении злокачественной меланомы. Рак . 1 октября 2003 г. 98 (7): 1355-61. [Медлайн].
Миддлтон М.Р., Гроб Дж. Дж., Ааронсон Н., Фирлбек Г., Тильген В., Зайтер С. и др.Рандомизированное исследование III фазы темозоломида по сравнению с дакарбазином в лечении пациентов с метастатической злокачественной меланомой на поздней стадии. Дж. Клин Онкол . 2000 января 18 (1): 158-66. [Медлайн].
Аткинс М.Б., Лотце М.Т., Датчер Дж. П., Фишер Р. И., Вайс Г., Марголин К. и др. Терапия высокими дозами рекомбинантного интерлейкина 2 для пациентов с метастатической меланомой: анализ 270 пациентов, пролеченных в период с 1985 по 1993 год. J Clin Oncol . 1999 июл.17 (7): 2105-16. [Медлайн].
Хаушильд А., Агарвала С.С., Трефзер У., Хогг Д., Роберт С., Херси П. и др. Результаты рандомизированного плацебо-контролируемого исследования фазы III сорафениба в комбинации с карбоплатином и паклитакселом в качестве терапии второй линии у пациентов с неоперабельной меланомой III или IV стадии. Дж. Клин Онкол . 2009, 10 июня. 27 (17): 2823-30. [Медлайн].
Perez DG, Suman VJ, Fitch TR, Amatruda T III, Morton RF, Jilani SZ, et al. Испытание фазы II карбоплатина, еженедельного приема паклитаксела и еженедельного приема бевацизумаба у пациентов с неоперабельной меланомой IV стадии: исследование North Central Cancer Treatment Group, N047A. Рак . Январь 2009. 115 (1): 119-27.
Flaherty KT, Puzanov I, Kim KB, Ribas A, McArthur GA, Sosman JA, et al. Ингибирование мутировавшего активированного BRAF при метастатической меланоме. N Engl J Med . 2010 26 августа. 363 (9): 809-19. [Медлайн].
Larkin J, Chiarion-Sileni V, Gonzalez R, Grob JJ, Cowey CL, Lao CD, et al. Комбинированный ниволумаб и ипилимумаб или монотерапия при нелеченой меланоме. N Engl J Med . 2015 г. 2 июля.373 (1): 23-34. [Медлайн]. [Полный текст].
Chustecka Z. Дабрафениб и траметиниб одобрены для лечения метастатической меланомы. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/804918. Доступ: 4 июня 2013 г.
Hauschild A, Grob JJ, Demidov LV, Jouary T., Gutzmer R, Millward M, et al. Дабрафениб при метастатической меланоме с мутацией BRAF: многоцентровое открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 2012 28 июля.380 (9839): 358-65. [Медлайн].
Chapman PB, Hauschild A, Robert C, et al. Повышение выживаемости с применением вемурафениба при меланоме с мутацией BRAF V600E. N Engl J Med . 2011, 30 июня. 364 (26): 2507-16. [Медлайн].
Hauschild A, Grob JJ, Demidov LV, Jouary T., Gutzmer R, Millward M, et al. Дабрафениб при метастатической меланоме с мутацией BRAF: многоцентровое открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 2012 28 июля.380 (9839): 358-65. [Медлайн].
Флаэрти К.Т., Роберт С., Херси П., Натан П., Гарбе С., Милхем М. и др. Повышение выживаемости за счет ингибирования MEK при меланоме с мутацией BRAF. N Engl J Med . 2012 Июль 12, 367 (2): 107-14. [Медлайн].
Флаэрти К.Т., Инфанте Дж. Р., Дауд А., Гонсалес Р., Кеффорд Р. Ф., Сосман Дж. И др. Комбинированное ингибирование BRAF и MEK при меланоме с мутациями BRAF V600. N Engl J Med . 2012 ноябрь 367 (18): 1694-703.[Медлайн]. [Полный текст].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA одобрило применение Мекинист в комбинации с Тафинларом для лечения меланомы на поздних стадиях. FDA. Доступно по адресу https://wayback.archive-it.org/7993/20170112222928/http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm381159.htm. Доступ: 15 января 2018 г.
Mulcahy N. FDA одобрило первую комбинированную терапию меланомы. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/818930.Доступ: 14 января 2014 г.
Ascierto PA, McArthur GA, Dréno B., Atkinson V, Liszkay G, Di Giacomo AM, et al. Кобиметиниб в сочетании с вемурафенибом при запущенной BRAF (V600) -мутантной меланоме (coBRIM): обновленные результаты эффективности в рандомизированном двойном слепом исследовании фазы 3. Ланцет Онкол . 2016 Сентябрь 17 (9): 1248-60. [Медлайн].
Даммер Р., Асьерто П.А., Гогас Х.Дж., Аранс А., Мандала М., Лишкай Г. и др. Сравнение энкорафениба и биниметиниба с вемурафенибом или энкорафенибом у пациентов с мутантной меланомой по BRAF (COLUMBUS): многоцентровое открытое рандомизированное исследование фазы 3. Ланцет Онкол . 2018 май. 19 (5): 603-615. [Медлайн].
Роберт С., Лонг Г.В., Брэди Б., Дютрио С., Майо М., Мортье Л. и др. Ниволумаб при ранее нелеченой меланоме без мутации BRAF. N Engl J Med . 2015 22 января. 372 (4): 320-30. [Медлайн]. [Полный текст].
Постов М.А., Чесни Дж., Павлик А.С., Роберт С., Гроссманн К., Макдермотт Д. и др. Сравнение ниволумаба и ипилимумаба с ипилимумабом при нелеченой меланоме. N Engl J Med .2015 21 мая. 372 (21): 2006-17. [Медлайн].
Johnson DB, Balko JM, Compton ML, Chalkias S, Gorham J, et al. Фульминантный миокардит с комбинированной иммунной блокадой контрольных точек. N Engl J Med . 2016 г. 3 ноября. 375 (18): 1749-1755. [Медлайн].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA одобрило Keytruda для лечения меланомы на поздних стадиях: первый препарат, блокирующий PD-1, получивший одобрение агентства [пресс-релиз]. 4 сентября 2014 г. Доступно по адресу https: // wayback.archive-it.org/7993/20170112023823/http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm412802.htm. Доступ: 15 января 2018 г.
Роберт С., Шехтер Дж., Лонг Г.В., Аранс А., Гроб Дж. Дж., Мортье Л. и др. Пембролизумаб против ипилимумаба при запущенной меланоме. N Engl J Med . 2015, 25 июня. 372 (26): 2521-32. [Медлайн].
Сарнаик А.А., Вебер Дж. С.. Последние достижения в использовании анти-CTLA-4 для лечения меланомы. Рак J .2009 май-июнь. 15 (3): 169-73. [Медлайн].
Hodi FS, O’Day SJ, et al. Повышение выживаемости при применении ипилимумаба у пациентов с метастатической меланомой. N Engl J Med . 19 августа 2010 г. 363 (8): 711-23. [Медлайн].
Ервой (ипилимумаб) [вкладыш в упаковке]. Принстон, Нью-Джерси: Компания Bristol-Myers Squibb. 2017 июль. Доступно в [Полный текст].
Роберт С., Томас Л., Бондаренко И. и др. Ипилимумаб плюс дакарбазин при ранее нелеченой метастатической меланоме. N Engl J Med . 2011, 30 июня. 364 (26): 2517-26. [Медлайн].
Weber JS, Dummer R, de Pril V, Lebbe C, Stephen Hodi F. Модели начала и разрешения иммунных побочных эффектов, представляющих особый интерес, с использованием ипилимумаба: подробный анализ безопасности из исследования фазы 3 у пациентов с запущенной меланомой. Рак . 2013 г. 7 февраля [Medline].
Эггермонт AM, Кьярион-Силени V, Grob JJ, Dummer R, Wolchok JD, Schmidt H, et al.Сравнение адъювантного ипилимумаба с плацебо после полной резекции меланомы III стадии высокого риска (EORTC 18071): рандомизированное двойное слепое исследование фазы 3. Ланцет Онкол . 2015 май. 16 (5): 522-30. [Медлайн].
Испания Л., Ларкин Дж. Комбинированная блокада иммунных контрольных точек с ипилимумабом и ниволумабом при лечении прогрессирующей меланомы. Экспертное мнение Biol Ther . 2016 1. 1-8. [Медлайн].
Mulcahy N. Иматиниб — еще один вариант лечения меланомы на поздней стадии. Медицинские новости Медскапа . 13 августа 2013 г. [Полный текст].
Hodi FS, Corless CL, Giobbie-Hurder A, et al. Иматиниб для меланом, содержащих мутационно активированный или усиленный KIT, возникающий на слизистой, акральной и хронически поврежденной солнцем коже. Дж. Клин Онкол . 2013 г. 8 июля [Medline]. [Полный текст].
Carvajal RD. Еще один вариант в нашем НАБОРЕ эффективных методов лечения меланомы на поздних стадиях. Дж. Клин Онкол . 2013 12 августа.[Медлайн]. [Полный текст].
Guo J, Si L, Kong Y, et al. Фаза II, открытое, индивидуальное исследование мезилата иматиниба у пациентов с метастатической меланомой, несущей мутацию или амплификацию c-Kit. Дж. Клин Онкол . 2011. 20 июля. 29 (21): 2904-9. [Медлайн].
Вакцины для индивидуального лечения меланомы показывают многообещающие перспективы. Национальный институт рака. Доступно по адресу https://www.cancer.gov/news-events/cancer-currents-blog/2017/melanoma-personalized-vaccine.4 августа 2017 г .; Доступ: 24 января 2018 г.
Хунчарек М., Купельник Б. Использование местного солнцезащитного крема и риск злокачественной меланомы. Результаты метаанализа 9 067 пациентов. Энн Эпидемиол . 2000 г., 1. 10 (7): 467. [Медлайн].
Autier P, Boniol M, Dore JF. Использование солнцезащитного крема и увеличение продолжительности преднамеренного пребывания на солнце: по-прежнему острая проблема. Инт Дж. Рак . 2007 г. 1. 121 (1): 1-5. [Медлайн].
Клинг Дж.Исследование призывает к вопросу солнцезащитный крем в профилактике меланомы. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/871438?src=soc_fb_161108-pm_mscpedt_news_pharm. 4 ноября 2016 г .; Дата обращения: 9 ноября 2016 г.
Целевая группа превентивных служб США, Биббинс-Доминго К., Гроссман, округ Колумбия, Карри С.Дж., Дэвидсон К.В., Эбелл М. и др. Скрининг рака кожи: Рекомендация рабочей группы США по профилактическим службам. ДЖАМА . 2016 26 июля. 316 (4): 429-35.[Медлайн]. [Полный текст].
Американская академия дерматологии. Бесплатные скрининги на рак кожи: программа скрининга на рак кожи SPOT me®. Доступно на https://www.aad.org/public/public-health/skin-cancer-screenings. Доступ: 2 марта 2020 г.
[Рекомендации] Бичакчян С.К., Халперн А.С., Джонсон TM, Фут Худ А., Гричник Дж. М., Светтер С. М. и др. Рекомендации по лечению первичной меланомы кожи. Американская академия дерматологии. J Am Acad Dermatol .2011 ноябрь 65 (5): 1032-47. [Медлайн]. [Полный текст].
[Рекомендации] Swetter SM, Tsao H, Bichakjian CK, Curiel-Lewandrowski C, Elder DE, Gershenwald JE, et al. Рекомендации по лечению первичной меланомы кожи. J Am Acad Dermatol . 2019 января 80 (1): 208-250. [Медлайн]. [Полный текст].
[Рекомендации] Даммер Р., Хаушильд А., Линденблатт Н., Пентерудакис Г., Кейлхольц Ю., Комитет по руководствам ESMO. Кожная меланома: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2015 26 сентября Дополнение 5: v126-32. [Медлайн]. [Полный текст].
[Рекомендации] Garbe C, et al; Европейский дерматологический форум (EDF), Европейская ассоциация дермато-онкологии (EADO) и Европейская организация по исследованию и лечению рака (EORTC). Европейское согласованное междисциплинарное руководство по меланоме. Часть 1: Диагностика — Обновление 2019. Eur J Cancer . 2020 9 января. [Medline]. [Полный текст].
[Рекомендации] Мичелин О., ван Аккоой А., Лориган П. и др.Консенсусные рекомендации конференции ESMO по ведению локорегиональной меланомы: Комитет по рекомендациям ESMO. Энн Онкол . 2020 22 июля. [Medline]. [Полный текст].
Киркланд Е.Б., Зителли Дж.А. Скорость митоза для тонких меланом: должна ли единичная митотическая фигура служить основанием для биопсии сторожевого лимфатического узла? Dermatol Surg . 2014 Сентябрь 40 (9): 937-45. [Медлайн].
McClain SE, Shada AL, Barry M, Patterson JW, Slingluff CL Jr.Исход биопсии сторожевого лимфатического узла и прогностические последствия регресса тонкой злокачественной меланомы. Melanoma Res . 2012 22 августа (4): 302-9. [Медлайн].
Kunishige JH, Brodland DG, Zitelli JA. Хирургические поля при меланоме in situ. J Am Acad Dermatol . 2012 Март 66 (3): 438-44. [Медлайн].
Специальная целевая группа, Коннолли С.М., Бейкер Д.Р., Колдирон Б.М. и др. Критерии надлежащего использования AAD / ACMS / ASDSA / ASMS 2012 для микрографической хирургии Мооса: отчет Американской академии дерматологии, Американского колледжа хирургии Мооса, Американского общества дерматологической хирургической ассоциации и Американского общества хирургии Мооса. J Am Acad Dermatol . 2012 Октябрь 67 (4): 531-50. [Медлайн].
[Рекомендации] Garbe C, et al; Европейский дерматологический форум (EDF), Европейская ассоциация дермато-онкологии (EADO) и Европейская организация по исследованию и лечению рака (EORTC). Европейское согласованное междисциплинарное руководство по меланоме. Часть 2: Лечение — Обновление 2019. Eur J Cancer . 19 декабря 2019 г. [Medline]. [Полный текст].
Хэнкок Б.В., Уитли К., Харрис С., Айвз Н., Харрисон Г., Хорсман Дж. М. и др.Адъювантный интерферон при меланоме высокого риска: рандомизированное исследование AIM HIGH Study — Координационный комитет Соединенного Королевства по исследованиям рака адъювантного низкодозного интерферона Альфа-2а длительного действия при резекции злокачественной меланомы высокого риска. Дж. Клин Онкол . 2004 г., 1. 22 (1): 53-61. [Медлайн].
Murali R, Desilva C, Thompson JF, Scolyer RA. Факторы, предсказывающие рецидив и выживаемость у пациентов с меланомой с положительными лимфоузлами. Энн Сург .2011 Июнь 253 (6): 1155-64. [Медлайн].
Maio M, Mackiewicz A, Testori A, Trefzer U, Ferraresi V, Jassem J, et al. Большое рандомизированное исследование тимозина альфа 1, интерферона альфа или обоих в комбинации с дакарбазином у пациентов с метастатической меланомой. Дж. Клин Онкол . 2010 г., 1. 28 (10): 1780-7. [Медлайн].
Флаэрти К.Т., Инфанте Дж. Р., Дауд А., Гонсалес Р., Кеффорд Р. Ф., Сосман Дж. И др. Комбинированное ингибирование BRAF и MEK при меланоме с мутациями BRAF V600. N Engl J Med . 2012 ноябрь 367 (18): 1694-703. [Медлайн]. [Полный текст].
Ларкин Дж., Кьярион-Силени В., Гонсалес Р. и др. Пятилетнее выживание с применением комбинации ниволумаба и ипилимумаба при запущенной меланоме. N Engl J Med . 2019 17 октября. 381 (16): 1535-1546. [Медлайн]. [Полный текст].
Уиллмор-Пейн С., Холден Дж. А., Трипп С., Лейфилд Л. Дж. Злокачественная меланома человека: обнаружение мутаций, активирующих BRAF и c-kit, с помощью анализа плавления ампликонов с высоким разрешением. Хум Патол . 2005. 36: 486–493.
Исторический обзор области переходного периода
Hematol Oncol Clin North Am. Авторская рукопись; доступно в PMC 2015 1 июня.
Опубликован в окончательной редакции как:
PMCID: PMC4040458
NIHMSID: NIHMS572192
Викрам К. Горантла
(1) Отделение гематологии / онкологии , Медицинский факультет Питтсбургского университета, Питтсбург, Пенсильвания
Джон М.Кирквуд
(1) Отделение гематологии / онкологии, Медицинский факультет, Школа медицины, Университет Питтсбурга, Питтсбург, PA
(2) Программа по лечению меланомы и рака кожи Института рака Питтсбургского университета, Питтсбург, Пенсильвания
(1) Отделение гематологии / онкологии, Медицинский факультет, Медицинский факультет Университета Питтсбурга, Питтсбург, Пенсильвания
(2) Программа по лечению меланомы и рака кожи Института рака Питтсбургского университета, Питтсбург, Пенсильвания
* Автор, ответственный за переписку: Джон М.Кирквуд, профессор медицины, дерматологии и трансляционных наук Ушера, Институт рака Университета Питтсбурга, 5115 Center Avenue, Suite 1.32, Pittsburgh PA 15232, телефон: 412-623-7707, факс: 412-623-7708, ude.cmpu@mjdoowkrikSee другие статьи в PMC, цитирующие опубликованную статью.
Abstract
За последние 30 лет произошла революция в области меланомы. Фундаментальные элементы хирургической, адъювантной медицинской и системной терапии заболевания были значительно изменены в сторону улучшения лечения и лучших результатов.Цель этой статьи — осмыслить прошлые усилия и исследования в области меланомы и текущую картину лечения меланомы. Мы также надеемся запечатлеть волнение, которое сейчас витает в поле зрения, и надежду на излечение. Цель лечения запущенной меланомы, которая когда-то считалась неизлечимой, изменилась с паллиативной на потенциально излечивающую. Надеемся, что результаты исследований в области иммунотерапии и мутаций драйверов в следующем десятилетии сделают эту цель реальностью.
Ключевые слова: Меланома, Прогноз, Биология, Иммунотерапия, Таргетная терапия, Неоадъювант, Адъювант, Ипилимумаб, BRAF, MEK
«Если я посмотрел немного дальше, то это стоит на плечах гигантов».
-Isaac Newton
Введение
В 2014 году в США у 76 100 пациентов разовьется новая первичная меланома, и 9710 человек умрут от этого заболевания. 1 В США меланома составляет менее 5% всех случаев рака кожи, но является основной причиной смертности от рака кожи. 2 Годовые темпы роста заболеваемости меланомой в настоящее время оцениваются в 3% по сравнению с 6% в период 70–80-х годов, но общая смертность остается относительно стабильной с 1990 года. 3 Во всем мире заболеваемость меланомой продолжает расти, несмотря на достижения При местной и системной терапии смертность продолжает расти: 80% смертей, связанных с раком кожи, приходится на меланому. 4 Прогресс в фундаментальной молекулярной биологии и иммунологии меланомы за последние 50 лет привел к улучшению результатов для пациентов с локализованным заболеванием, а также для пациентов с системным заболеванием.Распределение бремени болезни можно рассматривать как обратно пропорциональное возможности для улучшения исхода, при запущенном заболевании, которое будет менее частым со смертельным исходом, чем раннее операбельное заболевание, которое является форумом для адъювантных вмешательств, и раннее локализованное заболевание стадии, наиболее хорошо поддающиеся хирургическому лечению. 5 Результаты для пациентов с более глубокими первичными поражениями показывают иную картину. Пациенты с более глубокой локализацией AJCC стадии IIB – C имеют повышенный риск рецидива и смерти, в то время как микроскопическая региональная стадия IIIA заболевания, обнаруживаемая с помощью картирования дозорных лимфатических узлов и биопсии, имеет средний риск.Рецидивирующая узловая болезнь и объемная узловая болезнь IIIB – C имеют риск рецидива и смертности, приближающийся к 70% или более через 5 лет. 5 Лечение и исходы меланомы на поздних стадиях улучшились за последние двадцать лет благодаря быстрому прогрессу в области биологии опухолевых клеток, иммунологии и хирургических методов, радиохирургии, визуализации, которые, вероятно, еще больше преобразят эту область в области медицины. предстоящее десятилетие. Этот обзор будет отражать прогресс, достигнутый за последнее столетие, и познакомит читателя с текущим состоянием и лечением меланомы.
Меланома в древности
Описанный в древности как «смертельная черная опухоль», термин, производный от греческого (melas «темная» и «ома» опухоль), был придуман доктором Робертом Карсвеллом в 1838 году. опухоль »можно найти в сочинениях греческого врача Гиппократа в пятом веке до нашей эры, а у Руфа Эфесского — в первом веке нашей эры. 6 Хантеру приписывают первую резекцию меланомы в 1787 году. «Мягкое и черное» образование, удаленное из челюсти 35-летнего мужчины, было зарегистрировано как «злокачественное грибковое выделение». 7 Рене Лаэннек описал меланому как заболевание и ввел термин «меланоза» для описания опухоли в 1804 году. 8 Доктор Уильям Норрис отметил неоднородный внешний вид опухоли и ее склонность к метастазированию в 1820 году 9 и впервые отметил наследственный характер меланомы и семейной атипичной множественной меланомы. В дальнейших публикациях он заметил, что у большинства его пациентов была светлая кожа со светлым оттенком и бесполезность хирургического вмешательства и медикаментозного лечения в условиях отдаленных метастазов. 10 Томас Фоудингтон описал один из первых случаев увеальной меланомы и был в отчаянии из-за отсутствия знаний о методах лечения этого «коварного» процесса в 1820 году. 11 В 1844 году британский хирург Сэмюэл Купер 12 признал пользу раннее удаление опухоли и неизлечимый характер запущенного заболевания.
Патогенез
Меланоциты в эпидермисе кожи производят пигмент меланин, который присутствует в нескольких формах, которые по-разному защищают кожу от ультрафиолетового (УФ) излучения.В большинстве случаев меланома носит спорадический характер. Экологические нарушения с последующей активацией протоонкогенов в сочетании с подавлением генов-супрессоров опухолей и дефектами в механизме репарации ДНК, еще более усугубляемыми неспособностью иммунной системы сдерживать эти воздействия, приводят к меланоме. Уильям Норрис дальновидно наблюдал наследственную природу меланомы и светлых волос, а также цвет лица, связанный с меланомой в 1857 году. Он предположил, что невусы и воздействие окружающей среды предрасполагают к меланоме, наблюдение, которое было подтверждено открытием семейной атипичной множественной родинки-меланомы синдром FAMM 13 , 14 и синдром спорадического диспластического невуса. 15 Связь между воздействием УФ-излучения и повышенным риском меланомы у австралийского населения европеоидной расы была описана Генри Ланкастером в 1956 году, более поздняя работа которого продемонстрировала важность характеристик кожи в этиологии меланомы. 16 Эти наблюдения дали толчок усилиям по пониманию генетики меланомы. Открытие рецептора меланокортина 1 (MC1R) на фенотипе кожа / волосы 17 и его высокополиморфная природа помогли установить связь между бледной кожей / светлыми волосами с плохой реакцией на загар (английское / кельтское происхождение) и меланомой.Примерно 40% семейных меланом были связаны с наследственной мутацией зародышевой линии в гене циклинзависимой киназы (CDK) CDKN2A. 18 Дефекты в генах CDK4, xeroderma pigmentosum и MC1R участвуют в семейных меланомах. 19–22 Открытие роли семейства онкогенов Ras в 1980-х и их влияние на передачу сигналов ниже по течению было первым шагом на пути к идентификации мутаций-драйверов в меланоме. 23 NRAS впервые был идентифицирован в клеточной линии меланомы в 1984 году. 24 Затем последовала идентификация путей MAPK / ERK и PI3K / AKT онкогенеза меланомы. Мутации, названные «быстроускоренной фибросаркомой» (RAF), были первоначально идентифицированы при саркоме Юингса. Систематическое генетическое типирование выявило, что вариант V600E часто встречается при меланоме кожи в 2002 году. 25 Эта мутация и ее конститутивная активация пути MAPK стали целью многочисленных фармацевтических испытаний низкомолекулярных ингибиторов, в результате которых было разработано несколько новых методов лечения, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.Оценка других гистологических подтипов привела к открытию cKIT в меланоме акральной области и слизистой оболочки. 26 Увеальные меланомы обнаруживают мутации-драйверы в GNAQ, GNA11 и BAP1 с низкой частотой BRAF. 27 Различный образец мутаций драйвера в разных гистологических подтипах меланомы и числовое бремя мутаций в разных линиях клеток меланомы из отдельных опухолей и в образцах опухолей ex vivo 28,29 отражают генетическую гетерогенность меланомы и, вероятно, иметь глубокие последствия для молекулярной, а также иммунологической терапии меланомы.
Факторы риска
Меланома — это заболевание, от которого американцы европеоидной расы страдают в 20 раз чаще, чем афроамериканцы. Пожизненный риск меланомы составляет ~ 2% (1 из 50) для европеоидов, 0,1% (1 из 1000) для афроамериканцев и 0,5% (1 из 200) для выходцев из Латинской Америки. Риск меланомы увеличивается с возрастом — средний возраст заболеваемости составляет 61 год, но это не редкость среди лиц моложе 30 лет, особенно среди молодых женщин. У мужчин пожизненный риск выше, чем у женщин. Предыдущая история меланомы связана с примерно 7% вероятностью развития второй первичной меланомы.Воздействие УФ-излучения является основным фактором риска развития меланомы в окружающей среде. Предполагается, что кумулятивное солнечное воздействие и солнечные ожоги (УФ-B) являются причиной. Воздействие УФ-А от соляриев связано с риском и частотой развития меланомы, особенно среди женщин в возрасте до 35 лет. 30 Это привело к маркировке соляриев / ламп как канцерогенных веществ многими организациями здравоохранения, включая Национальный институт здравоохранения. . Большинство меланом возникает как новые поражения кожи, хотя значительная часть (25–40%) возникает из уже существующих невусов.Последние, клинически описанные как атипичные 31 и патологически идентифицированные как диспластические невусы 32 вместе с врожденными невусами, долгое время считались маркерами риска и необязательными предшественниками, требующими наблюдения. Гигантские врожденные невусы (> 20 см) несут повышенный риск меланомы и по возможности удаляются. 33 Семейный анамнез меланомы увеличивает индивидуальный риск меланомы в 8 раз. 34–37 Серии популяционных исследований показали повышенную заболеваемость раком кожи, включая меланому, у пациентов с ХЛЛ. 38 Носители мутации BRCA2 имеют в 2,58 раза больший риск развития меланомы, чем лица, не являющиеся носителями. 39
Диагноз
Пациенты могут обратиться к своему лечащему врачу или дерматологу с необычным, новым или изменяющимся поражением кожи. Меланома может проявляться в виде амеланотических образований телесного цвета или узловых образований. ABCDEs меланомы направляют решение к биопсии. Американская академия дерматологии рекомендует эксцизионную биопсию с узкими границами в качестве предпочтительной техники биопсии по сравнению с бритьем и послеоперационной биопсией. 40 Допускается более глубокая биопсия соуса, а послеоперационная биопсия подходит для поражений, подозрительных на меланому, которые не подходят для эксцизионной биопсии. Если выполняется пункционная биопсия, она должна быть достаточно глубокой, чтобы охватить основание поражения. 41 Пятна, традиционно используемые для идентификации меланомы, включают комбинацию S100B (в некоторых центрах это было заменено объединенной смесью антител к Melan-A / MART1), HMB-45 и тирозиназы. Новые цели для оценки IHC включают SOX10 и Mitf.Фаза роста (радиальная или вертикальная), морфотип (узловое или поверхностное распространение) митотическая скорость, изъязвление и наличие регрессии опухоли и инфильтрации опухоли лимфоцитами (TIL) обычно сообщаются для их прогностического значения. Меланома может быть разделена морфологически и анатомически на увеальный, кожный, слизистый и акральный типы, которые имеют различные молекулярные структуры онкогенов-драйверов. Инвазивные кожные меланомы исторически подразделялись в зависимости от модели роста на поверхностные распространяющиеся (наиболее частые), узловые (следующие по частоте) и акральные морфотипы лентигинозной слизистой оболочки и лентиго maligna, которые имеют различное биологическое поведение, прогноз и паттерны генов-драйверов молекул.
Постановка
Фундамент нынешней постановочной системы был заложен новаторскими работами Уоллеса Кларка и Александра Бреслоу. В 1966 году Кларк предложил систему, основанную на оценке уровня инвазии тканей, впоследствии названную «уровнем Кларка», чтобы помочь в патологической оценке прогноза меланомы. Инвазия слоев кожи (уровни I – V Кларка, представляющие соединение, верхние сосочковые, полноценные сосочковые, ретикулярные и подкожные зоны кожи) с уменьшением выживаемости, связанным с повышенным уровнем инвазии.Бреслоу в 1970 году заметил, что прогноз зависит от толщины опухоли и ухудшается с увеличением толщины, измеренной от зернистого слоя эпидермиса. Эти системы были включены в структуру клинических испытаний, создав основу для хирургического и медицинского управления и служившие общим языком для врачей для общения и сравнения пациентов в клиническом опыте. Американский объединенный комитет по раку (AJCC) Комитет по стадированию меланомы периодически переоценивал стадию меланомы для прогностической оценки и последний раз пересматривал систему стадирования в 2009 году (седьмое издание), которая была применена на практике после периода комментариев в 2010 году. 5 Комитет основывал свои действия на многомерном анализе примерно 38000 пациентов (7972 с болезнью Стадии IV) из Северной Америки, Европы и Австралии с целью пересмотра / уточнения классификации TNM и общих критериев группировки стадий. Он включает в себя ключевые прогностические характеристики, включая толщину Бреслоу, изъязвление, скорость митоза для тонких меланом (замененный уровень Кларка), поражение лимфатических узлов, включая проявления лимфатического распространения (поражения сателлитов, транзитное заболевание) и наличие отдаленных метастазов (легкое против.Другие). Система также интегрировала прогностические данные о выживаемости и риске рецидива на каждой стадии. Система определения стадий отражает превосходную долгосрочную выживаемость для меланомы AJCC стадии I и II — приближается к 90% и 80% соответственно через 20 лет, тогда как стадия IIB и выше имеет повышенный риск рецидива и смерти, а стадия IIIB – C приближается к 70% или выше. рецидив / летальность через 5 лет. 5
Прогноз
Прогноз при постановке диагноза в значительной степени определяется стадией заболевания.Постановка включает клинические и патологические особенности и определяет диагностические и терапевтические пути для данного человека. Степень заболевания, включая наличие или отсутствие поражения лимфатических узлов и отдаленные метастазы, являются наиболее важными прогностическими факторами. Система стадирования также включает другие важные прогностические факторы «микростадийности» первичной опухоли, такие как толщина по Бреслоу, наличие или отсутствие язвы и скорость митоза первичной опухоли. Пациенты старшего возраста имеют худший прогноз независимо от стадии заболевания по сравнению с пациентами более молодого возраста. 42 Среди морфотипов меланомы узловая меланома в силу преобладающей фазы вертикального роста и более частого наличия изъязвлений имеет худший прогноз. Акральные лентигинозные меланомы труднее обнаружить (незаметное расположение) и, как правило, сначала обнаруживаются на более поздних стадиях. Меланомы лентиго maligna обычно имеют более длительный срок беременности и могут быть обнаружены и прооперированы на меньшей глубине инвазии. Анатомически меланомы конечностей имеют лучшие результаты, чем меланомы туловища или головы / шеи.Женщины, как правило, добиваются большего успеха, чем мужчины. Изъязвление служит маркером агрессивной биологии опухоли и склонности к метастазированию. В тонких меланомах митотическая скорость ≥ 1 служит показателем более высокого риска и, следовательно, требует оценки сторожевых лимфатических узлов. Мутации NRAS и BRAF также связаны с разными паттернами агрессивности болезни. NRAS связан с более толстыми первичными молекулами и более высокой митотической скоростью. 43 Эти маркеры, по-видимому, коррелируют с агрессивной биологией опухоли, отражающей склонность к отдаленной инвазии.
Хирургическое лечение
Первичная опухоль
Уильям Норрис впервые в 1857 году осознал важность местного контроля над заболеванием и выступил за широкое иссечение первичной опухоли с окружающей непораженной тканью для предотвращения местного рецидива. 10 Эта рекомендация легла в основу последующей политики широкого местного удаления (WLE), которая до сих пор является стандартом практики. Его научное основание можно найти в представлении о том, что меланома образует прерывистые гнезда опухолевых клеток в лимфатических сосудах дермы, прилегающих к первичной опухоли.Уильям Хэндли предложил удаление окружающих тканей на два дюйма (5 см) до уровня мышечной фасции для местного контроля 44 , и до 1990-х годов допускались поля в 5 см. Эта гипотеза была проверена в нескольких крупных исследованиях, в которых изучали влияние больших пределов на общую выживаемость, местные рецидивы и выживаемость без болезней. 45–48 Никаких преимуществ не было связано с запасом в 3, 4 или 5 см с точки зрения местного рецидива, выживаемости без болезни или общей выживаемости. Thomas et al. 49 сообщили о несоответствии полей WLE в 1 см и 3 см.Плечо с краем WLE 1 см продемонстрировало повышенный риск локорегионального рецидива, хотя общая выживаемость была аналогичной. Данные этих и других исследований были обобщены в метанализе Haigh et al. 50 , показавшем, что поля в 1 см соответствуют первичным меланомам толщиной 1 мм по Бреслоу, но поля 2 см предпочтительны для толщины 1-2 мм и поля 2 см рекомендуются для толщины более чем 2 мм. При окончательной оценке патологии поля всегда должны быть отрицательными. Микрографическая хирургия Мооса (MMS) не получила должной оценки.Как правило, это делали дерматологи, у которых не было возможности провести биопсию сторожевого узла — поэтому пациенты часто остаются с границами, которые трудно оценить с точки зрения их патологического статуса единым блоком, и отсутствием оценки региональных дозорных узлов, проводимой с 2000 года. рекомендовано AJCC и другими группами экспертов по меланоме. Подход Моха к кожной меланоме в целом не одобрялся, учитывая опасения, что этот хирургический метод игнорирует биологию меланомы, прогностическое значение прерывистого лимфатического распространения и проводится без возможности проверки адекватных границ в том, что последовательные слои кожи, взятые в эта процедура не подвергается рецензируемой патологической оценке, в отличие от формальных образцов с широким иссечением.Тот факт, что операция Моха проводится в относительно ограниченном количестве изолированных бункеров, предполагает, что отсутствие проспективных клинических испытаний, сравнивающих MMS и WLE для обеспечения более строгого научно-обоснованного анализа этого открытого вопроса, является проблемой, которая не скоро будет исправлена,
Лимфаденэктомия
С самого начала врачи осознали агрессивную природу меланомы и ее склонность к лимфатическим и гематогенным метастазам, а также бесперспективность агрессивной локорегиональной хирургии после того, как она распространилась на отдаленные участки.Особое внимание уделялось раннему хирургическому вмешательству с лечебной целью с целью локально-регионального контроля. Основываясь на наблюдении, что меланома первоначально распространяется преимущественно на регионарные лимфатические узлы, Герберт Сноу предложил, чтобы плановая лимфаденэктомия (ELND) была включена в WLE для достижения излечения (1892). 51 Его гипотеза и работа доктора Уильяма Хэндли (1908) отражали стохастическую модель распространения опухоли, в которой лимфатические узлы служили стартовой площадкой для отдаленных метастазов. Множественные проспективные рандомизированные клинические испытания, начиная с 1972 г. и далее, не показали улучшения выживаемости от ELND 52–54 , хотя исследование ВОЗ 13, оценивающее немедленную LND (ILND) по сравнению сотсроченная LND (DLND) у 240 пациентов с меланомой туловища толщиной> 1,5 мм предположила преимущества для пациентов с скрытыми микроскопическими метастазами LN во время ILND. 55 Более недавнее понимание прогностических факторов, таких как толщина Бреслоу, изъязвление, митотический индекс и их клиническое применение, наряду с техническими достижениями в оценке сторожевых лимфатических узлов, положило конец этому противоречию.
Оценка лимфатических узлов
ELND для пациентов с меланомами туловища и области головы и шеи оказалось проблематичным, учитывая неоднозначный характер лимфатического дренажа, связанного с этими областями.Эта техническая проблема подтолкнула к исследованиям технологий определения паттернов лимфатического дренажа — и Вонг и Мортон 56 в 1977 году показали, что краситель и радиоактивные индикаторы, вводимые в кожу вокруг меланомы, позволят надежно идентифицировать дренирующий лимфатический узел (-ы) и связанные с ним бассейны. с туловищными дерматомами. Этот новый метод — лимфосцинтиграфия — позволил развить гипотезу о том, что «сторожевой» лимфатический узел может определять прогностическую оценку и хирургическое вмешательство, а также другие методы лечения меланомы.Эта гипотеза постулировала, что уникальный LN является первым, получающим лимфатический дренаж из опухолевого участка, и, следовательно, он также должен быть первым при метастазах меланомы. Использование витального синего красителя позволило Мортону и его коллегам продемонстрировать, что процедура точно определяет и позволяет проводить селективную биопсию СЛУ для оценки потенциального поражения метастазами опухоли. 56 Использование синего красителя вместе с радиоактивными индикаторами в сочетании с портативностью детекторов радиоактивных индикаторов значительно увеличило вероятность успеха биопсии СЛУ.Ретроспективный анализ Gershenwald et al. , 57, показал, что статус SLN был наиболее значимым прогностическим фактором для безрецидивной и специфической для болезни выживаемости в одномерном и множественном ковариатном анализах. Они также пришли к выводу, что статус SLN должен определять решения относительно достижения полной LND (CLND) у тех пациентов (~ 20%), у которых SLN был положительным. Существует общее мнение, что биопсия СЛУ оправдана для меланомы средней толщины> 1 мм по Бреслоу, учитывая, что у ~ 20% этих пациентов будет оккультное поражение ЛУ. 58 Более тонкие меланомы имеют меньший риск региональных и отдаленных метастазов. Решения относительно биопсии СЛУ у пациентов с тонкими меланомами (≤ 1 мм) обоснованно руководствуются наличием неблагоприятных прогностических факторов — митотической скоростью ≥ 1 / мм2 или наличием язвы, инфильтрации опухолевых лимфоцитов или положительного глубокого края исходной биопсии. . Пациенты с более толстыми меланомами ≥ 4 мм также должны пройти оценку SLN, учитывая прогностическую ценность вовлечения SLN и зависимость принятия решения о адъювантной терапии от точного определения стадии на станции LN.Также некоторые пациенты могут быть излечены с помощью SLND, особенно при микрометастазах в LN. Положительное вовлечение SLN в настоящее время является показанием для CLND на основании исследования многоцентровой селективной лимфаденэктомии (MSLT-1). 58 Значение MSLT-1 и анализа подгрупп, показывающее, что всем пациентам с микрометастатическим заболеванием помогает CLND, вызвало споры. Даже сегодня CLND остается болезненной процедурой. У меньшинства пациентов с поражением SLN обнаруживается поражение недозорных лимфатических узлов при CLND.Данные MSLT-I показывают, что у 88% пациентов, у которых есть единственный сторожевой узел, содержащий опухоль, не будет никаких дополнительных узловых метастазов при исследовании образца CLND. Исследование меланомы SunBelt показало, что вовлечение недозорных ЛУ составляет примерно 16%. 59 Выживаемость была замечена только при анализе подгруппы MSLT-1. Можно утверждать, что биология микрометастатического заболевания SLN в группе SLND может отличаться от группы наблюдения, где позже развились пальпируемые метастазы LN, и что эти две группы нельзя строго сравнивать.Для большинства доказательства того, что SLND дают критическую прогностическую информацию и могут быть связаны с улучшением заболеваемости и смертности, связанной с объемным региональным рецидивом, привели к принятию этого подхода. Тем не менее, эти дебаты продолжаются, и вопросы, связанные с разумным использованием и терапевтическим значением SLN, продолжаются в продолжающемся исследовании MSLT-II. Это исследование будет рандомизировать пациентов с положительными LN либо для ILND, либо для наблюдения, при этом CLND будет зарезервирован для пациентов с подтвержденными метастазами в не сигнальные узлы. 60 Это также поможет ответить на вопрос, является ли биопсия СЛУ у некоторых пациентов одновременно диагностической и терапевтической. Невозможно недооценить важность иммунобиологии меланомы в региональном лимфатическом узле, и исследования, которые в настоящее время проводятся в нашем центре и в других центрах по всему миру, обращаются к молекулярному профилю SLN, который может определять прогноз и будущее лечение болезни в большей степени. изысканная манера. Эти исследования задают вопросы, помимо того, есть ли опухоль в СЛУ или нет, — например, является ли ответ хозяина СЛУ адекватным или дисфункциональным, как теперь кажется, что это может быть у значительной части пациентов.SLN как форум для биологических исследований и как точка опоры для прогрессирования опухоли, вероятно, будет продуктивным центром исследований иммунобиологии этого заболевания на долгие годы.
Медицинский менеджмент
Подавляющее большинство пациентов обращаются с ранними стадиями заболеваний, поэтому обследование кожи для раннего выявления является обязательным для всех врачей первичного звена, а также тех, кто специализируется на лечении меланомы в медицинских учреждениях. как хирургические, так и дерматологические дисциплины.Данные из Германии, где в штате Шлезвиг-Гольштейн была принята программа скрининга среди дерматологов, и многие практикующие врачи в настоящее время предполагают, что рутинное обследование кожи всего тела значительно снижает толщину меланомы и смертность, связанную с заболеванием, на 50%. , основанный на временных тенденциях заболеваемости и смертности от меланомы в земле Шлезвиг-Гольштейн по сравнению с соседними штатами Германии и соседней Данией. Эти результаты уже привели к общенациональному стремлению к регулярному скринингу кожи для выявления меланомы по всей Германии — и системы здравоохранения в других странах мира рассматривают роль скрининга и вторичной профилактики на этой основе. 61 В то время как в немецкой модели использовался однодневный учебный модуль, более простые интернет-модули обучения, требующие всего 1-2 часа для врачей первичной медико-санитарной помощи 62 могут предоставить более практичные современные альтернативы, и одна такая образовательная программа первичной медико-санитарной помощи в сочетании с Рекомендуемый ежегодный общий скрининг кожи тела был инициирован в системе здравоохранения UPMC, где в течение следующих нескольких лет будет внимательно отслеживаться толщина меланомы и смертность от меланомы. Эти меры, вместе с доказательствами того, что надлежащее хирургическое лечение излечивает большинство пациентов с меланомой стадии IA – IB и многих с болезнью стадии IIA, в настоящее время быстро развиваются.Общая 5-летняя выживаемость при ранней стадии заболевания (AJCC IA – IIA) превышает 80%. 5 Характер рецидивов операбельной ранней меланомы предполагает, что данные для таких пациентов следует оценивать в более длительных горизонтах. Коварный характер некоторых рецидивов меланомы и более позднее распространение рецидивов на ранней стадии заболевания делают вопросы наблюдения за рецидивами особенно важными. 63 Рекомендуемая частота и использование радиологических исследований и исследований биомаркеров во всем мире сильно различаются.Они выходят за рамки настоящего обзора, за исключением того, что необходимо отметить, что экономическая тревога и беспокойство пациентов, а также избыточная диагностика последствий эпиднадзора не всегда учитывались в рекомендациях (например, S3 немецкая, итальянская и другие высокоинтенсивные программы по сравнению с австралийскими, голландскими, Британские и более минималистичные рекомендации). К сожалению, существует мало строгих доказательств в поддержку применения интервальных радиологических исследований или исследований биомаркеров для последующего наблюдения за пациентами с меланомой. Наблюдения с более короткими интервалами с использованием изображений и анализа крови на биомаркеры, такие как S1000B, которые были одобрены в Европе, не показали улучшения результатов выживаемости по сравнению с клинической оценкой с более широкими интервалами.Доступные данные, как правило, не учитывают огромных финансовых затрат и потенциального вреда для пациентов и общества в связи с предлагаемыми оценками визуализации. Поскольку методы лечения прогрессирующей меланомы быстро улучшаются, данные наблюдения за более ранними когортами пациентов не будут применимы к настоящему и будущему, в котором методы лечения могут иметь повышенный потенциал излечения заболевания в адъюванте, а также в условиях метастазирования. Необходимость разработки научно обоснованных подходов к эпиднадзору за пациентами с низким, средним и высоким риском (стадии IA – B, IIA – IIIA, IIIB – C и другие операбельные заболевания) является насущной.Доказательства, которые помогут нам определить, какие пациенты подвержены риску позднего рецидива, имеют решающее значение для определения того, каких пациентов следует рассматривать для наблюдения и, в конечном итоге, для адъювантной терапии. Роль медикаментозной терапии в снижении риска рецидива после операции, т. Е. Адъювантной терапии, была разделена на группы пациентов с низким, средним и высоким риском с различными результатами. Исследования с использованием более информативной оценки тканей продолжаются для определения эффективности «неоадъювантной» терапии меланомы.Агенты, используемые сегодня, соответствовали некоторым критериям, сформулированным Полом Эрлихом (1854–1915) более века назад — для « magische Kugel» или волшебной пули, и это, вероятно, изменит наш подход к наблюдению за рецидивами в промежуточных условиях. и операбельное заболевание высокого риска, а также неоперабельное заболевание, поскольку методы лечения, которые могут вылечить метастатическое заболевание, становятся более доступными.
Иммунология и иммунотерапия при меланоме
Burnet et al. придумал термин «иммунный надзор», который подразумевал наблюдение за хозяином на предмет злокачественных клеток, которые, как предполагалось, распознавались и уничтожались по мере их появления.Эта идея была подтверждена наблюдениями за спонтанной регрессией меланомы человека, лимфоцитарными / дендритными инфильтратами, зарегистрированными патологически внутри и вокруг первичных опухолей меланомы, а также увеличением заболеваемости меланомой среди пациентов с ослабленным иммунитетом. Регрессия меланомы среди реципиентов переливаний крови, когда кровь была получена от пациентов с историей регрессии меланомы 64 и присутствием опухолеспецифических Т-клеток и антител у пациентов, как продемонстрировали Morton et al. значение иммунологии в патогенезе меланомы.Голуб и др. 67 смогли продемонстрировать in vitro, , повышенную цитотоксическую активность лимфоцитов, полученных от пациентов с меланомой, против линий клеток меланомы. Мышиные модели показали возможность и эффективность трансфузии адоптивных лимфоцитов. 68 Открытие интерлейкина 2 (IL-2) как фактора роста Т-клеток помогло проложить путь для исследований in vivo иммунной модуляции и ее роли в прогрессирующей меланоме. Эти наблюдения и исследования составляют основу исследований вакцин, высоких доз цитокина IL-2, интерферона α2b (IFNα2b), блокирования цитотоксических Т-лимфоцитов и антигена 4 против CTLA4 (ипилимумаб, тремелимумаб) и анти PD-1 (запрограммированная смерть 1). методы лечения, которые будут обсуждаться, поскольку они произвели революцию в терапии меланомы (см. обсуждение ниже).
Адъювантное лечение
Целью адъювантной терапии является снижение риска рецидива для пациентов путем лечения в то время, когда измеримое или грубое заболевание не обнаруживается после операции. Эта терапия применялась при меланоме, как и при других солидных опухолях, для нацеливания на потенциальные микрометастазы после того, как пациент был хирургическим путем избавлен от болезни. Учитывая доказательства иммуногенности меланомы, адъювантная терапия проводилась с каждым из последующих поколений иммуномодуляторов, которые были разработаны за последние 50 лет, начиная с бактериальных иммуностимуляторов, таких как БЦЖ и C.парвум. Более широкая доступность интерферонов, сначала в виде нерекомбинантного сырого материала, закупленного у Красного Креста Финляндии Американским онкологическим обществом 69–71 , сопровождалась промышленным производством рекомбинантного интерферона множеством фармацевтических фирм и первыми систематическими оценками зависимости реакции от дозы несколько способов для продвинутых, а затем и дополнительных настроек болезни. IFNα2b оценивался в исследовании фазы I – II у пациентов с метастатической меланомой и другими видами рака Кирквудом и др. 70 .Результаты показали частоту ответа (ОР), сравнимую с химиотерапией одним агентом, и стойкий ответ у одной трети пациентов, ответивших на лечение. Фаза III испытаний началась в 1980-х и 90-х годах, оценивая роль адъюванта IFNα2b в различных дозах и схемах для пациентов с резектабельным глубоким первичным и регионарным поражением лимфоузлов меланомой. Основываясь на результатах серии исследований Восточной совместной онкологической группы (ECOG), начатой в 1984 году, FDA в 1995 году одобрило высокие дозы IFNα2b (HDI) для адъювантного лечения меланомы стадии IIB и стадии III.Это рандомизированное многоцентровое исследование фазы III показало преимущества с точки зрения общей выживаемости (OS) и выживаемости без признаков заболевания (DFS) по сравнению с наблюдениями. Затем низкие дозы IFNα2b и промежуточные дозы IFNα2b были оценены в нескольких исследованиях совместных групп во Франции, Австрии и Европе — испытании программ ВОЗ по меланоме 16, EORTC 18871, 18952,18991 (пегилированный IFNα2b) и исследованиях Северной группы по лечению меланомы, в которых выживание без рецидивов (RFS) ) преимущество наблюдалось постоянно. Недавний коллективный метаанализ 72 пришел к выводу, что при всех дозировках преимущество RFS наблюдается при HR ~ 0.83 и ОС HR ~ 0,91. Анализ отдельных испытаний показал преимущества ОС только при ИГД, как сообщалось в исследовании E1694 и US Intergroup E1694, в котором оценивали ИГД в отношении вакцины, которая, как теперь известно, не оказала значительного влияния ни на RFS, ни на OS. 72–74 Продолжаются дебаты относительно эффектов альтернативных схем в ретроспективно идентифицированных популяциях, таких как группы с язвенными первичными опухолями и микроскопическим узловым заболеванием, где текущие испытания проспективно проверяют эффекты альтернативных режимов PegIFN.FDA основывает одобрение HDI, первоначально предоставленное для зрелых 7-летних данных из E1684. В 2011 году FDA одобрило 5-летний режим лечения PegIFN на основании данных EORTC 18991, показывающих общее значительное улучшение RFS при раннем среднем периоде наблюдения 3,8 года. Однако последующий более зрелый анализ при медиане наблюдения 7,6 лет для pegIFNα2b показал меньшее преимущество RFS с HR 0,87, что при анализе ITT имеет незначительное значение. Поскольку никогда не было никаких доказательств воздействия этой схемы на ОС, статус этого агента менее ясен, чем статус исходной схемы E1684 HDI.Исторические наблюдения раннего улучшения результатов с HDI привели к серии исследований, в которых 1 месяц терапии сравнивался с 1 годом или 1 месяц терапии с наблюдением, но теперь они 75 были тщательно протестированы и не демонстрируют никаких доказательств. долгосрочного пособия только от 1 месяца, так что эта глава расследования была закрыта. Flaherty et al. провели межгрупповое исследование S0008, в котором сравнивали биохимиотерапию по сравнению с HDI, и впервые в истории продемонстрировали значительное преимущество BCT по сравнению с HDI, но без каких-либо доказательств влияния на ОС.Эти результаты не могут быть пересмотрены, учитывая быстрые успехи в молекулярно-таргетной терапии опухоли с помощью ингибиторов BRAF, MEK и, возможно, ERK, которые начали адъювантное исследование с ожидаемыми результатами, а также успехи в иммунотерапии с помощью ингибиторов иммунных контрольных точек, таких как блокирование анти-CTLA4. антитела, а также анти-PD 1 и анти-PD L1. Текущие клинические испытания, оценивающие роль ипилимумаба в качестве адъюванта, регистрируются во всей американской Intergroup и, вероятно, завершатся к 2014 году.Они будут оценивать RFS и OS влияние ипилимумаба в дозе 3 или 10 мг / кг по отношению к стандарту HDI у более чем 1500 пациентов из ECOG-ACRIN и SWOG, а также других совместных групп США и NCI-Canada. и ICORG.
Неоадъювантное лечение
Неоадъювантное лечение множественных солидных опухолей (груди, мочевого пузыря, пищевода и мочевого пузыря) связано с лучшими результатами с точки зрения выживаемости и хирургических результатов. Учитывая доказательства иммуногенности и феномена уклонения от иммунитета с прогрессированием меланомы, использование иммуномодулирующих агентов в неоадъювантных условиях было привлекательным в последнее десятилетие.В исследованиях фазы II оценивалась химиотерапия в комбинации и с иммуномодулирующими агентами (биохимиотерапия – ЛКТ), включая такие агенты, как IL-2, IFNα2b, цисплатин, дакарбазин, винбластин. Как и следовало ожидать, эти испытания показали более высокий ОР, но были связаны со значительной токсичностью. 76,77 Исследования фазы III, оценивающие BCT по сравнению с полихимиотерапией, не показали никаких преимуществ с точки зрения скорости ответа или выживаемости без прогрессирования. 78,79
Об использовании неоадъювантной платформы для исследования механизмов действия, помимо реакции на заболевание в этих более ранних условиях потенциальной резектабельности, впервые было сообщено в исследованиях UPCI в 2006 г. Moschos et al. 80 Пациенты (n = 20) получали ИФН внутривенно ежедневно, как в первый месяц однолетнего режима E1684, с последующей операцией с целью оценки ответа и тканевых коррелятов терапии. Десять процентов пациентов (n = 2) продемонстрировали патологический CR, а 40% (n = 8) имели PR. Образцы опухолей, систематически оцениваемые до и после терапии, показали увеличение популяции Т-клеток и дендритных клеток (ДК) с радикальными изменениями уровня конститутивно экспрессируемого STAT3 в опухолевой ткани в течение месяца внутривенного введения IFN.Тот же подход, предпринятый в UPCI с ипилимумабом, показал усиление инфильтрации опухоли активированными Т-клетками с индукцией / потенцированием Т-клеток памяти. Изменение Treg, наблюдаемое в опухоли, показало обратную связь с клинической пользой и было связано с улучшением безболезненности через один год. 81 Изучение комбинации ипилимумаба и IFN в настоящее время продолжается в неоадъювантных условиях в UPCI, чтобы подготовить почву для этой комбинации в будущих исследованиях фазы III.
Ведение метастатического неоперабельного (расширенного, системного) заболевания
Беспомощность, которую испытывает доктор.Томас Фоудингтон в 1826 году об отсутствии методов лечения пациентов с метастазами разделяет медицинских специалистов, проявляющих интерес к меланоме до настоящего времени. Однако достижения в области метастатической меланомы изменились за последние несколько лет так, что немногие в этой области могли предсказать десять лет назад. Несмотря на это, меланома остается неизлечимой болезнью для большинства пациентов. У 40% пациентов с мутированным BRAF V600E, которые отреагировали, а затем рецидивировали (или, реже, совсем не ответили) на молекулярно-таргетную терапию, включая ингибиторы BRAF и MEK, болезнь часто прогрессирует быстро, и варианты остаются паллиативными по своей природе.Результаты одобренных в настоящее время иммунотерапевтических препаратов ИЛ-2 и ипилимумаба приносят пользу 15–20% пациентов и могут быть продлены, но не приносят пользу большинству пациентов. Хотя результаты применения ингибиторов контрольных точек анти-PD1 были удовлетворительными и устойчивыми у несколько большей части пациентов, это в лучшем случае половина населения, и они еще не получили одобрения регулирующих органов.
Наиболее частые места отдаленного распространения включают легкие, печень, кости и мозг (большинство бессимптомных).Местный рецидив может составлять от 1% до 12% для меланом толщиной от ≤ 1 мм до ≥ 3 мм соответственно. 82 Меланома, как и рак молочной железы рецептора гормона ER / PR +, почечно-клеточная карцинома и лимфомы низкой степени злокачественности, нередко проявляется как поздний гематогенный рецидив. Хирургическая резекция для избавления пациентов от болезни должна быть изучена для пациентов с одиночными или ограниченными метастазами в мультидисциплинарных условиях. В испытаниях у пациентов, перенесших метастэктомию на фоне давно перенесенного DFS и олигометастатического заболевания, было выявлено до 40% 5-летнего DFS. 83,84 Местный рецидив лечится резекцией отрицательных краев. Медицинское лечение меланомы за последние тридцать лет эволюционировало от цитотоксической химиотерапии с использованием одного агента к иммунотерапии и к специфическим противоопухолевым агентам с «молекулярно направленными» ингибиторами передачи сигналов, которые во многих отношениях оправдывают пресловутую надежду на «волшебную пулю». Эта грядущая революция, вероятно, еще больше изменит парадигму в отношении иммунотерапии и ингибиторов контрольных точек, таких как анти-CTLA4, и анти-PD1 или PDL1, и будет рассмотрен здесь, а затем подробно описан в этом томе.
Химиотерапия
Истоки химиотерапии рака лежат в воздействии во время Первой мировой войны иприта на солдат, который был предшественником терапевтических алкилатов иприта и нитрозомочевин, таких как BCNU. К сожалению, эти агенты остаются токсичными, и их эффективность при меланоме незначительна, хотя дакарбазин был одобрен как неклассический алкилирующий агент и остается в формуляре, а пероральные аналоги, такие как темозоломид, были одобрены для терапии других солидных опухолей и сыграли роль в меланоме. за прошлое поколение.Дакарбазин (DTIC R ) был одобрен FDA в 1975 году. Исследования 1970-х годов 85–87 показали, что частота ответа составляет 19–28%, а общая выживаемость составляет около 5 месяцев, но более крупные недавние исследования показывают, что частота ответа составляет около 10%. 88 Темозоломид (TMZ), пероральный предшественник активного агента дакарбазина, имеет очевидное проникновение в ЦНС, но лишь незначительно превосходит дакарбазин. Мелфалан системно использовался в 60-е годы для лечения меланомы 89 , но сегодня он используется только для инфузии изолированной конечности или перфузионной терапии для пациентов с обширным транзитом заболеванием конечности. 90 Платиновые агенты, такие как цисплатин (RR 16,3%) 91 и карбоплатин (RR 19%) 92 , не показали превосходства над дакарбазином. Алкалоиды барвинка, включая виндезин, винролебин и винфлунин, были снова исследованы без значительного преимущества перед дакарбазином. Нитрозомочевины и особенно фотемустин и ломустин были исследованы на основании их липофильной природы, но надежды на то, что эти агенты окажутся полезными при метастазах в мозг, не оправдались.Таксаны, включая паклитаксел (относительный риск 15,6–16,4%) 93,94 и доцетаксел (относительный риск 17%) 95 , были изучены, и первое преимущество перед дакарбазином было зарегистрировано с помощью наб-паклитаксела в исследовании фазы III. . 96 Выживаемость без прогрессирования, основная конечная точка, была значительно улучшена при приеме наб-паклитаксела (медиана 4,8 по сравнению с 2,5 месяцами, ОР 0,79, 95% ДИ 0,63–0,99). Наблюдалась тенденция к улучшению общей выживаемости — медиана 12,8 против 10,7 месяцев (ОР 0,83, 95% ДИ 0,58–1.20, р = 0,09). Комбинированная химиотерапия не продемонстрировала превосходства над монотерапией дакарбазином, и обычно используемые / сравниваемые схемы включали цисплатин, винбластин, дакарбазин (ССЗ) или цисплатин, тамоксифен, кармустин, дакарбазин (DBCT или режим Дартмута). Сердечно-сосудистые заболевания сравнивали с дакарбазином в исследовании III фазы, в котором ОР составлял 19% против 14% соответственно без разницы в выживаемости. В фазе III было обнаружено, что DBCT не превосходит дакарбазин с RR 18,5% против 10,2% соответственно и без разницы в OS. 97
Биохимиотерапия (BCT)
BCT возникла в результате усилий по достижению стойких ответов с помощью иммунотерапии в сочетании с быстротой и величиной ответов, полученных с помощью химиотерапии. Химиотерапия в сочетании с IL-2 и / или IFNα2b была протестирована в нескольких исследованиях фазы I, II и III. Добавление IFNα2b к химиотерапии с одним агентом 98–100 или к мультиагентной химиотерапии 101-103 не показало дополнительных устойчивых преимуществ, несмотря на высокий общий RR (до 50%).Точно так же IL-2 не показал преимуществ, добавленных к химиотерапии. 104–106 Чтобы получить синергетический эффект IFNα2b и IL-2, комбинацию добавляли к сердечно-сосудистым заболеваниям как при последовательном, так и при одновременном приеме. Оба подхода привели к высокой ЧОО с полным ответом 23% и устойчивым ответом на 9%. 107 Сердечно-сосудистые заболевания при одновременном применении IFNα2b и IL-2 сравнивали с только сердечно-сосудистыми заболеваниями в исследовании III фазы. Не было обнаружено явного превосходства между двумя группами с точки зрения ЧОО и ОС. 78 Схема Дартмута с IFNα2b и IL-2 по сравнению с DBCT снова не показала различий в показателях OS или PFS. 108 Хотя схемы BCT давали высокую частоту ответа, это не привело к увеличению выживаемости с дополнительными затратами, связанными с токсичностью пациента и неудобствами, учитывая сложные схемы доставки, несмотря на попытки доставлять цитокины подкожно.
Иммунотерапия
Цель иммунотерапии состояла в том, чтобы активировать иммунную систему, распознать и убить опухолевые клетки, с мыслью, что там, где цитотоксики имеют кинетику первого порядка и нельзя надеяться на устранение последних опухолевых клеток, тогда как иммунные подходы могут достичь этой цели.Иммунные агенты, одобренные в настоящее время для лечения метастатической меланомы, включают высокие дозы ИЛ-2 (HD-ИЛ-2) и ипилимумаб. IL-2 был вторым цитокином, который продемонстрировал значительную противоопухолевую активность у пациентов с метастатической меланомой после IFNα2b в условиях адъюванта. Усилия в NCI 109–111 продемонстрировали эффекты ИЛ-2 на Т-клетки и индукцию функции лимфоцит-активированных клеток-киллеров (LAK), которая была связана с клеточными опухолевыми функциями in vitro . Этот эффект был отмечен как дозозависимый.Фаза II клинических испытаний ИЛ-2 как отдельного агента или в комбинации с клетками LAK (адоптивная клеточная терапия) проводилась в конце 1980-х — начале 90-х годов. 112–114 Данные этих испытаний (n- = 270 пациентов) показали общую частоту объективных ответов 16% с 17 полными ответами (CR = 6%) и 26 частичными ответами (PR = 10%). 113 Устойчивые ответы в этих испытаниях фазы II были приняты на рассмотрение регулирующим органом с одобрения FDA для IL-2 в 1998 году. Более низкие дозы IL-2, вводимые подкожно отдельно или в сочетании с другими иммунотерапевтическими препаратами, не показали превосходства над HD-IL-2 . 115,116 Аналогично, другие цитокины, включая IL-12, IL-18 и факторы, стимулирующие колонии гранулоцитарных макрофагов, не показали превосходства над IL-2. 112 Относительно небольшое исследование фазы III (n = 182), объединяющее IL-2 с пептидной вакциной gp100 по сравнению с IL-2, показало многообещающие. Комбинированная группа показала больший CR (16% против 6%) с увеличением медианы OS (17,8 против 11,1 месяцев; P = 0,06). 117 IL-2 в сочетании с ипилимумабом и антителом против PD-1 остается предметом интереса, учитывая предполагаемый синергизм между этими терапиями.
Повышающая регуляция иммунного ответа хозяина для достижения терапевтического противоопухолевого ответа при меланоме стала реальностью в отношении эффекторного Т-клеточного ответа на меланому. Антиген 4, ассоциированный с цитотоксическими Т-лимфоцитами (CTLA-4), представляет собой ингибирующую иммунную контрольную точку, которая подавляет пролиферацию Т-клеток. Блокада CTLA-4 антителами приводит к пролиферации Т-клеток и продукции IL-2 с повышенной противоопухолевой цитотоксической активностью. Ипилимумаб представляет собой моноклональное антитело IgG1, направленное против CTLA-4.В 2011 году FDA одобрило ипилимумаб для терапии нерезектабельной или метастатической меланомы на основании положительного эффекта на общую выживаемость, наблюдаемого с вакциной ипилимумаб +/- gp100 по сравнению с вакциной только gp100 (HR 0,66–0,68, P = 0,0004). 118 Это преимущество в отношении общей выживаемости при терапии второй линии было подтверждено в следующем исследовании фазы III первой линии, в котором сравнивали ипилимумаб + DTIC с одним DTIC (11,2 против 9,1 месяцев; HR = 0,72; P <0,001). Испытания по оценке ипилимумаба в сочетании с другими методами лечения, включая радиацию, фотемустин, IFNα2b, бевацизумаб и таргетные препараты, продолжаются.Однако испытания ингибиторного рецептора PD-1, экспрессируемого активированными Т-клетками, Т-клетками памяти и регуляторными Т-клетками, продвинулись еще более быстрыми темпами. Связывание PD-1 с его лигандами PDL-1 / PDL-2 приводит к подавлению регуляции активности Т-клеток. PDL-1 экспрессируется опухолевыми клетками меланомы и стромой и может использоваться в качестве биомаркера для лечения, направленного против PD-1 / PDL-1. Ниволумаб (BMS936558) представляет собой антитело против PD-1, которое оценивали в фазе 1/2 исследования у пациентов с запущенными формами рака, включая 94 пациента с меланомой. 119 ЧОО 28% наблюдалась при токсичности, которая была значительно меньше, чем наблюдаемая для антител, блокирующих анти-CTLA4. BMS936559, антитело против PDL-1 показало 20% ЧОО (9 из 52 оцениваемых пациентов с меланомой) в испытании фазы 1. 120 Антитело против PDL-1 показало аналогичную противоопухолевую активность и умеренную токсичность. 121 Испытания проводятся по оценке моноклонального антитела Merck к PD-1 MK-3475, и этот агент показал активность отдельного агента, достигающую 53% ответа, который проводится в фазе III оценки против меланомы и рака легких, а также в фазе II комбинации с IFN и вакцинами.
Таргетная терапия
Активированная митогеном протеинкиназа (MAPK) и путь Akt (PI3K-Akt) являются основными путями, конститутивно активируемыми в значительной части меланом. Последние несколько лет были захватывающим периодом для целенаправленной терапии меланомы. Обнаружение активирующих мутаций в BRAF V600E / K в 40–50% меланом кожи и мутаций NRAS еще в 20% меланом кожи в сочетании с высокоактивными и специфическими агентами, которые способны ингибировать эти пути, привело к терапевтической революции с значительный паллиативный эффект для многих пациентов с метастатической меланомой и улучшение выживаемости для пациентов с метастатической меланомой.Утвержденные FDA ингибиторы BRAF (BRAFi) — вемурафениб и дабрафениб (Braf V600E или положительные мутации E и K) и ингибитор MEK (MEKi) траметиниб. Вемурафениб сравнивался с DTIC в исследовании III фазы с превосходством по показателям ВБП (5,3 против 1,6 месяцев, HR 0,26 P <0,001) и ОВ (HR 0,37; P <0,001 через 6 месяцев). 122 Аналогичным образом, Дабрафениб показал превосходство по сравнению с дакарбазином в открытом испытании фазы III, которое позволило перекрестно. Медиана ВБП составила 5,1 месяца по сравнению с 2,7 месяца в группе дакарбазина (HR 0.30). 123 Эти агенты также показали себя многообещающими у пациентов с метастазами меланомы в головной мозг, очаг заболевания, который, как известно, трудно лечить и ранее часто исключаемый из новых исследований. Траметиниб сравнивали с дакарбазином или таксолом у пациентов с мутантом BRAF V600E / K. Было обнаружено, что он превосходит химиотерапию с точки зрения PFS и OS, несмотря на оценку в перекрестном дизайне. 124 MEKi играют роль у пациентов с мутантом BRAF, а также у пациентов с неперекрывающимися мутациями NRAS, обнаруженными при кожной и увеальной меланоме.В сочетании с BRAFi результаты свидетельствуют об улучшении противоопухолевых эффектов, а также снижении токсичности, а комбинации BRAFi (дабрафениб) и MEKi (траметиниб) получили одобрение регулирующих органов в январе 2014 года на основании результатов испытаний фазы II, которые делают возможной эту комбинацию. заменит одноагентную терапию BRAFi. MEKi продолжают исследоваться у пациентов с мутантной болезнью NRAS и особенно с увеальной (мутант GNAQ / GNA11) меланомой. Возможное развитие устойчивости к этим агентам с мутациями NRAS или MEK, усечением и амплификацией BRAF и повышенной экспрессией рецепторных тирозинкиназ представляет собой проблему.Меланома демонстрирует высокую степень неоднородности опухоли и частоту мутаций, которая превосходит все другие солидные опухоли. 29 Текущие клинические испытания оценивают комбинированную терапию с BRAFi и MEKi с целью преодоления резистентности и обеспечения устойчивых устойчивых ответов, хотя для этого могут потребоваться тройные или более сложные комбинации, учитывая мутационный ландшафт заболевания. Сорафениб, ингибитор мультикиназы, показал частоту ответа менее 10% 125 и отсутствие пользы в комбинации с карбоплатином и паклитакселом в исследованиях фазы III в качестве терапии первой и второй линии. 126 Иматиниб был исследован как агент при меланомах, положительных по cKit. Хотя он показал ограниченную эффективность в исследованиях фазы II, он показал впечатляющий ответ у пациентов с активирующей мутацией cKit. 127 Он продолжает оцениваться у пациентов с мутацией cKit под эгидой клинических испытаний. Темсиролимус показал минимальную активность во II фазе исследования. 128
Подходы к подавлению ангиогенеза, наблюдаемого при меланоме, и повышение уровней VEGF, которые могут способствовать устойчивости к иммунотерапии, были давними поисками.Фаза II испытаний бевацизумаба с IFNα2b показала стабильное заболевание, а исследования других предположительно антиангиогенных подходов, включая талидомид и семаксаниб, не дали перспектив. VEGF-ловушка в сочетании с HDIL-2 в настоящее время проходит оценку в большой фазе II ({«type»: «клиническое испытание», «attrs»: {«text»: «NCT01258855», «term_id»: «NCT01258855»}} NCT01258855) многоцентровое клиническое исследование. Белок теплового шока 90, шаперон для BRAF, активируется при меланоме. Таргетная терапия HSP 90 является потенциальным дополнением к терапии ингибитором BRAF для преодоления устойчивости к BRAFi.
Перспективы развития
Совокупность знаний, накопленных за последние десятилетия, послужила прочной основой, на которой сообщество меланомы строится лихорадочными темпами. Эта революция принесла пользу каждому аспекту этой области, от профилактики до хирургии и лечения, что, в свою очередь, привело к улучшению результатов лечения пациентов. По мере того, как растет понимание патофизиологии меланомы, растет и арсенал терапевтических средств. Каждое десятилетие давало надежду на излечение — IFNα2b в 1980-х, IL-2 в 1990-х, ипилимумаб и BRAFi в 2000-х.Появление терапии против PD-1 и понимание уклонения от опухоли с рядом дополнительных контрольных точек, таких как TIM1 и BTLA, гарантируют нам экспоненциальные улучшения в ближайшее десятилетие. Биомаркеры с прогностической и прогностической полезностью, а также комбинации молекулярно-направленной противоопухолевой терапии и значительно более эффективной иммунотерапии остаются горячими темами в будущем. Биомаркеры и мутационный анализ лягут в основу индивидуализированной терапии для пациентов с точки зрения как медикаментозной терапии, так и активного наблюдения.Как отсутствие, так и низкая частота стойкого ответа на терапию одним агентом заставляют нас полагать, что эффективная терапия будет представлять собой комбинацию иммунологических, таргетных агентов и, возможно, химиотерапии. Понимание того, каким образом опухоль способна преодолеть или подорвать иммунный ответ на опухоль в первичной локализации и в региональных лимфатических узлах, является ключевой задачей. Меланома показала свою способность развиваться, чтобы выжить, о чем свидетельствует высокая скорость генетических изменений в этой опухоли.Единственная система, которая может соответствовать своей способности адаптироваться и противодействовать опухоли, — это иммунная система человека. В конечном итоге лекарство от продвинутой меланомы, вероятно, будет заключаться в пробуждении и регулировании этого спящего гиганта.
-
За последние 30 лет произошла революция в области лечения меланомы.
-
Фундаментальные элементы хирургической, адъювантной медицинской и системной терапии заболевания были значительно изменены в сторону улучшения лечения и лучших результатов.
-
Цель лечения прогрессирующей меланомы, которая когда-то считалась неизлечимой, изменилась с паллиативной на потенциально излечивающую.
Сноски
Заявление издателя: Это PDF-файл неотредактированной рукописи, принятой к публикации. В качестве услуги для наших клиентов мы предоставляем эту раннюю версию рукописи. Рукопись будет подвергнута копирайтингу, верстке и рассмотрению полученного доказательства, прежде чем она будет опубликована в окончательной форме для цитирования.Обратите внимание, что во время производственного процесса могут быть обнаружены ошибки, которые могут повлиять на содержание, и все юридические оговорки, относящиеся к журналу, имеют отношение.
Ссылки
1. Siegel R, Ma J, Zou Z, et al. Статистика рака, 2014. CA Cancer J Clin. 2014; 64: 9–29. [PubMed] [Google Scholar] 3. Howlader N, Noone A, Krapcho M и др. Обзор статистики рака SEER, 1975–2009 гг. (Население урожая 2009 г.), Национальный институт рака; Bethesda, MD: 2012. http://seer.cancer.gov/csr/1975_2009_pops09/, основано на представленных в ноябре 2011 г. данных SEER, размещенных на веб-сайте SEER, апрель 2012 г.[Google Scholar] 5. Балч С.М., Гершенвальд Дж. Э., Сунг С. Дж. И др. Окончательная версия стадии и классификации меланомы AJCC 2009 г. J Clin Oncol. 2009. 27: 6199–206. [Бесплатная статья PMC] [PubMed] [Google Scholar] 6. Urteaga O, Pack GT. О древности меланомы. Рак. 1966; 19: 607–10. [PubMed] [Google Scholar] 7. На главную E. Наблюдения за раком, случай VIII. Лондон: 1805. [Google Scholar] 8. Лаэннек Р. Extrait au memoire de M Laennec, sur les melanoses. Париж: Bull L’Ecole Societie de Medicine; 1812. с.24. [Google Scholar] 10. Норрис В. Восемь случаев меланоза с патологическими и терапевтическими замечаниями по поводу этого заболевания. Лондон: Лонгман; 1857. [Google Scholar] 11. Фоудингтон Т. Случай меланоза с общими наблюдениями за патологией интересного заболевания. Лондон: Longman, Orme, Rees, Brown & Green; Робинсон и Бент; Манчестер: 1826 г. [Google Scholar] 12. Купер С. Первые направления теории и практики хирургии. Лондон: Лонгман; 1840. [Google Scholar] 14. Кларк У.Х. младший, Реймер Р.Р., Грин М. и др.Происхождение семейных злокачественных меланом из наследственных меланоцитарных поражений. «Синдром родинок B-K» Arch Dermatol. 1978; 114: 732–8. [PubMed] [Google Scholar] 15. Naeyaert JM, Brochez L. Клиническая практика. Диспластические невусы. N Engl J Med. 2003; 349: 2233–40. [PubMed] [Google Scholar] 16. Ланкастер ХО. Некоторые географические аспекты смертности от меланомы у европейцев. Med J Aust. 1956; 43: 1082–7. [PubMed] [Google Scholar] 17. Бомонт К.А., Вонг С.С., Эйнгер С.А. и др. Рецептор меланокортина MC (1) в генетике и модельных системах человека.Eur J Pharmacol. 2011; 660: 103–10. [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Холланд Э.А., Шмид Х., Кеффорд РФ и др. CDKN2A (P16 (INK4a)) и анализ мутаций CDK4 у 131 австралийского пробанда меланомы: влияние семейного анамнеза и множественных первичных меланом. Гены Хромосомы Рак. 1999; 25: 339–48. [PubMed] [Google Scholar] 19. Свидерская Е.В., Хилл С.П., Эванс-Уипп Т.Дж. и др. p16 (Ink4a) при старении и дифференцировке меланоцитов. J Natl Cancer Inst. 2002; 94: 446–54. [PubMed] [Google Scholar] 20.Гольдштейн А.М., Чан М., Харланд М. и др. Гены восприимчивости к меланоме высокого риска и рак поджелудочной железы, опухоли нервной системы и увеальная меланома в GenoMEL. Cancer Res. 2006; 66: 9818–28. [PubMed] [Google Scholar] 21. Кремер К. Диспластические невусы как предшественники наследственной меланомы. J Dermatol Surg Oncol. 1983; 9: 619–22. [PubMed] [Google Scholar] 22. Халуска Ф.Г., Цао Х., Ву Х. и др. Генетические изменения сигнальных путей при меланоме. Clin Cancer Res. 2006; 12: 2301с – 2307с. [PubMed] [Google Scholar] 23.Малумбрес М., Барбакид М. Онкогены РАН: первые 30 лет. Нат Рев Рак. 2003; 3: 459–65. [PubMed] [Google Scholar] 24. Падуя Р.А., Баррасс Н., Карри Г.А. Новый трансформирующий ген в линии клеток злокачественной меланомы человека. Природа. 1984; 311: 671–3. [PubMed] [Google Scholar] 25. Дэвис Х., Бигнелл Г.Р., Кокс С. и др. Мутации гена BRAF при раке человека. Природа. 2002; 417: 949–54. [PubMed] [Google Scholar] 26. Куртин Дж. А., Бусам К., Пинкель Д. и др. Соматическая активация KIT при различных подтипах меланомы.J Clin Oncol. 2006; 24: 4340–6. [PubMed] [Google Scholar] 27. Ван Рамсдонк CD, Безруков В., Грин Г. и др. Частые соматические мутации GNAQ при увеальной меланоме и синем невине. Природа. 2009; 457: 599–602. [Бесплатная статья PMC] [PubMed] [Google Scholar] 28. Halaban R, Zhang W, Bacchiocchi A, et al. PLX4032, селективный ингибитор киназы BRAF (V600E), активирует путь ERK и усиливает миграцию и пролиферацию клеток меланомы BRAF. Pigment Cell Melanoma Res. 2010; 23: 190–200. [Бесплатная статья PMC] [PubMed] [Google Scholar] 29.Йоханнесен С.М., Джонсон Л.А., Пиччони Ф. и др. Программа клонирования меланоцитов придает устойчивость к ингибированию пути киназы MAP. Природа. 2013; 504: 138–42. [Бесплатная статья PMC] [PubMed] [Google Scholar] 30. Вестердал Дж., Ингвар С., Масбак А. и др. Риск кожной злокачественной меланомы в связи с использованием соляриев: еще одно доказательство канцерогенности УФ-А излучения. Br J Рак. 2000; 82: 1593–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 31. Нордлунд Дж. Дж., Кирквуд Дж., Забудьте Б. М. и др. Демографическое исследование клинически атипичных (диспластических) невусов у пациентов с меланомой и субъектов сравнения.Cancer Res. 1985; 45: 1855–61. [PubMed] [Google Scholar] 32. Старейшина Д.Е., Голдман Л.И., Голдман С.К. и др. Синдром диспластического невуса: фенотипическая ассоциация спорадической меланомы кожи. Рак. 1980; 46: 1787–94. [PubMed] [Google Scholar] 33. Арнея Я.С., Госаин А.К. Гигантские врожденные меланоцитарные невусы. Plast Reconstr Surg. 2007; 120: 26e – 40e. [PubMed] [Google Scholar] 34. Hemminki K, Zhang H, Czene K. Семейные и связанные риски при меланоме кожи: эффекты пробанда и возраста. J Invest Dermatol. 2003. 120: 217–23.[PubMed] [Google Scholar] 35. Ларсон А.А., Личман С.А., Элиасон М.Дж. и др. Популяционная оценка риска немеланомного рака у родственников пробандов кожной меланомы. J Invest Dermatol. 2007; 127: 183–8. [PubMed] [Google Scholar] 36. Amundadottir LT, Thorvaldsson S, Gudbjartsson DF, et al. Рак как сложный фенотип: модель распространения рака внутри и за пределами нуклеарной семьи. PLoS Med. 2004; 1: e65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 37. Флорелл С.Р., Бушер К.М., Гариботти Г. и др.Популяционный анализ прогностических факторов и выживаемости при семейной меланоме. J Clin Oncol. 2005; 23: 7168–77. [PubMed] [Google Scholar] 38. Хисада М., Биггар Р.Дж., Грин М.Х. и др. Солидные опухоли после хронического лимфолейкоза. Кровь. 2001; 98: 1979–81. [PubMed] [Google Scholar] 39. Monnerat C, Chompret A, Kannengiesser C и др. Мутации зародышевой линии BRCA1, BRCA2, TP53 и CDKN2A у пациентов с раком груди и меланомой кожи. Fam Cancer. 2007; 6: 453–61. [PubMed] [Google Scholar] 40. Бичакчян С.К., Халперн А.С., Джонсон Т.М. и др.Рекомендации по лечению первичной меланомы кожи. Американская академия дерматологии. J Am Acad Dermatol. 2011; 65: 1032–47. [PubMed] [Google Scholar] 41. Лоу М., Хилл Н., Пейдж А и др. Влияние биопсии после бритья на ведение пациентов с тонкими меланомами. Am Surg. 2011; 77: 1050–3. [PubMed] [Google Scholar] 42. Пейдж А.Дж., Ли А., Хестли А. и др. Увеличение возраста связано с худшими прогностическими факторами и увеличением отдаленных рецидивов, несмотря на меньшее количество положительных результатов по Сторожевым лимфатическим узлам при меланоме.Int J Surg Oncol. 2012; 2012: 456987. [Бесплатная статья PMC] [PubMed] [Google Scholar] 43. Девитт Б., Лю В., Салеми Р. и др. Клинический исход и патологические особенности, связанные с мутацией NRAS при меланоме кожи. Pigment Cell Melanoma Res. 2011; 24: 666–72. [PubMed] [Google Scholar] 44. Хэндли В. Патология меланотических разрастаний в связи с их оперативным лечением. Ланцет. 1907; 1: 927–33. [Google Scholar] 45. Khayat D, Rixe O, Martin G и др. Хирургические границы при меланоме кожи (2 см против 5 см для очагов размером менее 2.Толщиной 1 мм) Рак. 2003; 97: 1941–6. [PubMed] [Google Scholar] 46. Veronesi U, Cascinelli N, Adamus J, et al. Тонкая первичная кожная злокачественная меланома I стадии. Сравнение иссечения с полями 1 или 3 см. N Engl J Med. 1988. 318: 1159–62. [PubMed] [Google Scholar] 47. Балч С.М., Урист М.М., Каракусис С.П. и др. Эффективность хирургических полей шириной 2 см при меланомах средней толщины (от 1 до 4 мм). Результаты мультиинституционального рандомизированного хирургического исследования. Ann Surg. 1993; 218: 262–7. обсуждение 267–9.[Бесплатная статья PMC] [PubMed] [Google Scholar] 48. Кон-Седермарк Г., Рутквист Л. Е., Андерссон Р. и др. Долгосрочные результаты рандомизированного исследования Шведской исследовательской группы по изучению меланомы на границах резекции 2 см по сравнению с 5 см у пациентов с меланомой кожи с толщиной опухоли 0,8–2,0 мм. Рак. 2000; 89: 1495–501. [PubMed] [Google Scholar] 49. Thomas JM, Newton-Bishop J, A’Hern R, et al. Поля иссечения при злокачественной меланоме высокого риска. N Engl J Med. 2004. 350: 757–66. [PubMed] [Google Scholar] 50. Хей П.И., ДиФронцо Л.А., Маккриди ДР.Оптимальные границы иссечения первичной меланомы кожи: систематический обзор и метаанализ. Может J Surg. 2003. 46: 419–26. [Бесплатная статья PMC] [PubMed] [Google Scholar] 51. Neuhaus SJ, Кларк MA, Томас JM. Д-р Герберт Ламли Сноу, доктор медицины, MRCS (1847–1930): первый чемпион в области выборной лимфодиссекции при меланоме. Энн Сург Онкол. 2004; 11: 875–8. [PubMed] [Google Scholar] 52. Балч С.М., Сунг С.Дж., Бартолуччи А.А. и др. Эффективность выборной регионарной лимфодиссекции меланом толщиной от 1 до 4 мм для пациентов в возрасте 60 лет и младше.Ann Surg. 1996. 224: 255–63. обсуждение 263–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 53. Балч С.М., Сунг С., Росс М.И. и др. Долгосрочные результаты мультиинституционального рандомизированного исследования, сравнивающего прогностические факторы и хирургические результаты меланом средней толщины (от 1,0 до 4,0 мм). Межгрупповое хирургическое исследование меланомы. Энн Сург Онкол. 2000. 7: 87–97. [PubMed] [Google Scholar] 54. Veronesi U, Adamus J, Bandiera DC, et al. Отсроченная регионарная лимфодиссекция при меланоме кожи нижних конечностей I стадии.Рак. 1982; 49: 2420–30. [PubMed] [Google Scholar] 55. Кашинелли Н., Морабито А., Сантинами М. и др. Немедленное или отсроченное рассечение регионарных узлов у пациентов с меланомой туловища: рандомизированное исследование. Программа ВОЗ по меланоме. Ланцет. 1998. 351: 793–6. [PubMed] [Google Scholar] 56. Мортон Д.Л., Вен Д.Р., Вонг Дж. Х. и др. Технические детали интраоперационного лимфатического картирования при меланоме на ранней стадии. Arch Surg. 1992; 127: 392–9. [PubMed] [Google Scholar] 57. Гершенвальд Дж. Э., Томпсон В., Мэнсфилд П. Ф. и др.Опыт мультиинституционального лимфатического картирования меланомы: прогностическая ценность статуса сторожевых лимфатических узлов у 612 пациентов с меланомой I или II стадии. J Clin Oncol. 1999; 17: 976–83. [PubMed] [Google Scholar] 58. Мортон Д.Л., Томпсон Дж. Ф., Кокран А. Дж. И др. Биопсия сторожевого узла или наблюдение узлов при меланоме. N Engl J Med. 2006; 355: 1307–17. [PubMed] [Google Scholar] 59. Макмастерс К.М., Нойес Р.Д., Рейнтген Д.С. и др. Уроки, извлеченные из исследования меланомы Sunbelt. J Surg Oncol. 2004. 86: 212–23. [PubMed] [Google Scholar] 60.Morton DL. Обзор и обновленная информация о III фазе испытаний многоцентровой селективной лимфаденэктомии (MSLT-I и MSLT-II) при меланоме. Clin Exp Metastasis. 2012; 29: 699–706. [Бесплатная статья PMC] [PubMed] [Google Scholar] 61. Каталинич А., Вальдманн А., Вайншток М.А. и др. Спасает ли скрининг на рак кожи жизни ?: обсервационное исследование, в котором сравниваются тенденции смертности от меланомы в регионах, где проводится скрининг и нет. Рак. 2012; 118: 5395–402. [PubMed] [Google Scholar] 62. Маркова А., Вайншток М.А., Рисика П. и др. Влияние веб-учебной программы на практику первичной медико-санитарной помощи: базовое испытание по сортировке рака кожи.Fam Med. 2013. 45: 558–68. [PubMed] [Google Scholar] 63. Лейтер У., Бюттнер П.Г., Эйгентлер Т.К. и др. Уровни риска рецидивирующей и вторичной меланомы кожи: анализ 33 384 пациентов в Немецком центральном регистре злокачественной меланомы. J Am Acad Dermatol. 2012; 66: 37–45. [PubMed] [Google Scholar] 64. Самнер WC, Foraker AG. Спонтанный регресс меланомы человека: клинические и экспериментальные исследования. Рак. 1960; 13: 79–81. [PubMed] [Google Scholar] 65. Мортон Д.Л., Мальмгрен Р.А., Холмс Е.С. и др. Демонстрация антител против злокачественной меланомы человека с помощью иммунофлуоресценции.Операция. 1968; 64: 233–40. [PubMed] [Google Scholar] 66. Мортон Д.Л., Эйлбер Ф.Р., Джозеф В.Л. и др. Иммунологические факторы при саркомах и меланомах человека: рациональная основа иммунотерапии. Ann Surg. 1970; 172: 740–9. [Бесплатная статья PMC] [PubMed] [Google Scholar] 67. Голуб Ш., Мортон ДЛ. Сенсибилизация лимфоцитов in vitro против антигенов, ассоциированных с меланомой человека. Природа. 1974; 251: 161–3. [PubMed] [Google Scholar] 68. Смит Х.Г., Хармель Р.П., Ханна М.Г., младший и др. Регрессия установленных внутрикожных опухолей и метастазов в лимфатические узлы у морских свинок после системного переноса иммунных лимфоидных клеток.J Natl Cancer Inst. 1977; 58: 1315–22. [PubMed] [Google Scholar] 69. Krown SE. Интерфероны при злокачественных новообразованиях: биопрепараты или модификаторы биологического ответа? J Natl Cancer Inst. 1988. 80: 306–9. [PubMed] [Google Scholar] 70. Кирквуд Дж. М., Эрнстофф М. С., Дэвис Калифорния и др. Сравнение внутримышечного и внутривенного рекомбинантного альфа-2 интерферона при меланоме и других видах рака. Ann Intern Med. 1985. 103: 32–6. [PubMed] [Google Scholar] 71. Кирквуд Дж. М., Харрис Дж. Э., Вера Р. и др. Рандомизированное исследование низких и высоких доз лейкоцитарного альфа-интерферона при метастатической почечно-клеточной карциноме: совместное исследование Американского онкологического общества.Cancer Res. 1985; 45: 863–71. [PubMed] [Google Scholar] 72. Mocellin S, Pasquali S, Rossi CR, et al. Адъювантная терапия интерфероном альфа у пациентов с меланомой высокого риска: систематический обзор и метаанализ. J Natl Cancer Inst. 2010; 102: 493–501. [PubMed] [Google Scholar] 73. Уитли К., Айвз Н., Хэнкок Б. и др. Интерферон как адъювантное лечение меланомы. Ланцет. 2002; 360: 878. [PubMed] [Google Scholar] 74. Lens MB, Dawes M. Терапия интерфероном альфа злокачественной меланомы: систематический обзор рандомизированных контролируемых исследований.J Clin Oncol. 2002; 20: 1818–25. [PubMed] [Google Scholar] 75. Pectasides D, Dafni U, Bafaloukos D, et al. Рандомизированное исследование III фазы: 1 месяц по сравнению с 1 годом адъювантного лечения высокими дозами интерферона альфа-2b у пациентов с резецированной меланомой высокого риска. J Clin Oncol. 2009; 27: 939–44. [PubMed] [Google Scholar] 76. Buzaid AC, Colome M, Bedikian A, et al. Исследование фазы II неоадъювантной сопутствующей биохимиотерапии у пациентов с меланомой с местно-регионарными метастазами. Melanoma Res. 1998. 8: 549–56. [PubMed] [Google Scholar] 77.Шах Г.Д., Соци Н.Д., Голд Дж. С. и др. Фаза II испытания неоадъювантного темозоломида у пациентов с резектабельной меланомой. Энн Онкол. 2010; 21: 1718–22. [PubMed] [Google Scholar] 78. Аткинс МБ, Хсу Дж., Ли С. и др. Испытание фазы III, сравнивающее сопутствующую биохимиотерапию цисплатином, винбластином, дакарбазином, интерлейкином-2 и интерфероном альфа-2b с цисплатином, винбластином и дакарбазином отдельно у пациентов с метастатической злокачественной меланомой (E3695): исследование, координируемое Восточной кооперативной онкологической группой.J Clin Oncol. 2008; 26: 5748–54. [Бесплатная статья PMC] [PubMed] [Google Scholar] 79. Кейлхольц У., Пунт С.Дж., Гор М. и др. Дакарбазин, цисплатин и интерферон-альфа-2b с интерлейкином-2 или без него при метастатической меланоме: рандомизированное испытание фазы III (18951) Группы Европейской организации по исследованию и лечению рака. J Clin Oncol. 2005; 23: 6747–55. [PubMed] [Google Scholar] 80. Moschos SJ, Edington HD, Land SR и др. Неоадъювантное лечение регионарной меланомы IIIB стадии высокими дозами интерферона альфа-2b вызывает объективную регрессию опухоли в сочетании с модуляцией клеточных иммунных ответов хозяина, инфильтрирующих опухоль.J Clin Oncol. 2006; 24: 3164–71. [PubMed] [Google Scholar] 81. Tarhini AA, Edington H, Butterfield LH, et al. Иммунный мониторинг кровообращения и микросреды опухоли у пациентов с регионально распространенной меланомой, получающих неоадъювантный ипилимумаб. PLoS One. 2014; 9: e87705. [Бесплатная статья PMC] [PubMed] [Google Scholar] 82. Moehrle M, Kraemer A, Schippert W. и др. Клинические факторы риска и прогностическое значение местного рецидива меланомы кожи. Br J Dermatol. 2004. 151: 397–406. [PubMed] [Google Scholar] 83.Ховард Дж. Х., Томпсон Дж. Ф., Моззилло Н. и др. Метастазэктомия при отдаленной метастатической меланоме: анализ данных первого исследования многоцентровой селективной лимфаденэктомии (MSLT-I) Ann Surg Oncol. 2012; 19: 2547–55. [Бесплатная статья PMC] [PubMed] [Google Scholar] 84. Васиф Н., Багария С.П., Рэй П. и др. Улучшает ли метастазэктомия выживаемость пациентов с меланомой IV стадии? Анализ результатов онкологического реестра. J Surg Oncol. 2011; 104: 111–5. [Бесплатная статья PMC] [PubMed] [Google Scholar] 85. Люс Дж. К., Турман В. Г., Айзекс Б. Л. и др.Клинические испытания противоопухолевого средства 5- (3,3-диметил-1-триазено) имидазол-4-карбоксамида (NSC-45388) Cancer Chemother Rep. 1970; 54: 119–24. [PubMed] [Google Scholar] 86. Натансон Л., Вольтер Дж., Хортон Дж. И др. Характеристики прогноза и реакции на имидазолкарбоксамид при злокачественной меланоме. Clin Pharmacol Ther. 1971; 12: 955–62. [PubMed] [Google Scholar] 87. Костанца М.Э., Натансон Л., Ленхард Р. и др. Терапия злокачественной меланомы имидазолкарбоксамидом и бис-хлорэтилнитрозомочевиной.Рак. 1972; 30: 1457–61. [PubMed] [Google Scholar] 88. Пател П.М., Сучиу С., Мортье Л. и др. Расширенный график, повышенная доза темозоломида по сравнению с дакарбазином при меланоме IV стадии: окончательные результаты рандомизированного исследования III фазы (EORTC 18032) Eur J Cancer. 2011; 47: 1476–83. [PubMed] [Google Scholar] 90. Крун Х.М., Томпсон Дж.Ф. Инфузия изолированной конечности: обзор. J Surg Oncol. 2009; 100: 169–77. [PubMed] [Google Scholar] 91. Гловер Д., Ибрагим Дж., Кирквуд Дж. И др. Рандомизированное исследование фазы II цисплатина и WR-2721 по сравнению с одним цисплатином при метастатической меланоме: исследование Восточной совместной онкологической группы (E1686) Melanoma Res.2003; 13: 619–26. [PubMed] [Google Scholar] 92. Evans LM, Casper ES, Rosenbluth R. Испытание фазы II карбоплатина при запущенной злокачественной меланоме. Cancer Treat Rep., 1987; 71: 171–2. [PubMed] [Google Scholar] 93. Бедикян А.Ю., Плагер С., Пападопулос Н. и др. Фаза II оценки паклитаксела путем короткой внутривенной инфузии при метастатической меланоме. Melanoma Res. 2004; 14: 63–6. [PubMed] [Google Scholar] 94. Верник PH, Эйнциг AI. Таксол при злокачественной меланоме. J Natl Cancer Inst Monogr. 1993: 185–7. [PubMed] [Google Scholar] 95.Аамдал С., Вольф И., Каплан С. и др. Доцетаксел (Таксотер) при запущенной злокачественной меланоме: исследование фазы II группы ранних клинических испытаний EORTC. Eur J Cancer. 1994; 30А: 1061–4. [PubMed] [Google Scholar] 96. Херш Э., Веккио М., Браун М. и др. Фаза 3, рандомизированное открытое многоцентровое испытание наб-паклитаксела по сравнению с дакарбазином у ранее нелеченных пациентов с метастатической злокачественной меланомой [аннотация] Pigment Cell Melanoma Res. 2012; 25: 863. [Google Scholar] 97. Чапман П.Б., Эйнхорн Л.Х., Мейерс М.Л. и др.Многоцентровое рандомизированное исследование фазы III схемы Дартмута по сравнению с дакарбазином у пациентов с метастатической меланомой. J Clin Oncol. 1999; 17: 2745–51. [PubMed] [Google Scholar] 98. Миддлтон М.Р., Лориган П., Оуэн Дж. И др. Рандомизированное исследование фазы III, сравнивающее дакарбазин, BCNU, цисплатин и тамоксифен с дакарбазином и интерфероном при запущенной меланоме. Br J Рак. 2000. 82: 1158–62. [Бесплатная статья PMC] [PubMed] [Google Scholar] 99. Гарсия М., дель Муро XG, Трес А. и др. Многоцентровое исследование фазы II темозоломида в комбинации с интерфероном альфа-2b при метастатической злокачественной меланоме.Melanoma Res. 2006; 16: 365–70. [PubMed] [Google Scholar] 100. Марголин К.А., Дорошов Ю.Х., Акман С.А. и др. Испытание фазы II цисплатина и альфа-интерферона при запущенной злокачественной меланоме. J Clin Oncol. 1992; 10: 1574–8. [PubMed] [Google Scholar] 101. Бафалукос Д., Павлидис Н., Фонзилас Г. и др. Рекомбинантный интерферон ALFA-2A в комбинации с карбоплатином, винбластином и блеомицином в лечении запущенной злокачественной меланомы. Am J Clin Oncol. 1996; 19: 296–300. [PubMed] [Google Scholar] 102. Штейн М.Э., Бернштейн З., Цалич М. и др.Химиоиммуногормональная терапия с использованием кармустина, дакарбазина, цисплатина, тамоксифена и интерферона при метастатической меланоме: проспективное исследование фазы II. Am J Clin Oncol. 2002; 25: 460–3. [PubMed] [Google Scholar] 103. Дапонте А., Асьерто П.А., Гравина А. и др. Цисплатин, дакарбазин и фотемустин плюс интерферон альфа у пациентов с запущенной злокачественной меланомой. Многоцентровое исследование фазы II Итальянской совместной онкологической группы. Рак. 2000. 89: 2630–6. [PubMed] [Google Scholar] 104. Даммер Р., Гор М.Э., Хэнкок Б.В. и др.Многоцентровое клиническое испытание фазы II с использованием дакарбазина и непрерывной инфузии интерлейкина-2 при метастатической меланоме. Клинические данные и иммуномониторинг. Рак. 1995; 75: 1038–44. [PubMed] [Google Scholar] 105. Исаксон Р., Кедар Э., Барак В. и др. Химио-иммунотерапия у пациентов с метастатической меланомой с использованием последовательного лечения дакарбазином и рекомбинантным человеческим интерлейкином-2: оценка гематологических и иммунологических параметров и корреляция с клиническим ответом. Immunol Lett. 1992; 33: 127–34.[PubMed] [Google Scholar] 106. Гуида М., Латорре А., Мастрия А. и др. Подкожный рекомбинантный интерлейкин-2 плюс химиотерапия цисплатином и дакарбазином при метастатической меланоме. Eur J Cancer. 1996. 32A: 730–3. [PubMed] [Google Scholar] 107. Легха С.С., Ринг С., Бедикян А. и др. Лечение метастатической меланомы с помощью комбинированной химиотерапии, содержащей цисплатин, винбластин и дакарбазин (ССЗ), и биотерапии с использованием интерлейкина-2 и интерферона-альфа. Энн Онкол. 1996; 7: 827–35. [PubMed] [Google Scholar] 108.Ацподиен Дж., Нойбер К., Каманаброу Д. и др. Комбинированная химиотерапия с п / к или без него. IL-2 и IFN-alpha: результаты проспективного рандомизированного исследования Совместной группы химиоиммунотерапии злокачественной меланомы (ACIMM) Br J Cancer. 2002; 86: 179–84. [Бесплатная статья PMC] [PubMed] [Google Scholar] 109. Mazumder A, Grimm EA, Zhang HZ, et al. Лизис свежих солидных опухолей человека аутологичными лимфоцитами, активированными лектинами in vitro. Cancer Res. 1982; 42: 913–8. [PubMed] [Google Scholar] 110.Lotze MT, Grimm EA, Mazumder A, et al. Лизис свежей и культивированной аутологичной опухоли лимфоцитами человека, культивированными в Т-клеточном факторе роста. Cancer Res. 1981; 41: 4420–5. [PubMed] [Google Scholar] 111. Розенберг С.А., Лотце М.Т., Муул Л.М. и др. Наблюдения за системным введением аутологичных лимфокин-активированных клеток-киллеров и рекомбинантного интерлейкина-2 пациентам с метастатическим раком. N Engl J Med. 1985; 313: 1485–92. [PubMed] [Google Scholar] 112. Аткинс МБ. Цитокиновая терапия и биохимиотерапия для запущенной меланомы.Clin Cancer Res. 2006; 12: 2353с – 2358с. [PubMed] [Google Scholar] 113. Аткинс МБ, Лотце М.Т., Датчер Дж. П. и др. Терапия высокими дозами рекомбинантного интерлейкина 2 для пациентов с метастатической меланомой: анализ 270 пациентов, пролеченных в период с 1985 по 1993 гг. J Clin Oncol. 1999; 17: 2105–16. [PubMed] [Google Scholar] 114. Паркинсон Д. Р., Абрамс Дж. С., Верник PH и др. Терапия интерлейкином-2 у пациентов с метастатической злокачественной меланомой: исследование II фазы. J Clin Oncol. 1990; 8: 1650–6. [PubMed] [Google Scholar] 115.Итон О., Розенблюм М.Г., Легха С.С. и др. Фаза I испытания подкожного рекомбинантного человеческого интерлейкина-2 у пациентов с метастатической меланомой. Рак. 2002; 95: 127–34. [PubMed] [Google Scholar] 116. Karp SE. Низкие дозы внутривенного болюсного введения интерлейкина-2 с терапией интерфероном-альфа при метастатической меланоме и почечно-клеточной карциноме. J Immunother. 1998. 21: 56–61. [PubMed] [Google Scholar] 117. Schwartzentruber DJ, Lawson DH, Richards JM и др. Пептидная вакцина gp100 и интерлейкин-2 у пациентов с запущенной меланомой.N Engl J Med. 2011; 364: 2119–27. [Бесплатная статья PMC] [PubMed] [Google Scholar] 118. Hodi FS, O’Day SJ, McDermott DF и др. Повышение выживаемости при применении ипилимумаба у пациентов с метастатической меланомой. N Engl J Med. 2010; 363: 711–23. [Бесплатная статья PMC] [PubMed] [Google Scholar] 119. Topalian SL, Hodi FS, Brahmer JR и др. Безопасность, активность и иммунные корреляты антитела против PD-1 при раке. N Engl J Med. 2012; 366: 2443–54. [Бесплатная статья PMC] [PubMed] [Google Scholar] 120. Брамер JR, Tykodi SS, Chow LQ и др.Безопасность и активность антител анти-PD-L1 у пациентов с запущенным раком. N Engl J Med. 2012; 366: 2455–65. [Бесплатная статья PMC] [PubMed] [Google Scholar] 121. Хамид О., Сосман Дж. А., Лоуренс Д. П. и др. Клиническая активность, безопасность и биомаркеры MPDL3280A, сконструированного антитела к PD-L1 у пациентов с местнораспространенной или метастатической меланомой (мМ) J Clin Oncol. 2013; 31 (доп.): Abstr 9010. [Google Scholar] 122. Чапман П.Б., Хаушильд А., Роберт С. и др. Повышение выживаемости с применением вемурафениба при меланоме с мутацией BRAF V600E.N Engl J Med. 2011; 364: 2507–16. [Бесплатная статья PMC] [PubMed] [Google Scholar] 123. Хаушильд А., Гроб Дж. Дж., Демидов Л. В. и др. Дабрафениб при метастатической меланоме с мутацией BRAF: многоцентровое открытое рандомизированное контролируемое исследование фазы 3. Ланцет. 2012; 380: 358–65. [PubMed] [Google Scholar] 124. Флаэрти К.Т., Роберт С., Херси П. и др. Повышение выживаемости за счет ингибирования MEK при меланоме с мутацией BRAF. N Engl J Med. 2012; 367: 107–14. [PubMed] [Google Scholar] 125. Эйзен Т., Ахмад Т., Флаэрти К.Т. и др. Сорафениб при запущенной меланоме: анализ рандомизированного прекращающего исследования фазы II.Br J Рак. 2006; 95: 581–6. [Бесплатная статья PMC] [PubMed] [Google Scholar] 126. Хаушильд А., Агарвала С.С., Трефцер У. и др. Результаты рандомизированного плацебо-контролируемого исследования фазы III сорафениба в комбинации с карбоплатином и паклитакселом в качестве терапии второй линии у пациентов с неоперабельной меланомой III или IV стадии. J Clin Oncol. 2009. 27: 2823–30. [PubMed] [Google Scholar] 127. Ходи Ф.С., Фридлендер П., Корлесс С.Л. и др. Основной ответ на мезилат иматиниба при меланоме с мутацией KIT. J Clin Oncol.2008; 26: 2046–51. [PubMed] [Google Scholar] 128. Марголин К., Лонгмат Дж., Баратта Т. и др. CCI-779 при метастатической меланоме: испытание фазы II Калифорнийского онкологического консорциума. Рак. 2005; 104: 1045–8. [PubMed] [Google Scholar]
вопросов и ответов по меланоме | Что спросить у врача
Что следует знать о меланоме
Меланома — агрессивная форма рака кожи. Ниже приведены некоторые общие вопросы и ответы об основах заболевания, его симптомах, профилактике и факторах риска.
Что вызывает меланому?
Меланома развивается, когда поврежденные клетки меланоцитов бесконтрольно растут.
Меланоциты находятся в основном вдоль дна эпидермиса, внешнего слоя кожи. Эти клетки содержат пигмент под названием меланин, который затемняет кожу при воздействии ультрафиолетового (УФ) излучения солнца или солярия. Меланоциты поглощают ультрафиолетовый свет, защищая кожу от ожогов и блокируя проникновение ультрафиолетового света более глубоко в кожу и внутренние органы.Избыточное воздействие ультрафиолета может не только обжечь кожу, но и повредить меланоциты, вызывая клеточные мутации, которые заставляют клетки бесконтрольно расти и, иногда, перемещаться в другие части тела. Меланома составляет около 2 процентов из более чем 3,5 миллиона случаев рака кожи, диагностируемых каждый год, но именно она является причиной большинства смертей от рака кожи. Если подсчитать отдельно, то по данным Национального института рака, меланома является пятым по распространенности типом рака, на который ежегодно приходится более 85 000 новых случаев.
Каковы признаки и симптомы меланомы?
Может быть трудно определить, является ли пятно или новообразование на коже родинкой, доброкачественным новообразованием, немеланомным раком кожи или меланомой. Как и большинство видов рака кожи, меланома может проявляться в виде темного безболезненного пятна или язвы на коже. По мере развития пятно может менять форму и цвет и кровоточить. В отличие от большинства видов рака кожи, меланома может развиваться на частях тела, которые обычно не подвергаются воздействию солнца, например, в паху, подмышках или ступнях.В редких случаях меланома также может быть обнаружена в глазу. Ежегодно диагностируется около 2500 случаев меланомы глаза. Специалисты рекомендуют проверять подозрительные или быстрорастущие пятна у врача. Фонд рака кожи предоставляет карту тела, которая поможет вам вести учет подозрительных пятен, и советует взять ее с собой при посещении дерматолога или другого врача для ежегодного осмотра.
Как отличить меланому от других форм рака кожи?
Метод ABCDE может помочь вам определить, может ли аномальный рост на вашей коже быть меланомой.
Симметрия A : Родинка имеет неправильную форму.
B заказ: Кромка не гладкая, а неровная или с зазубринами.
C Цвет: Родинка имеет неровную окраску или темные пятна.
D Диаметр: Пятно больше размера ластика карандаша.
E volving или E levation: Пятно меняет размер, форму или текстуру.
Единственный способ убедиться, что родинка является меланомой, — это обратиться к врачу.
Могу ли я снизить риск заболевания меланомой?
Воздействие УФ-излучения является основной причиной повреждения клеток, которое может привести к раку кожи, включая меланому. Большая часть УФ-света, достигающего Земли, — это УФ-А, длинноволновые ультрафиолетовые лучи, которые проникают в кожу глубже, чем УФ-В (коротковолновые) лучи. Эти сильные лучи могут проникать во внешний слой кожи, где расположены меланоциты.
Один из важных способов снизить риск рака кожи и меланомы — по возможности избегать пребывания на солнце и / или защищаться от вредных лучей.Следуйте этим советам:
- По возможности избегайте солнца с 10 до 16 часов, когда вредный ультрафиолетовый свет обычно наиболее сильный. Ищите тень, если вам нужно выйти на улицу.
- Защитите себя от солнца с помощью широкополой шляпы, длинных рукавов и длинных брюк. Носите солнцезащитные очки с защитой от ультрафиолета, чтобы снизить риск повреждения глаз.
- Обильно нанесите солнцезащитный крем. Используйте продукт широкого спектра действия, который защищает от лучей UVA и UVB.Убедитесь, что у него фактор защиты от солнца (SPF) 30 или выше. Повторно наносите солнцезащитный крем каждые два часа или чаще, если вы плаваете или потеете. И используйте солнцезащитный крем в другое время года, а не только летом. Кожа может загореться под воздействием солнечных лучей вне зависимости от времени года.
- Солнцезащитный крем — не единственный продукт, имеющий рейтинг SPF. Ищите номер SPF на этикетках пляжных зонтов, палаток и шляп.
- Проверяйте свою кожу на предмет появления прыщиков не реже одного раза в месяц.Попросите супруга или партнера посмотреть на вашу спину или другие части тела, которые вы не видите. Раз в год проходите осмотр у врача.
- Избегайте соляриев и соляриев.
- Если вы родитель, защитите своих детей от солнца. Ожог может значительно увеличить риск меланомы в более позднем возрасте. И регулярно осматривайте кожу своих детей, как свою собственную.
Как мне проверить себя на рак кожи?
Найдите время раз в месяц, чтобы осматривать свое тело буквально с головы до ног.Хорошо, если у вас есть большое зеркало или зеркало в полный рост и ручное зеркало. Начиная с макушки, ищите новые пятна, неровные или выступающие пятна или пятна, которые изменились или выросли с момента вашего последнего осмотра. Используйте ручное зеркало, чтобы заглянуть за уши, заднюю часть шеи и верхнюю часть кожи головы. Попросите партнера или супругу посмотреть на вашу спину, тыльную сторону колен или другие труднодоступные места. Не забывайте проверять подошвы ступней и между пальцами рук и ног.Подумайте о том, чтобы использовать карту тела, чтобы записывать подозрительные пятна, и принесите ее дерматологу или другому врачу для ежегодного осмотра.
Вопросы по лечению меланомы
Лечение меланомы может зависеть от стадии меланомы, от того, насколько рано она диагностирована и есть ли метастазы. Ниже приведены ответы на некоторые общие вопросы о доступных методах лечения меланомы:
Какие у меня варианты лечения меланомы?
Операция по лечению локальной меланомы может потребовать обширного иссечения и удаления лимфатических узлов.При широком иссечении хирург удаляет большой периметр вокруг пятна меланомы на коже. Эта операция также может повредить кожу более глубоко, чем процедуры при других типах рака кожи. Реконструктивная или пластическая операция может быть рассмотрена, если операция приводит к рубцеванию или обезображиванию. Если меланома дала метастазы или распространилась в отдаленные органы или другие части тела, может потребоваться хирургическое вмешательство для удаления метастатической опухоли. Химиотерапия, лучевая терапия, таргетная терапия и иммунотерапия — все это варианты лечения метастатической меланомы.
Какие побочные эффекты я могу ожидать от лечения?
Хирургические процедуры при меланоме могут быть болезненными и вызывать отек, синяк и / или повреждение нервов. Операция по удалению лимфатических узлов может привести к отеку, вызванному накоплением лимфатической жидкости, состоянию, известному как лимфедема. Химиотерапия, таргетная терапия и иммунотерапевтические препараты могут вызывать множество побочных эффектов, таких как тошнота и рвота, усталость, повреждение нервов, язвы во рту и сыпь. Пациенты, проходящие лучевую терапию, могут испытывать раздражение кожи.
К каким врачам я обращусь во время лечения меланомы?
В зависимости от стадии меланомы в вашу команду может входить несколько врачей, в том числе один или все врачи, указанные ниже:
- Дерматолог занимается лечением заболеваний кожи и ногтей. Это может быть первый врач, к которому вы обращаетесь, если у вас ранняя стадия заболевания, или чтобы определить, есть ли у вас меланома или другой тип рака кожи.
- Онколог-радиолог применяет лучевую терапию для лечения рака.
- Врач-онколог лечит рак с помощью химиотерапии и других препаратов.
- Хирург-онколог выполняет операции по удалению опухолей и окружающих тканей или для взятия образцов тканей для биопсии.
- Реконструктивный хирург ремонтирует или восстанавливает поврежденные участки тела, чтобы восстановить их функции и / или внешний вид.
Вопросы к врачу
Ниже приведены некоторые важные вопросы, которые пациенты с меланомой должны задавать своим врачам:
Что означает метастазирование моего рака?
Меланома более подвержена метастазам, чем большинство видов рака кожи.Клетки меланомы чаще всего попадают в легкие, печень, кости и мозг. Опухоли, обнаруженные в этих местах, по-прежнему считаются меланомой. Например, меланома, обнаруженная в головном мозге, называется метастатической меланомой или меланомой с метастазами в головной мозг. Чтобы определить, распространилась ли меланома, может быть проведена процедура, называемая биопсией сторожевого лимфатического узла. В этой процедуре хирург удаляет один или несколько лимфатических узлов, которые могли принимать лимфатическую жидкость из опухоли. Если сторожевой лимфатический узел не показывает признаков рака, дополнительная операция на лимфатическом узле может не потребоваться.Однако, если клетки меланомы обнаруживаются в одном или нескольких сторожевых лимфатических узлах, оставшиеся лимфатические узлы в этой области могут быть удалены.
Подходит ли мне иммунотерапия?
Препараты иммунотерапии, называемые ингибиторами контрольных точек, были одобрены для лечения определенных типов меланомы. Эти препараты действуют, нарушая химические сигналы, которые раковые клетки посылают, чтобы помочь спрятаться от иммунной системы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило некоторые препараты-ингибиторы контрольных точек для лечения меланомы.Однако иммунотерапия рекомендуется не всем пациентам, поэтому поговорите со своим онкологом о том, подходите ли вы для этих препаратов.
Следует ли мне участвовать в клиническом исследовании?
Лечение рака значительно улучшилось за последние годы благодаря достижениям, которые стали возможными благодаря пациентам, которые участвовали в исследованиях, изучающих новые варианты лечения, протоколы лекарств или другие подходы, прежде чем они получили федеральное разрешение. Эти клинические испытания могут предложить участникам новые варианты лечения, которые в противном случае были бы для них недоступны, особенно после изнуряющих традиционных методов лечения.Если вы заинтересованы в участии в клиническом исследовании, спросите своего врача, соответствуете ли вы критериям, и обсудите любые проблемы или вопросы, которые могут у вас возникнуть, чтобы помочь вам определить, подходит ли оно вам.
Следующая тема: Какие факты о меланоме?
Дерматопатология 20 ноября 2011 г.
Добро пожаловать в Йельский онкологический центр. Ответы врачей Франсин Фосс и Линн Уилсон. Доктор Фосс - профессор медицинской онкологии и дерматологии, специализирующийся на лечении лимфом.Доктор Уилсон - профессор терапевтической радиологии и эксперт по использованию излучения для лечения рака легких и кожных лимфом. Если вы хотите присоединиться к беседе, вы можете напрямую связаться с врачами. Адрес: [email protected], номер телефона: 1-888-234-4YCC. На этой неделе Франсин и Линн приветствуют доктора Россицу Лазову. Доктор Лазова - доцент кафедры дерматологии и патологии и директор Йельского отделения дерматопатологии.Фосс Не могли бы мы начать с того, чтобы вы немного поговорили о своем прошлом и объяснили нашей аудитории, что такое дерматопатология?
Лазова. Я дерматопатолог, кожный патолог.Когда у кого-то появляется сыпь, пигментное поражение или участок, подозрительный на рак, дерматолог часто берет кусок ткани для исследования под микроскопом. Мои коллеги, дерматопатологи, и я проводим это микроскопическое исследование. Мы смотрим на ткань под микроскопом, чтобы поставить правильный диагноз, чтобы пациенту было назначено соответствующее лечение. Мы смотрим на очень тонкие срезы ткани, окрашенные гематоксилином и эозином, синим и розовым, и определяем, есть ли у пациента рак или нет, и какой у него тип сыпи.Как только мы это определим и поставим правильный диагноз, дерматолог сможет правильно лечить пациента. Это всегда очень важно, поскольку, если мы поставим неправильный диагноз, лечение пациента изменится. Если мы диагностируем поражение как рак, а это не так, тогда пациенту предстоит ненужное лечение, часто хирургическое вмешательство. С другой стороны, если мы диагностируем поражение как доброкачественное, и это рак, пациент не получит должного лечения и не получит надлежащего лечения своего состояния.
Фосс Как дерматопатолог, вы когда-нибудь занимались клинической дерматологией? Вы когда-нибудь действительно видели пациентов с этими повреждениями или вы просто смотрите под микроскопом на кожу?
Курс Лазовой дерматопатологии следует за курсом патологии или дерматологии. Итак, все дерматопатологи имеют базовую подготовку. Оба они сертифицированы по специальности патология или дерматология, а стипендия дерматопатолога - это дополнительный год обучения только по кожной патологии.Дерма на латыни означает кожа, следовательно, дерматопатология - это патологические изменения в коже, и мы обучаемся не менее одного года в области кожной патологии или дерматопатологии, и в рамках этого обучения мы проводим шесть месяцев обучения по специальности, противоположной той, по которой мы обучались. Например, у меня патологический фон; поэтому я прошел шесть месяцев обучения дерматологии, поэтому я смотрел на пациентов. Я изучал дерматологию, поэтому могу распознавать кожные заболевания. Конечно, я не так хорошо обучен, как ординатор-дерматолог и практикующий дерматолог, но у меня есть базовые знания в дерматологии, которые можно отнести к моему опыту в области кожной патологии.
3:50 в mp3-файл http://yalecancercenter.org/podcasts/2011_1120_YCC_Answers_-_Dr_Lazova.mp3Foss Одна из вещей, о которой, вероятно, знают немногие в аудитории, - это то, что кожа на самом деле является самым большим органом в организме.
Лазова. Совершенно верно. Кожа - самый большой орган в теле и, на мой взгляд, самый замечательный орган в теле, потому что его очень легко исследовать. Это на поверхности, поэтому мы можем видеть, что происходит. Мы можем очень рано обнаружить любые изменения, которые появляются на нашей коже, и, следовательно, у нас есть большие шансы вылечить любое заболевание на очень ранней стадии с большим успехом.
Линн Как вы заинтересовались дерматопатологией?
Лазова Я была ординатором патологии в Рочестерском университете. Я сертифицирован по анатомической и клинической патологии, и в рамках своего обучения я изучал случаи патологии кожи с моим учителем доктором Глинисом Скоттом. Я был очарован ее способностью диагностировать различные кожные заболевания, глядя на клетки и образцы клеток, и даже с помощью нескольких клеток она смогла поставить диагноз, поэтому я очень заинтересовался дерматопатологией, потому что это было очень сложно, но увлекательно. меня.Я решил изучать эту область и продолжил стипендию по дерматопатологии, и мне посчастливилось тренироваться у лучшего специалиста по дерматопатологии всех времен, доктора Бернарда Аккермана.
Фосс Россица, для тех из нас, кто видит много пациентов с сыпью, сыпь - это сыпь в клинике, и единственный способ узнать, с чем мы имеем дело, - это то, что дерматопатолог говорит нам на основе биопсии.
Лазова. Да, это правильно. Я должен немного не согласиться, потому что дерматолог скажет вам, что разные высыпания отличаются, поэтому они могут распознать многие высыпания клинически на основе типичных особенностей, но во многих других случаях они могут имитировать друг друга.Поэтому биопсия поражения и исследование сыпи под микроскопом чрезвычайно важны, и в 99% случаев мы, дерматопатологи, очень полезны и можем поставить правильный диагноз, и, следовательно, пациентов можно лечить должным образом.
Фосс. Можете ли вы рассказать нам, с какими видами рака вы боретесь?
Лазова Мы сталкиваемся с разными видами рака, меланоцитарным и немеланоцитарным раком. Наиболее распространенными видами рака являются плоскоклеточный рак и базальноклеточный рак.Это эпителиальный рак. Они возникают из эпидермиса, который является самым внешним слоем нашей кожи. Плоскоклеточный рак и базальноклеточный рак связаны с воздействием солнца. Следовательно, чем больше человек находится на солнце, тем больше вероятность развития рака. С другой стороны,
7:09 в mp3-файл http://yalecancercenter.org/podcasts/2011_1120_YCC_Answers_-_Dr_Lazova.mp3
меланома - один из самых смертоносных видов рака, который также развивается на коже. Меланомы - очень интересный вид рака, потому что они могут быть очень тонкими, но спустя годы могут давать метастазы, и они могут убить пациента.Чрезвычайно важно поставить ранний диагноз и попытаться лечить пациента как можно раньше для лучшего успеха.
Линн.Есть несколько более необычных типов рака кожи, таких как карцинома из клеток Меркеля, которые не обязательно связаны с солнцем, и я думаю, что в последнее время они почувствовали, что может быть вирусная связь, воздействие вируса и карцинома из клеток Меркеля, для пример. Вы должны увидеть самые разные вещи, общие для базальноклеточного и плоскоклеточного рака и меланомы, но вы также должны увидеть целый ряд очень редких кожных заболеваний.Так ли это?
Лазова Верно. Мы видим целый ряд различных типов рака, включая карциному из клеток Меркеля. К сожалению, карцинома из клеток Меркеля также является одним из видов рака с очень плохим поведением, который может очень рано распространиться на лимфатические узлы и перерасти в широко распространенное метастатическое заболевание. Мы все больше и больше обнаруживаем, что многие виды рака связаны с вирусами и некоторыми другими инфекционными заболеваниями, и это удивительно.
Фосс Другой аспект того, что вы, вероятно, видите, - это пациенты с другими видами рака, например, с солидными опухолями, у которых могут быть кожные метастазы.
Лазова Верно. Иногда мы находим сюрпризы в коже. Мы обнаруживаем метастазы рака из других частей тела, которые присутствуют в коже, и затем нам приходится решать дилемму, является ли это первичным раком кожи или это метастатический рак, возникший в другой части тела, и, к счастью, у нас есть множество методик и тестов, которые могут помочь нам поставить правильный диагноз. У нас есть специальные пятна, мы называем их иммуногистохимическими пятнами, которые могут выявить некоторые виды рака, но являются отрицательными при других типах рака.Они очень помогают нам в постановке правильного диагноза.
Фосс. Не могли бы вы также прокомментировать использование генетических тестов при биопсии кожи?
Лазова Иногда для постановки правильного диагноза необходимы генетические тесты. При меланоцитарных поражениях существует несколько генетических тестов, в которых геномная гибридизация и FISH или флуоресцентная гибридизация на месте часто используются для определения того, является ли рост меланоцитов злокачественным, например меланомой, или доброкачественной родинкой. Позже я расскажу вам о моем захватывающем исследовании масс-спектрометрии у шпицоидов, которое не является генетическим, но, безусловно, очень захватывающим.
Линн. Вы также даете врачу, который делает биопсию, много другой информации. Вы можете сказать, что это меланома, но вы указываете размер, сколько места между краями
10:45 в mp3-файл http://yalecancercenter.org/podcasts/2011_1120_YCC_Answers_-_Dr_Lazova.mp3
меланома и края образцов, и многие из этих сведений, я думаю, очень полезны для клинициста. На самом деле вы предоставляете гораздо больше информации, чем просто ставите конкретный диагноз.
Лазова Верно. Помимо постановки диагноза меланомы, мы предоставляем определенные характеристики меланомы, чтобы помочь клиницисту определить, как лечить пациента, и многие из них имеют прогностическое значение. Они помогают клиницистам сориентировать пациента относительно возможных вариантов лечения, вероятности его выживания и т. Д. В частности, для меланомы мы должны измерить глубину, которая является наиболее важным прогностическим фактором и характерным фактором для лечения.Опять же, в прогнозе меланомы, чем глубже меланома, тем хуже прогноз. Таким образом, чрезвычайно важно, чтобы меланомы были обнаружены на ранней стадии, когда они еще очень поверхностны, и вылечены как можно раньше для лучшего успеха в лечении.
Foss Существует множество различных видов пигментных поражений кожи, и я уверен, что вы видите их целый спектр, но есть ли у пациентов определенные факторы риска развития меланомы или есть определенные вещи, которые вы ищете в одной из этих пигментных биопсий?
Лазова Есть факторы риска развития меланомы.Один из них - генетический риск. Есть семьи с повышенным риском развития меланомы, и очень важно, чтобы члены таких семей знали об этом и проводили самообследование, обращали внимание на свою кожу, обращали внимание на доброкачественные родинки, меняют ли они цвет, не изменяются ли они начинают зуд, кровотечение, увеличиваются ли они в размерах и обращаются за помощью к врачу, а также на регулярные осмотры врача, особенно у дерматологов, для скрининга и наблюдения за этими поражениями.
Линн Какие есть варианты скрининга на меланому?
Лазова Один из лучших вариантов скрининга - это самообследование, потому что, если вы подождете и пойдете к врачу на очень позднем этапе развития опухоли на вашей коже, это может быть слишком поздно или ваши варианты будут не такими хорошими, как если рак обнаружен раньше. Итак, мы должны смотреть на нашу кожу повсюду, даже между пальцами ног. Используйте зеркало, чтобы посмотреть на свою спину, или попросите своих близких, родственников, друзей осмотреть нас, если это возможно, или просто сходите к дерматологу один раз в год или один раз в несколько лет, чтобы сравнить и проверить пигментные поражения, потому что дерматолог снимает.Они сравнивают размер и действительно следят за поражениями и их развитием, чтобы убедиться, что они не перерастут в рак.
Линн. Мы собираемся сделать небольшой перерыв на медицинскую минуту. Следите за обновлениями, чтобы узнать больше о дерматопатологии у доктора Лазовой.
14:19 в mp3-файл http://yalecancercenter.org/podcasts/2011_1120_YCC_Answers_-_Dr_Lazova.mp3
Медицинский
Minute По оценкам Американского онкологического общества, более 1000 пациентов в Коннектикуте будут диагностированы с меланомой каждый год.В то время как меланома составляет только около 4% случаев рака кожи, она является причиной большинства смертей от рака кожи. Ключ к успеху - раннее обнаружение. При раннем обнаружении меланома легко поддается лечению и хорошо поддается лечению, а новые варианты лечения и хирургические методы оказывают выжившим после меланомы больше помощи, чем когда-либо прежде. В настоящее время в Йельском онкологическом центре, федеральном онкологическом центре Коннектикута, проводятся клинические испытания для тестирования инновационных методов лечения меланомы. Специализированные программы научных исследований и грант по борьбе с раком кожи в Йельском университете, также известный как грант SPORE, помогут разработать национальные руководящие принципы по изменению поведения и профилактике, а также выявлению новых целей в отношении лекарств.Это медицинский протокол, предоставленный вам онкологическим центром Йельского университета как общественная услуга. Более подробная информация доступна на yalecancercenter.org. Вы слушаете WNPR Health Forum в сети общественного вещания Коннектикута.
Уилсон Добро пожаловать обратно в Йельский онкологический центр. Ответы. Это доктор Линн Уилсон, и ко мне присоединилась моя соведущая доктор Франсин Фосс. Сегодня к нам присоединилась доктор Лазова, и мы обсуждаем дерматопатологию. Вы только что упомянули, что для людей было критически важно взглянуть на свою кожу, чтобы провести самообследование, и обратиться к дерматологу для обследования кожи, и в отношении меланомы, рассказать нам, что означают различия A, B, C, D. ?
Лазова Перед этим хочу отметить, что у многих из нас на коже есть доброкачественные и доброкачественные родинки.Это плоские или приподнятые участки кожи розового или коричневого цвета или от бело-коричневого до темно-коричневого цвета. Эти доброкачественные родинки часто присутствуют при рождении или развиваются в детстве или в раннем взрослом возрасте. С другой стороны, меланомы обычно развиваются в зрелом возрасте, и каждый человек должен периодически тщательно осматривать свою кожу. Если они видят бугорки или пигментированные участки, которые увеличиваются, становятся зудящими, меняют цвет или начинают кровоточить, им следует немедленно обратиться к дерматологу.Есть ли у человека меланома или нет и каковы признаки меланомы? Легко запомнить. Правило для меланомы - критерии A, B, C, D. Если на коже есть пигментное пятно, они могут проверить его на A, что означает асимметрию. Если вы проведете воображаемую линию посередине поражения, одна половина должна быть зеркальным отображением другой. Это симметрия. Однако, если одна половина отличается от другой, поражение асимметрично, и это может быть меланома. B обозначает границу. Граница или периферия доброкачественной родинки гладкая и правильная.Напротив, граница меланомы неровная, зубчатая и размытая. C обозначает цвет, доброкачественные родинки имеют однородный цвет. Меланома может быть самых разных цветов, таких как светло-коричневый, темно-коричневый, красный / черный, розовый, белый, синий и даже пурпурный, и, наконец, D означает диаметр или размер поражения. Обычно доброкачественные родинки небольшого размера. Меланомы обычно больше 6 мм или четверти дюйма. Давайте повторим правило A, B, C, D для меланомы. Меланомы бывают A-асимметричными, B-имеют неровную границу, C- имеют
18:28 в mp3-файл http: // yalecancercenter.org / podcasts / 2011_1120_YCC_Answers _-_ Dr_Lazova.mp3 разнообразных цветов в них и D-диаметра, они больше 6 мм или четверти дюйма. Асимметричное поражение с неровной границей, разного цвета и большого размера может быть меланомой, поэтому немедленно обратитесь к врачу, желательно к дерматологу.
Фосс. Можете ли вы рассказать нам, что такое невусы Шпица и как они связаны с меланомой?
Лазова Как я уже упоминала, существует много доброкачественных доброкачественных родинок, невус Шпица - это разновидность доброкачественной родинки.Обычно он развивается у детей или молодых людей. Обычно они развиваются на лице или голенях, часто около колен. Невусы шпица представляют собой плоские или слегка приподнятые шишки, которые могут иметь розовый, коричневый, белый, коричневый или даже темно-коричневый цвет, и они очень быстро растут. Опять же, невусы шпица - это доброкачественные родинки, которые часто развиваются у детей. С другой стороны, как я уже упоминал, меланомы обычно развиваются у взрослых, однако в очень редких случаях у детей может быть меланома, поэтому чрезвычайно важно отличать невус шпица от меланомы у детей.
Уилсон. Часто ли для этого требуется биопсия?
Лазова: Это верно, очень часто бывает важно провести биопсию поражения, чтобы убедиться, что это действительно невус шпица, а не меланома, и во многих случаях, к сожалению, это очень сложно даже под микроскопом при всех наших знаниях и гистопатологических критериях. Очень сложно отличить невус Шпица от меланомы, которая напоминает невус Шпица, мы называем их меланомами шпица. Мы очень глубоко изучаем эти поражения.Мы показываем их друг другу, мы делимся информацией и тщательно изучаем их, и хотя иногда мы отправляем их экспертам по дерматопатологии, которые являются мировыми экспертами, очень трудно с уверенностью предсказать поведение этих поражений. В редких случаях невозможно сказать, является ли поражение доброкачественной родинкой, невусом шпица или меланомой шпица.
Wilson Как у человека развивается невус шпица, и если это то, что у них есть, как это лечить?
Лазова Мы не знаем, почему у нас появляются родинки или невусы шпицев как один из видов родинок.В общем, у нас есть меланоциты в эпидермисе, это самый внешний слой нашей кожи. Эти меланоциты обычно присутствуют в базальном слое эпидермиса. На самом деле они производят меланин - пигмент, придающий цвет нашей коже. Чем больше у нас меланина, тем темнее наша кожа. Мы не знаем точно, что заставляет меланоциты расти, но когда они начинают расти, они образуют эти доброкачественные родинки или невусы, а когда начинают расти большие меланоциты, они образуют невусы Шпица. Под микроскопом меланоциты невусов Шпица очень большие.Они выступают в части, называемой ядром и обильной цитоплазмой, и это остальная часть клетки. Они очень большие и выглядят как раковые клетки, но все же это доброкачественные родинки.
22:31 в mp3-файл http://yalecancercenter.org/podcasts/2011_1120_YCC_Answers_-_Dr_Lazova.mp3
Фосс. Связаны ли они с солнцем, как и другие виды меланомы?
Lazova Нет, это интересная часть, они развиваются у детей, они не развиваются на открытых участках, хотя, можно сказать, лицо выставлено на солнце, но когда они развиваются так рано в детстве, солнце определенно не связано с их развитие.
Уилсон: Вам нужно что-то с ними делать, как с ними обращаются, их нужно удалить, или вы можете просто оставить их в покое?
Лазова. В этой области существуют разногласия: всякий раз, когда дерматолог сталкивается с поражением, которое, как подозревают, является невусом шпица, большую часть времени он проводит биопсию. Мы подтверждаем диагноз, что это действительно невус Шпица, и теперь дерматологи по-разному относятся к его лечению. Большинство дерматологов иссекают поражение, несмотря на то, что мы говорим им, что это невус шпица, потому что в редких случаях, как я уже упоминал, под микроскопом он выглядит как невус шпица, но позже они начинают плохо себя вести как меланомы.Они хотят убедиться, удалив 1 или 2 мм нормальной кожи вокруг невуса шпица, что они удалили ее полностью и снизили вероятность ее плохого поведения.
Фосс Россица, мы немного ранее говорили о некоторых интересных исследованиях, которые вы проводите. Не могли бы вы немного рассказать об этом?
Лазова. Да, я с удовольствием упомяну свое исследование. Как я уже говорил ранее, в редких случаях очень сложно отличить доброкачественный невус шпица от злокачественной спицеидной меланомы, и мы все расстроены этим, и можете ли вы представить себя родителем ребенка с поражением шпицами, и врач скажет вам, что я не уверен, есть ли у вашего ребенка доброкачественная родинка или смертельный рак, и ваш ребенок может умереть от нее.Это очень расстраивает нас и очень расстраивает пациентов и родителей пациентов. Итак, я решил заняться чем-то в этой области, и я изучаю невусы шпица и меланомы шпицоидов с помощью масс-спектрометрии. Это относительно новый метод, который все больше и больше используется в области медицины для изучения различных областей, и я изучил эти поражения с помощью масс-спектрометрии с отличными результатами. Добился большой специфичности и чувствительности. Мне удалось отличить 100 случаев невусов шпица от злокачественной меланомы шпица, поэтому я надеюсь, что это исследование будет очень полезно для врачей в будущем.
Фосс. Не могли бы вы рассказать нам немного об этой методике масс-спектроскопии, которую вы используете, и о том, доступен ли это обычному дерматопатологу?
Лазова. Это совершенно новый подход, и на самом деле меланоцитарные поражения ранее никогда не изучались с помощью масс-спектрометрии. Когда я говорю о меланоцитарных поражениях, я имею в виду фиксированные формалином и залитые парафином срезы тканей, которые я изучаю. Это срезы тканей из биопсии. Свежая ткань имеет
26:11 в mp3-файл http: // yalecancercenter.org / podcasts / 2011_1120_YCC_Answers _-_ Dr_Lazova.mp3 был изучен с помощью масс-спектрометрии, но не с помощью обычных срезов тканей, которые мы используем в повседневной практике патологов и дерматопатологов. Итак, это граница этой новой техники, применяемой в дерматопатологии, и в частности, при меланоцитарных поражениях и невусах шпица. Поэтому он недоступен для обычного практикующего дерматопатолога, однако в настоящее время они могут отправлять интересные случаи в Йельский репозиторий спицоидных новообразований, который я основал три года назад, и там случаи можно изучать с помощью масс-спектрометрии, и я уже получил такие случаи. , один из Чили, один из Швейцарии, данные прислали мне для изучения с помощью масс-спектрометрии, и люди все больше и больше интересуются этой новой техникой, и я надеюсь продолжить работу в этой области и надеюсь помочь.
Уилсон. Вы также являетесь директором программы стипендий, и очевидно, что Йельский университет является крупным академическим центром, и вы проводите исследования, вы предоставляете услуги по клинической патологии, но образование также является важной частью того, что вы делаете? Расскажите нам немного об этом и о программе стипендий?
Лазова Я очень горжусь тем, что являюсь директором отделения дерматопатологии в нашей лаборатории в отделении дерматологии. Я стал директором стипендии более 10 лет назад, и у нас есть один научный сотрудник в год, который занимается дерматопатологией, а со следующего года у нас будут два стипендиата, которые будут обучаться дерматопатологии.Как я уже упоминал, эти стипендиаты могут иметь опыт работы в области патологии или дерматологии, и поэтому они будут проходить обучение в течение шести месяцев либо по патологии, либо по дерматологии, чтобы получить знания в другой области, и они участвуют в преподавательской деятельности на протяжении всего периода обучения. Они учатся у нас на многоголовом микроскопе. Помимо стипендиатов, мы также обучаем ординаторов патологов и дерматологов. У нас всегда есть приезжие студенты-медики, приезжие жители со всей страны, у нас есть приезжие врачи со всего мира.Прямо сейчас у нас есть врач-дерматолог из Таиланда. У нас был кто-то из Турции, который только что уехал, и это было невероятное международное участие.
Доктор Россица Лазова - адъюнкт-профессор дерматологии и патологии и директор стипендии дерматопатологов Йельского университета.


