|
Рязанцева Н.В., Новицкий В.В., Агарков А.П., Степовая Е.А,
|
монография
|
Патология клеточных мембран при шизофрении
|
Томск, Изд-во ТГУ
|
2004
|
|
Акбашева О.Е., Позднякова И.А.
|
учебное пособие
|
Лекции по биохимии для студентов заочного отделения фармацевтического факультета СибГМУ
|
Томск, Изд-во СибГМУ
|
2005
|
|
Мамонтова И.П, Жаворонок Т.В., Акбашева О.Е., Тимин О.А., Дюкова Е.В., Кравченко А.И.
|
учебное пособие
|
Основы техники лабораторных работ в биохимии
|
Томск, Изд-во ТПУ
|
2005
|
|
КанскаяН.
|
учебное пособие
|
Интерпретация результатов основных лабораторных методов исследования в клинической практике
|
Томск, Изд-во «Ацтек»
|
2004
|
|
Серебров В.Ю., Федорова Тс., Кузьменко Д.И., Канская Н.В., Степовая Е.А., Акбашева О.Е., Климентьева Т.К., Мамонтова И.П., Тимин О.А., Тырышкин А.М., Позднякова И.А., Жаворонок Т.В.
|
Учебное пособие
|
Трудные вопросы биохимии (избранные лекции по общей и частной биохимии)
|
Томск, СибГМУ
|
2006
|
|
Евтушенко. И.Д., Удинцев С.Н., Краснов Е.А., Серебров В.Ю.
|
монография
|
Климактерический синдром и методы его негормональной коррекции
|
.
|
2006
|
|
Каракулова Е.В., Степовая Е.А., Федорова Т.С.
|
Учебное пособие
|
Витамины и микроэлементы
|
Томск
|
2005
|
|
Канская Н.В., Жаворонок Т.В., Рязанцева Н.В., Цыров Г.И., Бодрова Т.Н., Тетенев Ф.Ф, Серебров В.Ю., Черногорюк Г.Э., Байков А.Н., Позднякова И.А.
|
Учебно-методическое пособие
|
Интерпретация результатов основных лабораторных методов исследования в клинической практике
|
Томск: СибГМУ, Ацтек
|
2006
|
|
Суханова Г.А., Акбашева О.Е.
|
Учебно-методическое пособие
|
Апоптоз
|
Томск: Изд-во ТПУ
|
2006
|
|
Шевцова Н.
|
Монография
|
Ультрадисперсные порошки цирконата-титаната свинца: молекулярные и клеточные эффекты
|
Томский университет
|
2007
|
|
Кузьменко Д.И., Серебров В.Ю., Удинцев С.Н.
|
Учебное пособие
|
Свободнорадикальное окисление липидов, активные формы кислорода и антиоксиданты: роль в физиологии и патологии клетки
|
Томский политехнический университет
|
2007
|
|
Серебров В.Ю., Федорова Т.С., Канская Н.В., Суханова Г.А., Степовая Е.А., Кузьменко Д.И., Удинцев С.Н., Иванов В.В., Акбашева О.Е., Тимин О.А., Сереброва М.А,, Позднякова И.А.
|
Коллективная монография
|
Ожирение и нарушение метаболизма липидов
|
Томский политехнический университет
|
2008
|
Что означает показатель общего белка крови? Лекция для врачей
Термин клинической биохимии «общий белок крови» представляет собой сумму всех белков, находящихся в крови на момент анализа.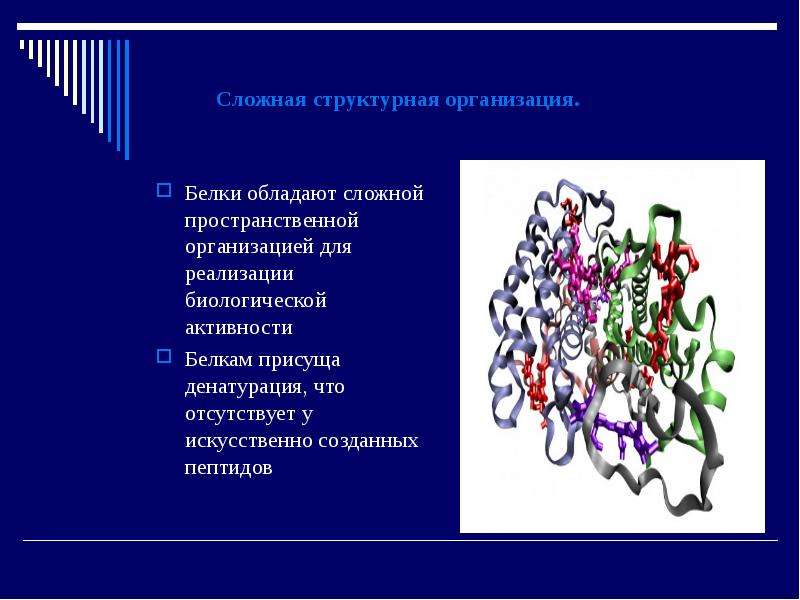 В норме он должен равняться 100 г/л. Хотя в большинстве справочников предлагается стандартный норматив — 65—85 г/л. Но в этом «нормативе» заведомо содержится непонимание очевидного: количество всех белков, находящихся в крови на момент анализа, — жесткая генетическая константа. В норме она не может иметь столь явный индивидуальный разброс. Почему?
В норме он должен равняться 100 г/л. Хотя в большинстве справочников предлагается стандартный норматив — 65—85 г/л. Но в этом «нормативе» заведомо содержится непонимание очевидного: количество всех белков, находящихся в крови на момент анализа, — жесткая генетическая константа. В норме она не может иметь столь явный индивидуальный разброс. Почему?
Дадим на этот вопрос сугубо биологический ответ. В организме тотально синтезируется около 100 000 белков. Общий белок, как вершина этого айсберга, свидетельствует о генетико-физиологическом благополучии.
В крови можно определить около 100 белков. Весь геном (примерно 8000 генов) представляет собой отрезок ДНК, который мысленно можно «вытянуть» во весь рост человека и даже больше. Его длина -2 м. Гены упакованы в 46 хромосом и дают с этой ДНК информацию обо всех реально синтезирующихся 100 000 белков.
В разных клетках работает разное число генов. Самая примитивная клетка — эритроцит — не имеет ядра, а значит, не имеет и генов. Но ее предшественник ретикулоцит располагает восьмью генами. Самое же большое количество функционирующих генов — в нервных клетках: 1560 генов в одном нейроне. (В клетке печени — гепатоците — 300 генов, в почечной клетке — 800 генов.) Чем больше генов, тем больше требуется аминокислот и белков. Поэтому у нервной системы сила, отсасывающая аминокислоты, не сравнима ни с каким другим живым функциональным аппаратом. Ее можно сравнить с самым мощным пылесосом! В связи с этим потенциально в физиологическом отношении в целостном организме всегда существует нехватка аминокислот, и особенно этот дефицит ощущает мозг.
Но ее предшественник ретикулоцит располагает восьмью генами. Самое же большое количество функционирующих генов — в нервных клетках: 1560 генов в одном нейроне. (В клетке печени — гепатоците — 300 генов, в почечной клетке — 800 генов.) Чем больше генов, тем больше требуется аминокислот и белков. Поэтому у нервной системы сила, отсасывающая аминокислоты, не сравнима ни с каким другим живым функциональным аппаратом. Ее можно сравнить с самым мощным пылесосом! В связи с этим потенциально в физиологическом отношении в целостном организме всегда существует нехватка аминокислот, и особенно этот дефицит ощущает мозг.
Движение аминокислот к мозгу напоминает движение электро-поездов в час пик. В онтогенезе в процессе жизнедеятельности мозг развивается. И чем интенсивнее протекает его развитие, тем большая у него потребность в аминокислотах. Ведь серое вещество, синапсы — это не что иное, как аминокислоты и белки. В организме взрослого человека уровень белка в физиологических условиях не может претерпевать резких колебаний. В белке всегда есть хоть небольшой дефицит.
В белке всегда есть хоть небольшой дефицит.
Образование одной пептидной связи (для соединения белков из аминокислот) требует около 15 молекул АТФ — это очень энергоемкий процесс. Исчезновение из крови 1 г белка означает потерю 30 г белка в тканях. Если из крови уйдет 2 г белка, то из тканей исчезнет тоже в два раза больше — 60 г белка, 3 г повлекут за собой потерю 90 г, 4 г — 120 г и т.д. Поэтому еще раз подчеркнем, что общий белок крови в норме не может иметь значительный разброс значений, если человек:
а) хорошо питается,
б) не болеет,
в) созрел, является взрослым.
В этом случае величина общего белка крови жестко генетически детерминирована.
Отсюда следует, что если у двух больных при прочих равных условиях уровень общего белка различен, то это чаще всего следует рассматривать как признак благополучия в одном случае и признак резкого неблагополучия — в другом. Лучше иметь высокое значение общего белка, чем низкое. Например, число 85 лучше, чем 65, так как 65 указывает на дефицит:
— иммунной системы;
— системы комплемента;
— бактерицидной белковой системы;
— системы транспорта жиров.
Книга «Правила чтения биохимического анализа»
Руководство предназначено врачу любой специальности. Изучение медицинской биохимии читателю предложено начать с отбора и врачебного осмысления той информации из фундаментальной биохимии, которая необходима врачу для практического использования в конкретной ситуации с конкретным пациентом. Одновременно эта информация должна дать ориентиры на глубинное (вплоть до молекулярного уровня) понимание патологии с учетом основных биохимических процессов, которые более известны в теории как патогенетические механизмы и редко упоминаются (хотя непременно должны упоминаться) в практике врача.
Семнадцать правил чтения биохимического анализа представлены в виде текста, цветных иллюстрированных схем, кратких формул и комментариев, что делает медицинский курс доходчивым для широкого круга читателей: студентов медицинских университетов, академий, факультетов, врачей, научных сотрудников, абитуриентов. Книга адаптирована для любознательного человека, который интересуется собственным организмом, хочет иметь современные научные представления о самом себе.
Руководство подготовлено главным научным сотрудником НИИ общей патологии и патофизиологии РАМН, ведущим научным сотрудником ЦНИИ эпидемиологии Роспотребнадзора РФ, д.м.н. Игорем Михайловичем Рослым.
Купить книгу «Правила чтения биохимического анализа»
Содержание книги «Правила чтения биохимического анализа»
Правило 1. Введение в медицинскую биохимию
Правило 2. Ферменты крови для биохимического анализа
Правило 3. ACT и переаминирование
Правило 4. АЛТ Глюкозо-аланиновый шунт
Правило 5. Биологический смысл работы двух трансаминаз: ACT и АЛТ
Правило 6. ГГТ — фермент мембранного транспорта аминокислот
Правило 7. Показатель общего белка крови
Правило 8. Молекулярные процессы реализации генотипа в фенотипе и их нарушения
Правило 9. Строение белков как иллюстрация их структурнофункциональной роли в формировании живых систем
Правило 10. Альбумины, мочевина и креатин — показатели катаболизма
Правило 11. Роль аминокислот в обеспечении церебральных процессов при нормальной активности головного мозга
Роль аминокислот в обеспечении церебральных процессов при нормальной активности головного мозга
Правило 12. Основные ферменты крови
Правило 13. Что важно знать врачу о холестерине
Правило 14. Щелочная фосфотаза
Правило 15. Лактатдегидрогеназа
Правило 16. Креатинфосфокиназа
Правило 17. Энергетический обмен
Правило 18. Алгоритм биохимического анализа, производимого врачом
Правило 19. Интеграция метаболических и энзимологических показателей («энзимо-метаболический веер»)
Правило 20. Гомеокинез
Биохимические исследования
Биохимические исследования – обширный раздел лабораторных исследований, включающий определение содержания различных органических и неорганических веществ, образующихся в результате биохимических реакций, а также измерение активности ферментов в сыворотке, плазме, крови, моче, ликворе и других биологических жидкостях.
Биохимические анализы отражают функциональное состояние различных органов и систем, дают представление о состоянии обмена веществ.
Биохимические маркеры в зависимости от того, какой вид обмена они характеризуют, делят на следующие группы:
- Маркеры белкового обмена — общий белок и белковые фракции: альбумин, ?-глобулины классов IgA, IgM, IgG
- Маркеры углеводного обмена – глюкоза сыворотки крови и мочи, глюкоза крови методом непрерывного мониторирования, гликозилированный гемоглобин
- Маркеры липидного обмена — холестерин, триглицериды, липидограмма (ЛПВП, ЛПОНП, ЛПНП), коэффициент атерогенности
Также выделяют группы биохимических тестов, необходимых для диагностики нарушений функционирования того или иного органа:
- Показатели функции печени и желчевыводящих путей — билирубин (общий, прямой, непрямой), аминотрансферазы (АлТ, АсТ), лактатдегидрогеназа (ЛДГ), гамма-глютамилтрансфераза (ГГТ), щелочная фосфатаза
- Показатели функции почек – электролиты (натрий, калий, хлор), мочевина, креатинин, мочевая кислота в сыворотке крови и моче, клиренс креатинина (проба Реберга), белок, альбумин мочи
- Показатели функции поджелудочной железы — ? — амилаза сыворотки крови и мочи, липаза сыворотки крови
- Маркеры кардиопатологии — креатинкиназа общая (КФК), изофермент креатинкиназы (КФК-МВ), миоглобин, тропонин I, ЛДГ, АСТ
- Диагностические маркеры анемий – железо сыворотки, общая железосвязывающая способность сыворотки (ОЖСС), трансферрин, коэффициент насыщения трансферрина железом, ферритин
- Маркеры острой фазы воспаления — прокальцитонин, С — реактивный белок (СРБ)
- Маркеры остеопороза – щелочная фосфатаза, фосфор, кальций
- Показатели водно-электролитного обмена — калий, кальций, натрий, магний, фосфор, хлориды в сыворотке крови и моче
- Исследования кислотно-основного состояния, газового состава и метаболитов крови — водородный показатель (рН), осмолярность, лактат, электролиты, бикарбонаты крови, общий диоксид углерода
Биохимические исследования выполняются на автоматическом биохимическом анализаторе.
Отделение лабораторной диагностики НМИЦ онкологии им. Н.Н. Петрова оснащено самым современным оборудованием для исследований.
Оптимальное время для сдачи крови на исследование утреннее, не ранее 8 часов после последнего приема пищи. За 3 дня до сдачи анализов желательно исключить употребление жирной пищи и алкоголя, а накануне исключить чрезмерные физические нагрузки. В день сдачи анализа не рекомендуется курение.
Готовность результатов исследований в НМИЦ онкологии им. Н.Н. Петрова в течение суток.
|
КОММЕНТАРИИ К ЛЕКЦИЯМ : |
|
|
|
● ● |
|
● |
|
● ● Статья USA Today об устойчивости сорняков к округлению
● ● Выпуск патента Monsanto |
|
|
|
● |
|
|
|
● |
|
Введение в ферменты |
|
|
|
●
● |
|
● Ключ к практическим задачам кинетики |
|
● |
|
|
|
|
|
|
|
|
|
|
|
|
|
● ● |
|
|
|
Лекция 31: Пентозофосфатный путь (НЕ ДЛЯ 2013 г.  ) ) |
|
● |
|
● |
|
● ● |
Глава 2: Структура белка — химия
Глава 2: Структура белка
2.1 Структура и свойства аминокислот
2. 2 Образование пептидной связи и структура первичного белка
2 Образование пептидной связи и структура первичного белка
2.3 Структура вторичного белка
2.4 Супервторичная структура и белковые мотивы
2,5 Структура третичного и четвертичного белка
2.6 Сворачивание, денатурация и гидролиз белков
2.7 Ссылки
2.1 Структура и свойства аминокислот
Белки являются одними из наиболее распространенных органических молекул в живых системах и обладают самым разнообразным набором функций среди всех макромолекул. Белки могут быть структурными, регуляторными, сократительными или защитными; они могут служить для транспортировки, хранения или перепонки; или они могут быть токсинами или ферментами. Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию. Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Их структуры, как и их функции, сильно различаются.Однако все они представляют собой полимеры альфа-аминокислот, расположенные в линейной последовательности и связанные друг с другом ковалентными связями.
Структура альфа-аминокислот
Основными строительными блоками белков являются альфа (α) аминокислот . Как следует из их названия, они содержат функциональную группу карбоновой кислоты и функциональную группу амина. Обозначение альфа используется, чтобы указать, что эти две функциональные группы отделены друг от друга одной углеродной группой.Помимо амина и карбоновой кислоты, альфа-углерод также присоединен к водороду и одной дополнительной группе, которая может различаться по размеру и длине. На схеме ниже эта группа обозначена как R-группа. В живых организмах в качестве строительных блоков белка используются 20 аминокислот. Они отличаются друг от друга только положением R-группы. Основная структура аминокислоты показана ниже:
Рисунок 2. 1 Общая структура альфа-аминокислоты
1 Общая структура альфа-аминокислоты
Всего 20 альфа-аминокислот, которые обычно включаются в белковые структуры (рисунок 2.Икс). Различные R-группы имеют разные характеристики в зависимости от природы атомов, включенных в функциональные группы. Есть R-группы, которые преимущественно содержат углерод и водород и очень неполярны или гидрофобны. Другие содержат полярные незаряженные функциональные группы, такие как спирты, амиды и тиолы. Некоторые аминокислоты являются основными (содержащие функциональные аминогруппы) или кислотными (содержащими функциональные группы карбоновых кислот). Эти аминокислоты способны образовывать полные заряды и могут взаимодействовать с ионами.Каждая аминокислота может быть сокращена с использованием трехбуквенного и однобуквенного кода.
Рис. 2.2 Структура 20 альфа-аминокислот, используемых в синтезе белка. R-групп обозначены обведенными / окрашенными участками каждой молекулы. Цвета указывают на определенные классы аминокислот: гидрофобные — зеленый и желтый, гидрофильные полярные незаряженные — оранжевый, гидрофильные кислые — синие, гидрофильные основные — розовые.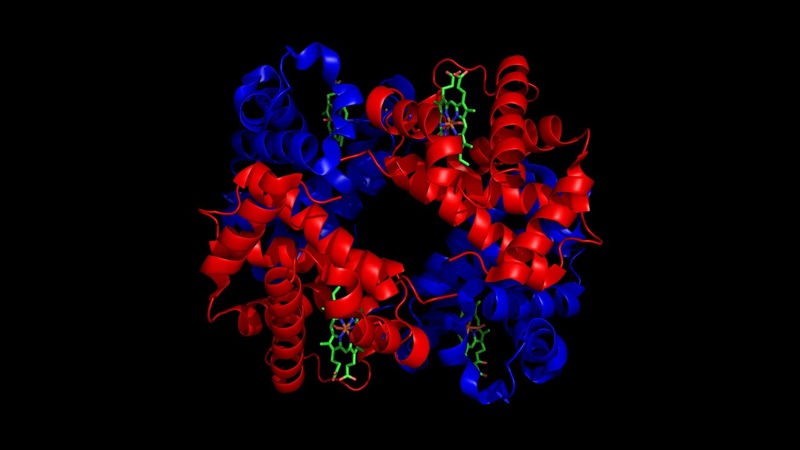
Щелкните здесь, чтобы загрузить версию таблицы аминокислот
Неполярные (гидрофобные) аминокислоты
Неполярные аминокислоты можно в значительной степени подразделить на два более конкретных класса: алифатические аминокислоты , и ароматические аминокислоты , . алифатических аминокислот (глицин, аланин, валин, лейцин, изолейцин и пролин) обычно содержат разветвленные углеводородные цепи, от простейших — от глицина до более сложных структур лейцина и валина. Пролин также классифицируется как алифатическая аминокислота, но обладает особыми свойствами, поскольку углеводородная цепь циклизована с концевым амином, создавая уникальную 5-членную кольцевую структуру. Как мы увидим в следующем разделе, посвященном первичной структуре, пролин может значительно изменить трехмерную структуру из-за структурной жесткости кольцевой структуры, когда он включен в полипептидную цепь и обычно обнаруживается в областях белка, где возникают складки или повороты.
Ароматические аминокислоты , (фенилаланин, тирозин и триптофан), , как следует из их названия, содержат ароматические функциональные группы в своей структуре, что делает их в значительной степени неполярными и гидрофобными из-за высокого содержания углерода / водорода. Однако следует отметить, что гидрофобность и гидрофильность представляют собой скользящую шкалу, и каждая из различных аминокислот может иметь разные физические и химические свойства в зависимости от своей структуры. Например, гидроксильная группа, присутствующая в тирозине, увеличивает его реакционную способность и растворимость по сравнению с фенилаланином.
Метионин, одна из серосодержащих аминокислот обычно классифицируется как неполярные, гидрофобные аминокислоты, поскольку концевая метильная группа создает функциональную группу тиоэфира, которая обычно не может образовывать постоянный диполь внутри молекулы и сохраняет низкую растворимость.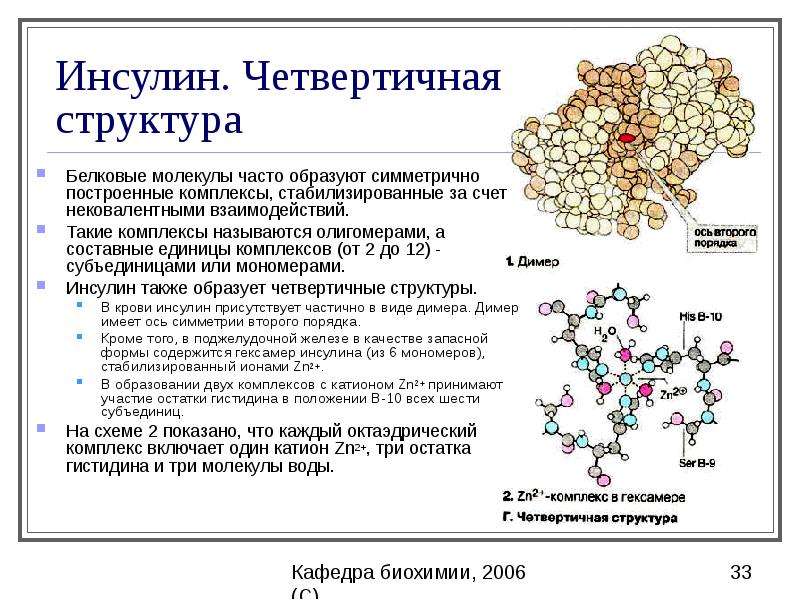
Полярные (гидрофильные) аминокислоты
Полярные гидрофильные аминокислоты можно подразделить на три основных класса: полярные незаряженные, кислотные и основные функциональные группы.В пределах полярного незаряженного класса боковые цепи содержат гетероатомы (O, S или N), которые способны образовывать постоянные диполи в R-группе. К ним относятся гидроксил- и сульфоксил-содержащие аминокислоты, серин, треонин и цистеин и амидсодержащие аминокислоты , глутамин и аспаригин. Две аминокислоты, глутаминовая кислота (глутамат) и аспарагиновая кислота (аспартат) составляют кислые аминокислоты и содержат боковые цепи с функциональными группами карбоновых кислот, способными полностью ионизироваться в растворе.Основные аминокислоты , лизин, аргинин и гистидин содержат функциональные аминогруппы, которые можно протонировать для обеспечения полного заряда.
Многие из аминокислот с гидрофильными R-группами могут участвовать в активном сайте ферментов. Активный центр — это часть фермента, которая напрямую связывается с субстратом и осуществляет реакцию. Белковые ферменты содержат каталитических групп , состоящих из R-групп аминокислот, которые способствуют образованию и разрушению связей.Аминокислоты, которые играют значительную роль в специфичности связывания активного сайта, обычно не соседствуют друг с другом в первичной структуре, а образуют активный сайт в результате сворачивания при создании третичной структуры, как вы увидите позже в глава.
Белковые структуры, построенные из основных аминокислот, могут состоять из сотен аминокислот. Таким образом, для простоты 20 аминокислот, используемых для синтеза белка, имеют аббревиатуры как трехбуквенного, так и однобуквенного кода (Таблица 2.1). Эти сокращения обычно используются для обозначения белковых последовательностей в биоинформатических и исследовательских целях.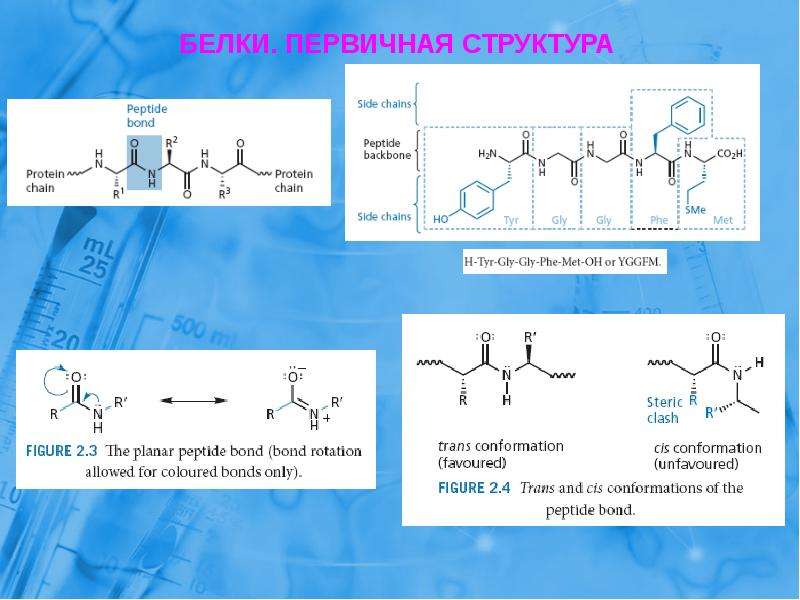
Таблица 2.1 Аббревиатуры α-аминокислот
Мысленный вопрос: Триптофан содержит функциональную группу амина, почему триптофан не является основным?
Ответ: Триптофан содержит индольную кольцевую структуру, которая включает функциональную группу амина. Однако из-за близости и электроноакцепторной природы ароматической кольцевой структуры неподеленная пара электронов на азоте недоступна для принятия протона.Вместо этого они участвуют в образовании связей p- в нескольких различных резонансных структурах, возможных для индольного кольца. На рис. 2.3A показаны четыре возможные резонансные структуры для индола. И наоборот, в структуре имидазольного кольца, обнаруженной в гистидине, есть два атома азота, один из которых участвует в образовании резонансных структур (азот № 1 на рисунке 2.3B) и не может принимать протон, а другой (азот № 3 ), которая имеет неподеленную пару электронов, которая может принять протон.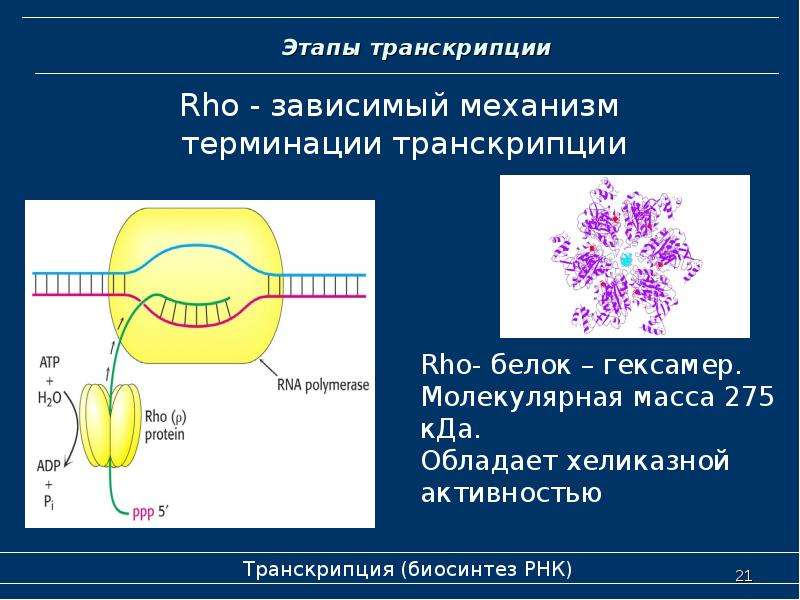
Рис. 2.3 Сравнение структурной доступности неподеленной пары электронов на азоте для принятия протона в кольцевой структуре индола и иммидизола . (A) Показаны четыре резонансные структуры индольной кольцевой структуры, демонстрирующие, что неподеленная пара электронов на азоте участвует в образовании pi -связей. (B) Кольцевая структура имидазола имеет один азот (1), который участвует в резонансных структурах (не показаны) и не может принимать протон, в то время как второй азот (3) имеет неподеленную пару электронов, доступных для принятия протона. как показано.
Работай самостоятельно:
В приведенном выше примере опишите с помощью химической диаграммы, почему амидные атомы азота, содержащиеся в аспарагине и глутамине, не являются основными.
Альфа-аминокислоты — хиральные молекулы
Если вы изучите структуру альфа-углерода в каждой из аминокислот, вы заметите, что все аминокислоты, за исключением глицина, являются хиральными молекулами (Рисунок 2. 4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Подобно левой и правой руке с большим пальцем и пальцами в одном и том же порядке, но они являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же элементы в одном и том же порядке, но они являются зеркальными, а не одинаковыми. Варианты зеркального отображения хиральных молекул имеют физические свойства, которые почти идентичны друг другу, что очень затрудняет их различение или разделение.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются способом вращения поляризованного света, а также тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.
4) Хиральная молекула — это молекула, которая не накладывается на свое зеркальное отображение. Подобно левой и правой руке с большим пальцем и пальцами в одном и том же порядке, но они являются зеркальными, а не одинаковыми, к хиральным молекулам прикреплены одни и те же элементы в одном и том же порядке, но они являются зеркальными, а не одинаковыми. Варианты зеркального отображения хиральных молекул имеют физические свойства, которые почти идентичны друг другу, что очень затрудняет их различение или разделение.Из-за этой природы им дано специальное название стереоизомера — энантиомеры , и фактически сами соединения получили такое же название! Эти молекулы действительно различаются способом вращения поляризованного света, а также тем, как они реагируют и взаимодействуют с биологическими молекулами. Молекулы, вращающие свет в правостороннем направлении, называются правовращающими и обозначаются буквой D. Молекулы, которые вращают свет в левом направлении, называются левовращающими и обозначаются буквой L, чтобы отличить один энантиомер от другого.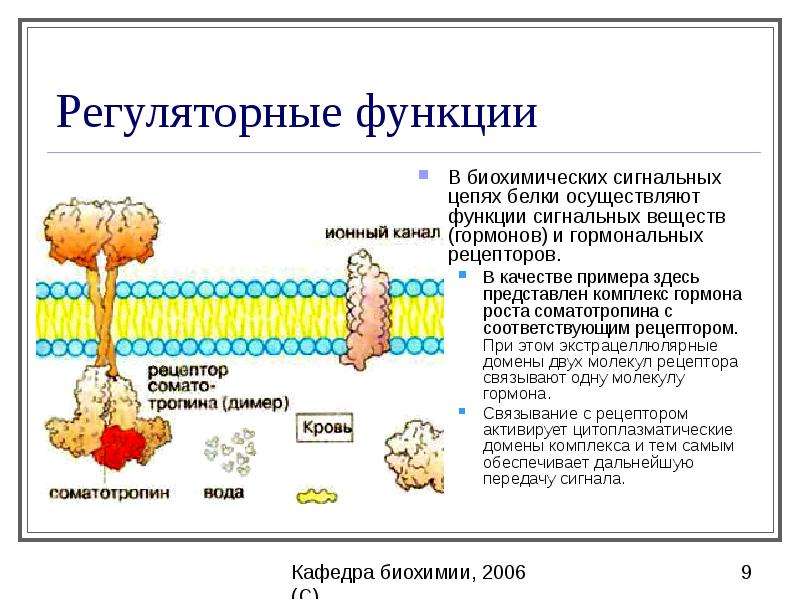 D- и L-формы аланина показаны на рисунке 2.4B.
D- и L-формы аланина показаны на рисунке 2.4B.
Хотя большинство аминокислот могут существовать как в левосторонней, так и в правосторонней формах, жизнь на Земле состоит почти исключительно из левосторонних аминокислот. Протеогенные аминокислоты, включенные в белки рибосомами, всегда находятся в L-конформации. Некоторые бактерии могут включать D-аминокислоты в пептиды, не кодируемые рибосомами, но D-аминокислоты в природе используются редко. Интересно, что когда мы обсудим структуру сахаров в главе XX, мы обнаружим, что сахара, которые включены в углеводные структуры, почти исключительно находятся в D-конформации.Никто не знает, почему это так. Однако доктор. Джон Кронин и Сандра Пиццарелло показали, что из аминокислот, которые падают на Землю из космоса на метеоритах, больше находится в L-конформации, чем в D-конформации. Таким образом, то, что мы состоим преимущественно из L-аминокислот, может быть связано с аминокислотами из космоса.
Почему аминокислоты в космосе благоприятствуют L-конформации? Никто точно не знает, но известно, что излучение также может существовать в левосторонней и правосторонней формах. Итак, существует теория под названием гипотеза Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Итак, существует теория под названием гипотеза Боннера , которая предполагает, что преобладающие формы излучения в космосе (т. Е.от вращающейся нейтронной звезды, например) может привести к селективному образованию гомохиральных молекул, таких как L-аминокислоты и D-сахара. Это все еще спекулятивно, но недавние открытия метеоритов делают эту гипотезу гораздо более правдоподобной.
Рисунок 2.4 Хиральность аминокислот. За исключением простейшей аминокислоты, глицина, все другие аминокислоты, которые включены в белковые структуры, имеют хиральную природу. (A) Демонстрирует хиральность структуры основной альфа-аминокислоты при использовании неспецифической R-группы.(B) Пара энантиомеров D- и L-аланина, верхняя диаграмма представляет модель шара и клюшки, а нижняя диаграмма представляет линейную структуру.
Изображение (A) из NASA
Обратите внимание, что обозначения D и L — это особые термины, используемые для того, как молекула вращает простой поляризованный свет. Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию. E.грамм. R или S , имея в виду Rectus или Sinister соответственно.
Это не означает абсолютную стереоконфигурацию молекулы. Абсолютная конфигурация относится к пространственному расположению атомов хирального молекулярного объекта (или группы) и его стереохимическому описанию. E.грамм. R или S , имея в виду Rectus или Sinister соответственно.
Абсолютные конфигурации хиральной молекулы (в чистом виде) чаще всего получают с помощью рентгеновской кристаллографии. Альтернативными методами являются оптическая вращательная дисперсия, колебательный круговой дихроизм, использование реагентов хирального сдвига в протонном ЯМР и визуализации кулоновского взрыва. После получения абсолютной конфигурации назначение R или S основано на правилах приоритета Кана – Ингольда – Прелога, , которые можно просмотреть, перейдя по ссылке и на рисунке 2.5. Все хиральные аминокислоты, кроме цистеина, также находятся в S-конформации. Цистеин содержит атом серы, из-за чего R-группа имеет более высокий приоритет, чем функциональная группа карбоновой кислоты, что приводит к R-конформации для абсолютной стереохимии.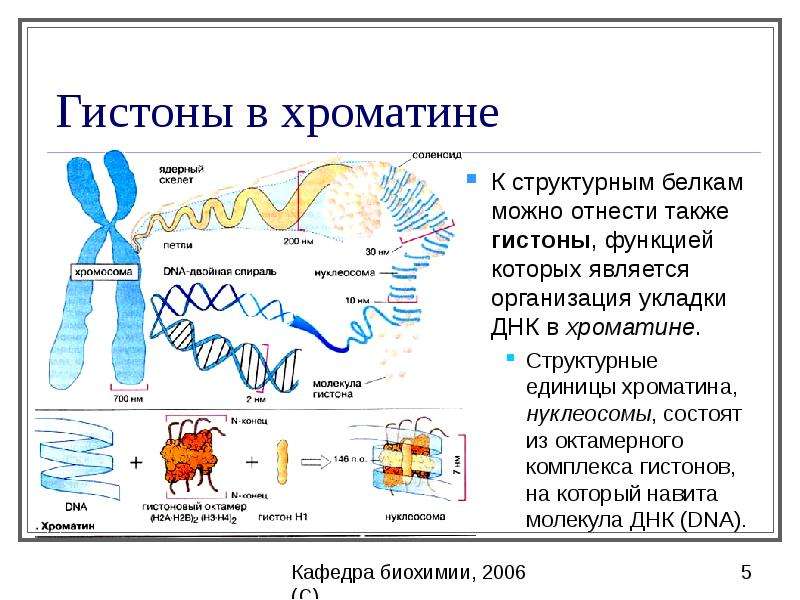 Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Однако цистеин действительно вращает простой поляризованный свет в левовращающем или левовращающем направлении. Таким образом, R- и S-обозначения не всегда соответствуют D- и L-конформации.
Рисунок 2.5 Абсолютная конфигурация определяется обозначениями Rectus (R) и Sinister (S). В системе Кан-Ингольда Прелога для наименования хиральных центров группы, присоединенные к хиральному центру, ранжируются в соответствии с их атомным номером, причем наивысший атомный номер получает наивысший приоритет (A на диаграмме выше), а наименьший атомный номер получает наименьший приоритет (D на диаграмме выше). Затем наблюдатель с самым низким приоритетом направляет молекулу в сторону, чтобы правильно сориентировать молекулу для дальнейшей оценки.Затем отслеживается путь приоритетов №1, №2 и №3 (соответствующих A, B и C выше). Если путь идет по часовой стрелке, хиральному центру присваивается R-обозначение, тогда как если путь идет против часовой стрелки, ему присваивается S-обозначение.
Изображение из Википедия
Аминокислоты — цвиттерионы
В химии цвиттерион представляет собой молекулу с двумя или более функциональными группами, из которых по крайней мере одна имеет положительный, а другая отрицательный электрический заряд, а суммарный заряд всей молекулы равен нулю при определенном pH.Поскольку они содержат по крайней мере один положительный и один отрицательный заряд, цвиттерионы также иногда называют внутренними солями . Заряды на различных функциональных группах уравновешивают друг друга, и молекула в целом может быть электрически нейтральной при определенном pH. PH, при котором это происходит, известен как изоэлектрическая точка .
В отличие от простых амфотерных соединений, которые могут образовывать только или катионные или анионные частицы, цвиттерион одновременно имеет оба ионных состояния.Аминокислоты являются примерами цвиттерионов (рис. 2.6). Эти соединения содержат аммонийную и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
2.6). Эти соединения содержат аммонийную и карбоксилатную группы, и их можно рассматривать как возникающие в результате своего рода внутримолекулярной кислотно-основной реакции: аминогруппа депротонирует карбоновую кислоту.
Рисунок 2.6 Аминокислоты — это цвиттерионы. Аминокислота содержит как кислотные (фрагмент карбоновой кислоты), так и основные (фрагмент амина) центры. Изомер справа — это цвиттерионная форма.
Поскольку аминокислоты являются цвиттерионами, а некоторые из них также содержат потенциал для ионизации в своих R-группах, их состояние заряда in vivo , и, таким образом, их реакционная способность может варьироваться в зависимости от pH, температуры и статуса сольватации локальных микросреда, в которой они расположены.Таблица стандартных значений pK и для аминокислот показана в таблице 2.1 и может использоваться для прогнозирования состояния ионизации / заряда аминокислот и получаемых ими пептидов / белков.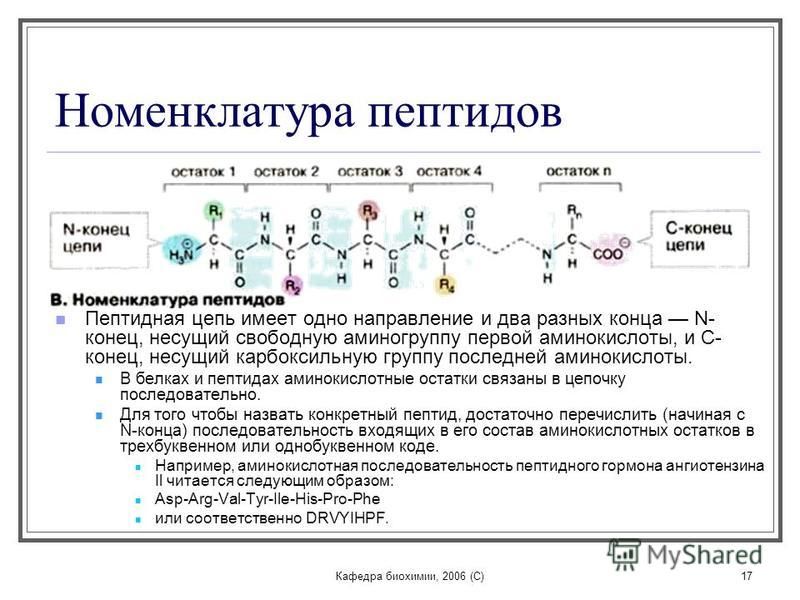 Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK и этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Однако следует отметить, что статус сольватации в микроокружении аминокислоты может изменять относительные значения pK и этих функциональных групп и обеспечивать уникальные реактивные свойства в активных центрах ферментов (таблица 2.1). Более подробное обсуждение эффектов десольватации будет дано в главе XX, посвященной механизмам ферментативных реакций.
Таблица 2.1
Версия для печати значений pKa
Как видно из таблицы 2.1, семь аминокислот содержат R-группы с ионизируемыми боковыми цепями и обычно находятся в активных центрах ферментов. Напомним, что pK a определяется как pH, при котором ионизированная и неионизированная формы ионизируемой функциональной группы в молекуле существуют в равных концентрациях. Таким образом, когда функциональная группа сдвигается выше или ниже ее значения pK на , произойдет сдвиг в концентрациях ионизированных и неионизированных форм в пользу одного состояния по сравнению с другим. На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
На рис. 2.7 показаны различные R-группы в их неионизированном и ионизированном состояниях и их предпочтительные состояния выше или ниже значения pK a .
Рис. 2.7 Ионизируемые функциональные группы в обычных аминокислотах. Во всех аминокислотах как функциональная группа карбоновой кислоты (C-конец), так и функциональная группа амина (N-конец) способны к ионизации. Кроме того, семь аминокислот (аспарагиновая кислота, глутаминовая кислота, аргинин, гистидин, лизин, тирозин и цистеин) также содержат ионизируемые функциональные группы в своих R-группах.Предпочтительные состояния функциональной группы показаны либо выше, либо ниже их соответствующих значений pK a .
Обычно ионизируемая группа будет благоприятствовать протонированному состоянию в условиях pH ниже ее соответствующих значений pK a и будет благоприятствовать депротонированному состоянию в условиях pH выше ее соответствующего значения pK a . Таким образом, значения pK a могут использоваться для помощи в прогнозировании общих зарядовых состояний аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Таким образом, значения pK a могут использоваться для помощи в прогнозировании общих зарядовых состояний аминокислот и их результирующих пептидов / белков в определенной среде.Например, если мы посмотрим на кривую титрования основной аминокислоты, гистидина (рис. 2.8). При достижении каждого pK a состояние заряда аминокислоты изменяется в пользу депротонированного состояния. Таким образом, гистидин будет медленно прогрессировать от общего заряда +2 при очень низком pH (полностью протонированный) до общего заряда -1 при очень высоком pH (полностью депротонирован).
Рис. 2.8. Состояние ионизации гистидина в средах с различным pH. (A) Кривая титрования гистидина от низкого pH до высокого pH.Указывается каждая точка эквивалентности (pK a ). (B) Показывает благоприятное состояние ионизации гистидина после прохождения каждого pK значения .
Изображение адаптировано из L. Van Warren
Дополнительная практика:
Изобразите глутаминовую кислоту и спрогнозируйте общее состояние заряда аминокислоты при pH = 1, pH = 3, pH = 7 и pH = 12.
Образование цистеиновой и дисульфидной связи
Цистеин также является уникальной аминокислотой, поскольку эта боковая цепь способна подвергаться обратимой окислительно-восстановительной ( редокс ) реакции с другими остатками цистеина, создавая ковалентную дисульфидную связь в окисленном состоянии (Рисунок 2.9). Вспомните, что когда молекулы окисляются, они теряют электроны, а когда молекулы восстанавливаются, они приобретают электроны. Во время биологических окислительно-восстановительных реакций ионы водорода ( протонов, ) часто удаляются с электронами из молекулы во время окисления и возвращаются во время восстановления. Таким образом, если реакция теряет или набирает протоны, это хороший признак того, что она также теряет или приобретает электроны и что происходит окислительно-восстановительная реакция.Таким образом, получение или потеря протонов может быть простым способом идентифицировать этот тип реакции.
Дисульфидные связи являются неотъемлемой частью образования трехмерной структуры белков и поэтому могут сильно влиять на функцию получаемого белка. В клеточных системах образование / разрыв дисульфидной связи является ферментно-опосредованной реакцией и может использоваться в качестве механизма для контроля активности белка. Дисульфидные связи будут обсуждаться более подробно в разделе 2.xx данной главы и в главе XX.
Рис. 2.9. Цистеин может окисляться с образованием дисульфидных связей. Во время образования дисульфидной связи два цистеина окисляются с образованием молекулы цистина. Это требует потери двух протонов и двух электронов.
обратно наверх
2.2 Образование пептидных связей и структура первичного белка
В клеточных системах белки связаны между собой большим ферментным комплексом, который содержит смесь РНК и белков.Этот комплекс называется рибосомой . Таким образом, поскольку аминокислоты связаны друг с другом с образованием определенного белка, они размещаются в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно рассмотрен в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Таким образом, поскольку аминокислоты связаны друг с другом с образованием определенного белка, они размещаются в очень определенном порядке, который диктуется генетической информацией, содержащейся в молекуле информационной РНК (мРНК). Этот специфический порядок аминокислот известен как первичная последовательность белка . Механизм трансляции, используемый рибосомой для синтеза белков, будет подробно рассмотрен в главе XX.В этой главе основное внимание будет уделено химической реакции, происходящей во время синтеза, и физическим свойствам полученных пептидов / белков.
Первичная последовательность белка связана вместе с использованием дегидратационного синтеза (потеря воды), которые объединяют карбоновую кислоту вышележащей аминокислоты с аминогруппой нижележащей аминокислоты с образованием амидной связи (рис. 2.10). ). Точно так же обратная реакция — это гидролиз и требует включения молекулы воды для разделения двух аминокислот и разрыва амидной связи. Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , , необходим для гидролиза белка.
Примечательно, что рибосома служит ферментом, который опосредует реакции синтеза дегидратации, необходимые для построения белковых молекул, тогда как класс ферментов, называемых протеазами , , необходим для гидролиза белка.
В белковых структурах амидная связь между аминокислотами известна как пептидная связь . Последующие аминокислоты будут добавлены на конце карбоновой кислоты растущего белка.Таким образом, белки всегда синтезируются направленным образом, начиная с амина и заканчивая хвостом карбоновой кислоты. Новые аминокислоты всегда добавляются к хвосту карбоновой кислоты, а не к амину первой аминокислоты в цепи. Направленность синтеза белка определяется рибосомой и известна как N-to C-синтез .
Рис. 2.10. Образование пептидной связи. Добавление двух аминокислот для образования пептида требует синтеза дегидратации.
Как отмечалось выше в разделе цвиттерионов, амидные связи имеют резонансную структуру, которая не позволяет атомной неподеленной паре электронов действовать как основание (рис. 2.11).
Рисунок 2.11 Резонансная структура амида. Во время амидного резонанса неподеленные пары электронов азота участвуют в образовании pi -связи с карбонильным углеродом, образующим двойную связь. Таким образом, амидные атомы азота не являются основными. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- .
Изображение В.К. Чанг
Вместо этого они участвуют в образовании связи — с карбонильным углеродом. Кроме того, связь C-N в амидной структуре зафиксирована в пространстве и не может вращаться из-за характера связи pi- . Это создает фиксированные физические положения R-групп в растущем пептиде либо в конформации цис или транс . Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис предпочтительна только для одной конкретной аминокислоты, пролина . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые возникают, когда пролин принимает конформацию trans (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Поскольку R-группы могут быть довольно объемными, они обычно чередуются по обе стороны от растущей белковой цепи в конформации транс .Конформация цис предпочтительна только для одной конкретной аминокислоты, пролина . Это связано с циклической структурой R-группы пролина и стерическими препятствиями, которые возникают, когда пролин принимает конформацию trans (рис. 2.12). Таким образом, остатки пролина могут иметь большое влияние на трехмерную структуру полученного пептида.
Рисунок 2.12. Конформация Cis и Trans R-групп аминокислот. На верхней диаграмме показаны конформации цис и транс двух соседних аминокислот, обозначенных как X и Y, которые обозначают любую из 20 аминокислот, за исключением пролина. В конформации trans R-группа из аминокислоты X повернута в сторону и находится на другой стороне молекулы по сравнению с R-группой из аминокислоты Y. Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы быть ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . Таким образом, пролин отдает предпочтение конформации цис , которая имеет меньшие стерические препятствия.
Эта конформация дает наименьшее количество стерических препятствий по сравнению с cis конформация, в которой R-группы расположены с одной стороны и в непосредственной близости друг от друга.На нижней диаграмме любая аминокислота X расположена перед остатком пролина. Из-за циклизации пролиновой R-группы с амидным азотом в основной цепи это смещает положение пролиновой R-группы, чтобы быть ближе к R-группе от аминокислоты X, когда она принимает конформацию trans . Таким образом, пролин отдает предпочтение конформации цис , которая имеет меньшие стерические препятствия.
Белки представляют собой очень большие молекулы, содержащие много аминокислотных остатков, связанных вместе в очень определенном порядке.Размер белков варьируется от 50 аминокислот до самого большого известного белка, содержащего 33 423 аминокислоты. Макромолекулы, содержащие менее 50 аминокислот, известны как пептиды (рис. 2.13).
2.13).
Рис. 2.13. Пептиды и белки — это макромолекулы, состоящие из длинных цепочек аминокислот, соединенных вместе амидными связями. Порядок и природа аминокислот в первичной последовательности белка определяют структуру укладки белка на основе окружающей среды белка (то есть, если он находится внутри клетки, он, вероятно, окружен водой в очень полярной среде. , тогда как если белок встроен в плазматическую мембрану, он будет окружен очень неполярными углеводородными хвостами).
Благодаря большому количеству аминокислот, которые могут быть включены в каждую позицию в белке, существуют миллиарды различных возможных комбинаций белков, которые можно использовать для создания новых белковых структур! Например, подумайте о трипептиде, полученном из этого пула аминокислот. В каждой позиции есть 20 различных опций, которые могут быть включены. Таким образом, общее возможное количество образующихся трипептидов будет 20 X 20 X 20 или 20 3 , что равно 8000 различных вариантов трипептидов! А теперь подумайте, сколько вариантов было бы для небольшого пептида, содержащего 40 аминокислот. Было бы 20 40 вариантов, или ошеломляющие 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Было бы 20 40 вариантов, или ошеломляющие 1,09 X 10 52 возможных вариантов последовательности! Каждый из этих вариантов будет различаться по общей форме белка, поскольку природа боковых цепей аминокислот помогает определить взаимодействие белка с другими остатками в самом белке и с окружающей его средой.
Характер аминокислот во всем белке помогает белку складываться и формировать его трехмерную структуру. Именно эта трехмерная форма требуется для функциональной активности белка (т.е. форма белка = функция белка ). Для белков, находящихся в водной среде клетки, гидрофобные аминокислоты часто находятся внутри структуры белка, тогда как водолюбивые гидрофильные аминокислоты будут на поверхности, где они могут связываться водородом и взаимодействовать с молекулами воды. Пролин уникален, потому что он имеет единственную R-группу, которая образует циклическую структуру с аминогруппой в основной цепи. Эта циклизация заставляет пролин принимать конформацию цис , а не конформацию транс в основной цепи. Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (Рисунок 2.14).
Этот сдвиг в структуре часто означает, что пролины представляют собой положения, в которых происходят изгибы или изменения направления внутри белка. Метионин уникален тем, что он служит исходной аминокислотой почти для всех многих тысяч белков, известных в природе. Цистеины содержат тиоловые функциональные группы и, таким образом, могут окисляться другими остатками цистеина с образованием ковалентных дисульфидных связей в структуре белка (рис. 2.14). Дисульфидные мостики добавляют дополнительную стабильность трехмерной структуре и часто требуются для правильного сворачивания и функционирования белка (Рисунок 2.14).
Рисунок 2.14 Дисульфидные связи. Дисульфидные связи образуются между двумя остатками цистеина в пептидной или белковой последовательности или между различными пептидными или белковыми цепями. В приведенном выше примере изображены две пептидные цепи, которые образуют гормон инсулин. Дисульфидные мостики между двумя цепями необходимы для правильного функционирования этого гормона по регулированию уровня глюкозы в крови.
Изображение предоставлено: CNX OpenStax через Wikimedia Commons
Форма и функция белка
Первичная структура каждого белка приводит к уникальному паттерну сворачивания, который характерен для этого конкретного белка.Таким образом, первичная последовательность — это линейный порядок аминокислот, поскольку они связаны вместе в белковой цепи (рис. 2.15). В следующем разделе мы обсудим сворачивание белка, которое приводит к образованию вторичных, третичных, а иногда и четвертичных белковых структур.
Рис. 2.15. Первичная структура белка представляет собой линейную последовательность аминокислот.
(кредит: модификация работы Национального исследовательского института генома человека)
обратно наверх
2.3 Структура вторичного белка
В предыдущем разделе мы отметили жесткость, создаваемую связью CN в амидной связи, когда аминокислоты соединяются друг с другом, и узнали, что это приводит к тому, что R-группы аминокислот благоприятствуют конфромации транс (за исключением пролина, который поддерживает конформацию цис ). Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод — азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз на связь α-углерод — азот в плоскости бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод-карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод-карбонильный углерод (Рисунок 2.16).
Эта жесткость каркаса белка ограничивает потенциал сворачивания и структуру получаемого белка. Однако связи, прикрепленные к α-углероду, могут свободно вращаться и вносить свой вклад в гибкость и уникальные паттерны сворачивания, наблюдаемые внутри белков.Чтобы оценить возможные модели вращения, которые могут возникнуть вокруг α-углерода, обычно измеряются торсионные углы Phi (Φ) и Psi (ψ). Угол кручения Phi (Φ) измеряет вращение вокруг связи α-углерод — азот, оценивая угол между двумя соседними карбонильными атомами углерода, когда вы смотрите прямо вниз на связь α-углерод — азот в плоскости бумаги (рис. 2.16). ). И наоборот, торсионный угол Psi (ψ) измеряет вращение вокруг связи α-углерод-карбонильный углерод, оценивая угол между двумя соседними атомами азота, когда вы смотрите прямо вниз на связь α-углерод-карбонильный углерод (Рисунок 2.16).
Рисунок 2.16 Торсионные углы Phi (Φ) и Psi (ψ). (A) Торсионный угол Phi (Φ) является мерой вращения вокруг связи между α-углеродом и амидным азотом. Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
Он измеряется как угол между двумя карбонильными атомами углерода, примыкающими к связи, показанный на нижней панели. (B) Торсионный угол Psi (ψ) является мерой вращения вокруг связи между α-углеродом и карбонильным углеродом. Он измеряется как угол между двумя атомами азота, примыкающими к связи, показанный на нижней панели.
В то время как связи вокруг α-углерода могут вращаться свободно, предпочтительные торсионные углы ограничены меньшим набором возможностей, поскольку соседние атомы избегают конформаций, которые имеют высокие стерические препятствия, связанные с ними. Г. Рамачандран создал компьютерные модели небольших пептидов для определения стабильных конформаций торсионных углов Phi (Φ) и Psi (ψ). На основе своих результатов он создал так называемый график Рамачандрана, который графически отображает области перекрытия наиболее благоприятных торсионных углов Phi (Φ) и Psi (ψ) (Рисунок 2.17)
Рисунок 2.17 График Рамачандрана. Благоприятный и очень благоприятный торсионные углы Phi (Φ) и Psi (ψ) обозначены желтым и красным соответственно. Указаны углы связи для общих вторичных белковых структур.
Указаны углы связи для общих вторичных белковых структур.
Изображение изменено с: J. Cooper
Внутри каждого белка небольшие участки белка могут принимать специфические повторяющиеся паттерны сворачивания. Эти специфические мотивы или узоры называются вторичной структурой .Двумя наиболее распространенными вторичными структурными особенностями являются альфа-спираль и бета-гофрированный лист (рис. 2.18). Внутри этих структур внутримолекулярные взаимодействия, особенно водородная связь между амином основной цепи и карбонильными функциональными группами, имеют решающее значение для поддержания трехмерной формы.
Рис. 2.18. Вторичные структурные особенности в структуре белка. Правая альфа-спираль и бета-складчатый лист являются общими структурными мотивами, обнаруженными в большинстве белков.Они удерживаются вместе за счет водородной связи между амином и карбонильным кислородом в основной цепи аминокислоты.
Изображение изменено из: The School of Biomedical Sciences Wiki
Альфа Спираль
Для альфа-спиральных структур очень распространена правая спираль, тогда как левые спирали очень редки. Это связано с торсионными углами Phi (Φ) и Psi (ψ), необходимыми для получения левой альфа-спиральной структуры.Чтобы получить правильную ориентацию левой спирали, белку придется складываться и закручиваться под множеством неблагоприятных углов. Таким образом, они не очень распространены в природе.
Для правой альфа-спирали каждый виток спирали содержит 3,6 аминокислотных остатка (рис. 2.19). Группы R (вариантные группы) полипептида выступают из -спиральной цепи . Основная цепь полипептида образует повторяющуюся спиральную структуру, которая стабилизируется водородными связями между кислородом карбонила и водородом амина.Эти водородные связи возникают с регулярными интервалами, по одной водородной связи на каждую четвертую аминокислоту, и заставляют основную цепь полипептида образовывать спираль. Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали составляет 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты по-разному склонны к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Каждая аминокислота продвигает спираль вдоль своей оси на 1,5 Å. Каждый виток спирали состоит из 3,6 аминокислот; следовательно, шаг спирали составляет 5,4 Å. На спираль приходится в среднем десять аминокислотных остатков. Различные аминокислоты по-разному склонны к образованию α -спирали. Аминокислоты, которые предпочитают принимать спиральные конформации в белках, включают метионин, аланин, лейцин, глутамат и лизин.Пролин и глицин почти не склонны к образованию спиралей.
Рис. 2.19. Структура правой альфа-спирали. (A) Модель шара и рукояти, вид сбоку. Всего для образования одного витка α -спирали требуется 3,6 аминокислоты. Водородная связь между кислородом карбонила и азотом 4-й аминокислоты стабилизирует спиральную структуру. На показанной структуре черные атомы представляют собой альфа-углерод, серый — карбонильные углероды, красный — кислород, синий — азот, зеленый — R-группы и светло-фиолетовый — атомы водорода.(B) Расширенный вид сбоку, линейная структура и модель заполнения пространства (C) Расширенный вид сверху, линейная структура и модель заполнения пространства
Изображение A изменено с: Максим Изображение B и C взято: Генри Якубовски
Ключевые моменты об альфа-спирали:
- Альфа-спираль более компактна, чем полностью вытянутая полипептидная цепь с углами phi / psi 180 o
- В белках среднее количество аминокислот в спирали составляет 11, что дает 3 витка.

- Левая альфа-спираль, хотя и разрешенная при осмотре графика Рамачандрана, наблюдается редко, поскольку аминокислоты, используемые для построения структуры белка, являются L-аминокислотами и смещены в сторону образования правой спирали. Когда левосторонние спирали все же образуются, они часто имеют решающее значение для правильного сворачивания белка, стабильности белка или непосредственно участвуют в формировании активного центра.
Рисунок 2.20 Левосторонняя структура альфа-спирали. На этой диаграмме левая альфа-спираль, показанная желтым цветом, является частью витка шпильки в структуре белка и стабилизирована двумя дисульфидными мостиками, показанными желтым цветом.
Рисунок из: Annavarapu, S., Nanda, V. (2009) BMC Struct Biol 9, 61
- Сердцевина спирали плотно упакована. В спирали нет отверстий и пор.
- Все R-группы простираются наружу и от оси спирали.
 R-группы могут быть гидрофильными или гидрофобными и могут быть локализованы в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21
R-группы могут быть гидрофильными или гидрофобными и могут быть локализованы в определенных положениях на спирали, образуя амфипатические области на белке, или полностью гидрофобные спирали могут также проходить через плазматическую мембрану, как показано на рис. 2.21
Рис. 2.21. Расположение R-групп в альфа-спиральных структурах. R-группы могут быть расположены внутри альфа-спирали для создания амфипатических областей внутри белка, где гидрофильные остатки расположены с одной стороны спирали, а гидрофобные — с другой, как показано на виде сбоку (A) или сверху вниз ( ДО Н.Э).R-группы также могут быть полностью гидрофобными в альфа-спиралях, охватывающих плазматическую мембрану, как показано на (D).
Рисунок изменен по: Khara, J.S., et al. (2017) Acta Biomat 57: 103-114 и Ryu, H., et al. (2019) Int J Mol Sci 20 (6) 1437
- Некоторые аминокислоты чаще встречаются в альфа-спиралях, чем другие.
 Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткий и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать Н-связь ( Ser, Asp, и Asn ) и не слишком длинные, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали.
Вот аминокислоты, которые обычно НЕ встречаются в альфа-спиральных структурах: Gly слишком мал и конформационно гибок, чтобы его можно было найти с высокой частотой в альфа-спиралях, в то время как Pro слишком жесткий и в цис -конформации. Pro часто нарушает спиральную структуру, вызывая изгибы белка. Некоторые аминокислоты с боковыми цепями, которые могут связывать Н-связь ( Ser, Asp, и Asn ) и не слишком длинные, по-видимому, действуют как конкуренты донора и акцептора Н-связи основной цепи и дестабилизируют альфа спирали. R-группы с ранним ветвлением, такие как Val и Ile, , дестабилизируют альфа-спираль из-за стерических взаимодействий объемных боковых цепей с основной цепью спирали. - Сводная информация о склонностях аминокислот к альфа-спиралям (а также к бета-структуре)
- Альфа-кератины, основной компонент волос, кожи, меха, клювов и ногтей, почти полностью представляют собой альфа-спираль.
Jmol: Обновлено Изолированная спираль из антифриза белка Jmol14 (Java) | JSMol (HTML5)
Бета-гофрированный лист:
В β-гофрированном листе «складки» образованы водородными связями между атомами в основной цепи полипептидной цепи.Группы R присоединены к атомам углерода и проходят выше и ниже складок складки в конформации trans . Складчатые сегменты выстраиваются параллельно или антипараллельно друг другу, а водородные связи образуются между частично положительным атомом азота в аминогруппе и частично отрицательным атомом кислорода в карбонильной группе остова пептида (рис. 2.21).
Рисунок 2.21 Структура листа с бета-гофрировкой. β-гофрированный лист может быть ориентирован в параллельной или антипараллельной ориентации, как показано на (A) выше, с β-гофрированным листом, представленным красными стрелками в виде ленты.Направление стрелки указывает ориентацию белка, при этом стрелка проходит в направлении от N к C. Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Водородная связь между карбонилом основной цепи и функциональными аминогруппами основной цепи стабилизировала как антипараллельные (B слева), так и параллельные (B справа) β-складчатые листовые структуры.
Изображение (A) с: Xenoblast Изображение (B) с: Fvasconcellos
Другие мотивы вторичной структуры:
Другие важные вторичные структуры включают витков, петель, шпильки и гибкие линкеры .Существует множество различных классификаций витков в структуре белка, включая α-витков, β-витков, γ-витков, δ-витков и π-витков . β-витки (наиболее распространенная форма) обычно содержат четыре аминокислотных остатка (рис. 2.22). Пролин и глицин обычно встречаются в поворотных мотивах, поскольку цис-конформация пролина способствует более резким конформационным изгибам, в то время как минимальная боковая цепь глицина позволяет более плотно упаковывать аминокислоты, чтобы способствовать структуре поворота.
Рис. 2.22. Схема β-витков типа I и II.
Изображение из: Muskid
ω-петля — универсальный термин для более длинных, расширенных или нерегулярных петель без фиксированной внутренней водородной связи. Шпилька — это особый случай поворота, при котором направление основной цепи белка меняется на противоположное и фланкирующие элементы вторичной структуры взаимодействуют. Например, шпилька для волос beta соединяет две антипараллельные β-нити с водородными связями.Иногда повороты обнаруживаются внутри гибких линкеров или петель, соединяющих белковые домены. Линкерные последовательности различаются по длине и обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединительным доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов.
обратно наверх
2.4 Супервторичная структура и белковые мотивы
Между вторичной структурой и третичной структурой белков находятся более крупные трехмерные особенности, которые были идентифицированы во множестве различных белковых структур.Они известны как супервторичная структура и как мотивы белка . Супервторичная структура обычно состоит из двух вторичных структур, связанных между собой витком, и включает спираль-поворот-спираль, спираль-петля-спираль, α-α-углы, β-β-углы и β-шпилька-β (рис. 2.23).
Рисунок 2.23 Примеры сверхвторичных структур. (A) β-шпилька-β-структуры характеризуются резким поворотом шпильки, который не нарушает водородные связи двух β-складчатых листовых структур.(B) Предполагаемая структура спирали-поворот-спираль белка Taspase1, (C) угловая структура α-α, присутствующая в белке Myoglobin.
Изображение A предоставлено: Isabella Daidone Изображение B: Johannes van den Boom, et al. (2016) PLosONE 11 (3): e0151431
Изображение C изменено с: Belles14104
Белковые мотивы представляют собой более сложные структуры, созданные из вторичных и супервторичных структурных компонентов, повторяющихся модальностей, визуализируемых во многих белковых структурах.
Бета-нити имеют тенденцию закручиваться в правильном направлении, чтобы минимизировать конформационную энергию. Это приводит к образованию интересных структурных мотивов, обнаруженных во многих типах белков. Две из этих структур включают скрученные листы или седла, а также бета-стволы (рис. 2.24)
Рис. 2.24. Общие структурные мотивы бета-нити. (A) Скрученный лист для правой руки, вид сверху и сбоку, (B) Вид сбоку бета-ствола и (C) Вид сверху бета-ствола
Автор изображения: Генри Якубовски
Структурные мотивы могут выполнять определенные функции в белках, такие как обеспечение связывания субстратов или кофакторов. Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять многонитевых складок, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфами. спирали.
Например, складка Россмана отвечает за связывание с кофакторами нуклеотидов, такими как никотинамидадениндинуклеотид (NAD + ) (рис. 2.25). Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист. Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой).Пять многонитевых складок, подобных Россманну, расположены в порядке 32145. Общая третичная структура складки напоминает трехслойный сэндвич, в котором начинка состоит из удлиненного бета-листа, а два ломтика хлеба образованы соединяющимися параллельными альфами. спирали.
Рис. 2.25. Складка Россмана. (A) Структура никотинамид-адениндинуклеотида (NAD + ) (B) Мультяшная диаграмма складки Россмана (спирали A-F красные и нити 1-6 желтые) из E. coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
coli фермент малатдегидрогеназа. Показано, что кофактор NAD + связывается как молекула, заполняющая пространство. (C) Схематическая диаграмма шестицепочечной складки Россмана.
Изображение изменено с: Boghog
Одной из особенностей складки Россмана является ее специфичность связывания кофакторов. Наиболее консервативный сегмент складок Россмана — это первый бета-альфа-бета-сегмент. Поскольку этот сегмент находится в контакте с ADP-частью динуклеотидов, таких как FAD, NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Интересно, что подобные структурные мотивы не всегда имеют общего эволюционного предка и могут возникнуть в результате конвергентной эволюции. Так обстоит дело с TIM Barrel, консервативной белковой складкой, состоящей из восьми α-спиралей и восьми параллельных β-цепей, которые чередуются вдоль пептидного остова. Структура названа в честь триозофосфатизомеразы, консервативного метаболического фермента. Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они имеют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Бочки TIM — одна из самых распространенных белковых складок. Одна из самых интригующих особенностей представителей этого класса белков заключается в том, что хотя все они имеют одну и ту же третичную складку, между ними очень мало сходства последовательностей.По крайней мере 15 различных семейств ферментов используют этот каркас для создания соответствующей геометрии активного сайта, всегда на С-конце восьми параллельных бета-цепей цилиндра.
Рисунок 2.26 Ствол TIM. TIM-бочки считаются α / β-складками белка, потому что они включают в себя чередующийся паттерн α-спиралей и β-цепей в одном домене. В цилиндре TIM спирали и нити (обычно по 8 штук) образуют соленоид, который изгибается вокруг себя и замыкается в форме пончика, топологически известной как тороид.Параллельные β-нити образуют внутреннюю стенку бублика (следовательно, β-бочонок), тогда как α-спирали образуют внешнюю стенку бублика. Каждая β-нить соединяется со следующей соседней нитью в цилиндре через длинную правую петлю, которая включает одну из спиралей, так что раскрашивание ленты N-C на виде сверху (A) происходит в радужном порядке вокруг бочка.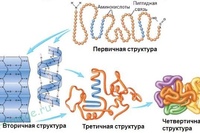 Ствол TIM можно также рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Ствол TIM можно также рассматривать как состоящий из 8 перекрывающихся правосторонних супервторичных структур β-α-β, как показано на виде сбоку (B).
Изображение изменено с: WillowW
Хотя ленточная диаграмма TIM Barrel показывает отверстие в центральном ядре белка, боковые цепи аминокислот на этом изображении не показаны (рис. 2.26). Ядро белка на самом деле плотно упаковано, в основном с объемными гидрофобными аминокислотными остатками, хотя необходимо несколько глицинов, чтобы дать пространство для маневра для сильно ограниченного центра из 8 приблизительных повторов, чтобы соответствовать друг другу. В упаковочных взаимодействиях между цепями и спиралями также преобладает гидрофобность, и разветвленные алифатические остатки валина, лейцина и изолейцина составляют около 40% от общего количества остатков в β-цепях.
По мере того, как наши знания о бесчисленном множестве структурных мотивов, обнаруженных в природной сокровищнице белковых структур, продолжают расти, мы продолжаем понимать, как структура белка связана с функцией, и мы можем лучше охарактеризовать вновь приобретенные последовательности белка, используя in silico технологии.
обратно наверх
2,5 Структура третичного и четвертичного белка
Полная трехмерная форма всего белка (или сумма всех вторичных структурных мотивов) известна как третичная структура белка и является уникальной и определяющей особенностью этого белка (Рисунок 2.27). В первую очередь, взаимодействия между группами R создают сложную трехмерную третичную структуру белка. Природа групп R, обнаруженных в задействованных аминокислотах, может противодействовать образованию водородных связей, описанных для стандартных вторичных структур, таких как альфа-спираль. Например, группы R с одинаковыми зарядами отталкиваются друг от друга, а группы с разными зарядами притягиваются друг к другу (ионные связи). Незаряженные неполярные боковые цепи могут образовывать гидрофобные взаимодействия.Взаимодействие между боковыми цепями цистеина может приводить к образованию дисульфидных связей.
Рисунок 2. 27. Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
27. Структура третичного белка. Третичная структура белков определяется множеством химических взаимодействий. К ним относятся гидрофобные взаимодействия, ионные связи, водородные связи и дисульфидные связи.
Изображение предоставлено: School of Biomedical Sciences Wiki
Все эти взаимодействия, сильные и слабые, определяют окончательную трехмерную форму белка.Когда белок теряет свою трехмерную форму, он обычно больше не функционирует.
В природе некоторые белки образуются из нескольких полипептидов, также известных как субъединицы, и взаимодействие этих субъединиц образует четвертичную структуру . Слабые взаимодействия между субъединицами помогают стабилизировать общую структуру. Например, инсулин (глобулярный белок) имеет комбинацию водородных и дисульфидных связей, из-за которых он в основном собирается в шар.Инсулин начинается как единый полипептид и теряет некоторые внутренние последовательности во время клеточного процессинга, которые образуют две цепи, удерживаемые вместе дисульфидными связями, как показано на рисунке 2. 14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
14. Затем три из этих структур группируются, образуя неактивный гексамер (рис. 2.28). Гексамерная форма инсулина — это способ для организма хранить инсулин в стабильной и неактивной конформации, чтобы он был доступен для высвобождения и реактивации в мономерной форме.
Рисунок 2.28 Гормон инсулина — хороший пример четвертичной структуры. Инсулин вырабатывается и хранится в организме в виде гексамера (единицы из шести молекул инсулина), в то время как активной формой является мономер. Гексамер представляет собой неактивную форму с долговременной стабильностью, которая служит средством защиты высокореактивного инсулина, но при этом остается легкодоступным.
Рисунок: Исаак Йонемото
Прогнозирование паттерна сворачивания белка на основе его первичной последовательности — чрезвычайно сложная задача из-за присущей аминокислотным остаткам гибкости, которые можно использовать для образования различных вторичных признаков.Как описано Fujiwara и др., Классификация SCOP (структурная классификация белков) и SCOPe (расширенная версия) являются основными базами данных, предоставляющими подробные и всесторонние описания всех известных структур белков. Классификация SCOP основана на иерархических уровнях: первые два уровня, семейство и суперсемейство , описывают близкие и дальние эволюционные отношения, тогда как третий, крат , описывает геометрические отношения и структурные мотивы внутри белка.В рамках схемы складчатой классификации большинство белков отнесено к одному из четырех структурных классов: (1) все α-спирали, (2) все β-листы, (3) α / β для белков с дисперсными структурами и (4) α + β для белков с участками, в которых преобладает тот или иной тип паттерна.
На основании их формы, функции и местоположения белки в широком смысле могут быть охарактеризованы как волокнистые, глобулярные, мембранные или неупорядоченные.
Волокнистые белки
Волокнистые белки характеризуются удлиненными белковыми структурами.Эти типы белков часто объединяются в филаменты или пучки, образуя структурные каркасы в биологических системах. У животных два наиболее распространенных семейства волокнистых белков — это α-кератин и коллаген.
α-кератин
α-кератин — ключевой структурный элемент, из которого состоят волосы, ногти, рога, когти, копыта и внешний слой кожи. Благодаря своей плотно намотанной структуре, он может функционировать как один из самых прочных биологических материалов и находить различное применение у млекопитающих, от хищных когтей до волос для тепла.α-кератин синтезируется путем биосинтеза белка с использованием транскрипции и трансляции, но когда клетка созревает и наполняется α-кератином, она умирает, создавая прочную несосудистую единицу ороговевшей ткани.
Первые последовательности α-кератинов были определены Ханукоглу и Фуксом. Эти последовательности показали, что существует два различных, но гомологичных семейства кератинов, которые были названы кератином типа I и кератином типа II. У человека 54 гена кератина, 28 из которых кодируют тип I, а 26 — тип II. Белки типа I являются кислыми, что означает, что они содержат больше кислых аминокислот, таких как аспарагиновая кислота, в то время как белки типа II являются основными, что означает, что они содержат больше основных аминокислот, таких как лизин. Эта дифференциация особенно важна для α-кератинов, потому что при синтезе его субъединицы димера, спиральной спирали , одна белковая спираль должна быть типа I, а другая — типа II (рис. 2.29). Даже в пределах типа I и II есть кислые и основные кератины, которые особенно дополняют друг друга в каждом организме.Например, в коже человека K5, α-кератин типа II, соединяется в основном с K14, α-кератином I типа, с образованием комплекса α-кератина клеточного слоя эпидермиса.
Димеры Coiled-coil затем собираются в протофиламенты, очень стабильный левосторонний сверхспиральный мотив, который далее мультимеризуется, образуя филаменты, состоящие из множества копий мономеров кератина (рис. 2.29). Основная сила, которая удерживает структуры coiled-coil, связанные друг с другом, — это гидрофобные взаимодействия между аполярными остатками вдоль спиральных сегментов кератина.
Рисунок 2.29. Формирование промежуточной нити. Промежуточные филаменты состоят из супспирального комплекса α-кератина. Первоначально два мономера кератина (A) образуют структуру димера спиральной спирали (B) Два димера спиральной спирали соединяются, образуя шахматный тетрамер (C), тетрамеры начинают соединяться вместе (D), в конечном итоге формируя лист из восьми тетрамеров (E ). Затем лист из восьми тетрамеров скручивают в левую спираль, образуя конечную промежуточную нить (E). Электронная микрофотография промежуточной нити показана в верхнем левом углу.
Автор изображения: Правительство США
Коллаген
Волокнистый белок Коллаген является наиболее распространенным белком у млекопитающих, составляя от 25% до 35% всего белка в организме. Он находится преимущественно во внеклеточном пространстве в различных соединительных тканях организма. Коллаген содержит уникальную четвертичную структуру из трех белковых цепей, соединенных вместе, образуя тройную спираль.В основном он находится в фиброзных тканях, таких как сухожилия, связки и кожа.
В зависимости от степени минерализации коллагеновые ткани могут быть жесткими (кость), податливыми (сухожилия) или иметь градиент от жесткого к податливому (хрящ). Его также много в роговице, кровеносных сосудах, кишечнике, межпозвонковых дисках и дентине зубов. В мышечной ткани он служит основным компонентом эндомизия. Коллаген составляет от одного до двух процентов мышечной ткани и составляет 6% веса сильных сухожильных мышц.Фибробласт — наиболее распространенная клетка, вырабатывающая коллаген. Желатин, который используется в пище и промышленности, представляет собой необратимо гидролизованный коллаген. Кроме того, в качестве пищевых добавок используются порошки частично или полностью гидролизованного коллагена. Коллаген имеет множество медицинских применений при лечении заболеваний костей и кожи.
Название коллаген происходит от греческого ( kólla ), что означает «клей», и суффикса -gen , что означает «производство». Это относится к раннему использованию соединения в процессе кипячения кожи и сухожилий лошадей и других животных для получения клея.
Более 90% коллагена в организме человека относится к типу I. Однако по состоянию на 2011 год было идентифицировано, описано и разделено на несколько групп в соответствии с формируемой ими структурой 28 типов коллагена. Пять наиболее распространенных типов:
- Тип I: кожа, сухожилие, сосудистая сеть, органы, кость (основной компонент органической части кости)
- Тип II: хрящ (основной коллагеновый компонент хряща)
- Тип III: сетчатый (основной компонент ретикулярных волокон), обычно встречается вместе с типом I
- Тип IV: образует базальную пластинку, секретируемый эпителием слой базальной мембраны
- Тип V: поверхности клеток, волосы и плацента
Здесь мы сосредоточимся на уникальных свойствах коллагена типа I.Коллаген I типа имеет необычный аминокислотный состав и последовательность:
.
- Глицин содержится почти в каждом третьем остатке.
- Пролин составляет около 17% коллагена.
- Коллаген содержит две необычные производные аминокислоты, не вставленные непосредственно во время трансляции. Эти аминокислоты находятся в определенных местах относительно глицина и посттрансляционно модифицируются различными ферментами, оба из которых требуют витамина С в качестве кофактора (рис. 2.30).
- Гидроксипролин, производный пролина
- Гидроксилизин, полученный из лизина — в зависимости от типа коллагена различное количество гидроксилизинов гликозилировано (в основном с присоединенными дисахаридами).
Рисунок 2.30. Гидроксилирование пролина и лизина во время посттрансляционной модификации коллагена типа I. Ферменты пролилгидроксилаза и лизилгидроксилаза необходимы для гидроксилирования остатков пролина (A) и лизина (B) соответственно. (Примечание: хотя положение 3 показано выше, пролиловые остатки альтернативно могут быть гидроксилированы в положении 4). Ферменты гидроксилазы модифицируют аминокислотные остатки после того, как они были включены в белок в качестве посттрансляционной модификации, и требуют витамина С (аскорбата) в качестве кофактора.(C) Дальнейшая модификация остатков гидроксилизина путем гликозилирования может привести к включению дисахарида (галактоза-глюкоза) в гидрокси-кислород.
Большинство коллагена образуется аналогичным образом. Процесс синтеза коллагена типа I описан ниже и демонстрирует сложность сворачивания и обработки белка (рис. 2.31).
- Внутри ячейки
- Во время трансляции на рибосомах вдоль грубого эндоплазматического ретикулума (RER) образуются альфа-цепи двух типов: альфа-1 и альфа-2 цепи.Эти пептидные цепи (известные как препроколлаген) имеют регистрирующие пептиды на каждом конце и сигнальный пептид.
- Полипептидные цепи высвобождаются в просвет RER.
- Сигнальные пептиды расщепляются внутри RER, и теперь эти цепи известны как про-альфа-цепи.
- Внутри просвета происходит гидроксилирование аминокислот лизина и пролина. Этот процесс зависит от кофактора аскорбиновой кислоты (витамина С).
- Происходит гликозилирование определенных остатков гидроксилизина.
- Тройная альфа-спиральная структура образована внутри эндоплазматического ретикулума из двух цепей альфа-1 и одной цепи альфа-2.
- Проколлаген доставляется в аппарат Гольджи, где он упаковывается и секретируется путем экзоцитоза.
- Вне камеры
- Регистрационные пептиды расщепляются, а тропоколлаген образуется проколлагеновой пептидазой.
- Множественные молекулы тропоколлагена образуют фибриллы коллагена посредством ковалентного сшивания (альдольная реакция) лизилоксидазой, которая связывает остатки гидроксилизина и лизина.Множественные коллагеновые фибриллы образуют коллагеновые волокна.
- Коллаген может быть прикреплен к клеточным мембранам через несколько типов белков, включая фибронектин, ламинин, фибулин и интегрин.
Рисунок 2.31. Синтез коллагена типа I. Полипептидные цепи синтезируются в эндоплазматическом ретикулуме и высвобождаются в просвет, где они гидроксилируются и гликозилируются. Тройная спираль проколлагена формируется и транспортируется через аппарат Гольджи, где подвергается дальнейшей обработке.Проколлаген секретируется во внеклеточный матрикс, где расщепляется на тропоколлаген. Тропоколлаген собирается в коллагеновые фибриллы, где происходит сшивание и водородные связи с образованием конечного коллагенового волокна.
Изображение изменено: E.V. Вонг и Британская энциклопедия
Дефицит витамина С вызывает цингу, серьезное и болезненное заболевание, при котором дефектный коллаген препятствует образованию прочной соединительной ткани. Десны портятся и кровоточат, с потерей зубов; кожа меняет цвет, а раны не заживают.До 18 века это состояние было печально известно среди длительных военных, особенно военно-морских, экспедиций, во время которых участников лишали продуктов, содержащих витамин С.
Аутоиммунное заболевание, такое как красная волчанка или ревматоидный артрит, может поражать здоровые коллагеновые волокна. Кортизол стимулирует расщепление коллагена до аминокислот, предполагая, что стресс может усугубить эти болезненные состояния.
Многие бактерии и вирусы выделяют факторы вирулентности, такие как фермент коллагеназа, который разрушает коллаген или препятствует его производству.
обратно наверх
Глобулярные белки
Глобулярные белки или сферопротеинов представляют собой сферические («шарообразные») белки и являются одним из распространенных типов белков. Глобулярные белки в некоторой степени растворимы в воде (образуют коллоиды в воде), в отличие от волокнистых или мембранных белков. Существует несколько классов складок глобулярных белков, поскольку существует множество различных архитектур, которые могут складываться в примерно сферическую форму.
Термин глобин может более конкретно относиться к белкам, включая глобиновую складку. Глобиновая складка представляет собой обычную трехмерную складку в белках и определяет суперсемейство глобиноподобных белков (рис. 2.32). Эта складка обычно состоит из восьми альфа-спиралей, хотя некоторые белки имеют дополнительные продолжения спиралей на концах. Глобиновая складка встречается в одноименных семействах глобиновых белков: гемоглобинах и миоглобинах, а также в фикоцианинах.Поскольку миоглобин был первым белком, структура которого была решена, глобиновая складка была первой обнаруженной белковой складкой. Поскольку глобиновая складка содержит только спирали, она классифицируется как полностью альфа-белковая складка.
Рисунок 2.32 Глобиновая складка. (A) Пример глобиновой складки, переносящего кислород белка миоглобина (PBD ID 1MBA) из моллюска Aplysia limacina. (B) Структура тетрамерного белка гемоглобина, содержащего в общей сложности четыре глобиновых складки.
Изображение A: Википедия Изображение B: Zephyris
Термин глобулярный белок довольно старый (датируется, вероятно, 19-м веком) и теперь несколько архаичен, учитывая сотни тысяч белков и более элегантный и описательный словарь структурных мотивов. Сферическая структура индуцируется третичной структурой белка. Неполярные (гидрофобные) аминокислоты молекулы связаны внутри молекулы, тогда как полярные (гидрофильные) аминокислоты связаны снаружи, что позволяет диполь-дипольным взаимодействиям с растворителем, что объясняет растворимость молекулы.
В отличие от волокнистых белков, которые выполняют преобладающую структурную функцию, глобулярные белки могут действовать как:
- Ферменты, катализируя органические реакции, происходящие в организме в мягких условиях и с высокой специфичностью. Эту роль выполняют разные эстеразы.
- Посланники, передающие сообщения для регулирования биологических процессов. Эту функцию выполняют гормоны, например, инсулин и т. Д.
- Переносчики других молекул через мембраны
- Запасы аминокислот.
- Регуляторные роли также выполняются глобулярными белками, а не волокнистыми белками.
- Структурные белки, например актин и тубулин, которые являются глобулярными и растворимыми как мономеры, но полимеризуются с образованием длинных жестких волокон
Многие из белков, которые будут подробно описаны в следующих главах, относятся к этому классу белков.
Мембранные белки
Мембранные белки — это белки, которые являются частью биологических мембран или взаимодействуют с ними.Они включают: 1) интегральные мембранные белки, которые являются частью мембраны или постоянно прикреплены к ней, и 2) периферические мембранные белки, которые временно прикрепляются к мембране через интегральные белки или липидный бислой. Интегральные мембранные белки далее классифицируются как трансмембранные белки, которые проходят через мембрану, или интегральные монотопные белки, которые прикрепляются только к одной стороне мембраны.
Мембранные белки, такие как растворимые глобулярные белки, волокнистые белки и неупорядоченные белки, являются обычными. Обладая символической важностью в медицине, мембранные белки являются мишенью для более 50% всех современных лекарственных препаратов. Подсчитано, что 20–30% всех генов в большинстве геномов кодируют мембранные белки. По сравнению с другими классами белков, определение структур мембранных белков остается проблемой в значительной степени из-за сложности создания экспериментальных условий, которые могут сохранить правильную конформацию белка в изоляции от его естественной среды (рис. 2.33).
Мембранные белки выполняют множество функций, жизненно важных для выживания организмов:
- Белки мембранных рецепторов передают сигналы между внутренней и внешней средой клетки.
- Транспортные белки перемещают молекулы и ионы через мембрану. Их можно разделить на категории в соответствии с базой данных классификации транспортеров.
- Мембранные ферменты могут обладать многими видами активности, такими как оксидоредуктаза, трансфераза или гидролаза.
- Молекулы клеточной адгезии позволяют клеткам идентифицировать друг друга и взаимодействовать.Например, белки, участвующие в иммунном ответе.
Рис. 2.33. Схематическое изображение трансмембранных белков. 1. одиночная трансмембранная α-спираль (битопический мембранный белок) 2. политопный трансмембранный α-спиральный белок 3. политопный трансмембранный β-листовой белок. Мембрана представлена светло-коричневым цветом.
Интегральные мембранные белки постоянно прикреплены к мембране. Такие белки можно отделить от биологических мембран только с помощью детергентов, неполярных растворителей или иногда денатурирующих агентов.Их можно классифицировать в зависимости от их отношения к бислою:
- Интегральные политопные белки — это трансмембранные белки, которые проходят через мембрану более одного раза. Эти белки могут иметь различную трансмембранную топологию. Эти белки имеют одну из двух структурных архитектур:
- белки спирального пучка, которые присутствуют во всех типах биологических мембран;
- бета-стволовых белков, которые обнаруживаются только во внешних мембранах грамотрицательных бактерий, а также в наружных мембранах митохондрий и хлоропластов.
- Битопические белки — это трансмембранные белки, которые проходят через мембрану только один раз. Трансмембранные спирали из этих белков имеют значительно отличающиеся распределения аминокислот от трансмембранных спиралей политопных белков.
- Интегральные монотопные белки представляют собой интегральные мембранные белки, которые прикреплены только к одной стороне мембраны и не охватывают весь путь.
Рисунок 2.34 Схематическое изображение различных типов взаимодействия между монотопными мембранными белками и клеточной мембраной. 1. взаимодействие амфипатической α-спирали, параллельной плоскости мембраны (плоская спираль мембраны) 2. взаимодействие гидрофобной петлей 3. взаимодействие ковалентно связанного липида мембраны ( липидирование ) 4. электростатические или ионные взаимодействия с мембранные липиды.
Автор изображения: : Foobar
Белки периферической мембраны временно присоединяются либо к липидному бислою, либо к интегральным белкам за счет комбинации гидрофобных, электростатических и других нековалентных взаимодействий.Периферические белки диссоциируют после обработки полярным реагентом, например раствором с повышенным pH или высокой концентрацией соли.
Интегральные и периферические белки могут быть посттрансляционно модифицированы с добавлением жирных кислот, диацилглицерина или пренильных цепей или GPI (гликозилфосфатидилинозитол), который может быть закреплен в липидном бислое.
Неупорядоченные белки
Внутренне неупорядоченный белок ( IDP ) — это белок, не имеющий фиксированной или упорядоченной трехмерной структуры (Рисунок 2.35). IDP охватывают спектр состояний от полностью неструктурированного до частично структурированного и включают случайные клубки, (предварительно) расплавленные глобулы и большие многодоменные белки, соединенные гибкими линкерами. Они составляют один из основных типов белков (наряду с глобулярными, волокнистыми и мембранными белками).
Рис. 2.35. Конформационная гибкость белка SUMO-1 (PDB: 1a5r). Центральная часть показывает относительно упорядоченную структуру. Напротив, N- и C-концевые области (левая и правая соответственно) демонстрируют «внутреннее нарушение», хотя короткая спиральная область сохраняется в N-концевом хвосте.Были преобразованы десять альтернативных моделей ЯМР. Элементы вторичной структуры: α-спирали (красные), β-тяжи (синие стрелки).
Автор изображения: Лукаш Козловский
Открытие IDP бросило вызов традиционной парадигме структуры белка, согласно которой функция белка зависит от фиксированной трехмерной структуры. Эта догма была поставлена под сомнение в течение последних двадцати лет из-за растущего количества данных из различных областей структурной биологии, предполагающих, что динамика белков может иметь большое значение для таких систем.Несмотря на отсутствие стабильной структуры, IDP представляют собой очень большой и функционально важный класс белков. В некоторых случаях IDP могут принимать фиксированную трехмерную структуру после связывания с другими макромолекулами. В целом IDP во многом отличаются от структурированных белков и, как правило, обладают различными свойствами с точки зрения функции, структуры, последовательности, взаимодействий, эволюции и регуляции.
В 1930-1950-х годах первые структуры белка были решены с помощью кристаллографии белков.Эти ранние структуры предполагали, что фиксированная трехмерная структура может обычно требоваться для обеспечения биологических функций белков. Утверждая, что белки имеют только одну однозначно определенную конфигурацию, Мирски и Полинг не признали, что работа Фишера поддержала бы их тезис с его моделью «Замок и ключ» (1894). Эти публикации закрепили центральную догму молекулярной биологии в том, что последовательность определяет структуру, которая, в свою очередь, определяет функцию белков.В 1950 году Каруш написал о «конфигурационной адаптивности», что противоречит всем предположениям и исследованиям XIX века. Он был убежден, что белки имеют более одной конфигурации на одном и том же уровне энергии и могут выбирать одну при связывании с другими субстратами. В 1960-х годах парадокс Левинталя предположил, что систематический конформационный поиск длинного полипептида вряд ли приведет к единственной свернутой структуре белка в биологически релевантных временных масштабах (то есть от секунд до минут). Любопытно, что для многих (небольших) белков или белковых доменов можно наблюдать относительно быструю и эффективную рефолдинг in vitro .Как указано в «Догме Анфинсена» 1973 года, фиксированная трехмерная структура этих белков уникально кодируется в их первичной структуре (аминокислотной последовательности), является кинетически доступной и стабильной в ряде (близких) физиологических условий и, следовательно, может рассматриваться как нативное состояние таких «упорядоченных» белков.
Однако в последующие десятилетия многие крупные белковые области не могли быть отнесены к рентгеновским наборам данных, что указывает на то, что они занимают несколько позиций, которые усредняются на картах электронной плотности.Отсутствие фиксированных уникальных положений относительно кристаллической решетки предполагало, что эти области были «неупорядоченными». Спектроскопия ядерного магнитного резонанса белков также продемонстрировала наличие больших гибких линкеров и концов во многих решенных структурных ансамблях. В настоящее время общепринято, что белки существуют как ансамбль подобных структур с некоторыми областями более ограниченными, чем другие. Внутренне неструктурированные белки (IUP) занимают крайний конец этого спектра гибкости, тогда как IDP также включают белки со значительной тенденцией к локальной структуре или гибкими многодоменными сборками.Эти высокодинамичные неупорядоченные области белков впоследствии были связаны с функционально важными явлениями, такими как аллостерическая регуляция и ферментный катализ.
Многие неупорядоченные белки обладают аффинностью связывания со своими рецепторами, регулируемыми посттрансляционной модификацией, поэтому было высказано предположение, что гибкость неупорядоченных белков облегчает различные конформационные требования для связывания модифицирующих ферментов, а также их рецепторов. Внутреннее нарушение особенно обогащено белками, участвующими в передаче клеточных сигналов, транскрипции и ремоделировании хроматина.
Гибкие линкеры
Неупорядоченные области часто встречаются в виде гибких линкеров или петель, соединяющих домены. Линкерные последовательности сильно различаются по длине, но обычно богаты полярными незаряженными аминокислотами. Гибкие линкеры позволяют соединяющим доменам свободно скручиваться и вращаться, чтобы рекрутировать своих связывающих партнеров через динамику белковых доменов. Они также позволяют своим партнерам по связыванию вызывать крупномасштабные конформационные изменения с помощью аллостерии на большие расстояния.
Линейные мотивы
Линейные мотивы — это короткие неупорядоченные сегменты белков, которые опосредуют функциональные взаимодействия с другими белками или другими биомолекулами (РНК, ДНК, сахарами и т. Д.).). Многие роли линейных мотивов связаны с клеточной регуляцией, например, с контролем формы клеток, субклеточной локализацией отдельных белков и регулируемым обменом белков. Часто посттрансляционные модификации, такие как фосфорилирование, настраивают сродство (не редко на несколько порядков величины) отдельных линейных мотивов к специфическим взаимодействиям. В отличие от глобулярных белков IDP не имеют пространственно расположенных активных карманов. Тем не менее, в 80% IDP (~ 3 дюжины), подвергнутых детальной структурной характеристике с помощью ЯМР, присутствуют линейные мотивы, называемые PreSMos (предварительно структурированные мотивы), которые являются временными вторичными структурными элементами, примированными для распознавания мишени.В нескольких случаях было продемонстрировано, что эти временные структуры становятся полными и стабильными вторичными структурами, например спиралями, после связывания мишени. Следовательно, PreSMos являются предполагаемыми активными сайтами IDP.
Фальцовка и переплет с сопряжением
Многие неструктурированные белки переходят в более упорядоченные состояния при связывании со своими мишенями. Спаренная укладка и связывание могут быть локальными, с участием только нескольких взаимодействующих остатков, или с участием всего белкового домена.Недавно было показано, что спаренная укладка и связывание позволяют захоронить большую площадь поверхности, что было бы возможно только для полностью структурированных белков, если бы они были намного больше. Более того, определенные неупорядоченные области могут служить «молекулярными переключателями» в регуляции определенных биологических функций, переключаясь на упорядоченную конформацию при молекулярном распознавании, например, при связывании малых молекул, связывании ДНК / РНК, ионных взаимодействиях.
Нарушение связанного состояния (нечеткие комплексы)
Внутренне неупорядоченные белки могут сохранять свою конформационную свободу, даже если они специфически связываются с другими белками.Структурный беспорядок в связанном состоянии может быть статическим или динамическим. В нечетких комплексах структурная множественность необходима для функционирования, и манипулирование связанной неупорядоченной областью изменяет активность. Конформационный ансамбль комплекса модулируется посредством посттрансляционных модификаций или белковых взаимодействий. Специфичность ДНК-связывающих белков часто зависит от длины нечетких областей, которая варьируется путем альтернативного сплайсинга. Внутренне неупорядоченные белки адаптируют множество различных структур in vivo в соответствии с условиями клетки, создавая структурный или конформационный ансамбль.
Следовательно, их структуры сильно зависят от функций. Однако только несколько белков полностью неупорядочены в своем естественном состоянии. Нарушение в основном обнаруживается в внутренне неупорядоченных областях (IDR) внутри хорошо структурированного белка. Термин «внутренне неупорядоченный белок» (IDP), следовательно, включает белки, которые содержат IDR, а также полностью неупорядоченные белки.
Наличие и вид белкового нарушения кодируется его аминокислотной последовательностью.В целом IDP характеризуются низким содержанием объемных гидрофобных аминокислот и высокой долей полярных и заряженных аминокислот, обычно называемой низкой гидрофобностью. Это свойство приводит к хорошему взаимодействию с водой. Кроме того, высокие чистые заряды способствуют беспорядку из-за электростатического отталкивания, возникающего из-за одинаково заряженных остатков. Таким образом, неупорядоченные последовательности не могут в достаточной степени скрыть гидрофобное ядро, чтобы сложиться в стабильные глобулярные белки. В некоторых случаях гидрофобные кластеры в неупорядоченных последовательностях дают ключи для идентификации областей, которые подвергаются сопряженной укладке и связыванию (см. Биологические роли).
Многие неупорядоченные белки обнаруживают области без какой-либо регулярной вторичной структуры. Эти области можно назвать гибкими по сравнению со структурированными петлями. В то время как последние являются жесткими и содержат только один набор углов Рамачандрана, IDP включают несколько наборов углов. Термин гибкость также используется для хорошо структурированных белков, но описывает другое явление в контексте неупорядоченных белков. Гибкость структурированных белков связана с равновесным состоянием, в то время как у ВПЛ это не так.Многие неупорядоченные белки также обнаруживают последовательности низкой сложности, то есть последовательности с избыточным представлением нескольких остатков. Хотя последовательности низкой сложности являются сильным признаком нарушения, обратное не обязательно верно, то есть не все неупорядоченные белки имеют последовательности низкой сложности. Неупорядоченные белки имеют низкое содержание предсказанной вторичной структуры.
обратно наверх
2.6 Сворачивание, денатурация и гидролиз белков
Сворачивание белка — это физический процесс, посредством которого белковая цепь приобретает свою естественную трехмерную структуру, конформацию, которая обычно является биологически функциональной, быстрым и воспроизводимым образом (Рисунок 2.36). Это физический процесс, с помощью которого полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного клубка. Каждый белок существует в виде развернутого полипептида или случайной спирали при трансляции из последовательности мРНК в линейную цепочку аминокислот. У этого полипептида отсутствует какая-либо стабильная (долговечная) трехмерная структура (левая часть первого рисунка). Поскольку полипептидная цепь синтезируется рибосомой, линейная цепь начинает складываться в свою трехмерную структуру.Сворачивание начинает происходить даже при трансляции полипептидной цепи. Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру, свернутый белок (правая часть рисунка), известный как нативное состояние. Полученная трехмерная структура определяется аминокислотной последовательностью или первичной структурой (догма Анфинсена).
Рисунок 2.36 Белок до и после сворачивания
Автор изображения: DrKjaergaard
Правильная трехмерная структура важна для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми или, как в случае IDP, оставаться гибкими, поэтому важна динамика белков.Неспособность свернуться в нативную структуру обычно приводит к образованию неактивных белков, но в некоторых случаях неправильно свернутые белки имеют модифицированную или токсичную функциональность. Считается, что несколько нейродегенеративных и других заболеваний являются результатом накопления неправильно свернутых белков, таких как амилоидные фибриллы, обнаруженные у пациентов с болезнью Альцгеймера.
Сворачивание — это спонтанный процесс, который в основном управляется гидрофобными взаимодействиями, образованием внутримолекулярных водородных связей, силами Ван-дер-Ваальса, и ему противостоит конформационная энтропия.Процесс сворачивания часто начинается совместно с трансляцией, так что N-конец белка начинает сворачиваться, в то время как C-концевой участок белка все еще синтезируется рибосомой; однако молекула белка может самопроизвольно складываться во время или после биосинтеза. Хотя эти макромолекулы можно рассматривать как «сворачивающиеся сами по себе», процесс также зависит от растворителя (вода или липидный бислой), концентрации солей, pH, температуры, возможного присутствия кофакторов и молекулярных шаперонов.Белки будут иметь ограничения на их способность к складыванию из-за ограниченных углов изгиба или возможных конформаций, как описано в графике Рамачандрана.
Рисунок 2.37 Гидрофобный коллапс. В компактной складке (справа) гидрофобные аминокислоты (показаны черными сферами) схлопываются к центру, чтобы защитить себя от водной среды.
Автор изображения: Tomixdf
Сворачивание белка должно быть термодинамически благоприятным внутри клетки, чтобы реакция была спонтанной.Поскольку известно, что сворачивание белка является спонтанной реакцией, оно должно принимать отрицательное значение свободной энергии Гиббса. Свободная энергия Гиббса при сворачивании белка напрямую связана с энтальпией и энтропией. Для возникновения отрицательного значения ΔG и для того, чтобы сворачивание белка стало термодинамически благоприятным, тогда либо энтальпия, либо энтропия, либо оба условия должны быть благоприятными.
Сведение к минимуму количества гидрофобных боковых цепей, подверженных воздействию воды, является важной движущей силой процесса складывания. Гидрофобный эффект (рис. 2.37) — это явление, при котором гидрофобные цепи белка схлопываются в ядро белка (вдали от гидрофильной среды). В водной среде молекулы воды имеют тенденцию к агрегированию вокруг гидрофобных областей или боковых цепей белка, создавая водные оболочки из упорядоченных молекул воды. Упорядочение молекул воды вокруг гидрофобной области увеличивает порядок в системе и, следовательно, способствует отрицательному изменению энтропии (уменьшению энтропии в системе).Молекулы воды фиксируются в этих водных клетках, что приводит к гидрофобному коллапсу или сворачиванию внутрь гидрофобных групп (рис. 2.38).
Рис. 2.38. Образование клатрата воды. ΔG. Подобные водные клетки могут объединяться вокруг гидрофобных белковых остатков перед правильным сворачиванием.
Гидрофобный коллапс возвращает энтропию в систему за счет разрушения водяных клеток, что освобождает упорядоченные молекулы воды. Множество гидрофобных групп, взаимодействующих внутри ядра глобулярно свернутого белка, вносит значительный вклад в стабильность белка после сворачивания из-за сильно накопленных сил Ван-дер-Ваальса (особенно сил Лондонской дисперсии).Гидрофобный эффект существует как движущая сила в термодинамике только при наличии водной среды с амфифильной молекулой, содержащей большую гидрофобную область. Прочность водородных связей зависит от их окружения; таким образом, водородные связи, заключенные в гидрофобное ядро, вносят больший вклад, чем водородные связи, находящиеся в водной среде, для стабильности нативного состояния.
Шапероны
Молекулярные шапероны представляют собой класс белков, которые помогают в правильной укладке других белков in vivo (Рисунок 2.39). Шапероны существуют во всех клеточных компартментах и взаимодействуют с полипептидной цепью, чтобы позволить сформироваться нативной трехмерной конформации белка; однако сами шапероны не включены в окончательную структуру белка, которому они помогают. Шапероны могут способствовать сворачиванию, даже когда возникающий полипептид синтезируется рибосомой. Молекулярные шапероны действуют путем связывания для стабилизации нестабильной в других отношениях структуры белка в его пути фолдинга, но шапероны не содержат необходимой информации, чтобы знать правильную нативную структуру белка, которому они помогают; скорее, шапероны работают, предотвращая неправильные складчатые конформации.
Рис. 2.39. Вид сверху комплекса бактериальных шаперонов GroES / GroEL, модель
Автор изображения: Википедия
Таким образом, шапероны фактически не увеличивают частоту отдельных шагов, участвующих в пути сворачивания к нативной структуре; вместо этого они работают, уменьшая возможные нежелательные агрегации полипептидной цепи, которые в противном случае могли бы замедлить поиск подходящего промежуточного соединения, и они обеспечивают более эффективный путь для полипептидной цепи, чтобы принять правильные конформации.Шапероны не следует путать с катализаторами сворачивания, которые на самом деле катализируют в противном случае медленные этапы пути сворачивания. Примерами катализаторов фолдинга являются протеин-дисульфидные изомеразы и пептидил-пролилизомеразы, которые могут участвовать в образовании дисульфидных связей или взаимном превращении между цис- и транс- стереоизомерами соответственно.
Показано, что шапероны
имеют решающее значение в процессе сворачивания белка in vivo , потому что они обеспечивают белок с помощью, необходимой для принятия его правильных выравниваний и конформаций, достаточно эффективно, чтобы стать «биологически релевантными».Это означает, что полипептидная цепь теоретически может складываться в свою нативную структуру без помощи шаперонов, как продемонстрировали эксперименты по укладке белков, проведенные in vitro ; , однако, этот процесс оказывается слишком неэффективным или слишком медленным, чтобы существовать в биологических системах; следовательно, шапероны необходимы для сворачивания белка in vivo. Показано, что наряду со своей ролью в содействии образованию нативных структур, шапероны участвуют в различных ролях, таких как транспорт белков, деградация и даже позволяют денатурированным белкам, подвергающимся воздействию определенных внешних денатурирующих факторов, возможность преобразоваться в их правильные нативные структуры.
Денатурация белка
Полностью денатурированный белок не имеет ни третичной, ни вторичной структуры, однако последовательность первичного белка остается нетронутой, и белок существует в виде случайной спирали (рис. 2.39). При определенных условиях некоторые белки могут складываться заново; однако во многих случаях денатурация необратима. Клетки иногда защищают свои белки от денатурирующего воздействия тепла с помощью ферментов, известных как белков теплового шока (тип шаперона), , которые помогают другим белкам как в сворачивании, так и в том, чтобы оставаться свернутыми (Рисунок 2.40). Белки теплового шока экспрессируются в ответ на повышенные температуры или другие стрессы. Некоторые белки вообще никогда не сворачиваются в клетках, кроме как с помощью шаперонов, которые либо изолируют отдельные белки, чтобы их сворачивание не прерывалось взаимодействиями с другими белками, либо помогают разворачивать неправильно свернутые белки, позволяя им повторно складываться в правильную нативную структуру. Эта функция имеет решающее значение для предотвращения риска осаждения в нерастворимые аморфные агрегаты.
Рисунок 2.40 Денатурация белка. На рисунке (1) изображен правильно свернутый интактный белок. На этапе (2) к системе подводится тепло, превышающее порог поддержания внутримолекулярных белковых взаимодействий. На этапе (3) показан развернутый или денатурированный белок. Цветные области денатурированного белка соответствуют окрашенным участкам природного свернутого белка, показанного на (1).
Схема предоставлена: Scurran15
К внешним факторам, участвующим в денатурации белка или нарушении нативного состояния, относятся температура, внешние поля (электрические, магнитные), скученность молекул и даже ограничение пространства, которые могут иметь большое влияние на сворачивание белков.Высокие концентрации растворенных веществ, экстремальные значения pH, механические силы и присутствие химических денатурирующих веществ также могут способствовать денатурации белка. Эти отдельные факторы вместе классифицируются как стрессы. Показано, что шапероны существуют в возрастающих концентрациях во время клеточного стресса и помогают правильному сворачиванию возникающих белков, а также денатурированных или неправильно свернутых.
При некоторых условиях белки не будут сворачиваться в свои биохимически функциональные формы.Температура выше или ниже диапазона, в котором, как правило, живут клетки, вызовет разворачивание или денатурирование термически нестабильных белков (вот почему кипячение делает яичный белок непрозрачным). Однако термостабильность белков далеко не постоянна; например, были обнаружены гипертермофильные бактерии, которые растут при температурах до 122 ° C, что, конечно, требует, чтобы их полный набор жизненно важных белков и белковых ансамблей был стабильным при этой температуре или выше.
Гидолиз
Гидролиз — это разрушение последовательности первичного белка путем добавления воды для преобразования отдельных мономерных звеньев аминокислот (Рисунок 2.41).
Рисунок 2.41 Гидролиз белков. В реакции гидролиза вода добавляется через амидную связь, включающую группу -ОН с карбонильным углеродом и реформируя карбоновую кислоту. Водород из воды преобразовывает амин.
Белки участвуют во многих клеточных функциях. Белки могут действовать как ферменты, которые увеличивают скорость химических реакций. Фактически, 99% ферментативных реакций внутри клетки опосредуются белками.Таким образом, они являются неотъемлемой частью процессов создания или разрушения клеточных компонентов. Белки также могут действовать как структурный каркас внутри клетки, помогая поддерживать клеточную форму. Белки также могут участвовать в клеточной передаче сигналов и коммуникации, а также в переносе молекул из одного места в другое. В экстремальных условиях, таких как голодание, белки также могут использоваться в качестве источника энергии внутри клетки.
обратно наверх
2.7 источников
OpenStax, белки. OpenStax CNX. 30 сентября 2016 г. http://cnx.org/contents/bf17f4df-605c-4388-88c2-25b0f000b0ed@2.
Файл: Хиральность руками.jpg. (2017, 16 сентября). Wikimedia Commons, хранилище бесплатных медиа . Получено 17:34, 10 июля 2019 г. с сайта https://commons.wikimedia.org/w/index.php?title=File:Chirality_with_hands.jpg&oldid=258750003.
авторов Википедии. (2019, 6 июля). Цвиттерион. В Википедия, Бесплатная энциклопедия .Получено 21:48, 10 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Zwitterion&oldid=9721
.
авторов Википедии. (2019, 8 июля). Абсолютная конфигурация. В Википедия, Бесплатная энциклопедия . Получено в 15:28, 14 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Absolute_configuration&oldid=
2423
.
Структурная биохимия / фермент / активный сайт. (2019, 1 июля). Викиучебники, проект бесплатного учебника . Получено 16:55, 16 июля 2019 г., с сайта https: // en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Enzyme/Active_Site&oldid=3555410.
Структурная биохимия / Белки. (2019, 24 марта). Викиучебники, проект бесплатного учебника . Получено в 19:16, 18 июля 2019 г., с сайта https://en.wikibooks.org/w/index.php?title=Structural_Biochemistry/Proteins&oldid=3529061.
Fujiwara, K., Toda, H., and Ikeguchi, M. (2012) Зависимость аминокислотной склонности α-спирали и β-складки от общего типа белковой складки. BMC Структурная биология 12:18.Доступно по адресу: https://bmcstructbiol.biomedcentral.com/track/pdf/10.1186/1472-6807-12-18
авторов Википедии. (2019, 16 июля). Кератин. В Википедия, Бесплатная энциклопедия . Получено 17:50, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Keratin&oldid=8340
.
авторов Википедии. (2019, 13 июля). Альфа-кератин. В Википедия, Бесплатная энциклопедия . Получено в 18:17, 19 июля 2019 г., с https://en.wikipedia.org/w/index.php? title = Альфа-кератин & oldid =
7410
Инициатива открытого обучения. (2019) Покровные уровни организации. Университет Карнеги Меллон. В анатомии и физиологии. Доступно по адресу: https://oli.cmu.edu/jcourse/webui/syllabus/module.do?context=4348
0020ca6010f804da8baf7ba.
авторов Википедии. (2019, 16 июля). Коллаген. В Википедия, Бесплатная энциклопедия . Получено в 03:42, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Collagen&oldid=
9954
.
авторов Википедии.(2019, 2 июля). Россманн фолд. В Википедия, Бесплатная энциклопедия . Получено в 16:01, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Rossmann_fold&oldid=
8788
.
авторов Википедии. (2019, 30 мая). Ствол ТИМ. В Википедия, Бесплатная энциклопедия . Получено в 16:46, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=TIM_barrel&oldid=899459569
.
авторов Википедии. (2019, 16 июля). Сворачивание белков. В Википедия, Бесплатная энциклопедия .Получено 18:30, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Protein_folding&oldid=4145
.
авторов Википедии. (2019, 11 июня). Глобулярный белок. В Википедия, Бесплатная энциклопедия . Получено 18:49, 20 июля 2019 г., с https://en.wikipedia.org/w/index.php?title=Globular_protein&oldid=
0467
.
авторов Википедии. (2019, 11 июля). Внутренне неупорядоченные белки. В Википедия, Бесплатная энциклопедия . Получено 19:52, 20 июля 2019 г., с https: // en.wikipedia.org/w/index.php?title=Intrinsically_disordered_proteins&oldid=2287
BCH / PLS / PPA 609 | Лекция Двадцать четыре веб-заметки
BCH / PLS / PPA 609 | Двадцать четвертая лекция в Интернете
Примечания
Двадцать четвертая лекция
Метаболизм азота — Незаменимые и небелковые
амино
кислотный биосинтез; прочие соединения азота
Цель: кратко рассказать об общих белковых аминокислотах и их свойствах.
Чтобы получить хорошие практические знания и понимание биосинтеза
незаменимые аминокислоты и другие избранные важные азотистые
соединения тканей растений.
Контур:
- Аминокислота обзор
- Биосинтез незаменимых аминокислот
- Катаболизм запасных белков
- Небелковые аминокислоты
- Амины
- Heme
- Азот и закись азота
Справочная информация для обсуждения
метаболизм аминокислот и других соединений N
:
a) ТРЕБУЕТСЯ (не требуется в 2016 году):
1 — Глава
8 и глава 9, раздел 9.5 биохимии и молекулярной биологии
текста класса «Растения».
б) ПРЕДЛАГАЕМЫЙ:
1 — Смарт, Д. и А. Дж. Блум. 2001. Листья пшеницы выделяют закись азота при ассимиляции нитратов. PNAS
98: 7875-7878.
2 — Лам
и другие. 1995. Использование мутантов и генов Arabidopsis для изучения амида амино.
кислотный биосинтез. Клетка растений 7, стр. 887-898.
3 — Го, Ф.К., М. Окамото и Н.М. Кроуфорд. 2003. Идентификация задействованного гена синтазы оксида азота растений.
в гормональной сигнализации. Наука 302: 100-103.
4 — Шоури
и другие. 1995. Запасные белки семян: структуры и биосинтез. Растение
Cell 7, pp. 945-956.
5 — фон
Wettstein et al. 1995. Биосинтез хлорофилла. Растительная клетка 7, стр.
1039-1057.
6 — Цайер, Дж., М. Делледон, Т. Мишина, Э. Севери, М.
Сонода и К. Лэмб. 2004. Генетическое выяснение передачи сигналов оксида азота
в несовместимых взаимодействиях растений и патогенов. Plant Physiol. 136:
2875-2886.
7 — Джасид, С., М. Симонтачки, К.Г. Бартоли и С. Пунтаруло. 2006. Хлоропласты как клеточный источник оксида азота. Влияние активных форм азота на хлоропластные липиды и белки. Plant Physiol. 142: 1246-1255.
8 — Пэн Пан, Эйлика Вул и Майкл Ф.Данн. 1997. Белок
архитектура, динамика и аллостерия в канале триптофансинтазы.
TIBS 22:
22-27.
Помните из лекций 22 и 23, N входит в корни как NO 3 — или
NH 4 + . NH 4 + включен в амино
кислоты в корнях и листьях, а аминокислоты накапливаются в белках. Главное если не
единственная функция некоторых белков — обеспечивать запас аминокислот (см. ниже).
Как упоминалось в лекциях 22 и 23, NH 4 + сформирован как
результат восстановления нитратов или фиксация N 2 — 1 st
включается в аминокислоты посредством реакции глутаминсинтетазы (GS):
Глутамат, потребляемый в реакции GS, пополняется за счет
альтернативный способ синтеза глутамата GOGAT г лютамат: o xo г лютарат a mino t трансфераза).
Общая схема метаболизма амино по отношению к общему метаболизму в растительных клетках:
приведено на следующем рисунке:
Растения содержат несколько изоферментов GS, некоторые из которых расположены в цитоплазме.
(= GS1), а другой — в пластидах (= GS2). Все исследованные растения содержат
не менее 3 изоферментов GS1, но только один кодируемый ядром GS2
изофермент.
[не охвачено в 2016 году]
GS2, по-видимому, наиболее важен в аммиаке.
ассимиляции, но изоферменты GS1 также функциональны.В
C 3 растений Производство аммония при фотодыхании может превышать
образующийся при восстановлении нитрита в 10 раз! Где аммоний
образуется при фотодыхании? Может ли аммоний усваиваться
другие ферменты?
Было показано, что GS2 пластид также ответственен за
фотодыхательная ассимиляция аммиака в листьях с помощью анализа GS2
мутанты. Как их можно выращивать? GS1 в листьях нет
экспрессируется в клетках мезофилла и, по-видимому, экспрессируется только во флоэме
клетки листьев.
[покрыто в 2016 году]
GS является мишенью для основного гербицида Баста ® (AgrEvo
Co.). Действующее вещество в Баста ® ,
Rely ® , Finale ® , Liberty ® и
Ignite ® — глюфосинат-аммоний. Глюфосинат (=
фосфинотрицин) — субстратный аналог глутамата и сильного
ингибитор GS, вызывающий накопление токсичных уровней аммония в обработанных
растения.Это может быть натуральный продукт, производимый Streptomyces (Lee et al., 2009). Таким образом, это гербицид широкого спектра действия. Глюфосинат
быстро разлагается в почве, не оставляя токсичных остатков.
В настоящее время на рынке продаются такие культуры, как кукуруза и рапс.
генетически сконструированы для устойчивости к фосфинотрицину или баста.
Такие гибриды кукурузы продаются под торговым наименованием.
Liberty-Link ® кукуруза. Метионин сульфоксимин также ингибирует GS.
азасерин ингибирует GOGAT (см. выше).Будет ли фосфинотрицин
как ожидается, повлияет на метаболизм у животных, включая человека? Назови некоторые
другие ферменты биосинтеза аминокислот, которые являются мишенями гербицидов
[не охвачено в 2016 году]
Считается, что
GDH в первую очередь катаболизирует (дезаминирует) глутамат. Почему?
Белки обычно содержат 20 различных аминокислот. Из них 20, 10
(называемые незаменимыми аминокислотами) не могут быть синтезированы млекопитающими и должны
быть полученным из рациона.Обсуждения аминокислот
биосинтез подчеркнет биосинтез незаменимых аминокислот в растениях.
См. Рис. 8.1
текста класса (в высоком разрешении). Какая аминокислота
кислоты «незаменимы»?
Все аминокислоты содержат основную аминогруппу и кислую карбоновую кислоту.
группу и имеют общую формулу:
NH 3 + CH (R) COO —
Заместитель R имеет широкий спектр химических свойств, начиная от H
в глицине, простейшей аминокислоте, к индольной группе
триптофан.
Аминокислоты разделены на четыре группы на основе
физико-химические свойства:
- Неполярный (гидрофобный):
________________________________________________ - Полярный
- незаряженный: ________________________________________________
- кислый: _________________________________________________
- основной: _________________________________________________
Белки представляют собой полипептиды, состоящие из> ~ 20-30 аминокислот, соединенных
пептидные связи.Пептидные связи образуются в реакциях дегидратации.
аналогично гликозидной связи полисахаридов, в которых амидная связь
образуется между карбоксильной группой одной аминокислоты и амино
группа другого:
Аминокислотный состав белков определяет его физические свойства.
тремя важными способами.
1. Размер или молекулярная масса белка.
зависит от количества (и размера) его аминокислот.
2. Заряд или изоэлектрическая точка pI зависит от относительной доли
основных и кислых аминокислот.
3. Гидрофобность определяется относительной
уровни гидрофобных и гидрофильных аминокислот.
Аминокислоты можно разделить на пять семейств в зависимости от биосинтетического происхождения (см.рис.
8.2):
- Семейство глутамата:
_______________________________________________ - Семейство пируватов: _______________________________________________
- Семья аспартатов: _______________________________________________
- Семья Шикимата: _______________________________________________
- Семейство серинов: _______________________________________________
Гистидин не входит ни в одно из этих семейств, поскольку не содержит других аминокислот.
кислота как непосредственный предшественник биосинтеза.
Биосинтез незаменимых аминокислот
Углеродные скелеты различных аминокислот поступают напрямую или
косвенно из промежуточных продуктов цикла Кальвина-Бенсона. Из этих,
3-фосфоглицерат является наиболее важным предшественником углерода в аминокислоте.
биосинтез, обеспечивающий углеродные скелеты для 16 из 20 аминокислот
кислоты. 3-фосфоглицерат, продуцируемый циклом Кальвина, может быть
экспортируется из пластид триозофосфатным транслокатором, расположенным в
пластидный конверт.Может быть преобразован в фосфоенолпируват.
(PEP) в цитозоле.
От PEP есть 2 ответвления пути: 1
приводя к пирувату, а другой к оксалоацетату.
Кроме того,
ПЭП + эритрозо-4-фосфат являются предшественниками синтеза ароматических
аминокислоты через путь шикимата. Оксалоацетат имеет 2
функции в синтезе аминокислот. 1) трансаминируется в аспартат,
предшественник аминокислот семейства аспартат; и 2) вместе с
пируват, это предшественник a-KG, который может быть
трансаминированный в глутамат, как описано в
Лекция 21.Глутамат — предшественник семейства глутамата.
аминокислоты. Фосфогликолят является предшественником семейства серинов.
аминокислоты и рибозо-5-фосфат для гистидина.
Происхождение аминокислот:
|
||||||||||||||||||||||
Эти промежуточные продукты биосинтеза аминокислот включают несколько
субклеточные сайты.Пируват и оксалоацетат образуются в
цитоплазма из 3-фосфоглицерата, первоначально образованная в хлоропластах
Цикл Кальвина. Некоторое количество пирувата перемещается в митохондрии, где
он превращается в ацетил-КоА, который может конденсироваться с оксалоацетатом,
образуя цитрат. Цитрат переносится в цитоплазму в
обмен на оксалоацетат, где он превращается в
а-КГ. Цитрат из цикла лимонной кислоты также может быть преобразован
в a-KG в митохондриях:
Глутамат, образованный из глутамина и α-KG,
как описано в лекции 23, является предшественником
синтез пролина, аргинина и аспартата.Аспартат
синтезируется из глутамата и оксалоацетата аминотрансферазой
реакция:
Глутамат + оксалоацетат α-KG + аспартат
Синтез аспарагина просто включает перенос другой аминогруппы.
от глутамина до аспартата в АТФ-зависимой реакции (см.рис.
8.4 выше). В темноте синтез аспарагина увеличивается:
аспарагин
может быть синтезирован непосредственно из аммония, но предпочтительно использует Q (gln) в качестве
Источник N:
Аспартат является предшественником синтеза 4 дополнительных аминокислот в
пластиды метионин, лизин, треонин и изолейцин (см. Galili 1995.The Plant Cell 7: 899-906 и следующий рисунок):
Стадия 1 st включает аспартаткиназу и это и некоторые
последующие ферменты в биосинтезе треонина и лизина являются
обратная связь подавляется этими двумя аминокислотами:
[охвачено в 2016 году]
3 ароматические аминокислоты: фенилаланин, тирозин и триптофан:
синтезируется из шикиматного пути, который встречается только в
микроорганизмы и растения.Путь шикимата — это не только
источник этих аминокислот также многих фенольных соединений, включая
пигменты, защитные соединения и особенно лигнин. Под нормальным
условий роста ~ 20% углерода, фиксируемого растениями, проходит через эту
путь. Путь шикимата включает 7 ферментативных этапов
очевидно расположенные в пластидах (рис. 1 из Herrmann 1995. The Plant Cell
7: 907-919). Этот путь, ведущий к фенилпропаноидам, был описан в лекциях 20 и 21 и в целом Guillet et al.(2000).
Биосинтез ароматических аминокислот
Предпоследняя стадия биосинтеза хоризматов катализируется енолом 5- пирувилшикимат-3-P синтазой (EPSPS)
[не охвачено в 2016 году]
Дикамба устойчивые культуры …
Биосинтез триптофана, пожалуй, наиболее изученная аминокислота.
биосинтетический путь у растений (см. раздел 8.3 текста класса). Синтез из хоризмат
включает 6 локализованных в пластиде ферментативных стадий, как показано на рисунке 2.
Радвански и Ласт (1995, The Plant Cell 7: 921-934) и рис.
8.33 текста класса. В
1 этап st включает добавление амина и третьего кольца
двойная связь, образующая антранилат. Остальное индольное кольцо
построение структуры начинается с добавления фосфорибозы. В
на этапе 3 rd происходит перегруппировка фосфорибозильной группы с последующим перегруппировкой
замыканием индольного кольца на этапе 4.Последние 2 шага:
катализируется субъединицами триптофансинтазы со стадией 5 -й
с удалением группы глицерин-3-P, образующей индол, и
6 -е добавление серина к индольному кольцу, продуцирующее
триптофан. Индольные фитоалексины образуются из Trp.
Биосинтез триптофана у кишечных бактерий представляет собой классический пример истинного биохимического «каналирования». Как Pan et al. (1997) объяснение:
«Форма α2β2 биферментного комплекса триптофансинтазы катализирует последние две стадии синтеза L-триптофана, последовательные процессы, которые зависят от канализации общего метаболита, индола, между сайтами α- и β-субъединиц через туннель длиной 25 Å.Направление индола и связывание активностей двух сайтов контролируется аллостерическими сигналами, происходящими от ковалентных преобразований в β-сайте, которые переключают фермент между открытым, низкоактивным состоянием, с которым связываются лиганды, и закрытым, состояние высокой активности, предотвращающее выход индола ».
Катаболизм запасных белков
Растения обычно хранят аминокислоты в белках в запасных тканях.
Также растения часто перерабатывают аминокислоты из оборота белков в
стареющие ткани, такие как листья. Растения содержат 5 основных классов
эндопротеиназы (обзор Callis 1995, The Plant Cell 7: 921-934 и в
раздел 9.5 текста класса):
- Сериновые протеиназы
- Цистеиновые протеиназы
- Протеиназы аспарагиновой кислоты
- Металлопротеиназы
- Протеосомные протеолитические комплексы
Группы 1-4 локализованы в вакуолях, в том числе в некоторых белковых телах и
большинство из них имеют оптимальные значения pH.
Протеосомы протеолитические
комплексы известны в ядрах и цитозоле. Пока не известно
если они также могут быть обнаружены в хлоропластах, митохондриях или ER.
Эти эндопротеиназы часто вызывают значительные проблемы при очистке.
и биохимическая характеристика растительных белков.Протеиназа
ингибиторы доступны для многих из этих эндопротеиназ. Серин
Ингибиторы протеиназ включают фенилметилсульфонилфторид (PMSF),
ингибиторы трипсина, апротинин и лейпептин. Цистеиновые протеиназы
может ингибироваться йодацетатом, йодацетамидом и аспарагиновой кислотой
протеиназа пепстатином. Ингибиторы металлопротеиназы включают:
1,10-фенантролин и ЭДТА. В последнее время ряд биохимических
поставщики ввели удобную (и довольно дорогую) протеиназу
коктейли с ингибиторами для облегчения исследований биохимии белков, поскольку многие
ткани имеют ряд протеиназ, которым необходим массив протеиназ.
ингибиторы.
Распад белка — важный фактор в растении.
развитие, как сообщили Хеллманн и Эстель в их журнале Science 2002 г.
статья.
Небелковые аминокислоты
Белки всех организмов основаны на 20 распространенных L-аминокислотах.
хотя некоторые из них могут быть изменены посттрансляционно. Однако некоторые
растения, особенно представители Leguminosae и Liliaceae, делают многие
разные аминокислоты, не входящие в состав белков.
Эти так называемые небелковые аминокислоты могут накапливаться до высокого уровня в
запасные ткани, такие как семена и корневища, в количестве до 10% от сухого веса
и 50% азота. Два примера небелковых аминокислот
представляют собой 3-цианоаланин и L-канаванин . Обратите внимание
структурное сходство 3-цианоаланина с L-аспарагином:
И L-канаванин до L-аргинина:
Эти небелковые аминокислоты в основном играют роль в защите растений, но могут
также действуют как уменьшенные структуры хранения N.У них есть несколько
действия по борьбе с вредителями, описанные в тексте, включая подавление
аминоацил-тРНК синтетазы или другие стадии синтеза белка. В
в других случаях они могут быть включены в белки вместо нормальных
аминокислоты, приводящие к дефектным белкам. Растения, синтезирующие
этим небелковым аминокислотам удается избежать любой токсичности этих
соединения, имеющие аминоацил-тРНК синтетазы, которые ни
ингибируются небелковыми аминокислотами и не включают их в
белки.Некоторые насекомые развили аналогичные приспособления, такие как
жук-брухидея и долгоносик, которые могут питаться семенами бобовых,
Dioclea megacarpa , уровень канаванина токсичен для других
насекомые (Розенталь, Великобритания, кафедра биологии).
Амины
Амины можно разделить на алифатические моно- и диамины,
полиамины , ароматические амины и конъюгаты аминов:
Амины являются катионными при физиологических значениях pH, имеющих pK и .
9-11.Особенно много алифатических моноаминов в цветках
некоторые растения, такие как Araceae и Rosaceae. У них есть
запах гниющей плоти и привлекателен для некоторых существ, которые служат
как опылители. Основной путь биосинтеза у высших растений
включает перенос аминогруппы от аланина к альдегиду в
митохондрии, продуцирующие амин и кетокислоту:
Полиамины спермидин и спермин кажутся
повсеместно встречается в растениях, как и диамин , путресцин .
Диамин, , кадаверин , был обнаружен только в бобовых:
Ожидаете ли вы, что эти молекулы будут иметь различный запах?
Что вы можете ожидать от этих молекул в клетках?
У бактерий путресцин и полиамины играют роль в стабилизации ДНК.
и структура хромосом, как и гистоны в ядерных хромосомах.
Хлоропласты и митохондрии не содержат гистонов, путресцина и
полиамины могут выполнять эту роль в этих органеллах.Полиамины могут
также стимулируют синтез белка, вероятно, за счет взаимодействия с РНК.
L-аргинин может быть предшественником путресцина, а L-лизин или
L-гомоаргинин кадаверина.
Конденсация S-метил-S-аденозил гомоцистеамина (SMAH)
[от декарбоксилирования S-аденозил-L-метионина (SAM) (см. лекцию 25)] с
путресцин образует спермидин и конденсацию спермидина с SMAH
образует спермин. Путресцин (и спермидин, и
спермин) также может быть получен в результате декарбоксилирования небелкового
аминокислота орнитин, как будет описано в лекции 26.
Ароматические амины обычно получают декарбоксилированием аминогруппы.
кислоты. Например, дофамин , триптамин и
гистамин образованы из 3,4-дигидроксифенилаланина, триптофана
или гистидин:
Гистамин и серотонин , образованные гидроксилированием триптамина,
являются важными нейротрансмиттерами. «Укус» крапивы
( Urtica dioica и другие виды) происходит от накопления
гистамин, серотонин и ацетилхолин в луковицах или железах на
кончики волосков или трихомы на листьях. Когда кто-то пробирается мимо этих
растения, эти нейротрансмиттеры сразу вводятся в кожу
вызывая болезненный зуд и отек.
В лекции 11 мы обсудили высвобождение токсичного цианида из цианогенных
глюкозиды , также известные как цианогены. Цианогенные глюкозиды являются
синтезируется из аминокислот и моносахаридов в микросомах:
Это включает N-гидроксилирование аминокислоты с последующим
декарбоксилирование с образованием альдоксимина.Альдоксимин обезвоживается
в нитрил, который затем гидроксилируют. Цианогенный гликозид — это
образуется между гидроксильной группой 2-гидроксинитрила и
моносахарид UDP-глюкозида.
Heme
Гем — порфирин — еще одно важное соединение азота. В
синтез гема такой же, как и для хлорофилла (описан в
Лекция 2 и фон Веттштейн и др. 1995 г. завода
Cell) до протопорфирина IX.Протопорфирин IX превращается в
гем путем добавления железа ферро-хелатазой. Гем — это
незаменимый компонент многих кислорода, включая белки, такие как цитохромы.
Хлорофиллы — это Mg +2 , содержащие замещенные
тетрапирролы, структурно связанные с гемами, Fe +2 , содержащие
порфирины. Структура хлорофилла представлена на рис.
статья von Wettstien et al. (1995) из Plant Cell:
Хлорофилл синтезируется в
хлоропласты из 8 молекул 5-аминолевулиновой кислоты.
8 красных линий указывают расположение частей 5-аминолевулиновой кислоты в
готовая молекула. Положение 3, которое представляет собой метильную группу в хлорофилле
a (проиллюстрировано) представляет собой формильную (CHO) группу в хлорофилле b. В высшем
растения 5-аминолевулиновая кислота синтезируется из глутаминовой кислоты в виде
проиллюстрировано на рис. 4 von Wettstien et al. (1995):
азота и закиси азота
Оксид азота (NO) — недавно обнаруженная сигнальная молекула в
животные.NO участвует как в физиологических, так и в патофизиологических процессах.
состояния, включая воспаление, острые реакции и запрограммированную гибель клеток.
NO входит в очень интересную группу соединений, известных как реактивных.
формы кислорода (АФК) . АФК действуют как диффузные межклеточные
сигналы для активации различных защитных генов у животных, бактерий и
растения. Можете ли вы назвать ROS, которую недавно предлагали активировать?
защитные реакции у растений?
NO обладает уникальным химическим составом, который обеспечивает одновременно стабильность и реакционную способность.
время.По этой причине NO и его окислительно-восстановительные формы считаются
как единственная ROS, которая может удовлетворить требования истинного внутри- и меж-
клеточная сигнальная молекула.
NO может образовываться в растениях двумя способами:
1. NO может производиться неферментативно в результате опосредованного светом превращения
NO 2 по каротиноидам или
2. NO может образовываться ферментативно из NO 2 нитратом NADPH.
редуктазы.
Накапливаются данные о причастности NO как эффектора к росту растений,
развитие и защита. Дурнер, Вендеэнн и Клессиг недавно в Рутгерсе
продемонстрировали индукцию защитного гена в табаке с помощью NO
(Дж. Дарнер, Дэвид Вендехенн и Дэниел Ф. Клессиг. 1998.
Индукция защитного гена в табаке оксидом азота, циклическим GMP и циклической ADP-рибозой
PNAS 95: 10328-10333).
Что такого особенного в структуре NO, что приводит к его уникальности?
характеристики?
Последнее задание на 2004 год: перечитайте Guo et al.(2003) документ (цитата выше), если необходимо, и опишите реакцию
катализируется ATNOS1 согласно Guo et al. (2003). Придайте структуру субстратам и изделиям. Вкратце какие
фенотипические последствия того, что растения арабидопсиса не могут осуществлять эту реакцию? (5 баллов)
Закись азота (N 2 O) является ключевым
атмосферный парниковый газ, который способствует глобальному изменению климата за счет
радиационное потепление и истощение стратосферного озона.Умный
и Bloom (2001) сообщают о корреляции листа N 2 O
выбросы с нитратом листьев
ассимиляционная активность, измеренная с помощью ассимиляционная активность
частное, отношение ассимилированного CO 2 к выделившемуся O 2 .
Продукция N 2 O in vitro как интактными хлоропластами, так и
нитритредуктаза, но не нитрат- редуктаза, указывает на то, что N 2 O, продуцируемый листьями, происходит
во время фотоассимиляции NO
в хлоропласте. Учитывая большое количество NO
ассимилировали растениями земной биосферы, эти
наблюдения показывают , что образование N 2 O во время NO
фотоассимиляция может быть важным глобальным биогенным источником N 2 O .
Справочная информация для обсуждения
Н / П соединения
:
а)
ТРЕБУЕТСЯ:
1 — Глава
16 разделов 16.10 — 16.14 Биохимии и молекулярной биологии
Текст класса растений.
б)
ПРЕДЛАГАЕМОЕ:
1 — Стефан Равенель, Бертран Гакьер, Доминик Джоб и Роланд
Дус. 1998. Особенности биосинтеза и метаболизма метионина в растениях. PNAS 95: 7805-7812.
2 — Томас Леустек, Мелинда Н. Мартин, Джули-Энн Бик и Джон П. Дэвис.
2000. ПУТИ И РЕГУЛЯЦИЯ ОБМЕНА СЕРЫ, ВЫЯВЛЕННЫЕ С ПОМОЩЬЮ МОЛЕКУЛЯРНЫХ И ГЕНЕТИЧЕСКИХ ИССЛЕДОВАНИЙ.Анну. Rev. Plant Physiol. Растение. Мол. Биол. 51: 141-165.
3 — Наоко Ёсимото, Эри Иноуэ, Кадзуки Сайто, Томоюки
Ямая и Хидеки Такахаши. 2003. Локализующийся во флоэме переносчик сульфата, Sultr1; 3, Опосредует перераспределение серы от источника к органам стока у Arabidopsis1.
Plant Physiol. 131:
1511-1517.
4 — Коприва С., М. Сутер, П. фон Баллмос, Х. Гессе, У. Крахенбуль, Х. Ренненберг и К. Брунольд.
2002. Взаимодействие ассимиляции сульфатов с метаболизмом углерода и азота у Lemna minor.Физиология растений. 130: 1406-1413.
5 — Анна
Копривова, Марианна Сутер, Роэль Оп ден Камп, Кристиан Брунольд, Станислав
Коприва. 2000 г.
Регуляция ассимиляции сульфатов азотом у Arabidopsis. Plant Physiol.
122:
737-746.
6 — Шибагаки, Н., А. Роуз, Дж. П. Макдермотт, Т. Фудзивара,
Х. Хаяси, Т. Йонеяма и Дж. П. Дэвис. 2002. Селенат-устойчивые мутанты Arabidopsis thaliana идентифицируют Sultr1; 2, переносчик сульфата, необходимый для эффективного транспорта сульфата в корни.Завод J. 29:
475-486.
Если у Вас возникнут вопросы, напишите нам.
или комментарии относительно курса или веб-страниц.
Эта страница последний раз была изменена 1 марта 2016 г.
Конспект, лекция 6 — Структура белка — BCh3333 — Введение
Лекция 6
Иерархию структуры белков можно разделить на четыре группы.
Первичная структура — это аминокислотная последовательность, которая определяет, какие строительные блоки
в протеине есть.Вторичная структура — это локализованные элементы, состоящие из 6-24 остатков (остаток
другой термин для аминокислоты). Есть альфа-спираль или бета-гофрированная вторичная
конструкции.
Третичная структура является результатом взаимодействия вторичной структуры, и это
взаимодействие определяет третичную структуру. Третичная структура всегда сделана
из одной полипептидной цепи.
Четвертичная структура состоит из собранных пептидов, которые взаимодействуют для создания
большой белковый комплекс.
Белки принимают трехмерную конформацию, и одна и та же первичная последовательность всегда дает
та же трехмерная структура.Это необычно, поскольку большинство молекул этому не соответствуют. Этот
«Собственная складка» важна по структуре, поскольку дает информацию о функции белка. В
сворачивание происходит потому, что оно более термодинамически стабильно. Родная складка имеет большую
количество благоприятных взаимодействий и его энтропийная стоимость преодолеваются благоприятными
взаимодействия в белке.
Гидрофобные взаимодействия уменьшают сольватную оболочку вокруг белка. Гидрофобный
аминокислоты: val, ile, leu, met, phe
Гидрофобные силы достаточно сильны, чтобы втягивать боковые цепи внутрь корпуса.
белок (воды там нет).
Водородные связи: HB возникают между основной цепью NH / CO и взаимодействия между
боковые цепи. Аминокислоты HB включают: Ser, Thr, Tyr, Gln, Asn, Trp. Все HB обычно включены
внутри белка, и всегда существует некоторая степень протекания водородных связей.
Силы Лондона: происходит, когда группы собираются близко друг к другу. Плотность упаковки составляет
высокий уровень белков (0,75 по сравнению с 0,7 кристаллов и 0,6 масла), поэтому есть сильные
ЛДФ в интерьере.
Электростатические силы возникают при взаимодействии заряженных боковых цепей и заряженных остатков.
часто находятся на поверхности белка.
Пептидная связь — это амидная связь, которая удерживает остатки вместе. Есть резонанс и
это приводит к тому, что связь становится короче, чем сигма-связь C-N (из-за некоторой двойной связи
степень). Связь C-O становится длиннее, и характеристики двойной связи вызывают
ограниченное вращение вокруг своей оси.
Белки существуют в транс- или цис-конфигурациях. Транс гораздо более распространен, чем цис.
стерическое препятствие между двумя атомами углерода sp3.
ИСКЛЮЧЕНИЕ: пролин, это 90% транс и 10% цис.
Плоскостность пептидных связей также влияет на их связи.Мы можем измерить плоскостность по двугранному
угол (омега). Омега — это 0 или 180 градусов. Фи и пси — это два других угла к
рассмотреть возможность. Каждый альфа-углерод имеет один угол фи и один фунт на квадратный дюйм. Пси и фи — самые длинные
угол, и это когда они полностью разводятся на 180 градусов.
Большинство углов phi / psi запрещены из-за стерического конфликта, эти углы рассчитываются по формуле
Рамачандра строит. Для каждой аминокислоты есть графики R. Графики были psi / phi
Углы наклона разветвленных аминокислот становятся меньше.График R для глицина равен
очень большой.
Пролин имеет наиболее жесткий R-график, и его углы psi / phi становятся очень ограниченными.
Вторичные структуры имеют небольшие диапазоны фи / фунт / кв. Дюйм, но разрешены три и
общие зоны.
Альфа-спираль
Бета-листы
Левая альфа-спираль (редко)
Три основных типа вторичных структур: альфа-спираль, бета-лист или
повороты / полосы.
Средний глобулярный белок состоит из 31% альфа-спирали, 28% бета-листа и ~ 40% витков и
петли.
Миоглобин и цитохром B 562 являются примерами полностью спиральных альфа-спиралей.
Иммуноглобины — это белки, полностью состоящие из бета-листов.
Винтовые конструкции можно охарактеризовать остатками на оборот (n) и расстоянием
высота подъема спирали за оборот (p)
Правая альфа-спираль имеет фи -57 градусов, фунт / кв.дюйм -47 градусов, n = 3,6 амино.
кислоты на виток и p 5,6 ангстрем на виток. Альфа-спираль удерживается вместе
водородные связи между NH и CO.HB — прочные и линейные, они плотно упакованы в конус, что позволяет
Лондон заставляет присутствовать. Боковые цепи / группы R всегда выступают из спирали.
Другие спиральные структуры образуются HB и обозначаются nm. n — вычеты, а m —
количество атомов на виток спирали.
2,2 7 никогда не встречается в природе, 3 10 плотнее и тоньше, чем альфа-спираль, пи
спираль шире и более плоская, чем спираль альфа. Полость пи-спирали менее устойчива и
больше, поэтому между атомами будет больше места.
Курс химии и физики биомолекул Страница
Химия и физика биомолекул
Биология 5357
Осенний семестр 2021 года
Курсный руководитель: Джей Пондер
Общая информация
Программа
и расписание
[PDF]
Конспекты лекций
Лекция 01 (30 августа): Таксономия белков I: Первичная и вторичная структура
[PDF]
[Video-Fall2020]
Лекция 02 (01 сентября): Таксономия белков II: Мотивы и супервторичная структура
[PDF]
[Video-Fall2020]
Лекция 03 (3 сентября): Таксономия белков III: Третичная структура и типы складок
[PDF]
[Video-Fall2020]
Лекция 04 (8 сентября): Сворачивание белков I: Силы, определяющие структуру
[PDF]
[Видео]
Лекция 05 (10 сентября): Сворачивание белка II: механизмы сворачивания белка
[PDF]
[Видео]
Лекция 06 (13 сентября): Сворачивание белков III: исследования мутагенеза сворачивания и стабильности
[PDF]
[Видео]
Лекция 07 (15 сентября): Внутренне нарушенные белки и их биологическое значение
[PDF]
[Видео]
Лекция 08 (17 сентября): Экспериментальные методы изучения IDR
[PDF]
[Видео]
Лекция 09 (20 сентября): Основы молекулярной динамики и моделирование методом Монте-Карло
[PDF]
[Видео]
Лекция 10 (22 сентября): Методы отбора проб и расчеты свободной энергии
[PDF]
[Видео]
Лекция 11 (24 сентября): Эксперименты по мутагенезу и дизайн белков
[PDF]
[Видео]
Лекция 12 (27 сентября): Прогнозирование структуры белка и AlphaFold DeepMind
[PDF]
[Видео]
Лекция 13 (29 сентября): Теоретические методы и примеры из практики для IDR
[PDF]
[Видео]
Лекция 14 (4 октября): Статистика полимеров I: Основы теории
[PDF]
[Видео]
Лекция 15 (6 октября): Статистика полимеров II: Реальные цепочки и приложения
[PDF]
[Video-Fall2020]
Лекция 16 (8 октября): Статистика полимеров III: Смеси полимеров
[PDF]
Наборы задач, предварительные экзамены и ответы
Белки: набор задач 01
[PDF]
Ответы
[PDF]
Белки: набор задач 02
[PDF]
Ответы
[PDF]
Белки: набор задач 03
[PDF]
Ответы
[PDF]
Белки: набор задач 04
[PDF]
Ответы
[PDF]
Экзамен по модулю
Proteins (2017)
[PDF]
Ответы
[PDF]
Экзамен по модулю
Proteins (2018)
[PDF]
Ответы
[PDF]
Экзамен по модулю
Proteins (2019)
[PDF]
Ответы
[PDF]
Экзамен на
Proteins Module (2021)
[PDF]
Ответы
Разделы обсуждения
Обсуждение 01 (02 сентября): Как использовать VMD, Chimera и PyMOL
[Video-Fall2020]
Обсуждение 02 (сентябрь 09): Третичный алфавит для наблюдаемого белка
Structural Universe, C.О. Маккензи, Дж. Чжоу и Г. Григорян,
Труды Национальной академии наук США, E7438-E7447 (2016)
[PDF]
Полезное резюме вышеупомянутой статьи PNAS появилось на Phys.org как:
Managing Compleity: Novel Protein Folding Tool значительно упрощает
Понимание того, как последовательность кодирует структуру, S. M. Dambrot, (2016)
[PDF]
Примечание, недавняя статья по теме: Universal Architectural Concepts
Underlying Protein Folding Patterns, A. S. Konagurthu, R.Субраманиан,
Л. Эллисон, Д. Абрамсон, П. Дж. Стаки, М. Гарсия де ла Банда
и А. М. Леск, Границы молекулярных биологических наук, 7 , 612920 (2021)
[PDF]
Обсуждение 03 (16 сентября): Сверхбыстрая кинетика сворачивания WW-доменов
Выявить, как аминокислотная последовательность определяет предел скорости сворачивания белка
, М. Щепаниак, М. Иглесиас-Бексига, М. Черминара, М. Садки,
К. Санчес де Медина, Дж. К. Мартинес, И. Луке и В. Муньос, Proceedings
Национальной академии наук США, 116 , 8137-8142 (2019)
[PDF]
Обзор механизма сворачивания белков быстрого сворачивания, выполненный некоторыми
теми же авторами: «Когда быстрее — лучше: основы сворачивания белков»
и механизмы сверхбыстрых подходов, V.Муньос и М. Черминара,
Биохимический журнал, 473 , 2545-2559 (2016)
[PDF]
Обсуждение 04 (23 сентября): Эффективные концентрации, обеспечиваемые
неупорядоченными линкерами, регулируются Polymer Physics,
CS Sorensen and M. Kjaerjaard, Proceedings of the National
Academy of Sciences USA, 116 , 8137-8142 (2019 )
[PDF]
Обсуждение 05 (30 сентября): Белок-пептидная ассоциация
Кинетика за пределами секунд временной шкалы из атомистического моделирования,
F.Пол, К. Вемейер, Э. Т. Абуалрус, Х. Ву, М. Д. Крэбтри,
Дж. Шонеберг, Дж. Кларк, К. Фройнд, Т. Р. Вейкл и Ф. Ноэ,
Nature Communications, 8 , 1095-1104 (2017)
[PDF]
Обсуждение 06 (октябрь 07): Конформационные ансамбли
внутренне неупорядоченного белка, согласующиеся с ЯМР, SAXS и одномолекулярным FRET
, G.-N. Гомес, М. Кшемински, А. Намини, Э. В. Мартин,
Т. Миттаг, Т. Хед-Гордон, Дж. Д. Форман-Кей и К. К. Градинару,
Журнал Американского химического общества, 142 , 15697-15710 (2020)
[PDF]
Материалы для чтения и ссылки
Структура и таксономия белка
Белки — это полимеры, которые складываются в определенные структуры, Глава 1,
Protein Actions,
Discussion 05 (Sep 30): Protein-Peptide Association
Kinetics Beyond the Seconds Timescale from Atomistic Simulations,
F.Пол, К. Вемейер, Э. Т. Абуалрус, Х. Ву, М. Д. Крэбтри,
Дж. Шонеберг, Дж. Кларк, К. Фройнд, Т. Р. Вейкл и Ф. Ноэ,
Nature Communications, 8 , 1095-1104 (2017)
[PDF]
И. Бехар, Р. Л. Джерниган и К. А. Дилл, стр. 1-28, Наука о гирляндах (2017)
[PDF]
Анатомия и таксономия структуры белка, Дж. С. Ричардсон,
[Обновлено Д. К. Ричардсон и Дж. С. Ричардсон, 2000-2007]
Достижения в химии белков, 34 , 167-339 (1981)
[PDF]
Взгляд на белки: представления, складывание, упаковка и дизайн,
J.С. Ричардсон, Д. К. Ричардсон, Н. Б. Твиди, К. М. Гернерт,
Т. П. Куинн,
М. Х. Хехт, Б. В. Эриксон, Ю. Ян, Р. Д. Макклейн, М. Е. Донлан
и M. C. Surles,
Biophysical Journal, 63 , 1186-1209 (1992).
[PDF]
интересных веб-сайтов для структурного анализа белков
[PDF]
Сворачивание и стабильность белков
Белки имеют стабильные равновесные конформации, Глава 3,
Protein Actions,
I. Behar, R. L. Jernigan и K. A. Dill, стр. 53-80, Наука о гирляндах (2017)
[PDF]
Сворачивание и агрегирование — кооперативные переходы, Глава 5,
Protein Actions,
I.Бехар, Р. Л. Джерниган и К. А. Дилл, стр. 107-128, Наука о гирляндах (2017)
[PDF]
Принципы кинетики сворачивания белков, Глава 6,
Protein Actions,
I. Behar, R. L. Jernigan и K. A. Dill, стр. 129-160, Наука о гирляндах (2017)
[PDF]
Проблема сворачивания белка, 50 лет спустя,
К. А. Дилл и Дж. Л. МакКаллум, Science, 338 , 1042-1046 (2012)
[PDF]
Когда голодание лучше: основы и механизмы сворачивания белков
от Ultrafast Approaches, V.Муньос и М. Черминара,
Биохимический журнал, 473 , 2545-2559 (2016)
[PDF]
Измерение конформационной стабильности белка,
С. Н. Пейс и Дж. М. Шольц,
из Структура белка: практический подход, 2-е издание ,
под редакцией Т. Крейтона, стр. 299-321, Oxford University Press (1997)
[PDF]
Понимание сворачивания белков через поверхности свободной энергии
из теории и экспериментов,
А. Р. Диннер, А. Сали, Л. Дж. Смит, К.М. Добсон и М. Карплюс,
Тенденции в биохимических науках, 25 , 331-339 (2000)
[PDF]
«Ограничение скорости сворачивания белков», J. Kubelka, J. Hofrichter и
W. A. Eaton,
Current Opinion in Structural Biology, 14 , 76-88 (2004)
[PDF]
The Protein Folding Problem, K. A. Dill, S. B. Ozkan, M. S. Shell и
T. R. Weikl, Annual Reviews of Biophysics, 37 , 289-316 (2008)
[PDF]
Мутантные последовательности как зонды механизмов сворачивания белков,
C.Р. Мэтьюз и М. Р. Херл, Bioessays, 6 , 254-257 (1987).
[PDF]
Кривые стабильности белка
, W. J. Becktel и J. A. Schellman,
Biopolymers, 26 , 1859-1877 (1987)
[PDF]
Внутренне нарушенные белковые области
Функциональная важность структуры в неструктурированных белковых областях,
Н. Э. Дэви, Текущее мнение в структурной биологии, 56 , 155-163 (2019)
[PDF]
Внутренне нарушенные белки и их «таинственная» (мета) физика,
V.Н. Уверский, Границы физики, 7 , 10 (2019)
[PDF]
Внутренне неупорядоченные белковые области и разделение фаз:
детерминанты последовательности сборки или ее отсутствия, Э. В. Мартин и
А. С. Холхаус, Новые темы в науках о жизни, 4 , 307-329 (2020)
[PDF]
Молекулярная динамика и моделирование Монте-Карло
Молекулярное моделирование и конформационный отбор образцов, Глава 10,
Protein Actions,
И. Бехар, Р. Л. Джерниган и К.А. Дилл, стр. 221-249, Наука о гирляндах (2017)
[PDF]
Дизайн и прогноз структуры белка
The Coming Age of de Novo Protein Design, P.-S. Хуанг,
С. Э. Бойкен и Д. Бейкер, Nature, 537 , 320-327 (2016)
[PDF]
Точное прогнозирование белковых структур и взаимодействий с использованием трехканальной нейронной сети
, М. Бэк, Ф. ДиМайо, И. Анищенко,
Дж. Даупарас, С. Овчинников, Г. Р. Ли, Дж. Ван, К. Конг, Л. Н. Кинч,
р.Д. Шеффер, К. Миллан, Х. Парк, К. Адамс, С. Р. Глассман,
А. ДеДжованни, Дж. Х. Перейра, А. В. Родригес, А. А. ван Дейк,
А. С. Эбрехт, Д. Д. Опперман, Т. Сагмайстер, К. Бюлхеллер,
Т. Павков-Келлер, М.К. Ратинасвами, Удит Далвади, С.К. Йип, Дж. Э. Берк,
К.С. Гарсия, Н.В. Гришин, П.Д. Адамс, Р.Дж. Рид и Д. Бейкер,
Science, 373 , 871-876 (2021)
[PDF]
AlphaFold 2 DeepMind
CASP14: Чего на самом деле удалось достичь с помощью AlphaFold2 от Google DeepMind,
и что он означает для сворачивания белков, биологии и биоинформатики,
C.О. Рубьера, Oxford Protein Informatics Group, декабрь 2020 г.
[PDF]
Революция в предсказании структуры белка, M. AlQuraishi,
Nature, 596 , 487-488 (2021)
[PDF]
Высокоточное предсказание структуры белка с помощью AlphaFold,
Дж. Джампер, Р. Эванс, А. Прицель, Т. Грин, М. Фигурнов, О. Роннебергер,
К. Тунясувунакул, Р. Бейтс, А. Зидек, А. Потапенко , A. Bridgland,
C. Meyer, SAA Kohl, AJ Ballard, A. Cowie, B. Romera-Paredes,
S.Николов, Р. Джайн, Дж. Адлер, Т. Бэк, С. Петерсен, Д. Рейман,
Э. Клэнси, М. Зелински, М. Стейнеггер, М. Пахольска, Т. Бергаммер,
С. Боденштейн, Д. Сильвер, О. Виньялс, А. В. Старший, К. Кавукчуоглу,
П. Кохли и Д. Хассабис, Nature, 596 , 583-589 (2021)
[PDF]
Высокоточное предсказание структуры белка для протеома человека,
K. Tunyasuvunakool, J. Adler, Z. Wu, T. Green, M. Zielinski, A. ídek,
A. Bridgland, A. Cowie, C. Meyer, A Лейдон, С.Веланкар, GJ Kleywegt,
A. Bateman, R. Evans, A. Pritzel, M. Figurnov, O. Ronneberger, R. Bates,
SAA Kohl, A. Potapenko, AJ Ballard, B. Romera-Paredes,
S. Николов, Р. Джайн, Э. Клэнси, Д. Рейман, С. Петерсен, А. В. Старший,
К. Кавукчуоглу, Э. Бирни, П. Кохли, Дж. Джампер и Д. Хассабис
Nature, 596 , 590- 596 (2021 год)
[PDF]
Статистика полимеров
Polymer Physics, M. Rubinstein and R.H. Colby,
Oxford University Press, 2003, Глава 2, Идеальные цепочки
[PDF]
Физика полимеров, М.Рубинштейн и Р. Х. Колби,
Oxford University Press, 2003, Глава 3, Идеальные цепи
[PDF]
Polymer Physics, M. Rubinstein and R.H. Colby,
Oxford University Press, 2003, Глава 4, Идеальные цепочки
[PDF]
Программное обеспечение для молекулярного моделирования
Информация о программном обеспечении
[ТЕКСТ]
Химера [DIR]
ChimeraX [DIR]
KiNG [DIR]
PyMOL [DIR]
VMD [DIR]
Онлайн-курс биохимии, Университет Торонто
Этот курс знакомит с основами биохимии и предлагает различные медицинские перспективы.Три основных предметных области — это белки и ферменты, метаболизм, нуклеиновые кислоты и поток биологической информации.
Курс даст вам представление о белках, молекулах, действующих в организме, о том, как сжигать жир в метаболических путях во время бега, а также о биоэнергетике во время марафонов, а также о том, как генетическая информация, хранящаяся в вашей ДНК, делает вас тем, кто вы есть. , связывая вас с вашими родителями и вашими детьми.
Предоставление нуклеотидного основания, связанного с ГТФазой.
Понимание на университетском уровне
Этот онлайн-видеокурс даст вам понимание концепций биохимии на университетском уровне. Содержание курса эквивалентно курсам BCH 210H (Биохимия I) и BCH 311H (Биохимия II) Университета Торонто и соответствует требованиям годичного курса биохимии с 54 часами иллюстрированных видеолекций и сопутствующими медицинскими перспективами.
Курс проводят опытные преподаватели кафедры биохимии медицинского факультета Университета Торонто.Курс включает короткие викторины в Интернете и завершается тщательным экзаменом в вашем районе.
Несмотря на то, что для прохождения этого курса нет предварительных требований, для облегчения понимания молекулярных процессов рекомендуется использовать биологию в средней школе и химию на первом курсе университета.
вернуться наверх
Перспективы медицины
В дополнение к 54 часам видеолекций, в курс включены видео-статьи с медицинскими сведениями о биохимии, связанной с различными заболеваниями.
Некоторые из текущих и актуальных медицинских проблем, которые необходимо изучить, включают:
- серповидноклеточная анемия
- Непереносимость лактозы
- гипергликемия
- цинга
- Болезнь Тея Сакса
- Муковисцидоз
- холера и коклюш
наверх
Основные направления обучения
Белки и ферменты
- природа связей в молекулах
- характеристики воды, универсального растворителя, и pH
- структуры и природа аминокислот, строительные блоки белков
- уровней структуры белка и трехмерной формы белка
- природа реакций, катализируемых ферментами, их регуляция, ингибирование и механизмы
- гемоглобин, белок транспорта кислорода
- характеристики углеводов, встречающихся в природе
- структуры и природа жирных кислот и липидов, обнаруженных в биологических мембранах
- Строение и функции мембранных белков: рецепторы, каналы и насосы
Метаболизм
- Основные понятия метаболизма и биоэнергетики
- как глюкоза питается через путь гликолиза и митохондриальное окисление
- наращивание запасов гликогена (полиглюкозы) после еды
- Как образуется глюкоза во время длительных упражнений
- как жирные кислоты служат топливом при беге на длинные дистанции
- Нарушение катаболизма жиров: диабет и кетоновые тела
- Эйкозаноиды и биохимия воспаления
- как образуются жирные кислоты, фосфолипиды и холестерин
- аминокислотный и нуклеотидный обмен
Нуклеиновые кислоты и поток биологической информации
- структуры информационных молекул, ДНК и РНК
- Репликация ДНК при делении клетки
- Ремонт и рекомбинация ДНК
- Синтез РНК
- процессинг тРНК и мРНК
- генетический код и синтез белка
- Технология рекомбинантной ДНК
наверх
Список лекций
Загрузите список лекций и расписание в формате PDF , чтобы получить подробную разбивку лекций курса, викторин, важных дат и многого другого.
Лекция 1 — Введение
Лекция 2 — Вода, pH, связи
Лекция 3 — Аминокислоты
Лекция 4 — Первичная и вторичная структура белка
Лекция 5 — Третичная и четвертичная структура белка
Лекция 6 — Ферменты: основные понятия
Лекция 7 — Кинетика ферментов
Лекция 8 — Регуляция ферментов, аллостерия
Лекция 9 — Подавление ферментов
Лекция 10 — Ферментные механизмы
Лекция 11 — Гемоглобин
Лекция 12 — Углеводы One
Лекция 13 — Углеводы два
Лекция 14 — Липиды: жирные кислоты, мембранные липиды
Лекция 15 — Структура мембраны и мембранные белки
Лекция 16 — Мембранный транспорт
Лекция 17 — Мембранные рецепторы
Лекция 18 — Метаболизм: основные понятия
Лекция 19 — Гликолиз
Лекция 20 — Доступ к запасам глюкогена
Лекция 21 — Пуруватдегидрогеназа и цикл лимонной кислоты
Лекция 22 — Окислительное фосфорилирование / Электронный транспорт
Лекция 23 — Окислительное фосфорилирование / Протонная движущая сила
Лекция 24 — Синтез гликогена
Лекция 25 — Мобилизация жира
Лекция 26 — Распад жирных кислот, АТФ, глюконеогенез
Лекция 27 — Диабет и кетоновые тела
Лекция 28 — Открытие инсулина
Лекция 29 — Синтез жирных кислот и триацилглицерина
Lecutre 30 — Синтез холестерина
Лекция 31 — Липопротеины
Лекция 32 — Эйкозаноиды и воспаление
Лекция 33 — Синтез фосфолипидов
Лекция 34 — Фосфоинозитиды и сигнализация
Лекция 35 — Синтез аминокислот
Лекция 36 — Разложение аминокислот
Лекция 37 — Нуклеотидный метаболизм
Лекция 38 — Первая структура нуклеиновой кислоты
Лекция 39 — Вторая структура нуклеиновой кислоты
Лекция 40 — Репликация ДНК
Лекция 41 — Ремонт и рекомбинация ДНК
Лекция 42 — Синтез РНК
Лекция 43 — Синтез РНК
Лекция 44 — Экспрессия гена I
Лекция 45 — Экспрессия гена II
Лекция 46 — Обработка РНК
Лекция 47 — Генетический код
Лекция 48 — Аминокислоты и тРНК
Лекция 49 — Синтез белков I
Лекция 50 — Синтез белка II
Лекция 51 — Секреция белка
Лекция 52 — Правила перевода
Лекция 53 — Рекомбинантная технология I
Лекция 54 — Рекомбинантная технология II
вернуться наверх



 В., Жаворонок Т.В., Рязанцева Н.В., Цыров Г.И., Бодрова Т.Н., Тетенев Ф.Ф., Серебров В.Ю., Черногорюк Г.Э., Байков А.Н., Позднякова И.А.
В., Жаворонок Т.В., Рязанцева Н.В., Цыров Г.И., Бодрова Т.Н., Тетенев Ф.Ф., Серебров В.Ю., Черногорюк Г.Э., Байков А.Н., Позднякова И.А.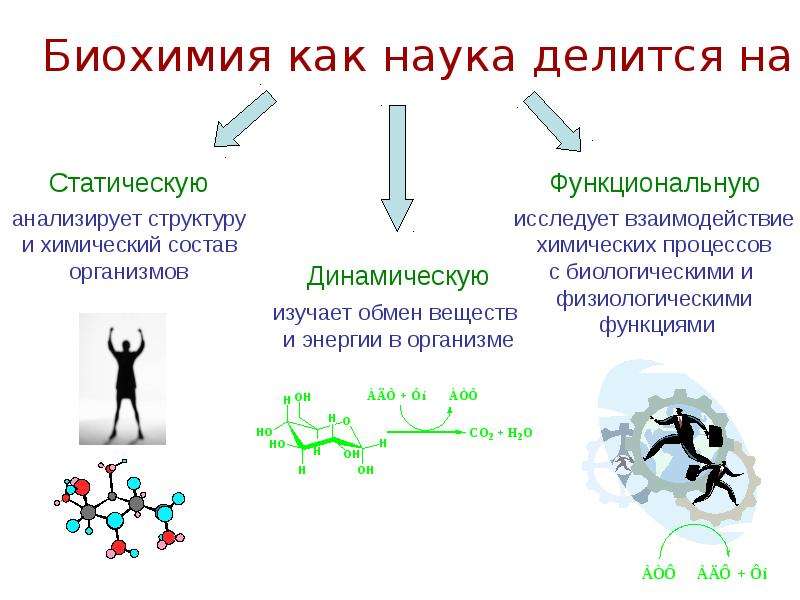 Томск. «Чародей»
Томск. «Чародей» М., Новицкий В.В., Степовая Е.А., Низкодубова С.В.
М., Новицкий В.В., Степовая Е.А., Низкодубова С.В.