Кроме белков: Закончи предложение. Кроме белков, жиров и углеводов нашему организму необходимы …..
Белок общий в сыворотке
Это измерение концентрации суммарного белка (альбумины + глобулины) в жидкой части крови, результаты которого характеризуют обмен белков в организме.
Синонимы русские
Общий белок, общий белок сыворотки крови.
Синонимы английские
Total Protein, Serum Тotal Protein, Total Serum Protein, TProt, ТР.
Метод исследования
Колориметрический фотометрический метод.
Единицы измерения
Г/л (грамм на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 12 часов перед исследованием.
- Исключить физическое и эмоциональное перенапряжение за 30 минут до исследования.
- Не курить в течение 30 минут до исследования.
Общая информация об исследовании
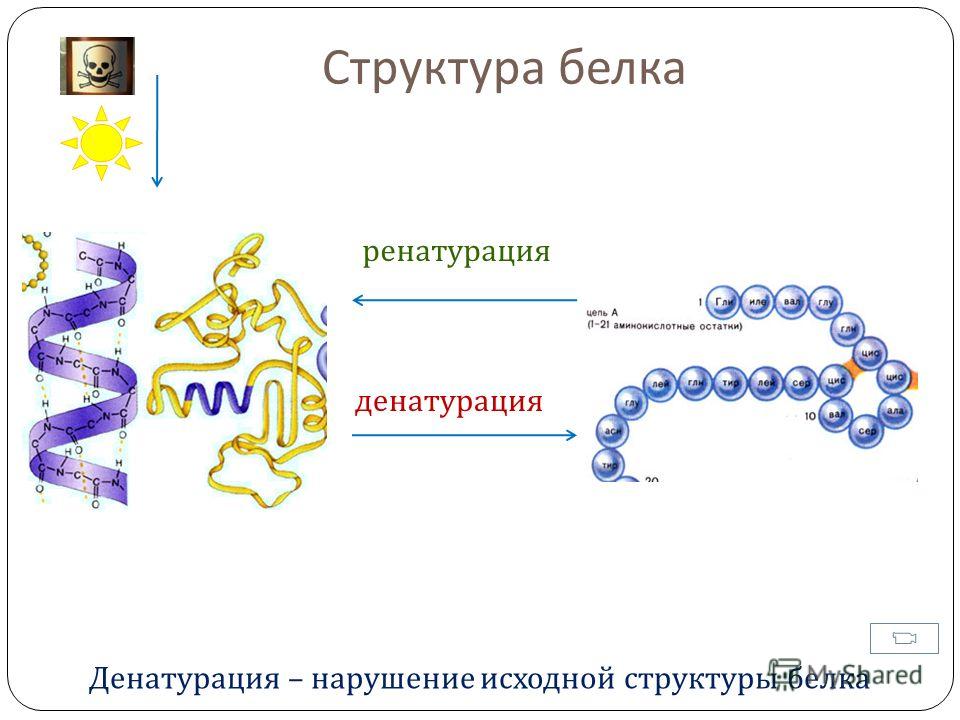
Общее содержание белка в сыворотке крови отражает состояние белкового обмена.
Белки преобладают в составе плотного остатка сыворотки крови (жидкой части, не содержащей клеточных элементов). Они служат основным строительным материалом для всех клеток и тканей тела. Из белков построены ферменты, многие гормоны, антитела и факторы свертывания крови. Помимо этого, они выполняют функцию переносчиков гормонов, витаминов, минералов, жироподобных субстанций и других компонентов обмена веществ в крови, а также обеспечивают их транспортировку внутрь клеток. От количества белков в сыворотке зависит осмотическое давление крови, благодаря которому поддерживается баланс между содержанием воды в тканях тела и внутри сосудистого русла. Оно определяет способность воды удерживаться в составе циркулирующей крови и поддерживать упругость тканей. Белки также ответственны за обеспечение правильного кислотно-щелочного равновесия (рН). Наконец, это источник энергии при недоедании или голодании.
Белки сыворотки крови делятся на два класса: альбумины и глобулины. Альбумины синтезируются в печени из пищи. Их количество в плазме влияет на уровень осмотического давления, которое удерживает жидкость внутри кровеносных сосудов. Глобулины выполняют иммунную функцию (антитела), обеспечивают нормальное свертывание крови (фибриноген), а также представлены ферментами, гормонами и белками-переносчиками разнообразных биохимических соединений.
Их количество в плазме влияет на уровень осмотического давления, которое удерживает жидкость внутри кровеносных сосудов. Глобулины выполняют иммунную функцию (антитела), обеспечивают нормальное свертывание крови (фибриноген), а также представлены ферментами, гормонами и белками-переносчиками разнообразных биохимических соединений.
Отклонение уровня общего белка крови от нормы может быть вызвано рядом физиологических состояний (не патологического характера) или являться симптомом различных заболеваний. Принято различать относительное отклонение (связанное с изменением содержания воды в циркулирующей крови) и абсолютное (вызванное изменениями в обмене – скорости синтеза/распада – сывороточных белков).
- Физиологическая абсолютная гипопротеинемия может возникать при длительном постельном режиме, у женщин во время беременности (особенно в ее последней трети) и кормления грудью, у детей в раннем возрасте, то есть в условиях недостаточного поступления белка с пищей или повышенной потребности в нем.
 В этих случаях показатель общего белка в крови снижается.
В этих случаях показатель общего белка в крови снижается. - Развитие физиологической относительной гипопротеинемии (понижения уровня общего белка в крови) связано с избыточным поступлением жидкости (повышенной водной нагрузкой).
- Относительная гиперпротеинемия (повышение уровня общего белка в крови) может быть вызвана избыточной потерей воды, как, например, при обильном потоотделении.
- Относительная патологическая (связанная с каким-либо заболеванием) гиперпротеинемия обусловлена значительной потерей жидкости и сгущением крови (при обильной рвоте, поносе или хроническом нефрите).
- Патологическая относительная гипопротеинемия наблюдается в обратных случаях – при избыточной задержке жидкости в циркулирующей крови (нарушение работы почек, ухудшение работы сердца, некоторые гормональные нарушения и т. д.).
- Абсолютное повышение общего белка крови может возникать при острых и хронических инфекционных заболеваниях из-за усиленной продукции иммунных глобулинов, при некоторых редких расстройствах здоровья, характеризующихся интенсивным синтезом ненормальных белков (парапротеинов), при заболеваниях печени и др.

Наибольшее клиническое значение имеет абсолютная гипопротеинемия. Абсолютное снижение концентрации общего белка в крови чаще всего происходит за счет уменьшения количества альбуминов. Нормальный уровень альбуминов в крови является показателем хорошего здоровья и правильного обмена веществ, и наоборот, пониженный говорит о низкой жизнеспособности организма. При этом потеря / разрушение / недостаточный синтез альбуминов является признаком и показателем степени тяжести некоторых заболеваний. Таким образом, анализ на общий белок крови позволяет выявить существенное снижение жизнеспособности организма в связи с какими-либо важными для здоровья причинами или сделать первый шаг в диагностике заболевания, связанного с нарушением белкового обмена.
Истощение запасов альбумина в крови может происходить при недоедании, заболеваниях желудочно-кишечного тракта и трудностях в усвоении пищи, хронических интоксикациях.
К заболеваниям, связанным с уменьшением количества альбуминов крови, относятся некоторые нарушения в работе печени (снижение синтеза белка в ней), почек (потеря альбуминов с мочой в результате нарушения механизма фильтрации крови в почках), определенные эндокринные расстройства (нарушения гормональной регуляции белкового обмена).
Для чего используется исследование?
- Как часть первого этапа комплексного обследования в процессе диагностики различных нарушений здоровья.
- Для выявления и оценки степени тяжести нарушений питания (при интоксикациях, недоедании, заболеваниях желудочно-кишечного тракта).
- В целях диагностики различных заболеваний, связанных с нарушениями белкового обмена, и для оценки эффективности их лечения.
- Для контроля за физиологическими функциями в процессе длительных клинических наблюдений.
- Для оценки функциональных резервов организма в связи с прогнозом в отношении текущего заболевания или предстоящими лечебными процедурами (лекарственная терапия, хирургическое вмешательство).
Когда назначается исследование?
- При первичной диагностике какого-либо заболевания.
- При симптомах истощения.
- При подозрении на заболевание, связанное с какими-либо нарушениями белкового обмена.

- Когда оценивают состояние обмена веществ или щитовидной железы.
- При обследовании функции печени или почек.
- При длительном клиническом наблюдении за ходом лечения заболеваний, связанных с нарушениями белкового обмена.
- Когда рассматривается возможность проведения хирургической операции.
- При профилактическом обследовании.
Что означают результаты?
Референсные значения (норма общего белка в крови)
|
Возраст
|
Референсные значения
|
|
0 — 7 мес.
|
44 – 76 г/л
|
|
7 — 12 мес.
|
51 — 73 г/л
|
|
1 — 3 года
|
56 — 75 г/л
|
|
3 — 18 лет
|
60 — 80 г/л
|
|
> 18 лет
|
64 — 83 г/л
|
Результаты анализа на общий белок в сыворотке крови позволяют оценить состояние здоровья, рациональность питания и функцию внутренних органов по эффективности их работы в отношении поддержания нормального белкового обмена. Если выявлено отклонение от нормы, для уточнения его причины требуется дальнейшее обследование.
Если выявлено отклонение от нормы, для уточнения его причины требуется дальнейшее обследование.
Причины повышения уровня общего белка в крови
- Острая и хроническая инфекция (включая туберкулез),
- нарушение функции коры надпочечников,
- аутоиммунные заболевания (ревматоидный артрит, системная красная волчанка, склеродермия),
- аллергические состояния,
- некоторые редкие системные заболевания,
- потеря жидкости (диабетический ацидоз, хронический понос и др.),
- дыхательная недостаточность,
- разрушение эритроцитов,
- активный хронический гепатит,
- некоторые редкие заболевания крови.
Причины понижения уровня общего белка в крови
- Задержка жидкости в связи с нарушением функции почек или ослаблением работы сердца,
- недостаточность поступления белка в организм или нарушение усвоения пищи в желудочно-кишечном тракте (вследствие голодания, недоедания, сужения пищевода, заболеваний кишечника воспалительного характера),
- снижение синтеза белка в печени (из-за гепатита, цирроза/атрофии печени, интоксикации),
- врождённые нарушения синтеза отдельных белков крови,
- повышенный распад белка (как результат злокачественных новообразований, гиперфункции щитовидной железы, послеоперационного состояния, длительной лихорадки, травмы, долгого лечения гормональными противовоспалительными препаратами),
- чрезмерная потеря белка при заболеваниях почек, сахарном диабете, кровотечениях,
- потеря белка вместе с жидкостью, которая накапливается в брюшной полости и полости плевры.

Что может влиять на результат?
Прием пищи может существенно повысить содержание белка в крови, в то время как после физической нагрузки оно снижается. На концентрацию белка также способны влиять употребление чая, кофе, алкоголя, лекарственных средств. Кроме того, для наиболее точного результата пациенту следует воздержаться от пищи со значительным количеством жиров.
Стратегия заговора: коронавирус маскирует свои белки под человеческие | Статьи
Коронавирус копирует последовательности аминокислот животных и человека, чтобы обмануть их иммунную систему и выдать свои белки за белки организма хозяина. Множество таких копий обнаружили ученые медицинского университета им. И.И. Мечникова и Института биорегуляции и геронтологии. Это свойство SARS CoV-2 позволяет патогену замедлять ответ иммунной системы носителя, а также может быть связано с аутоиммунными реакциями. По словам ученых, новые данные можно использовать при разработке вакцин: более безопасными будут препараты, вызывающие образование антител против тех участков вирусных белков, которые минимально похожи на белки человека.
Свой-чужой
Ученые из медицинского университета им. И.И. Мечникова Минздрава России и Института биорегуляции и геронтологии (Санкт-Петербург) обнаружили у SARS CoV-2 участки белка, идентичные человеческим. Выводы своего исследования специалисты изложили в статье в журнале Scientific Reports, входящего в группу Nature.
По новым данным, некоторые из этих белков расположены в шиповом белке коронавируса и, возможно, используются им, чтоб обходить иммунную защиту хозяина. Благодаря этим вставкам иммунитет может принимать белки возбудителя COVID-19 за собственные структуры организма. Это замедляет ответ иммунной системы. Такой хитрый ход позволяет коронавирусу легче распространяться в популяции. Также наличием идентичных последовательностей в белках SARS CoV-2 и человеческого организма может объясняться высокая частота аутоиммунных реакций у инфицированных коронавирусом.
«Взаимодействие SARS CoV-2 с иммунной системой хозяина во многом определяется структурной близостью между вирусными и человеческими белками», — утверждают ученые в статье.
Неслучайные связи
С помощью открытой базы данных последовательностей белков Uniport и собственной компьютерной программы специалисты сравнили протеом (набор белков) коронавируса с белками других организмов и человека. Последовательности были представлены в форме буквенного кода. Кроме S-белка (шипового протеина коронавируса), идентичные человеческим участки обнаружили в малом оболочечном (E), мембранном (М) и нуклеокапсидном (N) белках коронавируса. Авторы исследования полагают, что теоретически патоген мог бы позаимствовать любую последовательность, которую иммунная система потенциальной жертвы способна принимать за свою. Возможно, обнаруженные сейчас общие участки коронавирус скопировал у летучих мышей или других млекопитающих.
— Наше исследование началось с того, что мы сравнили структуру белков коронавируса SARS CoV-2 с человеческими белками и обнаружили в мембранном белке (M) коронавируса восемь аминокислот подряд, встречающиеся в одном из белков человека, а рядом еще восемь аминокислот, характерных для лактобактерий — постоянных обитателей просвета кишки, — рассказал заведующий кафедрой нормальной физиологии СЗГМУ им. И.И. Мечникова Александр Марьянович. — Вероятность случайного сочетания 16 аминокислот подряд равна единице, деленной на шесть с двадцатью нулями. Если не случайно, то зачем они здесь?
И.И. Мечникова Александр Марьянович. — Вероятность случайного сочетания 16 аминокислот подряд равна единице, деленной на шесть с двадцатью нулями. Если не случайно, то зачем они здесь?
По предположению ученых, коронавирус объединил столь длинную последовательность в мембранном белке ради мимикрии.
— Он предъявляет ее иммунной системе человека и как бы говорит: «Не стреляйте, я свой!» — объяснил Александр Марьянович.
В E-белке было обнаружено восемь участков, идентичных человеческим. Также там были найдены последовательности, совпадающие с белками кишечных бактерий и нескольких видов злаковых сельскохозяйственных растений. Такие участки могли быть приобретены коронавирусом не только от организма хозяина, но и от его кишечной микробиоты.
По мнению ученых, последовательности в E-белке SARS CoV-2 вряд ли может использовать для маскировки от иммунной системы хозяина. Но именно участки малого мембранного и некоторых других белков могут провоцировать аутоиммунную реакцию, так как защитная система организма атакует не только их, но и аналогичные им последовательности в собственных белках.
Новые данные могут помочь разработчикам вакцин от COVID-19.
— Желательно, чтобы их препараты вызывали образование антител против тех участков вирусных белков, которые имеют минимальную гомологию с белками человека, чтобы снизить вероятность аутоиммунных процессов, — отметил в разговоре с «Известиями» Александр Марьянович.
Безопасное лекарство
У многих микроорганизмов существует функция эвазии иммунной системы, то есть избегания ее ответа, сказал профессор-исследователь Балтийского федерального университета им. Иммануила Канта Андрей Продеус.
— Это давно известно, — подчеркнул эксперт. — Это обычный способ микроорганизмов приспосабливаться к взаимодействию с человеком. Например, к этому способны микробактерии туберкулеза, вирусы гриппа и стафилококки. Известно, что гемолитический стрептококк группы А вызывает ревмокардит и ревматизм — поражения суставов аутоиммунного характера.
Эксперт подтвердил, что результаты исследования можно будет использовать для создания вакцины или лекарства, которые действуют против определенной белковой последовательности. С этим согласен и профессор, заведующий лабораторией молекулярной биотехнологии и генной инженерии ЮУрГУ Александр Зурочка.
С этим согласен и профессор, заведующий лабораторией молекулярной биотехнологии и генной инженерии ЮУрГУ Александр Зурочка.
— Это важное и полезное для борьбы с коронавирусом исследование. Возможно, у вакцин на основе спайкового белка вируса могут быть белковые структуры, способные вызывать аутоиммунный процесс. Поэтому из вакцин нужно убирать компоненты белков вируса, которые совпадают с человеческими, — подчеркнул Александр Зурочка.
Полученные в ходе исследования данные могут быть использованы для создания лекарств, которые помогут иммунной системе не поддаваться на обман коронавируса и начинать борьбу с ним немедленно после попадания в организм.
Сдать анализ: Общий белок | МедЛаб
Описание анализа:
Общий белок крови – анализ, показывающий концентрацию белков в плазме крови. Белок крови состоит из трех основных групп компонентов: альбумина, глобулинов и фибриногена.
Альбумин, составляющий основную массу белка в крови, является материалом для создания новых клеток и поддержания целостности структуры органов. Глобулины отвечают за синтез иммунных белков (антител, иммуноглобулинов и пр.) и влияют на эффективность работы защитных сил организма. Фибриноген отвечает за свертываемость крови.
Глобулины отвечают за синтез иммунных белков (антител, иммуноглобулинов и пр.) и влияют на эффективность работы защитных сил организма. Фибриноген отвечает за свертываемость крови.
Нормальный анализ крови на белок говорит о том, что организм готов отреагировать на внезапные нарушения целостности или работы своих систем.
Показания к назначению анализа общего белка крови
Белки крови принимают важнейшее участие в жизнедеятельности организма, а потому их уровень может колебаться из-за воздействия множества факторов и заболеваний. Соответственно, обследование может назначаться широким кругом специалистов: эндокринологом, ревматологом, гастроэнтерологом, гематологом, нефрологом, аллергологом, хирургом, онкологом.
Показания к назначению в эндокринологии:
- гипотиреоз;
- гипертиреоз;
- сахарный диабет;
- дисфункция коры надпочечников;
- длительное лечение гормональными препаратами.

Показанием к назначению в ревматологии служат:
- ревматоидный артрит;
- системная красная волчанка;
- склеродермия.
Показания к назначению в гастроэнтерологии:
- сужение пищевода;
- колиты;
- цирроз печени;
- атрофия печени;
- панкреатит;
- токсические поражения печени.
Показанием к назначению в гематологии являются:
- усиленный гемолиз (разрушение) эритроцитов;
- анемии;
- миеломная болезнь;
- врожденные патологии синтеза белков крови.
Нефролог может назначить обследование при:
- протеинурии;
- почечной недостаточности.
Показания к назначению в хирургии:
- массивные кровотечения и сопутствующая им потеря белков;
- сепсис;
- ДВС-синдром.

Инфекционист может назначить анализ на общий белок крови при любых острых или хронических инфекциях, включая туберкулез и ВИЧ.
Уровень белков в крови изучается аллергологами при симптомах аллергических процессов.
Данный анализ используется в онкологии, так как уровень белков крови изменяется при образовании опухолей и их метастаз.
Норма общего белка в крови
Уровень белка в крови измеряется в граммах на литр (г/л), а его уровень изменяется в зависимости от возраста человека. Так у детей в возрасте до года референтными значениями являются 51-73 г/л, в возрасте от 1 до 2 лет – 53-75 г/л, у детей от 3 до 14 лет – 60-80 г/л. Референтными значениями уровня общего белка крови для взрослых являются 64-83 г/л вне зависимости от пола.
Однако замечено, что этот показатель у женщин примерно на 10% ниже, чем у мужчин, что связано с более высокими потребностями женского организма в белке.
Повышенный уровень белка в крови
Повышению показателя способствуют любые инфекции, аутоиммунные болезни, аллергические реакции, обезвоживание, интоксикация и активный гемолиз. Кроме того, уровень белка существенно возрастает после еды
Пониженный уровень общего белка
Развивается при болезнях печени, недоедании, истощении, эндокринных заболеваниях, онкологических заболеваниях и проблемах с всасыванием питательных веществ пищеварительным трактом.
Также пониженный показатель регистрируется у беременных женщин, что связано с более высокой потребностью организма в белке и увеличением объема плазмы.
Подготовка к обследованию
Стандартная при заборе крови для анализа биохимических показателей:
- сдавать кровь натощак и в утреннее время;
- в день обследования избегать стрессов, физических нагрузок, не курить;
- не употреблять жирную пищу, чай, кофе, алкоголь, медикаменты (или предупредить врача о применении последних).

Материал для анализа: венозная кров.
Метод проведения: конечной точки.
Срок готовности: 1 рабочий день.
Запись на анализы
Картофель: питание и диета — Международный год картофеля 2008
Богатый углеводами,
витамином С и другими
питательными веществами,
картофель удовлетворяет
растущий спрос на
«продукты быстрого
приготовления» во многих
развивающихся странах
Ключевые положения
Картофель – богатый источник
получаемой с пищей энергии
и питательных веществ, а по
содержанию белков намного
превосходит другие корнеплоды и
клубнеплоды.
Картофель обладает низким
содержанием жиров, однако
его приготовление и подача к
столу вместе с богатыми жиром
ингредиентами увеличивает общую
энергетическую ценность блюд.
Варка картофеля с кожурой
предотвращает потерю питательных
веществ.
Картофель играет важную роль
в различных рационах питания,
но при этом должен быть
сбалансирован другими овощами и
цельнозерновыми продуктами.
Для подтверждения наличия связи
между употреблением в пищу
картофеля и сахарным диабетом
2 типа необходимо проведение
дальнейших исследований.
Картофель – это универсальный,
богатый углеводами продукт
питания, который пользуется
высокой популярностью в мире и
может быть приготовлен и подан к
столу различными способами. Сразу
после уборки он содержит около 80
процентов воды и 20 процентов сухого
вещества. Около 60 — 80 процентов
сухого вещества составляет крахмал.
По содержанию белка в сухой массе
картофель примерно соответствует
зерновым и значительно превосходит
другие корнеплоды и клубнеплоды.
Кроме того, картофель обладает
низким содержанием жиров.
Картофель богат отдельными
микроэлементами, особенно
витамином С, — съеденный с кожурой
один средний картофельный клубень
весом в 150 г обеспечивает около
половины суточной потребности в
витамине С для взрослых (100 мг).
Картофель также содержит умеренное
количество железа, а высокое
содержание витамина С способствует
его усвоению организмом. Кроме
того, картофель является хорошим
источником витаминов В1, В3, В6 и
минералов, таких как калий, фосфор и
магний, содержит фолат, пантотеновую
кислоту и рибофлавин. Картофель
содержит пищевые антиоксиданты,
которые играют важную роль в
профилактике заболеваний, связанных
со старением, а также пищевую
клетчатку, благотворно влияющую на
здоровье.
Влияние способов приготовления картофеля
Питательная ценность пищи,
содержащей картофель, зависит от подаваемых с ним компонентов
и способа приготовления. Сам
Сам
по себе картофель не вызывает
полноту (а чувство сытости, которое
он дает, может даже помочь людям
контролировать свой вес). Однако
приготовление и подача картофеля с
ингредиентами, обладающими высоким
содержанием жира, повышает общую
калорийность блюда.
Поскольку человеческий организм не
переваривает содержащийся в сыром
картофеле крахмал, то картофель
готовят к употреблению в пищу путем
варки (в мундире или без), печения или
жарки. Каждый способ приготовления
по-разному влияет на питательный
состав картофеля, но при любом из них
уменьшается содержание клетчатки и
белков в связи с их проникновением
в воду, масло, разрушением под
действием тепловой обработки или
химических изменений, таких как
окисление.
Варка – самый распространенный
способ приготовления картофеля
в мире – приводит к значительной
потере витамина С, особенно
если он варится без кожуры. При
При
приготовлении картофеля-фри и
чипсов быстрая жарка в сильно
нагретом масле (от 140 до 180 °C)
приводит к абсорбции масла и
значительному снижению содержания
минералов и аскорбиновой кислоты.
Обычно запекание приводит к
несколько более значительным
потерям витамина С, чем варка, из-за
более высоких температур в печи,
однако потери других витаминов и
минералов при запекании ниже.
Пищевая ценность картофеля
(на 100 г картофеля, сваренного в кожуре и очищенного перед употреблением)
Источник: Министерство сельского хозяйства США, Национальная база данных по питательным веществам
Роль картофеля в «переходном
процессе в области питания» в
развивающихся странах
Во многих развивающихся странах,
особенно в городских районах, рост
уровня доходов ведет к «переходному
процессу в области питания» в
направлении употребления более
высококалорийных и готовых
продуктов питания. В условиях
В условиях
данного процесса растет спрос
на картофель. В Южной Африке
потребление картофеля в городских
районах увеличивается, в то время
как в сельской местности основным
продуктом питания по-прежнему
является кукуруза. В Китае рост
доходов населения и урбанизации
привели к увеличению спроса на переработанный картофель. Таким
образом, картофель уже играет
важную роль в диверсификации
рационов питания во многих странах.
Однако там, где выращиваются
другие основные пищевые культуры,
позволяющие удовлетворить
потребность в энергии, картофель
должен не заменять их, а скорее
дополнять рацион питания
витаминами, минералами и
высококачественным белком.
Картофель может быть важным
основным продуктом питания,
однако сбалансированный рацион
должен включать другие овощи и
цельнозерновые продукты питания.
Вследствие тенденции к
увеличению потребления продуктов
быстрого приготовления, растет
спрос на жареный картофель.
Избыточное потребление таких
высокоэнергетических продуктов
в сочетании с низкой физической
активностью может привести к
избыточному весу. Поэтому роль
продуктов, содержащих жареный
картофель, в пищевом рационе
должна учитываться при борьбе
с лишним весом и связанными
с питанием незаразными
заболеваниями, в том числе
болезнями сердца и сахарным
диабетом. Сахарный диабет 2 типа
вызывается многими факторами,
и для подтверждения наличия
связи между сахарным диабетом и
употреблением в пищу картофеля
необходимо проведение дальнейших
исследований.
Токсичные компоненты картофеля
Обеспечивая естественную защиту картофеля от грибков и насекомых,
его листья, стебли и побеги содержат высокий уровень токсичных
соединений, называемых гликоалкалоидами (обычно соланин и чаконин).
Гликоалколоиды как правило также содержатся в небольшом количестве
в клубнях, и в наибольшей концентрации непосредственно под кожурой.
Картофель следует хранить в темном, прохладном месте для
обеспечения низкого содержания гликоалкалоидов. Под действием
света картофель приобретает зеленоватый цвет в связи с повышением
уровня хлорофилла, что также может указывать на повышенный уровень
соланина и чаконина. Так как гликоалкалоиды не разрушаются в процессе
кулинарной обработки, для здорового питания перед приготовлением
картофель следует очистить и обрезать зеленые области.
Эта тематическая подборка была подготовлена Сильваной Прокоп и Янице Алберт по заказу Управления питания и защиты потребителей ФАО.
Протеин: состав, польза для спортсмена
Протеин, состав которого мы рассмотрим, является популярной пищевой добавкой. Цель ее использования – обеспечить питание организма (прежде всего мышц) белком при активных занятиях спортом.
Для чего спортсмену нужен белок?
Достаточное количество белка требуется для поддержания и наращивания мышечной массы, для роста силовых показателей, а также для укрепления и восстановления всех тканей организма: суставов, сухожилий, кожи, стенок сосудов и т. п.
п.
При активных занятиях спортом скорость метаболизма повышается, и аминокислот из белков пищевого рациона начинает не хватать. Здесь и приходит на помощь протеин – белковые добавки, обеспечивающие выносливость, работоспособность и рост мышц. Сывороточный протеин (whey), к примеру, очень быстро восполняет нехватку в аминокислотах. Состав сывороточного протеина определяет быстроту и относительную легкость его усвоения, благодаря чему его часто принимают за полчаса-час перед тренировкой, или сразу после.
Состав протеина
Поскольку очень многих волнует вопрос о том, какой у протеина состав, и как это влияет на выбор, то рассмотрим 2 самых важных момента.
1. Состав протеиновой смеси по степени очистки и обработки. Здесь выделяют 3 основные типа протеина:
- концентрат, содержащий от 60 до 80 % чистого белка,
- изолят, включающий до 95 % белка,
- гидролизат, являющийся даже не просто 95-100% протеином, но и предварительно расщепленным ферментами до ди- и трипептидов, что повышает легкость и скорость усвоения.

Кроме белков в составе концентрата (и в ничтожных количествах – изолята) присутствуют углеводы и жиры. Как правило, они не сильно ухудшают свойства протеина. Необходимо лишь следить, чтобы чистого белка в добавке не было меньше 70-75 %.
2. Аминокислотный состав хорошего протеина должен восполнять потребность организма в незаменимых аминокислотах. Их всего 9:
- лейцин,
- изолейцин и
- валин (вместе называемые BCAA),
- гистидин,
- лизин,
- метионин,
- треонин,
- фенилаланин и
- триптофан.
Сывороточный протеин имеет практически оптимальный состав аминокислот. Ниже нормы в нем только содержание гистидина и треонина. В этом белке также мало аргинина, важной аминокислоты, относящейся к частично заменимым.
Комплексный протеин решает эту проблему. В него входят разные по аминокислотному составу белки, которые дополняют друг друга, образуя смесь с идеальным аминокислотным профилем.
Еще одна проблема связана с тем, что недобросовестные производители могут добавлять в протеиновые смеси удешевляющие добавки (соевый белок, лецитин, большое количество эмульгаторов, пеногасителей, подсластителей и т. п.) Содержание белка (точнее незаменимых аминокислот) в таком протеине будет ниже и его анаболические качества будут хуже. Поэтому приобретать хороший сывороточный протеин следует только у проверенных добросовестных производителей.
п.) Содержание белка (точнее незаменимых аминокислот) в таком протеине будет ниже и его анаболические качества будут хуже. Поэтому приобретать хороший сывороточный протеин следует только у проверенных добросовестных производителей.
Какой протеин оптимален?
Для ответа на этот вопрос необходимо понимать, для чего спортсмен планирует использовать протеин, какие он ставит перед собой цели.
1. К примеру, для набора массы можно особо не привередничать: подойдет практически любой сывороточный протеин, купить который Вы сможете. Главное тут – общее количество белка. Но даже если в смеси его будет меньше, можно просто взять чуть больше порцию.
2. А вот если Вы сушитесь, или стремитесь похудеть – вот тут лучше выбрать изолят, поскольку в нем меньше остаточных углеводов и жиров. Кстати, и тем, кто страдает непереносимостью лактозы, лучше тоже выбирать изолят, поскольку в нем полностью отсутствует молочный сахар. Состав изолята протеина, как мы уже говорили, более очищенный, белка в нем более 95 %.
Если говорить об аминокислотном профиле, то наилучшим выбором будет мульти протеин, или казеин – в них все незаменимые аминокислоты присутствуют в необходимых количествах. Если Вы не хотите вдаваться в подробности, то смотрите на содержание аминокислот BCAA. Состав молочного протеина (сывороточного и казеина) в этом отношении всегда на уровне, в отличие, скажем, от яичного или говяжьего. BCAA являются главными анаболическими аминокислотами – именно они активно подавляют катаболическое разрушение мышц и стимулируют синтез белка в мышечных клетках.
Поскольку состав протеина whey protein характеризуется низким количеством аргинина, то если Вы употребляете сывороточный протеин перед тренировкой, то обязательно принимайте аргинин дополнительно, поскольку именно аргинин усиливает пампинг и улучшает кровоснабжение мышц, то есть обеспечивает лучшее снабжение мышц кислородом и питательными веществами, а также более быстрое удаление шлаков и молочной кислоты.
Итак, состав протеина whey (сывороточного) обеспечивает хороший рост сухой мышечной массы, поскольку в нем присутствует достаточное количество незаменимых аминокислот (особенно BCAA), а также своевременное восстановление после тренировок.
Биохимия, незаменимые аминокислоты — StatPearls
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма. Эти аминокислоты должны поступать из экзогенной диеты, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот. [1] [2] В питании аминокислоты подразделяются на незаменимые и несущественные. Эти классификации явились результатом ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или азотного баланса, даже когда имеется достаточное количество альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоническое слово PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка.Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно представляют собой растительные продукты. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека.[6]
Мнемоническое слово PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка.Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполных белков, которые обычно представляют собой растительные продукты. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека.[6]
Fundamentals
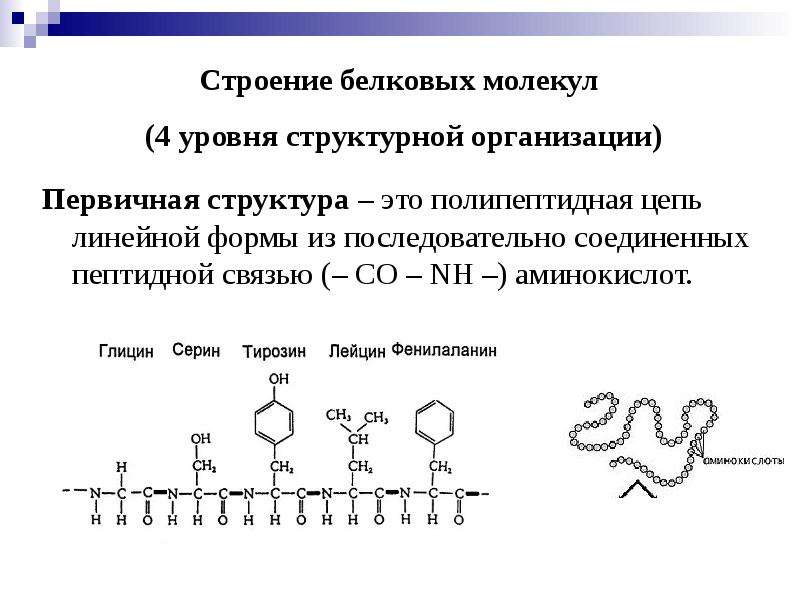
Аминокислоты являются основными строительными блоками белков, и они служат азотистыми скелетами для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота — это органическое соединение, которое содержит функциональные группы как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислота. Белки — это длинные цепи или полимеры определенного типа аминокислоты, известной как альфа-аминокислота. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновых кислот разделены только одним атомом углерода, который обычно является хиральным углеродом.В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки. [7] [8]
В химии аминокислота — это органическое соединение, которое содержит функциональные группы как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислота. Белки — это длинные цепи или полимеры определенного типа аминокислоты, известной как альфа-аминокислота. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновых кислот разделены только одним атомом углерода, который обычно является хиральным углеродом.В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки. [7] [8]
Белки представляют собой цепочки аминокислот, которые собираются через амидные связи, известные как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты. Затем уникальность различных белков определяется тем, какие аминокислоты они содержат, как эти аминокислоты расположены в цепи, и другими сложными взаимодействиями, которые цепь осуществляет с собой и с окружающей средой.Эти полимеры аминокислот способны производить разнообразие, наблюдаемое в жизни.
Существует около 20 000 уникальных генов, кодирующих белок, ответственных за более чем 100 000 уникальных белков в организме человека. Хотя в природе встречаются сотни аминокислот, для производства всех белков, присутствующих в организме человека и в большинстве других форм жизни, необходимо всего около 20 аминокислот. Все эти 20 аминокислот представляют собой L-изомер, альфа-аминокислоты. Все они, кроме глицина, содержат хиральный альфа-углерод.И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует упомянуть, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время синтеза рибосомных белков. Пирролойзин жизненно важен; однако люди не используют пирролизин для синтеза белка.После трансляции эти 22 аминокислоты также могут быть модифицированы посредством посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерацию белков. [8]
[8]
От 20 до 22 аминокислот, которые составляют белки, включают:
Из этих 20 аминокислот девять аминокислот являются незаменимыми:
-
Фенилаланин
-
Валин
-
Триптофан
-
Треонин
-
Метионин
-
Гистидин
-
Лейцин
-
Лизин
Изолейцин
Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточных количествах в течение определенных физиологических периодов роста, включая беременность, рост в подростковом возрасте или восстановление после травмы [9].
Механизм
Хотя для синтеза белка человека требуется двадцать аминокислот, люди могут синтезировать только половину этих необходимых строительных блоков.У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов, обнаруженных в путях биосинтеза заменимых аминокислот. Вероятно, есть эволюционное преимущество в удалении длинных путей, необходимых для синтеза незаменимых аминокислот с нуля. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду, чтобы обеспечить эти строительные блоки, эти организмы могут снизить расход энергии, особенно при репликации своего генетического материала.Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении материалов, необходимых для синтеза белка. [10] [11] [12]
Клиническая значимость
Классификация незаменимых и заменимых аминокислот была впервые представлена в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Rose 1957) показало, что человеческое тело способно поддерживать азотный баланс при диете, состоящей только из восьми аминокислот. [13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот.В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования кормления очищенными аминокислотами. Исследователи обнаружили, что, когда они исключили из рациона отдельные незаменимые аминокислоты, субъекты не смогли бы расти или поддерживать азотный баланс. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, хотя здоровый взрослый человек может синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для осуществления этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимым. незаменимая аминокислота в этих условиях.
Одно исследование (Rose 1957) показало, что человеческое тело способно поддерживать азотный баланс при диете, состоящей только из восьми аминокислот. [13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот.В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования кормления очищенными аминокислотами. Исследователи обнаружили, что, когда они исключили из рациона отдельные незаменимые аминокислоты, субъекты не смогли бы расти или поддерживать азотный баланс. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, хотя здоровый взрослый человек может синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для осуществления этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимым. незаменимая аминокислота в этих условиях. Эта концепция также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут привести организм в такое метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В целом, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Поиск оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером различных физиологических состояний, требующих различного потребления питательных веществ.Следовательно, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья. [1]
Эта концепция также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут привести организм в такое метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В целом, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Поиск оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером различных физиологических состояний, требующих различного потребления питательных веществ.Следовательно, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья. [1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или низкий аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, усталость, слабость, задержку роста у молодых и т. Д. Эти симптомы в основном вызваны недостаточным синтезом белка в организме из-за нехватки незаменимых аминокислот.Необходимое количество аминокислот необходимо для производства нейротрансмиттеров, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей, которым не уделяется должного ухода [2].
Эти симптомы могут включать депрессию, беспокойство, бессонницу, усталость, слабость, задержку роста у молодых и т. Д. Эти симптомы в основном вызваны недостаточным синтезом белка в организме из-за нехватки незаменимых аминокислот.Необходимое количество аминокислот необходимо для производства нейротрансмиттеров, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей, которым не уделяется должного ухода [2].
Квашиоркор и маразм — примеры более серьезных клинических расстройств, вызванных недоеданием и недостаточным потреблением незаменимых аминокислот. Квашиоркор — это форма недоедания, характеризующаяся периферическими отеками, сухим шелушением кожи с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизменным составом мышечных белков.Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания, характеризующаяся истощением, вызванным недостатком белка и недостаточным потреблением калорий в целом. [14]
[14]
Рисунок
Общая структура аминокислот. Внесен и создан Майклом Лопесом, B.S.
Ссылки
- 1.
- Hou Y, Yin Y, Wu G. Необходимость в питании «незаменимых аминокислот» для животных и людей. Exp Biol Med (Maywood).2015 август; 240 (8): 997-1007. [Бесплатная статья PMC: PMC4935284] [PubMed: 26041391]
- 2.
- Hou Y, Wu G. Adv Nutr. 01 ноября 2018 г .; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
- Reeds PJ. Незаменимые и незаменимые аминокислоты для человека. J Nutr. 2000 Июл; 130 (7): 1835С-40С. [PubMed: 10867060]
- 4.
- Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии.Curr Genomics. 2016 июн; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
- Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 сентябрь; 3 (3): 118-30. [Бесплатная статья PMC: PMC34] [PubMed: 24482589]
- 6.

- Джуд С., Капур А.С., Сингх Р. Аминокислотный состав и химическая оценка качества белка зерновых культур при поражении насекомыми. Растительная пища Hum Nutr. 1995 сентябрь; 48 (2): 159-67. [PubMed: 8837875]
- 7.
- ЛаПелуса А., Кошик Р. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 5 декабря 2020 г. Физиология, белки. [PubMed: 32310450]
- 8.
- Ву Г. Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 Май; 37 (1): 1-17. [PubMed: 19301095]
- 9.
- de Koning TJ. Нарушения синтеза аминокислот. Handb Clin Neurol. 2013; 113: 1775-83. [PubMed: 23622400]
- 10.
- Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM.Пути биосинтеза аминокислот и ассимиляции азота: большая делеция генома в ходе эволюции эукариот. BMC Genomics. 2011 22 декабря; 12 Дополнение 4: S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
- D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C.
 биосинтетические гены у бактерий. Эволюция. 2014 сентябрь; 68 (9): 2559-70. [PubMed: 24
биосинтетические гены у бактерий. Эволюция. 2014 сентябрь; 68 (9): 2559-70. [PubMed: 24
8] - 12.
- Сигенобу С., Ватанабе Х., Хаттори М., Сакаки И., Исикава Х.Последовательность генома внутриклеточного бактериального симбионта тлей Buchnera sp. APS. Природа. 2000, сентябрь 07; 407 (6800): 81-6. [PubMed: 10993077]
- 13.
- ROSE WC. Потребности в аминокислотах взрослого человека. Nutr Abstr Rev.1957 июл; 27 (3): 631-47. [PubMed: 13465065]
- 14.
- Benjamin O, Lappin SL. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 19 июля 2020 г., Квашиоркор. [PubMed: 29939653]
Структура белков: две спиральные конфигурации полипептидной цепи с водородными связями
В течение последних пятнадцати лет мы решали проблему структуры белков несколькими способами.Одним из этих способов является полное и точное определение кристаллической структуры аминокислот, пептидов и других простых веществ, связанных с белками, чтобы можно было получить информацию о межатомных расстояниях, углах связи и других конфигурационных параметрах, которые позволили бы надежное предсказание разумных конфигураций полипептидной цепи.
 Теперь мы использовали эту информацию, чтобы построить две разумные спиральные конфигурации с водородными связями для полипептидной цепи; мы думаем, что эти конфигурации, вероятно, составляют важную часть структуры как волокнистых, так и глобулярных белков, а также синтетических полипептидов.Письмо с объявлением об их открытии было опубликовано в прошлом году. 1
Теперь мы использовали эту информацию, чтобы построить две разумные спиральные конфигурации с водородными связями для полипептидной цепи; мы думаем, что эти конфигурации, вероятно, составляют важную часть структуры как волокнистых, так и глобулярных белков, а также синтетических полипептидов.Письмо с объявлением об их открытии было опубликовано в прошлом году. 1 Задача, которую мы поставили перед собой, состоит в том, чтобы найти все структуры с водородными связями для одной полипептидной цепи, в которых остатки эквивалентны (за исключением различий в боковой цепи R). Аминокислотный остаток (кроме глицина) не имеет элементов симметрии. Общая операция преобразования одного остатка одной цепи во второй остаток, эквивалентный первому, представляет собой, соответственно, вращение вокруг оси, сопровождаемое перемещением вдоль оси.Следовательно, единственные конфигурации для цепи, совместимые с нашим постулатом об эквивалентности остатков, — это спиральные конфигурации.
 Для угла поворота 180 ° спиральные конфигурации могут вырождаться в простую цепочку со всеми основными атомами, C, C ‘(карбонильный углерод), N и O, в одной плоскости.
Для угла поворота 180 ° спиральные конфигурации могут вырождаться в простую цепочку со всеми основными атомами, C, C ‘(карбонильный углерод), N и O, в одной плоскости. Мы предполагаем, что из-за резонанса двойной связи между положениями углерод-кислород и углерод-азот конфигурация каждого остатка плоская. Эта структурная особенность подтверждена для каждого из исследованных нами амидов.Более того, резонансная теория сейчас настолько хорошо обоснована, а ее экспериментальное обоснование настолько обширно, что не может быть никаких сомнений в ее применении к амидной группе. Наблюдаемое расстояние C — N, 1,32 Å, соответствует почти 50-процентному характеру двойной связи, и мы можем сделать вывод, что поворот на целых 10 ° от планарной конфигурации приведет к нестабильности примерно на 1 ккал. моль -1 . Предполагается, что межатомные расстояния и валентные углы внутри остатка имеют значения, показанные на рисунке 1.Эти значения были сформулированы 2 с учетом экспериментальных значений, обнаруженных в исследованиях кристаллической структуры dl-аланина, 3 l-треонина, 4 N-ацетилглицина 5 и β-глицилглицина 6 , что были сделаны в наших лабораториях.
Далее предполагается, что каждый атом азота образует водородную связь с атомом кислорода другого остатка с расстоянием азот-кислород, равным 2,72 Å, и что вектор от атома азота к атому кислорода с водородной связью лежит не более чем 30 ° от направления С — Н.Энергия водородной связи N — H · · · порядка 8 ккал. моль -1 , и такая большая нестабильность возникла бы в результате неспособности сформировать эти связи, что мы можем быть уверены в их наличии. Расстояние N-H · · · O не может быть точно 2,72 Å, но может несколько отклоняться от этого значения.
Рисунок 1.
Размеры полипептидной цепи.
Решение этой проблемы показывает, что существует пять и только пять конфигураций цепи, которые удовлетворяют условиям, отличным от условий направления водородной связи относительно направления N — H.Они соответствуют значениям 165 °, 120 °, 108 °, 97,2 ° и 70,1 ° для угла поворота. В первой, третьей и пятой из этих структур группа направлена отрицательно, а группа положительно направлена вдоль оси спирали, взятой как направление, соответствующее последовательности — CHR-CO-NH-CHR — атомов в пептидной цепи, и в двух других их направления поменялись местами.
 Первые три структуры неудовлетворительны в том смысле, что группа N-H не простирается в направлении атома кислорода при 2.72 Å; четвертый и пятый являются удовлетворительными, угол между вектором N-H и вектором N-O составляет примерно 10 ° и 25 ° для этих двух структур соответственно. Четвертая структура содержит 3,69 аминокислотных остатков на виток спирали, а пятая структура — 5,13 остатка на виток. В четвертой структуре каждая амидная группа связана водородными связями с третьей амидной группой за ее пределами вдоль спирали, а в пятой структуре каждая связана с пятой амидной группой за ее пределами; мы будем называть эти структуры либо 3.Структура из 7 остатков и структура из 5,1 остатков, соответственно, или структура с водородными связями третьего амида и структура с водородными связями пятого амида.
Первые три структуры неудовлетворительны в том смысле, что группа N-H не простирается в направлении атома кислорода при 2.72 Å; четвертый и пятый являются удовлетворительными, угол между вектором N-H и вектором N-O составляет примерно 10 ° и 25 ° для этих двух структур соответственно. Четвертая структура содержит 3,69 аминокислотных остатков на виток спирали, а пятая структура — 5,13 остатка на виток. В четвертой структуре каждая амидная группа связана водородными связями с третьей амидной группой за ее пределами вдоль спирали, а в пятой структуре каждая связана с пятой амидной группой за ее пределами; мы будем называть эти структуры либо 3.Структура из 7 остатков и структура из 5,1 остатков, соответственно, или структура с водородными связями третьего амида и структура с водородными связями пятого амида. Чертежи двух структур показаны на рисунках 2, 3, 4 и 5.
Рисунок 2.
Спираль с 3,7 остатками на оборот.
Рисунок 3.
Спираль с 5,1 остатками на оборот.
Рис.
 4.
4. План спирали 3,7 остатка.
Рис. 5.
План спирали с остатками 5.1.
Для глицина как 3.Спираль из 7 остатков и спираль из 5,1 остатков могут возникать как с положительной, так и с отрицательной трансляцией вращения; то есть в виде положительной или отрицательной спирали относительно положительного направления оси спирали, задаваемого последовательностью атомов в пептидной цепи. Однако для других аминокислот с l-конфигурацией положительная спираль и отрицательная спираль будут отличаться положением боковых цепей, и вполне можно ожидать, что в каждом случае одно направление спирали будет более стабильным, чем другое. .На рисунках сделано произвольное распределение групп R.
Трансляция вдоль оси спирали в спирали с 3,7 остатками составляет 1,47 Å, а в спирали с остатками 5,1 — 0,99 Å. Значения для одного полного оборота составляют 5,44 Å и 5,03 Å соответственно. Эти значения рассчитаны для расстояния водородных связей 2,72 Å; они должны быть увеличены на несколько процентов в случае наличия большего расстояния водородных связей (скажем, 2,80 Å).
Стабильность наших спиральных структур в некристаллической фазе зависит исключительно от взаимодействий между соседними остатками и не требует, чтобы количество остатков на поворот было отношением малых целых чисел.Значение 3,69 остатков на виток для спирали с третьей амидной водородной связью наиболее близко аппроксимируется 48 остатками в тринадцати витках (3,693 остатка на виток), а значение 5,13 для другой спирали наиболее близко аппроксимируется 41 остатком в восемь оборотов. Следует ожидать, что на количество остатков на виток в некоторой степени повлияет изменение расстояния водородных связей, а также что взаимодействие спиральных молекул с соседними аналогичными молекулами в кристалле вызовет небольшие крутящие моменты в спиралях, деформируя их. немного в конфигурации с рациональным количеством остатков на оборот.Для спирали с третьим амидом, связанной водородными связями, простейшими структурами такого типа, которые мы могли бы предсказать, являются спираль из 11 остатков, 3 витка (3,67 остатков на виток), спираль из 15 остатков, спираль с 4 витками (3,75) и спираль с 18 остатками, 5 витков (3.
 60). Мы нашли некоторые свидетельства того, что первый и третий из этих небольших вариантов этой спирали существуют в кристаллических полипептидах.
60). Мы нашли некоторые свидетельства того, что первый и третий из этих небольших вариантов этой спирали существуют в кристаллических полипептидах. Эти спиральные структуры ранее не описывались. В дополнение к конфигурации протяженной полипептидной цепи, которая в течение почти тридцати лет, как предполагалось, присутствует в вытянутых волосах и других белках со структурой β-кератина, конфигурации полипептидной цепи были предложены Astbury and Bell, 7 и особенно Хаггинсом 8 и Брэггом, Кендрю и Перуцем. 9 Хаггинс обсудил ряд структур, включающих внутримолекулярные водородные связи, а Брэгг, Кендрю и Перуц расширили обсуждение, включив дополнительные структуры, и исследовали совместимость структур с данными дифракции рентгеновских лучей для гемоглобина и миоглобина. Ни один из этих авторов не предложил ни нашу спираль из 3,7 остатков, ни спираль из 5,1. С другой стороны, мы бы исключили своими базовыми постулатами все предлагаемые ими структуры.
 Причина разницы в результатах, полученных другими исследователями и нами посредством по существу схожих аргументов, заключается в том, что и Брэгг, и его сотрудники, и Хаггинс подробно обсуждали только спиральные структуры с целым числом вычетов на оборот и, кроме того, предполагали лишь грубое приближение к требования к межатомным расстояниям, валентным углам и планарности сопряженной амидной группы, как указано в наших исследованиях более простых веществ.Мы утверждаем, что эти стереохимические особенности должны очень тесно сохраняться в стабильных конфигурациях полипептидных цепей в белках, и что нет особой стабильности, связанной с целым числом остатков на виток спиральной молекулы. Брэгг, Кендрю и Перуц описали структуру, топологически похожую на нашу спираль с 3,7 остатками, как спираль с водородными связями с 4 остатками на виток. В своем тщательном сравнении своих моделей с проекциями Паттерсона для гемоглобина и миоглобина они исключили эту структуру и пришли к осторожному выводу, что данные свидетельствуют в пользу неспиральной конфигурации α-кератина, сложенной из 3 остатков, по Эстбери и Беллу, в которой только один — треть карбонильных и аминогрупп участвует в образовании внутримолекулярной водородной связи.
Причина разницы в результатах, полученных другими исследователями и нами посредством по существу схожих аргументов, заключается в том, что и Брэгг, и его сотрудники, и Хаггинс подробно обсуждали только спиральные структуры с целым числом вычетов на оборот и, кроме того, предполагали лишь грубое приближение к требования к межатомным расстояниям, валентным углам и планарности сопряженной амидной группы, как указано в наших исследованиях более простых веществ.Мы утверждаем, что эти стереохимические особенности должны очень тесно сохраняться в стабильных конфигурациях полипептидных цепей в белках, и что нет особой стабильности, связанной с целым числом остатков на виток спиральной молекулы. Брэгг, Кендрю и Перуц описали структуру, топологически похожую на нашу спираль с 3,7 остатками, как спираль с водородными связями с 4 остатками на виток. В своем тщательном сравнении своих моделей с проекциями Паттерсона для гемоглобина и миоглобина они исключили эту структуру и пришли к осторожному выводу, что данные свидетельствуют в пользу неспиральной конфигурации α-кератина, сложенной из 3 остатков, по Эстбери и Беллу, в которой только один — треть карбонильных и аминогрупп участвует в образовании внутримолекулярной водородной связи.
По нашему мнению, структура α-кератина, α-миозина и подобных волокнистых белков тесно представлена нашей спиралью из 3,7 остатков, и что эта спираль также представляет собой важную структурную особенность в гемоглобине, миоглобине и других глобулярных соединениях. белков, а также синтетических полипептидов. Мы думаем, что спираль с 5,1 остатками может быть представлена в природе сверхсокращенным кератином и сверхсокращенным миозином. Доказательства, которые приводят нас к этим выводам, будут представлены в следующих статьях.
Нашей работе помогли гранты Фонда Рокфеллера, Национального фонда детского паралича и Службы общественного здравоохранения США. Многие расчеты были выполнены доктором С. Вайнбаумом.
Резюме
Были обнаружены две спиральные структуры с водородными связями для полипептидной цепи, в которых остатки стереохимически эквивалентны, межатомные расстояния и валентные углы имеют значения, найденные в аминокислотах, пептидах и других простых веществах, связанных с белками, и сопряженная амидная система плоская.
 В одной структуре с 3,7 остатками на виток каждая карбонильная и иминогруппа присоединена водородной связью к комплементарной группе в третьей амидной группе, удаленной от нее в полипептидной цепи, а в другой структуре с 5,1 остатками на виток, каждый связан с пятой амидной группой.
В одной структуре с 3,7 остатками на виток каждая карбонильная и иминогруппа присоединена водородной связью к комплементарной группе в третьей амидной группе, удаленной от нее в полипептидной цепи, а в другой структуре с 5,1 остатками на виток, каждый связан с пятой амидной группой. Обзор анализа белок-белкового взаимодействия | Thermo Fisher Scientific
Белки контролируют все биологические системы в клетке, и хотя многие белки выполняют свои функции независимо, подавляющее большинство белков взаимодействуют с другими для обеспечения надлежащей биологической активности.Характеристика белок-белковых взаимодействий с помощью таких методов, как коиммунопреципитация (co-IP), анализ методом «pull-down», перекрестное связывание, перенос метки и дальневестерн-блот-анализ имеет решающее значение для понимания функции белка и биологии клетки.
Посмотреть все продукты для анализа взаимодействия белков
Введение в белок-белковые взаимодействия
Белки — это рабочие лошадки, которые способствуют большинству биологических процессов в клетке, включая экспрессию генов, рост клеток, пролиферацию, поглощение питательных веществ, морфологию, подвижность, межклеточную коммуникацию и апоптоз.
 Но клетки реагируют на множество стимулов, и поэтому экспрессия белка — это динамический процесс; белки, которые используются для выполнения определенных задач, не всегда могут быть экспрессированы или активированы. Кроме того, не все клетки равны, и многие белки экспрессируются в зависимости от типа клетки. Эти основные характеристики белков предполагают сложность, которую может быть трудно исследовать, особенно при попытке понять функцию белка в надлежащем биологическом контексте.
Но клетки реагируют на множество стимулов, и поэтому экспрессия белка — это динамический процесс; белки, которые используются для выполнения определенных задач, не всегда могут быть экспрессированы или активированы. Кроме того, не все клетки равны, и многие белки экспрессируются в зависимости от типа клетки. Эти основные характеристики белков предполагают сложность, которую может быть трудно исследовать, особенно при попытке понять функцию белка в надлежащем биологическом контексте. Критические аспекты, необходимые для понимания функции белка, включают:
- Последовательность и структура белка — используются для обнаружения мотивов, которые предсказывают функцию белка
- История эволюции и консервативные последовательности — определяет ключевые регуляторные остатки
- Экспрессия профиль — выявляет специфичность клеточного типа и то, как регулируется экспрессия
- Посттрансляционные модификации — фосфорилирование, ацилирование, гликозилирование и убиквитинирование предполагают локализацию, активацию и / или функцию
- Взаимодействия с другими белками — функция может быть экстраполирована зная функцию партнеров по связыванию
- Внутриклеточная локализация — может указывать на функцию белка
До конца 1990-х годов анализ функции белков в основном фокусировался на отдельных белках.
 Однако, поскольку большинство белков взаимодействуют с другими белками для правильного функционирования, их следует изучать в контексте их взаимодействующих партнеров, чтобы полностью понять их функцию. С публикацией генома человека и развитием области протеомики понимание того, как белки взаимодействуют друг с другом и идентификация биологических сетей, стало жизненно важным для понимания того, как белки функционируют внутри клетки.
Однако, поскольку большинство белков взаимодействуют с другими белками для правильного функционирования, их следует изучать в контексте их взаимодействующих партнеров, чтобы полностью понять их функцию. С публикацией генома человека и развитием области протеомики понимание того, как белки взаимодействуют друг с другом и идентификация биологических сетей, стало жизненно важным для понимания того, как белки функционируют внутри клетки. Справочник по приготовлению белков
Узнайте больше о том, как обессоливать, заменять буфер, концентрировать и / или удалять загрязняющие вещества из образцов белка, иммунопреципитации и других методах очистки и очистки белков с помощью различных инструментов биологии белков Thermo Scientific в этом 32-страничном справочнике.
- Иммунопреципитация (IP), co-IP и хроматин-IP
- Теги очистки рекомбинантного белка
- Безопасный диализ образцов белка с помощью диализных кассет и устройств Slide-A-Lyzer
- Быстрое обессоливание образцов с высоким извлечением белка с помощью вращения Zeba колонки и планшеты для обессоливания
- Эффективное извлечение определенных загрязняющих веществ с помощью смол, оптимизированных для удаления детергентов или эндотоксинов
- Быстрое концентрирование разбавленных образцов белка с помощью концентраторов белка Pierce
Типы белок-белковых взаимодействий
Белковые взаимодействия в основном характеризуются как стабильные или временные, и оба типа взаимодействия могут быть сильными или слабыми.
 Стабильные взаимодействия связаны с белками, очищенными как мульти-субъединичные комплексы, и субъединицы этих комплексов могут быть идентичными или разными. Гемоглобин и ядерная РНК-полимераза являются примерами мульти-субъединичных взаимодействий, которые образуют стабильные комплексы.
Стабильные взаимодействия связаны с белками, очищенными как мульти-субъединичные комплексы, и субъединицы этих комплексов могут быть идентичными или разными. Гемоглобин и ядерная РНК-полимераза являются примерами мульти-субъединичных взаимодействий, которые образуют стабильные комплексы. Ожидается, что временные взаимодействия будут контролировать большинство клеточных процессов. Как следует из названия, временные взаимодействия носят временный характер и обычно требуют набора условий, способствующих взаимодействию, таких как фосфорилирование, конформационные изменения или локализация в отдельных областях клетки.Временные взаимодействия могут быть сильными или слабыми, быстрыми или медленными. Находясь в контакте со своими партнерами по связыванию, временно взаимодействующие белки участвуют в широком спектре клеточных процессов, включая модификацию белков, транспорт, фолдинг, передачу сигналов, апоптоз и клеточный цикл. Следующий пример представляет собой иллюстрацию белковых взаимодействий, которые регулируют апоптотические и антиапоптотические процессы.

Тяжелое белок-белковое взаимодействие BAD. Панель A: окрашенный кумасси гель SDS-PAGE рекомбинантного легкого и тяжелого BAD-GST-HA-6xHIS, очищенный из лизатов HeLa IVT (L) с использованием тандемного сродства глутатионовой смолы (E1) и кобальтовой смолы (E2).Указан расход (FT) из каждого столбца. Панель B: Схема фосфорилирования BAD и белковых взаимодействий во время выживания и гибели клеток (то есть апоптоза). Панель C: покрытие последовательности белка BAD, показывающее идентифицированные сайты консенсусного фосфорилирования Akt (красный прямоугольник). Панель D: МС-спектры меченного стабильным изотопом BAD пептида HSSYPAGTEDDEGmGEEPSPFr.
Белки связываются друг с другом посредством комбинации гидрофобных связей, сил Ван-дер-Ваальса и солевых мостиков в специфических доменах связывания каждого белка.Эти домены могут быть небольшими связывающими щелями или большими поверхностями и могут состоять всего из нескольких пептидов или состоять из сотен аминокислот.
 На силу связывания влияет размер связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильным межбелковым взаимодействиям, является лейциновая застежка-молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α -спираль, которая выступает между соседними спиральными пептидными цепями.Из-за плотной молекулярной упаковки лейциновые молнии обеспечивают стабильное связывание для мультибелковых комплексов, хотя все лейциновые молнии не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность соединения. взаимодействие.
На силу связывания влияет размер связывающего домена. Одним из примеров общего поверхностного домена, который способствует стабильным межбелковым взаимодействиям, является лейциновая застежка-молния, которая состоит из α-спиралей на каждом белке, которые связываются друг с другом параллельным образом посредством гидрофобного связывания регулярно расположенных остатков лейцина на каждом α -спираль, которая выступает между соседними спиральными пептидными цепями.Из-за плотной молекулярной упаковки лейциновые молнии обеспечивают стабильное связывание для мультибелковых комплексов, хотя все лейциновые молнии не связываются одинаково из-за нелейциновых аминокислот в α-спирали, которые могут уменьшить молекулярную упаковку и, следовательно, прочность соединения. взаимодействие. Два домена гомологии Src (SH), Sh3 и Sh4, являются примерами общих временных связывающих доменов, которые связывают короткие пептидные последовательности и обычно обнаруживаются в сигнальных белках. Домен Sh3 распознает пептидные последовательности с фосфорилированными остатками тирозина, которые часто указывают на активацию белка.
 Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой лиганд-опосредованное фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и GTPases для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность для различных белковых взаимодействий диктуется соседними аминокислотными остатками в соответствующем мотиве.
Домены Sh3 играют ключевую роль в передаче сигналов рецептора фактора роста, во время которой лиганд-опосредованное фосфорилирование рецептора по остаткам тирозина привлекает нижестоящие эффекторы, которые распознают эти остатки через их домены Sh3. Домен Sh4 обычно распознает богатые пролином пептидные последовательности и обычно используется киназами, фосфолипазами и GTPases для идентификации белков-мишеней. Хотя оба домена Sh3 и Sh4 обычно связываются с этими мотивами, специфичность для различных белковых взаимодействий диктуется соседними аминокислотными остатками в соответствующем мотиве.
Биологические эффекты белок-белковых взаимодействий
Результат двух или более белков, которые взаимодействуют с определенной функциональной целью, можно продемонстрировать несколькими различными способами. Измеримые эффекты белковых взаимодействий описаны следующим образом:
- Изменение кинетических свойств ферментов, что может быть результатом незначительных изменений в связывании субстрата или аллостерических эффектах
- Обеспечение канализации субстрата путем перемещения субстрата между доменами или субъединицами , что в конечном итоге приводит к намеченному конечному продукту
- Создать новый сайт связывания, обычно для малых эффекторных молекул
- Инактивировать или разрушить белок
- Изменить специфичность белка в отношении его субстрата посредством взаимодействия с различными партнерами связывания, например.
 g., продемонстрировать новую функцию, которую ни один белок не может проявлять по отдельности.
g., продемонстрировать новую функцию, которую ни один белок не может проявлять по отдельности. - Выполняет регуляторную роль либо в восходящем, либо в последующем событии.
Общие методы анализа белок-белковых взаимодействий
Обычно для проверки, характеристики и подтверждения белковых взаимодействий необходимо сочетание методов. Ранее неизвестные белки могут быть обнаружены по их ассоциации с одним или несколькими известными белками. Анализ взаимодействия белков может также выявить уникальные, непредвиденные функциональные роли хорошо известных белков.Обнаружение или проверка взаимодействия — это первый шаг на пути к пониманию того, где, как и при каких условиях эти белки взаимодействуют in vivo и функциональные последствия этих взаимодействий.
Несмотря на то, что различных методов и подходов к изучению межбелковых взаимодействий слишком много, чтобы их здесь можно было описать, приведенная ниже таблица и оставшаяся часть этого раздела посвящены общим методам анализа межбелковых взаимодействий и типам взаимодействий, которые могут быть изучены с использованием каждый метод.
 Таким образом, стабильные белок-белковые взаимодействия легче всего выделить физическими методами, такими как коиммунопреципитация и анализ методом pull-down, поскольку белковый комплекс не распадается с течением времени. Слабые или временные взаимодействия могут быть идентифицированы с использованием этих методов, сначала ковалентно сшивая белки, чтобы заморозить взаимодействие во время co-IP или pull-down. В качестве альтернативы, перекрестное сшивание, наряду с переносом метки и анализом дальнего вестерн-блоттинга, можно проводить независимо от других методов для выявления межбелковых взаимодействий.
Таким образом, стабильные белок-белковые взаимодействия легче всего выделить физическими методами, такими как коиммунопреципитация и анализ методом pull-down, поскольку белковый комплекс не распадается с течением времени. Слабые или временные взаимодействия могут быть идентифицированы с использованием этих методов, сначала ковалентно сшивая белки, чтобы заморозить взаимодействие во время co-IP или pull-down. В качестве альтернативы, перекрестное сшивание, наряду с переносом метки и анализом дальнего вестерн-блоттинга, можно проводить независимо от других методов для выявления межбелковых взаимодействий.Общие методы анализа различных типов белковых взаимодействий
Метод Белковые взаимодействия Коиммунопреципитация (co-IP) Стабильная или сильная 19 Stull-down
сильный
Анализ взаимодействия сшивающихся белков Временное или слабое Анализ взаимодействия белков переноса метки Временное или слабое Дальневосточный блот-анализ Умеренно стабильный
Коиммунопреципитация (ко-IP)
Коиммунопреципитация (co-IP) — популярный метод обнаружения взаимодействия белков.
 Co-IP проводится по существу так же, как иммунопреципитация (IP) одного белка, за исключением того, что целевой белок, осажденный антителом, также называемый «приманкой», используется для соосаждения комплекса связывающий партнер / белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается антителом, иммобилизованным на носителе. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттингом.Предположение, которое обычно делается при соосаждении связанных белков, состоит в том, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это только предположение, которое подлежит дальнейшей проверке.
Co-IP проводится по существу так же, как иммунопреципитация (IP) одного белка, за исключением того, что целевой белок, осажденный антителом, также называемый «приманкой», используется для соосаждения комплекса связывающий партнер / белок. , или «добыча», из лизата. По существу, взаимодействующий белок связывается с антигеном-мишенью, который связывается антителом, иммобилизованным на носителе. Иммунопреципитированные белки и их партнеры по связыванию обычно обнаруживаются электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-PAGE) и вестерн-блоттингом.Предположение, которое обычно делается при соосаждении связанных белков, состоит в том, что эти белки связаны с функцией антигена-мишени на клеточном уровне. Однако это только предположение, которое подлежит дальнейшей проверке. Совместная иммунопреципитация циклина B и Cdk1 . Магнитные гранулы Thermo Scientific Pierce Protein A / G связываются с антителом Cdk1 в комплексе с Cdk1. Циклин B связан с Cdk1 и захватывается вместе со своим партнером по связыванию.
Анализы Pull-down по методологии аналогичны коиммунопреципитации из-за использования подложки из шариков для очистки взаимодействующих белков. Однако разница между этими двумя подходами заключается в том, что в то время как co-IP использует антитела для захвата белковых комплексов, в методах «pull-down» используется белок «приманка» для очистки любых белков в лизате, которые связываются с приманкой. Нисходящие анализы идеальны для изучения сильных или стабильных взаимодействий или тех, для которых нет антител для коиммунопреципитации.
Общая схема анализа методом «выпадающего списка». Нисходящий анализ — это мелкомасштабная методика аффинной очистки, аналогичная иммунопреципитации, за исключением того, что антитело заменяется какой-либо другой системой аффинности. В этом случае аффинная система состоит из глутатион-S-трансферазы (GST), белка или связывающего домена, меченного полигис- или стрептавидином, который захватывается глутатионом, хелатом металла (кобальт или никель) или покрытыми биотином агарозными шариками.
 , соответственно.Иммобилизованный белок, меченный слиянием, действует как «приманка» для захвата предполагаемого партнера по связыванию (т.е. «жертвы»). В типичном нисходящем анализе иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных этапов промывки комплексы выборочно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга.
, соответственно.Иммобилизованный белок, меченный слиянием, действует как «приманка» для захвата предполагаемого партнера по связыванию (т.е. «жертвы»). В типичном нисходящем анализе иммобилизованный белок-приманка инкубируется с клеточным лизатом, и после предписанных этапов промывки комплексы выборочно элюируются с использованием конкурирующих аналитов или буферов с низким pH или восстанавливающих буферов для анализа в геле или вестерн-блоттинга.
Анализ взаимодействия сшивающего белка
Большинство белок-белковых взаимодействий являются временными, лишь кратковременно происходящими как часть единственного каскада или другой метаболической функции внутри клетки.Сшивание взаимодействующих белков — это подход к стабилизации или постоянному соединению компонентов комплексов взаимодействия. Как только компоненты взаимодействия ковалентно сшиты, другие стадии (например, лизис клеток, аффинная очистка, электрофорез или масс-спектрометрия) могут быть использованы для анализа взаимодействия белок-белок при сохранении исходного взаимодействующего комплекса.

Гомобифункциональные сшивающие агенты, реагирующие с амином, могут быть добавлены к клеткам для сшивания потенциально взаимодействующих белков вместе, которые затем могут быть проанализированы после лизиса с помощью вестерн-блоттинга.Сшивающие агенты могут быть мембранопроницаемыми, такими как DSS, для сшивания внутриклеточных белков, или они могут быть непроницаемыми для мембраны, такими как BS3, для сшивания белков клеточной поверхности. Кроме того, некоторые сшивающие агенты могут быть расщеплены восстанавливающими агентами, такими как DSP или DTSSP, для обращения сшивок.
В качестве альтернативы, гетеробифункциональные сшивающие агенты, которые содержат фотоактивируемую группу, такие как продукт SDA или Sulfo-SDA, могут быть использованы для захвата переходных взаимодействий, которые могут происходить, например, после определенного стимула.Фотоактивация также может происходить после метаболического мечения фотоактивируемыми аминокислотами, такими как L-фото-лейцин или L-фото-метионин.

Сайты сшивания между белками могут быть картированы с высокой точностью с помощью масс-спектрометрии, особенно если используется расщепляемый МС сшивающий агент, такой как DSSO или DSBU.
Анализ взаимодействия белков переноса меток
Перенос метки включает сшивание взаимодействующих молекул (например, белков наживки и жертвы) с меченым сшивающим агентом, а затем расщепление связи между наживкой и добычей, так что метка остается прикрепленной к жертве.Этот метод особенно ценен из-за его способности идентифицировать белки, которые слабо или временно взаимодействуют с интересующим белком. Новые неизотопные реагенты и методы продолжают делать этот метод более доступным и простым в использовании для любого исследователя.
Экспериментальная стратегия переноса биотиновой метки Sulfo-SBED и анализа методом вестерн-блоттинга.
Дальневосточный блот-анализ
Подобно тому, как анализы «pull-down» отличаются от ко-IP в обнаружении белок-белковых взаимодействий с использованием меченых белков вместо антител, так и анализ дальнего вестерн-блоттинга отличается от анализа вестерн-блоттингом , поскольку выявляются белок-белковые взаимодействия.
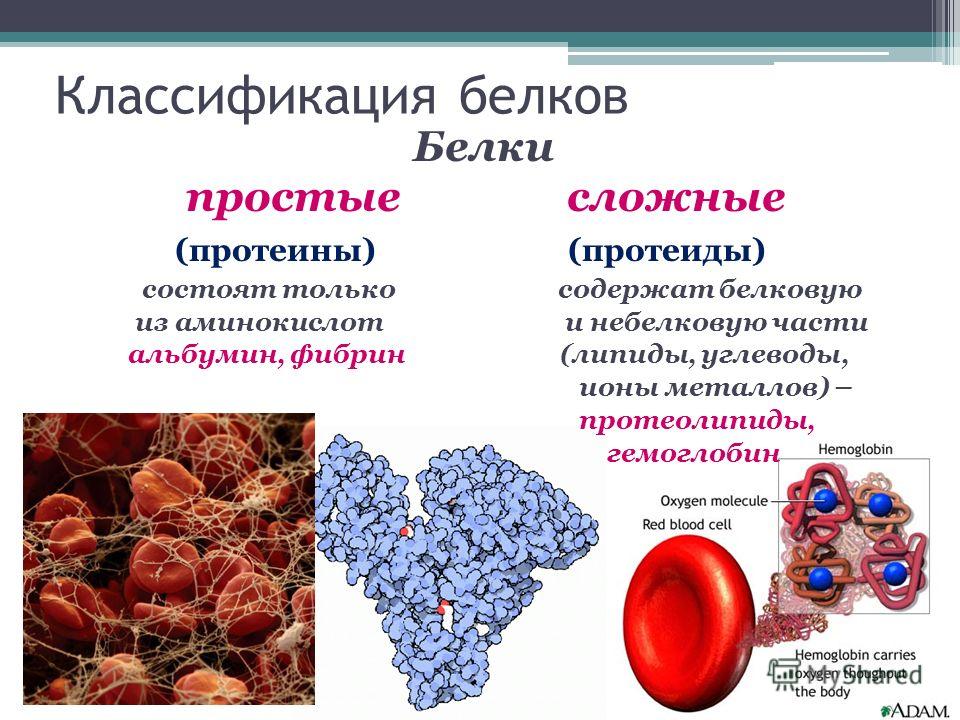 путем инкубации белков, подвергнутых электрофорезу, с очищенным, меченым белком-приманкой вместо антитела, специфичного к целевому белку, соответственно.Термин «далеко» был принят, чтобы подчеркнуть это различие.
путем инкубации белков, подвергнутых электрофорезу, с очищенным, меченым белком-приманкой вместо антитела, специфичного к целевому белку, соответственно.Термин «далеко» был принят, чтобы подчеркнуть это различие. Схема дальнего вестерн-блоттинга для анализа межбелковых взаимодействий. В этом примере меченый белок-приманка используется для зондирования переносящей мембраны или геля на предмет белка жертвы. После связывания антитело, конъюгированное с ферментом (пероксидаза хрена; HRP), которое нацелено на бирку-приманку, используется для обозначения взаимодействия, которое затем обнаруживается ферментативной хемилюминесценцией. Этот общий подход может быть скорректирован с помощью немаркированного белка приманки, который обнаруживается антителами, биотинилированного белка приманки, обнаруживаемого конъюгированным с ферментом стрептавидина, или меченного радиоактивным изотопом белка приманки, обнаруживаемого при воздействии на пленку.
- Golemis E (2002) Взаимодействие белков и белков: руководство по молекулярному клонированию.
 Колд-Спринг-Харбор (Нью-Йорк): Лаборатория Колд-Спринг-Харбор. p ix, 682.
Колд-Спринг-Харбор (Нью-Йорк): Лаборатория Колд-Спринг-Харбор. p ix, 682. - Phizicky EM, Fields S (1995) Белковые взаимодействия: методы обнаружения и анализа. Microbiol Rev 59: 94–123.
Типы посттрансляционных модификаций белков
Посттрансляционная модификация (PTM) белков относится к химическим изменениям, которые происходят после того, как белок был произведен.Это может повлиять на структуру, электрофильность и взаимодействие белков.
Кредит: BiCyte / Shutterstock.com
Виды посттрансляционных модификаций
Существует много типов модификации белков, которые в основном катализируются ферментами, распознающими специфические последовательности-мишени в белках. Эти модификации регулируют сворачивание белков, воздействуя на определенные субклеточные компартменты, взаимодействуя с лигандами или другими белками, или вызывая изменение их функционального состояния, включая каталитическую активность или передачу сигналов.
 Наиболее распространенные PTM:
Наиболее распространенные PTM: На основе сложения химических групп
На основе сложения комплексных групп
- Гликозилирование
- Ампилирование
- Липидирование
На основе добавления полипептидов
На основе расщепления белков
На основе модификации аминокислоты
Химические группы
Фосфорилирование
Обратимое фосфорилирование белков включает добавление фосфатной группы к остаткам серина, треонина или тирозина и является одним из важных и широко изученных ПТМ как у прокариот, так и у эукариот.
Некоторые ферменты или сигнальные белки «включаются» или «выключаются» путем фосфорилирования или дефосфорилирования. Фосфорилирование осуществляется ферментами, называемыми «киназами», а дефосфорилирование — «фосфатазами».
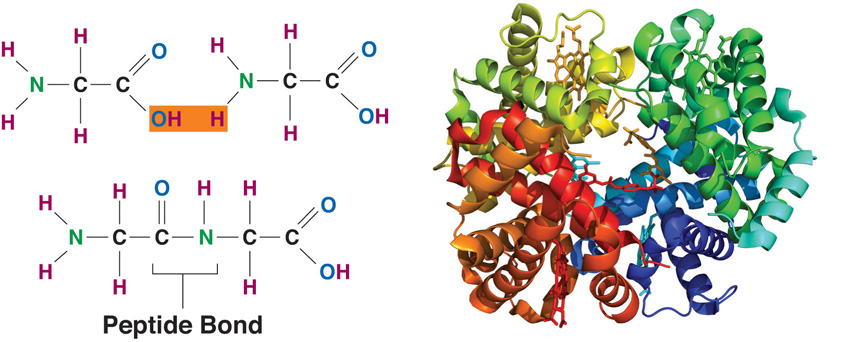
Добавление фосфатной группы может преобразовать ранее незаряженный карман белка в отрицательно заряженный и гидрофильный белок, тем самым вызывая конформационные изменения в белке.
Фосфорилирование влияет на несколько клеточных процессов, включая клеточный цикл, рост, апоптоз и пути передачи сигнала.Одним из примеров является активация р53, белка-супрессора опухоли. p53 используется в терапии рака и активируется фосфорилированием его N-конца несколькими киназами.
Ацетилирование
Ацетилирование относится к добавлению ацетильной группы в белок. Он участвует в нескольких биологических функциях, включая стабильность белка, локализацию, синтез; апоптоз; рак; Стабильность ДНК. Ацетилирование и деацетилирование гистона являются важной частью регуляции генов.
Ацетилирование гистонов снижает положительный заряд гистона, уменьшая его взаимодействие с отрицательно заряженными фосфатными группами ДНК, делая его менее плотно привязанным к ДНК и доступным для транскрипции генов.
 Ацетилирование р53, гена-супрессора опухолей, имеет решающее значение для его свойств подавления роста.
Ацетилирование р53, гена-супрессора опухолей, имеет решающее значение для его свойств подавления роста. Гидроксилирование
Этот процесс добавляет к белкам гидроксильную группу (-ОН). Он катализируется ферментами, называемыми «гидроксилазами», и помогает превращать гидрофобные или липофильные соединения в гидрофильные соединения.
Метилирование
Метилирование относится к присоединению метильной группы к остатку лизина или аргинина белка. Аргинин можно метилировать один или два раза, а лизин — один, два или три раза. Метилирование достигается ферментами, называемыми метилтрансферазами. Метилирование гистонов широко изучалось, где метилирование гистонов может приводить к активации или репрессии гена в зависимости от метилированного остатка.
Комплексные группы
Гликозилирование
Гликозилирование включает добавление олигосахарида, называемого «гликан», либо к атому азота ( N -связанное гликозилирование) или к атому кислорода ( O -связанное гликозилирование).
 N-связанное гликозилирование происходит в амидном азоте аспарагина, тогда как связанное с O гликозилирование происходит по атому кислорода серина или треонина.
N-связанное гликозилирование происходит в амидном азоте аспарагина, тогда как связанное с O гликозилирование происходит по атому кислорода серина или треонина. Углеводы, присутствующие в форме N-связанных или O-связанных олигосахаридов, присутствуют на поверхности клеток и секретируют белки. Они играют важную роль в сортировке белков, иммунном распознавании, связывании рецепторов, воспалении и патогенности. Например, N-связанные гликаны на иммунной клетке могут определять, как она мигрирует к определенным участкам.Точно так же он также может определять, как клетка распознает «я» и «не-я».
Ампилирование
AMPylation относится к обратимому добавлению AMP к белку. Он включает образование фосфодиэфирной связи между гидроксильной группой белка и фосфатной группой АМФ.
Липидация
Ковалентное связывание липидной группы с белком называется липидированием. Липидирование можно далее подразделить на пренилирование, N-миристоилирование, пальмитоилирование и присоединение гликозилфосфатидилинозитола (GPI) -анкоря.

Пренилирование включает добавление изопреноидной части к цистеиновому остатку белка-субстрата. Это критически важно для контроля локализации и активности нескольких белков, которые выполняют важные функции в биологической регуляции.
Миристоилирование включает присоединение миристоильной группы к остатку глицина посредством амидной связи. Он выполняет функции мембранной ассоциации и апоптоза. При пальмитоилировании пальмитоильная группа добавляется к цистеиновому остатку белка.
При добавлении GPI-якоря карбоксиконцевой сигнальный пептид белка расщепляется и заменяется GPI-якорем.Недавние исследования в области генетики человека показали, что якоря GPI важны для здоровья человека. Любые дефекты сборки, прикрепления или ремоделирования якорей GPI приводят к генетическим заболеваниям, известным как наследственный дефицит GPI.
Полипептиды
Убиквитинирование
Убиквитинирование включает добавление повсеместно встречающегося белка, называемого «убиквитин», к лизиновому остатку субстрата.
 Может быть присоединена либо одна молекула убиквитина (моноубиквитинирование), либо цепь из нескольких молекул убиквитина (полиубиквитинирование).
Может быть присоединена либо одна молекула убиквитина (моноубиквитинирование), либо цепь из нескольких молекул убиквитина (полиубиквитинирование).Полиубиквитинированные белки распознаются протеасомой 26S и впоследствии подвергаются протеолизу или деградации. Моноубиквитинированные белки могут влиять на отслеживание клеток и эндоцитоз.
Расщепление белков
Протеолиз
Протеолиз относится к расщеплению белков на более мелкие полипептиды или аминокислоты. Например, удаление N-концевого метионина, сигнального пептида, после трансляции приводит к превращению неактивного или нефункционального белка в активный.
Аминокислотная модификация
Деамидирование
Деамидирование — это удаление или преобразование остатка аспарагина или глутамина в другую функциональную группу. Аспарагин превращается в аспарагиновую кислоту или изоаспарагиновую кислоту, а глутамин превращается в глутаминовую кислоту или пироглутаминовую кислоту.
 Эта модификация может изменить структуру, стабильность и функцию белка.
Эта модификация может изменить структуру, стабильность и функцию белка. Дополнительная литература
Тест на белок в моче
Обзор
Что такое анализ мочи на белок (альбумин)?
Тест на белок в моче — это скрининговый тест для выявления присутствия белков в моче.Один из этих белков называется альбумином.
Почему можно заказать этот тест?
Белки — это «строительные блоки» организма, которые также выполняют другие жизненно важные функции, такие как:
- Салфетки питательные.
- Перенос гормонов, витаминов и других необходимых питательных веществ.
- Поддержание циркуляции жидкости в организме в нужном количестве.
Когда почки здоровы, белки практически не выходят из почек в мочу (удаляются только продукты жизнедеятельности, циркулирующие в крови).Однако, если почки человека заболевают или повреждаются, они теряют способность оставлять белки, и некоторые белки начинают просачиваться и появляться в моче.

В чем разница между микроальбуминурией и протеинурией?
Альбумин — это белок, который в больших количествах содержится в крови. Поскольку это небольшая молекула по размеру, это один из первых белков, способных проходить через почки в мочу при проблемах с почками. Это присутствие небольшого количества альбумина в моче — это состояние, называемое микроальбуминурией.Важно отметить, что некоторые физиологические состояния могут вызывать микроальбуминурию, например, физические упражнения. Если уровень микроальбумина в моче повышен, стоит повторить прием через день или два отсутствия физических упражнений.
По мере прогрессирования поражения почек и увеличения количества альбумина в моче название состояния меняется с микроальбуминурии на макроальбуминурию (макро означает большой) или протеинурию.
Каковы признаки микроальбуминурии / протеинурии?
На ранних стадиях может не быть заметных признаков или симптомов.Поскольку функция почек снижается и большое количество белков попадает в мочу, могут возникать отеки рук, ног, живота и лица.
 Если альбуминурия прогрессирует, это может привести к необратимому повреждению почек. У некоторых пациентов это может привести к необходимости диализа или трансплантации почки. С симптомами или без них единственный способ узнать, сколько белка попадает в мочу, — это проверить его.
Если альбуминурия прогрессирует, это может привести к необратимому повреждению почек. У некоторых пациентов это может привести к необходимости диализа или трансплантации почки. С симптомами или без них единственный способ узнать, сколько белка попадает в мочу, — это проверить его. Микроальбуминурия связана с сердечно-сосудистыми заболеваниями. Поврежденные кровеносные сосуды могут привести не только к заболеванию почек, но и к инсульту и сердечной недостаточности.
Кто подвержен риску развития микроальбуминурии / протеинурии?
Люди с определенными хроническими заболеваниями, включая диабет, гипертонию, ожирение и другие формы заболеваний почек, подвержены риску развития микроальбуминурии / протеинурии. К другим группам риска относятся:
- афроамериканцев.
- американских индейцев.
- латиноамериканцев.
- американцев с тихоокеанских островов.
- Пожилые люди.
- Люди с избыточным весом.
- Люди с семейным анамнезом почечной недостаточности.

Детали теста
Как используется анализ белка в моче для определения микроальбуминурии / протеинурии?
Вам будет предложено сдать образец мочи. Ваш врач решит, может ли образец быть случайным образцом, предоставленным в кабинете вашего врача, или должен быть образец, собранный в течение определенного периода времени (например, более четырех часов, в течение ночи или в течение 24 часов). В любом случае вам дадут контейнер и инструкции по правильному сбору пробы мочи.Затем образец будет протестирован для определения количества белка или альбумина в нем. Ваш врач может также назначить анализ крови, чтобы проверить наличие других признаков повреждения почек (чтобы найти продукты жизнедеятельности, которые обычно удаляются из крови, если почки функционируют должным образом).
Результаты и последующие действия
Что означают результаты анализа мочи на белок?
Существует ряд результатов тестов, которые могут указывать на нормальную функцию почек.
 Ваш лечащий врач обсудит с вами диапазоны и расскажет о ваших конкретных результатах.Высокие значения могут означать заболевание или повреждение почек. Если результат вашего теста показывает высокий уровень белка или альбумина, вероятно, ваш врач повторит тест.
Ваш лечащий врач обсудит с вами диапазоны и расскажет о ваших конкретных результатах.Высокие значения могут означать заболевание или повреждение почек. Если результат вашего теста показывает высокий уровень белка или альбумина, вероятно, ваш врач повторит тест. Если ваш второй тест также имеет высокий уровень, ваш лечащий врач может назначить дополнительные тесты для дальнейшей проверки вашей функции почек. Когда причиной альбуминурии является диабет или высокое кровяное давление, лечение этих проблем может уменьшить альбуминурию или ее прогрессирование до заболевания почек. Некоторые препараты для измерения артериального давления (ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы рецепторов ангиотензина II) особенно полезны для ограничения повреждения почек после обнаружения микроальбуминурии или альбуминурии.
Наука на расстоянии
Гигантские молекулы жизни
Белки
Аминокислоты
Строительными блоками всех белков являются аминокислоты.
 Существует около 20 общих аминокислот, все, кроме одной, имеют структуру, основанную на одном атоме углерода, к которому присоединены четыре различных атома или группы атомов; атом водорода, аминогруппа, группа карбоновой кислоты и переменная группа (называемая здесь R-группой).Это различная химическая структура и свойства R-группы, которые делают аминокислоты отличными друг от друга.
Существует около 20 общих аминокислот, все, кроме одной, имеют структуру, основанную на одном атоме углерода, к которому присоединены четыре различных атома или группы атомов; атом водорода, аминогруппа, группа карбоновой кислоты и переменная группа (называемая здесь R-группой).Это различная химическая структура и свойства R-группы, которые делают аминокислоты отличными друг от друга. Около 9 аминокислот имеют неполярные R-группы и относительно гидрофобны. Еще 6 аминокислот имеют сильно полярные R-группы, которые легко притягивают молекулы воды. Это гидрофильные аминокислоты. Остальные, примерно 5 аминокислот, имеют R-группы, которые могут ионизировать. При нормальном клеточном pH эти R-группы становятся электрически заряженными, что делает их даже более гидрофильными, чем полярные аминокислоты.
Некоторые из аминокислот
Аминокислота Аббревиатура % в гемоглобине # молекул в инсулине Год открытия Аланин Ала 9.  0
0 3 1875 Аспарагиновая кислота Asp 9,6 0 1868 Глутаминовая кислота Glu 6,6 4 1866 Гистидин Его 8.  8
8 2 1896 Лейцин Leu 14,0 6 1819 Пролин Pro 4,8 1 1901 Серин Ser 4.  4
4 3 1865 Тирозин Tyr 2,9 4 1846 Полипептиды I: первичная структура
Полимеры аминокислот называются «полипептидами», название происходит от типа связи, удерживающей цепи аминокислот вместе.В реакции присоединения, называемой «конденсация» или «синтез дегидратации», атом азота одной аминокислоты напрямую связан с атомом углерода в кислотной группе второй аминокислоты. Во время этой молекулярной перестройки образуется молекула воды.
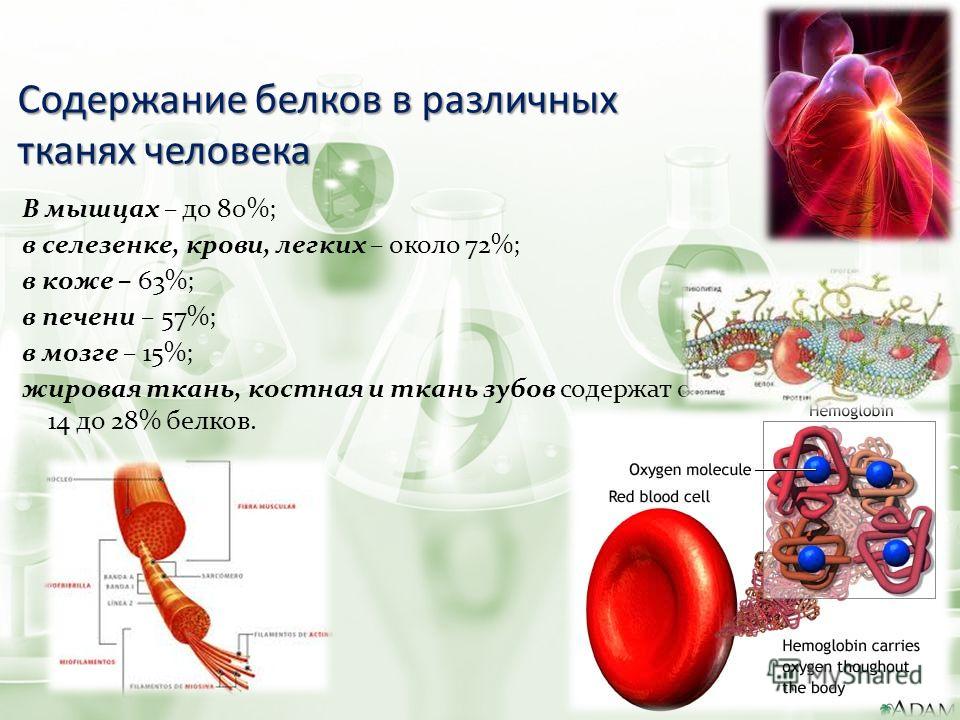 Результирующая группа атомов, которая удерживает аминокислоты вместе, называется пептидной связью .
Результирующая группа атомов, которая удерживает аминокислоты вместе, называется пептидной связью . Любая из 20 различных аминокислот может находиться в любом положении полипептидной цепи.Это означает, что существует очень большое количество возможных цепей даже при длине всего в несколько аминокислот. Количество и последовательность аминокислот в полипептидной цепи называется первичной структурой . Каждый тип полипептида, продуцируемый клеткой, имеет различную первичную структуру. Это тщательно контролируемое свойство цепи и регулируется генетическим кодом, обнаруженным в генах и молекулах ДНК. Все остальные свойства полипептидов и белков проистекают из первичной структуры.
Полипептиды II: вторичная структура
В воде полипептиды действуют и реагируют сами с собой и с окружающей средой. Сумма всех сил, действующих на сложные цепи и их химические R-группы, изгибает, скручивает и заставляет полипептид принимать фантастические формы.
 Они скручиваются и складываются в сложные трехмерные конформации, которые имеют решающее значение для их роли и свойств внутри клеток.Самый нижний уровень трехмерной формы называется вторичной структурой . Можно выделить три типа общей вторичной структуры.
Они скручиваются и складываются в сложные трехмерные конформации, которые имеют решающее значение для их роли и свойств внутри клеток.Самый нижний уровень трехмерной формы называется вторичной структурой . Можно выделить три типа общей вторичной структуры. Случайная прогулка
наблюдается в областях полипептида, где составляющие R-группы действуют и реагируют друг с другом. Положительно заряженная R-группа может быть привлечена к отрицательно заряженной R-группе, заставляя цепь изгибаться, пока две R-группы не приблизятся друг к другу.В качестве альтернативы, вторая положительно заряженная R-группа дальше по цепи будет отталкиваться первым положительным зарядом. Цепь растянулась бы так, чтобы между этими зарядами было как можно большее расстояние.
Бета-плиссированный лист
представляет собой гибкую, сильную конфигурацию, в которой альтернативные R-группы отходят от основы цепи в противоположных направлениях.
 Это создает зигзагообразный эффект, который поддерживается за счет сшивания водородных связей между соседними цепями.Белок шелка, бета-кератин, паутина, ваши ногти — все они содержат протеины с высокой долей бета-гофрированного полотна. Эти белки сопротивляются растяжению, поскольку их цепи практически полностью растянуты.
Это создает зигзагообразный эффект, который поддерживается за счет сшивания водородных связей между соседними цепями.Белок шелка, бета-кератин, паутина, ваши ногти — все они содержат протеины с высокой долей бета-гофрированного полотна. Эти белки сопротивляются растяжению, поскольку их цепи практически полностью растянуты. Альфа-спираль
является распространенной формой вторичной структуры, наблюдаемой во многих белках. Ряд слабых водородных связей образуется между атомами одной пептидной связи и атомами другой пептидной связи примерно на 3 аминокислоты дальше по цепи.Эти крошечные взаимодействия, тем не менее, достаточно сильны, чтобы свернуть полипептид в альфа-спираль; структура, которая выглядит так, как если бы цепочка аминокислот была обернута вокруг цилиндра. Эти спиральные, спиральные молекулы можно растягивать. Некоторые белки с большим содержанием спиралей легко растягиваются.
 Волосы и шерсть легко растягиваются, но, когда сила ослабляется, спираль возвращается в исходную форму, и белок возвращается к своей исходной форме.
Волосы и шерсть легко растягиваются, но, когда сила ослабляется, спираль возвращается в исходную форму, и белок возвращается к своей исходной форме. Третичная структура; становиться белком
Большинство белков складываются в сложные трехмерные глобулярные формы.Гидрофильные R-группы положительно взаимодействуют с окружающей водой. Вся цепь закручивается до тех пор, пока максимальное количество этих групп не войдет в полный контакт с окружающей водой. Взаимодействие между водой и гидрофильными R-группами поддерживает огромную молекулу белка и помогает удерживать ее в растворе. И наоборот, гидрофобные R-группы погружаются глубоко в складывающуюся макромолекулу, вдали от молекул воды. Эти силы, вместе с другими эффектами сшивания, удерживают гигантскую структуру в трехмерной форме, которая является отличительной и уникальной для этого белка.
Именно на этом уровне структуры многие белки берут на себя свою клеточную роль или функцию.
 Как полипептидная цепь, молекула не обладает особыми свойствами, но как трехмерный белок молекула способна совершать удивительное множество действий. Глобулярные белки катализируют химические реакции, другие действуют как защитные антитела в иммунной системе, а третьи вызывают бурные телесные реакции при прохождении через кровь.
Как полипептидная цепь, молекула не обладает особыми свойствами, но как трехмерный белок молекула способна совершать удивительное множество действий. Глобулярные белки катализируют химические реакции, другие действуют как защитные антитела в иммунной системе, а третьи вызывают бурные телесные реакции при прохождении через кровь. Четвертичная структура
Некоторые глобулярные белки объединяются в комплексы, состоящие из двух или более субъединиц.К этим субъединицам могут быть присоединены другие небелковые молекулы, такие как полисахариды. Эти более высокие уровни структуры можно увидеть в молекуле белка, такой как гемоглобин, большой глобулярный белок из четырех субъединиц с четырьмя дополнительными небелковыми добавками. Этот белок переносит кислород в крови.
Денатурация.
Большинство особых свойств белков проистекает из их уникальных трехмерных форм. Когда эта форма теряется, белок перестает функционировать.
 Процесс изменения формы белка таким образом, что функция теряется, называется денатурацией .
Процесс изменения формы белка таким образом, что функция теряется, называется денатурацией .Белки легко денатурируются при нагревании. При кипячении белковых молекул их свойства меняются. Например, они часто становятся
нерастворимы и остаются таковыми даже при охлаждении раствора. Варка яйца вызывает необратимую денатурацию всех содержащихся в нем белков, «белок» яйца, глобулярный белок, изменяет форму и затвердевает. Этот денатурированный белок имеет ту же первичную структуру, что и исходный белок, но третичная структура утрачена; поэтому обладают всеми важнейшими свойствами исходного или нативного белка.Денатурация может происходить не только с помощью тепла, но и другими способами. Все белки могут быть денатурированы при экстремальных значениях pH; щелочной или кислотный. Они чувствительны к органическим растворителям и мылу. Взбивание яичного белка вызовет механическую денатурацию за счет увеличения площади поверхности жидкости. Поверхностное натяжение теряет форму белка.
*** Сделайте дипептид ***Белки острой фазы — eClinpath
Белки острой фазы (АРР) определяются как белки, которые изменяют свою концентрацию в сыворотке более чем на 25% в ответ на воспалительные цитокины (IL-1, IL-6, TNFα).Реакция острой фазы считается частью врожденной иммунной системы, и АРР играют роль в опосредовании таких системных эффектов, как лихорадка, лейкоцитоз, повышение кортизола, снижение тироксина, снижение уровня железа в сыворотке и многие другие. APP можно разделить на положительные (увеличение концентрации в сыворотке) или отрицательные (уменьшение концентрации в сыворотке).
Повышенная продукция положительных белков острой фазы является чувствительным индикатором воспаления, которое может возникнуть до развития воспалительной лейкограммы.
Общий
Положительные белки острой фазы
Положительные белки острой фазы повышают концентрацию в плазме в ответ на воспаление (обычно в течение 1-2 дней). Положительные APP далее подразделяются на большие, умеренные или незначительные, в зависимости от степени увеличения.
- Major APP: Белок с низкой концентрацией в сыворотке здоровых животных (часто <0,1 мкг / дл), но при стимуляции увеличивается более чем в 100-1000 раз, достигая пика через 24-48 часов после инсульта, затем быстро уменьшается.Примером основного APP является сывороточный амилоид A.
- Умеренный APP: Присутствует в крови здоровых животных, но увеличивается в 5-10 раз при стимуляции, достигая пика примерно через 48-72 часа после инсульта, затем снижается медленнее, чем у основных APP.
- Minor APP: Увеличивайте только на 50–100% по сравнению с уровнями покоя и постепенно.
Скорость и величина увеличения каждого белка острой фазы варьируется в зависимости от вида.В следующей таблице перечислены белки острой фазы, которые являются основными и умеренными ответчиками у различных видов животных.
Виды Основное приложение Умеренное приложение Кот SAA AGP, Hp Собака CRP, SAA л.с., AGP, CP Лошадь SAA л.с. Корова л.с., SAA AGP Свинья CRP, Pig-MAP л.с., л.с.
Мышь SAA л.с., AGP Крыса α2-макроглобулин л.с., AGP SAA = амилоид А сыворотки; CRP = C-реактивный белок; Hp = гаптоглобин; Pig-MAP = основной белок острой фазы; Белки острой фазы являются частью врожденного иммунного ответа, и его биологическая функция, хотя и изменчивая, обычно связана с защитой от патологического повреждения и восстановлением гомеостаза.Однако конкретный АРР может оказывать как провоспалительное, так и противовоспалительное действие. В следующей таблице приведены функции основных приложений.
Белок Основная функция Альфа-1-кислотный гликопротеин Противовоспалительное и иммуномодулирующее средство: обладает антинейтрофильной и антикомплементарной активностью и увеличивает секрецию макрофагами антагониста рецептора IL-1.
Связывается с липофильными и кислыми лекарственными средствами.С-реактивный белок На бактериях он способствует связыванию комплемента, облегчая фагоцитоз.
Индукция цитокинов
Ингибирование хемотаксиса и модуляция функции нейтрофилов
Нейтрализует вредные эффекты гистоновЦерулоплазмин Транспорт меди (для заживления ран, образования и созревания коллагена)
Антиоксидант
Уменьшает количество нейтрофилов, прикрепляющихся к эндотелиюГаптоглобин Связывает свободный гемоглобин (ограничивает доступность Hb-железа для роста бактерий)
Природный антагонист рецепторно-лигандной активации иммунной системы Ингибирование хемотаксиса и фагоцитоза гранулоцитовАмилоид А сыворотки Хемотаксическое привлечение воспалительных клеток к участкам воспаления
Индукция воспалительных цитокинов (через поверхностные рецепторы, включая Toll-подобный рецептор)
Ингибирование высвобождения миелопероксидазы и пролиферации лимфоцитов
Участвует в метаболизме и транспорте липидов
Иммуномодулирующее (через воспаление масомы)Отрицательные белки острой фазы
Отрицательные белки острой фазы снижают концентрацию в плазме более чем на 25% в ответ на воспаление.Это снижение может происходить быстро (в течение 24 часов) или постепенно уменьшаться в течение нескольких дней. Двумя основными отрицательными белками острой фазы являются альбумин и трансферрин. Механизм снижения их концентраций, вероятно, является многофакторным, включая снижение продукции печенью в ответ на воспалительные цитокины и, возможно, увеличение потери или усиление протеолиза.
- Альбумин
- Снижение выработки альбумина позволяет увеличить количество аминокислот, доступных для положительной продукции АРР
- Концентрация альбумина снижается постепенно, и снижение концентрации более заметно при хроническом воспалительном заболевании
- Трансферрин
- Обычно измеряется для оценки состояния железа
- Овотрансферрин является птичьим аналогом, но он является положительным белком острой фазы.
- Адипонектин : Этот белок, который вырабатывается в жировой ткани и способствует использованию энергии за счет повышения чувствительности к инсулину, обладает противовоспалительными свойствами.Концентрация может снижаться в крови у собак с воспалением, особенно из-за сепсиса. Механизм снижения неясен и не специфичен для сепсиса, поскольку снижение концентрации может наблюдаться у тучных животных или животных с сахарным диабетом (Torrente et al 2020).
Измерение
Электрофорез сыворотки
Белки острой фазы мигрируют в α- (в основном) и β-областях электрофореграммы. Поскольку многие белки острой фазы являются α-глобулинами, повышение концентрации α1- или α2-глобулинов является признаком острофазового ответа и обнаруживается вскоре после начала воспаления, травмы или инфекции и может сохраняться до тех пор, пока стимулирующий стимул не исчезнет. решено.
Электрофореграмма острой фазы отклика
Типичные результаты SPE острой фазы ответа:
- Увеличение общего белка от нормального до умеренного (включено в отчет SPE, но измерено на химическом анализаторе)
- Снижение альбумина от нормального до умеренного (отрицательный белок острой фазы)
- Переменное увеличение α1- или α2 глобулинов
В следующей таблице показана электрофоретическая область, в которой определенные АРР появляются на электрофореграмме.
Сывороточный протеин Электрофоретическая область α1-Кислотный гликопротеин α 1 Амилоид А сыворотки α Гаптоглобин α 2 Церулоплазмин α 2 Трансферрин β 1 С-реактивный белок γ Увеличение α-глобулинов может наблюдаться только тогда, когда белки острой фазы обычно находятся в высоких концентрациях (количества в миллиграммах или граммах, например.грамм. гаптоглобин) увеличиваются в сыворотке. Белки острой фазы, обнаруженные в меньших количествах (нанограммы или пикограммы, например, сывороточный амилоид А), не приведут к увеличению альфа-глобулинов, даже если они заметно увеличены в сыворотке.
Измерение конкретных белков острой фазы является более чувствительным тестом реакции острой фазы, чем электрофорез.
С-реактивный белок
- Примеры использования
- Хранение: стабильный при -10 ° C в течение 3 месяцев
- Антикоагулянт: Не используйте пробирку с цитратом, так как уровни значительно снижаются
- Тесты
- Турбидиметрический иммуноанализ: используется на людях и адаптирован для автоматизированных биохимических анализаторов.Однако существует вариация перекрестной активности с различными антителами против человеческого CRP. Гемолиз мешает иммунотурбидиметрическому тестированию.
- ELISA: коммерчески доступный набор для собачьего CRP
- Тесты пассивной пассивной агглютинации латекса на слайдах / капиллярах
- Флуорометрия с временным разрешением (TRFIA): , недавно разработанная для анализов CRP в цельной крови, слюне и выпоте собак
Церулоплазмин
- Примеры использования
- Антикоагулянт : концентрации выше для гепарина и ниже для EDTA
- Тесты
- Существуют проблемы с анализами церулоплазмина из-за отсутствия коммерчески доступных эталонных материалов для стандартизации концентраций церулоплазмина.Поэтому использовались различные условные единицы, основанные на увеличении поглощения в единицу времени (единицы оксидазы UI / л).
Гаптоглобин
- Примеры использования
- Хранение : более стабильно в сыворотке, чем в очищенном препарате. Значения снижаются в сыворотке, хранящейся при -20 ° C. Рекомендуется хранение при -70 ° C.
- Антикоагулянты : концентрация повышена гепарином
- Помехи : Уровни гаптоглобина индуцируются стероидами, поэтому собаки с высоким содержанием эндогенных стероидов или на терапии экзогенными стероидами будут иметь повышенные концентрации Hp.При использовании анализов Hp, разработанных для других видов, образцы сыворотки собак необходимо разбавить. Это связано с тем, что концентрация Hp у собак в состоянии здоровья или болезни значительно выше, чем у других видов.
- Тесты


