Как проверить молочные железы самостоятельно: Как проверить женскую грудь на онкологию без визита к маммологу
Как проверить женскую грудь на онкологию без визита к маммологу
Медики рекомендуют женщинам внимательнее относиться к собственному здоровью.
Рак груди считается одним из самых распространенных видов онкологических заболеваний и чаще всего ему подвержены женщины, поэтому им необходимо своевременно проходить обследование у гинеколога и маммолога. Не лишней, по мнению врачей, будет ежедневная самодиагностика, при помощи которой можно будет на ранней стадии заболевания обратить внимание на необычные проявления или симптомы, чтобы заблаговременно обратиться за медицинской помощью.
Онкологи утверждают, что ранняя диагностика рака увеличивает шансы пациентки на скорейшее выздоровление. Соответственно, чем позже был диагностирован рак молочных желез, тем сложнее будет проходить лечение и вопрос о полном выздоровлении останется не таким уж однозначным.
Что нужно делать женщинам?
Осматривать свою грудь. Ежедневно перед зеркалом стоит посмотреть на свою грудь и оценить — не изменилась ли она внешне. Признаки рака груди — увеличение одной из молочных желез, деформация, появление «ямочек» или наоборот бугорков, ореола на одной из желез припухла и так далее. Любые изменения должны вас озадачить и заставить в ближайшее время обратиться к маммологу.
Признаки рака груди — увеличение одной из молочных желез, деформация, появление «ямочек» или наоборот бугорков, ореола на одной из желез припухла и так далее. Любые изменения должны вас озадачить и заставить в ближайшее время обратиться к маммологу.
Прощупывать молочные железы. Это позволит вам сразу определить, нет ли в молочных железах уплотнений и бугорков, при надавливании на которые вы ощутите дискомфорт или даже боль.
Периодически нажимать на соски для того, чтобы убедиться в отсутствии каких-либо выделений. Если вдруг при надавливании из соска стала выделяться жидкость желтоватого или даже зеленоватого оттенка, то откладывать визит к маммологу не рекомендуется.
Медики выделяют три основных причины рака молочных желез:
Наследственность. Когда кто-то из женщин в роду уже болел таким же онкологическим заболеванием с большой долей вероятности недуг может перейти младшему поколению, будто по наследству.
Травмы груди. Травмированные ткани молочной железы могут спровоцировать перерождение здоровых клеток в злокачественные.
Прием гормональных препаратов в течение длительного времени. Гормональные контрацептивы увеличивают уровень эстрогена в крови женщины, а это первый шаг на пути к развитию раковой опухоли, так считают врачи, поэтому пить по несколько лет гормональные препараты чревато для здоровья и жизни.
Не ждите, когда в груди начнет болеть, по статистике, болевой синдром при раке груди — явление нечастое, хотя и имеет место быть в некоторых случаях.
Вопрос-ответ: Маммолог
|
Сегодня, на самые частые вопросы в области мамммологии отвечает врач онколог- маммолог с 10-ти летним стажем Тазина Юлия Андреевна. Узнать стоимость на прием специалиста и записаться на приём можно в разделе Маммология |
|
Выделения из сосков (Обнаружила у себя белые и зеленые выделения из сосков при надавливание)
Прийти на обследование к маммологу и провести УЗИ молочных желез.
Грудь после удаления опухоли (обязательно ли нужна пластика или есть какие-нибудь другие методы восстановления)
В зависимости от того что понимают под словом пластика. После удаления злокачественного образования есть несколько методов формирования новой молочной железы:
Трансдермальные трансплантаты: методика формирования новой груди с помощью дорсальных мышц спины или живота.
Имплантаты – эспандеры. Этот метод используется если во время операции сохраняют кожу и ореолы молочной железы, что возможно не при всех размерах опухолях. Иногда во время операции затрагивается и кожа, когда в коже тоже присутствуют злокачественные клетки, тогда кожу тоже приходится удалять.
Чувство прилива молока к груди
Можно прийти к маммологу, можно прийти к эндокринологу. Чаще всего эти ощущения связаны с повышением пролактина.
Уплотнения в груди (появилось уплотнение, болит при нажиме)
Необходимо прийти на прием. Чаще всего это доброкачественные изменения, в основном дисгормональные.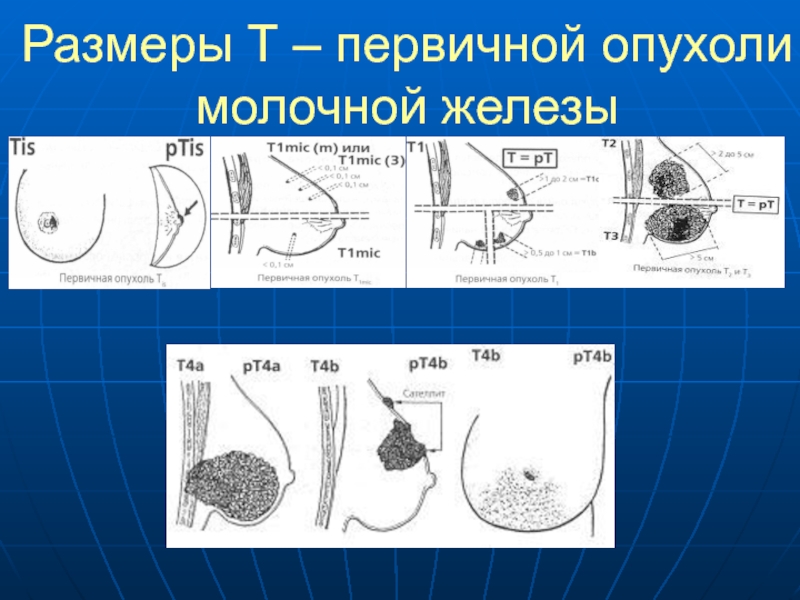 При выявлении уплотнений или образований при самостоятельном осмотре, в любом случае, необходимо прийти на прием к маммологу и сделать УЗИ молочных желез
При выявлении уплотнений или образований при самостоятельном осмотре, в любом случае, необходимо прийти на прием к маммологу и сделать УЗИ молочных желез
Лечение кисты груди
Выбор метода лечения кисты зависит ее от размера:
Мелкие кисты до 1-1,5 см мы наблюдаем, лечим фитопрепаратами.
Кисты более 1,5 см — обязательно проведение лечебно-диагностической процедуры — пункции (даже в случае наличия простой кисты).
Простые кисты — это образования, без внутрикистозных папиллярных разрастаний. Такую кисту пунктируем до полного опустошения, до полного слипания стенок. Выкаченную жидкость отправляем на цитологическое лабораторное обследование.
Большие ареолы (как операция по уменьшению может повлиять на развитие рака, кормление грудью и т.д.)
Пластические операции не влияют на развитие рака.
Кормление грудью: Перед операцией обсудите с хирургом перспективу кормления грудью, хирург подберет технику и манипуляции, производимые в ходе операции, подходящие для сохранения возможности грудного вскармливания. Во время операции не должны нарушить протоковую систему, чаще всего для этого сечение делают по окантовке – по краю ареолы.
Во время операции не должны нарушить протоковую систему, чаще всего для этого сечение делают по окантовке – по краю ареолы.
Мало молока при лактации (как повысить)
Больше кормить, количество молока в большей степени зависит от частоты прикладывания малыша к груди.
Доброкачественная диффузно фиброзно-кистозная мастопатия.
Если диагноз уже поставлен: Мелкие кисты наблюдаются и лечат. Кисты иногда бывают бессимптомны. Мелкая киста может быть одноразовым нарушением гормонального фона, который потом приходит в норму. Но наблюдение врача — обязательно.
Можно ли проводить УЗИ во время ГВ в профилактических целях или лучше дождаться завершения кормления?
Узи проводить можно, но необходимости, чаще всего, нет. Если до беременности наблюдались с кистозными изменениями, с фиброаденомами, то рекомендуется провести УЗИ на начальных сроках беременности и перед родами. Если же на УЗИ не было выявлено изменений, то следующее УЗИ проводится по завершению грудного вскармливания, через 3-4 месяца.
Узи проводится до 35 лет. Маммографию после 40.
С 35 до 50 лет лучше комбинировать. Все зависит от структуры молочной железы. Более плотная и железистая структура у молодых женщин подразумевает проведение УЗИ, но все в жизни очень индивидуально, бывает и ранняя жировая инволюция, тогда и показано проведение маммографии.
Когда лучше и правильнее проходить обследование у маммолога: до, во время или после менструации?
С 5 по 12 день цикла. Но, если вы в ходе самостоятельного осмотра обнаружили какие-либо выраженные уплотнения, образования, то можно приходить в любой день цикла. Чем раньше, тем лучше.
УЗИ молочной железы дает 100% результат или может не определить наличие мастопатии?
100%
Чем отличаются исследования: маммография и УЗИ, возможно обойтись только одним исследованием?
В зависимости от возраста.
Маммография — это рентгеновский метод исследования молочных желез. Это золотой стандарт в маммологии. Данный метод очень хорошо применяется женщин старше 45 лет с жировой инволюцией, т. е. когда железистая ткань уже не так ярко выражена.
е. когда железистая ткань уже не так ярко выражена.
С 35 до 50 лучше комбинировать. Все зависит от структуры молочной железы. Часто у более молодых девушек маммография используется как дополнение к УЗИ.
Какая разница между мастопатией и фиброаденомой?
Фиброаденома — это тканевое образование, объёмное.
Мастопатия — это сборное название всех доброкачественных дисплазий молочных желез. Кистозные изменения, расширение протоков (так называемая дуктэктазия), гиперплазия железистой ткани и т.д.
Можно ли при мастопатии кормить ребенка грудью? Если да, то не отразится ли это на ребенке?
В период грудного вскармливания диагноз мастопатия не ставят. Если ставили до, то обязательно кормить. Потому что беременность, роды, грудное вскармливание — это нормальная функция молочной железы. Длительное кормление вашего малыша приводит к здоровью молочной железы в дальнейшем.
Можно ли посещать солярий при мастопатии и на сколько это вредно!
Не рекомендую злоупотреблять. Если есть боли в молочной железе, ярко выраженные кисты, тогда лучше избегать солярий. При легкой степени мастопатии, когда за 5-7 дней до менструации обычно набухает грудь и появляются боли, лучше ограничить посещение солярия, бани и т.д. именно в эти дни.
Если есть боли в молочной железе, ярко выраженные кисты, тогда лучше избегать солярий. При легкой степени мастопатии, когда за 5-7 дней до менструации обычно набухает грудь и появляются боли, лучше ограничить посещение солярия, бани и т.д. именно в эти дни.
Можно ли увеличить грудь с помощью кремов которые рекламируют? И вообще можно ли увеличить грудь без операции?
нет
При каких симптомах нужно срочно обращаться к врачу
Если никогда не обследовались, то любой симптом, даже внезапное появление болей необходимо обследовать. Если вы постоянно самостоятельно осматриваете свои молочные железы, знаете их строение и вдруг что-то обнаруживаете (уплотнения, новообразования) нужно обязательно прийти на прием к врачу онкологу-маммологу.
Профилактика рака груди | ГАУЗ «Краевой клинический кожно-венерологический диспансер»
Рак молочной железы — это злокачественная опухоль железистой ткани молочной железы
Как возникает рак молочной железы
Рак молочной железы развивается так же, как и любая другая злокачественная опухоль в организме. Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги (метастазы).
Одна или несколько клеток железистой ткани в результате произошедшей в них мутации начинают аномально быстро делиться. Из них образуется опухоль, способная прорастать в соседние ткани и создавать вторичные опухолевые очаги (метастазы).
Причины и факторы риска
К сожалению, полной информации о причинах возникновения рака молочной железы у ученых пока нет. Существует список факторов риска, влияющих на вероятность появления опухоли, однако у некоторых болезнь диагностируют при отсутствии этих факторов, другие же остаются здоровыми при наличии сразу многих из них. Тем не менее, ученые все же связывают развитие рака груди с определенными обстоятельствами, наиболее часто предваряющими его появление.
К ним относятся:
• пожилой возраст;
• использование гормональных препаратов;
• травмы молочных желез;
• наличие в анамнезе случая рака молочной железы;
• диагностированный РМЖ у кого-то из родственников;
• воздействие радиации, например, в ходе лучевой терапии, проводимой для лечения другого типа рака;
• лишний вес;
• раннее начало менструации и позднее — менопаузы;
• отсутствие детей или поздние (после 35 лет) первые роды;
• курение и злоупотребление алкоголем;
• сахарный диабет;
• работа по графику с ночными сменами.
Симптомы рака молочной железы
Довольно часто на ранних стадиях рак молочной железы протекает бессимптомно. Но в ряде случаев признаки, указывающие на наличие заболевания, все же есть, и их можно заметить.
В первую очередь, к симптомам, которые должны насторожить, относят уплотнения в молочных железах, рядом с ними или в подмышечной впадине. В 9 случаях из 10 уплотнения бывают доброкачественными, однако установить это наверняка можно только на осмотре у маммолога.
Самостоятельно проверять грудь на наличие узелков или каких-либо других изменений стоит раз в месяц, по окончании менструации. Домашнюю диагностику удобнее всего проводить, принимая ванну или находясь под душем. О любых изменениях, которые удалось обнаружить, стоит как можно быстрее рассказать врачу.
К симптомам рака молочной железы относят:
1. Отвердение кожи
2. Участок втяжения кожи
3. Эрозия кожи
4. Покраснение кожи
5. Выделения из соска
6. Деформация молочной железы по типу ряби
7. Припухлость кожи
Припухлость кожи
8. Увеличение в размерах вены
9. Втяжение соска
10. Нарушение симметрии молочных желез
11. Симптом лимонной корки
12. Пальпируемый узел внутри молочной железы.
70% случаев рака молочной железы выявляются пациентами самостоятельно в результате самообследования груди.
При появлении указанных симптомов, а также любых других изменений в молочных железах (например, необычных или болезненных ощущений) нужно немедленно проконсультироваться с маммологом.
Как избежать рака молочной железы
Советы врача:
• Зимой и весной нужно принимать препараты, содержащие витамины А, В1, В2, С,E и микроэлементы – йод, селен.
• Дефицит йода можно восполнить морепродуктами. Много йода в печени трески. В небольшом количестве он содержится в картофеле.
• Очень важно не переутомляться, уходить от нервных потрясений.
• Нормализуют сон и деятельность нервной системы занятия физкультурой, водные закаливающие процедуры.
• Не рекомендуется пользоваться телевизором, компьютером, мобильным телефоном не более 20 часов в неделю.
• Злоупотребление алкоголем, курение, химические дезодоранты отрицательно сказываются на здоровье.
• Для своевременного выявления отклонений в состоянии здоровья всем женщинам обязательно 1 раз в год следует посещать смотровой кабинет поликлиники.
• В возрасте 35-49 лет необходимо ежегодно проходить специальные методы обследования (маммографию, ультразвуковое обследование), после 50 лет – 1 раз в полгода.
• Не менее важно ограничить прием высококаллорийной пищи, ввести в меню больше фруктов и овощей, особенно капусту, морковь, тыкву, кабачки, салат, льняное масло
• Женщинам любого возраста нужно регулярно, каждый месяц, проводить самообследование молочных желез
При осмотре перед зеркалом с опущенными и поднятыми руками обратить внимание: нет ли втяжения (или наоборот, появившейся выпуклости) участка кожи, втяжения соска или укорочения радиуса ареолы, изменения размера или формы одной из молочных желез, выделений из сосков или язвочек и др.
Продолжить осмотр, повернувшись вправо, влево. Кончиками пальцев круговыми движениями по часовой стрелке и против провести ощупывание молочных желез от сосковой области к периферии железы.
Тоже самое сделать в положении лежа на спине.
При ощупывании левой молочной железы под левую лопатку подложить небольшую подушку, а ладонь левой руки- под голову. И наоборот.
Для выявления выделений из молочной железы нужно осмотреть белье, несильно сдавить каждый сосок.
Если придерживаться данных рекомендаций, тогда многих страхов можно будет избежать.
Профилактика рака груди | Министерство здравоохранения Чувашской Республики
Ежегодно 23 сентября Всемирная организация здравоохранения (ВОЗ) объединяет усилия с Международным союзом против рака груди для продвижения способов облегчения глобального бремени рака. Профилактика рака и повышение качества жизни пациентов с раковыми заболеваниями периодически становятся темами этого международного дня.
Цель мероприятий, проводимых в этот день, — обратить внимание общества на проблематику рака груди, улучшить знания по этому вопросу, для того чтобы стала возможной диагностика заболевания на начальной стадии и было осуществлено надлежащее лечение.
В настоящее время рак молочной железы является самым распространенным раковым заболеванием среди женщин. В Чувашской Республике на него приходится 19% всех случаев заболевания раком среди женщин. Ежегодно в Чувашии около 400 женщин заболевает раком молочной железы. Из них доля ранних стадий составляет порядка 70%.
Единственным реальным путем успешного излечения и снижения смертности от рака груди в настоящее время является выявление опухолей на ранних стадиях и своевременное хирургическое лечение. Современные диагностические технологии позволяют выявлять злокачественные опухоли на очень ранних стадиях, когда они не превышают 5 мм и могут быть успешно излечены. Но чтобы «поймать» опухоль на таком раннем этапе развития, необходимо регулярно проходить обследование и делать маммографию.
Ежегодно в Чувашской Республике около 400 женщин заболевает раком молочной железы.
В 2015 году в Чувашской Республике стартовала Программа снижения смертности от рака молочной железы.
Республиканским клиническим онкологическим диспансером проводится целый ряд мероприятий, направленных на снижение смертности от новообразований молочной железы.
С начала года в республике реализуется профилактическая акция «Маммологический онкопатруль», в рамках которой в отдаленные районы выезжает современный передвижной рентгенологический маммографический комплекс для ранней диагностики рака молочной железы, оснащенный цифровым маммографом.
В июле 2015 года на базе онкологического диспансера состоялось открытие телемедицинского центра. Телемедицинская сеть по обмену снимками между медицинскими учреждениями республики, онкологическим диспансером и Российским онкологическим научным центром имени Н.Н. Блохина позволит значительно улучшить качество ранней диагностики.
Важное направление программы — информирование женщин о необходимости прохождения обследования.
Сознательные женщины должны ежегодно проходить скрининг: маммографию и профосмотр у гинеколога. А также ежемесячно на 6-12 день от начала менструации самостоятельно проводить осмотр молочных желез. В случае выявления плотного образования, локального отека кожи над уплотнением, втянутого или морщинистого участка кожи следует обратиться к специалисту. Между тем профилактическими осмотрами большинство пренебрегает, несмотря на то, что напоминания о них уже набили оскомину. Однако от этого они все же не теряют свою актуальность.
|
Самообследование молочной железы — важная составляющая не только профилактики рака груди, но и естественный способ выявить другие патологии, которые в результате могут привести к развитию опухоли.
Ранняя и своевременная диагностика позволяет в полном объеме провести все необходимые лечебные мероприятия и делать самые благоприятные прогнозы в плане полного сохранения здоровья.
|
Методика самообследования молочных желез
Самостоятельное обследование молочных желез проводят в домашних условиях раз в месяц, начиная с седьмого по десятый день от начала очередного менструального цикла. Самообследование молочной железы проводится при хорошем освещении. Перед началом самообследования рекомендуется расслабиться и успокоиться.
Шаг 1. Осмотр белья
Одним из признаков того, что в молочной железе происходят изменения, могут быть выделения из соска. Незначительные выделения из соска могут остаться незамеченными на его поверхности, но оставлять следы на бюстгальтере. Поэтому необходимо тщательно его осмотреть: нет ли на нем следов выделения из соска в виде кровянистых, бурых, зеленоватых или желтоватых пятен, корочек.
Шаг 2. Общий вид молочных желез
Осмотр молочных желез надо начинать с осмотра сосков и ареол, чтобы убедиться, что нет покраснений, высыпаний, шелушения, втяжения, изъязвления или других изменений этой зоны.
Необходимо раздеться до пояса и встать перед зеркалом. Затем свободно опустить руки. Внимательно рассмотреть в зеркале каждую молочную железу. Проверить, не отмечаются ли какие-то изменения их величины, формы и контуров. Асимметрия размеров и формы груди не всегда является признаком заболевания. Очень часто форма и размеры двух молочных желез у женщин могут несколько отличаться, но если эти отличия появляются и нарастают — это следует учесть.
Особое внимание следует обратить на наличие отёка верхней конечности, шеи, что может быть вызвано блоком лимфооттока.
Необходимо обращать внимание на возможные изменения формы желез с образованием возвышений, западаний, втягивания кожи или области соска. Надо посмотреть, не появляются ли при этих действиях из соска капли жидкости.
Шаг 3. Состояние кожи
На этом этапе проверяется состояние кожи, покрывающей молочные железы. Необходимо проверить эластичность кожи, как хорошо она собирается в складку. Надо обращать внимание на изменение цвета кожи, наличие покраснения всей ее поверхности или отдельных участков, нет ли на ней опрелости, сыпи, изменений в виде «лимонной корки».
Надо обращать внимание на изменение цвета кожи, наличие покраснения всей ее поверхности или отдельных участков, нет ли на ней опрелости, сыпи, изменений в виде «лимонной корки».
Кожа прощупывается на предмет ее уплотнений, набухания, наличия ямочек или бугорков на ее поверхности, втянутости, язвочек или сморщенности кожи.
Шаг 4. Самопальпация стоя
Ощупывание молочных желез стоя. Обследование левой молочной железы проводится правой рукой, а правой — левой рукой. Ощупывание проводится подушечками пальцев, а не их кончиками. Для этого надо сомкнуть три или четыре пальца. Затем начать ощупывание круговыми проникающими движениями. Большой палец в таком ощупывании не участвует. При больших размерах молочной железы ее надо поддерживать противоположной рукой. Имеются два метода ощупывания: прощупывать молочную железу можно по спирали, вверх и вниз, или по сегментам. Нужно выбрать один, наиболее удобный для вас способ и всегда придерживаться именно его — это позволит правильно сравнивать результаты пальпации.
Шаг 5. Самопальпация лежа
Техника и последовательность обследования лежа схожа с методикой обследования стоя. Данный этап является наиболее важной частью самообследования молочных желез, потому что только этим способом можно хорошо прощупать все их ткани. При этом определяют, каковы молочные железы на ощупь под пальцами, и запоминают эти ощущения. Ощупывание проводится лежа на твердой, плоской поверхности. Под лопатку со стороны осматриваемой молочной железы подкладывается подушка в виде валика, чтоб грудная клетка была приподнята, а молочная железа более распластана на грудной клетке. Руку следует вытянуть вдоль туловища или завести за голову.
Шаг 6. Обследование соска молочной железы
Проводя осмотр сосков, необходимо определить: не изменены ли их форма и цвет, нет ли в их области втянутости, мокнутий, изъязвлений или трещин. Необходимо прощупать сосок и область под соском, так как в этой области может быть опухоль.
В конце самообследования молочной железы необходимо осторожно взять сосок большим и указательным пальцами и надавить на него, обращая внимание на то, имеются ли из него выделения, и их характер, если они есть.
На что следует обратить внимание?
- Увеличение или уменьшение размеров желез, их формы, симметричностиСмещение вверх или в сторону, наличие подвижности или фиксация тканей
- Нарушение конфигурации желез (втяжения, выпячивания)
- Состояние соска и ареолы (втяжение, деформация, изъязвление)
- Состояние кожных покровов железы: локальная или разлитая гиперемия (покраснение) кожи железы, распространение ее на соседние участки
- Наличие выделений из соска, их характер — молозивные, зеленовато-бурые, серозные, мазеобразные, кровянистые
- Локальный или тотальный отек по типу «лимонной корки»
- Расширение кровеносных сосудов
- Наличие узелковых уплотнений, изъязвлений кожи, корок, мокнущих поверхностей, свищей, распада тканей.
При наличии любых изменений в молочной железе или при возникновении ощущений, не свойственных предыдущему самоосмотру, следует немедленно обратиться к врачу.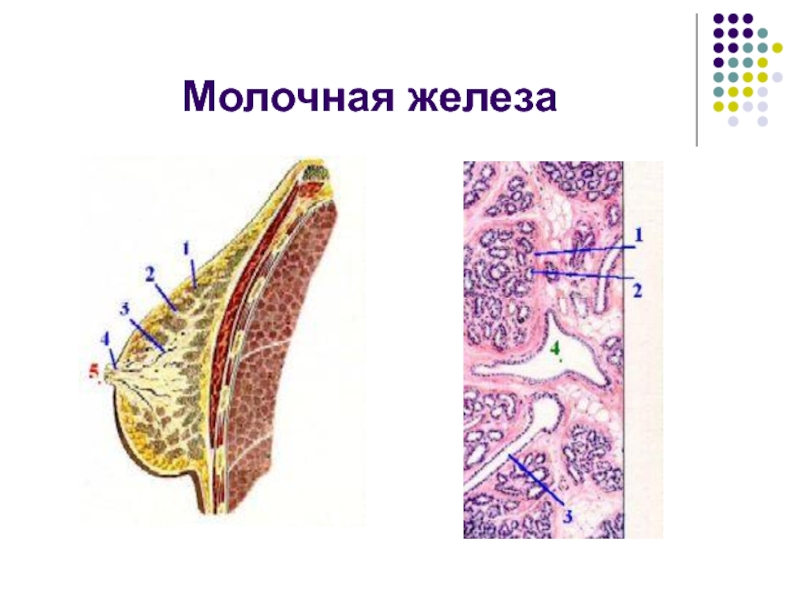
Кроме самообследования раз в год обязателен осмотр у врача.
Женщинам от 35 до 40 лет необходимо делать УЗ-исследование молочных желез.
Женщинам после 40 лет необходимо делать маммографию.
лечение и диагностика симптомов, причин в Москве
Важнейшее достижение в борьбе с раком молочной железы — это установление мер по скринингу и ранней диагностики рака, что способствует своевременному лечению и значительному снижению смертности.
Факторы риска развития рака молочной железы
- Генетика (носительство гена BRC1 и 2, нарушения гена p53 и др.)
- Гормональный дисбаланс: избыток эстрогена способствует пролиферации эстроген-зависимых тканей, в том числе и тканей молочной железы. К состояниям, создающим гиперэстрогению относятся: раннее менархе, поздняя менопауза, поздние роды, длительный прием комбинированных оральных контрацептивов, эстроген-продуцирующие опухоли.
- Диета, богатая животными жирами, алкоголь.

- Факторы окружающей среды (ионизирующее излучение).
Течение и симптомы рака груди
На ранних стадиях рак никак себя не проявляет. Увеличиваясь в размере и проникая глубже в подлежащие ткани, он может вызывать симптоматику: кровянистые выделения из сосков, пальпируемое образование в толще железы, изменение кожи по типу лимонной корочки, асимметричность сосков, втяжение соска или участка кожи, воспаление груди и т.д.
Диагностика
Самое главная и сложная задача в диагностике — определить рак на самых начальных стадиях.
Для решения этой проблемы была разработана скрининговая программа.Скрининг — это массовое обследование населения для определения группы людей, нуждающихся в углубленной диагностике заболевания.
Согласно скрининговой программе, каждая женщина должна проходить маммографию с 40 лет раз в 2 года, а с 50 — каждый год.
Маммография — это рентгенологическое исследование молочной железы, позволяющее визуализировать участки, подозрительные на рак.
Еще один метод первичной диагностики — пальпация молочной железы. Пальпацию может проводить каждая женщина самостоятельно, это называется — самообследование молочной железы. Пальпацию должен проводить врач-гинеколог на профилактическом осмотре. Пальпация не способна определить рак на самых начальных стадиях, когда он еще поддается относительно легкому излечиванию, но повышает внимательность к проблеме, позволяет определить доброкачественные образования и изменения, которые могут малигнизироваться.
Для более углубленной диагностики используются все доступные методы: УЗИ, МРТ, КТ, биопсия, генетический анализ крови и т.д.
Лечение рака молочной железы (груди)
Лечение рака молочной железы, как и любой другой онкологии, комплексное — хирургическая операция, химиотерапия, гормональная терапия, моноклональные антитела, облучение.
Хирургическая операция подразумевает резекцию части молочной железы или (что бывает чаще) полное удаление — мастэктомию. Последствия такой обширной операции сказываются не только на физическом здоровье, но и на психологическом состоянии женщины. К счастью, существуют реконструктивные операции, позволяющие восстановить внешний облик груди с помощью пластики и установки имплантов.
Последствия такой обширной операции сказываются не только на физическом здоровье, но и на психологическом состоянии женщины. К счастью, существуют реконструктивные операции, позволяющие восстановить внешний облик груди с помощью пластики и установки имплантов.
Все усилия врачей направлены не только на сохранение самой жизни, но и на сохранение ее высокого качества.
Почему стоит выбрать лечение в нашей клинике
Большой опыт работы
Хирурги-маммологи с опытом работы более 20 лет : органосохраняющие операции, операции с одномоментной реконструкции
Индивидуальный подход
Персонализированная терапия на основе генетического анализа, генетические тесты для оценки риска рецидива рака молочной железы
Многофункциональный центр
Пройдите все необходимые обследования и подготовку в одном медицинском учреждении.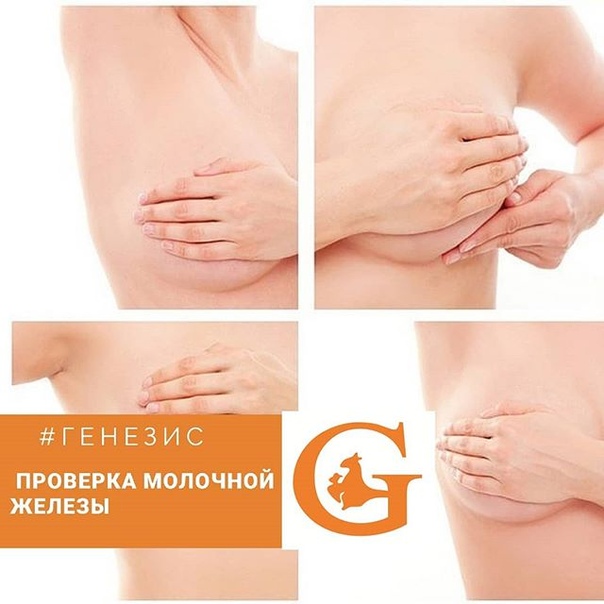
Международная деятельность
Постоянное повышение квалификации и участие наших специалистов в международных и отечественных конференциях и конгрессах.
Командная работа
В любой момент специалисты могут подключить к работе коллег из смежных областей.
В Депздраве назвали внешние признаки, которые могут указать на рак груди
Наиболее
распространенным онкологическим
заболеванием у женщин
является рак
молочной железы.
Врачи рекомендуют регулярно проводить
диагностику
груди в поликлинике, а также самостоятельно
следить за любыми изменениями в груди
и при их обнаружении, незамедлительно
обращаться к специалисту. В Департаменте
здравоохранения Москвы рассказали,
какие внешние
признаки могут свидетельствовать о
раке молочной железы.
«Стоя
перед зеркалом при ярком освещении
женщине следует внимательно рассмотреть
молочные железы спереди и сбоку, сперва
с опущенными, затем с поднятыми руками.
Во время самообследования обратите
внимание на зоны соска, ареолы, ткань
железы, подмышечную и надключичные
области. Оцените, нет ли изменений
размера или формы одной из молочных
желез, втянутости, изменения положения
или формы соска», – советует Гурам
Кветенадзе, руководитель отделения
хирургии и реконструкции молочной
железы МКНЦ им. Логинова ДЗМ.
Затем
стоит прощупать молочные железы,
подмышечные впадины и надключичные
области на присутствие припухлостей
или утолщения тканей. Ямки
или складки, особенно вокруг соска,
могут указывать на наличие доброкачественных
или злокачественных новообразований.
Также
врач рекомендует насторожиться, если
появились выделения
из одного или обоих сосков.
«Выделения
бывают самопроизвольными, которые можно
заметить по оставленным следам на
одежде, и полученными при пальпации,
если сдавить сосок у его основания
большим и указательным пальцами.
Прозрачные, “янтарные” и кровянистые
выделения являются отклонением», –
предупреждает Гурам
Кветенадзе.
Также
специалист сказал, что женщинам старше
18 лет следует проводить самообследование
молочных желез ежемесячно
на 5-14 день от начала менструального
цикла, а женщинам в менопаузе – в любой
день месяца.
При
наличии изменений груди требуется
обязательное обращение к врачу. Выявление
рака молочной железы на ранней стадии
дает шанс на полное выздоровление в 98%
случаев.
С
12 октября по 3 ноября в 79 медицинских
организациях в
соответствии с расписанием
москвички
могут пройти бесплатную диагностику
груди, получить консультацию специалистов
и прослушать тематические лекции
71
медорганизация
приглашает женщин с 18 до 39 лет на
ультразвуковое обследование, а дам
старше 40 – на маммографию.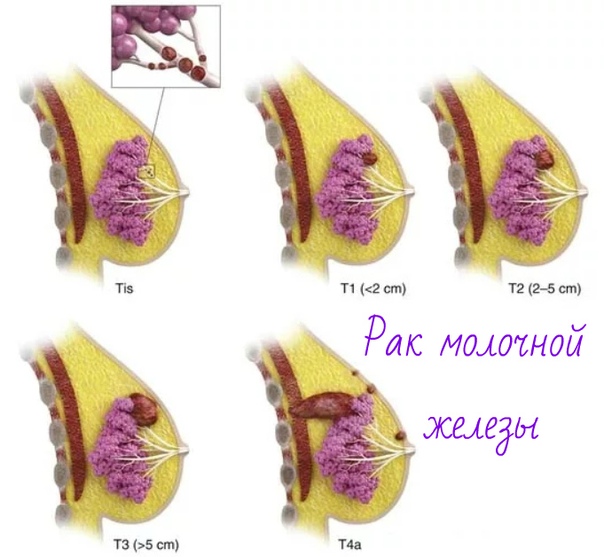 Врачи будут
Врачи будут
принимать с
19 октября до 3 ноября
по субботам с 9:00 до 18:00 и по воскресеньям
с 9:00 до 15:00. Предварительно нужно
записаться по контактному телефону
учреждения.
Также
женщины могут посетить открытые
диагностические дни в онкологических
больницах и лекции в Школе женского
здоровья. С полным списком активностей
и дополнительной информацией можно
ознакомиться на сайте https://mosgorzdrav.ru/rmj
Мероприятия
проводятся в рамках Всемирного
дня борьбы против рака молочной железы.
Самообледование молочных желез | ГУЗ Городской родильный дом г.Чита
Пользуясь порталом «ГОРОДСКОЙ РОДИЛЬНЫЙ ДОМ»,
Вы автоматически соглашаетесь с Правилами публикаций отзывов на сайте roddom-chita.ru
1.Общие положения:
1.1. Настоящие Правила регламентируют порядок размещения отзывов посетителей (пользователей) сайта roddom-chita. ru (далее – Сайт).
ru (далее – Сайт).
1.2. Посетители, приславшие отзывы для размещения на Сайте, (авторы отзывов), безвозмездно передают Администрации Сайта право свободного использования и предоставления широкого доступа к этим отзывам в пределах данного ресурса. Администрация Сайта оставляет за собой право использовать отзыв по собственному усмотрению и размещать его на других ресурсах (в печатных изданиях, на электронных носителях и т.д.).
2. Порядок публикации отзывов:
2.1. Администрация Сайта вправе самостоятельно и без уведомления пользователей отбирать отзывы для публикации, самостоятельно определять срок, в течение которого отзывы будут считаться актуальными.
2.2. До публикации отзыв проверяется Администрацией Сайта на соответствие настоящим Правилам, после чего Администрация Сайта принимает решение о его публикации.
2.3. Отзывы публикуются и используются без редактирования и поправок с сохранением авторской грамматики и пунктуации. Исключение составляет исправление явных опечаток.
2.4. В отзывах допускается только констатация и описание фактов, которые произошли с автором отзыва при обращении в ГУЗ «Городской родильный дом»
2.5. Отзывы без указания контактных данных (реальный e-mail пользователя, номер телефона и т.д.) считаются анонимными и на сайте не размещаются. В случае размещения такого отзыва, он наделяется пометкой: «Анонимный отзыв. Может содержать сведения, полностью не соответствующие действительности».
2.6. При размещении отзыва на Сайте администрация указывает исключительно имя автора отзыва. Контактные данные (реальный e-mail пользователя, номер телефона и т.д.) на страницах Сайта не указываются и не отображаются.
Контактными данными автора отзыва может воспользоваться исключительно Администрация сайта roddom-chita.ru для уточнения каких-либо данных, связанных с рассмотрением отзыва.
2.7. Администрация Сайта оставляет за собой право не публиковать отзыв пользователя, а также удалить с Сайта любой ранее опубликованный отзыв без объяснения причин и предупреждений в любое время.
2.8. В случае, если пользователь в будущем пожелает удалить свой отзыв с сайта roddom-chita.ru, он должен отправить запрос на удаление по адресу [email protected].
3. На сайте roddom-chita.ru не публикуются отзывы:
3.1. содержащие информацию, являющуюся клеветнической, дискредитирующей или угрожающей;
3.2. содержащие информацию, оскорбляющую честь и достоинство, а также национальные и религиозные чувства людей;
3.3. содержащие имена и другие персональные данные конкретных личностей, за исключением фамилии, имени, отчества медицинского работника ГУЗ «Городской родильный дом», в отношении которого написан отзыв;
3.4. содержащие ненормативную лексику, высказывания оскорбительного характера и т.д.;
3.5. представляющие собой явную коммерческую рекламу, содержащие спам, контакты организаций и ссылки на сайты;
3.6. содержащие информацию, не относящуюся к деятельности ГУЗ «Городской родильный дом»;
3.7. содержащие призывы или агитацию не пользоваться услугами ГУЗ «Городской родильный дом»;
3. 8. содержащие заведомо недостоверную информацию, призванную оттолкнуть клиентов от ГУЗ «Городской родильный дом»;
8. содержащие заведомо недостоверную информацию, призванную оттолкнуть клиентов от ГУЗ «Городской родильный дом»;
3.9. содержащие информацию о сравнении ГУЗ «Городской родильный дом» с другими юридическими лицами;
3.10. содержащие ссылки на отзывы, размещенные пользователями на других сайтах;
3.11. малоинформативные и необъективные.
4. Ответственность:
4.1. За содержание и достоверность информации в отзывах, размещаемых пользователями на сайте roddom-chita.ru, а также за нарушение прав третьих лиц, пользователь, разместивший данную информацию, несет ответственность самостоятельно.
4.2. Портал roddom-chita.ru, не является соавтором и распространителем данной информации, а лишь предоставляет площадку для ее размещения. Публикация отзыва на сайте не означает, что мнение Администрации сайта совпадает с мнением посетителя, оставившего отзыв. Администрация сайта не несет ответственности за достоверность сведений, содержащихся в отзывах.
4. 3. В случае, возникновения претензий к пользователям, разместившим информацию, о достоверности размещенной информации, а также в случае, если размещенная информация, нарушает чьи либо права, портал обязуется, согласно действующему законодательству Российской Федерации, раскрыть всю имеющуюся информацию о данном пользователе (контактные данные (e-mail пользователя, номер телефона и т.д.)), в срок, предусмотренный законом.
3. В случае, возникновения претензий к пользователям, разместившим информацию, о достоверности размещенной информации, а также в случае, если размещенная информация, нарушает чьи либо права, портал обязуется, согласно действующему законодательству Российской Федерации, раскрыть всю имеющуюся информацию о данном пользователе (контактные данные (e-mail пользователя, номер телефона и т.д.)), в срок, предусмотренный законом.
5. Прочие условия:
5.1. Администрация сайта roddom-chita.ru оставляет за собой право на внесение изменений и дополнений в настоящие Правила в любой момент времени без уведомления посетителей (пользователей) Сайта. Изменения вступают в силу с момента их публикации.
Анатомия груди: рак груди, грудное вскармливание, условия
Что такое грудь?
Грудь является частью женской и мужской половой анатомии. У женщин грудь одновременно функциональна (для кормления грудью) и сексуальна (доставляет удовольствие). У мужской груди нет функции.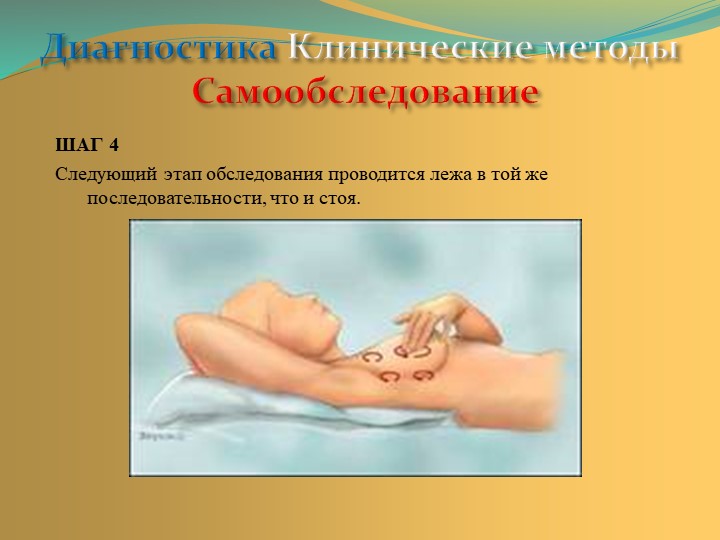 Видимые части анатомии груди включают соски и ареолы.
Видимые части анатомии груди включают соски и ареолы.
Из чего сделана грудь?
Женская грудь формируется из нескольких видов тканей. Мышцы соединяют грудь с ребрами, но они не являются частью анатомии груди.К различным типам тканей груди относятся:
- Железистая ткань: Железистая ткань, также называемая дольками, вырабатывает молоко.
- Жирность: Эта ткань определяет размер груди.
- Соединительная или волокнистая: Эта ткань удерживает железистую и жировую ткань груди на месте.
Какие части составляют анатомию груди?
Анатомия женской груди состоит из множества различных частей, в том числе:
- Доли: Каждая грудь имеет от 15 до 20 долей или секций.Эти лепестки окружают сосок, как спицы колеса.
- Железистая ткань (дольки): Эти небольшие участки ткани, находящиеся внутри долей, имеют крошечные луковичные железы на конце, которые производят молоко.
- Молочные (молочные) протоки: Эти маленькие трубочки или протоки несут молоко от железистой ткани (дольки) к соскам.
- Соски: Соска находится в центре ареолы. В каждом соске около девяти молочных протоков, а также нервов.
- Ареолы: Ареола — это круглая область кожи темного цвета, окружающая сосок.У ареол есть железы, называемые железами Монтгомери, которые выделяют смазочное масло. Это масло защищает соски и кожу от натирания во время кормления грудью.
- Кровеносные сосуды: Кровеносные сосуды обеспечивают циркуляцию крови по груди, груди и телу.
- Лимфатические сосуды: Являясь частью лимфатической системы, эти сосуды транспортируют лимфу, жидкость, которая помогает иммунной системе вашего организма бороться с инфекциями. Лимфатические сосуды соединяются с лимфатическими узлами или железами, находящимися под подмышками, в груди и других местах.

- Нервы: Соски имеют сотни нервных окончаний, что делает их чрезвычайно чувствительными к прикосновениям и возбуждению.
А мужская грудь?
У мужчин тоже есть грудь. В период полового созревания мужской гормон тестостерон обычно не дает груди развиваться, как женской. Снаружи у самцов есть соски и ареолы. Внутри у них неразвиты молочные протоки и нет железистой ткани. Проблемы с мужской грудью могут включать гинекомастию, доброкачественное заболевание, которое вызывает увеличение груди, и очень редко — рак груди.
Что такое плотная грудь?
В отчете о маммографии может быть указано, что у вас плотная грудь. Плотная грудь имеет больше железистой и фиброзной ткани и меньше жировой ткани. Плотная ткань груди и опухоли на маммограмме выглядят белыми, что затрудняет выявление рака груди. До половины женщин в возрасте от 40 до 74 лет имеют плотную грудь. Состояние не связано с размером груди, внешним видом или ощущением на ощупь. У женщин с очень плотной грудью риск рака груди несколько выше.
У женщин с очень плотной грудью риск рака груди несколько выше.
Как работает грудь?
Женские гормоны, а именно эстроген, прогестерон и пролактин, играют ключевую роль в развитии и функционировании груди.
- Эстроген растягивает молочные протоки и помогает им образовывать боковые ответвления для переноса большего количества молока.
- Пролактин способствует выработке прогестерона и подготавливает железы к производству молока.
- Прогестерон увеличивает количество и размер долек при подготовке к кормлению грудью. Этот гормон также увеличивает кровеносные сосуды и клетки груди после овуляции.Вы можете почувствовать опухшие и болезненные груди.
Какие состояния и нарушения влияют на анатомию груди?
Рак груди — угроза номер один для здоровья груди. Примерно каждая восьмая женщина получит диагноз рака груди в течение своей жизни. Другие состояния, влияющие на здоровье груди, включают:
Как сохранить здоровье груди?
Поскольку рак груди является главной проблемой, поговорите со своим врачом о том, когда и как часто проходить маммографию. Рекомендации различаются в зависимости от факторов риска, таких как семейный анамнез заболевания. Самообследование груди поможет вам лучше понять, как выглядит и ощущается ваша грудь, чтобы вам было легче заметить изменения или потенциальные проблемы.
Рекомендации различаются в зависимости от факторов риска, таких как семейный анамнез заболевания. Самообследование груди поможет вам лучше понять, как выглядит и ощущается ваша грудь, чтобы вам было легче заметить изменения или потенциальные проблемы.
Когда мне позвонить врачу?
Вы должны позвонить своему врачу, если у вас возникли проблемы:
- Недавно обнаруженная шишка.
- Выделение из соска.
- Боль в груди.
- Изменения в том, как выглядит или ощущается ваша грудь или кожа.
- Ниппель, который внезапно поворачивается внутрь (втянутый сосок).
- Сыпь на груди.
Записка из клиники Кливленда
Женская грудь может производить молоко для кормления грудью, а также служить эрогенной зоной (зоной удовольствия). Грудь формируется из разных тканей. Эти ткани могут стать злокачественными. Регулярные маммограммы или обследования груди могут помочь обнаружить рак на ранней стадии, когда он наиболее поддается лечению.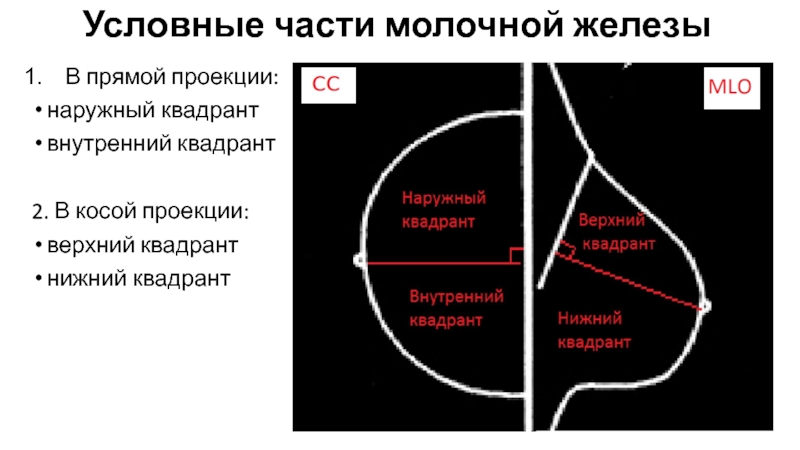 Звоните своему врачу в любое время, когда заметите изменение внешнего вида или ощущения вашей груди.
Звоните своему врачу в любое время, когда заметите изменение внешнего вида или ощущения вашей груди.
Способ получения генетически модифицированной молочной железы мыши | Исследование рака молочной железы
Мыши
Для анализа трансплантации в качестве мышей-реципиентов использовали rag2 — / — (любезно предоставлено доктором Такаки) линии мышей-альбиносов с ослабленным иммунитетом, подвергнутые обратному скрещиванию с FVB или C57BL / 6J. В качестве доноров использовали мышей FVB или C57BL / 6J.
Конструирование и получение вектора
Все векторы были сконструированы с использованием набора для лигазной реакции (Nippon Gene, Токио, Япония или Takara, Киото, Япония) или набора для реакции In-Fusion (Takara).В случае загрузки ВАС длинного транспозонного донорного вектора (фиг. 5a) матричный вектор сначала был сконструирован путем соединения шести фрагментов с использованием реакции In-Fusion после обеспечения каждого фрагмента с помощью полимеразной цепной реакции или отжига 2-олигонуклеотидов ДНК.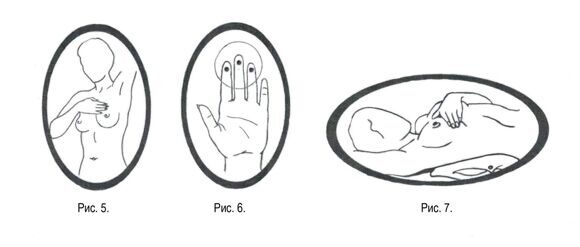 Содержимое этого вектора-шаблона изображено в нижней части рис. 5а. Здесь плечи длиной 70 и 134 п.о., гомологичные вектору ВАС (pBACe3.6), были помещены во фланкирующие области. Расщепленный фрагмент этого вектора-шаблона N ot I / B st XI (FastDigest от Thermo Scientific) в E.coli BAC clone B6Ng01-263 N07 (RIKEN BioResource Center (BRC)) путем электропорации, и реакцию гомологичной рекомбинации проводили с помощью системы RED / ET (Gene Bridges, Гейдельберг, Германия) для получения длинного транспозонного донорного вектора (рис. 5а).
Содержимое этого вектора-шаблона изображено в нижней части рис. 5а. Здесь плечи длиной 70 и 134 п.о., гомологичные вектору ВАС (pBACe3.6), были помещены во фланкирующие области. Расщепленный фрагмент этого вектора-шаблона N ot I / B st XI (FastDigest от Thermo Scientific) в E.coli BAC clone B6Ng01-263 N07 (RIKEN BioResource Center (BRC)) путем электропорации, и реакцию гомологичной рекомбинации проводили с помощью системы RED / ET (Gene Bridges, Гейдельберг, Германия) для получения длинного транспозонного донорного вектора (рис. 5а).
Затем длинный донорный вектор транспозона очищали с использованием набора NucleoBond Xtra BAC (Macherey-Nagel, Takara). Другие векторы очищали с помощью седиментации на ультрацентрифуге в градиенте CsCl после очистки методом щелочного лизиса.
Культура клеток
Фибробласты, полученные из эмбрионов мыши, C3h20T1 / 2 (RCB0247; RIKEN BRC), культивировали в среде Игла, модифицированной Дульбекко (DMEM; Wako Pure Chemical Industries, Ltd. , Токио, Япония), содержащей 5% фетальной бычьей сыворотки. (FBS), 100 мкг / мл сульфата стрептомицина (Meiji Seika Pharma, Токио, Япония) и 100 Ед / мл пенициллина G калия (Meiji Seika Pharma) при 37 ° C и 5% CO 2 . Для совместного культивирования с MEC клетки C3h20T1 / 2 обрабатывали 4 мкг / мл митомицина C (Wako) в течение 3 часов и инкубировали в течение ночи при 5% CO 2 и 37 ° C в течение 1-2 дней.
, Токио, Япония), содержащей 5% фетальной бычьей сыворотки. (FBS), 100 мкг / мл сульфата стрептомицина (Meiji Seika Pharma, Токио, Япония) и 100 Ед / мл пенициллина G калия (Meiji Seika Pharma) при 37 ° C и 5% CO 2 . Для совместного культивирования с MEC клетки C3h20T1 / 2 обрабатывали 4 мкг / мл митомицина C (Wako) в течение 3 часов и инкубировали в течение ночи при 5% CO 2 и 37 ° C в течение 1-2 дней.
Клетки NMuMG культивировали в среде DMEM с добавлением 10% FBS, 100 мкг / мл сульфата стрептомицина, 100 Ед / мл калия пенициллина G, 10 мкг / мл инсулина и 0,45% глюкозы.
Препарат клеток молочной железы
Грудные, брюшные и паховые молочные железы иссекали у самок мышей-доноров в возрасте 8–10 недель. После промывания в фосфатно-солевом буфере (PBS) ткани рубили бритвой. Затем ткани переваривали в течение 1-2 ч при 37 ° C при встряхивании в среде DMEM / F12 (Invitrogen, Carlsbad, CA, USA), содержащей 5% FBS, 2 мг / мл коллагеназы IV (Sigma, Poole, UK), и 0. 1 мг / мл гиалуронидазы (Sigma). После удаления эритроцитов в DMEM / F12 повторным центрифугированием в условиях низкой плотности с последующим суспендированием в буфере ACK (0,15 M NH 4 Cl, 10 мМ KHCO 3 , 0,1 мМ EDTA, pH 7,3) суспензия диссоциированных клеток получали пипетированием в течение 8–10 мин в буфере для диссоциации клеток (PBS, 0,05% трипсин, 0,5 мМ EDTA, 0,5% DNaseI), а затем в течение 2 минут в диспазе 5 мг / мл (StemCell Technologies, Ванкувер, Канада) –0,5 % DNaseI с последующей фильтрацией через сито 42 мкм.
1 мг / мл гиалуронидазы (Sigma). После удаления эритроцитов в DMEM / F12 повторным центрифугированием в условиях низкой плотности с последующим суспендированием в буфере ACK (0,15 M NH 4 Cl, 10 мМ KHCO 3 , 0,1 мМ EDTA, pH 7,3) суспензия диссоциированных клеток получали пипетированием в течение 8–10 мин в буфере для диссоциации клеток (PBS, 0,05% трипсин, 0,5 мМ EDTA, 0,5% DNaseI), а затем в течение 2 минут в диспазе 5 мг / мл (StemCell Technologies, Ванкувер, Канада) –0,5 % DNaseI с последующей фильтрацией через сито 42 мкм.
Сортировка клеток
Суспензию диссоциированных одиночных клеток метили биотинилированными антителами CD45, Ter119, CD31 и BP-1, содержащимися в коктейле для обогащения эпителиальных клеток EasySep Mouse (StemCell Technologies), в течение 30 минут на льду и после промывки инкубировали с анти-CD49f-PE (eBioscience, Сан-Диего, Калифорния, США), анти-CD24-perCP-cy5.5 (eBioscience), стрептавидином-ECD (Beckman-Coulter, Бреа, Калифорния, США) и 7-амино- актиномицин D (7-AAD; Calbiochem, Сан-Диего, Калифорния, США) в течение 30 мин на льду. Перед сортировкой клетки суспендировали в 2% сбалансированном солевом растворе FBS – Хэнка, включая ДНКазу. Сортировку клеток проводили с использованием метода сортировки клеток с активацией флуоресценции (FACS) SH800 (Sony, Токио, Япония). CD45 — Ter119 — CD31 — BP-1 — (Lin (-)) 7-AAD — CD49f высокий Клетки CD24 + были собраны для представления фракции, обогащенной MaSC.
Перед сортировкой клетки суспендировали в 2% сбалансированном солевом растворе FBS – Хэнка, включая ДНКазу. Сортировку клеток проводили с использованием метода сортировки клеток с активацией флуоресценции (FACS) SH800 (Sony, Токио, Япония). CD45 — Ter119 — CD31 — BP-1 — (Lin (-)) 7-AAD — CD49f высокий Клетки CD24 + были собраны для представления фракции, обогащенной MaSC.
Трансфекция
Всего 1 × 10 6 клеток отсортированной фракции, обогащенной MaSC, от примерно восьми мышей суспендировали и дважды промывали в Opti-MEM (Life Technologies, Карлсбад, Калифорния, США).Затем 10 мкг ДНК донорного и вспомогательного вектора смешивали в соотношении 3: 1 с MEC в Opti-MEM и подвергали электропорации с использованием NEPA21 (NEPAGENE, Chiba, Tokyo) с кюветой для электродов с зазором 2 мм (NEPAGENE , EC-002S). Настройки для этой электропорации показаны в Дополнительном файле 1 (Таблица S1).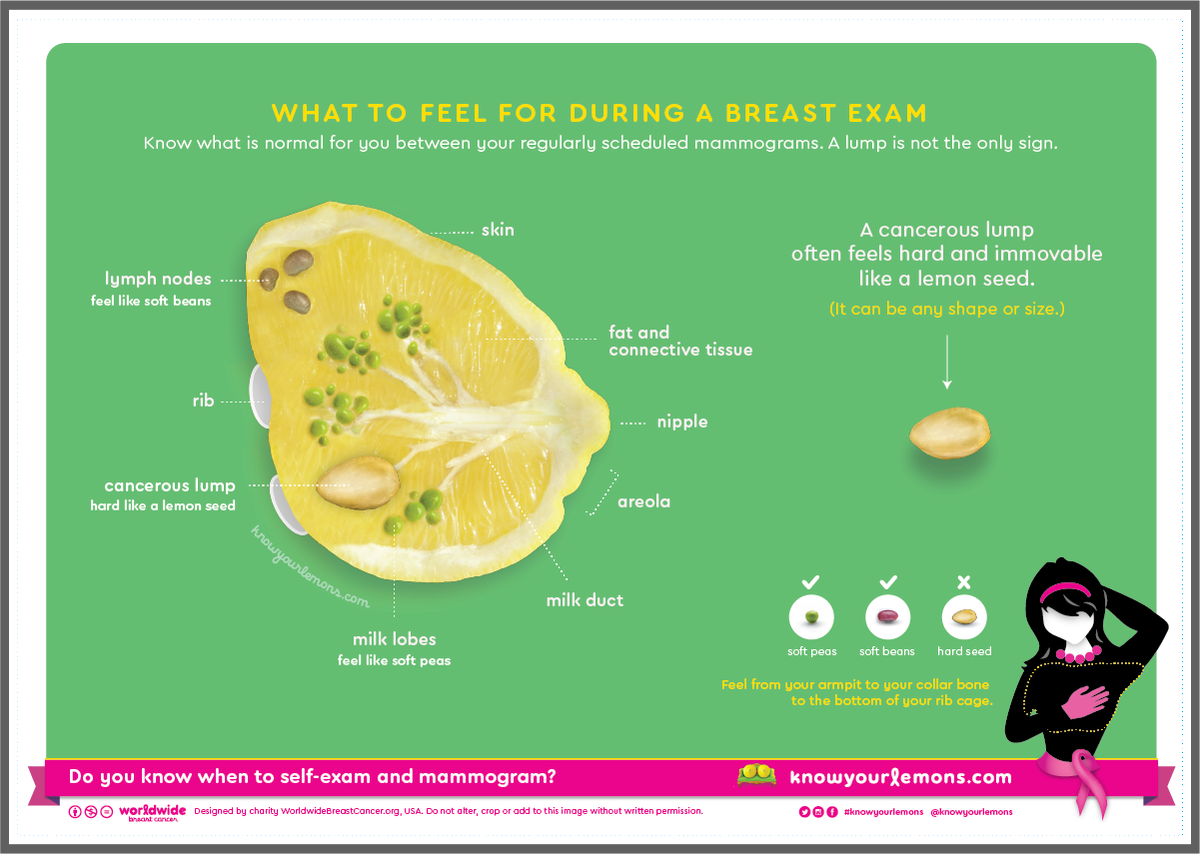 После электропорации суспензию клеток немедленно суспендировали в культуральной среде.
После электропорации суспензию клеток немедленно суспендировали в культуральной среде.
Для трансфекции в NMuMG диссоциированные клетки высевали на шестилуночные планшеты при 20–30% конфлюэнтности за день до трансфекции.Донорные и вспомогательные векторы вводили при соотношении OD 260 3: 1 путем выливания смеси из 4 мкг ДНК и 8–12 мкг полиэтиленимина (Polysciences, Warrington, PA) в 200 мкл Opti-MEM.
Система культивирования для поддержания стволовости MaSC
MEC были совместно культивированы с обработанным митомицином C C3h20T1 / 2 в DMEM / F12 с добавлением 10% FBS, 10 нг / мл фактора роста эпидермиса человека (hEGF; BD Biosciences, Токио, Япония), 5 мкг / мл инсулина (Wako), 0,5 мкг / мл гидрокортизона (Sigma), 5 мкМ форсколина (Wako), 1.8 × 10 -4 M аденин (Sigma), 100 мкг / мл стрептомицина (Meiji Seika Pharma), 100 Ед / мл пенициллина G (Meiji Seika Pharma), 50 мкг / мл гентамицина (Nakalai Tesque, Токио, Япония), 10 мкМ Rho-ассоциированного ингибитора киназы, образующего спиральную спираль (ROCKi; Y-27632; LC Laboratories, Нью-Бостон, Массачусетс, США) [20, 21], и 10% матригеля (сниженный фактор роста; BD Biosciences) в концентрации 5% CO 2 и 37 ° C в течение 7 дней. Количество MEC и C3h20T1 / 2 составляло 5000 и 6,25 × 10 4 соответственно в 250 мкл культуральной среды в 48-луночном планшете.Когда использовались лунки разного размера, эти числа менялись пропорционально площади лунки.
Количество MEC и C3h20T1 / 2 составляло 5000 и 6,25 × 10 4 соответственно в 250 мкл культуральной среды в 48-луночном планшете.Когда использовались лунки разного размера, эти числа менялись пропорционально площади лунки.
Анализ трансплантации
Трансфицированные МЭК в культуре обрабатывали диспазой в течение 1-2 часов при 37 ° C, а затем примерно 3% всех трансфицированных клеток суспендировали в 4–10 мкл DMEM / F12, включая 10% матригеля на трансплантацию. сайта и трансплантировали в очищенные жировые подушечки паховых молочных желез мышей rag2 — / — , у которых был удален эндогенный эпителий с помощью 50-мкл шприца, снабженного иглой 30-G (ITO, Сидзуока, Япония ).Репопуляцию молочных желез анализировали путем обнаружения биолюминесценции с использованием системы визуализации in vivo (IVIS Lumina XR, PerkinElmer, Waltham, MA, США) и флуоресценции mCherry с использованием стереомикроскопа (Leica, Wetzlar, Германия).
Окрашивание карминовыми квасцами
Рассеченные молочные железы распределяли на предметном стекле и фиксировали фиксатором Карнуа (60% этанол, 30% хлороформ и 10% ледяная уксусная кислота) в течение ночи при комнатной температуре. Фиксированные ткани промывали 70% этанолом, постепенно регидратировали до дистиллированной H 2 O, а затем инкубировали в растворе карминных квасцов (0.2 мас.% Кармина (Sigma) и 0,5 мас.% Сульфата алюминия-калия (Wako) в дистиллированной H 2 O) в течение от 2 часов до ночи при комнатной температуре. После постепенного обезвоживания от 70% этанола до 100% этанола жировые подушечки очищали в течение ночи в ксилоле и помещали в MGK-S (Мацунами, Осака, Япония).
Фиксированные ткани промывали 70% этанолом, постепенно регидратировали до дистиллированной H 2 O, а затем инкубировали в растворе карминных квасцов (0.2 мас.% Кармина (Sigma) и 0,5 мас.% Сульфата алюминия-калия (Wako) в дистиллированной H 2 O) в течение от 2 часов до ночи при комнатной температуре. После постепенного обезвоживания от 70% этанола до 100% этанола жировые подушечки очищали в течение ночи в ксилоле и помещали в MGK-S (Мацунами, Осака, Япония).
Окрашивание гематоксилином и эозином
После промывания в PBS рассеченные молочные железы и опухоли фиксировали в 4% параформальдегид-PBS в течение ночи и в течение 2 дней соответственно. После промывки в PBS образцы постепенно дегидратировали от 70% этанола до 100% этанола, а затем от 50% ксилола в этаноле до 100% ксилола после замены парафина с использованием полностью автоматического процессора закрытых тканей Leica ASP300 и заливки парафином с помощью Leica EG1160 .Затем залитые в парафин ткани разрезали на срезы толщиной 5 мкм с помощью скользящего микротома Leica SM200R. Срезы постепенно депарафинизировали в ксилоле, а затем в этаноле, постепенно уменьшая содержание этанола от 100% до 50%, и промывали дистиллированным H 2 O, а затем окрашивали в растворе гематоксилина (0,25% гематоксилин (Nacalai Tesque), 0,05% натрия йодат (Nacalai Tesque), 12,5% квасцов калия (Wako) и 0,25% лимонной кислоты (Wako)) в течение 10 мин. После промывки в дистиллированной H 2 O срезы были воронены в 0.1% насыщенный карбонат лития при 37 ° C в течение 5 минут, затем промывали в дистиллированной H 2 O и окрашивали в растворе эозина (1% эозина (Wako) и 0,02% ледяной уксусной кислоты) в течение 10 минут. После промывки в 90% и 100% этаноле срезы замачивали в ксилоле в течение 5 минут, а затем помещали в MGK-S (Matsunami).
Срезы постепенно депарафинизировали в ксилоле, а затем в этаноле, постепенно уменьшая содержание этанола от 100% до 50%, и промывали дистиллированным H 2 O, а затем окрашивали в растворе гематоксилина (0,25% гематоксилин (Nacalai Tesque), 0,05% натрия йодат (Nacalai Tesque), 12,5% квасцов калия (Wako) и 0,25% лимонной кислоты (Wako)) в течение 10 мин. После промывки в дистиллированной H 2 O срезы были воронены в 0.1% насыщенный карбонат лития при 37 ° C в течение 5 минут, затем промывали в дистиллированной H 2 O и окрашивали в растворе эозина (1% эозина (Wako) и 0,02% ледяной уксусной кислоты) в течение 10 минут. После промывки в 90% и 100% этаноле срезы замачивали в ксилоле в течение 5 минут, а затем помещали в MGK-S (Matsunami).
Иммуногистохимия
Паховые молочные железы иссекали, разрезали на фрагменты размером ~ 1–5 мм 3 и предварительно фиксировали в течение 10–15 минут в 4% параформальдегиде-PBS на льду.Ткани промывали холодным PBS и инкубировали примерно 1 час в 10% сахарозе-PBS при 4 ° C, в течение примерно 1 часа в 20% -м сахарозе-PBS при 4 ° C и в течение ночи в 40% -м сахарозе-PBS при 4 ° C. . Ткани замораживали в среде криозакрепления [22] в жидком азоте. Затем замороженные блоки разрезали на секции толщиной 5 или 10 мкм с помощью криостата Leica CM1850. Срезы сушили в течение 1–10 мин при комнатной температуре, помещали более чем на 10 мин в PBS и затем фиксировали в течение 10–15 мин в 3% параформальдегиде при комнатной температуре.После промывания в течение более 10 минут в PBS или 0,1% Tween-PBS срезы инкубировали в блокирующем буфере (0,1% тритон / 10% козья сыворотка в PBS) в течение 1 ч при комнатной температуре или в течение ночи при 4 ° C. Окрашивание первичными антителами проводили в течение ночи при 4 ° C или в течение 1 ч при комнатной температуре. Затем срезы промывали трижды PBS или 0,1% Tween-PBS в течение 10 мин и окрашивали растворами вторичных антител, содержащими 4 ‘, 6-диамидино-2-фенилиндол (DAPI), в течение 1 ч при комнатной температуре.В случае окрашивания глобул молочного жира (MFG) срезы инкубировали в BODIPY 493/503 (3 мкг / мл; Molecular Probes), содержащем DAPI в PBS, в течение 10 мин при комнатной температуре.
. Ткани замораживали в среде криозакрепления [22] в жидком азоте. Затем замороженные блоки разрезали на секции толщиной 5 или 10 мкм с помощью криостата Leica CM1850. Срезы сушили в течение 1–10 мин при комнатной температуре, помещали более чем на 10 мин в PBS и затем фиксировали в течение 10–15 мин в 3% параформальдегиде при комнатной температуре.После промывания в течение более 10 минут в PBS или 0,1% Tween-PBS срезы инкубировали в блокирующем буфере (0,1% тритон / 10% козья сыворотка в PBS) в течение 1 ч при комнатной температуре или в течение ночи при 4 ° C. Окрашивание первичными антителами проводили в течение ночи при 4 ° C или в течение 1 ч при комнатной температуре. Затем срезы промывали трижды PBS или 0,1% Tween-PBS в течение 10 мин и окрашивали растворами вторичных антител, содержащими 4 ‘, 6-диамидино-2-фенилиндол (DAPI), в течение 1 ч при комнатной температуре.В случае окрашивания глобул молочного жира (MFG) срезы инкубировали в BODIPY 493/503 (3 мкг / мл; Molecular Probes), содержащем DAPI в PBS, в течение 10 мин при комнатной температуре. Затем срезы дважды промывали PBS в течение 10 мин. Наконец, слайды были закреплены в MOWIOL DABCO.
Затем срезы дважды промывали PBS в течение 10 мин. Наконец, слайды были закреплены в MOWIOL DABCO.
Использовали следующие первичные антитела: анти-KRT14 (мышь, 1: 1000; Novocastra, Ньюкасл, Великобритания), анти-KRT8 (крыса, 1: 250; Developmental Studies Hybridoma Bank, University of Iowa), анти-mCherry ( кролик, 1: 250; Abcam, Кембридж, Великобритания) и анти-PyMT (крыса, 1: 500; Санта-Крус, Калифорния, США).Также использовались следующие вторичные антитела: антимышиные, антикроличьи и крысиные, конъюгированные с AlexaFluor 488 (1: 1000; Molecular Probes, Юджин, Орегон, США) и AlexaFluor 568 (1: 1000; Molecular Probes). . Окрашивание ядер проводили с помощью DAPI (1: 4000; DOJINDO, Токио, Япония). Корректировку вариаций яркости и / или контрастности всей области изображений выполняли с помощью программы Photoshop (Adobe, Сан-Хосе, Калифорния, США).
Иммуноблоттинг
Клетки собирали в буфере RIPA (10 мМ трис-HCl (pH 8.0), 1% (мас. / Об.) NP40, 0,1% (мас. / Об. ) Дезоксихолат натрия (Wako), 0,1% ( мас. / Об. ) SDS (Wako), 0,15 M NaCl (Wako), 1 мМ EDTA, 10 мМ NaF (Wako), 1,5 мМ Na 3 VO 4 (Wako) и коктейль ингибиторов протеазы cOmplete ™ (Roche)). Концентрации белка определяли с использованием набора для анализа белка BCA (Thermo Fisher Scientific). Собранный белковый лизат смешивали с загрузочным буфером SDS-PAGE (0,15 М трис-HCl, 6% (мас. / Об.) SDS, 0,003% (мас. / Об.) Бромфенолового синего (Wako), 30% (мас. / Об.) Глицерина (Wako). ) и 15% (мас. / об.) β-меркаптоэтанола (Wako)), а затем кипятили при 95 ° C в течение 5 минут с последующим SDS-PAGE и иммуноблоттингом.Антитела, используемые для иммуноблоттинга, были следующими: анти-молоко (кролик, 1: 1000; Nordic-MUbio, Susteren, Нидерланды), анти-PyMT (крыса, 1: 500; Санта-Крус), анти-mCherry (кролик, 1: 500; Abcam), анти-гистон h4 (кролик, 1: 2500; Cell Signaling Technology, MA, США) и анти-α-тубулин (мышь, 1: 5000; Calbiochem).
) Дезоксихолат натрия (Wako), 0,1% ( мас. / Об. ) SDS (Wako), 0,15 M NaCl (Wako), 1 мМ EDTA, 10 мМ NaF (Wako), 1,5 мМ Na 3 VO 4 (Wako) и коктейль ингибиторов протеазы cOmplete ™ (Roche)). Концентрации белка определяли с использованием набора для анализа белка BCA (Thermo Fisher Scientific). Собранный белковый лизат смешивали с загрузочным буфером SDS-PAGE (0,15 М трис-HCl, 6% (мас. / Об.) SDS, 0,003% (мас. / Об.) Бромфенолового синего (Wako), 30% (мас. / Об.) Глицерина (Wako). ) и 15% (мас. / об.) β-меркаптоэтанола (Wako)), а затем кипятили при 95 ° C в течение 5 минут с последующим SDS-PAGE и иммуноблоттингом.Антитела, используемые для иммуноблоттинга, были следующими: анти-молоко (кролик, 1: 1000; Nordic-MUbio, Susteren, Нидерланды), анти-PyMT (крыса, 1: 500; Санта-Крус), анти-mCherry (кролик, 1: 500; Abcam), анти-гистон h4 (кролик, 1: 2500; Cell Signaling Technology, MA, США) и анти-α-тубулин (мышь, 1: 5000; Calbiochem).
Новое понимание морфогенеза молочной железы плода: дифференциальные эффекты природных и экологических эстрогенов
de Assis, S. et al. Прием большого количества жиров или этинилэстрадиола во время беременности увеличивает риск рака молочной железы у нескольких поколений потомства. Nat. Commun. 3 , 1053 (2012).
et al. Прием большого количества жиров или этинилэстрадиола во время беременности увеличивает риск рака молочной железы у нескольких поколений потомства. Nat. Commun. 3 , 1053 (2012).
Артикул
Google ученый
Hoover, R. N. et al. Неблагоприятные последствия для здоровья женщин, подвергшихся внутриутробному воздействию диэтилстильбестрола. N. Engl. J. Med. 365 , 1304–1314 (2011).
CAS
Статья
Google ученый
Палмер, Дж. Р. и др. Пренатальное воздействие диэтилстильбэстрола и риск рака груди. Cancer Epidem. Биомар . 15 , 1509–1514 (2006).
CAS
Статья
Google ученый
Паулоза, Т., Сперони, Л., Сонненшайн, К. и Сото, А. М. Эстрогены в неправильном месте и в неподходящее время: воздействие BPA на плод и рак молочной железы. Репродукция. Toxicol. 54 , 58–65 (2015).
Toxicol. 54 , 58–65 (2015).
CAS
Статья
Google ученый
Трихопулос, Д. Рак груди возникает в утробе матери? 1 , 95–96 (1990).
CAS
Google ученый
Bakker, J. et al. Альфа-фетопротеин защищает развивающийся мозг самок мышей от маскулинизации и дефеминизации эстрогенами . 9 , 220–226 (2006).
CAS
Google ученый
Асеведо, Н., Дэвис, Б., Шеберле, К.M., Sonnenschein, C. & Soto, A. M. Перинатально вводимый бисфенол A как потенциальный канцероген для молочной железы у крыс . 121 , 1040–1046 (2013).
Google ученый
Бетанкур, А. М., Эльтум, И. А., Десмонд, Р. А., Руссо, Дж. И Ламартиньер, К. А. Внутриутробное воздействие бисфенола А сдвигает окно восприимчивости к канцерогенезу молочной железы у крыс. Environ. Перспектива здоровья. 118 , 1614–1619 (2010).
Environ. Перспектива здоровья. 118 , 1614–1619 (2010).
CAS
Статья
Google ученый
Durando, M. et al. Пренатальное воздействие бисфенола А вызывает предопухолевые поражения молочной железы у крыс линии Вистар. Environ. Перспектива здоровья. 115 , 80–86 (2007).
CAS
Статья
Google ученый
Jenkins, S. et al. Пероральное воздействие бисфенола А увеличивает индуцированный диметилбензантраценом рак молочной железы у крыс. Environ. Перспектива здоровья. 117 , 910–915 (2009).
CAS
Статья
Google ученый
Мюррей, Т. Дж., Маффини, М. В., Уччи, А. А., Зонненшайн, К. и Сото, А. М. Индукция гиперплазии протоков молочной железы и карциномы in situ после воздействия бисфенола А на плод . 23 , 383–390 (2007).
CAS
Google ученый
Вебер Лозада, К.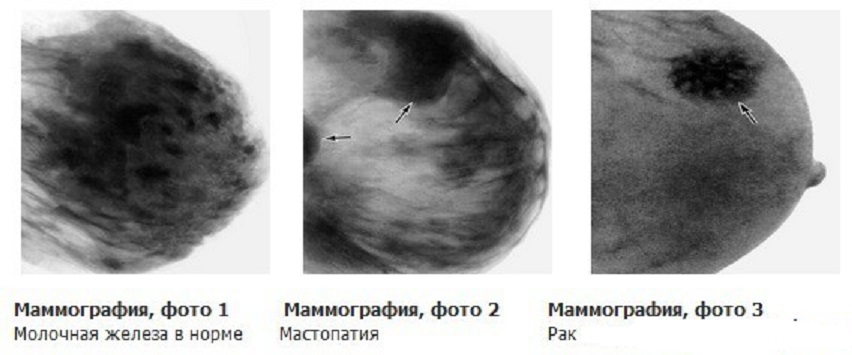 И Кери, Р. А. Бисфенол А увеличивает риск рака молочной железы в двух различных моделях рака молочной железы на мышах. Biol. Репродукция. 85 , 490–497 (2011).
И Кери, Р. А. Бисфенол А увеличивает риск рака молочной железы в двух различных моделях рака молочной железы на мышах. Biol. Репродукция. 85 , 490–497 (2011).
Артикул
Google ученый
Ванденберг, Л. Н., Хант, П. А., Майерс, Дж. П. и вом Заал, Ф. С. Воздействие бисфенола-А на человека: несоответствие между данными и предположениями. Rev. Environ. Здоровье 28 , 37–58 (2013).
CAS
Статья
Google ученый
Хен, Р.Данные S. NHANES подтверждают связь между обработкой квитанций на термобумаге и повышенным выделением бисфенола А с мочой. Environ. Sci. Technol. 50 , 397–404 (2016).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Thayer, K. A. et al. Бисфенол A, бисфенол S и 4-гидроксифенил-4-изопроксифенилсульфон (BPSIP) в моче и крови кассиров.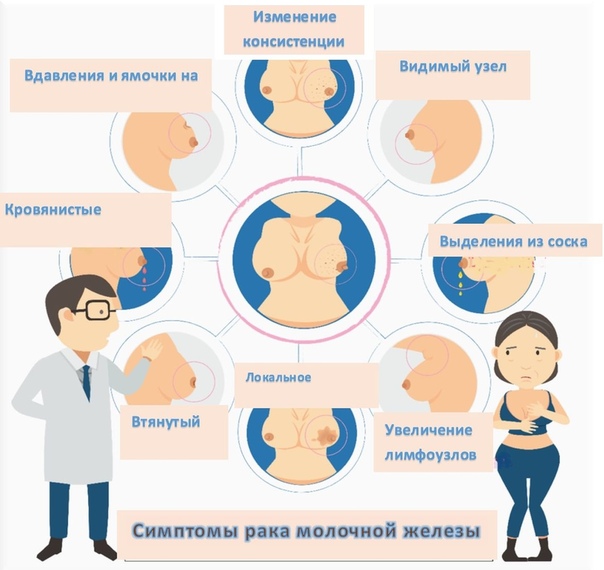 Environ. Перспектива здоровья. 124 , 437–444 (2016).
Environ. Перспектива здоровья. 124 , 437–444 (2016).
CAS
Статья
Google ученый
Calafat, A. M. et al. Концентрация бисфенола А и 4-нонилфенола в моче в контрольной популяции человека. Environ. Перспектива здоровья. 113 , 391–395 (2005).
CAS
Статья
Google ученый
Алонсо-Магдалена, П., Кесада, И. и Надаль, А. Пренатальное воздействие BPA и исходы у потомства: диабетическое поведение BPA. 13 , 15593258155 (2015).
vom Saal, F. S., Nagel, S. C., Coe, B. L., Angle, B. M. и Taylor, J. A. Эстрогенный эндокринный разрушающий химический бисфенол A (BPA) и ожирение. Мол. Клеточный эндокринол. 354 , 74–84 (2012).
CAS
Статья
Google ученый
Гор, А.С. и др. EDC-2: Второе научное заявление эндокринного общества о химических веществах, нарушающих работу эндокринной системы. Endocr. Ред. 36 , E1 – E150 (2015).
Endocr. Ред. 36 , E1 – E150 (2015).
CAS
Статья
Google ученый
Palanza, P., Nagel, S.C., Parmigiani, S. & vom Saal, F. S. Перинатальное воздействие эндокринных разрушителей: пол, время и поведенческие конечные точки. Curr. Opin. Behav. Sci. 7 , 69–75 (2016).
Артикул
Google ученый
Рубин, Б.S. et al. Свидетельства изменения половой дифференциации мозга у мышей, подвергшихся перинатальному воздействию низких экологически значимых уровней бисфенола A . 147 , 3681–3691 (2006).
CAS
Google ученый
Cabaton, N.J. et al. Воздействие в перинатальном периоде экологически значимых уровней бисфенола-А снижает фертильность и плодовитость мышей CD-1. Environ. Перспектива здоровья. 119 , 547–552 (2011).
CAS
Статья
Google ученый
Касс, Л. , Альтамирано, Г. А., Боскьяццо, В. Л., Луке, Э. Х. и Муньос де Торо, М. Перинатальное воздействие ксеноэстрогенов ухудшает дифференциацию молочных желез и изменяет состав молока у крыс Вистар. 33 , 390–400 (2012).
, Альтамирано, Г. А., Боскьяццо, В. Л., Луке, Э. Х. и Муньос де Торо, М. Перинатальное воздействие ксеноэстрогенов ухудшает дифференциацию молочных желез и изменяет состав молока у крыс Вистар. 33 , 390–400 (2012).
Ayyanan, A. et al. Воздействие бисфенола А в перинатальном периоде увеличивает прогестероновую реакцию молочной железы у взрослых и увеличивает количество клеток. Мол. Эндокринол. 25 , 1915–1923 (2011).
CAS
Статья
Google ученый
Fenton, S.E. Соединения, нарушающие работу эндокринной системы, и развитие молочных желез: раннее воздействие и последствия в дальнейшей жизни . 147 , S18 – S24 (2006).
CAS
Google ученый
Wadia, P. R. et al. Перинатальное воздействие бисфенола-А увеличивает чувствительность молочной железы к эстрогену у различных линий мышей. Environ. Перспектива здоровья. 115 , 592–598 (2007).
115 , 592–598 (2007).
CAS
Статья
Google ученый
Wadia, P. R. et al. Воздействие низких доз BPA изменяет мезенхимальные и эпителиальные транскриптомы молочной железы плода мыши. PLoS One. 8 , e63902 (2013).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Ванденберг, Л.N. et al. Воздействие экологически значимых доз ксеноэстрогена бисфенола-A изменяет развитие молочной железы эмбриона мыши . 148 , 116–127 (2007).
CAS
Google ученый
Tharp, A. P. et al. Бисфенол А изменяет развитие молочной железы макаки-резуса. Proc. Natl. Акад. Sci USA . 109 , 8190–8195 (2012).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Сото, А.М., Брискен, К., Шеберле, К. М. и Зонненшайн, К. Рак начинается в утробе матери? Нарушение развития молочной железы и предрасположенность к раку груди из-за внутриутробного воздействия эндокринных разрушителей. J. Mammary Gland Biol. Неоплазия 18 , 199–208 (2013).
М. и Зонненшайн, К. Рак начинается в утробе матери? Нарушение развития молочной железы и предрасположенность к раку груди из-за внутриутробного воздействия эндокринных разрушителей. J. Mammary Gland Biol. Неоплазия 18 , 199–208 (2013).
Артикул
Google ученый
Voutilainen, M. et al. Эктодисплазин регулирует гормон-независимый морфогенез протоков молочной железы через NF-êB. Proc. Nat. Акад. Sci. США 109 , 5744–5749 (2012).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Воутилайнен М., Линдфорс П. Х. и Миккола М. Л. Протокол: ex vivo культура зародышевых зачатков молочной железы мыши. J. Mammary Gland Biol. Неоплазия 18 , 239–245 (2013).
Артикул
Google ученый
Хогг, Н.А., Харрисон, К. Дж. И Тикл, С. Формирование просвета в развивающейся молочной железе мыши. 73 , 39–57 (1983).
73 , 39–57 (1983).
Sun, P., Yuan, Y., Li, A., Li, B. & Dai, X. Экспрессия цитокератина во время эмбрионального и раннего постнатального развития молочной железы мыши. Histochem. Cell Biol. 133 , 213–221 (2010).
CAS
Статья
Google ученый
Lemmen, J. G. et al.Экспрессия рецепторов эстрогена альфа и бета во время эмбриогенеза мышей. мех. Dev. 81 , 163–167 (1999).
CAS
Статья
Google ученый
Осборн, К. К., Уэйклинг, А. и Николсон, Р. И. Фулвестрант: антагонист рецепторов эстрогена с новым механизмом действия. Br. J. Cancer 90 Приложение 1, S2 – S6 (2004).
CAS
Статья
Google ученый
Сото, А.M. & Sonnenschein, C. Эндокринные разрушители: ДДТ, эндокринные нарушения и рак груди . 11 , 507–508 (2015).
CAS
Google ученый
Cohn, B.A. et al. Воздействие ДДТ в утробе матери и рак груди. J. Clin. Эндокринол. Метаб. 100 , 2865–2872 (2015).
CAS
Статья
Google ученый
Ванденберг, Л.N. et al. Перинатальное воздействие ксеноэстрогена бисфенола-A вызывает внутрипротоковую гиперплазию молочных желез у взрослых мышей CD-1 . 26 , 210–219 (2008).
CAS
Google ученый
Браун, М. М., Альбом, А., Флодерус, Б., Бринтон, Л. А. и Гувер, Р. Н. Влияние близнецов на заболеваемость раком яичка, груди и других локализаций (Швеция) . CCC 6 , 519–524 (1995).
CAS
Google ученый
Потишман Н.& Troisi, R. Внутриутробные и ранние периоды жизни в связи с риском рака груди. CCC 10 , 561–573 (1999).
CAS
PubMed
Google ученый
Рейно, А. и Рейно, Дж. Производство экспериментальных пороков развития молочной железы у плода мыши половыми гормонами [французский язык]. Ann. Inst. Пастер (Париж) 90 , 39–91 (1956).
CAS
Google ученый
Вреттос, А.С., Фотиу, С. и Папахаралампус, Н. Развитие груди у плода. Эффекты от приема гормональных препаратов во время беременности [французский]. J. Gynecol. Акушерство. Репродукция. (Париж) 5 , 561–566 (1976).
CAS
Google ученый
Когата, Н. и Ховард, Б. А. Протокол полной иммунофлуоресценции для трехмерной визуализации эмбрионального зачатка молочной железы. Дж.Mammary Gland Biol. Неоплазия 18 , 227–231 (2013).
Артикул
Google ученый
Shioda, T. et al. Важность стандартизации дозировки для интерпретации профилей транскриптомных сигнатур: данные исследований ксеноэстрогенов. Proc. Nat. Акад. Sci. США 103 , 12033–12038 (2006).
et al. Важность стандартизации дозировки для интерпретации профилей транскриптомных сигнатур: данные исследований ксеноэстрогенов. Proc. Nat. Акад. Sci. США 103 , 12033–12038 (2006).
CAS
ОБЪЯВЛЕНИЯ
Статья
Google ученый
Абэ, Х., Кин, К. Л. и Терасава, Е. Быстрое действие эстрогенов на внутриклеточные колебания кальция в нейронах лютеинизирующего гормона-1 приматов . 149 , 1155–1162 (2008).
CAS
Google ученый
Куриан, Дж. Р. и др. Острое влияние воздействия бисфенола А на высвобождение в гипоталамусе гонадотропин-высвобождающего гормона и кисспептина у самок макак-резусов . 156 , 2563–2570 (2015).
CAS
Google ученый
Ноэль, С. Д., Кин, К. Л., Бауман, Д. И., Филардо, Э. Дж. И Терасава, Е. Вовлечение рецептора 30, связанного с G-белком (GPR30), в быстрое действие эстрогена в нейронах LHRH приматов. Мол. Эндокринол. 23 , 349–359 (2009).
Мол. Эндокринол. 23 , 349–359 (2009).
CAS
Статья
Google ученый
PMCA2 регулирует апоптоз во время инволюции молочной железы и предсказывает исход рака молочной железы
Abstract
После лактации отлучение от груди вызывает апоптоз эпителиальных клеток молочной железы (MEC).МЭК экспрессируют кальций-АТФазу 2 (PMCA2) плазматической мембраны, которая переносит кальций через апикальную поверхность клеток в молоко. Здесь мы показываем, что PMCA2 подавляется на ранних этапах инволюции молочных желез, связанных с изменениями формы MEC. Мы демонстрируем, что потеря экспрессии PMCA2 повышает уровень внутриклеточного кальция и повышает чувствительность МЭК к апоптозу. Напротив, сверхэкспрессия PMCA2 в клетках рака молочной железы T47D снижает внутриклеточный кальций и защищает их от апоптоза. Наконец, мы показываем, что высокая экспрессия PMCA2 при раке груди связана с плохим исходом.Мы пришли к выводу, что потеря экспрессии PMCA2 при отлучении от груди запускает апоптоз, вызывая клеточный кальциевый кризис. С другой стороны, сверхэкспрессия PMCA2 может играть роль в прогрессировании рака груди, обеспечивая устойчивость к апоптозу.
С другой стороны, сверхэкспрессия PMCA2 может играть роль в прогрессировании рака груди, обеспечивая устойчивость к апоптозу.
Молочная железа претерпевает драматический цикл развития и регресса во время репродукции (1). Девственная железа состоит из простой системы эпителиальных протоков. Во время беременности эпителиальные клетки молочной железы (МЭК) размножаются и образуют большое количество альвеол.Род вызывает полную секреторную дифференциацию и производство молока. После отлучения секреторные клетки удаляются, и железа перестраивается в систему протоков, которая напоминает состояние зрелых первородящих (1). Этот процесс инволюции молочной железы включает два последовательных раунда апоптоза. Первый происходит между 12 и 24 часами после отлучения от груди и вызывает потерю многих, но не всех секреторных эпителиальных клеток (2, 3). Эта фаза инволюции обратима, и лактация может продолжаться, если сосать грудь возобновить в течение 48 часов (2, 3).Однако, если железа остается незатронутой в течение более длительных периодов времени, наступает второй раунд апоптоза, связанный с необратимым ремоделированием ткани. Начальная волна апоптоза является результатом местных факторов, связанных с накоплением молока в альвеолах (молочный застой) (2), тогда как ремоделирование молочной железы происходит из-за вывода пролактина (2). Как застой молока вызывает апоптоз МЭК, остается неясным. Традиционно предлагалось два объяснения. Во-первых, было высказано предположение, что в отсутствие сосания растворимые факторы, такие как TGF-β (4), серотонин (5) и LIF (6), накапливаются и вызывают апоптоз.Во-вторых, была выдвинута гипотеза, что механическая деформация МЭК, вызванная растяжением альвеол, запускает апоптоз (7).
Начальная волна апоптоза является результатом местных факторов, связанных с накоплением молока в альвеолах (молочный застой) (2), тогда как ремоделирование молочной железы происходит из-за вывода пролактина (2). Как застой молока вызывает апоптоз МЭК, остается неясным. Традиционно предлагалось два объяснения. Во-первых, было высказано предположение, что в отсутствие сосания растворимые факторы, такие как TGF-β (4), серотонин (5) и LIF (6), накапливаются и вызывают апоптоз.Во-вторых, была выдвинута гипотеза, что механическая деформация МЭК, вызванная растяжением альвеол, запускает апоптоз (7).
Производство молока требует транспорта большого количества кальция через эпителиальные клетки (8). Это создает проблемы для клеточного гомеостаза кальция. Уровень внутриклеточного кальция должен поддерживаться на низком уровне, потому что резкое повышение концентрации кальция в цитоплазме участвует в передаче сигнала (9), а стойкое повышение внутриклеточного кальция может вызвать клеточную дисфункцию и смерть (10–13).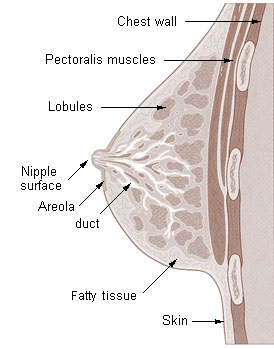 Фактически, многие пути апоптоза либо запускаются, либо приводят к токсичности внутриклеточного кальция (10–13). Кальций-АТФаза 2 (PMCA2) плазматической мембраны играет важную роль в транспорте кальция в молоко (8, 14, 15). Уровни мРНК PMCA2 увеличиваются в несколько сотен раз при функциональной дифференцировке МЭК во время лактации (14–16), и этот насос отвечает за транспортировку 60–70% молочного кальция (14, 15). Интересно, что уровни РНК и белка PMCA2 молочной железы резко падают после отлучения от груди (15, 17), что побудило некоторых исследователей предположить, что возникающее в результате нарушение экструзии кальция может привести к накоплению внутриклеточного кальция и способствовать апоптозу во время инволюции молочной железы (17, 18).В этом отчете мы приводим доказательства, демонстрирующие, что застой молока изменяет форму MEC и приводит к потере экспрессии PMCA2. Это, в свою очередь, нарушает внутриклеточный гомеостаз кальция и способствует инициации апоптоза в начале инволюции.
Фактически, многие пути апоптоза либо запускаются, либо приводят к токсичности внутриклеточного кальция (10–13). Кальций-АТФаза 2 (PMCA2) плазматической мембраны играет важную роль в транспорте кальция в молоко (8, 14, 15). Уровни мРНК PMCA2 увеличиваются в несколько сотен раз при функциональной дифференцировке МЭК во время лактации (14–16), и этот насос отвечает за транспортировку 60–70% молочного кальция (14, 15). Интересно, что уровни РНК и белка PMCA2 молочной железы резко падают после отлучения от груди (15, 17), что побудило некоторых исследователей предположить, что возникающее в результате нарушение экструзии кальция может привести к накоплению внутриклеточного кальция и способствовать апоптозу во время инволюции молочной железы (17, 18).В этом отчете мы приводим доказательства, демонстрирующие, что застой молока изменяет форму MEC и приводит к потере экспрессии PMCA2. Это, в свою очередь, нарушает внутриклеточный гомеостаз кальция и способствует инициации апоптоза в начале инволюции. Мы также сообщаем, что PMCA2 может защищать клетки рака молочной железы от апоптоза и что экспрессия PMCA2 в опухолях молочной железы коррелирует с клиническим исходом.
Мы также сообщаем, что PMCA2 может защищать клетки рака молочной железы от апоптоза и что экспрессия PMCA2 в опухолях молочной железы коррелирует с клиническим исходом.
Результаты
Застой молока снижает экспрессию PMCA2.
Сначала мы исследовали экспрессию PMCA2 в ответ на застой молока.Для этих исследований мы закрыли одну соску кормящей мыши хирургическим клеем. Это вызывает накопление молока только в этой железе и запускает апоптоз МЭК в течение 24 часов (19). В незапечатанных железах не происходит апоптоза и нет изменений в системных уровнях гормонов (2). Мы измерили уровни белка PMCA2 и РНК в закрытых и контралатеральных, незапечатанных молочных железах с помощью иммунофлуоресцентного окрашивания, вестерн-блоттинга и количественной ОТ-ПЦР (qRT-PCR) (рис. 1). Уровни белка PMCA2 значительно снизились уже через 4 ч после индукции молочного застоя (рис.1 E и F ), задолго до начала апоптоза в этой модели (2) (рис. S1). Уровень мРНК значительно снизился к 12 часам (рис. 1 G ). Уровни белка PMCA2 и мРНК достигают своего надира через 24–48 ч (рис. 1 E — G ).
1 G ). Уровни белка PMCA2 и мРНК достигают своего надира через 24–48 ч (рис. 1 E — G ).
Рис. 1.
PMCA2 быстро подавляется застоем молока. Молочные железы собирали через 2, 4, 12, 24 и 48 ч после запечатывания сосков, чтобы вызвать застой молока. Незакрытая контралатеральная железа служила контролем. По сравнению с контрольной железой ( A ) иммунофлуоресцентное окрашивание на PMCA2 было менее интенсивным через 4 часа ( B ) и почти не определялось через 48 часов ( C ).( D ) Показано окрашивание 5 мкг / мл кроличьего IgG (Vector Labs) в качестве отрицательного контроля. Вестерн-блоттинг с 15 мкг мембранного белка на каждую железу ( E ) выявил уменьшение белка PMCA2 со временем в герметизированных железах, тогда как PMCA2 в незапечатанных железах не уменьшалось. Количественный анализ вестерн-блотов ( F ) показал, что уровни белка PMCA2 значительно снизились к 4 часам и продолжали снижаться до минимума к 24 часам. В открытых железах уровни PMCA2 существенно не различались в разные моменты времени.Уровни белка PMCA2 были нормализованы по экспрессии белка β-актина, и все временные точки в незапечатанных железах были усреднены вместе, чтобы установить исходный уровень. Затем средние уровни PMCA2 в каждый отдельный момент времени представляли как долю от базовых уровней. В запломбированных железах уровни PMCA2 в периоды увеличения после запечатывания ( F ) значительно различаются по данным однофакторного дисперсионного анализа ( P <0,0001), и посттест на линейный тренд был значимым при P = 0.0001, r 2 = 0,8213. Аналогичным образом, уровни РНК PMCA2, измеренные с помощью qRT-PCR, были нормализованы до экспрессии Gapd , и все точки данных от незапечатанных желез были усреднены для установления исходного уровня. В ( G ) показаны уровни мРНК PMCA2 из запечатанных желез, представленные как фракция базовой экспрессии. Экспрессия гена PMCA2 значительно различалась со временем ( P = 0,0018) со значительным линейным трендом между временем после запечатывания и экспрессией PMCA2 ( P = 0.
 0001, r 2 = 0,7663). Столбики показывают среднее значение ± SEM для каждой группы. В ( F ) через 2, 12 и 24 часа n = 4; через 4 часа n = 6; и через 48 часов n = 5. В ( G ) n = 3 во все моменты времени. Значимые отличия от 2-часовой временной точки по посттесту Ньюмана-Кеулса обозначены * P <0,05, ** P <0,01 и *** P <0,001.
0001, r 2 = 0,7663). Столбики показывают среднее значение ± SEM для каждой группы. В ( F ) через 2, 12 и 24 часа n = 4; через 4 часа n = 6; и через 48 часов n = 5. В ( G ) n = 3 во все моменты времени. Значимые отличия от 2-часовой временной точки по посттесту Ньюмана-Кеулса обозначены * P <0,05, ** P <0,01 и *** P <0,001.
Накопление молока в альвеолах запечатанной железы было связано с очевидными изменениями формы клеток, показанными на рис.2 A — D путем окрашивания актинового цитоскелета фаллоидином. Во время лактации (Рис. 2 A и B ) эпителиальные клетки имеют столбчатую форму, демонстрируют заметное вздутие своих апикальных поверхностей на стыках клеток и обладают толстой сетью апикального подкоркового актина. После герметизации сосков клетки стали уплощенными, складки между клетками исчезли, а апикальная актиновая сеть стала тоньше (рис. 2 C и D ). Это «растяжение» эпителиальных клеток отражалось в прогрессивном увеличении их отношения площади поверхности к объему (SA: V) (рис.2 G ). Учитывая связь между формой клеток и уровнями PMCA2 in vivo, мы затем исследовали взаимосвязь между экспрессией PMCA2 и формой клеток в MECs in vitro. МЭК, выращенные в трехмерной культуре на обогащенной ламинином восстановленной базальной мембране (lrBM), организуются в сферы секреторных эпителиальных клеток, известные как маммосферы, тогда как MEC, выращенные на пластике или с высокой плотностью на тонком слое lrBM, образуют сплющенные монослои. Передача сигналов как интегрина, так и пролактина способствует дифференцировке MEC in vivo и на lrBM (19, 20).Однако, как видно на фиг. 2 H и J , экспрессия РНК и белка PMCA2 была низкой в первичных эпителиальных клетках молочной железы, выращенных в монослое на пластике или на тонком слое lrBM, независимо от присутствия или отсутствия пролактина. В отсутствие пролактина клетки, выращенные в 3D-культуре, экспрессировали несколько больше PMCA2, но в присутствии пролактина MECs в 3D-культуре экспрессировали высокие уровни PMCA2. Клетки, выращенные на тонком lrBM в 2D, имели выраженные стрессовые волокна, очень мало кортикального актина и плоскую морфологию с высоким соотношением SA: V.Однако в 3D они имели выраженный кортикальный актин и были более столбчатыми с более низким соотношением SA: V. Эти данные предполагают, что форма и / или деформация клеток взаимодействуют с передачей сигналов пролактина и интегрина, чтобы регулировать экспрессию PMCA2. Чтобы определить, может ли механическая деформация МЭК напрямую влиять на уровни PMCA2, мы исследовали эффекты гипосмотического отека (21). Как показано на фиг. 2 H — J , воздействие на МЭК в трехмерной культуре гипосмотической среды значительно снижает уровни белка и мРНК PMCA2.Таким образом, в трех отдельных экспериментальных моделях, модели молочного застоя с уплотнением сосков, трехмерной и двумерной культуре эпителиальных клеток молочных желез и гипосмотическом набухании уровни PMCA2 были снижены за счет растяжения MEC, что позволяет предположить, что форма клеток может регулировать экспрессию PMCA2.
Рис. 2.
уровней PMCA2 связаны с формой ячейки. Незапечатанные ( A и B ) и запечатанные ( C и D ) молочные железы, а также 3D и 2D культуры MMEC ( E и F соответственно) были окрашены Alexa-488. -фаллоидин для визуализации микрофиламентов.Морфометрические измерения ( G ) показали, что отношение площади поверхности к объему (SA: V) было значительно выше в герметизированных молочных железах и что эпителиальный слой становился тоньше по мере накопления молока в течение 24 часов. Каждая точка в G представляет собой измерение альвеол в одном отдельном поле зрения. Однофакторный дисперсионный анализ дал общее значение P <0,0001, а посттест множественного сравнения Ньюмана-Кеулса показал значительные различия между незапечатанными и запечатанными железами (через 4 и 24 часа) и между запечатанными железами при 4 и 4.24 часа (без запечатывания 4 часа n = 6; запечатанный 4 часа, n = 5; без запечатывания 24 часа, n = 10; запечатанный 24 часа, n = 9). Кроме того, MMEC, выращенные в 2D на lrBM, были тоньше, чем MMEC, выращенные в 3D ( P = 0,0211, n = 3). Тест Стьюдента t Значения P показаны над столбиками на графике g. Вестерн-блоттинг 100 мкг (дорожки 1–5) или 50 мкг (дорожки 6–9) общего белка ( H ) и qRT-PCR ( J ) показывают, что для максимальной экспрессии PMCA2 в MMEC требуется пролактин (PRL) и культура в 3D на lrBM.Уровни PMCA2 были снижены ( P = 0,0033 для белка, P = 0,0034 для РНК) механической деформацией культур 3D MMEC с 50% гипосмотической обработкой в течение 4 часов ( H – J ). Для белка + PRL n = 3; + ПРЛ с 50% гипосмотической средой, n = 3. Для РНК, пластик –PRL, n = 7; пластик + ПРЛ, n = 8; 2D lrBM −PRL, n = 8; 2D lrBM + PRL, n = 8; 3D lrBM −PRL, n = 3; 3D lrBM + PRL, н = 6; 3D lrBM + PRL с 50% гипосмотической средой, n = 3.Показаны средние значения ± SEM с отдельными точками данных для G и I .
Отсутствие PMCA2 вызывает апоптоз MEC.
Затем мы исследовали влияние дефицита PMCA2 на развитие молочных желез у мышей, несущих нулевую мутацию deafwaddler-2J (dfw-2J) в гене Atp2b2 (кодирующем PMCA2) (22). Хотя PMCA2 экспрессируется на низких уровнях эпителиальными клетками протоков, развитие молочной железы было неизменным до поздней беременности, когда уровни PMCA2 обычно повышаются как в протоковых, так и в альвеолярных клетках.Как показано на фиг. 3 A и B , к концу беременности альвеолярные структуры в железах dfw-2J казались меньше, чем у контрольных однопометников, разница, которая сохранялась в период лактации. Несмотря на уменьшение альвеолярной массы, мыши dfw-2J лактировали и поддерживали своих детенышей (15). MEC Dfw-2J пролиферировали и дифференцировались нормально во время беременности (фиг. S2), но окрашивание TUNEL выявило широко распространенный апоптоз на P18 (фиг. 3 C и D ).В железах dfw-2J 30,1 ± 10,0% клеток были TUNEL-положительными, хотя только 2,6 ± 1,2% клеток в контрольных железах были положительными. Наряду с апоптозом ранняя инволюция характеризуется характерными изменениями эпителиальной экспрессии ряда факторов транскрипции (23, 24). Как показано на рис. S3, они включают потерю ядерного фосфо-Stat5a (25) и индукцию ядерного фосфо-Stat3 (26) и NFκB (24). Подобно лактирующим железам, на P18 нормальные MECs экспрессировали ядерный фосфо-Stat5a, но не экспрессировали ядерный фосфо-Stat3 или NFκB.Однако на P18 эпителиальные клетки dfw-2J теряют ядерный фосфо-Stat5a и приобретают ядерный phsopho-Stat3 и NFκB, имитируя нормальные клетки во время инволюции. Таким образом, потеря PMCA2 привела к преждевременным изменениям в экспрессии фосфо-Stat5a, фосфо-Stat3 и NFκB, что сопровождалось широко распространенным апоптозом МЭК, имитирующим начальную фазу инволюции в конце беременности.
Рис. 3.
Недостаток PMCA2 вызывает апоптоз МЭК во время беременности. Молочные железы были взяты у гомозиготных мышей dfw-2J, у которых отсутствует экспрессия PMCA2, и мышей WT на 18 день беременности.Альвеолы были меньше в целых образцах молочной железы, полученных от мышей dfw-2J ( B ), по сравнению с мышами WT ( A ). Окрашивание TUNEL молочных желез WT ( C ) и dfw-2J ( D ) на P18 выявило гораздо больше апоптотических ядер в железах dfw-2J, чем в железах WT. Первичные MMEC культивировали на lrBM с лактогенной средой и обрабатывали 5 мкМ иономицином (Invitrogen) или носителем в течение 16 часов перед анализом апоптоза с использованием ELISA PLUS (Roche) ( E ) на гибель клеток.MMEC WT в культуре 3D lrBM были относительно устойчивы к 5 мкМ иономицин-индуцированному внутриклеточному кальциевому стрессу ( E ), хотя в MMEC dfw-2J иономицин индуцировал апоптоз ( P = 0,0009; n = 4). Повышенный апоптоз в dfw-2J MMEC, обработанном 5 мкМ иономицином, связан с более высоким уровнем внутриклеточного кальция по сравнению с WT MMEC ( F ) ( P = 0,0384, WT n = 122 клетки в двух экспериментах, dfw -2J n = 51 клетка в двух экспериментах).Клетки визуализировали при перфузии стандартной средой в течение приблизительно 2 минут для определения исходного уровня кальция с последующей перфузией средой, содержащей 5 мкМ иономицин. Данные выражены как средний процент увеличения флуоресценции по сравнению с исходным уровнем. Планки погрешностей представляют собой среднее значение ± SEM.
Рис. 4. Сверхэкспрессия
PMCA2 защищает клетки рака молочной железы T47D от кальций-опосредованного апоптоза. Контрольные клетки T47D / EV или клетки T47D / PMCA2, сверхэкспрессирующие PMCA2, обрабатывали 5 мкМ иономицином в течение 16 часов в присутствии 0, 2 или 10 мМ внеклеточного CaCl 2 перед оценкой апоптоза с помощью ELISA PLUS. ( А ).Увеличение внеклеточного кальция увеличивает индуцированный иономицином апоптоз в клетках T47D / EV и T47D / PMCA2. Однако сверхэкспрессия PMCA2 значительно снижает апоптоз. При 2 мМ и 10 мМ кальция общие значения однофакторного дисперсионного анализа ANOVA P были <0,0001. Тест Стьюдента t дал P = 0,0187 при 2 мМ кальция и P = 0,0308 при 10 мМ кальция для снижения апоптоза в T47D / PMCA2 по сравнению с клетками T47D / EV с иономицином. При 2 мМ кальция 5 мМ EGTA была способна предотвратить апоптоз, индуцированный иономицином ( B ).Однофакторный дисперсионный анализ ( P <0,0001 в целом, n = 4 для всех групп) с тестом множественного сравнения Ньюмана-Кеулса показал, что EGTA значительно ( P <0,05) снижает апоптоз, вызванный иономицином у T47D / EV ( P = 0,0064 на t тест) и клетки T47D / PMCA2 ( P = 0,0003 на t тест). Значительное снижение апоптоза по сравнению с обработанными иономицином клетками T47D / EV обозначено * (посттест Ньюмана-Кеулса, P <0.05, n = 4) в A и B . ( C ) Сверхэкспрессия PMCA2 изменила величину и форму внутриклеточного кальциевого ответа на лечение иономицином в клетках T47D ( P <0,0001 по парному тесту t для среднего значения 82 клеток T47D / EV и 87 T47D / PMCA2 из трех независимых экспериментов). ( D ) Активность кальпаина, указывающая на опосредованный кальцием апоптоз, была значительно увеличена иономицином в клетках T47D / EV ( P = 0.0305 однофакторный ANOVA, P <0,05 посттест Ньюмана-Кеулса, n = 3), тогда как избыточная экспрессия PMCA2 предотвращала повышение активности кальпаина в клетках T47D / PMCA2 ( P > 0,05 в посттесте Ньюмана-Кеулса) . Активность кальпаина также значительно увеличивается через 24 часа после начала инволюции ( P = 0,0298 по тесту Стьюдента t , n = 3) в закрытых и открытых молочных железах ( E ). ( F ) Сверхэкспрессия PMCA2 в клетках T47D / PMCA2 уменьшала апоптоз в ответ на лечение доцетакселом (5 нг / мл в течение 40 часов) по сравнению с контрольными клетками T47D / EV ( n = 9, P = 0.0199; четыре повтора в каждом из девяти независимых экспериментов). Столбики и линии представляют собой среднее значение ± SEM.
Время апоптоза MEC у мышей dfw-2J совпало с функциональной дифференцировкой MEC (27), которая также является точкой, в которой обычно увеличивается экспрессия PMCA2 (15). Вероятно, это также момент, когда поступление кальция в МЭК увеличивается при подготовке к началу производства молока. Поэтому мы предположили, что недостаток PMCA2 может привести к неспособности транспортировать повышенную нагрузку кальция, прогрессирующей внутриклеточной токсичности кальция и, в конечном итоге, к апоптозу.Чтобы проверить эту гипотезу, мы выращивали 3D-культуры первичных эпителиальных клеток молочной железы от мышей dfw-2J или контрольных мышей и оценивали их чувствительность к индуцированному кальцием апоптозу. На исходном уровне апоптоз имел тенденцию быть выше в клетках dfw-2J, чем в клетках WT, а приток кальция, вызванный обработкой иономицином, приводил к значительному увеличению апоптоза. Напротив, не наблюдалось увеличения апоптоза в контрольных клетках, подвергшихся воздействию иономицина (фиг. 3 E ). Аналогичным образом иономицин вызывал значительно большее повышение внутриклеточной концентрации кальция в клетках dfw-2J, чем в контрольных клетках (рис.3 F ). Следовательно, попадание кальция в MECs вызывает апоптоз в отсутствие PMCA2.
Сверхэкспрессия PMCA2 подавляет апоптоз в клетках рака молочной железы.
Если уровни PMCA2 регулируют чувствительность к индуцированному кальцием апоптозу в нормальных клетках груди, то сверхэкспрессия PMCA2 может защитить клетки рака груди от апоптоза. Мы решили изучить, влияет ли повышенная экспрессия PMCA2 на чувствительность клеток рака молочной железы T47D к индуцированному кальцием апоптозу. Хотя эти клетки экспрессируют более высокие уровни, чем нормальные клетки, клетки T47D экспрессируют более низкие исходные уровни PMCA2, чем несколько других стандартных клеточных линий.Клетки T47D трансфицировали конструкцией, кодирующей мышиный PMCA2b / w, для получения стабильной клеточной линии T47D / PMCA2 (фиг. S4). Линия контрольных клеток содержала пустой вектор (T47D / EV). В отсутствие внеклеточного кальция обработка иономицином вызвала небольшой апоптоз в клетках T47D / PMCA2 или T47D / EV. В клетках T47D / EV иономицин индуцировал прогрессирующее увеличение апоптоза при 2 мМ кальция и 10 мМ кальция. Однако как при 2 мМ, так и при 10 мМ кальция избыточная экспрессия PMCA2 значительно снижает апоптоз в ответ на иономицин в клетках T47D / PMCA2.Добавление EGTA к культуральной среде уменьшало апоптоз, индуцированный иономицином в клетках T47D / EV и T47D / PMCA2, подтверждая, что апоптоз зависел от проникновения внеклеточного кальция в клетки.
Рис. 5.
Высокая экспрессия PMCA2 предсказывает плохой исход в случаях рака груди у человека. ( A — C ) Используя базу данных Oncomine и инструменты интеллектуального анализа данных (www.oncomine.org), мы обнаружили связь между экспрессией PMCA2 (ген ATP2B2 ) и увеличением степени злокачественности опухоли груди ( A, P = 0). .004, корреляция Пирсона), смерть в течение 5 лет после постановки диагноза рака груди ( B , P = 0,043, t тест) и устойчивость к лечению доцетакселом ( C , P = 0,018, t тест ). ( D ) Связь между смертностью и тремя верхними и нижними квартилями экспрессии PMCA2 в подгруппе женщин с раком молочной железы в возрасте до 50 лет. По сравнению с тремя нижними квартилями для оценок PMCA2 AQUA, верхний квартиль экспрессии PMCA2 был значительно ниже. выживаемость (анализ Каплана-Мейера, P = 0.0120; Кокс непрерывный P = 0,0037; три нижних квартиля, n = 106; верхний квартиль, n = 35).
Избыточная экспрессия PMCA2 также изменяла внутриклеточные концентрации кальция в ответ на иономицин. Конфокальная кальциевая визуализация флуо-4 показала устойчивый рост внутриклеточных уровней кальция в контрольных клетках T47D / EV, обработанных иономицином (фиг. 4 C ). Это было связано с очевидным блеббингом плазматической мембраны во многих клетках, что согласуется с апоптотическим ответом.Однако в клетках T47D / PMCA2 иономицин вызывал лишь временное повышение внутриклеточных концентраций кальция (фиг. 4 C ). Считается, что одним из механизмов, посредством которого повышение внутриклеточного кальция вызывает апоптоз, является активация кальций-зависимого протеолитического фермента кальпаина (13). Поэтому мы исследовали активацию кальпаина в клетках T47D / PMCA2 и T47D / EV, подвергнутых воздействию кальция и иономицина. Как показано на фиг. 4 D , активность кальпаина была повышена в клетках T47D / EV в этих условиях, но не в клетках T47D / PMCA2.Интересно, что активность кальпаина также была повышена во время ранней инволюции, вызванной герметизацией сосков. Как показано на фиг. 4 E , активность кальпаина в незапечатанной железе, где уровни PMCA2 были высокими, была низкой. Однако в закрытой (инволюционной) железе, где уровни PMCA2 были низкими, кальпаин активировался через 24 часа. Следовательно, сверхэкспрессия PMCA2 снижает внутриклеточные уровни кальция и предотвращает активацию кальпаина и апоптоз в клетках рака молочной железы T47D. Наконец, было высказано предположение, что некоторые химиотерапевтические агенты, включая доцетаксел, вызывают апоптоз, отчасти за счет повышения уровня внутриклеточного кальция (28).Как показано на фиг. 4 F , клетки T47D / PMCA2 также продемонстрировали устойчивость к апоптозу в ответ на доцетаксел по сравнению с клетками T47D / EV.
Экспрессия PMCA2 предсказывает исход рака молочной железы.
Устойчивость к апоптозу — важный признак злокачественного прогрессирования (29). Учитывая, что PMCA2 изменяет чувствительность MEC и клеток рака груди к апоптозу, мы затем исследовали, коррелируют ли уровни PMCA2 с клинико-патологическими особенностями рака груди человека.Используя базу данных Oncomine и инструменты интеллектуального анализа данных (30), мы обнаружили, что высокая экспрессия мРНК PMCA2 была связана с более высокой степенью злокачественности опухоли (31) (рис. 5 A ) и более низкой 5-летней выживаемостью (32) (рис. 5 ). В ). Отражая наши результаты in vitro (фиг. 4 F ), мы также обнаружили, что экспрессия PMCA2 коррелировала с устойчивостью к доцетакселу у пациентов (33) (фиг. 5 C ). Затем мы окрасили тканевый микрочип (ТМА), состоящий из 652 первичных опухолей молочной железы, на PMCA2, используя автоматический количественный анализ (AQUA).Характеристики когорты пациентов показаны в таблице S1. Уровни PMCA2 положительно коррелировали с более высокой степенью опухоли, вовлечением лимфатических узлов и HER2-положительным статусом (Таблица S2). Типичные прогностические клинические маркеры, включая размер опухоли, узловой статус, ядерный класс и статус гормональных рецепторов (ER / PR), были достоверно связаны с выживаемостью по результатам одномерного анализа (Таблица S3). Экспрессия PMCA2 также обратно коррелировала с выживаемостью по результатам одномерного анализа ( P = 0,0089). Используя модель пропорциональных рисков Кокса, многомерный анализ (таблица S4) показал, что размер опухоли, узловой статус и баллы PMCA2 независимо связаны с выживаемостью ( P = 0.0489). Связь экспрессии PMCA2 с выживаемостью была более значимой для более молодых женщин в пременопаузе (в возрасте до 50 лет; характеристики этой когорты см. В таблице S1) со значением Kaplan-Meier P , равным 0,0120. В качестве непрерывной переменной уровни PMCA2 были связаны с выживаемостью у женщин в возрасте до 50 лет, но относительный риск был низким (непрерывный Кокса P = 0,0037, 1,042 относительный риск по одномерному анализу; P = 0,0027, 1,047 относительный риск по многомерному анализу. ).Однако, когда экспрессия была разделена на квартили, уровни PMCA2 стали надежно предсказывать выживаемость. На фиг. 5 D показан график Каплана-Мейера для выживаемости женщин в возрасте до 50 лет, с нанесением уровней PMCA2 в опухоли по квартилям. Как показано, у более молодых женщин с опухолями в наивысшем квартиле экспрессии PMCA2 наблюдалось резкое снижение выживаемости. Квартиль с наивысшей экспрессией PMCA2 в когорте <50 лет имел относительный риск смерти 2,475 ( P = 0,0015) по результатам одномерного анализа и 2.817 ( P = 0,0009) по результатам многомерного анализа по сравнению с остальной частью когорты. Применяя модель пропорциональных рисков Кокса только к женщинам в возрасте до 50 лет, многомерный анализ показал, что только PMCA2 оставался независимо связанным с выживаемостью ( P = 0,0009). Все другие маркеры потеряли значение, что свидетельствует о том, что уровни PMCA2 были более предсказуемыми для выживаемости пациентов у молодых женщин, чем стандартные прогностические маркеры, используемые в клинике. Наконец, поскольку уровни PMCA2 не зависели от статуса рецепторов эстрогена или прогестерона, но коррелировали со статусом HER2 (таблица S2), мы исследовали, коррелирует ли PMCA2 сильнее с выживаемостью у HER2-положительных пациентов.Во всей когорте уровни PMCA2 больше не позволяли прогнозировать выживаемость пациентов с HER2-отрицательными опухолями, но имели тенденцию прогнозировать смертность в HER2-положительных опухолях ( P = 0,08). Однако только у женщин до 50 лет прогностическая ценность PMCA2 не зависела от статуса HER2.
Обсуждение
Инволюция молочной железы запускается застоем молока и является одним из самых ярких примеров скоординированной гибели клеток в природе. Наши результаты предполагают, что важным событием в инициировании апоптоза является заметное изменение формы МЭК, которое, в свою очередь, связано с быстрым снижением уровней PMCA2 в клетках.Регулирование уровней PMCA2 с помощью застоя молока обеспечивает элегантный метод соединения секреторного процесса лактации с механизмом гибели клеток, необходимым для инволюции. По сути, подавляя PMCA2, длительное растяжение альвеол приводит к перегрузке кальциевой буферной способности клеток, вызывая устойчивое увеличение внутриклеточного кальция и апоптоз. Одним из эффектов повышенного содержания внутриклеточного кальция в МЭК, по-видимому, является активация активности кальпаина. Учитывая, что Stat5 и Stat3 являются субстратами для кальпаина (34, 35), и учитывая, что потеря PMCA2 связана с потерей ядерного фосфо-Stat5 и активацией Stat3, вполне вероятно, что повышение внутриклеточных уровней кальция при отъеме способствует изменения этих факторов транскрипции.
Помимо защиты МЭК от токсичности кальция во время лактации, мы обнаружили, что активность PMCA2 также защищает клетки рака груди от апоптоза. Это может объяснить, почему повышенная экспрессия PMCA2 связана с более крупными опухолями, более высокой степенью злокачественности и узловыми метастазами и предсказывает плохой исход у пациентов с раком груди. Интересно, что экспрессия PMCA2 коррелировала с экспрессией HER2 среди опухолей в когорте TMA. Поскольку HER2-положительные опухоли чаще встречались среди молодых женщин, это наблюдение может указывать на особенно очевидную связь между высоким уровнем PMCA2 и смертью у женщин в возрасте до 50 лет.Хотя экспрессия PMCA2 имела тенденцию прогнозировать смертность у женщин с HER2-положительными опухолями во всей когорте, эта связь не была достаточно статистически значимой ( P = 0,08). Эти результаты предполагают, что PMCA2 может быть особенно важным в биологии пременопаузального рака молочной железы и / или в HER2-положительных опухолях. Потребуются дальнейшие исследования, чтобы определить, существуют ли биологические взаимодействия между передачей сигналов ErbB2 и PMCA2 в опухолях молочной железы.
Методы
Инволюция молока, вызванная застоем.
Эксперименты на животных были одобрены Комитетом по уходу и использованию животных Йельского университета. Модель с уплотнением соски была выполнена, как описано Li et al. (2). Уровни мРНК и белка PMCA2 измеряли с помощью qRT-PCR и вестерн-блоттинга, как описано ранее (15). Иммуноокрашивание, морфометрические измерения и культура первичных эпителиальных клеток молочной железы мыши описаны в SI Text .
Анализ Deafwaddler-2J, мышей с дефицитом PMCA2.
Целые препараты молочной железы получали, как описано ранее (36).Ядра апоптоза метили с использованием DeadEnd Fluorometric TUNEL System (Promega). Апоптоз измеряли в 3D-культурах MMEC, используя ELISA PLUS (Roche). Концентрации внутриклеточного кальция визуализировали в MMEC на покровных стеклах в лактогенной среде с помощью конфокальной микроскопии живых клеток fluo-4 (Invitrogen) с использованием Zeiss LSM 510NLO и анализировали с помощью программного обеспечения Zeiss LSM и Volocity для анализа изображений (Improvision / Perkin-Elmer).
Сверхэкспрессия PMCA2 в клетках рака молочной железы T47D.
Генерация клеток T47D, сверхэкспрессирующих PMCA2 мыши, подробно описана в SI Text .
Микроматричный анализ тканей рака молочной железы.
Микроматрицы ткани карциномы молочной железы были сконструированы, как описано ранее (37). Анализ тканевых микрочипов и статистические методы описаны в SI Text .
Благодарности
Мы благодарим Эла Меннона за техническую помощь и Дэвида Така за полезные обсуждения. Эта работа финансировалась грантом DK069542 Национальных институтов здравоохранения (J.W.), грант Министерства обороны BC062952 (для J.V.) и Сьюзен Г. Комен для гранта KG081429 (для J.V.).
Сноски
- 1 Кому следует направлять корреспонденцию. Электронная почта: john.wysolmerski {at} yale.edu.
-
Вклад авторов: J.V. and J.W. спланированное исследование; J.V., C.S., C.B. и T.R. проведенное исследование; R.C. и D.L.R. внесены новые реагенты / аналитические инструменты; J.V., C.S., C.B., R.C., D.L.R. и G.C. проанализированные данные; и J.V., C.S. и J.W. написал статью.
-
Заявление о конфликте интересов: G.C. является консультантом HistoRx Inc. D.L.R. и R.C. являются учредителями, акционерами и консультантами HistoRx Inc.
-
Эта статья представляет собой прямое представление PNAS.
-
Размещение данных: Последовательность, указанная в этой статье, была депонирована в базе данных GenBank (инвентарный номер GU734816).
-
Эта статья содержит вспомогательную информацию на сайте www.pnas.org/lookup/suppl/doi:10.1073/pnas.0
6107/-/DCSupplemental.
Рак груди у мужчин — NHS
Рак груди часто считается чем-то, что поражает только женщин, но мужчины могут заболеть им в редких случаях. Он растет в небольшом количестве ткани груди у мужчин за сосками.
Обычно это происходит у мужчин старше 60 лет, но иногда может поражать и более молодых мужчин.
Информация:
Консультации по коронавирусу
Получите консультацию о коронавирусе и раке:
Симптомы рака груди у мужчин
Симптомы рака молочной железы у мужчин включают:
- уплотнение в груди — обычно твердое, безболезненное и не движется внутри груди
- сосок, поворачивающийся внутрь
- жидкость, сочащаяся из соска (выделения из соска) , на котором могут быть прожилки крови
- болезненность или сыпь вокруг соска, которая не проходит
- сосок или окружающая его кожа становится твердой, красной или опухшей
- небольшие бугорки в подмышечной впадине (опухшие железы)
Подробнее о симптомах рака груди у мужчин.
Когда обращаться к вашему GP
Обратитесь к терапевту, если у вас есть:
- уплотнение в груди
- любые другие тревожные симптомы, такие как выделения из сосков
- наличие в анамнезе рака груди (у мужчин или женщин) у членов вашей семьи, и вы беспокоитесь о ваших шансах получить его
Очень маловероятно, что у вас рак, но лучше проверить свои симптомы. Ваш терапевт осмотрит вашу грудь и при необходимости направит вас на обследование и сканирование на рак груди.
Если у вас нет симптомов, но у вас есть четкая семейная история рака груди, ваш терапевт может направить вас к генетическому специалисту, чтобы обсудить ваш риск его заболевания.
Есть некоторые унаследованные гены, которые увеличивают риск рака, и для их проверки можно сделать анализ крови. Прочтите о тестировании генов риска рака.
Лечение рака груди у мужчин
Лечение рака груди у мужчин зависит от того, насколько далеко распространился рак.
Возможные методы лечения:
- операция по удалению пораженной ткани груди и соска (мастэктомия) и некоторых желез в подмышечной впадине
- лучевая терапия — при которой радиация используется для уничтожения раковых клеток
- химиотерапия — при использовании лекарств от рака для уничтожения раковых клеток
- другие лекарства, которые помогают остановить рост рака груди, в том числе тамоксифен и трастузумаб (герцептин)
Многие мужчины переносят операцию, за которой следует одно или несколько других методов лечения.Это может помочь остановить рецидив рака в будущем.
Узнайте больше о лечении рака груди у мужчин.
Перспективы рака груди у мужчин
Перспективы рака груди у мужчин зависят от того, насколько далеко он распространился к моменту постановки диагноза.
Рак груди можно вылечить, если он обнаружен на ранней стадии.
Излечение гораздо менее вероятно, если рак обнаружен после того, как он распространился за пределы груди. В этих случаях лечение может облегчить ваши симптомы и помочь вам прожить дольше.
Поговорите со своей медсестрой, занимающейся грудным вскармливанием, если вы хотите узнать больше о перспективах вашего рака.
Причины рака груди у мужчин
Точная причина рака груди у мужчин неизвестна, но есть некоторые факторы, повышающие риск его заболевания.
К ним относятся:
- гены и семейный анамнез — наследование ошибочных версий генов, называемых BRCA1 или BRCA2, увеличивает риск рака груди
- состояний, которые могут повышать уровень эстрогена в организме, включая ожирение, синдром Клайнфельтера и рубцевание печень (цирроз)
- предыдущая лучевая терапия в области грудной клетки
Не факт, что вы можете что-то сделать, чтобы снизить свой риск, но сбалансированное питание, потеря веса при избыточном весе и отказ от употребления слишком большого количества алкоголя могут помочь .
Последняя проверка страницы: 18 марта 2020 г.
Срок следующей проверки: 18 марта 2023 г.
сигнальных путей, участвующих в раннем морфогенезе молочных желез и раке молочной железы
Abstract
Спецификация судьбы эпителиальных клеток молочной железы происходит во время эмбриогенеза, когда клетки объединяются с образованием зачатка молочной железы. Внутри зародышевого зачатка молочной железы существует популяция эпителиальных клеток, которые впоследствии будут пролиферировать с образованием протокового дерева, заполняющего стромальный компартмент, и которые могут производить молоко при терминальной дифференцировке после рождения.Впоследствии эти структуры могут быть реконструированы и возвращены в исходное состояние после отлучения от груди перед восстановлением в будущих беременностях. Пластичность эпителиальной клетки молочной железы и ее чувствительность к рецепторам гормонов способствует этому удивительному биологическому подвигу, но аберрантная передача сигналов также может привести к непредвиденным последствиям в виде частых злокачественных новообразований. Отражая эту тесную связь, значительное количество сигнальных путей участвует как в морфогенезе, так и в канцерогенезе молочных желез.
Образец цитирования: Howard B, Ashworth A (2006) Сигнальные пути, участвующие в раннем морфогенезе молочных желез и раке молочной железы. PLoS Genet 2 (8):
e112.
https://doi.org/10.1371/journal.pgen.0020112
Редактор: Элизабет М.К. Фишер, Университетский колледж Лондона, Соединенное Королевство
Опубликовано: 25 августа 2006 г.
Авторские права: © 2006 Howard и Эшворт. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Работа в нашей лаборатории поддерживается Исследовательским центром рака молочной железы «Прорыв».
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Как и многие другие органы, молочные железы образуются в результате обмена сигналами между эпителием и мезенхимой [1–3]. Однако процессы, с помощью которых недифференцированная ткань направляется на формирование эпителиального зачатка молочных желез во время эмбриогенеза, еще предстоит полностью выяснить.Неизвестно, как именно передается фенотип молочных желез, но похоже, что мезенхимальные сигналы вызывают локальную миграцию эпидермальных клеток с образованием зачатка молочных желез, а не через локализованную пролиферацию [4-6]. Как и в развитии всех эпителиальных придатков, плюрипотентные эпидермальные клетки направляются по определенным линиям, так что формируется специализированная структура, в данном случае молочная железа [7,8]. Фундаментальные процессы, необходимые для индуктивных событий развития зачатков молочных желез (миграция эпителия, изменения клеточной адгезии, рост, гибель и дифференцировка), также нарушаются при раке груди [9,10].Характеристика индуктивных сигнальных путей, участвующих в спецификации и формировании паттерна молочных желез, и регуляторных молекул, которые модулируют этот процесс, определит потенциальные мишени канцерогенеза молочной железы. Здесь мы выделяем самые ранние сигналы, обеспечивающие спецификацию молочных желез, и пытаемся консолидировать текущее понимание того, как действуют мезенхимальные факторы, чтобы вызвать начальные стадии развития зачатков молочных желез. Обсуждается взаимосвязь сигнальных путей, участвующих в нарушении регуляции рака.События на более поздних стадиях морфогенеза молочных желез недавно были подробно рассмотрены [11–14].
Развитие зачатков молочных желез у мышей
Эпителиальные зачатки молочных желез мышей обычно образуются в различных положениях вдоль оси тела и легко визуализируются путем окрашивания на экспрессию маркеров зачатков молочных желез, таких как Lef1, , сигнального компонента Wnt ниже по течению, или с помощью светового микроскопического анализа E12.5. Гистологический анализ сагиттальных срезов показывает первое появление зачатка молочной железы мыши у поздних E10 / ранних E11 эмбрионов [6] (Рисунок 1A).В это время отчетливые эллиптические агрегаты эпителиальных клеток видны на будущих участках зачатков 3 и 4 молочных желез, что определяется их положением относительно сомитов (Figure 1B). Однако сканирующая электронная микроскопия не выявляет явных признаков образования зачатка молочной железы [14] на этой стадии. К E11.5 (стадия ~ 48 сомитов) зачаток 3 выступает и при сканирующей электронной микроскопии наблюдается как небольшое возвышение над поверхностью эпидермиса [15]. Это первая пара зачатков молочной железы, обнаруживаемая на уровне всего эмбриона, причем зачаток 4 становится очевидным вскоре после зачатка 3.Псевдостратифицированный эпителий становится видимым, когда поперечные срезы будущего участка зачатка 3 анализируются на сходных стадиях [6,16]. Поскольку в презумптивной области молочной железы происходит небольшая локализованная пролиферация, предполагается, что эпителиальные клетки локально мигрируют или агрегируют с образованием зачатка, как это наблюдается у эмбрионов кроликов, где очевиден приподнятый гребень эпителиальных клеток, обладающих свойствами подвижных клеток, таких как ламеллоподии. [4–6,17]. После появления зачатка эллиптической формы клетки организуются в почку (Рис. 2A – 2E).Другой зачаток (1,2,5) становится морфологически отличным немного позже, и к E12 (52 сомита) все пять пар молочных зачатков становятся отчетливыми / видимыми.
Рисунок 1. Зачаток молочной железы
(A) Зачаток молочной железы 3 и 4 видны на E10.75 / E11.0 (38-40 сомитов) на гистологических сагиттальных срезах эмбрионов мыши, окрашенных гематоксилином.
FL, зачаток передних конечностей; HL, зачаток задней конечности; MLM, мезенхима линии молочных желез; NT, нервная трубка
(B) Более высокое увеличение области молочной железы из (A).Анлаген 3 и 4 при большем увеличении.
https://doi.org/10.1371/journal.pgen.0020112.g001
Рис. 2. Гистологические срезы зачатка молочных желез 4, окрашенные гематоксилином
(A) Поздние E10 / E11, когда клетки первоначально собираются в эллиптическую форму.
(B) E11.5 Утолщение эпидермиса.
(В) Е12.0 на бугорке.
(D) E13.0 на стадии шаровидной почки.
(E) E14.5 на стадии лампочки.
https: // doi.org / 10.1371 / journal.pgen.0020112.g002
Стволовые клетки молочных желез
Внутри зачатка существует популяция эпителиальных клеток, стволовых клеток, способных к самообновлению и генерированию дочерних клеток, которые могут дифференцироваться по различным клеточным линиям, так что все типы клеток зрелой молочной железы могут образовываться. . Эпителиальные зачатки молочных желез могут быть изолированы и трансплантированы в жировые подушечки, которые были «очищены» от всех эпителиальных протоковых элементов [18]. Этот метод используется экспериментально для изучения разрастания протоков молочной железы на моделях мутантных мышей, которые демонстрируют эмбриональную летальность и которые иначе не поддаются анализу фенотипа молочных желез [19,20].Из зачатков молочной железы, эксплантированных на ст. E12.5, обычно образуется проток со всеми нормальными характеристиками молочной железы, за исключением отсутствия соска. Эти эксперименты подтверждают существование определенной популяции стволовых клеток молочной железы, совпадающей с появлением зачатка молочной железы на E12.5.
У взрослых популяция стволовых клеток молочной железы была недавно очищена, но связь этой популяции постнатальных клеток с «эмбриональными» стволовыми клетками еще не установлена [21,22]. Считается, что помимо способности к самообновлению, эпителиальные стволовые клетки молочных желез обладают присущим им опухолевым потенциалом по мере того, как последующее развитие молочных желез продолжается и продолжается постнатально.Поскольку повреждения ДНК и мутации могут накапливаться на протяжении всего постнатального развития, те клетки-предшественники, на которые негативно влияют генетические изменения, могут сохраняться на протяжении всей жизни человека. Это эффективно создает популяцию клеток, несущих потенциально вредные генетические изменения, нестабильности и модификации — предполагаемые стволовые клетки рака груди [23,24]. Как клетки-предшественники молочных желез приобретают свойства, которые позволяют им постоянно сообщать идентичность молочных желез их потомству, и как поддерживается фенотип молочных желез, еще предстоит решить, но эти процессы начинаются во время эмбрионального морфогенеза молочных желез.
Мезенхима молочной железы может передавать судьбу эпителиальных клеток молочной железы
Точный момент времени, в который эпителий молочной железы приобретает регенеративную способность, еще не определен, но, вероятно, он совпадает со спецификацией зачатка молочной железы. Эпителий, выделенный из молочных желез на всех последующих стадиях, сохраняет способность генерировать протоковый отросток [25,26]. Постоянная потребность в поддержании судьбы клеток молочных желез за пределами стадий зачатка и зачатка указывается при исследовании нескольких моделей мышей, которые формируют зачатки молочных желез, которые не развиваются после стадии зачатка [27,28].Кроме того, реверсия фенотипа молочной железы может происходить до E15.5, как показано в исследованиях индуцибельных моделей PthrP на мышах [29]. К E13 определяется эмбриональный эпителий молочных желез, а к E17 он становится преданным судьбе молочных желез, как продемонстрировано исследованиями тканевой рекомбинации [30,31]. Следует также отметить, что помимо стимулирования судьбы молочных плакод, вероятно, существуют факторы, которые ингибируют судьбу молочных плакод. Судьба соседних клеток, вероятно, будет определяться существованием соседнего зачатка молочной железы.
Эксперименты по рекомбинации тканей продемонстрировали индуктивную способность мезенхимы молочной железы [1,32,33]. В этих экспериментах эпителий из различных немаммарных участков (дорсальный, вентральный) был индуцирован для образования ткани молочной железы при рекомбинации с предполагаемой мезенхимой молочной железы (из эмбрионов кролика, которые образуют приподнятый эпидермальный гребень, линию молочных желез, до образования зачатка [33]. ]) и мезенхимы молочной железы (от эмбриональной мезенхимы мыши, крысы или кролика, смежной с эпителиальным зачатком молочной железы) [14,32,34].Эти результаты показывают, что мезенхимные клетки вдоль линии молочных желез обладают сигнальными / индуктивными свойствами, как и мезенхима молочных желез, связанная с зачатками молочных желез. Вторичная мезенхима молочной железы (будущая жировая прослойка) не обладает этой индуктивной способностью. Это говорит о том, что существует окно, в котором индуктивные свойства существуют в мезенхиме молочной железы. Гиперпластический рост происходит, когда эмбриональная мезенхима молочной железы рекомбинируется с постнатальным эпителием молочной железы [31,35]. Это демонстрирует потенциально пагубное влияние эмбриональных регуляторов молочной железы на постнатальные эпителиальные популяции молочных желез.
Основные сигнальные регуляторы образования зачатков молочных желез также играют роль в раке молочной железы
Недавно было идентифицировано несколько мезенхимальных сигналов, которые регулируют начальные стадии развития молочных желез и вызывают локальную миграцию и изменения клеточной адгезии эпителиальных клеток (Рисунок 3). Напр., Передача сигналов Fgf10 через Fgfr2b необходима для инициации зачатка молочных желез за исключением 4 зачатка молочных желез, который может формироваться в отсутствие лиганда или рецептора [15].MMTV-опосредованный инсерционный мутагенез идентифицировал Fgfs как частые мутационные события в индуцированных ретровирусом опухолях молочной железы мышей; активация Fgf3, Fgf4, и Fgf8 кооперируется с сигналами Wnt в опухолевом генезе молочной железы мышей [36,37]. Более того, Fgf10 также может действовать как онкоген у мышей [38]. Повышенные уровни FGF10, наблюдаются примерно в 10% случаев рака груди человека [38], а амплификация и сверхэкспрессия нескольких FGFR, включая FGFR1, FGFR2, и FGFR4, наблюдаются при раке груди [39–44]. ].FGFRs играют хорошо изученную роль в ангиогенезе и миграции клеток [45,46], а передача сигналов FGFR способствует пролиферации клеток рака груди [47]. Помимо стимулирования пролиферации, передача сигналов Fgfr1 вносит вклад в потерю клеточной полярности и продвижение инвазивных свойств, таких как индукция Mmp3 в трехмерной модели in vitro эпителиальных клеток HC11 молочной железы мышей [48]. У трансгенных мышей устойчивая активация FGFR1 вызывает альвеолярную гиперплазию и инвазивные поражения молочных желез [49].Более того, блокирование передачи сигналов FGFR с помощью селективного ингибитора активности тирозинкиназы FGFR ингибирует пролиферацию клеток рака молочной железы за счет подавления некоторых членов семейства CyclinD [47]. Поскольку считается, что высокие уровни CyclinD1 непосредственно влияют на онкогенность, ингибирование передачи сигналов FGFR, вероятно, будет полезным терапевтическим подходом для лечения некоторых видов рака молочной железы.
Рис. 3. Выражение основных регуляторов образования зачатка молочных желез
60-мкм поперечные сечения вибратома через участок, где впоследствии будет формироваться зачаток 3.Экспрессия Fgf10 и Tbx3 наблюдается в дермамиотоме вдоль линии молочной железы у эмбрионов сомита E10.5 / 32 на стадии B6. Эти паттерны экспрессии сохраняются до тех пор, пока зачаток не станет морфологически отличным. Nrg3 широко экспрессируется в латеральной пластинке мезодермы, прилегающей к сомиту E10.75 37 сомитов стадии B6 эмбрионов, лежащих в основе будущего сайта зачатка 3. Экспрессия Wnt (визуализирована с использованием линии BAT-GAL репортерных мышей Wnt [124]) наблюдается в сомите и будущей зачатке молочной железы 3 сайте E10.75 37 эмбрион на стадии сомита. Как эпителиальная (стрелки), так и мезенхимальная экспрессия Wnt наблюдается вдоль линии молочных желез. Выражение по предполагаемой линии молочной железы обведено рамкой.
https://doi.org/10.1371/journal.pgen.0020112.g003
Tbx3 представляет собой репрессор транскрипции, который принадлежит к подсемейству Tbx2 / 3/4/5 регуляторов транскрипции T-box [50]. TBX3 мутирован при синдроме локтевой молочной железы, заболевании человека, которое нарушает развитие апокринных желез и конечностей [51].Модель нокаута Tbx3 у мышей демонстрирует потребность в Tbx3 для инициации зачатка молочных желез, с незначительной оговоркой, что иногда у этих мышей может формироваться один единственный зачаток молочных желез [52]. Передача сигналов через Fgfr1 участвует в индукции экспрессии Tbx3 [53]. Другая интересная роль Tbx3 была продемонстрирована с использованием Tbx3 , ретровирусно доставленных куриным эмбрионам [54]. Эти эксперименты подтверждают, что наряду с dHand и Gli3, Tbx3 может модулировать положение зачатков конечностей вдоль передне-задней оси [54].Хотя это предположение, это привлекательная идея, что подобный механизм может действовать в генезе молочной железы, посредством чего Tbx3 и др. Факторы определяют будущее расположение зачатков молочных желез вдоль оси тела.
TBX3 сверхэкспрессируется в некоторых клеточных линиях рака молочной железы [55], а высокие уровни экспрессии укороченной формы TBX3 обнаруживаются в плазме больных раком молочной железы на ранней стадии [56]. Подобно Tbx3, Tbx2 первоначально экспрессируется в мезенхиме вдоль презумптивной линии молочных желез до образования зачатка. Tbx3 (но не Tbx2 ) экспрессируется в эпителиальном компартменте формирующегося зачатка [57]. Наряду с Tbx2, Tbx3 может репрессировать гены старения, инактивируя путь ответа p53 [55]. Путь p19 (ARF) -Mdm2-p53 регулирует клеточный цикл и защищает клетки от онкогенной трансформации, а Tbx3 сильно подавляет экспрессию как мышиного p19 (ARF), так и человеческого p14 (ARF) [58]. Хотя Tbx2 -null мыши не обнаруживают дефектов в инициации развития молочной железы, дефекты поддержания плакод более серьезны у двойных гетерозигот для Tbx2 и Tbx3 , чем у мышей с гетерозиготами Tbx3 [57].Это исследование также показало, что во время раннего развития зачатка молочных желез взаимодействие Tbx2 и Tbx3 опосредуется через p19Arf / p53-независимый путь.
Сигналы
Wnt являются критическими для индукции молочных желез, а трансгенные мыши, экспрессирующие антагонист Wnt Dkk1, в развивающемся эпителии, не продуцируют зачатков молочных желез [59]. Lef1 необходим для образования зачатков 2 и 3 молочных желез [60]. Другой зачаток (1, 4 и 5) формируется у мышей Lef1 -null и затем не может продвигаться дальше E13.5 стадия бутона. Агрегаты Wnt-экспрессирующих эпителиальных и мезенхимальных клеток обнаруживаются в презумптивной области молочной железы у эмбрионов E10.5 [17,61]. Плакоды молочных желез, по-видимому, образуются из агрегации эпителиальных клеток, экспрессирующих по крайней мере один Wnt, включая Wnt10b, , который, по-видимому, соединяет формирующийся зачаток 2, 3, 4 и 5 вдоль молочной линии [16,17,62]. Кажется правдоподобным, что эти Wnt-экспрессирующие / Lef1-чувствительные клетки являются мишенями для мезенхимальных сигналов, генерируемых Tbx3 и Fgf10 вдоль предполагаемой линии молочных желез, или что эти сигналы индуцируют экспрессию Wnt в этих эпителиальных клетках вдоль участков, где молочные железы форма зачатка.Однако идентичность Wnt или Wnts , участвующих в индуктивных событиях в молочных железах, неизвестна, как и требуется ли экспрессия Wnt в эпителиальных или мезенхимальных клетках или в обоих [17].
Wnts, которые, вероятно, участвуют в спецификации и раннем морфогенезе молочных желез, такие как Wnt3a, Wnt6, и Wnt10b, также генетически изменены в MMTV-индуцированных опухолях молочной железы [17,63]. WNT3A, WNT4, WNT6, WNT8B, WNT9A, и WNT10B все сверхэкспрессируются во многих клеточных линиях рака молочной железы [64].Эти WNT передают сигнал через канонический путь передачи сигналов WNT / β-catenin. Сверхэкспрессия β-catenin и CyclinD1 наблюдается в некоторых линиях клеток рака молочной железы и в большом проценте случаев рака молочной железы, но не в эпителиальных клетках молочной железы человека, что указывает на то, что каноническая передача сигналов WNT / β-catenin активируется во время канцерогенеза [65]. WNT1, WNT4, и компоненты пути Wnt AXIN2 и LEF1 активируются при раке груди [66]. Рецепторы Frizzled 1 и 2 (FZD1 и FZD2) также сверхэкспрессируются при раке груди [67], а высокая активность β-катенина значительно коррелирует с плохим прогнозом у пациентов с раком груди [65].Увеличение передачи сигналов WNT1 в эпителиальных клетках молочной железы человека запускает ответ на повреждение ДНК и способствует опухолевой конверсии посредством Notch-зависимого процесса [66]. Хотя мутации в вышестоящих сигнальных компонентах WNT не наблюдались при раке груди, инактивирующие мутации APC наблюдаются в некоторых опухолях груди человека, и они, вероятно, увеличивают стабильность β-catenin [68]. Хотя о таких мутациях у человека не сообщалось, мышиные модели, которые экспрессируют стабилизированный β-catenin (путем мутации N-терминального домена) в просветных или миоэпителиальных клетках молочных желез, образуют карциномы молочных желез [69,70].
антагонисты WNT могут действовать как опухолевые супрессоры и вызывать конститутивную активацию передачи сигналов WNT при мутации; сниженная экспрессия секретируемых ингибиторов WNT SFRP1 и WIF1 наблюдалась при раке груди [71–73]. Недавнее исследование 24 первичных форм рака молочной железы показало, что 67% были аберрантно метилированы в промоторе WIF1; это коррелировало со снижением экспрессии в образцах опухоли по сравнению с нормальной тканью [73]. Подавление экспрессии SFRP1 также наблюдается в значительной части инвазивного рака груди и часто происходит из-за аберрантного гиперметилирования промотора [74,75]. SFRP1 инактивация при раке груди связана с плохим прогнозом [75,76].
Модели мышей MMTV-Wnt1 и MMTV-Wnt10b демонстрируют преждевременное развитие долек-альвеол, так что концы протоков проявляют фенотипы, сходные с теми, которые обычно наблюдаются во время беременности у небеременных самок и самцов мышей [77,78]. У этих мышей гиперплазии и аденокарциномы развиваются с очень высокой частотой и с коротким латентным периодом. Трансгенные мыши с промотором MMTV-LTR , управляющим активированной формой β-catenin, обладают сходным фенотипом и подтверждают представление о том, что онкогенные пути WNT действуют через β-catenin [79].Одним из возможных объяснений наблюдаемых агрессивных фенотипов опухолей является то, что опухоли MMTV-Wnt содержат увеличенную популяцию предшественников / стволовых клеток [21,80]. Было высказано предположение, что индуцированная WNT амплификация предшественников, вероятно, является ключевым событием в инициации опухоли [81]. Новые терапевтические стратегии могут быть разработаны путем нацеливания на пути, которые модулируют популяции предшественников в молочной железе.
Мутация scaramanga (ska) является полезной моделью для выяснения молекулярных механизмов, которые управляют спецификацией фенотипа молочной железы.Мутация ska нарушает некоторые из самых ранних аспектов развития молочных желез [82,83]. Зачаток 3 часто не формируется или гипопластичен, а эктопические зачатки молочных желез формируются рядом с зачатком 4 с высокой частотой. Наблюдаются также более тонкие дефекты размера, формы и положения зачатка молочной железы, так что стереотипное положение пяти пар молочных зачатков редко наблюдается, когда маркеры зачатков молочных желез используются для визуализации зародышевых зачатков. Фенотипы молочной железы, наблюдаемые у мутантов ska , согласуются с аномальными индуктивными событиями, происходящими до морфологического появления зачатка молочной железы.
Позиционное клонирование идентифицировало ген, пораженный у мутантов scaramanga ( ska) , как Neuregulin3 ( Nrg3 ) [61]. Nrg3 является плохо охарактеризованным членом важной сигнальной сети и экспрессируется при некоторых преинвазивных и инвазивных формах рака груди [84,85]. Nrg3 кодирует фактор роста, который связывает и активирует рецептор тирозинкиназы Erbb4 [86]. Erbb4 регулирует как пролиферацию клеток, так и терминальную дифференцировку в молочных железах [87–89].Предпочтительным партнером по гетеродимеризации для Erbbs (включая Erbb4) является Erbb2, который имеет глубокие связи с раком груди и который терапевтически нацелен с положительными клиническими результатами [90]. Erbb4 также модулирует миграцию клеток в развивающейся нервной системе. Nrg3 экспрессируется в переднем мозге крыс вместе со многими др. Связанными с Egf лигандами, а миграция и размещение нейробластов в переднем мозге крыс опосредуется Erbb4 [91]. Передача сигналов Erbb4 контролирует индуцированную Nrg1β1 миграцию в нейральных клетках-предшественниках, а также опосредует организацию и пролиферацию клеток в субвентрикулярной зоне, нейрогенной области переднего мозга взрослого человека [92,93].Другой лиганд для Erbb4, Nrg1, может индуцировать миграцию рака груди, меланомы и клеток in vitro [94,95]. Следовательно, вероятно, что контроль миграции предшественников эпителия молочных желез модулируется с помощью передачи сигналов Nrg-Erbb.
Локализованная экспрессия Nrg3 в презумптивной области молочных желез до морфологического появления зачатков и экспрессия эпителиальных маркеров зачатков предполагает индуктивную роль. Молочные зачатки появляются в сайтах, где локализуются Fgf10, Tbx3, и Wnt и Nrg3 , Erbb4 (т.е.е., вдоль линии молочной железы) в латеральной пластинке и покрывающей ее мезодерме (Рисунок 3). Эта совпадающая экспрессия Tbx3, Fgf10, Nrg3, и Wnts в эмбриональной мезенхиме происходит непосредственно перед определением от эмбриональной эктодермы к эпителию молочных желез, а не остается простой эпителиальной судьбой. Эктопические плакоды молочных желез могут быть индуцированы в культурах эксплантатов путем размещения пропитанных rNrg3-Egf шариков рядом с плотной мезенхимой вдоль линии молочных желез, которая маркируется экспрессией Fgf10, Tbx3 и Wnts .Эти результаты показывают, что Nrg3 является сигналом спецификации для молочных желез [61].
Похоже, что индукционная мезенхима линии молочных желез (которая представляет собой ткань из предполагаемой области молочной железы, которая экспрессирует Tbx3, Fgf10, и Nrg3 ), в сочетании с другим эпителием (которые экспрессируют Fgfr2B и Erbb рецепторов). Как сигналы от Fgf10 и Tbx3 (и, возможно, мезенхимальных Wnts) передаются от латеральной пластинки мезодермы к популяции предшественников эпителия, неизвестно, но Nrg3 является привлекательным кандидатом для передачи этого сигнала (Рис. 4).На стадиях, предшествующих морфологическому появлению зачатка, Nrg3 локализуется в мезенхиме, прилегающей к будущему участку зачатка (стадия сомита 35–47). На стадии, когда плакода 3 изначально выявляется с помощью сканирующей электронной микроскопии (стадия 47 сомитов), Nrg3 сначала экспрессируется на базальном крае эпителия зачатка, а позже все клетки собственно эпителиального зачатка молочных желез экспрессируют Nrg3. Erbb4 и Erbb4 экспрессируются аналогичным образом. Экспрессия Erbb2 также экспрессируется в эпителии и мезенхиме ранних зачатков молочных желез, прежде чем ограничиться зачатком.Пропитанные Fgf10 шарики, имплантированные в эксплантированные эмбрионы мыши, не влияли на экспрессию Lef1 или морфологию эпидермиса [15]. Следовательно, вероятно, что для передачи сигналов, генерируемых Fgf10, необходимы другие факторы. Когда пропитанные Fgf8 шарики имплантировали в эксплантированные эмбрионы мыши, наблюдалась повышенная экспрессия как Tbx3 , так и Lef1 в окружающей мезенхиме, но не было морфологических изменений в эпителии [53]. В то время как зачаток молочных желез изначально виден, экспрессия Tbx3 сдвигается с мезенхимы линии молочных желез на эпителиальный компонент [53].Наблюдалось увеличение как эпителиальной, так и мезенхимальной передачи сигналов Wnt у Wnt репортерных мышей, когда пропитанные rNrg3 шарики имплантировали в эксплантированные мышиные эмбрионы после 24 часов культивирования [61]. Кроме того, эпителиальные агрегаты часто обнаруживаются рядом с пропитанными Nrg3 гранулами, это указывает на то, что эктопическая экспрессия Nrg3 может влиять на инициацию образования зачатка молочных желез. Эти функциональные исследования и локализация экспрессии Nrg3 между сайтами экспрессии Fgf10 и Tbx3 в мезодерме латеральной пластинки и вышележащих эпителиальных клетках, экспрессирующих Wnt, подтверждают модель, согласно которой Nrg3 передает сигналы ниже Tbx3 и Fgf10 в вышележащий эпителий, чтобы влиять на их локальную агрегацию [61] (Рисунок 4).Хотя эта модель полезна в качестве гипотезы, она явно упрощена, поскольку явно задействованы другие факторы. Tbx3 и Fgf10 могут влиять на передачу сигналов Wnt независимо от Nrg3. Генетические иерархии и точные отношения между Fgf10, Nrg3, Tbx3 и Wnts еще предстоит полностью выяснить, как и роль каждого из них в эпителиальном и мезенхимальном компартментах.
Рисунок 4. Модель образования зачатка молочной железы и определения клеточной судьбы
Эта модель основана на функциональных исследованиях, а также на моделях экспрессии Fgf10, Nrg3, Tbx3, и Wnts в предполагаемой области молочной железы между E10 и E11 при инициации. вероятны процессы.Генерируются неизвестные осевые сигналы, так что зачаток молочных желез возникает в определенных местах вдоль передне-задней, дорсально-вентральной оси. Речь идет о других факторах, и генетические требования, вероятно, будут различаться для каждой из пяти пар зачатков. Например, Fgf10 не требуется для начального образования зачатка 4, поэтому эта упрощенная модель применима к зачатку 1, 2, 3 и 5.
https://doi.org/10.1371/journal.pgen.0020112.g004
Было продемонстрировано различное влияние дефицита Fgf10, Lef1, и Tbx3 как на зачаток молочной железы, так и на развитие специфического зачатка в протоке [15, 57,60].Как эти и другие гены вносят вклад в формирование специфического зачатка вдоль оси тела, не совсем понятно, но становится все более очевидным, что разные гены регулируют начальное образование отдельного зачатка [16]. Сайт между зачатком 3 и 4, по-видимому, очень чувствителен к уровням фактора роста, как показали исследования моделей мышей Nrg3 и Eda-A1 [96]. Временная последовательность начальной экспрессии разных генов в каждом зачатке эпителия молочных желез не идентична, также подтверждая, что каждый может вносить вклад в начальное образование зачатка вдоль оси тела по-разному [15,53,57].Также неизвестно, как осевые сигналы передаются к будущим участкам зачатка молочной железы. Экспрессия основных регуляторов самых ранних стадий морфогенеза молочных желез динамична, и в случае Tbx3 и Nrg3, переключаются с мезенхимы на эпидермис в то время, когда зачаток изначально очевиден. Изменение экспрессии может отражать сдвиг к отдельным функциям этих генов на более поздних стадиях морфогенеза молочных желез.
Eda and Edar
Мутации в компонентах пути эктодисплазина приводят к эктодермальной дисплазии как у людей, так и у мышей [97].В дополнение к аномалиям кожи, волос, зубов и потовых желез, гипогидротическая эктодермальная дисплазия иногда связана с отсутствием сосков [98]. Tabby и downless — модели мышей с мутациями в Eda и Edar, соответственно. Первоначальное образование зачатка молочной железы, по-видимому, протекает нормально в этих моделях, хотя ни одна из них еще не была тщательно проанализирована (Marja Mikkola, личное сообщение). Модель на мышах K14-Eda-A1 демонстрирует развитие эктопического эпителиального зачатка молочной железы и, вероятно, обеспечивает молекулярную связь между результатами, наблюдаемыми в различных моделях мышей, описанных выше, которые демонстрируют аномальную индукцию молочной железы [96,99].У мышей K14-Eda-A1 пять эндогенных пар молочных зачатков развиваются в своих стереотипных положениях. Дополнительные зачатки молочных желез и соски также развиваются вдоль «линии молочных желез» и в основном между участками зачатков 3 и 4. Eda является мишенью передачи сигналов Wnt, а Lef1 связывается с участком внутри промотора Eda , увеличивая транскрипцию ген [100]. Eda-A1, вариант сплайсинга, продукт которого связывает Edar, как полагают, способствует участию плакод, поскольку в этой модели на мышах также наблюдаются дополнительные зубы и увеличенные волосяные фолликулы.Передача сигналов через Eda-A1 и Edar опосредуется NF-κB, который часто аномально активируется при раке груди [101] .
Other Genetic Pathways
Многие другие генетические пути способствуют раннему развитию зачатка молочных желез. Эпителий не может расслаиваться, и зачатки молочных желез или др. Эпидермальные придатки не образуются у мышей p63 -null [102,103]. p63 регулирует несколько сигнальных путей, необходимых для развития эпидермиса. β -catenin и Fgr2b подавляются в эпителии p63 -null, что может объяснять затрудненный морфогенез молочных желез [104].Небольшое утолщение эпителия происходит у мышей, у которых как Msx1 , так и Msx2 инактивированы, но не имеют отчетливых форм зачатка молочных желез. Инактивация либо Msx1 , либо Msx2 сама по себе не влияет на образование зачатка [105]. И Msx1 , и Msx2 могут активировать экспрессию CyclinD1 [106]. Передача сигналов Notch действует на клетки-предшественники молочных желез и способствует самообновлению и клон-специфической дифференцировке судьбы миоэпителия [107].Ежики также участвуют в самообновлении и поддержании популяции предшественников молочных желез [108]. Исследования ролей Ihh и Shh в развитии зачатка молочных желез показывают, что они не требуются или что генетическая избыточность может скрывать эффекты потери того или другого [20,109]. Gli3 xt мышей, нулевой аллель Gli3 (фактор транскрипции, который формирует компонент пути Hh), неспособны формировать зачатки 3 и 5 [110].Передача сигналов Hh, по-видимому, блокируется у мышей Lef1 -null, поскольку экспрессия Ptch2 (который является одновременно рецептором Hh и транскрипционной мишенью Hh) снижается в мезенхиме молочной железы мышей Lef1 -null [60] . Недавнее исследование экспрессии SHH, PTCh2 и GLI1 в 52 раковых опухолях молочной железы показало, что эти компоненты пути Hh часто активируются по сравнению с соседней нормальной тканью [111].
Передача сигналов Nodal регулирует многие процессы развития, включая дифференцировку, формирование зародышевых листков и спецификацию переднезадней и лево-правой осей и средней линии эмбриона [112].Nodal действует через путь TGF-β / активин, связываясь с Acvr2b, рецептором активина типа II. Cripto действует как важный кофактор для пути Nodal. Cripto -null мыши лишены примитивной полоски и неспособны формировать мезодерму [113], фенотип, общий для мышей, лишенных Acvr1b, Acvr2a, Acvr2b, или Nodal . CRIPTO сверхэкспрессируется в карциномах груди, яичников, желудка, легких и поджелудочной железы [114]. И Cripto , и Nodal экспрессируются в недифференцированных ES-клетках человека и мыши и, как полагают, способствуют поддержанию плюрипотентности [115,116].Cripto и Nodal оба являются кандидатами в морфогены молочных желез, хотя ранние эмбриональные летальные фенотипы запрещают изучение фенотипов зачатков молочных желез [117].
Похоже, что окно развития существует, когда мезенхима экспрессирует факторы, которые необходимы для передачи судьбы эпителия молочных желез избранной группе недифференцированного эпителия. Неясно, как именно сходятся сигнальные пути, чтобы вызвать программу развития эпителия молочных желез. Выяснение генетической иерархии и способа взаимодействия различных сигнальных молекул в контексте спецификации молочной железы позволит интегрировать пути, которые, как известно, не регулируются при раке груди человека [4,12,33,38,54,56,77,111,118–123 ].
Заключение
Лучшее понимание генетических путей, вовлеченных в ранний морфогенез молочной железы, вероятно, будет иметь серьезные последствия для рака груди. Дальнейшее определение сигналов, которые запускают дифференцировку молочных желез, должно проложить путь для разработки новых терапевтических и профилактических стратегий. По мере открытия большего количества маркеров стволовых клеток молочной железы и анализа генетических моделей раннего морфогенеза молочных желез вопрос о том, как можно выбрать недифференцированную эпидермальную клетку, чтобы она стала строительным блоком для одного из самых интересных органов, станет все ближе к ответу.
Дополнительная информация
Регистрационный номер
Национальный центр биотехнологической информации EntrezGene (http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=gene) номера доступа для генов и белков, обсуждаемых в этой статье: Acvr1b (11479 ), Acvr2a (11480), Acvr2b (11481 ) , APC (324), AXIN2 (8313), β-катенин (1499), CRIPTO (6997), 12627), CyclinD1 (595), CyclinD1 (12443), dHand (15111), Dkk1 (13380), Eda (13607), Edar (13608), Erbb2 (138664) ( Erbb) 13869), Fgf3 (14174), Fgf4 (14175), Fgf8 (14179), FGF10 (2255), FGF10 (14165), FGFR1 (14182), 14182 (22) FGFR1 (22) Fgfr2b (14183), FGFR2 (2263), FGFR4 (2264 ) , FZD1 (8321), FZD2 (2535), GLI1 (2735), Gli3 (1463414), (16h) LEF1 9072 6 (51176), Lef1 (16842), Mdm2 (17246), Mmp3 (17392), Msx1 (17701), Msx2 (17702), NF-κB (4790), Nodal (18119), Nodal (18119) NRG1 (3084), Nrg1 (112400), Nrg3 (18183), p14 (ARF) (1029), p19Arf (12578), p53 (22059), p63 (22061), Ptch2 (19206), PTCh2 (5727 ), PthrP (19227), SFRP1 (6422), SHH (6469), Shh (20423), TBX3 (6926), Tbx3 (21386), WIF1 (11257) WNT1 (7471), Wnt1 (22408), WNT3A (89780), Wnt3a ( 22416), WNT4, (54361), WNT6 (7475256), WNT8B (7479), WNT9A (7483), WNT10B (7480) и Wnt10b (22410).
Благодарности
Мы благодарим Мэтта Смолли за обсуждение и критическое чтение рукописи, а также анонимных рецензентов за полезные комментарии.
Авторские взносы
BH и AA написали статью.
Ссылки
- 1.
Сакакура Т. (1987) Эмбриогенез молочных желез. В: Невилл М.С., Даниэль К.В., редакторы. Молочная железа: развитие, регуляция и функция. Нью-Йорк: Пленум Пресс. С. 37–66. С. - 2.Kratochwil K (1969) Органная специфичность в индукции мезенхимы продемонстрирована в эмбриональном развитии молочной железы мыши. Дев Биол 20: 46–71.
- 3.
Kratochwil K (1986) Комбинация тканей и исследования органной культуры в развитии эмбриональной молочной железы. Дев Биол (Нью-Йорк, 1985) 4: 315–333. - 4.
Propper AY (1978) Блуждающие эпителиальные клетки молочной линии зародыша кролика. Предварительное исследование на сканирующем электронном микроскопе.Дев Биол 67: 225–231. - 5.
Балинский Б. (1949–1950)) О процессах развития в молочных железах и других структурах эпидермиса. Trans R Soc Edin 62: 1–31. - 6.
Балинский Б.И. (1950) О пренатальном росте зачатка молочной железы у мышей. J Anat 84: 227–235. - 7.
Fuchs E, Raghavan S (2002) Попадание под кожу эпидермального морфогенеза. Нат Рев Генет 3: 199–209. - 8.
Pispa J, Thesleff I (2003) Механизмы эктодермального органогенеза.Дев Биол 262: 195–205. - 9.
Ханахан Д., Вайнберг Р.А. (2000) Признаки рака. Ячейка 100: 57–70. - 10.
Хоган Б.Л. (1999) Морфогенез. Ячейка 96: 225–233. - 11.
Hens JR, Wysolmerski JJ (2005) Ключевые этапы развития молочной железы: молекулярные механизмы, участвующие в формировании эмбриональной молочной железы. Рак молочной железы Res 7: 220–224. - 12.
Робинсон GW (2004) Идентификация сигнальных путей в раннем развитии молочных желез с помощью генетики мышей.Рак молочной железы Res 6: 105–108. - 13.
Parmar H, Cunha GR (2004) Эпителиально-стромальные взаимодействия в молочной железе мыши и человека in vivo. Endocr Relat Cancer 11: 437–458. - 14.
Veltmaat JM, Mailleux AA, Thiery JP, Bellusci S (2003) Эмбриональный маммогенез мышей как модель молекулярной регуляции формирования паттерна. Дифференциация 71: 1–17. - 15.
Mailleux AA, Spencer-Dene B., Dillon C, Ndiaye D, Savona-Baron C, et al.(2002) Роль передачи сигналов FGF10 / FGFR2b во время развития молочной железы у эмбриона мыши. Развитие 129: 53–60. - 16.
Veltmaat JM, Van Veelen W, Thiery JP, Bellusci S (2004) Идентификация линии молочных желез у мышей по экспрессии Wnt10b. Дев Дин 229: 349–356. - 17.
Chu EY, Hens J, Andl T., Kairo A, Yamaguchi TP, et al. (2004) Каноническая передача сигналов WNT способствует развитию молочных плакод и важна для инициации морфогенеза молочных желез.Развитие 131: 4819–4829. - 18.
Deome KB, Faulkin LJ Jr, Bern HA, Blair PB (1959) Развитие опухолей молочной железы из гиперпластических альвеолярных узлов, трансплантированных в жировые подушечки молочных желез самок мышей C3H. Cancer Res 19: 515–520. - 19.
Джексон-Фишер А.Дж., Беллинджер Дж., Рамабхадран Р., Моррис Дж. К., Ли К. Ф. и др. (2004) ErbB2 необходим для морфогенеза протоков молочной железы. Proc Natl Acad Sci U S A 101: 17138–17143. - 20.Gallego MI, Beachy PA, Hennighausen L, Robinson GW (2002) Дифференциальные требования для shh в ткани молочной железы и морфогенезе волосяного фолликула. Дев Биол 249: 131–139.
- 21.
Шеклтон М., Вайллант Ф., Симпсон К.Дж., Стингл Дж., Смит Г.К. и др. (2006) Создание функциональной молочной железы из одной стволовой клетки. Природа 439: 84–88. - 22.
Стингл Дж., Эйрев П., Рикетсон И., Шеклтон М., Вайллант Ф. и др. (2006) Очистка и уникальные свойства эпителиальных стволовых клеток молочной железы.Природа 439: 993–997. - 23.
Смолли М., Эшворт А. (2003) Стволовые клетки и рак груди: поле в пути. Нат Рев Рак 3: 832–844. - 24.
Аль-Хадж М., Вича М.С., Бенито-Эрнандес А., Моррисон С.Дж., Кларк М.Ф. (2003) Проспективная идентификация онкогенных клеток рака молочной железы. Proc Natl Acad Sci U S A 100: 3983–3988. - 25.
Young LJ, Medina D, DeOme KB, Daniel CW (1971) Влияние возраста хозяина и тканей на продолжительность жизни и скорость роста последовательно пересаженных молочных желез мышей.Exp Gerontol 6: 49–56. - 26.
Daniel CW, Young LJ, Medina D, DeOme KB (1971) Влияние маммогенных гормонов на последовательно пересаженную молочную железу мыши. Exp Gerontol 6: 95–101. - 27.
ван Гендерен С., Окамура Р.М., Фаринас И., Куо Т.Г., Парслоу Т.Г. и др. (1994) Развитие нескольких органов, которые нуждаются в индуктивных эпителиально-мезенхимальных взаимодействиях, нарушено у мышей с дефицитом LEF-1. Genes Dev 8: 2691–2703. - 28.
Wysolmerski JJ, Philbrick WM, Dunbar ME, Lanske B, Kronenberg H, et al.(1998) Спасение мышей с нокаутом белка, связанного с паратироидным гормоном, демонстрирует, что белок, связанный с паратироидным гормоном, необходим для развития молочной железы. Развитие 125: 1285–1294. - 29.
Фоли Дж., Данн П., Хонг Дж., Косгроув Дж., Дрейер Б. и др. (2001) Белок, связанный с паратироидным гормоном, поддерживает судьбу эпителия молочных желез и запускает дифференцировку кожи сосков во время эмбрионального развития груди. Развитие 128: 513–525. - 30.
Sakakura T, Nishizuka Y, Dawe CJ (1976) Зависимый от мезенхимы морфогенез и эпителиоспецифическая цитодифференцировка в молочной железе мыши.Science 194: 1439–1441. - 31.
Сакакура Т., Сакагами Ю., Нишизука Ю. (1979) Устойчивость реакции молочной железы взрослой мыши на индукцию эмбриональной мезенхимой. Дев Биол 72: 201–210. - 32.
Кунья Г.Р., Янг П., Христов К., Гусман Р., Нанди С. и др. (1995) Фенотипическая экспрессия молочной железы, индуцированная в эпидермальных клетках эмбриональной мезенхимой молочной железы. Acta Anat (Базель) 152: 195–204. - 33.
Propper A, Gomot L (1967) Взаимодействия тканей во время органогенеза молочной железы у эмбриона кролика.C R Acad Sci Hebd Seances Acad Sci D 264: 2573–2575. - 34.
Cunha GR, Hom YK (1996) Роль мезенхимно-эпителиальных взаимодействий в развитии молочных желез. J Mammary Gland Biol Neoplasia 1: 21–35. - 35.
Канадзава Т., Хосик Х.Л. (1992) Трансформированный фенотип роста эпителия молочной железы мыши в первичной культуре, индуцированный специфическими мезенхимами плода. J Cell Physiol 153: 381–391. - 36.
MacArthur CA, Shankar DB, Shackleford GM (1995) Fgf-8, активированный провирусной вставкой, взаимодействует с трансгеном Wnt-1 при онкогенезе молочной железы мышей.J Virol 69: 2501–2507. - 37.
Shackleford GM, MacArthur CA, Kwan HC, Varmus HE (1993) Инфекция вируса опухоли молочной железы мыши ускоряет канцерогенез молочной железы у трансгенных мышей Wnt-1 путем инсерционной активации int-2 / Fgf-3 и hst / Fgf-4. Proc Natl Acad Sci U S A 90: 740–744. - 38.
Теодору В., Бур М., Вайгельт Б., Йонкерс Дж., Ван дер Валк М. и др. (2004) Fgf10 представляет собой онкоген, активируемый инсерционным мутагенезом MMTV в опухолях молочной железы мышей и сверхэкспрессируемый в субпопуляции карцином молочной железы человека.Онкоген 23: 6047–6055. - 39.
Аднан Дж., Годрей П., Дионн К.А., Крамли Дж., Джей М. и др. (1991) BEK и FLG, два рецептора для членов семейства FGF, амплифицируются в подмножествах рака молочной железы человека. Онкоген 6: 659–663. - 40.
Penault-Llorca F, Bertucci F, Adelaide J, Parc P, Coulier F и др. (1995) Экспрессия генов рецепторов FGF и FGF при раке груди человека. Int J Cancer 61: 170–176. - 41.
Тейе С., Аделаида Дж., Луасон Дж., Бонне-Дорион Ф., Жакемье Дж. И др.(1993) гены FGFRI и PLAT и амплификация ДНК на 8p12 при раке груди и яичников. Гены Хромосомы Рак 7: 219–226. - 42.
Яаккола С., Салмикангас П., Нюлунд С., Партанен Дж., Армстронг Е. и др. (1993) Амплификация гена fgfr4 при раке груди и гинекологии человека. Int J Cancer 54: 378–382. - 43.
Хейсканен М., Кононен Дж., Барлунд М., Торхорст Дж., Заутер Дж. И др. (2001) Анализ CGH, кДНК и тканевых микроматриц указывает на то, что амплификация FGFR2 связана с небольшой подгруппой опухолей молочной железы.Патол анальных клеток 22: 229–234. - 44.
Бертуччи Ф., Ульгатт Р., Бензиан А., Гранжо С., Аделаида Дж. И др. (2000) Профили экспрессии генов первичной карциномы молочной железы с использованием массивов генов-кандидатов. Hum Mol Genet 9: 2981–2991. - 45.
Gerwins P, Skoldenberg E, Claesson-Welsh L (2000) Функция факторов роста фибробластов и факторов роста эндотелия сосудов и их рецепторов в ангиогенезе. Crit Rev Oncol Hematol 34: 185–194. - 46.Suyama K, Shapiro I, Guttman M, Hazan RB (2002) Путь передачи сигналов, ведущий к метастазированию, контролируется N-кадгерином и рецептором FGF. Cancer Cell 2: 301–314.
- 47.
Koziczak M, Holbro T, Hynes NE (2004) Блокирование передачи сигналов FGFR ингибирует пролиферацию клеток рака груди за счет подавления циклинов D-типа. Онкоген 23: 3501–3508. - 48.
Xian W, Schwertfeger KL, Vargo-Gogola T, Rosen JM (2005) Плейотропные эффекты FGFR1 на пролиферацию, выживание и миграцию клеток в трехмерной модели эпителиальных клеток молочной железы.J Cell Biol 171: 663–673. - 49.
Велм Б.Е., Фриман К.В., Чен М., Контрерас А., Спенсер Д.М. и др. (2002) Индуцибельная димеризация FGFR1: Разработка модели на мышах для анализа прогрессивной трансформации молочной железы. J Cell Biol 157: 703–714. - 50.
Rowley M, Grothey E, Couch FJ (2004) Роль Tbx2 и Tbx3 в развитии молочных желез и онкогенезе. J Mammary Gland Biol Neoplasia 9: 109–118. - 51.
Bamshad M, Lin RC, Law DJ, Watkins WC, Krakowiak PA, et al.(1997) Мутации в TBX3 человека изменяют конечность, апокринное и генитальное развитие при локтевом-молочном синдроме. Нат Генет 16: 311–315. - 52.
Davenport TG, Jerome-Majewska LA, Papaioannou VE (2003) Дефекты молочной железы, конечностей и желточного мешка у мышей, лишенных Tbx3, гена, мутировавшего при синдроме локтевой молочной железы человека. Разработка 130: 2263–2273. - 53.
Eblaghie MC, Song SJ, Kim JY, Akita K, Tickle C и др. (2004) Взаимодействие между сигналами FGF и Wnt и экспрессией гена Tbx3 в инициации молочной железы у эмбрионов мышей.Дж Анат 205: 1–13. - 54.
Rallis C, Del Buono J, Logan MP (2005) Tbx3 может изменять положение конечностей вдоль рострокаудальной оси развивающегося эмбриона. Разработка 132: 1961–1970. - 55.
Fan W, Huang X, Chen C, Gray J, Huang T (2004) TBX3 и его изоформа TBX3 + 2a функционально отличаются ингибированием старения и сверхэкспрессируются в подмножестве клеточных линий рака молочной железы. Cancer Res 64: 5132–5139. - 56.
Lomnytska M, Dubrovska A, Hellman U, Volodko N, Souchelnytskyi S (2006) Повышенная экспрессия cSHMT, Tbx3 и утрофина в плазме пациентов с раком яичников и молочной железы.Int J Cancer 118: 412–421. - 57.
Джером-Маевска Л.А., Дженкинс Г.П., Эрнстофф Э., Зинди Ф., Шерр С.Дж. и др. (2005) Tbx3, ген локтевого-молочного синдрома, и Tbx2 взаимодействуют в развитии молочных желез посредством p19Arf / p53-независимого пути. Дев Дин 234: 922–933. - 58.
Brummelkamp TR, Kortlever RM, Lingbeek M, Trettel F, MacDonald ME, et al. (2002) TBX-3, ген, мутировавший при ульнарно-молочном синдроме, является негативным регулятором p19ARF и ингибирует старение.J Biol Chem 277: 6567–6572. - 59.
Andl T, Reddy ST, Gaddapara T, Millar SE (2002) Сигналы WNT необходимы для инициации развития волосяного фолликула. Dev Cell 2: 643–653. - 60.
Boras-Granic K, Chang H, Grosschedl R, Hamel PA (2006) Lef1 необходим для перехода передачи сигналов Wnt от мезенхимальных к эпителиальным клеткам в эмбриональной молочной железе мышей. Дев Биол 295: 219–231. - 61.
Howard B, Panchal H, McCarthy A, Ashworth A (2005) Идентификация гена скараманга вовлекает Neuregulin3 в спецификацию молочной железы.Гены Дев 19: 2078–2090. - 62.
Christiansen JH, Dennis CL, Wicking CA, Monkley SJ, Wilkinson DG, et al. (1995) Wnt-11 и Wnt-12 мышей имеют ограниченные во времени и пространстве паттерны экспрессии во время эмбрионального развития. Mech Dev 51: 341–350. - 63.
Каллахан Р. (1996) Мутации, вызванные MMTV, в опухолях молочной железы мышей: их потенциальное значение для рака груди человека. Лечение рака груди 39: 33–44. - 64.
Benhaj K, Akcali KC, Ozturk M (2006) Избыточная экспрессия канонических лигандов Wnt в клеточных линиях рака груди человека.Онкол Реп 15: 701–707. - 65.
Lin SY, Xia W, Wang JC, Kwong KY, Spohn B и др. (2000) Бета-катенин, новый прогностический маркер рака груди: его роль в экспрессии циклина D1 и прогрессировании рака. Proc Natl Acad Sci U S A 97: 4262–4266. - 66.
Ayyanan A, Civenni G, Ciarloni L, Morel C, Mueller N, et al. (2006) Повышенная передача сигналов Wnt запускает онкогенное преобразование эпителиальных клеток молочной железы человека по Notch-зависимому механизму. Proc Natl Acad Sci U S A 103: 3799–3804. - 67.
Милованович Т., Планутис К., Нгуен А., Марш Дж. Л., Лин Ф. и др. (2004) Экспрессия генов Wnt и рецепторов Frizzled 1 и 2 в нормальном эпителии молочной железы и инфильтрирующей карциноме молочной железы. Int J Oncol 25: 1337–1342. - 68.
Фуруучи К., Тада М., Ямада Х., Катаока А., Фуруучи Н. и др. (2000) Соматические мутации гена APC при первичном раке груди. Am J Pathol 156: 1997–2005. - 69.
Imbert A, Eelkema R, Jordan S, Feiner H, Cowin P (2001) Delta N89 beta-catenin вызывает преждевременное развитие, дифференцировку и неоплазию в молочной железе.J Cell Biol 153: 555–568. - 70.
Teuliere J, Faraldo MM, Deugnier MA, Shtutman M, Ben-Ze’ev A, et al. (2005) Направленная активация передачи сигналов бета-катенина в базальных эпителиальных клетках молочных желез влияет на развитие молочных желез и приводит к гиперплазии. Развитие 132: 267–277. - 71.
Уголини Ф., Шараф-Жауффрет Э., Барду В.Дж., Дженикс Дж., Аделаида Дж. И др. (2001) Путь WNT и канцерогенез молочной железы: потеря экспрессии гена-кандидата опухолевого супрессора SFRP1 в большинстве инвазивных карцином, за исключением медуллярного типа.Онкоген 20: 5810–5817. - 72.
Wissmann C, Wild PJ, Kaiser S, Roepcke S, Stoehr R и др. (2003) WIF1, компонент пути Wnt, подавляется при раке простаты, груди, легких и мочевого пузыря. Дж. Патол 201: 204–212. - 73.
Ай Л., Тао Кью, Чжун С., Филдс С.Р., Ким В.Дж. и др. (2006) Инактивация экспрессии Wnt-ингибиторного фактора-1 (WIF1) посредством эпигенетического молчания — обычное явление при раке молочной железы. Канцерогенез 27: 1341–1348. - 74.Lo PK, Mehrotra J, D’Costa A, Fackler MJ, Garrett-Mayer E, et al. (2006) Эпигенетическое подавление экспрессии секретируемого родственного белка 1 (SFRP1) при раке груди человека. Cancer Biol Ther 5: 281–286.
- 75.
Veeck J, Niederacher D, An H, Klopocki E, Wiesmann F и др. (2006) Аберрантное метилирование антагониста Wnt SFRP1 при раке груди связано с неблагоприятным прогнозом. Онкоген 25: 3479–3488. - 76.
Klopocki E, Kristiansen G, Wild PJ, Klaman I, Castanos-Velez E, et al.(2004) Потеря SFRP1 связана с прогрессированием рака груди и плохим прогнозом при опухолях на ранних стадиях. Int J Oncol 25: 641–649. - 77.
Lane TF, Leder P (1997) Wnt-10b управляет гиперморфным развитием и трансформацией в молочных железах самцов и самок мышей. Онкоген 15: 2133–2144. - 78.
Tsukamoto AS, Grosschedl R, Guzman RC, Parslow T., Varmus HE (1988) Экспрессия гена int-1 у трансгенных мышей связана с гиперплазией молочных желез и аденокарциномами у самцов и самок мышей.Ячейка 55: 619–625. - 79.
Michaelson JS, Leder P (2001) Бета-катенин является последующим эффектором Wnt-опосредованного туморогенеза в молочной железе. Онкоген 20: 5093–5099. - 80.
Ли Й, Велм Б., Подсыпанина К., Хуанг С., Чаморро М. и др. (2003) Доказательства того, что трансгены, кодирующие компоненты пути передачи сигналов Wnt, преимущественно индуцируют рак молочной железы из клеток-предшественников. Proc Natl Acad Sci U S A 100: 15853–15858. - 81.
Liu BY, McDermott SP, Khwaja SS, Alexander CM (2004) Трансформирующая активность эффекторов Wnt коррелирует с их способностью индуцировать накопление клеток-предшественников молочной железы.Proc Natl Acad Sci U S A 101: 4158–4163. - 82.
Howard BA, Gusterson BA (2000) Характеристика мутанта мыши, у которого наблюдается аномальное развитие молочной железы. Геном мамм 11: 234–237. - 83.
Howard BA, Gusterson BA (2000) Формирование паттерна молочной железы в рекомбинантных инбредных штаммах AXB / BXA мышей. Mech Dev 91: 305–309. - 84.
Данн М., Синха П., Кэмпбелл Р., Блэкберн Е., Левинсон Н. и др. (2004) Совместная экспрессия нейрегулинов 1, 2, 3 и 4 при раке груди человека.Дж. Патол 203: 672–680. - 85.
Marshall C, Blackburn E, Clark M, Humphreys S, Gullick WJ (2005) Neuregulins 1–4 экспрессируются в цитоплазме или ядрах протоковой карциномы (in situ) груди человека. Лечение рака груди Res. С. 1–6. - 86.
Чжан Д., Сливковски М.Х., Марк М., Франц Дж., Акита Р. и др. (1997) Neuregulin-3 (NRG3): новый белок, обогащенный нервной тканью, который связывает и активирует ErbB4. Proc Natl Acad Sci U S A 94: 9562–9567. - 87.Sartor CI, Zhou H, Kozlowska E, Guttridge K, Kawata E, et al. (2001) Her4 опосредует лиганд-зависимые антипролиферативные и дифференцировочные ответы в клетках рака молочной железы человека. Mol Cell Biol 21: 4265–4275.
- 88.
Тидкомб Х., Джексон-Фишер А., Мазерс К., Стерн Д.Ф., Гассманн М. и др. (2003) Дефекты нервной системы и молочной железы у мышей с нокаутом ErbB4, генетически спасенные от эмбриональной летальности. Proc Natl Acad Sci U S A 100: 8281–8286. - 89.
Лонг В., Вагнер К.Ю., Ллойд К.С., Бинарт Н., Шиллингфорд Дж. М. и др.(2003) Нарушение дифференцировки и лактационная недостаточность Erbb4-дефицитных молочных желез идентифицируют ERBB4 как обязательного медиатора STAT5. Разработка 130: 5257–5268. - 90.
Holbro T, Civenni G, Hynes NE (2003) Рецепторы ErbB и их роль в прогрессировании рака. Exp Cell Res 284: 99–110. - 91.
Антон ES, Ghashghaei HT, Weber JL, McCann C, Fischer TM, et al. (2004) Рецепторная тирозинкиназа ErbB4 модулирует миграцию и размещение нейробластов в переднем мозге взрослого человека.Nat Neurosci 7: 1319–1328. - 92.
Gambarotta G, Garzotto D, Destro E, Mautino B, Giampietro C и др. (2004) Экспрессия ErbB4 в нейральных клетках-предшественниках (ST14A) необходима для опосредования миграции, индуцированной neuregulin-1beta1. J Biol Chem 279: 48808–48816. - 93.
Ghashghaei HT, Weber J, Pevny L, Schmid R, Schwab MH, et al. (2006) Роль взаимодействий нейрегулин-ErbB4 на пролиферацию и организацию клеток в субвентрикулярной зоне. Proc Natl Acad Sci U S A 103: 1930–1935. - 94.
Gordon-Thomson C, Jones J, Mason RS, Moore GP (2005) Рецепторы ErbB опосредуют как миграционную, так и пролиферативную активность в меланоцитах человека и клетках меланомы. Меланома Res 15: 21–28. - 95.
Луо Дж., Миллер М.В. (2000) Этанол усиливает erbB-опосредованную миграцию клеток рака груди человека в культуре. Лечение рака груди 63: 61–69. - 96.
Мустонен Т., Ильмонен М., Пуммила М., Кангас А.Т., Лауриккала Дж. И др. (2004) Ectodysplasin A1 способствует судьбе плакодных клеток во время раннего морфогенеза эктодермальных придатков.Развитие 131: 4907–4919. - 97.
Thesleff I, Mikkola ML (2002) Передача сигналов рецептора смерти, дающая жизнь эктодермальным органам. Научно-исследовательский институт STKE 2002: PE22. - 98.
Mikkola ML, Thesleff I (2003) Передача сигналов эктодисплазина в развитии. Фактор роста цитокинов Ред. 14: 211–224. - 99.
Мустонен Т., Писпа Дж., Миккола М.Л., Пуммила М., Кангас А.Т. и др. (2003) Стимуляция развития эктодермальных органов с помощью Ectodysplasin-A1. Дев Биол 259: 123–136. - 100.
Durmowicz MC, Cui CY, Schlessinger D (2002) Ген EDA является мишенью, но не регулирует передачу сигналов Wnt. Ген 285: 203–211. - 101.
Cao Y, Karin M (2003) NF-kappaB в развитии молочной железы и раке груди. J Mammary Gland Biol Neoplasia 8: 215–223. - 102.
Миллс А.А., Чжэн Б., Ван XJ, Фогель Х., Руп Д.Р. и др. (1999) p63 является гомологом p53, необходимым для морфогенеза конечностей и эпидермиса. Природа 398: 708–713. - 103.
Ян А., Швейцер Р., Сан Д., Кагад М., Уокер Н. и др. (1999) p63 необходим для регенеративной пролиферации конечностей, черепно-лицевого и эпителиального развития. Природа 398: 714–718. - 104.
Лауриккала Дж., Миккола М.Л., Джеймс М., Таммерс М., Миллс А.А. и др. (2006) p63 регулирует множественные сигнальные пути, необходимые для эктодермального органогенеза и дифференцировки. Развитие 133: 1553–1563. - 105.
Satokata I, Ma L, Ohshima H, Bei M, Woo I и др.(2000) Дефицит Msx2 у мышей вызывает плейотропные дефекты роста костей и формирования эктодермальных органов. Нат Генет 24: 391–395. - 106.
Hu G, Lee H, Price SM, Shen MM, Abate-Shen C (2001) Гены гомеобокса Msx ингибируют дифференцировку посредством активации циклина D1. Развитие 128: 2373–2384. - 107.
Донту Дж., Джексон К.В., МакНиколас Э., Кавамура М.Дж., Абдалла В.М. и др. (2004) Роль передачи сигналов Notch в определении судьбы стволовых клеток / клеток-предшественников молочной железы человека.Рак молочной железы Res 6: R605 – R615. - 108.
Woodward WA, Chen MS, Behbod F, Rosen JM (2005) О стволовых клетках молочной железы. J Cell Sci 118: 3585–3594. - 109.
Michno K, Boras-Granic K, Mill P, Hui CC, Hamel PA (2003) Экспрессия Shh необходима для эмбрионального волосяного фолликула, но не для развития молочной железы. Дев Биол 264: 153–165. - 110.
Lewis MT, Veltmaat JM (2004) Следующая остановка, сумеречная зона: регулирование развития молочной железы ежовой сетью.J Mammary Gland Biol Neoplasia 9: 165–181. - 111.
Кубо М., Накамура М., Тасаки А., Яманака Н., Накашима Н. и др. (2004) Сигнальный путь Hedgehog — новая терапевтическая мишень для пациентов с раком груди. Cancer Res 64: 6071–6074. - 112.
Schier AF (2003) Узловая передача сигналов в развитии позвоночных. Annu Rev Cell Dev Biol 19: 589–621. - 113.
Дин Дж., Ян Л., Ян Ю. Т., Чен А., Десаи Н. и др. (1998) Cripto необходим для правильной ориентации передне-задней оси у эмбриона мыши.Nature 395: 702–707. - 114.
Саломан Д.С., Бьянко С., Эберт А.Д., Хан Н.И., Де Сантис М. и др. (2000) Семейство EGF-CFC: новые белки, связанные с эпидермальным фактором роста, при развитии и раке. Endocr Relat Cancer 7: 199–226. - 115.
Минчиотти Г. (2005) Узелочно-зависимая передача сигналов Cripto в ES-клетках: от стволовых клеток до биологии опухоли. Онкоген 24: 5668–5675. - 116.
Strizzi L, Bianco C, Normanno N, Salomon D (2005) Cripto-1: многофункциональный модулятор во время эмбриогенеза и онкогенеза.Онкоген 24: 5731–5741. - 117.
Kenney NJ, Adkins HB, Sanicola M (2004) Nodal и Cripto-1: гены формирования эмбрионального паттерна, участвующие в развитии молочной железы и туморогенезе. J Mammary Gland Biol Neoplasia 9: 133–144. - 118.
Riese DJ Jr, van Raaij TM, Plowman GD, Andrews GC, Stern DF (1995) Клеточный ответ на нейрегулины регулируется сложными взаимодействиями семейства рецепторов erbB. Mol Cell Biol 15: 5770–5776. - 119.Робинсон GW, Karpf AB, Kratochwil K (1999) Регулирование развития молочной железы посредством тканевого взаимодействия. J Mammary Gland Biol Neoplasia 4: 9–19.
- 120.
Salomon DS, Brandt R, Ciardiello F, Normanno N (1995) Пептиды, связанные с эпидермальным фактором роста, и их рецепторы при злокачественных новообразованиях человека. Crit Rev Oncol Hematol 19: 183–232. - 121.
Howe LR, Brown AM (2004) Передача сигналов Wnt и рак груди. Cancer Biol Ther 3: 36–41. - 122.Бреннан К.Р., Браун А.М. (2004) Белки Wnt в развитии молочной железы и раке. J Mammary Gland Biol Neoplasia 9: 119–131.
- 123.
Hennighausen L, Robinson GW (2005) Информационные сети в молочной железе. Nat Rev Mol Cell Biol 6: 715–725. - 124.
Маретто С., Корденони М., Дюпон С., Брагетта П., Брокколи В. и др. (2003) Картирование передачи сигналов Wnt / бета-катенин во время развития мышей и в колоректальных опухолях. Proc Natl Acad Sci U S A 100: 3299–3304.
Рак груди у собак | Blue Cross
Опухоли груди (молочной железы) у собак проявляются в виде раковых образований различной формы и размера в молочных железах — эти железы можно найти вокруг сосков вашей собаки.
Рак груди или «рак молочной железы», как его называют у собак, гораздо чаще встречается у сук.
Симптомы рака груди у собак
Симптомы вашей собаки будут различаться в зависимости от того, на какой стадии находится рак молочной железы.
Симптомы могут включать:
- уплотнения у сосков (молочных желез)
- выделения из сосков
- воспаление и болезненность кожи над опухолью
При более поздней стадии рака вы можете увидеть:
- кашель (распространяется на легкие)
- потеря веса
- слабость
- появление нездоровья
Важно: У некоторых собак, не имеющих кашля, отек груди может быть нормальным явлением после их сезона (период самки), который называется « ложная беременность »- проконсультируйтесь с ветеринаром по этому поводу.
Как проверить свою собаку на рак груди
Найдите молочные железы собаки
Для этого вам нужно посмотреть на грудь и живот вашей собаки. Вы должны увидеть пять пар сосков, идущих линией вдоль их нижней стороны, от области груди к задним ногам. Их соски показывают, где находятся их молочные железы. У некоторых собак всего четыре пары сосков, но это нормально.
Лучше всего смотреть, когда ваша собака расслабляется и наслаждается растиранием живота. Пожалуйста, не заставляйте их показывать вам свой животик, для собак это очень стресс.
Нащупайте комочки
Расположив собаку в удобном для нее положении, осторожно пощупайте область вокруг каждой молочной железы собаки. Вы должны иметь возможность аккуратно двигать соском и кожей из стороны в сторону, и на сосках или вокруг них не должно быть твердых комков.
Ваша собака может позволить вам осмотреть их, когда они лежат, или они могут предпочесть, чтобы вы делали это, когда они стояли.
Дайте им много похвалы
Хвалите их спокойно и нежно, пока вы это делаете, и подарите им хорошую суету или угощение, чтобы поблагодарить их, когда закончите.Это займет около минуты.
Если вы обнаружите уплотнение — твердое или мягкое — на молочной железе вашего питомца, запишитесь на прием к ветеринару, чтобы он проверил его.
Как ветеринар определит рак груди у моей собаки?
Ваш ветеринар проверит все опухоли на наличие:
- размера
- опухоли
- твердой или подвижной
- любых язв (порезов или струпьев на коже)
Если есть подозрение на рак, ваш ветеринар сделает это. обсудить с вами следующие шаги.Они могут захотеть взять образец опухоли, другие могут назначить вашу собаку для удаления опухоли, а иногда операция может оказаться невозможной.
Что такое злокачественная опухоль?
Злокачественная опухоль — агрессивная форма рака. Эти опухоли быстро распространяются на другие части тела и быстро растут.
Их трудно лечить, потому что они могли уже распространиться к тому времени, когда ваш ветеринар их обнаружил, и, если будет проведена операция, они могут снова отрасти.
Что такое доброкачественная опухоль?
Эти опухоли легче поддаются лечению, они с меньшей вероятностью вырастут после операции и не распространятся на другие части тела.
Лечение рака груди у собак
Этот совет был одобрен нашим руководителем ветеринарной службы Blue Cross
Surgery
Хирургия — лучший вариант для вашей собаки. Чем раньше будет удалена опухоль, тем лучше.
Операция будет включать удаление раковых клеток из тела вашей собаки. В некоторых запущенных случаях ветеринару потребуется удалить всю цепочку молочных желез с одной стороны тела.
К сожалению, если у вашей собаки множественные опухоли или очень большая опухоль, операция может быть не рекомендована.Это связано с тем, что рак может быть слишком запущенным и распространился или может снова вырасти после операции.
Ваш ветеринар обсудит с вами варианты, учитывая, насколько далеко рак, и что лучше всего для вашей собаки. Мы знаем, что это может быть очень неприятное время, и готовы помочь вам, если вам нужно с кем-то поговорить.
Что происходит после операции?
После того, как ваша собака вышла из операции, она будет оставаться в больнице до тех пор, пока полностью не оправится от наркоза.Обычно они могут прийти домой в тот же день, хотя иногда им нужно остаться в больнице на ночь.
У вашей собаки после операции могут появиться синяки из-за чувствительной области, на которой была проведена операция.
Ваш ветеринар может попросить вас привести вашу собаку на контрольные приемы, чтобы они могли проверить ее на наличие новых опухолей и повторного роста удаленных опухолей.
Как ухаживать за собакой после операции
Ветеринар расскажет, как ухаживать за собакой дома.Обычно они просят вас:
- следить за раной на предмет отека и выделений
- обезболить вашу собаку — у вас будут конкретные инструкции о том, сколько таблеток и когда их давать. Не давайте вашему питомцу обезболивающее, если это специально не рекомендовано ветеринаром — некоторые лекарства для людей токсичны для домашних животных.



