12/л (10 в ст. 12/л), г/л (грамм на литр), % (процент), фл (фемтолитр), пг (пикограмм).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
- Исключить из рациона алкоголь и лекарственные препараты (по согласованию с врачом) за сутки до сдачи крови.
- Не принимать пищу в течение 8 часов перед исследованием, можно пить чистую негазированную воду.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Общий анализ крови, как правило, включает в себя от 8 до 30 пунктов: подсчет количества эритроцитов, лейкоцитов, тромбоцитов в 1 микролитре или литре крови, а также ряд других показателей, описывающих форму, объем и другие характеристики этих клеток.
Обычно в дополнение к этому назначается лейкоцитарная формула (процентное соотношение различных форм лейкоцитов) и подсчет скорости оседания эритроцитов (СОЭ).
Основные показатели, которые входят в общий анализ крови:
- количество лейкоцитов (white blood cells, WBC),
- количество эритроцитов (red blood cells, RBC),
- уровень гемоглобина (hemoglobin content, Hb),
- гематокрит (рematocrit, Hct),
- средний объем эритроцита (MCV),
- среднее содержание гемоглобина в эритроците (MCH),
- средняя концентрация гемоглобина в эритроцитах (MCHC),
- тромбоциты (platelet count, PC).
Кровь состоит из клеток (форменных элементов) и жидкой части – плазмы. Эти клетки – эритроциты, лейкоциты и тромбоциты – образуются и созревают в костном мозге и должны попадать в системный кровоток по мере необходимости.
При изучении мазка крови под микроскопом капля крови помещается на стекло, размазывается шпателем, а затем окрашивается специальным красителем и высушивается. После этого врач лаборатории может детально рассмотреть ее под микроскопом.
Отношение объема форменных элементов к плазме называется гематокритом. Изменение этого показателя характеризует степень «разжижения» или «сгущения» крови.
Лейкоциты
Лейкоциты – клетки, помогающие организму бороться с инфекцией. Они способны определять чужеродные агенты (бактерии, вирусы) в организме и уничтожать их.
Выделяют 5 различных видов лейкоцитов: эозинофилы, базофилы, нейтрофилы, лимфоциты и моноциты. Подсчет количества лейкоцитов, входящий в общий анализ крови, позволяет узнать суммарное количество всех типов клеток, лейкоцитарная формула – каждого типа в отдельности.
Общее количество лейкоцитов, как правило, повышено при остром инфекционном процессе, вызванном бактериями. Если лейкоцитов слишком мало, то организм становится более подверженным различным инфекциям.
Эритроциты
Эритроциты – клетки, имеющие форму бублика с более тонкой частью в центре вместо дырки. В их составе есть гемоглобин – белок, содержащий железо, который обладает способностью переносить кислород от легких к тканям и органам, а углекислый газ – от тканей и органов к легким, из которых он выдыхается. Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12— или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Общий анализ крови позволяет определить, достаточное ли количество эритроцитов содержится в крови, какова их форма, размеры и содержание в них гемоглобина (MCV, MCH, MCHC). Эритроциты должны быть одинаковы, однако при таких состояниях, как B12— или железодефицитная анемия, форма эритроцитов и их размер могут изменяться. Если количество эритроцитов снижено, значит, у пациента анемия, что может проявляться слабостью, быстрой утомляемостью и одышкой. Реже встречается повышение общего количества эритроцитов (эритроцитоз, или полицитемия).
Тромбоциты
Тромбоциты – клетки, играющие значительную роль в свертывании крови. Если у человека снижено количество тромбоцитов, риск кровотечения и образования синяков у него повышен.
Для чего используется исследование?
Данный тест применяют для общей оценки состояния здоровья, диагностики анемии, инфекций и множества других заболеваний. Фактически это совокупность анализов, оценивающих различные показатели крови.
- Подсчет количества лейкоцитов определяет количество лейкоцитов в единице крови (литре или микролитре). Его повышение или понижение может иметь значение в диагностике инфекций или, например, заболеваний костного мозга.
- Соответственно, количество эритроцитов в единице крови (литре или микролитре) определяет подсчет количества эритроцитов. Он необходим для диагностики анемии или полицитемии и дифференциальной диагностики различных типов анемий.
- Уровень гемоглобина важен для оценки тяжести анемии или полицитемии и для контроля за эффективностью терапии этих состояний.
- Гематокрит – процентное соотношение клеток крови (форменных элементов) к жидкой ее части. Используется в комплексной оценке анемий и полицитемий, для принятия решения о переливании крови и оценки результатов этой процедуры.
- Подсчет количества тромбоцитов определяет количество тромбоцитов в единице крови (литре или микролитре). Используется для выявления нарушений свертывания или заболеваний костного мозга.

- Средний объем эритроцита (MCV) – усредненный показатель, отражающий размер эритроцитов. Он необходим для дифференциальной диагностики различных типов анемий. Так, при B12-дефицитной анемии размер эритроцитов увеличивается, при железодефицитной – уменьшается.
- Среднее содержание гемоглобина в эритроците (MCH) – показатель того, сколько гемоглобина в среднем содержится в одном эритроците. При B12-дефицитной анемии в увеличенных эритроцитах количество гемоглобина повышено, а при железодефицитной анемии – снижено.
- Средняя концентрация гемоглобина в эритроците (MCHC) отражает насыщение эритроцита гемоглобином. Это более чувствительный параметр для определения нарушений образования гемоглобина, чем MCH, так как он не зависит от среднего объема эритроцита.
- Распределение эритроцитов по объему (RDW) – показатель, определяющий степень различия эритроцитов по размеру. Имеет значение в диагностике анемий.
- Средний объем тромбоцита (MPV) – характеристика тромбоцитов, которая может косвенно свидетельствовать об их повышенной активности или о наличии чрезмерного количества молодых тромбоцитов.

Когда назначается исследование?
Общий анализ крови – самый распространенный лабораторный анализ, используемый для оценки общего состояния здоровья. Он выполняется при плановых медицинских осмотрах, при подготовке к оперативному вмешательству, входит в медкомиссию при устройстве на работу.
Если человек жалуется на утомляемость, слабость или у него есть признаки инфекционного заболевания, воспаления, повышенная температура тела, то, как правило, назначается общий анализ крови.
Значительное повышение количества лейкоцитов обычно подтверждает воспаление. Снижение эритроцитов и гемоглобина говорит об анемии и требует дополнительных обследований для уточнения ее причины.
Множество различных патологических состояний могут приводить к изменениям количества основных клеточных популяций в крови. Общий анализ крови назначается для контроля за эффективностью лечения анемии или инфекционного заболевания, а также для оценки негативного влияния на клетки крови некоторых лекарств.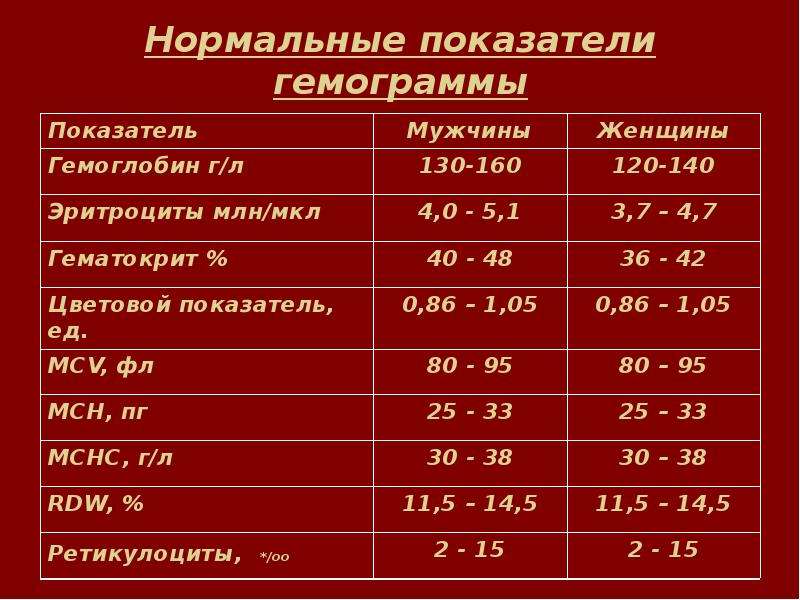 12/л
12/л
RDW-SD (распределение эритроцитов по объёму, стандартное отклонение): 37 — 54.
RDW-CV (распределение эритроцитов по объёму, коэффициент вариации): 11,5 — 14,5.
Гемоглобин
|
Возраст |
Референсные значения |
||
|
Меньше 2 недель |
134 — 198 г/л |
||
|
2 недели – 2 месяца |
124 — 166 г/л |
||
|
2-12 месяцев |
110 — 131 г/л |
||
|
1-2 года |
110 — 132 г/л |
||
|
2-3 года |
111 — 133 г/л |
||
|
3-4 года |
112 — 134 г/л |
||
|
4-5 лет |
114 — 134 г/л |
||
|
5-6 лет |
113 — 135 г/л |
||
|
6-7 лет |
115 — 135 г/л |
||
|
7-8 лет |
116 — 138 г/л |
||
|
8-9 лет |
115 — 137 г/л |
||
|
9-10 лет |
118 — 138 г/л |
||
|
10-11 лет |
114 — 140 г/л |
||
|
11-12 лет |
118 — 142 г/л |
||
|
12-13 лет |
117 — 143 г/л |
||
|
13-14 лет |
121 — 145 г/л |
||
|
14-15 лет |
120 — 144 г/л |
||
|
15-16 лет |
130 — 168 г/л |
||
|
16-17 лет |
130 — 168 г/л |
||
|
17-18 лет |
120 — 148 г/л |
||
|
18-45 лет
|
Мужской |
132 — 173 г/л |
|
| Женский |
117 — 155 г/л |
||
|
45-65 лет
|
Мужской |
131 — 172 г/л |
|
| Женский | 117 — 160 г/л | ||
|
Больше 65 лет
|
Мужской | 126 — 174 г/л | |
| Женский | 117 — 161 г/л | ||
Гематокрит
|
Пол |
Возраст |
Референсные значения |
|
Меньше 1 года |
33 — 41 % |
|
|
1-3 года |
32 — 40 % |
|
|
3-6 лет |
32 — 42 % |
|
|
6-9 лет |
33 — 41 % |
|
|
9-12 лет |
34 — 43 % |
|
|
Женский |
12-15 лет |
34 — 44 % |
|
15-18 лет |
34 — 44 % |
|
|
18-45 лет |
35 — 45 % |
|
|
45-65 лет |
35 — 47 % |
|
|
Больше 65 лет |
35 — 47 % |
|
|
Мужской |
12-15 лет |
35 — 45 % |
|
15-18 лет |
37 — 48 % |
|
|
18-45 лет |
39 — 49 % |
|
|
45-65 лет |
39 — 50 % |
|
|
Больше 65 лет |
39 — 50 % |
Снижение показателей отмечается при железо-, B12-дефицитной и других анемиях, острых и хронических кровотечениях.
Повышение – при истинной полицитемии, обезвоживании, кислородном голодании.
Средний объем эритроцита (MCV)
|
Пол |
Возраст |
Референсные значения |
|
|
Меньше 1 года |
71 — 112 фл |
|
1-5 лет |
73 — 85 фл |
|
|
5-10 лет |
75 — 87 фл |
|
|
10-12 лет |
76 — 94 фл |
|
|
Женский |
12-15 лет |
73 — 95 фл |
|
15-18 лет |
78 — 98 фл |
|
|
18-45 лет |
81 — 100 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
|
|
Мужской |
12-15 лет |
77 — 94 фл |
|
15-18 лет |
79 — 95 фл |
|
|
18-45 лет |
80 — 99 фл |
|
|
45-65 лет |
81 — 101 фл |
|
|
Больше 65 лет |
81 — 102 фл |
Среднее содержание гемоглобина в эритроците (MCH)
|
Возраст |
Референсные значения |
|
Меньше 1 года |
31 — 37 пг |
|
1-3 года |
24 — 33 пг |
|
3-12 лет |
25 — 33 пг |
|
13-19 лет |
26 — 32 пг |
|
Больше 19 лет |
27 — 31 пг |
Повышение показателя отмечается при B12— и фолиеводефицитной анемии.
Снижение – при железодефицитной анемии и талассемии.
Средняя концентрация гемоглобина в эритроците (MCHC)
|
Возраст |
Референсные значения |
|
Меньше 1 года |
290 — 370 г/л |
|
1-3 года |
280 — 380 г/л |
|
3-12 лет |
280 — 360 г/л |
|
13-19 лет |
330 — 340 г/л |
|
Больше 19 лет |
300 — 380 г/л |
Понижение показателя отмечается при анемии. 9/л
9/л
Понижение – при иммунной тромбоцитопенической пурпуре, онкологических заболеваниях костного мозга, сепсисе. Повышение показателя отмечается при истинной полицитемии, онкологических заболеваниях, туберкулезе, удалении селезенки.
Что может влиять на результат?
На различные показатели могут оказывать влияние, соответственно, разные факторы: беременность, курение, прием некоторых лекарств, интенсивная физическая нагрузка.
Также рекомендуется
Кто назначает исследование?
Терапевт, хирург, инфекционист, гематолог, нефролог.
Сдать анализ крови на Гликированный гемоглобин А1с в лаборатории KDL
Гликированный гемоглобин (HbA1c) — необратимое соединение глюкозы с гемоглобином в эритроцитах. Этот процесс происходит непрерывно и зависит от концентрации сахара в крови и продолжительности ее воздействия на эритроциты. Уровень гликогемоглобина не изменяется на протяжении периода жизни эритроцитов (90 -120 суток). Таким образом, показатель HbA1c отражает среднюю концентрацию глюкозы в течение предыдущего периода (приблизительно 8-12 недель) и позволяет гораздо эффективнее оценивать степень гликемии (уровень повышения сахара крови), чем определение глюкозы в крови и моче.
Уровень гликогемоглобина не изменяется на протяжении периода жизни эритроцитов (90 -120 суток). Таким образом, показатель HbA1c отражает среднюю концентрацию глюкозы в течение предыдущего периода (приблизительно 8-12 недель) и позволяет гораздо эффективнее оценивать степень гликемии (уровень повышения сахара крови), чем определение глюкозы в крови и моче.
В каких случаях обычно назначают исследование гемоглобина HbA1C?
В настоящее время анализ на гликированный гемоглобин вместе с определением глюкозы натощак являются наиболее точным инструментом для диагностики сахарного диабета (СД) и других форм нарушения обмена глюкозы, в том числе «скрытых форм» и диабета беременных. На содержание Hb1Ac не влияет время суток, физические нагрузки, диета, приём пищи, эмоциональное напряжение и другие внешние и внутренние факторы, осложняющие интерпретацию других исследований. Данный теста используются для оценки компенсации заболевания, эффективности лечения и расчета риска осложнений.
Анализ на HbA1c необходимо сдавать каждые 3 месяца всем пациентам, у которых диагностирован диабет.
Что именно определяют в процессе анализа?
В пробе цельной крови выделяется и измеряется специфический вид гемоглобина – гемоглобин А1С методом жидкостной хроматографии высокого давления.
Что означают результаты теста?
Согласно данным Всемирной организации здравоохранения (ВОЗ), концентрация Hb1Ac у здоровых людей составляет не более 6,0%.
Значения от 6,0 до 6,5% считаются пограничными и могут указывать на нарушения обмена углеводов: нарушение толерантности к глюкозе, преддиабет, диабет.
Значения выше 6,5% характерны для пациентов с диабетом.
Снижение уровня гликогемоглобина может отмечаться у пациентов с анемиями и в периоде восстановления организма после кровопотери
Обычный срок выполнения теста.
Обычно результат исследования на гликированный гемоглобин можно в течение 1-2 дней после сдачи крови.
Как подготовиться к анализу?
Специальной подготовки не требуется. С подробной информацией можно ознакомиться в соответствующем разделе статьи.
С подробной информацией можно ознакомиться в соответствующем разделе статьи.
Метаболизм железа в условиях инфекции. Обзор литературы
Ю.П. Орлов, Н.В. Говорова, В.Н. Лукач, Г.А. Байтугаева, А.В. Клементьев, Е.Н. Какуля
ФГБОУ ВО «Омский государственный медицинский университет» МЗ РФ, Омск, Россия
Для корреспонденции: Орлов Юрий Петрович — д-р мед. наук, профессор кафедры анестезиологии и реаниматологии ФГБОУ ВО «Омский государственный медицинский университет» Минздрава России, Омск; e-mail: [email protected]
Для цитирования: Орлов Ю.П., Говорова Н.В., Лукач В.Н., Байтугаева Г.А., Клементьев А.В., Какуля Е.Н. Метаболизм железа в условиях инфекции. Обзор литературы. Вестник интенсивной терапии им. А.И. Салтанова. 2020;1:90–99. DOI: 10.21320/1818-474X-2020-1-90-99
Реферат
Цель написания обзора. Анализ публикаций о роли метаболизма железа в манифестации сепсиса и зависимости активности бактериальной флоры от условий их доступа к железу. Методы. Проанализировано более 200 публикаций в базах данных медицинской литературы Pubmed, Medline, EMBASE в период с 2000 по 2018 г. с использованием поисковых слов: «железо и инфекция», «железо и сепсис», «обмен железа», «железо и бактерии» — включительно и доступные работы в отечественной (e-library) литературе. Результаты. В обзоре использованы материалы из 68 публикаций, отвечающих задачам поиска и отражающих как связь обмена железа с развитием септического процесса, так и важность для врачебного сообщества понимания выявленных взаимосвязей для поиска будущих терапевтических подходов.
Методы. Проанализировано более 200 публикаций в базах данных медицинской литературы Pubmed, Medline, EMBASE в период с 2000 по 2018 г. с использованием поисковых слов: «железо и инфекция», «железо и сепсис», «обмен железа», «железо и бактерии» — включительно и доступные работы в отечественной (e-library) литературе. Результаты. В обзоре использованы материалы из 68 публикаций, отвечающих задачам поиска и отражающих как связь обмена железа с развитием септического процесса, так и важность для врачебного сообщества понимания выявленных взаимосвязей для поиска будущих терапевтических подходов.
Заключение. В представленном обзоре приведены доказательства прямого участия железа в манифестации септического процесса, вызванного различной бактериальной (+/−) и грибковой флорой. Введение хелатирующих железо агентов и сидерофор — конъюгированных препаратов септическим пациентам представляется сегодня биологически приемлемым подходом в качестве вспомогательной терапии при лечении сепсиса, вызванного патогенами, зависящими от снабжения хозяина железом (многими бактериальными и грибковыми патогенами), но, безусловно, поднимаемая проблема требует продолжения экспериментальных и клинических исследований.
Ключевые слова: обмен железа, инфекция, сепсис, железо и сепсис, железо и бактерии, сидерофоры
Поступила: 14.12.2019
Принята к печати: 02.03.2020
Читать статью в PDF
Введение
Нарушение гомеостаза железа является основной стратегией взаимодействия хозяина и патогена. Области научного интереса колеблются от лучшего понимания молекулярных механизмов, лежащих в основе функции метаболизма железа, до потенциальной неблагоприятной роли железа, которая может быть сыграна при ряде критических состояний.
Поэтому современный обзор гомеостаза железа был бы неполным без рассмотрения влияния железа на микробиом и на сепсис, так как большинство бактерий требуют железа для роста и выживания, при этом для некоторых бактерий характерна абсолютная потребность в железе. В настоящем обзоре представлены доказательства автокаталитического участия железа, ведущего, в частности, к манифестации сепсиса. Этот факт ставит ряд вопросов, которые возникают перед клиницистом в период лечения пациентов с сепсисом, где для коррекции анемии часто используют препараты железа и переливание крови. Конечно, точные молекулярные механизмы, каскады и сети, задействованные в метаболизме железа, зависят и от многих других факторов, но тем не менее существуют обширные доказательства участия железа в развитии сепсиса, которые очень трудно игнорировать.
Природная суть железа и механизмы безопасности для организма
Ценность железа для организма можно объяснить тем, что его метаболизм до минимума исключает потери, а количество всасываемого микроэлемента, напротив, строго лимитировано [1, 2]. Организм человека содержит 3–5 г железа, большая часть которого внутриклеточная, и 65–75 % железа организма связано с порфириновым гемом (в виде гемоглобина) в эритроцитах. Каждый эритроцит может содержать до 280 млн молекул гемоглобина, в результате чего емкость железа составляет более 1 млрд атомов на клетку. Гемоглобин в стареющих эритроцитах тщательно перерабатывается макрофагами в ретикулоэндотелиальной системе, а гемоксигеназа (HO-1) высвобождает железо и монооксид углерода из протопорфиринового кольца, что приводит к образованию биливердина и перемещению железа обратно, в бассейны деятельности трансферрина или ферритина [3].
Сложная система транспортеров регулирует гомеостаз железа у человека, который поддерживается за счет тщательной координации дуоденальной абсорбции и утилизации запасов железа. Баланс железа жестко регулируется для предотвращения пагубных последствий не столько его дефицита, сколько перегрузки железом [4, 5].
На клеточном уровне регуляторные молекулы, такие как ферропортин и гепсидин, вносят вклад в регуляцию железа. Гепсидин — это «антибактериальный» пептидный гормон, вырабатываемый главным образом в печени, и его синтез жестко контролируется на транскрипционном уровне в ответ на уровень поступающего железа, потребности для эритропоэза, и особенно при воспалении или гипоксии [6]. Гепсидин регулирует доступность железа для использования в гемоглобине [7], но может подавлять экспорт железа на уровне тканей, и, наоборот, в ответ на дефицит железа организм может синтезировать дополнительные белковые субстанции для увеличения всасывания и транспортировки железа к местам его потребления [8]. Увеличение общего объема запасов железа в организме запускает выработку гепсидина, который впоследствии вызывает интернализацию и деградацию ферропортина. Поскольку ферропортин присутствует на поверхности макрофагов, гепсидин также уменьшает экспорт железа после рециркуляции ретикулоэндотелиальной системой [9].
Природа включает все механизмы безопасности, так как «знает» железо с «плохой стороны»: как активатора свободно-радикального окисления (СРО) [10], источник энергетического потенциала для бактерий и мембраноагрессора [11–13]. Например, инкубирование эритроцитов от здоровых доноров с плазмой крови больных с септическим шоком индуцировало гидролиз фосфатидилхолина мембраны эритроцитов до лизофосфатидилхолина, что повышало экспрессию фосфатидилсерина эритроцитов [13] и сокращало продолжительность жизни эритроцитов.
Взаимосвязь с миром бактерий только за счет потребления железа
Железо является важнейшим микроэлементом не только для людей, но и для бактерий, вирусов, грибков [14, 15]. Внеклеточное и несвязанное железо быстро извлекается трансферрином, ферритином, лактоферрином и другими железопротеинами только с целью безопасности — ограничить доступ железа для бактерий. При воспалении, и тем более при развитии генерализации процесса, у человека повышается синтез ферритина и лактоферрина, в результате возникает «железное голодание» для микробов, ограничивающее их рост, позволяя хозяину вовремя искоренить инфекцию с помощью иммунных механизмов, и конечно, антибиотиков [4, 14–16]. Условия «условной стерильности» тканей жестко привязаны к железу. Для роста бактериальных клеток требуется концентрации железа в среде от 0,4 до 4 мкмолей. Константа же связывания железа трансферрином составляет 1030, а количество свободного железа в равновесии с трансферрином составляет 6 × 10–9мкмолей, что в 108 раз меньше, чем требуется для роста бактерий [17].
Таким образом, во время сепсиса организм использует природную, эволюционно разработанную способность поглощать меньше железа, чтобы лишить вторгающиеся бактерии доступа к железу, которое им необходимо для роста и размножения [14, 17, 18]. Это врожденный иммунный механизм против вторжения патогенов, характерный не только для сепсиса, но и для различных критических состояний [19, 20].
Какие же стратегии используют патогены человека для преодоления всех многочисленных защитных барьеров, созданных природой, чтобы уберечь организм от развития инфекционного процесса и манифестации сепсиса?
Методы и стратегии бактериального «железного пиратства»
Патогены развили сложные стратегии, чтобы обойти «питательный иммунитет» хозяина. Существует несколько механизмов, с помощью которых бактерии реагируют на изменения концентраций Fe в окружающей среде. Самый общий механизм — через отрегулированное выражение системы поглощения железа, включает в себя регулятор поглощения железа (Fur), и небольшие РНК [21–23]. В связи с этим Fur служат в качестве датчиков, которые регулируют факторы вирулентности в дополнение к системам получения железа. Попав в организм хозяина и оценив Fe-окружающую среду, S. aureus реализует много факторов вирулентности, но наиболее активен альфа-токсин (Hla), который и приводит к гемолизу эритроцитов [24, 25].
Для того чтобы высвободить гемоглобин из эритроцитов, многие бактерии выделяют гемолизины. Эти протеины повреждают мембрану эритроцита, приводя к осмотическому лизису, позволяя патогену получить доступ к свободному гемоглобину, и транспортируют эту молекулу в цитоплазму — с целью повредить кольцо гема, для того чтобы получить свободное Fe2+ [26]. В ряде исследований было обнаружено, что S. pneumoniaе уклоняются от «убийства» антибиотиками, нейтрофилами и H2O2 в присутствии эритроцитов человека. Наше собственное исследование показало, что измеренная в первый день течения тяжелого сепсиса концентрация свободного гемоглобина, как следствие гемолиза эритроцитов, выше средней величины и прямо связана с увеличением 30-дневной летальности; уровень свободного гемоглобина в 1-е сутки заболевания характеризуется высокой чувствительностью, специфичностью и с точностью до 96,7 % может определить исход сепсиса [27].
Например, активность P. aeruginosa прямо зависит от приобретения железа у своего хозяина, и во время манифестации сепсиса бактерии могут активно использовать несколько различных систем для сбора железа: с помощью сидерофора пиовердина и путем утилизации гема [28]. Бактерии, используя свои рецепторы внешней мембраны, могут связывать и хелатировать железо непосредственно из трансферрина. Кроме того, бактерии могут синтезировать белки гемофоры, которые способны связывать гем и транспортировать белок хозяина в микробную среду через рецепторное поглощение [29]. Гемофоры, присущие как грамотрицательным (например, Escherichia coli, Pseudomonas aeruginosa, Klebsiella pneumoniae), так и грамположительным бактериям (например, золотистый стафилококк), применяют и второй способ получения железа — путем синтеза и секреции различных сидерофоров [30]. Это приводит к распространению бактерий в периферические органы, при этом активируется секреция провоспалительных цитокинов — интерлейкин-6 (ИЛ-6), нейтрофильные хемоаттрактанты (CXCL1 и CXCL2), которые рекрутируют нейтрофилы в место септического очага, что является демонстрацией неканонической роли сидерофоров в естественных условиях во время клебсиеллезного сепсиса. В дополнение к обеспечению железом возбудителя сидерофоры также способствуют распространению K. pneumoniae в селезенку путем индукции и стабилизации (гипоксия-индуцирующий фактор) HIF-1 в легочных эпителиальных клетках [31, 32].
Таким образом, микроорганизмы, в свою очередь, эволюционировали и приобрели множество стратегий, включая сложные системы транспортеров и регуляторов, для того чтобы получить важный металл, и приобретают железо для своих собственных нужд, как из окружающей среды, так и «похищая» металлы из ресурсов макроорганизма. Для многих типичных грамотрицательных и грамположительных бактерий и патогенных грибов именно гем — самый «богатый» источник железа [33].
Железо и сепсис
Сепсис представляет собой системный иммунный ответ на инфекцию. На сегодняшний день специфического лечения сепсиса пока нет. В настоящее время большое количество публикаций по тематике «обмен железа и сепсис» касается решения вопроса о целесообразности назначения таким пациентам препаратов железа или проведения гемотрансфузии, так как все пациенты с сепсисом имеют анемию воспаления. Как отмечено выше, рост бактерий, вирусов и грибков прямо зависит от наличия железа [34]. Как только насыщение трансферрина в организме человека превышает критический порог, свободное железо сразу становится доступным для использования бактериями [35].
В ряде исследований отмечено, что содержание гепсидина, эритропоэтина и ИЛ-6 в плазме крови больных сепсисом при поступлении в ОРИТ было достоверно выше (при р < 0,05), чем у здоровых добровольцев, и постепенно снижалось на протяжении всего исследования, но на 7-е сутки оставалось достоверно выше (при р < 0,05), чем у здоровых. Плазменный ферритин и (sTfR) трансферриновый рецептор, как и объем эритроцитов на 3-и и 7-е сутки поступления в ОРИТ, были достоверно повышены по сравнению с таковыми у здоровых добровольцев. Кроме того, уровень ферритина плазмы был выше в 3-и и 7-е сутки, чем в 1-е сутки. При прогнозировании 28-дневной летальности плазменный гепсидин имел площадь под кривой 0,808 и специфичность 87,3 %, что было самым высоким показателем среди всех исследуемых параметров, ассоциированных с воспалительной анемией у пациентов с сепсисом [36].
У пациентов с сепсисом, поступающих в ОРИТ, по мнению ряда авторов, быстро развивается анемия, что подтвердили другие исследования [37–39]. Анемия воспаления часто встречается у пациентов с сепсисом в условиях ОРИТ, что подтверждается снижением уровня гемоглобина вместе с изменениями параметров, связанных с анемией воспаления. Однако диагностировать дефицит железа в контексте анемии воспаления очень трудно, главным образом потому, что не существует общепринятого «золотого стандарта» для диагностики дефицита железа в контексте воспаления [40]. Кроме того, традиционные переменные, такие как sTfR и ферритин плазмы, не являются точными для диагностики дефицита железа у пациентов с сепсисом и, по мнению некоторых авторов, даже могут иметь противоположные изменения при железодефицитной анемии без воспаления [41, 42].
В литературе отмечено, что эритропоэз сильно страдает от воспаления, и воспалительные ассоциированные аномалии в эритропоэзе способствуют ранней анемии, выявленной у пациентов с септическим шоком [43]. Эритропоэз строго регулируется эритропоэтином [44], который индуцирует выработку эритроферрона (гликопротеинового гормона, секретируемого эритробластами) и подавляет синтез гепсидина, а значит, облегчает доставку железа во время стрессового эритропоэза [45]. Но оказалось, что воспаление само по себе может ингибировать эритропоэтические эффекты эритропоэтина. Кроме того, эритропоэтин плазмы обычно увеличивается в ответ на анемию и гипоксемию. Однако плазменный эритропоэтин оказался не столь высоким, как ожидалось, и, по данным некоторых авторов, быстро снижался. Это может быть связано с сочетанием нарушения функции почек (что снижает продукцию эритропоэтина) и ингибированием продукции эритропоэтина провоспалительными цитокинами у пациентов с сепсисом [46, 47].
По данным F. Tacke (2016), дисбаланс в метаболизме железа быстро возникает после поступления в ОРИТ наряду с воспалительным процессом, о чем свидетельствует снижение содержания железа и повышение ферритина, уровня sTfR гепсидина и ИЛ-6 в плазме в первую неделю после поступления в ОРИТ [38]. Однако влияние низкого содержания железа в плазме крови на пациентов с сепсисом представляется противоречивым.
С одной стороны, низкий уровень железа может оказывать защитное действие [38], так как железо является незаменимым микронутриентом практически для всех микроорганизмов и, следовательно, низкий уровень железа ограничивает «вредность» микроорганизмов для пациента. Свободное железо токсично, поскольку оно приводит к образованию активных форм кислорода, перекисному окислению липидов и повреждению эндотелия. Кроме того, содержание железа в макрофагах регулирует продукцию ими цитокинов [48, 49].
С другой стороны, слишком низкий уровень железа может привести к низкой доступности железа и железодефицитной анемии и, таким образом, ассоциироваться с неблагоприятными исходами у пациентов с сепсисом [41]. Таким образом, противоречивое влияние низкого уровня железа может объяснить противоречивые результаты (вредные, эффективные или неэффективные), полученные во многих исследованиях по добавкам железа (пероральным или внутривенным) у тяжелобольных пациентов [50, 51]. Кроме того, мы должны учитывать сложность механизмов сепсиса, связанных с анемией [52, 53]. Следовательно, некоторые терапевтические стратегии, такие как гемотрансфузии, добавление железа или антагонизм, использование гепсидина, могут не улучшить эту анемию, а наоборот, вызвать серьезные побочные эффекты.
В исследовании F. Tacke et al. (2016) параметры железа в сыворотке крови при поступлении коррелировали с кратковременной и долгосрочной летальностью у пациентов в ОРИТ. Концентрации гепсидина и ферритина были значительно повышены у пациентов по сравнению с донорами крови и самыми высокими — у пациентов с сепсисом. Напротив, уровни сывороточного железа и трансферрина с самыми низкими значениями отмечались у пациентов ОРИТ с сепсисом. Значения гепсидина коррелировали с уровнями ферритина, а сывороточное железо сильно коррелировало с насыщением трансферрина. Была отмечена умеренная корреляция гепсидина, ферритина и трансферрина с показателями воспаления. Все выжившие пациенты демонстрировали более высокие уровни ферритина и более низкое насыщение трансферрина. В анализах выживших имели место низкие уровни железа (отсечка 10,5 мкмоль/мл), низкое насыщение трансферрина (отсечка 55 %), высокие концентрации трансферрина в сыворотке крови (отсечка 1,6 г/л), которые были связаны с кратковременной и долгосрочной выживаемостью [38]. В подгруппе пациентов с сепсисом, имевших низкие уровни железа и насыщение трансферрина, вообще не отмечалось летальных исходов. Авторы делают выводы, что параметры метаболизма железа, в частности насыщение трансферрина, которые отражают доступность железа в сыворотке крови, являются сильными предикторами исхода у пациентов ОРИТ [38]. Эти данные свидетельствуют о том, что сбой в гомеостазе железа с повышенной доступностью железа в сыворотке происходит у пациентов с сепсисом, что требует проведения проспективных клинических испытаний, оценивающих полезность применения хелатообразующей железа при критических заболеваниях и сепсисе [38].
В контексте сепсиса метаболизм железа является важной терапевтической целью по нескольким причинам. Во-первых, железо необходимо патогену. Во-вторых, дисрегуляция обмена железа может привести (и наверно всегда приводит) к анемии. И, в-третьих, железо само по себе за счет своей токсичности может способствовать развитию патологии. Таким образом, для планирования эффективных терапевтических мероприятий необходимо более глубокое понимание метаболизма железа в организме пациента, тем более в критическом состоянии.
Сегодня перспективный подход к лечению сепсиса чаще рассматривается с осознанием того факта, что железо необходимо как для человека, так и для микробов и это имеет большое значение во многих физиологических и биохимических процессах [54]. Поскольку железо активно участвует в бактериальной пролиферации и иммунной дисрегуляции, можно предположить, что ограничение уровня железа хозяина путем применения хелаторов железа будет способствовать ослаблению бактериального роста и улучшению дисрегуляции внутриклеточной иммунной реакции в ответ на сепсис [55].
Хелатирование железа было предложено в качестве потенциальной терапии полибактериального абдоминального сепсиса [56]. Известно, что лечение хелатированием железа способно ослаблять рост бактерий [57]. Предполагается, что различные типы бактерий будут проявлять различия в их чувствительности к хелатированию железа на основе различий в их метаболизме железа [58]. Грамположительные и грамотрицательные бактерии, как известно, обладают различными системами приобретения железа, могущими повлиять на их реакцию к хелатированию. Новые хелаторы железа, которые не действуют как ксеносидерофоры, могут быть эффективными в лишении этих бактерий железа. Это имеет значение для лечения полибактериального сепсиса, эффективность которого может быть усилена, если известна чувствительность к хелатированию железа первичных возбудителей [59].
Поскольку патогены глубоко нуждаются в железе, чтобы выжить, введение хелаторов выглядит правдоподобной стратегией для лечения сепсиса и преодоления растущей устойчивости, развитой патогенами, к доступным лекарственным средствам. В ряде исследований показано, что хелаторы железа повышают эффективность химиотерапевтических средств против Candida albicans, золотистого стафилококка и полимикробного сепсиса [60, 61, 62].
Учитывая потребность хозяина в железе для его собственных метаболических потребностей, одной из важных проблем, связанных с терапией хелатирования железа, является разработка адекватных стратегий, которые могут гарантировать истощение железа для патогена без сопутствующего дефицита железа у хозяина.
С учетом вышесказанного проясняется другая проблема, которая имеет место в условиях сепсиса — развитие анемии. Эта анемия — результат борьбы микро- и макроорганизмов за выживание. Взаимосвязь между запасами железа у пациента с сепсисом (измеряемыми рутинно по уровню сывороточного железа) и инфекцией является сложной и в настоящее время широко обсуждается под эгидой главного вопроса: приводит ли назначение железа к бактериальному росту и есть ли риск прогрессирования инфекции? При этом нельзя забывать о том, что анемия, вызванная дефицитом железа, встречается у тяжелобольных пациентов только в 9 % [63, 64]. Очень часто эта анемия может носить ятрогенный характер, так как количество суточного забора крови у тяжелобольных пациентов колеблется от 23 до 40 мл в сутки [65] и более.
Существующая сегодня практически повсеместная, а у пациентов с сепсисом — в обязательном порядке, железодефицитная анемия является, по всей видимости, следствием эволюционных механизмов адаптации к постоянной инфекционной угрозе на фоне еще «слабых» побед антибактериальной терапии при сепсисе.
Решит ли трансфузия крови проблему анемии и метаболизма железа у пациентов с сепсисом?
Железо является необходимым питательным веществом почти для всех живых организмов, но его нелегко сделать доступным. Хозяева и патогены вступают в борьбу за металл во время инфекции, что приводит к серьезным изменениям в метаболизме железа хозяина. Указанное взаимодействие может приводить к важным патологическим последствиям, в том числе сепсису, анемии. В свою очередь, анемия, как частое осложнение сепсиса, может быть связана с неблагоприятными исходами.
В противовес сказанному другие исследования показали, наоборот, рост заболеваемости и смертности у пациентов, получающих переливание крови [56]. В исследование Р. Lan (2018) был включен 1891 больной с диагнозом «сепсис» по критериям сепсис-3, из которых у 324 был септический шок. После корректировки для смешанных переменных более высокий квартиль железа был связан с увеличением 90-дневной смертности в регрессионном анализе. Более того, при повышении уровня железа в сыворотке крови у больных с сепсисом наблюдалось поэтапное повышение риска 90-дневной смертности. Авторы сделали заключение, что более высокие уровни железа в сыворотке крови независимо связаны с увеличением 90-дневной смертности в этой большой когорте пациентов с сепсисом [56].
В недавнем исследовании К. Kristof et al. (2018) также отмечено, что у пациентов, получавших трансфузию эритроцитов между 28 днями до развития сепсиса и 28 днями после него (n = 302), отмечалась достоверно более высокая 90-дневная летальность (34,1 % vs 19,6 %; p = 0,004, анализ Каплана—Мейера). Эта ассоциация оставалась значимой после корректировки в многофакторном регрессионном анализе (отношение рисков 1,68; 95 %-й доверительный интервал 1,03–2,73; p = 0,035). У пациентов, получавших трансфузии, также наблюдались достоверно более высокие показатели заболеваемости, такие как баллы по шкале SOFA и длительность пребывания в ОРИТ, по сравнению с пациентами без переливаний (n = 133). Авторы делают вывод о том, что анемия и трансфузия ассоциированы с неблагоприятными исходами у пациентов с сепсисом [66].
В метаанализе N. Nielsen et al. (2017), куда были включены 17 исследований, отмечено, что в целом большинство исследований (11 из 17) пришли к следующему выводу: трансфузия в целом не улучшает оксигенацию тканей или микроциркуляцию. Однако межиндивидуальные эффекты были весьма вариабельны, и более тщательный обзор подгрупп, доступных в 9 исследованиях, показал, что пациенты с аномальной оксигенацией тканей или микроциркуляторными показателями до переливания имели улучшение этих показателей с переливанием, независимо от метода оценки [67]. То есть кому-то стало лучше, а кому-то нет. Этот вывод предлагает новую стратегию для будущих исследований в ОРИТ: использование параметров оксигенации тканей/микроциркуляции для определения потребности в трансфузии, а не произвольной оценки концентрации гемоглобина без учета состояния метаболизм железа.
Авторы обзора С. Dupuis et al. (2017) также констатируют, что на сегодняшний день «…данные о переливаниях эритроцитов у пациентов с сепсисом скудны, а высокая гетерогенность пациентов не позволяет сделать окончательные выводы» [68].
Заключение
Таким образом, данные, представленные в обзоре, позволяют резюмировать, что метаболизм железа должен контролироваться в ОРИТ, и особенно пристально — у пациентов с сепсисом.
Патофизиология расстройств метаболизма железа у пациентов с сепсисом многофакторна. Она включает:
- индуцирование гидролиза фосфатидилхолина мембраны эритроцитов до лизофосфатидилхолина, что повышает экспрессию фосфатидилсерина эритроцитов и сокращает продолжительность жизни эритроцитов;
- укорочение продолжительности жизни эритроцитов, вызванную эритрофагоцитозом, а также сниженным за счет гипоксии эритропоэзом;
- эритропоэз, в свою очередь, нарушен из-за активации воспалительных цитокинов, которые уменьшают пролиферацию предшественника эритроида и уровня эритропоэтина;
- уровни железа сыворотки, низкие за счет увеличения уровня гепсидина в ответ на воспалительные цитокины;
- гепсидин вызывает деградацию ферропортина — экспортера железа, что приводит к секвестрации железа внутри клеток и последующему низкому содержанию железа в плазме;
- в отличие от железодефицитной анемии, пациенты с сепсисом и сопутствующей анемией воспаления имеют не недостаток железа, а скорее сниженную доступность железа.
Так что же несет самый большой риск, когда мы должны переливать и когда мы должны воздержаться? Когда мы должны использовать препараты железа? Должны ли мы иметь фиксированные триггеры для переливания, и если да, то одинаковые у всех пациентов или дифференцированные для разных групп пациентов? Действительно, это более сложные решения, чем первоначально представлялось. Пациенты с сепсисом в ОРИТ очень неоднородны и по-разному реагируют на одно и то же вмешательство.
Для решения этого вопроса разумно будет использовать нижеприведенный алгоритм, построенный с учетом данных, представленных в обзоре.
Рис. 1. Алгоритм оценки метаболизма железа у пациента с сепсисом
Как таковые, решения о переливании должны быть строго индивидуализированы с учетом указанных факторов, приведенных в алгоритме, и факторов пациента, таких как возраст и сопутствующие патологии, физиологические переменные, а также значение гемоглобина. Этот подход обеспечит лечение анемии не как симптома, а как гипоксического синдрома (имеющего свои симптомы: снижение Sv, тахипноэ, тахикардию, высокий уровень лактата), когда это необходимо, избегая ненужного использования аллогенных эритроцитов.
Приведенные в обзоре факты являются подтверждением возрастающего интереса к проблеме сепсиса и его связей с железом. Поэтому крайне важно, чтобы фундаментальные исследования продолжали развиваться, с целью более глубокого понимания специфических изменений, происходящих в гомеостазе железа хозяина в ответ на септическую агрессию.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Орлов Ю.П. — научное руководство, редактирование статьи; Говорова Н.В., Лукач В.Н., — редактирование статьи; Байтугаева Г.А., Клементьев А.В., Какуля Е.Н. — набор и обработка материала, написание обзора.
ORCID авторов
Орлов Ю.П. — 0000-0002-6747-998X
Говорова Н.В. — 0000-0002-0495-902X
Лукач В.Н. — 0000-0002-9440-3235
Байтугаева Г.А. — 0000-0002-6479-7915
Клементьев А.В. — 0000-0002-7545-4782
Какуля Е.Н. — 0000-0002-2811-6051
Литература
-
Słomka A., Zekanowska E., Piotrowska K., Kwapisz J. Iron metabolism and maternal-fetal iron circulation. Postepy Hig Med Dosw (Online). 2012; 66: 876–887. DOI: 10.5604/17322693.1019651
-
Tandara L., Salamunic I. Iron metabolism: current facts and future directions. Biochem. Med. (Zagreb). 2012; 22 (3): 311–328.
-
Anderson G.J., Fraser D.M. Current understanding of iron homeostasis. Am J ClinNutr. 2017; 106(6): 1559S–1566S. DOI: 10.3945/ajcn.117.155804
-
Zhang D.L., Ghosh M.C., Rouault T.A. The physiological functions of iron regulatory proteins in iron homeostasis — an update. Front. Pharmacol. 2014; 5: 124. DOI: 10.3389/fphar.2014.00124
-
Kohgo Y., Ikuta K., Ohtake T., et al. Body iron metabolism and pathophysiology of iron overload. Int J Hematol. 2008; 88(1): 7–15. DOI: 10.1007/s12185-008-0120-5
-
Schmidt P.J. Regulation of Iron Metabolism by Hepcidin under Conditions of Inflammation. J Biol Chem. 2015; 290(31):18975–18983. DOI: 10.1074/jbc.R115.650150
-
Ganz T. Hepcidin, a key regulator of iron metabolism and mediator of anemia of inflammation. Blood. 2003; 102(3): 783–788.
-
Nemeth E., Ganz T. Regulation of iron metabolism by hepcidin. Annu Rev Nutr. 2006; 26: 323–342.
-
Nemeth E., Tuttle M.S., Powelson J., et al. Hepcidin regulates cellular iron efflux by binding to ferroportin and inducing its internalization. Science. 2004; 306(5704): 2090–2093.
-
Imam M.U., Zhang S., Ma J., et al. Antioxidants Mediate Both Iron Homeostasis and Oxidative Stress. Nutrients. 2017; 9(7): pii: E671. DOI: 10.3390/nu9070671
-
Olsson M.G., Allhorn M., Bülow L., et al. Pathological conditions involving extracellular hemoglobin: molecular mechanisms, clinical significance, and novel therapeutic opportunities for α(1)-microglobulin. Redox Signal. 2012; 17(5): 813–846. DOI: 10.1089/ars.2011.4282
-
Runyen-Janecky L.J. Role and regulation of heme iron acquisition in gram-negative pathogens. Front. CellInfect. Microbiol. 2013; 3: 55. DOI: 10.3389/fcimb.2013.00055
-
Dinkla S., van Eijk L.T., Fuchs B., et al. Inflammation-associated changes in lipid composition and the organization of the erythrocyte membrane. BBA Clin. 2016; 5: 186–192.
-
Dutra F.F., Bozza M.T. Heme on innate immunity and inflammation. Front Pharmacol. 2014; 5: 115. DOI: 10.3389/fphar.2014.00115
-
Gozzelino R., Arosio P. Iron Homeostasis in Health and Disease. Int. J. Mol. Sci. 2016; 17(1): 130. DOI: 10.3390/ijms17010130
-
Spitalnik S.L. Stored red blood cell transfusions: iron, inflammation, immunity, and infection. Transfusion. 2014; 54(10): 2365–2371. DOI: 10.1111/trf.12848
-
Bullen J.J. The significance of iron in infection. Rev Infect Dis. 1981; 3(6): 1127–1138.
-
Cassat J.E., Skaar E.P. Iron in infection and immunity. Cell Host Microbe. 2013; 13: 509–519. DOI: 10.1016/j.chom.2013.04.010
-
Орлов Ю.П., Лукач В.Н., Долгих В.Т. и др. Критические состояния как логическая и закономерная цепь событий в нарушении метаболизма железа (обобщение экспериментальных исследований). Биомедицинская химия. 2013; 59(6): 700–709.[Orlov Yu.P., Lukach V.N., Dolgih V.T., et al. Kriticheskie sostoyaniya kak logicheskaya i zakonomernaya tsep sobyitiy v narushenii metabolizma zheleza (obobschenie eksperimentalnyih issledovaniy). Biomeditsinskaya himiya. 2013; 59(6): 700–709. (InRuss)]
-
Saito H. Storage Iron Turnover from a New Perspective. Acta Haematol. 2019; 141(4): 201–208. DOI: 10.1159/000496324
-
Becker K.W., Skaar E.P. Metal limitation and toxicity at the interface between host and pathogen. FEMS Microbiol Rev. 2014; 38(6): 1235–1249. DOI: 10.1111/1574-6976.12087
-
Weiss G., Carver P.L. Role of divalent metals in infectious disease susceptibility and outcome. Clin Microbiol Infect. 2018; 24(1): 16–23. DOI: 10.1016/j.cmi.2017.01.018
-
Agranoff D., Krishna S. Metal ion transport and regulation in Mycobacterium tuberculosis. Front Biosci. 2004; 9: 2996–3006.
-
Schmitt M.P., Holmes R.K. Iron-dependent regulation of diphtheria toxin and siderophore expression by the cloned Corynebacterium diphtheriae repressor gene dtxR in C. diphtheriae C7 strains. Infect Immun. 1991; 59(6): 1899–1904.
-
Torres V.J., Attia A.S., Mason W.J, et al. Staphylococcus aureus fur regulates the expression of virulence factors that contribute to the pathogenesis of pneumonia. Infect Immun. 2010; 78(4): 1618–1628. DOI: 10.1128/IAI.01423-09
-
Mazmanian S.K., Skaar E.P., Gaspar A.H., et al. Passage of heme-iron across the envelope of Staphylococcus aureus. Science. 2003; 299(5608): 906–909.
-
Орлов Ю.П., Долгих В.Т., Глущенко А.В. Может ли свободный гемоглобин быть маркером тяжести общего состояния при сепсисе? Вестник интенсивной терапии имени А.И. Салтанова. 2018; 1: 48–54. [Orlov Yu.P., Dolgih V.T., Gluschenko A.V. Mozhet li svobodnyiy gemoglobin byit markerom tyazhesti obschego sostoyaniya pri sepsise? Vestnik intensivnoy terapii imeni A.I. Saltanova. 2018; 1; 48–54. (In Russ)]
-
Bonneau A., Roche B., Schalk I.J. Iron acquisition in Pseudomonas aeruginosa by the siderophorepyoverdine: an intricate interacting network including periplasmic and membrane proteins. Sci Rep. 2020; 10(1): 120. DOI: 10.1038/s41598-019-56913-x
-
Wilson B.R., Bogdan A.R., Miyazawa M., et al. Siderophores in Iron Metabolism: From Mechanism to Therapy Potential. Trends Mol Med. 2016; 22(12): 1077–1090. DOI: 10.1016/j
-
Li N., Zhang C., Li B., et al. Unique iron coordination in iron-chelating molecule vibriobactin helps Vibrio cholerae evade mammalian siderocalin-mediated immune response. J Biol Chem. 2012; 287(12): 8912–8919. DOI: 10.1074/jbc.M111. 316034
-
Behnsena J., Raffatellu M. Siderophores: More than Stealing Iron. mBio. 2016; 7(6): e01906– e01916. DOI: 10.1128/mBio.01906-16
-
Hartmann H., Eltzschig H.K., Wurz H., et al. Hypoxia-independent activation of HIF-1 by enterobacteriaceae and their siderophores. Gastroenterology. 2008; 134: 756–767. DOI: 10.1053/j.gastro.2007.12.008/
-
Holden V.I., Bachman M.A. Diverging roles of bacterial siderophores during infection. Metallomics. 2015; 7: 986–995. DOI: 10.1039/c4mt00333k
-
Butt A.T., Thomas M.S. Iron Acquisition Mechanisms and Their Role in the Virulence of Burkholderia Species. Front. Cell. Infect. Microbiol. 2017; 7: 460. DOI: 10.3389/fcimb.2017.00460
-
Ali M.K., Kim R.Y., Karim R., et al. Role of iron in the pathogenesis of respiratory disease. Int J Biochem Cell Biol. 2017; 88: 181–195. DOI: 10.1016/j.biocel.2017.05.003
-
Jiang Y., Jiang F., Kong F., et al. Inflammatory anemia-associated parameters are related to 28-day mortality in patients with sepsis admitted to the ICU: a preliminary observational study. Ann. Intensive Care. 2019; 9: 67. DOI: 10.1186/s13613-019-0542-7
-
Darveau M., Denault A.Y., Blais N., NotebaertE. Bench-to-bedside review: iron metabolism in critically ill patients. Crit Care. 2004; 8(5): 356–362. DOI: 10.1186/cc2862
-
Tacke F., Nuraldeen R., Koch A., et al. Iron parameters determine the prognosis of critically Ill patients. Crit Care Med. 2016; 44(6): 1049–1058. DOI: 10.1097/CCM.0000000000001607
-
Boshuizen M., Binnekade J.M., Nota B., et al. Iron metabolism in critically ill patients developing anemia of inflammation: a case control study. Ann Intensive Care. 2018; 8(1): 56. DOI: 10.1186/s13613-018-0407-5
-
Weiss G., Ganz T., Goodnough L.T. Anemia of inflammation. Blood. 2019; 133(1): 40–50. DOI: 10.1182/blood-2018-06-856500
-
Lasocki S., Lefebvre T., Mayeur C., et al. Iron deficiency diagnosed using hepcidin on critical care discharge is an independent risk factor for death and poor quality of life at one year: an observational prospective study on 1161 patients. Crit Care. 2018; 22(1): 314. DOI: 10.1186/s13054-018-2253-0
-
Lasocki S., Baron G., Driss F., et al. Diagnostic accuracy of serum hepcidin for iron deficiency in critically ill patients with anemia. Intensive Care Med. 2010; 36(6): 1044–1048. DOI: 10.1007/s00134-010-1794-8
-
Claessens Y.E., Fontenay M., Pene F., et al. Erythropoiesis abnormalities contribute to early-onset anemia in patients with septic shock. Am J Respir Crit Care Med. 2006; 174(1): 51–57. DOI: 10.1164/rccm.200504–561OC
-
Van Iperen C.E., Gaillard C.A., Kraaijenhagen R.J., et al. Response of erythropoiesis and iron metabolism to recombinant human erythropoietin in intensive care unit patients. Crit Care Med. 2000; 28(8): 2773–2778. DOI: 10.1097/00003246-200008000-00015
-
Ganz T. Erythropoietic regulators of iron metabolism. Free Radic Biol Med. 2019; 133: 69–74. DOI: 10.1016/j.freeradbiomed.2018.07.003
-
Rogiers P., Zhang H., Leeman M., et al. Erythropoietin response is blunted in critically ill patients. Intensive Care Med. 1997; 23(2): 159–162. DOI: 10.1007/s001340050310
-
Elliot J.M., Virankabutra T., Jones S., et al. Erythropoietin mimics the acute phase response in critical illness. Crit Care. 2003; 7(3): R35–R40. DOI: 10.1186/cc2185
-
Ganz T., Nemeth E. Iron homeostasis in host defence and inflammation. Nat Rev Immunol. 2015; 15(8): 500–510. DOI: 10.1038/nri3863
-
Rodriguez R.M., Corwin H.L., Gettinger A., et al. Nutritional deficiencies and blunted erythropoietin response as causes of the anemia of critical illness. J Crit Care 2001; 16(1): 36–41.
-
Shah A., Roy N.B., McKechnie S., et al. Iron supplementation to treat anaemia in adult critical care patients: a systematic review and meta-analysis. Crit Care. 2016; 20(1): 306. DOI: 10.1186/s13054-016-1486-z
-
Weiss G., Ganz T., Goodnough L.T. Anemia of inflammation. Blood. 2019; 133(1): 40–50. DOI: 10.1182/blood-2018-06-856500
-
Shah A., Roy N.B., McKechnie S., et al. Iron supplementation to treat anaemia in adult critical care patients: a systematic review and meta-analysis. Crit Care. 2016; 20(1): 306. DOI: 10.1186/s13054-016-1486-z
-
Vincent J.L., Baron J.F., Reinhart K., et al. Anemia and blood transfusion in critically ill patients. JAMA. 2002; 288(12): 1499–1507. DOI: 10.1001/jama.288.12.1499
-
Islam S., Jarosch S., Zhou J., et al. Anti-inflammatory and anti-bacterial effects of iron chelation in experimental sepsis. J SurgRes. 2016; 200(1): 266–273. DOI: 10.1016/j.jss.2015.07.001
-
Xia Y., Farah N., Maxan A., et al. Therapeutic iron restriction in sepsis. Med Hypotheses. 2016; 89: 37–39. DOI: 10.1016/j.mehy.2016.01.018
-
Lan P., Pan K.H., Wang S.J., et al. High Serum Iron level is Associated with Increased Mortality in Patients with Sepsis. Sci Rep. 2018; 8(1): 11072. DOI: 10.1038/s41598-018-29353-2
-
Gomes A.C., Moreira A.C., Mesquita G., Gomes M.S. Modulation of Iron Metabolism in Response to Infection: Twists for All TastesPharmaceuticals (Basel). 2018; 11(3). DOI: 10.3390/ph21030084
-
Ang M.T.C., Gumbau-Brisa R., Allan D.S., et al. DIBI, a 3-hydroxypyridin-4-one chelator iron-binding polymer with enhanced antimicrobial activity. Medchemcomm. 2018; 9(7): 1206–1212. DOI: 10.1039/c8md00192h
-
Thorburn T., Aali M., Kostek L., et al. Anti-inflammatory effects of a novel iron chelator, DIBI, in experimental sepsis. Clin Hemorheol Microcirc. 2017; 67(3–4): 241–250. DOI: 10.3233/CH-179205
-
Savage K.A., del Carmen Parquet M., Allan D.S., et al. Iron Restriction to Clinical Isolates of Candida albicans by the Novel Chelator DIBI Inhibits Growth and Increases Sensitivity to Azoles In Vitro and In Vivo in a Murine Model of Experimental Vaginitis. Antimicrob Agents Chemother. 2018; 62. DOI: 10.1128/AAC.02576-17
-
Richter K., Thomas N., Zhang G., et al. Deferiprone and Gallium-Protoporphyrin Have the Capacity to Potentiate the Activity of Antibiotics in Staphylococcus aureus Small Colony Variants. Front. Cell. Infect. Microbiol. 2017; 7: 280. DOI: 10.3389/fcimb.2017.00280
-
Islam S., Jarosch S., Zhou J., et al. Anti-inflammatory and anti-bacterial effects of iron chelation in experimental sepsis. J. Surg. Res. 2016; 200: 266–273. DOI: 10.1016/j.jss.2015.07.001.j.jinorgbio.2013 .01.002
-
Dupuis C., Sonneville R., Adrie C., et al. Impact of transfusion on 2017. Ann Intensive Care. 2017; 7(1): 5. DOI: 10.1186/s13613-016-0226-5
-
Rodriguez R.M., Corwin H.L., Gettinger A., et al. Nutritional deficiencies and blunted erythropoietin response as causes of the anemia of critical illness. J CritCare 2001; 16(1): 36–41.
-
Salisbury A.C., Reid K.J., Alexander K.P., et al. Diagnostic blood loss from phlebotomy and hospital-acquired anemia during acute myocardial infarction. Archivesofinternal medicine. 2011; 171(18): 1646–1653. DOI: 10.1001/archinternmed.2011.361
-
Kristof K., Büttner B., Grimm A., et al. Anaemia requiring red blood cell transfusion is associated with unfavourable 90-day survival in surgical patients with sepsis. BMC Res Notes. 2018; 11(1): 879. DOI: 10.1186/s13104-018-3988-z
-
Nielsen N.D., Martin-Loeches I., Wentowski C. The Effects of red Blood Cell Transfusion on Tissue Oxygenation and the Microcirculation in the Intensive Care Unit: A Systematic Review. Transfus Med Rev. 2017; 31(4): 205–222. DOI: 10.1016/j.tmrv.2017.07.003
-
Dupuis C., Sonneville R., Adrie C., et al. Review Impact of transfusion on patients with sepsis admitted in intensive care unit: a systematic review and meta-analysis. Ann Intensive Care. 2017; 7(1):5.
Сопряженность уровня гликемии и функциональных показателей миокарда у больных ишемической болезнью сердца на фоне сахарного диабета 2-го типа | Кондратьева
1. Сахарный диабет 2-го типа: от теории к практике; под ред. И.И. Дедова, М.В. Шестаковой. М.: Медицинское информационное агентство; 2016:571.
2. Leon B.M., Maddox T.M. Diabetes and cardiovascular disease: Epidemiology, biological mechanisms, treatment recommendations and future research. World J. Diabetes. 2015;6(13):1246–1258. DOI: 10.4239/wjd.v6.i13.1246.
3. Stratton I.M., Adler A.I., Neil H.A., Matthews D.R., Manley S.E., Cull C.A. et al. Association of glycaemia with macrovascular and microvascular complications of type 2 diabetes (UKPDS 35): Prospective observational study. BMJ. 2000;321(7258):405–412. DOI: 10.1136/bmj.321.7258.405.
4. Holman R.R., Paul S.K., Bethel M.A., Matthews D.R., Neil H.A.W. 10-year follow-up of intensive glucose control in type 2 diabetes. N. Engl. J. Med. 2008;359(15):1577–1589. DOI: 10.1056/NEJMoa080647.
5. Nathan D.M., Cleary P.A., Backlund J.Y., Genuth S.M., Lachin J.M., Orchard T.J. et al. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N. Engl. J. Med. 2005;353(25):2643–2653. DOI: 10.1056/NEJMoa052187.
6. The ACCORD Study Group. Long-term effects of intensive glucose lowering on cardiovascular outcomes. N. Engl. J Med. 2011;364(9):818–828. DOI: 10.1056/NEJMoa1006524.
7. Skyler S., Bergenstal R., Bonow R., Buse J., Deedwania P., Gale E.A. et al. Intensive glycemic control and the prevention of cardiovascular events: implications of the ACCORD, ADVANCE, and VA diabetes trials: a position statement of the American Diabetes Association and a scientific statement of the American College of Cardiology Foundation and the American Heart Association. Circulation. 2009;119(2):351–357. DOI: 10.1161/CIRCULATIONAHA.108.191305.
8. Zoungas S., Chalmers J., Neal B., Billot L., Li Q., Hirakawa Y. et al. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N. Engl. J. Med. 2014;371(15):1392–1406. DOI: 10.1056/NEJMoa1407963.
9. Bejan-Angoulvant T., Cornu C., Archambault P., Tudrej B., Audier P., Brabant Y. et al. Is HbA1c a valid surrogate for macrovascular and microvascular complications in type 2 diabetes? Diab. Metabol. 2015;41(3):195–201. DOI: 10.1016/j.diabet.2015.04.001.
10. Wang P., Huang R., Lu S., Xia W., Sun H., Sun J. et al. HbA1c below 7% as the goal of glucose control fails to maximize the cardiovascular benefits: a meta-analysis. Cardiovasc. Diabetol. 2015;14:124. DOI: 10.1186/s12933-015-0285-1.
11. IDF Annual Report 2015 by İnternational Diabetes Federation. URL: issuu.com/int.diabetes. federation/docs/idf.
12. Рябова Т.Р., Рябов В.В., Соколов А.А., Дудко В.А., Репин А.Н., Марков В.А. и др. Динамика структурно-геометрических и функциональных показателей левого желудочка в ранние и поздние сроки инфаркта миокарда. Ультразвуковая и функциональная диагностика. 2001;(3):54–60.
13. Uhl S., Freichel M., Mathar I. Contractility measurements on isolated papillary muscles for the Investigation of Cardiac Inotropy in Mice. J. Vis. Exp. 2015;(103):53076. DOI: 10.3791/53076.
14. Кондратьева Д.С., Афанасьев С.А., Реброва Т.Ю., Попов С.В. Сопряженность сократительной активности миокарда и уровня окислительного стресса у крыс при сочетанном развитии постинфарктного кардиосклероза и сахарного диабета. Известия Российской академии наук. Серия биологическая. 2019;(2):197–203.
15. Алгоритмы специализированной медицинской помощи больным сахарным диабетом; под ред. И.И. Дедова, М.В. Шестаковой, А.Ю. Майорова; 8-й вып. М.: УП ПРИНТ; 2017:112.
16. Palmieri V., Bella J.N., Arnett D.K., Liu J.E., Oberman A., Schuck M.Y. et al. Effect of type 2 diabetes mellitus on left ventricular geometry and systolic function in hypertensive subjects: Hypertension Genetic Epidemiology Network (HyperGEN) Study. Circulation. 2001;103(1):102–107. DOI: 10.1161/01.cir.103.1.102.
17. Fox C.S. Cardiovascular disease risk factors, type 2 diabetes mellitus, and the Framingham Heart Study. Trends Cardiovasc. Med. 2010;20(3):90–95. DOI: 10.1016/j.tcm.2010.08.001.
18. Королева Е.В., Хохлов А.Л. Факторы, влияющие на развитие структурно-функциональных нарушений сердца у больных сахарным диабетом 2-го типа. Международный научно-исследовательский журнал. 2017;58(4):156–159. DOI: 10.23670/IRJ.2017.58.152.
19. Sprenkeler D.J., Vos M.A. Post-extrasystolic potentiation: Link between Ca(2+) homeostasis and heart failure? Arrhythm. Electrophysiol. Rev. 2016;5(1):20–26. DOI: 10.15420/aer.2015.29.2.
20. Zima A.V., Kockskȁmper J., Blatter L.A. Cytosolic energy reserves determine the effect of glycolytic sugar phosphates on sarcoplasmic reticulum Ca2+ release in cat ventricular myocytes. J. Physiol. 2006;577(1):281–293. DOI: 10.1113/jphysiol.2006.117242.
21. Ritterhoff J., Tian R. Metabolism in cardiomyopathy: every substrate matters. Cardiovasc. Res. 2017;113(4):411–421. DOI: 10.1093/cvr/cvx017.
Латентная железосвязывающая способность сыворотки
Латентная железосвязывающая способность сыворотки — лабораторный показатель, отражающий потенциальную способность сыворотки крови к связыванию дополнительного количества железа.
Синонимы русские
Ненасыщенная железосвязывающая способность сыворотки, НЖСС, ЛЖСС.
Синонимы английские
Iron indices, iron profile, unsaturated iron binding capacity, UIBC.
Метод исследования
Колориметрический фотометрический метод.
Единицы измерения
Мкмоль/л (микромоль на литр).
Какой биоматериал можно использовать для исследования?
Венозную кровь.
Как правильно подготовиться к исследованию?
- Не принимать пищу в течение 8 часов до исследования, можно пить чистую негазированную воду.
- Прекратить прием лекарственных препаратов, содержащих железо, за 72 часа до исследования.
- Исключить физическое и эмоциональное перенапряжение и не курить в течение 30 минут до исследования.
Общая информация об исследовании
Железо – важный микроэлемент в организме. Оно является частью гемоглобина, который заполняет эритроциты и позволяет им переносить кислород от легких к органам и тканям.
Железо входит в состав мышечного белка миоглобина и некоторых ферментов. Оно всасывается из пищи и затем переносится трансферрином – специальным белком, который образуется в печени.
Обычно в организме содержится 4-5 г железа, около 3-4 мг (0,1 % от общего количества) циркулирует в крови «в связке» с трансферрином. Уровень трансферрина зависит от функционирования печени и от питания человека. В норме железом заполнена 1/3 связывающих центров трансферрина, остальные 2/3 остаются в резерве. Показатель латентной железосвязывающей способности сыворотки (ЛЖСС) отражает, сколько трансферрина «не заполнено» железом.
Этот параметр может рассчитываться по следующей формуле: ЛЖСС = ОЖСС – железо в сыворотке (ОЖСС – это общая железосвязывающая способность сыворотки крови – показатель, характеризующий максимальную возможность трансферрина «заполниться» железом).
При дефиците железа трансферрина становится больше, чтобы этот белок мог связаться с небольшим количеством железа в сыворотке. Соответственно, увеличивается и количество «не занятого» железом трансферрина, то есть латентная железосвязывающая способность сыворотки.
И напротив, при избытке железа почти все связывающие центры трансферрина заняты этим микроэлементом, поэтому латентная железосвязывающая способность сыворотки снижается.
Количество сывороточного железа может значительно варьироваться в разные дни и даже в течение одних суток (особенно в утренние часы), однако ОЖСС и ЛЖСС в норме остаются относительно стабильными.
На ранних стадиях недостаток железа иногда не проявляется никакими симптомами. Если человек в остальном здоров, то заболевание может дать о себе знать только при снижении гемоглобина ниже 100 г/л. Обычно это жалобы на слабость, утомляемость, головокружение, головные боли.
Для чего используется исследование?
Чтобы определить количество железа в организме и его связь с белками крови (вместе с анализом на железо в сыворотке, иногда с тестом на ОЖСС и на трансферрин). Эти исследования позволяют рассчитать процент насыщения трансферрина железом, то есть определить, сколько именно железа переносит кровь. Данный показатель наиболее точно характеризует обмен железа.
Цель таких анализов – диагностика дефицита или избытка железа. У пациентов с анемией они позволяют выяснить, вызвана ли болезнь дефицитом железа или иными причинами, например хроническим заболеванием или дефицитом витамина B12.
Когда назначается исследование?
- Когда выявлены какие-то отклонения в общем анализе крови, анализе на гемоглобин, гематокрит, количество эритроцитов (вместе с тестом на железо в сыворотке).
- При подозрении на дефицит или избыток железа в организме. При сильной нехватке железа бывает одышка, боль в грудной клетке и в голове, слабость в ногах. У некоторых появляется желание употреблять в пищу необычные продукты (мел, глину), жжение кончика языка, трещины в уголках рта. У детей могут возникнуть трудности с обучением.
- При подозрении на перегрузку организма железом (гемохроматоз). Это состояние проявляется по-разному, например болью в суставах или в животе, слабостью, усталостью, снижением сексуального влечения, нарушением сердечного ритма.
- При наблюдении за эффективностью лечения недостатка или избытка железа.
Что означают результаты?
Референсные значения: 20 — 62 мкмоль/л.
Интерпретация результатов анализа на ЛЖСС, как правило, производится с учетом остальных показателей, оценивающих метаболизм железа.
Причины повышения ОЖСС
- Анемия. Она обычно вызвана хронической кровопотерей или недостаточным употреблением мясных продуктов.
- Третий триместр беременности. В этом случае уровень железа в сыворотке снижается из-за повышения потребности в нем.
- Острый гепатит.
- Множественные переливания крови, введение железа внутримышечно, неадекватное назначение препаратов железа.
Причины понижения ОЖСС
- Хронические заболевания: системная красная волчанка, ревматоидный артрит, туберкулез, бактериальный эндокардит, болезнь Крона и др.
- Гипопротеинемия, связанная с расстройствами всасывания, хроническим заболеванием печени, ожогами. Уменьшение количества белка в организме приводит, в том числе, к падению уровня трансферрина, что снижает ОЖСС.
- Наследственный гемохроматоз. При этом заболевании из пищи всасывается слишком много железа, избыток которого откладывается в различных органах, вызывая их повреждение.
- Талассемия – наследственное заболевание, при котором изменена структура гемоглобина.
- Цирроз печени.
- Гломерулонефрит – воспаление почек.
Что может влиять на результат?
- Эстрогены, оральные контрацептивы приводят к повышению ЛЖСС.
- АКТГ, кортикостероиды, тестостерон могут снижать ЛЖСС.
- Количество сывороточного железа может значительно варьироваться в разные дни и даже в течение одних суток (особенно в утренние часы), однако ЛЖСС и ОЖСС в норме остаются относительно стабильными.
Скачать пример результата
Важные замечания
- Общая железосвязывающая способность сыворотки (ОЖСС) вычисляется как сумма ЛЖСС и железа в сыворотке.
- При нехватке железа его уровень падает, однако ЛЖСС повышается.
Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, гематолог, гастроэнтеролог, ревматолог, нефролог, хирург.
Стимуляция синтеза фетального гемоглобина как альтернативный метод лечения манифестных форм -талассемии | Красильникова
1. Nathan D., Oski F. Hematology of Infancy and Childhood, 3th ed. Philadelphia, W.B. Saunders, 1987; Vol. 1; 847 p.
2. Cazzola M., Borgna-Pignatti C., Locatelli F., Ponchio L., Beguin Y., De Stefano P. A moderate transfusion regimen may reduce iron loading in beta-thalassemia major without producing excessive expansion of erythropoiesis. Transfusion 1997; 37 (2): 135-40.
3. Cappellini M.D., Cohen A., Eleftheriou A., Piga A., Porter J., Taher A. Guidelines for the Management of Transfusion Dependent Thalassaemia, 2nd Edition TIF, 2007, 203 p.
4. Cappellini M.D., Bejaoui M., Agaoglu L., Canatan D., et al. Iron chelation with deferasirox in adult and pediatric patients with thalassemia major: efficacy and safety during 5 years’ follow-up. Blood 2011; 118 (4): 884-93.
5. Rachmilewitz EA, Giardina PJ. How I treat thalassemia. Blood 2011; 118 (13): 3479-88.
6. Sharef S.W., Al-Hajri M., Beshlawi I., Al-Shahrabally A., Elshinawy M., Zachariah M., et al. Optimizing Hydroxyurea use in children with sickle cell disease: low dose regimen is effective. Eur J Haematol 2013; 90 (6): 519-24.
7. Karnon J., Zeuner D., Brown J., Ades A.E., Wonke B., Modell B. Lifetime treatment costs of beta-thalassaemia major. Clin Lab Haematol 1999; 21(6): 377-85.
8. Ginsberg G., Tulchinsky T., Filon D., Goldfarb A., Abramov L., Rachmilevitz E.A. Cost-benefit analysis of a national thalassaemia prevention programme in Israel. J Med Screen 1998; 5 (3): 120-6.
9. de Silva S., Fisher C.A., Premawardhena A., Lamabadusuriya S.P., Peto T.E., Perera G., еt al. Thalassaemia in Sri Lanka: implications for the future health burden of Asian populations. Sri Lanka Thalassaemia Study Group Lancet 2000; 355 (9206): 786-91.
10. Angelucci E., Matthes-Martin S., Baronciani D., Bernaudin F.,Bonanomi S., Cappellini M.D., et al. Hematopoietic Stem Cell Transplantation In Thalassemia Major And Sickle Cell Disease: Indications And Management Recommendations From An International Expert Panel. Haematologica 2014; 99: 811-20.
11. Наследственные анемии и гемоглобинопатии (Под ред. Ю.Н. Токарева, С.Р. Холлан, Х.Ф. Корраля-Альмонте). — М.: Медицина, 1983, 336 с.
12. Schroeder W.A., Huisman T.H., Shelton J.R., Shelton J.B., Kleihauer E.F., Dozy A., Robberson B. Evidence of multiple structural genes for -chain of human fetal hemoglobin. Proc Natl Acad Sci USA 1968; 60: 537.
13. Deisseroth A., Neinhuis A., Lawrence J. Chromosomal localization of the human beta globin gene to human chromosome 11 in somatic cell hybrids. Proc Natl Acad Sci USA 1978; 75: 1456.
14. Важнейшие гемоглобинопатии и талас-семические синдромы (Под ред. А.Г. Румянцева, Ю.Н. Токарева, Н.С. Сметаниной). — М.: Практическая медицина, 2015, 448 с.
15. Лимборская С.А. Молекулярная природа генетической гетерогенности талассемии / В кн.: Теоретические проблемы медицинской генетики. — М., 1979, с. 4-16.
16. Stamatoyannopoulos G., Nienhuis A.W., Stamatoyannopoulos G., Papayannopoulou T., Stamatoyannopoulos G., Nienhuis A.W., editors. Fetal hemoglobin and the erythroid stem cell differentiation process. Cellular and Molecular Regulation of Hemoglobin Switching. Grune and Stratton; New York, NY. 1979; p. 323-50.
17. Wood W.G. Haemoglobin synthesis during human fetal development. Br Med Bull 1976; 32: 282-7.
18. Шиффман Ф.Д. Патофизиология крови. — М.: БИНОМ, 2009, 448 с.
19. Hematology: Basic principles and practice. Edited by: R. Hoffman, E.J. Benz, S.J. Shattil, B. Furie, H.J. Cohen, L.E. Silberstein, P. McGlave 4th ed. 2005, 2821 p.
20. Musallam K.M., Taher A.T., Cappellini M.D., Sankaran V.G. Clinical experience with fetal hemoglobin induction therapy in patients with -thalassemia. Blood 2013; 121: 2199-212.
21. Rund D., Rachmilewitz E. β-thalassemia. N Engl J Med, 2005; 353: 1135-1146.
22. Ley T.J., DeSimone J., Anagnou N.P., Keller G.H., Humphries R.K., Turner P.H., et al. 5-azacytidine selectively increases gamma-globin synthesis in a patient with beta+ thalassemia. N Engl J Med 1982; 307: 1469.
23. Charache S., Dover G., Smith K., Talbot C.C. Jr., Moyer M., Boyer S. Treatment of sickle cell anemia with 5-azacytidine results in increased fetal hemoglobin production and is associated with nonrandom hypomethylation of DNA around the gamma-delta-beta-globin gene complex. Proc Natl Acad Sci USA 1983; 80: 4842.
24. Ley T.J., DeSimone J., Noguchi C.T., Turner P.H., Schechter A.N., Heller P., Nienhuis A.W. 5-azacytidine increases gamma-globin synthesis and reduces the proportion of dense cells in patients with sickle cell anemia. Blood 1983; 62: 370.
25. Nienhuis A.W., Ley T.J., Humphries R.K., Young N.S., Dover G. Pharmacological manipulation of fetal hemoglobin synthesis in patients with severe beta thalassemia. Ann NY Acad Sci 1985; 445: 198.
26. Dover G.J., Humphries R.K. Pharmacological manipulation of fetal hemoglobin synthesis. In: Experimental Approaches for the Study of Hemoglobin Switching. Stamatoyannopoulos, G., and Nienhuis, A.W. (eds.), New York, Alan R. Liss, Inc., 1985, pp. 447-54.
27. Letvin N.L., Linch D.C., Beardsley G.P., Mcintyre K.W., Miller B.A., Nathan D.G. Influence of cell cycle phase-specific agnts on Simian fetal hemoglobin synthesis. J Clin Invest, 1985; 75: 1999.
28. Borgna-Pignatti C. Modern treatment of thalassaemia intermedia. Br J Haematol 2007; 138: 291-304.
29. Riggs A.D. 5-Methylcytosine, gene regulation, and cancer. Adv Can Res 1983; 40: 1.
30. Santi D.V., Garrett C.E., Barr P.J. On the mechanism of inhibition of DNA-cytosine methyltransferases by cytosine analogs. Cell 1983; 33: 9.
31. Cooper D.N. Eukaryotic DNA methylation. Hum Genet, 1983; 64: 315.
32. Lowrey C.H., Nienhuis A.W. Treatment with azacytidine of patients with end-stage -thalassemia. N Engl J Med 1993; 334: 845-8.
33. Сметанина Н.С., Румянцева Ю.В., Кутлар А., Токарев Ю.Н. Гидроксимочевина в лечении серповидно-клеточной анемии. Гематология и трансфузиология, 2003; 2 (1): 22-6.
34. Loukopoulos D., Voskaridou E., Stamoulakatou A., Papassotiriou Y., Kalotychou V., Loutradi A., et al. Hydroxyurea therapy in thalassemia. Ann N Y Acad Sci 1998; 850: 120-8.
35. Hoppe C., Vichinsky E., Lewis B., Foote D., Styles L. Hydroxyurea and sodium phenylbutyrate therapy in thalassemia intermedia. Am J Hematol 1999; 62: 221-7.
36. De Paula E.V., Lima C.S., Arruda V.R., Alberto F.L., Saad S.T., Costa F.F. Long-term hydroxyurea therapy in beta-thalassaemia patients. Eur J Haematol 2003; 70: 151-5.
37. Steinberg M.H., Rodgers G.P. Pharmacologic modulation of fetal hemoglobin. Medicine 2001; 80: 328-44.
38. Mancuso A., Maggio A., Renda D., Di Marzo R., Rigano P. Treatment with hydroxycarbamid for intermedia thalassemia: decrease of efficacy in some patients during log-term follow up. Bri J Haematol 2006; 133: 105-6.
39. Chim C.S., Kwong Y.L., Lie A.K., Ma S.K., Chan C.C., Wong L.G., et al. Long-term outcome of 231 patients with essential thrombocythemia: prognostic factors for thrombosis, bleeding, myelofibrosis, and leukemia. Arch Inter Med 2005; 165: 2651-8.
40. Wilson S. Acute leukemia in a patient with sickle cell anemia treated with hydroxyurea. Ann Inter Med 2000; 133: 925-6.
41. Amer J., Dana M., Fibach E. The antioxidant effect of erythropoietin on thalassemic blood cells. Anemia 2010; Art. ID 978710, p. 11.
42. Oliveri N.F., Freedman M.H., Perrine S.P., Dover G.J., Sheridan B., Essentine D.L., Nagel R.L. Trial of recombinant human erythropoietin: Three patient with thalassemia intermedia. Blood 1992; 80: 3258-60.
43. Bourantas K., Economou G., Georgiou J. Administration of high doses of recombinant human erythropoietin to patients with beta-thalassemia intermedia: A preliminary trial. Eur J Haematol 1997; 58: 22-5.
44. Rachmilewitz E.A., Aker M. The role of recombinant human erythropoietin in the treatment of thalassemia. Ann N Y Acad Sci 1998; 850: 134-8.
45. Nisli G., Kavakli K., Aydinok Y., Aydinok Y. Recombinant erythropoietin trial in children with transfusion-dependent homozygous beta-thalassemia. Acta Haematol 1997; 98: 199-203.
46. Makis A.C., Chaliasos N., Hatzimichael E.C., Bourantas K.L. Recombinant human erythropoietin therapy in a transfusion-dependent beta-thalassemia major patient. Ann Hematol 2001; 80: 492-5.
47. Rachmilewitz E.A., Aker M. The role of recombinant human erythropoietin in the treatment of thalassemia. Ann N Y Acad Sci 1998; 850: 134-8.
48. Гасанова А.Б., Алимирзоева З.Х., Мамедова Т.А., Асадов Ч.Д. Применение рекомбинантного эритропоэтина в лечении промежуточной формы -талас-семии. Гематологияитрансфузиология, 2012; т. 57 (прилож.), с. 41.
49. Perrine S.P., Miller B.A., Faller D.V. Sodium butyrate enhances fetal globin expression in erythroid progenitors of patients with HbSS and Thalassemia. Blood 1989; 74: 454-9.
50. Perrine S.P., Greene M.F., Falle D.V. Delay in fetal globin switch in infants of diabetic mothers. N Engl J Med 1985; 312: 334-8.
51. Perrine S.P., Rudolph A., Faller D.V., Faller D.V. Butyrate infusions in the ovine fetus delay the biologic clock for globin gene switching. Proc Natl Acad Sci USA 1988; 85: 8540-2.
52. Perrine S.P., Ginder G.D., Faller D.V., Dover G.H., Ikuta T., Witkowska H.E., et al. A short-term trial of butyrate to stimulate fetal-globin gene expression in the -globin disorders. N Engl J Med 1993; 328: 81-6.
53. Sher G.D., Oliveri N.F. Rapid healing of chronic leg ulcers during arginine butyrate therapy in patients with sickle cell disease and thalassemia. Blood 1994; 84: 2378-80.
54. Atweh G.F., Sutton M., Nassif I., Boosalis V., Dover G.J., Wallenstein S., et al. Sustained induction of fetal hemoglobin by pulse butyrate therapy in sickle cell disease. Blood 1999; 93: 1790-7.
55. Dover G.J., Brusilow S., Samid D. Increased fetal hemoglobin in patients receiving sodium 4-phenylbutyrate. N Engl Med 1992; 327: 43-9.
56. Chiu R.W., Lau T.K., Leung T.N., Chow K.C., Chui D.H., Lo Y.M. Prenatal exclusion of beta thalassemia major by examination of maternal plasma. Lancet 2002; 360: 998-1000.
57. Saiki R.K., Walsh P.S., Levenson C.H., Erlich H. Genetic analysis of amplified DNA with immobilized sequence-specific oligonucleotide probes. Proc Natl Acad Sci USA 1989; 86: 6230-4.
58. Kawasaki E., Saiki R., Erlich H. Genetic analysis using polymerase chain reaction-amplified DNA and immobilized oligonucleotide probes: Reverse dot blot typing. Methods Enzymol, 1993; 218: 369-81.
59. Paulson R.F. Targeting a new regulator of erythropoiesis to alleviate anemia.Nat Med 2014; 20 (4): 334-5.
60. Suragani R.N., Cadena S.M., Cawley S.M., Sako D., Mitchell D., Li R., et al. Transforming growth factor-β superfamily ligand trap ACE-536 corrects anemia by promoting late-stage erythropoiesis. Nat Med 2014; 20 (4): 408-14.
61. Cappellini M.D., Porter J., Origa R., Forni G.L., Laadem A., Galacteros F., et al. A Phase 2a, Open-Label, Dose-Finding Study To Determine The Safety and Tolerability Of Sotatercept (ACE-011) In Adults With Beta ()-Thalassemia: Interim Results. Blood 2013; 122: 3448.
62. Cao A., Galanello R. Effect of consanguinity on screening for thalassemia. N Engl J Med 2002; 347: 1200-2.
63. El-Hazmi M.A., al-Momen A., Kandaswamy S., Huraib S., Harakati M., al-Mohareb F., Warsy A.S. On the use of hydroxyurea/erythropoietin combination therapy for sickle cell disease. Acta Heamatol 1995; 94 (3): 128-34.
64. СазоноваА.И., ЕсаянР.М., КолегаеваО.И., ГардановаЖ.Р. Эффективность и безопасность применения препаратов метформина при беременности для лечения геста-ционного сахарного диабета: совре-менный взгляд на проблему. Сахарный диабет 2016; 19 (2): 164-70.
65. Хижняк О. Метформин в профилактике метаболического синдрома у детей и взрослых /http://www.mif-ua.com/archive/article/2890
66. http://moikompas.ru/compas/foxo
67. Zhang Y., Weiss M., Sumazin P., Sheehan V.A. Metformin Induces FOXO3-Dependent Fetal Hemoglobin Production in Primary Erythroid Cells. Blood 2016; 128: 322.
68. https://clinicaltrials.gov/ct2/show/NCT02981329
Эритропоэз и обмен железа при ожогах | Баркова
1. Игнатов С. В. Система эритрона при ожогах. Гематология и трансфузиология 1990; 3 (35): 22—26.
2. Бернат И. Патогенез ожоговой анемии. Будапешт; 1975.
3. Парамонов Б. А., Порембский Я. О., Яблонский В. Г. Ожоги. Руководство для врачей. СПб.: СпецЛит; 2000.
4. Гусак В. К., Анишенко Л. Г., Фисталь Э. Я. и др. Возможные аспекты лечения анемии при тяжелой ожоговой травме. Травма 2001; 2 (2): 133—137.
5. Deitch E. A., Sitting K. M. A serial study of the erythropoietic response to thermal injury. Ann. Surg. 1993; 217: 293—299.
6. Рязанцева Н. В., Новицкий В. В., Рязанцев В. П. и др. Влияние ожоговой травмы на эритроциты. Гематология и трансфузиология 2002; 1 (47): 25—29.
7. Tomas C., Tomas L. Biochemical markers and hematologic indices in the diagnosis of functional iron deficiency. Clin. Chem. 2002; 48 (7): 1066—1076.
8. Нарциссов Р. П. Дегидрогеназы с применением пара-нитротетразолия фиолетового.В кн.: Н. С. Кисляк, Р. В. Ленская. Клетки крови у детей в норме и патологии. М.: Медицина; 1978. 148—150.
9. Баркова Э. Н., Жданова Е. В., Курлович Н. А. Хронофизиология и хронопатология обмена железа. Екатеринбург: Полиграфист; 2001.
10. Мосягина Е. Н. Нормальное кроветворение и его регуляция М.: Медицина; 1976. 341—363.
11. Стальная И. Д. Современные методы в биохимии. М.: Медицина; 1977. 63-66.
12. Spolarics Z., Siddiqi M., Siegel J. H. et al. Increased incidence of sepsis and altered monocyte functions in severely injured type A-glucose-6-phosphate dehydrogenase- deficient African American trauma patients. Crit. Care Med. 2001; 29:728-736.
13. Vincent J. L., Baron J. F., Reinhart K. D. et al. Anemia and blood transfusion in critically ill patients. JAMA 2002; 288: 1499—1507.
14. Nakao K. S., Sassa O. et al. Enzymatic studies on erythroid differentiation and proliferation. Ann. N.Y. Acad. Sci. 1968; 149: 224—232.
15. Stohlman F., Ebbe S., Morse B. et al. Regulation of erythropoiesis. XX. Kinetics of red cell production. Ann. N.Y. Acad. Sci. 1968; 149:156—172.
16. Lajtha L. G., Gilbert C. W., Cuzman F. Kinetics of haematopoietic colony. Brit. J. Haemat.1971; 20: 343—354.
17. Шостка Г. Д. Анемия и пути ее коррекции. В кн.: Лечение ХПН. СПб.: 1997. 242—274.
18. Bessis M., Brecher G. A second look at stress erythropoiesis — Unanswered questions. Blood Cells 1975; 1 (3): 409—414.
19. Paganini E., Abdulhadi M., Gartia J. et al. Recombinant human erythropoietin correcion of anemia. Trans. Am. Soc. Artif. Intern. Organs1989; 35: 513—515.
20. Zhang J., Lodish. H. F. Identification of K-ras as the major regulator for cytokine — dependent. Akt activation in erythroid progenitors in vivo. Proc. Natl. Acad. Sci. 2005; 102 (41): 14605—14610.
21. Nakae H., Endo S., Yamada Y., Inada K. Bound and solution adhesive molecule and cytokine levels in patients with severe burns. Burns 2000; 26: 39—44.
В поисках нормальной концентрации гемоглобина | Кровь
Бейтлер и Ваален 1 берут на себя титаническую задачу — взяться за определение анемии, которое существует почти 40 лет назад Всемирной организацией здравоохранения (ВОЗ). Авторы упоминают несколько причин, по которым эти старые параметры не могут считаться действительными, и мы полностью согласны со всеми из них. Кроме того, они описывают 2 новых крупных эпидемиологических исследования, NHANES-III (третье обследование здоровья и питания США) и базы данных Скриппса-Кайзера, которые демонстрируют очень похожие концентрации гемоглобина среди различных слоев населения США.Оба этих исследования следует использовать в качестве платформы для установления нижнего предела нормальной концентрации гемоглобина в крови. Однако мы не согласны с авторами в том, что рисование линии нормальности должно выполняться путем выбора произвольного 95%, 97,5% или любого другого процентного значения из распределения Гаусса. Мы не должны бояться поднять планку до уровня, при котором 22% или более предположительно здоровых мужчин или женщин в США будут иметь анемию. Вопрос, который необходимо задать, заключается в том, где мы начинаем определять, что полезно, а что нет.Подход, который мог бы помочь нам выйти из этой извечной дилеммы и привести к определению нижнего предела нормального гемоглобина, был представлен Закаем и др. 2 в их проспективном эпидемиологическом исследовании, в котором они принимают во внимание влияние концентрации гемоглобина в качестве независимого предиктор риска смертности. Нам хорошо известно, что употребление 133 г / л и 145 г / л (13,3 г / дл и 14,5 г / дл) для женщин и мужчин в возрасте 65 лет и старше соответственно может создать огромную нагрузку на общественное здравоохранение. Однако мы должны признать это, точно так же, как мы пришли к пониманию за последние 25 лет ценности установления здорового уровня холестерина липопротеинов низкой плотности (ЛПНП), а не прежних нормальных уровней по нашим стандартам населения.Даже сейчас соответствующий уровень холестерина ЛПНП корректируется для некоторых групп высокого риска до еще более низких пределов. Таким образом, другой урок, который должен дать нам пример холестерина ЛПНП, когда мы ищем новый нижний нормальный предел концентрации гемоглобина, — это стратификация населения по значимым сопутствующим сопутствующим заболеваниям, а не просто стремление к универсальному значению в зависимости от возраста, пола, и гонка.
Мы согласны с Берингером и Дарденом в том, что установление нормальных пределов сопряжено с трудностями и что пороговые значения всегда в некоторой степени произвольны.Если врачи предпочитают использовать границу 95%, они просто присваивают вероятность того, что пациент является частью нормального распределения значений гемоглобина. Как утверждают Берингер и Дарден, вполне возможно, что уровень гемоглобина должен быть выше. В баскетболе средний рост является недостатком, хотя это совершенно нормально; возможно, средний уровень гемоглобина также не является оптимальным для жизненной игры.
Мы также согласны с тем, что важно попытаться прийти к какому-то функциональному определению нормального.В случае их примера с холестерином ЛПНП и сердечными заболеваниями данные, необходимые для установления функциональных пределов, потребовались десятилетия, чтобы получить и продолжают модифицироваться дополнительными данными. В случае анемии мы только начинаем накапливать необходимые данные. Хотя исследование Zakai et al, 1 , которое показывает повышенную смертность среди субъектов 65 и старше с уровнем гемоглобина даже в «нормальном диапазоне», интригует, в других исследованиях 2,3 смешанные сопутствующие состояния составляли большую часть или все различия между анемичными и неанемическими группами.Более того, даже если бы 22% населения подвергались риску преждевременной смерти из-за низкого уровня гемоглобина, еще предстоит доказать, что терапия, направленная на снижение уровня гемоглобина, будет иметь какое-либо влияние на выживаемость. Кроме того, учитывая, что высокий уровень гемоглобина также оказывает пагубное влияние на функцию, вполне вероятно, что нормальное распределение гемоглобина представляет собой баланс, установленный силами эволюции. Будущие исследования, некоторые из которых мы надеемся провести, могут прояснить некоторые из этих вопросов.Между тем, мы считаем, что врачам придется довольствоваться эталонными стандартами, основанными на популяционных нормах, как мы поступаем с большинством других клинических лабораторных измерений.
Для корреспонденции: Эрнест Бейтлер, Исследовательский институт Скриппса, 10550 N Torrey Pines Rd, La Jolla, CA 92037; электронная почта: [email protected].
1Закай Н.А., Кац Р., Хирш С. и др.Проспективное исследование статуса анемии, концентрации гемоглобина и смертности в когорте пожилых людей: Исследование здоровья сердечно-сосудистой системы.
Arch Intern Med
.
2005
;
165
:
2214
-2220.2Parfrey PS, Foley RN, Wittreich BH, Sullivan DJ, Zagari MJ, Frei D. Двойное слепое сравнение полной и частичной коррекции анемии у пациентов с гемодиализом без симптомов болезни сердца.
Дж. Ам Соц Нефрол
.
2005
;
16
:
2180
-2189.3Косибород М., Кертис Дж. П., Ван Ю. Ф. и др. Анемия и исходы у пациентов с сердечной недостаточностью: исследование Национального проекта кардиологической помощи.
Arch Intern Med
.
2005
;
165
:
2237
-2244.
1Бейтлер Э., Ваален Дж. Определение анемии: каков нижний предел нормы концентрации гемоглобина в крови?
Кровь
.
2006
:
107
:
1747
-1750.2Закай Н., Кац Р., Хирш С. и др. Проспективное исследование статуса анемии, концентрации гемоглобина и смертности в когорте пожилых людей: Исследование здоровья сердечно-сосудистой системы.
Arch Intern Med
.
2005
;
165
:
2214
-2220. AQ1: Пожалуйста, вставьте основной заголовок для вашего письма.
Связь между анемией и уровнями свинца, меди, цинка и железа в крови у детей | BMC Research Notes
Более половины детей (63.33%) имели BLL ≥10 мкг / дл, аналогично исследованию, проведенному Jain et al [6]. которые также сообщили о значительной связи умеренной и тяжелой анемии с уровнем свинца в крови 10-19,9 мкг / дл. Хотя в настоящем исследовании сообщается о значительной связи легкой и тяжелой анемии с уровнями свинца в крови 10-20 мкг / дл, разница в результатах может быть связана с небольшим размером выборки в настоящем исследовании. Однако настоящее исследование аналогично оценке, полученной для детей в Индии [17, 18]. Пороговое значение 10 мкг / дл, определенное Центром по контролю и профилактике заболеваний как предел повышенного уровня свинца в крови, в первую очередь основано на неврологической токсичности [19].В последнее время безопасным считается уровень менее 10 мкг / дл [4].
Шварц и др. [20]. сообщили, что у детей, живущих вблизи заводов по производству первичного свинца в США, штат Айдахо, уровень свинца в крови был около 25 мкг / дл, и они были связаны с анемией в зависимости от дозы. Кроме того, Дроссос и др. [21]. сообщили, что у детей с BLL> 30 мкг / дл наблюдается линейное снижение уровня гемоглобина. Напротив, Фрум и др. [22]. предположил, что уровень гемоглобина плохо коррелировал с BLL, и предположил, что анемия не связана с свинцом при низком BLL.Однако в других исследованиях сообщалось о вариабельной ассоциации [23–27].
Свинец вызывает анемию, нарушая синтез гема и увеличивая скорость разрушения эритроцитов [28]. С другой стороны, также возможно, что дефицит железа, который является доказанной причиной анемии, приводит к увеличению абсорбции свинца в организме, что приводит к высокому BLL [29, 30]. Хотя причинно-следственную связь определить невозможно, результаты исследования ясно демонстрируют связь между различной степенью тяжести анемии и повышенным уровнем BLL.
В текущем исследовании высокий BLL среди школьников (> 6 лет) может быть связан с использованием карандаша в школе, а высокий BLL у мальчиков, чем девочки, может быть объяснен большим количеством увлечений мужчин.
Fe, Cu и Zn — важные элементы для поддержания жизни и здоровья. Pb, который является тяжелым металлом, может быть вредным для здоровья человека. Поэтому у детей определяли уровень этих элементов в крови. Из-за наличия высокого уровня BLL в питьевой воде, как сообщила ВОЗ, это исследование было проведено для выявления взаимосвязи между высоким уровнем свинца в крови, микроэлементами, а также гематологическими параметрами у детей.
В настоящем исследовании уровень железа в группе пациентов с анемией оказался значительно ниже, чем в контрольной группе, как и ожидалось, аналогично Jain et al [6]. представляет собой нахождение меры. Поскольку Fe играет важную роль во многих биологических процессах, а его дефицит является проблемой мирового здравоохранения, особенно для младенцев и быстро растущих подростков. Поэтому важно поддерживать концентрацию железа в узком нормальном диапазоне [31].
В настоящем исследовании уровень Zn в сыворотке крови больных анемией незначительно ниже, чем в контрольной группе.Существует антагонизм между абсорбцией Zn и Fe из желудочно-кишечного тракта, поскольку повышение концентрации железа в просвете кишечника может препятствовать поглощению Zn [32]. Исследование, проведенное Себахатом и др. [1]. обнаружили снижение уровня Zn в сыворотке и повышение уровня Cu в сыворотке крови в группе пациентов с анемией по сравнению с контрольной группой.
Соответственно, хотя настоящее исследование показало, что уровень Cu был выше у пациентов с анемией, чем в контрольной группе, это повышение не было статистически значимым.Однако Cu играет роль в абсорбции железа. Окисление двухвалентного железа до трехвалентного осуществляется церулоплазмином. Это истощение Cu может ухудшить абсорбцию железа [33].
В настоящем исследовании уровень Pb в сыворотке крови в группе пациентов с анемией был значительно выше, чем в контрольной. Возможное объяснение состоит в том, что дефицит Fe увеличивает всасывание Pb из кишечника. Аналогичным образом исследование, проведенное в Канаде, выявило высокий уровень BLL у детей с дефицитом железа [25]. Другие исследования выявили значительную связь между дефицитом железа и высоким уровнем свинца в крови [30, 34].
Текущие результаты показали, что значения Hb, Hct, MCV, MCH и ферритина у детей с анемией снизились, а уровень RDW увеличился по сравнению с контрольной группой.
Кроме того, уровень свинца в крови был выше у детей с анемией. Это может быть связано с тем, что снижение уровня железа увеличивает абсорбцию свинца, что, в свою очередь, влияет на синтез гема, тем самым отрицательно влияя на гематологические параметры [28]. Более того, было обнаружено, что высокие BLL связаны с более низкими уровнями железа и ферритина, чем более низкие уровни свинца.Возможно, абсорбция железа происходит преимущественно в двенадцатиперстной кишке и тощей кишке. Кроме того, на абсорбцию железа влияет ряд диетических факторов, при этом аскорбат и цитрат увеличивают его усвоение. В частности, свинец является пагубным элементом для метаболизма железа. Поскольку он поглощается механизмами поглощения железа вместо железа и посредством конкурентного торможения. Более того, он препятствует ряду важных железозависимых метаболических этапов, таких как биосинтез гема [2].
В исследованных образцах воды считались пригодными для питья согласно EMH [35].поскольку уровень свинца был ниже допустимого предела (5 мкг / дл), хотя ВОЗ [36]. считается выше допустимого предела, равного 1 мкг / дл. В Дакахлии (Египет) уровень свинца в питьевой воде был выше допустимого предела по данным ВОЗ. В Египте контроль над свинцом неэффективен, поэтому уровень свинца в питьевой воде в некоторых спорадических районах все еще остается высоким [37].
В 2003–2004 годах водопроводная вода в Вашингтоне, округ Колумбия, превышала нормативы Агентства по охране окружающей среды (EPA).Это произошло из-за изменения процедур обеззараживания воды, которые увеличили способность воды вымывать свинец из соединительных труб между водопроводом и внутренним водопроводом в старых домах [38].
В развивающихся странах, таких как Индия, борьба с загрязнением свинцом идет гораздо медленнее и носит спорадический характер. По оценкам некоторых исследований, более половины детей в Индии имеют уровень свинца в крови> 10 мкг / дл [18].
Настоящая работа выявила связь между уровнем свинца в крови и низким уровнем сывороточного железа и ферритина.Это похоже на результаты нескольких исследований, в которых сообщается о более высокой доле детей с повышенным уровнем свинца в крови среди детей с низким уровнем железа и ферритина [39–41]. Эти результаты предполагают, что недостаточный статус железа может усилить эффект загрязнения окружающей среды свинцом за счет увеличения абсорбции и, возможно, удержания свинца в организме [39].
Напротив, Hershko et al [42] сообщили об отсутствии корреляции между железом и свинцом в крови у детей старшего возраста.
Гемоглобин и железо — NHS Blood Donation
Каждый раз, когда вы приходите сдавать кровь или тромбоциты, мы проверяем ваш уровень гемоглобина.
Гемоглобин или Hb — это белок, содержащийся в красных кровяных тельцах, который переносит кислород по вашему телу и придает крови красный цвет.
Уровни гемоглобина варьируются от человека к человеку. У мужчин обычно уровень выше, чем у женщин.
Мы установили довольно высокий «пороговый» уровень, потому что мы хотим быть уверены, что ваш гемоглобин не упадет ниже нормы после того, как вы сдадите кровь.
Если вы жертвуете тромбоциты, вы каждый раз теряете определенное количество эритроцитов, и после нескольких раз ваши запасы железа и гемоглобин могут упасть.Для обеспечения вашей безопасности нам необходимо, чтобы ваш гемоглобин составлял не менее 125 г / л для женщин и 135 г / л для мужчин до сдачи крови.
Почему уровень гемоглобина может быть слишком низким для сдачи крови
Есть три общие причины:
- Различия между людьми — некоторые из нас обычно имеют «низкий» уровень.
- Железо — всем нам нужно железо, чтобы производить гемоглобин. Если у вас низкие запасы железа, гемоглобин может упасть ниже нормы (или ниже донорского уровня).
- Процедура тестирования — хотя мы очень внимательно относимся к нашему тесту во время сеанса, иногда он занижает количество гемоглобина в крови.
При следующем пожертвовании
Вам будет предложено уйти как минимум за 3 месяца до следующего донорства, чтобы ваш гемоглобин достиг более высокого уровня. Мы надеемся, что в следующий раз, когда вы придете сдавать кровь, ваш гемоглобин будет выше нашего «порогового» уровня, и вы больше не будете разочарованы.
Если вы не можете сделать пожертвование 3 раза подряд, вы будете отозваны как донор.
Подробнее о железе
Железо очень важно, потому что оно помогает вашему организму вырабатывать гемоглобин, и вы выделяете много железа, когда сдаете кровь.
Поскольку железо содержится в различных продуктах питания, вы обычно можете получить его из сбалансированной диеты. В Великобритании основными источниками железа являются мясо и мясные продукты, злаки и овощи.
Повышение уровня железа
Вы можете повысить уровень железа, стараясь придерживаться хорошо сбалансированной диеты.
Хотя железо из немясных источников усваивается организмом с большим трудом, люди, соблюдающие хорошо сбалансированную вегетарианскую или веганскую диету, должны получать достаточное количество железа в своем рационе.
Каждый день старайтесь съедать три порции пищи ниже, которые являются хорошими источниками железа:
- нежирное красное мясо, индейка и курица
- рыба, включая скумбрию, сардины, лосось, сардины и моллюски
- яйца
- сухие завтраки — некоторые хлопья обогащены железом
- бобовые и фасоль, в частности печеные бобы, нут и чечевица
- орехи (включая арахисовое масло)
- коричневый рис
- тофу
- хлеб — особенно хлеб из непросеянной муки или черный хлеб
- листовые зеленые овощи — особенно кудрявая капуста, кресс-салат, брокколи и шпинат
- сухофрукты, в частности абрикосы, изюм и чернослив
Витамин C
Витамин С помогает усваивать больше железа.Поэтому, чтобы получить максимальную пользу от еды, ешьте во время еды продукты, богатые витамином С: например, свежие фрукты и овощи или напитки, такие как свежий апельсиновый сок.
Не пейте чай непосредственно перед, после или во время еды, так как это может снизить всасывание железа из продуктов.
Дополнительная информация
Если вы обеспокоены или вам нужна дополнительная информация, позвоните в нашу службу поддержки доноров по телефону 0300123 23 23
антител к HBG2 / гемоглобину гамма 2 | Кролик античеловеческий
добавить отзыв
LSBio Гарантия
Антитела:
.
HBG2 / гемоглобин гамма 2 Кроличьи антитела против поликлональных антител человека (aa101-133)
Заявка:
IHC, IHC-P, WB, Flo
Формат:
Несопряженный, Немодифицированный
Международный
206-374-1102
Только для исследовательских целей
Обзор
Антитела:
.
HBG2 / гемоглобин гамма 2 Кроличьи антитела против поликлональных антител человека (aa101-133)
Заявка:
IHC, IHC-P, WB, Flo
Формат:
Несопряженный, Немодифицированный
Технические характеристики
Описание
Гемоглобин гамма 2 антитело LS-C344238 представляет собой неконъюгированное кроличье поликлональное антитело к человеческому гемоглобину гамма 2 (HBG2) (aa101-133).Подтверждено для Flow, IHC и WB.
Цель
HBG2 человека / гамма гемоглобина 2
Синонимы
HBG2 | Аномальный гемоглобин | Гамма-2-глобин | Гемоглобин гамма-G цепь | Субъединица гемоглобина гамма-2 | Hb F Ggamma | Метгемоглобин | Гемоглобин гамма-2 цепь | TNCY | G-гамма глобин Паулиния | Гемоглобин, гамма G
Реакционная способность
Человек
(проверено или 100% идентичность иммуногенной последовательности)
Спряжение
Несопряженный
Очистка
Белок А очищенный
Специфичность
Это антитело к HBG2 получают от кролика, иммунизированного синтетическим пептидом, конъюгированным с KLH, между 101-133 аминокислотами из С-концевой области HBG2 человека.
Приложения
- IHC
- IHC — Парафин
- Вестерн-блоттинг (1: 1000)
- Проточная цитометрия (1:25)
|
Выполняете IHC? Ознакомьтесь с нашей полной линейкой реагентов для иммуногистохимии, включая растворы для извлечения антигенов, блокирующие агенты. |
Презентация
PBS, 0,09% азид натрия
Хранилище
Хранить в холодильнике при температуре от 2 ° C до 8 ° C до 6 месяцев. Для длительного хранения хранить при -20 ° C.
Ограничения
Только для исследовательских целей. Предназначен для использования профессионалами лаборатории.
Гарантия
На это антитело распространяется 100% гарантия LSBio.
LSBio Гарантия
О HBG2 / гемоглобин гамма 2
NCBI:
NM_000184
NP_000175.1
Публикации (0)
Отправить публикацию для LS-C344238
Отзывы клиентов (0)
Отправить обзор LS-C344238
Рекомендуемые товары
Разновидность:
Человек, Мышь
Приложения:
Вестерн-блоттинг, проточная цитометрия
Разновидность:
Человек
Приложения:
ELISA
Разновидность:
Человек, Шимпанзе
Приложения:
IHC, IHC — парафин, вестерн-блоттинг
Реактивность:
Человек
Диапазон:
1.56-100 мкг / мл
Реактивность:
Человек
Диапазон:
15,625-1000 пг / мл
Реактивность:
Обезьяна
Диапазон:
0.156-10 нг / мл
Запрос паспорт безопасности данных / MSDS
Чтобы запросить форму SDS / MSDS для этого продукта, свяжитесь с нашим отделом технической поддержки по телефону:
Запрошен из: Российская Федерация
Дата запроса: 07.05.2021
Низкий нормальный уровень гемоглобина и анемия связаны с повышенным риском терминальной стадии почечной недостаточности в общей популяции: проспективное когортное исследование
Аннотация
Фон
Влияние низко-нормального уровня гемоглобина (Hb) и анемии на риск терминальной стадии почечной недостаточности (ТПН) в общей популяции изучалось редко.
Методы
510 620 взрослых корейцев в возрасте 40–80 лет без известных хронических заболеваний почек (ХБП) прошли медицинское обследование в течение 2002–2003 годов и находились под наблюдением до 2013 года. Заболеваемость ТПН определялась по выписке из больницы и записям о посещениях.
Результаты
В течение среднего периода наблюдения 10,5 у 575 женщин и 1047 мужчин была диагностирована ТПН. Более низкие уровни Hb были связаны с повышенным риском ТПН при данной тяжести альбуминурии и при данной расчетной скорости клубочковой фильтрации (рСКФ).Hb 13–13,9 г / дл у мужчин, Hb 11–11,9 г / дл у женщин и следовая альбуминурия, определенная с помощью анализа мочи с помощью тест-полоски, были связаны с более чем удвоенным риском. Риск, связанный с более низким уровнем гемоглобина, был выше у женщин старшего возраста (≥60 лет), чем у молодых женщин. Среди 349 993 участников с информацией о рСКФ, многовариантно скорректированные ЧСС, связанные с более низким уровнем гемоглобина на 1 г / дл у участников со значениями рСКФ ≥60, 30–59 и <30 мл / мин / 1,73 м 2 составили 1,34 (95% CI, 1,17–1,54), 1,55 (1,38–1,74) и 1,75 (1,47–2.09), соответственно ( P, взаимодействие между группами рСКФ = 0,06).
Выводы
Низко-нормальный уровень гемоглобина и анемия являются факторами риска развития ТПН у людей без ХБП и прогрессирования ХБП в ТПН. Более низкий уровень гемоглобина увеличивает риск ТПН за счет синергических биологических взаимодействий с более низкой рСКФ и альбуминурией. Воздействие более низкого Hb может быть сильнее у женщин старшего возраста, чем у молодых. Правильное ведение и скрининг на ранней стадии снижения гемоглобина и анемии могут снизить бремя ХБП.
Образец цитирования: Yi S-W, Moon SJ, Yi J-J (2019) Низкий нормальный уровень гемоглобина и анемия связаны с повышенным риском терминальной стадии почечной недостаточности в общей популяции: проспективное когортное исследование. PLoS ONE 14 (4):
e0215920.
https://doi.org/10.1371/journal.pone.0215920
Редактор: Вивекананд Джа, Медицинский институт последипломного образования, ИНДИЯ
Поступила: 3 декабря 2018 г .; Одобрена: 10 апреля 2019 г .; Опубликовано: 25 апреля 2019 г.
Авторские права: © 2019 Yi et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Данные, лежащие в основе результатов, представленных в исследовании, доступны на домашней странице Национальной службы обмена данными по медицинскому страхованию NHIS (http://nhiss.nhis.or.kr/bd/ab/bdaba000eng.do ). Заявки на использование данных будут рассмотрены исследовательской комиссией NHIS, и после утверждения заявителю будет предоставлен доступ к данным.Кандидатам следует обратиться в NHIS (Управление по работе с большими данными, + 82-33-736-2469) для получения дополнительной информации.
Финансирование: Авторы не получали специального финансирования на эту работу.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Примерно 1,2 миллиона человек умерли во всем мире от хронической болезни почек (ХБП) и последующей терминальной стадии почечной недостаточности (ХПН) в 2015 году, что на 31,7% больше, чем в 2005 году, и эти заболевания поднялись в рейтинге и стали ведущей причиной преждевременных родов. смерть с 1990 и 2005 по 2015 гг. [1].Раннее выявление и первичная профилактика у лиц с высоким риском — это стратегии, используемые для снижения бремени ХБП. Однако, поскольку у большинства пациентов симптомы отсутствуют до поздних стадий ХБП, определение того, кого следует обследовать и кто подвергается высокому риску у бессимптомных взрослых, было сложной задачей [2].
В нескольких исследованиях изучалось влияние низкого уровня гемоглобина (Hb) и анемии на развитие ТПН, несмотря на то, что низкий уровень гемоглобина per se может способствовать прогрессированию ХБП в ХПН [3,4], в то время как Hb спад и анемия могут возникнуть как следствие ХБП даже на ранних стадиях [5].Низко-нормальному уровню гемоглобина, например 13–13,9 г / дл у мужчин, уделялось мало внимания. Кроме того, это редко исследовалось, и неясно, увеличивают ли низкие нормальные уровни Hb и анемия частоту ТПН у лиц с нормальной функцией почек, а именно отсутствием альбуминурии и нормальной скоростью клубочковой фильтрации (СКФ). Лучшее понимание влияния низкого уровня гемоглобина и анемии на ТПН может помочь выявить группы высокого риска и целевые уровни гемоглобина для профилактики, наблюдения и лечения ХБП как в общей популяции, так и у пациентов с ХБП.
В этом проспективном когортном исследовании заболеваемость ТПН оценивалась по уровням гемоглобина и альбуминурии, измеренным с помощью тест-полоски, а также изучалось взаимодействие между уровнями гемоглобина и альбуминурией. У лиц, располагающих информацией об уровне креатинина в сыворотке, эти ассоциации были изучены после дальнейшего рассмотрения расчетной СКФ (рСКФ).
Методы
Исследуемая популяция и последующее наблюдение
Девяносто семь процентов корейцев застрахованы через Национальную службу медицинского страхования (NHIS) [6].Когорта исследования (n = 514 795) представляла собой случайную выборку из 5,15 миллиона бенефициаров NHIS в возрасте 40–79 лет в 2002 г., прошедших медицинское обследование в 2002–2003 гг. Из этой выборки 3789 человек с отсутствующей информацией о кардиометаболических факторах, включая глюкозу натощак и индекс массы тела (ИМТ), экстремальный ИМТ (<12 или ≥50 кг / м 2 ) или крайнюю анемию (<7 г / дл). были исключены, как и 386 пациентов с известной распространенной ХБП на исходном уровне. Мы проследили за оставшимися 510 620 людьми до 31 декабря 2013 г. через привязку записей к данным NHIS.Все пациенты, которые были выписаны из больницы из-за ТПН или имели не менее 2 последовательных амбулаторных посещений по поводу ТПН в течение 1 года впервые в течение периода наблюдения, считались случаями инцидента. Случаи ТПН были идентифицированы с использованием кодов Международной классификации болезней 10-го пересмотра (МКБ-10): N180 в 2002–2010 гг. И N185 в течение 2011–2013 гг. Из-за возможности недиагностированной бессимптомной ХБП на исходном уровне, это исследование было сосредоточено на частоте ТПН, а не на ХБП. В соответствии с корейским законодательством [7] авторам был предоставлен доступ к анонимным данным от NHIS.Это исследование было одобрено институциональным наблюдательным советом католического университета Квандонг (CKU-16-01-0301). Информированное согласие было отклонено, поскольку данные, предоставленные NHIS, были анонимными в соответствии с принципами строгой конфиденциальности.
Сбор данных
Альбуминурия оценивалась с помощью тест-полоски, как правило, с использованием автоматического полоскового анализа, и она была отмечена как отрицательная, следовая, 1+, 2+, 3+ и 4+ [8] в базовых медицинских осмотрах в 2002–2003 годах. Анализ мочи с помощью индикаторных полосок очень чувствителен к альбумину и имеет достаточно хорошую чувствительность и специфичность для выявления альбуминурии [9–12].Уровень гемоглобина в сыворотке измерялся с использованием цианметгемоглобинового метода. Глюкозу и общий холестерин в сыворотке крови натощак определяли ферментативными методами [13]. Артериальное давление измеряли с помощью стандартного ртутного сфигмоманометра, когда испытуемый находился в сидячем положении. ИМТ рассчитывался как измеренный вес, деленный на квадрат измеренного роста (кг / м 2 ) [6]. Статус курения, употребление алкоголя и история рака, сердечных заболеваний или инсульта оценивались с помощью анкеты. Мы считали людей имеющими распространенную ХБП (N18), гипертонию (I10-I15) и диабет (E10-E14) на исходном уровне, если они посещали медицинское учреждение по поводу этих диагностированных состояний хотя бы один раз в течение 6 месяцев до или через 2 месяца после дата базового медицинского осмотра.
Медицинские осмотры и сбор данных проводились в соответствии со стандартным протоколом, официально задокументированным правительством. Регулярно выполнялась внешняя оценка качества клинической биохимии и анализа мочи [14,15].
Статистический анализ
Регрессия Пуассона была проведена для расчета частоты ТПН с поправкой на пол и возраст. Отношения рисков (HR) для заболеваемости ESRD были рассчитаны с использованием моделей пропорциональных рисков Кокса, стратифицированных по возрасту (годам) на исходном уровне (40–44, 45–54, 55–64, 65–74 и 75–80).Многопараметрический анализ с поправкой на возраст на исходном уровне (непрерывная переменная), пол, статус курения, употребление алкоголя, ИМТ, физическая активность (не реже одного раза в неделю; да или нет), статус дохода (децили; <4, 4–7, 8 –10 [высокий доход]), гематурия и альбуминурия, а также сопутствующий диабет, гипертония, рак, болезни сердца или инсульт.
Мы рассмотрели рСКФ у 349 993 участников с информацией о креатинине сыворотки во время медицинских обследований в 2009–2010 гг., Но без известных случаев ХБП (N18) или экстремальной рСКФ (<10 мл / мин / л).73 м 2 ). Уравнение креатинина CKD Epidemiology Collaboration (CKD-EPI) использовалось для расчета рСКФ [16].
Уровни
Hb в основном были разделены на 5 групп, зависящих от пола (<10, 10–10,9, 11–11,9, 12–12,9 и ≥13 г / дл у женщин; <12, 12–12,9, 13–13,9, 14– 14,9 и ≥15 г / дл у мужчин) в основных анализах и на 3 группы (<11, 11–11,9, ≥13 г / дл у женщин; <13, 13–13,9 и ≥14 г / дл в мужчин) в анализах с учетом рСКФ. Уровни гемоглобина также использовались в качестве непрерывной переменной.В основном анализе мужчины и женщины анализировались отдельно, а также был проведен анализ подгрупп по возрасту (<60 и ≥60 лет).
В тестах статистического взаимодействия, в которых изучалась разница в величине эффекта Hb между подгруппами в зависимости от пола, возраста, альбуминурии и категорий рСКФ, использовался метод взвешенного среднего с обратной дисперсией. Анализ подгрупп также использовался в качестве теста на чувствительность. Все значения P были двусторонними. Во всех анализах использовалась версия SAS 9.4 (SAS Institute Inc., Кэри, Северная Каролина, США).
Результаты
Общие характеристики
В течение среднего периода наблюдения 10,5 лет среди 233 497 женщин и 277 123 мужчин, 575 женщин и 1072 мужчин была диагностирована ТПН. Среднее значение ± стандартное отклонение Hb составило 12,9 ± 1,2 г / дл у женщин и 14,8 ± 1,1 г / дл у мужчин. Люди с более низким уровнем гемоглобина чаще имели низкий ИМТ и общий холестерин, а также тяжелую альбуминурию (Таблица 1). Люди с тяжелой альбуминурией, как правило, имели высокий ИМТ, высокий общий холестерин и сопутствующий диабет, гипертонию и сердечные заболевания / инсульт (таблица A в файле S1).Лица с самым низким уровнем гемоглобина были как самой молодой, так и самой старшей возрастными группами у женщин, в то время как они были самыми старыми у мужчин (рис. A в файле S1).
Связь гемоглобина и альбуминурии с заболеваемостью ТПН
Аналогичная обратная J-кривая связь Hb и линейная связь альбуминурии с заболеваемостью ESRD были обнаружены как у мужчин, так и у женщин (рис. B в файле S1). Скорректированная по возрасту частота ТПН была в целом выше при более низких уровнях Hb и более тяжелой альбуминурии у каждого пола (рис. 1).Скорректированная по возрасту заболеваемость на 10000 человеко-лет составила 1,07 и 1,67 у мужчин и женщин без альбуминурии и с самым высоким уровнем Hb, соответственно, в то время как у мужчин и женщин с альбуминурией ≥3 + и самым низким уровнем Hb он составлял 986,1 и 820,6 соответственно. соответственно.
В многопараметрическом анализе картина HR в целом была аналогична таковой у скорректированной по возрасту заболеваемости. Риск, связанный с самой низкой категорией гемоглобина и отсутствием альбуминурии, был выше, чем риск, связанный с самой высокой категорией гемоглобина и альбуминурией 1+ (таблица 2).
При анализе 15 комбинированных групп гемоглобина и альбуминурии связь низкого уровня гемоглобина с ТПН в целом не ослабевала в возрасте ≥60 лет по сравнению с более молодыми (рис. C в файле S1). Предполагая линейную связь, у женщин была большая обратная связь с Hb, чем у мужчин (Таблица 3; HR на 1 г / дл более низкого Hb = 1,69 у женщин против 1,52 у мужчин, P взаимодействие = 0,006). У женщин, но не у мужчин, HR, связанные с более низким уровнем гемоглобина, были сильнее в возрасте ≥60 лет, чем в возрасте <60 лет.Кроме того, величина эффекта более низкого уровня гемоглобина на 1 г / дл не различалась в зависимости от 5 категорий альбуминурии как у мужчин, так и у женщин (таблица B в файле S1)
Анализ после дальнейшего рассмотрения рСКФ
Среди 349 993 участников с информацией о рСКФ в течение среднего периода наблюдения 4,0 года у 316 человек была диагностирована ТПН. Лица с более низкой рСКФ, как правило, были старше, женского пола и страдали коморбидным диабетом и гипертонией (таблица C в файле S1). Скорректированная по возрасту частота и скорректированная по многим параметрам ЧСС ТПН в целом были выше при более низких уровнях гемоглобина, более тяжелой альбуминурии и более низкой рСКФ (рис. 2, таблица D в файле S1).
Рис. 2. Скорректированная по возрасту * частота ТПН в 27 группах комбинированного гемоглобина, альбуминурии и рСКФ.
ТПН, терминальная стадия почечной недостаточности; eGFR, расчетная скорость клубочковой фильтрации с использованием креатининового уравнения, разработанного совместно с Сотрудничеством по эпидемиологии хронических заболеваний почек (CKD-EPI). Группы гемоглобина 1, 2 и 3 соответствуют <11, 11–11,9 и ≥12 г / дл, соответственно, у женщин и <13, 13–13,9 и ≥14 г / дл, соответственно, у мужчин. * Использовалась регрессия Пуассона.
https: // doi.org / 10.1371 / journal.pone.0215920.g002
Многовариантно скорректированные HR, связанные с более низким уровнем гемоглобина на 1 г / дл у участников со значениями рСКФ ≥60, 30–59 и <30 мл / мин / 1,73 м 2 составили 1,34 (95% ДИ, 1,17–1,54), 1,55 (1,38–1,74) и 1,75 (1,47–2,09), соответственно ( P взаимодействие между группами рСКФ = 0,057). При анализе 9 комбинированных подгрупп альбуминурии и рСКФ HR, связанные с более низким уровнем гемоглобина на 1 г / дл, обычно были ниже у лиц с рСКФ ≥60, чем с <60 мл / мин / л.73 м 2 , независимо от категорий альбуминурии (таблица E в файле S1).
Когда биологическое взаимодействие между группами с низким гемоглобином, альбуминурией и рСКФ оценивалось с использованием многопараметрических скорректированных HR (таблица D в файле S1) [17], индекс синергии составил 45,5. Эти результаты свидетельствуют о сильном синергетическом взаимодействии.
Обсуждение
Более низкие уровни Hb были неизменно связаны с повышенным риском ТПН при данной тяжести альбуминурии и данных уровнях рСКФ.Эти результаты показали, что более низкий уровень гемоглобина взаимодействует с альбуминурией, а более низкая СКФ приводит к увеличению ТПН. Hb 13–13,9 г / дл у мужчин, Hb 11–11,9 г / дл у женщин и следы альбуминурии, полученные с помощью тест-полоски, были связаны с более чем удвоенным риском ТПН после поправки на вмешивающиеся факторы, включая рСКФ. У женщин была более сильная связь низкого уровня гемоглобина и альбуминурии с заболеваемостью ТПН, чем у мужчин. HR, связанный с более низким уровнем гемоглобина, у женщин становился сильнее в возрасте ≥60 лет, чем в возрасте <60 лет.
Анемия как фактор риска заболеваемости ХБП в общей популяции без ХБП
Анемия обычно считалась осложнением ХБП и фактором риска прогрессирования ХБП, но в целом не признавалась как фактор риска заболеваемости ХБП в общей популяции [2,18], несмотря на некоторые наводящие на размышления данные [19]. , 20].В нашем исследовании более низкий уровень гемоглобина был связан с повышенным риском ТПН для каждой категории тяжести альбуминурии и рСКФ, включая группу наименьшего риска с рСКФ ≥60 мл / мин / 1,73 м 2 и отсутствием альбуминурии. Эти результаты позволяют предположить, что более низкий уровень гемоглобина является фактором риска как для заболеваемости ХБП в общей популяции, так и для прогрессирования ХБП у пациентов с ХБП, потенциально из-за поражения почек в результате почечной гипоксии, вызванной анемией [19], хотя, по крайней мере, частично. Hb может быть следствием ХБП.Коррекция анемии у людей с анемией, но без ХБП может предотвратить развитие ХБП; однако текущее исследование не могло изучить влияние анемии различной этиологии, и поэтому конкретные рекомендации (например, по заместительной терапии железом) выходят за рамки наших возможностей.
Более сильное влияние анемии на прогрессирование ХБП, чем на заболеваемость ХБП
В нашем исследовании у людей с альбуминурией ≥ следов или рСКФ <60 мл / мин / 1,73 м. 2 , по-видимому, имели более сильную связь между низким уровнем гемоглобина и заболеваемостью ТПН, чем люди без альбуминурии или рСКФ ≥60 мл / мин / л. .73 м 2 . Это могло быть связано с тем, что комбинированное воздействие анемии и ХБП у людей с ХБП было сильнее, чем влияние одной анемии у лиц без ХБП.
Клиническая значимость наших результатов: наблюдение
Анемия не была признана фактором риска для рекомендации скрининга на ХБП. Распространенность анемии составляла 10,9% у женщин и 3,5% у мужчин в Корее [21]. В США распространенность анемии почти удвоилась с 2003–2004 гг. По 2011–2012 гг. (С 4,0% до 7.1%) [22]. Измерение гемоглобина — рутинная часть глобальной оценки состояния здоровья большинства взрослых [5]. Поскольку более низкий уровень гемоглобина был тесно связан с заболеваемостью ТПН, при выявлении анемии у обоих полов и гемоглобина 13–13,9 г / дл у мужчин во время медицинских осмотров можно дополнительно провести функциональные тесты почек для выявления потенциальной ХБП. Более того, поскольку более низкий уровень гемоглобина без ХБП также был связан с более высоким риском ТПН, дальнейшие исследования должны изучить, полезно ли регулярно контролировать развитие ХБП и ТПН у лиц с более низким уровнем гемоглобина, но нормальной функцией почек во время измерения гемоглобина.
Влияние низких и нормальных уровней гемоглобина на легкую анемию
Настоящее исследование показало, что мужчины с Hb 13–13,9 г / дл имели более чем удвоенный риск ТПН по сравнению с мужчинами с Hb ≥15 г / дл. Поскольку Hb <13 г / дл считается анемией у мужчин, мужчинам с Hb 13–13,9 г / дл обычно уделяется мало внимания с точки зрения риска ХБП и ТПН. Кроме того, легкая анемия у женщин (11–11,9 г / дл) и мужчин (11–12,9 г / дл) связана с более чем двукратным и четырехкратным повышением риска ТПН по сравнению с их аналогами.Правильное ведение на ранней стадии анемии у мужчин с Hb 13–13,9 г / дл и лиц с легкой анемией может предотвратить развитие ХБП в общей популяции и предотвратить прогрессирование до ТПН у пациентов с ХБП.
Важность следовой альбуминурии
В нашем исследовании следовая альбуминурия увеличивала риск ТПН более чем в 3 раза как у женщин, так и у мужчин. Из-за своей ограниченной точности, особенно чувствительности (доля истинно положительных [альбуминурия], правильно идентифицированных) для выявления альбуминурии, анализу мочи с помощью тест-полоски уделяется относительно мало внимания по сравнению с анализами крови, а следовая протеинурия, обнаруженная с помощью тест-полоски, часто игнорируется.Например, в Корее и Японии в национальных программах скрининга населения используется анализ мочи, но следовая протеинурия официально не считается протеинурией [8,23]. Наши результаты ясно показали, что людей со следовой протеинурией по тест-полоскам нельзя игнорировать, но следует дополнительно обследовать на предмет повреждения почек. Тест-полоска на протеинурию — это простой, недорогой и мгновенный тест, который можно легко выполнить в большинстве клинических условий [24]. Поскольку он обладает хорошей специфичностью (доля истинно отрицательных (без альбуминурии) правильно идентифицирована) и прогностической ценностью отрицательного результата (доля истинно отрицательных результатов среди отрицательных результатов теста), с учетом повышенного риска ТПН, связанного даже со следовой протеинурией, тест на протеинурию с помощью индикаторной полоски имеет роль для стратификации риска, особенно в условиях ограниченных ресурсов.
Клиническая значимость наших результатов: классификация рисков
Настоящее исследование показало, что анемия (или, в более широком смысле, уровень гемоглобина) играет роль в классификации риска развития и прогноза ХБП в общей популяции. Как упоминалось ранее, люди с низким уровнем гемоглобина (<14 г / дл у мужчин или <12 г / дл у женщин), тяжелой альбуминурией и СКФ ≥60 мл / мин / 1,73 м 2 , которые считаются высокими группа риска имела риск, сопоставимый с теми, у кого СКФ <30 мл / мин / л.73 м 2 но без альбуминурии (группа очень высокого риска). Лица с анемией (<13 г / дл у мужчин или <11 г / дл у женщин), без альбуминурии и СКФ ≥60 мл / мин / 1,73 м 2 , которые KDIGO считает группой низкого риска согласно рекомендациям, имели сопоставимый риск с пациентами с СКФ 30–59 мл / мин / 1,73 м 2 , без альбуминурии и нормальным уровнем гемоглобина (группа от умеренного до высокого риска).
Влияние анемии и низкого уровня гемоглобина на пожилое население
Многие факторы риска заболеваний имеют более слабую связь с заболеваниями в пожилом возрасте, о чем свидетельствует связь между ИМТ и смертностью [6], артериальным давлением и сердечно-сосудистыми заболеваниями [25], гамма-глутамилтрансферазой и сердечно-сосудистыми заболеваниями [26], а также альбуминурией и Заболеваемость ТПН в текущем исследовании.Что касается заболеваемости ТПН, относительные риски, связанные с анемией или низким уровнем гемоглобина, не были слабее у лиц в возрасте ≥60 лет, чем у лиц в возрасте <60 лет в нашем исследовании. У женщин риски, связанные с более низким уровнем гемоглобина, были выше у пожилых людей, чем у молодых людей. Поскольку распространенность анемии увеличивается с возрастом у взрослых мужчин и женщин в постменопаузе, как абсолютные, так и относительные риски, связанные с более низким уровнем гемоглобина, могут быть выше у пожилых людей, особенно у женщин. Поскольку ожидаемая продолжительность жизни во всем мире увеличилась, а распространенность анемии выше у пожилых людей [27], важность лечения анемии или снижения гемоглобина может возрастать с возрастом для профилактики ХБП и ТПН.
Сильные стороны и ограничения
Тот факт, что в анализе использовался Hb, а не гематокрит, является сильной стороной исследования [5]. В проспективном когортном исследовании ошибки отзыва и отбора, связанные с ретроспективным дизайном, были минимизированы. Еще одним преимуществом является почти полное отслеживание через привязку записей к национальной базе данных.
В этом исследовании есть ограничения. Во-первых, анализ рСКФ был ограничен людьми, у которых в 2009–2010 гг. Измеряли креатинин сыворотки.Во-вторых, информация об этиологии анемии была недоступна. В Корее более половины анемий были вызваны железодефицитной анемией (ЖДА), тогда как доля ЖДА заметно различалась в зависимости от пола и возраста [28]. Разница в величине эффекта гемоглобина в зависимости от пола и возраста может быть связана с разной этиологией анемии. В-третьих, анализы Hb и альбуминурии основывались на одном измерении. Хотя это ограничение, использование значений, которые были измерены один раз, с меньшей вероятностью приведет к завышению HR из-за эффектов регрессионного разбавления.В-четвертых, исследуемая популяция состояла из корейцев в возрасте 40–80 лет. Наши результаты не обязательно распространяются на молодых людей или на другие этнические группы.
Выводы
Низко-нормальные уровни гемоглобина и анемия были факторами риска возникновения ТПН в общей популяции без ХБП, а также для прогрессирования ХБП в ТПН. Более низкий Hb имел синергетические биологические взаимодействия с более низкой рСКФ и альбуминурией, что увеличивало риск возникновения ТПН. Hb 13–13,9 г / дл у мужчин 11–11 лет.9 г / дл у женщин и следы альбуминурии при анализе мочи с помощью тест-полоски были связаны с более чем удвоенным риском ТПН. Воздействие более низкого Hb может быть сильнее у женщин старшего возраста, чем у молодых. Включение людей с анемией или гемоглобином с низким уровнем гемоглобина в программы наблюдения и лечения для первичной и вторичной профилактики ХБП может снизить бремя ХБП.
Благодарности
Авторы благодарят сотрудников отдела управления большими данными NHIS за предоставленные данные и поддержку.
Список литературы
- 1.
ГББ 2015 Смертность и причины смерти соавторов. Ожидаемая продолжительность жизни на глобальном, региональном и национальном уровнях, смертность от всех причин и смертность от конкретных причин для 249 причин смерти, 1980–2015 гг .: систематический анализ для исследования глобального бремени болезней, 2015 г. Lancet. 2016; 388: 1459–1544. pmid: 27733281 - 2.
Qaseem A, Hopkins RH Jr, Sweet DE, Starkey M, Shekelle P, Комитет по клиническим рекомендациям Американского колледжа П.Скрининг, мониторинг и лечение хронической болезни почек 1-3 стадии: Руководство по клинической практике Американского колледжа врачей. Ann Intern Med. 2013; 159: 835–847. pmid: 24145991 - 3.
Iseki K, Ikemiya Y, Iseki C, Takishita S. Гематокрит и риск развития терминальной стадии почечной недостаточности. Пересадка нефрола Dial. 2003; 18: 899–905. pmid: 12686662 - 4.
Ishani A, Grandits GA, Grimm RH, Svendsen KH, Collins AJ, Prineas RJ, et al. Связь единичных измерений протеинурии, оцененной скорости клубочковой фильтрации и гематокрита с 25-летней заболеваемостью терминальной стадией почечной недостаточности в исследовании вмешательства с множественными факторами риска.J Am Soc Nephrol. 2006; 17: 1444–1452. pmid: 16611715 - 5.
Заболевание почек: улучшение глобальных результатов (KDIGO) Рабочая группа по анемии. KDIGO Руководство по клинической практике анемии при хронической болезни почек. Почки Int Suppl (2011). 2012; 2: 279–335. - 6.
Йи СВ, Орр Х, Шин С.А., Йи Дж.Дж. Половозрастная связь индекса массы тела со смертностью от всех причин среди 12,8 миллионов взрослых корейцев: проспективное когортное исследование. Int J Epidemiol. 2015; 44: 1696–1705. pmid: 26208807 - 7.Seong SC, Kim YY, Park SK, Khang YH, Kim HC, Park JH и др. Профиль когорты: Национальная служба медицинского страхования — Национальная когорта обследований здоровья (NHIS-HEALS) в Корее. BMJ Open. 2017; 7: e016640. pmid: 28947447
- 8.
Мок И, Мацусита К., Санг И, Балльу С.Х., Грамм М., Шин С.Ю. и др. Ассоциация мер по заболеваниям почек со смертностью от конкретных причин: Корейское исследование сердца. PLoS One. 2016; 11: e0153429. pmid: 27092943 - 9.
Лэмб Э.Дж., Маккензи Ф., Стивенс ЧП.Как следует определять и измерять протеинурию? Энн Клин Биохим. 2009. 46: 205–217. pmid: 19389884 - 10.
Lim D, Lee DY, Cho SH, Kim OZ, Cho SW, An SK и др. Диагностическая точность тест-полоски мочи на протеинурию у пожилых амбулаторных пациентов. Kidney Res Clin Pract. 2014; 33: 199–203. pmid: 26885477 - 11.
Пак Джи, Пэк Х., Ким Б.Р., Юнг Х.Х. Сравнение индикаторной полоски мочи и соотношения альбумин: креатинин для скрининга хронических заболеваний почек: популяционное исследование. PLoS One.2017; 12: e0171106. pmid: 28151999 - 12.
Уайт С.Л., Ю. Р., Крейг Дж. С., Полкингхорн К. Р., Аткинс Р. К., Чадбан С.Дж. Диагностическая точность тест-полосок мочи для выявления альбуминурии в обществе в целом. Am J Kidney Dis. 2011; 58: 19–28. pmid: 21411199 - 13.
Ли ЭЙ, Ли ЙХ, Йи С.В., Шин С.А., Йи Дж.Дж. ИМТ и смертность от всех причин при нормогликемии, нарушении глюкозы натощак, впервые диагностированном диабете и распространенном диабете: когортное исследование. Уход за диабетом. 2017; 40: 1026–1033.pmid: 28400430 - 14.
Kim KD, Koo SH, Kim EC, Kim JM, Kim JH, Kim JQ и др. Годовой отчет о внешней оценке качества анализа мочи в Корее (2005 г.). J Lab Med Qual Assur. 2006; 28: 63–89. - 15.
Мин В.К., Ким К.Д., Ким С.С., Ким С.С., Ким Ю.К., Ким Дж.Х. и др. Годовой отчет о внешней оценке качества клинической химии в Корее (2003 г.). J Lab Med Qual Assur. 2004; 26: 1–10. - 16.
Леви А.С., Стивенс Л.А., Шмид С.Х., Чжан Ю.Л., Кастро А.Ф. 3-й, Фельдман Н.И. и др.Новое уравнение для оценки скорости клубочковой фильтрации. Ann Intern Med. 2009. 150: 604–612. pmid: 19414839 - 17.
Андерссон Т., Альфредссон Л., Каллберг Х., Здравкович С., Альбом А. Расчет мер биологического взаимодействия. Eur J Epidemiol. 2005. 20: 575–579. pmid: 16119429 - 18.
Мойер В.А., Force USPST. Скрининг на хроническое заболевание почек: рекомендация Целевой группы по профилактическим службам США. Ann Intern Med. 2012; 157: 567–570. pmid: 22928170 - 19.Фу Кью, Колган С.П., Шелли К.С. Гипоксия: сила, движущая хронической болезнью почек. Clin Med Res. 2016; 14: 15–39. pmid: 26847481
- 20.
Исэки К., Кохагура К. Анемия как фактор риска хронической болезни почек. Kidney Int Suppl. 2007: S4–9. pmid: 17943141 - 21.
Министерство здравоохранения и социального обеспечения. Статистика здравоохранения Кореи, 2015 г .: Национальное обследование состояния здоровья и питания Кореи (KNHANES VI-3). Седжонг, Республика Корея: Министерство здравоохранения и социального обеспечения; 2016 г. - 22.
Le CH. Распространенность анемии и анемии средней степени тяжести среди населения США (NHANES 2003–2012). PLoS One. 2016; 11: e0166635. pmid: 27846276 - 23.
Нагаи К., Сайто С., Ватанабе Ф., Окубо Р., Сато С., Кавамура Т. и др. Годовая частота стойкой протеинурии в общей популяции по данным ежегодного анализа мочи Ибараки. Clin Exp Nephrol. 2013; 17: 255–260. pmid: 22971964 - 24.
Вэнь Ц.П., Ян Ю.К., Цай МК, Вэнь СФ. Индикаторная полоска мочи для выявления следов протеинурии: недостаточно используемый инструмент для определения недооцененного маркера риска.Am J Kidney Dis. 2011; 58: 1–3. pmid: 21684434 - 25.
Йи С.В., Мок Й., Орр Х., Йи Дж.Дж., Юн Ю.Д., Пак Дж. И др. Низкое систолическое артериальное давление и сосудистая смертность среди более чем 1 миллиона корейских взрослых. Тираж. 2016; 133: 2381–2390. pmid: 27143683 - 26.
Йи СВ, Ли Ш, Хван ХД, Йи ДжДж. Гамма-глутамилтрансфераза и смертность от сердечно-сосудистых заболеваний у взрослых корейцев: когортное исследование. Атеросклероз. 2017; 265: 102–109. pmid: 28881267 - 27.
Торговец А.А., Рой С.Н.Не столь доброкачественная гематология: анемия пожилых людей. Br J Haematol. 2012; 156: 173–185. pmid: 22050828 - 28.
Ли Джо, Ли Дж.Х., Ан С., Ким Дж.В., Чанг Х., Ким Й.Дж. и др. Распространенность и факторы риска железодефицитной анемии среди населения Кореи: результаты пятого обследования национального здравоохранения и питания Кореи. J Korean Med Sci. 2014; 29: 224–229. pmid: 24550649
Низкий уровень гемоглобина является фактором риска послеродовой депрессии — Penn State
TY — JOUR
T1 — Низкий уровень гемоглобина является фактором риска послеродовой депрессии
AU — Corwin, Elizabeth J.
AU — Murray-Kolb, Laura E.
AU — Beard, John L.
PY — 2003/12
Y1 — 2003/12
N2 — Роль материнской анемии в развитии послеродовой депрессии ( PPD) неясно. PPD — серьезное заболевание, которое может негативно повлиять на физическое и эмоциональное здоровье молодой матери и ее младенца. Хотя психосоциальные факторы, повышающие риск развития ППД, известны, в нескольких исследованиях были выявлены физиологические факторы, предрасполагающие к ППД у женщин.Роженицы посещали дома 7, 14 и 28 дней после несложных родов. Концентрация гемоглобина (Hb) измерялась путем укола крови из пальца при каждом посещении, и женщины заполняли шкалу Центра эпидемиологических исследований-депрессивной симптоматологии (CES-D) на 28 день. Была обнаружена отрицательная корреляция между концентрацией Hb на 7 день после родов. и депрессивные симптомы на 28 день (r = -4,26; P = 0,009). Показатели CES-D (средние значения ± SEM) на 7 день у женщин с нормальным уровнем гемоглобина> 120 г / л (12 г / дл) были значительно ниже (6.90 ± 1,04), чем у женщин с уровнем гемоглобина ≤ 120 г / л (12 г / дл) [16,36 ± 3,34; t (35) = -3,632, P = 0,001]. Таким образом, женщины, страдающие ранней послеродовой анемией, могут подвергаться повышенному риску развития ППД.
AB — Роль материнской анемии в развитии послеродовой депрессии (ППД) неясна. PPD — серьезное заболевание, которое может негативно повлиять на физическое и эмоциональное здоровье молодой матери и ее младенца. Хотя психосоциальные факторы, повышающие риск развития ППД, известны, в нескольких исследованиях были выявлены физиологические факторы, предрасполагающие к ППД у женщин.Роженицы посещали дома 7, 14 и 28 дней после несложных родов. Концентрация гемоглобина (Hb) измерялась путем укола крови из пальца при каждом посещении, и женщины заполняли шкалу Центра эпидемиологических исследований-депрессивной симптоматологии (CES-D) на 28 день. Была обнаружена отрицательная корреляция между концентрацией Hb на 7 день после родов. и депрессивные симптомы на 28 день (r = -4,26; P = 0,009). Показатели CES-D (средние значения ± SEM) на 7 день у женщин с нормальным уровнем гемоглобина> 120 г / л (12 г / дл) были значительно ниже (6.90 ± 1,04), чем у женщин с уровнем гемоглобина ≤ 120 г / л (12 г / дл) [16,36 ± 3,34; t (35) = -3,632, P = 0,001]. Таким образом, женщины, страдающие ранней послеродовой анемией, могут подвергаться повышенному риску развития ППД.
UR — http://www.scopus.com/inward/record.url?scp=0345600986&partnerID=8YFLogxK
UR — http://www.scopus.com/inward/citedby.url?scp=0345600986&partnerID=8YFLog
U2 — 10.1093 / jn / 133.12.4139
DO — 10.1093 / jn / 133.12.4139
M3 — Артикул
C2 — 14652362
AN — SCOPUS: 0345600986
VL — 133
000 SP — 133
000
EP — 4142
JO — Journal of Nutrition
JF — Journal of Nutrition
SN — 0022-3166
IS — 12
ER —
Выявленное увеличение сродства гемоглобина и кислорода, и эффект Бора совпал с водная специализация пингвинов
Значение
У ныряющих птиц, таких как пингвины, физиологические соображения предполагают, что повышенное сродство гемоглобина (Hb) -O 2 может улучшить извлечение легочного O 2 и повысить способность нырять.Мы объединили экспериментальные тесты цельной крови и нативного Hbs пингвинов с экспериментами по инженерии белка на реконструированных предковых Hbs. Эксперименты, связанные с воскрешением предковых белков, позволили нам проверить эволюционные изменения функции Hb в стволовой линии пингвинов после расхождения с их ближайшими неживыми родственниками. Мы демонстрируем, что пингвины развили повышенное сродство Hb-O 2 в сочетании со значительно усиленным эффектом Бора (т. Е. Снижение сродства Hb-O 2 при низком pH), что должно максимизировать легочную экстракцию O 2 без ущерба для O 2 доставка в системные капилляры.
Abstract
Возможности нырять у дышащих воздухом позвоночных диктуются бортовыми магазинами O 2 , предполагая, что физиологическая специализация ныряющих птиц, таких как пингвины, могла включать адаптивные изменения в конвективном переносе O 2 . Была выдвинута гипотеза, что повышенное сродство к гемоглобину (Hb) -O 2 улучшает легочную экстракцию O 2 и увеличивает способность нырять с задержкой дыхания. Чтобы исследовать эволюционные изменения функции гемоглобина, связанные с водной специализацией пингвинов, мы объединили сравнительные измерения цельной крови и очищенного нативного гемоглобина с экспериментами по белковой инженерии, основанными на сайт-направленном мутагенезе.Мы реконструировали и воскресили предкового Hb, представляющего общего предка пингвинов и более древнего предка, общего для пингвинов и их ближайших неживых родственников (отряд Procellariiformes, который включает альбатросов, буревестников, буревестников и буревестников). Эти два предка ограничивают филогенетический интервал, в котором могли бы развиться специфические для пингвинов изменения функции гемоглобина. Эксперименты показали, что пингвины развили производное увеличение сродства Hb-O 2 и значительно усилили эффект Бора (т.е., пониженное сродство Hb-O 2 при низком pH). Хотя повышенное сродство Hb-O 2 снижает градиент диффузии O 2 из системных капилляров в метаболизирующие клетки, это может быть компенсировано сопутствующим усилением эффекта Бора, тем самым способствуя разгрузке O 2 в подкисленных тканях. Мы предполагаем, что эволюционировавшее увеличение сродства Hb-O 2 в сочетании с усиленным эффектом Бора максимизирует как извлечение O 2 из легких, так и выгрузку O 2 из крови, позволяя пингвинам полностью использовать свой бортовой O 2 хранит и максимально увеличивает время кормления под водой.
У дышащих воздухом позвоночных возможности нырять определяются бортовыми запасами O 2 и эффективностью использования O 2 в метаболизме тканей (1). У полностью водных таксонов отбор на продление погружения с задержкой дыхания и время кормления под водой мог способствовать адаптивным изменениям во многих компонентах пути транспорта O 2 , включая свойства оксигенации гемоглобина (Hb). Hb позвоночных представляет собой тетрамерный белок, который отвечает за циркуляторный транспорт O 2 , загрузку O 2 в легочные капилляры и выгрузку O 2 в системный кровоток через четвертичные структурные сдвиги между высокоаффинными (преимущественно оксигенированными) расслабленными ( R) состояние и низкоаффинное (преимущественно деоксигенированное) напряженное (T) состояние (2).Хотя этот механизм респираторного транспорта газов сохраняется у всех Hbs позвоночных, изменение аминокислот в составляющих субъединицах α- и β-типа может изменять внутреннее сродство O 2 и реакцию на изменения температуры, pH эритроцитов и эритроцитов. концентрации аллостерических кофакторов (негемовых лигандов, которые модулируют сродство Hb-O 2 за счет преимущественного связывания и стабилизации дезокси-Т-конформации) (3, 4).
Хотя количество Hb обычно повышено в крови ныряющих птиц и млекопитающих по сравнению с их наземными родственниками, нет единого мнения о том, способствовали ли эволюционные изменения сродства Hb-O 2 повышению способности нырять (1).Была выдвинута гипотеза, что повышенное сродство Hb-O 2 может улучшить извлечение легочного O 2 у ныряющих млекопитающих, тем самым увеличивая способность нырять (5), но для оценки доказательств адаптивной тенденции необходимы дополнительные сравнительные данные (6, 7 ). Экспериментальные измерения цельной крови предполагают, что императорский пингвин ( Aptenodytes forsteri ) может иметь более высокое сродство к крови-O 2 по сравнению с неживыми водоплавающими птицами, открытие, которое укрепило мнение о том, что это свойство характеризует пингвинов как группу ( 8⇓ – 10).Однако сродство к крови-O 2 является очень пластичным признаком, на который влияют изменения в метаболизме эритроцитов и кислотно-щелочном балансе, поэтому измерения очищенного гемоглобина в стандартных условиях анализа необходимы для оценки наблюдаемых межвидовых различий в крови-O. 2 сродство связано с генетически обусловленными изменениями свойств оксигенации Hb. Более того, даже если видовые различия в аффинности Hb-O 2 имеют генетическую основу, сравнительные данные по существующим таксонам не показывают, связаны ли наблюдаемые различия с производным увеличением численности пингвинов, производным сокращением их недивущих родственников или комбинацией этих факторов. меняется в обоих направлениях.
Для исследования эволюционирующих изменений функции гемоглобина, связанных с водной специализацией пингвинов, мы объединили экспериментальные измерения цельной крови и очищенного природного гемоглобина с эволюционным анализом вариации последовательности глобина. Чтобы охарактеризовать механистическую основу эволюционных изменений функции гемоглобина в стволовой линии пингвинов, мы провели эксперименты по белковой инженерии на реконструированном и воскрешенном предковом гемоглобине, представляющем общего предка пингвинов и более древнего предка, общего для пингвинов и их ближайших неживых родственников (порядок Procellariiformes, куда входят альбатросы, буревестники, буревестники и буревестники) (рис.1). Эти два предка ограничивают филогенетический интервал, в котором могли бы развиться специфические для пингвинов изменения функции гемоглобина.
Рис. 1.
Диаграмма филогении, показывающая родство между Sphenisciformes (пингвины), Procellariiformes и Pelecaniformes. Hbs предков были реконструированы для двух указанных узлов: AncSphen и AncPro (суперотряд, содержащий Sphenisciformes и Procellariiformes). Время расхождения адаптировано из Claramunt и Cracraft (56).
Результаты и обсуждение
O
2 — Связывающие свойства цельной крови пингвинов и очищенного гемоглобина.
Используя образцы крови нескольких особей шести видов пингвинов, мы измерили парциальное давление O 2 (PO 2 ) при 50% насыщении (P 50 ) для цельной крови и очищенного Hb в отсутствие ( обнаженный) и присутствие аллостерических кофакторов (+ KCl + IHP [гексафосфат инозита]) (рис. 2). P 50 в цельной крови были одинаковыми для всех пингвинов, в среднем 33,3 ± 1,1 торр (рис.2 и приложение SI , таблица S1), что согласуется с ранее опубликованными данными для пингвинов императора, Адели, антарктического ремня и папуасского пингвина (8 , 9, 11).Точно так же измеренные аффинности O 2 к очищенному Hb показали очень небольшие различия между видами как в присутствии, так и в отсутствие аллостерических кофакторов (рис. 2 и SI, приложение , таблица S1). Пингвины экспрессируют одну изоформу Hb в постнатальном периоде жизни (HbA), в отличие от большинства других видов птиц, которые экспрессируют одну главную и одну второстепенную изоформу (HbA и HbD соответственно) (12, 13). Отсутствие вариации сродства Hb-O 2 у пингвинов согласуется с низким уровнем вариабельности аминокислот в α- и β-цепях ( SI Приложение , рис.S1). Эксперименты показали, что гемоглобин пингвинов демонстрирует удивительно большой сдвиг в величине эффекта Бора (т. Е. Снижение сродства Hb-O 2 в ответ на снижение pH) при добавлении аллостерических кофакторов ( SI Приложение , таблица S1). . Средний эффект Бора пингвинов Hbs более чем удваивается при добавлении аллостерических кофакторов, с -0,21 ± 0,03 до -0,53 ± 0,04 ( SI Приложение , Таблица S1).
Рис. 2. Значения
P 50 для цельной крови пингвинов и очищенного гемоглобина при 37 ° C, в отсутствие (вырезано) и в присутствии 100 мМ KCl и 0.2 мМ IHP (+ KCl + IHP). Чем выше P 50 , тем ниже сродство Hb-O 2 . Значения P 50 цельной крови представлены как среднее ± стандартная ошибка ( n = 3). Значения очищенного Hb P 50 получены из графиков зависимости logP 50 от pH, на которых линейная регрессия соответствовала оценке P 50 при точно pH 7,40 (± SE оценки регрессии).
Наши экспериментальные результаты показывают, что пингвины обычно имеют более высокое сродство Hb-O 2 , чем другие птицы (12, 14⇓⇓⇓⇓⇓⇓⇓ – 22), что согласуется с предыдущими предположениями, основанными на измерениях цельной крови (8, 9, 23⇓ – 25).Цельная кровь O 2 сродство шести исследованных видов пингвинов (от 30,4 до 38,1 торр при 37 ° C, pH 7,40) было неизменно выше, чем у представителя семейства Procellariiformes, южного гигантского буревестника ( Macronectes giganteus ; 42,5 торр при 38 ° C, pH 7,40) (9). Точно так же многие виды высокогорных птиц конвергентно эволюционировали с повышенным сродством Hb-O 2 (17, 18, 21), что, по-видимому, является адаптивным, поскольку помогает защитить артериальное насыщение O 2 , несмотря на снижение PO 2 вдыхаемый воздух (26⇓ – 28).Разница в значениях P 50 в крови между пингвинами и южным гигантским буревестником, как правило, намного больше по величине, чем различия в Hb P 50 между близкородственными видами низко- и высокогорных птиц (14⇓⇓⇓ – 18, 20⇓ – 22). Как и в случае с другими ныряющими позвоночными (29), эффект Бора Hb пингвина также значительно превышает типичные для птиц значения.
Воскрешение белков предков.
В принципе, наблюдаемое различие в сродстве Hb-O 2 между пингвинами и их ближайшими неживыми родственниками можно объяснить производным увеличением сродства Hb-O 2 в линии пингвинов (обычно предполагаемый адаптивный сценарий), производное сокращение стволовой линии Procellariiformes (неживой сестринской группы) или комбинация изменений в обоих направлениях.Чтобы проверить эти альтернативные гипотезы, мы реконструировали Hbs общего предка пингвинов (AncSphen) и более древнего общего предка Procellariimorphae (надотряд, состоящий из Sphenisciformes [пингвинов] и Procellariiformes; AncPro) (рис. 1 и SI Приложение , стр. Рис. S2 – S4). Затем мы рекомбинантно экспрессировали и очищали предковый гемоглобин для проведения функциональных тестов in vitro. Измерения кривых равновесия O 2 показали, что AncSphen Hb имеет значительно более высокое сродство к O 2 , чем AncPro Hb (рис.3), что указывает на то, что пингвины развили производное увеличение сродства Hb-O 2 . В присутствии аллостерических кофакторов P 50 AncSphen намного ниже (т.е. сродство O 2 выше) по сравнению с AncPro (11,8 против 20,2 торр). Подобно эволюционировавшему увеличению сродства Hb-O 2 у высокогорных птиц (18, 20⇓ – 22, 30), повышенное сродство O 2 пингвинового Hb скорее связано с увеличением внутреннего сродства, чем с сниженная чувствительность к аллостерическим кофакторам, поскольку разница в аффинности Hb-O 2 между AncSphen и AncPro сохраняется в присутствии и отсутствии Cl — и IHP (рис.3).
Рис. 3.
Структурные ( A — C ) и физиологические ( D и E ) эффекты аминокислотных замен в реконструированных белках Hb предка пингвинов (AncSphen) и последних общих предков пингвинов. совместно с Procellariiformes (AncPro). ( A ) Молекулярная модель тетрамера AncSphen Hb с черным прямоугольником, показывающим области, выделенные в B и C . ( B ) Молекулярная модель AncSphen Hb, демонстрирующая межсубъединичные стабилизирующие Н-связи (розовый) между β119Ser и как α111Ile, так и β120Lys.( C ) Молекулярная модель AncPro Hb, показывающая, что замена β119Ser на Thr удаляет межсубъединичные стабилизирующие Н-связи. ( D ) Hb-O 2 сродство (как измерено с помощью P 50 ) AncSphen, AncPro и двух мутантных rHbs со специфичными для пингвинов аминокислотными заменами, введенными на фоне AncPro: AncProβ119Ser и AncPro + 4. См. В тексте объяснение выбора сайтов-кандидатов для экспериментов по мутагенезу. Измерения проводились на растворах Hb (0.1 мМ Hb в 0,1 М Hepes / 0,5 мМ EDTA) при 37 ° C в отсутствие (снятый) и в присутствии + KCl + IHP. Значения P 50 получены из графиков зависимости logP 50 от pH, на которых линейная регрессия соответствовала оценке P 50 при точно pH 7,40 (± SE оценки регрессии). ( E ) Коэффициенты Бора (Δlog P 50 / ΔpH) были оценены из графиков зависимости logP 50 от pH, на которых эффект Бора представлен наклоном линейной регрессии (± SE оценки наклона) .
В дополнение к производному увеличению сродства Hb-O 2 , сравнения AncSphen и AncPro также показали, что Hb пингвинов развил повышенную чувствительность к pH (эффект Бора). В условиях снятия изоляции эффекты Бора AncSphen и AncPro (-0,30 ± 0,09 и -0,27 ± 0,1 соответственно) были очень похожи друг на друга и аналогичны значениям, измеренным для нативного Hb пингвинов в тех же условиях (рис. 3 E и SI Приложение , Таблица S1).Однако в присутствии аллостерических кофакторов эффект Бора AncSphen увеличился более чем в два раза (аналогично эффекту нативного Hb пингвинов), тогда как эффект AncPro показал незначительные изменения (рис. 3 E ), демонстрируя, что пингвины эволюционировали. усиление эффекта Бора, связанного с кофактором, после расхождения с их неживыми родственниками. Ожидается, что повышенное сродство Hb-O 2 уменьшит градиент диффузии O 2 из системных капилляров в клетки метаболизирующих тканей, а усиленный эффект Бора может компенсировать это за счет снижения сродства Hb-O 2 при низкий pH, что способствует разгрузке O 2 в подкисленных тканях.Подобное усиление эффекта Бора недавно было зарегистрировано в Hb высокогорных тибетских псовых (31). Таким образом, гемоглобин пингвинов развил увеличение сродства к O 2 и усиленный эффект Бора в сочетании с другими физиологическими и морфологическими специализациями для более полного водного существования.
Тесты положительного отбора.
Учитывая, что совместное увеличение аффинности O 2 и эффект Бора пингвинового Hb представляют собой производные состояния характера, мы провели анализ молекулярной эволюции, чтобы проверить доказательства положительного отбора в генах α- и β-глобина.В частности, мы проверили ускоренную скорость замены аминокислот в стволовой линии пингвинов (ветвь, соединяющая AncPro с AncSphen) с помощью теста сайтов ветвлений. Этот тест не выявил доказательств ускоренной скорости замены аминокислот в стволовой линии пингвинов ( SI, приложение , таблица S2), а тест клады не выявил значительных различий в скорости замены между различными линиями пингвинов ( SI, приложение ). , Таблица S3). Таким образом, если повышенное сродство пингвинов к Hb-O 2 представляет собой адаптацию, которая возникла в результате положительного отбора, природа причинных изменений не привела к обнаруживаемой статистической сигнатуре в генах глобина α- и β-типа.
Молекулярное моделирование.
Мы использовали молекулярное моделирование, чтобы определить, какие конкретные аминокислотные замены могут быть ответственны за повышенное сродство Hb-O 2 AncSphen по сравнению с AncPro. Из 17 аминокислотных замен, которые различают AncSphen и AncPro, наш анализ выявил четыре замены, которые потенциально могут изменять свойства связывания O 2 . Замена Thrβ119Ser в ветви, ведущей к AncSphen, влияет на стабилизацию R-состояния (оксигенированного) Hb.В частности, гидроксильная группа β119Ser в спирали G ориентирована по направлению к границе раздела субъединиц путем образования водородной связи с β120Lys, которая обеспечивает межсубъединичный контакт с α111Ile (рис. 3 A и B ). Эта связь между β119Ser и α111Ile стабилизирует конформацию R-состояния за счет ограничения межсубъединичных движений, что, по прогнозам, увеличивает сродство Hb-O 2 за счет увеличения свободной энергии связанного с оксигенацией аллостерического перехода R → T в четвертичной структуре.Кроме того, наша модель идентифицировала три другие аминокислотные замены — αA138S, βA51S и βI55L — которые создают межсубъединичные контакты и дополнительно стабилизируют конформацию R-состояния.
Тестирование причинных замен.
Чтобы проверить основанные на модели прогнозы о конкретных заменах, которые ответственны за повышенную аффинность O 2 пингвина Hb, мы использовали сайт-направленный мутагенез, чтобы ввести комбинации мутаций в четыре сайта-кандидата на фоне AncPro.Сначала мы протестировали эффект одной мутации, в результате которой β119Thr был заменен на Ser (AncProβT119S). Затем мы проверили чистый эффект мутаций на всех четырех сайтах на фоне AncPro (AncPro + 4: αA138S, βA51S, βI55L и βT119S). Эксперименты по белковой инженерии показали, что βT119S оказывает незначительное индивидуальное влияние на сродство Hb-O 2 при введении на фоне AncPro, но вызывает заметное усиление эффекта Бора (рис. 3 D и E ).Комбинация четырех мутаций приводила к умеренному увеличению сродства Hb-O 2 и более выраженному усилению эффекта Бора, но они не полностью воспроизводили наблюдаемые различия между AncPro и AncSphen в любом из этих свойств (рис. 3). . Эти данные предполагают, что эволюционирующие функциональные изменения Hb пингвина должны быть связаны с чистым эффектом множественных аминокислотных замен в структурно различных сайтах.
Адаптивное значение повышенного Hb-O
2 Сродство.
Ключом к увеличению времени погружения для водных позвоночных является увеличение пропускной способности O 2 при сохранении метаболических требований O 2 на минимально возможном уровне во время погружения с задержкой дыхания. Погружение в воду вызывает интенсивную брадикардию и периферическую вазоконстрикцию, которая сохраняет конечные запасы O 2 для тканей, непереносимых к гипоксии (т.е. центральной нервной системы и сердца) (32–35). Запасы O 2 обычно увеличиваются у ныряющих позвоночных за счет увеличения объема крови, увеличения концентрации гемоглобина в крови, увеличения концентрации миоглобина в скелетных мышцах, увеличения мышечной массы и, иногда, увеличения объема легких у ныряльщиков (1).Поскольку глубоко ныряющие китообразные и ластоногие выдыхают перед погружением, их легкие составляют менее 10% от общих запасов O 2 (1, 36). Это уменьшение объема легких при нырянии уменьшает количество газообразных N 2 и O 2 , что предположительно ограничивает декомпрессионную болезнь. И наоборот, поскольку пингвины вдыхают в начале погружения, объем их ныряющих легких составляет гораздо больший процент от общих запасов O 2 (19% для императорских пингвинов и 45% для пингвинов Адели) (1, 37).Действительно, у ныряющих императорских пингвинов извлечение O 2 из легочных запасов происходит непрерывно во время погружения (38, 39). Повышенное сродство Hb-O 2 (например, обнаруженное у пингвинов) может максимизировать извлечение O 2 из легочных запасов, поскольку большее насыщение крови O 2 может быть достигнуто при любом заданном парабронхиальном значении PO 2 . Однако, хотя повышенное сродство Hb-O 2 может обеспечить более полный перенос O 2 из легких в кровь, оно может ингибировать последующий перенос O 2 из крови в ткани.Несмотря на это, императорские пингвины почти полностью истощают свои кровеносные сосуды во время продолжительных погружений, так как их венозный PO 2 в конце погружения может составлять от 1 до 6 торр (38). Усиленный эффект Бора гемоглобина пингвина должен улучшить транспорт O 2 к рабочим (кислым) тканям, обеспечивая более полную разгрузку O 2 крови. Мы предполагаем, что эта модификация работает в тандеме с повышенным сродством Hb-O 2 , чтобы максимизировать как извлечение O 2 из легких, так и выгрузку O 2 из крови, что позволяет пингвинам полностью использовать свои встроенные запасы O 2 и максимально увеличить время кормления под водой.
Материалы и методы
Сбор крови.
Мы собрали кровь у 18 индивидуальных пингвинов, представляющих шесть видов: A. forsteri , Aptenodytes patagonicus , Pygoscelis adeliae , Pygoscelis papua , Pygoscelis antarcticus и Spheniscus magellanicus ( особей на вид). Все птицы были взяты во время плановых проверок здоровья в SeaWorld of California. Кровь собирали путем венепункции яремной вены с использованием набора для забора крови BD Vacutainer Safety-Lok с 21 G × 3/4 дюйма (0.8 × 19 мм), прикрепленную к пробирке для забора крови с гепарином (BD). Подвыборка цельной крови (200 мкл) была отложена для кривых кислородного равновесия (см. Ниже), а оставшаяся кровь центрифугировалась при 5000 × g в течение 15 мин. Фракции плазмы, лейкоцитарной пленки и гематокрита из центрифугированных образцов немедленно помещали в отдельные пробирки и мгновенно замораживали при -80 ° C для будущих анализов.
Секвенирование генов пингвинов глобина.
Секвенирование гена глобина проводили, как описано ранее (40).Вкратце, РНК экстрагировали из ~ 100 мкл мгновенно замороженных эритроцитов с помощью набора Qiagen RNeasy Universal Plus Mini Kit. кДНК синтезировали из свежеприготовленной РНК с использованием обратной транскриптазы SuperScript IV (Invitrogen). Ген-специфические праймеры, используемые для амплификации транскриптов глобина α- и β-типа, были сконструированы из 5′- и 3′-фланкирующих областей всех общедоступных генов глобина пингвинов. Реакции ПЦР проводили с использованием 1 мл матрицы кДНК в пробирках объемом 0,2 мл, содержащих 25 мкл реакционной смеси (0.5 мкл каждого dNTP [2,5 мМ], 2,5 мкл 10X реакционного буфера [Invitrogen], 0,75 мкл 50 мМ MgCl 2 , 1,25 мкл каждого праймера [10 пмоль / мкл], 1 мкл полимеразы Taq [Invitrogen] и 16,75 мкл ddH 2 O), используя градиентный термоциклер Eppendorf Mastercycler. После 5-минутного периода денатурации при 94 ° C желаемые продукты амплифицировали с использованием профиля циклов 94 ° C в течение 30 секунд, от 53 до 65 ° C в течение 30 секунд и 72 ° C в течение 45 секунд в течение 30 циклов с последующим последним 5-минутным периодом продления при 72 ° C.Амплифицированные продукты обрабатывали на 1,5% агарозном геле, после чего полосы нужного размера вырезали и очищали с использованием колонок для восстановления ДНК Zymoclean Gel (Zymo Research). Очищенные в геле продукты ПЦР лигировали в векторы pCR4-TOPO с использованием набора для клонирования TOPO TA, а затем трансформировали в химически компетентный One Shot TOP10 Escherichia coli (Thermo Fisher Scientific). От трех до шести трансформированных колоний культивировали в 5 мл среды LB, после чего плазмиды очищали с помощью набора GeneJET Plasmid Midiprep Kit (Thermo Fisher Scientific).Очищенные плазмиды секвенировали с помощью Eurofins Genomics.
Анализ последовательностей.
Геномные последовательности, содержащие полные кластеры генов α- и β-глобина для императорского пингвина ( A. forsteri ), пингвина Адели ( P. adeliae ), северного глупыша ( Fulmarus glacialis ), полосатого шторма из GenBank были получены буревестник ( Hydrobates castro ), южный гигантский буревестник ( M. giganteus ), нелетающий баклан ( Nannopterum harrisi ), хохлатый ибис ( Nipponia nippon ) и маленькая цапля ( Egretta garzetta ). .Кластеры генов α- и β-глобина от оставшихся 19 существующих видов пингвинов были получены из GigaDB (41). Кодирующие последовательности генов α- и β-глобина, выделенные из этих геномных последовательностей, были объединены с вновь созданными последовательностями кДНК, упомянутыми выше ( SI, приложение , рис. S2). Последовательности выравнивали с помощью MUSCLE (42), а затем использовали для оценки филогенетических деревьев, как описано ранее (40). Вкратце, наиболее подходящая модель замены кодонов и начальный поиск по дереву были оценены с использованием IQ-TREE с параметрами -st CODON, -m TESTNEW, -allnni и -bnni (43, 44).Затем исходные деревья были подвергнуты повторной загрузке 1000 мкл trafast (45). Деревья консенсуса начальной загрузки ( SI, приложение , рис. S3) были использованы для оценки предковых последовательностей глобина с использованием IQ-TREE с опцией -asr ( SI, приложение , рис. S2 и S4).
Выборочные анализы.
Мы проверили селекцию в эволюции генов α- и β-глобина пингвинов в рамках модели максимального правдоподобия с моделями на основе кодонов, реализованными в программе codeml из PAML v4.9 сюиты (46), используя описанные выше филогенетические деревья. Мы использовали модели сайта ветвления и клады для изучения вариаций ω, отношения скорости несинонимичных замен на несинонимичный сайт, dN, к скорости синонимичных замен на синонимичный сайт, dS. Мы использовали модель участка ответвления A (47, 48) для проверки положительного отбора в ответвлении, соединяющем AncPro с AncSphen (стволовая линия пингвинов) ( SI, приложение , таблица S2), и использовали модель клады C (49) для тест для отбора в кладу пингвинов с использованием M2a_rel от Weadick и Chang (50) в качестве нулевой модели ( SI, приложение , таблица S3).
Молекулярное моделирование.
Структурное моделирование было выполнено на сервере SWISS MODEL (51) с использованием Hb серого гуся в окси-форме (код PDB ID 1FAW). AncPro Hb и AncSphen Hb имели значения QMEAN –0,61 и –0,65 соответственно. Среднеквадратичное расстояние (RMSD) основной цепи между значениями шаблона и модели <0,09 Å считалось пригодным для использования (52). Структурный анализ и подготовка графики были выполнены с использованием системы молекулярной графики PyMOL, версия 2.3.2 (Schrödinger).Листинг водородных связей был выполнен с использованием скрипта PyMOL list_hb.py (Роберт Л. Кэмпбелл, биомедицинские и молекулярные науки, Королевский университет). Энергия связи интерфейса рассчитывалась сервером ePISA (53).
Строительство Hb экспрессирующих векторов.
Реконструированные предковые глобины были синтезированы с помощью GeneArt Gene Synthesis (Thermo Fisher Scientific) после оптимизации нуклеотидных последовательностей в соответствии с предпочтениями кодонов E. coli . Синтезированная кассета гена глобина была клонирована в пользовательскую векторную систему pGM вместе с геном метионинаминопептидазы (MAP), как описано ранее (54).Мы разработали замену Thrβ119Ser путем амплификации цельной плазмиды с использованием мутагенных праймеров и ДНК-полимеразы Phusion High-Fidelity (New England BioLabs), фосфорилирования полинуклеотидкиназой T4 (New England BioLabs) и циркуляризации с помощью набора NEB Quick Ligation Kit (New England BioLabs). . Все этапы сайт-направленного мутагенеза выполнялись с использованием протокола, рекомендованного производителем. Каждая плазмида была проверена секвенированием ДНК компанией Eurofins Genomics.
Экспрессия и очистка рекомбинантного гемоглобина.
Экспрессию рекомбинантного Hb проводили в штамме E. coli JM109 (DE3), как описано ранее (15, 54, 55). Лизаты бактериальных клеток загружали в анионообменную колонку HiTrap SP HP (GE Healthcare), а затем уравновешивали 50 мМ Hepes / 0,5 мМ EDTA (pH 7,0) и элюировали линейным градиентом от 0 до 0,25 М NaCl. Затем фракции, содержащие гемоглобин, загружали в катионообменную колонку HiTrap Q HP (GE Healthcare), уравновешенную 20 мМ трис-HCl / 0,5 мМ ЭДТА (pH 8,6), и элюировали линейным градиентом pH от 0 до 0.25 М NaCl. Фракции элюированного гемоглобина концентрировали с использованием центробежных фильтров Amicon Ultra-4 (EMD Millipore).
Приготовление пробы для O
2 Кривые равновесия.
Свежую цельную кровь разводили 1:15 собственной плазмой каждого человека, и сразу после отбора пробы измеряли кривые равновесия O 2 . Для получения очищенного гемолизата 100 мкл центрифугированных эритроцитов добавляли к 5-кратному объему 0,01 M Hepes / 0,5 мМ буфера EDTA (pH 7,4) с последующей 30-минутной инкубацией на льду для лизирования красных кровяных телец.Добавляли NaCl до конечной концентрации 0,2 М, и образцы центрифугировали при 20000 × g в течение 10 мин для удаления клеточного дебриса. Супернатанты гемолизата и очищенный рекомбинантный Hb обессоливали аналогичным образом, пропуская через обессоливающую колонку PD-10 (GE Healthcare), уравновешенную 25 мл 0,01 М Hepes / 0,5 мМ EDTA (pH 7,4). Элюаты концентрировали с использованием центробежных фильтров Amicon Ultra-4 (EMD Millipore). Из этих концентрированных образцов растворы Hb (0,1 мМ Hb в 0,1 М Hepes / 0.05 M EDTA-буфер) были приготовлены в отсутствие (очищенный) и в присутствии 0,1 M KCl и 0,2 мМ инозитол гексафосфата (+ KCl + IHP). Обработки очищенным и + KCl + IHP были приготовлены при трех различных значениях pH (всего шесть обработок на образец Hb). Рабочие растворы доводили с помощью NaOH до pH, максимально близкого к 7,2, 7,4 или 7,6, а затем точно измеряли pH с помощью pH-метра Orion Star A211 и комбинированного pH-микроэлектрода Orion PerpHecT ROSS (Thermo Fisher Scientific).
Измерение O
2 -Связующие свойства.
O 2 кривые равновесия были измерены с использованием системы связывания кислорода крови (BOBS; Loligo Systems) при 37 ° C. PH образцов цельной крови устанавливали путем измерения кривых в присутствии 45 торр CO 2 , тогда как pH растворов Hb устанавливали с помощью буфера Hepes (см. Выше). Каждый образец цельной крови и раствор Hb последовательно уравновешивали множеством напряжений кислорода (PO 2 ), в то время как поглощение образца непрерывно контролировали при 430 нм (пик дезокси) и 421 нм (точка изобестической окси / дезокси).Каждый этап уравновешивания считался завершенным, когда оптическая плотность при 430 нм стабилизировалась (от 2 до 4 минут). В последующих анализах использовались только значения PO 2 , дающие от 30 до 70% насыщения Hb O 2 . Графики Хилл (log [фракционное насыщение / [1 — фракционное насыщение]] по сравнению с logPO 2 ) были построены на основе этих измерений. К этим графикам была подобрана линейная регрессия, которая использовалась для определения PO 2 при половинном насыщении (P 50 ) и коэффициента кооперативности (n 50 ), где интервал x и наклон регрессии линии представляют собой P 50 и n 50 соответственно.Значения для образцов цельной крови ( n = 3) представлены как среднее ± стандартная ошибка. Для растворов Hb линейная регрессия соответствовала графикам logP 50 в зависимости от pH, и полученное уравнение использовалось для оценки значений P 50 при pH 7,40 (± SE оценки регрессии). Мы не проводили прямых сравнений между нативным гемоглобином и рекомбинантно экспрессируемым гемоглобином, поскольку рекомбинантный гемоглобин часто показывает несколько более низкие значения P 50 из-за повышенной скорости автоокисления. Таким образом, все выводы основаны на сравнении образцов нативного гемоглобина у существующих видов или на сравнении образцов рекомбинантного гемоглобина, представляющих реконструированных предков
Доступность данных
Все данные исследования включены в основной текст и SI Приложение .
Благодарности
Мы благодарим тренеров и ветеринарный персонал SeaWorld of California за их помощь в этом проекте, Дженнифер Рего за сбор образцов крови и доктора Джуди Сент-Леджер за материально-техническую поддержку. Мы также благодарим С. Мохаммади, Н. Гутьеррес-Пинто, Дж. Хайта, М. Кобиэла, А. Дхаванджевара, М. Кульбабу, М. Годри и А. Кихада-Родригеса за полезные комментарии к рукописи. Это исследование было поддержано финансированием NIH (HL087216, J.F.S и F32HL136202, M.S.T.), NSF (OIA-1736249, J.F.S .; IOS-1927675, J.F.S .; и 1927616, M.S.T.) и технический вклад SeaWorld Parks & Entertainment (2020-19).
Сноски
-
Авторские работы: A.V.S. и J.F.S. спланированное исследование; A.V.S., M.S.T., F.G.H., T.L.S. и H.M. проведенное исследование; M.S.T. и J.F.S. внесены новые реагенты / аналитические инструменты; A.V.S., M.S.T., F.G.H., H.M. и J.F.S. проанализированные данные; и А.В.С. и J.F.S. написал газету.
-
Авторы заявляют об отсутствии конкурирующей заинтересованности.
-
Эта статья представляет собой прямое представление PNAS.
-
Эта статья содержит вспомогательную информацию в Интернете по адресу https://www.pnas.org/lookup/suppl/doi:10.


