Где находятся белки в клетке?
Блакитнока темноволоса жінка, батько якої був світловолосим,
одружується на кароокому світловолосому чоловіку з родини, усі члени
якого протягом кіль
…
кох поколінь мали карі очі. Яких нащадків і з якою
ймовірністю слід очікувати від цього шлюбу? Врахуйте, що кароокість
домінує над блакитноокістю, а ознака темного волосся домінує над
ознакою світлого.
Определите признаки яйцекладущих млекопитающих:
1. грызущий ротовой аппарат.
2. дневные хищники.
3. отсутствие сосков.
4. есть хобот.
5. зубы редуциро
…
ваны.
6. откладывают яйца.
7. незавершенная теплокровность.
8. клоака.
9. наружное пищеварение.
10. есть клюв или роструб
помогите:)даю 15 балов
Питання №1 ?
1 бал
Прикладом якого рефлексу є виділення слини у відповідь на звук?
а Умовний
б Немає вірної відповіді
в Безумовний
г Інстинкт
Питання
…
№2 ?
1 бал
а Оберіть характеристику умовного рефлексу.
б Вірно все
в Передається спадково
г Видовий
Виникає і зникає протягом життя
Питання №3 ?
1 бал
Як називається згасання умовних рефлексів?
a Перистальтика
б Лізис
в Зникнення
г Гальмування
Питання №4 ?
1 бал
Прикладом чого є гра на музичних інструментах?
а Динамічний стереотип
б Звичка
в Інстинкт
г Безумовний рефлекс
Питання №5 ?
1 бал
Завдання із ЗНО 2018
Під час перегляду мультфільму в руках маленької дитини лопнула повітряна кулька. Дитина злякалася й заплакала. Відтоді щоразу під час перегляду цього мультфільму вона починала плакати. Яка причина такої поведінки дитини?
а сформувався умовний рефлекс
б виявився інстинкт
в виявився безумовний рефлекс
г відбулося зовнішнє гальмування
Питання №6 ?
1 бал
Умовні рефлекси
а зберігаються завжди протягом усього життя.
б адаптують організм до умов зовнішнього середовища.
в виявляються з моменту народження.
г успадковуються
Питання №7 ?
1 бал
Першим після народження дитини з’являється рефлекс
а хапальний.
б дихальний.
в захисний.
г смоктальний
Питання №8 ?
1 бал
Вкажіть властивості безумовного рефлексу.
а набутий, тимчасовий, індивідуальний
б вроджений, тимчасовий, видовий
в вроджений, постійний, видовий
г набутий, постійний, видовий
Питання №9 ?
1 бал
Установіть відповідність між видами умовних рефлексів (1-4) і їх характеристиками (А-Д).
1 натуральні
2 штучні
3 вегетативні
4 рухові
а виробляються під дією природних подразників; утворюються швидко і легко, стійкі
б пов’язані з діяльністю скелетної мускулатури;
в проявляються в змінах роботи внутрішніх органів
г виникають у відповідь на будь-яке подразнення, не пов’язане з безумовним подразником, яке сприймається різними рецепторами
д виробляються на час (як умовний подразник) при регулярній дії подразника
У чому проявляється хвороба руху
почему печень является не маловажным органом в процессе пищеварения
Помогите, дою 20 балов!!!!
Вважається, що кругообіг багатьох хімічних елементів неможливий без хемосинтетиків. Які наслідки для планети й існування людства виникнуть зі зникненн
…
ям хемосинтезуючих організмів?
Выберите три верных ответа из шести и запишите в таблицу цифры, под которыми они указаны.
В толстом кишечнике человека происходят процессы
1. Расщеп
…
ление клетчатки
2. Всасывание воды
3. Всасывание глюкозы
4. Синтез витаминов группы B
5. Расщепление жиров
6. Уничтожение бактерий
какой тип развития у сетчатого жирафа
1. Синтез белков в клетке
Каждая клетка содержит тысячи белков. Свойства белков определяются их первичной структурой, т. е. последовательностью аминокислот в их молекулах.
В свою очередь наследственная информация о первичной структуре белка заключена в последовательности нуклеотидов в молекуле ДНК. Эта информация получила название генетической, а участок ДНК, в котором содержится информация о первичной структуре одного белка, называется ген.
Ген — это участок ДНК, в котором содержится информация о первичной структуре одного белка.
Ген — это единица наследственной информации организма.
Каждая молекула ДНК содержит множество генов. Совокупность всех генов организма составляет его генотип.
Биосинтез белка
Биосинтез белка — это один из видов пластического обмена, в ходе которого наследственная информация, закодированная в генах ДНК, реализуется в определённую последовательность аминокислот в белковых молекулах.
Процесс биосинтеза белка состоит из двух этапов: транскрипции и трансляции.
Каждый этап биосинтеза катализируется соответствующим ферментом и обеспечивается энергией АТФ.
Биосинтез происходит в клетках с огромной скоростью. В организме высших животных в одну минуту образуется до \(60\) тыс. пептидных связей.
Транскрипция
Транскрипция — это процесс снятия информации с молекулы ДНК синтезируемой на ней молекулой иРНК (мРНК).
Носителем генетической информации является ДНК, расположенная в клеточном ядре.
В ходе транскрипции участок двуцепочечной ДНК «разматывается». На одной из цепочек синтезируется молекула иРНК.
Информационная (матричная) РНК состоит из одной цепи и синтезируется на ДНК в соответствии с правилом комплементарности.
Образуется молекула иРНК, которая является копией второй цепочки ДНК, только в ней тимин заменён на урацил. Закодированная в ДНК информация о первичной структуре белка переписывается на иРНК.
Как и в любой другой биохимической реакции, в этом процессе участвует фермент — РНК-полимераза.
Молекула ДНК содержит большое количество генов. В начале каждого гена располагается промотором — особая последовательность нуклеотидов ДНК, которую определяет РНК-полимераза, и с этого места начинает сборку молекулы иРНК.
Синтез иРНК продолжается до очередного «знака препинания» — терминатора. Эта последовательность нуклеотидов указывает на завершение синтеза иРНК.
Эта последовательность нуклеотидов указывает на завершение синтеза иРНК.
В клетках прокариот иРНК образуется в цитоплазме, поэтому образовавшиеся молекулы могут сразу участвовать в синтезе белков.
У эукариот иРНК синтезируется в ядре, поэтому сначала она взаимодействует со специальными ядерными белками и переносится через ядерную мембрану в цитоплазму.
Трансляция
Трансляция — это перевод последовательности нуклеотидов молекулы иРНК в последовательность аминокислот молекулы белка.
В цитоплазме клетки обязательно должен иметься полный набор аминокислот, необходимых для синтеза белков. Эти аминокислоты образуются в результате расщепления белков, получаемых организмом с пищей, а некоторые могут синтезироваться в самом организме.
Обрати внимание!
Аминокислоты доставляются к рибосомам транспортными РНК (тРНК). Любая аминокислота может попасть в рибосому, только прикрепившись к специальной тРНК.
На тот конец иРНК, с которого нужно начать синтез белка, нанизывается рибосома. Она движется вдоль иРНК прерывисто, «скачками», задерживаясь на каждом триплете приблизительно \(0,2\) секунды.
За это время молекула тРНК, антикодон которой комплементарен кодону, находящемуся в рибосоме, успевает распознать его. Аминокислота, которая была связана с этой тРНК, отделяется от «черешка» тРНК и присоединяется с образованием пептидной связи к растущей цепочке белка. В тот же самый момент к рибосоме подходит следующая тРНК (антикодон которой комплементарен следующему триплету в иРНК), и следующая аминокислота включается в растущую цепочку.
Аминокислоты, доставленные на рибосомы, ориентированы по отношению друг к другу так, что карбоксильная группа одной молекулы оказывается рядом с аминогруппой другой молекулы. В результате между ними образуется пептидная связь.
Рибосома постепенно сдвигается по иРНК, задерживаясь на следующих триплетах. Так постепенно формируется молекула полипептида (белка).
Так постепенно формируется молекула полипептида (белка).
Синтез белка продолжается до тех пор, пока на рибосоме не окажется один из трёх стоп-кодонов (УАА, УАГ или УГА). После этого белковая цепочка отсоединяется от рибосомы, выходит в цитоплазму и формирует присущую этому белку вторичную, третичную и четвертичную структуры.
Так как клетке необходимо много молекул каждого белка, то как только рибосома, первой начавшая синтез белка на иРНК, продвинется вперёд, за ней на ту же иРНК нанизывается вторая рибосома. Затем на иРНК последовательно нанизываются следующие рибосомы.
Все рибосомы, синтезирующие один и тот же белок, закодированный в данной иРНК, образуют полисому. Именно на полисомах и происходит одновременный синтез нескольких одинаковых молекул белка.
Когда синтез данного белка окончен, рибосома может найти другую иРНК и начать синтезировать другой белок.
Общая схема синтеза белка представлена на рисунке.
Пример:
последовательность нуклеотидов матричной цепи ДНК: ЦГА ТТА ЦАА.
На информационной РНК (иРНК) по принципу комплементарности будет синтезирована цепь ГЦУ ААУ ГУУ, в результате чего выстроится цепочка аминокислот: аланин — аспарагин — валин.
При замене нуклеотидов в одном из триплетов или их перестановке этот триплет будет кодировать другую аминокислоту, а следовательно, изменится и белок, кодируемый данным геном.
Изменения в составе нуклеотидов или их последовательности называются мутациями.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://distant-lessons. ru/molekula-rnk.html
ru/molekula-rnk.html
http://900igr.net
http://tonpix.ru/biosintez_belka_translyaciya_47725/
белки — урок. Биология, Общие биологические закономерности (9–11 класс).
Белки (протеины, полипептиды) — самые многочисленные, наиболее разнообразные и имеющие первостепенное значение биополимеры. В состав молекул белков входят атомы углерода, кислорода, водорода, азота и иногда серы, фосфора и железа.
Мономерами белков являются аминокислоты, которые (имея в своём составе карбоксильную и аминогруппы) обладают свойствами кислоты и основания (амфотерны).
Благодаря этому аминокислоты могут соединяться друг с другом (их количество в одной молекуле может достигать нескольких сотен). В связи с этим молекулы белков имеют большие размеры, и их называют макромолекулами.
Структура белковой молекулы
Под структурой белковой молекулы понимают её аминокислотный состав, последовательность мономеров и степень скрученности молекулы белка.
В молекулах белков встречается всего \(20\) видов различных аминокислот, и огромное разнообразие белков создаётся за счёт различного их сочетания.
- Последовательность аминокислот в составе полипептидной цепи — это первичная структура белка. Она уникальна для любого типа белка и определяет форму его молекулы, его свойства и функции.
- Длинная молекула белка сворачивается и приобретает сначала вид спирали в результате образования водородных связей между —СО и —NН группами разных аминокислотных остатков полипептидной цепи (между углеродом карбоксильной группы одной аминокислоты и азотом аминогруппы другой аминокислоты). Эта спираль — вторичная структура белка.
- Третичная структура белка — трёхмерная пространственная «упаковка» полипептидной цепи в виде глобулы (шарика). Прочность третичной структуры обеспечивается разнообразными связями, возникающими между радикалами аминокислот (гидрофобными, водородными, ионными и дисульфидными S–S связями).

- Некоторые белки (например, гемоглобин крови человека) имеют четвертичную структуру. Она возникает в результате соединения нескольких макромолекул с третичной структурой в сложный комплекс. Четвертичная структура удерживается непрочными ионными, водородными и гидрофобными связями.
Структура белков может нарушаться (подвергаться денатурации) при нагревании, обработке некоторыми химическими веществами, облучении и др. При слабом воздействии распадается только четвертичная структура, при более сильном — третичная, а затем — вторичная, и белок остаётся в виде полипептидной цепи. В результате денатурации белок теряет способность выполнять свою функцию.
Нарушение четвертичной, третичной и вторичной структур обратимо. Этот процесс называют ренатурацией.
Разрушение первичной структуры необратимо.
Кроме простых белков, состоящих только из аминокислот, есть ещё и сложные белки, в состав которых могут входить углеводы (гликопротеины), жиры (липопротеины), нуклеиновые кислоты (нуклеопротеины) и др.
Функции белков
- Каталитическая (ферментативная) функция. Специальные белки — ферменты — способны ускорять биохимические реакции в клетке в десятки и сотни миллионов раз. Каждый фермент ускоряет одну и только одну реакцию. В состав ферментов входят витамины.
- Структурная (строительная) функция — одна из основных функций белков (белки входят в состав клеточных мембран; белок кератин образует волосы и ногти; белки коллаген и эластин — хрящи и сухожилия).
- Транспортная функция — белки обеспечивают активный транспорт ионов через клеточные мембраны (транспортные белки в наружной мембране клеток), транспорт кислорода и углекислого газа (гемоглобин крови и миоглобин в мышцах), транспорт жирных кислот (белки сыворотки крови способствуют переносу липидов и жирных кислот, различных биологически активных веществ).

- Сигнальная функция. Приём сигналов из внешней среды и передача информации в клетку происходит за счёт встроенных в мембрану белков, способных изменять свою третичную структуру в ответ на действие факторов внешней среды.
- Сократительная (двигательная) функция — обеспечивается сократительными белками — актином и миозином (благодаря сократительным белкам двигаются реснички и жгутики у простейших, перемещаются хромосомы при делении клетки, сокращаются мышцы у многоклеточных, совершенствуются другие виды движения у живых организмов).
- Защитная функция — антитела обеспечивают иммунную защиту организма; фибриноген и фибрин защищают организм от кровопотерь, образуя тромб.
- Регуляторная функция присуща белкам — гормонам (не все гормоны являются белками!). Они поддерживают постоянные концентрации веществ в крови и клетках, участвуют в росте, размножении и других жизненно важных процессах (например, инсулин регулирует содержание сахара в крови).
- Энергетическая функция — при длительном голодании белки могут использоваться в качестве дополнительного источника энергии после того, как израсходованы углеводы и жиры (при полном расщеплении \(1\) г белка до конечных продуктов выделяется \(17,6\) кДж энергии). Аминокислоты, высвобождающиеся при расщеплении белковых молекул, используются для построения новых белков.
Источники:
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. 9 класс // ДРОФА.
Каменский А. А., Криксунов Е. А., Пасечник В. В. Биология. Общая биология (базовый уровень) 10–11 класс // ДРОФА.
Лернер Г. И. Биология: Полный справочник для подготовки к ЕГЭ: АСТ, Астрель.
http://ours-nature.ru/lib/b/book/1063747118/348
Биологи из МГУ выяснили, как начинает синтезироваться белок в живой клетке
Ученые из МГУ имени М.В.Ломоносова под руководством Сергея Дмитриева (НИИ физико-химической биологии имени А. Н. Белозерского МГУ) прояснили, как живая клетка решает, откуда начать синтез белка. Исследование было опубликовано в журнале Nucleic Acids Research (импакт-фактор 9.1).
Н. Белозерского МГУ) прояснили, как живая клетка решает, откуда начать синтез белка. Исследование было опубликовано в журнале Nucleic Acids Research (импакт-фактор 9.1).
Трудности перевода
Существенная доля нашей генетической информации, закодированной в ДНК, реализуется в живой клетке в виде белков. Для того, чтобы синтезировать нужный белок, эту информацию нужно перевести из последовательности нуклеотидов на язык аминокислот. Эта стадия преобразования называется трансляцией, и участвует в ней не ДНК, а матричная РНК — «временный носитель», на котором находится копия одного конкретного гена. Специальная молекулярная машина — рибосома — движется по матричной РНК и считывает тройки нуклеотидов, каждая из которых кодирует ту или иную аминокислоту.
Сложность заключается в том, что нуклеотиды матричной РНК просто следуют один за другим, и рибосома должна определить, с какого места ей необходимо начинать считывание. Если же первая тройка нуклеотидов будет выбрана неверно, рибосома начнет синтезировать неправильный белок, который окажется бесполезным или даже токсичным для клетки.
Сканирование и соскальзывание
«Для решения этой проблемы существует специальный механизм — рибосомное сканирование, — говорит Илья Теренин, соавтор работы. — Сначала малая субчастица рибосомы, нагруженная специальными белками, связывается с концом матричной РНК (которую можно сравнить с «ксерокопией» текста, записанного в ДНК: это как бы “инструкция” по сборке белковой молекулы). Затем рибосома начинает перемещаться по мРНК, «просматривая», как на конвейере, один за другим все встречающиеся ей тройки нуклеотидов. Как правило, в качестве точки старта используется тройка нуклеотидов «аденин-урацил-гуанин» (AUG). Когда рибосома находит его, она останавливается и начинает синтез белка. Ранее считалось, что обнаружение AUG — единственное и важнейшее событие, приводящее к началу синтеза с нужной точки, однако мы обнаружили, что это далеко не всегда так».
Когда малая субчастица встречает тройку нуклеотидов AUG, она может начать сборку белковой молекулы (инициировать трансляцию), а может и не начать. Это зависит от того, какой набор белков-помощников будет в ее распоряжении. Эти специальные белки так и называются — факторы инициации трансляции (сокращенно — eIF). Они имеют номера: так, у эукариот (организмов с ядром в клетке, к которым относимся и мы с вами) один из самых важных факторов — второй, или eIF2. Он вместе с транспортной РНК привозит первый «кирпичик» белка — аминокислоту метионин. В конце к малой субчастице рибосомы должна присоединиться еще и большая. Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
«Как оказалось, если гидролиза не произойдет, то малая субчастица проигнорирует стартовый кодон AUG и проскользнет дальше, как ни в чем не бывало. Мы назвали это слайдингом (от англ. sliding — “соскальзывание”)», — подводит итог Сергей Дмитриев.
Слайдинг по-семейному
Вышеизложенное можно попробовать объяснить следующей аналогией. Малая субчастица рибосомы — непоседливая младшая сестра в семье, которая в выходной встала раньше всех и хочет поиграть в конструктор — пособирать белок из аминокислот-деталек.
Большая субчастица — это старшая сестра, которая знает правила игры и умеет, в отличие от младшей, читать инструкцию по сборке красивых и сложных молекул, но устала за неделю и хочет выспаться. Она понимает, что младшая сестра будет плакать, если совсем не прийти к ней, и еще вчера пообещала с ней поиграть, поэтому поставила несколько будильников (троек нуклеотидов AUG).
Однако, как и все люди, которые ставят несколько будильников, она редко просыпается с первого раза, игнорируя сигнал AUG. Чтобы она проснулась и встала от очередного будильника, нужно успеть приготовить ее любимые блинчики на завтрак (гидролизовать ГТФ), которые своим запахом выманят соню из-под теплого одеяла. Папа (eIF2) тоже встает рано, он даже сходил в магазин за мукой (присоединил ГТФ), но печь блинчики он не умеет. Зато это умеет мама (eIF5), от которой и зависит успех всей затеи.
Таким образом, слайдинг — это игнорирование будильника. А когда все нужные факторы присутствуют, старшая сестра просыпается, ест и идет играть (собирать белки) с младшей сестрой.
Скользит и узнает
Открытие слайдинга опровергает устоявшееся мнение о том, что процесс выбора точки начала трансляции заканчивается на моменте распознавания точки старта синтеза. Решающим событием является не узнавание AUG, а гидролиз ГТФ.
Интересно, что примерно у половины матричных РНК стартовым кодоном является не первый AUG от конца молекулы, а второй, третий и даже более удаленный. До сих пор единственным объяснением этому было явление, именуемое в англоязычной литературе «leaky scanning» — при этом рибосома «проезжает» мимо первого AUG, не узнавая его. Однако leaky scanning требует, чтобы первый AUG находился в определенном нуклеотидном контексте, а это далеко не всегда так. Ученые показали, что возможно и другое объяснение: узнавание этих «преждевременных» AUG все-таки происходит, но после этого рибосома все равно оказывается на правильном стартовом кодоне благодаря открытому исследователями слайдингу.
Биологи МГУ узнали, как в живой клетке начинается синтез белка — Наука
Без гидролиза сборка белковой молекулы невозможна. Этот процесс ученые назвали «слайдингом», сообщает пресс-служба МГУ им М.В. Ломоносова. Исследование биологов под руководством Сергея Дмитриева опубликовано в журнале Nucleic Acids Research.
Существенная доля нашей генетической информации, закодированной в ДНК, реализуется в живой клетке в виде белков. Для того чтобы синтезировать нужный белок, эту информацию нужно перевести из последовательности нуклеотидов на язык аминокислот. В этой стадии преобразования участвует матричная РНК — «временный носитель», на котором находится копия одного конкретного гена. Специальная молекулярная машина — рибосома — движется по матричной РНК и считывает тройки нуклеотидов, каждая из которых кодирует ту или иную аминокислоту.
Таким образом, рибосома должна определить, с какого места ей необходимо начинать считывание. Если же первая тройка нуклеотидов будет выбрана неверно, рибосома начнет синтезировать неправильный белок, который окажется бесполезным или даже токсичным для клетки.
Для решения этой проблемы существует специальный механизм — рибосомное сканирование. Сначала малая субчастица рибосомы, нагруженная специальными белками, связывается с концом матричной РНК, которая играет роль «инструкции» по сборке белковой молекулы. Затем рибосома начинает перемещаться по мРНК, «просматривая» один за другим все встречающиеся ей тройки нуклеотидов. Как правило, в качестве точки старта используется тройка нуклеотидов AUG. Когда рибосома находит его, она останавливается и начинает синтез белка. Ранее считалось, что обнаружение AUG — единственное и важнейшее событие, приводящее к началу синтеза с нужной точки.
Когда малая субчастица встречает тройку нуклеотидов AUG, она может начать сборку белковой молекулы (инициировать трансляцию), а может и не начать. Это зависит от того, какой набор белков-помощников будет в ее распоряжении. Эти специальные белки так и называются — факторы инициации трансляции (сокращенно — eIF). Они имеют номера: так, у эукариот (организмов с ядром в клетке, к которым также относится человек) один из самых важных факторов — второй (eIF2). Он вместе с транспортной РНК привозит первый «кирпичик» белка — аминокислоту метионин. В конце к малой субчастице рибосомы должна присоединиться еще и большая. Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
Когда все компоненты есть в клетке в нужных количествах, происходит гидролиз (разложение) молекулы гуанозинтрифосфата (ГТФ), что и служит сигналом к началу трансляции. Молекула ГТФ связана с фактором трансляции eIF2, но сам eIF2 гидролизовать ГТФ не может — для этого ему нужен еще один белок-помощник, eIF5. Наличие eIF5 в необходимой концентрации как раз и определяет, гидролизуется ли ГТФ.
«Как оказалось, если гидролиза не произойдет, то малая субчастица проигнорирует стартовый кодон AUG и проскользнет дальше, как ни в чем не бывало. Мы назвали это слайдингом», – говорит Сергей Дмитриев.
Открытие слайдинга опровергает устоявшееся мнение о том, что процесс выбора точки начала трансляции заканчивается на моменте распознавания точки старта синтеза. Решающим событием является не узнавание AUG, а гидролиз ГТФ.
У клеток человека нашли вторую «дверь» для коронавируса
Pleiotrope / Wikimedia Commons
Китайские ученые обнаружили еще одну мишень для коронавируса SARS-CoV-2 на поверхности клеток человека. Это белок CD147, которым, кстати, пользуется не только предыдущий коронавирус, возбудитель атипичной пневмонии, но и малярийный плазмодий. Заблокировав этот белок, исследователям удалось остановить распространение вируса в клеточной культуре. Клинические испытания соответствующего препарата-блокатора уже начались. Работа опубликована на портале препринтов bioRxiv.
Лекарство от коронавируса SARS-CoV-2 можно искать разными способами: например, попробовать запретить ему размножаться внутри клеток или стимулировать собственные системы клеточной защиты. Но есть и другой путь — заблокировать вирусу дорогу внутрь клеток.
Но есть и другой путь — заблокировать вирусу дорогу внутрь клеток.
Атака вируса на мишень начинается с того, что он прилипает своими поверхностными белками к белкам на мембране клеток. Затем мембрана вируса сливается с клеточной, а внутреннее содержимое вирусной частицы (РНК-геном) оказывается внутри клетки. До сих пор считалось, что SARS-CoV-2, как и его предшественник, SARS-CoV, возбудитель атипичной пневмонии, лучше всего связывается с клеточными белком ACE2. Однако у нового коронавируса целых четыре поверхностных белка, поэтому логично предположить, что и мишеней, то есть точек связывания с клеткой, у него будет несколько.
Кэ Ван (Ke Wang) вместе с коллегами из Четвертого военного медицинского университета в Сиане описали еще одну такую «дверь» внутри клетки, которую может использовать SARS-CoV-2. Еще в 2005 году, после вспышки атипичной пневмонии, они заметили, что SARS-CoV может связываться с рецептором CD147 на поверхности клеток. Это белок из семейства иммуноглобулинов. Судя по всему, у него несколько функций: например, он запускает работу металлопротеиназ — белков, перестраивающий внеклеточное вещество в тканях. Поскольку и предыдущая мишень, АСЕ2, у двух вирусов оказалась общей, то они предположили, что новый коронавирус тоже будет связываться с CD147.
Чтобы это проверить, исследователи заразили коронавирусом культуру клеток человеческой почки. Затем они обрабатывали ее антителами к CD147 и измеряли количество поврежденных клеток, а также концентрацию вирусных геномов в среде культивирования. Оказалось, что при концентрации антител в 3 мкг/мл удается достичь практически стопроцентной остановки распространения вируса между клетками.
Затем авторы работы показали с помощью иммунофлуоресцентного анализа, что поверхностный белок коронавируса SP и CD147 способны взаимодействовать друг с другом. И, наконец, окрасили клетки, зараженные коронавирусом, антителами к этим белкам. Внутри клеток SP и CD147 оказались рядом, что подтверждает предположение о том, что CD147 может помогать вирусу проникнуть внутрь клеток.
Слева — клетка почки, зараженная коронавирусом. Черная стрелка указывает на вирусную частицу внутри клетки. Справа — колокализация вирусного белка SP (красная стрелка) и CD147 (желтая стрелка).
Wang et al. / bioRxiv, 2020
CD147 является мишенью не только для коронавирусов, но и для малярии — именно за эту молекулу на поверхности эритроцитов «хватается» малярийный плазмодий. Поэтому антитело-блокатор CD147 давно существует в виде нескольких препаратов. Параллельно с публикацией научных данных китайские ученые начали клиническое испытание этих препаратов для борьбы с SARS-CoV-2. Они считают, что закрывать эту «дверь» логичнее, чем предыдущую. Блокада ACE2 чревата разными побочными эффектами, в том числе для легких, которые и так в ходе инфекции страдают сильнее всего. В то же время, блокада CD147, по их мнению, не должна вызвать таких последствий.
Ранее китайские врачи уже применили стволовые клетки для лечения пневмонии, вызванной SARS-CoV-2. О других лекарствах, которые в мире тестируют против нового вируса, читайте в нашем материале «На дне аптечки».
Полина Лосева
как работают «лекарства для генов»
Мало кто знает, что на основе ДНК и РНК можно сделать лекарства, способные противостоять инфекции и даже исправлять мутации у людей с генетическими заболеваниями. О том, как работают разнообразные методы этой отрасли и какие проблемы в ней только предстоит разрешить, школьникам «Сириуса» рассказал Валентин Власов – доктор биологических наук, академик РАН и научный руководитель Института химической биологии и фундаментальной медицины СО РАН.
Как заставить гены молчать
Нуклеотиды – «буквы» ДНК (дезоксирибонуклеиновой кислоты) и РНК (рибонуклеиновой кислоты), молекул, в которых хранится и передается генетическая информация. Хотя «букв» в этом своеобразном алфавите всего четыре (А, У, Г и Ц в ДНК и А, Т, Г и Ц в РНК), с их помощью можно записать осмысленный «текст» – гены (инструкцию по сборке белков, о которой ученикам недавно рассказывал другой гость, Денис Ребриков). Эта инструкция переписывается с двуцепочечной молекулы ДНК, которая находится в ядрах наших клеток, на одноцепочечную молекулу РНК, и уже с нее синтезируется белок.
Но нуклеотиды не просто служат для записи инструкций по сборке – из их цепочек можно делать лекарства, которые будут разрушать систему синтеза белка у вирусов или бактерий, привязываться к определенным молекулам или даже «чинить» мутации в генах. Лекарства на основе нуклеотидов действуют по относительно легко объяснимому принципу и обычно очень специфичны: на каждую конкретную последовательность можно «натравить» свою цепочку нуклеотидов. Это работает потому, что каждый из четырех типов «букв» может образовать пару с другим. В ДНК две цепи держатся вместе, так как в каждой из них напротив стоят определенные буквы, тянущие друг к другу «руки» химических связей.
Если сделать цепочку нуклеотидов, соответствующую последовательности РНК, которая будет создана с нужного (а точнее – ненужного) гена, то наше лекарство, используя все те же связи между парными буквами, сыграет роль «второй цепи», сделает молекулу похожей на ДНК и заблокирует эту последовательность. С нее не произведется белок, и вред «неправильного» гена будет нейтрализован. Такие цепочки называют антисенс-РНК (или антисмысловыми РНК), так как они лишают записанный в определенном гене «текст» его «смысла» . При этом по теории вероятности произвольно выбранная последовательность из всего 20 нуклеотидов у человека встретится лишь один раз на весь геном, так что риск ошибки очень невелик.
Множество разных лекарств на основе нуклеиновых кислот легко одновременно делать на заводе: из одних и тех же типов нуклеотидов строится огромное количество последовательностей. Работать такие лекарства могут по-разному: менять структуру гена, действовать на одну из стадий синтеза белка, на активирование РНК перед этим синтезом и так далее.
Ирония судьбы и нуклеиновый Уроборос
Первая научная публикация на эту тему появилась в 1967 году, а Валентин Власов стал одним из ее соавторов. Вскоре биологи получили письмо из США: некий студент по имени Джон Саммертон поздравлял коллег и сетовал, что самому ему также приходила эта идея, но вот финансирование получить не удалось. Три десятка лет спустя он откроет морфолино – одну из молекул, при помощи которой можно блокировать синтез определенных белков, – и станет главой крупнейшей компании по производству противовирусных лекарств на основе цепочек нуклеотидов (один из примеров – препарат от вируса Эбола).
Некоторые рибонуклеиновые кислоты не просто блокируют РНК, чтобы с нее не мог производиться белок, а разрезают ее – то есть выполняют работу, которую обычно делают ферменты (белки, которые катализируют реакции). Теоретически такие молекулы могли стать основой будущей жизни, катализируя воспроизводство самих себя во времена, когда еще не было ни белков, ни ДНК. Такие многофункциональные рибонуклеиновые кислоты назвали рибозимами – от «рибонуклеиновая кислота» (РНК), и «энзим» (фермент). За открытие рибозимов Сидни Олтмен и Томас Чек получили Нобелевскую премию по химии.
В 1998 году биологи открыли еще один интересный эффект, который назвали РНК-интерференцией. Наша клетка «привыкла» видеть РНК в виде одной цепи. Появление двуцепочечной часто означает вторжение геномных паразитов – вирусов, у которых можно встретить такую причудливую конструкцию. Поэтому такая РНК вызывает немало подозрений, и клетки научились заставлять «молчать» гены, которым она соответствует. Введя в клетку специально подобранную двуцепочечную РНК, можно добиться блокировки определенного гена.
«Генетические ножницы» и путеводные аптамеры
В начале 90-х годов ученые развили технологию, при помощи которой можно получать аптамеры – цепочки нуклеотидов, удивительно точно распознающие определенную «мишень». Такой мишенью может стать белок, который нужно блокировать или просто обнаружить. Чтобы создать аптамеры, достаточно насинтезировать много случайных последовательностей нуклеотидов, а потом предоставить этим цепочкам возможность связаться с мишенью – клюнуть на молекулярную «удочку». Затем молекулы, которые избежали этой участи, отмываются специальным раствором. Этот процесс можно повторить несколько раз. После такого искусственного отбора остаются только те молекулы, которые хорошо привязываются к нужной мишени. Это и есть аптамеры. Их можно размножить при помощи специальной реакции, которая называется ПЦР, и использовать в медицине. К примеру, уже сейчас существуют аптамеры, которые связываются с белками на поверхности клеток рака простаты. Ученые присоединили их к лекарственной молекуле, и теперь она сама может находить свою цель.
Еще один знаменитый многообещающий метод, CRISPR/Cas9, ученые подсмотрели у бактерий. У нас в организме есть множество разновидностей иммунных клеток, а бактериальные организмы одноклеточны. Несмотря на это, у них есть собственный иммунитет, позволяющий защищаться от вирусов. Бактерии вносят кусочки ДНК своих врагов в специальную «картотеку», которую хранят в своем геноме. Если тот же вирус появляется в клетке снова и хочет синтезировать белок за ее счет, специальные белки Cas будут узнать его РНК и разрезать ее. Если же в такую «картотеку» вставить нужную нам последовательность, систему CRISPR/Cas9 можно использовать для редактирования генов. Эту систему часто сравнивают с волшебными генетическими ножницами – место разреза можно выбрать довольно точно, так что ее перспективы в редактировании человеческого генома более чем заманчивы. Более того, метод уже применили для излечения генетических заболеваний у первых пациентов.
Бдительный иммунитет и светлое будущее
Однажды в экспериментах с мышами, больными энцефалитом, Валентин Власов и его коллеги обнаружили, что иммунный ответ возник не только у мышей, которым ввели специфические для вируса энцефалита последовательности, но и у группы контроля, которой просто вводили случайные цепочки нуклеотидов. Ученые решили, что эксперимент не удался, но позднее другие биологи оказались упорнее и сообразительнее и выяснили, чем вызван этот странный эффект.
«Природа тоже умная и широко использует этот принцип – олигонуклеотиды действуют слишком хорошо, а не просто прилипают. Мы ожидали, что наш олигонуклеотид свяжется и будет мешать синтезу белка. Оказалось, что в клетке есть фермент рибонуклеаза H, который атакует такие комплексы и разрезает их. То есть, можно не просто блокировать мишень, а уничтожить ее», – рассказал академик.
Так была открыта «нелюбовь» организма к чужим нуклеиновым кислотам. Ученые установили, что наш иммунитет умеет отличать их от «родных» по некоторым признакам. Например, в наших генах на последовательностях Г-Ц висит специальная метка – метильная группа. У бактерий ее нет, поэтому последовательность без метки наша клетка принимает за бактериальную и начинает «воевать» против нее.
Несмотря на такое разнообразие потенциальных лекарств на основе нуклеиновых кислот, до реального применения дошли лишь несколько. Активно внедрять эту группу лекарств в клиническую практику мешают ее недостатки: такие молекулы могут быть беззащитны перед ферментами организма, которые будут стремиться их разрезать, да и клеточная оболочка тоже очень привередливо относится ко всевозможным непрошеным гостям, тем более если они большого размера и тоже заряжены отрицательно, как и она сама (а значит, будут от нее отталкиваться). К тому же, организм большой, и во все клетки сразу лекарство не доставить. Напротив – чаще всего оно требуется только в клетках определенного типа. Поэтому ученые подбирают нуклеиновым кислотам носители (например, золотые наночастицы), химически модифицируют их, привязывают к ним молекулы, которые сыграют роль «системы самонаведения». Решить эти задачи предстоит сегодняшним школьникам – и, возможно, вскоре они увидят широкое применение этой отрасли в медицине.
Решить эти задачи предстоит сегодняшним школьникам – и, возможно, вскоре они увидят широкое применение этой отрасли в медицине.
Biology4Kids.com: Структура клетки: Рибосомы
Клеткам необходимо производить белков . Белковые ферменты ускоряют биологические процессы. Другие белки поддерживают клеточные функции и находятся в мембранах. Белки даже составляют большую часть ваших волос. Когда клетке нужно производить белки, она ищет рибосомы. Рибосомы являются строителями белка или синтезаторами белка клетки. Они похожи на строителей, которые соединяют по одной аминокислоте за раз и выстраивают длинные цепочки.
Рибосомы особенные, потому что они встречаются как у прокариот, так и у эукариот. Хотя такая структура, как ядро, встречается только у эукариот, каждой клетке необходимы рибосомы для производства белков. Поскольку у прокариот нет мембраносвязанных органелл, рибосомы свободно плавают в цитозоле.
Рибосомы встречаются во многих местах вокруг эукариотической клетки. Вы можете обнаружить их плавающими в цитозоле. Эти плавающие рибосомы производят белки, которые будут использоваться внутри клетки.Другие рибосомы находятся в эндоплазматической сети. Эндоплазматический ретикулум с прикрепленными рибосомами называется грубым ER. Под микроскопом он выглядит ухабистым. Присоединенные рибосомы образуют белки, которые будут использоваться внутри клетки, и белки, предназначенные для экспорта из клетки. К ядерной оболочке также прикреплены рибосомы. Эти рибосомы синтезируют белки, которые попадают в перинуклеарное пространство.
Каждая рибосома состоит из двух частей или субъединиц. У эукариот ученые идентифицировали субъединицы 60-S (большие) и 40-S (маленькие).Несмотря на то, что рибосомы имеют немного разные структуры у разных видов, их функциональные области очень похожи.
Например, у прокариот рибосомы немного меньше, чем у эукариот. Модель 60-S / 40-S отлично работает для эукариотических клеток, в то время как прокариотические клетки имеют рибосомы, состоящие из 50-S и 30-S субъединиц. Это небольшая разница, но одна из многих, которые вы найдете в двух разных типах ячеек. Ученые использовали это различие в структуре рибосом для разработки лекарств, которые могут убивать прокариотические микроорганизмы, вызывающие заболевания.Существуют даже структурные различия между рибосомами, обнаруженными в митохондриях, и свободными рибосомами.
Модель 60-S / 40-S отлично работает для эукариотических клеток, в то время как прокариотические клетки имеют рибосомы, состоящие из 50-S и 30-S субъединиц. Это небольшая разница, но одна из многих, которые вы найдете в двух разных типах ячеек. Ученые использовали это различие в структуре рибосом для разработки лекарств, которые могут убивать прокариотические микроорганизмы, вызывающие заболевания.Существуют даже структурные различия между рибосомами, обнаруженными в митохондриях, и свободными рибосомами.
Когда рибосомы используются в процессе синтеза белка? Когда клетке необходимо производить белок, в ядре создается мРНК. мРНК затем отправляется из ядра в рибосомы. Когда приходит время производить белок, две субъединицы объединяются и соединяются с мРНК. Субъединицы фиксируются на мРНК и запускают синтез белка.
Процесс создания белков довольно прост.Во-первых, вам нужна аминокислота. Еще одна нуклеиновая кислота, которая живет в клетке, — это РНК переноса . тРНК связана с аминокислотами, плавающими вокруг клетки. С помощью инструкций по предложению мРНК рибосома соединяется с тРНК и извлекает одну аминокислоту. Затем тРНК высвобождается обратно в клетку и присоединяется к другой аминокислоте. Рибосома выстраивает длинную аминокислотную (полипептидную) цепь, которая в конечном итоге станет частью более крупного белка.
Клетки мозга из клеток кожи (видео Кембриджского университета)
Полезные справочные ссылки
Энциклопедия.com:
http://www.encyclopedia.com/topic/Ribosomes.aspx
Википедия:
http://en.wikipedia.org/wiki/Ribosomes
Британская энциклопедия:
http://www.britannica.com/EBchecked/topic/502164/ribosome
белков | Базовая биология
Белки — это строительные блоки жизни. Они жизненно важны для нашего существования и присутствуют в каждом организме на Земле.
Они жизненно важны для нашего существования и присутствуют в каждом организме на Земле.
Белки — это наиболее распространенные молекулы, обнаруживаемые в клетках.Фактически, они составляют больше сухого вещества клетки, чем липиды, углеводы и все другие молекулы вместе взятые.
Белок состоит из одной или нескольких полипептидных цепей, и каждая полипептидная цепь построена из более мелких молекул, называемых «аминокислотами». Всего существует 20 аминокислот, которые можно упорядочить в триллионы и триллионы различных способов для создания белков, выполняющих огромное количество функций.
Белки на самом деле являются наиболее структурно сложными молекулами, известными биологии.
Функции белков
Белки бывают самых разнообразных форм и выполняют широкий спектр функций. Примеры белков включают ферменты, антитела и некоторые гормоны, которые помогают ускорить химические реакции, защищают от болезней и регулируют активность клеток.
Белки также играют роль в движении, структурной поддержке, хранении, связи между клетками, пищеварении и транспортировке веществ по телу.
Движение
Двигательные белки, такие как миозин и динеины, обладают способностью преобразовывать химическую энергию в движение.Миозин — это белок, содержащийся в мышцах, который вызывает сокращение мышечных волокон в мышцах.
Динеины обеспечивают питание жгутиков. Жгутики — это длинные тонкие структуры, прикрепленные к внешней стороне определенных клеток, таких как сперматозоиды, и отвечают за их подвижность.
Структура и поддержка
Многие белки обеспечивают структурную поддержку определенных частей организма. Например, кератин — это белок, содержащийся во внешних слоях кожи, который делает кожу сильным защитным слоем для внешнего мира.Кератин также является структурным белком, из которого состоят волосы, рога и ногти.
Сотовая связь
Клетки взаимодействуют с окружающей средой и другими клетками. Рецепторные белки в клеточной мембране получают сигналы извне клетки и передают сообщения в клетку. Как только сигнал попадает в клетку, он обычно передается между несколькими белками, прежде чем достигнет своего конечного пункта назначения (также чаще всего белка).
Рецепторные белки в клеточной мембране получают сигналы извне клетки и передают сообщения в клетку. Как только сигнал попадает в клетку, он обычно передается между несколькими белками, прежде чем достигнет своего конечного пункта назначения (также чаще всего белка).
Пищеварение
Пищеварение обеспечивается, как вы уже догадались, белками.Ферменты — это белки, которые стимулируют пищеварение, ускоряя химические реакции.
Пищеварение — это расщепление пищи из крупных нерастворимых молекул на более мелкие, которые могут растворяться в воде. Поскольку более мелкие молекулы растворимы в воде, они могут попадать в кровь и переноситься по телу.
Пищеварительные ферменты — это ферменты, ответственные за расщепление молекул пищи на более мелкие водорастворимые молекулы. Вот некоторые примеры пищеварительных белков:
- Амилаза — фермент в слюне, расщепляющий крахмал на растворимые сахара
- Липаза — расщепляет жиры и другие липиды
- Пепсин — расщепляет белки в пище
Транспорт кислорода
Гемоглобин — еще один чрезвычайно важный белок для животных, таких как млекопитающие и птицы.Это белок крови, который связывается с кислородом, чтобы кислород мог транспортироваться по телу.
Гемоглобин содержит атом железа. Химическая структура гемоглобина вокруг атома железа позволяет кислороду связываться с железом, а затем высвобождаться в ткани, лишенные кислорода.
Как видите, белки чрезвычайно важны для здорового функционирования организма. Большинство примеров, которые я использовал, являются белками животного происхождения, но белки не менее важны для других форм жизни, таких как растения, грибы и бактерии.
Строительные блоки белков
Аминокислоты являются строительными блоками белков. Всего в природе существует 20 различных аминокислот. Аминокислоты могут связываться друг с другом самыми разными способами, создавая разные белки.
Химическая структура аминокислот — ключ к тому, почему белки стали основой жизни. Аминокислота состоит из карбоксильной группы (химическая структура -COOH), аминогруппы (-NH₂) и боковой цепи, состоящей в основном из углерода и водорода.
Аминокислота состоит из карбоксильной группы (химическая структура -COOH), аминогруппы (-NH₂) и боковой цепи, состоящей в основном из углерода и водорода.
Сайдчейн часто называют группой R. Различия в группе R — это то, что отличает 20 аминокислот друг от друга.
В зависимости от структуры группы R аминокислота может быть водорастворимой (полярной), нерастворимой в воде (неполярной) или содержать положительный или отрицательный заряд. Эти характеристики, в свою очередь, влияют на поведение аминокислот при связывании и влияют на общую форму и функцию белка.
Все 20 аминокислот необходимы для хорошего здоровья.Если в организме мало одной из 20 аминокислот, определенные белки не могут быть построены, и потеря их функций вызовет проблемы со здоровьем для организма.
Некоторые аминокислоты могут быть созданы организмом с использованием других молекул, в то время как другие аминокислоты должны быть получены из пищи. Аминокислоты, которые необходимо употреблять в пищу, известны как «незаменимые аминокислоты», потому что они являются неотъемлемой частью здорового питания. Аминокислоты, которые может производить наш организм, известны как «заменимые аминокислоты».
Полипептиды
Полипептид представляет собой цепочку аминокислот и является простейшей формой белка. Аминокислоты связываются вместе, образуя длинные линейные цепи, длина которых может составлять более 2000 аминокислот.
Порядок, в котором аминокислоты связаны друг с другом, определяет окончательную форму и структуру полипептидной цепи. Белок будет содержать один полипептид или несколько полипептидов, связанных вместе с образованием больших сложных белков.
Аминокислоты связаны между аминогруппой (-NHN) одной аминокислоты и карбоксильной группой (-COOH) второй аминокислоты.
Поскольку две аминокислоты связываются вместе, два иона водорода удаляются из аминогруппы, а кислород удаляется из карбоксильной группы. Аминогруппа и карбоксильная группа связываются вместе, и в качестве побочного продукта образуется молекула воды.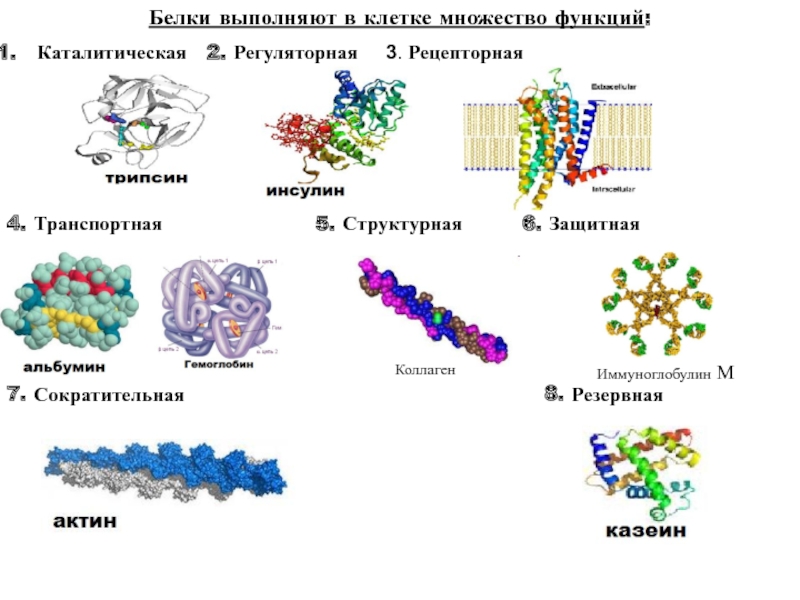 Связь известна как «пептидная связь».
Связь известна как «пептидная связь».
Соединение нескольких аминокислот вместе пептидными связями создает основу полипептида с группой R, отходящей от каждой аминокислоты. Как упоминалось ранее, каждая группа R из 20 аминокислот имеет свою уникальную структуру и химические свойства.Структура и химические свойства (такие как реакционная способность и температура кипения) полипептида и, в конечном итоге, белка определяются уникальной последовательностью групп R, которые отходят от основной цепи полипептида. Когда группы R притягиваются или отталкиваются друг от друга, полипептидная цепь изгибается и скручивается в белок уникальной формы.
Структура белка
Белки имеют четыре уровня структуры, о которых мы уже упоминали на этой странице. Эти четыре уровня известны как первичная, вторичная, третичная и четвертичная структура белка.
Первичная структура
Первичная структура — это определенная последовательность аминокислот, то есть порядок, в котором они связаны друг с другом. Точный порядок связывания аминокислот определяется информацией, хранящейся в генах.
Посредством процессов, называемых транскрипцией и трансляцией, ДНК предоставляет клеткам всю необходимую информацию для создания точной первичной структуры для тысяч различных белков. Первичная структура определяет вторичную и третичную структуры белков.
Вторичная структура
Вторичная структура белка образована водородными связями между атомами вдоль основной цепи полипептидной цепи.
Помня, что каждая аминокислота имеет карбоксильную группу и аминогруппу, небольшой отрицательный заряд кислорода карбоксильной группы образует слабую связь с небольшим положительным зарядом атома водорода аминогруппы другой аминокислоты. Водородные связи слабые, но многие из них создают достаточно прочности, чтобы влиять на форму полипептидной цепи.
Водородные связи заставляют основную цепь полипептида складываться и скручиваться в две возможные формы — α-спираль и β-складчатые листы. Спираль α (греческая буква «альфа») представляет собой спираль, похожую на двойную спираль известной цепи ДНК, но только с одной спиралью, и образована водородными связями между каждой четвертой аминокислотой. Спираль α обычна в структурных белках, таких как кератин.
Спираль α (греческая буква «альфа») представляет собой спираль, похожую на двойную спираль известной цепи ДНК, но только с одной спиралью, и образована водородными связями между каждой четвертой аминокислотой. Спираль α обычна в структурных белках, таких как кератин.
Складчатые листы β (греческая буква «бета») образуются, когда водородные связи возникают между двумя или более соседними полипептидными цепями и являются обычными для глобулярных белков (см. Ниже в разделе «Типы белков»).
Третичная структура
Третичная структура — это окончательная форма, которую принимает полипептидная цепь, и определяется группами R. Притяжение и отталкивание между различными группами R изгибает и складывает полипептид, создавая окончательную трехмерную форму белка.
Четвертичная структура
Не все белки имеют четвертичную структуру. Четвертичная структура возникает только тогда, когда несколько полипептидных цепей объединяются вместе с образованием большого сложного белка. В таких случаях каждый полипептид называют «субъединицей».
Гемоглобин является примером белка с четвертичной структурой. У большинства животных гемоглобин состоит из четырех глобулярных субъединиц.
Типы белков
Существует четыре основных типа белков. Наиболее известны глобулярные белки. Остальные три типа белков — это волокнистые, мембранные и неупорядоченные белки.
Глобулярные белки
Глобулярные белки — это любой белок, имеющий сферическую форму в своей третичной структуре. К ним относятся многие ферменты, антитела и белки, такие как гемоглобин.
Глобулярные белки растворимы в воде и создаются за счет притяжения и отталкивания различных R-групп водой. Полярные R-группы аминокислот в белках растворимы в воде, а неполярные R-группы нерастворимы в воде. Глобулярные белки образуются, потому что неполярные группы R прячутся во внутренних частях белка, а полярные группы R располагаются на внешней поверхности, которая подвергается воздействию окружающей воды.
Волокнистые белки
Волокнистые белки представляют собой удлиненные белки, не имеющие какой-либо третичной структуры.Вместо того, чтобы изгибаться и складываться с образованием глобулярного белка, волокнистые белки остаются в своей линейной вторичной структуре. Часто они являются важными структурными и поддерживающими белками.
Волокнистые белки нерастворимы в воде и часто имеют повторяющиеся структуры аминокислот вдоль их полипептидной цепи. Примеры волокнистых белков включают коллаген, кератин и шелк.
Мембранные белки
Мембранный белок — это любой белок, обнаруженный внутри или прикрепленный к клеточной мембране. Это уникальные белки из-за уникальной среды, в которой они существуют.
Клеточные мембраны состоят из двойного слоя фосфолипидов. Внутренние части клеточной мембраны неполярны, а внешние — полярны. Чтобы мембранные белки успешно существовали через клеточную мембрану, они должны содержать определенные неполярные и полярные участки.
Неупорядоченные белки
Открытие неупорядоченных белков в начале 2000-х годов бросило вызов историческому мышлению о белках. До этого считалось, что функция белка зависит от его фиксированной трехмерной структуры.Однако неупорядоченные белки не имеют упорядоченной структуры своей формы.
Некоторые белки могут быть полностью неструктурированными, в то время как другие частично структурированы с определенными неструктурированными участками. Другие белки обладают способностью существовать как неупорядоченные белки только для образования фиксированной структуры после связывания с другими молекулами.
Последний раз редактировалось: 23 апреля 2016 г.
БЕСПЛАТНЫЙ 6-недельный курс
Введите свои данные, чтобы получить доступ к нашему БЕСПЛАТНО 6-недельному вводному курсу электронной почты по биологии.
Узнайте о животных, растениях, эволюции, древе жизни, экологии, клетках, генетике, областях биологии и многом другом.
Успех! Письмо с подтверждением было отправлено на адрес электронной почты, который вы только что указали. Проверьте свою электронную почту и убедитесь, что вы щелкнули ссылку, чтобы начать наш 6-недельный курс.
Проверьте свою электронную почту и убедитесь, что вы щелкнули ссылку, чтобы начать наш 6-недельный курс.
Производство белка — основы биологии
Белки — одна из самых распространенных органических молекул в живых системах, обладающая невероятно разнообразным набором функций.Белки используются для:
- Строить структуры внутри клетки (например, цитоскелет)
- Регулировать производство других белков, контролируя синтез белка
- Проведите по цитоскелету, чтобы вызвать сокращение мышц
- Транспортные молекулы через клеточную мембрану
- Ускорение химических реакций (ферменты)
- Действовать как токсины
Каждая клетка живой системы может содержать тысячи различных белков, каждый из которых выполняет уникальную функцию.Их структуры, как и их функции, сильно различаются. Однако все они представляют собой полимеры аминокислот, расположенных в линейной последовательности ( Рисунок 1 ).
Функции белков очень разнообразны, потому что они состоят из 20 различных химически различных аминокислот, которые образуют длинные цепи, и аминокислоты могут быть в любом порядке. Функция белка зависит от формы белка. Форма белка определяется порядком аминокислот. Белки часто состоят из сотен аминокислот и могут иметь очень сложную форму, потому что существует очень много различных возможных порядков для 20 аминокислот!
Рисунок 1 Структура белка.Цветные шары в верхней части диаграммы представляют собой разные аминокислоты. Аминокислоты — это субъединицы, которые соединяются рибосомой с образованием белка. Затем эта цепочка аминокислот складывается, образуя сложную трехмерную структуру. (Предоставлено: Lady of Hats из Википедии; общественное достояние)
Вопреки тому, во что вы можете верить, белки обычно не используются клетками в качестве источника энергии. Белок из вашего рациона расщепляется на отдельные аминокислоты, которые собираются вашими рибосомами в белки, которые нужны вашим клеткам. Рибосомы не производят энергию.
Рибосомы не производят энергию.
Рисунок 2 Примеры продуктов с высоким содержанием белка. («Белок» Национального института рака находится в открытом доступе)
Информация для производства белка закодирована в ДНК клетки. При производстве белка создается копия ДНК (называемая мРНК), и эта копия переносится на рибосому. Рибосомы считывают информацию в мРНК и используют эту информацию для сборки аминокислот в белок. Если белок будет использоваться в цитоплазме клетки, рибосома, создающая белок, будет свободно плавать в цитоплазме.Если белок будет нацелен на лизосому, стать компонентом плазматической мембраны или секретироваться вне клетки, белок будет синтезироваться рибосомой, расположенной на шероховатом эндоплазматическом ретикулуме (RER). После синтеза белок будет перенесен в везикуле от RER к цис грани Гольджи (сторона, обращенная внутрь клетки). По мере того, как белок проходит через Гольджи, его можно модифицировать. Как только последний модифицированный белок завершен, он выходит из Гольджи в пузырьке, который отрастает от поверхности trans .Оттуда везикула может быть нацелена на лизосому или на плазматическую мембрану. Если везикула сливается с плазматической мембраной, белок станет частью мембраны или будет выброшен из клетки.
Рисунок 3 Схема эукариотической клетки. (Фото: Медиран, Викимедиа, 14 августа 2002 г.)
Инсулин
Инсулин — это белковый гормон, который вырабатывается определенными клетками поджелудочной железы, называемыми бета-клетками. Когда бета-клетки чувствуют, что уровень глюкозы (сахара) в кровотоке высок, они производят белок инсулина и выделяют его вне клеток в кровоток.Инсулин дает клеткам сигнал поглощать сахар из кровотока. Клетки не могут усваивать сахар без инсулина. Белок инсулина сначала образуется в виде незрелой, неактивной цепи аминокислот (препроинсулин — см. Рисунок 4). Он содержит сигнальную последовательность, которая направляет незрелый белок в грубый эндоплазматический ретикулум, где он складывается в правильную форму. Затем нацеливающая последовательность отрезается от аминокислотной цепи с образованием проинсулина. Этот обрезанный, свернутый белок затем отправляется к Гольджи внутри пузырька.В системе Гольджи из белка удаляется больше аминокислот (цепь C), чтобы произвести окончательный зрелый инсулин. Зрелый инсулин хранится в специальных пузырьках до тех пор, пока не будет получен сигнал для его попадания в кровоток.
Затем нацеливающая последовательность отрезается от аминокислотной цепи с образованием проинсулина. Этот обрезанный, свернутый белок затем отправляется к Гольджи внутри пузырька.В системе Гольджи из белка удаляется больше аминокислот (цепь C), чтобы произвести окончательный зрелый инсулин. Зрелый инсулин хранится в специальных пузырьках до тех пор, пока не будет получен сигнал для его попадания в кровоток.
Рисунок 4 Созревание инсулина. (Фотография предоставлена консорциумом Beta Cell Biology Consortium, Викимедиа. 2004 г. Это изображение находится в открытом доступе.
Если не указано иное, изображения на этой странице лицензированы OpenStax в соответствии с CC-BY 4.0.
Текст адаптирован из: OpenStax, Концепции биологии.OpenStax CNX. 18 мая 2016 г. http://cnx.org/contents/[email protected]
Белковая фабрика
Август в нашем календаре PDBe на 2020 год вдохновлен механизмами клеточного производства белка, называемыми рибосомами. Рибосомы — это очень сложные и важные структуры в клетке, которые выполняют жизненно важную роль в синтезе белка.
Белковая фабрика клетки
Каждая клетка нашего тела содержит около 10 миллиардов белков, которые позволяют нам думать, двигаться, есть, играть и делать многое другое.Их эффективное создание — это работа этих макромолекулярных машин, называемых рибосомами, которые обнаружены во всех живых клетках всех видов, от бактерий до людей.
Структура рибосомного комплекса
Глядя на рибосому, кажется, что она представляет собой запутанную мешанину белков и молекул РНК, однако на самом деле она сшита вместе с безупречной точностью.
Две субъединицы рибосомы, собранные вместе с малой и большой субъединицами, показанными в виде лент серого и бирюзового цветов соответственно (запись PDB 6KE0)
Криоэлектронная микроскопия и рентгеновская кристаллография показали, что рибосома состоит из двух субъединиц: малой и большой субъединиц. Каждая из этих субъединиц образует сложную сеть из нескольких молекул РНК с десятками различных белков. В 2000 году структурные биологи Венкатраман Рамакришнан, Томас А. Стейтц и Ада Э. Йонат разрешили первые кристаллические структуры рибосомы с атомным разрешением. В 2009 году этим трем исследователям была присуждена Нобелевская премия по химии за их исследования структуры и функции рибосомы, что свидетельствует о важности рибосомы.
Каждая из этих субъединиц образует сложную сеть из нескольких молекул РНК с десятками различных белков. В 2000 году структурные биологи Венкатраман Рамакришнан, Томас А. Стейтц и Ада Э. Йонат разрешили первые кристаллические структуры рибосомы с атомным разрешением. В 2009 году этим трем исследователям была присуждена Нобелевская премия по химии за их исследования структуры и функции рибосомы, что свидетельствует о важности рибосомы.
Синтез белка
Синтез новых белков начинается в ядре, где рибосомы получают команду начать этот процесс.Участки ДНК (гены), кодирующие определенный белок, копируются на нити информационной РНК (мРНК) в процессе, называемом транскрипцией.
После завершения транскрипции ДНК в мРНК, следующим процессом является трансляция, когда эти мРНК считываются для образования белков. Каждая мРНК определяет порядок, в котором аминокислоты должны быть добавлены к белковой цепи в процессе ее синтеза. Если за основу берется ДНК, то масоны — это рибосомы — они строят белок, используя аминокислоты в качестве «кирпичиков».
Для создания белков две рибосомные субъединицы, малая и большая, собираются вместе, образуя полную рибосому. Он имеет сайты связывания для молекул мРНК и транспортной РНК (тРНК). Большая субъединица находится поверх маленькой субъединицы, а матрица мРНК расположена между ними. После полной сборки рибосома начинает процесс производства белка.
Производство белка
Двигаясь вдоль мРНК, рибосома считывает набор трехнуклеотидных последовательностей на мРНК, называемых кодоном, который кодирует определенную аминокислоту.ТРНК доставляет эти аминокислоты, строительные блоки белка, к рибосоме. Каждая молекула тРНК имеет два разных конца или сайта, один для связывания с определенной аминокислотой, а другой для связывания с соответствующим кодоном мРНК. Во время трансляции эти тРНК переносят аминокислоты на рибосому и присоединяются к своим комплементарным кодонам на мРНК. Впоследствии они преобразуются в правильные аминокислоты в новой белковой цепи.
Впоследствии они преобразуются в правильные аминокислоты в новой белковой цепи.
Собранные аминокислоты сшиваются вместе с помощью молекул рРНК (рибосомной РНК), которые направляют процесс создания новой белковой цепи.Повторяя этот процесс для каждой аминокислоты, весь белок строится в процессе, называемом удлинением. Растущая белковая цепь останавливается только тогда, когда она встречает стоп-кодон на мРНК. Это сигнализирует об окончании полипептидной цепи во время трансляции. Как только аминокислоты сформированы правильно, вновь синтезированная белковая цепь транспортируется либо в цитоплазму, либо в аппарат Гольджи у прокариот или эукариот, соответственно.
Ниже приведено видео с сайта YourGenome, объясняющее этот процесс.
Больше, чем протеиновый завод
Точный и быстрый перевод генетической информации критически важен для производства функциональных белков для жизнеспособности клеток.Скорость производства белка должна быть быстрой и очень точной, чтобы своевременно реагировать на изменения в окружающей среде. Поразительная точность рибосомного оборудования имеет коэффициент ошибки 1 на 1000–10 000 аминокислот. Одна рибосома в эукариотической клетке может добавлять 2 аминокислоты к белковой цепи каждую секунду, однако у прокариот рибосомы могут работать еще быстрее, добавляя к полипептиду около 20 аминокислот каждую секунду. Рибосомы потребляют большое количество энергии для синтеза белков и составляют значительную часть клеточной массы, при этом значительная часть метаболизма клетки направляется на производство рибосомных белков и РНК.
Нацелены на бактериальные рибосомы
Рибосомы присутствуют во всех формах жизни и необходимы для синтеза белка, что делает их желательной мишенью для лекарств. Большинство клинически используемых антибиотиков нацелены на рибосомы и ингибируют процесс синтеза белка, вмешиваясь в трансляцию мРНК или блокируя образование пептидных связей.
Бактериальные рибосомы — одна из основных мишеней для антибиотиков. Эти антибиотики не позволяют бактериям синтезировать собственные белки из-за ингибирования их рибосомы, которая в конечном итоге убивает бактерии.Разработка таких антибиотиков стала возможной из-за различий между бактериальными и эукариотическими рибосомами. Они различаются не только по размеру, но также по последовательности и структуре, что позволяет антибиотикам убивать только бактерии, ингибируя их рибосомы, не затрагивая человеческие рибосомы.
В PDB доступны структуры многих антибиотиков в комплексе с рибосомами. Эти структуры с разрешением на атомарном уровне позволяют нам лучше понять механизм их действия.
Спасательные антибиотики
Антибиотики, такие как неомицин, гентамицин и стрептомицин, относятся к группе аминогликозидов, которые широко используются для лечения тяжелых инфекций брюшной полости и мочевыводящих путей. Они ингибируют малую субъединицу рибосомы, включая тетрациклины, которые блокируют связывание тРНК.
Другой широко назначаемый антибиотик, эритромицин, относится к классу натуральных продуктов. Он оказывает два эффекта на трансляцию: во-первых, предотвращает удлинение полипептидной цепи, а во-вторых, ингибирует образование большой субъединицы рибосомы.
На рисунке ниже показан ряд антибиотиков, которые нацелены на бактериальную рибосому в различных участках большой (голубовато-серый) и малой (желтый) субъединицы рибосомы.
Это изображение взято из статьи «Бактериальная рибосома как мишень для антибиотиков». Nat Rev Microbiol 3, 870–881 (2005). https://doi.org/10.1038/nrmicro1265
Ингибирование эукариотической рибосомы
Некоторые антибиотики, такие как генетицин, также называемый G418, ингибируют стадию элонгации как в прокариотических, так и в эукариотических рибосомах. Рицин, лектин (белок, связывающий углеводы), вырабатываемый семенами клещевины, является сильнодействующим токсином. Всего несколько крупинок очищенного порошка рицина могут убить взрослого человека. Он ингибирует удлинение путем ферментативной модификации рРНК большой рибосомной субъединицы эукариот. Другим известным ингибитором трансляции эукариот является циклогексимид, который обычно используется в лабораториях для подавления синтеза белка.
Рицин, лектин (белок, связывающий углеводы), вырабатываемый семенами клещевины, является сильнодействующим токсином. Всего несколько крупинок очищенного порошка рицина могут убить взрослого человека. Он ингибирует удлинение путем ферментативной модификации рРНК большой рибосомной субъединицы эукариот. Другим известным ингибитором трансляции эукариот является циклогексимид, который обычно используется в лабораториях для подавления синтеза белка.
Лечение рака
Биогенез рибосом, процесс создания рибосом, недавно стал эффективной мишенью в терапии рака.Несколько соединений, ингибирующих продукцию или функцию рибосом, предпочтительно убивающих раковые клетки, прошли клинические испытания. Недавние исследования показывают, что клетки экспрессируют гетерогенные популяции рибосом и что состав рибосом может играть ключевую роль в онкогенезе, открывая новые терапевтические возможности.
Об изображении
Два произведения искусства, керамическая скульптура (слева) и кусок шелкового батика (справа), были созданы Шином Галаутом и Мари Бишофс, 13-летними учениками Школы Персе и Колледжа Импингтон Вилладж, соответственно.Оба художника черпали вдохновение из комплексов белков и нуклеиновых кислот в базе данных PDB, а их работы основывались на процессе синтеза белка и рибосомах.
Дипти Гупта
Локализация белка
| MBInfo
Для того, чтобы субклеточные процессы осуществлялись в определенных компартментах или клеточных областях, должны существовать механизмы, гарантирующие, что необходимые белковые компоненты присутствуют на участках и в адекватной концентрации.Накопление белка в определенном месте называется локализацией белка.
SRP (частица распознавания сигнала) взаимодействует с сигнальной последовательностью, как только она выходит из туннеля выхода рибосомного полипептида (1-2). У эукариот удлинение пептида приостанавливается при образовании комплекса растущей цепи SRP / рибосомы; затем комплекс направляется на мембрану ER за счет взаимодействия с рецептором SRP (3). Связывание GTP с SRP и рецептором SRP является предпосылкой для образования комплекса рецепторов SRP / SRP.После позиционирования комплекса (3) комплекс рецептора SRP / SRP диссоциирует от пептида из-за гидролиза GTP. Растущий пептид постепенно переносится через белок-проводящий канал (транслокон) в просвет ЭПР (4). Обычно сигнальные последовательности отщепляются ко-трансляционно с помощью SPases (сигнальных пептидаз), и полученные отщепленные сигнальные последовательности называются сигнальными пептидами (4-5).
Связывание GTP с SRP и рецептором SRP является предпосылкой для образования комплекса рецепторов SRP / SRP.После позиционирования комплекса (3) комплекс рецептора SRP / SRP диссоциирует от пептида из-за гидролиза GTP. Растущий пептид постепенно переносится через белок-проводящий канал (транслокон) в просвет ЭПР (4). Обычно сигнальные последовательности отщепляются ко-трансляционно с помощью SPases (сигнальных пептидаз), и полученные отщепленные сигнальные последовательности называются сигнальными пептидами (4-5).
Рекрутинг белка — это, по сути, форма распознавания белка, которая стала возможной благодаря присутствию определенных аминокислотных последовательностей в структуре белка.Например, многие связанные с мембраной белки несут сигнальные пептиды, которые распознаются сигнальными рецепторами, которые направляют их к целевому сайту. Сигнал ядерной локализации — один из таких примеров. Белки, предназначенные для эндоплазматического ретикулума, также несут сигнальный пептид.
В других случаях белки могут нести сигнальный пластырь. Обычно он состоит примерно из 30 аминокислот, которые не присутствуют в линейной последовательности, но находятся в непосредственной пространственной близости в трехмерном пространстве.
Интересно, что организация клетки и ее различных регионов действительно играет роль в направлении рекрутирования белков в заданный сайт.Например, в эпителиальных клетках, которые поляризованы, состав белков на апикальной мембране сильно отличается от такового на базолатеральной мембране. Это достигается за счет распознавания различных сигнальных последовательностей, нацеленных на белки в каждой из этих областей. Например, белки апикальной мембраны очень часто прикреплены к GPI (гликофосфатидилинозитол), тогда как базолатеральные белки имеют сигнатурные последовательности на основе diLeu (N, N-диметиллейцин) или тирозиновых аминокислот [1].
Цитозольные белки, которые связаны с плазматическими мембранами, часто локализуются на основе их взаимодействия с мембранными липидами, такими как фосфоинозитиды. Фосфатидилинозитол-4,5-бисфосфат (PIP2) — самый распространенный фосфоинозитид в клетках млекопитающих. PIP2 обогащен в определенных областях на мембране и благодаря своей способности взаимодействовать с доменами PH (гомологии плекстрина) белков; он может локально рекрутировать белки, обладающие такими доменами. Белки, содержащие домен FERM, связывающие актин с мембраной, также могут взаимодействовать с PIP2 [2]. Другой близкородственный фосфоинозитид, фосфатидилинозитол-3,4,5-трифосфат (PIP3), также может быть обогащен в определенных областях плазматической мембраны.Было показано, что обогащение PIP3 накапливается на кончиках нейронов, вызывая поляризацию клеток и образование аксонов [3]. Также предполагается, что он вызывает локальную деполимеризацию актина в клетках Dictyostelium и влияет на миграцию клеток [4], хотя другие исследования нейтрофилов показали, что его роль заключается в полимеризации актина [5].
Фосфатидилинозитол-4,5-бисфосфат (PIP2) — самый распространенный фосфоинозитид в клетках млекопитающих. PIP2 обогащен в определенных областях на мембране и благодаря своей способности взаимодействовать с доменами PH (гомологии плекстрина) белков; он может локально рекрутировать белки, обладающие такими доменами. Белки, содержащие домен FERM, связывающие актин с мембраной, также могут взаимодействовать с PIP2 [2]. Другой близкородственный фосфоинозитид, фосфатидилинозитол-3,4,5-трифосфат (PIP3), также может быть обогащен в определенных областях плазматической мембраны.Было показано, что обогащение PIP3 накапливается на кончиках нейронов, вызывая поляризацию клеток и образование аксонов [3]. Также предполагается, что он вызывает локальную деполимеризацию актина в клетках Dictyostelium и влияет на миграцию клеток [4], хотя другие исследования нейтрофилов показали, что его роль заключается в полимеризации актина [5].
Кроме того, цитозольные домены трансмембранных белков могут привлекать другие белки, присутствующие в цитозоле, которые участвуют в сигнальных каскадах. Например, рецепторные тирозинкиназы (RTK) фосфорилируют определенные остатки тирозина в цитозольных доменах трансмембранных белков при связывании лиганда с внеклеточными доменами.Фосфорилированные тирозины привлекают белки, обладающие доменами Sh3 (src гомология) или PTB (связывание фосфотирозина), которые составляют сигнальный комплекс.
Кривизна мембран также может обогащать белки определенных допустимых размеров и механических свойств. Например, трансмембранные белки конической формы, такие как никотиновый ацетилхолиновый рецептор, предпочитают изогнутые области в мембране, поскольку это ослабляет натяжение и форму мембраны. Сортировка мембранных компонентов, которые предпочитают кривизну, наблюдалась в краях цистерн Гольджи, таким образом снижая механическое напряжение в более плоских цистернальных областях [6] [7].Белки, содержащие домен BAR (Bin / Amphiphysin / Rvs), могут обнаруживать и вызывать искривления мембран, а также помогать сортировать белки по разным участкам мембраны на основе кривизны. Белки домена BAR особенно обогащены в областях мембраны с высокой эндоцитарной активностью [8] [9].
Белки домена BAR особенно обогащены в областях мембраны с высокой эндоцитарной активностью [8] [9].
Направленная доставка компонентов
Локализация белка может быть результатом распознавания пассивно диффундирующих растворимых белков или белковых комплексов; однако это не может гарантировать достаточную концентрацию компонентов для поддержания данного процесса.Это может препятствовать его завершению, особенно при проведении в областях с ограниченным объемом цитоплазмы, таких как верхушка филоподий, или когда компоненты быстро переворачиваются.
Более эффективным способом поддержания концентрации белковых компонентов является их направленная доставка через цитоскелетную сеть.
Цитоскелет, состоящий из актиновых нитей и микротрубочек, охватывает всю клетку и соединяет плазматическую мембрану с ядром и другими органеллами.Эти нити выполняют множество функций, от обеспечения структурной поддержки клетки до создания сил, необходимых для транслокации клеток. Они также могут служить «дорожками», по которым моторные белки могут перемещаться при переносе груза из одного места в другое; аналогично грузовому поезду, перевозящему грузы по сети железнодорожных путей.
Доставка компонентов в первую очередь обеспечивается молекулярными моторами, управляемыми АТФ / ГТФ, такими как миозин V или миозин X, кинезин или динеин. Эти белки или их гомологи наблюдались во множестве типов клеток, включая дрожжевые, растительные и животные клетки.Молекулярные моторы динеин и кинезин проходят по микротрубочкам, а миозин — по актиновым филаментам. Ожидается, что эти двигатели движутся в одном направлении, хотя и не обязательно в одном направлении друг с другом.
Транспорт на основе микротрубочек в первую очередь изучался в нейрональных клетках. Аксоны могут иметь длину несколько микрон (иногда даже метр), поэтому существует необходимость в транспортировке белков, липидов, синаптических пузырьков, митохондрий и других компонентов по аксону. Все микротрубочки в аксонах однонаправлены, причем «минус» концы указывают на тело клетки, а «положительные» концы указывают на синапс.Двигатели кинезина движутся по этим дорожкам, чтобы переправлять груз от тела клетки к аксону. Нарушение опосредованного кинезином транспорта груза коррелирует с несколькими нервно-мышечными заболеваниями, такими как атрофия спинных мышц, спинальная и бульбарная мышечная атрофия [10] [11]. Динеин, с другой стороны, играет важную роль в транспортировке грузов в дендритах [12].
Все микротрубочки в аксонах однонаправлены, причем «минус» концы указывают на тело клетки, а «положительные» концы указывают на синапс.Двигатели кинезина движутся по этим дорожкам, чтобы переправлять груз от тела клетки к аксону. Нарушение опосредованного кинезином транспорта груза коррелирует с несколькими нервно-мышечными заболеваниями, такими как атрофия спинных мышц, спинальная и бульбарная мышечная атрофия [10] [11]. Динеин, с другой стороны, играет важную роль в транспортировке грузов в дендритах [12].
Большая часть нашего понимания доставки на основе миозина происходит из исследований на дрожжах, хотя механизмы, по-видимому, сохраняются до человека.В дрожжевых клетках двигатели миозина V используются для доставки пузырьков к участкам почкования [13]. Актомиозиновый комплекс также участвует в доставке секреторных пузырьков к участкам роста, экзоцитозу и сегрегации органелл во время деления клеток [14] [15] [16]. Другие миозины, которые участвуют в транспортировке грузов, включают миозин VI, который важен для генерации, сортировки и доставки эндоцитарных пузырьков [17], и миозин X, который переносит различные белки к концам филоподий через их домен FERM.Одним из примеров белка, переносимого миозином X, является β-интегрин.
Хотя функционально сходны, существуют важные различия между механизмами транспорта на основе микротрубочек и актина. В то время как транспорт на основе микротрубочек происходит на большие расстояния, доставка на основе актина происходит на гораздо более короткие расстояния 1-5 мкм [18], обзор в [19]. Более того, микротрубочки играют важную роль в доставке груза из ER в Golgi и на клеточную мембрану [20] [21]. С другой стороны, транспорт на основе актина связан с доставкой груза и пузырьков к плазматической мембране с целью инициирования быстро растущих и оттягивающихся выступов.Эти выступы определяют и измеряют механические свойства микросреды, облегчая миграцию клеток.
Пути связи
Поскольку различные процессы выполняются в отдельных субклеточных компартментах, организованных в разных областях клетки, внутриклеточная коммуникация имеет первостепенное значение. Такая коммуникация, которая более подробно описана в разделе «передача сигналов клетки», позволяет клеткам поддерживать концентрацию определенных белков в правильных областях, в зависимости от требований данного процесса или состояния клетки.Это в конечном итоге обеспечивает эффективное функционирование отдельных компартментов и позволяет одному субклеточному процессу управлять другим. В конечном итоге это позволяет клетке эффективно и согласованно выполнять свои основные функции.
Такая коммуникация, которая более подробно описана в разделе «передача сигналов клетки», позволяет клеткам поддерживать концентрацию определенных белков в правильных областях, в зависимости от требований данного процесса или состояния клетки.Это в конечном итоге обеспечивает эффективное функционирование отдельных компартментов и позволяет одному субклеточному процессу управлять другим. В конечном итоге это позволяет клетке эффективно и согласованно выполнять свои основные функции.
Сигнальные пути могут нести сигнал, исходящий извне клетки или из различных компартментов и обычно включающий перемещение ионов, растворенных веществ, белков и вторичных мессенджеров.
Все клетки имеют поверхностные рецепторы и другие белки для облегчения восприятия сигналов из внеклеточной среды.Эти сигналы могут быть в форме ионов, небольших молекул, пептидов, напряжения сдвига, механических сил, тепла и т. Д. Как только сигнал воспринимается поверхностным рецептором, он передается в цитоплазму обычно посредством конформационных изменений в рецепторе. или изменение его статуса фосфорилирования на цитозольной стороне. Это, в свою очередь, запускает нижестоящий сигнальный каскад, который очень часто достигает высшей точки в ядре. Сигнал обычно приводит к изменению профиля экспрессии генов клеток, помогая им реагировать на стимул.
Субклеточные компартменты также могут обладать механизмами, которые позволяют им регулировать функции друг друга. Например, синтез белка и секреторная активность ER и Гольджи модулируется фосфорилированием белков или липидов на их мембранах цитозольными ферментами, такими как семейство белков A и протеинкиназа D. Ионы кальция (Ca2 +) являются обычным средством передачи таких сигналов. трансдукция. Обычно концентрация этих ионов в цитозоле довольно низкая (~ 0,1 мкМ), но может увеличиваться до 1 мкМ при индукции сигналом.ER является хранилищем ионов Ca2 +, и, когда они высвобождаются в цитозоле, они связываются с несколькими белками, модулируя их активность. Например, одной мишенью для Ca2 + является киназа CaM, которая напрямую влияет на подвижность и миграцию клеток, контролируя активность киназы легкой цепи миозина.
Например, одной мишенью для Ca2 + является киназа CaM, которая напрямую влияет на подвижность и миграцию клеток, контролируя активность киназы легкой цепи миозина.
белков — что это такое и как они производятся — Science Learning Hub
Белки являются ключевыми рабочими молекулами и строительными блоками во всех клетках. Они производятся во всех организмах с помощью аналогичного двухэтапного процесса: сначала ДНК транскрибируется в РНК, а затем РНК транслируется в белок.
Перед отдельными генами последовательности ДНК, называемые промоторами, определяют, когда и в каком количестве продуцируются белки.
Что такое белок?
Белки — это основные «рабочие молекулы» в каждом организме. Помимо прочего, белки катализируют реакции, переносят кислород и защищают организмы от инфекций. Они также являются важными строительными блоками организмов. Они являются основными компонентами шерсти, хрящей и молока, они упаковывают ДНК в хромосомы и изолируют клетки нервной системы.Короче говоря, белки очень важны!
Белки состоят из большого количества аминокислот, соединенных встык. Цепочки складываются, образуя трехмерные молекулы сложной формы — это можно представить как оригами с очень длинным и тонким листом бумаги. Точная форма каждого белка вместе с содержащимися в нем аминокислотами определяет, что он делает.
Белки: ключевые примеры в Hub
Ферменты — это белки. Многие ферменты находят полезное применение в медицинской или промышленной биотехнологии.Узнайте больше в видеоролике: Улучшение ферментов.
Инсулин — это белок, регулирующий уровень глюкозы в крови. У диабетиков 1 типа инсулин не вырабатывается. Узнайте больше в видеоклипе: Сахарный диабет 1 типа.
Мидии крепко держатся за камни и груды с помощью своих прочных нитей, сделанных из протеина. Узнайте больше в интерактиве: Как выращивают мидии в Новой Зеландии.
Антитела — это белки, подробнее читайте в статье: Иммунная система.
Казеин — это белок молока, из которого делают сыр.Узнайте больше в анимационном видео: Сыр: молекулярный взгляд.
Факторы транскрипции — это специализированные белки, которые контролируют производство других белков. Узнайте больше в видеоклипе: Что влияет на телесный цвет яблока ?.
Макрофибриллы в шерсти состоят из белка. Узнайте больше в интерактивном материале: Структура и свойства шерстяных волокон.
Белки экспрессируются генами
Все организмы вырабатывают белки по существу одинаковым образом. Процесс начинается с гена — «инструкции» по созданию белка.По этой причине процесс создания белка также называется экспрессией генов.
Экспрессия гена состоит из двух основных стадий: транскрипции и трансляции.
Транскрипция
Структуры в клетке идентифицируют начало и конец гена и считывают последовательность ДНК между ними (порядок оснований A, C, G и T в гене). Создается молекулярное сообщение (молекула мРНК), которое повторяет последовательность самого гена. Во многих отношениях мРНК похожа на одноцепочечный фрагмент ДНК.
Трансляция
Рибосома получает молекулу мРНК и начинает выстраивать цепочку аминокислот (белок), которая точно соответствует инструкциям внутри мРНК. Рибосома «считывает» последовательность мРНК как серию трехосновных блоков или кодонов. Каждый кодон сообщает аппарату по производству белка, какую аминокислоту добавить следующей.
Генетический код по существу одинаков во всей природе.
Примечательно, что во всей жизни каждый кодон имеет одно и то же «значение» в любой данной клетке (за некоторыми незначительными исключениями).Например, кодон AGA — это инструкция по добавлению аминокислоты аргинина к растущему белку — независимо от того, растет ли этот белок в бактериальных клетках или клетках человека. Другими словами, каждая клетка следует одним и тем же правилам при производстве нового белка.
См. Статью Как добавить чужеродную ДНК к бактериям для получения дополнительной информации.
Какие белки производятся, когда — сила промотора
В любой клетке одновременно производится только часть белков. Белки, которые выполняют важные функции, производятся постоянно, в то время как другие экспрессируются только тогда, когда они необходимы.Клеткам также необходимы большие количества одних белков (таких как ферменты, участвующие в непрерывных процессах, таких как транскрипция и трансляция), и меньшие количества других (например, гормонов). Но как клетка решает, какие гены экспрессировать и сколько вырабатывать?
Промоторы — это последовательности ДНК, которые определяют, когда экспрессируется ген. Эти участки ДНК располагаются перед генами и обеспечивают «место посадки» для факторов транскрипции (белков, которые включают и выключают экспрессию генов) и РНК-полимеразы (белка, который считывает ДНК и создает копию мРНК).Различные промоторные последовательности имеют разную силу, и гены с «сильными» промоторами экспрессируются на более высоком уровне, чем гены со «слабыми» промоторами.
Промоторы и цвет мякоти яблока
В компании Plant & Food Research Ричард Эспли и его коллеги изучают роль промоторов в определении того, имеют ли яблоки мякоть белого или красного цвета. Группа обнаружила фактор транскрипции (MYB10), который связывается с промотором нескольких генов, которые продуцируют красный пигмент в яблоках, вызывая их экспрессию.В яблоках с красной мякотью намного больше MYB10, чем в яблоках с белой мякотью, поэтому эти гены пигмента экспрессируются на более высоком уровне и производят больше красного пигмента.
Подробнее читайте в статье: «Узнайте, что контролирует цвет мякоти яблока».
Белки и экспрессия генов
В этих статьях содержится дополнительная информация об экспрессии генов и белках.
Полезная ссылка
В этом интерактивном режиме из Учебного центра генетических наук Университета Юты исследуйте процесс экспрессии генов, беря фрагмент ДНК через процессы транскрипции и трансляции.
Британское общество клеточной биологии
Щелкните, чтобы просмотреть изображение микроскопа исследовательского уровня, интерпретированное с использованием технологии CIMR GridPoint
Быстрый просмотр:
Рибосома функционирует как микромашина для производства белков. Рибосомы состоят из особых белков и нуклеиновых кислот. ПЕРЕВОД информации и связывание аминокислот лежат в основе процесса производства белка. Рибосома, образованная из двух сцепляющихся вместе субъединиц, выполняет следующие функции: (1) переводит закодированную информацию из ядра клетки, обеспечиваемую матричной рибонуклеиновой кислотой (мРНК), (2) связывает вместе аминокислоты, выбранные и собранные из цитоплазмы путем переноса. рибонуклеиновая кислота (тРНК).(Порядок, в котором аминокислоты связаны друг с другом, определяется мРНК) и (3) Экспорт полученного полипептида в цитоплазму, где он сформирует функциональный белок.
Рибосомы обнаруживаются «свободными» в цитоплазме или связаны с эндоплазматическим ретикулумом (ER) с образованием грубого ER. В клетке млекопитающего может быть до 10 миллионов рибосом. К одной и той же цепи мРНК могут быть присоединены несколько рибосом, такая структура называется полисомой. Рибосомы существуют только временно.Когда они синтезируют полипептид, две субъединицы разделяются и либо повторно используются, либо разбиваются.
Рибосомы могут соединять аминокислоты со скоростью 200 в минуту. Таким образом, небольшие белки могут быть произведены довольно быстро, но для более крупных белков, таких как массивный мышечный белок титин, состоящий из 30 000 аминокислот, требуется два-три часа.
Рибосомы прокариот используют несколько иной процесс производства белков, чем рибосомы эукариот.К счастью, это различие представляет собой окно молекулярных возможностей для атаки антибиотиков, таких как стрептомицин. К сожалению, некоторые бактериальные токсины и вирус полиомиелита также используют его, чтобы атаковать механизм трансляции.
Чтобы просмотреть обзорную диаграмму производства белка, щелкните здесь.
(Диаграмма откроется в отдельном окне)
-
Это изображение, полученное с помощью электронного микроскопа, показывает часть шероховатой эндоплазматической сети в клетке корня растения кукурузы.Темные пятна — это рибосомы.
(любезно предоставлено Крисом Хоузом, Исследовательская школа биологии и молекулярных наук, Оксфордский университет Брукса, Оксфорд, Великобритания)
ПОСМОТРЕТЬ Рибосомы подольше:
Рибосомы — это макромолекулярные производственные единицы. Они состоят из рибосомных белков (рибопротеинов) и рибонуклеиновых кислот (рибонуклеопротеидов). Слово «рибосома» образовано из « рибо » из рибонуклеиновой кислоты и добавления его к « сома », латинскому слову «тело».Рибосомы могут быть связаны мембраной (мембранами), но они не являются мембранными.
Рибосома: микромашина для производства белков
Рибосома — это, по сути, очень сложная, но элегантная микромашина для производства белков. Каждая полная рибосома состоит из двух частей. Рибосома эукариот состоит из нуклеиновых кислот и около 80 белков и имеет молекулярную массу около 4200000 Да. Около двух третей этой массы состоит из рибосомальной РНК, а одна треть — из примерно 50+ различных рибосомных белков.
Рибосомы обнаружены в прокариотических и эукариотических клетках; в митохондриях, хлоропластах и бактериях. Те, что обнаруживаются у прокариот, обычно меньше, чем у эукариот. Рибосомы в митохондриях и хлоропластах по размеру сходны с таковыми у бактерий. В клетке млекопитающего около 10 миллиардов белковых молекул, большинство из которых вырабатывается рибосомами. Быстрорастущая клетка млекопитающего может содержать около 10 миллионов рибосом. [Одна клетка E. Coli содержит около 20 000 рибосом, что составляет около 25% от общей массы клеток].
Белки и нуклеиновые кислоты, которые образуют субъединицы рибосомы, образуются в ядрышке и экспортируются через ядерные поры в цитоплазму. Два субблока не равны по размеру и существуют в этом состоянии до тех пор, пока не потребуются для использования. Более крупная подгруппа примерно в два раза больше, чем меньшая.
Два субблока не равны по размеру и существуют в этом состоянии до тех пор, пока не потребуются для использования. Более крупная подгруппа примерно в два раза больше, чем меньшая.
Более крупный блок выполняет в основном каталитическую функцию; меньший подблок в основном декодирующий. В большой субъединице рибосомная РНК выполняет функцию фермента и называется рибозимом.Меньшая единица связывается с мРНК, а затем фиксируется на более крупной субъединице. Однажды сформированные рибосомы не являются статическими единицами. Когда производство определенного белка завершается, две субъединицы разделяются и затем обычно разбиваются. Рибосомы существуют только временно.
Иногда субъединицы рибосомы допускают мРНК, как только мРНК выходит из ядра. Когда это происходит с множеством рибосом, структура называется полисомой. Рибосомы могут функционировать в «свободном» состоянии в цитоплазме, но они также могут «оседать» на эндоплазматическом ретикулуме, образуя «грубый эндоплазматический ретикулум».Там, где имеется грубый эндоплазматический ретикулум, ассоциация между рибосомой и эндоплазматическим ретикулумом (ER) облегчает дальнейшую обработку и проверку вновь образованных белков с помощью ER.
Белковая фабрика: сайт и услуги.
Все предприятия нуждаются в таких услугах, как газ, вода, канализация и связь. Для того, чтобы они были предоставлены, должно быть место или участок.
Производство протеина также требует сервисных требований. Сайт, требующий предоставления услуг, образуется в небольшой субъединице рибосомы, когда цепь мРНК входит через одну селективную щель, а цепь инициаторной тРНК — через другую.Это действие заставляет маленькую субъединицу прикрепляться к большой субъединице рибосомы, чтобы сформировать полную и активную рибосому. Теперь можно начинать удивительный процесс производства белка.
Для трансляции и синтеза белка задействованы многие химические вещества-инициаторы и высвобождающие вещества, а также происходит множество реакций с использованием ферментов. Однако существуют общие требования, и они должны быть выполнены. В приведенном ниже списке показаны основные требования и порядок их выполнения:
Однако существуют общие требования, и они должны быть выполнены. В приведенном ниже списке показаны основные требования и порядок их выполнения:
- Требование: Безопасное (без загрязнения) и подходящее оборудование для процесса производства белка.
- Предоставление: это средство обеспечивается двумя субединицами рибосом. Когда две субъединицы соединяются вместе, образуя полную рибосому, входящие и выходящие молекулы могут делать это только через селективные щели или туннели в молекулярной структуре.
- Требование: Предоставление информации в форме, которую рибосома может переводить с высокой степенью точности. Перевод должен быть точным, чтобы производились правильные белки.
- Предоставление: Информация предоставляется ядром и доставляется на рибосому в виде цепи мРНК.Когда мРНК образуется в ядре, интроны (некодирующие участки) вырезаются, а экзоны (кодирующие участки) соединяются вместе посредством процесса, называемого сплайсингом.
- Требование: Запас аминокислот, из которых рибосомный механизм может получить определенные необходимые аминокислоты.
- Обеспечение: Аминокислоты, поступающие в основном с пищей, обычно свободно доступны в цитоплазме.
- Требование: Система, которая может выбирать и фиксировать аминокислоту в цитоплазме и доставлять ее к сайту трансляции и синтеза в рибосоме.
- Предоставление: Короткие цепи переносящей рибонуклеиновой кислоты (тРНК), образующиеся в ядре и доступные в цитоплазме, действуют как «адаптерные инструменты». Когда цепь тРНК зафиксирована на аминокислоте, тРНК называется «заряженной». тРНК диффундирует в меньшую субъединицу рибосомы, и каждая короткая цепь тРНК будет доставлять ОДИН аминокислоты.
- Требование: Средство высвобождения в цитоплазму: (a) вновь образованный полипептид, (b) мРНК, которая использовалась в процессе трансляции, и (c) тРНК, которая доставила аминокислота, которую он нес, и теперь «незаряженная».

- Предоставление: (a) , когда вновь образованная пептидная цепь продуцируется глубоко внутри большой субъединицы рибосомы, она направляется в цитоплазму по туннелю или щели. (b) «Использованная» мРНК покидает меньшую субъединицу рибосомы через туннель на стороне, противоположной точке входа. Движение через рибосому вызывается только односторонним, прерывистым движением рибосомы вдоль и в направлении входящей цепи мРНК. (c ) тРНК в «незаряженном» состоянии выходит через туннель в молекулярной архитектуре большой субъединицы рибосомы.
Белковая фабрика: что происходит внутри?
— Посмотрите на линию по производству белка, которая может соединять аминокислоты со скоростью 200 в минуту!
Теперь, когда мы рассмотрели требования и условия, необходимые для работы машины для производства белка, мы можем взглянуть на внутреннюю работу.
Как упоминалось ранее, в рибосоме протекают многие детальные биохимические реакции, и здесь дается только краткое описание, чтобы проиллюстрировать концепцию.
( См. Также «Схема рибосомы» в конце раздела)
В рибосоме есть ТРИ ЭТАПА и ТРИ операционных САЙТА, задействованных в производственной линии белка.
Три ЭТАПА — это (1) начало, (2) удлинение и (3) завершение.
Три рабочих или связывающих САЙТА — это A, P и E , считываемые с сайта входа мРНК (обычно с правой стороны).
Сайты A и P охватывают как субъединицы рибосомы, большая часть которых находится в большой субъединице рибосомы, так и меньшая часть — в меньшей субъединице. Сайт E , сайт выхода, находится в большой субъединице рибосомы.
Таблица сайтов связывания, положений и функций в рибосоме
(см. Также схему рибосомы в конце раздела)
Также схему рибосомы в конце раздела)
|
Место привязки |
Сайт входа цепи мРНК |
Биологический термин |
Основные процессы |
|
Участок А |
1-й |
A миноацил |
Допуск кодона мРНК «заряженной» цепи тРНК.Проверка и расшифровка и начало «передачи» одной молекулы аминокислоты |
|
Участок П |
2-я |
P эптидил |
Синтез пептидов, консолидация, удлинение и перенос пептидной цепи в сайт A |
|
Si t e E |
3-й |
Выход в цитоплазму |
Подготовка «незаряженной» тРНК для выхода |
Три этапа:
- Инициирование. На этой стадии небольшая субъединица рибосомы связывается с «начальным концом» цепи мРНК. «Инициатор тРНК» также входит в небольшую субъединицу. Затем этот комплекс присоединяется к большой субъединице рибосомы. В начале цепи мРНК есть сообщение «начало трансляции», и цепь тРНК, «заряженная» одной конкретной аминокислотой, входит в сайт A рибосомы.
 Производство полипептида уже начато. Чтобы тРНК не отвергалась, трехбуквенная кодовая группа, которую она несет (называемая антикодоном), должна совпадать с трехбуквенной кодовой группой (называемой кодоном) на цепи мРНК. в рибосоме.Это очень важная часть процесса перевода , и удивительно, как мало возникает «ошибок перевода». [В общем, конкретная аминокислота, которую он несет, определяется трехбуквенным антикодоном, который он несет, например если трехбуквенный код — CAG ( C иттозин, A денин, G уанин), тогда он будет выбирать и транспортировать аминокислоту глутамин (Gln)].
Производство полипептида уже начато. Чтобы тРНК не отвергалась, трехбуквенная кодовая группа, которую она несет (называемая антикодоном), должна совпадать с трехбуквенной кодовой группой (называемой кодоном) на цепи мРНК. в рибосоме.Это очень важная часть процесса перевода , и удивительно, как мало возникает «ошибок перевода». [В общем, конкретная аминокислота, которую он несет, определяется трехбуквенным антикодоном, который он несет, например если трехбуквенный код — CAG ( C иттозин, A денин, G уанин), тогда он будет выбирать и транспортировать аминокислоту глутамин (Gln)].
- Удлинение. Этот термин охватывает период между инициированием и завершением, и именно в это время вырабатывается основная часть обозначенного белка.Процесс состоит из серии циклов, общее количество которых определяется мРНК. Одним из основных событий при элонгации является транслокация . Это происходит, когда рибосома перемещается вдоль мРНК на одну кодонную выемку, и начинается новый цикл. Во время процесса «запуска» «инициирующая тРНК» переместится в сайт P (см. Схему рибосомы в конце раздела). ) и рибосома допустит в сайт A, новую тРНК, «заряженную» одной аминокислотой.«Заряженная» тРНК находится в сайте A до тех пор, пока она не будет проверена и принята (или отклонена), и пока растущая пептидная цепь, прикрепленная к тРНК в сайте P, не будет перенесена ферментами в «заряженную» тРНК в сайте A. Здесь одна новая аминокислота передается тРНК и добавляется к пептидной цепи. Благодаря этому процессу длина пептидной цепи увеличивается на одну аминокислоту. [Образованию пептидной связи между растущей пептидной цепью и вновь принятой аминокислотой способствует пептидилтрансфераза и происходит в большой субъединице рибосомы.Реакция происходит между тРНК, которая несет зарождающуюся пептидную цепь, пептидил-тРНК, и тРНК, которая несет входящую аминокислоту, аминоацил-тРНК].
 Когда это произошло, тРНК в сайте P, перенесла свою пептидную цепь и теперь без каких-либо прикреплений, перемещается в сайт E , сайт выхода. Затем тРНК в сайте A, в комплекте с пептидом. Цепь, увеличенная в длину на одну аминокислоту, переходит на сайт P . В сайте P рибопротеинов укрепляют связь пептидной цепи с вновь добавленной аминокислотой.Если пептидная цепь длинная, самая старая часть будет перемещена в цитоплазму, и за ней последует остальная часть цепи по мере ее образования. Следующий цикл
Когда это произошло, тРНК в сайте P, перенесла свою пептидную цепь и теперь без каких-либо прикреплений, перемещается в сайт E , сайт выхода. Затем тРНК в сайте A, в комплекте с пептидом. Цепь, увеличенная в длину на одну аминокислоту, переходит на сайт P . В сайте P рибопротеинов укрепляют связь пептидной цепи с вновь добавленной аминокислотой.Если пептидная цепь длинная, самая старая часть будет перемещена в цитоплазму, и за ней последует остальная часть цепи по мере ее образования. Следующий цикл
С сайтом A теперь пустым имеет место транслокация . Рибосома перемещается на расстояние в одну (трехбуквенную) кодонную выемку вдоль мРНК, чтобы ввести новый кодон в зону обработки. тРНК, «заряженная» присоединенной аминокислотой, теперь входит в сайт A, и при условии удовлетворительного совпадения кодона мРНК и антикодона тРНК цикл начинается снова.Этот процесс продолжается до тех пор, пока не будет достигнута стадия завершения. - Прекращение действия. Когда рибосома достигает конца цепи мРНК, появляется сообщение о конце или «конце белкового кода». Это регистрирует конец продукции конкретного белка, кодируемого этой цепью мРНК. Химические вещества «фактора высвобождения» предотвращают дальнейшее добавление аминокислот, и новый белок (полипептид) полностью перемещается в цитоплазму через щель в большой субъединице. Две субъединицы рибосомы отделяются, разделяются и используются повторно или разрушаются.
Резюме:
- Почти все белки, необходимые клеткам, синтезируются рибосомами. Рибосомы находятся «свободными» в цитоплазме клетки, а также прикреплены к грубому эндоплазматическому ретикулуму.
- Рибосомы получают информацию от ядра клетки и строительных материалов из цитоплазмы.
- Рибосомы транслируют информации, закодированной в матричной рибонуклеиновой кислоте (мРНК).



