РАЗНИЦА МЕЖДУ KJ И KCAL | СРАВНИТЕ РАЗНИЦУ МЕЖДУ ПОХОЖИМИ ТЕРМИНАМИ — НАУКА
В ключевое отличие между KJ и KCal заключается в том, что КДж — это единица измерения содержания энергии в веществе или химической реакции с использованием джоулей, тогда как Ккал — это единица измере
В ключевое отличие между KJ и KCal заключается в том, что КДж — это единица измерения содержания энергии в веществе или химической реакции с использованием джоулей, тогда как Ккал — это единица измерения содержания энергии в веществе с учетом калорий.
И кДж, и ккал — это единицы, которые используются для выражения содержания энергии в веществе или химической реакции. Приставка «K» в обоих этих терминах означает «килограмм», что означает, что эти термины дают содержание энергии в 103 порции.
1. Обзор и основные отличия
2. Что такое кДж
3. Что такое KCal
4. Отношения между KJ и KCal
5. Сравнение бок о бок — KJ и KCal в табличной форме
6. Резюме
Резюме
Что такое КДж?
Термин кДж означает «килоджоули». Один килоджоуль равен 1000 джоулей (103 джоулей). Когда дело доходит до здоровья, кДж представляет собой потребление энергии через еду и напитки. Когда дело доходит до химических реакций, кДж / моль или килоджоуль на моль — это единица, которая дает количество энергии, участвующей в химической реакции. Более того, с химической точки зрения джоуль равен кинетической энергии килограмма массы, движущейся со скоростью один метр в секунду. При рассмотрении энергетической ценности пищи жир и алкоголь имеют высокое содержание килоджоулей, а пищевые волокна имеют низкое содержание килоджоулей энергии, тогда как белки и углеводы имеют умеренное содержание энергии.
Что такое KCal?
Термин KCal относится к «килограммам калорий». Один килограмм калорий равен 1000 калорий (103 калорий).
Это единица измерения содержания энергии в еде или напитке. С химической точки зрения определение калорийности означает, что это энергия, необходимая для повышения температуры 1 килограмма воды на 1 ° C.
Какая связь между KJ и KCal?
- Между двумя терминами существует прямая связь: 1 ккал = 4,2 кДж.
В чем разница между KJ и KCal?
И кДж, и ккал являются единицами измерения содержания энергии в веществах. Термин кДж относится к килоджоулям, а ккал — к килограммам калорий. Между этими двумя терминами существует прямая связь; то есть 1 ккал равняется 4,18 кДж.
Резюме — KJ vs KCal
И кДж, и ккал являются единицами измерения содержания энергии в продуктах питания и напитках. Разница между кДж и ккал состоит в том, что кДж — это единица измерения содержания энергии в веществе или химической реакции с использованием джоулей, тогда как ккал — это единица измерения содержания энергии вещества в калориях.
|
Средняя пищевая ценность (30 гр)
|
Энергетической ценности пищевых — Справочник по медицине PRO7
Химический состав и энергетическая ценность пищевых продуктов.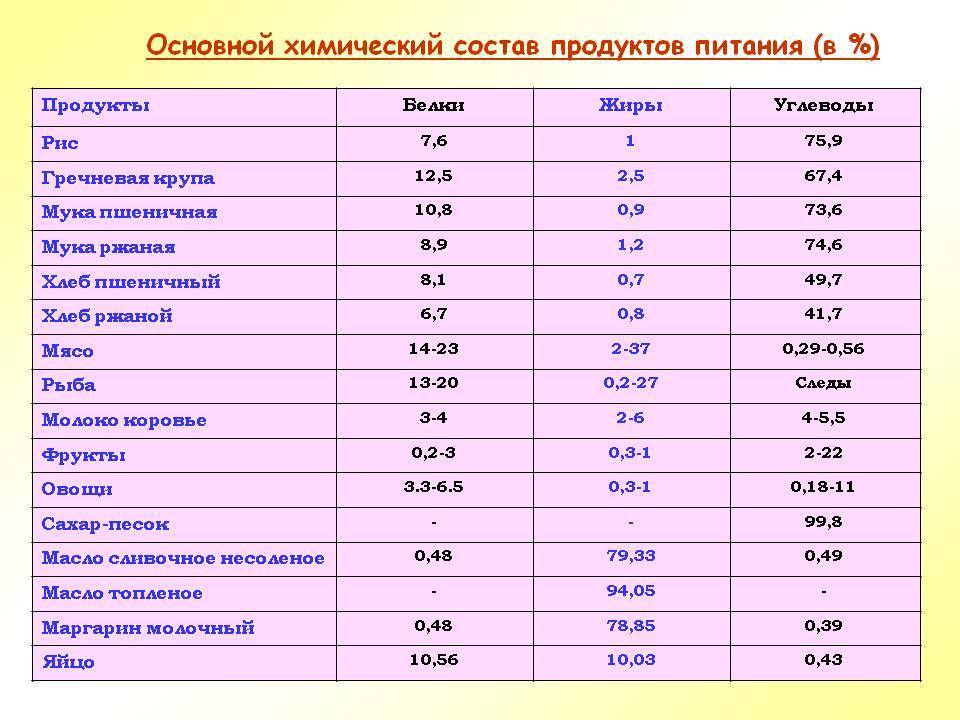 Справочник Макканса и Уиддоусона / Р. Маккане, Э. Уиддо-усон пер. с англ, под общ. ред. А. К. Батурина. — СПб. Профессия,… [Стр.102]
Справочник Макканса и Уиддоусона / Р. Маккане, Э. Уиддо-усон пер. с англ, под общ. ред. А. К. Батурина. — СПб. Профессия,… [Стр.102]
Таблица 6. Содержание основных веществ (в граммах на 100 г) продукта и энергетическая ценность пищевых продуктов… [Стр.172]
Рассчитывая энергетическую ценность пищевых продуктов, следует учитывать, что при окислении в организме 1 г белка образуется 4 ккал, 1 г жира — 9 ккал, 1 г усвояемых углеводов — 3,75 ккал. [Стр.35]
Примерная энергетическая ценность пищевых продуктов в расчете на 100 г. [Стр.79]
Химический состав пищевых продуктов. Справочные таблицы содержания основных пищевых веществ и энергетической ценности пищевых продуктов / под ред. А. А. Покровского. — М. Пищевая промышленность, 1976. — 268 с. [Стр.255]
Таблица 1. Изменение энергетической ценности пищевого рациона в расчете на душ населения в регионах и странах, находящихся на разном уровне экономического развития … [Стр.17]
Таблица 2. Энергетическая ценность пищевого рациона в расчете на душу населения в день в 20 наиболее густонаселенных странах Африки, расположенных к югу от Сахары, 1979-1981 гг.а… Энергетическая ценность пищевого рациона в расчете на душу населения в день в 20 наиболее густонаселенных странах Африки, расположенных к югу от Сахары, 1979-1981 гг.а… |
Для того чтобы снизить энергетическую ценность пищевого рациона, надо знать, сколько примерно килоджоулей (кДж) содержится в потребляемых вами продуктах. [Стр.60]
Таким образом, не сложно рассчитать энергетическую ценность пищевого рациона или составить его по заданной энергетической ценности с учетом физиологических потребностей организма. [Стр.64]
Энергетическая ценность пищевого рациона спортсмена в зависимости от его основной профессии и характера спортивной деятельности может быть выражена в следующих величинах (табл. 78). [Стр.285]
I. Энергетическая ценность пищевого рациона должна соответствовать 2000—2450 ккал, за счет белков должно обеспечиваться… [Стр.300]
За счёт растительных продуктов создаётся не менее 50% суточной энергетической ценности пищевых рационов.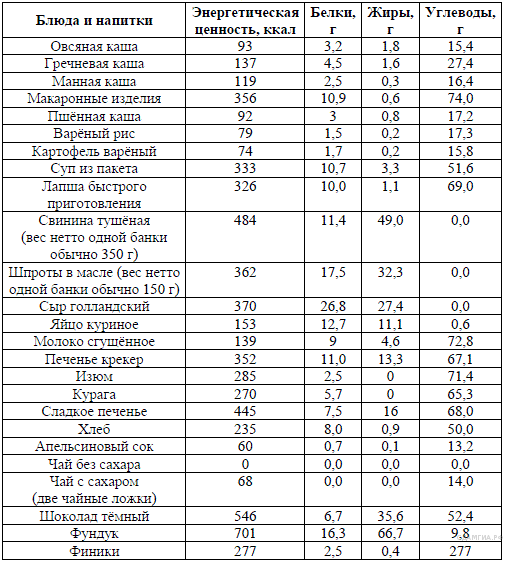 . [Стр.200]
. [Стр.200]
Избавиться от повышенной массы тела вы сможете только при повышенной двигательной активности и снижении энергетической ценности пищевого рациона. Это не такой быстрый путь, как скажем, строгие диеты или голодание. [Стр.60]
Энергетическая функция липидов весьма эффективна. Самыми высококалорийными веществами являются триглицериды (ТГ). При их полном окислении выход энергии составляет 9,5 ккал/л, тогда как для углеводов и белков эта величина составляет соответственно 4,2 и 4,3 ккал/л. Не надо путать эти величины с показателями энергетической ценности пищевых… [Стр.746]
Смотреть другие источники с термином Энергетической ценности пищевых:
[Стр.291]
[Стр.73]
[Стр.77]
[Стр.15]
[Стр.29]
[Стр.55]
[Стр.195]
[Стр.418]
[Стр.716]
[Стр.26]
[Стр. 23]
23]
[Стр.107]
[Стр.285]
[Стр.113]
[Стр.297]
[Стр.2]
[Стр.12]
[Стр.62]
[Стр.63]
[Стр.302]
[Стр.418]
[Стр.713]
[Стр.471]
[Стр.137]
[Стр.140]
[Стр.149]
[Стр.168]
[Стр.230]
[Стр.123]
[Стр.129]
[Стр.45]
[Стр.139]
[Стр.105]
[Стр.18]
|
| {{/ iff}}
{{#iff cardtype ‘eq’ ‘errormsg’}}
{{#iff code ‘eq’ ‘MISSING_PARAMETER’}}
При добавлении этого товара в корзину возникла проблема. Пожалуйста, попробуйте еще раз.
{{/ iff}}
{{#iff code ‘eq’ ‘BAD_REQUEST’}}
При добавлении этого товара в корзину возникла проблема. Пожалуйста, попробуйте еще раз.
Пожалуйста, попробуйте еще раз.
{{/ iff}}
{{#iff source.parameter ‘eq’ ‘quantity’}}
При удалении этого товара из вашей корзины возникла проблема.Пожалуйста, попробуйте еще раз.
{{/ iff}}
{{еще}}
{{#iff status ‘eq’ 412 ‘}}
{{#iff code ‘eq’ ‘STOCK_EXCEPTION’}}
Выбранный товар отсутствует в наличии, и его нельзя добавить в корзину.
{{/ iff}}
{{#iff code ‘eq’ ‘SUBSCRIPTION_BUNDLE_EXIST’}}
Сделайте отдельную покупку для дополнительных подписок
{{/ iff}}
{{else}}
При добавлении этого товара в корзину возникла проблема.Пожалуйста, попробуйте еще раз.
{{/ iff}}
{{/ iff}}
{{/ iff}}
Дата публикации статьи:
Получите именно ту поддержку, которая вам нужна
Ищете конкретные решения для вашего продукта?
Отслеживайте действие гарантии на продукт
Право на возврат денег, подарки и специальные предложения
Получите легкий доступ к поддержке продукта
Оплата
Мы принимаем следующие способы оплаты:
-
Добавить продукт
-
Добавить продукт
-
Добавить продукт
Нажав на ссылку, вы покинете официальный веб-сайт Royal Philips Healthcare («Philips»). Любые ссылки на сторонние веб-сайты, которые могут появляться на этом сайте, предоставляются только для вашего удобства и никоим образом не представляют собой какую-либо аффилированность или поддержку информации, представленной на этих связанных веб-сайтах. Philips не делает никаких заявлений и не дает никаких гарантий в отношении сторонних веб-сайтов или содержащейся на них информации.
Любые ссылки на сторонние веб-сайты, которые могут появляться на этом сайте, предоставляются только для вашего удобства и никоим образом не представляют собой какую-либо аффилированность или поддержку информации, представленной на этих связанных веб-сайтах. Philips не делает никаких заявлений и не дает никаких гарантий в отношении сторонних веб-сайтов или содержащейся на них информации.
Я понимаю
Наш сайт лучше всего просматривать с помощью последней версии Microsoft Edge, Google Chrome или Firefox.
15.2: Энергетические и химические реакции
Энергия связи
Атомы соединяются вместе, образуя соединения, потому что при этом они достигают более низких энергий, чем они обладают как отдельные атомы. Количество энергии, равное разнице между энергиями связанных атомов и энергиями отделенных атомов, обычно выделяется в виде тепла. То есть связанные атомы имеют более низкую энергию, чем отдельные атомы. Когда атомы объединяются в соединение, всегда выделяется энергия, и соединение имеет более низкую общую энергию.
Когда происходит химическая реакция, молекулярные связи разрываются и образуются другие связи, в результате чего образуются другие молекулы. Например, связи двух молекул воды разрываются с образованием водорода и кислорода.
\ [2H_2O \ стрелка вправо 2H_2 + O_2 \]
Для разрыва связи всегда требуется энергия, известная как энергия связи. Хотя концепция может показаться простой, энергия связи служит очень важной цели при описании структуры и характеристик молекулы.
Для разрыва связи всегда требуется энергия. Энергия высвобождается, когда создается связь.
| Облигация | Энергия связи (кДж / моль) |
|---|---|
| C – H | 413 |
| C – O | 358 |
| C = O * | 745 |
| C – N | 305 |
| К – К | 347 |
| С = С | 614 |
| C≡C | 839 |
| N – H | 391 |
| O — H | 467 |
| H – H | 432 |
| H — Класс | 427 |
| H — I | 295 |
| * C = O (CO 2 ) = 799 |
Когда происходит химическая реакция, атомы в реагентах меняют свои химические связи, образуя продукты. Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Следовательно, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из Таблицы \ (\ PageIndex {1} \).
Новое расположение связей не имеет такой же полной энергии, как связи в реагентах. Следовательно, когда происходят химические реакции, всегда будет сопутствующее изменение энергии . Изменение энтальпии для данной реакции можно рассчитать, используя значения энергии связи из Таблицы \ (\ PageIndex {1} \).
В этом процессе добавляется энергия реакции разрыва связей и извлекается энергия для образующихся связей.
\ [\ text {изменение энтальпии} = \ sum (\ text {облигации разорваны}) — \ sum (\ text {облигации сформированы}) \]
Пример \ (\ PageIndex {3} \): образование йодида водорода
Каково изменение энтальпии этой реакции и является ли она эндотермической или экзотермической?
\ [H_2 (г) + I_2 (г) \ стрелка вправо 2HI (г) \]
Решение
Сначала посмотрите на уравнение и определите, какие связи существуют в реагентах.
- одна H-H связка и
- одна облигация I-I
Проделайте то же самое с продуктами
Затем определите энергии этих связей из таблицы выше:
- H-H-связи: 436 кДж / моль
- Связи I-I: 151 кДж / моль
Сумма энтальпий на стороне реакции:
436 кДж / моль + 151 кДж / моль = 587 кДж / моль.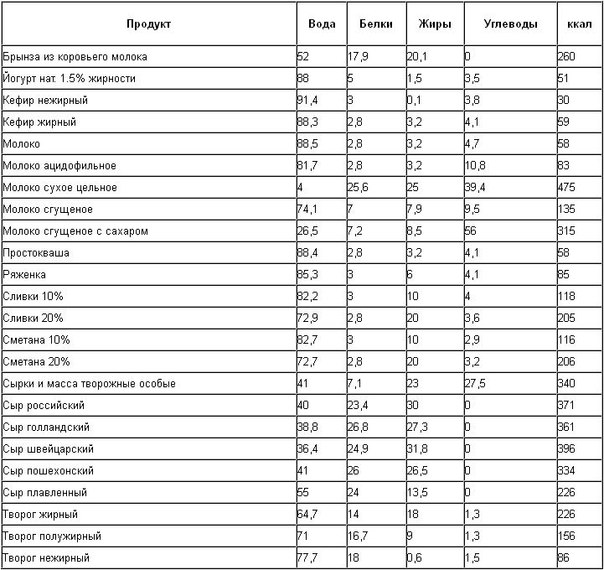
Это количество энергии, необходимое для разрыва связей на стороне реагента.Затем мы смотрим на образование облигаций на стороне продукта:
- 2 моль связи H-I: 297 кДж / моль
Сумма энтальпий на стороне продукта:
2 x 297 кДж / моль = 594 кДж / моль
Это количество энергии, высвобождаемой при образовании связей на стороне продукта. Таким образом, чистое изменение реакции составляет
.
587 кДж / моль -594 кДж / моль = -7 кДж / моль.
Поскольку это отрицательно, реакция экзотермическая .
Упражнение \ (\ PageIndex {3} \): разложение воды
Используя энергии связи, приведенные в таблице выше, найдите изменение энтальпии для термического разложения воды:
\ [2H_2O (г) \ стрелка вправо 2H_2 + O_2 (г) \]
Выше написана реакция экзотермическая или эндотермическая? Объяснять.
Решение
Изменение энтальпии касается разрыва двух моль связей O-H и образования 1 моля связей O-O и двух моль связей H-H (Таблица \ (\ PageIndex {1} \)).
- Сумма энергий, необходимых для разрыва связей на стороне реагентов, составляет 4 x 460 кДж / моль = 1840 кДж / моль.
- Сумма энергий, высвобождаемых для образования связей на стороне продуктов, равна
- 2 моля связей H-H = 2 x 436,4 кДж / моль = 872,8 кДж / моль
- 1 моль связи O = O = 1 x 498.7 кДж / мил = 498,7 кДж / моль
, что соответствует выходной (выделенной) энергии = 872,8 кДж / моль + 498,7 кДж / моль = 1371,5 кДж / моль.
Полная разница в энергии составляет 1840 кДж / моль — 1371,5 кДж / моль = 469 кДж / моль, что указывает на то, что реакция является эндотермической и что для ее проведения необходимо подвести 469 кДж тепла.
Эта реакция является эндотермической, поскольку для образования связей требуется энергия.
Энергия
Изменения, сопровождающие химические реакции
Все изменения, химические или физические, сопровождаются изменением
энергия.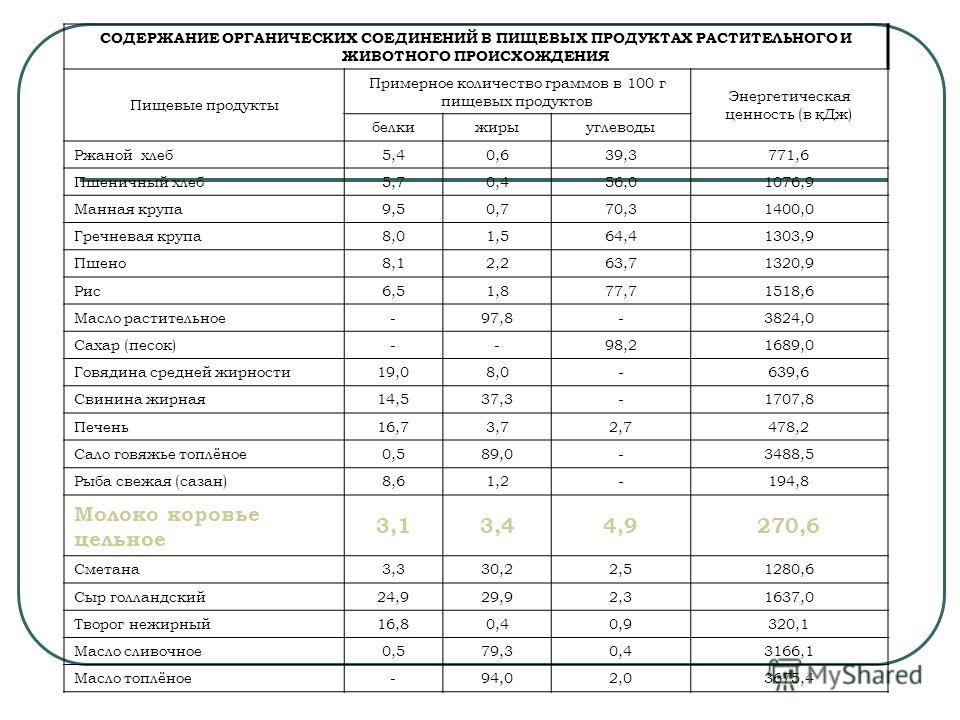 Каждая реагирующая молекула обладает определенным количеством энергии за счет
Каждая реагирующая молекула обладает определенным количеством энергии за счет
природа химических связей. Так делает каждая молекула продукта. Поскольку облигации
реагирующие молекулы разрываются и образуются новые связи продуктов, выделяется энергия
или абсорбируется, в зависимости от того, имеют ли реагенты более высокую или более низкую энергию
чем продукты.
Мы можем измерить изменение энергии несколькими способами. Два вида изменения энергии
Для нас наибольший интерес представляют: (1) изменение свободной энергии (
G), который представляет собой энергию, доступную для выполнения полезной работы (обсуждается в главе 13),
и (2) изменение энтальпии (
H), которая представляет собой тепловую энергию, поглощенную или выделенную в результате реакции и измеренную
при постоянном давлении.Большинство химических реакций протекает при постоянном
давление атмосферы. Энергия, выделяемая или поглощаемая такими реакциями.
изменение энтальпии,
H, который можно представить как
H реакция
= H продукты — H реагенты
В отчетных значениях
H верхний индекс используется для обозначения температуры, при которой проводились измерения.
сделал. Например, символ
H 0 ° C показывает, что изменение энтальпии было измерено при 0 ° C.Если нет температуры
Как показано, изменение энтальпии было измерено при 25 ° C. Все изменения измеряются
при давлении в одну атмосферу.
Значение H дано
с уравнением относится к этому конкретному уравнению. Когда энтальпия меняется
был измерен, физические состояния компонентов были такими, как указано в
уравнение. Если физические состояния разные, будет другая энтальпия.
изменение. Это различие иллюстрируется следующими двумя уравнениями для формации
воды.Они различаются изменением энтальпии. В первом образуется газообразная вода,
а во втором — образуется жидкая вода; разница между их энтальпиями
Изменения отражают разницу в содержании энергии между газом и жидкостью.
(См. Главу 9 для более подробного обсуждения
эта точка.)
Изменение энтальпии, указанное для реакции, также зависит от коэффициентов
используется в уравнении реакции. Таким образом, если уравнение образования
Таким образом, если уравнение образования
воды написано
изменение энтальпии вдвое больше, чем в предыдущем уравнении для
образование газообразной воды, когда коэффициент воды был 1. Эта последняя проблема
можно решить, выполнив те же действия, что и в нескольких уравнениях, в которых мы сообщаем энтальпию
изменение на моль одного компонента реакции, таким образом устраняя любую двусмысленность
в интерпретации.
A. Эндотермические и экзотермические реакции
Реакция с поглощением энергии — это эндотермическая реакция; изменение его энтальпии
(H) положительно. В
энтальпия продуктов реакции больше, чем у реагентов.
Энергия поглощается из окружающей среды. Следующие реакции являются эндотермическими.
- Образование иодистого водорода:
- Разложение воды:
Реакция с высвобождением энергии является экзотермической реакцией; его энтальпия
изменение отрицательное. Энтальпия продуктов меньше, чем у реагентов.
Энтальпия продуктов меньше, чем у реагентов.
Энергия передается в окружающую среду. Следующие реакции являются экзотермическими.
- Сжигание метана:
- Образование воды:
Обратите внимание, что разложение воды (уравнение b) является эндотермическим и требует
расход энергии 285,8 кДж на моль разложившейся воды. Обратная реакция,
образование одного моля воды из водорода и кислорода (уравнение d), является
экзотермический и высвобождает 285.Энергия 8 кДж. Количество энергии такое же, но
знак изменения энергии другой.
Другой пример — взаимосвязь между изменением энергии и направлением
одной из реакций является образование и разложение глюкозы. Глюкоза (C 6 H 12 O 6 )
образуется из углекислого газа и кислорода в клетках зеленых растений в
процесс называется фотосинтезом. Фотосинтез — это эндотермическая реакция. В
источником энергии для образования глюкозы является свет (лучистая энергия),
обычно от солнца.
Таким образом, зеленые растения обладают замечательной способностью улавливать энергию солнечного света.
и использовать эту энергию для производства глюкозы из углекислого газа и воды. Энергия
хранится в глюкозе. Клетки животных и растений обладают одинаково замечательными
способность метаболизировать глюкозу и использовать высвобождаемую энергию для поддержания температуры тела
или выполнять биологическую работу, например сокращать мышцы или думать.
|
Пример Решение а. Изменение энтальпии положительное; реакция эндотермическая. В б. с. Изменение энтальпии отрицательное; реакция экзотермическая. Обратное |
B. Стехиометрия изменений энергии
Изменение энергии, связанное с реакцией, является стехиометрической величиной и
можно рассматривать арифметически, как и изменения массы в разделе 8.4. Для многих
реакции, изменения энтальпии были определены и занесены в таблицу в химическом
литература. Изменения, перечисленные в таких источниках, относятся только к форме
уравнение, которое они сопровождают, как объяснялось ранее.
|
Пример Решение Уравнение Разыскиваются: Дано Коэффициенты пересчета Арифметическое уравнение |
|
Пример Решение Уравнение Требуется Дано Коэффициенты пересчета Глюкоза, масса в молях: 180 г глюкозы = 1 моль глюкозы Арифметическое уравнение Ответ Ответ |
Расчет изменений энергии — Высшая — Экзотермические и эндотермические реакции — AQA — GCSE Chemistry (Single Science) Revision — AQA
Использование энергий связи
Изменение энергии в реакции может быть рассчитано с использованием энергий связи.Энергия связи — это количество энергии, необходимое для разрыва одного моля конкретной ковалентной связи.
Различные связи имеют разную энергию связи. Они даются, когда они нужны для расчетов.
Чтобы рассчитать изменение энергии для реакции:
- сложите вместе энергии связей для всех связей в продуктах — это это «энергия на выходе»
- изменение энергии = энергия на входе — энергия на выходе
Пример
Водород и хлор реагируют с образованием газообразного хлористого водорода:
H − H + Cl − Cl → 2 × (H − Cl)
Используйте энергии связи в таблице, чтобы вычислить изменение энергии для этой реакции.
| Связь | Энергия связи | |
|---|---|---|
| H − H | 436 кДж моль -1 | |
| Cl − Cl | 243 кДж моль -1 | 432 кДж моль -1 |
Входная энергия = 436 + 243 = 679 кДж моль -1
Выходная энергия = (2 × 432) = 864 кДж моль -1
Энергия change = in — out
= 679-864
= -185 кДж моль -1
Изменение энергии отрицательное.Это показывает, что реакция экзотермическая.
Пример 2
Бромистый водород разлагается с образованием водорода и брома:
2 × (H-Br) → H-H + Br-Br
Используйте энергии связи в таблице, чтобы рассчитать изменение энергии для этой реакции.
| Связь | Энергия связи | |
|---|---|---|
| H − Br | 366 кДж моль -1 | |
| H − H | 436 кДж моль -1 | 193 кДж моль -1 |
Входная энергия = 2 × 366 = 732 кДж моль -1
Выходная энергия = 436 + 193 = 629 кДж моль -1
Изменение энергии = вход — выход
= 732 — 629
= +103 кДж моль -1
Изменение энергии положительное.Это показывает, что реакция эндотермическая.
- Вопрос
-
Водород реагирует с кислородом с образованием воды:
2 × (H − H) + O = O → 2 × (HOH)
Используйте энергии связи в таблице, чтобы рассчитать изменение энергии для этого реакция.
Связь Энергия связи H − H 436 кДж моль -1 O = O 498 кДж моль -1 906
464 кДж моль -1 - Показать ответ
-
Энергия на входе = (2 × 436) + 498
= 872 + 498
= 1370 кДж моль -1
Энергия на выходе = 2 × 2 × 464
= 1856 кДж моль -1 (в каждой молекуле воды есть две связи ОН)
Изменение энергии = вход — выход
= 1370 — 1856
= -486 кДж моль -1
Изменение энергии отрицательное.Это показывает, что реакция экзотермическая.
Свободная энергия Гиббса
Свободная энергия Гиббса
Свободная энергия Гибба
Направление самопроизвольного изменения — это направление, в котором общая энтропия увеличивается. Общее изменение энтропии, также называемое изменением энтропии Вселенной, представляет собой сумму изменения энтропии системы и ее окружения:
DS унив = DS sys + DS surr
Согласно второму закону термодинамики энтропия Вселенной, S univ , всегда должна увеличиваться для спонтанного процесса, то есть DS univ > 0.
Свободная энергия и изменение свободной энергии — свободная энергия Гиббса, G , используется для описания спонтанности процесса.
G = H — TDS
Изменение свободной энергии, DG, равно -TDS univ и применяется только к самой системе , без учета окружающей среды. Он определяется уравнением Гиббса:
DG = DH — TDS
Для самопроизвольного процесса при постоянной температуре и давлении DG должно быть отрицательным.Во многих случаях мы можем предсказать знак по признакам
DH и DS.
Стандартное изменение свободной энергии, DG o — стандартное изменение свободной энергии, DG o может быть рассчитано (1) путем подстановки стандартных энтальпий и энтропий реакции и температуры Кельвина в уравнение Гиббса или ( 2) путем объединения стандартных свободных энергий образования посредством выражения
Сводка свободной энергии Гиббса
|
Изменение энтальпии |
Изменение энтропии |
Свободная энергия Гиббса |
Спонтанность |
|
положительный |
положительный |
зависит от T, может быть + или — |
да, если температура достаточно высокая |
|
отрицательный |
положительный |
всегда отрицательно |
всегда спонтанно |
|
отрицательный |
отрицательный |
зависит от T, может быть + или — |
да, если температура достаточно низкая |
|
положительный |
отрицательный |
всегда положительный |
никогда не спонтанно |
Проблем:
1) В процессе Габера для производства аммиака
|
Уравнение |
Изменение энтальпии |
Изменение энтропии |
|
|
N 2 + 3H 2 2NH 3 |
ΔH = -93 кДж / моль |
ΔS = -198 дж / моль K |
|
|
|
|
|
При какой температуре вышеуказанная реакция станет самопроизвольной?
Тот факт, что оба члена отрицательны, означает, что уравнение свободной энергии Гиббса сбалансировано и зависит от температуры:
ΔG = ΔH — TΔS
|
ΔG = -93000 — (T x -198) обратите внимание, что энтальпия дана в килограммах джоулей |
|
если ΔG = 0 то система находится на пределе спонтанности реакции |
|
Когда ΔG = 0 , тогда (T x -198) = -93000 |
|
и T = 93000/198 Кельвин |
|
поэтому реакция становится спонтанной, когда T = 469 K (196 ºC) |
ниже этой температуры реакция протекает самопроизвольно.
2) Определите дельта G в стандартных условиях, используя свободные энергии образования Гиббса, найденные в подходящей термодинамической таблице для следующей реакции:
4HCN (л) + 5O 2 (г) —> 2H 2 O (г) + 4CO 2 (г) + 2N 2 (г)
- Убедитесь, что уравнение сбалансировано
- Найдите стандартную свободную энергию образования H 2 O (г) и умножьте на ее коэффициент (2) в уравнении.
2 моля (-237,2 кДж / моль) = -474,4 кДж = стандартная свободная энергия образования для двух моль H 2 O (л)
- Найдите стандартную свободную энергию образования CO 2 (г) и умножьте на ее коэффициент (4)
4 моля (-394,4 кДж / моль) = -1577,6 кДж = стандартная свободная энергия образования для четырех моль CO 2
- Найдите стандартную свободную энергию образования N 2 (г) и умножьте на ее коэффициент (2)
2 моля (0.00 кДж / моль) = 0,00 кДж = стандартная свободная энергия образования для 2 моль N 2 (г)
- Добавьте результаты шагов 2, 3 и 4, чтобы получить стандартную бесплатную энергию для продуктов
(-474,4 кДж) + (-1577,6 кДж) + 0,00 = -2052 кДж = стандартная свободная энергия для продуктов
- Найдите стандартную свободную энергию образования для HCN (l) и умножьте на ее коэффициент (4)
4 моля (121 кДж / моль) = 484 кДж = стандартная свободная энергия для 4 моль HCN (л)
- Найдите стандартную свободную энергию образования O 2 (г) и умножьте на ее коэффициент (5)
5 моль (0.00 кДж / моль) = 0,00 кДж = стандартная свободная энергия 5 моль O 2 (г)
- Добавьте результаты шагов 7 и 8, чтобы получить стандартную свободную энергию реагентов
(484) + (0,00) = 484 кДж = стандартная свободная энергия для реагентов
- Вычтите результат шага 9 из результата шага 5, чтобы получить стандартное изменение свободной энергии для реакции
Сумма свободной энергии продуктов — Сумма свободной энергии реагентов = (-2052 кДж) — (484 кДж) = -1568 кДж = стандартное изменение свободной энергии для реакции.
3) Для следующей реакции с использованием таблицы термодинамики:
CoCl 2 (г) —> CO (г) + Cl 2 (г)
- Рассчитайте при 127 ° C DG
- Рассчитайте температуру, когда указанная выше реакция находится в равновесии (DG = 0).
- При какой температуре эта реакция будет спонтанной?
- Проверьте, сбалансировано ли уравнение
- Определите дельту H реакции, используя закон суммирования Гесса и стандартные энтальпии образования
Дельта H = Сумма дельты H f продуктов — Сумма дельта H f реагентов
Дельта H = [1 (-110.5) + 1 (0,00)] — [1 (-220)]
Дельта H = -110,5 — (-220) = +110,5 кДж
- Определите дельту S для реакции, используя стандартные молярные энтропии и закон суммирования Гесса
Дельта S = Сумма стандартных молярных энтропий продуктов — сумма стандартных молярных энтропий реагентов
Дельта S = [1 моль (197,5 Дж / моль-K) + 1 моль (223) Дж / моль-K] — [1 моль (283,7 Дж / моль-K)]
Дельта S = 420,5 Дж / К — 283,7 Дж / К = 136.8 Дж / К
- Преобразовать дельту S из Дж / К в кДж / К
136,8 Дж / К X 1 кДж / 1000 Дж = 136,8 / 1000 = 0,1368 кДж / К
- Преобразование 127 C в K
К = С + 273 = 127 + 273 = 400 К
- Подставьте результаты шагов 2 и 4 в уравнение Гиббса-Гельмгольца вместе с температурой Кельвина, чтобы получить дельту G реакции
Дельта G = Дельта H — T (Дельта S)
Дельта G = 110.5 кДж — 400 К (0,1368 кДж / К)
Delta G = 110,5 — 54,72 кДж = + 55,78 кДж
Поскольку эта реакция имеет положительную дельту G, она не будет спонтанной, как написано.
Название вида Delta Hf (кДж / моль) Delta Gf (кДж / моль) S (Дж / моль-K)
CO 2 (г) -393,5 -394,4 213,7
CH 3 OH (л) -238.6 -166,2 127
COCl 2 (г) -220-206 283,7
CO (г) -110,5 -137,2 197,5
C 2 H 2 (г) 227209 200,9
Класс 2 (г) 0 0 223
HCN (л) 105 121 112.8
H 2 O (г) -241,8 -228,6 188,7
H 2 O (л) -285,8 -237,2 69,9
HNO 3 (водн.) -206,6 -110,5 146
N 2 (г) 0 0 191.5
НЕТ 2 (г) 33,2 51 239,9
NO (г) 90,3 86,6 210,7
O 2 (г) 0 0 205
КС 2 151
Н 2 0 0130.6
СН 4 -74,8 -50,8 186,3
H 2 S -20,17 -33,01 205,6
СО 2 248,1
Свободная энергия и равновесие.
Поскольку DG является мерой того, насколько благоприятна реакция, он также связан с константой равновесия.
- Реакция с отрицательным ДГ очень благоприятна, поэтому у нее большой К.
- Реакция с положительным ДГ неблагоприятна, поэтому у нее небольшой К.
- Реакция с DG = 0 находится в равновесии.
- Есть несколько разных генеральных директоров. Важно различать их.
- DG o (дельта G, с надстрочным индексом o) — это изменение свободной энергии для реакции, при которой все находится в стандартных состояниях (газы при 1 бар и растворы при концентрации 1 M) и при определенной температура (обычно 25 ° C)
- DG (только дельта G).Это изменение свободной энергии для реакции, которая не находится в стандартном состоянии.
- ГД связаны следующим образом. ЗНАЙТЕ ЭТО УРАВНЕНИЕ и поймите, как им пользоваться:
DG = DG o + RT ln Q
Где Q — это то же значение Q, которое мы использовали для расчета равновесия (K является частным случаем для Q в состоянии равновесия).
- Спонтанность и скорость реакции. В этом разделе просто указывается, что нет прямой зависимости между DG и скоростью реакции (кинетикой).
Проблема:
Исходя из изменения свободной энергии при постоянной температуре: DG ° = DH ° — TDS ° и зависимости между DG и константой равновесия, K: DG ° = -RT lnK, выведите линейное уравнение, которое выражает lnK как функция 1 / T (линейное уравнение имеет вид y = mx + b).
(b) Приведены константы равновесия для превращения 3-фосфоглицерата в 2-фосфоглицерат при pH 7:
|
T (° C) |
К |
|
0 |
0.1535 |
|
20 |
0,1558 |
|
30 |
0,1569 |
|
45 |
0,1584 |
Рассчитайте DG ° при 25 ° C.
(c) Какова концентрация каждого изомера фосфоглицерата, если 0.150 M фосфоглицерат достигает равновесия при 25 ° C.
|
T (ºC) |
Т (К) |
1 / Т (К -1 ) |
К |
линк |
|
0 |
273 |
0,00366 |
0.1535 |
-1,874 |
|
20 |
293 |
0,00341 |
0,1558 |
-1,859 |
|
30 |
303 |
0,00330 |
0,1569 |
-1,852 |
|
45 |
318 |
0.00314 |
0,1584 |
-1,843 |
b) Для T = 25ºC, используя уравнение графика, lnK = -1,8557 и K = 0,1564.
в)
Как выглядит 8,700 килоджоулей?
Очевидно, в среднем 8 700 килоджоулей в день. Фактическое количество килоджоулей, которое вам нужно, будет варьироваться в зависимости от вашего возраста, пола, стадии жизни (если вы растете или беременны, поскольку для этого требуется больше энергии), веса, роста и вашей физической активности.
Например, очень активному 16-летнему человеку требуется 12 000 кДж в день, что на 4 000 кДж больше, чем 70-летнему сидячему человеку. А еще есть такая замечательная вещь, как генетическая наследственность. Большинство из нас знает людей, которые всегда «быстро сжигают пищу» и редко прибавляют в весе — скорее всего, они из семьи со схожей метаболической тенденцией!
В показанной рекламе пиццы Legends 6654 кДж на всю пиццу, что превращается в 832 кДж на ломтик или кусочек.Подумайте, если это реальный размер порции — вы бы съели одну восьмую обычной пиццы? Вряд ли. Вы, вероятно, засунете половину (3327 кДж) или хотя бы два клина (1664 кДж).
8700 килоджоулей = 2080 калорий
В старых числах 8 700 килоджоулей эквивалентны 2080 калориям. Или просто округлите это количество до 2000 калорий для облегчения запоминания.
Кто должен стремиться съесть 8,700?
- Женщины в возрасте от 19 до 50 лет, занимающиеся легкой деятельностью, с весом от 55 до 60 кг.
- Женщины в возрасте от 51 до 70 лет, занимающиеся легкой деятельностью, и весом от 60 до 65 кг.
- Женщины старше 70 лет, занимающиеся легкими физическими нагрузками, и весом от 70 до 75 кг.
- Мужчины старше 70 лет, занимающиеся легкой деятельностью, и весом от 55 до 65 кг.
- Девочки 12–13 лет, занимающиеся легкой деятельностью.
- Мальчики 11 или 12 лет, занимающиеся легкой деятельностью.
Ваши индивидуальные обстоятельства будут определять, нужно ли вам БОЛЬШЕ или МЕНЬШЕ 8,700. Щелкните здесь, чтобы увидеть полную таблицу рекомендуемых суточных доз в килоджоулей.Или обратитесь к аккредитованному практикующему диетологу, чтобы получить более индивидуальный совет по питанию.
килоджоулей в континентальных чизкейках — см. Объявление
Чизкейки, показанные выше, показывают количество килоджоулей для всего торта. Вам придется разделить это число на 8 или 10 в зависимости от количества подаваемых вами подач. Эти данные должны быть на их веб-сайте, в формах заказа и рекламных проспектах.
Сколько еды означает 8,700?
1.«Среднесуточный» рацион
Вот как может выглядеть обычный день еды, когда в сумме получается около 8700 *.
| Питание | килоджоулей |
|---|---|
| Завтрак (17% от общего дневного рациона) | |
| 2 Weet-Bix | 480 |
| Обезжиренное молоко, примерно 1 стакан | 535 |
| Мед, 1 столовая ложка | 95 |
| Банан | 335 |
| Утренний чай (17%) | |
| Маффин с шоколадной стружкой | 925 |
| Капучино на обычном молоке | 465 |
| Сахар, 1 чайная ложка | 65 |
| Обед (20%) | |
| Поджаренный бутерброд с сыром и помидорами | 980 |
| Ванна клубничного йогурта с пониженным содержанием жира | 760 |
| Послеобеденный чай (6%) | |
| Батончик мюсли | 325 |
| Яблоко | 300 |
| Ужин (40%) | |
| Спагетти с мясным соусом болоньез, покрытые тертым сыром | 2,355 |
| 1 стакан красного вина | 290 |
| 2 TimTams | 790 |
| ИТОГО | 8,700 |
* Для удобства чтения цифры округлены до ближайшего 0 или 5.Цифры рассчитаны с помощью Foodworks 6.0.
2. Быстрый доступ к 8,700
Если вы едите много фаст-фуда, вам не понадобится много времени, чтобы набрать 8700 килоджоулей. Посмотрите, сколько еды было за этот день ниже, и вы увидите, что только шесть блюд быстрого приготовления приведут вас к вашим 8700.
| Прием пищи | килоджоулей |
|---|---|
| Завтрак (0%) | |
| Нет | 0 |
| Позднее утро (40%) | |
| Gloria Jean’s Large White Chocolate Mocha | 1870 |
| Банановый хлеб, поджаренный (Gloria Jean’s) с маслом | 1,615 |
| Обед (20%) | |
| McDonald’s Cheeseburger | 1,190 |
| Coca-Cola 375 мл банка | 675 |
| Ужин (40%) | |
| Super Supreme Pizza, тонкое тесто | 2,350 |
| Слиток Mars, 53 г | 1 050 |
| ИТОГО | 8,750 |
Обратите внимание: обед даже не включает в себя вездесущую «картошку-фри с этим»!
Откуда взялась цифра 8700?
На основе национальных опросов о том, что якобы едят австралийцы.Согласно Стандартам пищевых продуктов, мы съедаем в среднем около 8 700 килоджоулей в день.
Эта цифра в 8,700 ДОЛЖНА быть указана где-нибудь на досках меню быстрого питания. См. Пример файла cookie из Subway выше. Посмотрите, как отображается количество килоджоулей для каждого файла cookie, ПЛЮС, что среднее потребление для взрослого составляет 8700 человек.
Какой процент? Разделите килоджоули на 8700 и сравните
.
Да, все в порядке! Этот бургер с бонди дает вам 35% от дневной нормы.Разделите 3180 на 8700, и вы получите 35%. Спросите себя: хочу ли я съесть 35 процентов от общего количества потребляемой пищей за один прием?
Связанная информация
- Поменяйте местами, не останавливайте сайт правительства
- На 8,700 веб-сайте Управления по контролю за продуктами питания штата Новый Южный Уэльс излагаются новые законы, требующие от операторов быстрого питания отображать количество килоджоулей в своих меню.
Экономия
энергии (килоджоулей) — Healthy Kids
Килоджоуль (кДж) — это просто мера энергии.Чтобы наши тела функционировали, нам нужна энергия, которая питает их. Согласно австралийским законам о еде, энергия должна отображаться в килоджоулей для описания количества энергии, содержащейся в порции еды. Другой термин, о котором вы, возможно, слышали для обозначения энергии, — это калории. Калории — это американская мера, и их часто можно увидеть на упакованных американских товарах. Эти термины используются как синонимы, чтобы говорить об энергии. Однако важно знать, что 1 Cal = 4,2 кДж.
Сколько килоджоулей нужно человеку?
Среднесуточная потребность в килоджоулях (энергии) для взрослого составляет приблизительно 8700 кДж или 2000кал.Ежедневные потребности человека в энергии различаются в зависимости от пола, количества упражнений, роста и веса, а также от того, страдают ли они от определенных заболеваний или расстройств. В то время как среднему здоровому взрослому австралийцу требуется около 8700 кДж / день, это может быть другим для вас и, несомненно, будет другим для вашего ребенка.
Чтобы помочь рассчитать ваши потребности в энергии, посетите страницу кампании 8700:
http://www.8700.com.au/kj-explained/your-ideal-figure/
Что такое избыточная энергия?
Когда говорят, что пища содержит избыток энергии, это означает, что это может привести к потреблению большего количества килоджоулей, чем требуется вашему организму.Когда потребляется избыточная энергия (сверх наших дневных энергетических потребностей), она откладывается в виде жира. Это может увеличить риск избыточного веса или ожирения, если не будет сбалансировано с упражнениями.
Пища, которую мы едим, содержит разное количество энергии в зависимости от того, сколько в ней жиров, углеводов, белков или алкоголя. Каждый грамм жира обеспечивает 37 кДж по сравнению с углеводами и белками, которые содержат 16 кДж и 17 кДж соответственно. Спирт содержит 27 кДж / г.
Вот почему есть предупреждения о потреблении диеты с высоким содержанием жиров, поскольку это наиболее калорийное питательное вещество.



 Изменение энтальпии отрицательное; реакция экзотермическая. Обратное
Изменение энтальпии отрицательное; реакция экзотермическая. Обратное 5 г C 3 H 8 ;
5 г C 3 H 8 ;
