Конспекты лекций, аминокислоты, белки — Биохимия — РУДН
Preview text
Аминокислоты. Белки.
Аминокислотами называются соединения, в молекуле которых содержится
одновременно аминые и карбоксильные группы. Например, NH
2
-CH
2
COOH
(аминоуксусная кислота — глицин (гликокол)).
В зависимости от положения аминогруппы по отношению к карбоксилу
различают α-, β-, γ- аминокислоты и т.д.
H
2
N
HN
N
H H 2 N
CO
2
H
H
2
N
OH
H
2
N
OH
H
2
N
H
2
C
H
2
N H
2
N
H
2
C
CH
2
H
2
C
NH
2
H
2
N
H
2
C
CH
2
HN
C
NH
2
NH
H
2
N
N
NH
H
2
N
SH
H
2
N
CO
2
H
S
H
3
C
H
2
N
C
H
2
N O
H
2
N
C
H
2
N
O
H
2
N
OH
CH
3
Глицин
Gly
Лейцин
Leu
Тирозин
Tyr
Аспаргиновая
кислота, Asp
Глутаминовая
кислота, Glu
Серин
Ser
Аланин
Ala
Аргинин
Arg
Лизин
Lys
Фенилаланин
Phe
Цистеин
Cys
Пролин
Pro
Валин
V al
Триптофан
Try
Гистидин
His
Аспарагин
Asn (Asx)
Метионин
M et
Треонин
T hr
Глутамин
Gln (Glx)
Изолейцин
I le
CO
2
H
CO
2
H
CO
2
H
CO
2
H
CO
2
H
CO
2
H
H
2
N
HO
2
C
CH
3
CH
2
H
2
N
HO
2
C
H
2
N
HO
2
C
CH
3
CH
3
H
2
N
HO
2
C
CH
3
H
3
C
H
2
N
HO
2
C
CH
3
CH
3
CO
2
H
CO
2
H
CO
2
H
серусодержащие
амины
амино-
спирты
CO
2
H CO
2
H
CO
2
H
CO
2
H
HO
2
C
CO
2
H
амиды
производные
гетероциклов
ароматические производные
α-Аминопропионовая кислота (аланин) содержится в белках в виде L (+)-
аланина.
 β-Аминопропионовая кислота найдена в мышечной ткани, входит в
β-Аминопропионовая кислота найдена в мышечной ткани, входит в
состав витамина В
3
(пантотеновая кислота). Глицин – улучшает метаболические
процессы в тканях мозга, оказывает положительное действие при мышечной
дистрофии.
Аминокислоты играют исключительно важную роль в процессах
жизнедеятельности живых организмов. Так как являются теми соединениям, из
которых строится молекула любого белка.
Широко принято деление аминокислот на природные (обнаруженные в
растительных и животных организмах) и синтетические, не имеющих природных
аналогов. Среди природных аминокислот выделают группу так называемых
незаменимых аминокислот, которые не могут синтезироваться в животном
организме и организме человека.
В настоящее время в природных объектах обнаружено свыше 150
аминокислот, 20 из них входит в состав белков, а 10 — являются незаменимыми
аминокислотами. Они не синтезируются в организме человека.
 При некоторых
При некоторых
(врождённых) заболеваниях перечень незаменимых аминокислот расширяется –
фенилкетонурия (не синтезируется α-аминокислота тирозин – синтез в
организме здоровых людей при гидроксилировании фенилаланина).
Способы получения
I. α — Аминокислоты.
1. Промышленный метод.
R CO
2
H
Br
2 NH
3
— NH
4
Br NH
2
R CO
2
NH
4
HCl, H
2
O
NH
2
R CO
2
H
2. Циангидринный метод.
H O
3
C
H
HCN
H OH
3
C
CN
NH
3
— H
2
O
NH
2
H
3
C
CN
2 H
2
O
— NH
3
NH
2
H
3
C
CO
2
H
H O
3
C
H
NH
3
— H
2
O
H NH
3
C
H
HCN
NH
2
H
3
C
CN
2 H
2
O
— NH
3
NH
2
H
3
C
CO
2
H
а)
альдимин
б)
3.
 Из α-кетокислот.
Из α-кетокислот.
NH
3
— H
2
O
H
2
/ Pd
H
2
N R
CO
2
H
CO
2
O H
R
CO
2
HN H
R
4. Из оксимов α-кетокислот.
NH
2
OH
— H
2
O
4 [H]
H
2
N R
CO
2
H
CO
2
O H
CH
3
CO
2
N H
R
HO
HCl/Zn
5. Восстановлние α-нитрокислот.
O
OC
2
H
5
H
3
C
NO
2
O
OC
2
H
5
H
3
C
NH
2
2 H
2
/Ni
— 2 H
2
O
H
2
O
— С
2
H
5
OH
O
OH
H
3
C
NH
2
6.
 Микробиологический синтез.
Микробиологический синтез.
В промышленности многие аминокислоты получают микробиологическим
путем, выращивая на специальной питательной среде микроорганизмы,
производящие в процессе своей жизнедеятельности определенные аминокислоты.
Так им путем получают, например, лизин, глутаминовую кислоту. Аминокислоты
бумаге или в гелях, то он называется электрофорезом. Его применяют для
разделения и идетификации аминокислот.
Для каждой аминокислоты существуют определенное значение рН, при
котором концентрация катионов равна концентрации анионов и концентрация
цвиттер-иона максимальна. Следовательно, при этом рН
i
в условиях
электрофореза переноса ионов происходить не будет. Такое значение рН
называется изоэлектрической точкой.
Солеобразный характер аминокислот проявляется и в их физических
свойствах: аминокислоты обладают высокой Тпл, летучи, в большинстве своем
растворимы в Н
2
О и плохо или совсем нерастворимы в неполярных органических
растворителях.
 Вследствие амфотерности аминокислот они способны
Вследствие амфотерности аминокислот они способны
нейтрализовать небольшое количество других кислот и оснований в водных
растворах и поэтому их растворы обладают буферными свойствами (сохраняют
соnst рН). Следовательно в живых организма аминокислоты буферы,
поддерживающие определенную среду.
Во всех (кроме глицина) природных аминокислотах имеются
асимметричные углеводороды:
H
2
N H
CO
2
H
CH
3
L (+)-аланин
NH
2
H
CO
2
H
CH
3
D (-)-аланин
CH
3
-CH-COOH
NH
2
Аминокислоты входят в состав белков и других природных соединений
относятся к L-ряду. D-формы встречаются сравнительно редко.
Как правило, D-аминокислоты не усваиваются животными организмами,
часто бывают токсичными. Синтетически полученные аминокислоты являются
рацематами.
 Для их разделения существуют специальные методы: химический,
Для их разделения существуют специальные методы: химический,
микробиологический, ферментативный.
Подобно другим соединениям со смешанными функциями аминокислоты
проявляют свойства и кислот и аминов.
I. Реакции по карбоксильной группе.
1. образование солей (с Ме, МеОН, солями более слабых кислот)
NH
3
(СH
2
)
4
COO NH
2
(CH
2
)
4
COONa
NaOH
+ H
2
O
Кроме обычных солей аминокислоты могут образовывать
внутрикомплексные соли с катионами тяжелых металлов.
O
O
N
H
O H
O
N
H
H
Cu
2+
O OH
NH
2
2
Cu
2+
Ni
2+
, Zn
2+
, Co
2+
медная соль глицина
(интенсивное окрашивание
в синий цвет)
используется для выделения
и очистки аминокислот
2.
 образование эфиров.
образование эфиров.
NH
2
— СH
2
-COOH NH
3
-CH
2
-COOCH
3
CH
3
OH
HCl
Cl
гидрохлорид
метилового эфира глицина
NH
3
— NH
4
Cl
NH
2
— СH
2
-COOCH
3
3. образование галогенангидридов.
NH
2
— СH
2
-COOH NH
3
-CH
2
-COСl
PCl
5
Cl
Сами ангидриды неустойчивы и существуют только в виде солей. Поэтому,
обычно, предварительно защищают аминогруппу:
NH
2
— СH
2
-COOH CH
3
-C(O)-NH-CH
2
-COOH
PCl
5
(CH
3
CO)
2
O
CH
3
-C(O)-NH-CH
2
-COCl
4. декарбоксилирование для α-аминкосилот (Ва(ОН)
2
, t)
NH
2
— СH(R)-COOH RCH
2
NH
2
+ CO
2
1) Ba(OH)
2,
t
2)ферменты
(декарбоксилазы)
II.
 Реакции аминогруппы аминокислот.
Реакции аминогруппы аминокислот.
1. образование солей с кислотами
NH
2
— СH
2
-COOH NH
3
-CH
2
-CO
2
H
HCl
Cl (подобно аминам)
2. действие НNO
2
NH
2
— СH
2
-COOH HO-CH
2
-CO
2
H + N
2
+ H
2
O
HNO
2
(количественное определениеNH
2
—
в аминокислотах и белках)
3. ацилирование (реакцию применяют в синтезе пептидов).
NH
2
— СH
2
-COOH CH
3
-C(O)-NH-CH
2
-COOH
C
6
H
5
COCl
(CH
3
CO)
2
O
C
6
H
5
-C(O)-NH-CH
2
-COOH
4. алкилирование.
NH
2
— СH
2
-COOH CH
3
NH-CH
2
-CO
2
H
CH
3
I
— HI
(CH
3
)
3
N-CH
2
-CO
2
H
2 CH
3
I
— HI
I
N-метилгликокол
(содержится в листьях
сахарной свеклы)
AgOH
— H
2
O
(CH
3
)
3
N-CH
2
-CO
2
H
OH
— H
2
O
(CH
3
)
3
N-CH
2
-COO
бетаин
5.
 взаимодействие с карбонильными соединениями (образование оснований
взаимодействие с карбонильными соединениями (образование оснований
Шиффа).
NH
2
— СH(R)-COOH R-CH=N-CH(R)-CO
2
H
альдегид
а)
-аминокислота
+ R-CH=O
R-CH(OH)-NH-СH(R)-COOH
карбиноламин
— H
2
O
замещённый имин
В можно получить два дипептида: АВ и ВА, различающихся по физическим и
химическим свойствам. Например:
аланилглицин глицилаланин
N
H
O
NH
2
H
3
C
O
OН
N
H
O
H
2
N
CH
3
O
OН
Для синтеза пептидов определенного строения обычно берут не сами
аминокислоты, а их производные. Такими «активированными» соединениями
могут быть, например, хлорангидриды кислот. Функциональные группы, которые
не должны участвовать в реакции, заранее «защищают», а после получения
нужного пептида защиту снимают.

Образование дипептида глицилаланина.
+
1.защитаNH
2
OH
O
H
2
N
O Cl
O
глицин
N-концевая
аминокислота
карбобензоксихлорид
N
H
O
O
O
OH
защита
C
6
H
5 — HCl
C
6
H
5
(бензилхлорформиат)
OC
2
H
5
Cl
O
— HCl
N
H
O
O
O
O
C
6
H
5
OC
2
H
5
O
A
3.защитаСООН
OH
O
H
2
N
CH
3
аланин
С-концевая
аминокислота
H
(CH
3
)
3
COH
OC(CH
3
)
3
O
H
2
N
CH
3
B
2.
 активацияCOOH
активацияCOOH
4.образованиепептиднойсвязи
A B
+ N
H
O
O
O
H
N
C
6
H
5
CH
3
OC(CH
3
)
3
O
— CO
2
— C
2
H
5
OH
H
2
N
O
H
N
CH
3
OH
O
1) H
2
/Pd
2) H
2
O/OH
—
снятие"защиты"
сохраняется-C(O)-NH- глицилаланин
+ C
6
H
5
CH
3
+ CO
2
+ (CH
3
)
3
COH
Олигопептиды: до 10 аминокислот.
Полипептиды: 10-70 аминокислот.
Белки: 100 и более α-аминокислот.
Синтетические полипетиды.
1. Найлон-6,
O
n HOOC-(CH
2
)
4
-COOH + n H
2
N-(CH
2
)
6
-NH
2
OOC-(CH
2
)
4
-C(O)-[-NH-(CH
2
)
6
-NH-C(O)-(CH
2
)
4
-C(O)-]
n
-NH(CH
2
)
6
NH
3
1.
 Капрон (перлон)
Капрон (перлон)
-капролактам капрон
O
поликонд-я
O
NH
2
OH
N
OH
H
2
SO
4 NH
O
200 — 270С
N
H
n
Пропуская под давлением расплав нейлона или капрона через фильеры с
мельчайшими отверстиями получают волокна, превосходящие по прочности
натуральные. Полиамидные волокна применяются в производстве автопокрышек
и авиапокрышек, для изготовления прочных и не гниющих рыболовных сетей и
т.д.
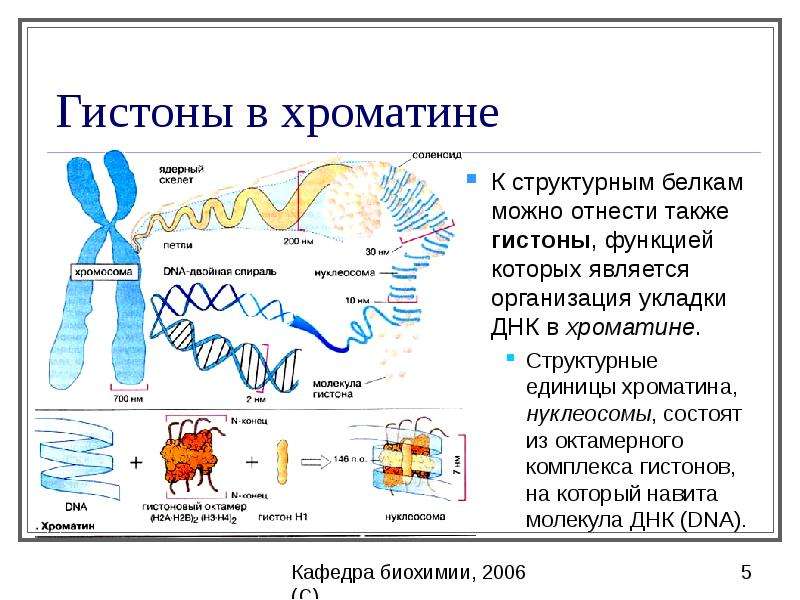
Белки.
Белки это высокомолекулярные природные полимеры, построенные из
остатков α-аминокислот, соединенных амидной (пептидной) связью -С(О)-NH-.
Белки входят в состав всех живых организмов, но особо важную роль они
играют в животных организмах, которые состоят главным образом из тех или
иных форм белков. Мышцы, покровные ткани, внутренние органы, хрящи, кровь
все это белковые вещества.

Растения синтезируют белки из СО
2
и Н
2
О за счет фотосинтеза. Животные
организмы получают в основном готовые аминокислоты с пищей и на их базе
строят белки своего организма. Практически все белки построены из 20 α-
аминокислот, принадлежащих, за исключением глицина, к L-ряду.
Белки биополимеры α-аминокислот
протеины
протеиды
(делятся в зависимости от состава небелковой
части)
1. Альбумины – небольшая молекулярная
масса, растворимы в воде (белок яйца, пенка
кипячёного молока).
1. Фосфопротеиды – содержат
фосфорную кислоту. Играют большую роль в
питании молодого организма (казеин – белок
молока).
2. Глобулины – растворимы в 10%
растворе NaCl, самые распространённые
(мышечные волокна, кровь, молоко, семена
растений).
2. Липопротеиды — простой белок +
липиды. Содержатся в зёрнах хлорофилла и
3.
 Проламины – плохо растворяются в протоплазмы клеток, биологических мембран.
Проламины – плохо растворяются в протоплазмы клеток, биологических мембран.
воде, растворимы в спирте. Характерны для
семян злаков.
Медный комплекс
биурета
O
N
H
NH
O
H —
N
O H
N
HN
—
O
H
N
Cu
2Na
+
2+
2+
N N
N N
Cu
O
—
O
—
O
O
R
2
R
3
R
R
1
R
4
O
NH
O
предполагаемый
белковый комплекс
2. Ксантопротеиновая реакция появление при действии HNO
3
(конц.) желтого
окрашивания. Реакция связанная с наличием в молекуле ароматических
колец (финилаланин, гистидин).
HO
N
H
O
остаток тирозина
HNO
3
HO
N
H
O
жёлтый
NO
2
NaOH
O
N
H
O
оранжевый
NO
2
Na
3.
 Нингидриная реакция (аминогруппа) появление сине-фиолетового
Нингидриная реакция (аминогруппа) появление сине-фиолетового
окрашивания при кипячении с водным раствором нингидрина.
O
O
OH
OH
Нингидрин
O
O
NH
2
H
2
N
CH
CO
2
H
R
+ + CO +
2
RCHO
O
O
O
O
O
H
2
+ N
O
O
N
O
HO
фиолетово-синий
— H
2
O
| № п/п | Тема лекции | Лектор |
| 2 курс, III семестр (осенний) | ||
| 1 | Предмет и задачи биохимии. Белки. Общая характеристика, свойства, строение, классификация. | Наумова Н.Г. |
| 2 | Значение белков в питании.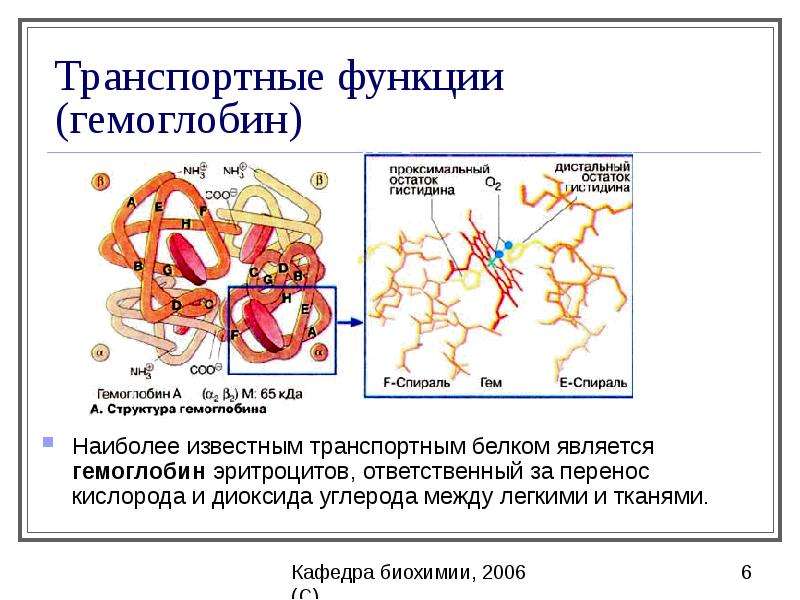 Азотистый баланс. Переваривание и всасывание белков. Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени Азотистый баланс. Переваривание и всасывание белков. Гниение белков в толстом кишечнике. Обезвреживание продуктов гниения в печени |
Трофимова С.Р. |
| 3 | Судьба всосавшихся аминокислот. Общие пути метаболизма аминокислот. Обмен отдельных аминокислот. Наследственные нарушения обмена аминокислот. | Наумова Н.Г. |
| 4 | Конечные продукты обмена белков. Синтез мочевины. Азотемии. Патологии обмена белков. | Наумова Н.Г. |
| 5 | Нуклеопротеины. Нуклеиновые кислоты. Строение, свойства, обмен, биологическая роль. Нарушения обмена нуклеопротеинов. | Трофимова С.Р. |
| 6 | Биосинтез белков. Регуляция биосинтеза белков. Перспективы использования генной инженерии в медицине. | Трофимова С.Р. |
| 7 | Хромопротеины. Строение, свойства, обмен, биологическая роль. Желчные пигменты, их роль в дифференциальной диагностике желтух.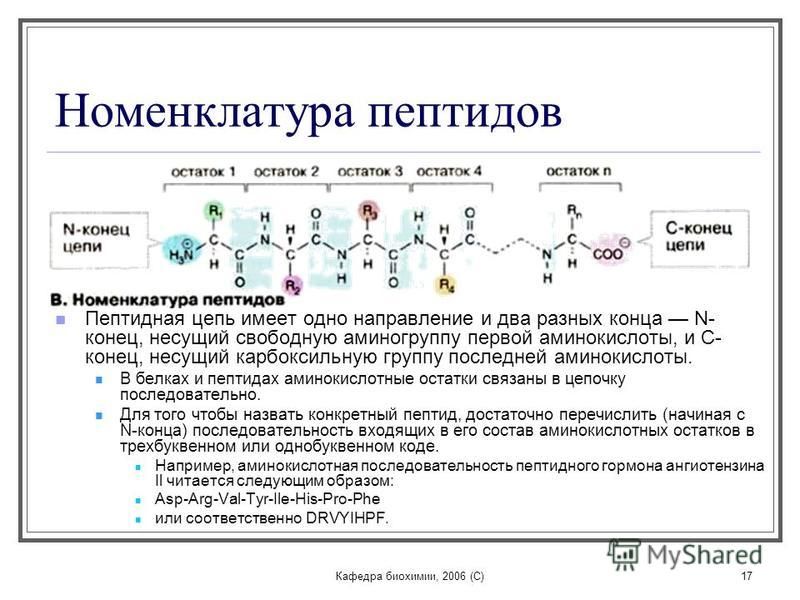 |
Бутолин Е.Г. |
| 8 | Ферменты. Общая характеристика, свойства. Классификация ферментов. | Трофимова С.Р. |
| 9 | Ферменты. Регуляция активности ферментов. Активаторы и ингибиторы. Применение ферментов в медицине. | Трофимова С.Р. |
| 10 | Липиды. Строение, свойства, классификация. Роль липидов в питании. Переваривание и всасывание липидов. | Наумова Н.Г. |
| 11 | Обмен липидов. Биосинтез и окисление жирных кислот. Липопротеины плазмы. Регуляция обмена липидов. | Бутолин Е.Г. |
| 2 курс, IV семестр (весенний) | ||
| 1 | Обмен холестерина: биологическая роль, синтез, выведение из организма. Синтез и значение кетоновых тел. Нарушения липидного обмена. | Бутолин Е.Г. |
| 2 |
Классификация и характеристика углеводов. |
Трофимова С.Р. |
| 3 | Синтез гликогена. Общая схема превращения глюкозы. Анаэробный распад углеводов | Бутолин Е.Г. |
| 4 | Аэробный распад углеводов. Цикл трикарбоновых кислот (Кребса). Пентозофосфатный путь (ПФП). Глюконеогенез | Бутолин Е.Г. |
| 5 | Регуляция обмена углеводов. Нарушения углеводного обмена. | Данилова О.В. |
| 6 | Энергетический обмен. Роль митохондрий в энергетическом обмене. Биологическое (тканевое) окисление. | Трофимова С.Р. |
| 7 |
Окислительное фосфорилирование. Разобщение тканевого дыхания и окислительного фосфорилирования. Регуляция обмена веществ. Гормоны. |
Трофимова С.Р. Савинова Н.В. |
| 8 | Гормоны, их классификация, механизм действия.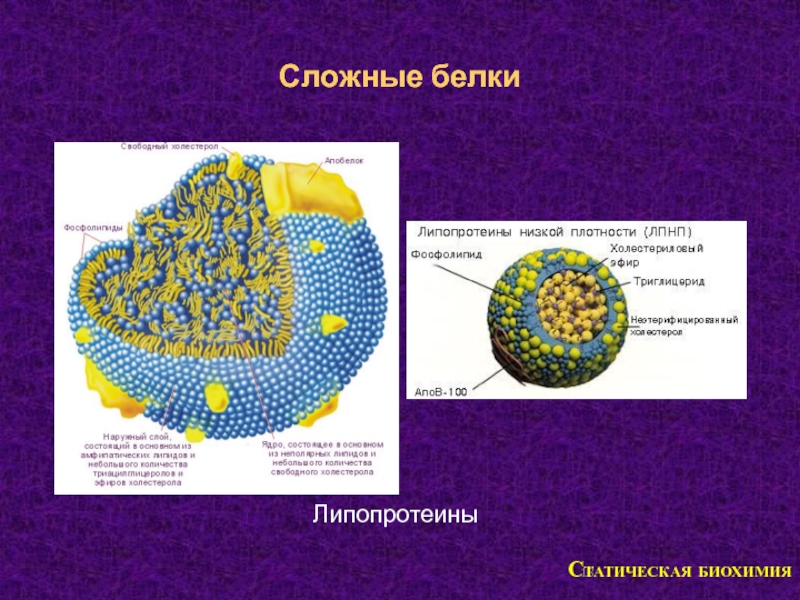 Тканевые гормоны. Тканевые гормоны. |
Савинова Н.В. |
| 9 | Витамины. Классификация. История открытия и изучения витаминов. Характеристика жирорастворимых витаминов | Переведенцева С.Е. |
| 10 | Характеристика водорастворимых витаминов. Применение витаминов в медицине. | Переведенцева С.Е. |
| 11 | Биохимия мочи. Механизм образования. Первичная и вторичная моча. | Бутолин Е.Г. |
| 12 | Биохимия соединительной ткани. Биохимия мышечной ткани. | Савинова Н.В. |
| 13 | Биохимия крови. Химический состав. Характеристика белков плазмы. Каскадный механизм свертывания крови. | Наумова Н.Г. |
| 14 | Биохимия печени. Обезвреживание токсических веществ в печени. Водно-минеральный обмен. Биохимия костной ткани. | Наумова Н.Г. |
| 15 | Особенности обмена веществ в детском организме. Биохимия молока. Взаимосвязь обмена веществ. | Данилова О.В. |
Лекция 5. Белки — BioBox All Secrets
БЕЛКИ – это биополимеры, мономерами которых являются аминокислоты.
Это карбоновые кислоты, в составе которых присутствует аминогруппа
-NH2
такие образования аминокислоты образуются из карбоновых кислот путем их аминирования.
| СН3 – СН2 – СООН | СН2NH2 – СН2 — СООН | |
| пропановая кислота | аминопропановая кислота |
Общим правилом является то, что аминогруппа и карбоксильная группа не могу быть присоединены к одному атому углерода. Для всех аминокислот характерно явление изомерии.
-
структурная.
Касается изменения положения NH2 группы относительно углеводородного скелета.
| СН3 – СН2 – СООН | СН2NH2 – СН2 — СООН | |
| В А | В А | |
| В – аминопропановая кислота | ||
| СН3 – СНNH2 – CООН | ||
| А – аминопропановая кислота |
Биологическое значение имеет гамма-аминомасляная кислота или ГАМК, которая является тормозным нейромедиатором в химических синапсах.
Н2NH2 – CH2 – CH2 – COOH гамма-аминомасляная кислота.
В белках встречаются только А-аминокислоты
-
D, L – изомерия
| l-изомер | d-изомер |
в белках встречаются только L-изомеры. В целом аминокислоты хорошо растворимы в воде, могут образовывать эфирные соединения и соли, благодаря своей амфотерности. Это значит, что вещество может выступать как основание, так и кислота. Растворимость аминокислот в воде будет зависеть от длины и структуры радикала и с этой точки зрения аминокислоты делятся на:
-
полярные или гидрофильные
-
неполярные или гидрофобные.
Существует аминокислота без свободной аминогруппы – это уникальная аминокислота пролин. В состав белков в живых клетках входят 20 L-А аминокислот, часть из которых синтезируется в организме человека, но 10 аминокислот не синтезируются и поэтому являются незаменимыми.
Функции аминокислот.
-
метаболическая или пластическая. Аминокислоты входят в состав более крупных соединений.
-
регуляторная выполняют аминокислоты, которые могут выступать в качестве тормозных нейромидеаторов в нервных синопсах (например, ГАМК)
-
сигнальная. Некоторые гормоны являются производными аминокислот. Например, стероидные гормоны, адреналин, норадленали являются производными аминокислоты тирозина.
Это органические соединения, которые образуются в результате реакции поликонденсации из аминокислот. С точки зрения строения можно выделить три группы пептидов:
-
дипептиды – состоят из 2 аминокислотных остатков;
-
олигопептиды – от 3 до 10 аминокислотных остатков;
-
полипептиды – от 10 до 100 аминокислотных остатков.
Полипептиды, в которых количество аминокислотных остатков превышает 100, называются белками.
Реакция конденсации между 2 аминокислотами определяется их амфотерностью, при этом образуется так называемая пептидная связь между аминогруппой одной аминокислоты и карбоксильной группой другой аминокислоты.
пептидная связь имеет свои особенности т.к. в ее состав входят электроотрицательные элементы. Азот оттягивает электронную плотность от водорода, поэтому водород приобретает частично положительный заряд. Кислород также является электроотрицательным элементом, поэтому он стремится притянуть электронную плотность на себя, в результате связь между углеродом и азотом становится практически двойной. Поскольку связь в пептидных группировках практически двойная, углеводородный скелет становится очень жестким и, соответственно, атомы кислорода и водорода не могут вращаться относительно него, поэтому эти атомы всегда занимают транс положение. Трансположение О2 и Н2 в пептидных группировках способствуют образованию в белках более сложного уровня организации, чем пептидная цепь.
Разнообразие пептидов зависит от длинны полипептидной цепи, а также от разнообразия аминокислотных остатков, входящих в состав полипептидов.
Функции полипептидов.
-
метаболическая. Полипептиды могут входить в состав более крупных соединений, например комплексных протеинов.
-
сигнальная. На основе пептидов формируется большое количество гормонов, например, все гормоны гипофиза имеют пептидную природу. Среди них встречаются как крупные, так и достаточно мелкие гормоны. К важнейшим относятся:
-
липотропный гормон – регулирует обмен липидов и жирных кислот;
-
кортикотропный гормон гипофиза. Стимулирует синтез гормонов коры надпочечников;
-
соматотропный гормон регулирует все процессы общего обмена, в большом количестве выделяется при различных инфекциях, травмах и после сильной физический нагрузки;
-
гормоны группы эндорфинов – это гормоны, которые снижают болевые ощущения в организме и состояние депрессии.
-
-
защитная или ингибиторная. Многие пептиды входят в состав антибиотиков, например стрептомицина, блеомицина.
— это крупные полипептиды, в состав которых входят более 100 аминокислотных остатков. Классификация белков достаточно сложна, как правило, выделяют различные группы по их растворимости в спиртах или способности образовывать соли. Более простой является классификация, в которой учитывается положение белка в трехмерном пространстве или его конфигурацию.
Глобулярная структура <1:4
Фибриллярная >1:10
В одной молекуле могут находиться как фибриллярные, так и глобулярные участки. Части молекул, которые имеют разную пространственную конфигурацию, называются доменами.
миозин
Все белки обладают определенным уровнем организации. Выделяют четыре уровня организации:
- Первичный
- Вторичный
- Третичный
- Четвертичный, который не является универсальным.
ПЕРВИЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ.
Представлен полипептидной цепью, т.е. образуется за счет формирования пептидных связей. На первичном уровне организации белки не функциональны. Этот уровень необходим для создания следующего вторичного уровня.
ВТОРИЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ.
Вторичный уровень организации создается за счет возникновения водородных связей, которые образуются между атомами О2 и Н2 разных пептидных группировок. Количество водородных связей определяет регулярность и нерегулярность вторичной структуры.
Регулярная структура определена большим количеством водородных связей и с этой точки зрения выделяют две структуры:
А – спираль
В – складчатый слой.
В А-спирали количество водородных связей наибольшее, однако, водородные связи возникают не чаще, чем между первым и четвертым аминокислотным остатком.
Трансположение атомов кислорода и водорода в пептидной группе приводит к тому, что молекула принимает вид правильной спирали.
А-спирали гидрофобны, поэтому они могут взаимодействовать друг с другом за счет гидрофобных связей. Именно поэтому А-спирали образуют трансмембранные домены белков.
В- складчатый слой, также образуется за счет водородных связей между пептидными группировками, однако эти связи более редкие, чем в А-спирали. Небольшое количество водородных связей в полипептиде определяет нерегулярную вторичную структуру, причем в одном белке могут быть участки, имеющие как регулярное, так и нерегулярное строение.
На регулярность строения белковой молекулы влияет характер и длинна радикала. С этой точки зрения все аминокислоты делятся на 2 группы:
Способствующие аминокислоты
Препятствующие аминокислоты
Дестабилизирующие аминокислоты (аминокислота пролин)
На вторичном уровне организации некоторые белки могут быть функциональноактивны, например коллаген и эластин белки рыхлой и плотной соединительной ткани, а также актин и миозин, это двигательные белки.
ТРЕТИЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ.
Третичный уровень организации возникает между радикалами аминокислотных остатков. Радикалы могут связываться за счет водородных гидрофобных электростатических взаимодействий, а также могут возникать ковалентные дисульфидные мостики, возникают в том случае, если в полипептидной цепи присутствует аминокислота цистеин.
На основе А-спирали формируют фибриллы, а на основе В-складчатого слоя формируют глобулы. Практически все белки на третичном уровне организации функциональны. На третичном уровне организации функциональны биологические катализаторы или ферменты.
ЧЕТВЕРТИЧНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ.
Не является универсальным и характерен для немногих белков. На этом уровне организации белки состоят из нескольких полипептидных цепей, связаны нековалентными связями.
Полипептиды, входящие в состав четвертичной структуры получили название субьединицы или протомеры. Минимально 2 цепи – максимально – 10 цепей. Гемоглобин состоит из 2 А и 2 В цепей. К+/Na+ — насос, коровые частицы.
Для белков с третичным и четвертичным уровнем организации характерно явление временной или постоянной утраты функциональной активности это явление получило название денатурация, при денатурации за счет перехода на более низкий уровень организации, например на вторичный. Денатурация бывает обратимая и необратимая, причем факторы, вызывающие ее, разнообразны, например действие химических агентов, изменение РН, температура и давление.
Обратимая денатурация характерна для многих белков ферментов и является одним из механизмов регуляции их активности. При обратимой денатурации возможен обратимый переход белка в исходное состояние. Процесс перехода белка в исходное состояние называется денатурацией. Примером необратимой денатурации является очень редкая аллергическая реакция на наркоз, которая называется злокачественная гипертермия. Разрушение первичной структуры белка до аминокислотных остатков называется протеолизом.
Функции белков.
-
каталитическая или ферментативная. (См. далее)
-
транспортная функция. Ее выполняют белки плазмы крови, например, гемоглобин, выполняет газотранспортную функцию, многие альбулины и глобулины плазмы транспортируют жирные кислоты витамины, лекарственные препараты ионы металлов. Например, белок феритин транспортирует железо. На мембране клеток локализовано большое количество переносчиков, которые транспортируют в клетку и из нее ионы, аминокислоты, глюкозу и т.д. примером является К+/Na+ — насос, Са2+ — насос, протонные помпы, переносчики для глюкозы и аминокислот.
-
структурная. В соединительной ткани выполняется каллогеном и эластином, кроме того, в самих клетках существует так называемые скелетные фибриллы, которые определяют структуру клетки. К ним относятся белки кадгерины.
-
двигательная. Ее осуществляют двигательные белки актин и миозин, создавая в клетке актомиозиновую систему. Особенно хорошо она развита в клетках поперечно исчерченной мускулатуры
-
рецепторная. Ее выполняют белковые молекулы, которые локализованы в наружной мембране клеток. Они могут соединятся с сигнальными молекулами и изменять свою конформацию и передавать сигнал в клетку.
-
защитная. Выполняют иммуноглобулины или антитела, которые препятствуют внедрению в организм любых антигенов. Некоторые клетки выделяют белки лейкины, лейцины и плакины, которые обладают бактерицидным действием. Белки системы свертывания крови препятствуют внезапным кровопотерям. Кроме того, в плазме крови существует две крупные белковые фракции, которые участвуют в работе иммунной системы. Эта система комплемента и пропердиновая система.
-
индивидуализационная. Ее выполняют белки, локализованные на мембране наиболее известным системным антигеном является резус фактор
RH+ — белок на мембране эритроцитов есть
RH— — белок на мембране эритроцитов отсутствует.
-
регуляторная. Большое количество гормонов имеют пептидную природу, например гормоны гипофиза и гормоны поджелудочной железы или инсулин. Кроме того, многие белки в плазме крови способны определять и регулировать ее физико-химические свойства, например онкотическое давление, суспензионная устойчивость, полиоидную стабильность. Буферные свойства крови, т.е. поддержание постоянного Рh. Все эти свойства определяет наличие белков альбуминов в плазме.
-
контактная. Белки, входящие в состав наружных мембран клеток при взаимодействии друг с другом обеспечивают формирование межклеточных контактов, к таким белкам относятся кадгерины.
-
ингибиторная. Многие пептиды входят в состав антибиотиков.
-
токсическая. Многие пептиды и белки входят в состав различных ядов, например ферменты фосфолипазы встречаются в составе ядов змей (кобра) и токсине холерного вибриона.
-
депонирующая. У животных белки практически не запасаются, а могут запасаться только в яйцеклетках в виде фосфопротеинов. У растений белки могут запасаться в виде гранул. У растений основной запас белков создается в семенах.
-
энергетическая. Выполняется аминокислотами, но существует ряд трудностей связанных с наличием аминогруппы.
АК —— карбоновые кислоты —— nC2 ——- Н2О + СО2
АДФ+ФН ——АТФ
При превращении аминокислот в карбоновые кислоты возможно две ситуации:
-
могут пройти реакции дезаминирования, при этом образуется аммиак, который является крайне токсическим соединением.
-
возможны реакции переаминирования, при этом аминогруппа переносится на другую органическую молекулу, однако этот процесс требует затраты энергии.
КАТАЛИТИЧЕСКАЯ ФУНКЦИЯ БЕЛКА.
Основной функцией белков в клетки является каталитическая или ферментативная, т.е. белки в клетке выполняют роль катализаторов реакций. Помимо белков в клетке функцию катализаторов могут выполнять некоторые нуклеиновые кислоты, например малые ядерные РНК в этом случае эти кислоты называются рибозимы. С т.з. термодинамики в клетке могут проходить два типа реакций:
Спонтанные реакции, они идут без затраты энергии — это реакции распада ионив проходят с понижением свободной энергии вещества;
Реакции, которые не могут походить спонтанно для них требуется затрата энергии и к ним относятся реакции синтеза;
| G1>G0 |
|
G1<G0 |
Одной из функций ферментов являются сопряженные реакции синтеза с реакциями распада, кроме того, при физиологически нормальных температурах все реакции в клетке протекают очень медленно, для ускорения реакций в организме необходимы ферменты или катализаторы. В клетке химические вещества существуют в стабильном состоянии.
* S1 —- S2
Для того чтобы перевести биохимические реакции необходимо субстрат перевести в так называемое метастабильное состояние.
S1 —S1* —- S2
Переводом в метастабильное состояние занимаются ферменты. Практически для всех ферментов характерна так называемая субстратная специфичность. Это значит, что фермент будет работать на субстрате, к которому у него определена доля сродства. Субстратная специфичность объясняется тремя гипотезами, две из которых имеют историческое значение.
-
гипотеза или теория Фишера или гипотеза полного стерического соответствия. По гипотезе Фишера фермент подходит к субстрату как «ключ к замку». Это эта гипотеза не объясняет конформационные изменения входе его работы на субстрате.
-
гипотеза Кошланда или гипотеза неполного стерического соответствия по ней фермент подходит к субстрату как «перчатка к руке». Эта гипотеза не объясняет конформационные изменения субстрата.
-
гипотеза «трех точек» или неполного стерического соответствия, по этой гипотезе в любом ферменте существует активный центр, который можно разделить на: каталитический, необходимый для связывания фермента и субстрата, регуляторный, необходимый ля регуляции активности ферментов.
Присоединение фермента к каталитическому центру вызывает изменение его конформации, затем следует конформационные изменения регуляторного центра, который приводит к вторичному изменению конформации каталитического центра, после чего следуют конформационные изменения субстрата. На этом этапе для фермента и субстрата характерно полное стерическое соответствие. Субстрат переводится в метастабильное состояние, на нем протекают химические реакции, и он превращается в субстрат2 . т.к. соответствие между ферментом и субстратом2 отсутствует, субстрат2 выходит из каталитического центра.
Фер1 + S1 —Фер1S1 ——Фер1* S1 —- Фер1* S1*— Фер1*S2 —Фер1* +S2
С точки зрения регуляции активности существует два возможных варианта:
-
активация работы ферментов.
Активация в простейшем варианте может быть связана с присоединением к ферменту фосфатного остатка, который образуется за счет отщеплении его от молекулы АТФ. В этом случае говорят, что фермент обладает АТФ-азной активностью, т.е. способен расщеплять молекулу АТФ и изменять свою конформацию. В этом случае если фермент был неактивен, то присоединение фосфатного остатка может привести к открыванию каталитического центра и фермент начинает работать на субстрате. Если фермент был неактивен и содержал фосфатную группу, то отщепление фосфатной группы может привести к его активации. Присоединение фосфатной группы к ферменту называется фосфолилирование, а отщепление фосфатного остатка – дефосфолилирование. Активация работы фермента возможно только за счет расщепления молекул АТФ без присоединения фосфатного остатка. В этом случае изменение конформации фермента осуществляется только за счет энергии АТФ. Многие ферменты не могут выполнять каталитическую функцию без определенных небелковых сигнальных молекул, которые называются коферменты. Такие ферменты называются апоферментами, а их белковая часть – холоферментами. С коферментом часто связаны оксидоредуктазы.
Поскольку КоФер может изменяться входе реакции, то по механизму реакции он является КоСубстратом.
Активация работы фермента возможна благодаря аллостерическими взаимодействиям фермента с определенными сигнальными молекулами. Для таких взаимодействий на ферменте существуют специальные аллостерические центры, причем эти центры могут быть связаны с активным центром, а могут находится от него недостаточном отдалении. Один фермент может содержать несколько аллостерических центров. В качестве сигнальных молекул могут выступать ионы Са2+, ДАГ, циклическ. молекулы АМФ
-
ингибирование работы ферментов.
неконкурентное ингибирование (см. активацию), конкурентное.
Конкурентное ингибирование. При нем фермент может связываться не только с субстратом, но и с его аналогом. При этом аналог закрывает каталитический центр, однако фермент не может перевести его в метастабильное состояние и, следовательно, реакции на аналоге субстрата не проходят. Связывание фермента с аналогом происходит только при недостатке субстрата. В клетке. Сродство фермента к субстрату значительно больше, чем его сродство к аналогу, поэтому при накоплении субстрата в клетке комплекс фермент с аналогом диссациирует. Работа фермента зависит от многих физических и химических факторов клетки, в частности от температуры, давления. Рh среды. При действии некоторых факторов, например, температуры возможно обратимое ингибирование ферментов. Изменение Рh среды также приводит к ингибированию работы ферментов, например ферментов группы пепсины работают в желудке в кислой среде и их работа ингибируется в 12-типерстной кишке в щелочной среде.
Помимо субстратной специфичности фермент обладает групповой специфичностью (существуют реакции, которые катализируются данной группой ферментов) с точки зрения номенклатуры выделяют 6 классов ферментов:
-
оксидоредуктазы, катализируют окислительно-восстановительные реакции, к ним относятся различные дегидролазы (отнимают Н), оксидазы (отнимают О)
-
трансферазы. Эти ферменты катализируют перенос химических групп, например трансоминазы (переносят аминогруппы), фосфолипазы (переносят фосфатный остаток)
-
гидролазы эти ферменты катализируют реакции гидролиза, к ним относятся липазы, амилазы, пептидазы, нуклеазы.
-
Лиазы это ферменты, которые могу отщеплять различные функциональные группы, т.е. расщеплять прочные ковалентные связи, часто отщепление боковых групп приводит к двойных связей в молекуле, примером является дикарбоксилаза
-
Изомеразы катализируют реакции изомеризации, к ним относится ферменты мутазы, изомеразы.
-
Липазы это ферменты способные образовать ковалентные связи с использованием энергии АТФ, например синтетазы.
Введение в биохимию. Строение и функции белков
КУБАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ
УНИВЕРСИТЕТ
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ
БИОХИМИИ
Лекция по биохимии
Тема:
ВВЕДЕНИЕ в БИОХИМИЮ.
Строение и функции белков
КРАСНОДАР
2015
2. БИОХИМИЯ –
наука, изучающая химический состав
живых организмов, химические
процессы, которые лежат в основе
жизнедеятельности и обеспечивают
организму сложную морфологическую
целостность и высокую
функциональную активность
3. ГЛАВНАЯ ЗАДАЧА БИОХИМИИ –
ПОЗНАНИЕ ХИМИЧЕСКИХ
ОСНОВ ЖИЗНИ, УСЛОВИЙ
И МЕХАНИЗМОВ ЕЁ
ВОЗНИКНОВЕНИЯ И
РАЗВИТИЯ
4. Метаболизм –
совокупность химических
превращений веществ от
момента поступления их в
клетку до выделения
конечных продуктов
5. Метаболизм
Катаболизм –
Анаболизм –
совокупность
поэтапных
ферментативных
процессов
расщепления сложных
молекул до простых.
Идет с
высвобождением
энергии –
экзэргонический
процесс
совокупность
поэтапных
ферментативных
процессов построения
сложных веществ из
более простых
предшественников.
Идет с затратой
энергии,
эндэргонический
процесс
6. БЕЛКИ (протеины) –
ВЫСОКОМОЛЕКУЛЯРНЫЕ
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ
СОЕДИНЕНИЯ, МАЛО
ОТЛИЧАЮЩИЕСЯ ПО
ЭЛЕМЕНТАРНОМУ СОСТАВУ, НО
РЕЗКО ОТЛИЧАЮЩИЕСЯ ПО
ХИМИЧЕСКОМУ СОСТАВУ,
СТРОЕНИЮ, СВОЙСТВАМ,
ФУНКЦИЯМ И СОСТАВЛЯЮЩИЕ
ОСНОВУ ВСЕГО ЖИВОГО
7. Функции белков
• Каталитические
(ферменты)
Регуляторные
(гормоны)
Рецепторая (мембранные,
цитозольные и др. рецепторы)
Транспортные (Нb,
трансферрин)
Защитные
(Ig, шапероны)
Сократительные
8. Элементарный состав белков (%)
Углерод
Кислород
Азот
Водород
Сера
50,5-54,5
21,5-23,5
15,0-17,6
6,5-7,3
0,5-2,5
9. БЕЛКИ –
биополимеры, структурными
единицами которых
(мономерами) являются
α-аминокислоты, соединённые
между собой пептидными
связями. 20 аминокислот, из
которых построены все белки,
называются протеиногенными.
10. Строение протеиногенных аминокислот
α
R СН COOH
,
NH
2
11. Пептидная связь
h3N СН COOH +
h3N СН COOH
СН2
Ch4
аланин
OH
серин
Н2О
h3N СН CO NH СН COOH
Ch4
СН2
OH
пептидная связь
аланилсерин
12. Классификация производных аминокислот
2-10 аминокислотных остатков
– пептид,
10-100 ─» ─ полипептид,
> 100
─» ─ белок
Молекулярная масса белков
от 10000 Да до нескольких миллионов Да
13. Первичная структура белка
n
радикалы
аминокислот
N-конец
С-конец
14. Первичная структура определяет:
Физико-химические свойства (размер,
массу, растворимость, заряд и т.д.)
Все последующие уровни структурной
организации белка, а следовательно
Биологическую активность белка
Видовую и тканевую специфичность
белка
15. Закономерности первичной стуктуры
1. Чем важнее роль белка в процессах
жизнедеятельности, тем
разнообразнее его аминокислотный
состав (и, наоборот, чем примитивнее
функция белка, тем беднее его
«аминокислотная корзина»)
16. Строение молекулы инсулина
S
S
21 ак
А-цепь
(21 ак)
S
S
S
S
В-цепь
(30 ак)
30 ак
17. Структура молекулы коллагена
от 1050 ак
Gly
Arg
Hyp
Gly
Gln
Arg
Gly
Pro
Hyp
Gly
Pro
Gln
Gly
Ala
Arg
Gly
X
Y
18. Строение эластина
Гли – 27%
Ала – 19%
Вал – 10%
Лей – 1,7%
растяжение
отдельная
молекула белка
сокращение
сшивки
19. Закономерности первичной стуктуры
2. Чем важнее роль белка в процессах
жизнедеятельности, тем больше
сходство первичных структур
гомологичных белков (гомологичные
белки – белки, выполняющие одну и
ту же функцию у разных видов
животных)
20. Закономерности первичной стуктуры
3. Чем ближе расположены виды на
эволюционной лестнице, тем больше
сходство первичных структур
гомологичных белков
21. Различия аминокислотного состава инсулина
Инсулины
Номер аминокислот в цепи А
8
9
10
Бык
Ала
Сер
Вал
Свинья
Тре
Сер
Иле
Овца
Ала
Гли
Вал
Лошадь
Тре
Гли
Иле
Человек
Тре
Сер
Иле
Цыпленок
Гис
Асп
Тре
Утка
Глу
Асп
Про
22. Различия аминокислотного состава цепи β гемоглобина человека
тип
гемоглобина
Остатки аминокислот
1
2
3
4
Hb A Вал
Гис
Лей
Тре
Hb S
Вал
Гис
Лей
Hb C Вал
Гис
Hb G Вал
Гис
5
6
7
8
Про
Глу
Глу
Лиз
Тре
Про
Вал
Глу
Лиз
Лей
Тре
Про
Лиз
Глу
Лиз
Лей
Тре
Про
Глу
Гли
Лиз
23. Методы изучения I структуры белка
Методы «меток» – определение
концевых аминокислот (методы
Сэнджера, Эдмана, Акабори,
дансильный)
Гидролиз
Хроматография
Секвенирование
24. Методы изучения I структуры белка
гидролиз
по характеру
катализатора
по глубине
по условиям
полный
неполный
мягкий
(ферменты,
t≈36ºC,
нормальное
давление)
жёсткий
(высокая
температура,
кислоты, щёлочи)
кислотный
щелочной
нейтральный
(ферментативный)
Вторичная структура белка
представляет собой способ укладки I структуры
в виде:
α-спирали
β-структуры
удерживается водородными связями
26. Вторичная структура белка
Первичная
структура
α-спираль
β-структура
Вторичная структура
27. β-структура
N-конец
N
C
C
N
С-конец
28. Вторичная структура
α-спираль
57%
β-структура
16%
неупорядоченная
структура 27%
29. Формирование третичной структуры белка
30. Третичная структура
31. Форма белковых молекул
Глобулярные (шарообразные)
Фибриллярные (нитевидные)
фибрилла
глобула
32. Связи, характерные для третичной структуры
33. Доменное строение глобулярных белков
Домен – часть полипептидной цепи,
сходная с самостоятельным глобулярным
белком
β-структура
α-спираль
34. Формирование четвертичной структуры белка
35. Олигомерная молекула гемоглобина
субъединицы
(протомеры)
36. Важнейшие свойства белков:
Способность к специфическим
взаимодействиям (образование
белково-лигандных комплексов)
Способность к самосборке
(образование надмолекулярных
структур)
37. Образование белково-лигандного комплекса
Образование белковолигандного комплекса
Происходит только в определённом
месте белка, который называется
центр связывания (или активный
центр)
Взаимодействие высокоизбирательно
Быстрое насыщение
Взаимодействие обратимо
Образование белковолигандного комплекса
лиганд
+
активный
центр
белок
Фермент (Е) + субстрат (S)
Гормон (Г) + рецептор (Р)
Актин (А) + миозин (М)
Антитело (Ат) + антиген (Аг)
белково-лигандный
комплекс
ЕS–комплекс
ГР–комплекс
АМ–комплекс
Ат-Аг–комплекс
39. Надмолекулярные структуры
Синтетаза
жирных кислот
Микротрубочки
40. Различие белкового состава органов и тканей
Орган, ткань
Белки
Мышцы
Соединительная
ткань
Эритроциты
Плазма крови
Актин, миозин
Коллаген, эластин
Печень
Гемоглобин
Фибриноген, альбумины,
иммуноглобулины
Ферритин, ферменты
цикла
мочевинообразования
41. Типы классификации белков
По форме
молекулы.
По физикохимическим
свойствам.
По
происхождению.
По
42. Классификация по функциям
Каталитические
(ферменты)
Регуляторные
(гормоны)
Транспортные (Нb,
трансферрин)
Защитные
(Ig,
шапероны)
Сократительные
43. Химическая классификация белков п Белки (протеины)
Простые
(гомопрот
еины)
Только
аминокис
лоты
Сложные
(гетеропр
отеины)
Апопротеи
н (ак) +
простетич
еская
Химическая классиф
Простые:
Сложные:
Альбумины;• Нуклеопро
Глобулины; теины;
Проламины;• Хромопрот
Глютелины; еины;
Протамины;• Гликопрот
еины;
Гистоны;
• Фосфопрот
Склеропроте
еины;
ины
• Липопроте
45. Классификация белков по семействам
Сериновые
протеиназы
Шапероны
Иммуноглобулины
46. Структура IgG человека
48. Шапероны
Полипептид,
синтезирующийся на
рибосоме
Нативный белок
49. Методы количественного определения белков
Прямые
Непрямые
Гравиметри (по азоту
ческие;
Колориметр
ические;
Оптические:
нефелометри
50. Методы выделения и очистки белков
Гомогениза
ция;
Экстракция
;
Высаливани
е;
Диализ;
Аудиокурс Биохимия [Электронный ресурс]. : лекции для студентов : белки, ферменты, матричные биосинтезы, мембраны, энергетический обмен, углеводы, межклеточный матрикс, алкоголизм, липиды, атеросклероз, аминокислоты, нуклеотиды, гормоны, детоксикация ксенобиотиков, биохимия крови, свертывание крови : [Звукозапись] :
Поиск по определенным полям
Чтобы сузить результаты поисковой выдачи, можно уточнить запрос, указав поля, по которым производить поиск. Список полей представлен выше. Например:
author:иванов
Можно искать по нескольким полям одновременно:
author:иванов title:исследование
Логически операторы
По умолчанию используется оператор AND.
Оператор AND означает, что документ должен соответствовать всем элементам в группе:
исследование разработка
author:иванов title:разработка
оператор OR означает, что документ должен соответствовать одному из значений в группе:
исследование OR разработка
author:иванов OR title:разработка
оператор NOT исключает документы, содержащие данный элемент:
исследование NOT разработка
author:иванов NOT title:разработка
Тип поиска
При написании запроса можно указывать способ, по которому фраза будет искаться. Поддерживается четыре метода: поиск с учетом морфологии, без морфологии, поиск префикса, поиск фразы.
По-умолчанию, поиск производится с учетом морфологии.
Для поиска без морфологии, перед словами в фразе достаточно поставить знак «доллар»:
$исследование $развития
Для поиска префикса нужно поставить звездочку после запроса:
исследование*
Для поиска фразы нужно заключить запрос в двойные кавычки:
«исследование и разработка«
Поиск по синонимам
Для включения в результаты поиска синонимов слова нужно поставить решётку «#» перед словом или перед выражением в скобках.
В применении к одному слову для него будет найдено до трёх синонимов.
В применении к выражению в скобках к каждому слову будет добавлен синоним, если он был найден.
Не сочетается с поиском без морфологии, поиском по префиксу или поиском по фразе.
#исследование
Группировка
Для того, чтобы сгруппировать поисковые фразы нужно использовать скобки. Это позволяет управлять булевой логикой запроса.
Например, нужно составить запрос: найти документы у которых автор Иванов или Петров, и заглавие содержит слова исследование или разработка:
author:(иванов OR петров) title:(исследование OR разработка)
Приблизительный поиск слова
Для приблизительного поиска нужно поставить тильду «~» в конце слова из фразы.4 разработка
По умолчанию, уровень равен 1. Допустимые значения — положительное вещественное число.
Поиск в интервале
Для указания интервала, в котором должно находиться значение какого-то поля, следует указать в скобках граничные значения, разделенные оператором TO.
Будет произведена лексикографическая сортировка.
author:[Иванов TO Петров]
Будут возвращены результаты с автором, начиная от Иванова и заканчивая Петровым, Иванов и Петров будут включены в результат.
author:{Иванов TO Петров}
Такой запрос вернёт результаты с автором, начиная от Иванова и заканчивая Петровым, но Иванов и Петров не будут включены в результат.
Для того, чтобы включить значение в интервал, используйте квадратные скобки. Для исключения значения используйте фигурные скобки.
Белки (протеины) | Биохимия. Реферат, доклад, сообщение, кратко, презентация, лекция, шпаргалка, конспект, ГДЗ, тест
Белки, или протеины, необходимы для жизнедеятельности всех клеток любого организма. Поверхностный комплекс клетки, все её внутренние структуры построены с участием молекул белков. Из всех органических веществ они составляют наибольшую массу в клетке (50-70%).
В состав белков входят углерод, кислород, водород и азот. Некоторые белки содержат ещё серу. Все белки являются полимерными соединениями, мономерами которых являются аминокислоты.
Между собой аминокислоты соединены пептидными связями в длинную цепь, образуя первичную структуру белка (рис. 82) (она отображает химическую формулу белка). Полипептидная цепь обычно закручивается в спираль — это вторичная структура белка, затем ещё скручивается, образуя комочек (глобулу) — третичную структуру белка. Несколько молекул белка, объединяясь между собой, могут создавать четвертичную структуру белка. Например, у гемоглобина молекула состоит из четырёх сложным образом свёрнутых полипептидных цепей.
В зависимости от формы белковой молекулы различают фибриллярные и глобулярные белки. Фибриллярные белки выполняют преимущественно опорную или защитную функции, а глобулярные — динамическую функцию в клетке. К глобулярным белкам относятся ферменты, некоторые гормоны и многие транспортные белки. От определённой пространственной ориентации полипептидной цепи в глобуле зависит специфичность и биологическая активность белка.
В зависимости от состава различают простые белки — протеины (состоят только из аминокислот) и сложные белки — протеиды, в состав которых наряду с аминокислотами входят углеводы или липиды, нуклеиновые кислоты или металлы и др.
| Рис. 82. Структура молекулы белка: а — первичная; б — вторичная; в — третичная; г — четвертичная |
Белки в клетках, постоянно обновляясь, стимулируют обмен веществ живой клетки. Материал с сайта http://doklad-referat.ru
Функции белков в клетках очень разнообразны. Белки участвуют в строении клетки и во всех процессах её жизнедеятельности. Входя в состав клеточных структур, они выполняют строительную (пластическую) функцию. Молекулы белка образуют клеточный скелет, обеспечивают транспортировку веществ внутри клетки и между клетками. Специальные белки (миозин, актин и др.) осуществляют движения клеток, образуют антитела, которые наряду с регуляторными выполняют и защитные функции. Но особенно важную роль в живой материи играют белки-ферменты (лат. fermentum — «брожение», «закваска»).
Белки — важнейшие биологические молекулы, без которых жизнь невозможна.
На этой странице материал по темам:
-
Белки доклад кратко
-
Доклад про протеины
-
Сообщение про протеины реферат
-
Белки протеины доклад
-
Тема белки анатомия доклад
Вопросы по этому материалу:
-
Чем характеризуются молекулы белка?
Структура белка — Краткие конспекты лекций | Класс Easy Biology
Цели обучения: Структура белка: первичная структура, вторичная структура (альфа-спираль, бета-пластины, бета-повороты), третичная структура, четвертичная структура, связи, стабилизирующие различные белковые структуры.
Структура белка
Ø Белки представляют собой полимеры аминокислот. Отдельные аминокислоты (остатки) соединены пептидными связями с образованием линейной полипептидной цепи.Эта линейная полипептидная цепь свернута в конкретные структурные конформации или просто «структура ». Белок может иметь до четырех уровней структурных конформаций. Ранее мы обсуждали, кроме «связей , участвующих в структуре белка ». В этом посте мы обсудим различные типы белковых структур.
Ø Белок может иметь Четыре уровня структурной организации :
Ø Они обозначаются как:
(1).Первичная структура
(2). Вторичная структура
(3). Третичная структура
(4). Четвертичная структура
Ø Вторичная, третичная и четвертичная структура вместе называются трехмерной (3D) структурой белка.
Ø Все функциональные белки будут иметь до 3 (третичный уровень) структур.
Ø Некоторые белки имеют все 4 уровня структур (вплоть до четвертичной структуры).
(1). Первичная структура
Ø Первичная структура белка дает подробную информацию об аминокислотной последовательности белка.
Ø Первичная структура расскажет вам о двух основных вещах: (i) число аминокислотных остатков в белке и (ii) последовательность аминокислот .
Ø Информация о «последовательности» содержит правильный порядок аминокислот в белке, начиная с N-конца до C-конца.
Ø Первичная структура белка будет определять все другие уровни структурной организации белка (вторичный, третичный и четвертичный).
Ø Первичная структура стабилизирована Peptide Bonds ( Covalent Bond ).
Ø Первым исследованием неизвестного белка будет определение его последовательности (определение первичной структуры).
Ø Первый секвенированный белок: Инсулин от Frederick Sanger .
Первичная структура инсулина
Важность первичной структуры:
Ø Первичная структура белка даст представление о его:
(a). Трехмерная структура (3D)
(б). Функция белка
(в). Сотовая связь , адрес
(д). Эволюция белка
Ø Данные первичной структуры могут использоваться для поиска последовательности из баз данных белков .
Трехмерные структуры белков
Ø Каркас белка содержит сотни отдельных связей .
Ø Вокруг многих из этих связок возможно свободное вращение.
Ø Свободное вращение допускает неограниченное количество конформаций вокруг этих связей.
Ø Однако каждый белок имеет специфическую (уникальную) структурную конформацию .
Ø Это уникальное структурное образование белка называется его трехмерной структурой .
Ø Пространственное расположение атомов в белке называется «Конформация ».
Ø Белки в их функциональной складчатой конформации называются нативными белками .
Ø Конформации белка в основном стабилизируются слабыми взаимодействиями, такими как водородных связей, , гидрофильных взаимодействий, гидрофобных взаимодействий и т. Д.
Ø Эти слабые взаимодействия могут быть легко искажены с меньшими затратами энергии.
Ø Белки могут иметь три уровня трехмерных (3D) организаций.Это:
Вторичная структура
Третичная структура
Четвертичная структура
(2). Вторичная структура
Ø Вторичная структура — это особая локальная конформация некоторой части полипептидной цепи.
Ø Это складчатость обычного полипептидного остова.
Ø В природе встречаются разные типы вторичных структур.
Ø Вторичные конструкции в основном стабилизированы водородными связями .
Ø Три наиболее важные вторичные структуры в белке:
A. α-Helix
B. β-конформации (β-пластины)
C. β-витки
(A) . α-спираль
Ø α-спираль — наиболее распространенная вторичная структура.
Ø Это правильные структуры, повторяющиеся через каждые 5,4 Å.
Ø Это простейшее расположение полипептидной цепи.
Ø α-спиральная структура белка была предложена Полингом и Кори в 1951 году.
Ø Каркас полипептида плотно намотан вокруг воображаемой оси, проведенной продольно через середину спирали, а R-группы аминокислотных остатков выступают наружу из спирального каркаса.
Ø Шаг спирали: Повторяющийся элемент спирали.
Ø Шаг — это один виток спирали, который простирается примерно на 5,4 Å.
Ø Каждый виток α-спирали содержит 3,6 аминокислот.
Ø Спираль α-спирали во всем белке правосторонняя .
Ø α-спираль стабилизирована водородными связями .
Ø α-Спираль так часто встречается в белках, потому что она оптимально использует внутренние водородные связи.
Ø Водородные связи образуются между водородом, присоединенным к электроотрицательному атому азота пептидной связи, и электроотрицательным карбонильным атомом кислорода четвертой аминокислоты на аминоконцевой стороне пептидной связи.
Ø Внутри α-спирали каждая пептидная связь участвует в водородной связи.
Ø Все водородные связи вместе обеспечивают значительную стабильность α-спирали.
Ø Все полипептиды не могут образовывать α-спираль соболя.
Ø Взаимодействия между боковыми цепями аминокислот могут стабилизировать или дестабилизировать α-спираль.
Ø Например, если полипептидная цепь имеет длинный участок остатков глутаминовой кислоты, этот сегмент цепи не будет образовывать α-спираль.
Ø Отрицательно заряженная карбоксильная группа соседних остатков Glu сильно отталкивается друг от друга, так что они предотвращают образование α-спирали.
Ø Подобным образом полипептид, богатый пролином , не будет образовывать α-спираль.
Ø В пролине атом азота является частью жесткого кольца, и вращение вокруг связи N — Cα НЕВОЗМОЖНО.
Ø Таким образом, пролин вводит дестабилизирующий излом в полипептид, и, следовательно, пролин очень редко обнаруживается в α-спирали.
β-конформации (β-пластины)
Ø β-конформация или β-пластины организуют полипептидные цепи в листов .
Ø β-конформация представляет собой удлиненную форму полипептидной цепи.
Ø Здесь полипептидный каркас расширен в зигзагообразную структуру .
Ø Зигзагообразные полипептидные цепи могут быть расположены бок о бок, образуя структуру, напоминающую серию складок, называемых β-листами.
Ø Здесь также структура стабилизирована водородными связями .
Ø Однако, в отличие от α-спирали, водородные связи образуются между соседними сегментами цепи.
Ø R-группы соседних аминокислот выступают из зигзагообразной структуры в противоположном направлении, создавая чередующийся узор.
Ø Полипептидные цепи в β-листах могут быть расположены либо параллельно (в одном направлении), либо антипараллельно (в противоположном направлении).
Ø На основании этого β-пластины подразделяются на два типа: (диаграмма)
(a) Противопараллельные β-пластины
(b) Параллельные β-пластины
(С).β-Повороты:
Ø β-витки очень распространены в белках, где пептид делает поворот или петлю (пептид делает обратное направление).
Ø В глобулярных белках почти треть аминокислотных остатков находится в β-поворотах.
Ø β-витки — это соединительные элементы, которые связывают последовательные участки полипептидной цепи.
Ø β-виток соединяет концы двух соседних сегментов встречно-параллельных β-листов.
Ø Структура β-витка представляет собой поворот на 180º с участием четырех аминокислотных остатков
Ø Карбонильный кислород первого остатка образует водородную связь с водородом аминогруппы четвертой аминокислоты в свою очередь.
Ø Глицин (Gly) и пролин (Pro) часто встречаются в β-поворотах.
Ø Глицин из-за его очень маленького размера (группа R — H) допускает β-повороты.
Ø Пролин представляет собой иминокислоту, боковая цепь которой ковалентно связана с аминогруппой.
Ø Остаток пролина в пептидной связи предполагает конфигурацию ‘cis’ .
Ø Конформация ‘cis’ хорошо поддается крутым поворотам.
Ø Существует несколько типов β-витков с типом I и типом II, которые являются наиболее распространенными.
Ø β-виток типа I встречается более чем в два раза чаще, чем тип II.
Ø В типе II третий остаток всегда будет остатком глицина.
(3). Третичная структура Белки
Ø Третичная структура: Общее трехмерное расположение всех атомов в белке называется третичной структурой.
Ø Третичная структура будет иметь один полипептидный «каркас» с одной или несколькими вторичными структурами.
Ø Третичная структура определяется атомными координатами .
Ø Третичные структуры в белке стабилизируются как ковалентными, так и нековалентными связями.
Ø Ковалентная связь: Дисульфидные связи (между двумя остатками Cys)
Ø Нековалентные взаимодействия: Ионные взаимодействия (электростатическое притяжение), гидрофильные взаимодействия, Ван-дер-Ваальсовы взаимодействия.
Ø Термин « Домен » используется для обозначения отдельной функциональной единицы белка.
Ø Белок может иметь множество доменов со специфическими функциями.
Ø Белок с одной субъединицей имеет только третичную структуру.
(4). Четвертичная структура
Ø Большинство функциональных белков содержит более одной полипептидной цепи, и такой белок называется олигомерным .
Ø Каждый пептид образует субъединицу или мономер или протомер .
Ø Четвертичная структура: Расположение белковых мономеров в трехмерных комплексах в многосубъединичном белке называется четвертичной структурой.
Ø Чтобы белок имел четвертичную структуру, он должен удовлетворять двум условиям:
§ Он должен иметь более одной полипептидной субъединицы
§ Не должно быть постоянного (ковалентного) взаимодействия между субъединицами (например, дисульфидная связь).
Ø Инсулин не имеет четвертичной структуры, даже если он содержит две субъединицы.
Ø Два полипептида в инсулине ковалентно связаны двумя дисульфидными связями.
Ø Таким образом, инсулин может иметь третичную структуру (не четвертичную).
Ø Связи, стабилизирующие четвертичную структуру: водородные связи, гидрофильные взаимодействия, гидрофобные взаимодействия, ван-дер-ваальсовы взаимодействия.
Обзор :
Ссылка
Нельсон, Д.Л., Ленингер, А.Л. и Кокс, М.М., 2008. Принципы биохимии Ленингера. Макмиллан.
Обучение офлайн (без Интернета)
Теперь вы можете Скачать PDF этого сообщения Абсолютно бесплатно!
Щелкните ссылку для скачивания / Кнопка ниже, чтобы сохранить сообщение как единый файл PDF.PDF-файл откроется в новом окне в самом браузере. Щелкните правой кнопкой мыши PDF-файл и выберите опцию « Сохранить как », чтобы сохранить файл на свой компьютер.
Пожалуйста, Поделитесь PDF-файлом со своими друзьями, родственниками, студентами и коллегами…
Есть ли у вас какие-либо вопросы?
Пожалуйста, оставьте меня в разделе комментариев ниже.
Я буду рад прочитать ваши комментарии и ответы.
Вам также могут понравиться…
@.Protein Structure PPT (Загрузить)
@. Связи, участвующие в структуре белка
@. Классификация белков на основе структуры и функций
Дополнительные примечания к лекциям по биохимии…
Совместное использование — это забота … Пожалуйста, поделитесь с друзьями …
|
Лекция 1а — Основы биохимии 2,8 МБ Лекция 1б — 2.95 МБ Лекция 2 — Термодинамика и химическое равновесие. 53 МБ Лекция 3 — Молекулы и вода 2.28 МБ Лекция 4 — Кислоты и основания 813 КБ Лекция 5 — Аминокислоты 1,45 МБ Лекция 6 — Структура белка 4,45 МБ Лекция 7 — Очистка белков 3,21 МБ Лекция 8 — Эволюция и анализ белков 2,4 МБ Лекция 9 — «Обзорная сессия без заметок по курсу» Лекция 10 — Вторичная структура белка 1.25 МБ Лекция 11 — Вторичная структура белка II 2,45 МБ Лекция 12а — Структура белка 2,02 МБ Лекция 12b — Структура белка (продолжение) 3,78 МБ Лекция 13 — Функция белков (глобины и антитела) 4.5MB Лекция 14 — Функция белков (глобины и антитела) 4.5MB Лекция 16 — Кинетика и катализ ферментов 3.3MB Лекция 17 — Ферментная кинетика и катализ II 2.1 МБ Лекция 15а — Катализ 3.2MB Лекция 15b — Механизмы лизоцима Лекция 18 — Сворачивание белков, шапероны, прионы, болезнь Альзигеймера 3.0 МБ Лекция 19 -Метаболизм и сахара 3.1MB Лекция 20 — Метаболизм II и гликоль 4,3 МБ Лекция 21 — Гликолиз 2,5 МБ Лекция 22 — Гликолиз (продолжение) 2,8 МБ Лекция 23 — Цикл лимонной кислоты 2.6 МБ Лекция 24 — Citric Acid Cycle II / Pentose Phosphate Pathway 3,6 МБ Лекция 25 — Глюконеогенез / оценки 3,1 МБ |
Домашнее задание № 1 Домашнее задание № 2 Домашнее задание № 3 Домашнее задание № 4 |
Загрузить % распределение оценок в классе Комплексный заключительный экзамен: ОКОНЧАТЕЛЬНЫЕ ОЦЕНКИ |
Биохимия: основы — онлайн-курс
Спасибо.
ЛеТаня Т., 29 сентября 2021 г., для биохимии: основы
Отличный ресурс. Спасибо. Мне также нравятся викторины и практические медицинские сценарии.
Ясный и короткий
Автор Габриэла София О., 20 сентября 2021 г. для натрий-калиевой АТФазы — функции белка
Он объясняет идеальным и коротким способом, облегчая понимание
Бабушка получает диплом врача нейрохирургии!
Кристина Г.27 августа 2021 г. для биохимии: основы
Отличный обзор основ; был практикующим доктором хиропрактики в течение 27 лет, и ваши видео возвращают все это снова! На пути к сдаче MCAT, чтобы получить докторскую степень по детской неврологии со специализацией в нейрохирургии.
Планирую начать тренировку, когда мне будет около 68/69 … моя вторая карьера. Спасибо за помощь в этом великом начинании !!
Выбор, который изменит жизнь!
Дайра Нерея М.06 августа 2021 г. для биохимии: основы
Пятизвездочная оценка не только за полезную информацию, но и за отличных учителей, тесты с интервалом для повторения и статьи.
Спасибо всем за этот удивительный формат обучения !!
Perfecto !!
Автор: halima u. 26 июля 2021 г. для биохимии: основы
Действительно хорошее объяснение.И мне нравится профессор. Я понял
Добавить дополнительную клиническую корреляцию и перейти к другим областям
Герберт Г. 13 июля 2021 г. для биохимии: основы
Пожалуйста, важно добавить больше клинической корреляции, клинических случаев и связать с другими областями: фармакологией, микробиологией и т. Д.
Усмле тест на интеграцию знаний.
Трещотка
Автор eyob a. 28 июня 2021 г. для биохимии: основы
Интересно.
Душевная жажда хорошо утоляет.
Связано. Достаточно информации.
Доктор Кевин веселые лекции.
ок
Автор eyob a.26 июня 2021 г. для вовлеченных белков — движение белков и передача сигналов клеток
Ok. можно было бы улучшить
Пожалуйста, укажите, что кинезин и динеин — это АТФазы, которые потребляют энергию.
кроме того, здесь отображается только кинезин. Я был так занят поиском информации о Dynein, что информация о Kinesin вышла из другого уха. Это может быть лучше, если улучшить диаграмму.
Отличная презентация биохимии
Кларисса Н.17 июня 2021 г. для биохимии: основы
Этот курс — отличная презентация биохимии. Профессор Ахерн представляет материал в ясном, кратком, легком для понимания формате, которому легко следовать. Мне очень нравится, что я могу выбирать лекции, которые мне нужно посмотреть, особенно те, которые мне нужны для подготовки к предстоящему экзамену. Я нахожу вопросы обзора очень полезными. В целом, я считаю этот курс очень полезным и с нетерпением жду возможности пройти его еще раз.
Отличный класс
Написано Элизабет М. 01. июня 2021 г. для биохимии: основы
Я люблю это! Понятно и лаконично! Доктор Ахерн — жемчужина, у которой можно учиться. Он разбирает это до того, что я могу понять.
Обожаю!
Адеронке И.31 мая 2021 г. для биохимии: основы
Хороший оратор и иллюстрации. Лекции были увлекательными. Спасибо!
Хорошие лекции!
Матильда Н., 7 мая 2021 г., для биохимии: основы
Кевин Ахерн действительно хороший учитель, мне очень нравятся его лекции, но иногда трудно следить за лекцией, потому что презентация изображает одно, а он говорит о другом.А также, когда он говорит о презентации, мне хотелось, чтобы у него был какой-то указатель, чтобы мне было легче узнать, о какой структуре он говорит ????????
идеально
Автор shalu b. 25 апреля 2021 г. для нуклеотидов — ДНК, РНК и генетический код
Красивое и очень хорошее объяснение. легкие горки.Спасибо. учебный материал также предоставлен
Отличное обслуживание
Мохаммад Дж. От 10 апреля 2021 г. для биохимии: основы
Презентация очень красивая и полезная.
Организация тем была очень хорошей
Информация о высокой доходности.
ТИЕНТЧЕУ М., 01 апреля 2021 г., для биохимии: основы
Я впечатлен тем, насколько полезна эта информация. Профессор затрагивает очень важные аспекты в кратчайшие сроки, которые есть в одном видео, и это действительно впечатляет. У меня есть степень в области биохимии и молекулярной биологии, поэтому я постепенно осваиваю этот курс. Конечно, я рекомендую этот курс своим друзьям из того же колледжа, которые, как и я, стремятся изучать медицину.
Действительно хорошие темы
Карлос А., 8 марта 2021 г., для биохимии: основы
Видео короткие и конкретные, а также отличные объяснения
Замечательные лекции
Мелвин К.06 марта 2021 г. для биохимии: основы
Отличное объяснение с отличными примерами. Знание предмета, актуальное содержание
ТРАНСПОРТ
Автор EDUARDO R. 04. марта 2021 г. для экспрессии генов — функции белка
ПЕРЕВОД НЕПРАВИЛЬНЫЙ, НЕТ СОГЛАСОВАНИЯ В ПРЕДЛОЖЕНИЯХ
«Основы биохимии» замечательная презентация основ биохимии !!
Ян Э.28 февраля 2021 г. для биохимии: основы
Большое спасибо за возможность заново изучить большинство важных и ключевых концепций, связанных с этим краеугольным камнем фонда медицины и наук о жизни! Жаль, что у меня не было этого инструмента во время учебы в бакалавриате !!
????????????
Автор Neuer N. 21 февраля 2021 г. для связи и передачи сигналов — движение белков и передача сигналов клеток
Клянусь, он здесь лучший
Идк, но он мне нравится
Биохимия Лектурио
Автор Хикмет Г.18 февраля 2021 г. для биохимии: основы
Отличный курс для вводного уровня биохимии. Профессор Кевин Ахен — отличный учитель, знающий не только тему, но и ее историческую подоплеку …
Хм он мне нравится
Автор: Нойер Н., 12 февраля 2021 г., для журнала «Биохимия: основы»
Он легенда о, я не знаю, что еще мне сказать, чтобы завершить 10 слов
биохимия сложна как химия раньше.Пришлось продолжать просматривать, мне очень понравились тесты и презентация курса.
Автор robin s. 11 февраля 2021 г. для биохимии: основы
биохимия была сложной задачей, поскольку раньше у меня не было химии. Пришлось продолжать пересматривать, мне нравились тесты и презентация курса, и я был очень доволен, когда получил правильные ответы. Отличная система для таких, как я. не могу дождаться, чтобы заняться другими предметами, когда закончу эту.
лучший профессор
Автор vivek k.31 января 2021 г. для журнала History — Introduction to Biochemistry
какая замечательная лекция
Боже, благослови вас, сэр, и я хочу встретиться с вами когда-нибудь
Большое спасибо и отзывы (у вас будет ответ на проблему)
Автор: Шан Я. К., 24 января 2021 г., «Экспрессия генов — метаболизм и регулирование
».
Большое спасибо; Тем не менее, мне действительно нужно сообщить вам, что ваш словарный запас превышает мой
Точный и точный
Автор: Мельчора Ф.19 января 2021 г. для вторичной структуры — пептиды
Я очень хорошо понимаю, спасибо, профессор Кевин, они мне очень помогают
Большой обзор биохимии.
Юрий К. от 14 января 2021 г. для биохимии: основы
В целом для меня это был очень необходимый обзор. Спасибо.
Отличная работа!
Джозеф Г. от 14 января 2021 г. для биохимии: основы
Мне очень понравились эти видео. Они помогли мне понять концепции, с которыми я боролся.
Ясно и понятно
Автор Брент Х.14 января 2021 г. для биохимии: основы
Отличная работа, я так рад за четко понятный английский
Больше времени необходимо для правильного усвоения информации
ОКВИР А. 07. декабря 2020, Биохимия: основы
Мне просто нужно дополнительное время, чтобы пересмотреть это, особенно в автономном режиме.Я всегда замечаю, что делаю какие-то заметки, в отличие от Анатомии!
Слишком быстро, без подробностей
Расул Г., 28 ноября 2020 г., для биохимии: основы
Я думаю, что это слишком быстро и не содержит подробностей, поэтому, пожалуйста, исправьте эти проблемы
Отлично
Ян П.28 ноября 2020 г. для полисахаридов — сложных углеводов
Великолепная лекция о полисахаридах и их функциях для хранения и выпуска
Precise
Автор Ian P., 24 ноября 2020 г. для гидрофобных R-групп — аминокислоты
В видео освещены важные концепции группы гидрофобных аминокислот
.
Хорошо не слишком много хорошего просто счастлив
Рашид К.28 октября 2020 г. для биохимии: основы
Это просто хорошо, поэтому 4. Мне не нравится, что это не слишком объясняет клиническую практику
Простой способ обучения
Написано Отару О. 26 октября 2020 г. для биохимии: основы
Ничего страшного …. Но как-то непонятно.Я буду рад, если вы сможете облегчить понимание учения.
отлично
Написано Mai L. 10 сентября 2020 г. для Structure — Amino Acids
это видео короткое и легкое для понимания. Спасибо, учитель
Перевод
Джозеф А.08. сентября 2020 г. для перевода — ДНК, РНК и генетический код
Хорошее объяснение. Довольно плохая диаграмма. Наверное, лучше сработала бы анимация.
Clases de bioquimica
Мария Хосе П., 2 сентября 2020 г., Биохимия: основы
Me encantan las clases son muy explicativas y muy detalladas, simplemente excelente !!!
это видео мне очень помогло, и я улучшил свои оценки
Автор: Нойер Дж.31 августа 2020 г. для журнала History — Introduction to Biochemistry
Мне понравилась каждая секунда этого видео, и это открыло мне возможность изучать больше и стать тем, кем я всегда хотел быть радиологом
Основные лекционные материалы
Автор: Лиза Р., 25 августа 2020 г., Общие сахара: номенклатура и структура — простые углеводы
Лаконично и ясно; именно то, что мне нужно для этой темы, спасибо.
Отлично
Автор Olive O. 24 августа 2020 года для биохимии: основы
Хорошее количество деталей в удобоваримых количествах. Очень ценю возможность запускать видео с разной скоростью.
скучно .. как книгу читать
Мустафа Н.23 августа 2020 г. для Structure — Amino Acids
Никаких объяснений, просто читаю, извините за это, Никакого взаимодействия
Просто потрясающе!
Патрик Лэнс С. 17 августа 2020 года для биохимии: основы
Приятно учиться у кого-то, кто увлечен своей специальностью и даже лучше умеет ее преподавать.Спасибо, доктор Ахерн (:
Очень хороший отзыв
Тина Дж., 23 июля 2020 г., для журнала «Биохимия: основы»
Мне нравятся короткие видео. Они описали, что важно, и позже вы получите вопросы о видео.
Отличный материал для класса, но вопросы викторины необходимо улучшить
Автор: Миа Х.26 июня 2020 г. для биохимии: основы
Мне нравится иметь доступ к таким богатым учебным материалам, спасибо, что сделали этот ресурс доступным. Единственное, что меня критикуют, это то, что вопросы викторины можно улучшить, а профессор может говорить медленнее, чтобы было легче делать заметки. В целом, очень благодарен за то, что нашел это!
Полезное
САБРИНА Ю.12 июня 2020 г. для биохимии: основы
Понятно !!! Легко запомнить! И очень полезно !!! Вам действительно нужно изучить основные темы в области медицинской карьеры, это наверняка заставит вас выделиться среди других студентов
Действительно хорошо
Рене К. от 10. июня 2020 для биохимии: основы
Это помогло мне прояснить некоторые проблемы, с которыми у меня возникли проблемы.
Моя ошибка
Автор Луис Дэвид Э. 08. июня 2020 г. для категорий R-группы — Аминокислоты
Извините, в следующих видео есть информация, которую я искал, еще раз извините
ВЕЛИКИЙ: D
Вале А.15 мая 2020 года для истории — Введение в биохимию
Мне очень понравилось, действительно интересно и легко понять, большое спасибо 🙂
Хорошо
Автор: Aipathi rao u. 12 мая 2020 г. для биохимии: основы
Нужно больше mcq для практики и хорошего контента. Очень четкая концепция s
Спасибо
Биниша Б.8 мая 2020 г. для биохимии: основы
Очень хороший
Спасибо
На самом деле это не займет много времени, и это действительно хорошо
презентация очень обширная
Автор kofi o. 06 мая 2020 г. для биохимии: основы
лекция подробна и исчерпывающа
это хорошо представлено
Мне также понравился тест, который приходит после лекции.
можно улучшить
Автор Cherry E. 30. апреля 2020 для категорий R-группы — Аминокислоты
Почти всегда не удается объяснить «почему». Эти списки есть в любом учебнике. Я искал объяснение, чтобы понять это. Кроме того, визуально он смотрит на стол в течение 5 минут, картинки можно было бы лучше объяснить.
Видео хорошо обобщены и полны полезной информации
Автор Хатегекамунгу А., 26 апреля 2020 г., Биохимия: основы
Уважаемый сэр / мадам
Что касается основ биохимии, я очень доволен курсами. На самом деле, видео по основам биохимии хорошо обобщены и полны полезной информации в отношении медицинских исследований.Из-за этого я получаю удовольствие от курса и продолжаю узнавать гораздо больше.
Искренне Ваш
Ашер Хатегекамунгу
Прекрасный курс
Автор: Хосе Артуро Г., 19 апреля 2020 г., журнал Biochemistry: Basics
Доктор Ахерн — фантастический лектор. Весь курс просто потрясающий.
Простой курс
Брэндон А.12 апреля 2020 г. для биохимии: основы
По курсу было легко следовать, и в нем есть хорошие иллюстрации концепций. Мне также нравится часть курса с викториной.
Имеет действительно хорошие резюме по биохимии.
Андре М. от 5 апреля 2020 г. для журнала History — Introduction to Biochemistry
Отличный профессор и простые темы по биохимии с хорошим объяснением.
Изучение биохимии
Грег Б. от 01. апреля 2020 года для биохимии: основы
Я работаю в рутинном отделении биохимии крупной государственной больницы, когда изучал этот предмет там, где нет компьютеров, только учебники. Итак, это напоминание и обновление темы. Мне нравится этот «новый» способ обучения, и он расширяет мои профессиональные знания, поскольку понимание теории важно для хорошего выполнения работы.
Потрясающе!
Абдулла Ф. от 01. марта 2020 для биохимии: основы
Мне нравится его стиль, и я уважаю его усилия. Я использовал этих лекторов для проверки своих знаний
Подготовка к этапам 1 и 2 экзамена ECFMG
Автор: andre g.27 января 2020 г. для биохимии: основы
Привет
Видео по биохимии интересны и дают мне информацию, оратор правильно произносит.
Как вы знаете, я делаю все возможное, чтобы подготовить следующий экзамен ecfmg и следующий экзамен, конечно, после достаточного обучения и советов под вашим руководством.
Я хотел бы подать заявку на экзамен ecfmg в этом году. Не могли бы вы дать мне больше информации для подготовки к экзамену на первый и второй этапы.
I
Мэри С.15 декабря 2019 г., информация о структуре — аминокислоты
две звезды просто за старания. Но это все равно что читать по книге. Ничего особенного. Очень скучный. Никакого взаимодействия.
Просто, информативно и очень хорошо объясняет
Автор: Patwant S., 29 ноября 2019 г. для транспорта кислорода — функции белка
Четко говорит и объясняет все ключевые моменты, чтобы вы могли понять лекцию простым языком
Я пытаюсь изучить азбуку по каждому предмету
Автор: Лина К.13 ноября 2019 г. для биохимии: основы
Изучение лекций по биохимии помогает мне понимать и запоминать каждый случай, так что это лучший
Biochem
Ekene O., 24 октября 2019 г., журнал Biochemistry: Basics
Это неплохая лекция, но это объемный материал, который не упрощен для привлечения внимания, поймите меня правильно, в ней есть свои основные моменты, но это могло бы быть более интересным.
нравится до глубины души
Бхавья С., 24 сентября 2019 г., для журнала Biochemistry: Basics
Все объяснения точны по существу … и охватывают все важные концепции
Потрясающие лекции по биохимии
Автор: Хейли С.12 сентября 2019 г. для биохимии: основы
Профессор отличный. Мне нравится, как он все объясняет. Некоторые преподаватели часто двигают руками, что может отвлекать, или все время проводят, глядя на компьютер. С другими кажется, что все написано со слайдов. Однако лекции по биохимии написаны очень хорошо и пока что мои любимые.
Обожаю!
Эли О.30 июля 2019 г. для обзора — Введение в биохимию
Спасибо за ваши знания и за то, что вы так распространяете их для нас, студентов.
Завораживающее произведение природы
Кабвеа Т., 19 июля 2019 г., для журнала Biochemistry: Basics
Лектор делает тему интересной, понятной.Начинаешь понимать, как эти вещи связаны с повседневным человеческим существованием и как они играют ключевую роль.
хорошая лекция!
Ронг Ф. от 28. июня 2019 для других липидов и их функций — липидов
это хорошо и тщательно, также охватывает второстепенные типы липидов! хорошо учиться
Отлично
Автор: Даниэла Б.15 июня 2019 г. для TRNA Charging и Ribosomes — DNA, RNA and Genetic Code
Объясняет полностью от начала до конца, все понятно и просто. Структура очень проста для понимания.
Очень полезно
Автор: Хоакин Васкес Дж., 11 мая 2019 г. для обзора — Введение в биохимию
Я учусь в Дауни Хай, и я действительно хочу стать кардиоторакальным хирургом, и я не знал, чему учиться, но я знаю, что этот сайт мне поможет.
биохимия базовая
Автор: dr. Jadumoni g. 24 апреля 2019 г. для биохимии: основы
от базовых до маленьких деталей конечно. легко понять это.
Не скучно!
Джеральдин С.20 апреля 2019 г. для журнала History — Introduction to Biochemistry
Я думаю, что это интересный способ изучить историю биохимии.
Удивительно
Автор: Франк В., 10 апреля 2019 г. для обзора — Введение в биохимию
Я люблю этого парня. То, как он объясняет, делает Biochem проще
Коротко, просто и понятно
Офир Перес Д.02. апреля 2019 г. для транспорта кислорода — функции белков
Он ясен, краток и упрощает самые важные моменты
первые шаги
Игнасио Р., 27 марта 2019 г., для обзора — Введение в биохимию
он очень ясный и хороший учитель, и он использует соответствующий уровень техники
нравится, но кажется, что докторская диссертация такая быстрая, но я использовал субтитры.
Автор Hussein A. 13 марта 2019 г. для перевода — ДНК, РНК и генетический код
Мне очень понравился этот сайт, и он кажется мне полезным.
Я учусь в старшей школе. Я сейчас учусь в 10 классе. Я просто хочу стать врачом-хирургом, потому что хочу спасти жизни людей. Я знаю, что я должен сделать правильный выбор для этого сайта, и мне не нужно представляться вам, люди. Мне не нужно изучать это, потому что я не понимал сегодняшнего предмета.Я просто хочу быть готовым к поступлению в медицинскую школу. Надеюсь, этот сайт поможет мне подготовиться и, удачи.
кратко и по существу с соответствующими группами аминокислот
Автор Vinh N. 01. марта 2019 для гидрофильных и ионных R-групп — аминокислоты
чрезвычайно полезно, когда аминокислоты разделены по функциональному назначению.
Это было полезно. Спасибо.
К 92 0. 24 января 2019 г. для категорий R-группы — аминокислоты
🙂
Спасибо .
все в этой лекции ясно.
очень нравиться.
Тоска по большему
Автор: Иван М.8 января 2019 г. для обзора — Введение в биохимию
Это только первая лекция, и я впервые впервые углубляюсь в биохимию, так сложно сказать, но что-то в манере профессора Ахерна вызывает у меня любопытство и вызывает прекрасное чувство предвкушения. Отлично подходит для первой лекции.
отличная работа
Абида А.04. января 2019 г. для Экспрессии генов — Метаболизм и Регламент
это было описано простым и легким для понимания способом, спасибо.
Где кислые аминокислоты?
Автор Sergio N. 03. января 2019 для гидрофильных и ионных R-групп — аминокислоты
В этом видео действительно не показаны аспарагиновая кислота или глутаминовая кислота?
Он удивительно упрощает эти вещи
Автор: Ари Т.на 01. января 2019 г. для структуры — аминокислоты
Он очень легко упрощает вещи. Вот почему я даю ему пятизвездочный обзор
.
Рекомендовать!
Тиффани Х., 28 декабря 2018 г. для обзора — Введение в биохимию
Удивительно, очень понравилось. Легко понять и ясно.
Высокая доходность, ключевые точки
Автор Alejandro Gonzalo V. 12 декабря 2018 г. для гидрофобных R-групп — аминокислоты
Классная лекция, классный профессор. Мой учитель потратил почти час на объяснение этого. Спасибо, доктор Ахерн
могло быть лучше
Автор: д-р АГНЕЛ X.06 декабря 2018 г. для биохимии: основы
как новичок, я ничего не понимал, о чем говорит лектор, а лектор работает слишком быстро
Поздравляю!
Автор: Барбара Алехандра К., 04 декабря 2018 г. для вторичной структуры — пептиды
Меня зовут Барбара, я из Колумбии, и мне очень нравятся ваши видео, Mr.Кевин, потому что я думаю, что содержание легко понять.
Отличная лекция!
Автор Armin S. 17 ноября 2018 г. для полипептидов — пептидов
Очень хорошо объясненная и подробная лекция, но для лучшего понимания было бы неплохо, если бы в видео были показаны некоторые имена и термины (например, сюжет Рамачандрана)!
Слишком быстро
Ида А.15 ноября 2018 г. для гидрофобных R-групп — аминокислоты
слишком быстро ???? Я действительно хочу, чтобы учитель говорил медленнее, так как теперь мне приходится делать паузы и перематывать назад и т. д.
Легко следовать
Автор: Джанет Г. 31 октября 2018 г. для обзора — Введение в биохимию
Прямая и понятная.Длина видео тоже помогает.
Не требуется
Написано Клэр У. 17 октября 2018 года для журнала History — Introduction to Biochemistry
Отличный профессор, но, к сожалению, детали этой лекции не важны для USMLE Step 1
Отлично
Андрей С.15 октября 2018 г. для Structure — Amino Acids
Легко понять, а объяснение очень ясное. Спасибо большое, хорошая работа!
Детали и темп
Автор Abdulmohsen A. 26. Сентябрь 2018 для категорий R-группы — Аминокислоты
Требуется больше деталей, и делайте это медленнее, чтобы аудитория могла получить более полное представление о теме (видео действительно не должно быть таким коротким)
Хорошая лекция
Габриэла Г.25 сентября 2018 г. для Structure — Amino Acids
Я нашел это действительно полезным. Ваши объяснения были ясными и легкими для понимания.
Адам Уильям Мейсон Доран
Адам Уильям Мейсон Д., 22 сентября 2018 г., для Структура — Аминокислоты
Спасибо за видео, тезисы действительно вам пригодились.с нетерпением жду продолжения обучения.
хорошо сделанная лекция
Автор: wafaa s. 14 сентября 2018 г. для журнала History — Introduction to Biochemistry
очень хорошая четкая и организованная лекция. Спасибо. это добавляет много к моим простым знаниям
Дополнительная лекция
Бадр Л.11 сентября 2018 г. для четвертичной структуры и сводки — пептиды
спасибо за то, что научили меня так ясно, точно и в то же время обогащающим образом
просто лучший!
Бадр Л., 31 августа 2018 г., для журнала History — Introduction to Biochemistry
отличная лекция. Cristal clear; не слишком медленно не слишком быстро, плавные переходы и яркая концовка
Точная презентация.
Автор: Антру С., 20 августа 2018 г. для обзора — Введение в биохимию
Это было очень точно и по делу. Презентация получилась интересной, что побуждает учиться лучше.
отличных объяснений
Автор: Роберто М. 18 августа 2018 г. для блокатора и открывателя ионных каналов — биологических мембран
очень хорошая лекция.довольно хорошо организовано и поучительно. У него глубокое знание материала, что заставляет меня уделять особое внимание всем его лекциям.
Очень хорошо
Автор: Ариэль Карина Т., 16 августа 2018 г., для обзора и введения в жирные кислоты — липиды
Очень приятная и информативная лекция, легкая для понимания и запоминания
Еще раз, простое и совершенное объяснение липидов.
Автор Сухас М. 16 августа 2018 г. для Глицеролипидов и Глицерофосфолипидов — Липидов
Я следил за доктором Ахерном на всех курсах лекций по биохимии, и он всегда делал это.
Спасибо!
Натан А. Л., 16 августа 2018 г. для Biochemistry: Basics
Отличная работа, доктор.Ахерн. Спасибо за лучшее понимание этих концепций! Ваши видео на Lecturio, используемые в качестве дополнения к лекциям и презентациям, были для меня чрезвычайно полезны!
Структура-Аминокислоты
Автор Sergei R. 11 августа 2018, для Структура — Аминокислоты
Очень хорошая лекция, я считаю, что это одна из самых полных тем, которые я читал…Молодец.
Отличная информация и очень полезный метод исследования биохимии
Хосе С. от 02. июня 2018 г., журнал Biochemistry: Basics
Его немного сложно понять, но полная информация, а также таблицы и графики очень помогают
Мои сомнения развеялись
Марьям Дж.29 мая 2018 г. для транскрипции — ДНК, РНК и генетический код
Кратко и понятно изложил процесс. Мне тоже понравился способ презентации.
«вау»
Автор Митра стр. 26 мая 2018 г. для обзора — Введение в биохимию
его учение ясное, и оно не позволяет мне вызвать ни единого сомнения.
Понятно понятий!
Автор yamuna m.25 мая 2018 г. для биохимии: основы
я мог лучше понять концепции. объяснение было хорошим. диаграммы говорят сами за себя. Благодаря этому я почувствовал, что биохимия намного интереснее.
Ваше объяснение имеет смысл и связывает биохимию с реальной жизнью!
Автор: mei huah c. 16 мая 2018 г. для связи и передачи сигналов — движение белков и передача сигналов клеток
Мне нравится, как вы связываете одно с другим.Yuu высоко оценил эти лекции за их краткое и исчерпывающее объяснение! Спасибо, проф!
«вау»
Автор Митра стр. 30 апреля 2018 г., информация о структуре — аминокислоты
мне нравится ваше обучение. сэр. это помогает мне ясно понимать концепции.
Спасибо
Херардо К.30 апреля 2018 г. для структуры белков — движение белков и передача сигналов клеток
Отличная информация и объяснение, это мне очень помогает. Поздравляю, лекция!
Учитесь эффективно и широко!
Йен Чун Л., 03. апреля 2018 для биохимии: основы
Факты о высокой урожайности и четкое объяснение, основные элементы и эффективный путь к освоению биохимии!
Подробнее
Автор: Миа Ю.03. апреля 2018 для биохимии: основы
Я новичок в этой программе, однако мне бы хотелось, чтобы лекции были длиннее. Я надеюсь, что другие лекции будут более подробными, например регуляция / экспрессия генов.
Лектор очень хорошо осведомлен, понятно.
Я наслаждаюсь курсом
Виктор Родриго Ф.03. апреля 2018 для биохимии: основы
Мне этот курс очень понравился. Это очень интересно и хорошие учителя.
Отличное покрытие по основам
Тимоти Б., 27 января 2018 г., для журнала «Биохимия: основы»
Как бы я хотел, чтобы это было, когда я только поступил в медицинский институт.Объяснения были четкими и краткими. Использование простых слов позволяет мне лучше понять это, а возможность сделать паузу в любое время позволяет глубже усвоить факты.
Очень хорошая лекция
Каран Д. от 02. декабря 2017 для биохимии: основы
Очень хорошее объяснение понятий. Можно добавить анимацию для отличного объяснения.
Выдающаяся лекция с художественным оформлением!
Нойер Н., 28 ноября 2017 г. для журнала History — Introduction to Biochemistry
Лекция была очень интригующей! Доктор Ахерн так хорошо сформулирован!
Введение в биохимию и ее связь с нашей повседневной жизнью
Автор: Нойер Н.05 ноября 2017 г. для обзора — Введение в биохимию
Лекция хороша, она рассказывает о том, как биохимия связана с другими областями жизни
Лаконично и информативно
Автор Юлиана В. 27 октября 2017 г. для пептидных облигаций — пептиды
Курсы очень лаконично представлены, это действительно полезно для подготовки к экзамену
Подробнее
Ханаа А.26 октября 2017 г. для категорий R-группы — аминокислоты
Нужны подробности
Нужно идти медленнее
Но в целом неплохо
хорошая лекция
Автор: Janes S. 16 октября 2017 г. для категорий R-группы — аминокислоты
Лектор очень хорошо разбирается в биохимии.Хорошо объяснено и понятно до сих пор.
Все его учения
Автор Schola A. 04. октября 2017 года для Метаболизм — Окисление и снижение метаболизма
Профессор доктор Кевин Ахерн очень четко представляет.
Люблю короткие, но очень информативные лекции.
Рекомендую всем, с пониманием биохимии или без.Большое тебе спасибо
Профессор и спасибо создателю Lecturio.
Молодец
Франсиска Х., 27 сентября 2017 г., журнал «Биохимия: основы»
Все было на высоте ..
Обязательно поделюсь с друзьями.
Наконец, несколько легкодоступных и отличных лекций!
Йохан Фриц Г.21 сентября 2017 г. для журнала History — Introduction to Biochemistry
Короче говоря, я люблю лекции, они действительно очень полезны. Теперь все, что мне нужно сделать, это потрудиться, чтобы получить деньги, чтобы заплатить за эту потрясающую лекцию. Спасибо, Лектурио!
Замечательный курс, использующий полезную информацию для относительно быстрого обзора
Томас Р.18 сентября 2017 г. для биохимии: основы
Я обнаружил, что лекции очень информативны и содержат полезную информацию для относительно быстрого обзора предмета. Единственная причина, по которой я ставлю 4 *, — это несколько технических проблем с курсом; но что касается материала курса, Lecturio предлагает прекрасный обзор биохимии с доктором Ахерном.
Стол AA
Автор: Лоран Дж.10 сентября 2017 г. для структуры — аминокислоты
Мне нравится, как AA представлены в виде таблицы между основным и второстепенным.
Я буду использовать его для запоминания.
Красиво и лаконично.
Автор Mal D. 10 сентября 2017 г. для обзора — Введение в биохимию
Отличное / четкое объяснение, определенно рекомендую студентам.Для тех, кто жаловался, опишите, что нужно объяснить, или просто держите свою дырочку закрытой. Быть двусмысленным бессмысленно.
Мне нравятся вопросы после лекции!
Автор tatyana s. 04. сентября 2017 г. для биохимии: основы
Мне нравится стиль преподавания и представленный материал! Это понятно и понятно.Спасибо!
История Введение в биохимию
Автор Neuer N. от 25 августа 2017 г. для журнала History — Introduction to Biochemistry
Кевин Арен очень хорошо объяснил роль. Мне понравилось, как он объяснил эту часть. Я из бизнеса.
больше, чем ожидалось
Автор: Нойер Н.22 августа 2017 г. для катализа — функции белков
мне нравится эта лекция.
способ представления и объяснения довольно хорош.
Нужны подробности
Написано Бхавишья Н. 16 августа 2017 г. для обзора — Введение в биохимию
Очень красиво, но нужно подробное объяснение, и тогда было бы идеально.
Спасибо! Лучше, чем любой из моих преподавателей в моем университете!
Автор: Сара П.20 июля 2017 г. для сахаридов — простые углеводы
Отличная работа, желаю, чтобы ты был моим учителем в моем университете! Так ясно!
отлично
Автор: luiz s. 19 июня 2017 г. для биохимии: основы
очень хороший курс, я бы хотел иметь деньги, чтобы оплатить весь курс
Биохимия
Автор: Яда С.16 мая 2017 г. для биохимии: основы
Эти лекции сделаны простыми для кого-то вроде меня, очень уязвимого к биохимии.
в целом отлично
Автор: neha a. 12 апреля 2017 г. для биохимии: основы
Поскольку это моя первая лекция, я думаю, что мне нужно много работать, чтобы получить большую пользу от ваших великих наставников.следовательно, я должен был дать эту ставку. сейчас нет таких антипатий. Что ж, большое спасибо за любезную помощь.
Два пальца вверх
Автор Khalena K. от 4 апреля 2017 г. для Biochemistry: Basics
Прекрасные лекторы и подробные объяснения по каждому предмету. После просмотра лекций я действительно понял и сохранил, потому что его лекции очень хорошо организованы.
Полезно для студентов-медиков
Ратна П. от 21 марта 2017 г., журнал Biochemistry: Basics
Это очень полезно. Я студент медицинского факультета и полностью доволен лекцией. Я могу охватить все учебные планы. Это помогает мне экономить время. Мне не нужны все эти заметки и всякие ерунды. Самое главное, я могу попрактиковаться в множестве вопросов! Я порекомендую всем студентам-медикам хотя бы раз прослушать эту замечательную лекцию, чтобы вы смогли понять.Спасибо @lecturio! ????
У МЕНЯ БЫЛО ТРУДНО С АМИНОКИСЛОТАМИ ХИМИЯ БЫЛА ТРУДНО С ЗАХВАТОМ
Энтони Б., 22 февраля 2017 г., для журнала Biochemistry: Basics
ОЧЕНЬ ИНТЕРЕСНЫЙ КУРС, НО ТРЕБУЕТСЯ МНОГО ВРЕМЕНИ ДЛЯ ИЗУЧЕНИЯ, ЧТОБЫ ПОНИМАТЬ ХИМИЮ АМИНОКИСЛОТ.
Чтобы быть честным, я 85-летний фармацевт, выполнивший пенсию, стараюсь не отставать.
Биохимия пока прекрасна!
Эми К. от 20 февраля 2017 г. для журнала Biochemistry: Basics
Мне очень нравится темп и ясность этого лектора в том, как он излагает материал. Было бы неплохо иметь анимированные картинки в сигнале и транспорте. Я также хотел бы, чтобы там были разделы, посвященные ферментативному катализу и кинетике.В целом очень хорошо! Спасибо за изготовление этих
Шанс бесконечности
Автор Audrea L. 17 января 2017 г., журнал Biochemistry: Basics
Я оцениваю это на пять звезд, потому что мне нравится повторять это, когда я занимаюсь другими делами и более одного раза.
Отлично!
Автор: Анна Х.17 января 2017 г. для биохимии: основы
Обзор биохимии действительно полезен! Изображения отличные, а лекция действительно качественная.
Хороший динамик
Тамми Ф. от 07. января 2017 для биохимии: основы
Я надеялся получить немного больше подробностей о химическом составе темы, однако мне нравится, как все видео выложено и описано.
Очень мотивирует!
Автор Берк Т. 21 ноября 2016 г., журнал «Биохимия: основы»
Смотреть эти видео с Lecturio очень похоже на мою школу. Разница в том, что Lecturio веселее и вдохновляет нас каждый раз, когда мы хотим.
Профессор Ахерн готовит почву для понимания биохимии
Кристофер Д.30 октября 2016 г. для биохимии: основы
С помощью этого вводного курса вы познакомитесь с основными аспектами биохимии. Профессор Ахерн подчеркивает, что глубокие знания основ биохимии чрезвычайно помогут вам в понимании жизненных процессов на макроскопическом уровне. Один только этот курс стоил месячной оплаты в 24 доллара. Все остальные блюда были привлекательным, но несущественным дополнением … «глазурью на торте»!
Отличные лекции!
Дэвид З.19 октября 2016 г. для биохимии: основы
Профессор Ахерн действительно великолепен! Прекрасный выбор. Он ясно объясняет концепции и проявляет искренний энтузиазм по поводу тем. Вам нужно вернуть его на лекции об аминокислотах и цикле мочевины, а также о цепи переноса электронов.
Просто добавьте пояснения
Омар М.18 сентября 2016 г. для биохимии: основы
Очень легко следовать, хороший поток и просто объяснил, исключительный профессор! просто хочу, чтобы у вопросов были объяснения, тогда я бы поставил видео более высокий балл.
круто
Ikechukwu I., 12. Сентябрь 2016, для Biochemistry: Basics
это помогло мне углубить понимание биохимии.с нетерпением жду новых лекций
Отличный курс!
Автор Tamela E. 15 августа 2016 для Biochemistry: Basics
Мне нравится этот курс, и энтузиазм профессора Ахерна удерживает мое внимание. Возможность смотреть видео снова и снова помогает усвоить урок. Впервые я наслаждаюсь биохимией. Спасибо, что сделали эти видео такими доступными и простыми в использовании.
Удивительно
Нванзе Т., 5 августа 2016 г., для журнала «Биохимия: основы»
Поскольку я начинаю эту биохимию, это помогает мне вспомнить некоторые основные концепции, которые я забыл
Это потрясающий курс!
Раша И.25 июля 2016 г. для биохимии: основы
Это потрясающий курс!
Профессор Кевин сделал каждую деталь простой и ясной. Его глубокие знания и понимание этого предмета хорошо отражаются в его стиле преподавания.
Материалы, которые он использовал, очень привлекательны, что позволяет легко их запоминать.
Я определенно рекомендую это как для студентов, так и для аспирантов.
Отличный курс по биохимии!
Джесси Р.15 июля 2016 г. для биохимии: основы
Этот курс сделан хорошо. Это основательно. Я пересматриваю то, что узнал, и очень скоро перейду к более сложным материалам. Я бы хотел, чтобы это было во время учебы в бакалавриате.
Биохимия Биохимия — одна из лучших, потому что профессор Ахерн — потрясающий доцент, который заставляет любить лекции
Автор: Эвер Л.02. июля 2016 для биохимии: основы
Биохимия — одна из лучших, потому что профессор Ахерн — потрясающий доцент, который заставляет любить лекции
лекций по Нейрату | UW Биохимия
Ханс Нейрат
1909 — 2002
Кафедра-основатель
Кафедра биохимии
Основатель кафедры биохимии профессор Ханс Нейрат скончался в пятницу, 12 апреля 2002 г.Ганс был страстным человеком к белкам и биохимии, к горам и музыке, а также к своей дорогой жене Сузи и его детям. Отделение вместе с его семьей, бесчисленными друзьями, коллегами и студентами оплакивает смерть великого человека, заложившего основу для нашего нового мира протеомики и применения биомедицинских исследований ко всем аспектам здоровья и болезней человека.
Нейрат основал и возглавлял департамент с 1950 года до своего официального выхода на пенсию в 1975 году, но он оставался активным в научной сфере и продолжал проявлять большой интерес к благополучию департамента в течение многих лет после этого.Действительно, до февраля 2002 года Нейрат приходил на работу каждый день, посещал собрания преподавателей и (как всегда!) Выражал ясные и убедительные мнения почти по каждому предмету.
В дополнение к своим многочисленным научным достижениям в области химии белков, Нейрат основал два крупных научных журнала: Biochemistry, публикацию Американского химического общества, которую он редактировал с 1961 по 1991 год; и Protein Science, публикация Protein Society, которую он редактировал с 1991 по 1998 год.Какая лучшая иллюстрация видения и энергии Нейрата, чем его 81-летнее решение основать и редактировать новый высококлассный журнал, находящийся на переднем крае современных исследований? Он был не из тех, кто почивал на лаврах.
Ханс Нейрат Преподаватели
В 1983 году ZymoGenetics и Департамент биохимии учредили ежегодную лекцию Ганса Нейрата, которая на протяжении двух десятилетий привлекала светил в медицинский факультет. ZymoGenetics, биофармацевтическая фирма из Сиэтла, была основана в 1981 году двумя преподавателями Вашингтонского университета — Эрлом Дэви, профессором биохимии, который сам был докторантом в Neurath, и Бенджамином Холлом, профессором генетики — вместе с покойным Майклом Смитом, профессором доктор биохимии в Университете Британской Колумбии и лауреат Нобелевской премии 1993 года по химии за сайт-направленный мутагенез ДНК.
- 1983 Артур Корнберг
- 1984 Манфред Эйген
- 1985 Питер Райхард
- 1986 Джеральд Эдельман
- 1987 Пол Берг
- 1988 Дэвид Балтимор
- 1989 Бенгт Самуэльссон
- 1990 Майкл С. Браун
- 1991 Гарольд Вармус
- 1992 Дэниэл Натанс
- 1993 Х. Гобинд Хорана
- 1994 Аарон Клуг
- 1995 Эдмонд Фишер
- 1996 Иоганн Дайзенхофер
- 1998 Джеймс Спудич
- 1999 Дэвид Эйзенберг
- 2000 Дж.Майкл Бишоп
- 2001 Гюнтер Блобель
- 2003 Роберт Хубер
- 2004 Линда Бак
- 2005 Роберт Рёдер
- 2006 Нэнси Хопкинс
- 2007 Стивен Харрисон
- 2008 Аврам Гершко
- 2009 Кристофер Добсон
- 2012 Рэнди Шекман
- 2013 Льюис К. Кэнтли
- 2014 Джоан А. Стейтц
- 2015 Сьюзан Линдквист
- 2016 Томас К. Судхоф
- 2017 Дженнифер Дудна
- 2018 Ева Ногалес
- 2020 Рэйчел Грин
Взносы в фонд Neurath Lectureship Fund можно безопасно сделать онлайн или чеком на:
Департамент биохимии
c / o по развитию медицины
Вашингтонский университет
Box 358220
Seattle, WA 98195-8220
Биохимия и молекулярная биология
BMB 7010 Лекция по общей биохимии Кр.4
Введение в биохимию: строение биологических молекул, ферменты, биоэнергетика, промежуточный метаболизм. Биосинтез ДНК, РНК и белков. Предлагается осень.
BMB 7015 Введение в метаболизм Cr. 2
Введение в промежуточный метаболизм углеводов, липидов, аминокислот и белков. Сосредоточен на метаболических путях, участвующих в синтезе и распаде метаболитов. Предлагается осень.
BMB 7020 Биохимическая лаборатория Вращение Cr.1-4
Исследования в лабораториях с различными факультетами. Предлагается каждый срок.
BMB 7030 Основные концепции технологий в биохимии и молекулярной биологии Cr. 4
Методический подход к пониманию основных концепций биохимии и биотехнологии. Студенты приобретают навыки, позволяющие им объяснять и применять эти подходы. Предлагается осень.
BMB 7140 Основы науки о данных Кр. 3
Введение в основные понятия линейной алгебры и их применение в анализе данных.Программы MATLAB и PYTHON представлены и используются в качестве инструментов для практической реализации вычислительных методов. Предлагается осень.
BMB 7320 Структура и функция белка Cr. 3
Структура, функция и дизайн белков: архитектура, функция, регуляция, сборка и эволюция белков и белковых комплексов; теория и методы кинетического анализа; новые методы дизайна и инженерии белков. Предлагается зима.
BMB 7330 Advanced Molecular Biology Cr.2
Современные темы в биохимии, включая динамику нуклеиновых кислот, геномную структуру, репликацию и репарацию ДНК, транскрипцию, процессинг РНК, трансляцию и синтез белка. Предлагается зима.
BMB 7360 Продвинутая структурная биология Cr. 2
Определение структуры и динамики биологических молекул методами ЯМР и кристаллографии; акцент на структуре и функции белков. Предлагается зима.
BMB 7670 Лаборатория продвинутой биохимии Кр.2-10
Передовые лабораторные методы применительно к исследованиям биологических материалов. Предлагается каждый срок.
BMB 7890 Журнал Club Cr. 1
Студенческие презентации статей из недавней литературы или собственных исследований. Предлагается осень, зима.
BMB 7996 Research Cr. 1-15
Предлагается каждый срок.
BMB 8999 Магистерская диссертация Исследования и направление Кр. 1-8
Предлагается на каждый срок.
BMB 9990 Докторантура Кр. 1-8
Исследования в рамках подготовки докторской диссертации. Предлагается каждый срок.
BMB 9991 Докторантура Статус I: диссертация и направление Кр. 7,5
Предлагается на каждый срок.
BMB 9992 Докторантура II: диссертация и направление Кр. 7,5
Предлагается на каждый срок.
BMB 9993 Статус докторанта III: диссертация и направление Кр.7,5
Предлагается на каждый срок.
BMB 9994 Статус докторанта IV: диссертация и направление Кр. 7,5
Предлагается на каждый срок.
BMB 9995 Кандидатский статус: докторская диссертация и направление Кр. 0
Предлагается на каждый срок.
|
15 сен. |
Пн. |
9: 00-11: 00 |
Углеводная структура |
Ким |
|
16 сен. |
Вт. |
9: 00-11: 00 |
Гликолиз и глюконеогенез |
Ким |
|
17 сен. |
ср. |
9: 00-11: 00 |
Метаболизм гликогена, пентозофосфатный путь |
Ким |
|
22 сен. |
Пн. |
9: 00-11: 00 |
Катаболизм фруктозы и других углеводов, регуляция углеводного обмена |
Ким |
|
23 сен. |
Вт. |
9: 00-11: 00 |
Клеточная биология углеводного обмена, Молекулярная манипуляция метаболизма |
Ким |
|
24 сен. |
ср. |
9: 00-11: 00 |
Цикл Кребса |
Ким |
|
29 сен |
Пн. |
9: 00-11: 00 |
Окислительное фосфорилирование |
Ким |
|
30 сен |
Вт. |
9: 00-11: 00 |
Липидная структура |
Войчик |
|
1 окт. |
ср. |
9: 00-11: 00 |
Липидный обмен |
Войчик |
|
6 октября |
Пн. |
9: 00-11: 00 |
Липидный обмен |
Войчик |
|
7 окт. |
Вт. |
9: 00-11: 00 |
Синтез холестерина и стероидных гормонов |
Войчик |
|
8 окт. |
ср. |
9: 00-11: 00 |
Экзамен 2 |
|
|
13 окт. |
Пн. |
9: 00-11: 00 |
Цикл мочевины |
Десаи |
|
14 октября |
Вт. |
9: 00-11: 00 |
Обмен аминокислот |
Десаи |
|
15 окт |
ср. |
9: 00-11: 00 |
Обмен аминокислот |
Десаи |
|
20 окт. |
Пн. |
9: 00-11: 00 |
Метаболизм нуклеотидов |
Штрайх |
Краткое содержание курса: Биохимия (CHM380)
Информация о курсе
Кредиты: 4
Часы работы:
Примечание о лаборатории: и лекция, и лабораторная работа должны проходить одновременно; отдельный
оценки также выставляться не будут.Студенты должны сдать лабораторный раздел в
получить проходную оценку за весь курс.
предлагаемых семестров: осень, весна и лето
Предварительные требования: CHM 260 или CHM 271
Каталог Описание курса:
Курс продолжительностью один семестр, охватывающий основы биохимии.Рассматриваемые темы включают:
структура и функция важных биомолекул, таких как углеводы, липиды,
аминокислоты, белки и нуклеиновые кислоты; кинетика ферментов и использование кофакторов
и коферменты; и метаболические пути, включая гликолиз, TCA, перенос электронов
система, пути жирных кислот и аминокислот. Лабораторная работа включает текущие биохимические
лабораторные методы, такие как хроматография и электрофорез, применение специфических
темы, описанные выше, и анализ данных лабораторных экспериментов.
Элективный курс для: Биология
Тексты курса: Эксперименты по биохимии доктора Глена Хинкли.
Дополнительные тексты: Biochemistry by Garrett & Grisham, 5-е издание, Brooks / Cole
Прочие обязательные учебные материалы
Лабораторный халат и защитные очки
Задачи курса
И.Обзор биологии
Основные органеллы в клетке, Организация клетки, Основные органы в организме
В конце этого раздела студент должен уметь:
- Определите основные органеллы клетки и их функции.
- Определите основные органы тела и их функции
- Воспроизвести структуру ячейки на схематическом уровне
II.Обзор общей химии
Термодинамика, равновесие, теории кислот / оснований, кинетика
В конце раздела студент должен уметь:
- Определять спонтанность и соотносить ее со свободной энергией Гиббса
- Расшифровка уравнения равновесия и расчет концентрации.
- Дайте определение кислотно-основным теориям Аррениуса и Бренстеда-Лоури и определите, в какие
попадают в классификацию конкретных соединений. - Интерпретируйте уравнение скорости и выполните вычисления скоростей и констант скорости
III. Природа воды
Полярные и неполярные вещества, Водородные связи, сильные и слабые кислоты и основания, Henderson-Hasselbalch
уравнение, буферные растворы.
В конце этого раздела студент должен уметь:
- Различают полярные и неполярные соединения
- Изобразите схему водородной связи между донором и акцептором
- Рассчитайте концентрации, pH и pKa, используя уравнение Хендерсона-Хассельбаха
- Определите важные области, особенно буферную область, при титровании
слабая кислота
IV.Обзор органической химии
Функциональные группы в органической химии, теория кислот / оснований Льюиса, основы
органические реакции и механизмы, кислотность альфа-углерода по отношению к карбонилам
В конце этого раздела студент должен уметь:
-
Определить органические функциональные группы по названию и структуре
- Определять соединения как кислоты или основания Льюиса
- Определение нуклеофилов и электрофилов в органических реакциях
- Предсказать продукт биохимически значимых органических реакций
- Изобразите таутомеризацию кетона
В.Липиды
Классификация, жирные кислоты, триглицериды, терпены и стероиды, фосфо- и сфинголипиды,
физические свойства липидов
По окончании этого раздела студент должен уметь:
- Идентифицировать и классифицировать липиды по структуре и названию
- Изобразите структуру жирных кислот (лауриновой, миристиновой, пальмитиновой, стеариновой, олеиновой, линолевой,
линоленовая) - Изобразите структуру триглицеридов и фосфолипидов
- Прогноз относительных свойств плавления и полярности липидов
- Определите функцию каждого типа липидов
VI.Углеводы
Классификация по длине и типу, стереоизомерии, циклическим формам, аномерам, ди- и
структуры и связи полисахаридов, типичные структуры и функции полисахаридов,
восстанавливающие сахара и тесты на.
В конце этого раздела студент должен уметь:
- Классифицировать сахара по длине, типу и стереоизомерам
- Изобразите циклическую форму сахаров по их структуре с прямой цепью и наоборот
- Идентифицировать и определить основные ди- и полисахариды, включая их функции и пищеварение
- Определите восстанавливающие сахара и спрогнозируйте результаты тестов на восстанавливающие сахара.
VII. Аминокислоты и пептиды
Структуры, названия и трехбуквенные и однобуквенные коды всех 20 распространенных аминокислот,
Цвиттерион, состояния ионизации аминокислот при различных значениях pH, структура
пептидной связи.
В конце этого раздела студент должен уметь:
- Определите все аминокислоты по структуре, названию, трехбуквенному и однобуквенному коду
- Определить заряд и состояние ионизации всех ионизируемых групп на аминокислоте
с учетом определенного pH - Построить пептид из последовательности и данных аминокислотных структур
VIII.Белки
Четыре уровня структуры белка, факторы, влияющие на каждый уровень структуры белка,
включая водородные связи и гидрофобный эффект, типы белков (волокнистые,
глобулярный, мембранный), основные характеристики кератина и коллагена, денатурация, гликозилирование
и липоилирование
В конце этого раздела студент должен уметь:
- Определять каждый уровень структуры белка
- Выявление и интерпретация основных факторов, влияющих на структуру белка
- Различать основы, сильные и слабые стороны рентгеновской кристаллографии и
Определение структуры белка ЯМР. - Катагоризовать белки по типу и характеристикам
- Перечислите основные характеристики кератина и коллагена
- Определить денатурацию и интерпретировать средства денатурации
- Определить гликозилирование и липоилирование и определить их важность для структуры белка
и функция
IX.Миоглобин / гемоглобин
Общая структура миоглобина и гемоглобина, структура, состояния и функции гема,
уравнения связывания лиганда, кооперативность, влияние pH, CO2 и BPG на связывание кислорода
к гемоглобину.
В конце этого раздела студент должен уметь:
- Определить структуру гема
- Перечитайте и определите три степени окисления гема
- Определите лиганд
- Определите K D и рассчитайте, используя соответствующие уравнения
- Определите совместную привязку и нарисуйте кривую привязки
- Назовите и объясните три фактора, которые влияют на связывание кислорода с гемоглобином
- Используйте данное равновесие с гемоглобином, чтобы интерпретировать изменения в связывании кислорода с
гемоглобин
Х.Ферменты
Классификации, каталитическая теория, механизмы катализа, уравнение Михаэлиса-Ментен,
типы ингибирования, коферменты и кофакторы
В конце этого раздела студент должен уметь:
- Определить состояние активации, катализ и стабилизацию состояния активации
- Определите и объясните три механизма катализа
- Напишите уравнение Михаэлиса-Ментен и определите V max и K M
- Вычислить V max и K M по заданной кривой Михаэлиса-Ментен
- Нарисуйте график Лайнуивера-Берка для V max и K M
- Определите три типа задержек
- Интерпретировать изменения в V max и K M применительно к типам ингибирования
- Определите основные коферменты и их функции
XI.Нуклеиновые кислоты
Пурины и пиримидины, нуклеозиды и нуклеотиды, структура и функции ДНК,
взаимосвязь между последовательностью ДНК / РНК и последовательностью пептида / белка
В конце этого раздела студент должен уметь:
- Определите четыре основания по их строениям
- Определите три фосфорилированных версии нуклеиновых кислот и сокращения
- Определить РНК и ДНК и выявить структурные и функциональные различия
- Определите пару оснований и сколько водородных связей в каждой паре оснований
- Нарисуйте одноцепочечную нуклеиновую кислоту длиной от 2 до 3 оснований
- Используйте генетический код для перевода последовательности РНК в последовательность белка
XII.Метаболизм Введение
Анаболизм и катаболизм, АТФ и высокоэнергетические фосфатные соединения, переносчики электронов (NAD + и FAD), метаболический контроль за счет потока и регулирования.
В конце этого раздела студент должен уметь:
- Определите анаболизм и катаболизм и определите данные реакции как таковые
- Рассчитайте изменения свободной энергии для двух объединенных реакций
- Определите ATP, NAD + и FAD и каковы их функции
- Определите аллостерию и ее функцию в положении
- Опишите необходимость использования нескольких ферментов в точках контроля потока.
XIII. Метаболизм глюкозы
Гликолиз, глюконеогенез, метаболизм гликогена, пируватдегидрогеназа, лимонная кислота
цикл
По окончании этого раздела студент должен уметь:
- Соберите все промежуточные структуры и названия в правильном порядке в гликолизе / глюконеогенезе
и пути цикла лимонной кислоты - Определить фосфорилирование на уровне субстрата и окислительное декарбоксилирование
- Рассчитайте АТФ, НАДН и ФАДН 2 s, полученные на каждом этапе.
- Определить фосфорилирование белка, его функцию и последствия
- Расскажите о влиянии инсулина и глюкагона на все пути метаболизма глюкозы
XIV. Электронный транспорт
Реакции восстановления / окисления, путь переноса электронов, АТФаза F1-F0, разделение,
значения преобразования для НАДН и ФАДН 2 в АТФ.
В конце этого раздела студент должен уметь:
- Соберите компоненты пути переноса электронов и определите функцию
каждого. - Перечислите, какие компоненты пути прокачивают протоны через митохондриальную мембрану
- Рассчитайте общее количество АТФ из значений NADH и FADH 2 .
- Определите разделение и его цель
XV. Обмен липидов
β-Окисление, синтез жирных кислот, регуляция метаболизма жирных кислот инсулином
/ система глюкагона, кетоновые тела и кетоз, синтез холестерина из ацетил-КоА,
транспорт липидов по телу.
В конце этого раздела студент должен уметь:
- Рассчитайте общее количество ацетил-КоА, НАДН и FADh3, образующихся при β-окислении любого насыщенного
жирная кислота - Рассчитайте общее количество ацетил-КоА, НАДФН и FADh3, необходимых для синтеза любых жирных кислот.
кислота. - Определите действие инсулина и глюкагона на синтез, хранение и
β-окисление - Определите кетоновые тела, их функции и последствия их производства.
- Определите основные промежуточные звенья пути холестерина
- Определите, какие липопротеины участвуют в транспорте липидов, их происхождении и функциях.
XVI. Аминокислотный метаболизм
Дезаминирование и трансаминирование, Цикл мочевины, глюкогенные против кетогенных, незаменимые и
заменимые аминокислоты
В конце этого раздела студент должен уметь:
- Предсказать результат дезаминирования аминокислоты
- Соберите все промежуточные структуры и названия в надлежащем порядке в цикле мочевины
- Определите глюкогенные и кетогенные аминокислоты
- Определите все аминокислоты как незаменимые или заменимые.
Цели лабораторного отделения:
- Познакомить учащихся с биохимическими методами и методами.
- Использовать следующие биохимические методы.
- спектрофотометрия
- электрофорез
- анализ белка
- ферментные анализы и активность
- ионообменная и эксклюзионная хроматография
- высокоэффективная жидкостная хроматография
- тонкослойная хроматография
- микропипетирование
- Для проведения биохимических экспериментов:
- pH
- белков
- липиды
- углеводов
- ферменты
- Для получения и анализа данных для вышеуказанных методов / экспериментов:
- Вручите лабораторные отчеты, показывающие данные и выводы, сделанные на их основе.
- Отчеты классифицируются по аккуратности, точности данных и / или результатов и заключений.
- Студенты также проходят тест в конце семестра, проверяющий их теорию.
и практические знания биохимии, которые они получили в течение семестра.
График лаборатории
- Калибровка пипеток
- Спектроскопия
- Конструкция буфера
- Анализ углеводов
- Определение концентрации белка
- Эксклюзионная хроматография
- Спектроскопия гемоглобина
- Michaelis-Menten Kinetics
- Тонкослойная хроматография липидов
- Проект очистки лизоцима: периодическая хроматография
- Проект очистки лизоцима: анализ ферментов
- Лизоцим III: денатурирующий протеиновый гель-электрофорез
- Практический экзамен
ПРИМЕЧАНИЕ: Этот план курса заменяет собой любую программу курса, предоставленную профессором.



 Переваривание и всасывание углеводов в желудочно-кишечном тракте.
Переваривание и всасывание углеводов в желудочно-кишечном тракте.